Изобретение относится к медицинской технике, а именно к области биотехнологии и регенеративной медицины, и может быть использована при "выращивании" клеточно- и тканеинженерных конструкций (КИК и ТИК соответственно), культивировании клеток, микроорганизмов, исследовании биосовместимости различных материалов, а также для изучения влияния различных факторов на эти процессы.
Известен проточный минибиореактор [Egger D., Spitza S., Fischer M, Handschuh S.,  Friemert В., Egerbacher M., Kasper C. Application of a Parallelizable Perfusion Bioreactor for Physiologic 3D Cell Culture. // CellsTissuesOrgans. - 2017. - Vol. 203. p. 316-326], состоящий из нескольких камер, изготовленных из полиоксиметилена. Каждая камера состоит из цилиндрического корпуса 10 мм в диаметре, внутреннего поршня, двух прокладок, между которыми помещается образец и крепежной гайки. Каждая проточная камера соединена с перистальтическим насосом и отдельным резервуаром со средой, которые образуют замкнутую систему. Камеры помещаются в термостатируемый инкубатор, в котором контролируется и поддерживается газовая атмосфера, состоящая из углекислого газа и воздуха. В каждой камере измеряются скорость потока среды и гидростатическое давление. При этом камеры друг с другом не связаны.
Friemert В., Egerbacher M., Kasper C. Application of a Parallelizable Perfusion Bioreactor for Physiologic 3D Cell Culture. // CellsTissuesOrgans. - 2017. - Vol. 203. p. 316-326], состоящий из нескольких камер, изготовленных из полиоксиметилена. Каждая камера состоит из цилиндрического корпуса 10 мм в диаметре, внутреннего поршня, двух прокладок, между которыми помещается образец и крепежной гайки. Каждая проточная камера соединена с перистальтическим насосом и отдельным резервуаром со средой, которые образуют замкнутую систему. Камеры помещаются в термостатируемый инкубатор, в котором контролируется и поддерживается газовая атмосфера, состоящая из углекислого газа и воздуха. В каждой камере измеряются скорость потока среды и гидростатическое давление. При этом камеры друг с другом не связаны.
Недостатками известного биореактора являются:
 большой расход дорогостоящей культуральной среды;
большой расход дорогостоящей культуральной среды;
 отсутствие оксигенатора, позволяющего насыщать культуральную среду газами;
отсутствие оксигенатора, позволяющего насыщать культуральную среду газами;
 отсутствие датчиков кислорода, углекислого газа, рН и блока отбора проб, дающих возможность мониторинга состояния КИК и ТИК в культуральных камерах по изменению состава культуральной среды;
отсутствие датчиков кислорода, углекислого газа, рН и блока отбора проб, дающих возможность мониторинга состояния КИК и ТИК в культуральных камерах по изменению состава культуральной среды;
 в реакторе реализуется высокое гидростатическое давление в пределах 100-500 мм Hg, которое неприемлемо для выращивания клеточных культур, чувствительных к высокому давлению;
в реакторе реализуется высокое гидростатическое давление в пределах 100-500 мм Hg, которое неприемлемо для выращивания клеточных культур, чувствительных к высокому давлению;
 минимальная скорость потока превышает 1,5 мл/мин, что ограничивает его применение, например, при «выращивании» ТИК печени, когда требуется скорость потока меньше 0,1 мл/мин.
минимальная скорость потока превышает 1,5 мл/мин, что ограничивает его применение, например, при «выращивании» ТИК печени, когда требуется скорость потока меньше 0,1 мл/мин.
Наиболее близким к патентуемому изобретению является компактный перфузионный биореактор с ячейками для формирования тканевых структур [Sevastianov V.I., Basok Yu.В., Grigoryev A.M., Kirsanova L.A., Vasilets V.N. A Perfusion Bioreactor for Making Tissue-Engineered Constructs. Biomedical Engineering. - 2017. - Vol. 51. - Issue 3. - p. 162-165.] (прототип). Биореактор включает в себя две системы циркуляции. Ячейки и резервуары со средой помещают в инкубатор, где поддерживают постоянную температуру 37°С, относительную влажность 90-100% и состав газовой смеси: углекислого газа - 5% и кислорода - 20%. Емкости с культуральной средой через стерильные фильтры сообщаются с атмосферой в инкубаторе. Постоянную циркуляцию среды с заданной скоростью обеспечивают четыре перистальтических насоса, размещенные снаружи инкубатора. Управление потоком осуществляют через контроллер, связанный с компьютером.
Недостатками прототипа являются:
 отсутствие возможности отбора проб культуральной среды во время работы устройства при поддержании стерильности;
отсутствие возможности отбора проб культуральной среды во время работы устройства при поддержании стерильности;
 отсутствие датчиков давления, позволяющих контролировать нагрузку и состояние работы системы;
отсутствие датчиков давления, позволяющих контролировать нагрузку и состояние работы системы;
 отсутствие оксигенатора, позволяющего насыщать культуральную среду газами;
отсутствие оксигенатора, позволяющего насыщать культуральную среду газами;
 отсутствие датчиков кислорода, углекислого газа, рН и блока отбора проб, дающих возможность мониторинга состояния КИК и ТИК в культуральных камерах по изменению состава культуральной среды;
отсутствие датчиков кислорода, углекислого газа, рН и блока отбора проб, дающих возможность мониторинга состояния КИК и ТИК в культуральных камерах по изменению состава культуральной среды;
 большой расход культуральной среды: 220 мл в неделю для «выращивания» четырех ТИК.
большой расход культуральной среды: 220 мл в неделю для «выращивания» четырех ТИК.
Техническая проблема заключается в разработке проточного многоканального биореактора, который обеспечит одновременное культивирование нескольких КИК и/или ТИК, и/или клеток, и/или микроорганизмов, исследование биосовместимости различных материалов, а также позволит изучать влияние различных факторов на эти процессы в контролируемых условиях.
Технический результат заключается в обеспечении возможности одновременного культивирования нескольких КИК и/или ТИК при оптимальном (экономном) расходе культуральной среды и постоянном контроле состояния культивируемых объектов.
Предлагаемая конструкция позволяет получить приближенные к физиологическим специфические условия культивирования для различных КИК или ТИК, а также биоматериалов за счет возможности изменения концентрации газов в среде культивирования, скорости ее потока, а также создания избыточного давления. Отбор проб при сохранении стерильности системы дает возможность оценивать специфические параметры, характеризующие культивируемые КИК, или ТИК, или клетки, или исследуемые материалы.
Сущность изобретения заключается в следующем.
Проточный биореактор для культивирования клеточно-инженерных и/или тканеинженерных конструкций включает резервуар с культуральной средой и перистальтические насосы, образующие систему циркуляции культуральной среды через культуральные камеры, связанные со средствами контроля и регулирования параметров культивирования клеточно-инженерных и/или тканеинженерных конструкций, разделенную на две части резервуаром с культуральной средой. В каждой из частей на выходе из резервуара с культуральной средой размещен перистальтический насос. При этом, биореактор содержит, по меньшей мере, одну систему циркуляции культуральной среды. Каждая часть этой системы содержит по две подключенные параллельно друг другу культуральные камеры, следующие по потоку культуральной среды за перистальтическим насосом. Одна часть системы циркуляции после культуральных камер ниже по потоку культуральной среды содержит последовательно установленные датчик давления, датчик содержания кислорода, датчик содержания углекислого газа, датчик рН и блок отбора проб. Другая часть системы циркуляции содержит оксигенатор, подключенный к баллону с газовой смесью, расположенный после двух культуральных камер ниже по потоку культуральной среды.
Отличительными признаками патентуемого изобретения от прототипа являются: количество систем циркуляции (по меньшей мере, одна), число культуральных камер (4 вместо двух в одной системе циркуляции), наличие датчиков давления, содержания кислорода, содержания углекислого газа, рН, блока отбора проб в одной части системы циркуляции и оксигенатора, подключенного к баллону с газовой смесью, в другой части системы циркуляции, а также их расположение друг относительно друга.
Работа предлагаемого проточного биореактора поясняется следующими фигурами.
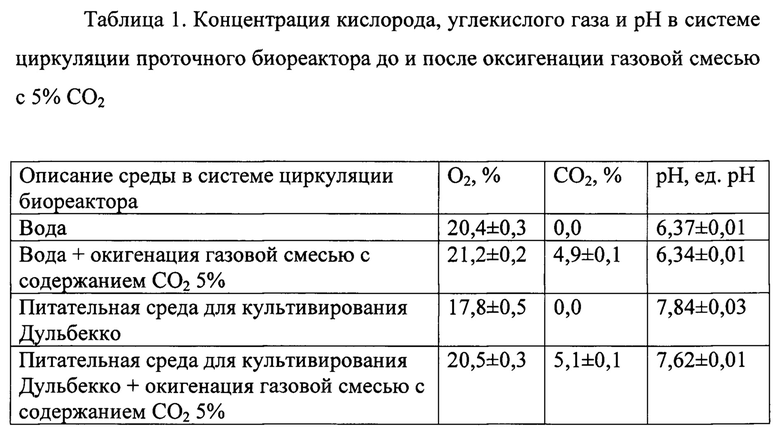
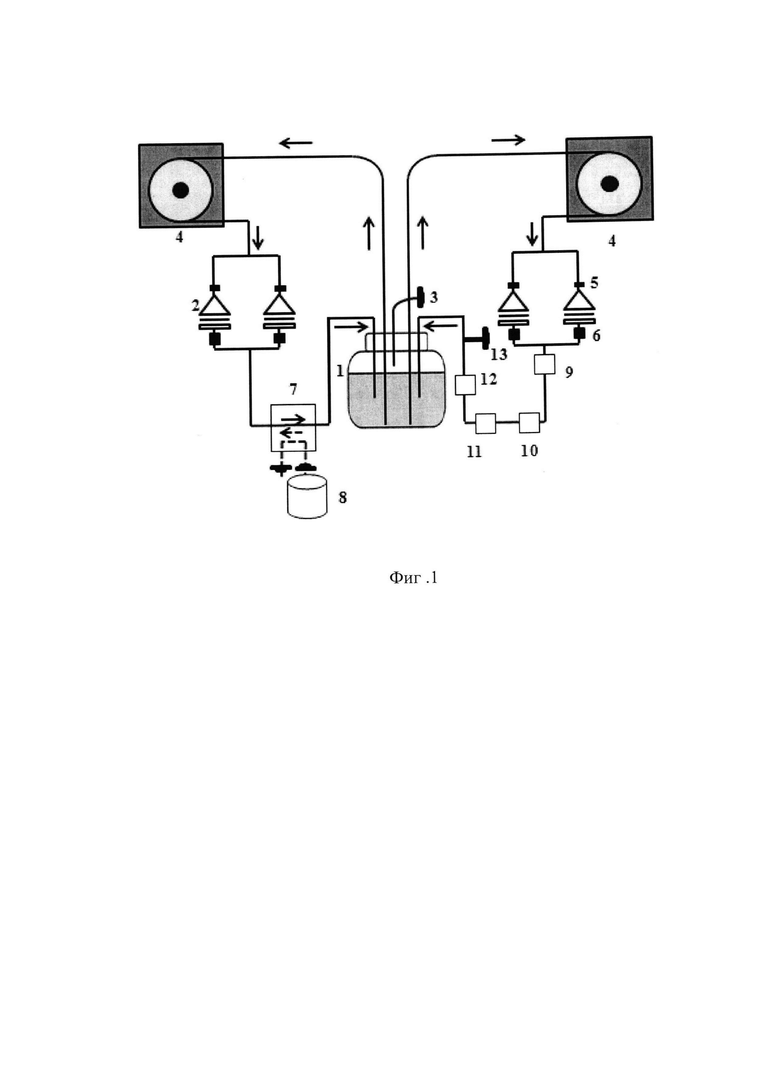
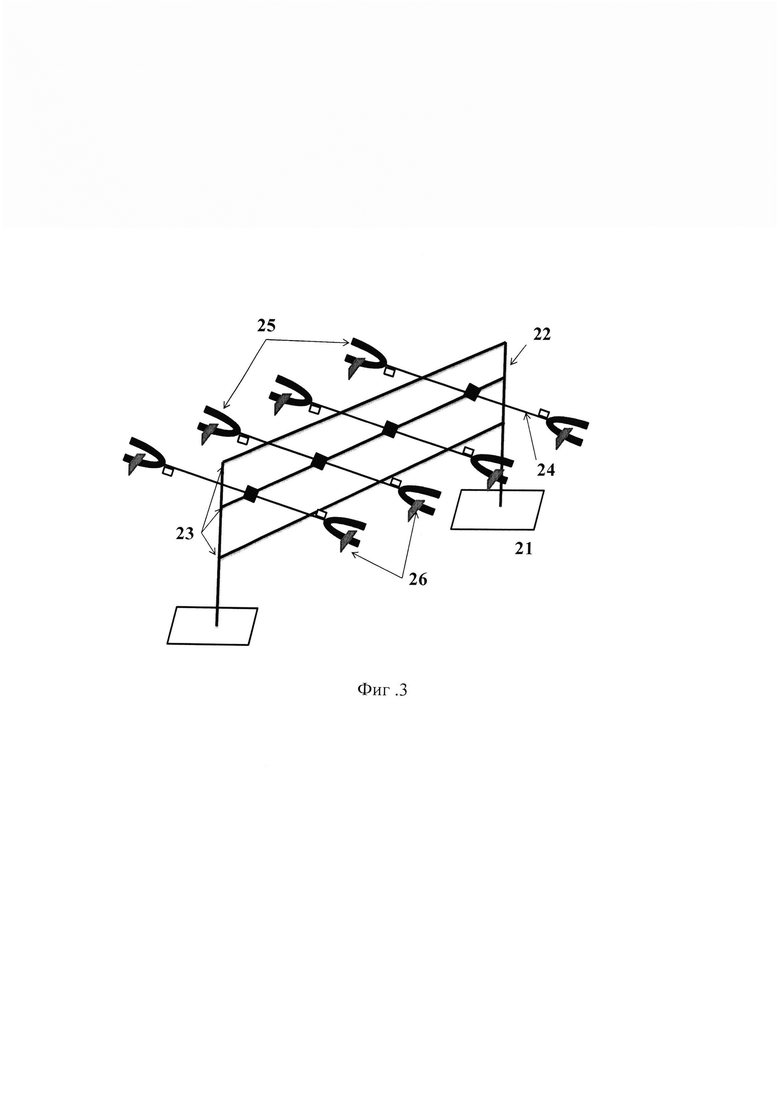
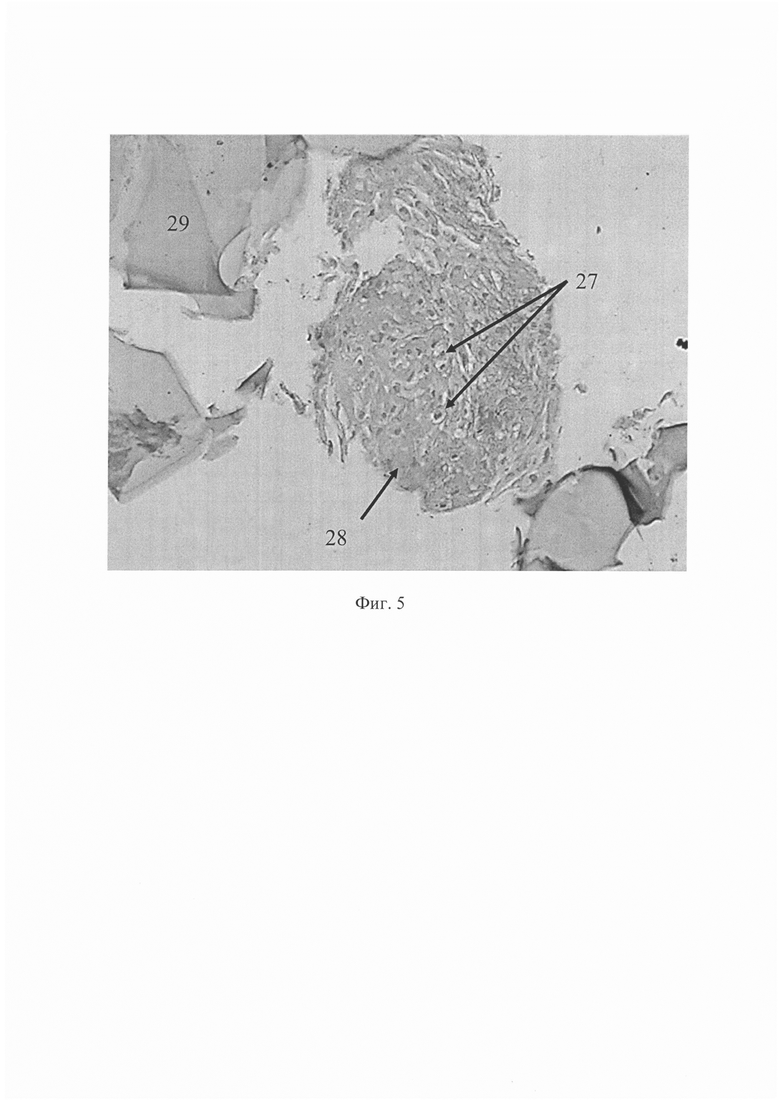
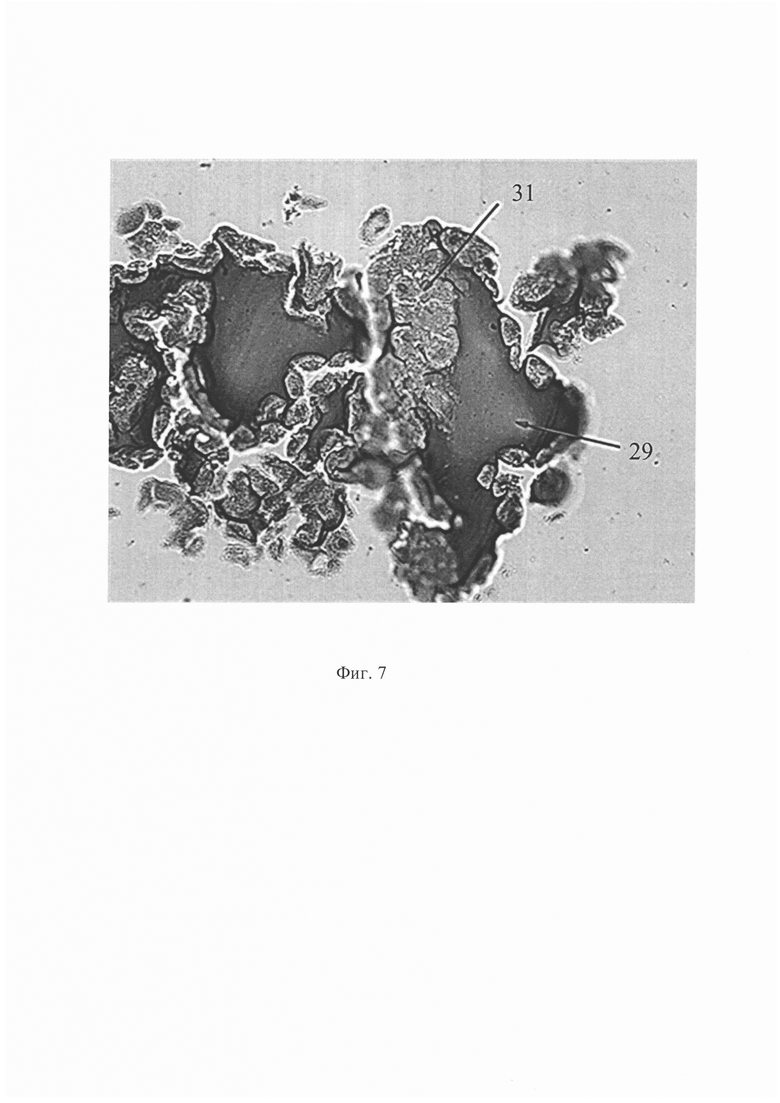
На фиг. 1 изображена система циркуляции проточного биореактера; на фиг. 2 продемонстрирована схема культуральной камеры; на фиг. 3 представлена схема штатива для фиксации культуральных камер и шлангов; на фиг. 4 показано изменение давления в системе циркуляции во времени при различных скоростях потока; на фиг. 5 - гистологическая картина ТИК хряща на 25 сутки культивирования в условиях потока при скорости 1,0 мл/мин, увеличение Х40, на фиг. 6 - гистологическая картина ТИК хряща на 25 сутки культивирования в условиях потока при скорости 1,0 мл/мин, увеличение Х200, на фиг. 7 - гистологическая картина КИК на третьи сутки культивирования в условиях потока при скорости 0,02 мл/мин, увеличение Х400, на фиг. 8 - пористые диски из полилактида (ПД ПЛА) после 14 суток культивирования мезенхимальных стромальных клеток жировой ткани человека (МСК ЖТч) в статике и в потоке при скорости 0,2 мл/мин, где
1 - резервуар с культуральной средой;
2 - культуральная камера;
3 - стерильный фильтр;
4 - перистальтический насос;
5 - коннектор;
6 - соединение коннекторов;
7 - оксигенатор;
8 - баллон с газовой смесью;
9 - датчик давления;
10 - датчик кислорода;
11 - датчик углекислого газа;
12 - датчик рН;
13 - блок отбора проб;
14 - внешний вид культуральной камеры;
15 - внутреннее пространство культуральной камеры;
16 - сетчатый фильтр, удерживающий КИК, или ТИК, или материал;
17 - нижняя часть культуральной камеры;
18 - верхняя часть культуральной камеры;
19 - уплотнительное кольцо;
20 - разъем для соединения с коннекторами;
21 - основание культуральной камеры;
22 - вертикальная стойка;
23 - штанга;
24 - горизонтальная перекладина;
25 - зажим «лапка»;
26 - регулировочный винт;
27 - молодые хондроциты;
28 - внеклеточный матрикс (ВКМ);
29 - биополимерный микрогетерогенный коллагенсодержащий гидрогель (БМКГ);
30 - сфероподобная структура;
31 - клетки печени;
32 - пористые диски из ПД ПЛА после 14 суток культивирования МСК ЖТч в статике;
33 - пористые диски из ПД ПЛА после 14 суток культивирования МСК ЖТч в потоке при скорости 0,2 мл/мин.
Проточный биореактор содержит, по меньшей мере, одну систему циркуляции (фиг. 1). В последней к резервуару с культуральной средой 1 параллельно подключены по две культуральные камеры 2 в каждой из двух частей (магистралей, рукавов) системы циркуляции. Резервуар с культуральной средой сообщается с атмосферой через стерильный фильтр 3. Для переноса культуральной среды применяют шланги, способные поддерживать скорость потока от 0,018 до 18 мл/мин. Постоянную циркуляцию среды с заданной скоростью обеспечивают два перистальтических насоса 4. Культуральные камеры подсоединяются к системе циркуляции при помощи коннектора 5 сверху и соединения коннекторов 6, связанного с нижней частью культуральной камеры через шланг.
За узлом, соединяющим две культуральные камеры, по направлению течения среды, в одной из частей системы циркуляции расположен оксигенатор 7 (возможные доступные модели оксигенатора: Hemofilter D150 (Medica S.p.A., Италия) или Hollow Fiber Hemofilter KW800 (Dongguan KeweibMedical Instruments Co., ltd, Китай)), сообщающийся с баллоном с газовой смесью 8 и атмосферой через стерильные фильтры. На параллельной магистрали (в другой части системы циркуляции) за узлом, соединяющим две культуральные камеры, по направлению течения среды установлены последовательно датчик давления 9 (возможные доступные модели датчика давления: PendoTECH Pressure Sensor Polycarbonate («PendoTECH», США) или TruWave pressure monitoring transducer kit (Edwards Lifesciences Corporation, США)), датчик кислорода 10 (возможные доступные модели датчика кислорода: optical oxygen (O2) sensor (Polestar Technologies, Inc., США) или PreSens' Featured Oxygen Measurement System for Perfusion Monitoring (PreSens Precision Sensing GmbH, Германия)), датчик углекислого газа 11 (возможные доступные модели датчика углекислого газа: optical carbon dioxide (CO2) sensor (Polestar Technologies, Inc., США) или PreSens' Featured dCO2 Measurement System for Perfusion Monitoring (PreSens Precision Sensing GmbH, Германия)), датчик рН 12 (возможные доступные модели датчика рН: optical рН sensor (Polestar Technologies, Inc., США) или PreSens' Featured рН Measurement System for Perfusion Monitoring (PreSens Precision Sensing GmbH, Германия) и блок отбора проб 13.
На фиг. 2 изображена схема культуральной камеры, выполненной из полипропилена, включающая внешний вид культуральной камеры 14 и внутреннее пространство 15. Сетчатый фильтр 16 из нейлона располагается на пористой подложке нижней части культуральной камеры 17. В верхней части культуральной камеры 18 закрепляется уплотнительное кольцо из силикона 19. В центре верхней части культуральной камеры имеется разъем для надежного крепления камеры в систему биореактора 20.
На фиг. 3 изображена схема штатива, который может быть использован для крепления культуральных камер. Штатив включает два основания 21 с двумя вертикальными стойками 22, соединенными под прямым углом с тремя штангами 23. К средней из штанг перпендикулярно на равном расстоянии друг от друга и параллельно основаниям закреплены четыре горизонтальные перекладины 24, оканчивающиеся зажимами «лапка» 25, снабженными регулировочными винтами 26 для фиксации культуральных камер в вертикальном положении. Все элементы штатива выполнены из нержевеющей стали.
Предлагаемый проточный биореактор работает следующим образом.
Культуральные камеры, уплотнительные элементы, соединительные элементы, шланги, резервуары для культуральной среды, штатив стерилизуют в парах воды в автоклаве в течении 45 минут при температуре 121°С. Мембраны из нейлона стерилизуют путем гамма-облучения при дозе 1,5 Мрад.
Сборка компонентов проточного биореактора происходит в стерильных условиях. Шланг блока отбора проб 13 зажимается корнцангами. Работа перистальтических насосов 4, расположенных снаружи инкубатора, обеспечивает заполнение системы циркуляции культуральной средой. После заполнения системы насосы выключают. Шланги, расположенные сверху и снизу коннекторов, пережимают корнцангами.
Культивируемый объект помещают на мембрану 16 из нейлона с размером пор 10 мкм, которая размещается на пористой подложке нижней части культуральной камеры, переходящей в шланг, оканчивающийся коннектором. Далее сверху накручивают верхнюю часть культуральной камеры с монтированным в нее уплотнительным элементом 19 из силикона. Культуральную среду вводят в камеры сверху с помощью шприца. Для сохранения культуральной среды в камере шланг, выходящий из культуральной камеры, пережимают корнцангами вблизи коннектора.
Культуральные камеры устанавливают в лапки штатива 25 и через коннекторы подключают к заполненной системе биореактора, таким образом, что одна система циркуляции (если проточный биореактор включает две назависимые системы циркуляции) оказывается справа от штанг 23, а другая слева. Шланги, несущие культуральную среду в камеры, закрепляются хамутами на верхней штанге, а шланги, выводящие культуральную среду из камер, - на нижней штанге. Штатив с культуральными камерами и резервуары со средой помещают в инкубатор, где поддерживается температура 37°С, относительная влажность 90-100%, состав газовой смеси углекислого газа - 5% и кислорода - 20%. Затем корнцанги, блокирующие поток среды через магистрали, разжимают, и запускают насосы с выбранной скоростью потока.
В случае культивирования конструкции, требующей повышенного содержания кислорода в культуральной среде, включается оксигенатор 7. Датчики давления 9, связанные с компьютером, непрерывно регистрируют давление в системе. Превышение заданного порогового значения величины давления является сигналом к отправке сообщения пользователю на электронную почту. Содержание кислорода, углекислого газа и рН регистрируют соответствующими датчиками 10, 11, 12 в постоянном режиме.
Забор проб культуральной среды для исследований необходимых параметров осуществляют при выключенных насосах шприцом через фильтр, расположенный на блоке отбора проб 13. При этом корнцангами пережимают шланг между узлом, соединяющим культуральные камеры, и блоком отбора проб. По окончанию манипуляции корнцангами пережимают шланг блока отбора проб, а корнцанги, тормозящие поток циркулирующей культуральной среды, разжимают и работа насосов возобновляется. Аналогичный подход используют для замены культуральной среды.
Культуральную среду также можно менять в стерильных условиях, устанавливая новый биорезервуар со свежей культуральной средой при остановке потока. Изъятие культуральных камер происходит после выключения насосов. Шланги, находящиеся перед коннектором 5 и после соединения коннекторов 6, пережимают корнцангами, что позволяет избежать заполнения магистралей воздухом. Далее культуральную камеру и шланг с коннектором выкручивают из системы проточного биореактора, а оставшиеся коннекторы соединяют, корнцанги пережимают, что дает возможность включить насосы и возобновить поток.
Были проведены испытания предлагаемого проточного биореактора, заполненного модельным раствором.
В Таблице 1 представлены значения концентрации кислорода, углекислого газа и рН в системе циркуляции проточного биореактора до и после оксигенации газовой смесью с 5% СО2.
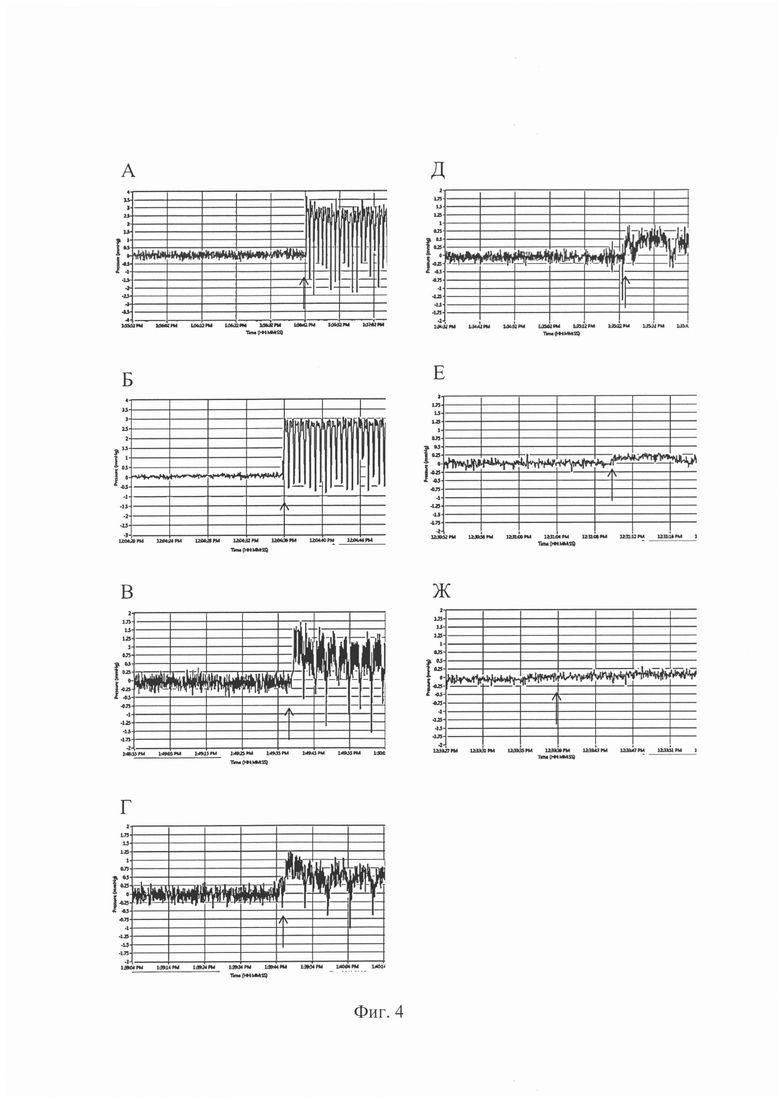
На фиг. 4 представлены кривые изменения давления в системе проточного биореактора при разных скоростях потока:
А - давление в системе проточного биореактора при скорости потока 2,5 мл/мин;
Б - давление в системе проточного биореактора при скорости потока 2,0 мл/мин;
В - давление в системе проточного биореактора при скорости потока 1,0 мл/мин;
Г - давление в системе проточного биореактора при скорости потока 0,5 мл/мин;
Д - давление в системе проточного биореактора при скорости потока 0,3 мл/мин;
Е - давление в системе проточного биореактора при скорости потока 0,1 мл/мин;
Ж - давление в системе проточного биореактора при скорости потока 0,02 мл/мин.
Стрелками на фиг. 4 обозначен момент включения перистальтического насоса.
Результаты испытаний в таблице 1 и на фиг. 4 подтверждают достижение указанного технического результата.
Таблица 1 демонстрирует эффективность оксигенатора и датчиков содержания кислорода, углекислого газа и рН при включении в систему циркуляции биореактора для насыщения газами и контроля уровня кислорода, углекислого газа и рН как для модельного раствора (вода), так и для культуральной среды, при культивировании КИК и ТИК в проточном биореакторе. Фиг. 4 подтверждает возможность непрерывного мониторинга уровня давления в системе циркуляции биореактора при различных задаваемых скоростях потока, что позволяет подобрать и контролировать оптимальные условия культивирования КИК и ТИК.
Для доказательства возможности достижения заявленного назначения и достижения указанного технического результата - пригодности проточного биореактора для "выращивании" КИК и ТИК, культивировании клеток, микроорганизмов а также для изучения влияния различных факторов на эти процессы приводим также следующие данные.
Пример 1.
Для доказательства возможности создания ТИК из КИК в проточном биореакторе приводим результаты культивирования КИК хрящевой ткани человека, включающей БМКГ и хондрогенную культуральную среду. МСК ЖТч получали от здорового донора при информированном согласии пациента. Клетки выделяли и культивировали по стандартной методике [Surguchenko V.A., Ponomareva A.S., Kirsanova L.A., Skaleckij N.N., Sevastianov V.I. The cell-engineered construct of cartilage on the basis of biopolymer hydrogel matrix and human adipose tissue-derived mesenchymal stromal cells (in vitro study) // J. Biomed. Mat. Soc. Part A 2015; 103(2): 463-470.] В каждую культуральную камеру вносили КИК хрящевой ткани человека в виде 1,5 мл суспензии, содержащей 6*106 МСК ЖТч в ростовой культуральной среде, послойно смешанных с 1 мл БМКГ (АО «Биомир сервис», г. Краснознаменск). Для проведения экспериментов по формированию ТИК хрящевой ткани человека разработанный малогабаритный проточный биореактор помещали в СО2-инкубатор. Культуральные камеры с КИК хрящевой ткани первые сутки культивировали в ростовой среде в статике, затем 3-е суток в условиях потока при скорости 1,0 мл/мин, после чего заменяли культуральную среду на дифференцировочную. Замену культуральной среды проводили еженедельно. Жизнеспособность клеток оценивали методом флуоресцентного окрашивания витальным красителем «Live/Dead» («Invitrogen», США). Морфологическое исследование проводили, используя методы гистологического окрашивания.
После 72 часов культивирования КИК в ростовой среде в условиях потока наблюдали значительное увеличение клеточной массы и прорастание клеток в толщу БМКГ. На 11 сутки во внеклеточном матриксе появилась слабая положительная окраска на гликозаминогликаны при окрашивании альциановым синим. На 25 сутки эксперимента значительная часть клеток вступила в хондрогенную дифференцировку. В некоторых препаратах обнаружены клетки с лакунообразным строением - молодые хондроциты 27, при этом, формирование собственного ВКМ 28 сопровождалось резорбцией с постепенным замещением БМКГ 29, что свидетельствует о формировании ТИК хряща в условиях in vitro (фиг. 5). Наблюдали спонтанное образование сфероподобных структур 30, сходных с микросферами, образуемыми МСК, дифференцирующимися в хондрогенном направлении при использовании технологии, не включающей матрикс в состав ТИК (фиг. 6).
Таким образом, показана эффективность формирования ТИК из описанной КИК в проточном биореакторе, что указывает на перспективность проточного биореактора для создания ТИК хрящевой ткани человека.
Пример 2. Для доказательства возможности культивирования КИК в проточном биореакторе приводим результаты культивирования КИК, включающей клетки печени и МСК ЖТч в динамических условиях. На пористую подложку нижней части держателя культуральной камеры, помещали мембрану, удерживающую матрикс с клетками. В качестве матрикса для КИК был выбран БМКГ из линейного ряда композиции имплантируемого гетерогенного геля. МСК ЖТч и клетки печени были получены из фрагментов подкожной жировой клетчатки и печени от здоровых доноров. Выбор оптимальной скорости потока в биореакторе при совместном культивировании клеток печени и МСК ЖТч был сделан по величине создаваемого давления в описываемой системе, заполненной модельным раствором. В многосуточном эксперименте аликвоты рабочих суспензий, содержащих 150000 МСК ЖТч и 7,5×105 клеток печени, послойно смешивали с 1,0 мл гидрогелевого матрикса, переносили на нейлоновую подложку, на ней помещали в культуральную камеру биореактора и инкубировали в среде Williams Е в течение суток без потока. Затем заполненные культуральные камеры подключали к системе циркуляции биореактора и инкубировали в условиях потока при скорости и объеме циркулирующей среды 0,02 мл/мин и 110 мл, соответственно. На 3, 5, 7 и 10 сутки по одной культуральной камере изымали из биореактора, фиксировали образец 10%-м раствором формалина и проводили гистологическое исследование. Замену культуральной среды проводили через неделю культивирования. Концентрацию глюкозы и мочевины в пробах культуральной среды определяли на биохимическом анализатора Konelab Prime 60i (Thermo Fisher Scientific, Финляндия), принцип действия которого основан на измерении значений оптической плотности жидкой биологической пробы. На 3 сутки культивирования наблюдали активную резорбцию БМКГ 29 в местах контакта матрикса с адгезированными клетками печени 31 (фиг. 7), что может свидетельствовать о метаболической активности гепатоцитов.
Результаты проведенных экспериментов показали, что в биореакторе при скорости потока 0,02 мл/мин на седьмые сутки эксперимента культивирования КИК, состоящей из клеток печени, МСК ЖТч, БМКГ и среды Williams Е, в культуральных камерах присутствовали крупные клетки с характерной для гепатоцитов морфологией - полигональной формой и центрально расположенным круглым ядром. Биохимический анализ проб культуральной среды из биореактора на первые и третьи сутки эксперимента не выявил в образцах мочевины на уровне, превышающем предел обнаружения 1,1 ммоль/л. Однако, к седьмым суткам содержание мочевины в культуральной среде составило 2,1±0,14 ммоль/л.
Таким образом, метаболическая активность гепатоцитов в исследуемой КИК подтверждалась присутствием мочевины в культуральной среде на седьмые сутки культивирования в биореакторе и резорбцией БМКГ, что свидетельствует о перспективности использования проточного биореактора при культивировании КИК печени.
Пример 3. Для доказательства возможности изучения биосовместимости материалов в проточном биореакторе приводим результаты сравнительного исследования матриксных свойств ПД ПЛА и БМКГ, т.е. способности их поддерживать адгезию и пролиферацию МСК ЖТч. Культуры МСК ЖТч были получены из подкожной жировой клетчатки при информированном согласии от здоровых доноров. Образцы ПД ПЛА предварительно инкубировали в культуральной среде Williams Е в течение суток в СО2-инкубаторе при стандартных условиях. На поверхность ПЛА ПД наносили 2,9×106 клеток МСК ЖТч 3-го пассажа. То же количество МСК ЖТч послойно смешивали с 1,5 мл БМКГ. Полученные КИК помещали в культуральные камеры биореактора и инкубировали в статике в течение 2 ч для прикрепления клеток к поверхности ПД ПЛА и адгезии на БМКГ. Дальнейшую инкубацию КИК в биореакторе проводили в проточном режиме со скоростью потока культуральной среды 0,2 мл/мин при 37°С в стандартных условиях во влажной атмосфере, содержащей (5±1)% СО2 с однократной сменой культуральной среды на 7 сутки инкубации. Параллельно аналогичные КИК инкбировали в статических условиях. Количество адгезированных клеток на ПД ПЛА и их пролиферативную активность оценивали на 7 и 14 сутки инкубации КИК в биореакторе в режиме потока.
На 7-е сутки инкубирования в проточном биореакторе образца КИК, состоящего из ПД ПЛА и МСК ЖТч, в гистологической картине КИК наблюдали мелкоячеистую структуру полилактидной губки, на периферии которого были выявлены многочисленные тяжи МСК ЖТч. Морфология адгезированных на ПД ПЛА клеток была фибробластоподобная, характерная для нормального роста культуры МСК ЖТч на поверхности культурального пластика. Видна активная пролиферация клеток, о чем свидетельствует наличие митозов в клетках в центральной части препарата. Отметим, что клетки были распределены по всей толщине образца с максимальной плотностью на периферии диска. На 14-е сутки наблюдали сформировавшиеся клеточные пласты на поверхности ПД ПЛА.
При культивировании клеток с БМКГ отмечали увеличение количества МСК ЖТч на сроке 14 суток по сравнению с 7 сутками, однако, на ПД ПЛА пролиферативная активность МСК ЖТч была значимо выше.
Таким образом, был сделан вывод о том, что при культивировании МСК ЖТч в гепатогенной среде в присутствии ПД ПЛА наблюдается активная адгезия и пролиферация МСК ЖТч как на поверхности, так и в объеме пористого матрикса. Полученные данные свидетельствуют о выраженных матриксных свойствах ПД ПЛА. При этом к 14-м суткам культивирования на ПД ПЛА без потока МСК ЖТч пластов не образовывали, располагались в основном на периферии матрикса. Важно, что структура дисков в биореакторе 33 на 14 сутки сильно изменилась - диск стал ломким, развалился на фрагменты, тогда как в статике 32 ПД ПЛА лишь спался, но остался упругим и целостным (фиг. 8). Полученные данные указывают на пригодность проточного биореактора для исследования биосовместимости материалов в условиях близко приближенных к физиологическим.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения тканеспецифического матрикса для тканевой инженерии хряща | 2019 |
|
RU2716577C1 |
| БИОПОЛИМЕРНЫЙ МАТЕРИАЛ ДЛЯ КЛЕТОЧНО-ИНЖЕНЕРНЫХ И/ИЛИ ТКАНЕИНЖЕНЕРНЫХ КОНСТРУКЦИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2021 |
|
RU2774947C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2015 |
|
RU2586952C1 |
| СИСТЕМА ПЕРФУЗИОННОЙ ФИЛЬТРАЦИИ ДЛЯ НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ КУЛЬТУР КЛЕТОК | 2022 |
|
RU2800874C1 |
| СПОСОБ ПЕРФУЗИОННОЙ ФИЛЬТРАЦИИ ДЛЯ НЕПРЕРЫВНОГО КУЛЬТИВИРОВАНИЯ КУЛЬТУР КЛЕТОК | 2022 |
|
RU2794425C1 |
| БИОРЕАКТОР | 2013 |
|
RU2525139C1 |
| СПОСОБЫ И АППАРАТЫ ДЛЯ ПОДГОТОВКИ КЛЕТОЧНЫХ ПОПУЛЯЦИЙ ДЛЯ КЛЕТОЧНОЙ ТЕРАПИИ | 2016 |
|
RU2761634C2 |
| Устройство для культивирования клеток млекопитающих на тканеинженерных конструкциях с изменяемыми условиями культивирования | 2019 |
|
RU2720871C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| Способ искусственного кровообращения у реципиента сердца при его трансплантации и система для его осуществления | 2024 |
|
RU2826522C1 |


Изобретение относится к медицинской технике, а именно к области биотехнологии и регенеративной медицины, и может быть использовано при "выращивании" клеточно- и тканеинженерных конструкций, культивировании клеток, микроорганизмов, исследовании биосовместимости различных материалов, а также для изучения влияния различных факторов на эти процессы. Проточный биореактор включает резервуар с культуральной средой и перистальтические насосы, образующие систему циркуляции культуральной среды через культуральные камеры, разделенную на две части резервуаром с культуральной средой. В каждой из частей на выходе из резервуара размещен перистальтический насос. Каждая часть системы содержит по две подключенные параллельно друг другу культуральные камеры, следующие за перистальтическим насосом. Одна часть системы циркуляции после культуральных камер содержит последовательно установленные датчик давления, датчик содержания кислорода, датчик содержания углекислого газа, датчик рН и блок отбора проб. Другая часть системы циркуляции - оксигенатор, подключенный к баллону с газовой смесью. Осуществление изобретения обеспечивает возможность одновременного культивирования нескольких КИК и/или ТИК при оптимальном (экономном) расходе культуральной среды и постоянном контроле состояния культивируемых объектов. 8 ил, 1 табл., 3 пр.
Проточный биореактор для культивирования клеточно-инженерных и/или тканеинженерных конструкций, включающий резервуар с культуральной средой и перистальтические насосы, образующие систему циркуляции культуральной среды через культуральные камеры, связанные со средствами контроля и регулирования параметров культивирования клеточно-инженерных и/или тканеинженерных конструкций, разделенную на две части резервуаром с культуральной средой, в каждой из которых на выходе из резервуара с культуральной средой размещен перистальтический насос, отличающийся тем, что содержит по меньшей мере одну систему циркуляции культуральной среды, каждая часть которой содержит по две подключенные параллельно друг другу культуральные камеры, следующие по потоку культуральной среды за перистальтическим насосом, при этом одна часть системы циркуляции после культуральных камер ниже по потоку культуральной среды содержит последовательно установленные датчик давления, датчик содержания кислорода, датчик содержания углекислого газа, датчик рН и блок отбора проб, а другая часть системы циркуляции - оксигенатор, подключенный к баллону с газовой смесью, расположенный после двух культуральных камер ниже по потоку культуральной среды.
| СЕВАСТЬЯНОВ В.И.; БАСОК Ю.Б.; ГРИГОРЬЕВ А.М.; КИРСАНОВА Л.А.; ВАСИЛЕЦ В.Н | |||
| Перфузионный биореактор для создания тканеинженерных конструкций | |||
| Медицинская техника | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Прибор для определения температуры сваривания дермы | 1960 |
|
SU137290A1 |
| НЕЗАМЕРЗАЮЩИЙ ГИДРАНТ | 1927 |
|
SU8157A1 |
| EP 0003060648 A4, 31.05.2017. | |||
Авторы
Даты
2023-02-14—Публикация
2018-08-01—Подача