Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к области биологии и биотехнологии, представляет собой способ перфузионной фильтрации для непрерывного культивирования культур клеток животных.
Настоящее изобретение находит применение при культивировании культур клеток животных, насекомых и растений для получения секретируемых веществ, таких как белки, антитела, полипептиды и вирусы.
Культивирование клеток вызвало значительный интерес в последние годы в связи с революцией в генной инженерии и биотехнологии. Клетки культивируют для производства белков, рецепторов, вакцин и антител для терапии, исследований и диагностики. Одним из ограничений использования этой технологии является высокая стоимость.
Традиционно культивирование проводили в периодическом режиме. В периодическом режиме биореактор засевают небольшим количеством клеток, которые выращивают до высокой плотности. Клетки выделяют интересующий продукт и в конечном итоге погибают из-за недостатка питательных веществ, после чего культуру собирают. Такой метод имеет ряд недостатков: во-первых, большая часть питательных веществ теряется в просто растущих клетках и не используется непосредственно для изготовления продукта; во-вторых, образование продуктов часто ингибируется из-за накопления токсичных побочных продуктов метаболизма; и, наконец, критические питательные вещества часто истощаются, что приводит к низкой плотности клеток и, следовательно, к снижению выхода продукта.
Таким образом различают несколько способов культивирования.
«Периодическое культивирование» - это такой тип культивирования клеток, в котором определенное количество новой культуральной среды засевают клетками, которые быстро переходят в фазу логарифмического роста, и в котором среду для выращивания культуры не выводят непрерывным образом и не заменяют свежей средой. В этом виде культивирования, определенное количество свежей среды засевают клетками, которые быстро входят в фазу логарифмического роста. В процессе роста и деления клеток, они потребляют доступные питательные вещества от среды и выделяют вредные побочные продукты (метаболиты). С течением времени культура будет входить в стационарную фазу роста и в конечном счете в фазу разложения. Несмотря на то, что оптимизация процесса «периодического» культивирования сделала его более эффективным с течением времени, финальные модифицированные протоколы периодического культивирования все же приводят к циклам быстрого роста и разложения.
«Культивирование с подпиткой» - это такой тип культивирования клеток, в котором определенное количество новой культуральной среды засевают клетками первоначально, добавляют дополнительные питательные компоненты к культуре во время процесса ферментации, с периодическим выводом клеток, выросших в объема биореактора, и/или продукта перед завершением культивирования или без такого отбора. Процесс «культивирования с подпиткой» относится к дополнительному улучшению метода культивирования клеток по отношению к традиционным методам «периодического» культивирования. Данный процесс делает возможным выращивание культур клеток при более высокой плотности. Но данный тип культивирования ограничен в своей возможности эффективно выращивать культуры клеток высокой плотности и, поэтому, это ограничивает процесс генерирования клеток для формирования банка клеток высокой плотности.
Также процесс «периодического» культивирования имеет ограниченную способность к достижению необходимой концентрации клеток, которая требуются, чтобы сделать возможным формирование банка клеток высокой плотности.
Основным направлением технологии непрерывного культивирования в биофармацевтическом производстве является перфузионный процесс. Он заключается в постоянном поступлении в биореактор с определенной скоростью свежей питательной среды и отводе с той же скоростью, отработанной культуральной жидкости с сохранением клеточной биомассы внутри реактора. Отделение биомассы от отработанной культуральной жидкости достигается использованием различных сепарирующих устройств, таких как наклонные осадители, проточные центрифуги, ультразвуковые сепараторы, модули тангенциальной фильтрации, спинфильтры и т.д. В последние 10-15 лет технологии перфузионного культивирования были значительно усовершенствованы, что сделало непрерывные процессы более надежными, масштабируемыми и производительными. Благодаря этому перфузионные процессы получают все большее распространение в фармацевтической промышленности. Перфузионные процессы позволяют достигать в реакторах высоких клеточных плотностей, несравнимых с таковыми в периодических процессах. Постоянное выведение культуральной жидкости из реактора в охлаждаемый сборник повышает сохранность высоколабильных белков, таких как, например, факторы свертываемости крови. В ходе непрерывного культивирования существует возможность управления скоростью клеточного роста для повышения экспрессии ростзависимых белков и поддержания культуры клеток в активном состоянии. Кроме того, в некоторых случаях оптимизация перфузионного процесса способна продлить продолжительность культивирования до нескольких недель и даже месяцев, повышая тем самым экономическую эффективность процесса.
Большая часть лекарственных препаратов нарабатывается на культурах клеток. Из-за низкой продуктивности, связанной с медленным ростом, для культур клеток предпочтителен непрерывный процесс культивирования с задержанием клеток с помощью фильтроэлементов и возвращения их в биореактор (перфузионная система). Это позволяет достичь большей плотности культуры клеток и отводить метаболиты, что в результате увеличивает продуктивность.
Разработка перфузионного процесса является комплексной задачей. Основные стадии оптимизации требуют большого расхода питательных сред и использования сложного биореакторного оборудования со сложными системами перфузии, тогда как периодические процессы сейчас можно эффективно разрабатывать, не выходя за рамки объемов в несколько долей литра. Кроме того, опыт разработки перфузионного культивирования в отраслевой литературе описан слабо и, зачастую, является коммерческой тайной фармацевтических компаний. Это делает разработку перфузии нетривиальной задачей и повышает ценность каждого эксперимента и всей разработки в целом.
Давно признано, что перфузионная культура более экономична. В ходе этой операции клетки остаются в биореакторе, а продукт непрерывно удаляется вместе с токсичными побочными продуктами метаболизма. Постоянно добавляют корм, содержащий питательные вещества. Эта операция позволяет достичь высокой плотности клеток и, что более важно, клетки могут поддерживаться в высокопродуктивном состоянии в течение нескольких недель. Это обеспечивает гораздо более высокие выходы и уменьшает размер необходимого биореактора. Это также полезный метод для культивирования первичных или других медленно растущих клеток. Перфузионные операции обладают огромным потенциалом для выращивания большого количества клеток, необходимых для применения в клетках человека и генной терапии.
Важная проблема перфузионной культуры заключается в том, как сохранить клетки в биореакторе. Предшествующий уровень техники можно разделить на 3 основные технологии разделения: 1) фильтрация, 2) гравитационное осаждение и 3) центрифугирование. Методы фильтрации требуют некоторых средств для предотвращения засорения фильтра в течение требуемых недель работы. Обычно используются перекрестные фильтры. Здесь используется высокая тангенциальная скорость жидкости для поддержания чистоты поверхности. Вращающиеся фильтры являются еще одним воплощением этой концепции. Для разделения клеток можно использовать гравитационное осаждение, и сообщалось о нескольких типах наклонных отстойников. Основная проблема с отстойниками заключается в различных характеристиках седиментации в разных ячейках и сложности масштабирования до промышленных систем.
Согласно настоящему изобретению предпочтительно использовать способ перфузионной фильтрации для нерерывного культивирования клеток. Перфузионное культивирование является таким способом выращивания клеток, при котором определенное количество новой культуральной среды засевают клетками, быстро входящими в фазу логарифмического роста (как указано выше), и в котором среду для выращивания культуры удаляют непрерывным образом из культуры и заменяют свежей средой. Таким образом, культура постоянно получает свежую среду с высокими уровнями питательных веществ, наряду с тем, что среда, содержащая побочные продукты и имеющая низкие уровни питательных веществ, удаляется. Этот тип культивирования позволяет поддерживать стадию логарифмического роста клеток, в котором минимум один объем культуры заменяют ежесуточно, и концентрация клеток гораздо выше, чем те ее величины, которые достигаются в традиционном или модифицированном периодическом культивировании (увеличение от 2 до более чем 10 раз).
При культивировании рН, температура, концентрация растворенного кислорода и осмотическая концентрация раствора могут быть отрегулированы для максимизирования жизнеспособности культуры и производительности. Одним из методов регулирования концентрации растворенного кислорода и рН культур является применение автоматического регулятора с обратной связью. Этот вид автоматического регулятора функционирует при применении компьютеров на базе микропроцессоров. Используя автоматизацию, контроль и регулировка рН и концентрации растворенного кислорода культуры позволяет поддерживать оптимальные условия для роста клеток. Таким образом, в наиболее предпочтительном варианте осуществления настоящего изобретения может быть использован неавтоматический метод регулирования этих параметров.
Рекомендации для выбора подходящей среды для культивирования клеток хорошо известны в области биотехнологии и подробно рассмотрены в литературе. Также может быть использована среда, не содержащая компонентов животного происхождения (ADC).
Обычные синтетические минимальные среды могут содержать неорганические соли, аминокислоты, витамины, источник углевода и воду. В некоторых вариантах осуществления перфузионного процесса может быть использована среда CD-CHO (GIBCO, Invitrogen Corp.). Такая среда не содержит компонентов животного происхождения, имеет известный химический состав и не содержит белков, гидролизатов или компонентов неизвестного происхождения. В дополнение к этому, среда может иметь дополнительные компоненты, включающие глутамин и/или метотрексат или другие факторы, которые могут способствовать росту или адгезии.
В определенных вариантах осуществления процесса культивирования клетки являются клетками-хозяевами, включающими экспрессионную конструкцию для экспрессии терапевтически важного белка или другого полипептида, представляющего интерес. Любая клетка, экспрессирующая полипептид, представляющий интерес, (например, связующий полипептид), может быть использована в перфузионном процессе. Клетки могут необязательно содержать последовательности природной или рекомбинантной нуклеиновой кислоты, например, экспрессирующий вектор, который содержит полипептид, представляющий интерес. Экспрессирующий вектор может не содержать подходящие транскрипционные и трансляционные необходимые последовательности и может быть осуществлен при применении технологии рекомбинантной ДНК. Экспрессирующие векторы могут быть включены в любую клетку-хозяина, и полученные клетки затем могут быть культивированны с целью получения банка клеток высокой плотности. Затем банк клеток высокой плотности может быть разморожен и имеется возможность провести культивирование в соответствии с методиками, известными в данной области, с целью получения кодируемого белка, представляющего интерес. Далее белок необходимо будет очистить от балластных компонентов.
В определенных вариантах осуществления процесса может быть использован ряд систем экспрессии хозяина, чтобы изготавливать терапевтически важные белки. Также система экспрессии хозяина может быть системой для клетки млекопитающих (например, СНО, CHO-DBX11, CHO-DG44, CHO-S, СНО-K1, Vero, BHK, HeLa, COS, MDCK, HEK-293, NIH-3Т3, W138, ВТ483, Hs578T, НТВ2, ВТ20, T47D, NSO, CRL7030, HsS78Bst клеток, PER.C6, SP2/0-Agl4 и гибридомных клеток), включающей конструкции рекомбинантной экспрессии, содержащие промоторы, производные от генома клеток млекопитающих. Вирусные системы экспрессии также часто используются совместно с клетками млекопитающих. Эффективность экспрессии может быть улучшена за счет добавления элементов, включающих подходящие элементы усиления транскрипции и терминаторы транскрипции.
Также имеются варианты ведения процесса, при которых выбранный штамм клетки-хозяина, сам регулирует экспрессию введенных последовательностей или который модифицирует, обрабатывает генный продукт определенным требуемым образом. Различные клетки-хозяева имеют характерные и конкретные механизмы для посттрансляционной обработки и модификации белков и генных продуктов. Выбирая подходящие линии клеток или системы хозяина, можно обеспечить надлежащую модификацию и обработку экспрессированного полипептида (например, связующего полипептида).
Для перфузионного культивирования можно использовать любой биореактор, оснащенный для данного ведения процесса. Засевают биореактор при помощи аликвоты клеток с необходимой концентрацией (клетки из стартовой культуры, например, из качалочной колбы). Подходящая концентрация клеток для культуры зависит от нескольких факторов: тип клеток, тип, используемого биореактора.
При определенных условиях ведения процесса можно использовать биореактор одноразового типа, например, биореактор с эластичным мешком или пластиковой колбой, которые соединены с системой для удерживания клеток посредством гибких трубок. Биореактор одноразового типа используется обычно объемами от 1 лидо 150 л. Примерами одноразовых биореакторов являются биореакторы с мешком для культивирования клеток WAVE® (GE Healthcare, Pittsburgh, PA).
Рабочий объем реактора - это объем, занятый культуральной жидкостью. Обычно рабочий объем составляет 10-70% или более, однако предпочтительно не более чем 75%.
Часто используют биореакторы многоразового использования. Предпочтительно используют биореактор, изготовленный из нержавеющей стали или стекла.
Биореакторы связывают с системой удерживания клеток по-разному. Редко используются встроенные фильтры. Чаще используют внешние системы тангенциальной проточной фильтрации (TFF) с картриджем и системы фильтрации с чередующимся тангенциальным потоком (ATF).
Перфузионный процесс зависит от возможности удаления из культуральной жидкости сред, обедненных питательными компонентами и содержащих метаболиты, при минимальном воздействии на клетки. В изначальных методах удерживания клеток, в которых обедненную среду отделяли от культивированных клеток, часто происходило повреждение клеток вследствие создание сдвиговых усилий. В результате это приводило к засорению фильтров и отказу перфузионных систем, многие из которых являлись внутренними узлами биореактора.
Предшествующий уровень техники настоящего изобретения
Согласно патенту US 2013330787 известен способ культивирования в биореакторе. Предлагаемая в данном патенте система культивирования предназначена для культивирования прокариотических микроорганизмов и клеток дрожжей. К недостаткам данного способа культивирования клеток можно отнести несовершенную систему система самоочистки фильтроэлементов, поскольку система культивирования клеток на линии очистки фильтроэлементов содержат дополнительные насосы, которые выполняют функцию создания потока. Кроме того, для очистки фильтроэлемента применяется подача газа аппаратом подачи промывочных газов. Также известный способ не позволяет получить высокие концентрации клеток, имеется разрушительное воздействие на клетки. К недостаткам можно отнести невозможность использования одного и того же устройства с различными объемами реакторов, отсутствие возможности стерилизации системы перфузии паром в линии.
Кроме того, сохраняется потребность в способе перфузионной фильтрации для непрерывного культивирования культур клеток, обеспечивающем более высокую плотность клеток в культуре и, таким образом, более высокий выход представляющего интерес продукта.
Таким образом была поставлена задача разработать эффективный способ перфузионной фильтрации для непрерывного культивирования культур клеток с возможностью эффективной самоочистки фильтроэлементов в автоматическом режиме, обеспечивающий более высокую плотность клеток в культуре и, таким образом, более высокий выход представляющего интерес продукта.
Раскрытие сущности настоящего изобретения
Поставленная задача была решена авторами настоящего изобретения посредством разработки нового способа перфузионной фильтрации для непрерывного культивирования культур клеток в биореакторе, согласно которому обеспечивают культуральную среду, содержащую клетки в биорекаторе, отбирают культуральную жидкость из биореактора в автоматическом режиме с настройкой программного отбора жидкости, далее направляют культуральную жидкость с помощью насоса из биореактора в фильтродержатель, содержащий фильтроэлементы, где осуществляют задержание клеток и их возврат в биореактор, причем при задержании клеток на фильтроэлементах часть жидкости, не содержащей клетки, отводят на автоматизированную систему управления мембранных клапанов с программным обеспечением, представляющую собой 4 отдельные линии отвода фильтрата с датчиками давления, которые регистрируют изменение давления, скорость изменения давления, показывают степень загрязненности фильтроэлементов, с возможностью регулирования частоты открывания, закрывания мембранных клапанов (4.1-7.3), как указано на Фиг. 1, далее запускают режим самоочистки фильтроэлементов в автоматическом режиме, и проводят дополнительный отбор фильтрата при автоматизированном контроле отхождения фильтрата с заменой в биореакторе питательной среды на свежую.
Согласно предпочтительному варианту выполнения заявленного изобретения на каждой из четырех линий отвода фильтрата расположено по меньшей мере по три клапана (4.1-7.3).
Согласно наиболее предпочтительному варианту выполнения изобретения система перфузионной фильтрации для непрерывного культивирования культур клеток, включает насос (1) для подачи циркуляционной жидкости в систему, обеспечивающий создание тангенциального потока; фильтродержатель со сменными фильтроэлементами (2); автоматизированную систему управления мембранных клапанов с программным обеспечением, представляющую собой четыре отдельных линии отвода фильтрата с датчиками давления (3), позволяющие регистрировать изменение давления и скорость изменения давления, в свою очередь показывающие степень загрязненности фильтрующего элемента, с возможностью регулирования частоты открывания, закрывания мембранных клапанов (4.1-7.3) и запуска режима самоочистки фильтроэлементов в автоматическом режиме, где на каждой линии отвода фильтрата присутствуют три мембранных клапана, причем клапана (4.1; 5.1; 6.1; 7.1) и (4.3; 5.3; 6.3; 7.3) работают с возможностью обеспечения отсечение потока, а клапана (4.2; 5.2; 6.2; 7.2) работают с возможностью обеспечения создание потока, а также с возможностью обеспечения очистки фильтроэлементов в автоматическом режиме, при автоматизированном контроле отхождения фильтрата с заменой в биореакторе питательной среды на свежую. Согласно одному варианту осуществления насос представляет собой циркуляционный насос. Согласно другому варианту осуществления насос представляет собой перистальтический.
Таким образом согласно заявленному способу перфузионной фильтрации для непрерывного культивирования в биореакторе происходит постоянное поступление в биореактор с определенной скоростью свежей питательной среды и отвод с той же скоростью, отработанной культуральной жидкости с сохранением клеточной биомассы внутри реактора. Согласно заявленному способу автоматизированная система перфузионной фильтрации необходима для ведения непрерывного процесса культивирования с задержанием клеток с помощью фильтроэлементов и возвращения их в биореактор. Приведенная автоматизированная система имеет систему клапанов с датчиками давления, способствующих дополнительному эффективному промыванию фильтроэлементов и отводу фильтрата.
Технический результат заявленного способа заключается в повышении плотности культур клеток, что приводит к увеличению выхода продукта (например, рекомбинантного белка, антител).
Конструкция системы, используемой в способе перфузионной фильтрации, позволяет удерживать клетки в биореакторе, проводя процесс перфузии в щадящем режиме в течение продолжительного времени. Заявленный способ также позволяет использовать биореакторы меньшего объема по сравнению с классическим периодическим способом культивирования. Система значительно упрощает различные стадии биотехнологических процессов.
Следует отметить, что согласно заявленному способу постоянное выведение культуральной жидкости из биореактора в сборочную емкость повышает сохранность высоколабильных белков. Преимущество заявленного способа заключается также в достижении повышенной концентрации клеток и объемной производительности, в связи с чем он становится широко используемой стратегией в производстве вакцин. Также заявленная технология перфузионной фильтрации позволяет усовершенствовать технологии получения инактивированной вакцины, что в свою очередь может быть актуально в животноводстве.
Краткое описание чертежей
На Фиг. 1 представлена общая схема системы перфузионной фильтрации, применяемая в способе непрерывного культивирования клеток, включающая насос (1), фильтроэлементы (2). Клапаны первой линии (4.1; 4.2; 4.3), клапаны второй линии (5.1; 5.2; 5.3), клапаны третьей линии (6.1; 6.2; 6.3), клапаны четвертой линии (7.1; 7.2; 7.3; 7.4). На Фиг. 2 представлена трехмерная модель системы перфузионной фильтрации. Автоматическая система управления оснащена программным обеспечением, которое позволяет анализировать и контролировать степень загрязненности фильтроэлемента с помощью датчиков давления (3). Программное обеспечение регистрирует изменение давления и скорость изменения давления, что позволяет системе регулировать частоту открывания и закрывания клапанов на первой, второй, третьей и четвертой фильтратных линиях.
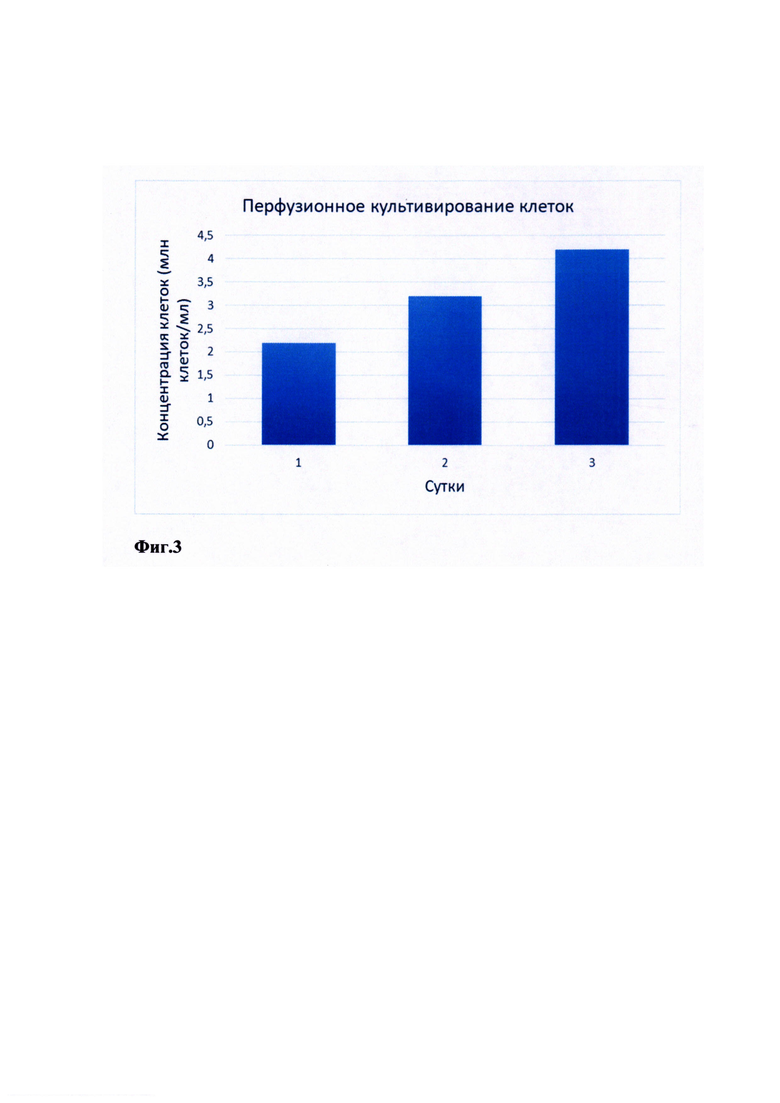
На Фиг. 3 представлены результаты эффективного культивирования клеток, заключающиеся в достижении в реакторах высоких клеточных плотностей.
Осуществление изобретения
Перед началом работы системы устройство необходимо простерилизовать. Стерилизацию можно провести в автоклаве или в линии паром или перекисью водорода. Система является многократно стерилизуемой.
Система перфузионной фильтрации согласно Фиг. 1 работает следующим образом: насос (1) подхватывает культуральную жидкость, содержащую клетки, из биореактора и направляет ее в фильтродержатель, в котором установлены фильтроэлементы (2). На фильтроэлементах происходит разделение клеток и культуральной жидкости, при этом клетки возвращаются в биореактор с потоком, часть жидкости, не содержащая клетки, отводится в фильтратные линии. Клапаны (4.1; 5.1; 6.1; 7.1) открыты, клапаны (4.3; 5.3; 6.3; 7.3) закрыты. Клапаны (4.2; 5.2; 6.2; 7.2) периодически открываясь, набирают жидкость внутрь корпуса клапанов (4.2; 5.2; 6.2; 7.2), и закрываются, тем самым вытесняя жидкость из корпуса и создавая необходимый поток. Периодичность закрытия/открытия клапанов (4.2; 5.2; 6.2; 7.2) происходит с интервалом времени, который задается системой автоматического управления. При закрытых клапанах (4.3; 5.3; 6.3; 7.3), клапаны (4.2; 5.2; 6.2; 7.2), периодически открываясь и закрываясь способствуют дополнительной очистке мембраны. При открытых (4.3; 5.3; 6.3; 7.3), клапаны (4.2; 5.2; 6.2; 7.2) позволяют отводить фильтрат из биореактора. Частота открытия/закрытия клапанов (4.2; 5.2; 6.2; 7.2) регулируется системой автоматического управления и зависит от степени загрязненности фильтроэлемента (2). При этом в биореакторе происходит смена питательной среды на свежую. Автоматическая система управления оснащена программным обеспечением, которое позволяет анализировать и контролировать степень загрязненности фильтроэлемента с помощью датчиков давления (3). Программное обеспечение регистрирует изменение давления и скорость изменения давления, что позволяет системе регулировать частоту открывания и закрывания клапанов (4.2; 5.2; 6.2; 7.2). Автоматизация системы с помощью мембранных клапанов и датчиков давления позволяет регистрировать падение эффективности работы фильтрующего элемента и запускает режим самоочистки.
Согласно основному аспекту заявленного изобретения было установлено, что принцип работы четырех отдельных линий отвода фильтрата с по меньшей мере тремя мембранными клапанами на каждой линии и датчиками давления приводят к эффективной самоочистке фильтроэлементов в автоматическом режиме. Предлагаемая система позволила также многократно ее использовать без необходимости регулярной замены одноразовых компонентов. Также в ходе экспериментов было выявлено максимальное снижение процента гибели клеток при очистке системы в процессе работы.
В соответствии с нижеприведенными примерами осуществления настоящего изобретения было установлено, что система позволяет использовать стерилизацию автоклавированием и паром в линии. Также были испытаны различные типы мембран из разных материалов и с разными порогами отсечения, в частности 0.65, 0.4, 0.2, 0.1 мкм; 10, 30, 50, 100, 500 кДа.
Работа автоматизированной системы самоочистки фильтроэлементов согласно заявленному способу позволяла оценить степень чистоты фильтров после каждого цикла перфузии. Согласно приведенным примерам чистота фильтров оценивалась по производительности фильтрата в конце процесса, а также непрерывно в ходе процесса в автоматическом режиме с помощью датчиков давления.
В ходе приведенных экспериментов была также установлена возможность увеличения концентрации клеток (СНО 120 млн./мл; PER.C6 200 млн./мл) и повышения объемной производительности.
Результаты по увеличению плотности клеток и увеличению выхода конечного продукта приведены в примерах 1-4.
Пример 1 (сравнительный пример)
Перфузионный процесс проводят в 2 этапа, сущность которых заключается в запуске биореактора, выращивании клеток, прохождение клеток через фильтр.
Второй этап заключается в открытии трех линий клапанов с целью запуска перфузионного процесса.
Использовали фильтр поливинилиден-фторид (F=0,2 м2; 300 кДа). Прогнали через установку 50 л Н2О. Далее произвели стерилизацию установки 6% Н2О2 50 л. Общее время стерилизации около пяти часов.
Загрузили в биореактор объемом 5 л клетки ВНК (клетки почки сирийского хомяка), использовали суспензионную среду и сыворотки. Концентрация клеток на момент запуска 0,5 * 106 млн. клеток/мл. Оставили культивироваться на 2-е суток.
Объем клеток составил 1,0 * 106 млн. клеток/мл спустя 2 суток циркуляции (отобраны пробы 2 раза по 70 мл). Объем среды в сосуде на момент начала перфузии составил 2 литра. До запуска перфузионной установки подтвердили стерильность. Открыли трубки входа и выхода в фильтр. Мощность насоса 50%. Воздух подавали для удаления воздушной пробки. Ph 6.44. Температура 32 градуса. Насос работал на 90 оборотах/мин.
Отобрали пробу клеток, произвели осмотр под микроскопом. Клетки находились в неделящейся фазе. Установили, что, проходя через насос, клетки бьются. Концентрация клеток не изменилась - 0,5 * 106 млн. клеток/мл.
Пример 2
Проводили стерилизацию паром в автоклаве.
Запускали работу биореактора, выращивали клетки, прогоняли клетки через фильтр. Открыли четыре линии клапанов с целью запуска перфузионного процесса. Далее осуществляли подготовку и стерилизацию в автоклаве паром. Загрузили 0,35 * 106 млн. клеток/мл в биореактор объемом 5 л. Использовали в качестве питательной среды суспензионную среду + сыворотку.
Объем клеток вырос до 0,98 * 106 млн. клеток/мл в биореакторе. Подсчет клеток производится под микроскопом, используя камеру Горяева. Взяли пробу. Обнаружено много разрушенных клеток под микроскопом. Добавили сыворотку на два дня. Циркуляционный насос мощность 15%.
Отобрали повторную пробу. Большинство клеток оказались разбитые (10% целые). Слили среду с клетками в биореакторе и добавили готовые клетки в биореактор объемом 3 литра 2,2 * 106 млн. клеток/мл. Добавили 2 л сыворотки. Насос циркуляции работает на 7,5%.
Результаты эксперимента:
- Циркуляционный насос разбивает клетки.
- Автоклавирование паром обеспечивает стерильность.
Пример 3
Заменили циркуляционный насос на перистальтический.
Проводили стерилизацию паром в автоклаве.
Запускали работу биореактора, выращивали клетки, прогоняли клетки через фильтр.
Открыли четыре линии клапанов с целью запуска перфузионного процесса.
Загрузили 3 литра клеток ВНК концентрацией 3.5 * 106 млн. клеток/мл.
Взяли две пробы по 70 мл на подсчет клеток: фильтрат и суспензия. Цвет пробы у фильтрата темнее, чем в пробе, отобранной в биореакторе.
Результаты эксперимента:
- Перистальтический насос не разбивает клетки.
- Клетки проходят через фильтр и осаждаются на нем.
- Необходима замена фильтра.
Пример 4
Используя результаты примера 3, разобрали систему. При снятии фильтра для промывки линий обнаружилось, что клетки осаждаются на нем. Далее использовали фильтр Paul, присоединенный к перфузионной системе. Открыли четыре линии клапанов с целью запуска перфузионного процесса.
Загрузили 3 л клеток и разбавили 2,5 л среды (суспензионная среда + сыворотка). Добавили пеногаситель. Концентрация клеток 2,2 млн. клеток/ мл. Насос 30% мощности. На первые сутки культивирования концентрация клеток увеличилась до 3,2 млн. клеток/мл. На вторые сутки культивирования концентрация клеток увеличилась до 4,2 млн. клеток/мл. Много конгломератов. Фильтрат чистый. Клетки не разбиваются.
Результаты эксперимента:
- Клетки проходят через фильтр и не осаждаются на нем.
- Концентрация клеток увеличивается каждые сутки.
- Достигается высокая концентрация клеток и, соответственно, высокая плотность клеток по сравнению с предшествующим уровнем техники и, в частности, по сравнению со сравнительным примером 1.
- В фильтрате отсутствуют клетки.
Таким образом, согласно настоящему изобретению перфузионные процессы проводятся непрерывным образом, позволяют работать с чувствительными к механическим воздействиям клетками, обеспечивают сохранность биомассы, обладают высокой эффективностью. Преимущества по сравнению с аналогами заключаются в достижении в реакторах высоких концентраций клеток, и, соответственно, высоких плотностей клеток (см. Фиг. 3, а также Пример 4), что, таким образом, приводит к увеличению выхода продукта, позволяя использовать биореактор меньшего объема по сравнению с другими способами.


Изобретение относится к биотехнологии. Представлен способ перфузионной фильтрации для непрерывного культивирования культур клеток в биореакторе, включающий следующие стадии: обеспечение культуральной среды, содержащей клетки в биорекаторе; отбор культуральной жидкости из биореактора в автоматическом режиме с настройкой программного отбора жидкости; направление культуральной жидкости с помощью насоса из биореактора в фильтродержатель, содержащий фильтроэлементы, где осуществляется задержание клеток и их возврат в биореактор, согласно которому при задержании клеток на фильтроэлементах часть жидкости, не содержащей клетки, отводят на автоматизированную систему управления мембранных клапанов с программным обеспечением, представляющую собой четыре отдельные линии отвода фильтрата с датчиками давления, которые регистрируют изменение давления. Скорость изменения давления показывает степень загрязненности фильтроэлементов, с возможностью регулирования частоты открывания, закрывания мембранных клапанов и запуска режима самоочистки фильтроэлементов в автоматическом режиме. Затем проводят дополнительный отбор фильтрата при автоматизированном контроле отхождения фильтрата с заменой в биореакторе питательной среды на свежую. Изобретение позволяет повысить плотность культур клеток и увеличить выход продукта. 3 з.п. ф-лы, 3 ил., 4 пр.
1. Способ перфузионной фильтрации для непрерывного культивирования культур клеток в биореакторе, включающий следующие стадии:
- обеспечение культуральной среды, содержащей клетки в биорекаторе;
- отбор культуральной жидкости из биореактора в автоматическом режиме с настройкой программного отбора жидкости;
- направление культуральной жидкости с помощью насоса из биореактора в фильтродержатель, содержащий фильтроэлементы, где осуществляется задержание клеток и их возврат в биореактор,
отличающийся тем, что
при задержании клеток на фильтроэлементах часть жидкости, не содержащей клетки, отводят на автоматизированную систему управления мембранных клапанов с программным обеспечением, представляющую собой четыре отдельные линии отвода фильтрата с датчиками давления, которые регистрируют изменение давления, скорость изменения давления, показывают степень загрязненности фильтроэлементов, с возможностью регулирования частоты открывания, закрывания мембранных клапанов и запуска режима самоочистки фильтроэлементов в автоматическом режиме, и проводят дополнительный отбор фильтрата при автоматизированном контроле отхождения фильтрата с заменой в биореакторе питательной среды на свежую.
2. Способ по п. 1, где насос представляет собой циркуляционный насос.
3. Способ по п. 1, где насос представляет собой перистальтический.
4. Способ по п. 1, где система управления мембранных клапанов является многократно стерилизуемой.
| US 2013330787 A1, 12.12.2013 | |||
| Ручной прибор для оттяжки на заготовках лезвий ножей, кос, лопат и т.п. | 1930 |
|
SU23816A1 |
| СПОСОБ ОЧИСТКИ ИМИГЛЮЦЕРАЗЫ | 2017 |
|
RU2668158C1 |
Авторы
Даты
2023-04-18—Публикация
2022-10-11—Подача