Область техники, к которой относится изобретение
Изобретение относится к области медицины и фармакологии и может быть использовано для лечения ожогов различного генеза и тяжести, острых и хронических ран различного генеза и тяжести, а также других заболеваний человека, связанных с нарушениями ангиогенеза и нейрогенеза, таких как трофические язвы, в том числе у больных диабетом, при заболеваниях пародонта, ишемии нижних конечностей, алопециях, при повреждениях нервной системы.
Уровень техники
Из уровня техники известен способ для лечения ожогов с помощью лекарственного средства на основе кондиционированной среды, полученной при культивировании МСК костного мозга человека (RU 2292212 C1). Кондиционированная среда содержит солевой состав и аминокислоты, пенициллин, амфотерицин, L-глутамин и ЭБС, достаточные для поддержания жизнеспособности и роста МСК костного мозга человека. При этом кондиционированную среду получают на стадии стационарного роста культуры стабильной клеточной линии МСК, находящихся в Go периоде клеточного цикла. Показано, что полученная среда обладает лечебным эффектом при термических ожогах.
Из уровня техники также известна композиция, предназначенная для регенерации кожи и слизистых оболочек, содержащая культуральную питательную среду, включающую биологически активные соединения на основе низкомолекулярных пептидов и цитокинов, используемая для культивирования in vitro эукариотических клеток и кондиционированная продуктами жизнедеятельности и ростовыми факторами эукариотических клеток, выделяемыми ими в питательную среду в процессе их культивирования (RU 2455354 C1). Данная композиция также содержит костномозговые МСК человека в количестве, по меньшей мере, 105 клеток/мл, а в качестве кондиционированной среды содержит культуральную питательную среду, кондиционированную продуктами жизнедеятельности и ростовыми факторами МСК, полученную на стадиях логарифмической фазы и стационарной фазы роста стабильной клеточной культуры клеток, содержащую биологически активные соединения на основе низкомолекулярных пептидов с молекулярной массой 6-8 кДа и низкомолекулярных веществ с молекулярной массой 2-3 кДа, соответствующих активным цитокинам. Стоит отметить, что культуральная питательная среда содержит ЭБС (эмбриональную бычью сыворотку).
Кроме того, из уровня техники известны способ и композиция для предотвращения или лечения кожных дефектов, включающий нанесение на кожный дефект композиции, содержащей МСК костного мозга или кондиционную среду, полученную от МСК, или их комбинацию (WO 2008155659 А2). К числу кожных дефектов, для лечения которых может быть использована композиция, относятся морщины, рубец, возрастное пятно, порез или язва. Следует отметить, что и в данном изобретении использована среда роста, содержащая ЭБС.
В указанных выше изобретениях для получения кондиционированной среды использованы МСК костного мозга. Однако по данным различных авторов МСК жировой ткани обладают более выраженными паракринными эффектами в отношении стимуляции роста кровеносных сосудов и нервов по сравнению с МСК костного мозга, использованными в данных изобретениях. Кроме того, в данных изобретениях кондиционированная среда включает в себя потенциально опасные животные компоненты в виде ЭБС.
Из уровня техники также известен способ получения обработанной среды, согласно которому проводят культивирование стволовых клеток в среде без факторов роста, содержащей десферроксамин, при этом стволовые клетки предварительно культивируют в ростовой среде, что обеспечивает получение кондиционированной среды, которая включает факторы, секретируемые данными стволовыми клетками (WO 2011127090 A1). Затем полученную кондиционированную среду отбирают и фильтруют с целью получения обработанной кондиционированной среды. Полученная таким способом среда может использоваться в составе композиции, дополнительно содержащей полимер, для лечения кожных ожогов.
Однако в данном изобретении для получения кондиционированной среды используется среда, не предназначенная специально для поддержания функционального состояния стволовых клеток.
Из уровня техники также известна кондиционированная культуральная среда, полученная при культивировании МСК, их потомства или клеточной линии, полученной из них, в культуральной среде. При этом МСК получают путем культивирования клеточной колонии эмбриональных стволовых клеток или их потомства, в отсутствие сокультуры и в бессывороточной среде, содержащей FGF2 (fibroblast growth factor 2) (US 2010323027 A1). Указанная среда может быть использована в составе композиции для лечения сердечной недостаточности, заболеваний костного мозга, заболеваний кожи, ожогов и дегенеративных заболеваний, таких как диабет, болезнь Альцгеймера, болезнь Паркинсона и рак.
Однако для поддержания МСК в функциональном состоянии при культивировании в бессывороточной среде путем добавления только одного ростового фактора - FGF2 может быть недостаточно, что оказывает негативное влияние на состав продуктов, секретируемых МСК в среду культивирования, и снижает регенеративный потенциал кондиционированной среды.
Из уровня техники также известен способ, включающий добавление регенеративных клеток в культуральную среду, при этом культуральная среда подобрана таким образом, чтобы обеспечивать рост и поддержание регенеративных клеток (в частности, МСК) и позволить секрецию благоприятствующих факторов из регенеративных клеток в культуральную среду так, чтобы образовывать кондиционированную среду. Затем из полученной кондиционированной среды выделяют экстракт, который не содержит целых клеток. Полученный экстракт и/или его компоненты используют для местного нанесения на участок кожи человека с целью стимулирования роста клеток кожи (WO 2010038232 A1). В заявке предлагается использование композиции, содержащей полученный экстракт, для лечения дерматологических нарушений и/или нарушений роста волос, но нет экспериментальных данных, подтверждающих возможность и эффективность лечения ожогов и ран предлагаемым средством.
Другим направлением в лечении заболеваний с помощью регенеративной терапии является использование частиц, секретируемых МСК. В частности, для лечения кожных заболеваний и ожогов могут быть использованы частицы, включающие везикулы или эксзосомы (WO 2009105044 A1). Описан способ получения частицы, включающий получение среды, кондиционированной МСК; концентрирование полученной среды, кондиционированной МСК; обработку сконцентрированной среды, кондиционированной МСК, путем гель-фильтрации; отбор фракции, которая демонстрирует динамическое рассеяние света, путем УФ-детектирования при 220 нм. При этом этап отбора фракции включает сбор фракций, которые элюируют со временем удерживания 11-13 минут. Полученная частица может быть использована в составе фармацевтической композиции, применяемой для лечения заболеваний с помощью подходов регенеративной медицины.
Однако, несмотря на то, что в последнее время получено значительное количество данных, указывающих на важную роль экзосом в реализации паракринных эффектов МСК, нет доказательств того, что именно фракция, описанная в изобретении, является ключевой для регенеративного действия этих клеток. Помимо этого, использование представленной в изобретении технологии значительно усложняет процесс производства конечного продукта.
Кроме того, недостатком указанных выше изобретений является отсутствие указаний на количественное содержание факторов, обеспечивающих эффективность изобретений.
Из уровня техники известен также способ лечения ожогов и ран с использованием мази «Солкосерил», содержащей депротеинизированный диализат из крови здоровых молочных телят, стандартизированный химически и биологически и обладающий регенеративным действием. Однако этот препарат представляет собой комплекс пептидов неизвестного состава, полученных из тканей животных, потенциально способный вызывать иммунные реакции и содержать инфекционные агенты животного происхождения.
Из уровня техники также известно, что в качестве материалов для закрытия дефектов кожи используют коммерческие продукты на основе живых кожных заменителей дермального, эпидермального или двойного типа:
1) Dermagraft (криоконсервированные аллогенные фибробласты человека из кожи крайней плоти новорожденных, выращенные на биосорбирующей сетчатой подложке из полиглактина);
2) OrCel (двухслойный матрикс из бычьего коллагена типа 1, на поверхности и в пористом слое которого культивируются аллогенные дермальные фибробласты, а на непористом слое - эпидермальные кератиноциты от того же донора);
3) Epicel (искусственно полученный эпидермальный аутотрансплантат, представляющий собой слой (от 2 до 8 слоев клеток) аутологичных кератиноцитов, культивированных ex vivo в присутствии мышиных фибробластов);
4) Invitrx CSS (Composite Skin Substitute) представляет собой 3-мерный кожный эквивалент, состоящий из дермальных аутологичных фибробластов, помещенных на коллаген/викриловую сетку, и верхнего слоя кератиноцитов.
Кроме того, среди таких решений стоит отметить перевязочное средство, которое может быть использовано для лечения нарушений кожного покрова различного генеза, в том числе ожогов (RU 103474 U1). Перевязочное средство включает биосовместимую прозрачную полимерную пленку толщиной 3-100 мкм со сквозными отверстиями диаметром 0,01-3,00 мкм, на одной из поверхностей которой выращен слой диплоидных клеток фибробластов легкого эмбриона человека, взятых от 6-20 пассажа и выращенных на пленке в бессывороточной среде в присутствии кондиционной среды от аналогичной культуры. Средство эффективно при лечении обширных трофических поражений кожи.
Помимо этого, известно двухслойное раневое покрытие с использованием клеточного материала человека, которое применяется для заживления ран разной площади и содержит гидратированную микробную целлюлозу с наслоенным на нее коллагеновьм гелем (RU 94151 U1). В слоях или на их границе присутствует, по крайней мере, один источник ростовых факторов, ускоряющий эпителизацию раны. В качестве источников ростовых факторов применяют клетки мезодермального и/или эктодермального типа и/или тромбоциты крови. Описаны комбинации клеточного материала, дающие высокий лечебный эффект заявляемого лекарственного раневого покрытия. Сочетание бактериальной целлюлозы и коллагенового геля в двухслойном покрытии для ран создает оптимальные условия для проявления свойств ростовых факторов.
Однако все указанные выше продукты содержат живые клетки человека, что увеличивает риски, связанные с биобезопасностью препаратов, усложняет процессы их производства, стандартизации и контроля качества, кроме того, с учетом отсутствия в РФ законов, регулирующих использование клеточных технологий, коммерциализация подобных продуктов в России затруднена.
Наиболее близким к заявляемому решению является средство для лечения, в том числе ран и ожогов, содержащее кондиционированную клеточную культуральную среду, полученную при культивировании эукариотических клеток в трех измерениях (RU 2280459 C1). Клеточные культуры, культивированные в трех измерениях, могут включать различные типы клеток, в том числе МСК, нервные стволовые клетки, фибробласты, эмбриональные стволовые клетки и др. Указанное средство содержит кондиционированную культуральную среду, из которой отделены клеточные культуры, и включает такие внеклеточные продукты, как факторы роста, противовоспалительные медиаторы, ферменты, цитокины, гормоны, факторы свертывания крови, регуляторные факторы, ангиогенные факторы или антиангиогенные факторы.
Однако в описании данного изобретения не представлено количественное содержание в кондиционированной среде факторов, обеспечивающих эффективность средства для лечения ран и ожогов, не раскрыты способы ее очистки, не подтверждено сохранение фармакологических свойств среды после процедуры лиофилизации.
Раскрытие изобретения
Задачей изобретения является создание нового лекарственного средства для лечения ожогов и ран, обладающего комплексным воздействием на различные этапы раневого процесса.
Техническим результатом, на достижение которого направлено заявленное изобретение, является получение лекарственного средства, с высокой эффективностью стимулирующего заживление ожогов и ран за счет регенеративного действия сбалансированного комплекса цитокинов и факторов роста, секретируемых мезенхимными клетками человека в культуральную среду, не содержащую животных компонентов. Эффективность средства обеспечивается за счет подобранного содержания ключевых факторов роста, необходимых для реализации регенеративного действия МСК, а именно фактора роста эндотелия сосудов (VEGF), фактора роста гепатоцитов (HGF), основного фактора роста фибробластов (bFGF) и ангиопоэтина 1 типа (Angpt-1), концентрацию которых измеряют с помощью иммуноферментного анализа (ELISA).
Поставленная задача решается тем, что способ получения средства для лечения ожогов и ран включает культивирование мезенхимных стромальных клеток жировой ткани (МСК ЖТ) человека 2-5 пассажей в среде роста до момента достижения концентрации общего белка в среде 3-4 мг/мл, отбор и очистку среды культивирования, содержащей продукты секреции МСК ЖТ человека, от остатков клеток, ее концентрирование до уменьшения исходного объема очищенной среды культивирования в 9-11 раз с получением стерильного концентрата, с последующей его лиофилизацией для получения средства, содержащего продукты секреции МСК человека, включающие ключевые факторы роста: FGF basic в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопоэтин-1 в концентрации от 0,5 до 10,0 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в 100 мл стерильного физиологического раствора, при этом среда роста содержит раствор Advance S ТЕМ Cell Culture Media (HyClone, USA), раствор антибиотиков Penicillin-Streptomycin (HyClone, USA), добавки AdvanceSTEM Stem Cell Growth Supplement (HyClone, USA), которые берут при следующем соотношении компонентов, об.%:
AdvanceSTEM Cell Culture Media - 85-95
Раствор антибиотиков Penicillin-Streptomycin - 0,95-1,05
Добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement - 9,5-10,5.
Культивирование может быть осуществлено в культуральных флаконах или чашках Петри (фирмы Corning или аналогичные), при этом клетки выращивают на плоской подложке с плотностью 5-15·103/см2 в среде роста в объеме 0,1-0,2 мл/см2 в условиях CO2 инкубатора при 37±1°C, 5%-ном содержании CO2 и относительной влажности ≥95% до достижения концентрации общего белка в среде 3-4 мг/мл или в биореакторе (BioFlo / CelliGen 115, New Brunswick, США), при этом клетки выращивают на микроносителях (например, FibraCel, 50 г микроносителей на 2-2,5 л среды) плотностью 106-107 клеток/см3 до достижения концентрации общего белка в среде 3-4 мг/мл. Очистка среды культивирования от отстатков клеток (клеточного дебриса) может быть реализована центрифугированием, например, при 5000±10 об/мин, температуре 6±2°C в течение 10 минут. Концентрирование очищенной среды культивирования осуществляют посредством ее ультрафильтрации с удалением низкомолекулярных соединений массой менее 5 кДа, при этом для получения стерильного концентрата дополнительно осуществляют микрофильтрацию полученного концентрата через фильтры с диаметром пор 0,22 мкм. Концентрирование может быть осуществлено с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной с использованием ультрафильтрационных кассет (Minimate TFF capsule, PALL) или аналогичных. Лиофилизация может быть осуществлен в 6-10 стадий при давлении 0,013-0,027 кПа, температуре от -45°C до 25°C, время лиофилизации не более 24 часов при максимальной загрузке лиофильной сушки.
Поставленная задача решается также тем, что средство для лечения ожогов и ран включает среду роста в виде лиофилизата, полученного по способу, описанному выше, который содержит ключевые факторы роста - FGF basic в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопоэтин-1 в концентрации от 0,5 до 10,0 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении 2,5±0,3 г лиофилизата в 100 мл стерильного физиологического раствора.
Поставленная задача решается также тем, что способ лечения ожогов и ран включает разведение средства, описанного выше, в стерильном физиологическом растворе или стерильной воде для инъекций, из расчета 2,5±0,3 г средства на 100 мл раствора или воды, пропитывание повязок или материалов для закрытия дефектов кожи с последующим нанесением пропитанных повязок и материалов на ожог или рану 1-2 раза в день в течение 3-7 дней или до начала эпителизации раны.
В качестве повязок могут быть использованы повязки с сорбционными свойствами на основе целлюлозы и ее производных (марля, вата и алигнин медицинской марки А или аналогичные); раневые целлюлозные повязки (Cosmopor steril, Германия или аналогичные) с гидрофобной микросеткой со стороны раны, всасывающей подушечкой из чистой ваты и мягкой основой из нетканого материала, покрытого гипоаллергенным полиакрилатным клеем; повязки на основе лигнина (Полифепан, Россия или аналогичные); атравматичные повязки с поглотительным слоем из целлюлозы, не приклеивающимся внутренним слоем и внешним водоотталкивающим слоем, препятствующим просачиванию секрета (повязка Zeruvit, Германия или аналогичные); повязки на основе карбоксиметилцеллюлозы (Aquacel, Великобритания), вискозы (Мероге, Германия), окисленной целлюлозы (Oxydized cellulose (США), Феранцел (Беларусь)) или аналогичные. В качестве материалов для закрытия дефектов кожи могут быть использованы атравматичные, сорбирующие покрытия на основе природных и синтетических полимеров: на основе натриевой соли карбоксиметилцеллюлозы (повязка Aquacel, Великобритания или аналогичные); на основе альгинатов (натриево-кальциевая соль альгиновой кислоты - полисахарида морских водорослей, Альгипор, (Россия), Sorbsan, Sorbalgon и Algosteril (США), Tegagel, Kaltostat и Fibracol (Великобритания), Comfeel Sea-Sorb (Дания) или аналогичные).
Таким образом, технический результат достигается за счет того, что лекарственное средство для лечения ожогов и ран получают при культивировании мезенхимных стромальных клеток человека в бессывороточной среде, поддерживающей рост недифференцированных стволовых и прогениторных клеток мезенхимного происхождения, путем сбора кондиционированной среды, содержащей цитокины и факторы роста, секретируемые клетками в культуральную среду, очистки и концентрирования полученной среды с помощью ультрафильтрации и ее стабилизации путем лиофилизации. Полученный лиофилизат разводят в стерильном физиологическом растворе и используют для местного лечения ожогов и ран путем пропитывания средств для перевязки.
Эффективность разрабатываемого лекарственного средства предполагает наличие целого комплекса воздействий, направленных на стимулирование пролиферации фибробластов кожи, реэпителизации (стимуляции базальных кератиноцитов), регуляцию процессов воспаления, а затем грануляцию вновь формирующейся ткани, и наконец, формирование стабильной сети сосудов и подрастание нервов. При этом необходимость восстановления сосудистой сети и нервных окончаний в зоне регенерации после ожогов является актуальной задачей. На сегодняшний день основной упор делается на быстрое закрытие раны и предотвращение развития воспаления. Это приводит к формированию рубца, развитию фиброза, а в ряде случае формированию келоидных рубцов. Использование среды культивирования, кондиционированной мезенхимными клетками человека, позволит решить весь комплекс проблем, возникающих при регенерации ткани после ожогов и ран. Предполагается, что ускоренное заживление кожных повреждений, в том числе за счет стимуляции васкуляризации и реиннервации, может быть осуществлено с помощью бессывороточной среды, содержащей комбинацию цитокинов и факторов роста, секретированных МСК человека. Данное решение позволяет получить оптимальное сочетание факторов роста, секретированных клетками человека - т.е. прошедших необходимые модификации и способствующее ангиогенезу и нейрогенезу в среде, не содержащей белков животного происхождения и бактериальных фрагментов.
Для получения кондиционированной среды нами использованы мультипотентные мезенхимные стромальные клетки (МСК) человека, отвечающие за репарацию и регенерацию тканей и органов как в норме, так и при повреждениях. Одним из наиболее богатых источников МСК у человека является жировая ткань. МСК могут быть легко выделены в результате ферментативной обработки образцов жировой ткани, полученной в результате косметической липосакции или в ходе хирургического удаления жирового отложения. Культивирование изолированных МСК жировой ткани (МСК ЖТ) приводит к получению относительно гомогенной популяции мультипотентных стромальных фибробластоподобных клеток.
В заявляемом изобретении могут быть использованы МСК, полученные самостоятельно по любому известному из уровня техники способу (см. Пример 1), и в виде коммерческих препаратов МСК, имеющих сертификат качества и предназначенных, в том числе, для клинического применения, например, такие как продукт АТСС (АТСС® PCS-500-011), представляющий собой МСК человека, выделенные из липоаспирата, культивированные до 2 пассажа и подвергнутые криоконсервации, или аналогичные.
Ранее на моделях ишемии конечности и инфаркта миокарда и подкожно имплантированного матригеля у животных нами было показано, что локальное и системное введение МСК ЖТ способствует увеличению количества сосудов в тканях с нарушенным кровоснабжением, приводит к улучшению кровотока в этих тканях и уменьшению или исчезновению симптомов ишемии. Кроме того, нами было выявлено, что введение МСК ЖТ способствует прорастанию нервных окончаний в подкожно имплантированный матригель и улучшает восстановление периферических нервов после травматического повреждения. Согласно данным наших исследований и работ других научных коллективов, основным механизмом, лежащим в основе регенеративного эффекта МСК ЖТ, является продукция этими клетками широкого спектра биологически активных цитокинов и факторов роста, ускоряющих процессы заживления и восстановления тканей после повреждения.
В большинстве протоколов выделения и культивирования МСК ЖТ используется среда с добавлением эмбриональной телячьей сыворотки (ЭТС) или фетальной бычьей сыворотки (ФБС). Эти сыворотки содержат необходимый коктейль факторов роста, гормонов и витаминов, стимулирующих клеточную адгезию и пролиферацию в условиях культивирования in vitro. В то же время накапливается все больше сведений о том, что клетки, выращенные с использованием сывороток животных, потенциально небезопасны, в частности, существует риск заражения прионами или вирусами культуры клеток при культивировании с использованием сывороток животных, а также возможность иммунной реакции со стороны организма реципиента. Кроме того, было показано, что длительное культивирование в присутствии ФБС значительно изменяет свойства клеток различного происхождения. Так, мезенхимные клетки костного мозга, культивированные в присутствие ФБС, характеризуются нестабильностью транскриптома, включая изменение экспрессии генов, ответственных за регуляцию клеточного цикла, апоптоз и клеточную адгезию.
Отличительной особенностью данного изобретения является использование специализированной среды, поддерживающей рост и функциональные свойства недифференцированных МСК человека и не содержащей животной сыворотки (AdvanceSTEM Cell Culture Media (HyClone, USA) с добавлением раствора антибиотиков Penicillin-Streptomycin (HyClone, USA) и добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement (HyClone, USA)), которые берут при следующем соотношении компонентов, об.%:
AdvanceSTEM Cell Culture Media - 85-95
Раствор антибиотиков Penicillin-Streptomycin - 0,95-1,05
Добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement - 9,5-10,5.
МСК выделяют из подкожной жировой ткани человека и культивируют в указанной среде роста до 2-5 пассажа. Затем к клеткам добавляют свежую среду роста и культивируют в условиях CO2 инкубатора до достижения заданной концентрации общего белка в среде. Кондиционированную среду, содержащую все продукты секреции МСК человека, собирают в стерильные емкости для центрифугирования, очищают путем центрифугирования от клеточного дебриса и полученный супернатант подвергают концентрированию с помощью процедуры ультрафильтрации, удаляя все низкомолекулярные соединения массой менее 5 кДа с уменьшением исходного объема в 9-11 раз. На этапе ультрафильтрации при использовании соответствующего оборудования и соблюдении асептических условий можно получить стерильный продукт. Если невозможно обеспечить стерильность продукта при процедуре ультрафильтрации, то добавляют этап микрофильтрации. Для этого концентрированную среду фильтруют через одноразовые стерильные фильтры с диаметром пор 0,22 мкм, достаточным для очистки от потенциально содержащихся в продукте микроорганизмов, а затем подвергают процедуре лиофилизации для получения итогового продукта (лиофилизат концентрированной среды, содержащей продукты секреции МСК человека), содержащего в том числе ключевые факторы роста, по которым проводится стандартизация конечного продукта. Так, при восстановлении 2,5±0,3 г лиофилизата в 100 мл стерильного физиологического раствора методом иммуноферментного анализа в растворе должны определяться FGF basic в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопозтин-1 в концентрации от 0,5 до 10,0 пкг/мл.
Технической особенностью данного изобретения является также возможность использования в качестве культуральной емкости для выращивания эукариотических клеток биореактора (BioFlo/CelliGen 115, New Brunswick, США или аналогичного), при этом клетки выращивают на специальных микроносителях (например, FibraCel, 50 г микроносителей на 2-2,5 л среды) с высокой плотностью, что позволяет в более сжатые сроки получить кондиционированную среду с заданными характеристиками.
Другой технической особенностью данного изобретения является возможность концентрировать кондиционированную среду с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной, используя ультрафильтрационные кассеты (Minimate TFF capsule, PALL) или аналогичные, что позволяет значительно ускорить процесс концентрирования и способствует лучшему сохранению биологически активных веществ в кондиционированной среде.
В результате осуществления данного изобретения получают лекарственное средство на основе цитокинов и факторов роста секретируемых МСК человека, используемое для лечения ожогов и ран, преимущественно, на ранних этапах раневого процесса, которым пропитывают повязки и материалы для закрытия дефектов кожи.
Краткое описание чертежей
Изобретение поясняется чертежами.
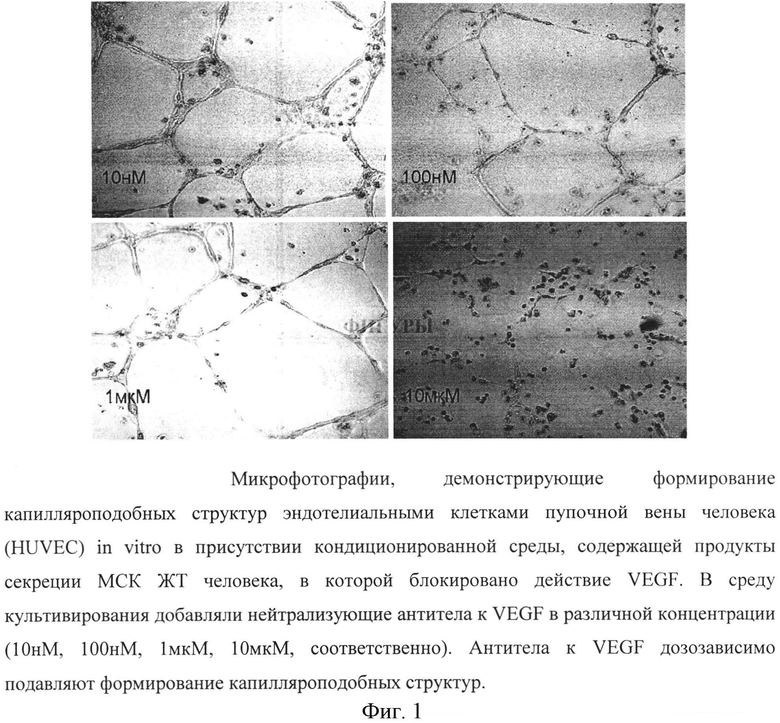
Фигура 1. Микрофотографии, демонстрирующие формирование капилляроподобных структур эндотелиальными клетками пупочной вены человека (HUVEC) in vitro в присутствии кондиционированной среды, содержащей продукты секреции МСК ЖТ человека, в которой блокировано действие VEGF. В среду культивирования добавляли нейтрализующие антитела к VEGF в различной концентрации (10 нМ, 100 нМ, 1 мкМ, 10 мкМ, соответственно). Антитела к VEGF дозозависимо подавляют формирование капилляроподобных структур.
Фигура 2. Микрофотографии культур фибробластов человека при культивировании в контрольной среде (А) и при культивировании в концентрированной кондиционированной среде, содержащей продукты секреции МСК ЖТ человека (Б).
Фигура 3. Диаграмма, отражающая изменения пролиферативного индекса фибробластов человека при культивировании в концентрированной кондиционированной среде, содержащей продукты секреции МСК ЖТ человека (темный столбик), и контрольной среде (светлый столбик), не содержащей сыворотки, через 24 часа после нанесения раны.
Фигура 4. Диаграмма, отражающая рост скорости миграции фибробластов человека при культивировании в концентрированной кондиционированной среде, содержащей продукты секреции МСК ЖТ человека (темный столбик), и контрольной среде, не содержащей сыворотки, через 24 часа после нанесения раны. * - p<0.05.
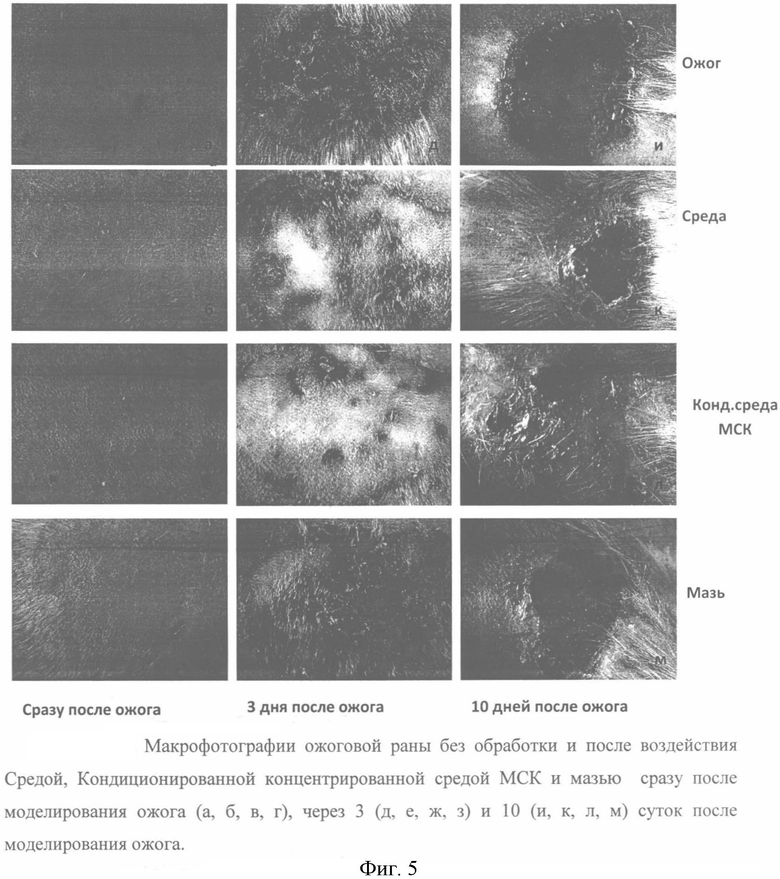
Фигура 5. Макрофотографии ожоговой раны без обработки и после воздействия средой, кондиционированной концентрированной средой МСК и мазью сразу после моделирования ожога (а, 6, в, г), через 3 (д, е, ж, з) и 10 (и, к, л, м) суток после моделирования ожога.
Фигура 6. Микрофотографии срезов кожи крыс через 20 суток в группе кондиционированная концентрированная среда МСК (гематоксилин-эозин). Масштабный отрезок соответствует 100 мкм (в-г) и 50 мкм (а-б). Восстановление структуры эпидермиса и дермы и волосяных фолликулов. Единичные мелкие сосуды в дерме.
Фигура 7. Микрофотографии срезов кожи крыс через 20 суток в группе мазь (гематоксилин-эозин). Масштабный отрезок соответствует 100 мкм (в, г) и 50 мкм (а, б). Крупные сосуды в дерме. Элементы воспаления, отложения коллагена (б, г). Нет восстановления эпителиального слоя и структуры дермы.
Фигура 8. Микрофотографии срезов кожи крыс через 20 суток в группе Физ. раствор (гематоксилин-эозин). Масштабный отрезок соответствует 100 мкм (г-е) и 50 мкм (а-в). Крупные отечные сосуды в дерме, элементы воспаления во всей толще дермы. Нет восстановления эпидермального слоя даже на границе перехода ожог/интактная ткань. Отложения коллагена.
Фигура 9. Микроскопическая картина раны на 3 сутки при смачивании повязки исследуемым лекарственным средством: А - увеличение 100, окраска по Ван-Гизону; Б - увеличение 600, окраска гематоксилином и эозином.
Фигура 10. Микроскопическая картина раны на 14 сутки при смачивании повязки исследуемым лекарственным средством, увеличение 100, окраска гематоксилином и эозином.
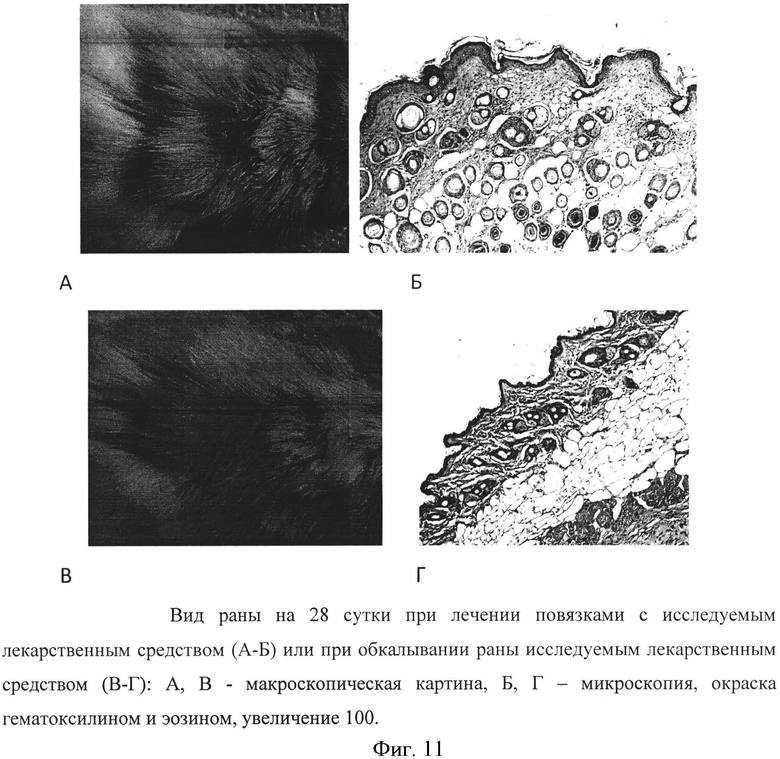
Фигура 11. Вид раны на 28 сутки при лечении повязками с исследуемым лекарственным средством (А-Б) или при обкалывании раны исследуемым лекарственным средством (В-Г): А, В - макроскопическая картина, Б, Г - микроскопия, окраска гематоксилином и эозином, увеличение 100.
Осуществление изобретения
Ниже представлено подробное описание изобретения на примерах конкретного выполнения, которые демонстрируют практическую осуществимость изобретения, но не ограничивают возможность осуществления изобретения с помощью иных средств и методов.
Пример 1. Получение МСК жировой ткани человека.
МСК выделяют из подкожного жирового отложения здоровых доноров обоих полов. Клетки выделяют из материала, полученного при проведении малого хирургического вмешательства под местной анестезией или в ходе плановых хирургических операций. Хирургический материал (15 г жировой ткани, взятой из околопупочной области или другой области локализации подкожного жира) помещают в одноразовую пробирку с буфером HBSS (HyClone), содержащим 5-кратную концентрацию антибиотика 500 ед./мл (HyClone).
В стерильных условиях культурального бокса биоптат фрагментируют до однородной массы, используя стерильные инструменты, после чего подвергают его ферментативной обработке в растворе, содержащем среду AdvanceSTEMтм (HyClone) /500 ед./мл антибиотика (HyClone), 200 ед./мл коллагеназы I типа и диспазы (40 ед/ml) (Worthington Biochemical) (соотношение объема ферментов и жира должно быть 1:1:1), при 37°C в течение 30-45 минут при постоянном помешивании. По окончании инкубации к образцу добавляют равный объем среды с сывороткой и фильтруют через нейлоновые мембраны с размером пор 100 мкм (BD). Профильтрованную суспензию центрифугируют в течение 5 мин при 200g, после чего супернатант полностью удаляют. Осадок клеток подвергают обработке буфером для лизиса эритроцитов (BD) до покраснения раствора, после чего центрифугируют в течение 5 мин при 200g. Супернатант полностью удаляют, а осажденные клетки ресуспендируют в среде роста МСК. Для культивирования мезенхимных клеток используют среду AdvanceSTEMтм support expansion and maintenance of undifferentiated human MSCs (HyClone) в сочетании с добавлением 10% раствора добавок AdvanceSTEMтм Stem Cell Growth Supplement (HyClone) и 100 ед./мл антибиотика (HyClone). Эта среда была разработана фирмой-производителем (HyClone) для культивирования недифференцированных МСК, в частности клеток, происходящих из жировой ткани без добавления сыворотки (http://www.thermo.com).
Выделенные мезенхимные клетки высевают в концентрации 200 тыс. в мл в чашках Петри и культивируют в среде роста в инкубаторе при 37°C и при 5%-ной концентрации CO2. При достижении 80% монослоя МСК ЖТ (0 пассаж) замораживают в жидком азоте и хранят в мастер-банке для дальнейшего использования с целью наработки среды.
Для наработки среды МСК ЖТ масштабируют. Перед снятием с поверхности культурального пластика клетки трехкратно промывают раствором Версена. Затем наносят в каждую чашку по 1 мл реагента для диссоциации клеток HyQTase (HyClone). При приобретении клетками округлой формы и откреплении их от подложки в каждую культуральную емкость вносят по 9 мл среды роста и интенсивно пипетируют клеточную суспензию. Затем клетки рассевают в соотношении 1:4.
Пример 2. Получение кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека.
Для получения кондиционированной среды МСК ЖТ наращивают до 2-5 пассажа. МСК ЖТ человека добавляют в количестве 5-15·103/см2 в культуральные емкости для выращивания эукариотических клеток и заполняют их свежей средой роста (AdvanceSTEM Cell Culture Media (HyClone, USA) (90±5 мл), раствор антибиотиков Penicillin-Streptomycin (HyClone, USA) (1,00±0,05 мл) и добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement (HyClone, USA) (10,0±0,5 мл) на 100 мл) в количестве 0,1-0,2 мл/см2, а затем культивируют в условиях CO2 инкубатора при 37±1°C, 5%-ном содержании CO2 и относительной влажности >95% до достижения концентрации общего белка в среде 3-4 мг/мл.
В качестве культуральных емкостей для выращивания эукариотических клеток используют культуральные флаконы или чашки Петри (фирмы Corning или аналогичные), при этом клетки выращивают на плоской подложке плотностью 5-15·103/см2.
Для ускорения и повышения эффективности процесса кондиционирования среды используют биореактор (BioFlo/ CelliGen 115, New Brunswick, США), при этом клетки выращивают на специальных микроносителях (FibraCel, 50 г микроносителей на 2-2,5 л среды) плотностью 106-107 клеток/см3. Для этого клетки в количестве 106-107/см3 помещают в сосуды биореактора (к одной управляющей станции подключены 2 сосуда, объем каждого сосуда 3 л), в каждый сосуд наливают до 2000 мл среды роста (AdvanceSTEM Cell Culture Media (HyClone, USA) (90±5 мл), раствор антибиотиков Penicillin-Streptomycin (HyClone, USA) (1,00±0,05 мл) и добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement (HyClone, USA) (10,0±0,5 мл) на 100 мл) и 50 г дисков FibraCel (New Bmnswick Scientific) и хорошо перемешивают. В течение 30 мин происходит прикрепление клеток к поверхности дисков FibraCel, после чего производится запуск работы биореактора, клетки культивируют при температуре 37±1°C, 5%-ном содержании CO2 и постоянном перемешивании 200 об/мин с помощью магнитной мешалки.
Культивирование клеток проводят до 6 дней. Ежедневно наблюдают за состоянием клеток, отбирают пробы культуральной среды (0,5 мл) и проводят анализ в ней общего белка. Если показатель концентрации общего белка в среде достигает интервала 3-4 мг/мл, начинают сбор кондиционированной среды: из 1 сосуда отбирают 1 л кондиционированной среды в стерильную емкость, после отбора в соответствующий сосуд биореактора вносят 1 литр свежей среды роста и продолжают процедуру культивирования. Сбор среды проводят ежедневно (по 1 л в день) до 1 месяца. По истечении этого срока клетки утилизируют, сосуды биореактора и диски промывают и подвергают автоклавированию.
Пример 3. Очистка и концентрирование кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека, методом ультрафильтрации.
Кондиционированную среду, содержащую все продукты секреции МСК ЖТ человека, собирают в стерильные емкости для центрифугирования, центрифугируют при (5000±10) об/мин, температуре (6±2) С, в течение 10 минут для очистки от клеточного дебриса. Полученный супернатант отбирают в новые стерильные емкости объемом 250-500 мл.
Концентрирование среды проводят с помощью системы фильтрации в тангенциальном потоке Minim II (Life Sciences), используя ультрафильтрационные кассеты (Minimate TFF capsule, PALL, 5 кДа) или аналогичные. Для этого питающий резервуар заполняют 500 мл кондиционированной среды, контролируя с помощью мерных цилиндров начальный объем раствора. Производительность насоса устанавливают на уровне 50 мл/мин, давление не более 2 атмосфер. С помощью мерного сосуда и таймера определяют начальную скорость фильтрации, собирая фильтрат в течение 10 минут, и рассчитывают время фильтрации 80% начального объема, исходя из начальной скорости, после чего устанавливают таймер на расчетное время. По мере концентрирования среды скорость фильтрации постепенно снижается, а производительность насоса и фильтрационное давление существенно не меняется. При уменьшении начального объема в 2 раза добавляют еще 500 мл кондиционированной среды в питающий резервуар. Затем процедуру повторяют еще необходимое количество раз для концентрирования всего объема кондиционированной среды, добавляя каждый раз по 500 мл кондиционированной среды. Осуществляя периодический контроль, добиваются уменьшения объема кондиционированной среды в 9-11 раз. После этого выключают насос, переносят возвращающий шланг в сосуд для сбора сконцентрированного раствора, включают насос и дожидаются осушения питающего резервуара. Для вытеснения остатков сконцентрированной среды в питающий резервуар добавляют фосфатно-солевой буфер/0,5% раствор антибиотиков Penicillin-Streptomycin (HyClone), включают насос и под визуальным контролем собирают концентрированную среду до момента выхода из системы всего сконцентрированного раствора.
Очищенную концентрированную среду подвергают микрофильтрации. Фильтрацию кондиционированной среды осуществляют через одноразовые стерильные фильтры с диаметром пор 0,22 мкм, обеспечивающие стерилизацию продукта. Среду подают на фильтры перистальтическим насосом. Фильтрат собирают в стерильную полипропиленовую емкость.
Пример 4. Лиофилизация концентрированной кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека.
Очищенную концентрированную фильтрованную среду подвергают процедуре лиофилизации для получения итогового продукта (лиофилизат концентрированной среды, содержащей продукты секреции МСК человека). Для этого разливают очищенную концентрированную фильтрованную среду по (10,0±0,1) мл в стерильные стеклянные флаконы емкостью 100 мл. Флаконы укупоривают бутиловыми резиновыми пробками для лиофилизации. Затем флаконы помещают в лиофильную сушку. Охлаждают до -45°C с контролем по температуре полок, затем 1 час выдерживают при указанной температуре. После этого включают конденсор, охлаждают его до -45°C, включают вакуумный насос и доводят давление до 0,027 кПа. Проводят следующие шаги:
1) ступенчатый нагрев до -40°C за 30 минут при давлении 0,013 кПа;
2) ступенчатый нагрев до -30°C за 60 минут при давлении 0,013 кПа;
3) ступенчатый нагрев до -10°C за 180 минут при давлении 0,013 кПа;
4) ступенчатый нагрев до -5°C за 180 минут при давлении 0,013 кПа;
5) плавный нагрев от -5°C до 0°C за 180 минут при давлении 0,013 кПа;
6) ступенчатый нагрев до 10°C за 60 минут;
7) ступенчатый нагрев до 25°C за 60 минут;
8) снижение температуры до 8°C (в течение 12 часов до отключения оператором);
9) девакуумирование до 0,05 кПа;
10) полная автоматическая укупорка резиновыми пробками;
11) сброс вакуума;
12) выгрузка флаконов.
Общая продолжительность процедуры лиофилизации не превышает 24 часов при полной загрузке лиофильной сушки. После выгрузки на флаконы надевают алюминиевые колпачки и завальцовывают их с помощью ручной машины для обжима колпачков.
Пример 5. Выявление ключевых факторов, опосредующих регенеративные эффекты среды, кондиционированной МСК жировой ткани человека.
В многочисленных исследованиях было показано, что МСК-ЖТ секретируют в среду культивирования широкий спектр биологически активных веществ, факторов роста и цитокинов, играющих важную роль в процессах регенерации и репарации.
Одним из важнейших проангиогенных факторов, играющих центральную роль в стимуляции пролиферации и миграции эндотелиальных клеток, является VEGF. Как было показано ранее, МСК ЖТ секретируют VEGF в среду культивирования. Для выявления вклада VEGF в стимулирующий эффект кондиционированной среды МСК-ЖТ на образование капилляроподобных структур эндотелиальными клетками действие VEGF блокировали. Для этого в среду культивирования эндотелиальных клеток, содержащую кондиционированную среду от МСК ЖТ, добавляли блокирующие антитела против VEGF (Abeam, ab9570) в концентрации 0,1 мкг/мл. В качестве отрицательного контроля для нейтрализующих антител использовали неспецифические изотипические иммуноглобулины мыши.
Добавление блокирующих антител против VEGF человека приводило к значительному подавлению эффекта среды культивирования на стимуляцию образования тубулярных структур - в среднем на 57% (40% и 65%) (Фиг. 1). Следует отметить, что этот эффект был тем больше выражен, чем выше были показатели содержания мРНК VEGF в клетках (r=0,64, p=0,09) и уровня продукции VEGF в среду культивирования (r=0,94, p=0,02). Таким образом, на модели образования капилляроподобных структур эндотелиальными клетками было подтверждено, что VEGF, основной фактор роста эндотелиальных клеток, является необходимым для реализации паракринных эффектов кондиционированной среды МСК ЖТ человека.
Для выявления других ключевых факторов использовали последовательное исключение наиболее важных, согласно данным литературы, факторов, продуцируемых МСК ЖТ. Для этого в среду культивирования добавляли блокирующие антитела к плацентарному фактору роста (PLGF), HGF, FGFb, ангиопоэтину-1, ангиогенину, тромбоспондину-1, ингибитору активатора плазминогена 1 типа (PAI-1) и анализировали способность такой среды стимулировать формирование капилляроподобных структур эндотелиальными клетками на Матригеле.
Добавление блокирующих антител против HGF (Abeam, GeneTex), ангиопоэтина-1 (MyBioSource, LifeSpan Biosciences) и FGFb (antibodies-online Inc.) имело наиболее выраженный эффект и приводило к подавлению стимуляции образования тубулярных структур. Антитела к ангиогенину (LifeSpan Biosciences, santa cruz biotechnology, inc.) оказывали умеренный эффект по снижению стимулирующей ангиогенез активности среды культивирования МСК ЖТ, антитела к PLGF (GeneTex, RnDSystems), тромбоспондину-1 (Invitrogen), PAI-1 (antibodies-online Inc.) такого эффекта не оказывали (Таблица 1).

С учетом полученных результатов стандартизацию кондиционированной среды, содержащей продукты секреции МСК ЖТ человека, проводят по концентрации четырех ключевых факторов роста: VEGF, HGF, FGFb, Angpt-1.
Пример 6. Метод оценки концентрации ключевых факторов, опосредующих регенеративные эффекты среды, кондиционированной МСК жировой ткани человека.
Оценку содержания VEGF, HGF, FGF basic (FGFb), Angpt-1 в восстановленном в 100 мл стерильного физиологического раствора лиофилизате концентрированной среды, содержащей продукты секреции МСК человека, проводят методом иммуноферментного анализа (ELISA). В растворе должны определяться FGFb в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопоэтин-1 в концентрации от 0,5 до 10,0 пкг/мл.
Оценка содержания FGFb с использованием набора фирмы R&D Systems Human FGF basic Quantikine ELISA Kit
Для определения концентрации FGFb методом ELISA используют коммерческий набор фирмы R&D Systems (Human FGF basic Quantikine ELISA Kit, cat#DFB50) или аналогичный.
Используя стандартизированный раствор FGFb, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл FGFb, каждая последующая содержала FGFb в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора FGFb троекратно наносят в лунки 96-луночный планшет и инкубируют на шейкере в течение 12 часов при 4°C. Планшет отмывают буфером Wash Buffer и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против FGFb человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания HGF с использованием набора фирмы R&D Systems Human HGF Quantikine ELISA Kit.
Для определения концентрации HGF методом ELISA используют коммерческий набор фирмы R&D Systems (Human HGF Quantikine ELISA Kit, cat#DHG00) или аналогичный.
Используя стандартизированный раствор HGF, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл HGF, каждая последующая содержала HGF в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора HGF троекратно наносят в лунки 96-луночного планшета и инкубируют на шейкере в течение 12 часов при 4°C. Планшет отмывают буфером Wash Buffer и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против HGF человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания ангиопоэтина-1 с использованием набора фирмы R&D Systems Human Angiopoietin-1 Quantikine ELISA Kit.
Для определения концентрации ангиопоэтина-1 методом ELISA используют коммерческий набор фирмы R&D Systems (Human Angiopoietin-1 Quantikine ELISA Kit, cat#DANG10) или аналогичный.
Используя стандартизированный раствор ангиопоэтина-1, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл ангиопоэтина-1, каждая последующая содержала ангиопоэтина-1 в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора ангиопоэтина-1 троекратно наносят в лунки 96-луночный планшет и инкубируют на шейкере в течение 12 часов при 4°C. Планшет отмывают буфером Wash Buffer и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против ангиопоэтина-1 человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания VEGF с использованием набора фирмы R&D Systems Human VEGF Quantikine ELISA Kit.
Для определения концентрации VEGF методом ELISA используют коммерческий набор фирмы R&D Systems (Human VEGF Quantikine ELISA Kit, cat#DVE00) или аналогичный.
Используя стандартизированный раствор VEGF, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл VEGF, каждая последующая содержала VEGF в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора VEGF троекратно наносят в лунки 96-луночного планшета и инкубируют на шейкере в течение 12 часов при 4°C. Планшет отмывают буфером Wash Buffer и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против VEGF человека. Через 3 часа инкубации планшеты отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Пример 7. Специфическая активность лекарственного средства на основе цитокинов и факторов роста, секретируемых МСК жировой ткани человека, на моделях in vitro.
Для оценки способности разрабатываемого лекарственного средства эффективно стимулировать заживление кожных повреждений использовали два типа клеток входящих в состав кожи - эпидермиса и дермы - линейные эпителиальные клетки и первичные дермальные фибробласты человека 4-5 пассажа, полученные от здоровых доноров.
Клетки культивировали в среде DMEM с добавлением 10% эмбриональной телячьей сыворотки. Для моделирования условий зарастания раны использовали модель клеточной раны (scratch assay), воспроизводящую условия зарастания раны после повреждения (Фиг. 2). Для этого клетки высаживали на чашки Петри в концентрации 200 тыс. кл./мл для эпителиальных клеток и 100 тыс. кл./мл для дермальных фибробластов и культивировали в стандартных условиях до достижения субконфлюентного монослоя. Затем клетки депривировали 2 и 12 часов соответственно.
Стерильным наконечником 1000 мкл на монослое клеток наносили стандартную по ширине царапину длиной 2 см и заливали клетки концентрированной кондиционированной средой, содержащей продукты секреции МСК ЖТ человека. В качестве отрицательного контроля использовали среду DMEM без сыворотки. В качестве положительного контроля использовали среду DMEM с добавлением 10% эмбриональной телячьей сыворотки. Клетки культивировали 24 часа, а затем оценивали пролиферацию и жизнеспособность клеток, подсчитывая митотические клетки в ране и рассчитывая пролиферативный индекс (Фиг. 3). Клетки промывали дважды раствором Версена и фиксировали, а затем подсчитывали по 10 полей зрения в каждой лунке. Пролиферативные характеристики фибробластов и кератиноцитов оценивали также в режиме реального времени, регистрируя показания через каждые 15 минут в течение первых 8 часов культивирования клеток в присутствии концентрированной кондиционированной среды, содержащей продукты секреции МСК ЖТ человека, или контрольной среды с использованием аппарата xCELLigence (Roche). Использование этого метода позволяет наблюдать изменение клеточного индекса в режиме реального времени. Результаты были аналогичны полученным на модели клеточной раны.
Миграцию фибробластов в рану оценивали, измеряя просвет раны через каждые 3 часа с момента нанесения раны. Динамику закрытия раны оценивали, проводя по 5 измерений в разных зонах раны (Фиг. 4).
При исследовании действия концентрированной кондиционированной среды, содержащей продукты секреции МСК ЖТ человека, на кератиноциты не было обнаружено достоверных различий, однако во всех проведенных исследованиях наблюдалась тенденция к увеличению пролиферации, жизнеспособности и миграции кератиноцитов.
Пример 8. Специфическая активность лекарственного средства на основе цитокинов и факторов роста, секретируемых МСК жировой ткани человека, на модели ожогового повреждения у крыс in vivo.
Поскольку лекарственное средство предполагается использовать для лечения ожогов и ран, его потенциальную эффективность оценивали на экспериментальной модели ожогового повреждения кожи in vivo. Для моделирования ожога горячим паром использовали установку, состоящую из стеклянной термостойкой колбы объемом 100 мл, на горлышко которой плотно был насажен пластиковый цилиндр внутренним диаметром 2,5 см и высотой 12 см. Колбу на 2/3 заполняли водой и все время нагревали с помощью лабораторной газовой горелки, добиваясь стойкого постоянного кипения воды. Животных наркотизировали (хлоралгидрат 400 мг/кг внутрибрюшинно) и подносили к пластиковому цилиндру плотно, но не укладывали животное на цилиндр. Время выполнения ожога было подобрано в предварительных сериях эксперимента. Экспозицию паром выполняли в течение 2 сек. Крысу располагали над паром так, чтобы ожог формировался не в центре спины, в области позвоночника, а сбоку от него, ниже лопатки справа или слева от позвоночника. В этом случае на спине формируется аккуратное пятно круглой формы с диаметром 2,5 см.
В исследование были включены 90 крыс линии Wistar. Были сформированы 5 групп животных по 18 крыс в группе (по 6 крыс для каждой точки выведения животных из эксперимента):
1) группа с термическим ожогом без терапии (№1 - Ожог);
2) группа с термическим ожогом и нанесением препарата сравнения (мазь «Левомеколь», Нижфарм, Россия), 200 мкл/прием, 1 раз в 3 дня (№2 - Мазь);
3) группа с термическим ожогом и подкожным введением под область ожога 0,9 мл стерильного физиологического раствора, 1 раз в 3 дня (№3 - Физ. р-р);
4) группа с термическим ожогом и подкожным введением под область ожога 0,9 мл контрольной среды, не содержащей продуктов секреции МСК ЖТ человека, 1 раз в 3 дня (№4 - Среда);
5) группа с термическим ожогом и подкожным введением под область ожога 0,9 мл лекарственного средства на основе цитокинов и факторов роста, секретируемых МСК ЖТ человека, 1 раз в 3 дня (№5 - Кондиционированная концентрированная среда МСК).
С учетом фаз заживления ожогов из эксперимента животных выводили на 3 (оценка воспалительной реакции), 9 (оценка развития регенеративных процессов) и 20 (оценка ремоделирования ткани и заживления) сутки.
Согласно полученным данным, подкожное введение лекарственного средства на основе цитокинов и факторов роста, секретируемых МСК ЖТ человека, один раз в три дня приводит к более быстрому заживлению раны (Фиг. 5). Так, на 20 сутки после нанесения ожога наблюдается уменьшение площади раны при введении субстанции по сравнению с другими группами (ожог без лечения, лечение препаратом сравнения - мазью «Левомеколь», подкожное введение физиологического раствора или контрольной среды). Исследование гистологических препаратов кожи крыс после ожога методами световой и поляризационной микроскопии выявило, что через 20 суток в зоне ожога в группах животных, получавших терапию исследуемым лекарственным средством, происходит восстановление эпидермиса и дермы и отхождение струпа (Фиг. 6). В группах животных, у которых для лечения ожогов использовали контрольную среду или препарат сравнения (мазь «Левомеколь»), также есть участки восстановления дермы (Фиг. 7). Однако формирование слоя эпидермиса происходит фрагментарно и не у всех животных. Для групп негативного контроля (ожог без лечения и подкожное введение физиологического раствора) восстановление кожи наблюдается по периферии раны (Фиг. 8). В центре можно видеть отложения коллагена, расширенные капилляры/мелкие сосуды и очаги воспаления. Это свидетельствует о незавершенном процессе грануляции и воспаления в зоне регенерации. Таким образом, полученные результаты указывают на положительную динамику и комплексное восстановление тканей кожи после ожога через 20 суток только при использовании лекарственного средства на основе цитокинов и факторов роста, секретируемых мезенхимными клетками человека.
Пример 9. Специфическая активность лекарственного средства на основе цитокинов и факторов роста, секретируемых МСК жировой ткани человека, на модели механической раны у мышей in vivo.
Вторая модель, использованная для изучения специфической активности лекарственного средства in vivo, представляет собой модель глубокой механической раны, края которой для предупреждения стягивания были подшиты к пластиковому кольцу. На данной модели, в отличие от модели ожогового поражения кожи паром, использовали режим введения исследуемого лекарственного средства только на самых ранних этапах раневого процесса (в течение первых 3 дней после моделирования раны) как в качестве средства для смачивания марлевых повязок, так и в виде подкожных инъекций. В качестве препарата сравнения использовали повязки, пропитанные мазью «Левомеколь». Исследование проводили на 60 белых беспородных мышах (по 12 мышей в каждой группе).
Полученные результаты у животных опытных групп, которым применяли для лечения исследуемое лекарственное средство как в виде аппликаций в течение 3 дней, так и в виде инъекций, уже на этом сроке наблюдения показали различия в течении раневого процесса. Так, у животных в опытных группах в ране отсутствовал фибрин, экссудация и гиперемия окружающих тканей были слабо выражены, отмечалось набухание краев раны, что свидетельствовало о стихании воспаления, в то же время отмечалось появление фибробластов в инфильтрате, что указывало на начало фазы пролиферации (Фиг. 9). Смещение пика фазы воспаления в этих группах на более ранний срок наиболее вероятно связано с действием факторов роста и цитокинов, содержащихся в исследуемом лекарственном средстве. К концу фазы пролиферации на 14 сутки от начала эксперимента в контрольных группах наблюдали продолжающийся процесс эпителизации раневой поверхности, тогда как у животных опытных групп отмечали полное заживление раны и признаки процесса ремоделирования тканей, что указывало на более высокие темпы регенерации при использовании исследуемого препарата (Фиг. 10). К 28 суткам наблюдения восстановление дериватов кожи наблюдали только в опытных группах (Фиг. 11). При этом действие исследуемого лекарственного средства не зависело от способа введения. Сходные результаты были отмечены в группах как при применении средства в виде аппликаций на марлевых повязках в течение трех дней, так и в виде микроинъекций в дно и окружающие ткани сразу после нанесения раны.
Пример 10. Параметры контроля качества получаемого средства.
Описание: средство представляет собой лиофилизат (аморфную массу) белого цвета с сероватым оттенком. После растворения в стерильной воде - прозрачный раствор темно-розового цвета.
Подлинность: в восстановленном растворе должны определяться ключевые факторы роста в концентрации FGF basic от 2 до 4 пкг/мл; HGF от 40 до 80 пкг/мл; VEGF от 200 до 800 пкг/мл; ангиопоэтин-1 от 0,5 до 10,0 пкг/мл. Определяют методом ИФА.
Растворимость: не более 2 минут.
Прозрачность: восстановленный раствор должен быть прозрачным.
Цветность: восстановленный раствор должен быть темно-розовым или не превышать эталон R4.
Механические включения: видимые механические включения должны отсутствовать в растворе. РД 42-501-98 «Инструкции по контролю на механические включения инъекционных лекарственных средств» при определении видимых механических включений.
pH: от 6,5 до 7,5. Определяют потенциометрическим методом по ГФ XII, ч. 1, с. 89.
Потеря в массе при высушивании: Не более 5%. Определяют весовым методом,
ГФ XI.
Стерильность: должно быть стерильным. Контроль проводят методом мембранной фильтрации (ГФ XII, ч. 1, с. 150).
Бактериальные эндотоксины: содержание бактериальных эндотоксинов должно быть не более 5 ЕЭ/мл. Определяют в хромогенном кинетическом ЛАЛ-тесте, ГФ XII.
Нуклеиновые кислоты: содержание ДНК не более 35 мкг/мл. Определяют спектрофотометрически.
Количественное определение: Концентрация общего белка 3-4 мг/мл. Определяют спектрофотометрически.
Специфическая активность: коэффициент активности должен составлять не менее 1,1. Определяют на модели стимуляции пролиферации фибробластов человека in vitro.
Метод определения специфической активности: специфическую активность опытного образца средства определяют по способности стимулировать пролиферацию линейных фибробластов кожи человека. Для этого линейные фибробласты человека 6-7 пассажа снимают с чашек Петри с помощью реагента для диссоциации клеток HyQTase, ресуспендируют в среде DMEM с добавлением 10% ЭБС (HyClone) и раствора антибиотиков/антимикотиков (HyClone) и высаживают для проведения исследования в 24-луночный планшет (Costar) в концентрации 2×105 клеток в мл в объеме 250 мкл на лунку. Клетки культивируют в течение суток, затем депривируют в течение 12 часов в среде DMEM без сыворотки. Для функционального теста в лунки с депривированными фибробластами добавляют по 250 мкл опытного образца средства. В качестве положительного контроля используют среду роста фибробластов (DMEM), содержащую 10%» ЭБС (HyClone), в качестве отрицательного контроля - DMEM без сыворотки в аналогичных объемах. Клетки культивируют 24 часа, после чего среду удаляют, клетки промывают теплым фосфатно-солевым буфером (ФСБ), фиксируют 4% раствором парафармальдегида (Рапгеас) в ФСБ в течение 5 минут, затем промывают дистиллированной водой три раза по 5 минут и окрашивают раствором гематоксилина (Merck). Подсчитывают число клеток с помощью счетчика клеток. Подсчитывают число окрашенных клеток на поле зрения в 10 полях зрения на каждую лунку. Индекс специфической активности опытного образца средства рассчитывают как отношение числа клеток в лунках, содержащих испытуемое средство, к числу клеток в лунках, содержащих среду роста фибробластов с добавлением 10% ЭБС.
Таким образом, применение лекарственного средства на основе цитокинов и факторов роста, секретируемых МСК ЖТ человека, в лечении глубокой обширной раны у лабораторных животных как в виде аппликаций (смачивание марлевой повязки) в течение первых трех суток после нанесения раны, так и в виде инъекций в дно раны и окружающие ткани сразу после нанесения раны способствует более высоким темпам процессов регенерации за счет сокращения сроков воспалительной и пролиферативной фаз.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА | 2015 |
|
RU2620167C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2652902C1 |
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ/СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2620342C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2653779C1 |
| СПОСОБ ОЦЕНКИ АНГИОГЕННОГО ПОТЕНЦИАЛА ПРОГЕНИТОРНЫХ КЛЕТОК У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ | 2011 |
|
RU2548801C2 |
| СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ В ИШЕМИЗИРОВАННЫХ ТКАНЯХ | 2011 |
|
RU2497529C2 |
| Бесклеточные терапевтические средства для регенеративной медицины и способы их получения | 2018 |
|
RU2742034C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ ПОРАЖЕНИЙ ТКАНЕЙ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2012 |
|
RU2522778C2 |
| КОМПОЗИЦИЯ ДЛЯ НЕЙРОПРОТЕКЦИИ И СТИМУЛЯЦИИ НЕЙРОРЕГЕНЕРАЦИИ ГОЛОВНОГО МОЗГА ПОСЛЕ ПОВРЕЖДЕНИЯ, СРЕДСТВО НА ЕЕ ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2803286C1 |
| Способ биотехнологического восстановления кожного покрова аллогенными стволовыми клетками человека | 2017 |
|
RU2687007C2 |








Группа изобретений относится к медицине, а именно к биотехнологии, и может быть использована для лечения ожогов и ран. Для этого получают средство способом, включающим культивирование мезенхимных стромальных клеток жировой ткани (МСК ЖТ) человека 2-5 пассажа в среде роста до момента достижения концентрации общего белка в среде 3-4 мг/мл. Проводят отбор и очистку среды культивирования и ее концентрирование до уменьшения исходного объема очищенной среды культивирования в 9-11 раз с получением стерильного концентрата, с последующей его лиофилизацией. Средство содержит продукты секреции МСК человека, включающие ключевые факторы роста: FGF basic в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопоэтин-1 в концентрации от 0,5 до 10,0 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в 100 мл стерильного физиологического раствора. При этом среда роста содержит раствор AdvanceSTEM Cell Culture Media, раствор антибиотиков Penicillin-Streptomycin и добавки AdvanceSTEM Stem Cell Growth Supplement при следующем соотношении компонентов, об.%: AdvanceSTEM Cell Culture Media - 85-95, раствор антибиотиков Penicillin-Streptomycin - 0,95-1,05, добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement - 9,5-10,5. Группа изобретений относится также к способу лечения ожогов и ран. Использование данной группы изобретений позволяет стимулировать заживление ожогов и ран за счет регенеративного действия сбалансированного комплекса цитокинов и факторов роста, секретируемых мезенхимными клетками человека в культуральную среду. 3 н. и 7 з.п. ф-лы, 11 ил., 1 табл.,10 пр.
1. Способ получения средства для лечения ожогов и ран, включающий культивирование мезенхимных стромальных клеток жировой ткани (МСК ЖТ) человека 2-5 пассажа в среде роста до момента достижения концентрации общего белка в среде 3-4 мг/мл, отбор и очистку среды культивирования, содержащей продукты секреции МСК ЖТ человека, от остатков клеток, ее концентрирование до уменьшения исходного объема очищенной среды культивирования в 9-11 раз с получением стерильного концентрата, с последующей его лиофилизацией для получения средства, содержащего продукты секреции МСК человека, включающие ключевые факторы роста: FGF basic в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопоэтин-1 в концентрации от 0,5 до 10,0 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в 100 мл стерильного физиологического раствора,
при этом среда роста содержит раствор AdvanceSTEM Cell Culture Media (HyClone, USA), раствор антибиотиков Penicillin-Streptomycin (HyClone, USA), добавки AdvanceSTEM Stem Cell Growth Supplement (HyClone, USA), которые берут при следующем соотношении компонентов, об.%:
AdvanceSTEM Cell Culture Media - 85-95
раствор антибиотиков Penicillin-Streptomycin - 0,95-1,05
добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement - 9,5-10,5.
2. Способ по п. 1, характеризующийся тем, что культивирование осуществляют в культуральных флаконах или чашках Петри (фирмы Corning или аналогичные), при этом клетки выращивают на плоской подложке с плотностью 5-15·103/см2 в среде роста в объеме 0,1-0,2 мл/см2 в условиях CO2 инкубатора при 37±1°C, 5%-ном содержании CO2 и относительной влажности ≥95% до достижения концентрации общего белка в среде 3-4 мг/мл.
3. Способ по п. 1, характеризующийся тем, что культивирование осуществляют в биореакторе (BioFlo/CelliGen 115, New Brunswick, США), при этом клетки выращивают на микроносителях (например, FibraCel, 50 г микроносителей на 2-2,5 л среды) плотностью 106-107 клеток/см3 до достижения концентрации общего белка в среде 3-4 мг/мл.
4. Способ по п. 1, характеризующийся тем, что очистку среды культивирования осуществляют центрифугированием.
5. Способ по п. 1, характеризующийся тем, что концентрирование очищенной среды культивирования осуществляют посредством ее ультрафильтрации с удалением низкомолекулярных соединений массой менее 5 кДа, при этом для получения стерильного концентрата дополнительно осуществляют микрофильтрацию полученного концентрата через фильтры с диаметром пор 0,22 мкм.
6. Способ по п. 1, характеризующийся тем, что лиофилизацию осуществляют в 6-10 стадий при давлении 0,013-0,027 кПа, температуре от -45°C до 25°C, время лиофилизации не более 24 часов при максимальной загрузке лиофильной сушки.
7. Способ по п. 4, характеризующийся тем, что центрифугирование осуществляют при 5000±10 об/мин, температуре 6±2°C в течение 10 минут для очистки от клеточного дебриса.
8. Способ по п. 1, характеризующийся тем, что концентрирование осуществляют с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной с использованием ультрафильтрационных кассет (Minimate TFF capsule, PALL) или аналогичных.
9. Средство для лечения ожогов и ран в виде лиофилизата, полученного по п. 1, включающего ключевые факторы роста - FGF basic в концентрации от 2 до 4 пкг/мл, HGF в концентрации от 40 до 80 пкг/мл, VEGF в концентрации от 200 до 800 пкг/мл, ангиопоэтин-1 в концентрации от 0,5 до 10,0 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении 2,5±0,3 г лиофилизата в 100 мл стерильного физиологического раствора.
10. Способ лечения ожогов и ран, включающий разведение средства по п. 9 в стерильном физиологическом растворе или стерильной воде для инъекций, из расчета 2,5±0,3 г средства на 100 мл раствора или воды, пропитывание повязок или материалов для закрытия дефектов кожи с последующим нанесением пропитанных повязок и материалов на ожог или рану 1-2 раза в день в течение 3-7 дней или до начала эпителизации раны.
| Способ электрической стыковой сварки | 1943 |
|
SU69449A1 |
| КОНДИЦИОННАЯ СРЕДА, ОБЛАДАЮЩАЯ ЛЕЧЕБНЫМ ЭФФЕКТОМ | 2005 |
|
RU2292212C1 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И РЕГЕНЕРАЦИИ КЛЕТОК, А ТАКЖЕ СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2006 |
|
RU2341270C2 |
| WO 2010038232 A1, 08.04.2010 | |||
| РАСУЛОВ М.Ф | |||
| Трансплантация мезенхимальных стромальных клеток костного мозга для лечения термических ожогов кожи // Автореферат дмн, Москва, 2007. | |||
Авторы
Даты
2016-01-27—Публикация
2014-09-30—Подача