ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области минеральных микрочастиц, состоящих из гидроксида алюминия, фосфата алюминия или фосфата кальция или их смесей, для применения в качестве системы для доставки или адсорбции биомолекул, например, для применения в качестве адъювантов вакцин. Конкретнее, настоящим изобретением предоставляются органически дериватизированные микрочастицы гидроксида алюминия, фосфата алюминия или фосфата кальция, их применения и способы их получения.
УРОВЕНЬ ТЕХНИКИ
Минеральные адъюванты, такие как алюминийсодержащие адъюванты, включая фосфат алюминия, гидроксид алюминия и фосфат кальция, успешно использовались в течение десятилетий для усиления иммунного ответа на убитые, инактивированные и субъединичные вакцинные антигены. Алюминийсодержащие адъюванты в настоящее время являются наиболее широко используемыми адъювантами как в ветеринарных вакцинах, так и в вакцинах для человека. Это вызвало большой интерес к повышению эффективности этих минералсодержащих адъювантов. Более эффективные адъюванты и вакцины означают потенциально упрощенные и сокращенные мероприятия по вакцинации, что является способом потенциально снизить нагрузку на пациентов, медицинский персонал и улучшить соотношение между затратами и выгодами.
Важный аспект эффективности адъювантов зависит от доставки и презентации антигенов клеточной или гуморальной ветвям иммунной системы в дренирующем лимфатическом узле. Количество или загрузка антигена, адсорбированного адъювантом, (представленная в весовом отношении), является одним важным параметром, поскольку оно (она) обусловливает вероятность того, что некоторые молекулы антигена вместе с адъювантом будут распознаваться как чужеродный материал и индуцировать соответствующий иммунный ответ. Достижение более высоких доз антигена на единицы адъювантов является потенциально желательным, поскольку это позволяет снизить адъювантную нагрузку в случае одинаковой дозы антигена, что может снизить затраты на производство. Сила и природа связывания антигена с адъювантом представляет собой другой важный параметр, поскольку он обусловливает вероятность того, что антиген будет представлен в виде частиц (связан с частицами адъюванта) вместо высвобождения в свободной форме в окружающую физиологическую среду. Это может быть особенно актуально в случае небольших растворимых пептидов с высокими константами диффузии, на самом деле, пептиды в качестве вакцин, как общеизвестно, индуцируют слабую иммуногенность и нуждаются в адъювантах ((Li, W., Joshi, M. D., Singhania, S., Ramsey, K. H., & Murthy, A. K. (2014). Peptide vaccine: progress and challenges. Vaccines, 2(3), 515-536.]). Относительно сильное связывание с частицами будет снижать вероятность десорбции антигена и его диффузии в среду и избегания распознавания антигенпрезентирующими клетками, что ограничивает эффективность вакцины. Однако исследования показали, что слишком сильная адсорбция антигенов на алюминийсодержащих адъювантах может привести к снижению эффективности вакцины из-за недостаточного процессирования и презентации адсорбированных антигенов антигенпрезентирующими клетками (Hansen B. et al., Relationship between the strength of antigen adsorption to an aluminum-containing adjuvant and the immune response, Vaccine, 2007). Таким образом, вакцинное сообщество и индустрия находятся под давлением необходимости лучше контролировать способ максимальной доставки антигенов в сочетании с адъювантами. Возможным ключом к этой проблеме является возможность конструировать адъюванты, адаптированные к физико-химическим особенностям антигена, который должен быть доставлен.
Другой аспект эффективности адъюванта может быть связан с размером частиц. Например, Morefield и др. (Morefield G.L. et al., Role of aluminum-containing adjuvants in antigen internalization by dendritic cells in vitro, Vaccine, 2005) и Li и др. (Li X. et al., Aluminum hydroxide nanoparticles show a stronger vaccine adjuvant activity than traditional aluminum hydroxide micro-particles, J. Control. Release, 2014) установили, что алюминийсодержащие частицы меньшего размера работают лучше по сравнению с более крупными частицами, в частности, для индукции специфических для антигенов гуморальных ответов, поскольку более мелкие частицы могут переноситься в ближайшие афферентные лимфатические узлы. В настоящее время доступно множество методов уменьшения размера частиц, таких как обработка ультразвуком, сдвиг при высоком давлении, фильтрация, гомогенизация, измельчение, микрофлюидизация, осаждение или рекристаллизация. Кроме того, хорошо известны протоколы синтеза, которые приводят к получению частиц определенного размера. Регулировка параметров синтеза, таких как стехиометрическое соотношение Al3+ и PO43- (или OH) и pH, потенциально может привести к частицам разного размера (Burrell L.S. et al., Aluminium phosphate adjuvants prepared by precipitation at constant pH. Part I: composition and structure, Vaccine, 2000; Burrell L.S. et al., Aluminium phosphate adjuvants prepared by precipitation at constant pH. Part II: physicochemical properties, Vaccine, 2000).
Однако остается потребность в улучшенных способах, которые требуют меньше времени и затрат, которые обеспечивают лучший контроль над единообразием размера частиц и которые позволяют получить минеральные микрочастицы с оптимальными антигенсвязывающими свойствами.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В одновременно рассматриваемой международной заявке PCT/EP 2017/076232 авторы настоящего изобретения описывают, каким образом перемешивание суспензии минеральных микрочастиц некоторых солей двух- или трехвалентных металлов, выбранных из фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, или их смесей, в водном растворе одного или более неорганических полифосфатов, например, растворе неорганического полифосфата, вызывает модификацию указанных минеральных микрочастиц, что приводит как к значительному изменению их номинального электростатического потенциала, так и к уменьшению размера частиц.
Без ограничения какой-либо теорией предполагается, что эти модификации вызваны реакцией замещения, или обменом лигандами, гидроксидных или ортофосфатных групп неорганический полифосфат-ионами на поверхности указанных минеральных микрочастиц.
Авторы настоящего изобретения в то время обнаружили, что аналогичная реакция замещения или обмена лигандами может быть достигнута с использованием органических полифосфатов общей формулы 1A или 1B:
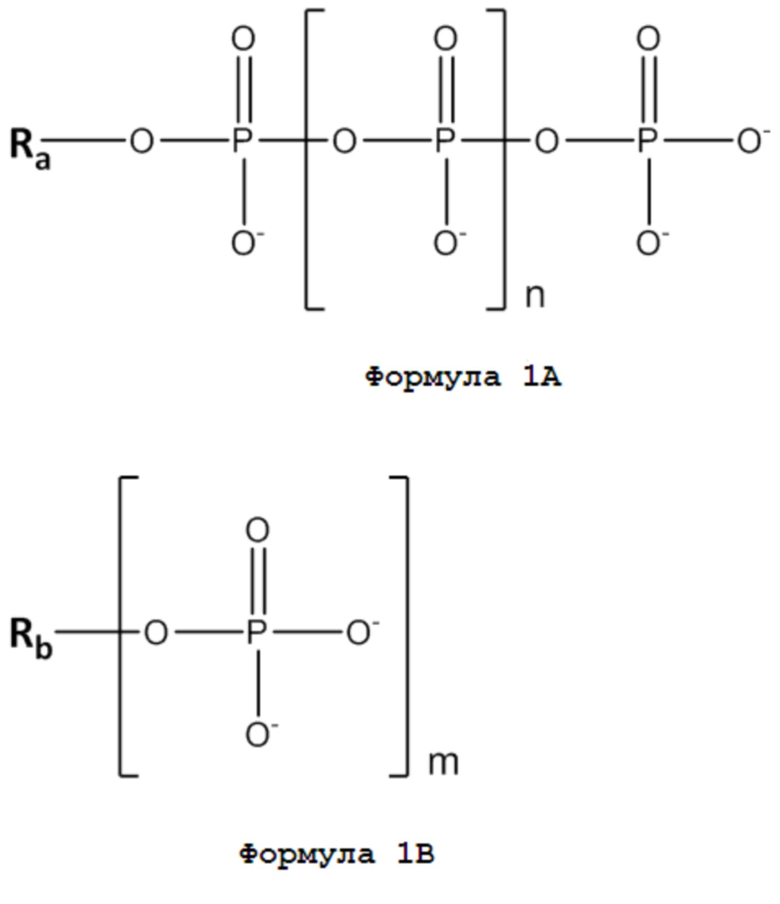
где n представляет собой целое число в диапазоне от 0 до 5, а m представляет собой целое число в диапазоне от 2 до 10, и где Ra обозначает органические заместители, выбранные из аденозина и других нуклеозидов, тиаминов, углеводов и изопренов, а Rb обозначает органические заместители, выбранные из инозитов и других циклитов, а также углеводов.
Таким образом, органические полифосфаты в соответствии с настоящим изобретением могут рассматриваться как «полифосфаты» на основании того, что они содержат по крайней мере одну полифосфатную группу -O-PO2-(-O-PO2-)n-O-PO3, где n представляет собой целое число в диапазон от 0 до 5, или содержат от двух до десяти фосфатных групп, -O-PO3.
В качестве примеров органических полифосфатов формулы 1A можно упомянуть аденозин и другие нуклеозидфосфаты, такие как АТФ и АДФ, тиаминфосфаты, такие как тиаминтрифосфат и -дифосфат, полифосфаты углеводов, такие как α-D-рибозо-5-трифосфат и L-аскорбиновая кислота-2-трифосфат, фосфаты птерина и фосфаты изопреноидов, такие как геранилдифосфат.
В качестве примеров органических полифосфатов формулы 1B можно упомянуть инозитфосфат и фосфаты других циклитов, такие как инозитбисфосфат (IP2), инозиттрисфосфат (IP3), инозиттетрафосфат (IP4), инозитпентакисфосфат (IP5) и инозитгексафосфат (IP6), также известный как фитиновая кислота или фитат (в виде соли). Дальнейшие примеры формулы 1B включают фосфаты углеводов, такие как глюкозо-1,6-бисфосфат, фруктозо-1,6-бисфосфат, фруктозо-2,6-бисфосфат, рибулозо-1,5-бисфосфат, 2-дезокси-D-рибозо-1,5-бисфосфат и 1,3- и 2,3-дифосфоглицерат.
Настоящее изобретение, раскрытое здесь, обеспечивает неожиданные преимущества по сравнению с раскрытием одновременно рассматриваемой международной заявки PCT/EP 2017/076232. Использование органических полифосфатов общей формулы 1A или 1B приводит к увеличению выхода реакции на поверхности частиц, что приводит к большему покрытию поверхности. Как следствие, наблюдается более значительное изменение номинального электростатического потенциала микрочастиц, чем раньше, и контролировать уменьшение размера частиц, по-видимому, проще, поскольку стабильность получаемых в результате более мелких органически дериватизированных минеральных микро- и наночастиц вроде бы выше. Во-вторых, и это наиболее важно, использование органических полифосфатов, особенно общей формулы 1B, приводит к более высокой термостойкости конечных модифицированных минеральных микрочастиц, чем может быть достигнуто с неорганическими полифосфатами, описанными в одновременно рассматриваемой международной заявке PCT/EP 2017/076232, что важно для автоклавирования/стерилизации. Наконец, адсорбционная емкость по отношению к антигенам, как показано на примере модельного антигена лизоцима куриного яйца (HEL), органически дериватизированных минеральных микрочастиц в соответствии с настоящим изобретением выше таковой, наблюдаемой у модифицированных неорганическими полифосфатами микрочастиц, описанных в совместно рассматриваемой международной заявке PCT/EP 2017/076232. Авторы настоящего изобретения полагают, что это, вероятно, вызвано хелатным эффектом положительно заряженных остатков в белках и полипептидах, таких как лизин и аргинин, в отношении органических полифосфатов общей формулы 1B, в частности, что приводит к более сильной адсорбции на поверхности частиц.
Органические полифосфаты общей формулы 1A могут иметь более низкую термостойкость, чем полифосфаты общей формулы 1B. Нуклеотиды (примеры органических полифосфатов общей формулы 1A) представляют собой биологические многофункциональные молекулы, которые играют центральную роль в энергетическом метаболизме, синтезе ДНК и передаче сигналов в клетках. Они состоят из нуклеозидной составляющей с моно-, ди- или трифосфатной группой в 5'-положении -озной составляющей. Из-за сродства фосфатов к алюминийсодержащим гелям такие нуклеотиды, как АТФ, адсорбируются на алюминийсодержащих адъювантах и, следовательно, могут использоваться для изменения электростатического потенциала поверхности частиц адъюванта. Аналогичным образом, частицы алюминийсодержащего адъюванта могут использоваться для переноса и доставки нуклеотидов в клетки. Однако алюминийсодержащие адъюванты, как правило, стерилизуют в автоклаве, что несовместимо с химической целостностью нуклеотидов. В условиях высокой температуры и давления, встречающихся при автоклавировании, будет происходить гидролиз фосфорных ангидридных связей неорганической полифосфатной цепи АДФ или АТФ, и физические и химические свойства этих молекул будут утрачены или изменены неблагоприятным образом. В качестве альтернативы автоклавированию растворы концентрированных АТФ, АДФ или АМФ с концентрацией до 100 мМ в воде можно стерилизовать фильтрованием через мембрану с порами размером 0,22 мкм или 0,10 мкм, а стерилизованные растворы загружать в автоклавированные частицы алюминийсодержащего адъюванта до соответствующей конечной концентрации, например от 0,5 мМ до 2 мМ, что устраняет необходимость в автоклавировании.
Реакция с органическими полифосфатами формулы 1A или формулы 1B была проведена с некоторыми солями двух- или трехвалентных металлов, выбранными из фосфата алюминия, гидроксида алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, но применима к широкому ряду других минеральных микрочастиц.
Реакция замещения, или обмен лигандами, может быть проведена в широком диапазоне температур, который совместим с водной реакционной средой.
На протяжении настоящей заявки термин «немодифицированная минеральная микрочастица» будет относиться к исходному материалу для указанной реакции замещения/обмена лигандами, тогда как термин «органически дериватизированная минеральная микрочастица» будет относиться к результату или продукту указанной реакции замещения/обмена лигандами.
На фиг. 6А представлена предполагаемая реакция между исходным материалом минеральной микрочастицы (здесь: фосфатом алюминия) и раствором органического полифосфата, которая происходит на поверхности микрочастицы. Упоминаемый в настоящем контексте фосфат алюминия (адъюванты) по существу представляет собой гидроксифосфат алюминия, в котором некоторые гидроксильные группы (Al-OH) были замещены ортофосфатными группами (Al-OPO3, обозначаемыми Pi). Реакция происходит в основном между доступными группами Al-OH и растворенными органический полифосфат-ионами и со временем приводит к постепенному более полному покрытию поверхности частиц фосфата алюминия органическими полифосфатными группами (обозначенными nPorg). В реакции замещения предположительно также участвуют ортофосфатные группы; т.е. так что доступные ортофосфатные группы до некоторой степени замещаются органическими полифосфатными группами. Однако предполагается, что гидроксильные группы являются лучше уходящими группами, чем ортофосфатные группы, и поэтому предпочтительно замещаются.
Исходный материал минеральных микрочастиц фактически состоит из кластеров/агрегатов более мелких кристаллитов, как это видно с помощью электронной микроскопии на фиг. 6С. Предполагается, что кристаллиты удерживаются вместе, по крайней мере частично, при помощи водородных связей между гидроксильными группами, расположенными на частицах. Как только гидроксильные группы начинают обмениваться на органические полифосфатные группы, уменьшение числа водородных связей ослабляет когезию кристаллитов. В то же время, растущее число близко расположенных органических полифосфатных групп с их множественным отрицательным зарядом приводит к дальнейшей дестабилизации кластера кристаллитов и его возможной дезагрегации (фиг. 6B), как это видно с помощью электронной микроскопии (фиг. 6C).
Однако по сравнению с модифицированными неорганическим полифосфатом минеральными микрочастицами, описанными в одновременно рассматриваемой международной заявке PCT/EP 2017/076232, стабильность полученных органически дериватизированных минеральных микрочастиц по настоящему изобретению увеличена. Во-первых, фосфоэфирная связь в молекуле типа 1B имеет гораздо более высокую энергию активации, чем фосфорная ангидридная связь между двумя ортофосфатами (в молекуле общей формулы 1A), что дает возможность выполнять термообработку для стерилизации без гидролиза большей части фосфатных групп и, следовательно, сохранению свойств в виде модификации такими органическими полифосфатами. Во-вторых, и без ограничения какой-либо теорией, авторы настоящего изобретения полагают, что повышенная стабильность частиц в суспензии (коллоиде) обусловлена, по крайней мере частично, растущим стерическим препятствиям, создаваемым органическими фосфатными группами, которые сами присоединились к поверхности минеральной микрочастицы. Органический остаток (Ra или Rb) органических фосфатных групп намного больше, чем неорганический полифосфат-ионы, обсуждаемые в PCT/EP 2017/076232. Следовательно, после того, как некоторые из первоначальных гидроксильных или ортофосфатных групп, расположенных на поверхности минеральных микрочастиц, были замещены органическими полифосфатными группами, доступ к оставшимся гидроксильным или ортофосфатным группам становится эффективно заблокированным для дальнейшего замещения.
Кроме того, авторы настоящего изобретения обнаружили, что органически дериватизированные минеральные микрочастицы обладают увеличенными способностями к связыванию положительно заряженных биомолекул или биомолекул с участками положительного заряда, конкретнее антигенсвязывающими свойствами. Это свойство предположительно обусловлено увеличенным притяжением положительно заряженных биомолекул, таких как антигены, к поверхности указанных органически дериватизированных минеральных микрочастиц, что приводит к повышенной адсорбционной емкости и/или силе связывания, т.е. увеличению константы ассоциации. Ввиду этого органически дериватизированные минеральные микрочастицы в соответствии с настоящим изобретением могут, например, применяться в качестве улучшенных адъювантов вакцин.
Соответственно, в первом аспекте здесь обеспечивается способ получения органически дериватизированных минеральных микрочастиц, который включает перемешивание суспензии исходного материала минеральных микрочастиц в растворе одного или более органических полифосфатов, причем указанные минеральные микрочастицы выбраны из микрочастиц фосфата алюминия, гидроксида алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция или их смесей, и причем указанный органический полифосфат выбран из соединений формулы 1A или 1B:

где n представляет собой целое число в диапазоне от 0 до 5, а m представляет собой целое число в диапазоне от 2 до 10, и где Ra обозначает органические заместители, выбранные из аденозина и других нуклеозидов, тиаминов, углеводов и изопренов, а Rb обозначает органические заместители, выбранные из инозитов и других циклитов, а также углеводов.
Перемешивание продолжают в течение времени, достаточного для допуска протекания реакции на поверхности минеральной микрочастицы, посредством которой доступные гидроксидные и в некоторой степени также ортофосфатные группы обмениваются, т.е. замещаются органическими полифосфат-ионами. Реакции замещения можно позволить протекать в течение более короткого или более длительного периода, чтобы вызвать частичное или более полное замещение ионов.
Вышеупомянутая химическая реакция может быть описана как реакция обмена лигандами или замещения лиганда, посредством которой гидроксид-анионы, расположенные на поверхности исходного материала минеральных микрочастиц, обмениваются на органический полифосфат-ионы. Поскольку фосфатные группы в органический полифосфат-ионах обладают гораздо большим сродством к Al(III), чем гидроксидные группы, равновесие смещается вправо (например: AdjuPhos+nPorg → AdjuPhos-nPorg+OH-), в соответствии с принципом Ле Шателье.
Описанная выше реакция обмена лигандами/замещения, как правило, происходит в водной реакционной среде и может проводиться в диапазоне температур от приблизительно 0 до приблизительно 100 градусов Цельсия (°C), например, от 5 до 95°C, или от 10 до 90°C, или от 15 до 85°C, или от 20 до 80°C, или от 25 до 75°C, или от 30 до 70°C, или от 40 до 60°C. Реакцию удобно проводить при температуре окружающей среды или при приблизительно 20°C ± 5-10°C. Реакцию замещения или обмен лигандами также можно проводить при умеренном давлении при температурах выше >100°C.
Во время реакции обмена лигандами/замещения размер частиц уменьшается по сравнению с размером исходных (немодифицированных) частиц. Уменьшение размера зависит от того, насколько далеко позволили протекать реакция замещения, от скоростей реакции и продолжительности реакции. Скорости реакции являются комплексными, поскольку они зависят от таких параметров, как конкретный исходный материал, тип органического полифосфата, начальная концентрация органических полифосфатов, pH основного объема растворителя, температура реакции и межфазные эффекты (на границе раздела поверхности частицы и основного объема растворителя).
За ходом реакции можно следить либо в режиме реального времени путем измерения in situ, либо в автономном режиме путем отбора проб и последующего анализа отобранной пробы. Таким образом, квалифицированному специалисту не потребуется никакой изобретательской работы для установления правильного периода реакции для определенной комбинации исходного материала минеральных микрочастиц с органическими полифосфатами. Например, использование ионной хроматографии позволило бы количественно оценить количество органических полифосфат-ионов, исчезающих из основного объема раствора, в зависимости от времени, и предоставить непрямое определение количества таких ионов, которые адсорбированы на поверхности частиц фосфата алюминия или фосфата кальция. В качестве альтернативы, прямое измерение органических полифосфат-ионов, адсорбированных на поверхности частиц, может быть осуществлено с помощью чувствительных электрохимических методов, таких как электрохимическая сканирующая туннельная микроскопия (STM), электрохимическая проницаемость кристаллов кварца (EQCA), или даже путем детектирования изменений массы, используя чувствительные кварцевые микровесы (QCM). Согласно теории двойного электрического слоя, изменения электрокинетического потенциала (дзета-потенциала) частиц также отражают адсорбцию полифосфатов на плоскости Гельмгольца в виде поверхности частиц.
Соответствующая процедура отслеживания реакции обмена лигандами/замещения, описанной выше, включает, таким образом, отслеживание изменения дзета-потенциала в зависимости от времени или в зависимости от концентрации органического полифосфата, поскольку поверхностный электростатический заряд с высокой чувствительностью будет отражать химические модификации поверхности частицы. Дополнительные методы отслеживания модификации поверхности частиц включают, но без ограничения этим, рамановское рассеяние и инфракрасную абсорбционную спектроскопию, которая детектирует конкретные химические признаки адсорбированного органического полифосфата, масс-спектроскопию вторичных ионов, которая отслеживает вторичные ионы (из органических полифосфатов), десорбировавшиеся с поверхности частиц при облучении ионными пучками, или элементный анализ, такой как энергодисперсионное рентгеновское рассеяние, для регистрации присутствия углерода из модификатора в частицах, изначально лишенных углерода. Реакция обмена лигандами/замещения может быть остановлена при достижении желаемого дзета-значения путем удаления органически дериватизированных минеральных микрочастиц из раствора органического полифосфата и промывания их водой. Альтернативно реакция может быть остановлена при отсутствии изменения дзета-потенциала на более чем 10%, предпочтительно не более чем на 5%, в течение периода 5-10 минут, например 5 минут, 7,5 минут или 10 минут.
Для удобства описанная выше реакция обмена лигандами/замещения с участием минеральных микрочастиц в растворе органического полифосфата в дальнейшем и на протяжении всей настоящей заявки на патент будет называться «уравновешиванием» или «стадией уравновешивания».
Во втором аспекте настоящим изобретением предоставляются органически дериватизированные минеральные микрочастицы, которые могут быть получены способом уравновешивания в соответствии с первым аспектом.
В конкретных вариантах осуществления указанное уравновешивание приводит к частичному или полному замещению фосфат-ионов или гидроксид-ионов, которые расположены на поверхности микрочастиц, органическими полифосфат-ионами.
В других конкретных вариантах осуществления указанное уравновешивание проводят с использованием органических полифосфат-ионов общей структуры 1A.
В предпочтительных вариантах осуществления указанное уравновешивание проводят с использованием органических полифосфат-ионов общей структуры 1B.
В особенно предпочтительном варианте осуществления указанное уравновешивание проводят с использованием фитиновой кислоты/IP-6/инозитгексафосфата или его соли.
В конкретных вариантах осуществления указанное уравновешивание указанных минеральных микрочастиц с использованием органического полифосфата увеличивает номинальный электростатический потенциал указанных минеральных микрочастиц.
В конкретных вариантах осуществления указанное уравновешивание указанных минеральных микрочастиц с использованием органического полифосфата уменьшает размер указанных минеральных микрочастиц.
В конкретных вариантах осуществления указанный раствор органического полифосфата включает отрицательно заряженную соль органического полифосфата, причем, предпочтительно, указанный раствор имеет физиологический pH.
В другом варианте осуществления указанный раствор органического полифосфата включает смесь солей двух или более отрицательно заряженных органических полифосфатов.
В особенно предпочтительных вариантах осуществления указанный раствор органического полифосфата включает инозитгексафосфат (фитиновую кислоту/IP-6).
В других конкретных вариантах осуществления указанная стадия уравновешивания выполняется
i. при температуре окружающей среды или при приблизительно 20°C ± 5-10°C,
ii. в течение периода реакции, составляющего по крайней мере 2 минуты, и/или
iii. с начальной концентрацией органических полифосфатов, составляющей не менее 0,1 мМ и не более 20 мМ, и/или
iv. при значениях pH между pH 4,0 и pH 7,5.
В конкретных вариантах осуществления указанный исходный материал минеральных микрочастиц имеет
i. номинальный размер, составляющий не менее 0,1 мкм и не более 5 мкм, при измерении в коллоидной суспензии методом DLS или лазерной дифракции, и/или
ii. дзета-потенциал, составляющий не менее -20 и не более -30 мВ, для фосфата алюминия при измерении при pH 7,0 в дистиллированной воде.
iii. дзета-потенциал, составляющий не менее +10 и не более +20 мВ, для гидроксида алюминия при измерении при pH 7,0 в дистиллированной воде.
iv. дзета-потенциал, составляющий не менее -10 и не более -20 мВ, для фосфата кальция при измерении при pH 7,0 в дистиллированной воде.
Здесь также предоставляются органически дериватизированные минеральные микрочастицы, полученные путем уравновешивания минеральных микрочастиц, выбранных из списка, состоящего из микрочастиц гидроксида алюминия, микрочастиц фосфата алюминия, микрочастиц аморфного гидроксифосфата алюминия и/или фосфата кальция, причем по крайней мере часть гидроксид-ионов, расположенных на поверхности указанных минеральных микрочастиц, замещена органический полифосфат-ионами.
В конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы в соответствии с настоящим изобретением имеют
(i) номинальный дзета-потенциал, составляющий по крайней мере -35 мВ, для фосфата алюминия при измерении при pH 7,0 в дистиллированной воде,
(ii) дзета-потенциал, составляющий не менее +10 и не более +20 мВ, для гидроксида алюминия при измерении при pH 7,0 в дистиллированной воде.
(iii) номинальный дзета-потенциал, составляющий по крайней мере -40 мВ, для фосфата кальция при измерении при pH 7,0 в дистиллированной воде,
(iv) номинальный размер, составляющий не менее 0,01 мкм и не более 2 мкм,
(v) стехиометрическое отношение Al к P, равное 1,2 +/- 0,15 к 1,
(vi) стехиометрическое отношение Ca к P, равное 1,7 +/- 0,2, и/или
(vii) максимальное покрытие поверхности указанных микрочастиц органическими полифосфат-ионами, ведущее к максимальному стехиометрическому отношению nPorg/Al=0,05.
В других конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы предоставляются в виде взвеси или суспензии в стерилизованном, забуференном водно-солевом растворе.
В еще одних конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы предоставляются в виде порошка, высушенного путем замораживания орошением, (Wanning et al., Pharmaceutical spray freeze drying. International Journal of Pharmaceutics, 2015, 488:136-153), готового разведение в стерильной воде.
В еще одном конкретном варианте осуществления органически дериватизированные минеральные микрочастицы предоставляются в виде сухого лиофилизированного препарата, необязательно содержащего трегалозу в качестве стабилизирующего наполнителя.
В конкретных вариантах осуществления указанные органически дериватизированные минеральные микрочастицы в соответствии с настоящим изобретением обладают увеличенными способностями к связыванию биомолекул по сравнению с исходным материалом минеральных микрочастиц, причем предпочтительно указанная биомолекула имеет заряд, противоположный таковому указанной модифицированной микрочастицы, или причем указанная биомолекула является нейтральной, когда указанная модифицированная микрочастица является нейтральной.
В конкретных вариантах осуществления указанная биомолекула представляет собой антиген.
Здесь также предусматривается применение в медицине указанных органически дериватизированных минеральных микрочастиц в соответствии с настоящим изобретением.
В конкретных вариантах осуществления указанные органически дериватизированные минеральные микрочастицы в соответствии с настоящим изобретением применяют в качестве систем для доставки или адсорбции биомолекул.
В конкретных вариантах осуществления указанная система доставки биомолекул представляет собой адъювант вакцин.
В конкретных вариантах осуществления указанные органически дериватизированные минеральные микрочастицы в соответствии с настоящим изобретением применяют в качестве вакцинных адъювантов в вакцинах.
В конкретных вариантах осуществления указанные органически дериватизированные минеральные микрочастицы в соответствии с настоящим изобретением применяют при фракционировании крови, предпочтительно в качестве систем для адсорбции биомолекул.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Адсорбционная емкость по отношению к лизоциму куриного яйца (HEL) частиц адъюванта Adju-Phos®, обработанных IP6.
На фиг. 1 показано количество HEL, адсорбированного на частицах Adju-Phos®, в зависимости от концентрации HEL в суспензиях. Очевидно, что обработка частиц Adju-Phos® с использованием IP6 увеличивает адсорбционную емкость частиц по сравнению с обработкой метагексафосфатом (m6Pi), при этом максимальная емкость составляет 1,4 мг HEL/мг эквивалентов Al3+ в случае IP6 по сравнению с 1,1 мг HEL/мг эквивалентов Al3+ в случае m6Pi и ~0,8 мг HEL/мг эквивалентов Al3+ в случае ортофосфата (Pi). Кроме того, эти результаты показывают, что превосходная адсорбционная емкость по отношению к HEL у частиц Adju-Phos®, обработанных IP6, достигается даже после автоклавирования, используемого в качестве процесса стерилизации Adju-Phos.
Фиг. 2: Эффект инозитгексафосфата (IP6) на дзета-потенциал частиц адъюванта на основе фосфата кальция.
На фиг. 2 показана зависимость дзета-потенциала частиц фосфата кальция от концентрации ортофосфата (Pi), мета-гексафосфата (m6Pi) и инозитгексафосфата (IP6). Обработка любым фосфатом приводит к увеличению дзета-потенциала частиц фосфата кальция, что предполагает событие адсорбции фосфат-ионов на поверхности частиц. Эта зависимость дзета-потенциала от концентрации напоминает изотерму адсорбции ленгмюровского типа, которая предполагает насыщение сайтов связывания. В то время как ортофосфат приводит к увеличению приблизительно с -5 мВ до -20 мВ, полифосфаты m6Pi и IP6 демонстрируют более резкое увеличение дзета-потенциала приблизительно до -50 мВ и -60 мВ, соответственно.
Фиг 3: Адсорбционная емкость по отношению к лизоциму куриного яйца частиц фосфата кальция, обработанных инозитгексафосфатом (IP6).
На фиг. 3 показано количество HEL, адсорбированного на частицах фосфата кальция, в зависимости от концентрации HEL в суспензиях. Очевидно, что обработка частиц фосфата кальция с использованием IP6 увеличивает адсорбционную емкость частиц по сравнению с обработкой метагексафосфатом, при этом максимальная емкость составляет ~180 мкг/мг эквивалентов Ca2+ в случае IP6 по сравнению с ~120 мкг/мг эквивалентов Ca2+ в случае m6Pi и ~45 мкг/мг эквивалентов Ca2+ в случае Pi.
Фиг. 4: Адсорбционная емкость по отношению к аденозину, аденозин-5'-монофосфату (АМФ) и аденозин-5'-трифосфату (АТФ) частиц Adju-Phos®.
Фиг. 4 ясно демонстрирует, каким образом увеличивается в по крайней мере 5 раз адсорбционная емкость по отношению к АТФ по сравнению с АМФ и нефосфорилированным аденозином. Можно сделать вывод, что за этот эффект отвечает присутствие конденсированной трифосфатной группы в АТФ, а не монофосфатной группы в АМФ. Механизмы, с помощью которых трифосфатная группа увеличивает адсорбционную емкость по отношению к аденозину, еще предстоит исследовать. Можно предположить, что присутствие дополнительных гидроксильных групп в полифосфатной цепи статистически увеличивает вероятность связывания с Adju-Phos® посредством обмена лигандами, или что эти реакционноспособные гидроксилы менее стерически затруднены в АТФ. Альтернативно, химическая активность концевых гидроксильных групп в трифосфатной цепи АТФ выше, чем в случае АМФ, или то, что фосфат в α-положении в ATP становится более реакционноспособным благодаря действию пирофосфата (фосфатов в β- и γ-положениях) как уходящая группа.
Фиг. 5: Эффект концентрации инозитгексафосфата (IP6) на ζ-потенциал Adju-Phos.
На фиг. 5 показана та же картина, которая наблюдается с другими фосфат- и полифосфат-ионами, когда в первой фазе ζ-потенциал увеличивается с -43 мВ до -60 мВ в ответ на адсорбцию инозитгексафосфата (IP6) на поверхности частиц Adju-Phos® частиц, и когда во второй фазе ζ-потенциал снижается с -60 мВ до -35 мВ, скорее всего, в результате увеличения ионной силы, приводящей к кулоновскому экранированию зарядов и сжатию двойного электростатического слоя. Таким образом, в этом эксперименте обнаруживается, что оптимальный баланс достигается в случае концентрации=5 мМ IP6.
Фиг. 6A и 6B. Гипотетическая реакция замещения на поверхности частиц гидроксифосфата алюминия и растворенных органических полифосфат-ионов.
На фиг. 6A показано, каким образом минеральные микрочастицы (например, гидроксид алюминия) реагируют с органическим полифосфатом с образованием органически дериватизированных минеральных микрочастиц, в которых некоторые гидроксигруппы были замещены органическими полифосфатными группами.
На фиг. 6В показано, каким образом органически дериватизированные минеральные микрочастицы в конечном итоге начинают распадаться из-за (предположительно) отталкивания заряда от заряда.
Фиг. 6C. Электронные микрофотографии (TEM) частиц Adju-Phos® (наверху) и Adju-PhosZP (внизу).
На фиг. 6C сравнивается микроскопическая морфология немодифицированных частиц Adju-Phos® (верхнее изображение) с таковой Adju-PhosZP, модифицированных 2 мМ Na-IP6. Частицы Adju-Phos® имеют средний размер данных распределения ~2,5 мкм и состоят из агрегатов небольших пластинчатых кристаллитов размером ~20 нм. При обработке IP6 микроскопические частицы Adju-Phos® частично дезагрегируются, что видно на нижнем изображении в виде отдельных кристаллитов размером ~20 нм.
Фиг. 7. Адсорбционная емкость по отношению к аденозину, аденозин-5'-монофосфату (АМФ) и аденозин-5'-трифосфату (АТФ) частиц Adju-Phos.
На фиг. 7 показано, каким образом увеличивается в по крайней мере 2 раза адсорбционная емкость по отношению к АТФ по сравнению с АМФ и нефосфорилированным аденозином. Можно сделать вывод, что за этот эффект отвечает присутствие конденсированной трифосфатной группы в АТФ, а не монофосфатной группы в АМФ. Механизмы, с помощью которых трифосфатная группа увеличивает адсорбционную емкость по отношению к аденозину, еще предстоит исследовать. Можно предположить, что присутствие дополнительных гидроксильных групп в полифосфатной цепи статистически увеличивает вероятность связывания с Adju-Phos® посредством обмена лигандами, или что эти реакционноспособные гидроксилы менее стерически затруднены в АТФ. Альтернативно, химическая активность концевых гидроксильных групп в трифосфатной цепи АТФ выше, чем в случае АМФ, или то, что фосфат в α-положении в ATP становится более реакционноспособным благодаря действию пирофосфата (фосфатов в β- и γ-положениях) как уходящая группа.
Фиг. 8. Адсорбционная емкость по отношению к аденозину, аденозин-5'-монофосфату (АМФ) и аденозин-5'-трифосфату (АТФ) частиц Alhydrogel.
На фиг. 8 показано, каким образом АТФ и АМФ, обе фосфорилированные формы аденозина, сильно адсорбируются на Alhydrogel по сравнению с нефосфорилированным аденозином. Нет очевидной разницы между адсорбционными емкостями по отношению к АТФ и АМФ, что указывает на то, что присутствие трифосфатной цепи в АТФ, по-видимому, не дает каких-либо дополнительных улучшений по сравнению с монофосфатной группой в АМФ. Это контрастирует с Adju-Phos, адсорбционная емкость по отношению к АТФ которого выше адсорбционной емкости по отношению к АМФ для того же диапазона концентраций. Гидроксид алюминия из-за своей природы имеет гораздо более высокую долю гидроксидных групп (на моль алюминия), чем Adju-Phos (гидроксифосфат алюминия), которые могут вступать в реакцию обмена лигандами с фосфатами. Поэтому ожидается, что Alhydrogel обладает большей адсорбционной емкостью, чем Adju-Phos в отношении фосфорилированных молекул, таких как АТФ или АМФ. Реактивность Alhydrogel по отношению к АМФ и АТФ является одинаковой или схожей, поскольку она может вовлекать только концевую фосфатную группу с небольшой разницей в реактивности.
Фиг. 9. Эффект концентрации аденозин-5'-трифосфата (АТФ) и аденозин-5'-монофосфата (АМФ) на ζ-потенциал Adju-Phos.
На фиг. 9 показано, что ζ-потенциал Adju-Phos увеличивается (в абсолютных значениях) с -40 мВ до -48 мВ при увеличении концентрации АТФ до 1 мМ. Дальнейшее увеличение концентрации АТФ с 1 мМ до 6 мМ не приводит к дальнейшему увеличению ζ-потенциала, что указывает на то, что насыщение сайтов адсорбции АТФ достигается в пределах 1 мМ. В отличие от АТФ, обработка АМФ приводила к снижению ζ-потенциала (в абсолютных значениях) с -40 мВ до -35 мВ. Эта разница между АТФ и АМФ может быть объяснена большей адсорбционной емкостью Adju-Phos в отношении АТФ, чем АМФ (фиг. 1), и более высокими отрицательными зарядами, которыми обладает АТФ (трифосфат вместо монофосфата). Никаких значительных изменений ζ-потенциале не наблюдалось для Adju-Phos, обработанного нефосфорилированным аденозином.
Фиг. 10. Эффект концентрации аденозин-5'-трифосфата (АТФ) и аденозин-5'-монофосфата (АМФ) на высоту слоя осадка Adju-Phos.
Фиг. 10 представляет собой фотографию гомогенизированных суспензий в пластиковых спектрофотометрических кюветах, демонстрирующую эффект концентрации аденозин-5'-трифосфата (АТФ) и аденозин-5'-монофосфата (АМФ) на высоту слоя осадка Adju-Phos. Концентрации АТФ слева направо: 0,0 мМ, 0,5 мМ, 1,0 мМ, 2,0 мМ, 3,0 мМ, 4,0 мМ и 5,0 мМ.
Фиг. 11. Эффект концентраций аденозин-5'-трифосфата (АТФ) и аденозин-5'-монофосфата (AMP) на высоту слоя осадка Adju-Phos.
На фиг. 11 показано, что высота слоя осадка Adju-Phos, измеренная после 48 часов в состоянии покоя, уменьшается в зависимости от концентрации АТФ с 16 мм до 9,5 мм. Наиболее резкое уменьшение высоты слоя происходит от 0,0 до 1,0 мМ АТФ, что соответствует диапазону концентраций, в котором ζ-потенциал Adju-Phos наиболее повышен (фиг. 9), что позволяет предположить, что эти два параметра являются связанными. Интересно, что обработка AMP приводит к противоположному эффекту, когда высота слоя осадка Adju-Phos увеличивается в зависимости от концентрации. Похоже, что трифосфатная цепь в аденозин-5'-трифосфате индуцирует упаковку частиц Adju-Phos, несмотря на увеличенный ζ-потенциал, ввиду которого ожидается, что силы электростатического отталкивания будут обособлять частицы друг от друга. Аналогичная картина наблюдается с неорганическими полифосфатами и фитатом (инозитгексафосфатом).
Фиг. 12. Адсорбционная емкость по отношению к аденозину, аденозин-5'-монофосфату (АМФ) и аденозин-5'-трифосфату (АТФ) частиц фосфата кальция.
На фиг. 12 показано, что фосфат кальция адсорбирует АТФ, АМФ и аденозин, и что адсорбционная емкость увеличивается в зависимости от концентрации, по-видимому, линейно, с незначительным признаком насыщения (внутри диапазона концентраций нуклеотидов, используемых в этом эксперименте). АТФ и АМФ также, по-видимому, адсорбируются в больших количествах, чем аденозин, что позволяет предположить, что фосфатные группы являются причиной более высокой адсорбционной емкости. Можно предположить, что присутствие фосфатных групп в АМФ и АТФ увеличивает адсорбцию на фосфате кальция посредством обмена лигандами с гидроксид-ионами в матрице фосфата кальция, поскольку адъювант на основе фосфата кальция, используемый в этом эксперименте, представляет собой (нерастворимую в воде) гидратированную соль кальция и фосфата с неизвестным стехиометрическим числом гидроксидов.
Фиг. 13. Эффект концентрации аденозин-5'-трифосфата (АТФ) и аденозин-5'-монофосфата (АМФ) на ζ-потенциал фосфата кальция.
На фиг. 13 показано, что ζ-потенциал фосфата кальция увеличивается (в абсолютных значениях) с -5 мВ до -40 мВ с увеличением концентрации АТФ до 1 мМ. Это резкое увеличение ζ-потенциала определяется как специфическая адсорбция на поверхности частиц - слое Штерна (согласно модели двойного электростатического слоя). Дальнейшее увеличение концентрации АТФ с 1 мМ до 6 мМ приводит только к незначительному увеличению ζ-потенциала, что указывает на то, что насыщение сайтов адсорбции АТФ достигается в пределах 1 мМ. В отличие от АТФ, обработка АМФ приводит только к небольшому увеличению ζ-потенциала (в абсолютных значениях) с -5 мВ до -10 мВ, что также указывает на специфическую адсорбцию на поверхности частиц. Поскольку адсорбционная емкость по отношению к АТФ и АМФ фосфата кальция кажется одинаковой (фиг. 3), заметная разница в ζ-потенциале между АТФ и АМФ может быть объяснена более высоким отрицательным зарядом, которым обладает АТФ (трифосфат вместо монофосфата). В случае фосфата кальция, обработанного нефосфорилированным аденозином, не наблюдалось значительных изменений ζ-потенциала, что указывает на отсутствие специфической адсорбции на поверхности частиц - слое Штерна. Этот результат указывает на то, что адсорбция аденозина на фосфате кальция (фиг. 3) может быть неспецифической, в результате массопереноса и захвата в гелевую матрицу. Адсорбция АТФ и АМФ является, по-видимому, специфической, поскольку изменения ζ-потенциала указывают на процесс хемосорбции, в результате которого изменяется результирующий электростатический заряд частиц фосфата кальция.
Фиг. 14. Фотография гомогенизированных суспензий в пластиковой спектрофотометрической кювете, демонстрирующая эффект концентрации аденозин-5'-трифосфата (АТФ) и аденозин-5'-монофосфата (АМФ) на высоту слоя осадка фосфата кальция. Концентрации АТФ слева направо: 0,0 мМ, 1,0 мМ, 2,0 мМ, 3,0 мМ, 4,0 мМ и 5,0 мМ.
Фиг. 15. Эффект концентрации аденозин-5'-трифосфата (АТФ) и аденозин-5'-монофосфата (АМФ) на высоту слоя осадка фосфата кальция.
На фиг. 15 показано, что высота слоя осадка фосфата кальция, измеренная после 48 часов в состоянии покоя, уменьшается в зависимости от концентрации АТФ с 11 мм до 6 мм. Наиболее резкое уменьшение высоты слоя происходит от 0,0 до 2,0 мМ АТФ, что соответствует диапазону концентраций, в котором ζ-потенциал фосфата кальция наиболее повышен (фиг. 13), что позволяет предположить, что эти два параметра являются связанными. Интересно, что обработка AMP не изменяет высоту слоя осадка фосфата кальция. Похоже, что трифосфатная цепь в аденозин-5'-трифосфате индуцирует упаковку частиц фосфата кальция, несмотря на увеличенный ζ-потенциал, ввиду которого ожидается, что силы электростатического отталкивания будут обособлять частицы друг от друга. Аналогичная картина наблюдается с неорганическими полифосфатами и фитатом (инозитгексафосфатом).
Фиг. 16. Эффект последовательных разведений Adju-Phos®, первоначально обработанного инозитгексафосфатом натрия.
На фиг. 16 показано, что при разведении 5 мМ имидазолом при pH 7,0 ζ-потенциал необработанного Adju-Phos снижается (в абсолютных значениях) с -35 мВ до -22 мВ в диапазоне разведений от 5-кратного до 320-кратного, соответственно. Напротив, Adju-Phos, первоначально обработанный 0,2 мМ Na-IP6, демонстрирует более высокие значения ζ-потенциала от -47 мВ до -33 мВ, следуя тенденции, параллельной тенденции, наблюдаемой для необработанного Adju-Phos.
В случае необработанного Adju-Phos уменьшение ζ-потенциала в зависимости от разведения можно было бы объяснить уменьшением напряженности электростатического поля, поскольку среднее расстояние между частицами увеличивается с разведением. Это указывает на то, что при низкой кратности разведения частицы находятся на близком расстоянии, и их взаимное электростатическое поле взаимодействует (перекрывается) и кажется более сильным (более высокий ζ-потенциал). С увеличением разведения расстояние между частицами увеличивается, и кажущаяся напряженность электростатического поля уменьшается (более низкий ζ-потенциал). Этот эффект также наблюдается в случае Adju-PhosZP. Однако разница в более высоком ζ-потенциале между Adju-PhosZP и Adju-Phos является постоянным значением=приблизительно -12 мВ.
Если бы IP6 только обратимо адсорбировался на Adju-Phos, можно было бы ожидать, что ζ-потенциал Adju-PhosZP при высокой кратности разведения достигнет такового Adju-Phos®, но это не так. 320-кратное разведение исходного Adju-Phos®, обработанного 0,2 мМ IP6, привело бы к конечной концентрации IP6, составляющей 0,6 мкМ. Когда Adju-Phos® обрабатывают концентрациями IP6 ниже 10 мкМ, изменения ζ-потенциала не наблюдается. Таким образом, результат, представленный на фиг. 16, убедительно указывает на то, что часть исходного IP6 сильно адсорбирована на Adju-Phos и необратимо изменила его ζ-потенциал.
Фиг. 17. Эффект последовательных разведений Adju-Phos®, первоначально обработанного АТФ.
Фиг. 17 показывает, что при разведении 5 мМ имидазолом при pH 7,0 ζ-потенциал обычного (необработанного) Adju-Phos® уменьшается (в абсолютных значениях) с -41 мВ до -27 мВ в диапазоне разведений от 5-кратного до 320-кратного, соответственно. Adju-Phos®, первоначально обработанный 1,0 мМ АТФ, показывает незначительно более высокие значения ζ-потенциала от -44 мВ до -30 мВ, следуя тенденции, параллельной тенденции, наблюдаемой для необработанного Adju-Phos®.
По сравнению с обработкой Adju-Phos IP6 (экспериментом № 12, фиг. 16), Adju-Phos, обработанный АТФ, также показывает увеличение ζ-потенциала независимо от кратности разведения, хотя разница в ζ-потенциале составляет всего лишь приблизительно -3 мВ (по сравнению с -12 мВ для IP6). Следуя той же аргументации, что и в случае эксперимента № 12, этот результат указывает на сильную адсорбцию АТФ на Adju-Phos.
Фиг. 18. Эффект последовательных разведений фосфата кальция, первоначально обработанного IP6 или АТФ.
На фиг. 18 показано, что при разведении 5 мМ имидазолом при pH 7,0 ζ-потенциал необработанного фосфата кальция увеличивается (в абсолютных значениях) с -5 мВ до -10 мВ в диапазоне разведений от 5-кратного до 320-кратного, соответственно. Напротив, фосфат кальция, первоначально обработанный 0,5 мМ Na-IP6, демонстрирует более высокие значения ζ-потенциала от -26 мВ до -23 мВ. Точно так же фосфат кальция, первоначально обработанный 1,0 мМ АТФ, демонстрирует более высокие значения ζ-потенциала от -16 мВ до -22 мВ.
Если бы IP6 или АТФ только обратимо адсорбировались на фосфате кальция, можно было бы ожидать, что ζ-потенциал фосфата кальция при высокой кратности разведения достигнет такового фосфата кальция, но это не так. 320-кратное разведение исходного фосфата кальция, обработанного либо 0,5 мМ IP6, либо 1,0 мМ АТФ, приведет к конечной концентрации IP6, составляющей 1,5 мкМ IP6 или 3,0 мкМ АТФ, соответственно. Когда фосфат кальция обрабатывают концентрациями IP6 или АТФ ниже 10 мкМ, изменения ζ-потенциала не наблюдается. Таким образом, результат, представленный на фиг. 18, убедительно показывает, что часть исходного IP6 или АТФ сильно адсорбирована на фосфате кальция и необратимо изменила его ζ-потенциал.
ОПРЕДЕЛЕНИЯ
Если не указано иное, все используемые здесь технические и научные термины имеют то же значение, в котором они обычно понимаются специалистом со средним уровнем компетентности в области, к которой относится это изобретение. Хотя любые методы и материалы, подобные или эквивалентные тем, которые здесь описаны, могут использоваться при осуществлении на практике проверки настоящего изобретения, теперь описываются предпочтительные методы и материалы.
В этом описании и прилагаемой формуле изобретения формы единственного числа «a», «an» и «the» включают ссылки во множественном числе, если контекст явно не диктует иное.
Используемые здесь термины «содержащий (включающий)», «содержит (включает)» и «состоящий из» являются синонимами с терминами «включающий», «включает» или «содержащий», «содержит» и являются включающими или открытыми и не исключают дополнительные, не перечисленные члены, элементы или стадии метода.
Термины «содержащий (включающий)», «содержит (включает)» и «состоящий из» также включают термин «состоящий из».
Термин «приблизительно», используемый здесь по отношению к измеряемому значению, такому как параметр, количество, продолжительность времени и т.п., предназначен для охвата вариаций +/- 10% или менее, предпочтительно +/- 5% или менее, более предпочтительно +/- 1% или менее, и еще более предпочтительно +/- 0,1% или менее от указанного значения, если такие вариации являются подходящими для выполнения в раскрытом изобретении. Следует понимать, что само значение, к которому относится модификатор «приблизительно», также конкретно и предпочтительно сообщается.
Указание числовых диапазонов с помощью конечных точек включает все числа и дроби, входящие в соответствующие диапазоны, а также указанные конечные точки.
В следующих отрывках различные аспекты или варианты осуществления настоящего изобретения определены подробнее. Каждый аспект или вариант осуществления, определенный таким образом, может быть объединен с любым другим аспектом(ами) или вариантом(ами) осуществления, если явно не указано иное. В частности, любой признак, указанный как предпочтительный или полезный, может быть объединен с любыми другим признаком или признаками, указанными как предпочтительные или полезные.
Ссылка в этом описании на «один вариант осуществления», «вариант осуществления» означает, что конкретный признак, структура или характеристика, описанный(ая) в связи с этим вариантом осуществления, включены в по крайней мере один вариант осуществления настоящего изобретения. Таким образом, появление выражений «в одном варианте осуществления» или «в варианте осуществления» в различных местах в этом описании не обязательно относится, но может относиться, к одному и тому же варианту осуществления. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим способом, как будет очевидно специалисту в данной области техники из этого раскрытия, в одном или более вариантах осуществления.
Используемый здесь термин «фосфат алюминия» относится к аморфному гидроксифосфату алюминия (Shirodkar S. et al., Aluminum compounds used as adjuvants in vaccines. Pharmaceutical Research, 1990, 7:1282-1288), в котором некоторые гидроксильные группы гидроксида алюминия замещены фосфатными группами. Неупорядоченное аморфное состояние отвечает за большую площадь поверхности и высокую адсорбционную емкость. Он не является стехиометрическим соединением, и его состав зависит от способа и условий осаждения. Предпочтительно атомное отношение Al:P равно 1,2 ± 0,15-1.
Поверхность фосфата алюминия, упоминаемого здесь, состоит из групп Al-OH и Al-OPO3. Изоэлектрическая точка (IEP) варьируется от 9,4 до 4,5 в зависимости от степени замещения фосфатными группами. Коммерческие адъюванты на основе фосфата алюминия имеют значения IEP в диапазоне от 4,5 до 5,5.
Используемый здесь термин «гидроксид алюминия» относится к оксигидроксиду алюминия, который представляет собой кристаллическое стехиометрическое соединение.
Используемый здесь термин «фосфат кальция» относится к негидроксиапатитной форме фосфата кальция или композиционному материалу, содержащему в основном негидроксиапатитную форму фосфата кальция. Фосфат кальция может быть представлен в виде формулы Ca3(PO4)2 или как нестехиометрический гидроксиапатит, Ca10-x(HPO4)x (PO4)6-x (OH)2-x, где x представляет собой целое число от 0 до 2 (Jiang D. et al., Structure and adsorption properties of commercial calcium phosphate adjuvant, Vaccine, 2004, 23:693-698). Например, фосфат кальция может относиться к композиционному материалу, состоящему из брушита (CaHPO4 ⋅ 2 H2O) и фосфата кальция (Ca3(PO4)2), который может быть представлен в виде формулы [Ca3(PO4)2]x ⋅ [CaHPO4 ⋅ 2 H2O]y, где количество фосфата кальция (x) больше количества брушита (y), или где x>y. Конкретнее, фосфат кальция может относиться к композиционному материалу, состоящему из брушита (CaHPO4 ⋅ 2 H2O), в котором весовое отношение Ca/P равно приблизительно 1,29, и негидроксиапатитной формы фосфата кальция (Ca3(PO4)2), в которой весовое соотношение Са/Р равно 1,94. Предпочтительно атомное отношение Ca:P равно 1,7±0,2-1.
Используемый здесь термин «микрочастицы» относится к частицам с номинальным размером, составляющим не менее 0,01 мкм и не более 10 мкм, не более 5 мкм или не более 2 мкм. Микрочастицы исходного материала предпочтительно имеют номинальный размер, составляющим не менее 0,1 мкм и не более 5 мкм. Кроме того, когда указанная микрочастица представляет собой микрочастицу фосфата алюминия, микрочастица исходного материала может иметь номинальный ζ-потенциал, составляющий не менее -10 и не более -20 мВ при измерении в дистиллированной воде.
Используемый здесь термин Pi или Pi будет означать неорганический фосфат. Когда конденсированные неорганические фосфаты являются циклическими, добавляется «m» (мета), как в случае m6Pi. Например, дифосфат=2Pi, а метагексафосфат=m6Pi.
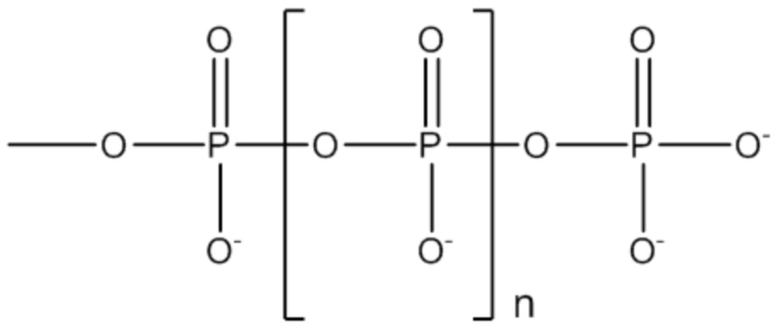
Используемый здесь термин «органический полифосфат» будет означать органическую молекулу, замещенную по крайней мере двумя фосфатными группами (-O-PO3), или органическую молекулу, замещенную по крайней мере одной полифосфатной группой -O-PO2-(-O-PO2-)n-O-PO3, где n представляет собой целое число в диапазоне от 0 до 5:

Используемый здесь термин nPorg означает органический полифосфат с n=количеством фосфатных групп.
Используемый здесь термин «полифосфат» относится к полимерам конденсированного фосфата или фосфорной кислоты, более предпочтительно выбранным из списка, включающего дифосфат, трифосфат, тетрафосфат, пентафосфат, гексафосфат, мета-трифосфат, мета-гексафосфат.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет собой дальнейшую разработку изобретения, раскрытого в одновременно рассматриваемой международной заявке PCT/EP 2017/076232, которая относится к способу получения модифицированных минеральных микрочастиц, включающему суспендирование минеральных микрочастиц некоторых солей двух- или трехвалентных металлов, выбранных из фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, или их смесей, в водном растворе одного или более неорганических полифосфатов, что вызывает модификацию указанных минеральных микрочастиц, как в плане значительного изменения их номинального электростатического потенциала, так и в плане уменьшения размера частиц.
В настоящем изобретении теперь раскрываются органически дериватизированные минеральные микрочастицы, содержащие фосфат алюминия, аморфный гидроксифосфат алюминия, гидроксид алюминия и/или фосфат кальция, полученные аналогичным образом с использованием раствора одного или более органических полифосфатов, например, раствора одного органического полифосфата, в способе получения. Было обнаружено, что способности к связыванию биомолекул, предпочтительно, когда указанная биомолекула представляет собой вакцинный антиген, микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция, значительно улучшаются в результате обработки указанных микрочастиц органическими полифосфатами в сравнение с вышеупомянутой обработкой неорганическими полифосфатами, описанной в одновременно рассматриваемой международной заявке PCT/EP 2017/076232.
В частности, было установлено, что предполагаемое замещение фосфат-ионов или гидроксид-ионов органическими полифосфат-ионами увеличивает численное значение ζ-потенциала указанных микрочастиц, тем самым увеличивая напряженность электростатического потенциала, например, для притяжения биомолекул, предпочтительно антигенов, и/или силу связывания с поверхностью указанных микрочастиц. Кроме того, как описано в одновременно рассматриваемой международной заявке PCT/EP 2017/076232, было обнаружено, что замещение исходных анионов в микрочастицах фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция приводит к дестабилизации суперструктуры материала и его распаду. Как следствие, обработка таких микрочастиц неорганическими полифосфатами приводит к уменьшению номинального размера частиц.
В настоящее время установлено, что модификации, описанные в одновременно рассматриваемой международной заявке PCT/EP 2017/076232, включая уменьшение номинального размера микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или кальция фосфата, также могут быть достигнуты с использованием органических полифосфатов, описанных здесь.
Однако реакции с использованием органических полифосфатов, раскрытые здесь, легче контролировать, особенно в отношении уменьшения размера, что будет подробно описано в другом месте настоящего описания. Более того, продукты реакций с использованием органических полифосфатов, описанные здесь, имеют, как правило, более высокую термостойкость, чем термостойкость, наблюдаемая для продуктов реакций с использованием неорганических полифосфатов, описанных в одновременно рассматриваемой международной заявке PCT/EP 2017/076232.
В способе в соответствии с настоящим изобретением можно удобно использовать коммерчески доступные микрочастицы фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция.
Соответственно, первый аспект настоящего изобретения относится к способу получения органически дериватизированных минеральных микрочастиц, который включает стадию уравновешивания указанных минеральных микрочастиц с раствором одного или более органических полифосфатов, например, раствором одного органического полифосфат, причем указанные минеральные микрочастицы выбраны из списка, состоящего из микрочастиц фосфата алюминия, микрочастиц аморфного гидроксифосфата алюминия, микрочастиц гидроксида алюминия и/или микрочастиц фосфата кальция, и причем указанный органический полифосфат выбран из соединений формулы 1A или 1B:

где n представляет собой целое число в диапазоне от 0 до 5, а m представляет собой целое число в диапазоне от 2 до 10, и где Ra обозначает органические заместители, выбранные из аденозина и других нуклеозидов, тиаминов, углеводов и изопренов, а Rb обозначает органические заместители, выбранные из инозитов и других циклитов, а также углеводов.
Реакции органических полифосфатов формулы 1A и 1B с минеральными микрочастицами изучались по отдельности, и каждая из них демонстрирует значительные преимущества по сравнению с аналогичной реакцией с неорганическими полифосфатами.
Органические полифосфаты формулы 1A с короткой конденсированной полифосфатной группой, такие как трифосфаты (т.е. для которых n=1, примером которых здесь является АТФ), по-видимому, намного лучше реагируют с гидроксильными группами на поверхности частиц фосфата алюминия, чем аналогичный монофосфат (АМФ). Без ограничения какой-либо теорией авторы настоящего изобретения предполагают, что фосфоангидрид в АТФ является более энергоемким и, следовательно, более нуклеофильным. Еще одной причиной могут быть дополнительные отрицательные заряды в молекуле АТФ по сравнению с АМФ.
Органические полифосфаты формулы 1B выгодны с точки зрения увеличения дзета-потенциала частиц, что снова приводит к увеличению адсорбции антигенов. Это особенно верно в случае органических полифосфатов, полученных из инозитов и других циклитов. Инозитгексафосфат (IP6), например, имеет формальный заряд 12 при нейтральном pH по сравнению с 6 в случае гексаметафосфата (m6Pi). Таким образом, плотность заряда будет на 100% больше в случае IP6, чем в случае m6Pi. Кроме того, экспериментально было показано, что фосфоэфирная связь в IP6 более устойчива к гидролизу, чем фосфоангидрид в m6Pi, что указывает на то, что адъюванты на основе IP6 лучше выдерживают автоклавирование, чем адъюванты на основе m6Pi.
В предпочтительном варианте осуществления один или более органических полифосфатов выбран из соединений, имеющих общую структуру 1B. В другом предпочтительном варианте осуществления один или более органических полифосфатов выбран из инозитфосфата и фосфатов других циклитов в их различных изомерных и/или энантиомерных формах, например инозитбисфосфата (IP2), инозиттрисфосфата (IP3), инозиттетрафосфата (IP4), инозитпентакисфосфата (IP5) и инозитгексафосфата (IP6), также известного как фитиновая кислота или фитат (в виде соли).
Более предпочтительно, когда один или более органических полифосфатов включает инозиттрисфосфат (IP3) или инозитгексафосфат (IP6).
Наиболее предпочтительно настоящее изобретение относится к способу получения органически дериватизированных минеральных микрочастиц, который включает стадию уравновешивания указанных минеральных микрочастиц с раствором инозитгексафосфата (IP6), также известного как фитиновая кислота, или ее соли (фитата), предпочтительно фитата натрия.
В другом предпочтительном варианте осуществления минеральные микрочастицы представляют собой микрочастицы фосфата кальция.
Органически дериватизированные микрочастицы предпочтительно имеют номинальный размер, составляющий не менее 0,01 мкм и не более 1 мкм, предпочтительно от 0,1 до 0,5 мкм, и номинальный ζ-потенциал, определенный в другом месте в описании. Микрочастицы могут иметь различную форму и могут быть, например, сферическими, коническими, эллипсоидными, сложной формы, цилиндрическими или кубическими. Кроме того, все микрочастицы в совокупности микрочастиц могут не иметь одинаковый размер или форму. Используемый здесь термин «модифицированный» или «модифицирование» относится к изменению, изменению или внесению изменений, либо незначительных, либо фундаментальных, в форму или характер объекта, предпочтительно с целью создания улучшенного (модифицированного) варианта указанного объекта. Например, органически дериватизированные минеральные микрочастицы, описанные здесь, могут иметь полное или частичное замещение фосфат-ионов или гидроксид-ионов, которые расположены на поверхности исходного материала исходных немодифицированных микрочастиц, органический полифосфат-ионами, изменение поверхностного заряда, изменение ζ-потенциала, изменение способности к связыванию биомолекул и адсорбции биомолекул и/или изменение размера по сравнению с исходным материалом минеральных микрочастиц перед уравновешиванием с раствором одного или более органических полифосфатов. Предпочтительно, когда указанный поверхностный заряд численно выше, указанный ζ-потенциал численно выше, указанные способности к связыванию биомолекул и адсорбции биомолекул увеличиваются, и/или указанный номинальный размер уменьшается по сравнению с исходным материалом минеральных микрочастиц до уравновешивания с раствором органического полифосфата. В предпочтительных вариантах осуществления указанная биомолекула представляет собой антиген. Кроме того, органически дериватизированные минеральные микрочастицы могут иметь специфические участки связывания для хелирования основных аминокислотных остатков на поверхности пептидов, белков или полипептидов, например биомолекул, которые не присутствуют в исходном материале минеральных микрочастиц.
В конкретных вариантах осуществления уравновешивание указанных минеральных микрочастиц с раствором органического полифосфата изменяет номинальный электростатический потенциал указанных минеральных микрочастиц.
Используемые здесь термины «электростатический потенциал», «электрический потенциал» или «V» относятся к общему значению этого термина, как он понимается специалистом в данной области техники, и, в частности, к потенциальной энергии заряженного объекта, такого как протон, электрон или ион, в определенном месте рядом с молекулой и может быть определен как энергия на единицу заряда (q) (V=U/q). Электростатический потенциал может быть представлен в единицах джоули/кулоны или вольтах. Электростатический потенциал может использоваться для прогнозирования и/или расчета энергий, необходимых для перемещения зарядов, например, от одного потенциала V1 к другому потенциалу V2.
Используемый здесь термин «дзета-потенциал» или «ζ-потенциал» описывает показатель относительного электрического заряда микрочастиц, взвешенных в жидкости. Конкретнее, ζ-потенциал относится к промежуточному электрическому потенциалу на определенном расстоянии от физической поверхности частицы, границе так называемого диффузного слоя (так называемой плоскости скольжения), где ионы находятся в равновесии между притягивающим электростатическим полем поверхности частицы и окружающей жидкостью (например, растворителем). Соответственно, ζ-потенциал описывает электрический потенциал на определенном расстоянии от физической поверхности частицы, где заряд упомянутой частицы больше не влияет на окружающую жидкость. ζ-потенциал, как правило, находится в диапазоне от +100 мВ до -100 мВ и может быть измерен с помощью Zetasizer nano ZS (Malvern Instruments Inc.) в электрокинетическом режиме, предпочтительно при 25°C и/или в деионизированной воде. На микрочастицы в жидкости распространяется то, что чем выше номинальный ζ-потенциал, тем выше стабильность в плане уменьшения тенденции к осаждению в суспензии. Например, микрочастицы с ζ-потенциалом, составляющим больше +25 мВ или меньше -25 мВ, как правило, обладают высокой степенью стабильности. Изменение ζ-потенциала минеральных микрочастиц путем уравновешивания указанных микрочастиц с раствором органического полифосфата, как здесь описано, может представлять собой увеличение, уменьшение, реверсию и/или нейтрализацию ζ-потенциала указанных микрочастиц. Увеличение или уменьшение номинального ζ-потенциала, как здесь описано, относится к увеличению или уменьшению абсолютного значения номинального ζ-потенциала, независимо от символа ((+) или (-)) перед ним. Например, когда начальный номинальный ζ-потенциал равен -10 мВ, увеличение указанного номинального ζ-потенциала может составлять -15 мВ, -20 мВ, -25 мВ, -30 мВ и т.д., в то время как уменьшение указанного номинального ζ-потенциала может составлять -5 мВ, -3 мВ, -1 мВ, 0 мВ и т.д. Другой пример, когда начальный номинальный ζ-потенциал равен +10 мВ, увеличение указанного номинального ζ-потенциала может составлять +15 мВ, +25 мВ, +50 мВ, +100 мВ и т.д., в то время как уменьшение указанного номинального ζ-потенциала может составлять +5 мВ, +3 мВ, +1 мВ, 0 мВ и т. Д. Изменение любого номинального ζ-потенциала до 0 мВ также может называться нейтрализацией ζ-потенциала. Инверсия номинального ζ-потенциала означает изменение заряда, например, номинальный ζ-потенциал плюс 10 мВ может быть инвертирован до минус 10 мВ.
Тип изменения (например, увеличение, уменьшение, реверсия, нейтрализация) ζ-потенциала минеральных микрочастиц путем уравновешивания указанных микрочастиц с раствором полифосфата, таким как раствор органического полифосфата, как здесь описано, зависит от типа минеральной микрочастицы и ее начального заряда и/или ζ-потенциала. Например, замена гидроксид-ионов на полифосфат-ионы на поверхности положительно заряженного гидроксида алюминия может привести к инверсии ζ-потенциала микрочастиц гидроксида алюминия, в то время как замена фосфат-ионов на органический полифосфат-ионы на поверхности отрицательно заряженного фосфата алюминия или фосфата кальция может привести к увеличению абсолютного значения ζ-потенциала микрочастиц фосфата алюминия или микрочастиц фосфата кальция, соответственно.
В конкретных вариантах осуществления указанный исходный материал минеральных микрочастиц имеет
(i) дзета-потенциал, составляющий не менее -20 и не более -30 мВ, для фосфата алюминия при измерении при рН 7,0 в дистиллированной воде.
(ii) дзета-потенциал, составляющий не менее +10 и не более +20 мВ, для гидроксида алюминия при измерении при pH 7,0 в дистиллированной воде.
(iii) дзета-потенциал, составляющий не менее -10 и не более -20 мВ, для фосфата кальция при измерении при рН 7,0 в дистиллированной воде.
В конкретных вариантах осуществления уравновешивание микрочастиц фосфата алюминия и/или фосфата кальция с раствором органического полифосфата, как здесь описано, увеличивает напряженность электростатического потенциала и/или абсолютное значение ζ-потенциала указанных микрочастиц. Предпочтительно указанный ζ-потенциал увеличивается до по крайней мере -20 мВ, по крайней мере -25 мВ, по крайней мере -30 мВ, по крайней мере -35 мВ, по крайней мере -40 мВ, по крайней мере -50 мВ, по крайней мере -60 мВ, по крайней мере -70 мВ, по крайней мере -80 мВ или по крайней мере -90 мВ при измерении в дистиллированной воде, предпочтительно по крайней мере -40 мВ, по крайней мере -50 мВ, по крайней мере -60 мВ или по крайней мере -70 мВ, более предпочтительно по крайней мере -50 мВ.
В конкретных вариантах осуществления уравновешивание микрочастиц гидроксида алюминия с раствором органического полифосфата, как здесь описано, аннулирует или реверсирует номинальный электростатический потенциал указанных микрочастиц и/или номинальный ζ-потенциал указанных микрочастиц.
В конкретных вариантах осуществления уравновешивание минеральных микрочастиц, описанное здесь, приводит к уменьшению размера указанных микрочастиц. Полученный размер органически дериватизированных минеральных микрочастиц, как правило, зависит от исходного размера микрочастиц исходного материала и от продолжительности периода уравновешивания.
В конкретных вариантах осуществления указанные минеральные микрочастицы исходного материала имеют номинальный размер, составляющий не менее 0,1 мкм и не более 5 мкм, при измерении в коллоидной суспензии с помощью динамического рассеяния света (DLS) или лазерной дифракции.
В конкретных вариантах осуществления описанные здесь способы могут предоставить органически дериватизированные минеральные микрочастицы, имеющие размер не более 1 мкм, не более 0,5 мкм, не более 0,2 мкм или не более 0,1 мкм, не более 0,05 мкм, не более 0,02 мкм, предпочтительно не более 0,2 мкм. Например, описанная здесь процедура уравновешивания микрочастиц фосфата алюминия в течение периода до 40 часов может привести к уменьшению номинального значения размера=2 мкм для частиц исходного материала до номинального размера=0,2 мкм для образующихся в результате органически дериватизированных минеральных микрочастиц. Органически дериватизированные микрочастицы, описанные здесь, могут возникать в виде аморфных агрегатов более мелких кристаллитов или более мелких аморфных агрегатов с таким же размером кристаллитов.
В других конкретных вариантах осуществления описанные здесь способы могут предоставить органически дериватизированные минеральные микрочастицы, имеющие размер меньше, чем частицы исходного материала, например, меньше на по крайней мере приблизительно 10%, или по крайней мере приблизительно 20%, или по крайней мере приблизительно 30%, или по крайней мере приблизительно 40%, или по крайней мере приблизительно 50%, или по крайней мере приблизительно 60%, или по крайней мере приблизительно 70%, или по крайней мере приблизительно 80%, или по крайней мере приблизительно 90% по сравнению с размером частиц исходного материала, т.е. минеральных микрочастиц исходного материала, с которыми проводится сравнение.
Используемый здесь термин «уравновешивание», «уравновешивать» или «уравновешивание» относится к действию приведения минеральных микрочастиц, таких как микрочастицы фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция, в контакт с раствором одного или более органических полифосфатов в течение определенного периода времени при определенной температуре и обеспечения потока вещества и/или энергии между минеральными микрочастицами и окружающим раствором одного или более органических полифосфатов до тех пор, пока микрочастицы больше не будут иметь тенденцию к дальнейшему изменению со временем (например, до отсутствия изменения ζ-потенциала). Предполагается, что в течение этого периода времени на поверхности указанных минеральных микрочастиц происходит реакция замещения, или обмена лигандами, гидроксидных или ортофосфатных групп на органический полифосфат-ионы. Эта реакция замещения, или обмен лигандами, продолжается до тех пор, пока не будет достигнуто равновесие.
Стадия уравновешивания, как правило, включает смешивание минеральных микрочастиц с раствором одного или более органических полифосфатов. Неограничивающими примерами устройств, которые могут использоваться для выполнения смешивания, являются качающиеся платформы, вращающаяся карусель, вихревые мешалки, смесители (например, винтовые, ленточные или лопастные) или смесители (например, винтовые, ленточные или лопастные). Кроме того, минеральные микрочастицы можно промыть перед добавлением в раствор одного или более органических полифосфатов. Предпочтительно промывку проводят в деионизированной воде. Продолжительность периода уравновешивания зависит от типа минеральных микрочастиц (например, фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция) и/или цели уравновешивания (например, изменения размера, электростатического потенциала и/или ζ-потенциала указанной микрочастицы) и может варьироваться от по крайней мере 1 минуты до по крайней мере 50 часов. Как правило, для изменения электростатического потенциала и/или ζ-потенциала минеральных микрочастиц, как здесь описано, требуется более короткий период уравновешивания по сравнению с изменением размера. Предпочтительно период уравновешивания для изменения электростатического потенциала и/или ζ-потенциала минеральных микрочастиц составляет не более одного часа, в то время как период уравновешивания для изменения размера минеральных микрочастиц составляет по крайней мере один час. Более предпочтительно, когда период уравновешивания для изменения электростатического потенциала и/или ζ-потенциала минеральных микрочастиц составляет по крайней мере 2 минуты, по крайней мере 3 минуты, по крайней мере 4 минуты, по крайней мере 5 минут, по крайней мере 6 минут, по крайней мере 7 минут, по крайней мере 8 минут, по крайней мере 9 минут, по крайней мере 10 минут, по крайней мере 11 минут, по крайней мере 12 минут, даже более предпочтительно по крайней мере 10 минут, а период уравновешивания для изменения размера минеральных микрочастиц составляет по крайней мере 5 часов, по крайней мере 10 часов, по крайней мере 15 часов, по крайней мере 20 часов, по крайней мере 25 часов, по крайней мере 30 часов, по крайней мере 35 часов, по крайней мере 40 часов, по крайней мере 45 часов, по крайней мере 50 часов, даже более предпочтительно по крайней мере 40 часов. В конкретных вариантах осуществления указанный период уравновешивания выполняется при комнатной температуре. Необязательно, либо раствор одного или более органических полифосфатов может быть удален из полученных органически дериватизированных минеральных микрочастиц, либо полученные органически дериватизированные минеральные микрочастицы могут быть отделены от раствора одного или более органических полифосфатов после периода уравновешивания. Неограничивающими примерами способов достижения этого разделения являются фильтрация, центрифугирование, оптически индуцированные диэлектрофоретические (ODEP) силы, замена буфера, промывка или другие методы, известные специалисту.
Во втором аспекте настоящим изобретением предоставляются органически дериватизированные минеральные микрочастицы, которые могут быть получены способом уравновешивания в соответствии с первым аспектом.
Микрочастицы, полученные способом по настоящему изобретению, трудно описать точными, объективными терминами из-за химических реакций, изменений поверхности и уменьшения размера, описанных выше. Измеряемый дзета-потенциал значительно изменяется во время реакции обмена лигандами/замещения, и его следует рассматривать как результат указанных химических реакций, изменений поверхности и уменьшения размера. Однако опыт показывает, что органически дериватизированные минеральные микрочастицы многократно получают с практически идентичными характеристиками/дзета-потенциалом, следуя описанной процедуре. Таким образом, органически дериватизированные минеральные микрочастицы наиболее точно описываются как продукт указанного способа уравновешивания.
Как упоминалось выше, предполагается, что органические полифосфаты реагируют с поверхностью фосфата алюминия или фосфата кальция путем обмена лигандами с гидроксид-ионами, связанными с катионом металла ионными связями. Измерение изменений дзета-потенциала частиц является прямым доказательством адсорбции ионов на границе раздела между физической поверхностью частицы и основным объемом растворителя (так называемой плоскость Гельмгольца). В случае отрицательно заряженных органических полифосфатов адсорбция на отрицательно заряженной поверхности неблагоприятна из-за электростатического отталкивания. Однако представленные здесь экспериментальные данные показывают, что дзета-потенциал фосфата алюминия увеличивается при обработке органическими полифосфатами, демонстрируя специфическую адсорбцию органических полифосфатов на частицах фосфата алюминия. Кроме того, данные показывают, что увеличенные значения дзета-потенциала частиц фосфата алюминия, обработанных органическими полифосфатами (по сравнению с необработанными частицами или частицами, обработанными ортофосфатом), сохраняются после экстенсивной промывки частиц деионизированной водой. Данные указывают на то, что органические полифосфаты прочно связываются с поверхностью частиц, что подтверждает факт обмена лигандами.
Следовательно, отслеживание изменения дзета-потенциала частиц в зависимости от времени дает кинетику адсорбции органических полифосфатов на поверхности частиц (плоскости Гельмгольца). Однако этот способ не дает кинетику обмена лигандами взамен гидроксид-ионов. Скорости обмена лигандами в случае Al(III) являются одними из самых медленных, зафиксированных в гидратах алюминия (III) (Martin R.B., The chemistry of aluminum as related to biology and medicine. Clinical Chemistry, 1986, 32:1797-806). Однако в случае фосфата алюминия, где Al(III) в основном образует комплекс с фосфатом, кинетика обмена лигандами взамен гидроксид-ионов в Al(III) неизвестна.
Прямые доказательства обмена лигандами с использованием спектроскопии, как ожидается, будут менее сложными, чем для аналогичной реакции с использованием неорганических полифосфатов, из-за присутствия углерода в этих молекулах и присутствия фосфоэфирных связей, что даст отчетливые демаскирующие признаки в аналитической спектроскопии, такие как спектр Рамана или IR, химические демаскирующие признаки, изначально не присутствующие в исходных немодифицированных частицах. Неорганические полифосфаты, состоящие из полимеров фосфорной кислоты, демонстрируют характерные признаки ортофосфата, уже присутствующего в частицах фосфата алюминия или фосфата кальция. Ожидается, что спектр комбинационного рассеяния света (спектр Рамана) от поверхности частицы, модифицированной органическими полифосфатами, будет отличаться от спектра для исходных немодифицированных частиц. Более того, гидроксид-ионы, высвобождаемые в результате реакции обмена лигандами, приведут к подщелачиванию раствора, и измерения pH в зависимости от времени могут, следовательно, также выявить кинетику обмена лигандами.
В конкретных вариантах осуществления описанный здесь способ начинается с коммерчески доступных (немодифицированных) микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция, которые впоследствии модифицируют. Предпочтительно указанные микрочастицы фосфата алюминия в качестве исходного материала представляют собой микрочастицы AdjuPhos®, а указанные немодифицированные микрочастицы гидроксида алюминия (т.е. исходного материала) представляют собой микрочастицы Alhydrogel®, более предпочтительно микрочастицы 2% AdjuPhos® или 2% Alhydrogel®, соответственно. Предпочтительно указанные микрочастицы фосфата кальция в качестве исходного материала являются негидроксиапатитными микрочастицами. В дальнейших конкретных вариантах осуществления микрочастицы фосфата алюминия или фосфата кальция могут содержать долю гидроксильных групп. В даже дальнейших конкретных вариантах осуществления микрочастицы фосфата алюминия или фосфата кальция могут содержать небольшие доли других химических соединений или элементов, таких как хлорид натрия (например, 0,8% - 1,0% в весовом отношении), хлорид (например, ≤0,33% в весовом отношении), азот (например, ≤0,05% в весовом отношении), нитрат (например, ≤100 частей на миллион), сульфат (например, ≤0,1% в весовом отношении), железо (например, ≤15 частей на миллион), мышьяк (например, ≤1 частей на миллион), тяжелые металлы (например, ≤20 частей на миллион), аммоний (например, ≤50 частей на миллион).
В конкретных вариантах осуществления способы, включающие стадию уравновешивания указанных микрочастиц гидроксида алюминия, фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция с указанным раствором одного или более органических полифосфатов, как здесь описано, приводят к частичному или полному замещению гидроксид-ионов или фосфат-ионов, которые расположены на поверхности микрочастиц, органическими полифосфат-ионами.
Используемый здесь термин «замещение» относится к замене одного аниона другим в твердой матрице, также называемой обменом лигандами. Из-за их противоположных зарядов катионы и анионы будут притягиваться друг к другу из-за кулоновских сил, которые они могут оказываться взаимно друг на друга. По мере уменьшения межатомного расстояния оно станет достаточно коротким, чтобы электрон с валентной оболочки аниона переместился на валентную оболочку катиона, тем самым образуя ионную связь (электровалентную). Для сравнения, в гидроксиде алюминия алюминий (Al3+) находится в ионной связи с гидроксидом (ОН). Ионные связи, в отличие от ковалентных связей, не являются локализованными. Максимальное покрытие поверхности микрочастиц фосфата алюминия, гидроксида алюминия или фосфата кальция органическими полифосфат-ионами может находиться в диапазоне от 0,2% до 0,8% (в весовом отношении), при допущении, что микрочастицы имеют простую сферическую форму и монослойное покрытие поверхности органический полифосфат-ионами.
Используемый здесь термин «поверхность» относится к внешней границе трехмерной структуры, такой как микрочастица, белок, пептид, полипептид, биомолекула или антиген, которая доступна для взаимодействия с растворителями (например, водой) и растворенными веществами (например, ионами) из окружающей жидкой среды (например, жидкого буфера), также называемой доступной для растворителя поверхностью. Доступная для растворителя поверхность минеральных микрочастиц, описанная здесь, может быть определена или экстраполирована исходя из изотерм связывания.
В конкретных вариантах осуществления уравновешивание указанных минеральных микрочастиц с раствором одного или более органических полифосфатов, как здесь описано, увеличивает способности к связыванию биомолекул и/или адсорбционную емкость по отношению к биомолекулам указанных минеральных микрочастиц. Способность к связыванию биомолекул и/или адсорбционная емкость по отношению к биомолекулам указанных органических дериватизированных минеральных микрочастиц, выбранных из списка, состоящего из микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция, может быть в по крайней мере 1,5 раза, по крайней мере 2 раза, по крайней мере 2,5 раза, по крайней мере 3 раза, по крайней мере 3,5 раза, по крайней мере 4 раза, по крайней мере 5 раз, по крайней мере 5,5 раз, по крайней мере 6 раз выше способности к связыванию биомолекул и/или адсорбционной емкости по отношению к биомолекулам исходных материалов, выбранных из микрочастиц фосфата алюминия, гидроксида алюминия или фосфата кальция. Предпочтительно указанные биомолекулы представляют собой антигены.
Термин «связывать», «взаимодействовать», «специфически связывать» или «специфически взаимодействовать», используемый на протяжении этого описания, означает, что агент связывается или влияет на одну или более желаемых молекул или аналитов, в значительной степени исключая другие молекулы, которые являются случайными или неродственными, и, возможно, в значительной степени исключая другие молекулы, которые являются структурно родственными. Термин «связывать», «взаимодействовать», «специфически связывать» или «специфически взаимодействовать» не обязательно требует, чтобы агент связывался исключительно с намеченной для него мишенью(ями). Например, можно сказать, что агент специфически связывается с представляющей интерес мишенью(ями), если его сродство к такой намеченной мишени(ям) в условиях связывания больше в по крайней мере приблизительно 2 раза, предпочтительно по крайней мере приблизительно 5, более предпочтительно по крайней мере приблизительно 10 раз, еще более предпочтительно по крайней мере приблизительно 25 раз, еще более предпочтительно по крайней мере приблизительно 50 раз и даже более предпочтительно по крайней мере приблизительно 100 раз, чем его сродство к не являющейся мишенью молекуле.
Связывание или взаимодействие между агентом и намеченной для него мишенью(ями) может быть нековалентным (т.е. опосредованным нековалентными силами, такими как, например, ионные взаимодействия, водородные мостики, диполярные взаимодействия, ван-дер-ваальсовы взаимодействия и т.п.). Предпочтительно, когда агент может связываться или взаимодействовать с намеченной для него мишенью(ями) со сродством или константой ассоциации (KA) такого связывания KA≥1×106 M-1, более предпочтительно KA≥1×107 M-1, еще более предпочтительно KA≥1×108 M-1, даже более предпочтительно KA≥1×109 M-1, и еще более предпочтительно KA≥1×1010 M-1 или KA≥1×1011 M-1, где KA=[A_T]/[A][T]=ka/kd, где A обозначает агент, T обозначает намеченную мишень, ka обозначает скорость абсорбции, и kd обозначает скорость десорбции. Определение KA может быть выполнено с помощью методов, известных в данной области техники, таких как, например, использование равновесного диализа и анализа графика Скэтчарда.
Для увеличения напряженности электростатического потенциала, ответственного за притяжение биомолекул (и силу связывания) к поверхности микрочастиц, предпочтительно, чтобы абсолютное значение ζ-потенциала модифицированных микрочастиц было как можно более высоким. Кроме того, поскольку более высокое отношение поверхности к весу приводит к более высоким потенциальным загрузкам биомолекулы на единицу веса адъюванта, размер модифицированных микрочастиц находится в субмикронном диапазоне, предпочтительно в нанометровом диапазоне. Предпочтительно указанная биомолекула представляет собой вакцинный антиген.
Первый общий механизм, с помощью которого растворимые ионные частицы могут адсорбироваться на поверхности частиц, заключается в электростатических силах притяжения дальнего действия. Эти силы признаны наиболее важным фактором адсорбции биомолекул, таких как антигены, на поверхности микрочастиц (например, микрочастиц адъюванта). Следуя этому механизму, они приведут к тому, что биомолекулы, такие как антигены, будут захвачены притягивающим электростатическим полем микрочастицы, вышеупомянутого диффузного слоя, со свободой диффундировать внутри диффузного слоя, а также внутрь и наружу относительно основного объема растворитель. По мере приближения биомолекул к поверхности частицы могут иметь место другие силы короткого действия, такие как силы Ван-дер-Ваальса или диполь-дипольные взаимодействия (водородные связи). Эффекты растворителя (гидрофобный эффект) могут также добавить к механизмам и общей силе связывания биомолекулы с поверхностью частицы.
Авторы настоящего изобретения обнаружили, что за счет увеличения номинального отрицательного электростатического потенциала микрочастиц фосфата алюминия путем уравновешивания указанных микрочастиц в растворе одного или более органических полифосфатов, например в растворе одного органического полифосфата, как здесь описано, напряженность этого электростатического поля также увеличивалась, что, в свою очередь, увеличивало способность к связыванию биомолекул, таких как антигенные белки, с противоположным (положительным) зарядом. Кроме того, не желая ограничиваться какой-либо теорией, авторы настоящего изобретения предполагают, что замена гидроксидов на органические полифосфаты на поверхности положительно заряженного гидроксида алюминия может привести к инверсии ζ-потенциала, что позволяет адсорбировать положительно заряженные биомолекулы, такие как антигенные белки, которые обычно электростатически отталкиваются от микрочастиц гидроксида алюминия.
Не желая ограничиваться какой-либо теорией, авторы настоящего изобретения предполагают, что второй механизм, посредством которого биомолекулы, такие как антигены, могут связываться с поверхностью минеральных микрочастиц, как здесь описано, заключается в более специфических взаимодействиях, включающих образование ионных связей между положительно заряженными аминокислотами на поверхности белка в качестве биомолекулы, предпочтительно лизином и аргинином, и отрицательно заряженными органическими фосфатными группами на поверхности микрочастиц (например, микрочастиц адъюванта). Сродство фосфатных групп к положительно заряженным аминокислотным остаткам в белках, особенно лизину и аргинину, хорошо документально подтверждено в биохимии на примере протеинкиназ и фосфатаз, причем фосфорильная группа нуклеотидов транзиторно участвует в ионном спаривании с остатками лизина или аргинина каталитического центра фермента (Mavri J. and Vogel M. J., Ion pair formation of phosphorylated amino acids and lysine and arginine side chains: A theoretical study, Proteins Structure Function and Bioinformatics, 1996). В некоторых конкретных случаях белок-белковых взаимодействий было установлено, что этот тип ионной связи может быть столь же прочным, как и ковалентная связь (Woods A. S. and  S., Amazing stability of the arginine-phosphate electrostatic interaction, Journal of Proteome Research, 2005), и это свойство используется в случае некоторых применений (Fokkens M. et al., A molecular tweezer for lysine and arginine, Journal of the American Chemical Society, 2005; Schug K. A. et al., Noncovalent binding between guanidinium and anionic groups: focus on biological-and synthetic-based arginine/guanidinium interactions with phosph[on]ate and sulf[on]ate residues, Chemical Reviews, 2005). Авторы настоящего изобретения, кроме того, предполагают, что этот тип взаимодействия может происходить на поверхности фосфатсодержащих микрочастиц (например, используемых в качестве адъювантов), таких как фосфаты алюминия или кальция, при соответствующих значениях pH и ионной силе основного объема растворителя. Кроме того, введение органический полифосфат-ионов на поверхность минеральных микрочастиц, как здесь описано, может улучшить этот механизм связывания таким образом, что благодаря своей полимерной природе и конформационной гибкости органические полифосфаты могут хелатировать положительно заряженные аминокислотные остатки, предпочтительно боковые цепи лизина или аргигина. В результате способность к связыванию или сила связывания для таких биомолекул, как антигены, представляющих такие основные остатки на своей поверхности, может быть значительно улучшена за счет хелатных эффектов. Интересно, что в случае гидроксида алюминия, который является положительно заряженным, в качестве сравнения, замещение некоторых гидроксид-ионов органический полифосфат-ионами может создавать некоторые сайты для специфической адсорбции положительно заряженных биомолекул, таких как антигены, которые, как ожидается в противном случае, будут демонстрировать слабое сродство к гидроксиду алюминия из-за отталкивающих заряд-зарядовых взаимодействий при значениях pH, обычно используемых в случае применений систем доставки или систем биомолекул, таких как производство вакцин.
S., Amazing stability of the arginine-phosphate electrostatic interaction, Journal of Proteome Research, 2005), и это свойство используется в случае некоторых применений (Fokkens M. et al., A molecular tweezer for lysine and arginine, Journal of the American Chemical Society, 2005; Schug K. A. et al., Noncovalent binding between guanidinium and anionic groups: focus on biological-and synthetic-based arginine/guanidinium interactions with phosph[on]ate and sulf[on]ate residues, Chemical Reviews, 2005). Авторы настоящего изобретения, кроме того, предполагают, что этот тип взаимодействия может происходить на поверхности фосфатсодержащих микрочастиц (например, используемых в качестве адъювантов), таких как фосфаты алюминия или кальция, при соответствующих значениях pH и ионной силе основного объема растворителя. Кроме того, введение органический полифосфат-ионов на поверхность минеральных микрочастиц, как здесь описано, может улучшить этот механизм связывания таким образом, что благодаря своей полимерной природе и конформационной гибкости органические полифосфаты могут хелатировать положительно заряженные аминокислотные остатки, предпочтительно боковые цепи лизина или аргигина. В результате способность к связыванию или сила связывания для таких биомолекул, как антигены, представляющих такие основные остатки на своей поверхности, может быть значительно улучшена за счет хелатных эффектов. Интересно, что в случае гидроксида алюминия, который является положительно заряженным, в качестве сравнения, замещение некоторых гидроксид-ионов органический полифосфат-ионами может создавать некоторые сайты для специфической адсорбции положительно заряженных биомолекул, таких как антигены, которые, как ожидается в противном случае, будут демонстрировать слабое сродство к гидроксиду алюминия из-за отталкивающих заряд-зарядовых взаимодействий при значениях pH, обычно используемых в случае применений систем доставки или систем биомолекул, таких как производство вакцин.
Другой аспект настоящего изобретения относится к органически дериватизированным минеральным микрочастицам, выбранным из списка, состоящего из микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция, в которых ортофосфат-ионы, расположенные на поверхности микрочастиц фосфата алюминия или фосфата кальция, или гидроксид-ионы, расположенные на поверхности микрочастиц гидроксида алюминия, частично или полностью замещены органический полифосфат-ионами.
В конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы, описанные здесь, имеют
(i) номинальный ζ-потенциал, составляющий по крайней мере - 40 мВ, для фосфата алюминия при измерении при pH 7,0 в дистиллированной воде или
(ii) номинальный ζ-потенциал, составляющий по крайней мере менее -20 мВ, для гидроксида алюминия при измерении при pH 7,0 в дистиллированной воде или
(iii) номинальный ζ-потенциал, составляющий по крайней мере -40 мВ, для фосфата кальция при измерении при pH 7,0 в дистиллированной воде.
В конкретных вариантах осуществления модифицированные микрочастицы фосфата алюминия имеют номинальный ζ-потенциал, составляющий по крайней мере -20 мВ, по крайней мере -25 мВ, по крайней мере -30 мВ, по крайней мере -35 мВ, по крайней мере -40 мВ, по крайней мере -50 мВ, по крайней мере -60 мВ, по крайней мере -70 мВ, по крайней мере -80 мВ или по крайней мере -90 мВ при измерении в дистиллированной воде, предпочтительно по крайней мере -40 мВ, по крайней мере -50 мВ, по крайней мере -60 мВ, по крайней мере -70 мВ, более предпочтительно по крайней мере -50 мВ.
В конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы, выбранные из списка, состоящего из микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция, в соответствии с настоящим изобретением имеют номинальный размер, составляющий не менее 0,01 мкм и не более 2 мкм, не более 1 мкм, не более 0,5 мкм, не более 0,2 мкм, не более 0,1 мкм, не более 0,05 мкм, не более 0,02 мкм, предпочтительно не более 2 мкм.
В конкретных вариантах осуществления органически дериватизированный фосфат алюминия в соответствии с настоящим изобретением имеет стехиометрическое отношение Al к P, составляющее 1,2 +/- 0,15 к 1.
В конкретных вариантах осуществления органически дериватизированный фосфат кальция в соответствии с настоящим изобретением имеет стехиометрическое отношение Ca к P, составляющее 1,7 +/- 0,20 к 1.
В конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы, описанные здесь, могут иметь максимальное покрытие поверхности указанных микрочастиц органическими полифосфат-ионами от 0,2 до 0,8% в весовом отношении.
Как отмечалось выше, минералсодержащие адъюванты, включая фосфат алюминия, гидроксид алюминия и фосфат кальция, успешно применялись в приготовлении вакцин в течение десятилетий для усиления иммунного ответа на убитые, инактивированные и субъединичные антигены.
В конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы, описанные здесь, обладают увеличенными способностями к связыванию биомолекул по сравнению с микрочастицами гидроксида алюминия, фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция в качестве исходного материала, причем, предпочтительно, указанная биомолекула имеет заряд, противоположный заряду указанной модифицированной микрочастицы, или причем указанная биомолекула является нейтральной, когда указанная модифицированная микрочастица является нейтральной. Например, органически дериватизированные микрочастицы фосфата алюминия заряжены отрицательно и предпочтительно связываются с положительно заряженными биомолекулами.
Используемый здесь термин «биомолекулы», как подразумевается, включает ингредиенты или агенты, которые происходят от живых организмов путем очистки или синтеза и которые могут быть биологически активными. Эти термины также включают диагностические средства, а также так называемые «космецевтики». Диагностические средства включают, например, флуоресцентные белки (например, зеленый флуоресцентный белок или GFP) или радиоактивно меченные молекулы. Космецевтики включают активные ингредиенты, которые влияют на внешний вид индивидуума, например на кожу, волосы, губы и глаза, и включают средства против морщин и средства, улучшающие цвет лица. В этих применениях модифицированные микрочастицы, описанные здесь, предпочтительно имеют наружное применение. Активные фармацевтические ингредиенты (также называемые лекарственными средствами или лекарствами) представляют особый интерес и образуют подгруппу биомолекул.
Биомолекулы могут включать небольшие молекулы (например, имеющие молекулярную массу, составляющую менее приблизительно 1500), синтетические или природные, такие как моносахариды, дисахариды, трисахариды, олигосахариды, пептиды, нуклеиновые кислоты, а также аналоги и производные нуклеиновых кислот; или большие молекулы, включая плазмиды, векторы, полисахариды, биологические макромолекулы, например, более крупные пептиды (полипептиды), белки, аналоги пептидов и их производные, пептидомиметики, молекулы на основе нуклеиновых кислот (например, ДНК, РНК, мРНК, тРНК, иРНК, миРНК, микроРНК или любые другие ДНК- или РНК-подобные молекулы), полинуклеотиды, олигонуклеотиды, ферменты, антибиотики, экстракты, полученные из биологических материалов, таких как бактерии, растения, грибы или клетки или ткани животных, терапевтические средства, профилактические средства, диагностические средства, визуализирующие средства, аптамеры (включая аптамеры в виде олигонуклеотидных или белковых молекул).
В одном варианте осуществления биомолекулы являются водорастворимыми, в частности водорастворимыми активными фармацевтическими ингредиентами. Такие ингредиенты могут относиться к классу I или III биофармацевтической системы классификации (BCS), которая подразделяет лекарственные вещества на четыре класса: класс I - высокая проницаемость, высокая растворимость; класс II - высокая проницаемость, низкая растворимость; класс III - низкая проницаемость, высокая растворимость; класс IV - низкая проницаемость, низкая растворимость. Водорастворимые лекарственные средства также могут быть определены по количеству воды (г), необходимому для растворения 1 г соединения, причем водорастворимые лекарственные средства представляют собой те, которые соответствуют следующим критериям растворимости: 10-30 г («растворимые»); 30-100 г («труднорастворимые»); 100-1000 г («малорастворимые»); 1000-10000 г («очень малорастворимые» или «плохорастворимые»); или особенно растворимые, труднорастворимые и малорастворимые лекарственные средства.
В другом варианте осуществления биомолекулы могут представлять собой антитела или фрагменты антител. Термин «антитело», как подразумевается, включает моноклональные антитела, поликлональные антитела и полиспецифические антитела (например, биспецифические антитела). Фрагменты антител включают часть антитела, обычно его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают Fab-, Fab'-, F(ab')2- и Fv-фрагменты; диатела; линейные антитела; одноцепочечные молекулы антител; полиспецифические антитела, образованные из фрагментов антител.
В предпочтительных вариантах осуществления биомолекулы могут представлять собой антигены, которые способны индуцировать иммунный ответ в организме-хозяине. Соответственно, в предпочтительных вариантах осуществления органически дериватизированные минеральные микрочастицы, описанные здесь, обладают увеличенными способностями к связыванию антигенов по сравнению с микрочастицами исходного материала: фосфата алюминия, аморфного гидроксифосфата алюминия, гидроксида алюминия и/или фосфата кальция, причем предпочтительно указанный антиген имеет заряд, противоположный заряду указанной модифицированной микрочастицы, или причем указанный антиген является нейтральным, когда указанная модифицированная микрочастица является нейтральной. Например, модифицированные микрочастицы фосфата алюминия заряжены отрицательно и предпочтительно связываются с положительно заряженными антигенами.
Термин «организм-хозяин», как правило, обозначает животных, предпочтительно позвоночных, в том числе птиц, людей и не являющихся людьми млекопитающих, таких как мыши, крысы, хомяки, морские свинки, свиньи, коровы, лошади, овцы, козы, собаки, кошки или приматы.
В конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы, описанные здесь, могут обладать увеличенными адсорбционными емкостями по отношению к антигенам в результате их повышенных способностей к связыванию антигенов. Такие увеличенные адсорбционные емкости по отношению к антигенам сделают возможным создание комбинированных вакцин, которые могут содержать антигены от большего числа инфекционных агентов по сравнению с теми, что доступны в предшествующем уровне техники. Адсорбционные емкости по отношению к белкам адъюванта могут быть определены с помощью ряда аналитических методов. Например, сравнивая содержание белка в водной фазе раствора антигена до и после адсорбции на адъюванте (Lindblad E., Aluminum compounds for use in vaccines, Immunology and Cell Biology, 2004, 82:497-505), или в случае, если доступно антитело, специфическое для желаемого антигена, адсорбцию, адсорбционную емкость по отношению к белку можно определить с использованием методов иммунопреципитации, используя либо количественный иммуноэлектрофорез, либо простую радиальную иммунодиффузию. Без использования антитела ее можно проверить спектрофотометрически (Lindblad E., Aluminum compounds for use in vaccines, Immunology and Cell Biology, 2004, 82:497-505).
Используемый здесь термин «адсорбция» относится к физической адсорбции (например, за счет силы Ван-дер-Ваальса) или хемосорбции (например, за счет ковалентной или ионной связи), при которой устанавливается связь между поверхностью микрочастиц и биомолекулой (например, антигеном и/или органической молекулой).
В конкретных вариантах осуществления способности к связыванию биомолекул у указанных органически дериватизированных минеральных микрочастиц, выбранных из списка, состоящего из микрочастиц гидроксида алюминия, фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, в по крайней мере 1,5 раза, по крайней мере 2 раза, по крайней мере 2,5 раза, по крайней мере 3 раза, по крайней мере 3,5 раза, по крайней мере 4 раза, по крайней мере 5 раз, по крайней мере 5,5 раз, по крайней мере 6 раз выше способностей к связыванию биомолекул у микрочастиц исходного материала: гидроксида алюминия, фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, предпочтительно, когда указанная биомолекула является антигеном. Отношение адсорбированной биомолекулы (например, антигена) к микрочастицам гидроксида алюминия (мг/г), фосфата алюминия (мг/г), аморфного гидроксифосфата алюминия (мг/г) или фосфата кальция (мг/г) зависит от комбинации типа модифицированной микрочастицы и природы биомолекулы (например, антиген). Например, отношение биомолекулы (например, антигена) к минеральной микрочастице (мг/г) может составлять по крайней мере 3, по крайней мере 4, по крайней мере 5, по крайней мере 6, по крайней мере 7, по крайней мере 8, по крайней мере 9, по крайней мере 10, по крайней мере 11, по крайней мере 12, предпочтительно по крайней мере 12.
Органически дериватизированные минеральные микрочастицы, выбранные из списка, состоящего из микрочастиц гидроксида алюминия, фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, в соответствии с настоящим изобретением могут обладать улучшенными физико-химическими свойствами, т.е. повышенной коллоидной стабильностью или пониженной агрегацией, что может быть обусловлено увеличением электростатического отталкивания между частицами; и/или увеличенной адсорбцией и связыванием биомолекул, предпочтительно, когда указанная биомолекула является антигеном.
Кроме того, другим аспектом настоящего изобретения является применение указанных органически дериватизированных минеральных микрочастиц, описанных здесь, в медицине.
В конкретных вариантах осуществления «лекарственное средство» может быть лекарством для человека и/или используемым в ветеринарии.
В конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы, описанные здесь, могут применяться в качестве систем доставки или адсорбции биомолекул, причем предпочтительно указанная система доставки биомолекул представляет собой адъювант вакцины.
В конкретных вариантах осуществления указанные органически дериватизированные минеральные микрочастицы, описанные здесь, могут применяться в вакцинах, предпочтительно в качестве систем доставки биомолекул, более предпочтительно в качестве адъювантов вакцин.
В конкретных вариантах осуществления указанные органически дериватизированные минеральные микрочастицы, описанные здесь, могут применяться для производства вакцины.
В других конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы, полученные из исходного материала, выбранного из гидроксида алюминия, фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, могут применяться для производства адъюванта вакцины или компонента вакцины, и/или могут применяться при производстве вакцины.
Модифицированные минеральные микрочастицы, с поверхностью которых связаны антигены, как здесь описано, могут применяться для индукции выработки антител, таких как поликлональные антитела, у животных. Это достигается путем инъекции указанных минеральных микрочастиц, с поверхностью которых связаны антигены, лабораторным или сельскохозяйственным животным с целью индукции высоких уровней экспрессии антигенспецифических антител в сыворотке, которые затем могут быть выделены из животного. Поликлональные антитела могут быть выделены непосредственно из сыворотки, в то время как моноклональные антитела получают путем слияния секретирующих антитела клеток селезенки иммунизированных мышей с иммортализованными клетками миеломы для создания линий моноклональных гибридомных клеток, которые экспрессируют специфические антитела в супернатант клеточной культуры.
Следовательно, другим аспектом настоящего изобретения является применение органических дериватизированных минеральных микрочастиц в соответствии с настоящим изобретением для продукции антител.
Минеральные микрочастицы, способные к связыванию биомолекул и/или загрязнителей (например, мышьяка, хрома, нитрата, кальция, радия, урана, фторида), могут применяться в качестве систем адсорбции биомолекул, например, в процессах очистки, разделения и деконтаминации водных и других растворов, содержащих ионы, (например, в качестве ионообменников). Например, положительно заряженные минеральные микрочастицы могут быть способны связывать отрицательно заряженный альбумин и поэтому могут применяться для удаления альбумина из образцов крови. В другом примере заряженные минеральные микрочастицы могут применяться для селективного обогащения в отношении кислых или основных белков в различных образцах. В промышленных масштабах очистку, разделение и деконтаминацию часто проводят с использованием сорбционных колонок (например, ионообменной хроматографии).
Соответственно, органически дериватизированные минеральные микрочастицы, описанные здесь, могут применяться в качестве систем адсорбции биомолекул в процессах очистки, разделения и деконтаминации.
В конкретных вариантах осуществления органически дериватизированные минеральные микрочастицы, описанные здесь, могут применяться для удаления нежелательных белков во время фракционирования крови.
Настоящее изобретение дополнительно проиллюстрировано следующими неограничивающими примерами.
ПРИМЕРЫ
Эксперимент № 1
Адсорбцию модельного антигена в виде лизоцима куриного яйца (HEL) проводили с использованием частиц Adju-Phos®, обработанных инозитгексафосфатом (IP6), и сравнивали с метагексафосфатом (m6Pi), ортофосфатом (Pi) и водой в качестве контролей. Adju-Phos® с концентрацией 20 г/л обрабатывали путем добавления IP6 или m6Pi до конечной концентрации 5 мМ, и pH снова доводили до pH 5,0, и суспензию оставляли на 12 часов при осторожном перемешивании для уравновешивания и для гарантии отсутствия возникновения осаждения частиц. Затем частицы Adju-Phos® тщательно промывали ультрачистой водой для удаления избытка ионов и автоклавировали. pH суспензии доводили до 7,0 перед проведением адсорбции HEL.
Адсорбционную емкость частиц определяли в зависимости от концентрации HEL. Последовательные разведения были сделаны исходя из 2 мМ исходного раствора HEL и добавлены соответственно к фиксированным объемам частиц фосфата кальция, например, конечные концентрации варьировались от 10 мкМ до 120 мкМ, а конечная концентрация частиц фосфата кальция составляла 4 мг/мл. Смеси оставляли для уравновешивания на 30 минут при комнатной температуре при перемешивании, чтобы гарантировать отсутствие возникновения седиментации частиц. Количество адсорбированного HEL определяли по количеству, оставшемуся в супернатанте после осаждения частиц. Результаты представлены на фиг. 1.
Эксперимент № 2
Эффект концентрации инозит-6-фосфата (I6P) на дзета-потенциал частиц фосфата кальция. Частицы адъюванта на основе фосфата кальция (Brenntag-Biosector, Дания) тщательно промывали ультрачистой водой (6 мкСм/см) перед обработкой в течение 60 минут при комнатной температуре различными концентрациями ортофосфата (Pi), метагексафосфата (m6Pi) или инозит-гексафосфат (IP6). Измерения дзета-потенциала выполняли с помощью Zetasizer Nano ZS (Malvern, Великобритания) на 10-кратных разведениях исходной суспензии промытых частиц в соответствующих фосфатных растворах. Результаты представлены на фиг. 2.
Эксперимент № 3
Адсорбцию модельного антигена в виде лизоцима куриного яйца (HEL) проводили с использованием частиц фосфата кальция, обработанных 0,2 мМ фосфатами, для определения адсорбционной емкости частиц в зависимости от концентрации HEL. Последовательные разведения были сделаны исходя из 2 мМ исходного раствора HEL и добавлены соответственно к фиксированным объемам частиц фосфата кальция, например, конечные концентрации находились в диапазоне от 10 мкМ до 120 мкМ, а конечная концентрация частиц фосфата кальция составляла 4 мг/мл. Смеси оставляли для уравновешивания на 30 минут при комнатной температуре при перемешивании, чтобы гарантировать отсутствие возникновения седиментации частиц. Количество адсорбированного HEL определяли по количеству, оставшемуся в супернатанте после осаждения частиц. Результаты представлены на фиг. 3.
Эксперимент № 4
Влияние степени фосфорилирования аденозинсодержащих нуклеотидов на адсорбцию на Adju-Phos® исследовали путем сравнения аденозинтрифосфата (АТФ) с аденозинмонофосфатом (АМФ) и аденозином (А). Adju-Phos® с концентрацией 1% (в отношении веса к объему) доводили до pH 7,0 и смешивали с растворами А, АМФ и АТФ с концентрациями от 0,1 мМ до 2,5 мМ и оставляли для уравновешивания на 1 час при комнатной температуре при перемешивании во избежание осаждения Adju-Phos®. Затем частицы центрифугировали, и измеряли оптическую плотность супернатантов при 259 нм. Количества адсорбированных аденозинов рассчитывали по разнице между начальными концентрациями и конечными концентрациями после адсорбции, используя коэффициент молярной экстинкции = 15400 см-1 M-1. Результаты представлены на фиг. 4.
Эксперимент № 5
Исследовали эффект концентрации инозитгексафосфата (IP6) на дзета-потенциал частиц Adju-Phos®. Частицы Adju-Phos® разводили до 0,1% (в отношении веса к объему) растворами IP6 с концентрацией от 0,2 мМ до 40 мМ, с доведением pH до 7,0. После 60 мин уравновешивания при комнатной температуре ζ-потенциал регистрировали с помощью DLS (Zetasizer Nano ZS, Malvern Instruments). Результаты представлены на фиг. 5.
Эксперимент № 6
Адсорбцию аденозинсодержащих нуклеотидов на Adju-Phos и Alhydrogel исследовали путем сравнения аденозинтрифосфата (АТФ) с аденозинмонофосфатом (АМФ) и аденозином (А). Adju-Phos или Alhydrogel с концентрацией 1% (в отношении веса к объему) забуферивали при pH 7,0 5 мМ имидазолом и смешивали с растворами А, АМФ и АТФ с концентрациями от 0,2 до 6,0 мМ и оставляли для уравновешивания на 2 часа при комнатной температуре при перемешивании во избежание осаждения частиц адъюванта. Частицы адъюванта центрифугировали, и измеряли оптическую плотность при 259 нм (максимальная оптическая плотность в случае аденина) супернатантов с помощью спектрофотометра. Количество адсорбированных нуклеотидов рассчитывали по разнице между начальными концентрациями и конечными концентрациями после адсорбции, используя коэффициент молярной экстинкции = 15400 см-1 M-1 для аденина. Результаты представлены на фиг. 7 и фиг. 8.
Эксперимент № 7
Эффект аденозинсодержащих нуклеотидов (АТФ и АМФ) на электростатический ζ-потенциал Adju-Phos определяли с помощью динамического рассеяния света (Zeta-Sizer, Nano series, Malvern). Adju-Phos с концентрацией 0,2% (в отношении веса к объему) в 5 мМ имидазоловом буфере при pH 7,0 смешивали с растворами АТФ или АМФ с концентрациями от 0,2 до 4,0 мМ и оставляли для уравновешивания на 2 часа при комнатной температуре при перемешивании во избежание осаждения частиц адъюванта. Образцы переносили в капиллярные ячейки (DTS1060, Malvern), и измерения проводили в трех повторах при 25°C после 2 минут уравновешивания температуры. Результаты представлены на фиг. 9.
Эксперимент № 8
Исследовали эффект аденозинсодержащих нуклеотидов (АТФ и АМФ) на оседание Adju-Phos и высоту слоя. Когда Adju-Phos обрабатывают полифосфатами при одних и тех же условиях pH и процентного содержания соли, плотность упаковки материала в виде частиц увеличивается, что приводит к уменьшению высоты слоя. Более высокая плотность упаковки осадка Adju-Phos затрудняет ресуспендирование частиц адъюванта в основной фазе растворителя, что может стать бременем для производителей вакцин. Следовательно, отслеживание плотности упаковки модифицированного Adju-Phos является важным параметром для последующих применений.
К 1 мл 2%-ного (в отношении веса к объему) Adju-Phos в 5 мМ имидазоловом буфере при pH 7,0 добавляли концентрированные растворы АТФ или АМФ до достижения конечных концентраций в диапазоне от 0,2 мМ до 5,0 мМ. Гомогенизированную суспензию (при энергичном встряхивании) переносили в пластиковую спектрофотометрическую кювету и оставляли для осаждения на 48 часов до тех пор, пока не наблюдалось четкое разделение фаз между слоем частиц и жидкостью выше. Высоту слоя измеряли в зависимости от концентрации нуклеотидов. В этих условиях высота общего объема суспензии в кювете была постоянной и равной 22 мм. Результаты представлены на фиг. 10 и фиг. 11.
Эксперимент № 9 Адсорбция аденозинсодержащих нуклеотидов на фосфат кальция
Адсорбцию аденозинсодержащих нуклеотидов на фосфат кальция исследовали путем сравнения аденозинтрифосфата (АТФ) с аденозинмонофосфатом (AMP) и аденозином (A). Фосфат кальция с концентрацией 1% (в отношении веса к объему) забуферивали при pH 7,0 5 мМ имидазолом и смешивали с растворами А, АМФ и АТФ с концентрациями от 0,2 мМ до 6,0 мМ и оставляли для уравновешивания на 2 часа при комнатной температуре при перемешивании во избежание осаждения частиц адъюванта. Частицы адъюванта центрифугировали и измеряли оптическую плотность при 259 нм (максимальная оптическая плотность в случае аденина) супернатантов с помощью спектрофотометра. Количество адсорбированных нуклеотидов рассчитывали по разнице между начальными концентрациями и конечными концентрациями после адсорбции, используя коэффициент молярной экстинкции = 15400 см-1 M-1 для аденина. Результаты представлены на фиг. 12.
Эксперимент № 10 Эффект аденозинсодержащих нуклеотидов на электростатический ζ-потенциал фосфата кальция
Эффект аденозинсодержащих нуклеотидов (АТФ и АМФ) на электростатический ζ-потенциал фосфата кальция определяли с помощью динамического рассеяния света (Zeta-Sizer, Nano series, Malvern). Adju-Phos с концентрацией 0,2% (в отношении веса к объему) в 5 мМ имидазоловом буфере при pH 7,0 смешивали с растворами АТФ или АМФ с концентрациями от 0,2 мМ до 4,0 мМ и оставляли для уравновешивания на 2 часа при комнатной температуре при перемешивании во избежание осаждения частиц адъюванта. Образцы переносили в капиллярные ячейки (DTS1060, Malvern), и измерения проводили в трех повторах при 25°C после 2 минут уравновешивания температуры. Результаты представлены на фиг. 13.
Эксперимент №11. Эффект аденозинсодержащих нуклеотидов на осаждение фосфата кальция.
Определяли эффект аденозинсодержащих нуклеотидов (АТФ и АМФ) на осаждение фосфата кальция и высоту слоя. Когда фосфат кальция обрабатывают полифосфатами в одних и тех же условиях pH и процентного содержания соли, плотность упаковки материала в виде частиц увеличивается, что приводит к уменьшению высоты слоя. Более высокая плотность упаковки осадка фосфата кальция затрудняет ресуспендирование частиц адъюванта в основной фазе растворителя, что может стать бременем для производителей вакцин. Следовательно, отслеживание плотности упаковки модифицированного фосфата кальция является важным параметром для последующих применений.
К 1 мл 2%-ного (в отношении веса к объему) фосфата кальция в 5 мМ имидазоловом буфере при pH 7,0 добавляли концентрированные растворы АТФ или АМФ до достижения конечных концентраций в диапазоне от 0,5 мМ до 5,0 мМ. Гомогенизированную суспензию (при энергичном встряхивании) переносили в пластиковую спектрофотометрическую кювету и оставляли для осаждения на 48 часов до тех пор, пока не наблюдалось четкое разделение фаз между слоем частиц и жидкостью выше. Высоту слоя измеряли в зависимости от концентрации нуклеотидов. В этих условиях высота общего объема суспензии в кювете была постоянной и равной 22 мм. Результаты представлены на фиг. 14 и фиг. 15.
Эксперимент № 12 Проверка на необратимую адсорбцию IP6 на частицах Adju-Phos®
Для проверки необратимой адсорбции IP6 на частицах Adju-Phos® (например, посредством обмена лигандами) Adju-Phos с концентрацией 2% (в отношении веса к объему) обрабатывали 0,2 мМ Na-IP6 в течение 24 часов в 5 мМ имидазольном буфере при pH 7,0. Это соответствует минимальной концентрации IP6, при которой ζ-потенциал Adju-Phos достигает своего максимального значения с целью ограничения избытка свободного, неадсорбированного IP6. Полученный в результате Adju-PhosZP (модифицированный IP6) последовательно разводили 5 мМ имидазольным буфером при pH 7,0 для поддержания постоянными условий pH и ионной силы. ζ-потенциал регистрировали в зависимости от кратности разведения и сравнивали с обычным (необработанный) Adju-Phos®. Результаты представлены на фиг. 16.
Эксперимент № 13 Проверка на необратимую адсорбцию АТФ на частицах Adju-Phos®
Для проверки необратимой адсорбции АТФ на частицах Adju-Phos® (например, посредством обмена лигандами) проводился эксперимент, подобный эксперименту № 12. Adju-Phos с концентрацией 2% (в отношении веса к объему) обрабатывали 1,0 мМ АТФ в течение 24 часов в 5 мМ имидазольном буфере при pH 7,0. Полученный Adju-Phos, модифицированный АТФ, последовательно разводили 5 мМ имидазольным буфером при pH 7,0 для поддержания постоянными условий pH и ионной силы. ζ-потенциал регистрировали в зависимости от кратности разведения и сравнивали с обычным (необработанным) Adju-Phos®. Результаты представлены на фиг. 17.
Эксперимент № 14 Проверка на необратимую адсорбцию IP6 и АТФ на фосфат кальция
Для проверки необратимой адсорбции IP6 или АТФ на частицах фосфата кальция (например, посредством обмена лигандами), проводился эксперимент, подобный эксперименту №№ 13 и 14. Фосфат кальция с концентрацией 2% (в отношении веса к объему) обрабатывали либо 0,5 мМ IP6, либо 1,0 мМ АТФ в течение 24 часов в 5 мМ имидазольном буфере при pH 7,0. Полученный фосфат кальция, модифицированный либо IP6, либо АТФ, последовательно разводили 5 мМ имидазольным буфером при pH 7,0 для поддержания постоянными условий pH и ионной силы. ζ-потенциал регистрировали в зависимости от кратности разведения и сравнивали с обычным (необработанным) фосфатом кальция. Результаты представлены на фиг. 18.
Эксперимент № 15. Метод крупномасштабного производства Adju-PhosZP® (Adju-Phos®, модифицированного инозитгексафосфатом натрия)
После осаждения и фиксации 45 кг соли в виде гидрата фосфата алюминия (III) в объеме 2000 л чистой воды в реакционный резервуаре, 50 л свежеприготовленного раствора 20 мМ инозитгексафосфата додеканатрия (Na-IP6) в чистой воде добавляют к суспензии со скоростью потока 5 мл/мин и при постоянном перемешивании. После добавления всего объема раствора Na-IP6 суспензию оставляют при перемешивании еще на два часа. Дзета-потенциал измеряют через определенные промежутки времени с момента начала добавления раствора Na-IP6 для отслеживания протекания адсорбции фитата на частицах фосфата алюминия. Как правило, стабильное значение дзета-потенциала достигается в пределах первых двух часов после добавления 20 мМ раствора Na-IP6. Затем к суспензии добавляют 5,84 кг NaCl для контролирования ионной силы, а также кажущейся плотности частиц фосфата алюминия. Затем суспензия переносят в резервуар автоклава, где Adju-Phos, обработанный Na-IP6, стерилизуют при 121°C в течение 30 минут под давлением 1,3 бара. После охлаждения суспензию в асептических условиях расфасовывают в пластиковые контейнеры для транспортировки.
Эксперимент № 16 Сравнение адъювантного эффекта IP6-модифицированного Adju-Phos® (Adju-PhosZP®) с обычным Adju-Phos®.
Адъювантный эффект IP6-модифицированного Adju-Phos® (Adju-PhosZP®) сравнивают in vivo с обычным Adju-Phos® и свободным (без адъюванта) антигеном в качестве контроля в двух разных моделях, используя самок мышей Balb/C и лизоцим куриных яиц (HEL) в качестве антигена. Эксперимент создан с использованием Majgaard Jensen, O. et al. “On the effect of Al(OH)3 as an immunulogical adjuvant” APMIS 96, 257-264 (1988).
Модель 1
В случае модели 1 вводят подкожно количество HEL, которое близко соответствует адсорбционной емкости Adju-PhosZP®. Это значение может быть получено исходя из фиг. 1 выше. Таким образом, насыщение Adju-PhosZP® и обычного Adju-Phos® достигается (фиг. 1) при концентрации лизоцима куриного яйца = 125 мкМ, при которой наблюдается адсорбционная емкость, составляющая 1,4 и 0,5 мг HEL/мг Al, соответственно, для двух адъювантов.
Для исследования in vivo используют две разные дозы адъюванта: 250 мкг Al и 500 мкг Al.
Исходя из адсорбционной емкости, составляющей 1,4 мг HEL/мг Al, для Adju-PhosZP® в системе модели 1 должны использоваться следующие количества HEL:
В случае дозы, составляющей 250 мкг, используется количество = 350 мкг HEL (250 мкг * 1,4), и
В случае дозы, составляющей 500 мкг, используется количество = 700 мкг HEL (500 мкг * 1,4).
Эти количества, 350 мкг и 700 мкг HEL, затем исследуют тремя различными способами: адсорбированные на 1)Adju-PhosZP®, 2)адсорбированные на обычном Adju-Phos® и 3)использованные без адъюванта, т.е. не адсорбированные.
Аналогично, исходя из адсорбционной емкости, составляющей 0,5 мг HEL/мг Al, для обычного Adju-Phos® в системе модели 2 должны использоваться следующие количества HEL:
В случае дозы, составляющей 250 мкг, используется количество = 125 мкг HEL (250 мкг * 0,5), а
В случае дозы, составляющей 500 мкг, используется количество = 250 мкг HEL (500 мкг * 0,5).
В условиях модели 1 количество используемого HEL будет полностью адсорбироваться количеством Adju-PhosZP®, но лишь частично количеством обычного Adju-Phos® из-за более низкой адсорбционной емкости этого адъюванта. Таким образом, в случае дозы, составляющей 250 мкг, инъекция будет содержать (350-125) мкг = 225 мкг несвязанного антигена при использовании обычного Adju-Phos®. В случае дозы, составляющей 500 мкг, будет (700-250) мкг = 450 мкг не связавшегося антигена при использовании обычного Adju-Phos®. Для контрольной группы весь введенный HEL по определению будет несвязанным.
Модель 2
В случае модели 2 вводят подкожно количество HEL, которое близко соответствует адсорбционной емкости обычного Adju-Phos®. Значения насыщения рассчитывают согласно модели 1 выше. Снова используют две разные дозы адъюванта: 250 мкг и 500 мкг Al, поэтому в случае дозы, составляющей 250 мкг, используют количество = 125 мкг HEL (250 мкг * 0,5), а в случае дозы, составляющей 500 мкг, используют количество = 250 мкг HEL (500 мкг * 0,5). Эти количества, 150 и 300 мкг HEL, снова исследуют тремя различными способами: адсорбированные на 1)Adju-PhosZP®, 2)адсорбированные на обычном Adju-Phos® и 3)использованные без адъюванта, т.е. не адсорбированные.
В условиях модели 2 количество используемого HEL будет полностью адсорбироваться количеством Adju-PhosZP®, а также количеством обычного Adju-Phos®. Однако в этих условиях вся емкость Adju-PhosZP® не используется полностью. Это означает, что введенная доза Adju-PhosZP® будет иметь свободную емкость, которую можно представить в виде эквивалентного количества HEL. Таким образом, в случае дозы, составляющей 250 мкг, свободная адсорбционная емкость Adju-PhosZP® будет равна (350-125) мкг = 225 мкг HEL. В случае дозы, составляющей 500 мкг, свободная адсорбционная емкость Adju-PhosZP® будет равна (700-250) мкг = 450 мкг HEL. В случае контрольной группы по определению не будет свободной адсорбционной емкости.
Исследование:
Каждая из двух моделей (1 или 2) содержит 3 группы исследования, каждая из которых содержит 6-8 самок мышей Balb/C. Им вводят подкожно 200 мкл, содержащих следующие количества антигена («AG») и адъюванта (Adju-PhosZP®, обозначенного «ZP», и обычного Adju-Phos®, обозначенного «AP»)
Антитела против HEL (Ат=IgG) анализируют после заключительного спуска крови у мышей через 21 день после вакцинации, используя тест ELISA на антитела в сыворотке, как описано выше. Более высокий гуморальный ответ наблюдается для комбинации AG+ZP, чем для AG+AP. В случае модели 2 также наблюдается более высокий гуморальный ответ для комбинации AG+ZP, чем для AG+AP, несмотря на одинаковое количество введенного антигена, что указывает на то, что свободная адсорбционная емкость Adju-PhosZP® в системе модели 2 может иметь положительный эффект в случае схожих доз антигена.
Эксперимент № 17 Сравнение адъювантного эффекта IP6-модифицированного фосфата кальция (IP6-CAPO) с обычным фосфатом кальция (CAPO).
Этот эксперимент проводится аналогично эксперименту № 15, описанному выше. Насыщение IP6-CAPO и обычного CAPO (смотрите фиг. 3) достигается при адсорбционной емкости, составляющей 175 мкг HEL/мг Ca и 40 мкг HEL/мг Ca, соответственно. В случае этих значениях для насыщения следующие количества антигена (HEL) для инъекции могут быть рассчитаны аналогично вышеприведенному эксперименту 15:
Для модели 1: в случае указанных выше количеств будет несвязанный с CAPO антиген*. В случае вводимой дозы Са, составляющей 250 мкг, несвязанное количество антигена составит (44-10) мкг = 34 мкг. В случае вводимой дозы Са, составляющей 500 мкг, несвязанное количество антигена составит 88-20=68 мкг.
Для модели 2: в случае указанных выше количеств будет свободная адсорбционная емкость* IP6-CAPO. В случае вводимой дозы Са, составляющей 250 мкг, она будет составлять 44-10=34 мкг антигена, а в случае вводимой дозы Са, составляющей 500 мкг, она будет составлять 88-20=68 мкг антигена.
Исследование:
Исследование in vivo двух моделей (1 или 2) проводят, как в эксперименте 15, описанном выше.
Каждая модель содержит 3 группы исследования, каждая из которых содержит 6-8 самок мышей Balb/C. Им вводят подкожно 200 мкл, содержащих следующие количества антигена («AG») и адъюванта (IP6-CAPO, обозначенного «CAPO*», и обычного фосфата кальция, обозначенного «CAPO»):
Антитела против HEL (Ат=IgG) анализируют после заключительного спуска крови у мышей через 21 день после вакцинации, используя тест ELISA на антитела в сыворотке, как описано выше. Более высокий гуморальный ответ наблюдается для комбинации AG+CAPO*, чем для AG+CAPO. В случае модели 2 также наблюдается более высокий гуморальный ответ для комбинации AG+CAPO*, чем для AG+CAPO, несмотря на одинаковое количество введенного антигена, что указывает на то, что свободная адсорбционная емкость IP6-модифицированного фосфата кальция (IP6-CAPO, CAPO*) в системе модели 2 может иметь положительный эффект в случае схожих доз антигена.
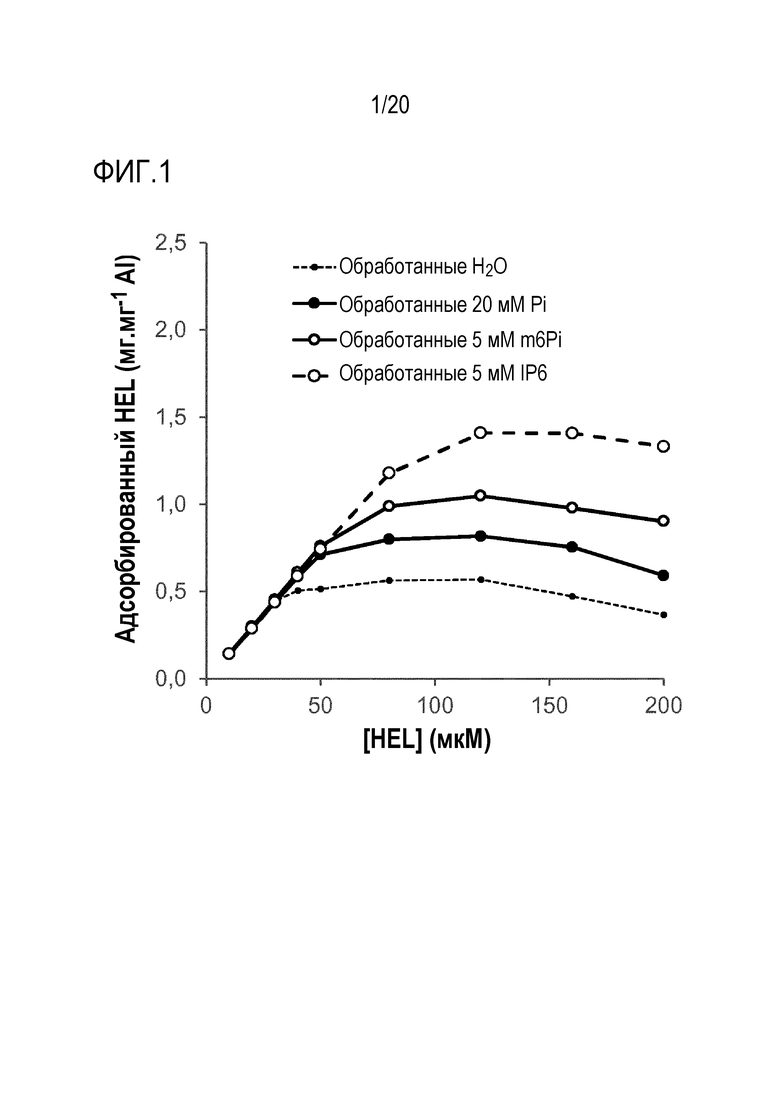
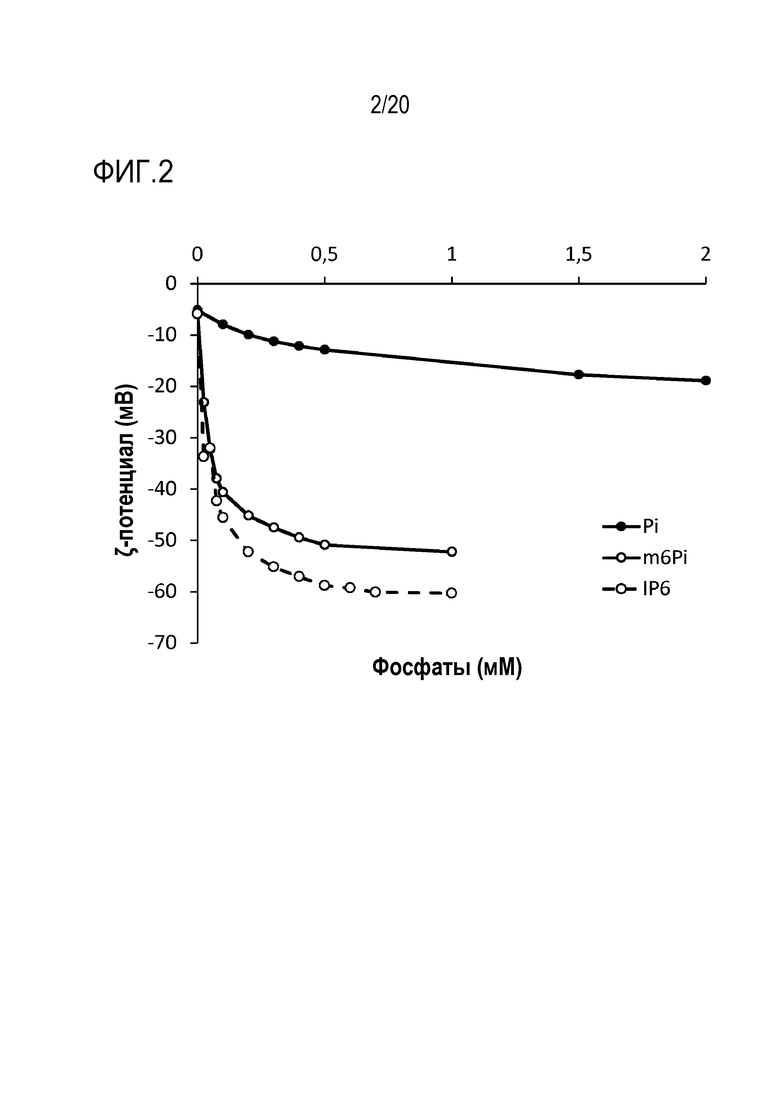
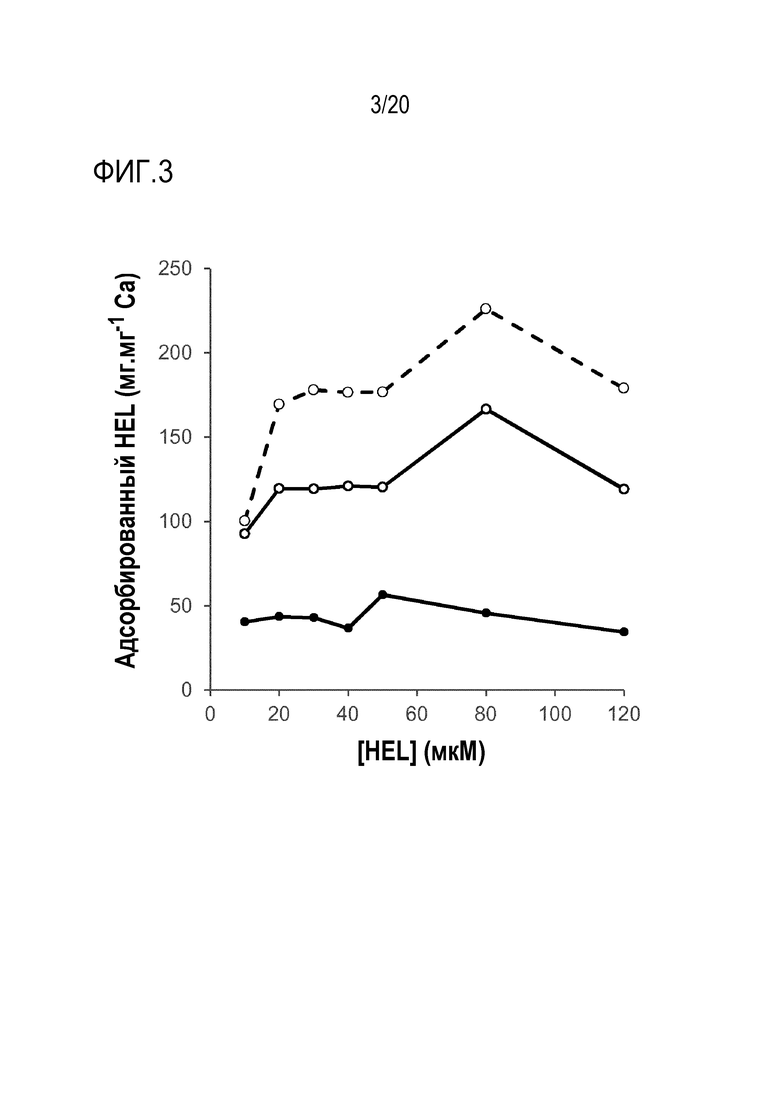

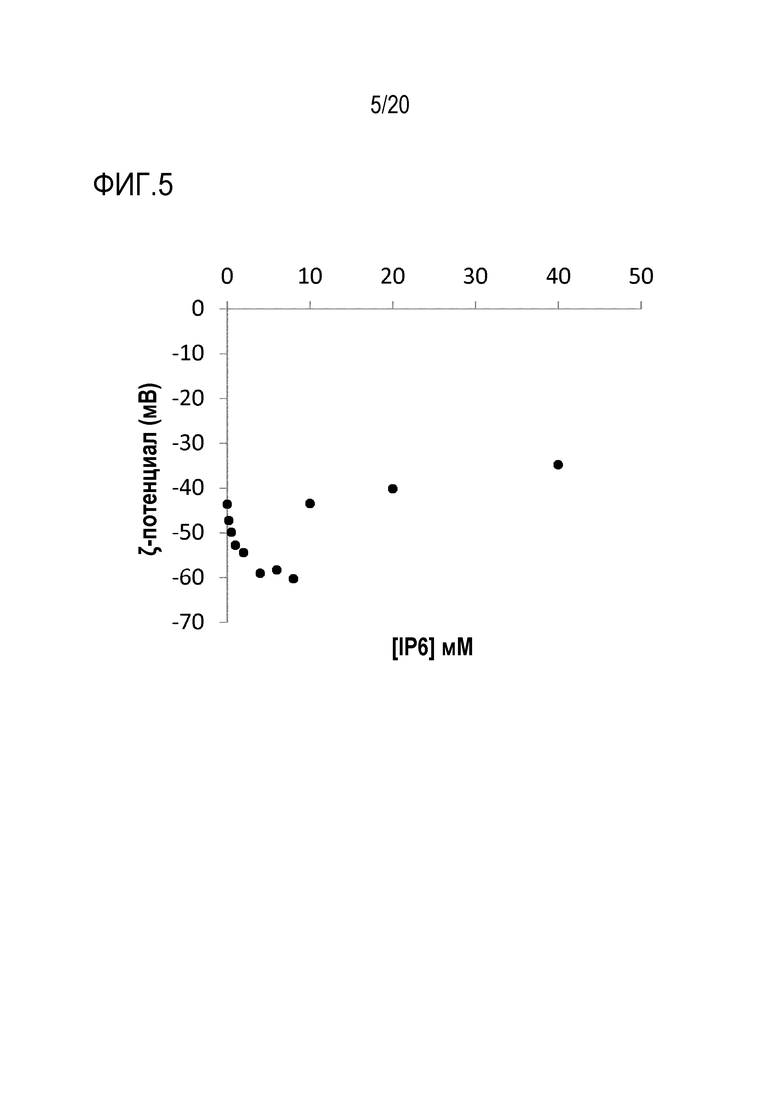








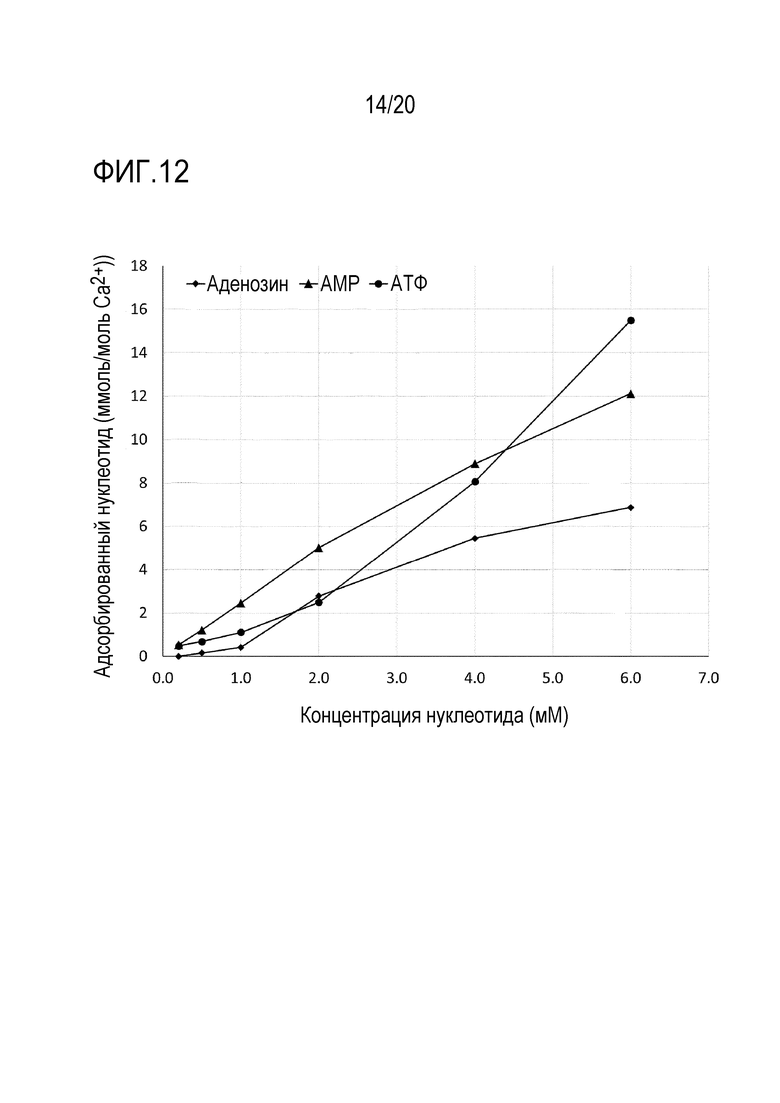






Группа изобретений относится к области получения и применения минеральных микрочастиц. Предложен способ получения органически дериватизированных минеральных микрочастиц, который включает обеспечение раствора одного или более органических полифосфатов, обеспечение минеральных микрочастиц, суспендирование указанных минеральных микрочастиц в указанном растворе одного или более органических полифосфатов, и перемешивание полученной в результате суспензии. При этом перемешивание суспензии продолжают до отсутствия изменения дзета-потенциала органически дериватизированных минеральных микрочастиц на более чем 10% в течение периода времени, составляющего 5 минут, с определением путем анализа образцов продукта реакции, выделенных с интервалом в 5 минут ± 10 секунд. Минеральные микрочастицы выбраны из микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, и указанные минеральные микрочастицы имеют размер в диапазоне от 0,01 мкм до 10 мкм. Также раскрыты органически дериватизированные минеральные микрочастицы, полученные указанным способом, и применение указанных частиц в качестве систем доставки биомолекул, в частности, в качестве адъювантов вакцин или при фракционировании крови. Изобретение обеспечивает упрощение способа получения органически дериватизированных минеральных микрочастиц, увеличение выхода реакции на поверхности частиц, что приводит к большему покрытию поверхности, причем полученные микрочастицы обладают повышенной термостойкостью и улучшенной адсорбционной емкостью по отношению к антигенам. 8 н. и 6 з.п. ф-лы, 18 ил., 17 пр.
1. Способ получения органически дериватизированных минеральных микрочастиц, который включает
a) обеспечение раствора одного или более органических полифосфатов,
b) обеспечение минеральных микрочастиц,
c) суспендирование указанных минеральных микрочастиц в указанном растворе одного или более органических полифосфатов,
d) перемешивание полученной в результате суспензии, где указанное перемешивание продолжают до отсутствия изменения дзета-потенциала органически дериватизированных минеральных микрочастиц на более чем 10% в течение периода времени, составляющего 5 минут, с определением путем анализа образцов продукта реакции, выделенных с интервалом в 5 минут ± 10 секунд,
причем указанные минеральные микрочастицы выбраны из микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, и указанные минеральные микрочастицы имеют размер в диапазоне от 0,01 мкм до 10 мкм,
и причем указанный органический полифосфат выбран из соединений формулы 1A или 1B:

где n представляет собой целое число в диапазоне от 1 до 5, Ra обозначает органические заместители, выбранные из аденозина;

где m представляет собой целое число в диапазоне от 2 до 10, и где Ra обозначает органические заместители, выбранные из аденозина и других нуклеозидов, а Rb обозначает органические заместители, выбранные из инозитов.
2. Способ по п. 1, в котором раствор одного или более органических полифосфатов включает инозитфосфат, выбранный из инозитбисфосфата (IP2), инозиттрисфосфата (IP3), инозиттетрафосфата (IP4) и инозитпентакисфосфата (IP5) инозитгексафосфата (IP6).
3. Способ по п. 1 или 2, в котором раствор одного или более органических полифосфатов включает инозитгексафосфат (IP6) или его соль.
4. Способ по любому из пп. 1-3, в котором стадию d) продолжают до отсутствия изменения дзета-потенциала органически дериватизированных минеральных микрочастиц на не более чем на 5% в течение периода времени, составляющего 5 минут, с определением путем анализа образцов продукта реакции, выделенных с интервалом в 5 минут ± 10 секунд.
5. Способ по любому из пп. 1-4, в котором исходный материал минеральных микрочастиц включает микрочастицы фосфата кальция.
6. Способ по любому из пп. 1-4, в котором исходный материал минеральных микрочастиц содержит алюминий.
7. Органически дериватизированные минеральные микрочастицы, полученные способом по любому из пп. 1-6, который включает
a) обеспечение раствора одного или более органических полифосфатов,
b) обеспечение минеральных микрочастиц,
c) суспендирование указанных минеральных микрочастиц в указанном растворе одного или более органических полифосфатов,
d) перемешивание полученной в результате суспензии, где указанное перемешивание продолжают до отсутствия изменения дзета-потенциала органически дериватизированных минеральных микрочастиц на более чем 10% в течение периода времени, составляющего 5 минут, с определением путем анализа образцов продукта реакции, выделенных с интервалом в 5 минут ± 10 секунд,
причем указанные минеральные микрочастицы выбраны из микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, и указанные минеральные микрочастицы имеют размер в диапазоне от 0,01 мкм до 10 мкм,
и причем указанный органический полифосфат выбран из соединений формулы 1A или 1B:

где n представляет собой целое число в диапазоне от 1 до 5, Ra обозначает органические заместители, выбранные из аденозина;

где m представляет собой целое число в диапазоне от 2 до 10, и где Ra обозначает органические заместители, выбранные из аденозина и других нуклеозидов, а Rb обозначает органические заместители, выбранные из инозитов.
8. Органически дериватизированные микрочастицы фосфата кальция, полученные способом по пп. 1-5.
9. Органически дериватизированные минеральные микрочастицы по любому из пп.7-8, отличающиеся тем, что они имеют номинальный дзета-потенциал, измеренный при pH 7,0 в дистиллированной воде, который составляет по крайней мере - 35 мВ в случае микрочастиц, полученных из фосфата или гидроксифосфата алюминия, или по крайней мерее - 40 мВ в случае микрочастиц, полученных из фосфата кальция.
10. Органически дериватизированные минеральные микрочастицы для применения в медицине, полученные способом по любому из пп. 1-6, который включает:
a) обеспечение раствора одного или более органических полифосфатов,
b) обеспечение минеральных микрочастиц,
c) суспендирование указанных минеральных микрочастиц в указанном растворе одного или более органических полифосфатов,
d) перемешивание полученной в результате суспензии,
где указанные минеральные микрочастицы выбраны из микрочастиц фосфата алюминия, аморфного гидроксифосфата алюминия и/или фосфата кальция, причем указанные минеральные микрочастицы имеют размер в диапазоне от 0,01 мкм до 10 мкм и
указанный органический полифосфат выбран из соединений формулы 1A или 1B:

где n представляет собой целое число в диапазоне от 1 до 5, Ra обозначает органические заместители, выбранные из аденозина;

где m представляет собой целое число в диапазоне от 2 до 10, и где Ra обозначает органические заместители, выбранные из аденозина и других нуклеозидов, а Rb обозначает органические заместители, выбранные из инозитов.
11. Применение органических дериватизированных минеральных микрочастиц по любому из пп. 7-9 в качестве систем доставки или адсорбции биомолекул.
12. Применение органических дериватизированных минеральных микрочастиц по п. 10 в качестве систем доставки биомолекул, причем указанная система доставки биомолекул представляет собой адъювант вакцины.
13. Применение органических дериватизированных минеральных микрочастиц по п. 10 в качестве адъювантов вакцин, в вакцинах.
14. Применение органических дериватизированных минеральных микрочастиц по п. 10 при фракционировании крови.
| GUAN XIAO-HONG et al | |||
| "Competitive adsorption between orthophosphate and other phosphates on aluminum hydroxide", SOIL SCIENCE, WILLIAMS AND WILKINS CO., BALTIMORE, US, (20050101), vol | |||
| Аппарат для передачи фотографических изображений на расстояние | 1920 |
|
SU170A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| US 8377909 B2, 19.02.2013 | |||
| Руководство по адъювантам в вакцинах для медицинского применения | |||
| Перевод: PharmAdvisor, версия перевода | |||
Авторы
Даты
2023-02-14—Публикация
2019-04-10—Подача