Описываемые в данном документе изобретения были выполнены в соответствии с Соглашением о совместных исследованиях между компаниями Novartis Pharma AG и Alcon Inc.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в целом относится к технологии полимерных глазных вставок и более конкретно к растворимым полимерным глазным вставкам, которые высвобождают различные смазывающие вещества и лекарственные средства в глаз (в том числе без ограничения в передний и задний сегменты) в течение продолжительного периода времени по сравнению с такими лекарственными формами, как местные капли.
УРОВЕНЬ ТЕХНИКИ
Многие офтальмологические составы содержат соединения, которые обеспечивают смазываемость и другие необходимые свойства. При внесении этих составов в глаз свойства таких соединений могут предупреждать нежелательные проблемы, такие как биоадгезия и образование вызванного трением повреждения тканей, а также способствовать естественному заживлению и восстановлению ранее поврежденных тканей.
Соблюдение режима применения местно применяемых офтальмологических составов, таких как жидкости, мази, гели, спреи, зачастую нарушается, особенно в случае лечения сухости глаз, аллергии, инфекции и медленно прогрессирующих заболеваний, таких как глаукома, требующих многократного применения в день для смазывания и доставки лекарственного средства к глазу. Воздействие местно применяемых водных составов зачастую обусловлено коротким временем удерживания состава на поверхности глаза, которое может составлять менее 25 минут после внесения. Paugh et al., Optom Vis Sci. 2008 Aug; 85(8):725-31. Типичные водные составы для глазного применения могут подвергнуться разбавлению или быть смыты с поверхности глаза за несколько минут, что вносит варьируемость в их применение или приводит к менее четким и точным дозам, вводимым в глаз. Соответственно, существует потребность в уменьшении нагрузки лечения и улучшении соблюдения режима лечения.
Более точное применение могут обеспечивать мази и гели, которые являются очень вязкими и обычно остаются в глазу дольше, чем жидкость. Однако они также могут мешать зрению пациента, и для них может требоваться введение как минимум 2-3 доз в день. По этим и другим причинам доля прекращения применения может быть очень высокой. Swanson, M., J. Am. Optom. Assoc., 2011; 10:649-6.
Также доступны вставки, как биоразлагаемые, так и не биоразлагаемые, что делает возможным более редкое их введение. Pescina S et al., Drug Dev Ind Pharm; 2017 May 7:1-8; Karthikeyan, MB et al., Asian J. Pharmacol; 2008; Oct-Dec. 192-200. Однако в случае данных вставок необходима сложная и тщательная подготовка, и они могут доставлять дискомфорт пациенту. Дополнительным недостатком не биоразлагаемых вставок является то, что их необходимо удалять после их применения. Однако при правильном применении и надлежащем обучении пациента вставки могут быть эффективным и безопасным выбором для лечения пациентов с синдромом сухости глаз.
Для пациентов с синдромом сухости глаз применяют гидроксипропилцеллюлозные глазные вставки, такие как LACRISERT® (Aton Pharmaceuticals Inc.). Данные вставки представляют собой полупрозрачные целлюлозные стержни, которые по размерам составляют 1,27 мм в диаметре и 3,5 мм в длину. Каждая из этих вставок содержит 5 мг гидроксипропилцеллюлозы без консервантов или других ингредиентов. Данный лекарственный препарат вводят путем помещения одной вставки в нижний свод глаза под основанием тарзальной пластинки. Данные вставки особенно показаны пациентам, у которых продолжают сохраняться симптомы сухости глаз после надлежащей пробной терапии искусственными слезами. Они также показаны пациентам с сухим кератоконъюнктивитом, кератитом, развивающимся при несмыкании глазной щели, пониженной чувствительностью роговицы и рецидивирующими эрозиями роговицы. Было проведено несколько исследований для оценки эффективности офтальмологических вставок из HPC. (Luchs, J, et al., Cornea, 2010; 29:1417-1427; Koffler B, et al., Eye Contact Lens; 2010; 36:170-176; McDonald M, et al., Trans Am Ophthalmol. Soc., 2009; 107:214- 221; Wander A, and Koffler B, Ocul Surf. 2009 Jul;7(3):154-62).
Однако при применении вставок данных типов также возникают проблемы. Например, вставки LACRISERT® имеют склонность к медленному растворению и могут оставаться в глазу даже спустя 15-20 часов. Стержень является жестким и неэластичным по краям из-за стержневой конструкции. Свойства медленного растворения в сочетании с жесткостью и конструкцией стержня могут привести к побочным эффектам, в том числе к нечеткому зрению, ощущению инородного тела и/или дискомфорту, раздражению или гиперемии глаза, гиперчувствительности, светобоязни, отеку века, а также к слеживанию или высыханию вязкого материала на ресницах. Наиболее частым побочным эффектом у данных гидроксипропилцеллюлозных офтальмологических вставок является нечеткое зрение из-за длительного времени удерживания вставки. Следовательно, требуются дополнительные подходы для разработки полимерных глазных вставок, которые являются удобными и улучшают соблюдение режима лечения пациентов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предусмотрена полимерная глазная вставка, при этом вставка содержит: один или более мукоадгезивных полимеров, которые являются биосовместимыми с поверхностью глаза и слезной пленкой глаза; и где при введении полимерной глазной вставки в свод глаза толщина слезной пленки увеличивается на период времени, составляющий по меньшей мере 30 минут после введения. В настоящем изобретении также предусмотрен способ лечения глазного нарушения, который включает нанесение полимерной глазной вставки, которая представляет собой вставку в соответствии с вариантами осуществления настоящего изобретения, на/в свод глаза.
Настоящее изобретение отчасти основано на обнаружении проблем, заключающихся в тенденции к медленному растворению и продолжении пребывания в глазу даже спустя 15-20 часов при применении таких коммерчески доступных офтальмологических вставок, как вставки LACRISERT®. Данную проблему можно решить путем применения полимерной глазной вставки в соответствии с вариантами осуществления настоящего изобретения, которая является достаточно малой, чтобы помещаться в своде глаза и быстро смачиваться, так что при введении возникает небольшое раздражение или не возникает никакого раздражения, и данная вставка также является достаточно большой, чтобы растворение было возможным в течение примерно 30-120 минут для обеспечения прохождения высвобождения смазывающего(смазывающих) вещества(веществ) и/или фармацевтически активных средств. Вставка также характеризуется толщиной, которая является относительно комфортной для пользователя. Предпочтительная толщина составляет 50-250 микрон, и наиболее предпочтительная толщина составляет 70-150 микрон. Целевая толщина составляет 90 микрон в случае пленок, растворяющихся менее чем за 2 часа.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Для обеспечения более полного понимания настоящего изобретения ниже представлено следующее описание, приведенное в сочетании с прилагаемыми графическими материалами, на которых:
на ФИГ. 1 изображено размещение полимерной глазной вставки в соответствии с вариантами осуществления настоящего изобретения;
на ФИГ. 2A - 2C изображены размеры слезной пленки в случае глазных капель SYSTANE® ULTRA до введения дозы (ФИГ. 2A), сразу после введения дозы (ФИГ. 2B) и через 5 минут после введения дозы (ФИГ. 2C);
на ФИГ. 3A - 3C показаны размеры слезной пленки в случае гелевых глазных капель GENTEAL® до введения дозы (ФИГ. 3A), сразу после введения дозы (ФИГ. 3B) и через 5 минут после введения дозы (ФИГ. 3C);
на ФИГ. 4A - 4E показаны размеры слезной пленки в случае инъекционной формы PROVISC® до введения дозы (ФИГ. 4A), сразу после введения дозы (ФИГ. 4B), через 5 минут после введения дозы (ФИГ. 4C), через 10 минут после введения дозы (ФИГ. 4D) и через 20 минут после введения дозы (ФИГ. 4E);
на ФИГ. 5A - 5I отображены размеры слезной пленки, связанные с введением полимерной глазной вставки в соответствии с вариантами осуществления настоящего изобретения;
на ФИГ. 6A отображены средние размеры слезной пленки с применением полимерных глазных вставок в соответствии с одним вариантом осуществления настоящего изобретения;
на ФИГ. 6B отображены размеры слезной пленки у отдельного животного в соответствии с одним вариантом осуществления настоящего изобретения;
на ФИГ. 6C отображены размеры слезной пленки по местоположению в глазу, в том числе размеры в нижней части глаза, верхней части глаза, в височной области и области носа в соответствии с одним вариантом осуществления настоящего изобретения;
на ФИГ. 7A отображено динамическое изменение толщины слезной пленки по отношению к полимерным глазным вставкам в соответствии с вариантами осуществления настоящего изобретения;
на ФИГ. 7B отображены размеры слезной пленки по местоположению (верхушка, область носа, височная область, верхняя часть и нижняя часть) для полимерных глазных вставок в соответствии с вариантами осуществления настоящего изобретения;
на ФИГ. 8 отображены средние размеры слезной пленки в случае геля GENTEAL® для правого и левого глаза;
на ФИГ. 9 отображены данные о толщине слезной пленки в зависимости от времени, прошедшего после введения дозы; и
на ФИГ. 10A - 10C проиллюстрированы различные формы и характеристики полимерных глазных вставок в соответствии с вариантами осуществления настоящего изобретения.
На ФИГ. 11 проиллюстрированы результаты, полученные для первичной конечной точки исследования (оценка комфорта) для двух вариантов осуществления (толстая вставка и тонкая вставка) в соответствии с вариантами осуществления настоящего изобретения;
на ФИГ. 12 проиллюстрированы результаты, полученные для вторичной конечной точки исследования (затуманивание зрения) для двух вариантов осуществления (толстая вставка и тонкая вставка) в соответствии с вариантами осуществления настоящего изобретения;
на ФИГ. 13 проиллюстрированы результаты, полученные в ходе оценки растворимости полимерной глазной вставки в соответствии с вариантами осуществления настоящего изобретения;
на ФИГ. 14 проиллюстрированы результаты, полученные для вторичной конечной точки исследования (NITBUT) для двух вариантов осуществления (толстая вставка и тонкая вставка) в соответствии с настоящим изобретением;
на ФИГ. 15 проиллюстрированы результаты, полученные для вторичной конечной точки исследования (высота мениска слезной жидкости) для двух вариантов осуществления (толстая вставка и тонкая вставка) в соответствии с настоящим изобретением;
на ФИГ. 16 проиллюстрированы результаты, полученные в ходе опроса о раздражении глаз для двух вариантов осуществления (толстая вставка и тонкая вставка) в соответствии с настоящим изобретением;
на ФИГ. 17 проиллюстрированы результаты, полученные в ходе опроса о сухости глаз для двух вариантов осуществления (толстая вставка и тонкая вставка) в соответствии с настоящим изобретением;
на ФИГ. 18 проиллюстрированы результаты, полученные в ходе опроса о жжении/рези в глазах для двух вариантов осуществления (толстая вставка и тонкая вставка) в соответствии с настоящим изобретением;
на ФИГ. 19 проиллюстрированы результаты, полученные в ходе опроса о зуде в глазах для двух вариантов осуществления (толстая вставка и тонкая вставка) в соответствии с настоящим изобретением.
ПОДРОБНОЕ ОПИСАНИЕ
В вариантах осуществления настоящего изобретения предусматривается полимерная глазная вставка, содержащая смазывающее вещество для глаз, содержащее один или более полимеров. В одном варианте осуществления настоящего изобретения полимерная глазная вставка может состоять из гиалуроновой кислоты, гидроксипропилгуара (HP-гуара) и пластификатора, такого как полиэтиленгликоль (PEG); однако можно применять и другие полимеры и пластификаторы/смягчители без выхода за пределы объема настоящего изобретения. Вставка в соответствии с вариантами осуществления настоящего изобретения может быть введена в нижнее веко (также известное как свод) глаза, и после введения вставка может быстро впитывать слезы и растворяться с высвобождением смазывающего вещества для глаз в слезную пленку для смазывания и защиты глазной поверхности в течение продолжительного времени, которое превосходит таковое у ранее известных офтальмологических композиций для местного применения. В полимерные глазные вставки в соответствии с вариантами осуществления настоящего изобретения могут быть включены фармацевтически активные средства. Введение полимерной глазной вставки в соответствии с вариантами осуществления настоящего изобретения может облегчить у пациента симптомы сухости глаз, а также других патологических состояний глаз.
Биоматериал для формирования полимерной глазной вставки в соответствии с вариантами осуществления настоящего изобретения может состоять из одного или более полимеров, которые являются биосовместимыми с глазной поверхностью и слезной пленкой. К полимерам, которые можно применять в полимерных глазных вставках в соответствии с вариантами осуществления настоящего изобретения, относятся без ограничения гиалуроновая кислота (в кислотной или солевое форме), гидроксипропилметилцеллюлоза (HPMC), метилцеллюлоза, полисахарид из семян индийского финика (TSP), галактоманнаны, например, гуар и его производные, такие как гидроксипропилгуар (HP-гуар), склероглюкановый полоксамер, полигалактуроновая кислота, альгинат натрия, пектин, ксантановая камедь, ксилоглюкановая камедь, хитозан, карбоксиметилцеллюлоза натрия, поливиниловый спирт, поливинилпирролидин, карбомер, полиакриловая кислота и/или их комбинации.
Предпочтительными биосовместимыми полимерами являются гиалуроновая кислота, гуар и их производные и/или комбинации. Гиалуроновая кислота представляет собой несульфатированный гликозаминогликан, состоящий из повторяющихся дисахаридных звеньев N-ацетилглюкозамина (GlcNAc) и глюкуроновой кислоты (GlcUA), связанных друг с другом чередующимися бета-1,4- и бета-1,3-гликозидными связями. Гиалуроновая кислота также известна как гиалуронан, гиалуронат или HA. Используемый в данном документе термин "гиалуроновая кислота" также охватывает солевые формы гиалуроновой кислоты, такие как гиалуронат натрия. Предпочтительная гиалуроновая кислота представляет собой гиалуронат натрия. Средневесовая молекулярная масса гиалуроновой кислоты, применяемой во вставке по настоящему изобретению, может варьировать, но обычно она составляет от 0,1 до 2,0 млн. дальтонов. В одном варианте осуществления гиалуроновая кислота характеризуется средневесовой молекулярной массой, составляющей от 0,5 до 1 млн. дальтонов. В другом варианте осуществления гиалуроновая кислота характеризуется средневесовой молекулярной массой, составляющей от 1,5 до 2,0 млн. дальтонов.
Галактоманнаны в соответствии с настоящим изобретением можно получать из множества источников. К таким источникам относятся камедь пажитника, гуаровая камедь, камедь рожкового дерева и камедь тары. Кроме того, галактоманнаны также можно получать с помощью классических путей синтеза или можно получать путем химической модификации встречающихся в природе галактоманнанов. Используемый в данном документе термин "галактоманнан" означает полисахариды, полученные из вышеупомянутых природных камедей или схожих природных или синтетических камедей, содержащих маннозные или галактозные фрагменты или как первую, так и вторую группы в качестве основных структурных компонентов. Предпочтительные галактоманнаны по настоящему изобретению состоят из линейных цепей (1-4)-бета-D-маннопиранозильных звеньев с альфа-D-галактопиранозильными звеньями, присоединенными (1-6)-связями. В случае предпочтительных галактоманнанов соотношение D-галактозы к D-маннозе варьируется, но обычно составляет от приблизительно 1:2 до 1:4. Наиболее предпочтительными являются галактоманнаны с соотношением D-галактоза:D-манноза, составляющим приблизительно 1:2. Кроме того, в определение "галактоманнан" также входят и другие химически модифицированные варианты полисахарида. Например, в галактоманнаны в соответствии с настоящим изобретением можно вводить гидроксиэтиловые, гидроксипропиловые и карбоксиметилгидроксипропиловые заместители. Особенно предпочтительными, если требуется мягкий гель, являются неионогенные разновидности галактоманнанов, такие как содержащие алкокси- и алкильные (C1-C6) группы (например, гидроксилпропильные заместители). Особенно предпочтительными являются заместители в отличных от цис-гидроксильных положениях. Примером галактоманнана с неионогенным заместителем в соответствии с настоящим изобретением является гидроксипропилгуар с молярным замещением, составляющим приблизительно 0,4. В галактоманнаны также можно вводить анионные заместители. Анионный заместитель является особенно предпочтительным, если требуются сильно реагирующие гели. Предпочтительными галактоманнанами по настоящему изобретению являются гуар и гидроксипропилгуар. Особенно предпочтительным является гидроксипропилгуар. Средневесовая молекулярная масса гидроксипропилгуара во вставке по настоящему изобретению может варьироваться, но обычно она составляет от 1 до 5 млн. дальтонов. В одном варианте осуществления гидроксипропилгуар характеризуется средневесовой молекулярной массой, составляющей от 2 до 4 млн. дальтонов. В другом варианте осуществления гидроксипропилгуар характеризуется средневесовой молекулярной массой, составляющей от 3 до 4 млн. дальтонов.
Полимеры, применяемые во вставках в соответствии с вариантами осуществления настоящего изобретения, должны быть нетоксичными и способными растворяться в глазных жидкостях для обеспечения того, что вставка в конечном итоге устранится из глаза, обычно в течение временного промежутка, составляющего 60 минут. Следует понимать, что выбранный(выбранные) полимер(полимеры) должен(должны) быть мукоадгезивным(мукоадгезивными). Также следует понимать, что один или более полимеров могут быть смешаны в соответствии с вариантами осуществления настоящего изобретения. Например, в одном варианте осуществления настоящего изобретения гиалуроновая кислота (HA) может быть смешана с полисахаридом семян индийского финика (TSP), поскольку было показано, что TSP увеличивает время пребывания HA в агрегатных смесях, и такая смесь придает требуемые механические и смазывающие свойства пленке. В других вариантах осуществления настоящего изобретения, как более подробно описано ниже, гиалуроновую кислоту можно сочетать с HP-гуаром.
В некоторых вариантах осуществления один или более мукоадгезивных полимеров присутствуют в количестве от приблизительно 50% до приблизительно 99% вес/вес, от приблизительно 60% до приблизительно 95% вес/вес, от приблизительно 70% до приблизительно 90% вес/вес или от приблизительно 80% до приблизительно 90% вес/вес от сухого веса полимерной глазной вставки. В отдельных вариантах осуществления мукоадгезивные полимеры присутствуют в количестве, составляющем приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90% или приблизительно 95% вес/вес от сухого веса полимерной глазной вставки. Общий сухой вес или общая сухая масса полимерной глазной вставки может находиться в диапазоне от приблизительно 1 до приблизительно 10 мг или от приблизительно 2 до приблизительно 8 мг и в отдельных вариантах осуществления может составлять от приблизительно 2,5 до приблизительно 5 мг.
В некоторых вариантах осуществления настоящего изобретения к одному или более полимерам можно добавлять смягчитель и/или пластификатор для способствования изготовлению более мягкой, податливой системы доставки, а также обеспечения повышенного комфорта при введении. Пластификатор может размягчать материал, обеспечивая требуемые скорости растворения. Следует понимать, что смягчители и/или пластификаторы могут представлять собой соединения с низким или высоким молекулярным весом, в том числе без ограничения полиэтиленгликоль (PEG) и его производные, воду, витамин E и триэтилцитрат.
В некоторых вариантах осуществления пластификатор или смягчитель присутствует в количестве от приблизительно 2% до приблизительно 30% вес/вес, от приблизительно 5% до приблизительно 25% вес/вес, от приблизительно 5% до приблизительно 20% вес/вес или от приблизительно 5% до приблизительно 15% вес/вес от сухого веса полимерной глазной вставки. В отдельных вариантах осуществления пластификатор или смягчитель присутствует в количестве, составляющем приблизительно 5%, приблизительно 7%, приблизительно 10%, или 12%, или приблизительно 15% вес/вес от сухого веса полимерной глазной вставки.
В некоторых вариантах осуществления полимерная глазная вставка может характеризоваться содержанием воды от приблизительно 1% до приблизительно 50% после увлажнения. В отдельных вариантах осуществления полимерная глазная вставка может характеризоваться содержанием воды, составляющим 30-40%.
Полимерная глазная вставка может характеризоваться любым размером или любой формой, подходящими для введения в глаз. К иллюстративным формам относятся пленка, стержень, сфера или неправильная форма, характеризующаяся максимальным размером в любом единственном измерении, составляющим 5-6 мм. Дополнительные иллюстративные формы показаны на ФИГ. 10A - 10C.
В некоторых вариантах осуществления полимерная глазная вставка характеризуется толщиной, составляющей приблизительно 50-400 мкм, приблизительно 100-300 мкм, приблизительно 150-250 мкм или приблизительно 200 мкм.
В отдельных вариантах осуществления полимерная глазная вставка характеризуется толщиной, составляющей приблизительно 150-250 мкм, и содержанием воды, составляющим от 30 до 50 вес/вес %.
В некоторых вариантах осуществления настоящего изобретения полимерная глазная вставка не включает дополнительное фармацевтически активное средство. В других вариантах осуществления полимерная глазная вставка может включать одно или более дополнительных фармацевтически активных средств. В некоторых вариантах осуществления одно или более фармацевтически активных средств могут быть выбраны из группы, состоящей из смазывающих веществ для глаз, средств против покраснения, таких как агонисты альфа-2-адренергических рецепторов, такие как бримонидин, апраклонидин и т. д., симпатомиметических аминов, таких как тетрагидрозолин, нафазолин, агонистов TRPM8, таких как ментол, аналоги ментола, стероидов и нестероидных противовоспалительных средств для снятия глазной боли и глазного воспаления, антибиотиков, антигистаминных средств, таких как олопатадин, противовирусных средств, антибиотиков и антибактериальных средств для лечения инфекционного конъюнктивита, антимускариновых средств, таких как атропин и его производные для лечения миопии, и средств доставки лекарственных средств от глаукомы, таких как простагландин и аналоги простагландина, такие как травопрост, или их терапевтически подходящих комбинаций.
Полимерные глазные вставки в соответствии с вариантами осуществления настоящего изобретения можно получать с помощью различных методик обработки, в том числе без ограничения путем формования прессованием и литьем из раствора. Формование прессованием можно проводить при значениях температуры и давления, которые не изменяют материал и не приводят к значительным побочным реакциям. Например, при формовании прессованием частично гидратированных полисахаридов можно применять силу прессования, равную примерно 5000-12000 фунтов при приблизительно 200-300 градусах Цельсия в течение примерно 1-2 минут. Литье из раствора или отливку пленки можно проводить с применением растворителей и/или сорастворителей, которые могут обеспечивать однородные пленки с незначительными дефектами или вообще без дефектов. Растворитель можно удалять путем высушивания на воздухе или высушивания в вакууме, в результате чего материал вставки может не содержать остаточных растворителей. Например, можно отливать 1% (вес/об.) водный раствор полимера (или смеси), а затем обеспечивать его выпаривание. Затем пленку можно нарезать с помощью штампа овальной формы с требуемыми размером и геометрической формой. Несмотря на то, что были описаны формование прессованием и литье из раствора/отливка пленки, следует понимать, что можно применять и другие методики обработки без выхода за пределы объема настоящего изобретения.
В одном варианте осуществления было обнаружено, что применяемый способ отливки пленки обеспечивает воспроизводимые вставки и надлежащую структурную целостность. В данном варианте осуществления дистиллированную воду помещали в колбу Эрленмейера объемом 1 л с последующим добавлением полимера(полимеров). Колбу помещали в ультразвуковой аппарат и присоединяли к размещаемой сверху механической мешалке. Смесь обрабатывали ультразвуком и перемешивали в течение 60 минут при 30°C. Скорость механической мешалки доводили до 700 об./мин. и обеспечивали перемешивание в течение 60 минут. Останавливали перемешивание и в колбу добавляли пластификатор (PEG и/или PVP). Данную смесь перемешивали в течение 30 минут при обработке ультразвуком при скорости 700 об./мин. при 30°C до получения однородного бесцветного раствора. Затем останавливали механическое перемешивание и обеспечивали продолжение обработки ультразвуком дополнительно в течение 30 минут для удаления всех пузырьков. Затем колбу Эрленмейера вынимали из ультразвукового аппарата и обеспечивали отстаивание содержимого при комнатной температуре в течение 30 минут. Для получения пленок чашку Петри (диаметр 150 мм × высота 15 мм) заполняли с помощью приблизительно 150 г ± 2 г исходного раствора. Исходный раствор подвергали оценке с применением различных методик выпаривания. В первом эксперименте применяли вакуумную печь при 50°C. Чашки Петри помещали в печь и с помощью вакуумного насоса откачивали воздух из печи. Через 30 часов полученные пленки имели желтый цвет, и некоторые из пленок характеризовались искривленными поверхностями. Эксперименты повторяли при 45°C, 40°C и 35°C в тех же условиях вакуумирования. При всех описанных выше экспериментальных условиях получали окрашенные пленки или пленки с неравномерным распределением веса. Также было замечено, что чем выше была температура, тем темнее и интенсивнее становился желтый цвет. Предпочтительная методика выпаривания предусматривала выпаривание в камере, оснащенной вытяжкой с регулируемой скоростью, при комнатной температуре. В процессе выпаривания измеряли воздушный поток, температуру и влажность. Описанная выше методика обеспечивала равномерное выпаривание и обеспечивала получение пленок с равномерной толщиной.
Как рассмотрено ранее, результаты исследования в условиях in vivo свидетельствуют о том, что традиционные офтальмологические смазывающие вещества для местного применения не остаются в глазу дольше чем примерно 25 минут. Однако применение одного или более полимеров в комбинации с пластификатором/смягчителем, таким как HP-гуар и гиалуроновая кислота, смешанная с пластификатором (таким как PEG), может обеспечивать эластичные пленки с регулируемыми значениями скорости увлажнения и растворения для комфортного введения. Хотя в определенных вариантах осуществления настоящего изобретения предусмотрены полимерные глазные вставки, содержащие смесь гиалуроновой кислоты, HP-гуара и PEG, следует принимать во внимание, что в соответствии с другими вариантами осуществления настоящего изобретения для полимерных глазных вставок можно применять и другие смеси. На ФИГ. 1 изображено размещение глазной вставки в соответствии с одним вариантом осуществления настоящего изобретения на поверхности глаза.
Глазные вставки по настоящему изобретению представляют собой платформу для доставки смазывающих веществ и других фармацевтически активных средств для лечения симптомов на поверхности глаза (таких как покраснение, зуд и сухость). В некоторых вариантах осуществления полимерные глазные вставки можно применять для продления воздействия фармацевтически активных средств или обеспечения продолжительной доставки фармацевтически активных средств в глаз. Таким образом, в некоторых вариантах осуществления в настоящем изобретении предусмотрен способ обеспечения продолжительной доставки лекарственного средства или продления воздействия фармацевтически активного средства на глаз путем введения нуждающемуся в этом пациенту полимерной глазной вставки, включающей фармацевтически активное средство.
В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ лечения или уменьшения признаков и/или симптомов заболевания сухости глаз (сухого кератоконъюнктивита), предусматривающий введение полимерной глазной вставки в соответствии с настоящим изобретением нуждающемуся в этом пациенту.
Для иллюстрации вариантов осуществления настоящего изобретения представлены последующие неограничивающие примеры.
ПРИМЕРЫ
Пример 1
В одном варианте осуществления настоящего изобретения для формирования полимерной глазной вставки, содержащей HP-гуар и гиалуронат натрия, можно применять гиалуронат-флуоресцеин (Creative PegWorks; Чапел-Хилл, Северная Каролина), гиалуронат натрия (Novozyme; Франклинтон, Северная Каролина), HP-гуар, HP-гуар-флуоресцеин, PEG 400 и воду; однако следует понимать, что для формирования полимерной глазной вставки можно применять большее или меньшее количество компонентов из разных партий и/или от разных поставщиков без выхода за пределы объема настоящего изобретения.
Для того, чтобы сформировать данную вставку с HP-гуаром/гиалуронатом натрия, добавляли примерно 100 мл воды в колбу Эрленмейера, которую предварительно обрабатывали в автоклаве в течение примерно 30 минут. Температура воды составляла примерно 22 градуса по Цельсию. HA-компонент был помечен флуоресцеин-изотиоцианатом (FITC) для отслеживания его высвобождения in vivo. Затем к воде добавляли FITC-гиалуроновую кислоту (примерно 102,2 мг) при перемешивании при примерно 23 градусах Цельсия при настройке 500 (1/мин.) с применением нагревательной плиты/мешалки IKA® Ret Control-Visc C. Затем добавляли гиалуронат натрия (примерно 354,3 мг) с последующим добавлением HP-гуара (454,1 мг) и PEG 400 (примерно 97,2 мг). Затем добавляли дополнительное количество воды (примерно 100 мл). Смесь перемешивали в течение примерно 20 часов при температуре окружающей среды (примерно 22 градуса Цельсия) с применением настроек перемешивания 600 (1/мин.). Затем раствор выливали в стерильную полистироловую одноразовую чашку Петри (VWR, диаметр 55 мм, высота 15 мм). Затем чашку Петри, содержащую раствор, помещали в конвекционную печь Lindberg Blue M (Thermo Scientific), нагревали до примерно 35 градусов Цельсия, а затем высушивали в грубоком вакууме при примерно 23 градусах Цельсия в течение примерно 1-2 дней.
Полученная композиция для данного варианта осуществления полимерной глазной вставки была следующей: 102,2 мг (примерно 10%) FITC-гиалуроновой кислоты/354,3 мг (примерно 35%) гиалуроната натрия, 454,1 мг (примерно 45%) HP-гуара и 97,2 мг (примерно 9%) PEG 400. Затем с помощью штампа вырезали диски диаметром 6 мм для оценочных исследований в условиях in vivo. Хотя выше была описана методология формирования вставки с HP-гуаром/гиалуроновой кислоты в соответствии с одним вариантом осуществления настоящего изобретения, следует принимать во внимание, что можно использовать и другие методологии для формирования таких или схожих полимерных глазных вставок без выхода за пределы объема настоящего изобретения.
Исследование переносимости в условиях in vivo проводили с применением одиночных полимерных глазных вставок и новозеландских белых кроликов. Полимерные глазные вставки, использованные в данном исследовании, состояли из дисков размером 3-7 мм, содержащих смесь HP-гуара/гиалуроновой кислоты с применением PEG в качестве пластификатора. Компонент гиалуроновой кислоты был помечен флуоресцеин-изотиоцианатом (FITC) для отслеживания его высвобождения in vivo. В данном исследовании была выявлена приемлемая переносимость и комфорт при применении пленки толщиной 200 мкм и диаметром 6 мм. Также проводили исследование удерживания в условиях in vivo с применением одной пленки из смеси HP-гуара/гиалуроновой кислоты/PEG (с применением 5% FITC-гиалуроновой кислоты). Пленка увлажнялась в своде глаза, но спустя два часа все еще оставались ее фрагменты. Однако эти фрагменты можно объяснить низкой частотой моргания и прерывистым морганием, характерным для субъектов-кроликов. Результаты измерения флуоресценции этих полимерных глазных вставок показаны в ТАБЛИЦЕ 1.
ТАБЛИЦА 1
ФЛУОРЕСЦЕНЦИЯ ТОНКОПЛЕНОЧНЫХ ВСТАВОК-МОМЕНТЫ ВРЕМЕНИ С ≥1,5X ИСХОДНЫМ УРОВНЕМ
Все полимерные глазные вставки переносились весьма надлежащим образом, без каких-либо физических реакций, выделений, прищуриваний или попыток тронуть лапой. После размещения вставка оставалась в глазу с очень небольшим движением до полного ее растворения. Вставки растворялись в течение первых 30 минут после введения. Спустя один час на поверхности роговицы был виден остаток смазывающего вещества. Спустя 6 часов остатка больше не было. Было определено, что размер, составляющий 6 мм, был наибольшим диаметром, который мог поместиться в своде без нарушения роговично-склерального лимба. При диаметре 7 мм вставка пересекала лимб. Однако можно использовать и другие диаметры вставок без выхода за пределы объема настоящего изобретения.
Тесты по изучению полимерных глазных вставок в соответствии с вариантами осуществления настоящего изобретения были выполнены с применением Spectralis HRA-OCT. Это диагностическое устройство, которое объединяет SD-OCT с визуализацией глазного дна cSLO. Кератотопографический модуль, предоставляемый Spectralis, может обеспечивать возможность визуализации структур переднего сегмента. Визуализация SD-OCT является желательной, поскольку для нее нет необходимости в меченном тестируемом изделии, она обладает как визуализирующими, так и количественными свойствами, обеспечивает прямое микрометрическое измерение слезной пленки/полимерной глазной вставки и обеспечивает возможность за секунды регистрировать высоту слезной пленки в четырех квадрантах глаза. На таком изображении можно было видеть скопление полимерной вставки в нижнем мениске слезной жидкости.
Пример 2
Получали различные полимерные вставки путем отливки пленок с целью оценки совместимости полимеров для получения бесцветных и/или достаточно прозрачных вставных пленок. С применением различных соотношений концентрации каждого указанного полимера получали и оценивали следующие полимерные составы: HA/PEG, HA/PVP/PEG, HA/PVP, HA/HP-гуар/PEG, HP-гуар/PVP/PEG, HA/HP-гуар/PVP/PEG, HA/HP-гуар/PAA/PEG, HA/HP-гуар/HPMC/PEG. Ниже приведено описание способов изучения характеристик вставных пленок.
1. Морфология
Морфологию поверхности вставных пленок изучали с помощью соответствующего микроскопа. Исследовали текстуру и прозрачность вставных пленок и регистрировали результаты наблюдений. Отмечали, если поверхность пленки оказывалась бесцветной и прозрачной. Также отмечали, если наблюдали нерастворенные частицы или помутнение.
2. Однородность толщины
Отбирали образцы четырех пленок и оценивали их толщину путем нарезания вставочных дисков с диаметром 6 мм. Измеряли толщину дисков. Местоположения для нарезания дисков выбирали случайным образом, в середине и по краям каждой пленки. Толщину дисков измеряли с помощью цифрового штангенциркуля Mitutoyo. Для каждой пленки рассчитывали среднее значение и стандартное отклонение у 12 дисков.
3. Однородность веса
Для определения однородности веса выбирали четыре различных пленки и вырезали 12 дисков с диаметром 6 мм. Местоположения для нарезания дисков выбирали случайным образом на исходных пленках. Вес каждого диска определяли с помощью высокоточных весов Sartorius. Измеряли вес каждого отдельного диска и определяли средний вес 12 дисков для каждой пленки. Рассчитывали и регистрировали стандартное отклонение для 12 точек данных.
4. Процент влагопоглощения
Для теста на влагопоглощение в процентах получали четыре круглые пленки с диаметром 150 мм. Из каждой пленки вырезали четыре круглых диска с диаметром 20 мм. Четыре диска помещали в камеру, содержащую 100 мл насыщенного раствора хлорида алюминия. Камеру плотно закрывали на 72 часа. В течение этого периода времени внешний вид поверхности диска оставался бесцветным. Диски осторожно извлекали из камеры и измеряли вес каждого диска. Процент влагопоглощения каждого диска рассчитывали по следующей формуле:
%MA = ((конечный вес − изначальный вес) / изначальный вес) × 100
Регистрировали средний процент влагопоглощения для 12 дисков, вырезанных из четырех различных пленок.
5. Процент потери влаги
Для измерения процента потери влаги использовали те же пленки, которые изготовляли для расчета процента влагопоглощения. Четыре вышеупомянутых диска на 72 часа помещали в осушитель, содержащий безводный хлорид кальция. Затем диски извлекали из осушителя и определяли их вес. Процент потери влаги для каждой пленки рассчитывали с применением следующего уравнения:
%ML= ((изначальный вес −конечный вес) / конечный вес) × 100
Регистрировали среднюю потерю влаги для 12 дисков, вырезанных из четырех различных пленок.
6. Сопротивление излому
Получали четыре большие круглые пленки с диаметром 150 мм. Из каждой пленки получали четыре квадратных пленки с размерами 4 см × 4 см. Полоски пленок многократно сгибали в одном и том же месте до тех пор, пока пленки не разламывались или не давали видимую трещину. Количество раз, сколько пленки можно было согнуть в одном и том же месте без разламывания, давало значение сопротивления излому. Собирали данные и регистрировали средние результаты. Определяли среднее сопротивление излому у 16 квадратных полосок, вырезанных из четырех различных пленок.
7. Время растворения и pH раствора
Из основных круглых пленок с диаметром 150 мм вырезали четыре круглых диска с диаметром 6 мм. Пленки помещали во флакон с 2 мл DI воды и регистрировали время, необходимое для полного растворения. Регистрировали среднее время растворения и стандартное отклонение для каждой группы.
8. Предел прочности, модуль упругости, смещение и относительное удлинение в процентах
Для измерения каждой точки данных применяли четыре полоски пленки с размерами 4 см × 2 см. Все пленки проверяли на наличие пузырьков воздуха и физических дефектов. Во время измерения полоски пленки удерживали между двумя зажимами, расположенными на расстоянии 3 см. Пременяемая нагрузка на ячейку составляла 5 килограмм. Полоски натягивали верхним зажимом со скоростью 10 см/мин. Измеряли и регистрировали средние предел прочности, модуль упругости и относительное удлинение в процентах. Ниже представлены составы, применяемые для получения тестовых пленок, с полимерными композициями и данными тестирования. Из результатов в ТАБЛИЦЕ 2 видно, что присутствие 5% PVP в составе с HA/PEG улучшало гибкость и эластичность пленки. Как видно из ТАБЛИЦЫ 3, присутствие 30% PVP и 30% HP-гуара также обеспечивало пленку с относительно высокой эластичностью и гибкостью. Наличие карбопола в тестируемых составах приводило к образованию хрупких пленок, как видно из данным в ТАБЛИЦЕ 4. Присутствие 200 ppm ментола приводило к более высокой скорости растворения и обеспечивало жесткие пленки, как видно из ТАБЛИЦЫ 5. Пленки с содержанием ментола <200 ppm (например, 150 ppm) были лучше со схожим модулем упругости и относительным удлинением в % по сравнению с такими же пленками без добавления ментола.
ТАБЛИЦА 2. КОМБИНАЦИИ HA/PVP И PEG
ТАБЛИЦА 3. КОМБИНАЦИИ HA/HP-ГУАР/PVP/PEG
HP-гуар (22,5%):
PVP (45%):
PEG (10%)
HP-гуар (30%):
PVP (30%):
PEG (10%)
HP-гуар (40%):
PVP (10%):
PEG (10%)
HP-гуар (42,5%): PVP (5%):
PEG (10%)
HP-гуар (45%): PVP (10%)
ТАБЛИЦА 4. КОМБИНАЦИЯ HA/HP-ГУАР/PAA/PEG
(не измеряли)
(не измеряли)
HP-гуар (22,5%):
PAA (45%):
PEG (10%)
HP-гуар (30%):
PAA (30%):
PEG (10%)
HP-гуар (40%):
PAA (10%):
PEG (10%)
HP-гуар (42,5%):
PAA (5%):
PEG (10%)
HP-гуар (45%):
PAA (10%)
ТАБЛИЦА 5. Комбинация HA/HP-ГУАР/PEG с 200 ppm ментола
HP-гуар (45,4%):
PEG (9,2%)
HP-гуар (45,4%):
PEG (9,2%):
Ментол (200 ppm)
HP-гуар (45,4%):
PEG (9,2%):
Ментол (100 ppm)
Изучение характеристик пленки из HA/HP-гуара/PEG
На основании данных, полученных для широкого спектра пленочных композиций, было определено, что предпочтительная полимерная композиция содержала 45,4% гиалуроновой кислоты (HA): 45,4% гидроксипропилгуара (HP-гуара): 9,2% полиэтиленгликоля (PEG 400) (ниже называемая составом 2). Данную пленку получали следующим образом.
ТАБЛИЦА 6. КОМБИНАЦИЯ HA/HP-ГУАР/PEG
В колбу Эрленмейера объемом 1 л выливали 750 мл дистиллированной воды с последующим добавлением гиалуроновой кислоты (5,107 грамма). Затем колбу помещали в ультразвуковой аппарат и присоединяли к размещаемой сверху механической мешалке. Обеспечивали перемешивание и обработку ультразвуком смеси в течение 30 минут (± 10 минут) на скорости, составляющей 700 об./мин., при температуре от 25°C до 35°C до получения однородного бесцветного раствора. Затем в колбу добавляли гидроксипропилгуар (5,107 грамма). Колбу помещали обратно в ультразвуковой аппарат и присоединяли к размещаемой сверху механической мешалке. Смесь перемешивали и подвергали обработке ультразвуком в течение 120 минут (± 10 минут) на скорости, составляющей 700 об./мин., при температуре от 38°C до 42°C до получения однородного бесцветного раствора. В колбу добавляли пластификатор полиэтиленгликоль-400 (1,035 грамма). Обеспечивали перемешивание и обработку ультразвуком смеси в течение 30 минут (± 10 минут) на скорости, составляющей 700 об./мин., при температуре от 40°C до 45°C до получения однородного бесцветного раствора. Смесь обрабатывали ультразвуком без перемешивания дополнительно в течение 30 минут (± 10 минут) при температуре от 40°C до 45°C до получения однородного бесцветного раствора (без пузырьков). Обеспечивали отстаивание колбы при комнатной температуре в течение 30 минут (± 10 минут). После надлежащего перемешивания раствор для литья (150 г ± 2 г) выливали в чистую чашку Петри (150 мм × 15 мм). Чашку Петри высушивали при комнатной температуре в течение 60 ч. (± 5 ч.) в испарительной камере, снабженной вытяжным вентилятором. После высушивания диск нарезали на части размером 9 см × 9 см и выдерживали в герметичном пакете в течение 24 ч. (± 3 ч.) при контролируемой влажности (<50%) и температуре (от 23°C до 26°C) для применения в последующих исследованиях характеристик.
ТАБЛИЦА 7. Результаты измерений среднего веса для состава 2
мг
ТАБЛИЦА 8. Результаты измерений влагопоглощения у состава 2
(среднее ± SD)
ТАБЛИЦА 9. Результаты измерений потери влаги у состава 2
(среднее ± SD)
ТАБЛИЦА 10. Результаты измерений сопротивления излому для состава 2
(среднее ± SD)
ТАБЛИЦА 11. Результаты измерений времени растворения и pH у состава 2
ТАБЛИЦА 12. Результаты измерений предела прочности, модуля упругости и относительного удлинения в процентах у состава 2
Пример 3
С помощью HRA-OCT было возможно прямое измерение толщины слезной пленки. Для получения размера толщины слезной пленки после введения вставки применяли визуализацию HRA-OCT, и она косвенно показывала эффект, возникающий в результате доставки смазывающего вещества (т. е. увеличение толщины слезной пленки указывало на доставку смазывающего вещества и/или лекарственного средства). Ожидали, что после введения вставка будет медленно растворяться и высвобождать смазывающее вещество и/или лекарственное средство. Ниже описан общий применяемый способ с применением новозеландских кроликов. В данной процедуре вставку с применением 45,4% гидроксипропилгуара (HP-гуара) и 9,2% полиэтиленгликоля (PEG 400) оценивали на кроликах с помощью HRA-OCT. В 1-й день одну вставку помещали в центральную часть нижнего свода правого глаза с помощью щипцов или другого подходящего устройства. Обработку повторяли на 3-й день, когда вставки применяли по отношению к левому глазу. Схема исследуемой обработки кратко описана в ТАБЛИЦЕ 13.
ТАБЛИЦА 13. Примерная схема исследования
Одна (1) вставка в 3-й день в левый глаз
Животных подвергали сканированию с помощью оптической когерентной томографии (OCT) в различные моменты времени до 3 часов, если в этом была необходимость. Способ визуализации посредством OCT и анализа изображений у кролика был следующим.
1. Для облегчения визуализации приглушали освещение в комнате для визуализации.
2. Слегка касались под глазом, с которого необходимо было получить изображение, аппликатором с ватным наконечником для вызова естественной реакции моргания.
3. Получали одно горизонтальное изображение с центром на вершине роговицы.
4. Снова слегка касались под глазом аппликатором с ватным наконечником для вызова естественной реакции моргания.
5. Получали одно вертикальное изображение с центром на вершине роговицы.
6. Документировали информацию о дозе и номерах изображений.
7. Определяли 3 точки на каждом изображении для анализа (по горизонтали: область носа, верхушка, височная область глаза; по вертикали: верхняя часть, верхушка, нижняя часть глаза).
8. Для определения толщины слезной пленки в каждой точке анализа применяли измерительный инструмент на Bioptogen и документировали результаты измерений.
Группы обработки и графики визуализации для тестовых животных представлены ниже в ТАБЛИЦАХ 14 и 15.
ТАБЛИЦА 14. Группы обработки
ТАБЛИЦА 15. График визуализации группы
Непосредственно после введения дозы
Через 15 и 30 минут после 1-й дозы
Непосредственно после введения дозы
Через 15, 30, 45, 60, 75 и 90 минут после введения дозы
Непосредственно после введения дозы
Через 15, 30, 45, 60, 75, 90, 105, 120, 135 и 150 минут после введения дозы
Непосредственно после введения дозы
Через 15, 30, 45, 60, 75, 90, 105, 180 и 360 минут после введения дозы
На ФИГ. 9 представлены данные о толщине слезной пленки по результатам тестирования. В данном тесте в качестве контроля применяли LACRISERT®. В данном эксперименте в условиях in vivo не было выявлено значительных проблем, связанных с безопасностью или переносимостью LACRISERT® и тестируемых изделий, содержащих HP-гуар/HA/PEG. В данном тесте в условиях in vivo тестируемые изделия подвергали воздействию двух разных режимов после введения дозы. В одном случае после введения добавляли BSS каждые 15 минут в попытке ускорить растворение вставки. Во втором случае дозу BSS вводили однократно после введения вставки. LACRISERT® просто вводили в соответствии с инструкциями для человеческого глаза. Из результатов измерения с помощью OCT было видно увеличение толщины слезной пленки для тестируемых изделий в обоих случаях. Добавление BSS ускоряло растворение вставки, о чем свидетельствовало быстрое увеличение толщины слезной пленки за около 5 минут до максимальной толщины слезной пленки, составляющей 50 микрон, через 15 минут. Для сравнения, случай с одной каплей после введения демонстрировал, что толщина слезной пленки увеличивалась в течение 90 минут с последующим уменьшением до исходного уровня за 2 часа. LACRISERT® в течение этого временного промежутка не оказывал заметного влияния на толщину слезной пленки, и спустя 3 часа он оставался в твердом состоянии. Тестируемые изделия вставки с HA/HPG/PEG в данном эксперименте полностью растворялись через 2 часа.
Пример 4. Вставки с фармацевтически активными средствами
Вставки по настоящему изобретению могут включать одно или более фармацевтически активных средств, как подробно описано выше. Ниже представлена вставочная пленка, приготовленная с антимускариновым средством атропином.
Получение глазной вставки с атропином
40% гиалуроновой кислоты (HA): 40% гидроксипропилгуара (HP): 10% полиэтиленгликоля (PEG 400): 10% поливинилпирролидона: 500 ppm атропина
ТАБЛИЦА 17. Состав вставки с атропином
Процедура
Для получения 350 г состава вставки требуются следующие количества: HA (2,1 г): HP-гуар (2,1 г): PEG-400 (0,525 г): PVP (0,525 г): атропин (0,175 г) в 350 мл дистиллированной воды. В колбе Эрленмейера объемом 1 л смешивали 350 мл дистиллированной воды с 2,1 г гиалуроновой кислоты и 0,525 г поливинилпирролидона. Колбу присоединяли к размещаемой сверху механической мешалке и смесь перемешивали со скоростью 600 об./мин. в течение 30 минут при 35°C. Затем добавляли 2,1 г гидроксипропилгуара. Затем смесь перемешивали в течение 120 минут при 38°C до получения однородного бесцветного раствора. Затем в колбу добавляли пластификатор полиэтиленгликоль-400 (0,525 г) и атропин (0,175 г) и смесь перемешивали еще в течение 30 минут при 700 об./мин. Обеспечивали охлаждение смеси в течение 30 минут. На данной стадии раствор был готов для отливки пленки.
Отливка пленки
Выливали 150 г ± 2 г раствора в чистую чашку Петри (150 мм × 15 мм). Чашку Петри высушивали в течение 30 ч. при комнатной температуре с применением сушильной камеры. Полученная пленка была бесцветной и не демонстрировала никакой кристаллизации или необычного внешнего вида.
Препарат глазных вставок с повидон-йодом
В другом примере со вставкой использовали биоцид широкого спектра действия - повидон-йод. Данная вставка имела следующий состав: 40% гиалуроновой кислоты (HA): 40% гидроксипропилгуара (HP): 10% полиэтиленгликоля (PEG 400): 10% поливинилпирролидона и 500 ppm PVP-I в общей массе.
Процедура
Процедура приготовления партии размером 350 г состава в колбе Эрленмейера объемом 1 л с концентрацией 0,015 г/мл. HA (2,1 г): HP-гуар (2,1 г): PEG-400 (0,525 г): PVP (0,525 г): PVP-I (0,175 г) в 350 мл дистиллированной воды. В колбу Эрленмейера объемом 1 л добавляли 350 мл дистиллированной воды, гиалуроновую кислоту (2,1 г) и поливинилпирролидон (0,525 г). Колбу помещали в ультразвуковую ванну и присоединяли к размещаемой сверху механической мешалке. Смесь перемешивали и одновременно подвергали обработке ультразвуком в течение 30 минут (± 10 минут) на скорости 600 об./мин. и при температуре от 25°C до 35°C до получения однородного бесцветного раствора. Затем добавляли гидроксипропилгуар (2,1 г). Содержимое колбы перемешивали в течение 120 минут (± 10 минут) на скорости 600 об./мин. и при температуре от 38°C до 41°C до получения однородного бесцветного раствора. Затем в колбу добавляли полиэтиленгликоль-400 (0,525 г) и PVP-I (0,175 г). Смесь перемешивали дополнительно в течение 45 минут. 150 г ± 2 г раствора выливали в чистую чашку Петри (150 мм × 15 мм). Чашку Петри высушивали при комнатной температуре в течение 30 ч. (±1 ч.) в вентилируемой камере. Количество PVP-I, составляющее 500 ppm, было рассчитано на основе общей массы, в том числе воды.
Пример 5
Размеры слезной пленки в случае полимерных глазных вставок в соответствии с вариантами осуществления настоящего изобретения также сравнивали с размерами слезной пленки в случае глазных капель SYSTANE® ULTRA, а также гелевых глазных капель GENTEAL® и инъекционного препарата PROVISC®.
На ФИГ. 2A - 2C изображены размеры слезной пленки в случае глазных капель в SYSTANE® ULTRA до введения дозы (ФИГ. 2A), сразу после введения дозы (ФИГ. 2B) и через 5 минут после введения дозы (ФИГ. 2C). На ФИГ. 2A - 2C отображено, что размер слезной пленки составляет 22 мкм до введения дозы, 60 мкм сразу после введения дозы и 19 мкм через 5 минут после введения дозы.
На ФИГ. 3A - 3C показаны размеры слезной пленки в случае гелевых глазных капель GENTEAL® до введения дозы (ФИГ. 3A), сразу после введения дозы (ФИГ. 3B) и через 5 минут после введения дозы (ФИГ. 3C). На ФИГ. 3A - 3C отображено, что размер слезной пленки составляет 20 мкм до введения дозы, 31 мкм сразу после введения дозы и 19 мкм через 5 минут после введения дозы.
На ФИГ. 4A - 4E показаны размеры слезной пленки в случае инъекционной формы в PROVISC® до введения дозы (ФИГ. 4A), сразу после введения дозы (ФИГ. 4B), через 5 минут после введения дозы (ФИГ. 4C), через 10 минут после введения дозы (ФИГ. 4D) и через 20 минут после введения дозы (ФИГ. 4E). На ФИГ. 4A - 4E отображено, что размер слезной пленки составлял 19 мкм до введения дозы, 194 мкм сразу после введения дозы, 114 мкм через 5 минут после введения дозы, 61 мкм через 10 минут после введения дозы и 16 мкм через 20 минут после введения дозы.
Каждое из измерений слезной пленки, представленных на ФИГ. 2A - 2C, 3A - 3C и 4A - 4E, отражало увеличение толщины слезной пленки сразу после введения дозы, но она возвращалась к толщине, аналогичной измеренной до введения дозы в пределах где-то 5-20 минут после введения дозы.
Для сравнения, на ФИГ. 5A - 5I отображены измерения слезной пленки, связанные с введением полимерной глазной вставки в соответствии с вариантами осуществления настоящего изобретения. Данные размеры отражали, что размер слезной пленки составлял 14 мкм до введения дозы (ФИГ. 5A), 20 мкм через 15 минут после введения дозы (ФИГ. 5B), 81 мкм через 30 минут после введения дозы (ФИГ. 5C), 45 мкм через 45 минут после введения дозы (ФИГ. 5D), 43 мкм через 1 час после введения дозы (ФИГ. 5E), 37 мкм через 1 час и 15 минут после введения дозы (ФИГ. 5F), 33 мкм через 1 час и 30 минут после введения дозы (ФИГ. 5G), 22 мкм через 1 час и 45 минут после введения дозы (ФИГ. 5H) и 18 мкм через 2 часа после введения дозы (ФИГ. 5I). Соответственно, в данном варианте осуществления настоящего изобретения толщина слезной пленки не возвращалась к своей толщине до введения дозы в течение примерно 2 часов после введения дозы.
Проводили дополнительные измерения слезной пленки на новозеландских белых кроликах. Каждый кролик получал одну полимерную глазную вставку. За один момент времени получали 3 горизонтальных и 3 вертикальных изображения. Для определения глубины слезной пленки/тестируемого изделия измеряли три точки на каждой линии и увеличивали до 800%.
На ФИГ. 6A отображены средние измерения слезной пленки с применением полимерных глазных вставок в соответствии с вариантами осуществления настоящего изобретения. Тесты проводили на трех кроликах, и каждый кролик перед захватом изображения моргнул три раза. Диаметр вставки (6 мм) оставался неизменным при тестировании каждого кролика, а вес вставки варьировал от 2,6 мг до 2,9 мг. На ФИГ. 6B отображены размеры слезной пленки по отдельному животному. На ФИГ. 6C отображены размеры слезной пленки по местоположению в глазу, в том числе размеры в нижней части глаза, в верхней части глаза, в височной области и в области носа.
В ходе дополнительного тестирования на новозеландских белых кроликах измеряли динамическое изменение толщины слезной пленки, связанное с полимерными глазными вставками в соответствии с вариантами осуществления настоящего изобретения (ФИГ. 7A). Диаметр вставки оставался на уровне 6 мм. Вес вставки для левого глаза (OS) находился в диапазоне от 3,2 до 3,8 мг, а вес вставки для правого глаза находился в диапазоне от 2,2 до 2,6 мм. На ФИГ. 7B отображены измерения слезной пленки по местоположению (верхушка, область носа, височная область, верхняя часть и нижняя часть).
В ходе данного теста также производили аналогичные измерения в отношении геля GENTEAL® с дозировкой 80 мкл или примерно 76,3 мг в центральной части нижнего свода глаза. На ФИГ. 8 отображены средние размеры слезной пленки в случае геля GENTEAL® для правого и левого глаза.
После проведения измерений как в случае полимерной глазной вставки в соответствии с вариантами осуществления настоящего изобретения, так и в случае геля GENTEAL® производили анализ результатов. В представленной ниже ТАБЛИЦЕ 18 отображено количество животных со средним значением 6 результатов считывания, превышающих или равных 30 мкм.
ТАБЛИЦА 18
Данное тестирование подтверждало, что изменение толщины слезной пленки можно эффективно отслеживать с помощью Spectralis HRA+OCT. У большинства животных вставки начинали растворяться через 15 минут после введения дозы. У большинства животных, которым вводили полимерную глазную вставку в соответствии с вариантами осуществления настоящего изобретения, наблюдали значительное увеличение толщины слезной пленки на по меньшей мере 30 минут после введения дозы. Следует понимать, что местоположение полимерной глазной вставки, как при первоначальном размещении, так и при перемещении после моргания, могло создавать отклонения в данных, особенно в ранние моменты времени; однако ИК-изображение и OCT могли помочь различать влияние местоположения вставки. Также следует понимать, что на продолжительность удерживания мог влиять вес вставки. Дополнительно следует понимать, что на результаты могли влиять природные различия среди животных. Например, одно животное характеризовалось самой большой продолжительностью увеличения толщины слезной пленки независимо от размера вставки; однако более крупная вставка удерживалась примерно на 45 минут дольше. Также было замечено, что водные растворы вызывали небольшие изменения толщины слезной пленки.
Как отображено в описанных выше результатах исследований, полимерная глазная вставка в соответствии с одним вариантом осуществления настоящего изобретения может принимать форму растворяющейся пленки, состоящей из гидрофильных полимеров с высокими мукоадгезивными свойствами и свойствами формирования водородных связей. Пленка может содержать один или более природных полисахаридов или синтетических полимеров, которые были биосовместимыми и надлежащим образом переносились глазом. Растворимая пленка может иметь тонкопленочную структуру, которая может обеспечивать легкое и удобное введение в свод глаза, поскольку пленка должна была быть достаточно небольшой, чтобы помещаться в своде, вызывая минимальное раздражение или вообще не вызывая раздражение при введении, но достаточно большой, чтобы растворение происходило в течение более длительного периода времени. Такая растворимая пленка может быстро увлажняться с образованием растворимого геля и высвобождать смазывающее вещество и/или фармацевтически активное средство в течение короткого временного промежутка (например, в первые 5-10 минут после введения). Такой медленный импульсный поток смазывающего вещества может максимизировать адгезию и время пребывания смазывающего вещества на поверхности глаза по сравнению с применением местных капель. Время удержания смазывающего вещества на глазу можно было увеличить за счет медленной доставки в слезную пленку и поверхность глаза.
Введение растворимой пленки в соответствии с вариантами осуществления настоящего изобретения не приводит к нарушению зрения через несколько минут. Следует понимать, что растворимая пленка могла удерживать смазывающее вещество в течение примерно двух часов или более; тем не менее, могут быть варианты осуществления настоящего изобретения, в которых удерживание может происходить в течение примерно 30-60 минут. Следовательно, растворимая пленочная или полимерная глазная вставка в соответствии с вариантами осуществления настоящего изобретения может обеспечивать ряд преимуществ, в том числе без ограничения быстрое растворение для уменьшения затуманивания зрения, тонкопленочную структуру для улучшения кинетики смачивания и переносимости глазом, повышение комфорта при введении и снижение инородного ощущения. Кроме того, переносимость и доставка смазывающего вещества могут быть улучшены по сравнению с другими системами местной доставки или вставками.
Несмотря на то, что варианты осуществления настоящего изобретения были описаны для применения в качестве различных смазывающих веществ и/или фармацевтически активных средств для лечения синдрома сухости глаз, следует принимать во внимание, что полимерные глазные вставки в соответствии с вариантами осуществления настоящего изобретения также могут обладать преимуществами для офтальмологической доставки фармацевтически активных средств для лечения других глазных нарушений. Неполный перечень таких нарушений включает глазную гипертонию, глаукому, глаукоматозную ретинопатию, невропатию зрительного нерва, дегенерацию желтого пятна, диабетическую ретинопатию, хориоидальную неоваскуляризацию, пролиферативную витреоретинопатию, глазные раны и инфекции, а также миопию.
Хотя некоторые варианты осуществления были описаны в форме пленок, следует понимать, что полимерная глазная вставка в соответствии с вариантами осуществления настоящего изобретения может принимать ряд форм, в том числе без ограничения пленок, стержней и сфер. В одном варианте осуществления настоящего изобретения может быть использована круглая пленка диаметром примерно 0,5-10 мм. В других вариантах осуществления особенно предпочтительными являются круглые пленки диаметром 4-7 мм. В определенных вариантах осуществления могут применяться различные другие формы пленки, такие как представленные на ФИГ. 10A - 10C.
Независимо от того, какую форму принимает вставка, полимерная глазная вставка в соответствии с вариантами осуществления настоящего изобретения должна быть достаточно малой, чтобы помещаться в свод глаза, и быстро смачиваться, чтобы при введении вызывать незначительное раздражение или вовсе не вызывать никакого раздражения. Вставка также должна быть достаточно большой, чтобы обеспечивать растворение в течение где-то от примерно 30 до 120 минут, обеспечивая высвобождение смазывающего(смазывающих) вещества(веществ) и/или фармацевтически активных средств. Вставка также должна иметь толщину, которая является относительно комфортной для пользователя. Предпочтительная толщина составляет 50-250 микрон, и наиболее предпочтительная толщина составляет 70-150 микрон. Целевая толщина составляет 90 мкм в случае пленок, растворяющихся менее чем за 2 часа.
Пример 6
Исследование переносимости на обезьянах
Для данного исследования был выбран самец яванского макака китайского происхождения (не получавший белков) на основании фармакологического и анатомического соответствия глаза обезьяны и после оценки переносимости на кроликах. Глаз обезьяны моргает с такой же частотой, что и человеческий. Клинические наблюдения за переносимостью глазного тестируемого изделия производили через 15, 30, 45, 60, 120, 180 и 240 минут после введения дозы. Особое внимание уделяли удержанию слезной пленки и переносимости. Макроскопические исследования включали слезотечение, покраснение, отек и моргание. Через 24 часа после введения дозы животным в группах 1 и 2 вводили слабое седативное средство и обработанный глаз тщательно исследовали на наличие слезной пленки. Если обнаруживали какую-либо слезную пленку, это отмечали в клинических наблюдениях, а оставшуюся пленку удаляли. Дополнительные клинические наблюдения отмечали при необходимости, если отклонения от нормы продолжались после конечного момента времени наблюдения. Если имели место какие-либо неожиданные клинические признаки, немедленно ставили в известность ветеринара. Животных удерживали вручную, химическими способами (кетамин или альтернатива, например, телазол, при необходимости, в соответствии с ветеринарными руководствами) или механически (в кресле). Введение дозы осуществляли под слабым седативным действием. Наблюдения производили на животных, находящихся под слабым седативным действием, или на бодрствующих животных. Тестируемые изделия вводили животным, находящимся под слабым седативным действием (кетамин, 5-15 мг/кг, внутримышечно, или альтернатива [например, телазол 5-10 мг/кг, внутримышечно]). За момент времени введения дозы принимали завершение введения дозы в один глаз. После наступления слабого седативного действия одно тестируемое изделие-вставку помещали в центральную часть нижнего свода левого глаза животных с помощью щипцов или другого подходящего устройства.
Диски глазных вставок состояли из 40% HP-гуара/40% HA/10% PVP/10% PEG и были обозначены как TA1 и TA2. TA1 имел диаметр 6 мм и толщину 86 микрон (стандартное отклонение составляло 8,4 микрона). TA2 имел диаметр 6 мм и толщину 108 микрон (стандартное отклонение составляло 8,3 микрона). В качестве контроля применяли SYSTANE ULTRA®.
Результаты наблюдений и выводы
После введения дозы в T=0 более тонкие вставки TA1 тяжелее размещались и имели склонность сгибаться при контакте с влагой на ткани, но после того, как они размещались, они без особых проблем лежали в ровном состоянии. Более толстые пленки TA2 не сгибались, и их было легко вводить, и они сразу же лежали в ровном состоянии на ткани. В обеих группах, TA1 и TA2, после введения имело место слезотечение от слабого до умеренного (у животных, которые получали капли, слезотечение отсутствовало). На протяжении трех часов не было признаков раздражения, покраснения, трения глаз и других случаев прищуривания. Через 24 часа ни у одного животного не было остаточного материала вставки, и все обработанные глаза выглядели приемлемо по сравнению с глазами, обработанными местными каплями SYSTANE ULTRA®, без покраснения, отека или каких-либо других признаков раздражения.
Пример 7. Исследование смазывающей полимерной глазной вставки на людях
Для оценки биосовместимости, безопасности и переносимости полимерной глазной вставки проводили исследование варианта осуществления настоящего изобретения в рандомизированной перекрестной схеме на людях. В ходе одного исследовательского дня в отношении каждого участника применяли три обработки: 2 полимерные глазные вставки и один тип смазывающих глазных капель. Обработки применяли только по отношению к одному глазу, а другой необработанный глаз выступал в качестве контрольного глаза.
Схема исследования
В исследовании принимали участие десять участников (5 женщин, 5 мужчин). Средний возраст участников составлял 35,5 года (медианный 33 года в диапазоне от 23 до 61 года).
Выходные измерения для исследования были следующими.
Первичный выходной параметр: субъективная оценка комфорта для глаза.
Вторичный выходной параметр: субъективная оценка затуманивания зрения, скорости растворения полимерной глазной вставки, оценка исследователем легкости в эксплуатации и времени до неинвазивного разрыва слезной пленки (NITBUT).
Исследование проводили следующим образом. Исследовательский день длился примерно 9 часов и включал скрининг и проверку на пригодность для участия в исследовании, введение первого средства обработки (полимерной глазной вставки или смазывающих глазных капель) в 1 глаз, оценки и промывание глаза примерно через 2 часа после введения. После ожидания в течение минимум 1 часа применяли вторую обработку в отношении другого глаза (глаза, который ранее не был использован) и повторяли процедуры. Перед внесением последнего средства обработки выдерживали паузу, составляющую минимум 1 час, и повторяли процедуры. В случае каждой обработки производили оценки комфорта для глаза и качества зрения: до введения, через 5, 15, 30, 60, 90 и 105 минут после введения для оценки переносимости средства обработки. Оценки слезной пленки производили через 5, 60, 90 и 105 минут после введения. Измерения безопасности для глаз производили на этапе скрининга и после каждой обработки. В конце исследовательского дня участников просили указать, какому средству обработки они отдали предпочтение.
Материалы исследования
Были две различные полимерные глазные вставки являются следующими.
ТАБЛИЦА 19
(толстая вставка)
(тонкая вставка)
Гиалуроновая кислота (HA), 40%
Поливинилпирролидон/
полиэтиленгликоль
(PVP/PEG), 10%
Гиалуроновая кислота (HA), 40%
Поливинилпирролидон/
полиэтиленгликоль
(PVP/PEG), 10%
В качестве контрольного средства обработки применяли глазные смазывающие капли (Systane). Глазные смазывающие капли содержали следующие компоненты.
Полиэтиленгликоль (PEG) 400, 0,4%,
Пропиленгликоль, 0,3%
0,001% вес/об.
Данное исследование заняло один исследовательский день. В течение исследовательского дня участников просили совершить пять запланированных визитов.
Визит 1: скрининг и проверка на пригодность для участия в исследовании (0,75 часа)
Визит 2: ведение, оценки и удаление средства 1 обработки (2,0 часа)
Визит 3: ведение, оценки и удаление средства 2 обработки (2,0 часа)
Визит 4: ведение, оценки и удаление средства 3 обработки (2,0 часа)
Визит 5: окончание исследования (0,25 часа).
Между визитами 2 и 3 и между 3 и 4 применяли одночасовой период вымывания.
Процедуры на каждом визите кратко изложены в таблице 20.
ТАБЛИЦА 20. Исследовательские визиты и процедуры
(0,75 часа)
(2 ч./обработка)
(0,25 часа)
Результаты исследования
Первичный выходной параметр - оценка комфорта
В каждый момент времени (до введения, через 5, 15, 30, 60, 90 и 105 минут после введения) участникам задавали следующий вопрос: "Как бы вы оценили комфорт для своих глаз?".
Участники отвечали, используя шкалу от 0 до 100, где 0 означало "очень низкий комфорт", а 100 означало "отличный комфорт". Результаты представлены на ФИГ. 11.
Как можно видеть на ФИГ. 11, имело место статистически значимое различие между вставками и каплями в 5- и 15-минутные моменты времени, при этом капли имели статистически значимые более высокие оценки комфорта. Две вставки характеризовались схожими результатами с точки зрения оценок комфорта, однако в 60-минутный момент времени имело место статистически значимое различие, при этом комфорт от толстой вставки был оценен выше (90 по сравнению с 95, p=0,04).
Вторичный выходной параметр
Результаты для вторичных выходных параметров были следующими.
Затуманивание зрения - в каждый момент времени (до введения, через 5, 15, 30, 60, 90 и 105 минут после введения) участникам задавали следующий вопрос: "Как бы вы оценили затуманивание зрения для своих глаз?". Участники отвечали по шкале от 0 до 100, где 0 означало "Чрезвычайно затуманено. Невозможно ничего правильно увидеть", а 100 означало "Нет совсем никакого затуманивания". Результаты представлены на ФИГ. 12.
Как можно видеть на ФИГ. 12, по сравнению с каплями обе вставки приводили к статистически значимо более низким оценкам затуманивания зрения в 5, 15 и 30-минутные моменты времени (p<0,01 или p=0,01). Кроме того, толстая вставка вызвала статистически значимое снижение оценок затуманивания зрения в 60-минутный момент времени (93 по сравнению с 100, p=0,01), однако через 60 минут между толстой и тонкой вставкой не было никакого статистически значимого различия (88 по сравнению с 93, p=0,28).
Легкость введения клиницистами - исследователи давали оценку легкости введения полимерных глазных вставок во время введения. Легкость введения оценивали по шкале от 0 до 4 с шагом 0,5, где 0 означало "очень легко", а 4 означало "очень сложно".
Результаты были следующими: тонкая вставка - 1,3 ± 0,5, толстая вставка - 1,6 ± 0,5. Из результатов было видно, что в простоте введения двух вставок не было никакого статистически значимого различия. Кроме того, вставки было относительно легко размещать в глазу даже при минимальной тренировке.
Скорость растворения полимерной глазной вставки - степень растворения полимерных глазных вставок оценивали в каждый момент времени. Исследователи оценивали степень растворения полимерных глазных вставок в каждый момент времени (в момент введения, через 45, 60, 75, 90 и 105 минут после введения). Оценку степени растворения производили по шкале от 0 до 6, где 0 означало "растворение отсутствует", а 6 означало "полностью растворилось".
Результаты представлены на ФИГ. 13, где видно, что ~90% твердого смазочного материала растворялось в промежутке от 60 до 90 мин. Кроме того, из этих данных видно, что в степени растворения двух вставок не было статистически значимых различий.
NITBUT - оценку времени до неинвазивного разрыва слезной пленки (NITBUT) производили в момент введения и через 60 минут, 90 минут и 105 минут после введения. Результаты представлены на ФИГ. 14.
На ФИГ. 14 проиллюстрировано, что в случае обеих вставок в момент введения имели место статистически значимые различия между глазами с обработкой и контрольными глазами, при этом NITBUT глаза с обработкой было больше, чем у контрольного глаза (толстая вставка: 18,52 по сравнению с 8,12, p=0,01; тонка вставка: 17,26 по сравнению с 7,93, p<0,01). Также имели место статистически значимые различия с толстой вставкой между глазами с обработкой и контрольными глазами в моменты времени 60 и 90 минут (60 минут: 14,47 по сравнению с 5,89, p=0,02; 90 минут: 10,36 по сравнению с 5,77, p=0,02).
Мениск слезной жидкости - исследователи давали оценку для высоты мениска слезной пленки во время обработки в определенные моменты времени и через 60 минут, 90 минут и 105 минут после введения. Результаты представлены на ФИГ. 15.
Прочие параметры
Раздражение глаза - в каждый момент времени (до введения, через 5, 15, 30, 60, 90 и 105 минут после введения) участников спрашивали: "Как бы вы оценили ощущение раздражения для своих глаз?" Участники давали ответ, используя шкалу от 0 до 100, где 0 означало "сильное ощущение раздражения глаза", а 100 означало "полное отсутствие ощущения раздражения глаза".
Результаты показаны на ФИГ. 16. Как можно видеть ФИГ. 16, в случае обеих вставок в момент времени 5 минут имели место статистически значимые различия между глазами с обработкой и контрольными глазами, при этом оценка раздражения глаза с обработкой была статистически значимо ниже (толстая вставка: 71 по сравнению с 100, p=0,01; тонкая вставка: 67 по сравнению с 99, p=0,02). Статистически значимых различий в оценке раздражения глаз между двумя вставками не было.
Сухость глаза - в каждый момент времени (до введения, через 5, 15, 30, 60, 90 и 105 минут после введения) участников спрашивали: "Как бы вы оценили сухость своих глаз?" Участники отвечали, используя шкалу от 0 до 100, где 0 означало "очень сухой", а 100 означало "полное отсутствие сухости". Результаты показаны на ФИГ. 17. В случае всех средств обработки не было никаких статистически значимых различий между глазами с обработкой и контрольными глазами с точки зрения сухости. Также не было различий между вставками.
Жжение/резь - в каждый момент времени (до введения, через 5, 15, 30, 60, 90 и 105 минут после введения) участников спрашивали: "Как бы вы оценили чувство жжения/рези своих глаз?" Участники давали ответ, используя шкалу от 0 до 100, где 0 означало "сильное ощущение жжения/рези", а 100 означало "полное отсутствие жжения/рези". Результаты представлены на ФИГ. 18. В случае всех средств обработки не было никаких статистически значимых различий между глазами с обработкой и контрольными глазами с точки зрения чувства жжения/рези. Также не было различий между вставками.
Зуд - в каждый момент времени (до введения, через 5, 15, 30, 60, 90 и 105 минут после введения) участников спрашивали: "Как бы вы оценили ощущение зуда для своих глаз?" Участники отвечали, используя шкалу от 0 до 100, где 0 означало "интенсивный зуд", а 100 означало "полное отсутствие зуда". Результаты представлены на ФИГ. 19. Как видно из результатов, в случае всех средств обработки не было никаких статистически значимых различий между глазами с обработкой и контрольными глазами с точки зрения зуда. Также не было различий между вставками.
Высококонтрастная острота зрения при сильном освещении - исследователи давали оценку высококонтрастной остроте зрения при сильном освещении во время скрининга и во время визитов для обработки на момент введения и через 60 и 105 минут после введения. Имели место статистически значимые различия между глазами с обработкой и контрольными глазами в момент введения и в 60-минутные моменты времени, при этом участники характеризовались значимым снижением остроты зрения. (Момент введения: толстая вставка: 0,05 по сравнению с −0,11, p<0,01; тонкая вставка: 0,07 по сравнению с −0,10, p=0,01) (60 минут: толстая вставка: −0,06 по сравнению с −0,1, p=0,03; −0,07 по сравнению с −0,10, p=0,02). Различие в остроте зрения через 60 минут соответствовало примерно 2 буквам, что нельзя было считать клинически релевантным. К концу визита для обработки острота зрения возвращалась к норме. Статистически значимых различий в остроте зрения между вставками не было.
Состояние здоровья глаз - бульбарную и лимбальную гиперемию (покраснение) и неоваскуляризацию оценивали по шкале от 0 до 4 с шагами в 0,1 (шкала Эфрона), при этом 0 означало норму, а 4 означало тяжелое. Для всех показателей состояния здоровья глаз не было клинически релевантных различий.
Заключение о результатах
Был достигнут первичный клинический результат субъективного комфорта и переносимости. Вставки были терпимыми для участников, и на состояние здоровья глаз у всех пациентов во время и после ношения не оказывалось отрицательного воздействия.
Статистически значимых различий между SYSTANE ULTRA и вставками в отношении жжения, рези, зуда или сухости у участников не было.
Вставки не оказывали отрицательного воздействия на состояние здоровья глаз.
Данные исследования в условиях in vivo на кроликах и клинического комфорта свидетельствовали, что устройство могло бы стать ценной платформой для доставки глазных смазывающих веществ и других местных лекарственных средств для глаз.
Несмотря на то, что были подробно описаны настоящее изобретение и его преимущества, следует понимать, что в нем могут быть сделаны различные изменения, замены и модификации без отступления от сути и объема настоящего изобретения, которые определяются прилагаемой формулой изобретения. Более того, не подразумевается, что объем настоящей заявки ограничен отдельными вариантами осуществления способа, устройства, изготовления, композиции веществ, средств, способов и стадий, представленных в описании. Специалист средней квалификации в данной области техники легко поймет из настоящего изобретения, что в соответствии с настоящим изобретением можно использовать способы, устройства, изготовление, композиции веществ, средства, способы или стадии, которые существуют в настоящее время или будут разработаны позднее, которые выполняют практически ту же функцию или позволяют достичь практически тот же результат, что и описанные в данном документе соответствующие варианты осуществления. Следовательно, подразумевается, что прилагаемая формула изобретения включает в своем объеме такие способы, устройства, изготовление, композиции веществ, средства, способы или стадии. Все публикации и патентные заявки, а также патенты, упомянутые в данном описании, включены в данный документ во всей своей полноте посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАСТВОРИМЫЕ ПОЛИМЕРНЫЕ ОФТАЛЬМОЛОГИЧЕСКИЕ ВКЛАДКИ С БИОРАЗЛАГАЕМЫМ ПОЛИМЕРОМ | 2020 |
|
RU2802441C1 |
| ОФТАЛЬМОЛОГИЧЕСКАЯ ЭМУЛЬСИЯ НА ОСНОВЕ ЛИПИДОВ | 2019 |
|
RU2793333C2 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ КОМПОЗИЦИИ С ЭТИЛЕНОКСИД-БУТИЛЕНОКСИДНЫМИ БЛОК-СОПОЛИМЕРАМИ | 2010 |
|
RU2548789C2 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ КОМПОЗИЦИИ С УЛУЧШЕННОЙ ЗАЩИТОЙ ОТ ОБЕЗВОЖИВАНИЯ И УДЕРЖИВАНИЕМ | 2013 |
|
RU2659207C2 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ КОМПОЗИЦИИ | 2020 |
|
RU2798842C1 |
| ВОДНЫЙ ОФТАЛЬМОЛОГИЧЕСКИЙ РАСТВОР И СПОСОБ ЛЕЧЕНИЯ СИНДРОМА СУХИХ ГЛАЗ | 2015 |
|
RU2688935C2 |
| ОФТАЛЬМОЛОГИЧЕСКАЯ КОМПОЗИЦИЯ С ВЫСОКОЙ КОНЦЕНТРАЦИЕЙ ОЛОПАТАДИНА | 2012 |
|
RU2613715C2 |
| ГЛАЗНЫЕ КОМПОЗИЦИИ НА ОСНОВЕ ПОЛИСАХАРИДА СЕМЯН ТАМАРИНДА И ГИАЛУРОНОВОЙ КИСЛОТЫ | 2008 |
|
RU2493855C2 |
| ОФТАЛЬМОЛОГИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2734344C2 |
| ГЛАЗНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ МУКОАДГЕЗИВНЫЕ ПОЛИСАХАРИДЫ, СПОСОБНЫЕ СТИМУЛИРОВАТЬ ВОССТАНОВЛЕНИЕ ЭПИТЕЛИЯ РОГОВИЦЫ | 2013 |
|
RU2663449C2 |

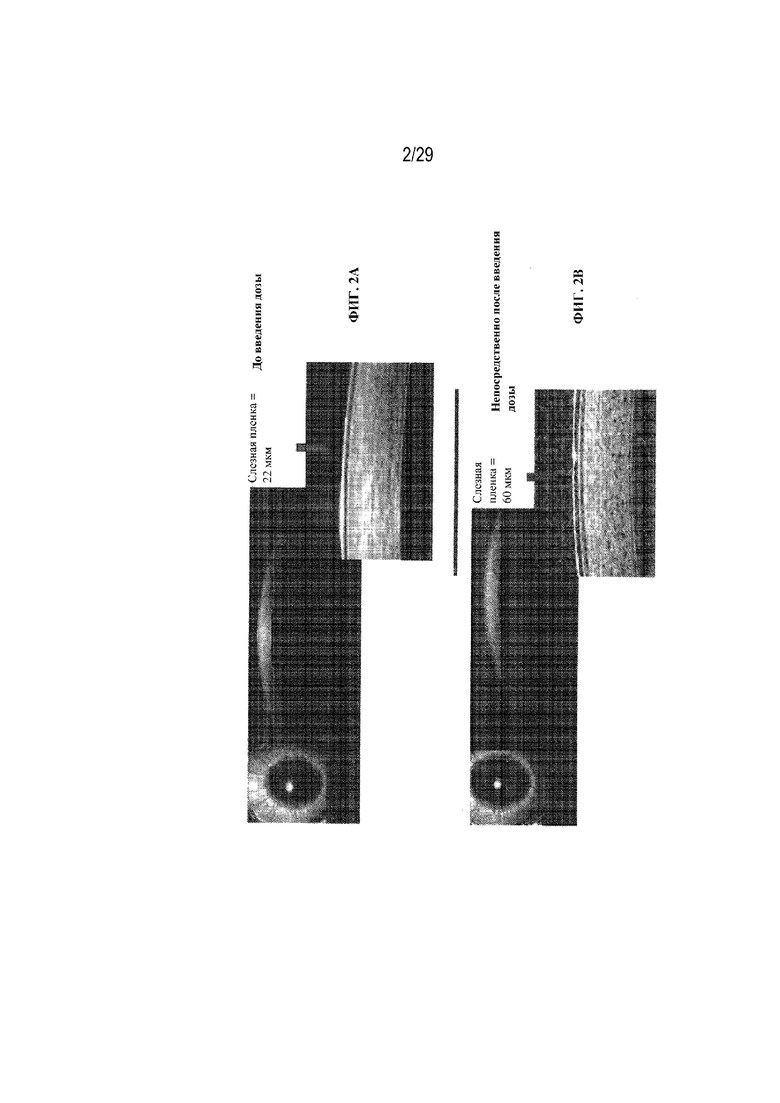

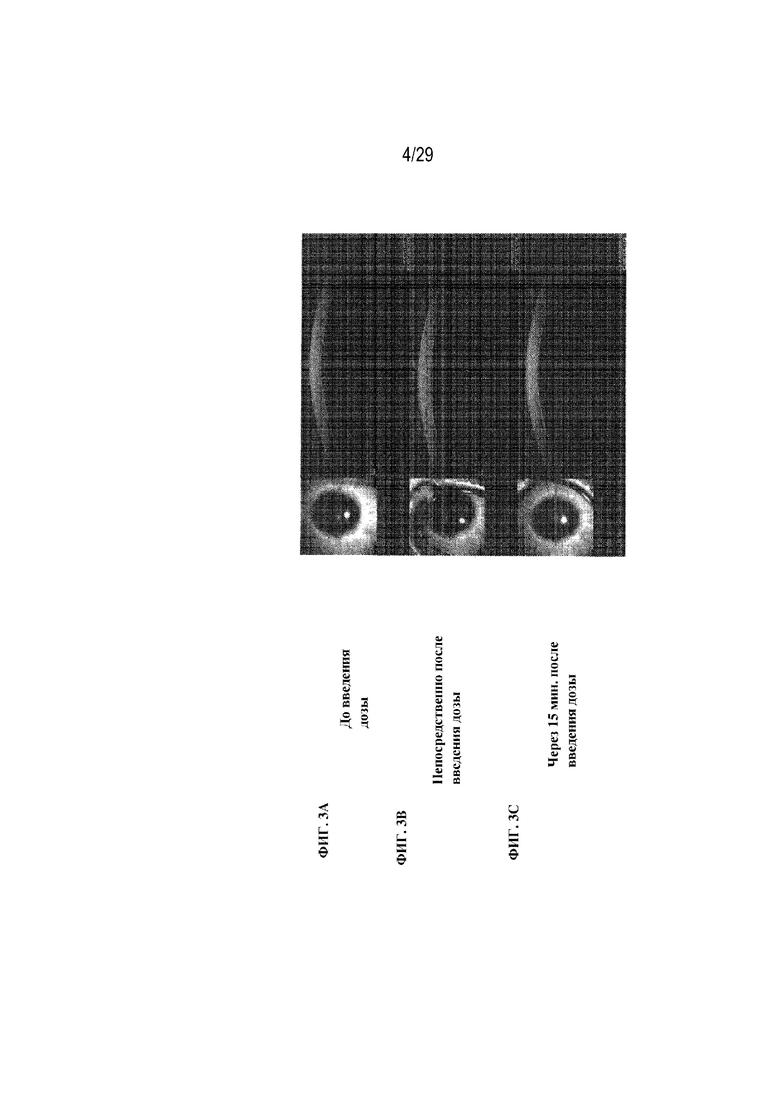
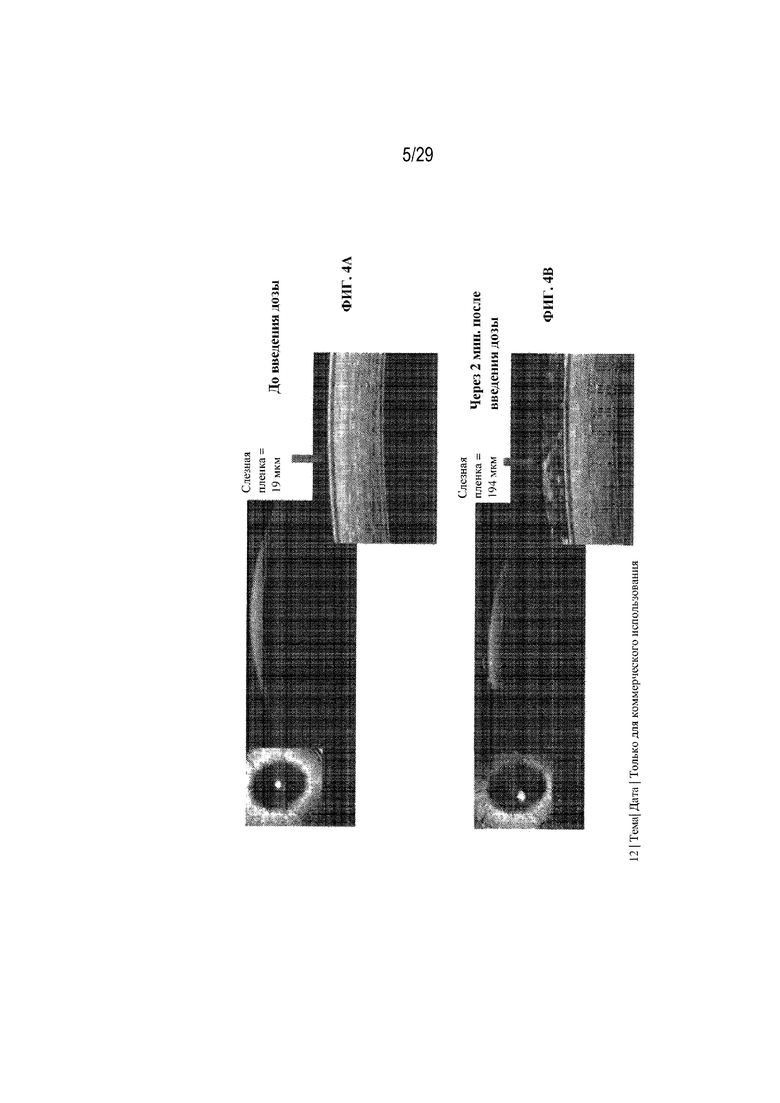
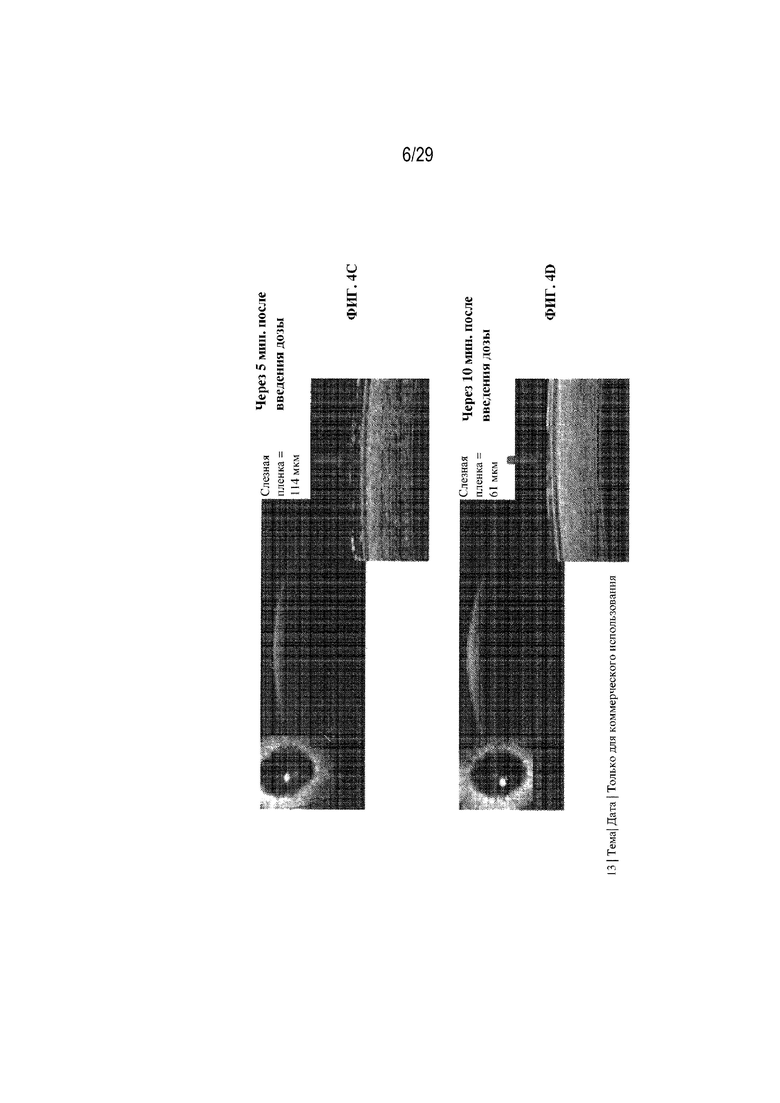



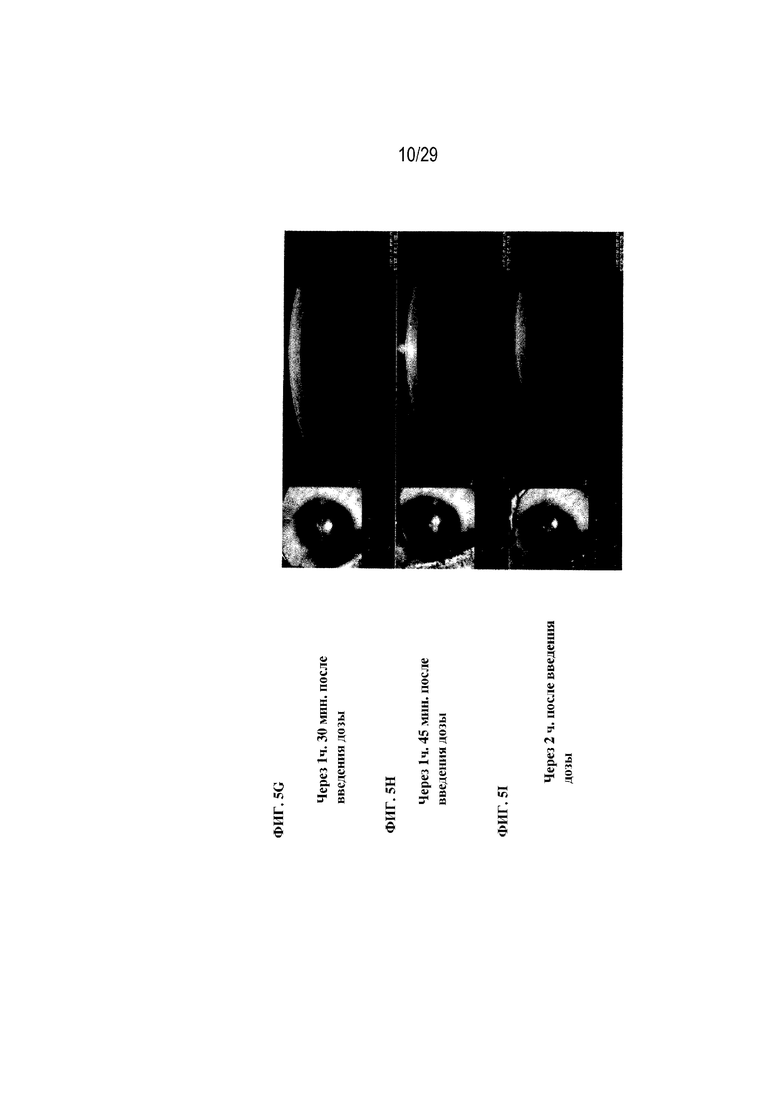
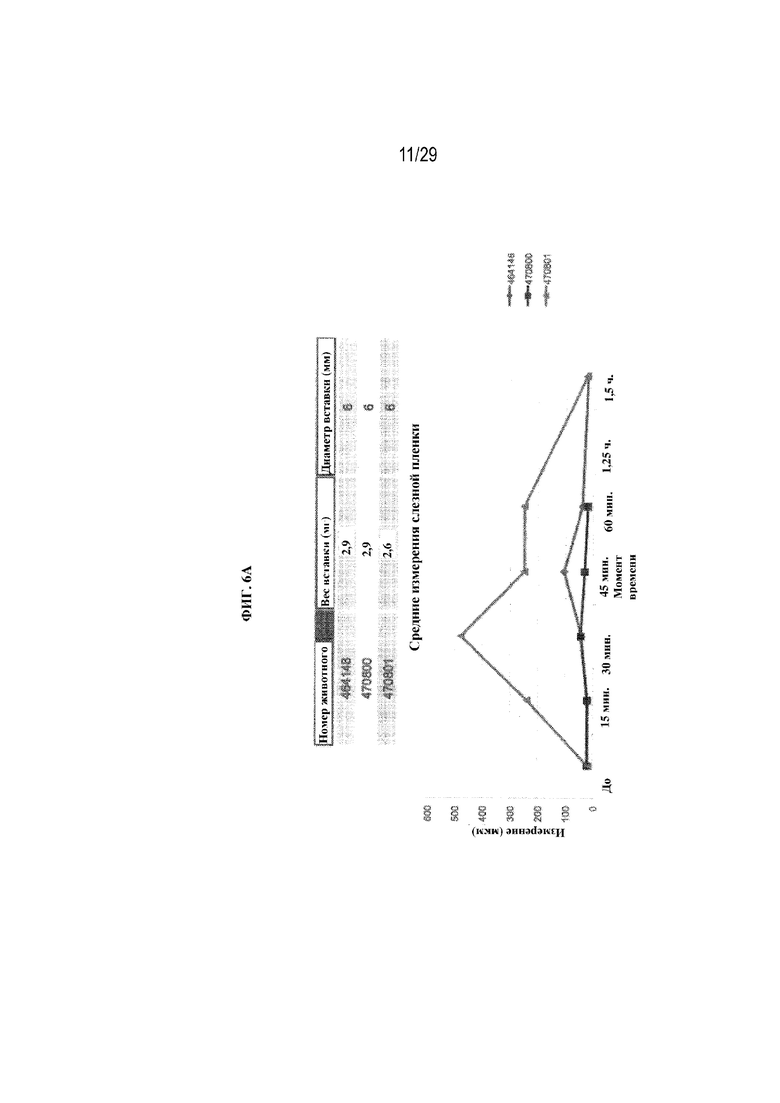
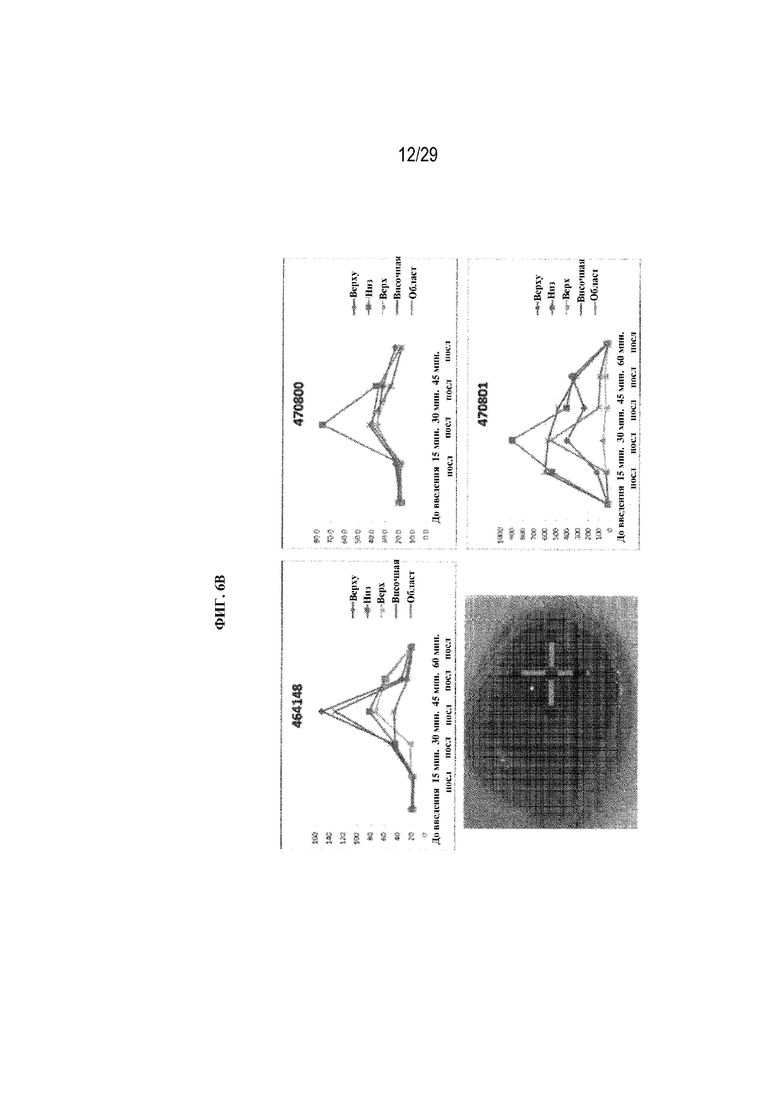
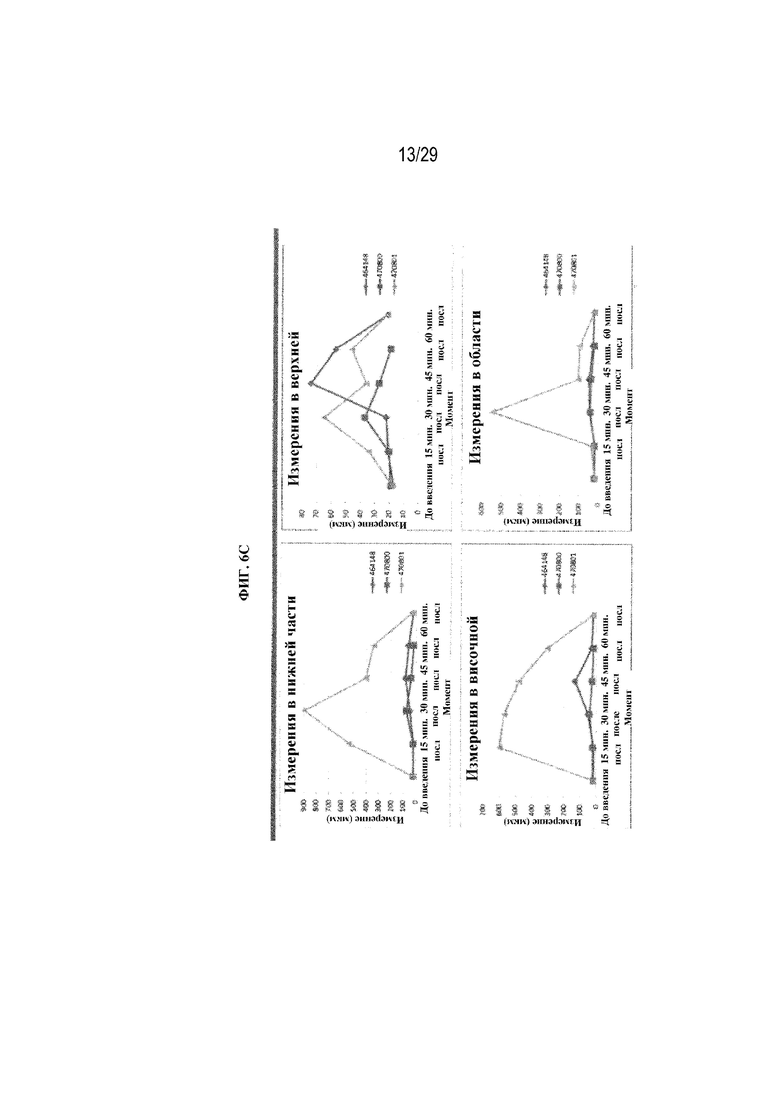
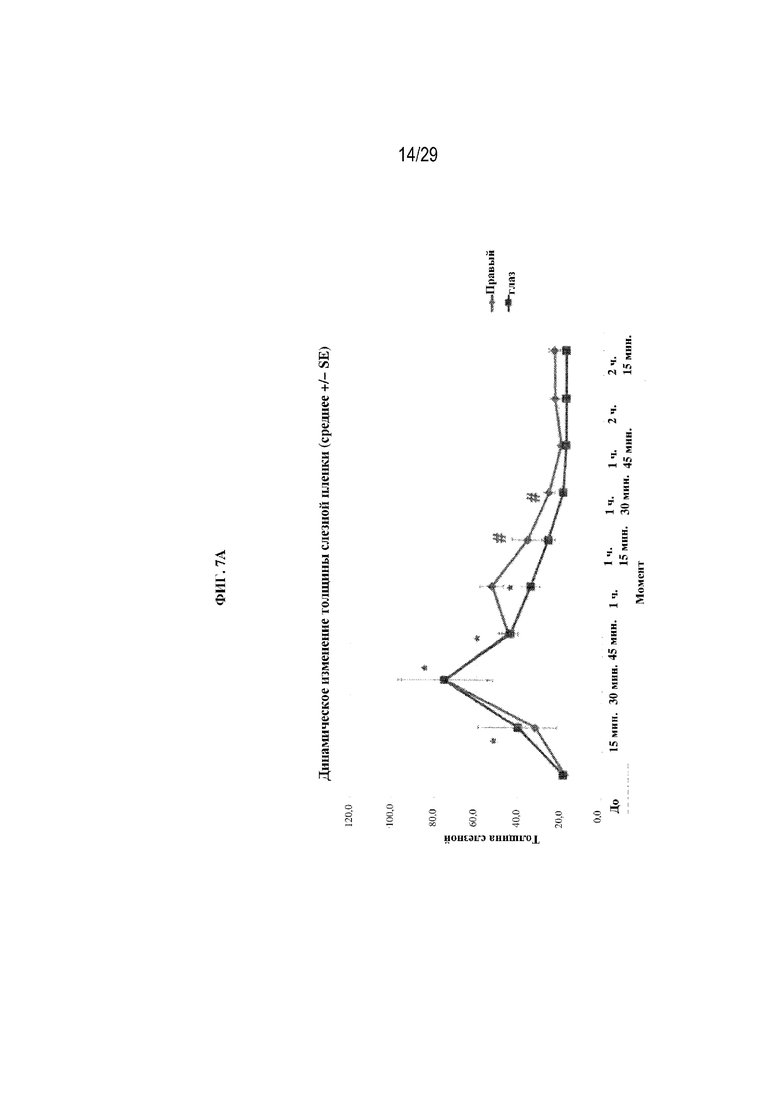
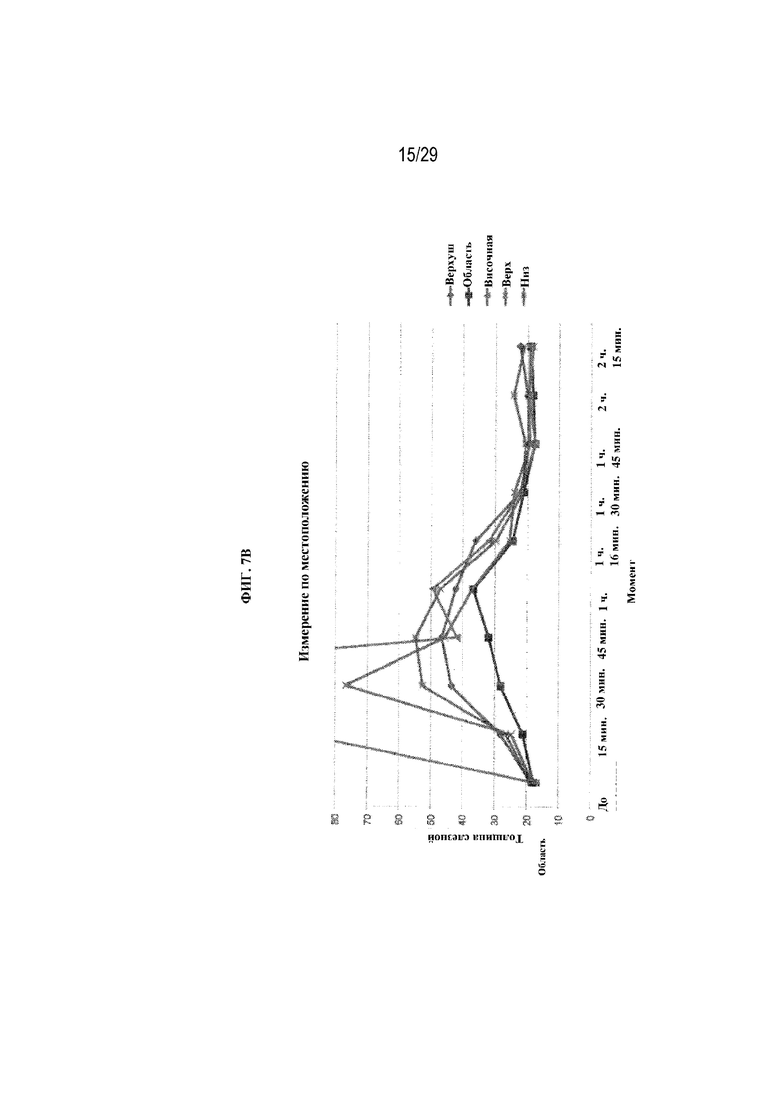
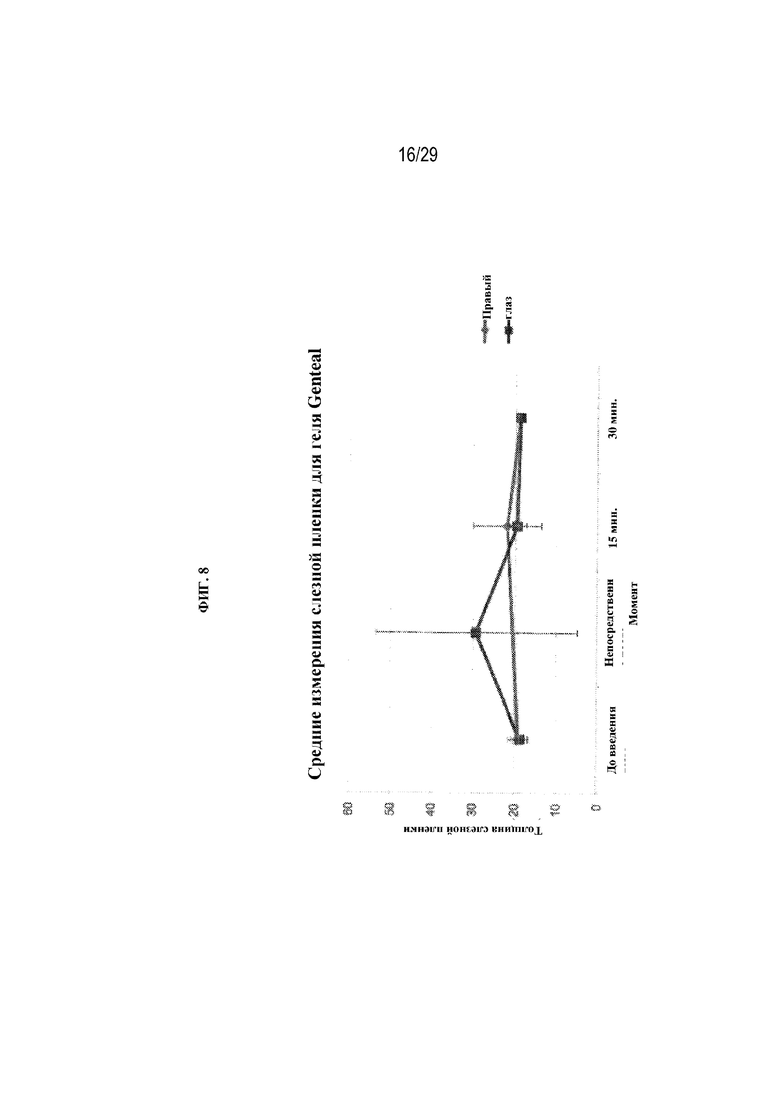

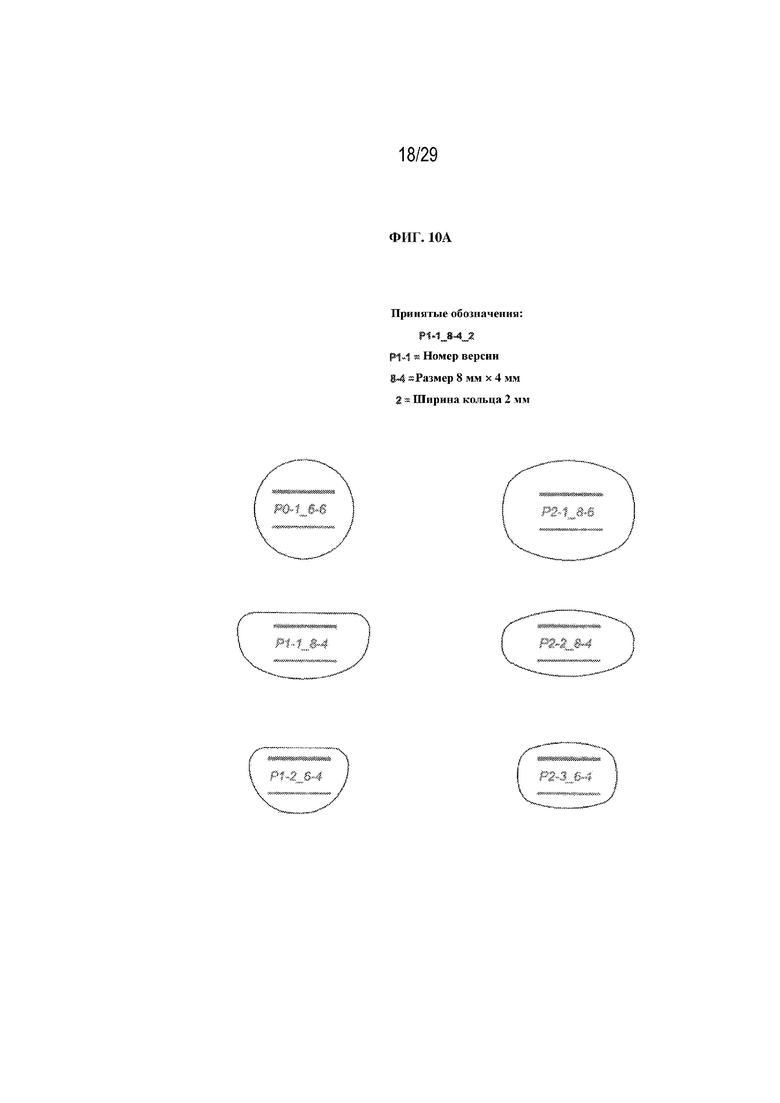
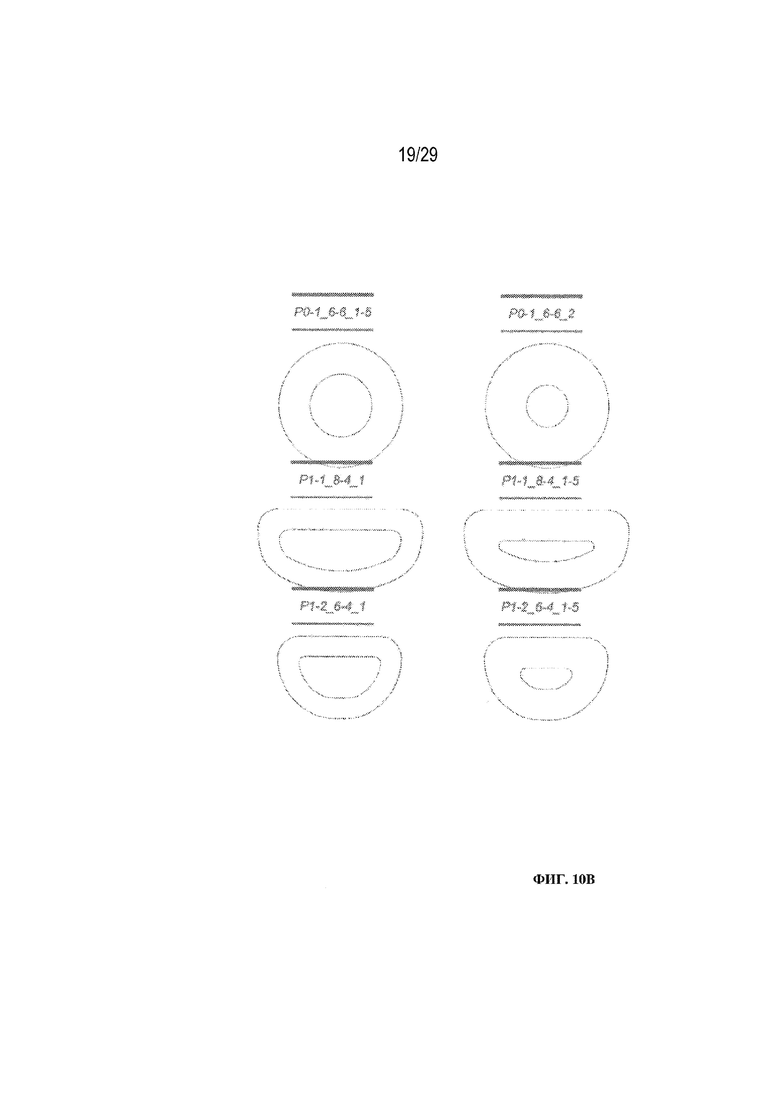
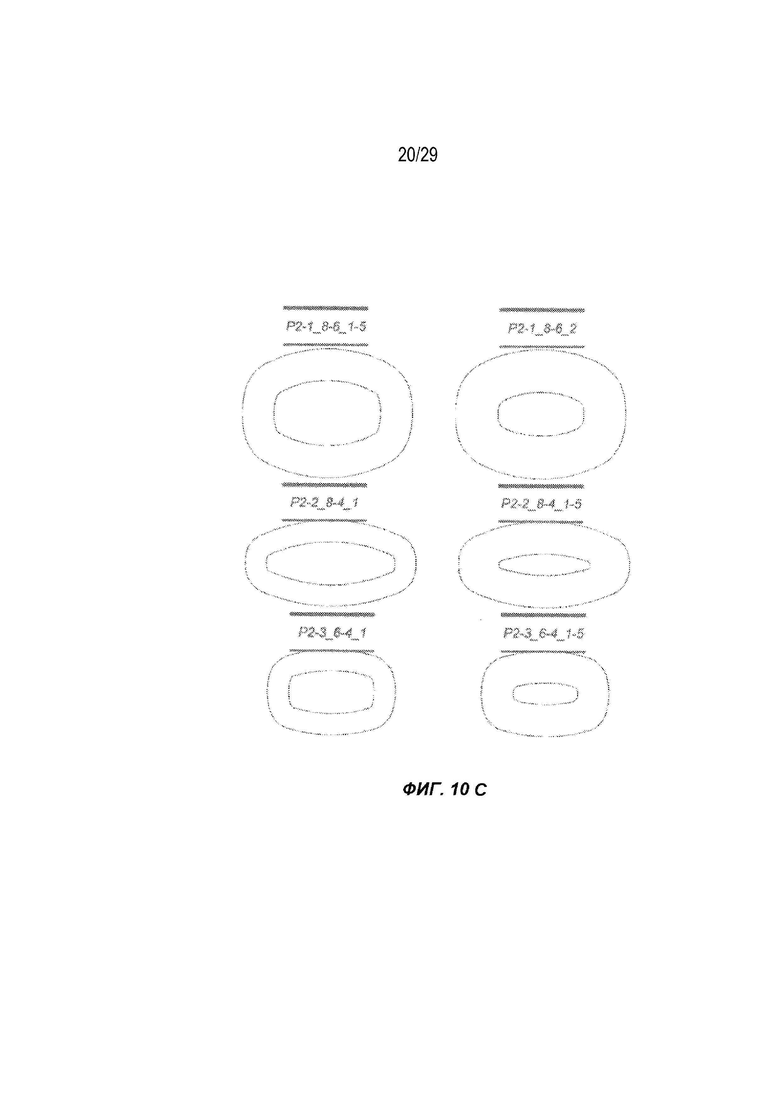
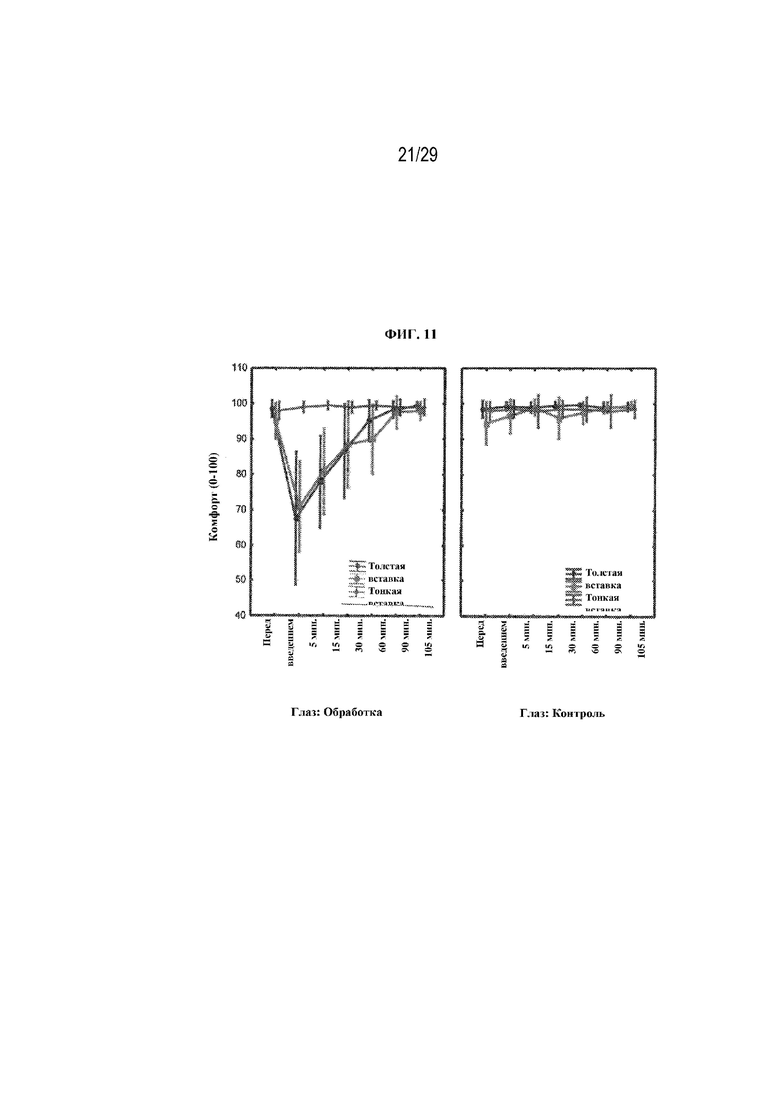
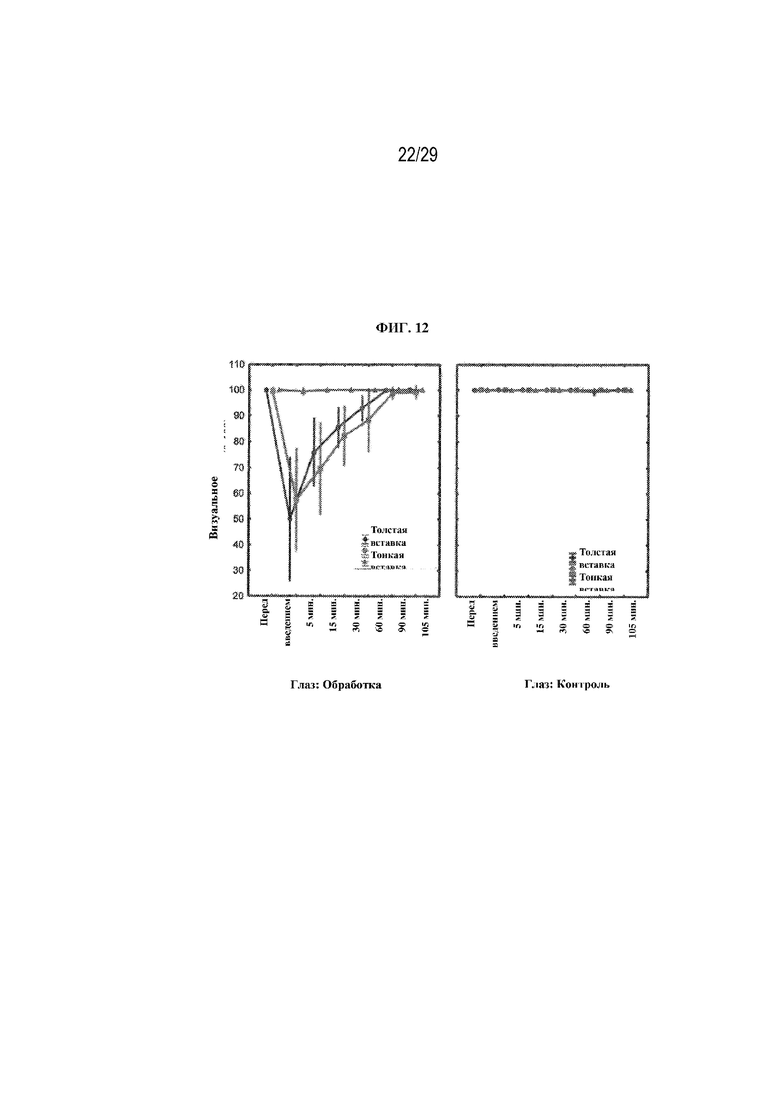
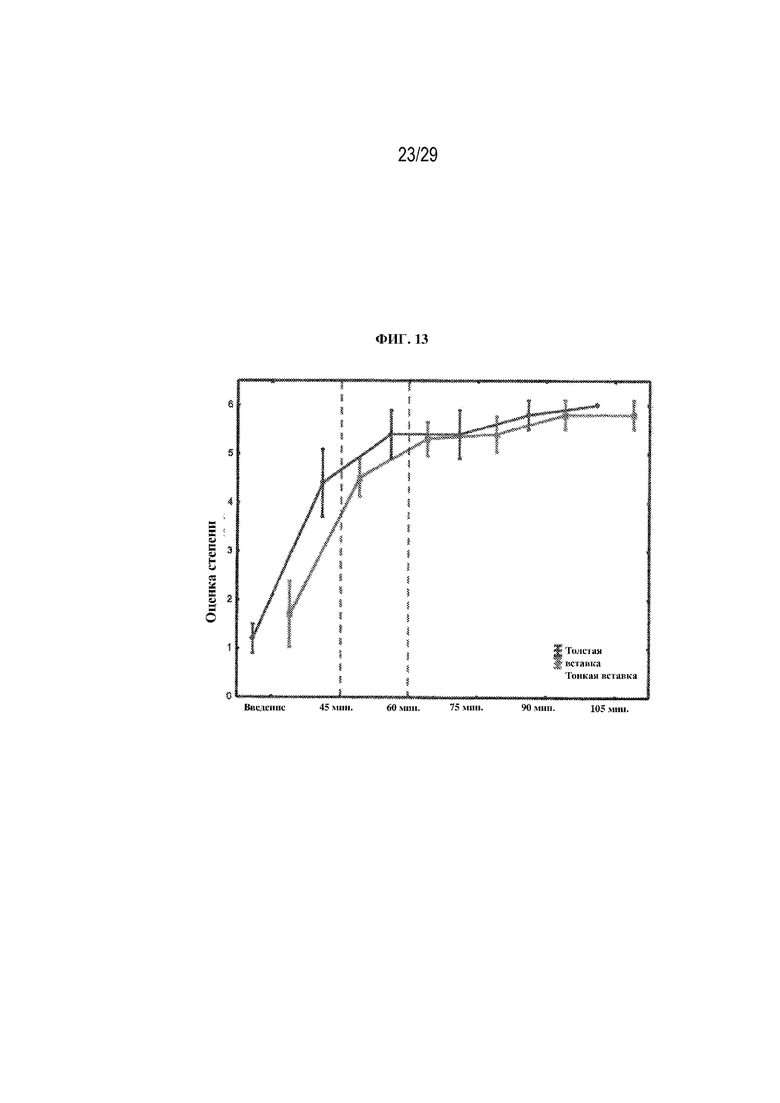
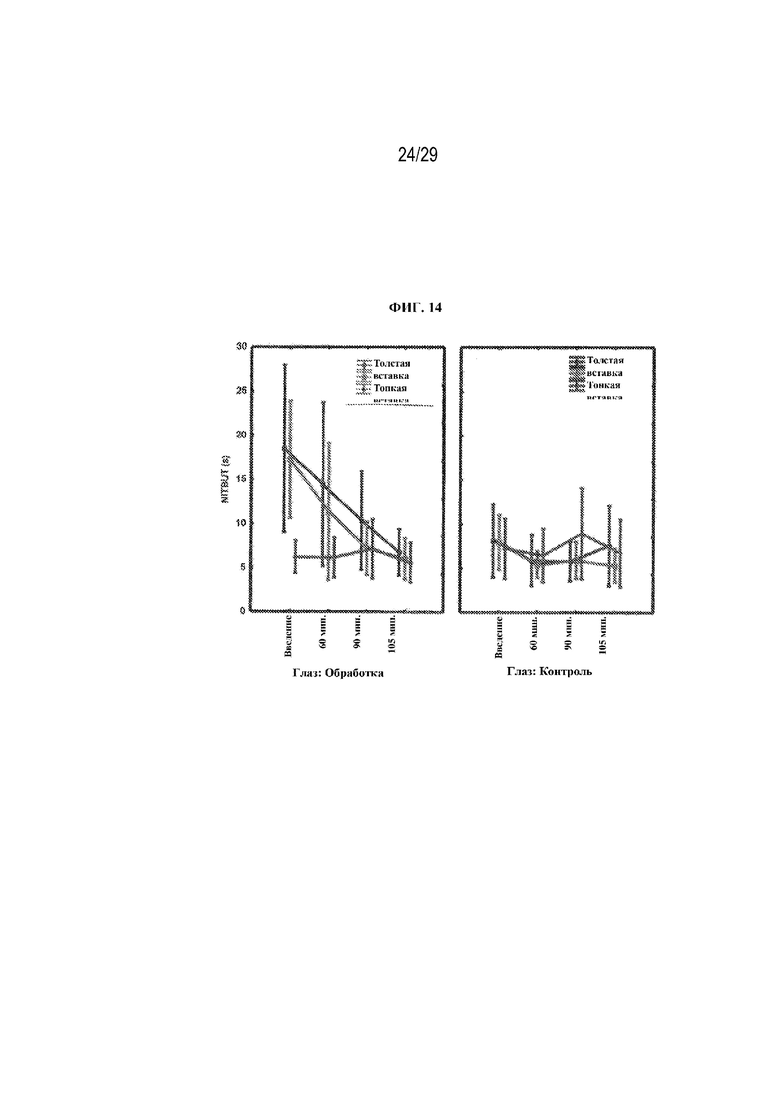
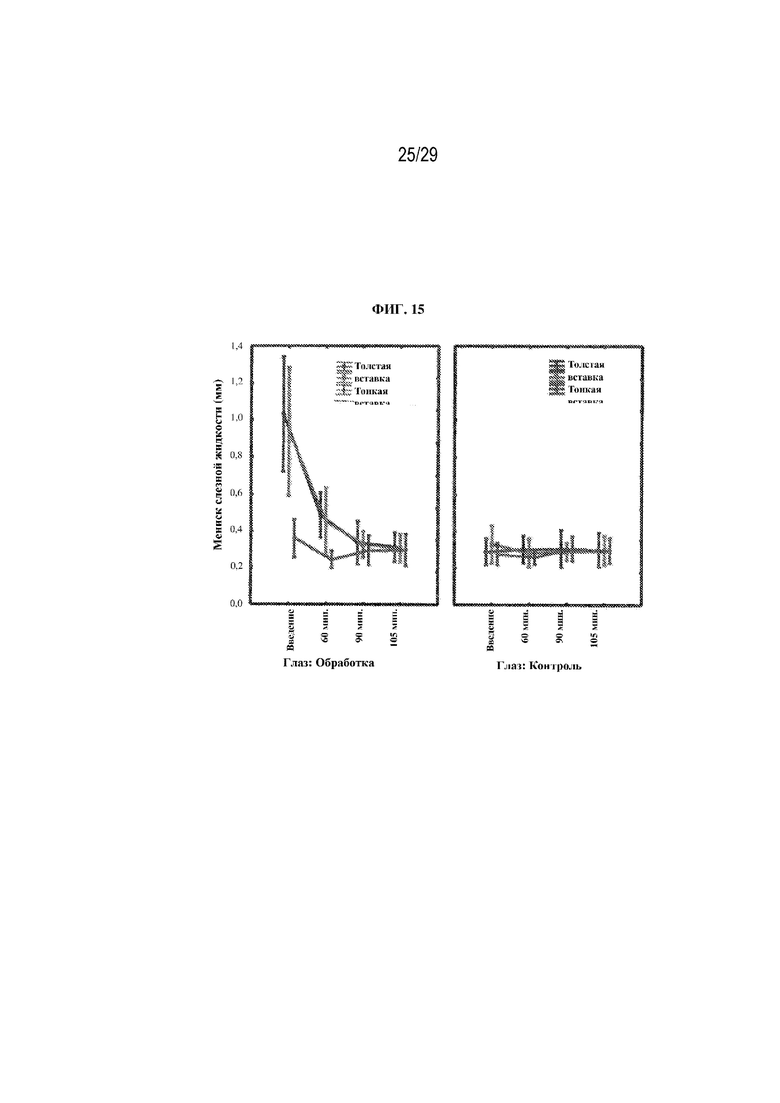
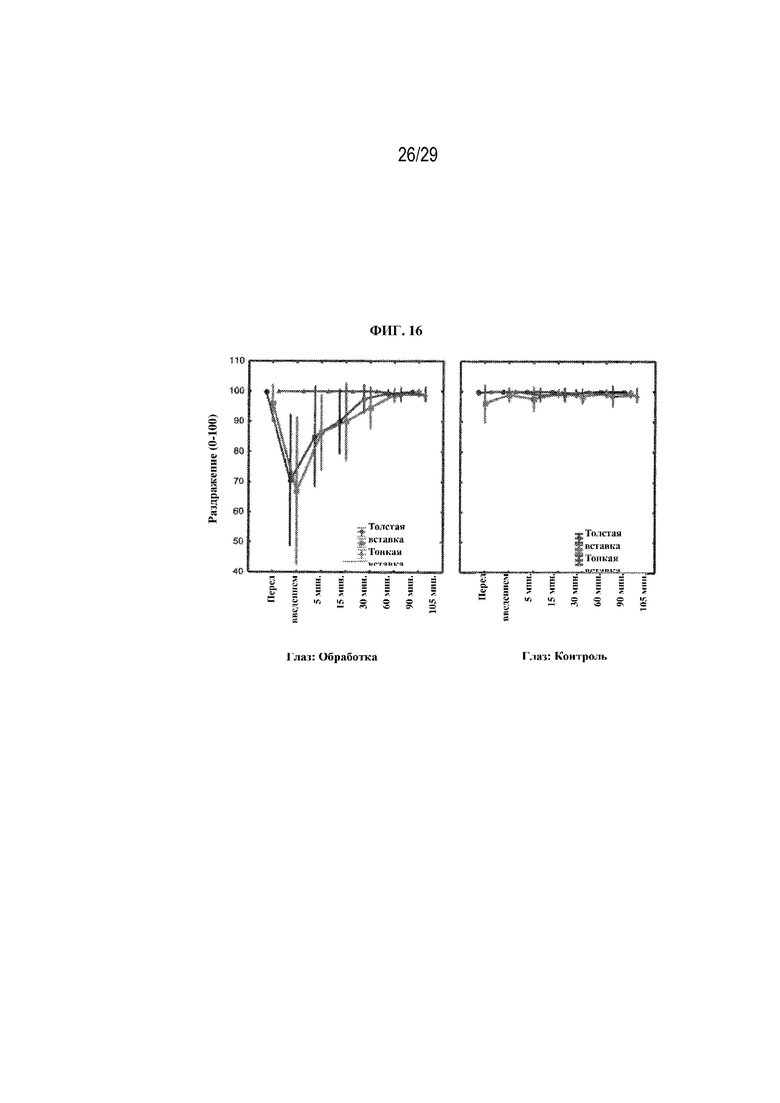
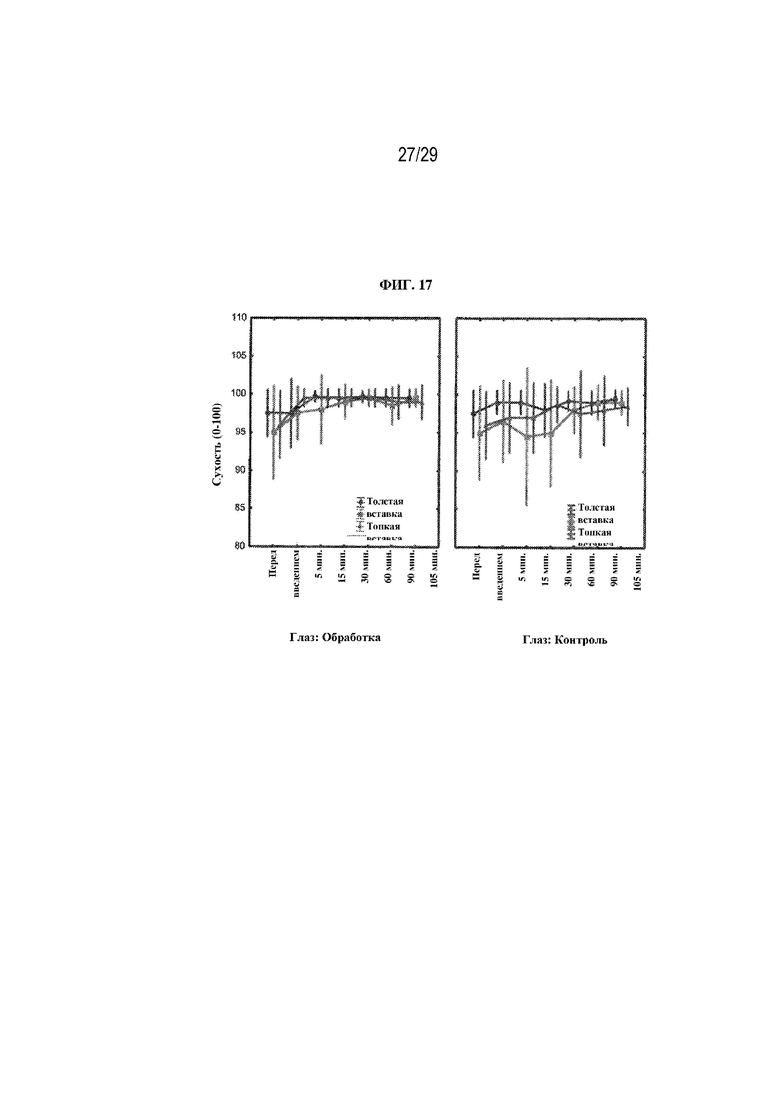
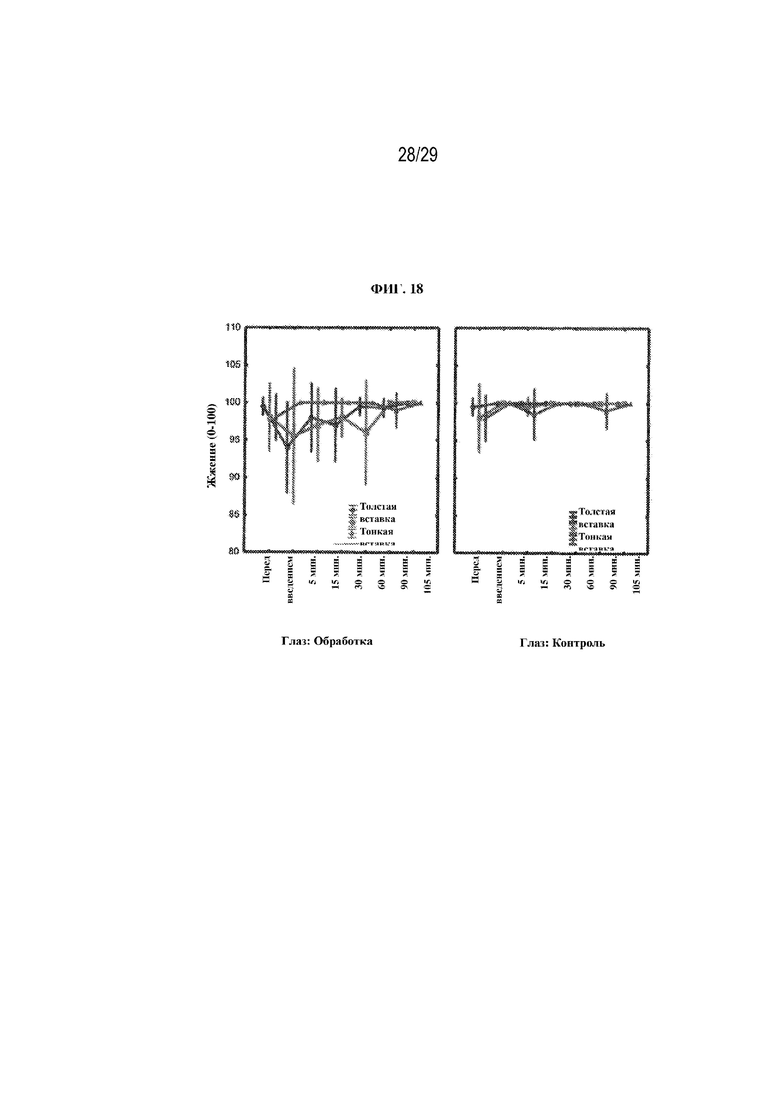
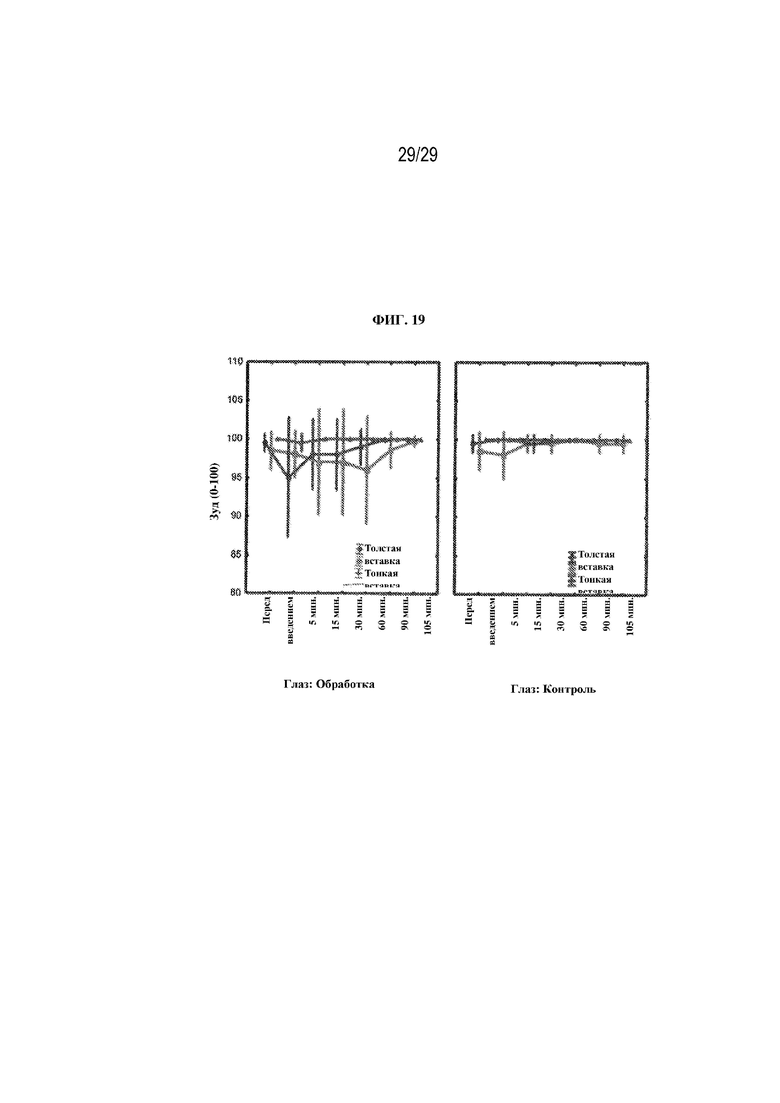
Изобретение относится к области медицины, а именно к офтальмологии, и предназначено для увеличения толщины слезной пленки. Полимерная глазная вставка содержит один или более мукоадгезивных полимеров, которые являются биосовместимыми с поверхностью глаза и слезной пленкой глаза, пластификатор или смягчитель. Один или более мукоадгезивных полимеров представляют собой HP-гуар, гиалуроновую кислоту или гиалуронат натрия и присутствуют в количестве от 80 до 90% вес./вес. полимерной глазной вставки. При введении полимерной глазной вставки в свод глаза толщина слезной пленки увеличивается на по меньшей мере 30 минут после введения. Использование изобретения обеспечивает медленное выделение смазывающего вещества в слезную пленку для смазывания и защиты поверхности глаза в течение продолжительного периода времени, что позволяет снизить частоту введения доз и нагрузку на пациента, обычно связанную с применением местных капель. 17 з.п. ф-лы, 19 ил., 20 табл., 7 пр.
1. Полимерная глазная вставка, при этом вставка содержит:
один или более мукоадгезивных полимеров, которые являются биосовместимыми с поверхностью глаза и слезной пленкой глаза, пластификатор или смягчитель, причем один или более мукоадгезивных полимеров представляют собой HP-гуар, гиалуроновую кислоту или гиалуронат натрия, и причем один или более мукоадгезивных полимеров присутствуют в количестве от 80 до 90% вес./вес. полимерной глазной вставки; и
где при введении полимерной глазной вставки в свод глаза толщина слезной пленки увеличивается на по меньшей мере 30 минут после введения.
2. Вставка по п. 1, где пластификатор или смягчитель выбран из группы, состоящей из:
полиэтиленгликоля (PEG), производного PEG, воды, витамина E и триэтилцитрата.
3. Вставка по п. 2, где пластификатор или смягчитель присутствует в количестве от 2 до 30% вес./вес., от 5 до 25% вес./вес., от 5 до 20% вес./вес. или от 5 до 15% вес./вес. полимерной глазной вставки.
4. Вставка по п. 2 или 3, где пластификатор или смягчитель представляет собой PEG.
5. Вставка по любому из предыдущих пунктов, где вставка состоит из примерно 40% HP-гуара, примерно 10% PVP, примерно 40% гиалуроната натрия и примерно 10% PEG.
6. Вставка по п. 1, дополнительно содержащая 1-200 ppm ментола.
7. Вставка по п. 6, дополнительно содержащая 20-100 ppm ментола.
8. Вставка по п. 1, где вставка свободна от дополнительного фармацевтически активного средства.
9. Вставка по п. 1, где вставка содержит одно или более фармацевтически активных средств.
10. Вставка по п. 9, где одно или более фармацевтически активных средств выбраны из группы, состоящей из:
производных атропина, которые не являются донорами оксида азота, комбинированного лекарственного средства на основе травопроста с оксидом азота, смазывающих веществ, стероидов, антибиотиков, нестероидных противовоспалительных лекарственных средств, антигистаминных средств, противовирусных средств, антибактериальных средств, вазоконстрикторов и аналогов простагландина.
11. Вставка по п. 1, где толщина слезной пленки не возвращается к толщине до введения в течение примерно двух часов после введения.
12. Вставка по п. 1, где после введения в свод глаза толщина слезной пленки увеличивается на период до по меньшей мере двух часов после введения.
13. Вставка по п. 1, где формой вставки является пленка, стержень, сфера, кольцо или неправильная форма с максимальным размером в любом одном направлении, составляющим 5-6 мм.
14. Вставка по п. 13, где вставка имеет круглую форму с диаметром приблизительно 5 мм, толщину, составляющую 50-400 мкм, и содержание воды от 1 до 50% вес./вес.
15. Вставка по п. 14, где вставка имеет толщину, составляющую приблизительно 150-250 мкм, и содержание воды от 30 до 50% вес./вес.
16. Вставка по п. 1, где HP-гуар имеет средневесовую молекулярную массу от 2 до 4 млн Да, и гиалуронат натрия имеет средневесовую молекулярную массу от 0,1 до 2 млн Да.
17. Вставка по любому из пп. 1-16, для применения в способе лечения глазного нарушения, включающем нанесение полимерной глазной вставки на свод глаза.
18. Вставка по п. 17, где глазное нарушение выбрано из группы, состоящей из сухости глаз, покраснения глаз, миопии, глаукомы, аллергии и воспаления.
| WO 2015193677 A1, 23.12.2015 | |||
| WO 2012112636 A1, 23.08.2012 | |||
| US 4730013 A, 08.03.1988 | |||
| WO 9640005 A1, 19.12.1996 | |||
| MOON SANG-WOONG et al | |||
| The Impact of Artificial Tears Containing Hydroxypropyl Guar on Mucous Layer | |||
| Cornea, 2010, 29(12):1430-5. |
Авторы
Даты
2023-03-01—Публикация
2020-05-01—Подача