ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в целом относится к кристаллическим формам (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида. Настоящее изобретение также в целом относится к фармацевтической композиции, содержащей кристаллические формы, а также к способам получения и способам применения кристаллических форм в лечении конкретных аутоиммунных заболеваний, ассоциированных с активностью эндосомального Toll-подобного рецептора, выбранного из TLR7 и TLR8, и к способам получения таких кристаллических форм.
УРОВЕНЬ ТЕХНИКИ
(S)-N-(4-((5-(1,6-Диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамид впервые был раскрыт в виде HCl-соли в WO2018/047081, поданном 6 сентября 2017 г., который включен посредством ссылки во всей своей полноте, и он представляет собой двойной ингибитор TLR7 и TLR8, характеризующийся структурой формулы I:
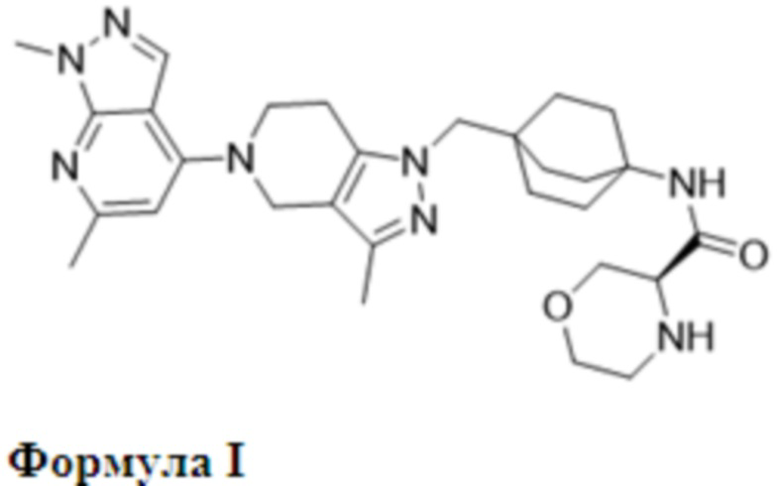
Соединение формулы I является применимым в лечении различных аутоиммунных болезненных состояний, ассоциированных с активностью эндосомального Toll-подобного рецептора, выбранного из TLR7 и TLR8. Таким образом, соединение формулы I, следовательно, является применимым в лечении определенных аутоиммунных заболеваний, в том числе, например, системной красной волчанки, кожной волчанки, дискоидной волчанки, смешанного заболевания соединительной ткани, первичного билиарного цирроза, иммунной тромбоцитопенической пурпуры, гнойного гидраденита, дерматомиозита, полимиозита, синдрома Шегрена, артрита, ревматоидного артрита или псориаза.
Твердая форма активного фармацевтического ингредиента (API) конкретного лекарственного средства зачастую является важным определяющим фактором в отношении простоты получения лекарственного средства, гигроскопичности, устойчивости, растворимости, устойчивости при хранении, простоты составления, скорости растворения в жидкостях желудочно-кишечного тракта и биологической доступности in vivo. Кристаллические формы наблюдаются, когда вещество аналогичного состава кристаллизуется в виде различных структурных решеток, что приводит к различным термодинамическим свойствам и видам стабильности, характерным для конкретной кристаллической формы. Кристаллические формы также могут включать различные гидраты или сольваты того же соединения. При принятии решения о том, какая форма является предпочтительной, сравнивают ряд свойств форм и выбирают предпочтительную форму, исходя из множества переменных физических свойств. Вполне возможно, что одна форма может быть предпочтительной при некоторых обстоятельствах, когда определенные аспекты, такие как простота получения, стабильность и т. д., считаются критическими. В других ситуациях может быть предпочтительной другая форма вследствие более высокой скорости растворения и/или лучшей биологической доступности. Пока невозможно предсказать, будут ли конкретные соединение или соль соединения образовывать полиморфы, будут ли какие-либо такие полиморфы пригодными для коммерческого применения в терапевтической композиции, или какие полиморфы будут проявлять такие необходимые свойства.
КРАТКОЕ ОПИСАНИЕ
В настоящем изобретении предусмотрены кристаллические формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида в свободной форме (т.е. в несолевой форме). В конкретном варианте осуществления свободная форма дополнительно содержит воду (называемая в данном документе гидратом).
Таким образом, в настоящем изобретении предусмотрена кристаллическая форма (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида в свободной форме.
В настоящем изобретении дополнительно предусмотрена кристаллическая форма гидрата (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида.
Варианты осуществления таких кристаллических форм включают такие формы, которые обозначены в данном документе как форма A и форма HA. Названия, применяемые в данном документе для определения конкретной формы, например "формы A" или "формы HA, не должны рассматриваться как ограничивающие по отношению к любому другому веществу, обладающему сходными или идентичными физическими и химическими характеристиками, напротив, следует понимать, что такие обозначения являются всего лишь идентификаторами, которые следует интерпретировать в соответствии с информацией о характеристиках, также представленной в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1 представлен иллюстративный спектр XRPD для свободной формы соединения формулы I, обозначенной в данном документе как форма A, при этом по оси X показаны градусы 2θ (2-тета), и по оси Y показана относительная интенсивность.
На фиг. 2 представлены иллюстративные результаты DSC для свободной формы соединения формулы I, обозначенной в данном документе как форма A.
На фиг. 3 представлены иллюстративные результаты TGA для свободной формы соединения формулы I, обозначенной в данном документе как форма A.
На фиг. 4 представлен иллюстративный спектр XRPD для гидратной формы соединения формулы I, обозначенной в данном документе как форма HA, при этом по оси X показаны градусы 2θ (2-тета), и по оси Y показана относительная интенсивность.
На фиг. 5 представлены иллюстративные результаты DSC для гидратной форме соединения формулы I, обозначенной в данном документе как форма HA.
На фиг. 6 представлены иллюстративные результаты TGA для гидратной формы соединения формулы I, обозначенной в данном документе как форма HA.
Более подробные перечни пиков XRPD для каждой из форм A и HA представлены на таблицах 1 и 2, соответственно ниже, на которых также представлены значения % относительной интенсивности (I/I0×100). Следует понимать, что на спектрах порошковой рентгеновской дифракции или на порошковых рентгеновских дифрактограммах присутствует естественная изменчивость в отношении значений, измеренных в градусах 2θ (°2θ), в результате, например, погрешности прибора (включая различия между приборами). В связи с этим следует понимать, что в измерениях пиков XRPD присутствует изменчивость °2θ, составляющая до ± 0,2, и, тем не менее, такие значения пиков также будут считаться характерными для конкретной твердой формы кристаллических веществ, описанных в данном документе. Также следует понимать, что другие измеренные значения из экспериментов XRPD и экспериментов DSC/TGA, такие как относительная интенсивность и содержание воды, могут изменяться в результате, например, условий получения образца, и/или хранения, и/или окружающей среды, и измеренные значения также будут считаться характерными для конкретной твердой формы кристаллических веществ, описанных в данном документе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к кристаллической форме свободной формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (соединения формулы I), которая описана и свойства которой определены в данном документе.
Настоящее изобретение также относится к кристаллической форме гидрата (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида. Более конкретно, настоящее изобретение относится к кристаллической форме гемигептагидрата (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, которая описана и свойства которой определены в данном документе.
В одном варианте осуществления в настоящем изобретении предусмотрена кристаллическая форма свободной формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (форма A), характеризующаяся порошковой рентгеновской дифрактограммой (XRPD), содержащей характеристический пик, выраженный в °2θ, при значении °2θ, составляющем 18,6 ± 0,2, измеренный при температуре, составляющей приблизительно 25°C. В другом варианте осуществления дифрактограмма XRPD дополнительно содержит один или несколько дополнительных иллюстративных пиков при значениях, выбранных из значения °2θ, составляющего 4,1 ± 0,2, и значения °2θ, составляющего 16,3 ± 0,2. В одном аспекте предыдущего варианта осуществления дифрактограмма XRPD дополнительно содержит один или несколько дополнительных характеристических пиков при значениях, выбранных из значения °2θ, составляющего 18,2 ± 0,2, и значения °2θ, составляющего 19,8 ± 0,2, измеренных при температуре, составляющей приблизительно 25°C. Соответственно, дифрактограмма XRPD для кристаллической формы свободной формы соединения формулы I может содержать один, два, три или четыре характеристических пика при значениях, выбранных из значения °2θ, составляющего 18,6 ± 0,2, значения °2θ, составляющего 4,1 ± 0,2, значения °2θ, составляющего 16,3 ± 0,2, значения °2θ, составляющего 18,2 ± 0,2, и значения °2θ, составляющего 19,8 ± 0,2, измеренные при температуре, составляющей приблизительно 25°C. В другом варианте осуществления кристаллическая форма свободной формы соединения формулы I характеризуется дифрактограммой XRPD, которая может дополнительно содержать один или несколько дополнительных характеристических пиков при значениях, выбранных из значения °2θ, составляющего 8,2 ± 0,2, значения °2θ, составляющего 15,2 ± 0,2, и значения °2θ, составляющего 16,9 ± 0,2, измеренных при температуре, составляющей приблизительно 25°C. Таким образом, дифрактограмма XRPD для кристаллической формы свободной формы соединения формулы I может содержать один, два, три, четыре, пять или шесть характеристических пиков при значениях, выбранных из значения °2θ, составляющего 18,6 ± 0,2, значения °2θ, составляющего 4,1 ± 0,2, значения °2θ, составляющего 16,3 ± 0,2, значения °2θ, составляющего 18,2 ± 0,2, значения °2θ, составляющего 19,8 ± 0,2, значения °2θ, составляющего 8,2 ± 0,2, значения °2θ, составляющего 15,2 ± 0,2, и значения °2θ, составляющего 16,9 ± 0,2, измеренных при температуре, составляющей приблизительно 25°C. Дифрактограмма XRPD для кристаллической формы свободной формы соединения формулы I может содержать один, два, три, четыре, пять или шесть характеристических пиков, выбранных из пиков, раскрытых в таблице 1 и измеренных при температуре, составляющей приблизительно 25°C.
В другом аспекте вышеуказанного варианта осуществления кристаллическая форма свободной формы соединения формулы I характеризуется порошковой рентгеновской дифрактограммы, содержащей четыре или более значений 2θ (CuKα λ=1,54184 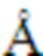 ), выбранных из группы, состоящей из значений 4,1±0,2°, 8,2±0,2°, 15,2 ± 0,2°, 16,3 ± 0,2°, 16,9 ± 0,2°, 18,2 ± 0,2°, 18,6 ± 0,2°, 19,8 ± 0,2°и 20,4 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C.
), выбранных из группы, состоящей из значений 4,1±0,2°, 8,2±0,2°, 15,2 ± 0,2°, 16,3 ± 0,2°, 16,9 ± 0,2°, 18,2 ± 0,2°, 18,6 ± 0,2°, 19,8 ± 0,2°и 20,4 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C.
В другом аспекте вышеуказанного варианта осуществления кристаллическая форма свободной формы соединения формулы I характеризуется порошковой рентгеновской дифрактограммой, содержащей пять или более значений 2θ (CuKα λ=1,54184 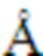 ), выбранных из группы, состоящей из значений 4,1 ± 0,2°, 8,2 ± 0,2°, 15,2 ± 0,2°, 16,3 ± 0,2°, 16,9 ± 0,2°, 18,2 ± 0,2°, 18,6 ± 0,2°, 19,8 ± 0,2°и 20,4 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C.
), выбранных из группы, состоящей из значений 4,1 ± 0,2°, 8,2 ± 0,2°, 15,2 ± 0,2°, 16,3 ± 0,2°, 16,9 ± 0,2°, 18,2 ± 0,2°, 18,6 ± 0,2°, 19,8 ± 0,2°и 20,4 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C.
В еще одном аспекте вышеуказанного варианта осуществления кристаллическая форма свободной формы соединения формулы I характеризуется дифрактограммой XRPD, которая является по сути такой, как показанная на фиг. 1. Следует понимать, что содержание воды в форме A может находиться в диапазоне от приблизительно 0% до приблизительно 1,5%, и она все еще считается кристаллической формой, характеризующейся дифрактограммой XRPD, содержащей один, два, три, четыре, пять или шесть характеристических пиков, описанных выше или в таблице 1. Содержание воды, определенное с помощью способ титрования по Карлу Фишера, для формы A составляет 0,9%.
Свойства кристаллической формы свободной формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида могут быть определены с помощью термического анализа. В одном варианте осуществления кристаллическая форма свободной формы соединения формулы I характеризуется термическим профилем, измеренным с помощью дифференциальной сканирующей калориметрии (DSC) со скоростью нагревания 10°C/мин, содержащим один эндотермический пик, который начинается при приблизительно 182,7°C, с энтальпией ΔH 65 Дж/г.
В другом варианте осуществления кристаллическая форма свободной формы соединения формулы I характеризуется термограммой DSC, которая является по сути такой, как показанная на фиг. 2. Следует понимать, что для гидратированных форм могут быть получены различные термограммы (в отношении формы пика и профиля) в зависимости от параметров прибора, таким образом, аналогичное вещество может иметь термограммы, которые выглядят по сути отличными друг от друга, если данные получены на двух различных приборах.
В другом варианте осуществления кристаллическая форма свободной формы соединения формулы I характеризуется диаграммой термогравиметрического анализа (TGA), которая является по сути такой, как показанная на фиг. 3. Потеря веса при TGA составляет приблизительно 0,4% при 182°C.
В еще одном варианте осуществления кристаллическая форма A представляет собой по сути чистую фазу.
В еще одном варианте осуществления настоящее изобретение относится к способу получения кристаллической формы A соединения (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, при этом указанный способ включает стадии
a) суспендирования аморфной свободной формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида в ацетоне или изопропаноле с образованием смеси в виде суспензии,
b) нагревания смеси в виде суспензии до температуры, составляющей приблизительно 50°C, до растворения с образованием раствора,
c) охлаждения раствора до приблизительно 15°C в течение периода, составляющего приблизительно 4 ч, с образованием смеси в виде суспензии,
d) необязательно повторения стадий b) и c) один или два раза,
e) нагревания смеси в виде суспензии до приблизительно 50°C и добавления по каплям гептана,
f) перемешивания смеси при 50°C в течение приблизительно 1 ч,
g) охлаждения раствора до приблизительно 15°C в течение периода, составляющего приблизительно 4 ч, с образованием смеси в виде суспензии,
h) перемешивания смеси в виде суспензии при 15°C в течение 1 ч и
i) фильтрования суспензии со сбором кристаллической формы A.
В настоящем изобретении дополнительно предусмотрена кристаллическая форма гидрата (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (форма HA), характеризующаяся порошковой рентгеновской дифрактограммой (XRPD), содержащей характеристический пик, выраженный в °2θ, при значении °2θ, составляющем 14,3 ± 0,2, измеренный при температуре, составляющей приблизительно 25°C. В другом варианте осуществления дифрактограмма XRPD дополнительно содержит один или несколько дополнительных характеристических пиков при значениях, выбранных из значения °2θ, составляющего 6,6 ± 0,2, значения °2θ, составляющего 16,0 ± 0,2, и значения °2θ, составляющего 17,3 ± 0,2, измеренных при температуре, составляющей приблизительно 25°C.
В качестве альтернативы, дифрактограмма XRPD для кристаллической формы указанного гидрата соединения формулы I может содержать один, два, три или четыре характеристических пика при значениях, выбранных из значения °2θ, составляющего 14,3 ± 0,2, значения °2θ, составляющего 6,6 ± 0,2, значения °2θ, составляющего 16,0 ± 0,2, и значения °2θ, составляющего 17,3 ± 0,2, измеренного при температуре, составляющей приблизительно 25°C.
В другом варианте осуществления кристаллическая форма указанного гидрата соединения формулы I характеризуется дифрактограммой XRPD, которая может дополнительно содержать один или несколько дополнительных характеристических пиков при значениях, выбранных из значения °2θ, составляющего 23,5 ± 0,2, значения °2θ, составляющего 26,5 ± 0,2, значения °2θ, составляющего 27,3 ± 0,2. Таким образом, дифрактограмма XRPD для кристаллической формы указанного гидрата соединения формулы I может содержать один, два, три, четыре, пять или шесть характеристических пиков при значениях, выбранных из значения °2θ, составляющего 14,3 ± 0,2, значения °2θ, составляющего 6,6 ± 0,2, значения °2θ, составляющего 16,0 ± 0,2, значения °2θ, составляющего 17,3 ± 0,2, значения °2θ, составляющего 23,5 ± 0,2, значения °2θ, составляющего 26,5 ± 0,2, и значения °2θ, составляющего 27,3 ± 0,2, или выбранных из пиков, раскрытых в таблице 2 и измеренных при температуре, составляющих приблизительно 25°C.
В другом варианте осуществления указанная гидратная форма характеризуется порошковой рентгеновской дифрактограммой, содержащей четыре или более значений 2θ (CuKα λ=1,54184 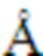 ), выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C.
), выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C.
В другом варианте осуществления указанная гидратная форма характеризуется порошковой рентгеновской дифрактограммой, содержащей пять или более значений 2θ (CuKα λ=1,54184  ), выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C.
), выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C.
В еще одном варианте осуществления кристаллическая форма гидрата соединения формулы I характеризуется дифрактограммой XRPD, которая является по сути такой, как показанная на фиг. 4. Следует понимать, что содержание воды в форме HA может находиться в диапазоне от приблизительно 9% до приблизительно 12%, и она все еще считается гидратом, характеризующимся дифрактограммой XRPD, содержащей один, два, три, четыре, пять или шесть характеристических пиков, описанных выше. Содержание воды, определенное с помощью способ титрования по Карлу Фишера, для формы HA составляет 10,6%.
Свойства кристаллической формы гидрата (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида могут быть определены с помощью термического анализа. В одном варианте осуществления кристаллическая форма гидрата соединения формулы I, характеризуется профилем дифференциальной термогравиметрии, содержащим эндотермический пик, который начинается при приблизительно 54,2°C, с энтальпией ΔH 284 Дж/г (соответствующий дегидратации) и эндотермический пик, который начинается при приблизительно 130,6°C, с энтальпией ΔH 24 Дж/г (соответствующий плавлению).
В другом варианте осуществления кристаллическая форма гидрата соединения формулы I характеризуется термограммой DSC, которая является по сути такой, как показанная на фиг. 5. Следует понимать, что для гидратированных форм могут быть получены различные термограммы (в отношении формы пика и профиля) в зависимости от параметров прибора, таким образом, аналогичное вещество может иметь термограммы, которые выглядят по сути отличными друг от друга, если данные получены на двух различных приборах.
В другом варианте осуществления кристаллическая форма гидрата соединения формулы I характеризуется диаграммой термогравиметрического анализа (TGA), которая является по сути такой, как показанная на фиг. 6. Потеря веса при TGA составляет приблизительно 9,9% при 96°C.
В еще одном варианте осуществления кристаллическая форма HA, описанная выше, представляет собой гемигептагидратную форму.
В еще одном варианте осуществления кристаллическая форма HA представляет собой по сути чистую фазу.
В еще одном варианте осуществления настоящее изобретение относится к способу получения кристаллической формы HA соединения (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, при этом указанный способ включает стадии
a) суспендирования аморфной свободной формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида в смеси растворителей, содержащей по меньшей мере приблизительно 2% по весу воды, с образованием смеси в виде суспензии,
b) нагревания смеси в виде суспензии до некоторой температуры до растворения с образованием раствора,
c) охлаждения раствора до приблизительно -10°C с образованием суспензии,
d) фильтрования суспензии со сбором кристаллической формы HA.
В конкретном аспекте вышеуказанного варианта осуществления настоящее изобретение относится к способу получения кристаллической формы A, где смесь растворителей на стадии a) содержит ацетон, спирт, тетрагидрофуран или ацетонитрил.
В еще одном аспекте предыдущего варианта осуществления настоящее изобретение относится к способу получения кристаллической формы A, где смесь растворителей на стадии a) выбрана из смеси ацетон/вода 98:2 (вес/вес) и смеси изопропанол/вода 95:5 (вес/вес).
В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество кристаллической формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (формы A или формы HA или их комбинации) и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. В конкретном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей кристаллическую форму A и один или несколько фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей кристаллическую форму A в по сути чистой фазе. В еще одном варианте осуществления настоящее изобретение относится к фармацевтическому составу, содержащему кристаллическую форму A и дополнительно содержащему по меньшей мере одну другую твердую форму 5(S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида. В одном аспекте данного варианта осуществления другая твердая форма представляет собой кристаллическую форму HA. В еще одном варианте осуществления другая твердая форма представляет собой аморфную форму (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида.
В конкретном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей кристаллическую форму HA и один или несколько фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей кристаллическую форму HA в по сути чистой фазе. В еще одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей кристаллическую форму HA и дополнительно содержащей по меньшей мере одну другую твердую форму 5(S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида. В одном аспекте данного варианта осуществления другая твердая форма представляет собой кристаллическую форму A. В еще одном варианте осуществления другая твердая форма представляет собой аморфную форму (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида.
В других вариантах осуществления настоящее изобретение относится к комбинациям, в частности фармацевтическим комбинациям, содержащим терапевтически эффективное количество кристаллической формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (формы A, формы HA или их комбинации) и одного или нескольких терапевтических средств.
В конкретном варианте осуществления настоящее изобретение относится к фармацевтической комбинации, содержащей кристаллическую форму A и одно или несколько терапевтических средств. В еще одном аспекте настоящее изобретение относится к фармацевтической комбинации, содержащей кристаллическую форму A в по сути чистой фазе и одно или несколько терапевтических средств. В еще одном варианте осуществления настоящее изобретение относится к фармацевтической комбинации, содержащей кристаллическую форму A и дополнительно содержащей по меньшей мере одну другую твердую форму 5(S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида. В одном аспекте данного варианта осуществления другая твердая форма представляет собой кристаллическую форму HA. В еще одном варианте осуществления другая твердая форма представляет собой аморфную форму (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида.
В конкретном варианте осуществления настоящее изобретение относится к фармацевтической комбинации, содержащей кристаллическую форму HA и одно или несколько терапевтических средств. В еще одном аспекте настоящее изобретение относится к фармацевтической комбинации, содержащей кристаллическую форму HA в по сути чистой фазе и одно или несколько терапевтических средств. В еще одном варианте осуществления настоящее изобретение относится к фармацевтической комбинации, содержащей кристаллическую форму HA и дополнительно содержащей по меньшей мере одну другую твердую форму 5(S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида. В одном аспекте данного варианта осуществления другая твердая форма представляет собой кристаллическую форму A. В еще одном варианте осуществления другая твердая форма представляет собой аморфную форму (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида.
В другом варианте осуществления в настоящем изобретении предусмотрены фармацевтические комбинации, описанные выше, где второе средство независимо выбрано из группы, состоящей из противовоспалительных средств, иммуномодулирующих средств, иммунодепрессивных средств, цитокинов, нестероидных противовоспалительных лекарственных средств (NSAID), противомалярийных соединений, противоревматических соединений, ингибиторов фактора активации B-клеток (BAFF), ингибиторов стимулятора B-лимфоцитов (BLyS) и стероидных гормонов.
В одном варианте осуществления настоящее изобретение относится к способу лечения аутоиммунного заболевания у субъекта, нуждающегося в этом, при этом способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества кристаллической формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (формы A, формы HA или их комбинации) отдельно или в комбинации с одним или несколькими терапевтическими средствами.
В другом варианте осуществления настоящее изобретение относится к способу лечения аутоиммунного заболевания у субъекта, нуждающегося в этом, включающему введение указанному субъекту фармацевтической композиции, описанной выше, отдельно или в комбинации с одним или несколькими терапевтическими средствами.
В другом варианте осуществления настоящее изобретение относится к способу лечения аутоиммунного заболевания у субъекта, нуждающемуся в этом, включающему введение указанному субъекту фармацевтической комбинации, описанной выше.
В одном варианте осуществления настоящее изобретение относится к применению кристаллической формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (формы A, формы HA или их комбинации) отдельно или в комбинации с одним или несколькими терапевтическими средствами для лечения аутоиммунного заболевания.
В еще одном варианте осуществления настоящее изобретение относится к кристаллической форме (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (форме A, форме HA или их комбинации) для применения в лечении аутоиммунного заболевания.
В еще одном варианте осуществления настоящее изобретение относится к комбинации кристаллической формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (формы A, формы HA или их комбинации) и одного или нескольких терапевтических средств для применения в лечении аутоиммунного заболевания.
В одном варианте осуществления настоящее изобретение относится к способу лечения, применению, соединению для применения или комбинации для применения, описанных выше, где аутоиммунное заболевание ассоциировано с активностью эндосомального Toll-подобного рецептора, выбранного из TLR7 и TLR8. В одном аспекте данного варианта осуществления аутоиммунное заболевание, ассоциированное с активностью эндосомального Toll-подобного рецептора, выбранного из TLR7 и TLR8, выбрано из системной красной волчанки, кожной волчанки, дискоидной волчанки, смешанного заболевания соединительной ткани, первичного билиарного цирроза, иммунной тромбоцитопенической пурпуры, гнойного гидраденита, дерматомиозита, полимиозита, синдрома Шегрена, артрита, ревматоидного артрита и псориаза.
В одном варианте осуществления настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вышеуказанным вариантом осуществления, где терапевтическое средство вводится совместно в одной композиции или вводится по отдельности в двух или более различных формах композиций.
В одном варианте осуществления настоящее изобретение относится к способу, применению или комбинации для применения, описанных выше, где терапевтическое средство вводится одновременно с кристаллической формой (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, до или после нее.
Было обнаружено, что кристаллические формы, описанные в данном документе, обладают преимущественными свойствами. Критериями отбора являются токсикологические факторы, кристалличность, точка плавления, гигроскопичность, стабильность в нерасфасованном виде, совместимость с вспомогательными веществами, pH водного раствора, растворимость в воде и водных средах, морфология, обращение и полиморфное поведение. Свободная форма A и гидратная форма HA продемонстрировали лучшие варианты поведения, в частности, по сравнению с HCl-солью, которая была ранее известна и описана в WO2018/047081. Было обнаружено, что HCl-соль является гигроскопичной при выше 70%RH и также обладала потенциальной коррозионной активностью.
Кристаллическая форма A представляет собой безводную форму (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, которая представляет собой высококристаллическое вещество, состоящее из тонких пластинчатых частиц. Оно является слегка гигроскопическим при не более 70%RH с поглощением 1,3% влаги, однако при более высоких значениях влажности (т. е. выше 70%RH) оно превращается в гидрат кристаллической формы HA.
Кристаллическая форма HA представляет собой гидратированную форму (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида. Данные TGA и DVS указывают, что она представляет собой гемигептагидрат. Кристаллическая форма HA является слегка гигроскопической при значениях влажности выше 30%RH. Ниже 20%RH она дегидратирует с образованием ангидратной формы, характеристики которой не определяли, которая регидратирует обратно до гидратной формы HA, как только влажность достигнет значения 30%RH.
Стабильность в растворителе
Проводили тесты в отношении конкурентного равновесия для исследования относительной стабильности форм A и HA в экспериментах на конкурентное установление равновесия в растворителе. Смесь 1:1 формы A и формы HA получали и суспендировали в различных растворителях или их смеси при температуре от 25°C до 50°C в течение семи дней. Полученную суспензию фильтровали и анализировали с помощью XRPD/DVS. Эксперименты на конкурентное установление равновесия и полученные данные указывали на то, что происходит преобразование формы A в форму HA при низком содержании воды. Результаты продемонстрировали, что преобразование формы A в форму HA происходит при активности воды примерно aw=0,25.
Стабильность твердого состояния в нерасфасованном виде и со смесями вспомогательных веществ
В отношении формы A и формы HA проводили исследование на стабильность и совместимость с вспомогательным веществом. Обе формы подвергали различным условиям испытания, описанным ниже.
Условия испытания в нерасфасованном виде: 1 неделя в герметичном контейнере при 80°C, 50°C, 80°C-75%RH или 50oC-75%RH.
Условия испытания со смесями вспомогательных веществ (EM):
a. 1% формы A или формы HA в EM1 в течение 2 недель при 50°C;
b. 1% формы A или формы HA в EM2 в течение 2 недель при 50°C;
c. 10% формы A или формы HA в размельченной твердой желатиновой капсуле (HGC) в течение 2 недель при 50°C;
d. 10% формы A или формы HA в размельченной гидроксипропилметилцеллюлозе (HMPC) в течение 2 недель при 50°C;
e. 1% формы A или формы HA в EM1 в течение 2 недель при 50°C и 75%RH;
f. 1% формы A или формы HA в EM2 в течение 2 недель при 50°C и 75%RH;
g. 10% формы A или формы HA в размельченной HGC в течение 2 недель при 50°C и 75%RH;
h. 10% формы A или формы HA в размельченной HMPC в течение 2 недель при 50°C и 75%RH.
EM1: Смесь вспомогательных веществ 1: высушенная распылением лактоза (53%), микрокристаллическая целлюлоза (MCC) PH102 (40%), кросповидон XL (5%), Aerosil (0,5%), стеарат магния (1,5%).
EM2: Смесь вспомогательных веществ 2: маннит DC (68%), MCC PH102 (26%), Ac-Di-Sol (4%), Aerosil (0,5%), стеарат магния (1,5%).
Продукты разрушения анализировали с помощью HPLC, и образец анализировали с помощью XPRD для выявления любых изменений твердого состояния.
При вышеописанных условиях испытания как форма A, так и форма HA продемонстрировали хорошую стабильность в нерасфасованном состоянии и со вспомогательными веществами.
Дополнительно как форма A, так и форма HA проявили хорошую физическую и химическую стабильность в условиях воздействия света (воздействие 1200 клюкс при 25°C).
Физическая стабильность
Поведение при прессовании. Также оценивали физическую стабильность каждой кристаллической формы (формы A или формы HA).
100 мг кристаллической формы прессовали в течение 5 минут при 10 тоннах с помощью гидравлического пресса (диаметр таблетки 8 мм). Свойства образца затем определяли с помощью XRPD для выявления любого изменения в твердом состоянии.
Не наблюдали с помощью XRPD какого-либо изменения кристаллической формы для кристаллической формы A и кристаллической формы HA. Таким образом, было показано, что кристаллические формы A и HA обладают хорошими свойствами в отношении физической стабильности.
Поведение при эксперименте с моделированием грануляции. Физическую стабильность кристаллических форм A и HA также оценивали в экспериментах с моделированием грануляции. В таких экспериментах к кристаллической форме A или HA добавляли по каплям растворитель для гранулирования до тех пор, пока твердое вещество не было достаточно увлажнено. Смесь затем перемешивали вихревым способом между каждым добавлением при 25°C. В качестве альтернативы, проводили сухое измельчение. Кристалличность материала (после измельчения) повторно оценивали с помощью XRPD и/или DSC. В условиях сухого измельчения не выявили какого-либо изменения формы после измельчения кристаллической формы HA. При грануляции с применением этанола и воды в качестве растворителя для грануляции результаты XRPD также указывали на отсутствие изменения формы.
Модификация A также являлась устойчивой в условиях сухого измельчения, однако частично изменялась во время грануляции с водой в кристаллическую форму HA.
Растворимость
Форма A является хорошо растворимой при значениях pH 4,7 и ниже (растворимость выше 2 мг/мл), однако при более высоких уровнях pH образование менее растворимой формы HA приводит к более низким значениям растворимости.
Форма HA демонстрирует растворимость в водных буферах в соответствующих биологических средах, составляющую приблизительно 0,004 мг/мл.
В заключение, кристаллическая форма HA продемонстрировала химическую и физическую стабильность как в растворенном, так и в твердом состояниях, но демонстрирует более низкую растворимость. Кристаллическая форма HA является устойчивой в большом диапазоне значений влажности и является высококристаллической. Кристаллическая форма A является высококристаллической и безводной формой. Для нее была показана химическая и физическая стабильность в твердом состоянии, но она превращается с образованием HA в растворителе с низким содержанием воды. Форма A является более растворимой.
ОПРЕДЕЛЕНИЕ
Используемые в данном документе термины "приблизительно" и "по сути" указывают в отношении признаков, таких как эндотермы, эндотермический пик, экзотермы, смещения базовой линии и т. д., на то, что их значения могут изменяться. Относительно положения пиков рентгеновской дифракции "приблизительно" или "по сути" означает, что принимается во внимание типичная изменчивость положения и интенсивности пика. Например, специалист в данной области техники поймет, что положения пика (2θ) будут демонстрировать некоторую изменчивость между устройствами, как правило, до 0,2°. Иногда изменчивость может составлять более 0,2° в зависимости от различий в калибровке устройства. Кроме того, специалист в данной области техники поймет, что значения относительной интенсивности пика будут демонстрировать некоторую изменчивость между устройствами, а также изменчивость, обусловленную степенью кристалличности, предпочтительной ориентацией, полученной поверхностью образца и другими факторами, известными специалистам в данной области техники, и должны рассматриваться только как качественный показатель. Для DSC изменение в отношении наблюдаемых значений температуры будет зависеть от скорости изменения температуры, а также способа получения образца и конкретного используемого прибора. Таким образом, значения эндотермы/точки плавления, о которых сообщается в данном документе в отношении термограмм DSC/TGA, могут изменяться на ±2°C (и также считаются характерными для конкретной кристаллической формы, описанной в данном документе). В случае использования в контексте других признаков, таких как, например, процент по весу (% по весу), термин "приблизительно" указывает изменение на ± 3%.
Используемый в данном документе термин "полиморф" относится к кристаллическим формам, характеризующимся аналогичным химическим составом, но различными расположениями в пространстве молекул, атомов и/или ионов, образующих кристалл.
Используемый в данном документе термин "аморфный" относится к твердой форме молекулы, атома и/или ионов, которая не является кристаллической. Аморфные твердые вещества не демонстрируют определенную дифракционную рентгенограмму.
Используемое в данном документе выражение "по сути чистая фаза", в случае использования в отношении любой кристаллической формы соединения формулы I, означает соединение, характеризующееся чистотой фазы, составляющей более чем приблизительно 90% по весу, в том числе более чем приблизительно 90, 91, 92, 93, 94, 95, 96, 97, 98 и приблизительно 99% по весу, а также в том числе равной приблизительно 100% по весу соединения формулы I, в пересчете на вес соединения на безводной основе. Термин "чистая фаза" или "чистота фазы" в данном документе относится к однородности фазы в отношении конкретной твердой формы соединения формулы I и не подразумевает обязательно высокую степень химической чистоты при отсутствии прямого указания на это. Чистота фазы может быть определена в соответствии со способами, известными из уровня техники, например, с применением XRPD, для выполнения количественного фазового анализа с применением одного или нескольких подходов, известных из уровня техники, например, с помощью способа внешнего стандарта, прямых сопоставлений линейных (пиковых) характеристик, которые относятся к различным фазам в конкретных спектрах, или с помощью способа внутреннего стандарта. Однако количественное определение чистоты фазы с помощью XRPD может быть осложнено присутствием аморфного вещества. Соответственно, другие способы, которые можно применять для определения чистоты фазы, включают, например, ЯМР-спектроскопию твердого тела, спектроскопию комбинационного рассеяния и/или инфракрасную спектроскопию. Специалист в данной области техники сможет легко понять такие способы и то, как применять такие дополнительные (или альтернативные) способы для определения чистоты фазы.
Используемое в данном документе выражение "по сути химически чистый", в случае использования в отношении любой кристаллической формы соединения формулы I, означает соединение, характеризующееся химической чистотой, составляющей более чем приблизительно 90% по весу, в том числе более чем приблизительно 90, 91, 92, 93, 94, 95, 96, 97, 98 и приблизительно 99% по весу, а также в том числе равное приблизительно 100% по весу соединения формулы I, в пересчете на вес соли (на безводной основе). Оставшееся вещество в общем содержит другие соединения, такие как, например, другие стереоизомеры соединения формулы I, примеси, образующиеся в результате реакции, исходные вещества, реагенты, побочные продукты и/или другие примеси, образующиеся в результате обработки, возникающие в результате получения, и/или выделения, и/или очистки конкретной кристаллической формы. Например, кристаллическая форма соединения формулы I может считаться по сути химически чистой, если было определено, что она характеризуется химической чистотой, составляющей более чем приблизительно 90% по весу, измеренной посредством стандартных и общепринятых способов, известных из уровня техники, где оставшуюся часть менее чем приблизительно 10% по весу составляют другие вещества, такие как другие стереоизомеры соединения формулы I, примеси, образующиеся в результате реакции, исходные вещества, реагенты, побочные продукты и/или примеси, образующиеся в результате обработки. Химическая чистота может быть определена в соответствии со способами, известными из уровня техники, например, с помощью высокоэффективной жидкостной хроматографии (HPLC), LC-MS (жидкостной хроматографии с масс-спектрометрией), спектроскопии ядерного магнитного резонанса (ЯМР) или инфракрасной спектроскопии. Специалист в данной области техники сможет легко понять такие способы и то, как применять такие дополнительные (или альтернативные) способы для определения химической чистоты.
Термин "терапевтически эффективное количество" соединения по настоящему изобретению относится к количеству соединения по настоящему изобретению, которое будет вызывать биологический или медицинский ответ у субъекта, например, снижение или подавление активности фермента или белка, или уменьшать тяжесть симптомов, облегчать состояния или замедлять или сдерживать прогрессирование заболевания и т. д. В одном неограничивающем варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое при введении субъекту является эффективным в отношении (1) по меньшей мере частичного облегчения, подавления и/или снижения тяжести состояния, или нарушения, или заболевания, (i) ассоциированного с активностью TLR7 и/или TLR8 или (ii) характеризующегося активностью (нормальной или аномальной) рецепторов TLR7 и/или TLR8; или (2) снижения или подавления активности рецепторов TLR7 и/или TLR8. В другом неограничивающем варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое при введении в клетку, или ткань, или неклеточный биологический материал, или среду является эффективным в отношении по меньшей мере частичного снижения или подавления активности TLR7 и/или TLR8 или по меньшей мере частично снижения или подавления экспрессии рецепторов TLR7 и/или TLR8.
Используемый в данном документе термин "субъект" относится к животному. Предпочтительно животное является млекопитающим. Субъект относится к, например, приматам (например, людям), коровам, овцам, козам, лошадям, собакам, котам, кроликам, крысам, мышам, рыбам, птицам и т. п. В предпочтительном варианте осуществления субъектом является человек.
Используемые в данном документе термины в форме единственного числа и подобные термины, применяемые в контексте настоящего изобретения (в частности, в контексте формулы изобретения), следует истолковывать как охватывающие как формы единственного числа, так и формы множественного числа, если в данном документе не указано иное или нет явного противоречия по контексту.
Все способы, описанные в данном документе, можно осуществлять в любом подходящем порядке, если в данном документе не указано иное или нет иного явного противоречия по контексту. Использование всех возможных примеров или иллюстративного стиля изложения (например, "такой как"), предоставленных в данном документе, предназначено только для лучшего освещения настоящего изобретения и не предполагает ограничения объема настоящего изобретения, заявленного иным образом.
Используемые в данном документе термины "подавлять", "подавление" или "подавляющий" означают снижение или ослабление данного состояния, симптома, или нарушения, или заболевания или значительное снижение исходной активности в отношении биологической активности или процесса.
Используемые в данном документе термины "лечить", "осуществление лечения" или "лечение" любого заболевания или нарушения в одном варианте осуществления относятся к уменьшению тяжести заболевания или нарушения (т. е. замедлению, или остановке, или снижению развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечить", "осуществление лечения" или "лечение" относятся к облегчению или уменьшению тяжести по меньшей мере одного физического параметра, в том числе таких, которые могут быть неявными для пациента. В еще одном варианте осуществления "лечить", "осуществление лечения" или "лечение" относится к модулированию заболевания или нарушения физическим путем (например, путем стабилизации явного симптома) либо физиологическим путем (например, путем стабилизации физического параметра) или с помощью того и другого. В одном варианте осуществления "лечить" или "лечение" относится к задержке прогрессирования заболевания или нарушения.
Используемый в данном документе термин "предупреждать", "осуществление предупреждения" или "предупреждение" любого заболевания или нарушения означает профилактическое лечение заболевания или нарушения или задержку возникновения заболевания или нарушения.
Термин "аутоиммунное заболевание" или "аутоиммунное нарушение", используемый в данном документе, относится к заболеваниям, где клетки неконтролируемо атакуют собственные ткани и органы организма (аутоиммунная реакция), вызывая воспалительные реакции и другие серьезные симптомы и заболевания. Неограничивающие примеры аутоиммунных заболеваний включают идиопатическую тромбоцитопеническую пурпуру, гемолитическую анемию, системную красную волчанку, кожную волчанку, дискоидную волчанку, ревматоидный артрит (RA), рассеянный склероз (MS), системный склероз, иммуноопосредованный или 1-го типа сахарный диабет, иммуноопосредованный гломерулонефрит, склеродермию, пернициозную анемию, алопецию, пузырчатку, обыкновенную пузырчатку, миастению гравис, воспалительные заболевания кишечника, болезнь Крона, болезнь Грейвcа, псориаз, аутоиммунные заболевания щитовидной железы, болезнь Хашимото, тиреоидит Хашимото, полимиозит, дерматомиозит, CREST-синдром, синдром Гудпасчера, смешанное заболевание соединительной ткани, псевдопаралитическую миастению гравис, симпатическую офтальмию, факогенный увеит, хронический агрессивный гепатит, первичный билиарный цирроз, аутоиммунную гемолитическую анемию, болезнь Верльгофа, обыкновенное витилиго, болезнь Бехчета, коллагеновое заболевание, увеит, синдром Шегрена, аутоиммунный миокардит, аутоиммунные заболевания печени, аутоиммунный гастрит, пузырчатку, синдром Гийена-Барре, атеросклероз, воспалительное заболевание кишечника, анкилозирующий спондилит, идиопатическую тромбоцитопению, нодозный полиартериит, первичный билиарный склероз, саркоидоз, склерозирующий холангит, артериит Такаясу, темпоральный артериит, гранулематоз Вегенера и HTLV-1-ассоциированную миелопатию.
Используемый в данном документе термин "комбинация" относится либо к фиксированной комбинации в одной единичной лекарственной форме, либо к комбинированному введению, где кристаллическая форма соединения формулы I и партнер по комбинации (т.е. иммунотерапевтическое средство) могут быть введены независимо в одно и то же время или по отдельности через промежутки времени, в частности, когда данные промежутки времени дают возможность партнерам по комбинации демонстрировать кооперативный, например, синергетический, эффект. Отдельные компоненты могут быть упакованы в набор или находиться по отдельности. Один или оба компонента (например, порошки или жидкости) могут быть восстановлены или разбавлены до требуемой дозы перед введением.
Термины "совместное введение" или "комбинированное введение" или им подобные, используемые в данном документе, понимаются как охватывающие введение выбранного партнера по комбинации одному субъекту, нуждающемуся в этом (например, пациенту), и предполагают включение схем лечения, в которых средства необязательно вводят тем же путем введения или в то же время.
Используемые в данном документе термины "фармацевтическая комбинация" и "комбинированный продукт" используются взаимозаменяемо и относятся либо к фиксированной комбинации в одной единичной лекарственной форме, либо к нефиксированной комбинации или набору из частей для комбинированного введения, где два или более терапевтических средств могут вводиться независимо в одно и то же время или по отдельности в пределах временных интервалов, в частности, когда такие временные интервалы обеспечивают возможность демонстрации кооперативного, например, синергетического, эффекта партнеров по комбинации. Термин "фиксированная комбинация" означает, что как кристаллическая форма соединения формулы I, так и партнер по комбинации (т.е. иммунотерапевтическое средство) вводятся пациенту одновременно в форме единого объекта или дозы. Термин "нефиксированная комбинация" означает, что как кристаллическая форма соединения формулы I, так и партнер по комбинации (т.е. иммунотерапевтическое средство) вводятся пациенту в виде отдельных объектов либо одновременно, параллельно, либо последовательно без конкретных ограничений по времени, при этом такое введение обеспечивает эффективные терапевтические уровни двух соединений в организме пациента. Последнее также применяется в отношении "коктейльной терапии", например, введения трех или более терапевтических средств. В предпочтительном варианте осуществления фармацевтическая комбинация представляет собой нефиксированную комбинацию.
Термин "комбинированная терапия" относится к введению двух или более терапевтических средств для лечения аутоиммунного нарушения, описанного в настоящем изобретении. Такое введение охватывает совместное введение этих терапевтических средств по сути одновременно, например, в одной капсуле, имеющей фиксированное соотношение активных ингредиентов. В качестве альтернативы, такое введение охватывает совместное введение в нескольких или в отдельных контейнерах (например, в таблетках, капсулах, порошках и жидкостях) для каждого активного ингредиента. Порошки и/или жидкости могут быть восстановлены или разбавлены до требуемой дозы перед введением. Кроме того, такое введение также охватывает применение каждого типа терапевтического средства последовательным образом, либо приблизительно в одно и то же время, либо в различное время. В любом случае схема лечения будет обеспечивать полезные эффекты комбинации лекарственных средств при лечении состояний или нарушений, описанных в данном документе.
Фармацевтическая композиция, комбинация, доза и введение
В некоторых вариантах осуществления кристаллические формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, описанные в данном документе, могут использоваться отдельно или они могут быть составлены в фармацевтическую композицию, которая также содержит по меньшей мере одно фармацевтически приемлемое вспомогательное вещество и зачастую содержит по меньшей мере два или более фармацевтически приемлемых вспомогательных веществ. Некоторые подходящие вспомогательные вещества раскрыты в данном документе. Могут применяться другие вспомогательные вещества, которые известны из уровня техники, без отступления от сути и объема данной заявки.
В некоторых вариантах осуществления в настоящем изобретении применяют фармацевтическую композицию, содержащую соединение по настоящему изобретению и фармацевтически приемлемое вспомогательное вещество. Фармацевтическая композиция может быть составлена для конкретных путей введения, таких как пероральное введение, парентеральное введение и ректальное введение и т. д. Кроме того, фармацевтические композиции по настоящему изобретению можно получать в твердой форме (в том числе без ограничения в капсулах, таблетках, пилюлях, гранулах, порошках или суппозиториях) или в жидкой форме (в том числе без ограничения в растворах, суспензиях или эмульсиях). Фармацевтические композиции можно подвергать традиционным фармацевтическим технологическим операциям, таким как стерилизация, и/или они могут содержать традиционные инертные разбавители, смазывающие средства, носители или буферные средства, а также вспомогательные средства, такие как растворители, консерванты, стабилизаторы, смачивающие средства, эмульгаторы и объемообразующие средства и т.д.
Как правило, фармацевтические композиции представляют собой таблетки или капсулы, содержащие активный ингредиент вместе с по меньшей мере одним вспомогательным веществом, например:
a) разбавителями, например, лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой и/или глицином;
b) смазывающими веществами, например, диоксидом кремния, тальком, стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем; в случае таблеток также со
c) связующими средствами, например, алюмосиликатом магния, крахмальной пастой, желатином, трагакантом, метилцеллюлозой, натрий-карбоксиметилцеллюлозой и/или поливинилпирролидоном; при необходимости;
d) носителями, такими как водная среда-носитель, содержащая совместно растворяющееся вещество, такое как каптизол, PEG, глицерин, циклодекстрин или т. п.;
e) разрыхлителями, например, видами крахмала, агаром, альгиновой кислотой или ее натриевой солью или шипучими смесями; и/или
f) абсорбентами, красящими веществами, ароматизаторами и подсластителями.
Таблетки могут быть либо покрыты пленочной оболочкой, либо покрыты кишечнорастворимой оболочкой в соответствии со способами, известными из уровня техники.
Предпочтительно соединение или композицию получают для перорального введения, например, в виде таблетки или, например, капсулы, и необязательно упаковывают в форме нескольких доз, подходящей для хранения и/или распределения однократных доз фармацевтического продукта. Примеры подходящей упаковки включают без ограничения герметично закрытые виды фольги, контейнеры с однократной дозой (например, флаконы), блистерные упаковки и контурные безъячейковые упаковки.
Таблетки могут содержать активный ингредиент в смеси с нетоксичными, фармацевтически приемлемыми вспомогательными веществами, которые являются подходящими для изготовления таблеток. Такие вспомогательные вещества представляют собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и разрыхляющие средства, например кукурузный крахмал или альгиновая кислота; связующие средства, например крахмал, желатин или аравийская камедь; и смазывающие средства, например стеарат магния, стеариновая кислота или тальк. Таблетки являются непокрытыми или покрытыми посредством известных методик для замедления распада и абсорбции в желудочно-кишечном тракте и тем самым обеспечения устойчивого действия в течение более длительного периода. Например, можно применять материал для обеспечения замедленного действия, такой как глицерилмоностеарат или глицерилдистеарат. Составы для перорального применения могут быть представлены в виде твердых желатиновых капсул, где активный ингредиент смешивают с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент смешивают с водой или масляной средой, например, с арахисовым маслом, жидким парафином или оливковым маслом.
В настоящем изобретении дополнительно предусмотрены безводные фармацевтические композиции и лекарственные формы, содержащие соединения по настоящему изобретению в качестве активных ингредиентов, поскольку вода может содействовать разрушению некоторых соединений.
Безводные фармацевтические композиции и лекарственные формы по настоящему изобретению можно получать с применением безводных ингредиентов или ингредиентов с низким содержанием влаги и условий с низким содержанием влаги или низкой влажностью. Безводную фармацевтическую композицию можно получать и хранить таким образом, чтобы сохранялась ее безводная природа. Соответственно, безводные композиции предпочтительно упаковывают с применением материалов, которые, как известно, предотвращают воздействие воды, так чтобы их можно было включать в подходящие рецептурные наборы. Примеры подходящей упаковки включают без ограничения герметично закрытые виды фольги, пластиковые материалы, контейнеры с однократной дозой (например флаконы), блистерные упаковки и контурные безъячейковые упаковки.
В настоящем изобретении дополнительно предусмотрены фармацевтические композиции и лекарственные формы, которые содержат одно или несколько средств, которые снижают скорость, с которой соединение по настоящему изобретению в качестве активного ингредиента будет распадаться. Такие средства, которые упоминаются в данном документе как "стабилизаторы", включают без ограничения антиоксиданты, такие как аскорбиновая кислота, буферы для регулирования pH или солевые буферы и т.д.
Фармацевтическая композиция или комбинация по настоящему изобретению может быть представлена в однократной дозировке, составляющей приблизительно 1-1000 мг активного (активных) ингредиента(ингредиентов) для субъекта весом приблизительно 50-70 кг, или приблизительно 1-500 мг, или приблизительно 1-250 мг, или приблизительно 1-150 мг, или приблизительно 0,5-100 мг, или приблизительно 1-50 мг активных ингредиентов. Терапевтически эффективная доза соединения, фармацевтической композиции или их комбинаций зависит от вида субъекта, веса тела, возраста и индивидуального состояния, нарушения или заболевания, лечение которых осуществляют, или их тяжести. Квалифицированный лечащий врач, клиницист или ветеринар может легко определить эффективное количество каждого из активных ингредиентов, необходимое для предупреждения, лечения или подавления прогрессирования нарушения или заболевания.
Вышеупомянутые параметры дозировки являются очевидными в тестах in vitro и in vivo с применением преимущественно млекопитающих, например, мышей, крыс, собак, нечеловекообразных обезьян или выделенных органов, тканей и их препаратов. Соединения по настоящему изобретению можно применять in vitro в виде растворов, например, предпочтительно водных растворов, и in vivo либо энтерально, либо парентерально, преимущественно внутривенно, например, в виде суспензии или водного раствора. Доза in vitro может находиться в диапазоне молярной концентрации от приблизительно 10-3 моль/л до 10-9 моль/л. Терапевтически эффективное количество in vivo в зависимости от пути введения может находиться в диапазоне приблизительно 0,1-500 мг/кг или приблизительно 1-100 мг/кг.
В других вариантах осуществления предусмотрена фармацевтическая композиция, которая содержит по меньшей мере одно соединение в соответствии с вариантами осуществления выше и по меньшей мере один носитель.
Кристаллические формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, описанные в данном документе, также являются применимыми в качестве активных фармацевтических ингредиентов (API), а также материалов для получения составов, которые включают одно или несколько фармацевтически приемлемых вспомогательных веществ и являются подходящими для введения субъектам-людям.
Используемый в данном документе термин "фармацевтически приемлемые вспомогательные вещества" включает все без исключения растворители, носители, разбавители, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные средства, противогрибковые средства, антиоксиданты), средства для обеспечения изотоничности, замедляющие абсорбцию средства, соли, стабилизаторы лекарственных средств, связующие средства, добавки, объемообразующие средства, разрыхляющие средства, смазывающие вещества, подслащивающие средства, ароматизирующие средства, красители и т.п. и их комбинации, которые будут известны специалистам в данной области техники (см., например, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). Следует понимать, что если традиционное вспомогательное вещество является несовместимым с активным ингредиентом, то данной заявкой предусмотрено применение любого традиционного вспомогательного вещества в любых терапевтических или фармацевтических композициях.
Соответственно, в одном варианте осуществления настоящего изобретения предусмотрена кристаллическая форма (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (форма A или форма HA) в форме по сути чистой фазы. Данная кристаллическая форма (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида (форма A или форма HA) в форме по сути чистой фазы может применяться для получения фармацевтических композиций, которые могут дополнительно содержать одно или несколько фармацевтически приемлемых вспомогательных веществ. В некоторых вариантах осуществления кристаллическая форма (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида может не сохранять свою кристалличность в фармацевтической композиции. Например, в некоторых вариантах осуществления кристаллическая форма A или HA может применяться в способе получения фармацевтической композиции, который, например, включает распылительное высушивание или влажную грануляцию; таким образом возможно, что в полученной фармацевтической композиции будет выявлено небольшое количество кристаллической формы A или HA или она не будет выявлена.
Терапевтические наборы
В одном варианте осуществления в настоящем изобретении предусмотрен набор, содержащий две или более отдельных фармацевтических композиций, по меньшей мере одна из которых содержит кристаллическую форму соединения формулы (I) (форму A или форму HA). В одном варианте осуществления набор содержит средства для раздельного содержания указанных композиций, такие как контейнер, разделенная бутылка или разделенный пакет из фольги. Примером такого набора является блистерная упаковка, как правило, применяемая для упаковки таблеток, капсул и т.п.
Набор по настоящему изобретению можно применять для введения различных лекарственных форм, например, для перорального и парентерального применения, для введения отдельных композиций с различными интервалами между введениями доз или для титрования отдельных композиций одна относительно другой. В целях содействия соблюдению режима лечения набор по настоящему изобретению, как правило, содержит инструкции по введению.
В видах комбинированной терапии по настоящему изобретению кристаллическая форма соединения формулы (I) (т.е. форма A или форма HA) и другое терапевтическое средство могут быть изготовлены и/или составлены одним и тем же или разными производителями. Более того, кристаллическую форму соединения формулы (I) и другое терапевтическое средство можно объединять в средстве комбинированной терапии: (i) до того, как комбинированный продукт попадает к врачам (например, в случае набора, содержащего кристаллическую форму соединения формулы (I) и другое терапевтическое средство); (ii) самими врачами (или под наблюдением врача) незадолго до введения; (iii) у самих пациентов, например, во время последовательного введения кристаллической формы соединения формулы (I) и другого терапевтического средства.
Соответственно, в настоящем изобретении предусмотрено применение кристаллической формы, описанной в данном документе (т.е. формы A или формы HA), для лечения аутоиммунных заболеваний, где лекарственный препарат получен для введения с другим терапевтическим средством. В настоящем изобретении также предусмотрено применение терапевтического средства для лечения аутоиммунных заболеваний, где лекарственный препарат вводят с кристаллической формой соединения формулы (I).
В настоящем изобретении также предусмотрена кристаллическая форма соединения формулы (I) (т.е. форма A или форма HA) для применения в способе лечения аутоиммунных заболеваний, где кристаллическая форма соединения формулы (I) получена для введения с другим терапевтическим средством. В настоящем изобретении также предусмотрено другое иммунотерапевтическое средство для применения в способе лечения аутоиммунных заболеваний, где другое терапевтическое средство получено для введения с кристаллической формой соединения формулы (I). В настоящем изобретении также предусмотрена кристаллическая форма соединения формулы (I) для применения в способе лечения аутоиммунных заболеваний, где кристаллическая форма соединения формулы (I) вводится с другим терапевтическим средством. В настоящем изобретении также предусмотрено другое терапевтическое средство для применения в способе лечения аутоиммунных заболеваний, где другое терапевтическое средство вводится с кристаллической формой соединения формулы (I).
В настоящем изобретении также предусмотрено применение кристаллической формы соединения формулы (I) для лечения аутоиммунных заболеваний, где пациент ранее (например, в течение 24 часов) подвергался лечению с помощью другого терапевтического средства. В настоящем изобретении также предусмотрено применение другого терапевтического средства для лечения аутоиммунных заболеваний, где пациент ранее (например, в течение 24 часов) подвергался лечению с помощью кристаллической формы соединения формулы (I).
Комбинация
Дополнительные терапевтические средства, применяемые в комбинации с кристаллической формой по настоящему изобретению, включают без ограничения противовоспалительные средства, иммуномодулирующие средства, иммунодепрессивные средства, цитокины, нестероидные противовоспалительные лекарственные средства (NSAID), противомалярийные соединения, противоревматические соединения, ингибиторы фактора активации B-клеток (BAFF), ингибиторы стимулятора B-лимфоцитов (BLyS) и стероидные гормоны.
Нестероидные противовоспалительные лекарственные средства (NSAID), применяемые в комбинации с соединениями по настоящему изобретению, включают без ограничения салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, этодолак, мефенаминовую кислоту, меклофенамат натрия, толметин, кеторолак, диклофенак, ибупрофен, напроксен, напроксен натрий, фенопрофен, кетопрофен, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, набуметон, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон и нимесулид.
Противоревматическое соединение, применяемое в комбинации с соединениями по настоящему изобретению, включает без ограничения метотрексат.
Противомалярийное соединение, применяемое в комбинации с соединениями по настоящему изобретению, включает без ограничения хлорохин и гидроксихлорохин.
Ингибиторы фактора активации B-клеток (BAFF), также известные как ингибиторы стимулятора B-лимфоцитов (BLyS), применяемые в комбинации с соединениями по настоящему изобретению, включают без ограничения белимумаб (Benlysta®), блисибимод и BR3-Fc.
Иммунодепрессивные средства, применяемые в комбинации с соединениями по настоящему изобретению, включают без ограничения микофенолата мофетил (MMF), микофеноловую кислоту, циклофосфамид, азатиоприн и лаквинимод (5-хлор-N-этил-4-гидрокси-1-метил-2-оксо-N-фенил-1,2-дигидрохинолин-3-карбоксамид).
Стероидные гормоны, применяемые в комбинации с соединениями по настоящему изобретению, включают без ограничения дегидроэпиандростерон (DHEA).
Получение кристаллической формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида
Кристаллические формы можно получать различными способами, включая, например, кристаллизацию или перекристаллизацию из подходящего растворителя, сублимацию, выращивание из расплава, превращение в твердом состоянии из другой фазы, кристаллизацию из сверхкритической жидкости и струйное распыление. Методы кристаллизации или перекристаллизации кристаллических форм из смеси растворителей включают, например, выпаривание растворителя, снижение температуры смеси растворителей, затравку кристаллами перенасыщенного раствора молекулы и/или соли в смеси растворителей, сублимационную сушку смеси растворителей и добавление антирастворителей (противорастворителей) в смесь растворителей. Иллюстративные способы получения кристаллических форм, описанных в данном документе, подробно представлены ниже.
Кристаллы лекарственных средств, в том числе полиморфы, способы получения и описание характеристик кристаллов лекарственных средств рассмотрены в Solid-State Chemistry of Drugs, S.R. Byrn, R.R. Pfeiffer, and J.G. Stowell, 2nd Edition, SSCI, West Lafayette, Indiana (1999).
В случае методик кристаллизации, в которых используются растворители, выбор растворителя или растворителей обычно зависит от одного или нескольких факторов, таких как растворимость соединения, методика кристаллизации и давление паров растворителя. Можно применять комбинации растворителей, например, соединение можно солюбилизировать в первом растворителе для получения раствора с последующим добавлением антирастворителя для уменьшения растворимости соединения в растворе для обеспечения образования кристаллов. Антирастворитель представляет собой растворитель, в котором соединение характеризуется низкой растворимостью.
В одном способе получения кристаллов соединение суспендируют и/или перемешивают в подходящем растворителе с получением взвеси, которую можно нагревать для обеспечения растворения. Используемый в данном документе термин "взвесь" означает насыщенный раствор соединения, который также может содержать дополнительное количество соединения для получения гетерогенной смеси соединения и растворителя при данной температуре. Данное также может называться суспензией.
Для обеспечения кристаллизации в любую кристаллизационную смесь можно добавлять затравочные кристаллы. Введение затравки можно использовать для регулирования роста конкретного полиморфа или для регулирования распределения частиц кристаллического продукта по размеру. Соответственно, расчет необходимого количества затравочных кристаллов зависит от размера доступного затравочного кристалла и необходимого размера средней частицы продукта, как описано, например, в "Programmed Cooling of Batch Crystallizers," J.W. Mullin and J. Nyvlt, Chemical Engineering Science, 1971,26, 369-377. Как правило, затравочные кристаллы малого размера необходимы для эффективного регулирования роста кристаллов в партии. Затравочный кристалл малого размера может быть получен путем просеивания, размалывания или микронизации крупных кристаллов, или путем микрокристаллизации растворов. Следует обращать внимание, чтобы размалывание или микронизация кристаллов не приводили к какому-либо изменению кристаллической формы необходимой формы кристалла (т.е. к изменению в аморфное состояние или в другой полиморф).
Охлажденную кристаллизационную смесь можно фильтровать под вакуумом, и выделенный твердые вещества можно промывать с помощью подходящего растворителя, такого как холодный растворитель для перекристаллизации, и высушивать при продувании азотом с получением необходимой кристаллической формы. Выделенные твердые вещества можно анализировать с помощью подходящей спектроскопической или аналитической методики, такой как ядерный магнитный резонанс твердого тела, дифференциальная сканирующая калориметрия, порошковая рентгеновская дифракция или т. п., для обеспечения образования предпочтительной кристаллической формы продукта. Как правило, полученную в результате кристаллическую форму получают в количестве, соответствующем практическому выходу, составляющему более чем приблизительно 70 вес. %, предпочтительно практическому выходу, составляющему более чем 90 вес. %, в пересчете на вес соединения, изначально используемого в процедуре кристаллизации. Продукт можно совместно измельчать или пропускать через сито для удаления при необходимости комков продукта.
В качестве альтернативы, кристаллические формы можно получать непосредственно из реакционной среды из конечного способа получения (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида. Это можно обеспечить, например, посредством использования на конечной стадии способа растворителя или смеси растворителей, из которых может быть кристаллизован (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамид. Кроме того, кристаллические формы можно получать с помощью методик перегонки или добавления растворителя.
В дополнение к способам, кратко рассмотренным ниже, следует понимать, что можно применять различные аналитические способы для определения характеристик любого из веществ, описанных в данном документе.
Следующие неограничивающие примеры иллюстрируют настоящее изобретение.
ПРИМЕРЫ
Сокращение:
DIPEA: N, N-Диизопропилэтиламин
HATU: O-(7-Азобензoтриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат
DCM: Дихлорметан
THF: Тетрагидрофуран
Пример 1. Получение кристаллической формы A
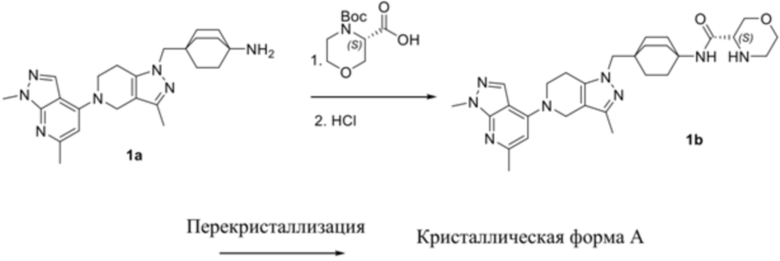
(S)-4-(трет-Бутоксикарбонил)морфолин-3-карбоновую кислоту (637 г, 2,75 моль) растворяли в THF (1,1 л), добавляли DIPEA (508 г, 3,9 моль), HATU (1097 г, 2,9 моль) и 4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-амин (1a, 1,1 кг, 2,6 моль, как описано в WO 2018/047081), смесь перемешивали до превращения желтой суспензии в желтый раствор в течение 16 ч, HPLC указала, что реакция была завершена, смесь гасили водой (7,4 кг), экстрагировали с помощью DCM (14,6 кг), слой на основе DCM промывали с помощью 0,5 M раствора HCl (5,5 кг, с полным удалением DIPEA) и насыщ. раствора NaCl (5,5 кг), отделяли слой на основе DCM.
К данному слою на основе DCM добавляли воду (5,3 кг) и 31% раствор HCl (1,2 кг). Смесь перемешивали при 35°C в течение 16 ч, HPLC указала, что реакция удаления защитной группы была завершена. Реакционную смесь охлаждали до комнатной температуры, разделяли и органический слой отбрасывали. К водной фазе добавляли DCM (14,6 кг) и при перемешивании добавляли 20% раствор NaOH (~3,2 кг) до pH >8. Органический слой отделяли и промывали с помощью 5% NaOH (5,5 кг*2, с полным удалением HPF6), затем промывали водой (5,5 кг*3), органический слой высушивали с помощью Mg2SO4 и фильтровали, затем концентрировали при пониженном давлении с получением (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида в виде свободного основания (1b).
Стадия перекристаллизации
Полученный выше материал (1b) поглощали в ацетоне (8,7 кг*3) и нагревали до внутренней температуры 50°C, затем охлаждали до 15°C в течение периода, составляющего 4 ч. Цикл нагревание/охлаждение дважды повторяли с образованием белой суспензии. Белую суспензию нагревали до 50°C, по каплям добавляли гептан (15,6 кг), суспензию перемешивали при внутренней температуре 50°C в течение 1 ч, затем охлаждали до внутренней температуры 15°C в течение периода, составляющего 4 ч. Смесь перемешивали при 15°C в течение 1 ч, фильтровали, промывали с помощью смеси ацетон/гептан (0,87 кг/1,56 кг) и высушивали при 50°C в течение 16 ч с получением 890 г белого твердого вещества. Белое твердое вещество анализировали с помощью XRPD, DSC и TGA (фиг. 1-3 соответственно).
Пример 2. Получение гидрата кристаллической формы HA
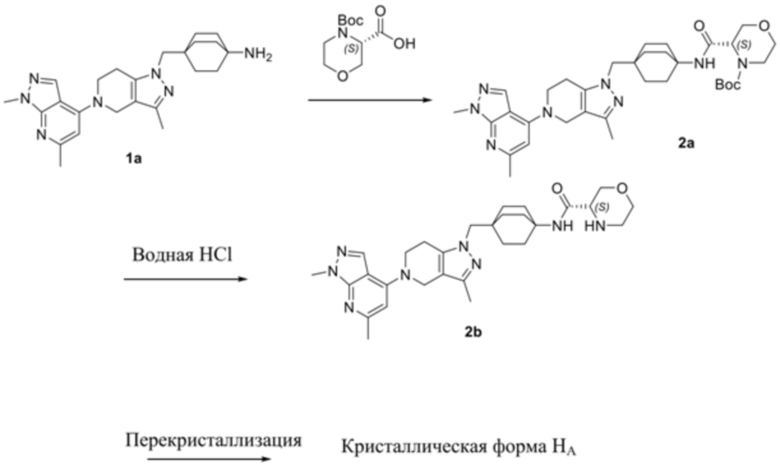
К смеси (3S)-4-(трет-бутоксикарбонил)морфолин-3-карбоновой кислоты (6,06 г, 26,2 ммоль) и 4-метилморфолина (3,62 г, 35,8 ммоль) в 125 мл дихлорметана добавляли 4-{[5-(1,6-Диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил]метил}бицикло[2.2.2]октан-1-амин (1a, 10,0 г, 23,8 ммоль, как описано в WO 2018/047081) в 25 мл дихлорметана, добавляли HATU (10,9 г, 28,6 ммоль), затем смесь перемешивали при комнатной температуре в течение 16 часов. После завершения превращения реакционную смесь промывали водным раствором гидроксида натрия и водным раствором хлорида натрия. Отделенный органический слой концентрировали и обрабатывали раствором гидрохлорида 2-пропанола в трет-бутилметиловом эфире. Полученную суспензию фильтровали и промывали трет-бутилметиловым эфиром и продукт, трет-бутил-(3S)-3-[(4-{[5-(1,6-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил]метил}бицикло[2.2.2]октан-1-ил)карбамоил]морфолин-4-карбоксилат (2a), выделяли и высушивали в виде хлористоводородной соли.
К смеси продукта, трет-бутил-(3S)-3-[(4-{[5-(1,6-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил]метил}бицикло[2.2.2]октан-1-ил)карбамоил]морфолин-4-карбоксилата (2a, 7,56 г, 11,3 ммоль), в 70 мл воды добавляли 50 мл дихлорметана, затем добавляли 31% водный раствор гидрохлорида (4,65 г, 39,5 ммоль) и смесь перемешивали при 37°C в течение 16 часов. После завершения превращения фазу на основе дихлорметана отделяли и водный слой промывали трет-бутилметиловым эфиром. Значение pH водной фазы регулировали до 7-8 с помощью 16% водного раствора гидроксида натрия, добавляли 25 мл 2-пропанола и значение pH дополнительно регулировали до 8-9 с помощью 16% водного раствора гидроксида натрия. pH смеси дополнительно регулировали до >12 с помощью 16% водного раствора гидроксида натрия. Полученную суспензию фильтровали и суспендировали в смеси 2-пропанол/вода (70 мл/5 мл), твердое вещество собирали посредством фильтрации, и промывали с помощью смеси вода/2-пропанол (50 мл/3 мл), и продукт, (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамид (2b), выделяли и высушивали в виде свободной формы.
Стадия перекристаллизации
(S)-N-(4-((5-(1,6-Диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамид (2b, описанный выше) суспендировали в смеси ацетон/вода 98: 2 (вес:вес) и нагревали до 50°C с растворением всего количества вещества. После фильтрации с получением прозрачного продукта к раствору добавляли воду с получением смеси ацетон/вода 95:5 (вес:вес). В раствор вносили затравку при 45°C. Затем суспензию охлаждали до -10°C. Продукт выделяли и промывали с помощью смеси ацетон/вода 95:5 (вес:вес), фильтровали и аккуратно высушивали под вакуумом.
Высушивание также можно осуществлять в присутствии воды.
В качестве альтернативы, (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамид (2b как описано выше) суспендировали в смеси изопропанол:вода 95: 5 (вес:вес) и нагревали до 50°C с растворением всего количества вещества. После фильтрации с получением прозрачного продукта раствор охлаждали до 25°C и в него вносили затравку. Добавляли дополнительное количество воды и охлаждали до -10°C. Продукт выделяли и аккуратно высушивали под вакуумом.
Высушивание также можно осуществлять в присутствии воды.
Другие растворители, которые можно применять в способе, описанном выше, который приводит к образованию гидрата кристаллической формы HA (всегда в сочетании с водой), представляют собой другие спирты, такие как этанол, метанол и изобутанол; THF или ацетонитрил.
Порошковая рентгеновская дифракция
Данные порошковой рентгеновской дифракции (XRPD) получали с применением Bruker Discovery D8 с детектором LynxEye. Образцы порошка помещали на Si-держатель образца без фоновых помех. Излучение представляло собой Cu Kα (l=1,5418  ). Данные собирали для 2-тета 2-40° со временем выдерживания образца по меньшей мере 300 секунд.
). Данные собирали для 2-тета 2-40° со временем выдерживания образца по меньшей мере 300 секунд.
Таблица 1
Данные порошковой рентгеновской дифракции для кристаллической формы A
Таблица 2
Данные порошковой рентгеновской дифракции для кристаллической гидратной формы HA
Термический Анализ (TA)
Кристаллические формы анализировали с применением прибора Discovery от TA instrument (DSC) и термогравиметрического анализа (TGA): Discovery (DSC) и Discovery (TGA) с алюминиевым тигелем (T150603); скорость нагревания 10°C/мин, диапазон температуры: 30-300°C.
DSC
Дифференциальную сканирующую калориметрию выполняли для каждой кристаллической формы с применением прибора от TA Instruments, модели Discovery. Для каждого анализа ячейку DSC продували с помощью 50 мл/мин сверхчистым газообразным азотом. Прибор калибровали по высокочистому индию. Скорость нагревания составляла 10°C в минуту в диапазоне температур от 30 до 300°C. Строили на графике зависимость теплового потока, который нормализировали по весу образца, от измеренной температуры образца. Значения температуры приведены в градусах Цельсия (°C), и значения энтальпии приведены в Джоулях на грамм (Дж/г). На графиках эндотермические пики показаны в направлении вниз. Эндотермический пик плавления (точка плавления) устанавливали по экстраполированной температуре начала плавления. Точность измеренной температуры образца с помощью данного способа составляет приблизительно ± 1°C, и удельная теплота плавления может быть измерена с относительной погрешностью, составляющей приблизительно ± 5%.
Иллюстративные профили DSC, полученные с применением кристаллических форм A и HA, показаны на фиг. 2 и 4, соответственно.
Форма A: эндотерма плавления: Tначала=182,7oC, ΔH=65 Дж/г
Форма HA: эндотерма плавления: Tначала=54,2°C с энтальпией ΔH 284 Дж/г, и Tначала=130,6°C с энтальпией ΔH 24 Дж/г
TGA
Прибор от TGA instruments, применяемый для тестирования кристаллических форм, представлял собой модель Q5000 от TA Instruments. 10-20 миллиграмм образцов анализировали при скорости нагревания 10°C/мин в диапазоне температур от 25°C до 300°C при постоянном потоке 20 мл/мин сверхчистого газообразного азота. Строили график зависимости потери веса от измеренной температуры образца. Значения температуры приведены в градусах Цельсия (°C), и потеря веса приведена в %.
Иллюстративные профили TGA, полученные с применением кристаллических форм A и HA, показаны на фиг. 3 и 6, соответственно.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ В КАЧЕСТВЕ ИНГИБИТОРОВ ЭНДОСОМАЛЬНЫХ TOLL-ПОДОБНЫХ РЕЦЕПТОРОВ | 2017 |
|
RU2759678C2 |
| ПРОИЗВОДНЫЕ АМИНОПИРИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ИНГИБИТОРОВ ALK-2 | 2022 |
|
RU2803084C1 |
| ПРОИЗВОДНЫЕ АМИНОПИРИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ИНГИБИТОРОВ ALK-2 | 2017 |
|
RU2777979C2 |
| ПРОИЗВОДНЫЕ АМИНОПИРИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ИНГИБИТОРОВ ALK-2 | 2017 |
|
RU2747318C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| ПРОИЗВОДНЫЕ АМИНОПИРИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ИНГИБИТОРОВ ALK-2 | 2023 |
|
RU2826177C1 |
| СИГМА-ЛИГАНДЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРОФИЛАКТИКЕ И/ИЛИ ЛЕЧЕНИИ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ | 2011 |
|
RU2569055C2 |
| НЕГИГРОСКОПИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ МАЛЕАТНАЯ СОЛЬ 5-[(Z)-(5-ФТОР-2-ОКСО-1,2-ДИГИДРО-3H-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-N-[(2S)-2-ГИДРОКСИ-3-МОРФОЛИН-4-ИЛПРОПИЛ]-2,4-ДИМЕТИЛ-1H-ПИРРОЛ-3-КАРБОКСАМИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ РАКА | 2004 |
|
RU2319702C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ N-[4-(ХЛОРДИФТОРМЕТОКСИ)ФЕНИЛ]-6-[(3R)-3-ГИДРОКСИПИРРОЛИДИН-1-ИЛ]-5-(1H-ПИРАЗОЛ-5-ИЛ)ПИРИДИН-3-КАРБОКСАМИДА | 2020 |
|
RU2836337C2 |
| ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12 | 2011 |
|
RU2572593C2 |
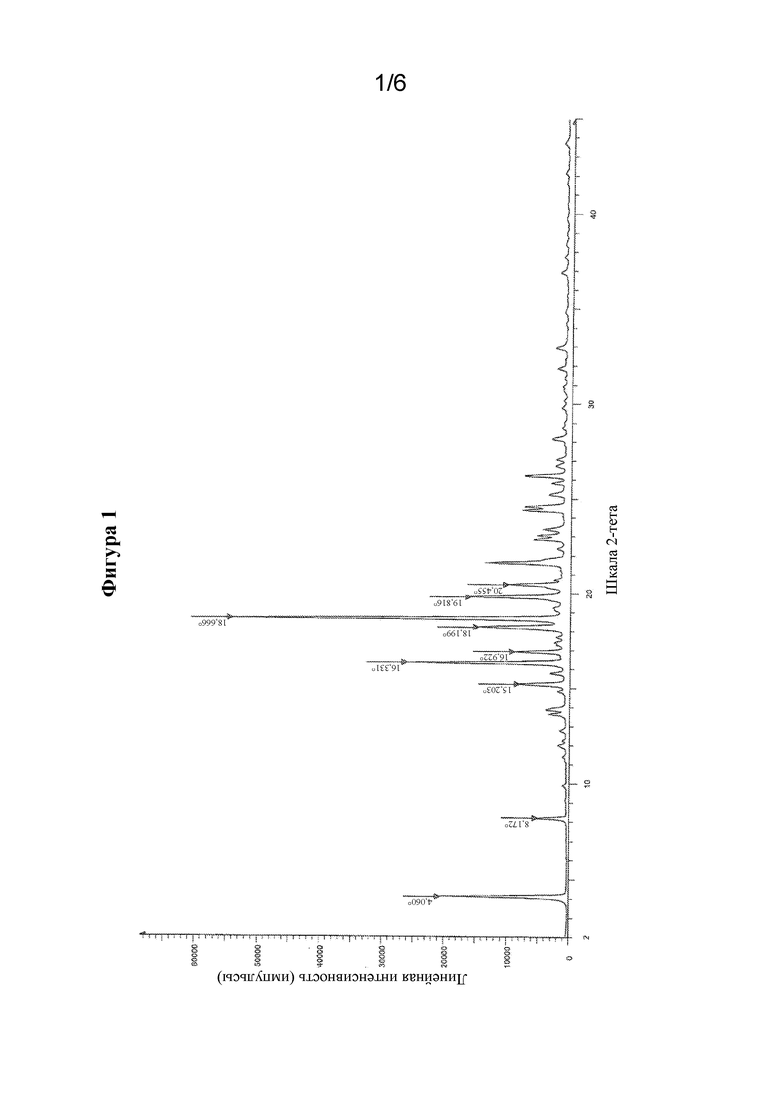
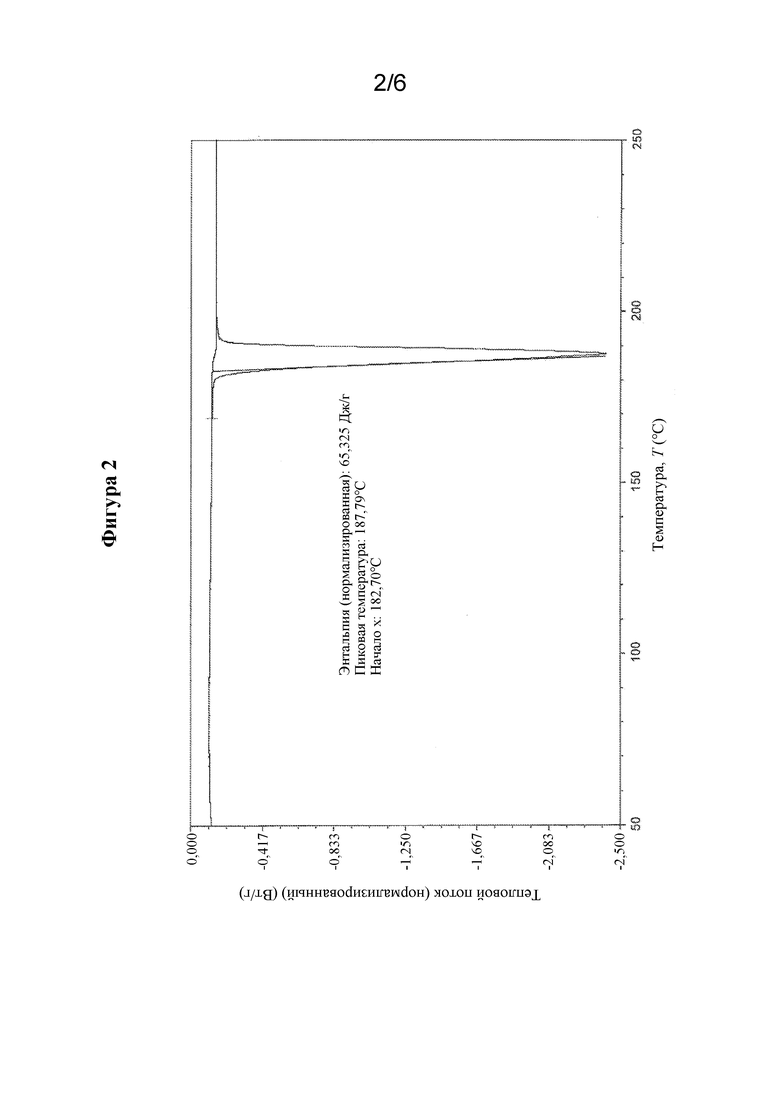
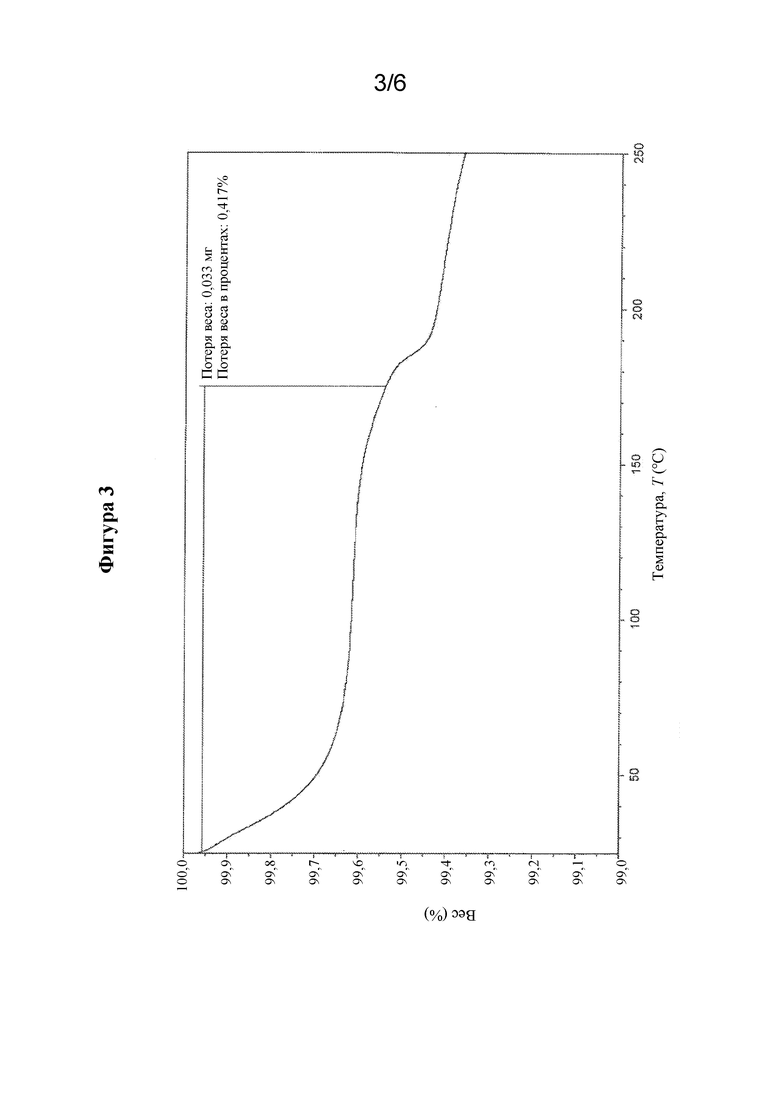
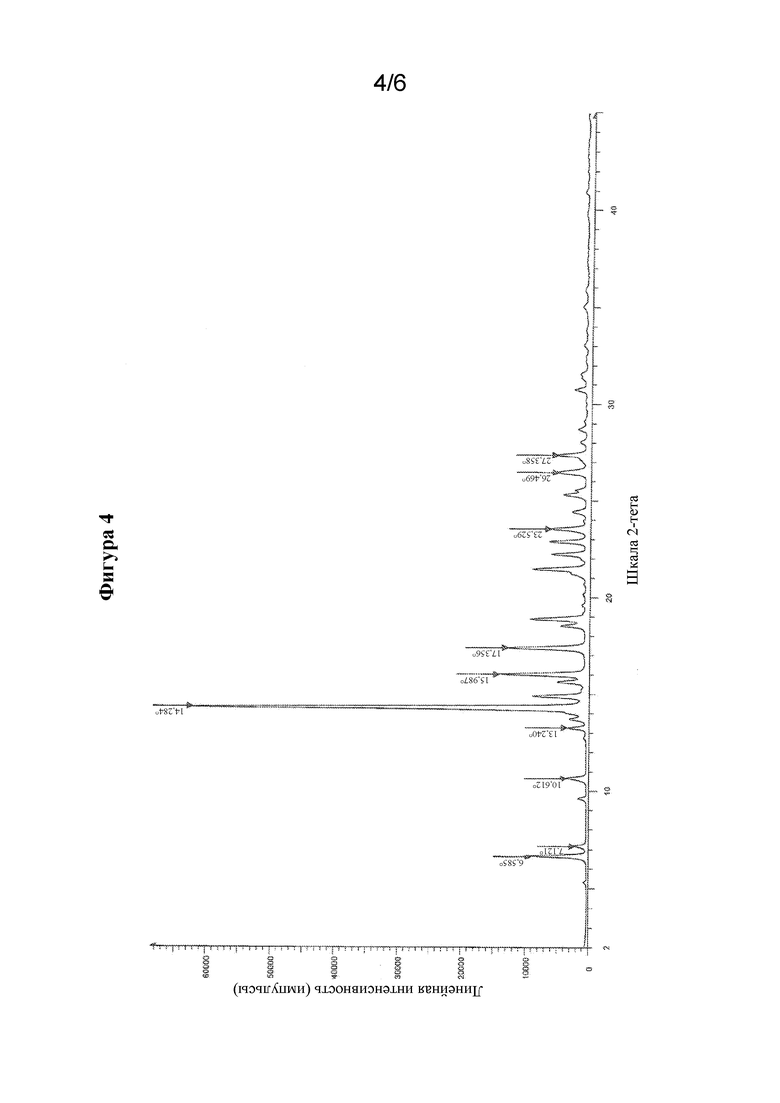
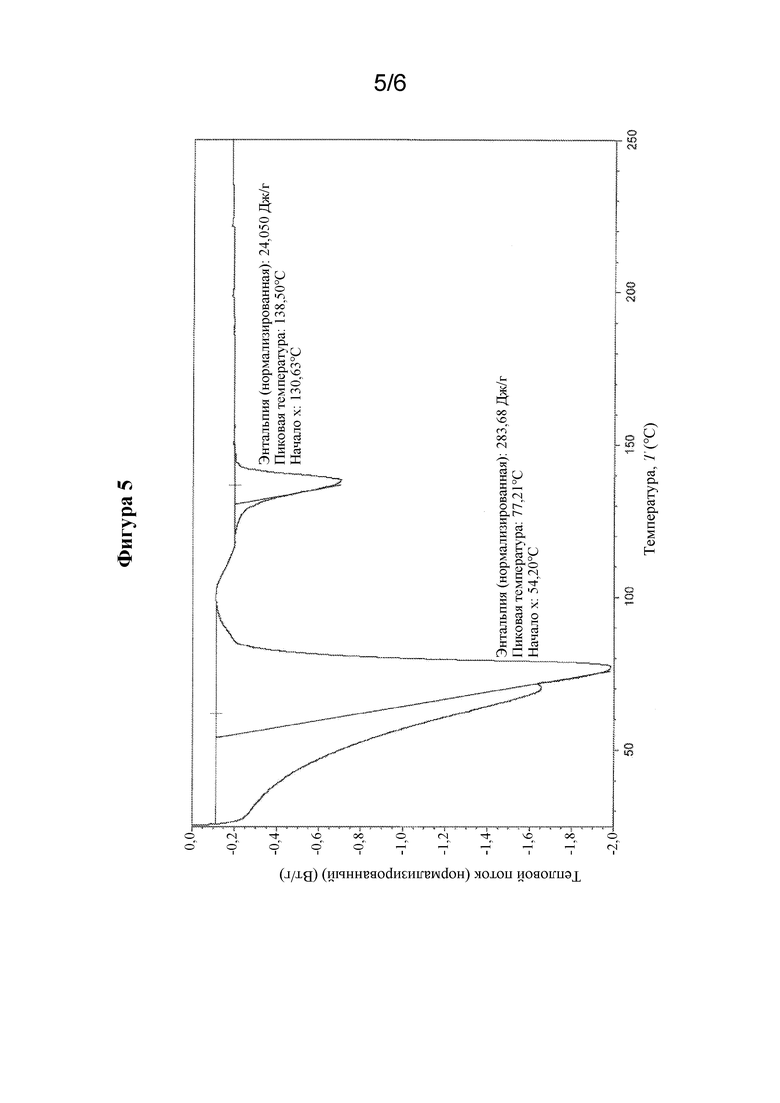
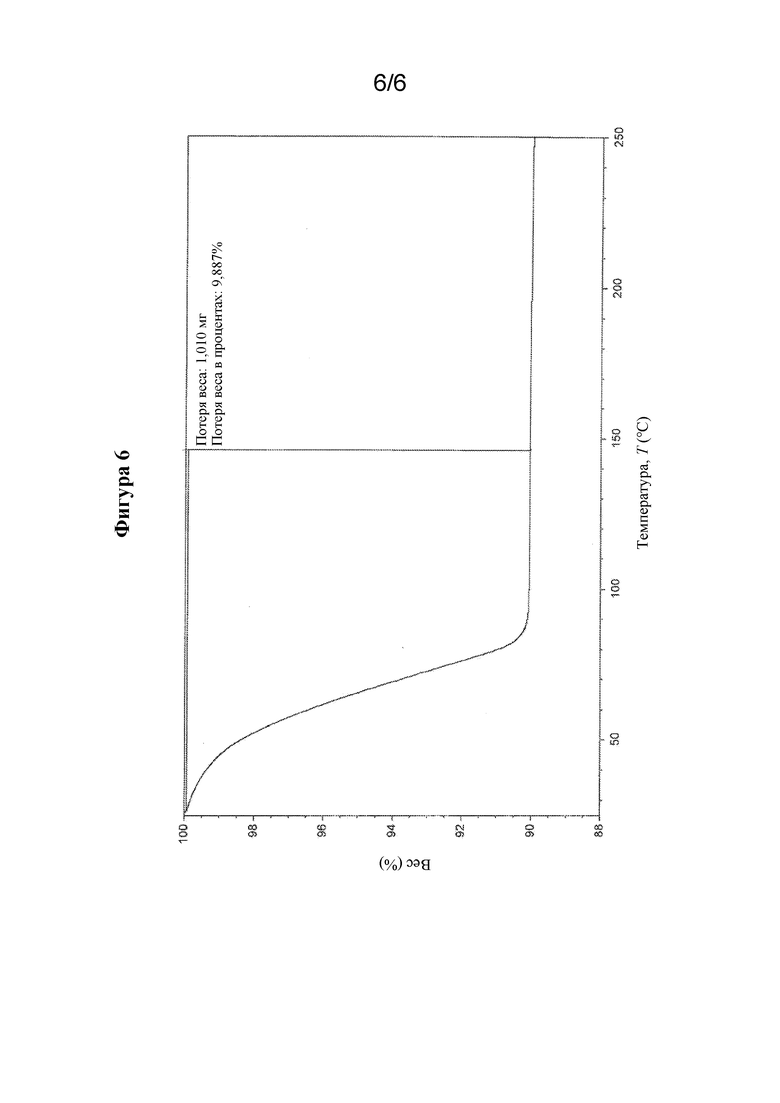
Изобретение относится к способу получения кристаллической формы соединения (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, включающий стадии: a) суспендирования аморфной свободной формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида в смеси растворителей, содержащей ацетон, этанол, метанол, изопропанол, изобутанол, тетрагидрофуран или ацетонитрил и по меньшей мере 2% по весу воды, с образованием смеси в виде суспензии, b) нагревания смеси в виде суспензии до растворения с образованием раствора, c) охлаждения раствора до -10°C с образованием суспензии, d) фильтрования суспензии со сбором кристаллической формы, где соединение представляет собой гемигептагидрат, кристаллическая форма находится в свободной форме и характеризуется одной из следующих характеристик: (i) порошковой рентгеновской дифрактограммой, содержащей характеристические пики, выраженные в 2θ, при значении °2θ, составляющем 6,6 ± 0,2, значении °2θ, составляющем 16,0 ± 0,2, и значении °2θ, составляющем 17,3 ± 0,2, измеренные при температуре, составляющей приблизительно 25°C, и при длине волны рентгеновского излучения, λ, составляющей 1,5418  ; (ii) порошковой рентгеновской дифрактограммой, содержащей четыре или более значений 2θ, выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C, и при длине волны рентгеновского излучения, λ, составляющей 1,5418
; (ii) порошковой рентгеновской дифрактограммой, содержащей четыре или более значений 2θ, выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C, и при длине волны рентгеновского излучения, λ, составляющей 1,5418  ; и (iii) порошковой рентгеновской дифрактограммой, содержащей пять или более значений 2θ, выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2, измеренных при температуре, составляющей приблизительно 25°C, и при длине волны рентгеновского излучения, λ, составляющей 1,5418
; и (iii) порошковой рентгеновской дифрактограммой, содержащей пять или более значений 2θ, выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2, измеренных при температуре, составляющей приблизительно 25°C, и при длине волны рентгеновского излучения, λ, составляющей 1,5418  . Технический результат: разработан новый способ получения кристаллической формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил) бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, который является применимым в лечении различных аутоиммунных болезненных состояний, ассоциированных с активностью эндосомального Toll-подобного рецептора, выбранного из TLR7 и TLR8. Твердая форма активного фармацевтического ингредиента (API) конкретного лекарственного средства зачастую является важным определяющим фактором в отношении простоты получения лекарственного средства, гигроскопичности, устойчивости, растворимости, устойчивости при хранении, простоты составления, скорости растворения в жидкостях желудочно-кишечного тракта и биологической доступности in vivo. 2 з.п. ф-лы, 6 ил., 2 табл., 2 пр.
. Технический результат: разработан новый способ получения кристаллической формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил) бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, который является применимым в лечении различных аутоиммунных болезненных состояний, ассоциированных с активностью эндосомального Toll-подобного рецептора, выбранного из TLR7 и TLR8. Твердая форма активного фармацевтического ингредиента (API) конкретного лекарственного средства зачастую является важным определяющим фактором в отношении простоты получения лекарственного средства, гигроскопичности, устойчивости, растворимости, устойчивости при хранении, простоты составления, скорости растворения в жидкостях желудочно-кишечного тракта и биологической доступности in vivo. 2 з.п. ф-лы, 6 ил., 2 табл., 2 пр.
1. Способ получения кристаллической формы соединения (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида, включающий стадии
a) суспендирования аморфной свободной формы (S)-N-(4-((5-(1,6-диметил-1H-пиразолo[3,4-b]пиридин-4-ил)-3-метил-4,5,6,7-тетрагидро-1H-пиразолo[4,3-c]пиридин-1-ил)метил)бицикло[2.2.2]октан-1-ил)морфолин-3-карбоксамида в смеси растворителей, содержащей ацетон, этанол, метанол, изопропанол, изобутанол, тетрагидрофуран или ацетонитрил и по меньшей мере 2% по весу воды, с образованием смеси в виде суспензии,
b) нагревания смеси в виде суспензии до растворения с образованием раствора,
c) охлаждения раствора до -10°C с образованием суспензии,
d) фильтрования суспензии со сбором кристаллической формы,
где соединение представляет собой гемигептагидрат, кристаллическая форма находится в свободной форме и характеризуется одной из следующих характеристик:
(i) порошковой рентгеновской дифрактограммой, содержащей характеристические пики, выраженные в 2θ, при значении °2θ, составляющем 6,6 ± 0,2, значении °2θ, составляющем 16,0 ± 0,2, и значении °2θ, составляющем 17,3 ± 0,2, измеренные при температуре, составляющей приблизительно 25°C, и при длине волны рентгеновского излучения, λ, составляющей 1,5418  ;
;
(ii) порошковой рентгеновской дифрактограммой, содержащей четыре или более значений 2θ, выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2°, измеренных при температуре, составляющей приблизительно 25°C, и при длине волны рентгеновского излучения, λ, составляющей 1,5418  ; и
; и
(iii) порошковой рентгеновской дифрактограммой, содержащей пять или более значений 2θ, выбранных из группы, состоящей из значений °2θ, составляющих 6,6 ± 0,2°, 7,1 ± 0,2°, 10,6 ± 0,2°, 13,2 ± 0,2°, 14,3 ± 0,2°, 16,0 ± 0,2°, 17,3 ± 0,2°, 23,5 ± 0,2°, 26,5 ± 0,2° и 27,3 ± 0,2, измеренных при температуре, составляющей приблизительно 25°C, и при длине волны рентгеновского излучения, λ, составляющей 1,5418  .
.
2. Способ по п.1, где кристаллическая форма имеет термограмму дифференциальной сканирующей калориметрии (DSС), полученную при нагревании от 30 до 300°C со скоростью 10°C в минуту, которая показывает эндотермы плавления при Tначала = 54,2°C с энтальпией ΔH 284 Дж/г и при Tначала = 130,6°C с энтальпией ΔH 24 Дж/г.
3. Способ по п.1 или 2, где кристаллическая форма имеет диаграмму термогравиметрического анализа (ТGA), полученную при нагревании от 30 до 300°С со скоростью 10°С в минуту, которая показывает потерю веса 9,9% при 96°С.
| WO2018047081A1, 15.03.2018 | |||
| MINO R CAIRA, "CRYSTALLINE POLYMORPHISM OF ORGANIC COMPOUNDS", TOPICS IN CURRENT CHEMISTRY, vol | |||
| Складная решетчатая мачта | 1919 |
|
SU198A1 |
| Прибор для иллюстрации получения стоячих волн | 1931 |
|
SU29281A1 |
| СПОСОБЫ ПОЛУЧЕНИЯ ИЗОХИНОЛИНОНОВ И ТВЕРДЫЕ ФОРМЫ ИЗОХИНОЛИНОНОВ | 2012 |
|
RU2626883C2 |
Авторы
Даты
2023-03-15—Публикация
2019-05-16—Подача