Перекрестные ссылки на родственные заявки
В настоящей заявке испрашивается приоритет в связи с предварительной заявкой на выдачу патента US №62/558303, поданной 13 сентября 2017 г., и предварительной заявкой на выдачу патента US №62/572456, поданной 14 октября 2017 г.
Предпосылки создания настоящего изобретения
Атопический дерматит (AD) является распространенным хроническим и рецидивирующим, воспалительным расстройством кожи, вызванным гиперчувствительной реакцией кожи, и характеризуется интенсивным и устойчивым симптомом чесотки или зуда, которое может быть локализованным или даже генерализованным, и его нельзя облегчить расчесыванием. Другие клинические признаки включают эритему, экскориацию, отек, лихенификацию, мокнутие и патологическую сухость. Расчесывание из-за зуда может внести вклад в формирование участков ободранной, чувствительной, припухлой кожи и привести к повышенной чувствительности кожи к инфекции. Атопический дерматит также известен как диффузный дерматит или экзема, и часто наблюдается у детей.
Опосредованная иммуноглобулином Е (IgE) аллергия играет центральную роль в патофизиологии атопического дерматита и других клинических фенотипах, таких как астма и пищевая аллергия. Атопия и концентрация IgE в плазме являются генетически сложными признаками (т.е. наследуемость которых зависит от ряда генов), а конкретные генетические факторы риска, которые приводят к разрегуляции IgE и клинической атопии, являются областью активного исследования.
В фенотип атопического дерматита также включены другие гены. Ген CTNNA3 кодирует структурный кадгерин, который играет важную роль в межклеточной адгезии. CTNNA3 также играет важную роль в аллергии и астме. Сниженные уровни CTNNA3 выявлены в образцах биопсии из бронхов астматиков и обратно пропорционально коррелируются с числом эозинофилов. По данным полногеномых исследований ассоциаций (GWAS) было установлено, что варианты CTNNA3 связаны с ответной реакцией на глюкортикоидную терапию у детей с астмой.
INADL представляет собой ген, который кодирует белок с несколькими доменами PDZ, которые локализуются в плотных сочленениях и на апикальной мембране эпителиальных клеток. У пациентов с атопическим дерматитом были выявлены дефекты плотного сочленения; в частности, плотные сочленения располагаются непосредственно под роговым слоем эпидермиса и регулируют избирательную проницаемость трансклеточного пути.
Хронический зуд, включая зуд, вызванный атопическим дерматитом, представляет собой серьезную и неудовлетворенную медицинскую потребность. Считается, что ощущение зуда индуцируется, по меньшей мере частично, под действием эндогенного нейропептидного вещества Р (SP) при связывании с рецепторами NK-1R, экспрессируемыми на множестве клеток кожи.
NK-1R экспрессируется в различных тканях организма, при этом основная активность выявлена в нейрональной ткани. Взаимодействия SP и NK-1R в нейрональной ткани локально регулируют нейрогенное воспаление и путь восприятия боли через центральную нервную систему. SP и NK-1R активность также проявляется в других тканях, включая эндотелиальные клетки и иммунные клетки. Активация NK-1R природным лигандом SP включена во множество физиологических процессов, включая восприятие боли, поведенческие факторы стресса, пристрастия и процессы тошноты и рвоты. Нарушенная сверхэкспрессия SP либо в нервной ткани, либо в периферических тканях может привести к патологическим состояниям, таким как зависимость от химических веществ, тревога, тошнота/рвота и зуд. Антагонист NK-1R может обладать способностью снижать такую сверхстимуляцию NK-1R и в результате устранять патофизиологию симптомов, лежащих в основе этих состояний.
Традипитант является эффективным и селективным антагонистом рецептора нейрокинина-1, первоначально известным как VLY-686, и имеющий химические названия 2-[1-[[3,5-бис(трифторметил)фенил]метил]-5-(4-пиридинил)-1Н-1,2,3-триазол-4-yl]-3-пиридинил](2-хлорфенил)метанона и {2-[1-(3,5-бистрифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанола со следующей химической структурой:
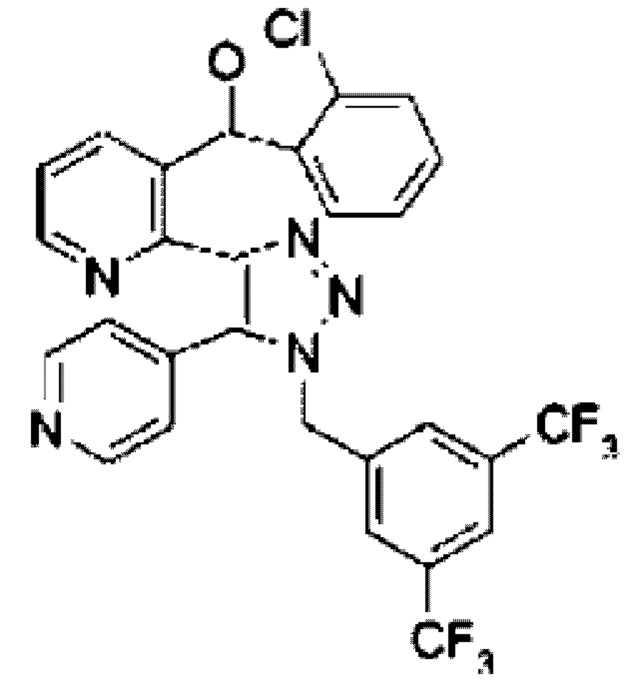
Традипитант описан в патенте US 7320994 и содержит шесть основных структурных фрагментов: остаток 3,5-бис-трифторметилфенила, два пиридиновых кольца, кольцо триазола, кольцо хлорфенила и метанон. Кристаллические формы традипитанта IV и V описаны в патенте US 7381826. Способ синтеза традипитанта описан в патентах US 8772496, US 9708291 и US 10035787.
Краткое описание сущности настоящего изобретения
Различные объекты настоящего изобретения, описанные здесь, относятся к усовершенствованным способам лечения зуда или атопического дерматита у индивидуума, нуждающегося в таком лечении, путем введения традипитанта в эффективных для такого лечения количествах. В одном таком усовершенствовании предлагается возможность выбора пациента для лечения, основанного на определении того, что генотип пациента включает генотип, который связан с высоким уровнем IgE или с положительной ответной реакцией на лечение традипитантом. В частности, в способе введения традипитанта в количестве, эффективном для лечения пациента, страдающего от зуда или атопического дерматита, одним объектом настоящего изобретения является усовершенствование, включающее выбор пациента для лечения, основанного на определении того, что генотип пациента включает генотип, который связан с высоким уровнем IgE или с положительной ответной реакцией на лечение традипитантом.
В этой связи, генотип связанный с высоким уровнем IgE, можно выбрать из группы, состоящей из: rs4575660 ТТ, rs276555 СС, rs74416548 АТАТ, rs276556 GG, rs276560 СС, rs276561 ТТ, rs276562 GG, rs276563 CC, rs276563 CC, rs276564 GG, rs276564 GG, rs276571 GG, rs140796 TATTGTATTG, rs276573 TT, rs276574 GG, rs4895474 ТТ, rs4895475 GG, rs9483989 TT, rs9373178 CC, rs4896234 CC, rs2327798 GG, rs62420823 GG, rs17252967 CC, rs9494657 AA, rs9402871 GG, rs9402872 CC, rs9399201 GG, rs4896235 AA, rs719640 AA, rs9373179 AA, rs9385784 TT, rs2146275 AA, rs6941440 TT, rs4896237 TT, rs6929580 GG, rs4896239 TT, rs4895479 CC, rs4895480 TT, rs4280975 GG, rs6911523 AA, rs6912319 GG, rs2280090 non-GG и rs57930837 non-AA.
Кроме того, генотип связанный с положительной ответной реакцией на лечение традипитантом, можно выбрать из группы, состоящей из: rs16847120 GG, rs249122 AA, rs6862796 CC, rs249137 TT, rs249138 TT, rs144713688 GAGAA, rs73258486 GG/GA, rs6480251 CC/CT, rs6480252 TT/TC, rs10822978 TT/TA, rs10997525 GG/GA, rs10997527 CC/CA, rs7074325 CC/CT, rs57930837 CC/CA, rs11453660 CACA/CAC, rs2199792 AA/AG, rs4963245 non-CC, rs12990449 non-TT, rs727162 non-CC, rs58161637 non-GG, rs62622847 non-CC, rs3213755 non-AA, rs41521946 non-TT, rs28362678 non-AA, rs35624343 non-AA, rs28362677 non-TT, rs11207832 non-CC, rs1954436 non-CC, rs11207834 non-CC, rs370530530 non-CTCT, rs11207838 non-TT, rs150980554 non-AA, rs7551886 non-CC, rs6664979 non-CC, rs12043665 non-AA, rs12030784 non-TT, rs79037385 non-GG, rs74568317 non-CC, rs3790575 non-CC и rs77939406 non-GG.
Другой объект настоящего изобретения относится к способу введения традипитанта в количестве, эффективном для лечения пациента, страдающего от зуда или атопического дерматита, который включает усовершенствование, включающее выбор пациента для такого лечения, основанный на определении того, что уровень IgE превышает или равен 50 кЕ/л. В другом варианте, такое усовершенствование применяют, если у пациента уровень IgE превышает или равен 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л. В любом случае, такие усовершенствованные способы, как описано выше, можно использовать на практике при введении внутрь такому пациенту традипитанта в дозе 100-400 мг/день или 100-300 мг/день или 100-200 мг/день. В частности, суточная доза может включать введение внутрь пациенту традипитанта в дозе 85 мг два раза в день (bid).
В настоящем изобретении также предлагается усовершенствованный способ лечения пациента, страдающего от зуда или атопического дерматита, с помощью традипитанта, включающий сначала выбор дозировки, эффективной для лечения пациента, основанный на определении того, что генотип пациента по одному или более SNP (одиночных нуклеотидных полиморфизмов) включает генотип, который связан с уровнем IgE или с положительной ответной реакцией на лечение традипитантом, и затем:
если генотип пациента связан с высоким с уровнем IgE или с положительной ответной реакцией на лечение традипитантом, то введение внутрь пациенту традипитанта в дозировке, эффективной для лечения зуда или атопического дерматита у пациента, которая была бы выбрана без идентификации генотипа пациента, и
если генотип пациента не связан с высоким с уровнем IgE или с положительной ответной реакцией на лечение традипитантом, то введение внутрь пациенту традипитанта в более высокой дозировке по сравнению с дозировкой, которая в ином случае была бы выбрана для пациента без идентификации генотипа пациента.
Вышеупомянутый способ может применяться на практике путем идентификации генотипа пациента по SNP, который связан с высоким уровнем IgE, и этот SNP выбран из группы, состоящей из: rs4575660, rs276555, rs74416548, rs276556, rs276560, rs276561, rs276562, rs276563, rs276563, rs276564, rs276564, rs276571, rs140796, rs276573, rs276574, rs4895474, rs4895475, rs9483989, rs9373178, rs4896234, rs2327798, rs62420823, rs17252967, rs9494657, rs9402871, rs9402872, rs9399201, rs4896235, rs719640, rs9373179, rs9385784, rs2146275, rs6941440, rs4896237, rs6929580, rs4896239, rs4895479, rs4895480, rs4280975, rs6911523, rs6912319, rs2280090 и rs57930837.
Например, этот способ можно применять на практике, если генотип, связанный с высоким уровнем IgE, выбран из группы, состоящей из: rs4575660 ТТ, rs276555 СС, rs74416548 АТАТ, rs276556 GG, rs276560 СС, rs276561 ТТ, rs276562 GG, rs276563 CC, rs276563 CC, rs276564 GG, rs276564 GG, rs276571 GG, rs140796 TATTGTATTG, rs276573 TT, rs276574 GG, rs4895474 TT, rs4895475 GG, rs9483989 TT, rs9373178 CC, rs4896234 CC, rs2327798 GG, rs62420823 GG, rs17252967 CC, rs9494657 AA, rs9402871 GG, rs9402872 CC, rs9399201 GG, rs4896235 AA, rs719640 AA, rs9373179 AA, rs9385784 TT, rs2146275 AA, rs6941440 TT, rs4896237 TT, rs6929580 GG, rs4896239 TT, rs4895479 CC, rs4895480 TT, rs4280975 GG, rs6911523 AA, rs6912319 GG, rs2280090 non-GG и rs57930837 non-AA.
В другом варианте, этот способ может применяться на практике путем идентификации генотипа пациента по SNP, который связан с положительной ответной реакцией на лечение традипитантом, и SNP выбран из группы, состоящей из: rs16847120, rs249122, rs6862796, rs249137, rs249138, rs144713688, rs73258486, rs6480251, rs6480252, rs10822978, rs10997525, rs10997527, rs7074325, rs57930837, rs11453660, rs2199792, rs4963245, rs12990449, rs727162, rs58161637, rs62622847, rs3213755, rs41521946, rs28362678, rs35624343, rs28362677, rs11207832, rs1954436, rs11207834, rs370530530, rs11207838, rs150980554, rs7551886, rs6664979, rs12043665, rs12030784, rs79037385, rs74568317, rs3790575 и rs77939406.
В еще одном варианте, вышеупомянутый способ можно применять на практике, если генотип, связанный с положительной ответной реакцией на лечение традипитантом, выбран из группы, состоящей из: rs16847120 GG, rs249122 AA, rs6862796 CC, rs249137 TT, rs249138 TT, rs144713688 GAGAA, rs73258486 GG/GA, rs6480251 CC/CT, rs6480252 TT/TC, rs10822978 TT/TA, rs10997525 GG/GA, rs10997527 CC/CA, rs7074325 CC/CT, rs57930837 CC/CA, rs11453660 CACA/CAC, rs2199792 AA/AG, rs4963245 non-CC, rs12990449 non-TT, rs727162 non-CC, rs58161637 non-GG, rs62622847 non-CC, rs3213755 non-AA, rs41521946 non-TT, rs28362678 non-AA, rs35624343 non-AA, rs28362677 non-TT, rs11207832 non-CC, rs1954436 non-CC, rs11207834 non-CC, rs370530530 non-CTCT, rs11207838 non-TT, rs150980554 non-AA, rs7551886 non-CC, rs6664979 non-CC, rs12043665 non-AA, rs12030784 non-TT, rs79037385 non-GG, rs74568317 non-CC, rs3790575 non-CC и rs77939406 non-GG.
Другой объект настоящего изобретения относится к способу лечения пациента, страдающего от зуда или атопического дерматита, путем введения традипитанта в количестве, эффективном для такого лечения, который включает выбор эффективной для лечения пациента дозировки, основанный на идентификации исходного уровня IgE у пациента, и
если исходный уровень IgE пациента превышает приблизительно 100 кЕ/л, то введение внутрь пациенту традипитанта в дозировке, эффективной для лечения зуда или атопического дерматита у пациента, которая была бы выбрана без идентификации исходного уровня IgE пациента, и
если исходный уровень IgE пациента не превышает приблизительно 100 кЕ/л, то введение внутрь пациенту традипитанта в более высокой дозировке по сравнению с дозировкой, которая в ином случае была бы выбрана без идентификации исходного уровня IgE пациента.
Кроме того, вышеупомянутый способ может дополнительно включать идентификацию исходного уровня IgE у пациента при исследовании биологического образца от пациента для определения количества IgE в этом биологическом образце. Кроме того, вышеупомянутые способы приводят к определению различных дозировок, основанным на генотипе, включая введение пациенту, получающему более высокую дозировку при введении внутрь традипитанта в количестве от более 170 мг/день до 340 мг/день, в частности от более 170 мг/день до 255 мг/день. Более предпочтительно, количество может составлять более 170 мг/день, например приблизительно на 25% выше 170 мг/день. В качестве примера выбора дозировки, пациент с идентифицированным исходным уровнем IgE более приблизительно 100 кЕ/л получает дозу 170 мг/день, например 85 мг два раза в день (bid).
В другом объекте настоящего изобретения, предлагается способ выбора дозировки традипитанта, эффективной для лечения пациента, страдающего от атопического дерматита, включающий:
(1) идентификацию генотипа пациента по одному или более SNP, выбранного из группы, состоящей из: rs4575660, rs276555, rs74416548, rs276556, rs276560, rs276561, rs276562, rs276563, rs276563, rs276564, rs276564, rs276571, rs140796, rs276573, rs276574, rs4895474, rs4895475, rs9483989, rs9373178, rs4896234, rs2327798, rs62420823, rs17252967, rs9494657, rs9402871, rs9402872, rs9399201, rs4896235, rs719640, rs9373179, rs9385784, rs2146275, rs6941440, rs4896237, rs6929580, rs4896239, rs4895479, rs4895480, rs4280975, rs6911523, rs6912319, rs2280090, rs57930837, rs4963245, rs12990449, rs727162, rs58161637, rs62622847, rs3213755, rs41521946, rs28362678, rs35624343, rs28362677 и rs11207834; и
(2) выбор дозировки приблизительно 170 мг/день, если:
(А) генотип пациента включает один или более вариантов, связанных с высоким уровнем IgE, выбранных из группы, состоящей из: rs4575660 ТТ, rs276555 СС, rs74416548 АТАТ, rs276556 GG, rs276560 СС, rs276561 ТТ, rs276562 GG, rs276563 CC, rs276563 CC, rs276564 GG, rs276564 GG, rs276571 GG, rs140796 TATTGTATTG, rs276573 TT, rs276574 GG, rs4895474 TT, rs4895475 GG, rs9483989 TT, rs9373178 CC, rs4896234 CC, rs2327798 GG, rs62420823 GG, rs17252967 CC, rs9494657 AA, rs9402871 GG, rs9402872 CC, rs9399201 GG, rs4896235 AA, rs719640 AA, rs9373179 AA, rs9385784 TT, rs2146275 AA, rs6941440 TT, rs4896237 TT, rs6929580 GG, rs4896239 TT, rs4895479 CC, rs4895480 TT, rs4280975 GG, rs6911523 AA, rs6912319 GG, rs2280090 non-GG и rs57930837 non-AA; или
(В) один или более вариантов, связанных с положительной ответной реакцией на лечение традипитантом, выбранных из группы, состоящей из: rs16847120 GG, rs249122 AA, rs6862796 CC, rs249137 TT, rs249138 TT, rs144713688 GAGAA, rs73258486 GG/GA, rs6480251 CC/CT, rs6480252 TT/TC, rs10822978 TT/TA, rs10997525 GG/GA, rs10997527 CC/CA, rs7074325 CC/CT, rs57930837 CC/CA, rs11453660 CACA/CAC, rs2199792 AA/AG, rs4963245 non-CC, rs12990449 non-TT, rs727162 non-CC, rs58161637 non-GG, rs62622847 non-CC, rs3213755 non-AA, rs41521946 non-TT, rs28362678 non-AA, rs35624343 non-AA, rs28362677 non-TT, rs11207832 non-CC, rs1954436 non-CC, rs11207834 non-CC, rs370530530 non-CTCT, rs11207838 non-TT, rs150980554 non-AA, rs7551886 non-CC, rs6664979 non-CC, rs12043665 non-AA, rs 12030784 non-TT, rs79037385 non-GG, rs74568317 non-CC, rs3790575 non-CC и rs77939406 non-GG; или
(3) выбор дозировки, превышающей приблизительно 170 мг/день, если генотип пациента не включает вариант, связанный с высоким IgE или с положительной ответной реакцией на лечение традипитантом.
Настоящее изобретение также включает способ определения дозировки традипитанта, эффективной для лечения пациента, страдающего от атопического дерматита, у которого идентифицирован исходный уровень IgE, который включает выбор дозировки приблизительно 170 мг/день, если исходный уровень IgE пациента составляет более приблизительно 100 кЕ/л, или дозировки более 170 мг/день, если исходный уровень IgE пациента не превышает приблизительно 100 кЕ/л. Также настоящее изобретение относится к способу определения возможности ответной реакции у пациента на лечение атопического дерматита традипитантом, который включает:
(1) идентификацию генотипа пациента по одному или более SNP, выбранного из группы, состоящей из: rs4575660, rs276555, rs74416548, rs276556, rs276560, rs276561, rs276562, rs276563, rs276563, rs276564, rs276564, rs276571, rs140796, rs276573, rs276574, rs4895474, rs4895475, rs9483989, rs9373178, rs4896234, rs2327798, rs62420823, rs17252967, rs9494657, rs9402871, rs9402872, rs9399201, rs4896235, rs719640, rs9373179, rs9385784, rs2146275, rs6941440, rs4896237, rs6929580, rs4896239, rs4895479, rs4895480, rs4280975, rs6911523, rs6912319, rs2280090, rs57930837, rs4963245, rs12990449, rs727162, rs58161637, rs62622847, rs3213755, rs41521946, rs28362678, rs35624343, rs28362677 и rs11207834; и
(2) определение возможности развития у пациента ответной реакции на указанное лечение, если генотип пациента включает один или более вариантов, выбранных из: rs4575660 ТТ, rs276555 СС, rs74416548 АТАТ, rs276556 GG, rs276560 СС, rs276561 ТТ, rs276562 GG, rs276563 CC, rs276563 CC, rs276564 GG, rs276564 GG, rs276571 GG, rs140796 TATTGTATTG, rs276573 TT, rs276574 GG, rs4895474 TT, rs4895475 GG, rs9483989 TT, rs9373178 CC, rs4896234 CC, rs2327798 GG, rs62420823 GG, rs17252967 CC, rs9494657 AA, rs9402871 GG, rs9402872 CC, rs9399201 GG, rs4896235 AA, rs719640 AA, rs9373179 AA, rs9385784 TT, rs2146275 AA, rs6941440 TT, rs4896237 TT, rs6929580 GG, rs4896239 TT, rs4895479 CC, rs4895480 TT, rs4280975 GG, rs6911523 AA, rs6912319 GG, rs2280090 non-GG и rs57930837 non-AA; или
один или более вариантов, связанных с положительной ответной реакцией на лечение традипитантом, выбранных из группы, состоящей из: rs16847120 GG, rs249122 AA, rs6862796 CC, rs249137 TT, rs249138 TT, rs144713688 GAGAA, rs73258486 GG/GA, rs6480251 CC/CT, rs6480252 TT/TC, rs10822978 TT/TA, rs10997525 GG/GA, rs10997527 CC/CA, rs7074325 CC/CT, rs57930837 CC/CA, rs11453660 CACA/CAC, rs2199792 AA/AG, rs4963245 non-CC, rs12990449 non-TT, rs727162 non-CC, rs58161637 non-GG, rs62622847 non-CC, rs3213755 non-AA, rs41521946 non-TT, rs28362678 non-AA, rs35624343 non-AA, rs28362677 non-TT, rs11207832 non-CC, rs1954436 non-CC, rs11207834 non-CC, rs370530530 non-CTCT, rs11207838 non-TT, rs150980554 non-AA, rs7551886 non-CC, rs6664979 non-CC, rs12043665 non-AA, rs12030784 non-TT, rs79037385 non-GG, rs74568317 non-CC, rs3790575 non-CC и rs77939406 non-GG.
Также настоящее изобретение относится к способу идентификации пациента, у которого уровень IgE идентифицирован как вероятный для ответной реакции на лечение атопического дерматита традипитантом, который включает определение вероятности ответной реакции пациента на лечение традипитантом, если исходный уровень IgE у пациента превышает 100 кЕ/л.
На основании вышеизложенного, настоящее изобретение характеризуется рядом объектов, которые можно описать следующим образом.
В первом объекте настоящего изобретения предлагается усовершенствованный способ лечения зуда или атопического дерматита у индивидуума, нуждающегося в таком лечении, включающий введение внутрь традипитанта.
Во втором объекте настоящего изобретения предлагается способ, который включает лечение зуда и/или атопического дерматита у индивидуума, нуждающегося в таком лечении, включающий введение внутрь традипитанта этому индивидууму. Согласно этому способу, пациента для лечения можно выбрать на основании того, что уровень IgE у пациента превышает или равен предельному значению, которое может составлять, например 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л.
В первом или втором объекте, доза традипитанта может составлять, например, 100-400 мг/день, 100-300 мг/день, 100-200 мг/день или приблизительно 170 мг/день, которую можно вводить по 85 мг два раза в день (bid).
В третьем объекте настоящего изобретения предлагается способ лечения пациента традипитантом, где пациент страдает от зуда и/или атопического дерматита. Способ включает следующие стадии: идентификацию генотипа пациента по одному или более SNP, связанного с уровнем IgE или с эффектом лечения традипитантом, и если генотип пациента связан с высоким уровнем IgE или с положительной ответной реакцией на лечение традипитантом, то введение внутрь пациенту традипитанта в первой дозировке, а если генотип пациента не связан с высоким с уровнем IgE или с положительной ответной реакцией на лечение традипитантом, то введение внутрь пациенту традипитанта во второй дозировке, которая превышает первую дозировку, или введение внутрь активного фармацевтического ингредиента, отличающегося от традипитанта.
В четвертом объекте настоящего изобретения предлагается способ лечения пациента традипитантом, где пациент страдает от зуда и/или атопического дерматита. Способ включает следующие стадии: идентификацию исходного уровня IgE у пациента, и если исходный уровень IgE у пациента превышает или равен предельному значению, которое может составлять, например 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, то введение внутрь пациенту традипитанта в первой дозировке, а если исходный уровень IgE у пациента не превышает предельное значение, то введение внутрь пациенту традипитанта во второй дозировке, которая превышает первую дозировку, или введение активного фармацевтического ингредиента, отличающегося от традипитанта. В различных вариантах осуществления настоящего изобретения, первая дозировка может составлять приблизительно 170 мг/день, которую можно вводить по 85 мг два раза в день, а вторая дозировка может составлять, например приблизительно >170-340 мг/день или >170-255 мг/день.
В пятом объекте настоящего изобретения предлагается способ выбора дозировки традипитанта для лечения пациента, страдающего от атопического дерматита, который включает идентификацию генотипа пациента по одному или более SNP, который связан с высоким уровнем IgE или с положительной ответной реакцией на лечение традипитантом, где дозировка составляет приблизительно 170 мг/день, если генотип пациента включает один или более вариантов, связанных с высоким уровнем IgE, и дозировка превышает приблизительно 170 мг/день, если генотип пациента не включает вариант, связанный с высоким уровнем IgE или с положительной ответной реакцией на лечение традипитантом.
В шестом объекте настоящего изобретения предлагается способ выбора дозировки традипитанта для лечения пациента, страдающего от атопического дерматита, который включает идентификацию исходного уровня IgE у пациента, где дозировка составляет приблизительно 170 мг/день, если исходный уровень IgE у пациента превышает или равен предельному уровню, такому как, например, 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, и дозировка составляет более приблизительно 170 мг/день, если исходный уровень IgE у пациента составляет величину менее предельного уровня.
В седьмом объекте настоящего изобретения предлагается способ прогнозирования вероятности ответной реакции пациента на лечение от атопического дерматита и/или зуда традипитантом, включающий идентификацию генотипа пациента по одному или более SNP, связанного с высоким уровнем IgE или с положительной ответной реакцией на лечение традипитантом, где у пациента может наблюдаться ответная реакция на указанное лечение, если генотип пациента включает один или более вариантов, связанных с высоким IgE, и у пациента вероятность ответной реакции на указанное лечение является маловероятной, если генотип пациента не включает вариант, связанный с высоким IgE или с положительной ответной реакцией на лечение традипитантом.
В восьмом объекте настоящего изобретения предлагается способ прогнозирования вероятности ответной реакции пациента на лечение от атопического дерматита и/или зуда традипитантом, включающий идентификацию исходного уровня IgE у пациента, где у пациента может наблюдаться ответная реакция на указанное лечение традипитантом, если исходный уровень IgE пациента равен предельному уровню или превышает его, например, равен или превышает 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, и у пациента вероятность ответной реакции на указанное лечение является маловероятной, если исходный уровень IgE у пациента ниже предельного уровня.
Краткое описание фигур
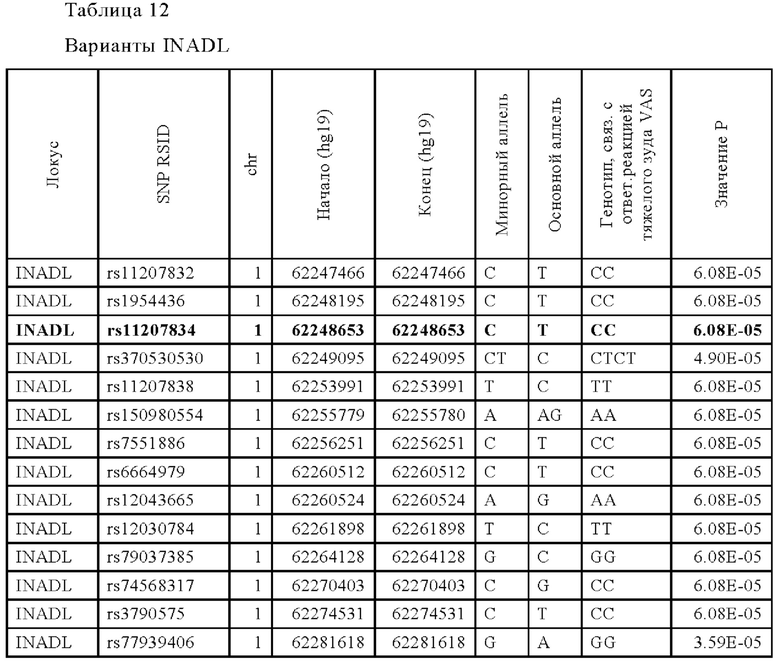
На Фиг. 1 представлена диаграмма разброса изменения показателей по визуально-аналоговой шкале (VAS) в зависимости от концентрации-массы традипитанта (величина ранговой корреляции Спирмена p=0,0204), как описано в Примере 1.
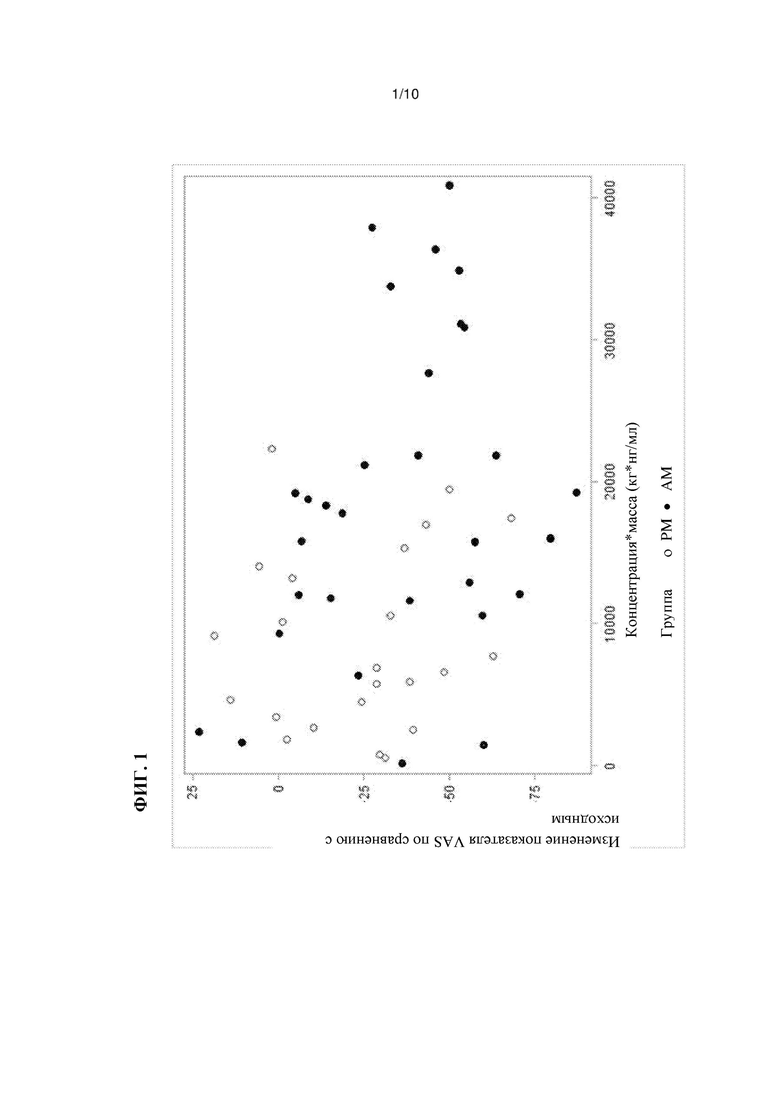
На Фиг. 2 представлена диаграмма разброса уровней традипитанта в сыворотке, то есть показано изменение концентрации-массы в зависимости от времени посещения врача, как описано в Примере 1.
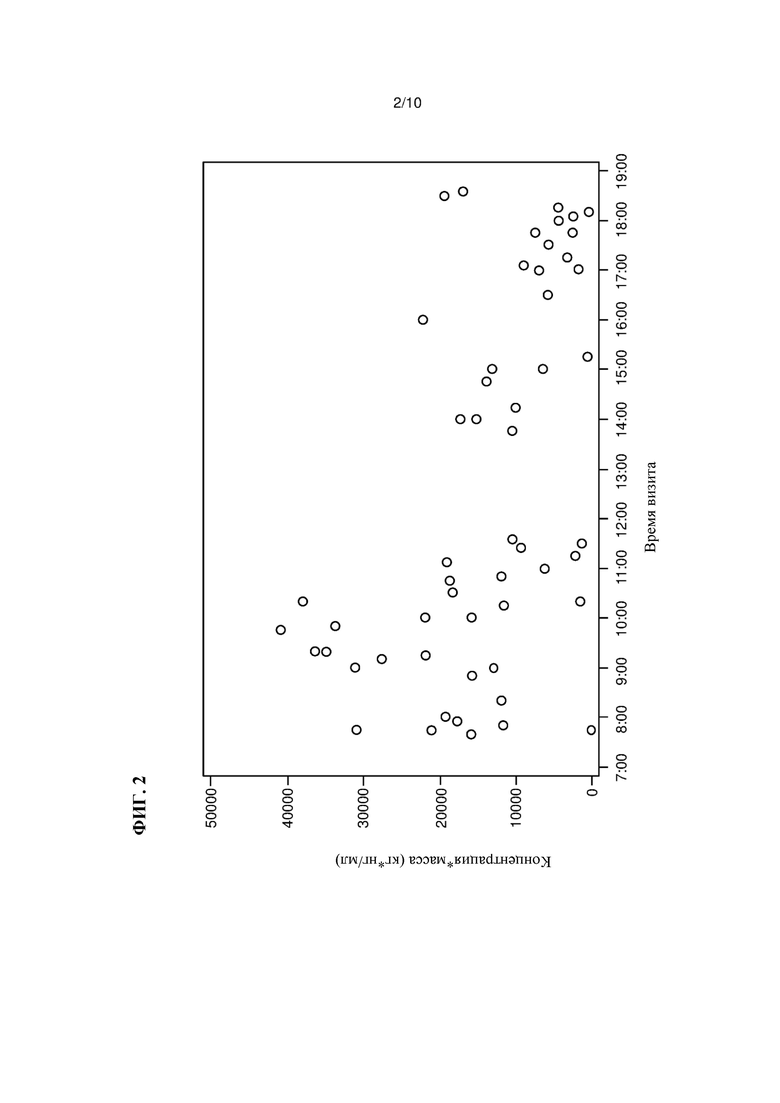
На Фиг. 3 показана схема испытаний, как описано в Примере 3.
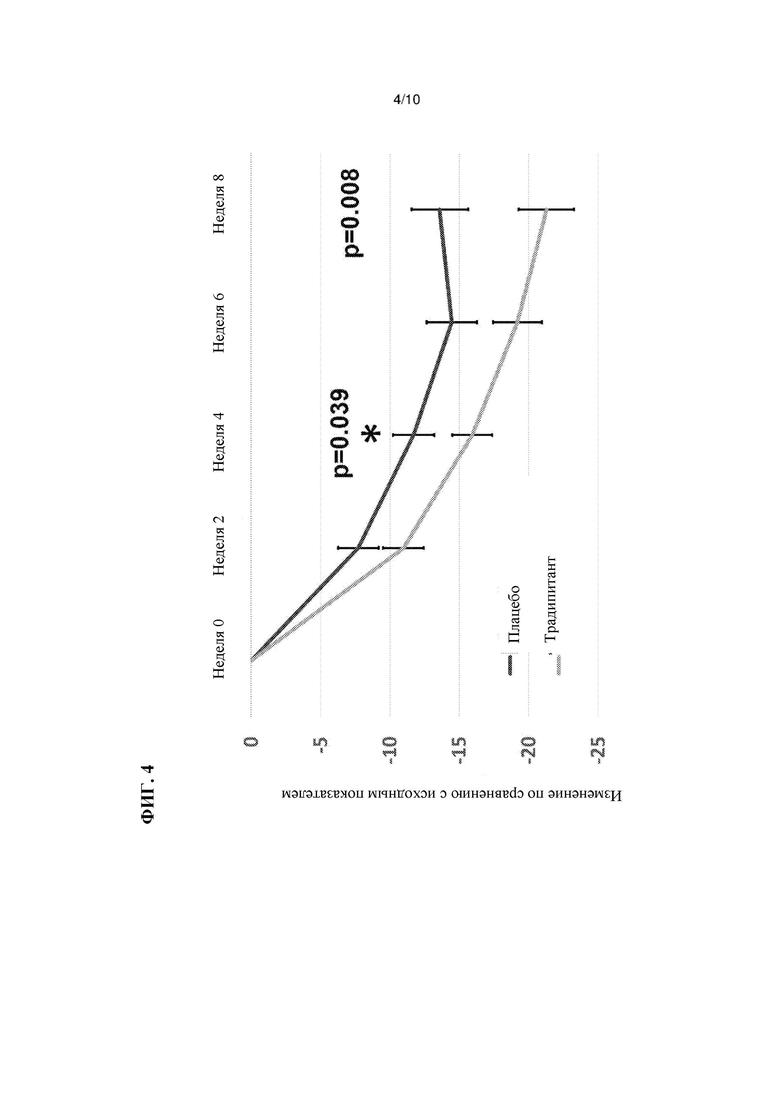
На Фиг. 4 показана зависимость изменения показателей зуда от времени по сравнению с исходными результатами в ходе испытаний, как описано в Примере 3.
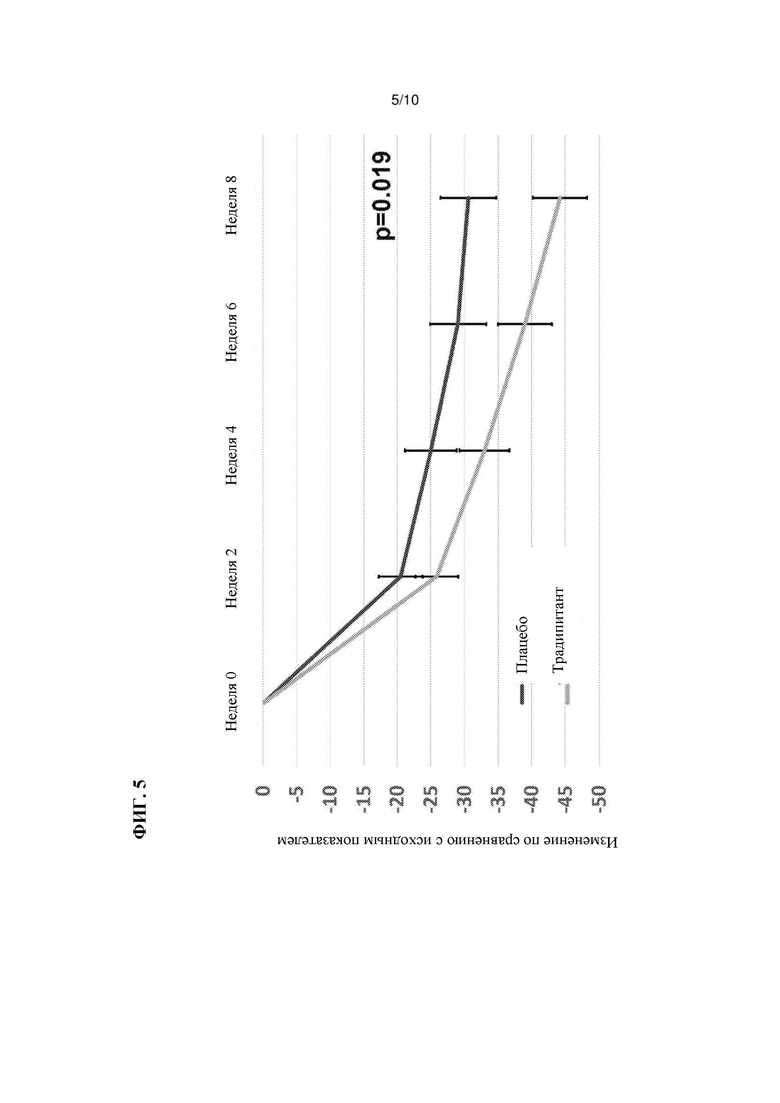
На Фиг. 5 показана зависимость показателей заболевания от времени в ходе испытаний, описанных в Примере 3.
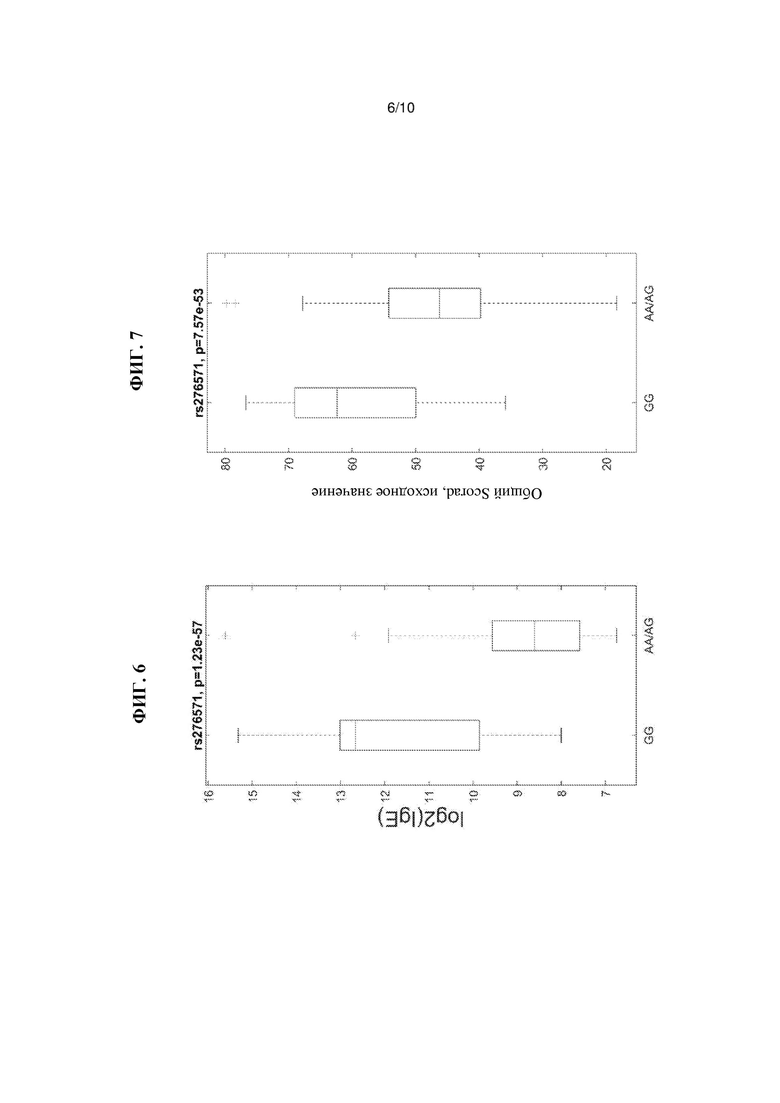
На Фиг. 6 показана связь SNP rs276571 с уровнями IgE, как описано в Примере 5.
На Фиг. 7 показана связь SNP rs276571 с исходным значением SCORAD, как описано в Примере 5.
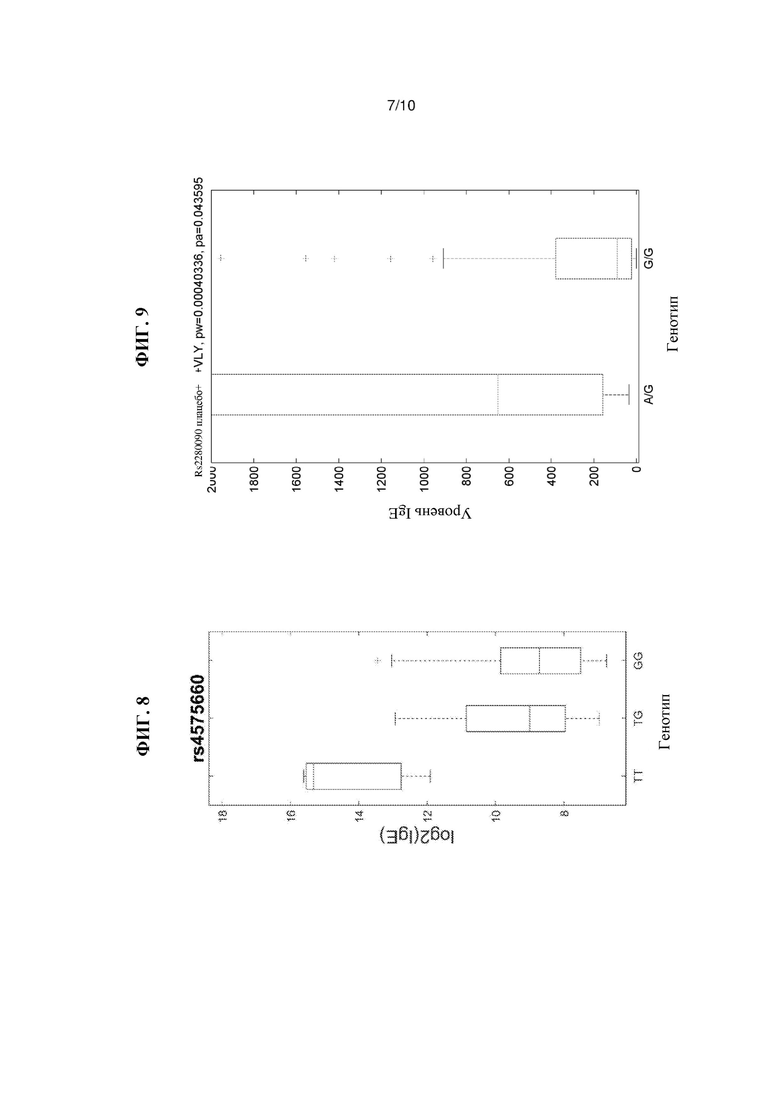
На Фиг. 8 показана связь SNP rs4575660 с логарифмически преобразованными данными уровней IgE, как описано в Примере 5.
На Фиг. 9 показана связь SNP rs2280090 с уровнями IgE, как описано в Примере 5.
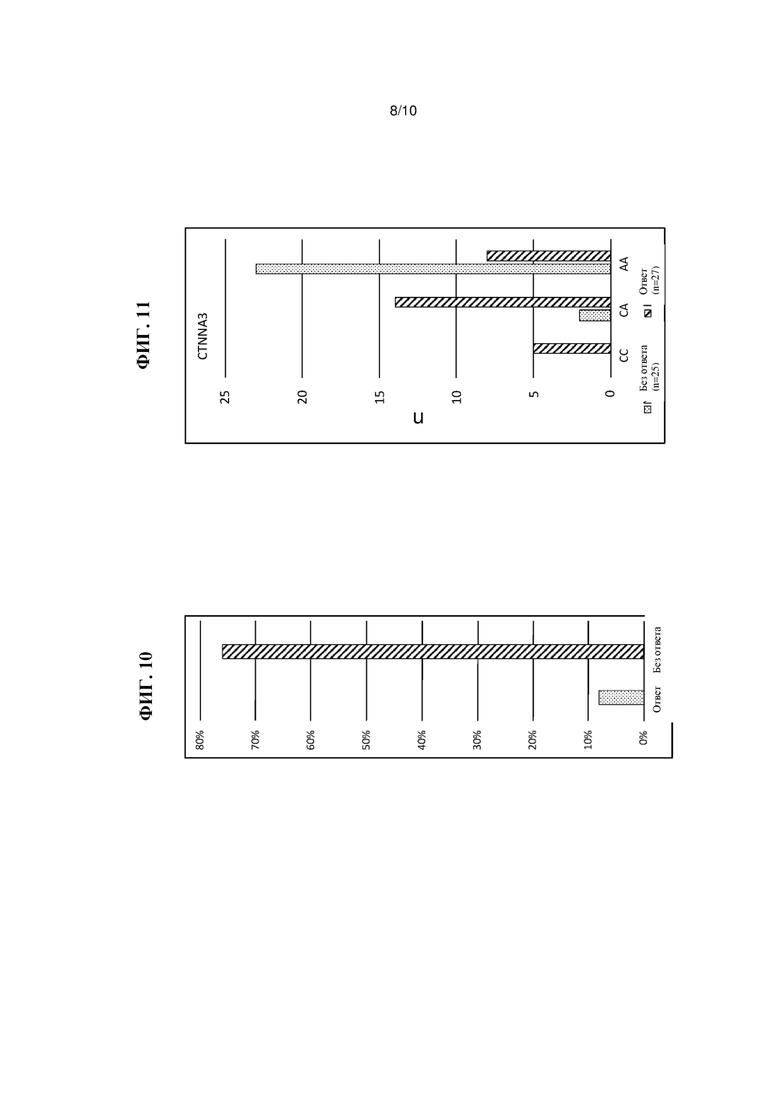
На Фиг. 10 показана доля пациентов с ответной реакцией и без ответной реакции на лечение атопического дерматита с помощью традипитанта среди носителей минорного аллеля CTNNA3 rs57930837, как описано в Примере 6.
На Фиг. 11 показано число пациентов (n) с ответной реакцией и без ответной реакции на лечение атопического дерматита с помощью традипитанта, разделенных по генотипам CTNNA3 rs57930837, как описано в Примере 6.
На Фиг. 12 показана связь вариантов CTNNA3 rs57930837 с уровнем IgE, как описано на Фиг. 6.
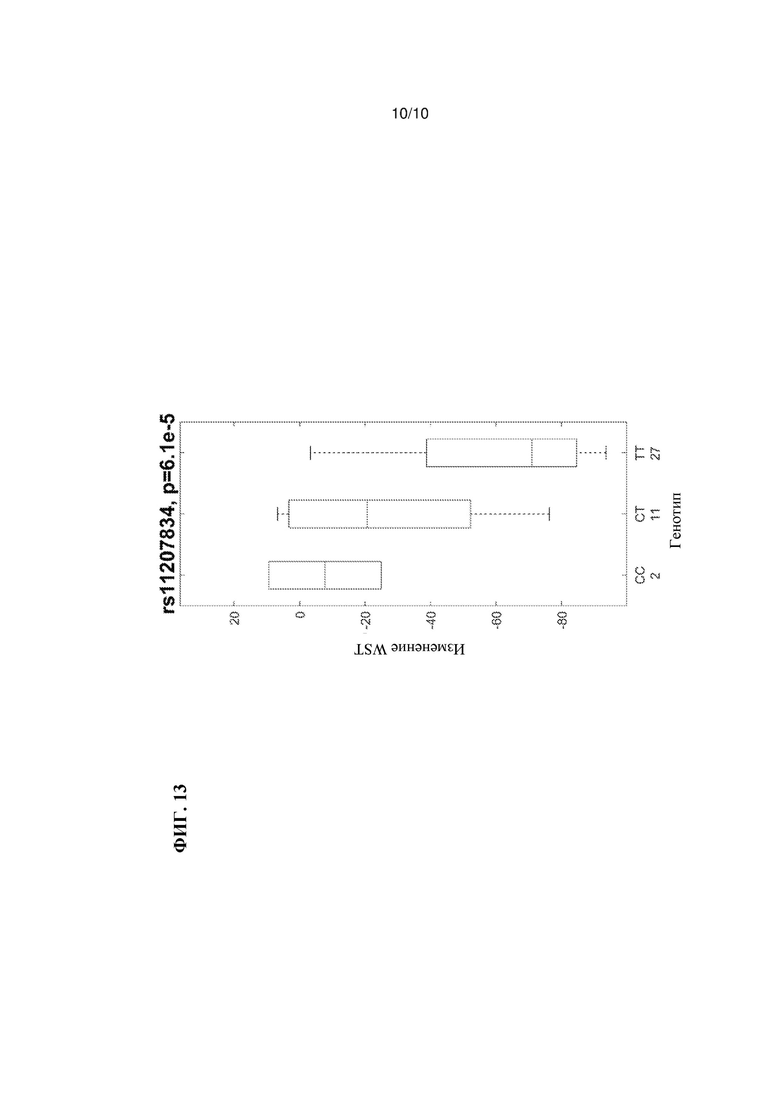
На Фиг. 13 показана связь вариантов INADL rs11207834 с изменением показателей теста «тяжелый зуд», как описано в Примере 6.
Подробное описание настоящего изобретения
В различных вариантах осуществления настоящего изобретения усовершенствованные способы, описанные здесь, включают способы лечения зуда и/или атопического дерматита с использованием традипитанта, способы выбора дозировки традипитанта для лечения пациента, страдающего от атопического дерматита и/или зуда, а также способы определения возможности развития у пациента ответной реакции на лечение атопического дерматита и/или зуда с помощью традипитанта.
Способ применения традипитанта для лечения атопического дерматита и/или зуда у пациента может включать, прежде всего, идентификацию генотипа пациента по одному или более SNP, которые связаны с одним или обоими параметрами - с уровнем IgE или с эффектом лечения традипитантом. Как описано в разделе Примеры ниже, исходный уровень иммуноглобулина Е (IgE) связан с эффектом лечения традипитантом. По этой причине генетические модификаторы IgE также можно рассматривать как маркеры эффекта лечения традипитантом. Кроме того, в данном изобретении был идентифицирован ряд генетических маркеров, которые напрямую связаны с эффектом лечения традипитантом независимо от уровня IgE. Примеры таких SNP представлены здесь, например в Таблицах 8, 10, 11 и 12.
Стадия идентификации может включать ряд различных способов идентификации. В одном объекте настоящего изобретения, идентификация генотипа может включать проведение генотипирования биологического образца, взятого у пациента, который нуждается в лечении. Биологический образец может включать, например кровь, сыворотку, слюну, мочу и т.п., как известно в данном уровне техники. В другом объекте настоящего изобретения, идентификация генотипа может включать изучение истории болезни пациента, отчета о результатах исследования или другого документа, содержащего результаты проведенного ранее анализа или генетического тестирования. В других объектах настоящего изобретения, идентификация может включать распоряжение или запрос о проведении анализа другим лицом, или распоряжение или запрос на просмотр истории болезни пациента, отчета о результатах или другого документа, содержащего результат ранее выполненного анализа или генетического теста.
В том случае, если генотип пациента при одном из указанных SNP связан с одним или обоими параметрами - с высоким уровнем иммуноглобулина Е (IgE) или с значительным эффектом лечения традипитантом, то способ дополнительно включает введение внутрь пациенту первой дозы традипитанта. Первая доза может составлять, например, от 100 до 400 мг/день, от 100 до 300 мг/день, от 100 до 200 мг/день или приблизительно 85-170 мг/день, которую можно вводить, например, в виде дозы от 50 до 200 мг два раза в день, от 50 до 150 мг два раза в день, от 50 до 100 мг два раза в день или приблизительно 85 мг два раза в день (bid).
В том случае, если генотип пациента при одном из указанных SNP не связан с одним или обоими параметрами - с высоким уровнем IgE или с значительным эффектом лечения традипитантом при любом из указанных SNP, то способ включает альтернативное лечение. Такое альтернативное лечение может включать, например, введение внутрь второй дозы традипитанта, которая превышает первую дозу. Например, вторая доза может составлять 150%, 200%, 250% или 300% от первой дозы, или может превышать дозу от 170 мг/день до 255 мг/день, или от 170 мг/день до 340 мг/день. Доза выше 170 мг/день может означать, например, на 25% больше. Такие повышенные дозировки могут сопровождаться усилением мониторинга пациента. В других вариантах осуществления настоящего изобретения, альтернативное лечение может включать введение внутрь активного фармацевтического ингредиента, отличающегося от традипитанта.
Другой способ применения традипитанта для лечения атопического дерматита и/или зуда у пациента, включает, прежде всего, идентификацию исходного уровня IgE. Уровень IgE пациента можно идентифицировать, например, при отборе биологического образца от пациента и определении количества IgE, присутствующего в биологическом образце. Биологическим образцом может являться образец крови, образец сыворотки или аналогичный образец, известный в данном уровне техники.
Как при тяжести зуда, так и при тяжести заболевания, стабильно наблюдается более сильный лечебный эффект среди пациентов с высоким уровнем IgE по сравнению с низким уровнем IgE, независимо от конкретного порогового значения, используемого для установления границы между высоким и низким уровнями IgE. Например, такая взаимосвязь наблюдается независимо от того, определяется ли группа с высоким IgE как превышающая предельное значение, например 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, и определяется ли группа с низким IgE как с более низким значением, чем предельное значение, например 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л. На практике использования настоящего изобретения можно применять любое из этих определений высокого или низкого уровня IgE.
Если у пациента определен высокий уровень IgE, например, уровень IgE превышает или равен предельному значению, которое составляет 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, то можно ожидать, что у пациента будет наблюдаться значительный эффект лечения традипитантом. Такому пациенту можно вводить внутрь традипитант в первой дозировке. Однако, если у пациента исходный уровень IgE ниже выбранного предельного значения, например менее 50 кЕ/л, менее 75 кЕ/л, менее 100 кЕ/л, менее 150 кЕ/л, менее 200 кЕ/л или менее 300 кЕ/л, то пациенту можно вводить внутрь традипитант во второй дозировке, которая превышает первую дозировку, или можно вводить внутрь активный фармацевтический ингредиент, отличающийся от традипитанта. Первая дозировка и вторая дозировка могут превышать ранее описанные дозировки.
Здесь также описаны способы выбора дозировки для лечения пациента, страдающего от атопического дерматита и/или зуда, с помощью традипитанта. Такой способ может включать идентификацию генотипа пациента по одному или более SNP, описанных как связанные с одним или обоими параметрами - с уровнем IgE или с эффектом лечения традипитантом, или в другом варианте идентификацию уровня IgE у пациента. Способы идентификации указанного генотипа или уровня IgE могут включать способы, описанные ранее. На основе идентификации или определения генотипа или уровня IgE у индивидуума, можно выбрать дозировку для конкретного пациента. Например, если генотип пациента включает один или более вариантов, связанных с высоким IgE или с положительной ответной реакцией на лечение традипитантом, или если уровень IgE пациента идентифицирован как превышающий предельное значение, например 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, то для пациента можно выбрать дозировку приблизительно 170 мг/день. Более предпочтительно такая дозировка может составлять, например, 85 мг два раза в день (bid). Если уровень IgE пациента идентифицирован на уровне ниже предельного значения, например ниже 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, то для пациента можно выбрать дозировку превышающую приблизительно 170 мг/день. Такая дозировка может составлять, например, 150%, 200%, 250% или 300% от первой дозировки равной приблизительно 170 мг/день. Таким образом, дозировка может составлять, например, более приблизительно от 170 мг/день до 255 мг/день, или более приблизительно от 170 мг/день до 340 мг/день.
Также дополнительно описаны способы предсказания возможности ответной реакции у пациента на лечение атопического дерматита традипитантом. Такие способы могут включать идентификацию генотипа пациента по одному или более SNP, описанные здесь как связанные с одним или обоими параметрами - с уровнем IgE или с эффектом лечения традипитантом, или в другом варианте идентификацию уровня IgE пациента. Способы идентификации указанного генотипа или уровня IgE могут включать способы, описанные ранее. На основе идентификации или определения генотипа или уровня IgE у индивидуума, можно предсказать, будет ли у пациента наблюдаться благоприятная ответная реакция на лечение атопического дерматита и/или зуда с помощью традипитанта. Например, если генотип пациента включает один или более вариантов, связанных с высоким IgE или с положительной реакцией на лечение традипитантом, или если уровень IgE пациента идентифицирован как превышающий предельное значение, например 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, то у пациента может наблюдаться ответная реакция на лечение традипитантом. Однако, если генотип пациента не включает любой из вариантов, связанный с высоким IgE или с положительной реакцией на лечение традипитантом, или если уровень IgE пациента идентифицирован ниже предельного значения, например ниже 50 кЕ/л, 75 кЕ/л, 100 кЕ/л, 150 кЕ/л, 200 кЕ/л или 300 кЕ/л, то можно считать маловероятной или менее вероятной ответную реакцию у пациента на лечение традипитантом, или маловероятным или менее вероятным развитие у пациента значительной ответной реакции на лечение традипитантом. Такая информация является полезной для пациентов и медицинских работников, поскольку она имеет важное значение для плановой идентификации пациентов, которые особенно выиграют от лечения традипитантом, а также для снижения ошибочных испытаний и попыток для определения успешной терапии, прежде всего, в случае индивидуумов, для которых маловероятно развитие ответной реакции на лечение традипитантом в дозе 170 мг/день. Для таких индивидуумов может наблюдаться благоприятный эффект от лечения, например, другим фармакологически активным ингредиентом, или более высокой дозой традипитанта.
Использованные здесь термины «пациент» и «индивидуум» означают млекопитающее, которое страдает от одного или более расстройств, интенсивность которых снижается при введении традипитанта, например, атопический дерматит, зуд и зуд, связанный с атопическим дерматитом. Примерами млекопитающих в рамках этого термина являются морские свинки, собаки, кошки, крысы, мыши, лошади, крупный рогатый скот и человек. Следует понимать, что наиболее предпочтительным пациентом является человек.
Следует также отметить, что специалист в данной области техники может воздействовать на расстройство или проводить профилактику пациента, страдающего от расстройства, с помощью эффективного количества традипитанта. Таким образом, термины «лечение» или «терапия» предназначены для обозначения всех процессов, которые могут замедлить, прервать развитие, остановить развитие, контролировать или приостановить прогрессирование заболеваний или расстройств, описанных здесь, и подразумевается, что эти термины включают профилактические меры против таких расстройств, но не обязательно указывают на полное устранение всех симптомов расстройств.
Использованный здесь термин «эффективное количество» традипитанта означает количество, эффективное при лечении расстройств, описанных здесь.
Что касается дозировки, то «qd» означает введение один раз в день, a «bid» обычно означает введение один раз утром и один раз вечером, в основном с интервалом не менее приблизительно 8 ч или более чем приблизительно 16 ч, например, с интервалом 10-14 ч или с интервалом 12 ч (Q12H).
Использованные здесь термины «первый», «второй» и т.д. не означают любой порядок, количество или важность, а скорее используются для разграничения одного элемента от другого, и термин указанный здесь в единственном числе, не означает ограничение количества, а скорее означает присутствие по меньшей мере одного из перечисленных элементов. Термин «приблизительно», используемый здесь в связи с количеством, включает в себя указанное значение и имеет значение, определяемое контекстом (например, включает в себя степень ошибки, связанную с измерением конкретного количества). Предполагается, что указание на множественное число в скобках означает как единственное, так и множественное число термина, тем самым включает один или более таких терминов (например, метал(лы) означает один или более металлов). Интервалы, описанные здесь, являются включительно и независимо комбинируемыми интервалами (например, интервалы «вплоть до приблизительно 25 мг, или в частности от приблизительно 5 мг до приблизительно 20 мг» включают конечные показатели и все промежуточные значения интервалов «от приблизительно 5 мг до приблизительно 25 мг» и т.п.).
Специалисту в данной области техники представляется очевидным, что можно выбрать дополнительные предпочтительные варианты осуществления настоящего изобретения при комбинировании предпочтительных указанных выше вариантов или при ссылке на представленные здесь примеры.
Пример 1
Монотерапия традипитантом для лечения хронического зуда у пациентов, страдающих от атопического дерматита
Проводили клиническое исследование II фазы для подтверждения концепции с целью исследования безопасности и эффективности традипитанта при лечении в режиме мототерапии хронического зуда у пациентов, страдающих от атопического дерматита (Study ID VP-VLY-686-2101, "Proof of Concept of VLY-686 in Subjects With Treatment-Resistant Pruritus Associated With Atopic Dermatitis").
Несмотря на очень значительное и клинически значимое улучшение по сравнению с исходным уровнем при лечении традипитантом (улучшение 40,5 мм по сравнению с исходным уровнем, р<0,0001), измеренное по визуально-аналоговой шкале (VAS) в 100 мм устройстве для оценки зуда, очень высокий эффект плацебо (улучшение 36,5 мм по сравнению с исходным уровнем, р<0,0001), на изменение по сравнению с исходным показателем привело к отсутствию статистически значимого отличия от плацебо. Тем не менее, последующий анализ фармакокинетики (РК) среди популяции всех пациентов, включенных в исследование, выявил значительные и клинически значимые ответные реакции по множеству конечных показателей, оцененных у индивидуумов с более высокими уровнями воздействия традипитанта во время оценки зуда.
Предварительно заданным конечным показателем в ходе испытания в фазе II для доказательства концепции клинических испытаний являлось изменение зуда по сравнению с исходным значением по визуально-аналоговой шкале (VAS). Благодаря высокому эффекту плацебо, для этого предварительно установленного конечного параметра не наблюдалось значительного отличия от плацебо. Тем не менее, по результатам последующих анализов неожиданно было установлено, что существует взаимосвязь ответной реакции и воздействия. Наблюдалось существование значительной и клинически значимой ответной реакции по некоторым связанным с зудом результатам, оцененным у индивидуумов с более высокими уровнями традипитанта в плазме крови. На основании данных, изученных в ходе исследования, более низкий уровень традипитанта в плазме крови может быть ниже порога эффективности, достаточного для ослабления ощущения зуда у пациентов.
Методы
В ходе испытаний пациентов, которые ощущали зуд по шкале VAS более 70 мм в течение одного из двух дней перед включением в испытания, рандомизировали для приема перорально либо 100 мг традипитанта (n=34), либо плацебо (n=35) один раз в день вечером. В ходе испытаний в группах традипитанта пациенты принимали перорально традипитант в составе капсул со стандартными эксципиентами в количестве 100 мг вечером. Клинические анализы проводили через 3 или 4 недели после ежедневного приема или как через 3 недели, так и через 4 недели, причем каждый анализ проводили утром в день после последнего приема или в полдень в день после последнего приема. Традипитант вводили в форме с немедленным высвобождением, включающей традипитант и фармацевтически приемлемые эксципиенты в капсуле. Размер частицы традипитанта составлял приблизительно D10: <5 мкм, D50: <10 мкм и D90: <25 мкм, где D10 означает, что 10% частиц имеют указанный средний размер частиц, D50 означает, что 50% частиц имеют указанный средний размер частиц и D90 означает, что 90% частиц имеют указанный средний размер частиц.
Исходные значения оценок в баллах по шкале VAS составляли 76,1 и 77,2 в группах традипитанта и плацебо, соответственно. Эффективность оценивали с использованием ряда приборов для клинических испытаний. Кроме того, одновременно с оценкой эффективности собирали образцы крови для анализа фармакокинетики (РК) с целью определения уровней традипитанта в плазме.
Результаты
Как показано на Фиг. 1, данные по PK-PD (фармакокинетические-фармакодинамические данные) в группах традипитанта указывают на значительную корреляцию между уровнями традипитанта в крови и изменениями VAS по сравнению с базовой линией (р<0,05). У индивидуумов с более высокими циркулирующими уровнями традипитанта в момент оценки эффективности наблюдается более высокое значение ответной реакции. Отдельный РК анализ в момент оценки зуда, показанный на Фиг. 2, свидетельствует о том, что половина пациентов, принимавших участие в испытании, посещали лабораторию для оценки у них зуда утром (группа AM, через ~12 ч после введения дозы) и что у этих пациентов также наблюдаются более высокие уровни традипитанта в крови, чем у пациентов, которые посещали лабораторию после полудня (группа РМ, через ~18 ч после введения дозы).
Средние концентрации традипитанта в плазме у исследованных пациентов из групп AM и РМ находились в интервале от приблизительно 125 нг/мл до приблизительно 225 нг/мл. У пациентов, обследованных во второй половине дня (РМ) (среднее = через приблизительно 20 ч после последнего введения), наблюдались, как правило, более низкие концентрации традипитанта в плазме, чем у пациентов, обследованных утром (AM) (среднее = через приблизительно 15 ч после последнего введения). Средняя концентрация в плазме в группе РМ составляет приблизительно 125 нг/мл, а средняя концентрация в плазме в группе AM составляет приблизительно 225 нг/мл, причем разница в значительной степени связана с продолжительностью времени после введения. Что еще более важно, результаты указывают на корреляцию между концентрацией в плазме и эффективностью, когда у пациентов у которых концентрация в плазме составляет >100 нг/мл (например, приблизительно 125 нг/мл или более, приблизительно 150 нг/мл или более, приблизительно 175 нг/мл или более, приблизительно 200 нг/мл или более, или приблизительно 225 нг/мл или более), как правило, наблюдается большая эффективность, чем у пациентов с более низкими концентрациями в плазме.
Последующий анализ в группе AM показал значительный и клинически значимый эффект традипитанта по сравнению с плацебо, как показано в Таблице 1. Более высокие концентрации традипитанта связаны с более высокой эффективностью при лечении хронического зуда в ходе испытаний. Аналогичный анализ в группе РМ показал отсутствие значимого различия между традипитантом и плацебо.
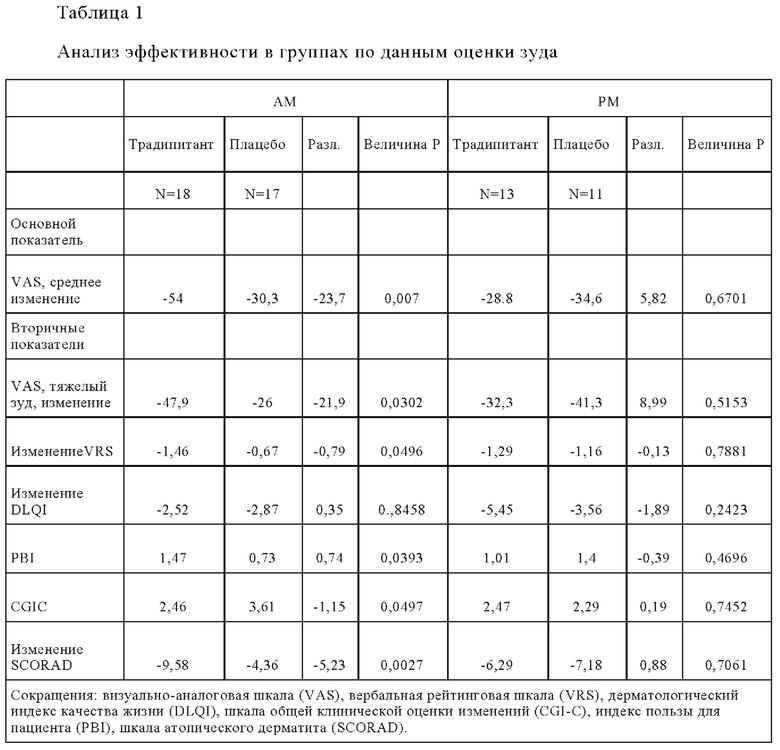
Эти данные соответствуют гипотезе о том, что традипитант - антагонист рецептора NK-1R, может привести к облегчению симптомов у пациентов, страдающих от зуда (субъективная оценка по параметрам VAS, VRS, SCORAD). В ходе испытаний собирали также данные по конечным показателям, которые соответствовали основному заболеванию (аппарат SKINDEX, объективная оценка SCORAD, индекс тяжести и площади экземы EASI и DLQI). Эти результаты не показывают каких-либо существенных отличий от плацебо, которые можно было бы ожидать от лекарственного средства, направленного на симптом зуда в краткосрочном 4-недельном исследовании. Важно отметить, что поскольку пациенты главным образом жалуются на неустранимый зуд, связанный с атопическим дерматитом, эффекты которые также наблюдались по шкале CGI-C и по шкалам PBI, указывают на заметный общий клинически значимый эффект как с точки зрения врача, так и с точки зрения пациента. Заключение
Эти данные подтверждают вывод о том, что пациентов страдающих от зуда, например зуда связанного с атопическим дерматитом, можно лечить при пероральным введении традипитанта, например, в виде формы IV или формы V (или его фармацевтически приемлемой соли) в количестве и с частотой введения, требуемыми для достижения концентраций в плазме по меньшей мере приблизительно 100 нг/мл, например, 125 нг/мл или более, 150 нг/мл или более, 175 нг/мл или более 200 нг/мл или более, или 225 нг/мл или более. Такие уровни концентраций в плазме можно достигать, например, при пероральном введении традипитанта в виде твердых лекарственных форм с немедленным высвобождением один раз в день в более высокой дозе или форм с немедленным высвобождением с улучшенной биодоступностью или форм с контролируемым высвобождением или при пероральном введении традипитанта несколько раз в день, например, два или более раз в день, в более низкой дозе в виде форм с немедленным высвобождением или с контролируемым высвобождением. В то время как данные испытаний указывают на возможность достижения эффективной концентрации в плазме через приблизительно 12-18 ч, например, приблизительно 15 ч, после лечения традипитанта в дозе 100 мг/день в виде твердой формы, то есть капсул с немедленным высвобождением, следует понимать, что можно достигать эффективных концентраций в плазме с использованием различных доз и/или различных составов, включая, но не ограничиваясь перечисленным, составы с контролируемым высвобождением.
В заключение, следует отметить, что несмотря на то, что в ходе данных испытаний не был показан общий эффект предварительно определенной дозы традипитанта, в основном, из-за значительного эффекта плацебо, испытания свидетельствуют о взаимосвязи РК и ответной реакции, а также о значительных благоприятных эффектах в группе пациентов, которых обследовали в моменты более высоких концентраций традипитанта. В ходе этих испытаний традипитант в дозе 100 мг один раз в день характеризовался хорошей переносимостью и низким профилем нежелательных явлений, который был подобен показателю для плацебо.
Лечение пациента может продолжаться до тех пор, пока симптомы зуда у пациента не будут улучшены или устранены, например, улучшены таким образом, что пациент способен более или менее нормально функционировать в период бодрствования и более или менее нормально спать в часы, отведенные для сна.
Как описано выше, данные свидетельствуют о том, что пациентов, страдающих от зуда, например от зуда, связанного с атопическим дерматитом, можно лечить при пероральном введении традипитанта. Следующие испытания демонстрируют безопасность и эффективность различных схем введения доз.
Пример 2
Уровни концентрации традипитанта в плазме
В ходе испытаний здоровые участники принимали перорально 85 мг традипитанта в день испытания 3, и затем 85 мг традипитанта каждые 12 ч (Q12H) в дни испытания 4-16. Уровни концентрации традипитанта в плазме измеряли в день 3, день 7 и день 11.
В ходе этих испытаний было установлено, что введение 85 мг традипитанта один раз в день (в день 3) приводит к средней концентрации в плазме в течение 0-12 ч, что составляет приблизительно 50% от концентрации в плазме, наблюдаемой в группе РМ в Примере 1. В дни 7 и 11 средняя концентрация в плазме в течение 0-12 ч после введения традипитанта 85 мг два раза в день (bid, в частности, Q12H) составляет около 150% от концентрации в плазме, наблюдаемой в группе РМ в Примере 1. Средняя концентрация в плазме в течение 0-12 ч в каждый момент измерений определяли при делении значения AUC (в единицах (ч) × (нг/мл)) в течение 0-12 ч на 12 ч.
Эти результаты свидетельствуют о том, что пациентов, страдающих от зуда, например от зуда, связанного с атопическим дерматитом, можно лечить при пероральном введении традипитанта, например, в виде формы IV или формы V (или его фармацевтически приемлемой соли) в количестве 85 мг два раза в день, например 85 мг Q12H, чтобы достигать концентраций в плазме выше 125 нг/мл, наблюдаемых в группе РМ в Примере 1.
Пример 3
Лечение традипитантом хронического зуда, связанного с атопическим дерматитом
Проводили многоцентровое, рандомизированное, двойным-слепым методом, плацебо-контролируемое клиническое испытание фазы II, («Традипитант при терапевтически резистентном зуде, связанным с атопическим дерматитом», испытания clintrials.gov ID NCT02651714) для определения эффективности традипитанта по сравнению с плацебо при снижении хронического зуда по показателям, измеренным по шкале VAS.
Методы
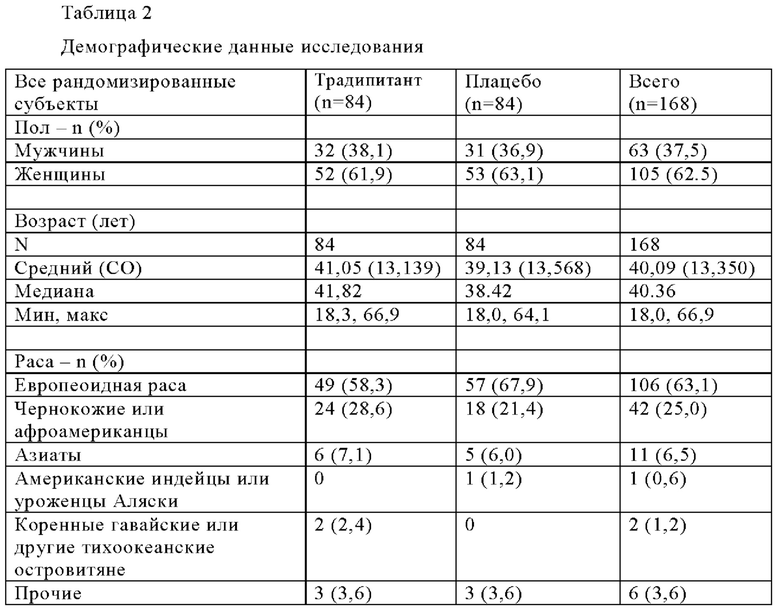
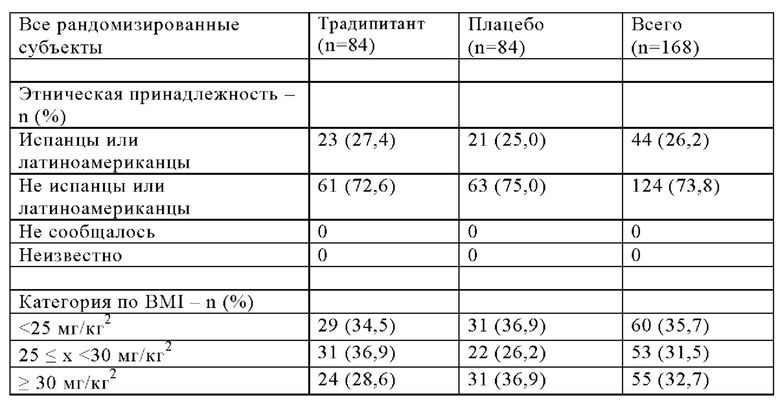
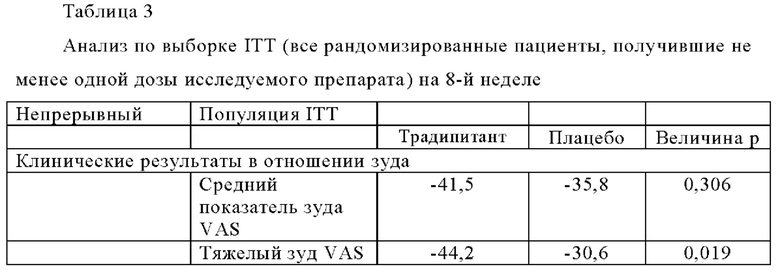
Критерии включения в испытания включают хронический (≥6 недель) зуд, связанный с атопическим дерматитом, резистентным к лечению в анамнезе пациента, средний показатель зуда по шкале VAS≥70 мм (из 100 мм), показатель по вербальной рейтинговой шкале (VRS)≥3 по меньшей мере в один из последних трех дней до рандомизации, и показатель SCORAD<80. Демографические данные исследования приведены в Таблице 2 ниже.
BMI - индекс массы тела
Пациентов рандомизировали в группы приема либо 85 мг традипитанта либо плацебо (1:1) два раза в день (bid). Схема многоцентрового, рандомизированного, двойным-слепым методом, плацебо-контролируемого клинического испытания показана на Фиг. 3. Индивидуумам с хроническим зудом, связанным с атопическим дерматитом, вводили 85 мг традипитанта или плацебо BID в течение 8 недель. Среднюю тяжесть зуда и наивысшую степень тяжести зуда оценивали по параметрам VAS, и параметры VRS оценивали каждые две недели. Кроме того, лечение оценивали два раза в неделю с использованием объективной и субъективной оценки индекса атопического дерматита (SCORAD) (Severity Scoring of Atopic Dermatitis: The SCORAD Index, Consensus Report of the European Task Force on Atopic Dermatitis, Dermatology 1993; 186:23-31) и Eczema Area and Severity Index (EASI) (Hanifin et al., The eczema area and severity index (EASI): assessment of reliability in atopic dermatitis, Experimental Dermatology 10(1): 11-18 (2001)).
В ходе испытаний также использовали шкалу общей клинической оценки изменений (CGI-C), шкалу общей оценки состояния пациентом (PGIC) в отношении как зуда, так и атопического дерматита, индекс пользы для пациента (PBI) и SKINDEX-16. Дважды в день пациенты заполняли анкеты, чтобы сообщить о тяжелом и среднем зуде по цифровой рейтинговой шкале (NRS).
Объективная оценка SCORAD включает параметры, включающие распространенность, интенсивность, ссадины, эритему, мокнутие или коросту, присутствие отека или папул, лихенизацию и сухость кожи. Субъективная оценка SCORAD включает оценку пациентом зуда и бессонницы.
Результаты
Как было указано, 168 пациентов-участников испытания рандомизировали в группы приема BID традипитанта (n=84) и плацебо (n=84). Среди 84 пациентов, рандомизированных в группу приема традипитанта, 56 пациентов завершили испытания, а 28 пациентов досрочно завершили испытания. Среди 84 пациентов, рандомизированных в группу приема плацебо, 59 пациентов завершили испытания, а 25 пациентов досрочно завершили испытания.
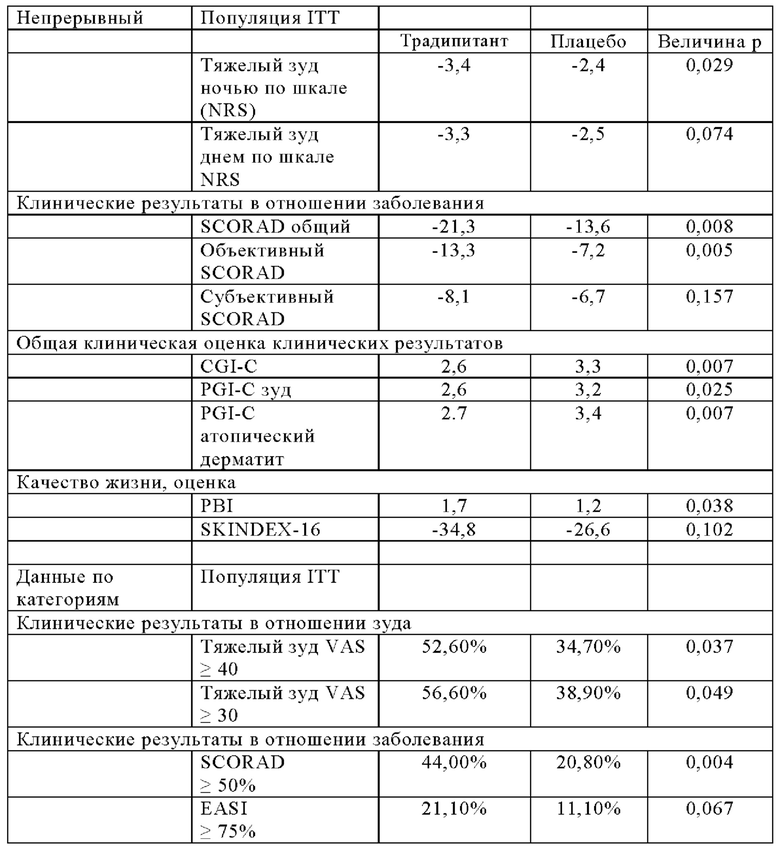
Результаты этих испытаний показаны в Таблицах 3-4, а также на Фиг. 4-5. Аналогично результатам испытаний в группе AM, описанных в Примере 1, наблюдаются статистически значимые различия между группами традипитанта и плацебо в отношении тяжелого зуда ((р=0,019), РВ1 (р=0,038), CGIC (р=0,007) и объективной оценки по шкале SCORAD scale (р=0,005). При этом эффекты лечения как зуда, так и тяжести заболевания, проявляются уже на 2-й неделе (Фиг. 4-5). Множество симптомов атопического дерматита регистрировали с помощью анкет для ежедневого заполнения, в которых также демонстрировали различия ранее, чем на 2-й неделе.
Эти результаты также показывают статистически значимые различия в отношении оценок по шкале PGI-C как зуда, так и атопического дерматита (р=0,0246 и 0,007, соответственно), а также доли пациентов у которых улучшение оценки по шкале SCORAD составило 50% или более, или улучшение у 75% или более по шкале EASI статистически значимо выше у пациентов, получавших традипитант по сравнению с плацебо.

Выводы
Описанные выше результаты свидетельствуют о том, что традипитант снижает интенсивность тяжелого зуда у пациентов, а также тяжесть заболевания атопическим дерматитом. Традипитант характеризуется значительным и клинически значимым улучшением при проведении ряда мер по снижению интенсивности зуда. Прежде всего, значительные улучшения наблюдаются при измерении параметров тяжелого зуда по шкале VAS (р=0,019). Традипитант также оказывает значительное действие по данным оценки пациентов с ответной реакцией на лечение тяжелого зуда с улучшением более или равным 40 пунктам по сравнению с базовой линией по шкале тяжелого зуда VAS (р=0,037) или более или равным 30 пунктам (р=0,049). При оценке предварительно определенного основного конечного показателя среднего зуда по шкале VAS, традипитант характеризуется улучшением по сравнению с плацебо, но такое улучшение не является значимым из-за высокого эффекта плацебо и недостаточной чувствительности этого измерения.
Согласно наблюдаемым улучшениям по шкале тяжелого зуда, которые связаны с расчесыванием, традипитант также характеризуется модифицирующими заболевание свойствами, то есть значительным улучшением по шкале общего параметра SCORAD (р=0,008) и шкале объективного SCORAD (р=0,005). В частности, традипитант характеризуется значительными улучшениями по нескольким клиническим показателям тяжести атопического дерматита, включая экскориацию, эритему, мокнутие и сухость.
Указанные клинически значимые эффекты также связаны со значительными улучшениями по шкале Общая Клиническая оценка Изменения (CGI-C) (р=0,007), по шкале Общая Клиническая оценка пациентом зуда (PGI-C) (р=0,024), и по шкале PGI-C атопический дерматит (р=0.007). Аналогичным образом, традипитант также характеризуется преимуществами, напрямую сообщаемыми пациентами по данным оценки согласно индексу пользы для пациента (РВ1) (р=0,037). Эти улучшения, а также улучшения по данным оценки по индексу тяжести и площади экземы (EASI, измерение степени (доля поражения в каждом из четырех отделов тела: голова и шея, туловище, верхние конечности и нижние конечности) и тяжести заболевания (оценка покраснения, толщины, расчесывания и лихенификации)) демонстрируют эффективность традипитанта в улучшении показателей тяжести основного заболевания атопическим дерматитом в дополнение к симптомам зуда.
Пример 4
Иммуноглобулин Е
В ходе описанных выше в Примере 3 испытаний проводили поисковое исследование для оценки уровней иммуноглобулина Е (IgE) и эффекта лечения атопического дерматита и зуда традипитантом. Для целей исследования участники испытаний с уровнем IgE, превышающим или равным 100 кЕ/л, считались пациентами с высоким уровнем IgE, тогда как участники испытаний с уровнем IgE менее 100 кЕ/л считались пациентами с низким уровнем IgE. Исходное среднее значение и общий диапазон показателей SCORAD для каждой исследуемой популяции, группы с высоким IgE и группы с низким IgE, показаны ниже в Таблице 5.
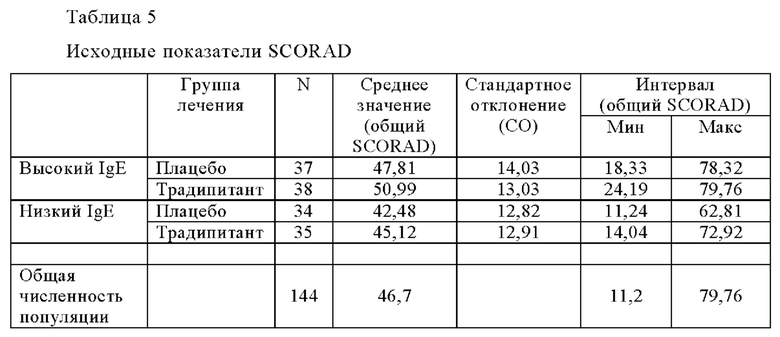
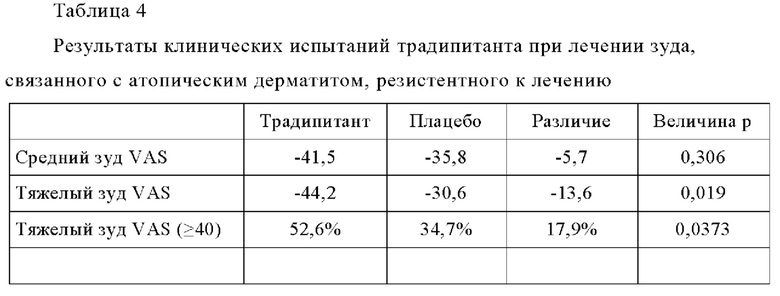
Среднее значение и интервал общих значений SCORAD, указанные в Таблице 5, показывают что исследуемая популяция подвергается разным уровням тяжести заболевания, от легкой до тяжелой степени тяжести. В Таблице 5 также показано сходство тяжести заболевания между группами с высоким уровнем IgE и группами с низким уровнем IgE. В Таблице 6 (ниже) представлены результаты испытаний традипитанта при лечении зуда, связанного с атопическим дерматитом, резистентным к лечению, у индивидуумов с высокими исходными уровнями IgE (IgE≥100 кЕ/л), а в Таблице 7 (ниже) представлены результаты испытаний традипитанта при лечении зуда, связанного с атопическим дерматитом, резистентным к лечению, у индивидуумов с низкими исходными уровнями IgE (IgE<100 кЕ/л). Данные, приведенные в Таблицах 6-7, представляют собой разделение по уровню IgE данных, приведенных в Таблице 4 выше.
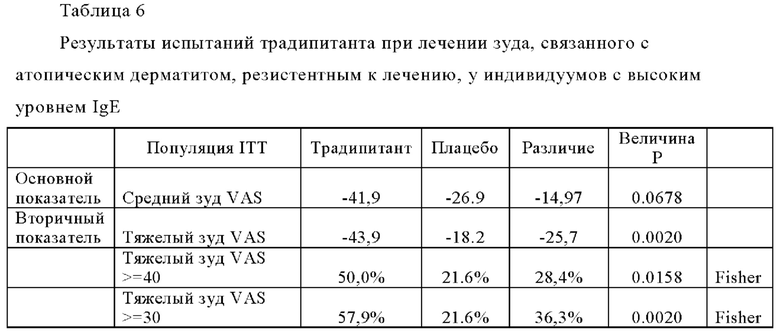
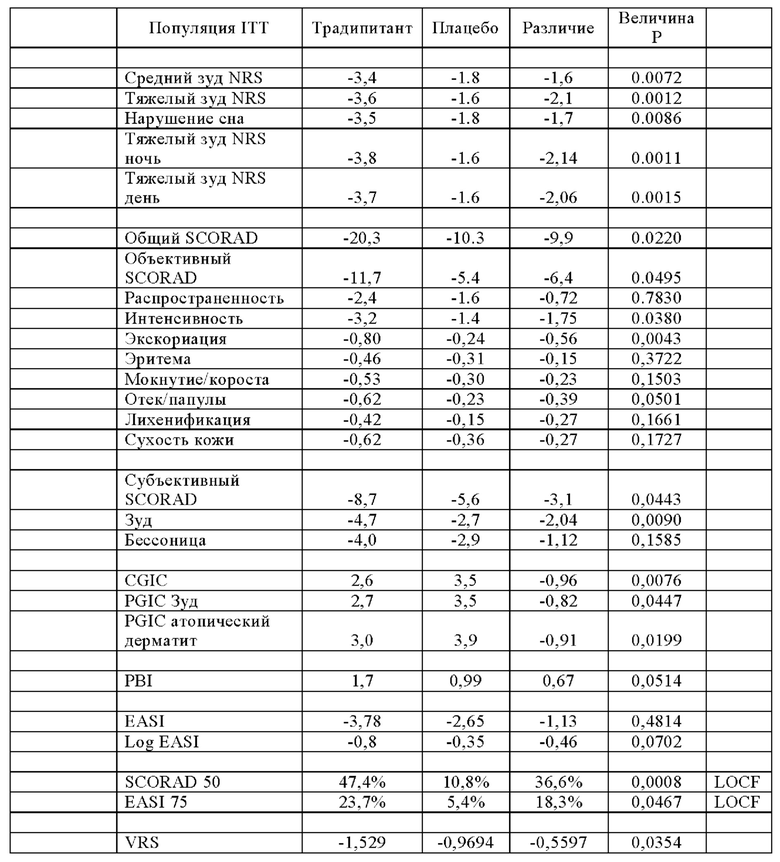
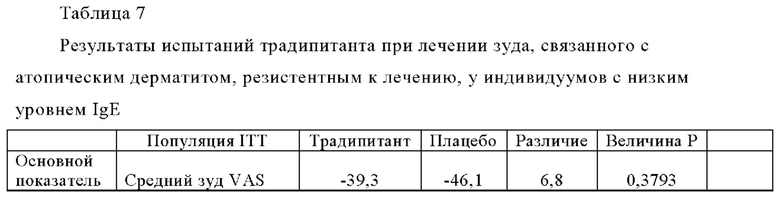
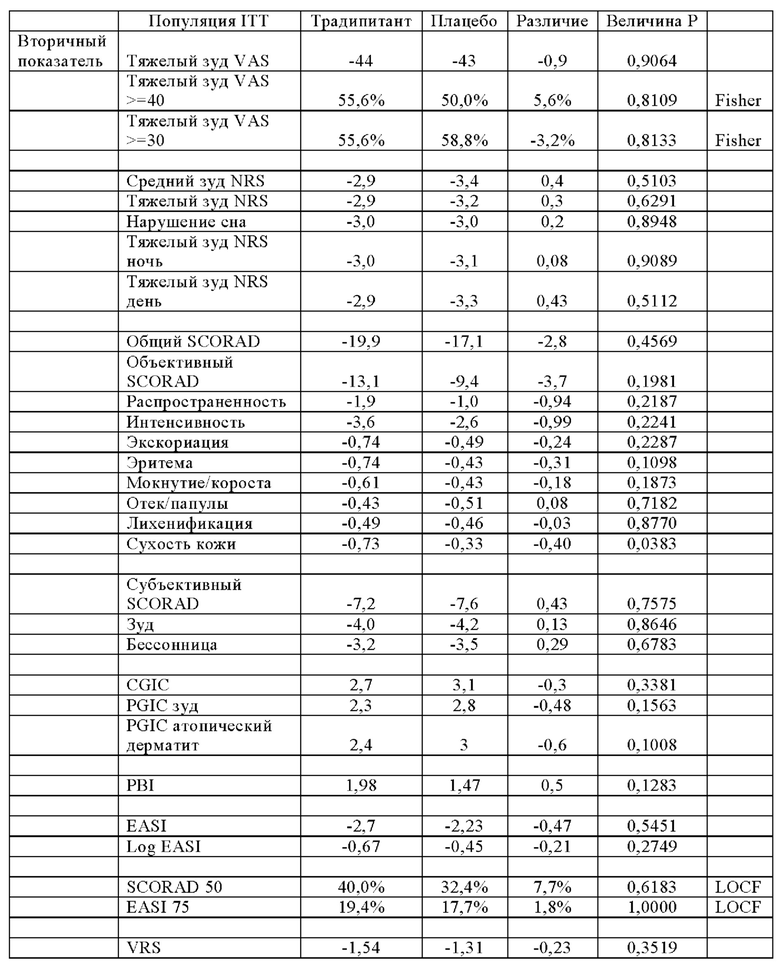
В Таблицах 6-7 показаны результаты по сравнению с исходными показателями. Как продемонстрировано в Таблице 6, у пациентов с высоким исходным значением IgE наблюдается значительный эффект традипитанта (р<0,05) по большинству исследованных показателей, включая, например, тяжелый зуд и сон. Неожиданно было установлено, что при сравнении индивидуумов с низкими уровнями IgE (Таблица 7), у индивидуумов с высокими уровнями IgE (Таблица 6) также наблюдаются значительные лечебные эффекты по показателям тяжести заболевания атопическим дерматититом. По данным того же самого анализа в 8-ю неделю, у 47% пациентов, получавших лечение традипитантом, достигалось по меньшей мере 50-процентное снижение показателя SCORAD (SCORAD 50) по сравнению с 11% пациентов, получавших плацебо (р=0,0008).
Для целей настоящего исследования, индивидуумов с уровнем IgE более или равным 100 кЕ/л рассматривали как пациентов с высокими уровнями IgE, а пациентов с уровнем IgE менее 100 кЕ/л, рассматривали как пациентов с низкими уровнями IgE. Проводили также дополнительные исследования, в которых индивидуумов с высокими уровнями IgE рассматривали как пациентов с уровнями IgE от более или равными 50 кЕ/л до более или равными 300 кЕ/л. Как в отношении зуда, так и в отношении тяжести заболевания, значительно более высокий лечебный эффект наблюдался в группе с высоким уровнем IgE по сравнению с группой с низким уровнем IgE, независимо от того, определяется ли группа с высоким IgE по следующим значениям, например IgE≥50 кЕ/л, ≥100 кЕ/л, или ≥300 кЕ/л, и определяется ли группа с низким IgE по следующим значениям, например IgE <50 кЕ/л, <100 кЕ/л или <300 кЕ/л. В качестве предельного значения для группы с высоким уровнем IgE, для наиболее подробного исследования (Таблицы 6-7) было выбрано значение, превышающее или равное 100 кЕ/л, в качестве значения, которое рассматривается контрольной лабораторией в качестве верхнего предела нормального диапазона для взрослых. На основании этих результатов и экстраполяции нормального диапазона у детей можно также определить группу с высоким уровнем IgE в педиатрической популяции по эффекту традипитанта на зуд и тяжесть заболевания при атопическом дерматите.
На основании этих данных можно сделать вывод о том, что у пациентов с высокими исходными уровнями IgE наблюдается более значительная степень воздействия как на зуд, так и на тяжесть заболевания по сравнению с пациентами с низким уровнем IgE. Хотя значение 100 кЕ/л использовали в качестве предельного для разграничения между высокими и низкими уровнями IgE в Таблицах 6-7, следует отметить, что индивидуумов с уровнями IgE, например более 75 кЕ/л, более 100 кЕ/л, более 150 кЕ/л, более 200 кЕ/л, 30-700 кЕ/л, 50-200 кЕ/л, 100-200 кЕ/л или 200-2000 кЕ/л, можно рассматривать как пациентов с высокими уровнями IgE. Соответственно, индивидуумов с уровнями IgE, например более 75 кЕ/л, более 100 кЕ/л, более 150 кЕ/л, более 200 кЕ/л, 30-700 кЕ/л, 50-200 кЕ/л, 100-200 кЕ/л или 200-2000 кЕ/л, можно отбирать, например, для лечения антагонистом рецептора NK-1, таким как традипитант.
Кроме того, полученные данные указывают на то, что традипитант оказывает значительный модифицирующий эффект на заболевание в отношении атопического дерматита Этот эффект можно оценивать количественно, используя такие показатели, как например, IGA, EASI, SCORAD, CGIC и PGIC, а также соответствующие признаки и симптомы атопического дерматита.
Пример 5
Генетические модификаторы IgE
Для идентификации генетических факторов риска, которые приводят к разрегуляции IgE, проводили полногеномное исследование ассоциаций с использованием полногеномного секвенирования 117 образцов атопического дерматита. С использованием линейной регрессии, напрямую исследовали связь между 14322979 однонуклеотидных полиморфизмов (SNP) и логарифмически трансформированными уровнями IgE. Наиболее высоко значимые локусы функциональной релевантности включают LRP1B, IL20RA и IL22RA2 (см. Таблицу 8 ниже).
LRP1B, IL20RA и IL22RA2 и IgE
SNP, которые связаны с разрегуляцией IgE, включают сильный сигнал в области 6q23, которая содержит гены иммунного ответа, такие как альфа субъединица рецептора интерлейкина 20 (IL20RA) и альфа субъединица рецептора интерлейкина 22 (IL22RA2). Это семейство цитокинов может оказывать про-воспалительный эффект и может принимать участие в воспалении кожи. Топ-локусы этого исследования характеризуются повышенной активностью рецептора цитокина и связыванием интерлейкина-20 (GO: 0042018, GO: 0042020).
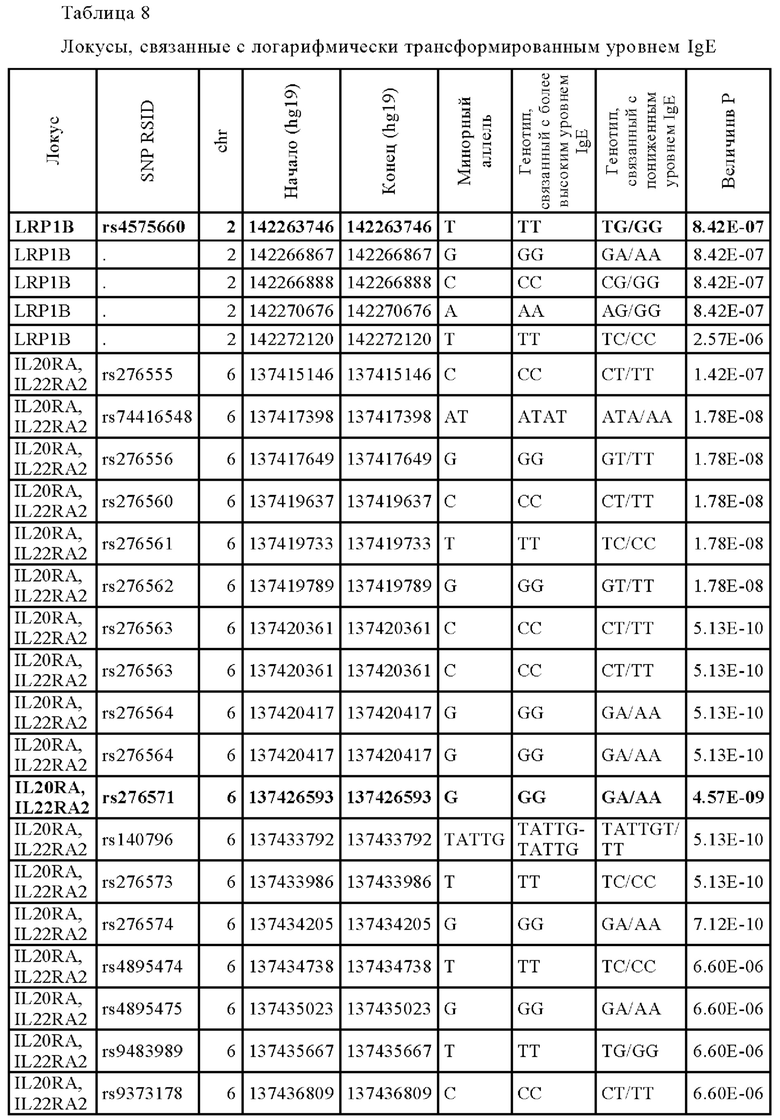
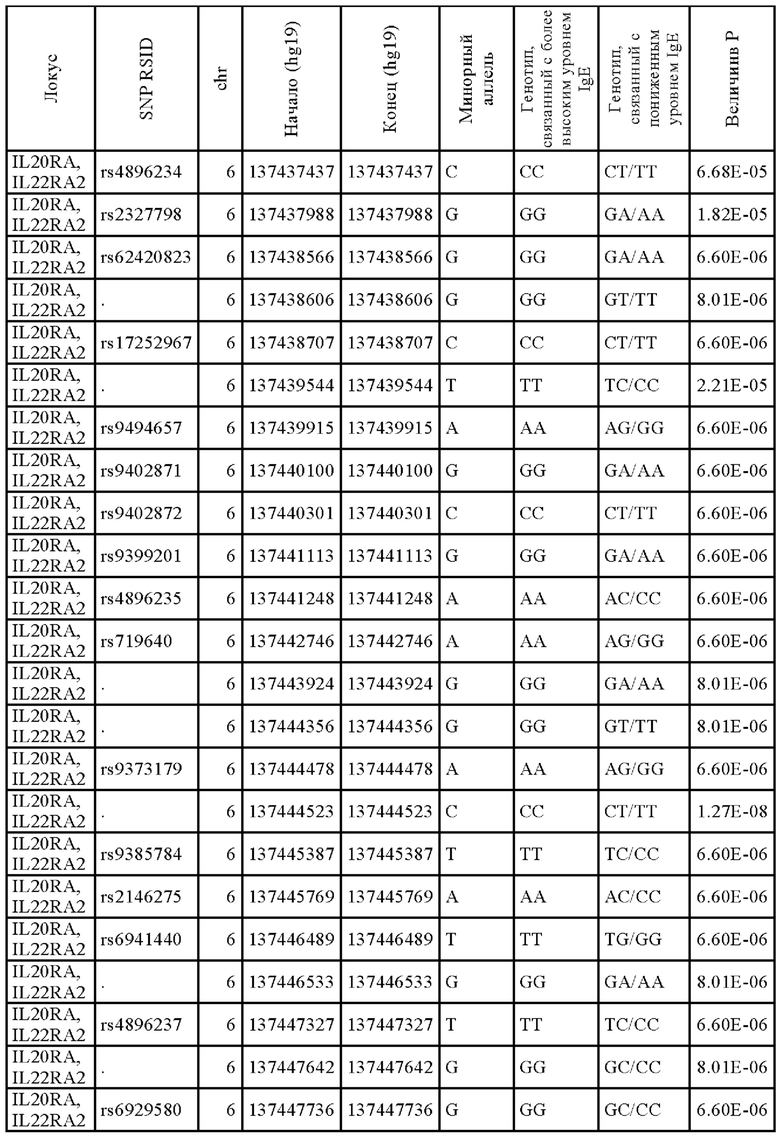
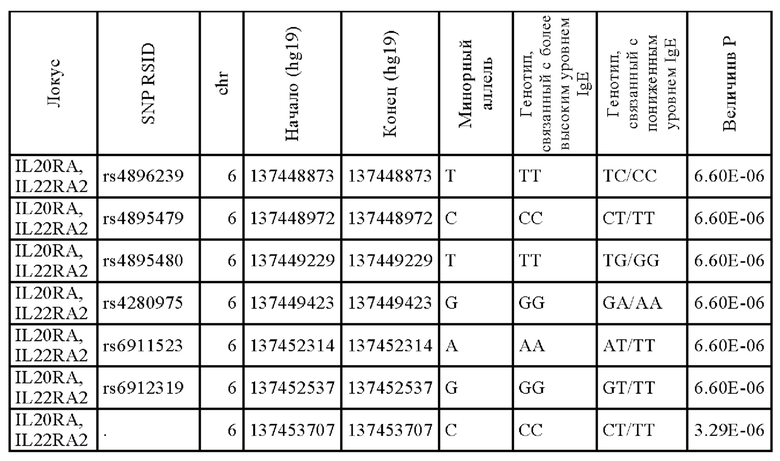
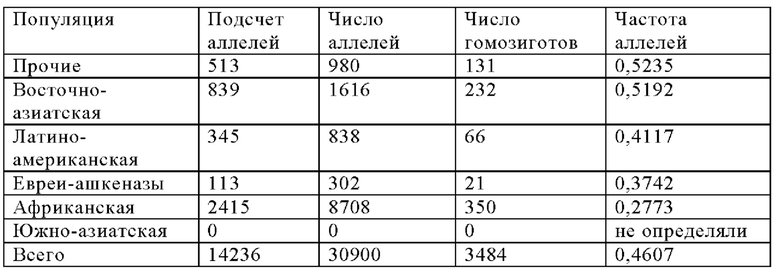
Как показано на Фиг. 6, SNP rs276571 (Таблица 8) является типичным SNP, связанным с высокими уровнями IgE, так что у индивидуумов с генотипом GG rs276571 наблюдаются более высокие уровни IgE, чем у индивидуумов с генотипами AG или AA rs276571. Кроме того, как показано на Фиг. 7, идентифицированный вариант не только является модификатором уровня IgE, но также оказывает значительное влияние на исходный SCORAD. В частности, генотип GG rs276571 обеспечивает значительно более высокие исходные параметры SCORAD тяжести заболевания атопическим дерматитом по сравнению с генотипами АА или AG rs276571. Аллель риска также коррелирует с более высокой экспрессией IL20RA. Было установлено, что локус rs276571 является значимым локусом количественного признака в экспрессии (eQTL) для IL20RA в тканеспецифичном генотипе экспрессии (GTEx). В приведенной ниже Таблице 9 представлены популяционные частоты аллелей rs276571.
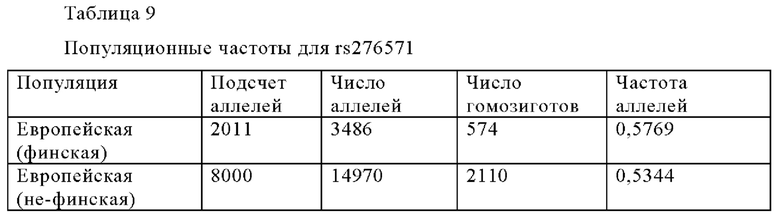
Другой представляющий интерес SNP - rs4575660 (Таблица 8), найденный в гене LRP1B, также связан с уровнем IgE. Как показано на Фиг. 8, у индивидуумов с генотипом ТТ rs4575660 наблюдается значительно более высокие уровни IgE, чем у индивидуумов с генотипами TG или GG rs4575660. В локусе rs4575660 минорный аллель обеспечивает более высокий уровень IgE. Как дополнительно обсуждается ниже, варианты LRP1B представляют особый интерес в связи с их связью с показателями VAS и SCORAD, как обсуждается ниже в Примере 6.
ADAM33 и IgE
Кроме того, миссенс-вариант rs2280090, найденный в гене 33 дисинтегрина и металлопротеазы (ADAM33), также связан с разрегуляцией IgE. Как показано на Фиг. 9, у индивидуумов с гетерозиготным генотипом AG rs2280090 наблюдаются значительно более высокие уровни IgE, чем у индивидуумов с генотипом GG rs2280090. Среди участников исследования число человек с генотипом AA rs2280090 составляло n=0.
Выводы
Как было описано выше в Примере 4, у индивидуумов с высокими исходными уровнями IgE наблюдается более высокая величина лечебного эффекта традипитанта в отношении тяжести как зуда, так и заболевания атопическим дерматитом, чем у пациентов с низкими уровнями IgE. Следовательно, для пациентов, страдающих от атопического дерматита, генотипы которых включают один или более генотипов SNP, указанных в Таблице 8 как связанные с высоким уровнем IgE, можно ожидать более значительную величину лечебного эффекта традипитанта в отношении тяжести как зуда, так и заболевания атопическим дерматитом, чем у пациентов, последовательности генов которых не включают любой из SNP, указанных в Таблице 8 как связанные с высоким IgE.
Пример 6
Генетические маркеры, коррелирующиеся с ответной реакцией на лечение традипитантом
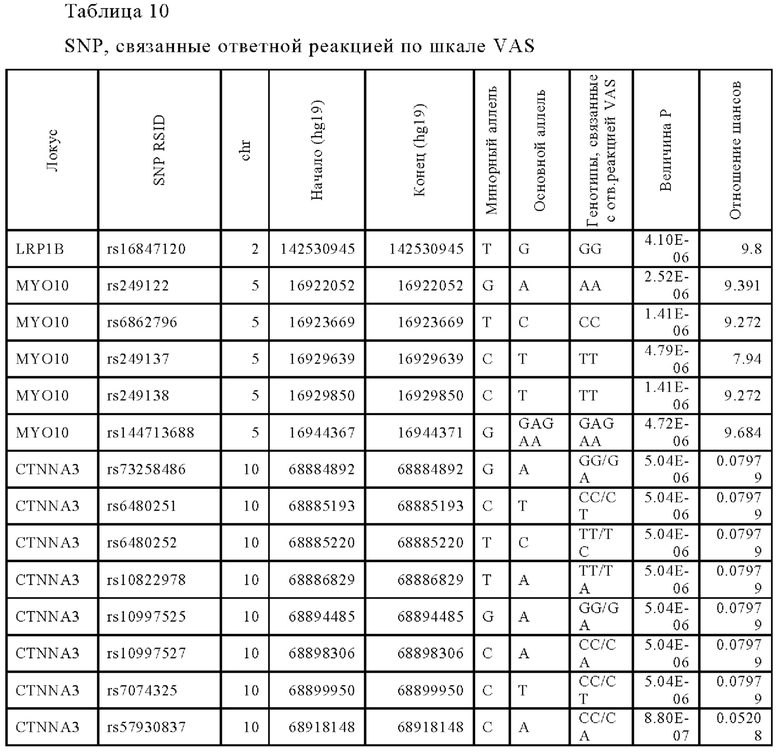
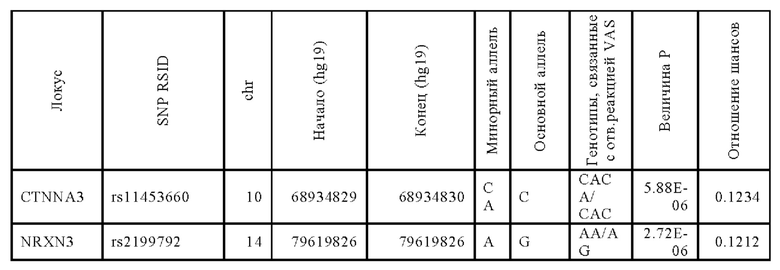
Следующее исследование проводили для идентификации дополнительных генетических маркеров, которые напрямую коррелируются с положительной ответной реакцией на лечение традипитантом. Для идентификации генетических маркеров проводили ассоциативный анализ с использованием логистической аддитивной модели. Визуально-аналоговую шкалу (VAS) использовали в качестве критерия результатов ответной реакции. Идентифицированные варианты указаны ниже в Таблице 10.
Кроме того, было установлено, что вариант в CTNNA3, rs57930837, характеризуется значительным различием между пациентами с ответной реакцией на лечение атопического дерматита и пациентами без ответной реакции на лечение атопического дерматита. Как показано на Фиг. 10, у большинства носителей минорного аллеля наблюдается ответная реакция на лечение атопического дерматита традипитантом по сравнению с носителями, у которых отсутствует ответная реакция на такое лечение. На Фиг. 11 представлена иллюстрация числа пациентов с ответной реакцией и без ответной реакции на лечение традипитантом, разделенных по генотипу rs57930837. Как видно, у всех индивидуумов с генотипом СС rs57930837 наблюдается ответная реакция на лечение, у большинства индивидуумов с генотипом СА rs57930837 наблюдается ответная реакция на лечение, а у большинства индивидуумов с генотипом AA rs57930837 ответная реакция на лечение отсутствует.Было установлено, что вариант rs57930837 характеризуется повышенной частотой минорного аллеля (MAF) (0,44) по сравнению с контрольными образцами (0,04). Кроме маркера ответной реакции, было установлено, что существует значительное различие уровня IgE у индивидуумов с генотипами СС/СА по сравнению с генотипом АА в этом локусе, как показано на Фиг. 12. Для этого варианта по результатам этого анализа достигается наиболее высокий уровень значимости (rs57930837, Р=2.19×10-7, 7% по сравнению с 83%).
Чтобы оценить биологические последствия топ-локусов, отличающих пациентов с ответной реакцией от пациентов без ответной реакции, проводили анализ представленных групп генов. Другие важные локусы указывают на липопротеины LRP1B (несинонимичный вариант), MYO10 и NRXN3, обогащенные активностью рецептора липопротеинов низкой плотности (GO: 0005041) и активностью биоактивного рецептора липидов (GO: 0045125). SNP rs57930837 отображается в области открытого хроматина, характеризующегося гиперчувствительностью к ДНКазе, и демонстрирует присутствие Foxp1 и других регуляторных мотивов.
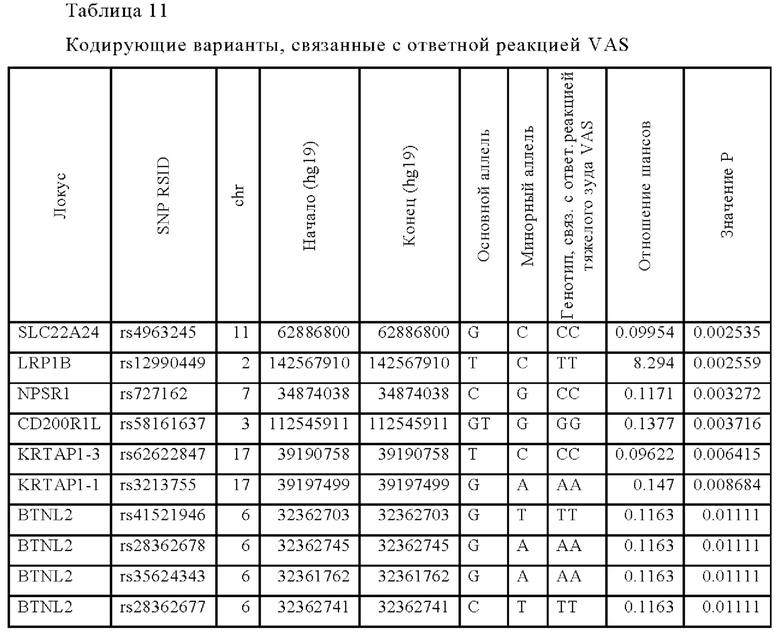
Используя топ-значимые SNP, выбранные по предельному значению р, индивидуумов классифицировали по статусу пациентов с ответной реакцией на лечение традипитантом, со значением AUC 0,95 (10-кратная перекрестная проверка). Варианты потери функции (LOF) и кодирующие белки варианты исследовали по результатам оценки VAS в когорте случаев. Значимые варианты были выявлены в генах NPSR1, KRTAP1-1, CD200R1L, LRP1B и BTNL2, как показано в Таблице 11.
Кроме того, в когорте получавших лечение, как описано в Примере 4, Таблице 6, топ-локусами, идентифицированными по модифицирующему изменению тяжелого зуда (VAS), являются варианты, локализованные в гене INADL, как показано ниже в Таблице 12.
Как показано на Фиг. 13, минорный аллель rs11207834 связан со сниженной ответной реакцией на лечение 85 мг традипитантом два раза в день (bid) по показателям изменения тяжелого зуда (VAS). Наоборот, у пациентов, страдающих от атопического дерматита, у которых генотипом rs11207834 является генотип ТТ, наблюдается улучшение по шкале зуда, и можно ожидать, что у таких индивидуумов будет наблюдаться более высокий эффект после лечения.
Хотя здесь описаны различные варианты осуществления настоящего изобретения, на основании настоящего описания следует понимать, что специалисты в данной области техники могут использовать различные комбинации элементов, вариантов и улучшений, которые включены в объем настоящего изобретения. Кроме того, можно осуществлять множество модификаций для того, чтобы привести в соответствие идеи настоящего изобретения с конкретной ситуацией или материалом, не выходя за пределы его существенного объема. Следовательно, предполагается, что изобретение не ограничивается конкретным раскрытым вариантом осуществления, но что изобретение будет включать в себя все варианты осуществления, включенные в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСОВЕРШЕНСТВОВАННОЕ ЛЕЧЕНИЕ АТОПИЧЕСКОГО ДЕРМАТИТА ТРАДИПИТАНТОМ | 2018 |
|
RU2812890C2 |
| СПОСОБ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ТРАДИПИТАНТА | 2016 |
|
RU2770050C2 |
| СПОСОБ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ТРАДИПИТАНТА | 2016 |
|
RU2810253C2 |
| Способ прогнозирования повышенного риска развития хронической истинной экземы у мужчин с использованием данных о полиморфизме гена филаггрина | 2021 |
|
RU2750963C1 |
| ЛЕЧЕНИЕ АТОПИЧЕСКОГО ДЕРМАТИТА С ПОМОЩЬЮ ТРАДИПИТАНТА | 2021 |
|
RU2818164C1 |
| СПОСОБ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА У ДЕТЕЙ | 2006 |
|
RU2348423C2 |
| СПОСОБ ПРОГНОЗА ТЕЧЕНИЯ И ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА | 2015 |
|
RU2603463C1 |
| СПОСОБЫ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА С ПОМОЩЬЮ АНТАГОНИСТА IL-4R | 2013 |
|
RU2698907C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА С ПОМОЩЬЮ АНТАГОНИСТА IL-4R | 2013 |
|
RU2666630C2 |
| СПОСОБЫ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ АЛЛЕРГИИ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2017 |
|
RU2777328C2 |

Изобретение относится к области медицины, а именно к терапии и дерматологии, и предназначено для лечения пациента, страдающего от зуда или атопического дерматита. Способ лечения пациента, страдающего от зуда или атопического дерматита, включает определение, присутствует или нет биомаркер, который связан с эффектом лечения традипитантом, в биологическом образце от пациента. Если биомаркер, связанный с эффектом лечения традипитантом, присутствует, то пациенту вводят традипитант или его фармацевтически приемлемую соль в дозе, которая является обычной дозой, которая была бы выбрана без проведения стадии определения. Использование изобретения обеспечивает безопасное и эффективное лечение в режиме мототерапии хронического зуда у пациентов, страдающих от атопического дерматита. 13 з.п. ф-лы, 13 ил., 12 табл., 6 пр.
1. Способ лечения пациента, страдающего от зуда или атопического дерматита, который характеризуется путем:
определения, присутствует или нет биомаркер, который связан с эффектом лечения традипитантом, в биологическом образце от пациента, где биомаркер, связанный с эффектом лечения традипитантом, представляет собой:
a) генотип пациента по SNP, который связан с исходным уровнем IgE, выбранный из группы, состоящей из:
rs4575660, rs276555, rs74416548, rs276556, rs276560, rs276561, rs276562, rs276563, rs276563, rs276564, rs276564, rs276571, rs140796, rs276573, rs276574, rs4895474, rs4895475, rs9483989, rs9373178, rs4896234, rs2327798, rs62420823, rs17252967, rs9494657, rs9402871, rs9402872, rs9399201, rs4896235, rs719640, rs9373179, rs9385784, rs2146275, rs6941440, rs4896237, rs6929580, rs4896239, rs4895479, rs4895480, rs4280975, rs6911523, rs6912319, rs2280090 и rs57930837; или
b) генотип пациента no SNP, выбранный из группы, состоящей из:
rs16847120, rs249122, rs6862796, rs249137, rs249138, rs144713688, rs73258486, rs6480251, rs6480252, rs10822978, rs10997525, rs10997527, rs7074325, rs57930837, rs1 1453660, rs2199792, rs4963245, rs12990449, rs727162, rs58161637, rs62622847, rs3213755, rs41521946, rs28362678, rs35624343, rs28362677, rs11207832, rs1954436, rs11207834, rs370530530, rs11207838, rs150980554, rs7551886, rs6664979, rs12043665, rs12030784, rs79037385, rs74568317, rs3790575 и rs77939406; или
c) исходный уровень IgE пациента по сравнению с предельным значением уровня IgE; и
если биомаркер, связанный с эффектом лечения традипитантом, присутствует, то введение пациенту традипитанта или его фармацевтически приемлемой соли в дозе, которая является обычной дозой, которая была бы выбрана без проведения стадии определения.
2. Способ по п. 1, дополнительно включающий:
если биомаркер, связанный с эффектом лечения традипитантом, не присутствует, то введение пациенту традипитанта в дозе, которая является более высокой, чем обычная доза.
3. Способ по п. 1 или 2, где биомаркер в а) присутствует, если SNP генотип выбран из группы, состоящей из:
rs4575660 ТТ, rs276555 СС, rs74416548 АТАТ, rs276556 GG, rs276560 СС, rs276561 ТТ, rs276562 GG, rs276563 СС, rs276563 СС, rs276564 GG, rs276564 GG, rs276571 GG, rs140796 TATTGTATTG, rs276573 TT, rs276574 GG, rs4895474 TT, rs4895475 GG, rs9483989 TT, rs9373178 CC, rs4896234 CC, rs2327798 GG, rs62420823 GG, rs17252967 CC, rs9494657 AA, rs9402871 GG, rs9402872 CC, rs9399201 GG, rs4896235 AA, rs719640 AA, rs9373179 AA, rs9385784 TT, rs2146275 AA, rs6941440 TT, rs4896237 TT, rs6929580 GG, rs4896239 TT, rs4895479 CC, rs4895480 TT, rs4280975 GG, rs6911523 AA, rs6912319 GG, rs2280090 non-GG и rs57930837 non-AA; и
биомаркер в а) не присутствует, если SNP генотип выбран из группы, состоящей из:
rs4575660 non-TT, rs276555 non-CC, rs74416548 non-ATAT, rs276556 non-GG, rs276560 non-CC, rs276561 non-TT, rs276562 non-GG, rs276563 non-CC, rs276563 non-CC, rs276564 non-GG, rs276564 non-GG, rs276571 non-GG, rs140796 non-TATTGTATTG, rs276573 non-TT, rs276574 non-GG, rs4895474 non-TT, rs4895475 non-GG, rs9483989 non-TT, rs9373178 non-CC, rs4896234 non-CC, rs2327798 non-GG, rs62420823 non-GG, rs17252967 non-CC, rs9494657 non-AA, rs9402871 non-GG, rs9402872 non-CC, rs9399201 non-GG, rs4896235 non-AA, rs719640 non-AA, rs9373179 non-AA, rs9385784 non-TT, rs2146275 non-AA, rs6941440 non-TT, rs4896237 non-TT, rs6929580 non-GG, rs4896239 non-TT, rs4895479 non-CC, rs4895480 non-TT, rs4280975 non-GG, rs6911523 non-AA, rs6912319 non-GG, rs2280090 GG и rs57930837 AA.
4. Способ по п. 1 или 2, где биомаркер в b) присутствует, если SNP генотип выбран из группы, состоящей из:
rs16847120 GG, rs249122 AA, rs6862796 CC, rs249137 TT, rs249138 TT, rs144713688 GAGAA, rs73258486 GG/GA, rs6480251 CC/CT, rs6480252 TT/TC, rs10822978 TT/TA, rs10997525 GG/GA, rs10997527 CC/CA, rs7074325 CC/CT, rs57930837 CC/CA, rs11453660 CACA/CAC, rs2199792 AA/AG, rs4963245 non-CC, rs12990449 non-TT, rs727162 non-CC, rs58161637 non-GG, rs62622847 non-CC, rs3213755 non-AA, rs41521946 non-TT, rs28362678 non-AA, rs35624343 non-AA, rs28362677 non-TT, rs11207832 non-CC, rs1954436 non-CC, rs11207834 non-CC, rs370530530 non-CTCT, rs11207838 non-TT, rs150980554 non-AA, rs7551886 non-CC, rs6664979 non-CC, rs12043665 non-AA, rs12030784 non-TT, rs79037385 non-GG, rs74568317 non-CC, rs3790575 non-CC и rs77939406 non-GG; и
где биомаркер в b) не присутствует, если SNP генотип выбран из группы, состоящей из:
rs16847120 non-GG, rs249122 non-AA, rs6862796 non-CC, rs249137 non-TT, rs249138 non-TT, rs144713688 non-GAGAA, rs73258486 non-GG/GA, rs6480251 non-CC/CT, rs6480252 non-TT/TC, rs10822978 non-TT/TA, rs10997525 non-GG/GA, rs10997527 non-CC/CA, rs7074325 non-CC/CT, rs57930837 non-CC/CA, rs11453660 non-CACA/CAC, rs2199792 non-AA/AG, rs4963245 CC, rs12990449 TT, rs727162 CC, rs58161637 GG, rs62622847 CC, rs3213755 AA, rs41521946 TT, rs28362678 AA, rs35624343 AA, rs28362677 TT, rs11207832 CC, rs1954436 CC, rs11207834 CC, rs370530530 CTCT, rs11207838 TT, rs150980554 AA, rs7551886 CC, rs6664979 CC, rs12043665 AA, rs12030784 TT, rs79037385 GG, rs74568317 CC, rs3790575 CC и rs77939406 GG.
5. Способ по п. 1 или 2, где:
биомаркер в с) присутствует, если исходный уровень IgE пациента выше предельного значения,
биомаркер в с) не присутствует, если исходный уровень IgE пациента ниже предельного значения, и
предельное значение уровня превышает или равно 50 кЕ/л.
6. Способ по п. 5, где предельное значение уровня, превышающее или равное 50 кЕ/л, составляет больше или равно 75 кЕ/л.
7. Способ по п. 6, где предельное значение уровня, превышающее или равное 50 кЕ/л, составляет больше или равно 100 кЕ/л.
8. Способ по п. 7, где предельное значение уровня, превышающее или равное 50 кЕ/л, составляет больше или равно 150 кЕ/л.
9. Способ по п. 8, где предельное значение уровня, превышающее или равное 50 кЕ/л, составляет больше или равно 200 кЕ/л.
10. Способ по п. 9, где предельное значение уровня, превышающее или равное 50 кЕ/л, составляет больше или равно 300 кЕ/л.
11. Способ по любому из пп. 1-10, где обычная доза традипитанта составляет 170 мг/день.
12. Способ по п. 11, где обычная доза традипитанта составляет 85 мг два раза в день (bid).
13. Способ по любому из пп. 2-10, где доза, которая является большей, чем обычная доза традипитанта, составляет от более 170 мг/день до 340 мг/день.
14. Способ по п. 13, где доза, которая является большей, чем обычная доза традипитанта, составляет от более 170 мг/день до 255 мг/день.
| WO 2016141341 A1, 09.09.2016 | |||
| JP 2006199614 A, 03.08.2006 | |||
| US 2013052190 A1, 28.02.2013 | |||
| WO 2007096782 A2, 30.08.2007 | |||
| OHMURA T et al | |||
| Involvement of substance P in scratching behaviour in an atopic dermatitis model | |||
| Eur J Pharmacol., 2004, 491(2-3):191-4. |
Авторы
Даты
2023-03-30—Публикация
2018-08-30—Подача