Область техники
Настоящее изобретение относится к контрастному веществу Т1 на основе ультратонких наночастиц оксида железа для магнитно-резонансной визуализации (MRI), и конкретнее, к контрастному веществу Т1 для магнитно-резонансной визуализации на основе наночастиц оксида железа одинородного размера, поверхность которых гидрофилизована.
Уровень техники
Магнитно-резонансная визуализация (магнитно-резонансная томография) (MRI) является методом получения анатомической, физиологической и биохимической информации об организме в виде изображений с использованием явления, при котором спины атомов водорода релаксируют в магнитном поле. MRI является одним из современных неинвазивных диагностических инструментов для визуализации органов живых людей и животных в реальном времени.
Для его разнообразного и точного использования в области биологических наук и медицины MRI выполняется путем введения инородных материалов в организм для повышения контрастности изображений. Такие материалы называются контрастными веществами. Суперпарамагнитные и парамагнитные материалы используются в качестве контрастных веществ для контрастирования сигналов от частей тела, которые изображаются с помощью MRI, чтобы части тела можно было четко отличить от их окружения. Контраст между тканями на изображении MRI усиливается из-за различной релаксации в тканях. Релаксация представляет собой явление, при котором спины ядер молекулы воды в тканях возвращаются в их состояние равновесия. Контрастное вещество воздействует на релаксации, создавая большое различие в степени релаксации между тканями, и вызывает изменения в сигналах MRI, делая контраст между тканями более четким.
Усиленный контраст с использованием контрастных веществ повышает или снижает интенсивность сигналов изображения от конкретных живых органов и тканей относительно их окружения, чтобы обеспечить более четкое изображение органов и тканей. Положительные контрастные вещества (или контрастные вещества Т1) относятся к контрастным веществам, которые повышают интенсивность сигналов изображения от частей тела, которые изображаются MRI, относительно их окружения. Отрицательные контрастные вещества (или контрастные вещества Т2) относятся к контрастным веществам, которые снижают интенсивность сигналов изображения от частей тела, которые изображаются MRI, относительно их окружения. Конкретнее, контрастные вещества для MRI делятся на контрастные вещества Т1, использующие высокие спины парамагнитных материалов, и контрастные вещества Т2, использующие магнитную неоднородность вокруг ферромагнитных или суперпарамагнитных материалов.
Контрастные вещества Т1 ассоциируются с продольной релаксацией. Продольная релаксация представляет собой явление, при котором компонент намагниченности Mz в направлении оси Z спина поглощает импульс энергии RF, приложенный от оси Х, выравнивается с осью Y на плоскости X-Y и возвращается к своему исходному значению, в то время как энергия высвобождается наружу. Это явление также выражается как «релаксация Т1». Время для возврата Mz к 63% его исходного значения называется «временем релаксации Т1». Чем короче релаксация Т1, тем сильнее сигнал MRI, включая меньшее время получения изображения.
Контрастные вещества Т2 ассоциируются с поперечной релаксацией. Компонент намагниченности Mz в направлении оси Z спина поглощает импульс энергии RF, приложенный с оси Х, выравнивается с осью Y на плоскости X-Y и возвращается к своему исходному значению, в то время как энергия затухает или высвобождается к окружающим спинов. В это время компонент My равномерно уширенного спина на плоскости X-Y распадается как экспоненциальная функция. Это явление выражается как «релаксация Т2». Время для возврата My к 37% его исходного значения называется «временем релаксации Т2». My снижается как функция времени и измеряется с помощью приемника, установленного на оси Y. Измеренная величина называется «сигналом спада свободной индукции (FID)». Ткань с коротким временем релаксации Т2 при MRI выглядит более темной.
В настоящее время в коммерчески доступных положительных и отрицательных контрастных веществах для MRI используются парамагнитные соединения и суперпарамагнитные наночастицы, соответственно. В настоящее время для контрастных веществ Т2 используются наночастицы оксида железа, такие как наночастицы суперпарамагнитного оксида железа (SPIO). Контраст Т2 является отрицательным контрастом, который делает целевую область темнее, чем ее окружение. Контрастный эффект контраста 2 не очень значительный. Другим недостатком контраста Т2 является то, что из-за эффекта Bloom контрастируется большая площадь, чем фактическая площадь. Между тем, контрастные вещества Т1 основаны на положительном контрасте и имеют преимущество в том, что изображения нужных участков выглядят яркими. Для контрастных веществ Т1 используются материалы с высоким спином, обычно комплексы гадолиния с 7 незаполненными спинами на орбитали 4f.
Контрастные вещества на основе гадолиния (Gd) разработаны еще в 1970-е. Однако с тех пор не было значительных технологических достижений в разработке контрастных веществ. В последнее время сообщалось, что контрастные вещества на основе гадолиния вызывают побочные эффекты, такие как необратимый склероз кожи и органов из-за токсичности свободного гадолиния. В другом недавнем сообщении показано, что гадолиний постоянно откладывается в тканях головного мозга пациентов, которым дают инъекции контрастного вещества для MRI. В этих обстоятельствах появляется опасность гадолиниевых контрастных веществ. Хотя распространенность сосудистых заболеваний у пациентов с хронической почечной недостаточностью и их смертность высоки, использование Gd контрастных веществ запрещено из-за их опасности вызвать нефрогенный системный фиброз. Таким образом, существует острая необходимость в разработке контрастных веществ для MRI, которые можно безопасно использовать у пациентов с хронической почечной недостаточностью.
Оксиды железа, используемые в суперпарамагнитных материалах, можно разделить на два типа согласно размеру их частиц: суперпарамагнитные оксиды железа (SPIO), имеющие частицы размером 50 нм или больше, и ультрамелкие суперпарамагнитные оксиды железа (USPIO), имеющие частицы размером меньше, чем у SPIO. Более мелкий USPIO имеет склонность оставаться в кровеносных сосудах в течение более длительного времени, поскольку он менее восприимчив к фагоцитарному действию макрофагов в кровеносных сосудах. На основании такой склонности USPIO можно использовать для определения того, являются ли кровеносные сосуды здоровыми или нет. USPIO можно инъецировать в небольшом количестве по сравнению с SPIO, что позволяет инъецировать его быстро. USPIO снижает Т1 и Т2 в схожей степени, приводя к повышению интенсивности сигнала в Т1-взвешенных изображениях и снижению интенсивности сигнала в Т2-взвешенных изображениях. Многие контрастные вещества, такие как феридекс, были использованы клинически. Большинство таких контрастных веществ синтезируется методами соосаждения и страдает от ограничений, таких как плохая кристалличность, приводящая к ухудшению магнитных свойств и неоднородному размеру.
С конца 1990-х годов разрабатываются новые методы пиролиза для синтеза наночастиц оксида железа с однородными размерами 5-20 нм. Несмотря на описанный факт, что наночастицы оксида железа, синтезированные методами пиролиза, обладают лучшими эффектами контраста MRI, чем наночастицы, разработанные методами соосаждения, в клинических применениях предпочтительно используются Т1-взвешенные изображения по сравнению с Т2-взвешенными изображениями, поскольку Т1-взвешенные изображения являются более точными, и Т2-взвешенные изображения страдают от серьезных помех сигналу. По этим причинам существует необходимость в разработке наночастиц, эффект контраста Т1 которых сравним или лучше, чем контрастных веществ на основе гадолиния, и которые могут заменить контрастные вещества на основе гадолиния.
Подробное описание изобретения
Способы решения проблем
Одной из целей настоящего изобретения являются ультратонкие наночастицы оксида железа, которые получают на основе комбинации метода синтеза однородных ядер и метода гидрофилизации поверхности и имеют однородный эффект контраста, сохраняя в то же время свою однородность in vivo, что, таким образом является подходящим для использвания при получении контрастных веществ Т1, которые могут заменить обычные контрастные вещества на основе гадолиния.
Другой целью настоящего изобретения является платформа для мультиплексных анализов с использованием ультратонких наночастиц оксида железа.
Еще одной целью настоящего изобретения является способ получения наночастиц для мультиплексных анализов, поверхность которых модифицирована гидрофилизующим материалом и функционализирующим материалом.
Согласно одному аспекту, настоящее изобретение относится к контрастному веществу Т1 для магнитно-резонансной визуализации, включающему ядра мелких наночастиц оксида железа и мицеллы, инкапсулирующие частицы ядер, причем мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь.
В одном воплощении настоящего изобретения ядра могут иметь диаметр 6 нм или меньше и индекс полидисперсности (PDI) 0,2 или меньше.
В другом воплощении настоящего изобретения гидрофильная часть может содержать полиалкиленгликолевую цепь.
В другом воплощении настоящего изобретения неионогенное поверхностно-активное вещество может представлять собой поверхностно-активное вещество полисорбат.
В другом воплощении настоящего изобретения контрастное вещество может иметь общий диаметр 10 нм или меньше и PDI 0,2 или меньше.
Настоящее изобретение относится к платформе для мультиплексных анализов с эффектом контраста Т1 для магнитно-резонансной визуализации, включающей ядра мелких наночастиц оксида железа и мицеллы, инкапсулирующие частицы ядер, причем на поверхность ядер внедрено линкерное соединение, и мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь.
В одном воплощении настоящего изобретения линкер может представлять собой соединение, вызывающее клик-реакцию.
В другом воплощении настоящего изобретения линкер может представлять собой амфифильное соединение, содержащее гидрофобный фрагмент на одном конце и гидрофильный фрагмент, связанный с клик-реактивным материалом, на другом конце.
Настоящее изобретение также относится к способу получения наночастиц для мультиплексных анализов, включающему предоставление ядер мелких наночастиц оксида железа; модификацию частиц ядер соединением, вызывающим клик-реакцию; предоставление раствора мицелл, включающих неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь; диспергирование модифицированных частиц ядер в растворе мицелл для придания модифицированным частицам ядер гидрофильности посредством инкапсуляции лиганда; и связывания функционализирующего материала, содержащего клик-реактивную часть, с поверхностью частиц ядер для модификации поверхности частиц ядер.
В одном воплощении настоящего изобретения неионогенное поверхностно-активное вещество может быть использовано для гидрофилизации в 15-25-кратном молярном избытке относительно гидрофобного материала на поверхности ядер.
В другом воплощении настоящего изобретения функционализирующий материал может быть выбран из группы, состоящей из агентов, нацеленных на заболевание, хелатирующих агентов, флуоресцентных материалов и их смесей.
В другом воплощении настоящего изобретения способ может дополнительно включать центрифугирование в градиенте плотности.
Согласно другому аспекту настоящее изобретение относится к способу получения наночастиц для мультиплексных анализов, включающему предоставление ядер мелких наночастиц оксида железа; предоставление раствора мицелл, в которых неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь, смешано с амфифильным материалом, содержащим функционализирующую группу; и диспергирование частиц ядер в растворе мицелл, так что одновременно выполняется гидролизация частиц ядер посредством инкапсуляции лиганда и модификация поверхности функционализирующим материалом.
В одном воплощении настоящего изобретения способ может дополнительно включать центрифугирование в градиенте плотности.
Контрастное вещество Т1 для MRI на основе ультратонких наночастиц оксида железа согласно настоящему изобретению может заменить существующие гадолиниевые контрастные вещества Т1 для MRI. Кроме того, гидрофилизация обеспечивает однородность наночастиц, делая возможным быстрое распределение контрастного вещества Т1 для MRI в крови и быстрое выведение контрастного вещества Т1 для MRI из организма.
Кроме того, согласно платформе для мультиплексных анализов и способу получения наночастиц для мультиплексных анализов функционализирующий материал, содержащий клик-реактивную группу, конъюгируется с поверхностью платформы из ннаночастиц оксида железа, и поверхность платформы из модифицированных наночастиц оксида железа гидрофилизуется путем инкапсуляции мицеллами.
Краткое описание чертежей
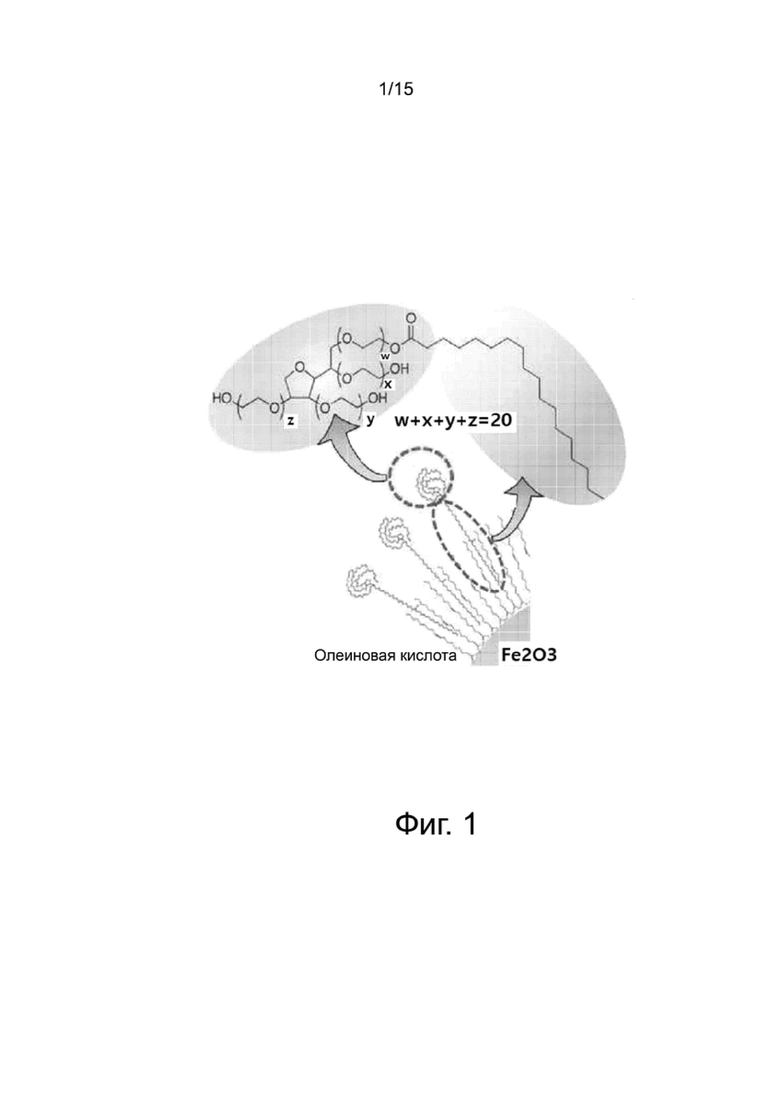
Фиг.1 поясняет принцип гидрофилизации наночастиц оксида железа по настоящему изобретению.
Фиг.2 схематически показывает реакцию гидрофилизованных наночастиц оксида железа по настоящему изобретению.
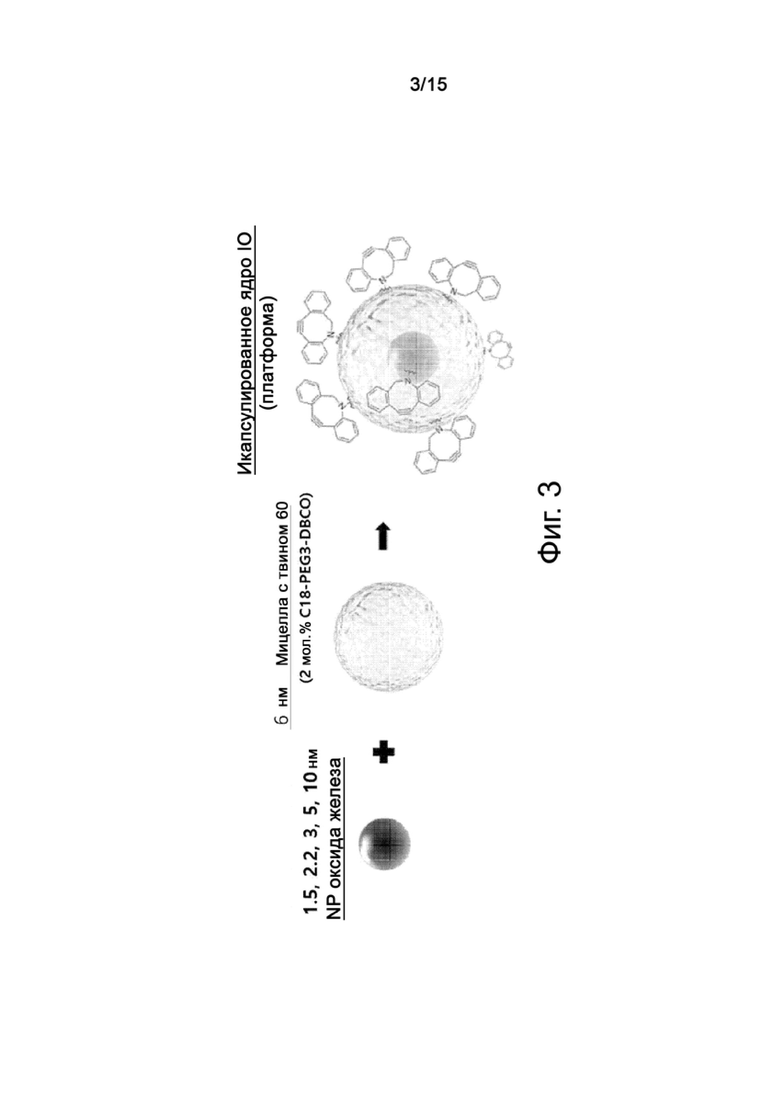
Фиг.3 схематически показывает нанесение вызывающего клик-реакцию соединения и реакцию гидрофилизованных наночастиц оксида железа по настоящему изобретению.
Фиг.4 показывает устойчивость при хранении гидрофилизованных наночастиц оксида железа, которую оценивают в экспериментальном примере 1.
Фиг.5 показывает устойчивость при хранении гидрофилизованных наночастиц оксида железа в сыворотке, которую оценивают в экспериментальном примере 1.
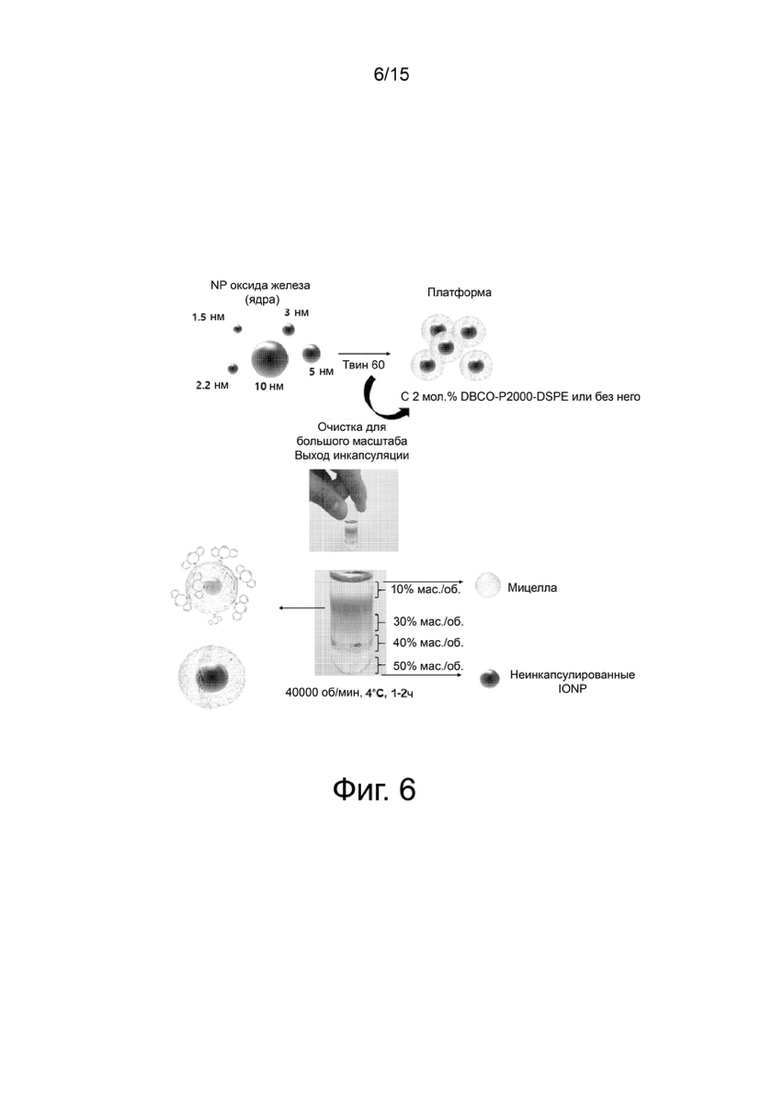
Фиг.6 отображает раствор гидрофилизованных наночастиц оксида железа и оставшиеся мицеллы, которые разделились из-за различия плотности с образованием слоев.
Фиг.7 представляет собой таблицу, показывающую выход гидрофилизованных наночастиц оксида железа согласно настоящему изобретению при получении в большом масштабе.
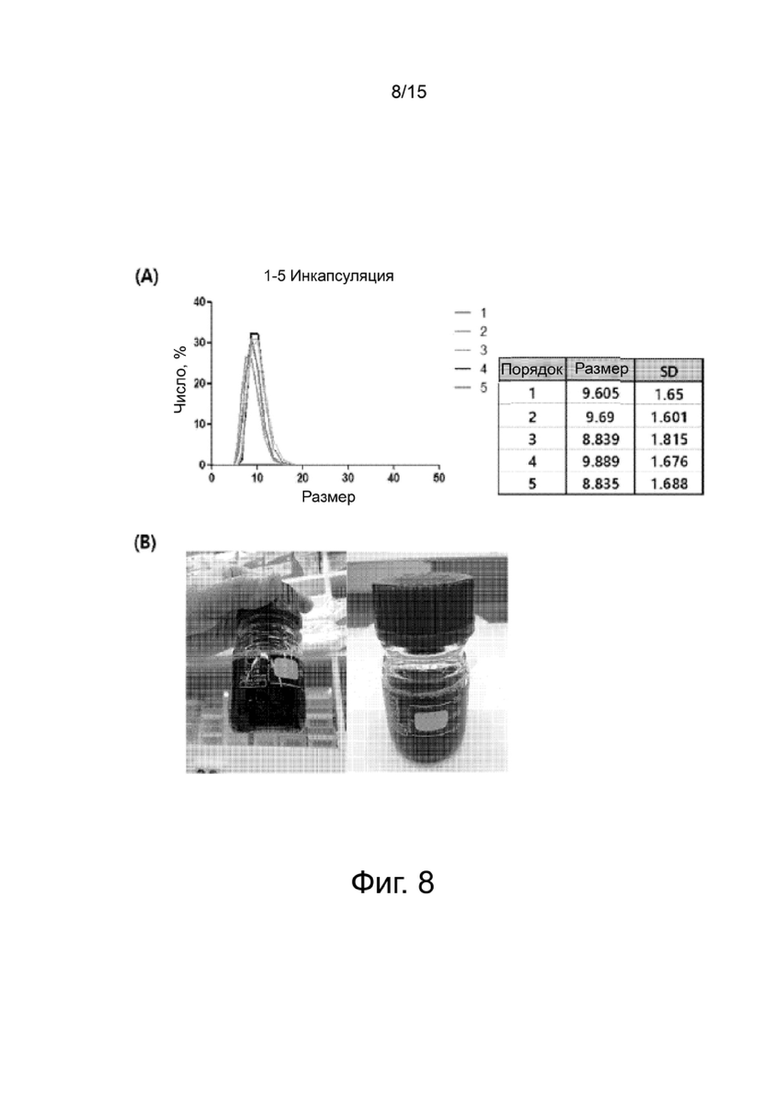
Фиг.8 показывает (А) размеры гидрофилизованных наночастиц оксида железа согласно настоящему изобретению при получении в большом масштабе и (В) фотографии раствора, содержащего гидрофилизованные наночастицы (В).
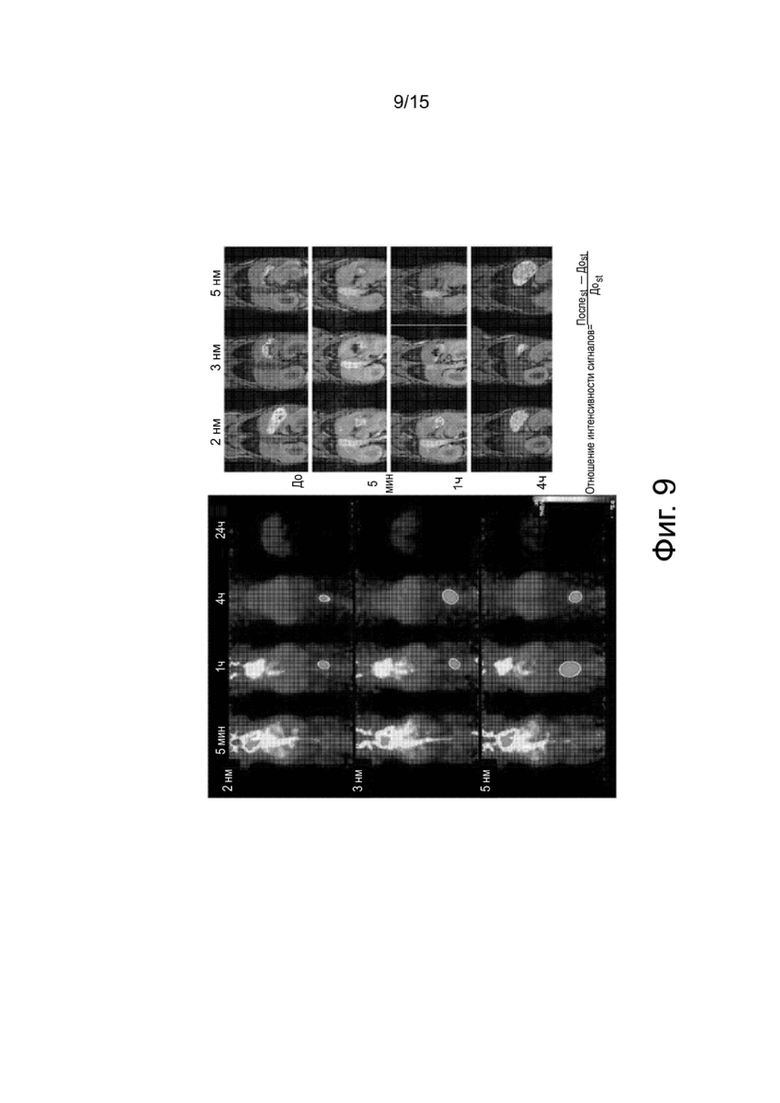
Фиг.9 показывает изображения, подтверждающие распределение in vivo гидрофилизованных наночастиц оксида железа согласно настоящему изобретению.
Фиг.10 показывает результаты введения радиоактивной метки, устойчивость при хранении и устойчивость радиоактивной метки гидрофилизованных наночастиц оксида железа согласно настоящему изобретению, подтверждающие распределение in vivo гидрофилизованных наночастиц.
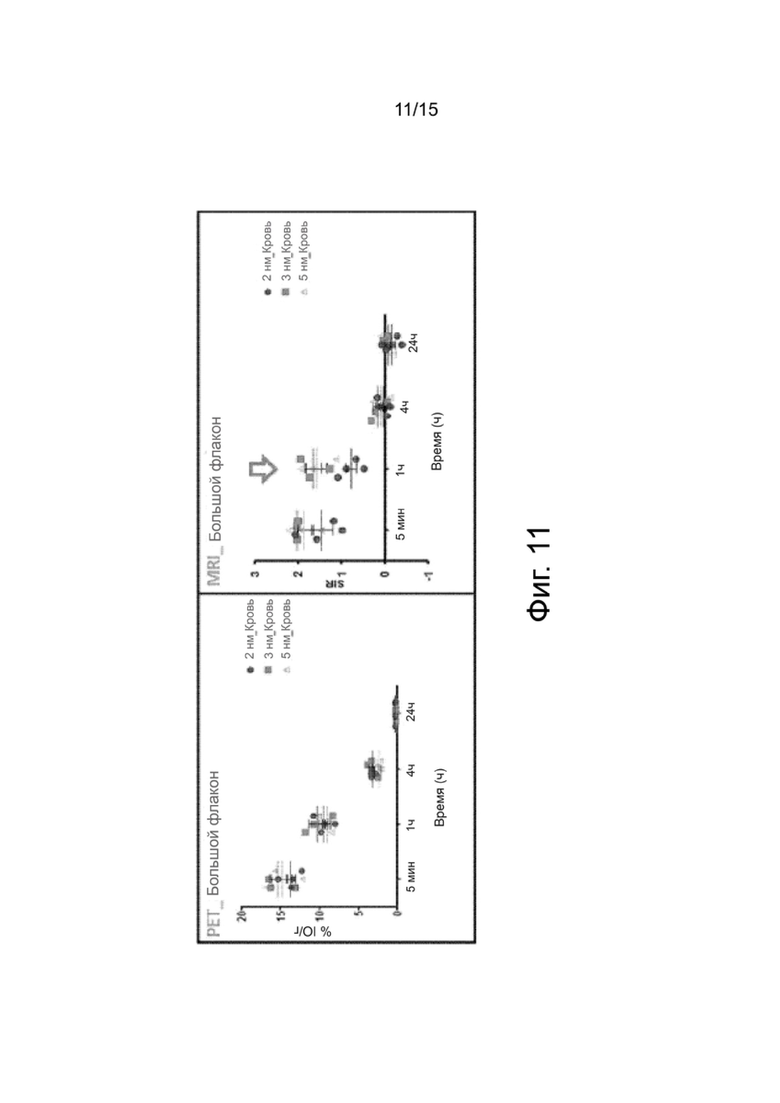
Фиг.11 показывает количественные данные РЕТ и MRI крупных сосудов с использованием гидрофилизованных наночастиц оксида железа согласно настоящему изобретению.
Фиг.12 представляет собой фотографию, показывающую гидрофилизованные наночастицы оксида железа в твердой фазе после удаления всех жидких компонентов выпариванием в экспериментальном примере 5.
Фиг.13 показывает результаты DLS на гидрофилизованных наночастицах оксида железа по настоящему изобретению, которые повторно диспергированы через предварительно установленное время после получения, для того, чтобы оценить применимость гидрофилизованных наночастицах оксида железа для набора.
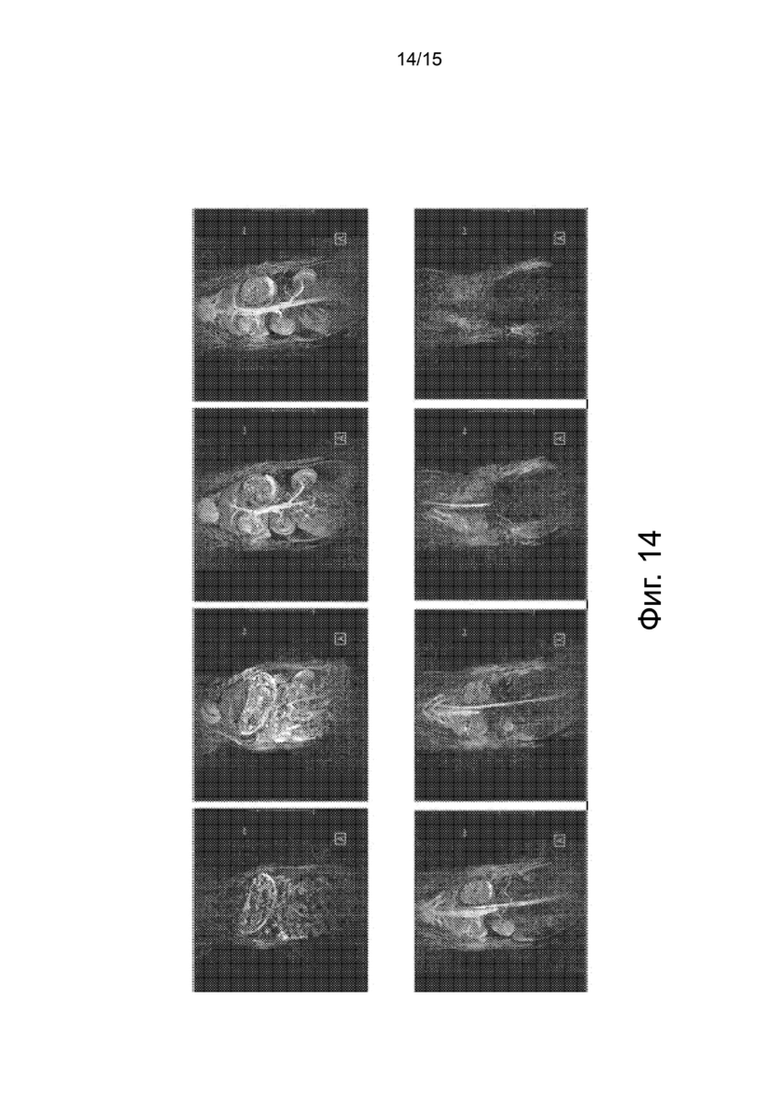
Фиг.14 показывает результаты эксперимента на животных с использованием гидрофилизованных наночастиц оксида железа по настоящему изобретению, для того, чтобы определить эффекты контраста гидрофилизованных наночастиц в печени, нижней полой вене (IVC), левом желудочке (LV), аорте, почках и мозговом веществе почек кролика после инъекции гидрофилизованных наночастиц.
Фиг.15 показывает результаты эксперимента на животных с использованием гидрофилизованных наночастиц оксида железа по настоящему изобретению, для того, чтобы сравнить интенсивность контрастов гидрофилизованных наночастиц в печени, нижней полой вене (IVC), левом желудочке (LV), аорте, почках и мозговом веществе почек кролика после инъекции гидрофилизованных наночастиц с интенсивностью контрастов контрастного вещества на основе гадолиния.
Способ осуществления изобретения
Гадолиний и магний являются элементами, которые не встречаются в организме человека. Гадолиний и магний после использования в материалах для контрастных веществ остаются в организме и вызывают побочные действия, такие как постоянное осаждение и склеродермия. Железо является центральным атомом гемоглобина – важной молекулы, которая связывается с кислородом в красных клетках крови человека и является одним из основных элементов, составляющих организм человека. Железодефицитная анемия вызывается недостатком железа. Таким образом, очень маловероятно, что железо вызывает побочные действия у людей даже когда используется в качестве материала для контрастного вещества. В частности, наночастицы оксида железа используются клинически для диагностических контрастных веществ Т2 для диагностики рака печени и являются высоко биосоместимыми материалами для терапевтических средств в случае анемии, а также в качестве контрастных веществ для MRI.
Для разработки ультратонких наночастиц оксида железа для контрастных веществ Т1 для MRI требуется метод синтеза ядер однородного размера и метод гидрофилизации ядер наночастиц с сохранением в то же время их однородного размера. Настоящее изобретение относится к контрастным веществам Т1 для MRI на основе ультратонких наночастиц оксида железа, которые могут заменить существующие контрастные вещества Т1 на основе гадолиния. Кроме того, в настоящем изобретении используется метод гидрофилизации, обеспечивающий однородность наночастиц для возможности быстрого распределения контрастного вещества Т1 для MRI в крови и ангиографии в течение по меньшей мере 1 часа. Настоящее изобретение теперь будет описано подробно.
Термин «ультратонкие наночастицы оксида железа» при использовании в настоящем описании имеет такое же значение, как термин «мелкие наночастицы оксида железа». Термин «гидрофилизованные наночастицы оксида железа» при использовании в настоящем описании имеет такое же значение, как термин «гидрофильные наночастицы оксида железа».
Конкретно, настоящее изобретение относится к контрастному веществу Т1 для магнитно-резонансной визуализации, включающему ядра – мелкие наночистицы оксида железа и мицеллы, инкапсулирующие частицы ядер, причем мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь.
Ядра предпочтительно имеют диаметр 6 нм или меньше и PDI 0,2 или меньше. Когда ядра регулируют до размера 6 нм или меньше, предпочтительно 4 нм – 1 нм, предпочтительнее 3 нм – 1,5 нм, магнитное взаимодействие между ионами железа, распределенными по поверхности наночастиц, уменьшается с таким результатом, что магнитные свойства наночастиц превращаются в парамагнетизм, подобный гадолинию. Когда магнитные свойства наночастиц изменяются от суперпарамагнетизма до парамагнетизма, перекрывание эффекта контраста Т1 с эффектом контраста Т2 исчезает, что позволяет эффективного использовать наночастицы железа для контрастного вещества Т1. Наночастицы оксида железа имеют диаметр 6 нм или меньше, предпочтительно 4 нм – 1 нм, предпочтительнее 3 нм – 1,5 нм, и PDI 0,2 или меньше. предпочтительно 0,01-0,2, предпочтительнее 0,1-0,2. В указанных диапазонах можно ожидать более хороший Т1-взвешенный эффект контраста и размер наночастиц может сохраняться постоянным во время хранения.
Ядра можно получить взаимодействием комплекса железа, включающего железо в качестве центрального атома железа, и С4-С25 органических кислотных групп (карбоксилатов) в качестве лигандов, связанных с центральным атомом, С4-С25 жирной кислоты и С4-С25 алифатического спирта или амина. Конкретно, ядерные наночастицы можно получить следующей процедурой. Сначала смешивают как исходные материалы комплекс железа, жирную кислоту и алифатический спирт (или алифатический амин). Смеси дают возможность реагировать. Температуру реакции повышают от комнатной температуры до 150-350°С со скоростью 5°С/мин или большей и затем поддерживают при 150-350°С в течение 5-60 минут. Размер ядер можно регулировать путем изменения молярного соотношения С4-С25 жирной кислоты и С4-С25 алифатического спирта или амина как исходных материалов. Так как ядра мелких наночастиц оксида железа имеют диаметр 6 нм или меньше, однородный размер, PDI 0,2 или меньше и однородное распределение, можно достигнуть постоянного эффекта контраста.
Предпочтительно комплекс железа включает атом железа и С4-С25 органические кислотные группы в качестве лигандов, связанных с центральным атомом. Примеры лигандов включают стеариновую кислоту, олеиновую кислоту, линолевую кислоту, пальмитиновую кислоту, пальмитолеиновую кислоту, миристиновую кислоту, лауриновую кислоту, арахидоновую кислоту и бегеновую кислоту. Предпочтительно комплекс железа может представлять собой олеат железа. Жирная кислота С4-С25 может представлять собой, например, стеариновую кислоту, олеиновую кислоту, линолевую кислоту, пальмитиновую кислоту, пальмитолеиновую кислоту, миристиновую кислоту, лауриновую кислоту, арахидоновую кислоту, рицинолеиновую кислоту или бегеновую кислоту. Алифатический спирт С4-С25 может представлять собой, например, стеариловый спирт (октадеканол), олеиловый спирт, линолеиловый спирт, гексадеканол, пальмитолеиловый спирт, тетрадеканол, додеканол, арахидониловый спирт, эйкозанол, докозанол или гексадекандиол. Алифатический амин С4-С25 может представлять собой, например, стеариламин (октадециламин), олеиламин, гексадециламин, пальмитолеиламин, тетрадециламин, додециламин или арахидониламин. Наиболее предпочтительно жирная кислота представляет собой олеиновую кислоту, алифатический спирт представляет собой олеиловый спирт и алифатический амин представляет собой олеиламин.
Применение наночастиц оксида железа для контрастного вещества Т1 требует гидрофилизации наночастиц оксида железа для диспергирования в растворе, поскольку поверхность ядер наночастиц оксида железа является гидрофобной, а также контроля над размером наночастиц оксида железа. Гидрофилизацию можно выполнить подходящим способом, например, замещением или нанесением покрытия. Способ замещения относится к способу обмена гидрофобной группы на поверхности наночастиц на гидрофильный материал, и способ нанесения покрытия относится к способу нанесения на поверхность наночастиц гидрофильного материала (например, полимера или диоксида кремния). Согласно обычно используемому способу замещения лиганды замещаются материалом, таким как полиэтиленгликольфосфат (РО-PEG), в органическом растворителе с последующим повторным диспергированием в воде как новом диспергирующем растворителе. РО-PEG используют для гидрофилизации в большом количестве. Очистка наночастиц оксида железа является существенной в качестве дополнительного процесса для функционализации, но она вызывает проблемы в плане выхода и стабильности способа. Другой проблемой является то, что в многостадийной реакции может происходить агрегация в зависимости от полярности концевых функциональных групп. Кроме того, неизбежны многие изменения от партии к партии, пока не будет получен конечный материал. Также известно, что во время гидрофилизации радиус гидратированной частицы становится большим по сравнению с размером ядра. В итоге традиционный способ замещения страдает от трудностей гидрофилизации наночастиц при сохранении в то же время сверхтонкого размера наночастиц.
Указанные проблемы решаются путем инкапсуляции частиц ядер в мицеллах для гидрофилизации поверхности частиц ядер. Мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь. Согласно настоящему изобретению, инкапсуляция мелких и однородных частиц ядер с помощью мицелл дает возможность для устойчивой гидрофилизации наночастиц без агрегации, предотвращает значительное повышение радиуса гидратированной частицы даже после гидрофилизации и допускает возможность иметь наночастицам PDI 0,2 или меньше. Таким образом, наночастицы подходят для использования в контрастном веществе и могут быть получены в большом масштабе.
Неионогенное поверхностно-активное вещество может иметь структуру A-O-C(O)-B (где A представляет собой гидрофильный фрагмент и B представляет собой гидрофобный фрагмент). Гидрофильный фрагмент может включать две или больше цепей, каждая из которых имеют одну или несколько концевых групп -OH и включает -O-(CH2)n- или C3-C5 алициклическую углеводородную группу. Две или больше из них необязательно могут связываться друг с другом, образуя цепочечную структуру. Цепочечная структура может быть разветвленной, так что число концевых групп равно 2 или больше, предпочтительно 2-10, предпочтительнее 2-8. Концевые группы могут представлять собой группы -OH. Когда число концевых групп находится в диапазоне, определенном выше, можно добиться улучшенной гидрофильности.
Каждая из алициклических углеводородных групп предпочтительно прерывается атомом кислорода, серы или азота, способным к водородной связи с носителем. Как другой пример, в каждом алициклическом углеводородном цикле могут присутствовать одна или больше двойных связей.
В каждом из блоков -O-(CH2)n- n равен целому числу в диапазоне от 1 до 10, предпочтительно от 2 до 8, предпочтительнее от 2 до 5. В пределах указанного диапазона можно добиться улучшенной гидрофильности. Каждый из блоков -O-(CH2)n- может представлять собой, например, полиэтиленгликоль, полипропиленгликоль или полибутиленгликоль.
Блоки -O-(CH2)n- могут отвечать по меньшей мере за 80 мас.% или по меньшей мере за 90 мас.% фрагмента А. Фрагмент А в своей цепочечной структуре может включать C10-C60 углеводородную группу, предпочтительно C20-C50 углеводородную группу. Когда число атомов углерода в углеводородной группе находится в диапазоне, определенном выше, может быть обеспечена хорошая устойчивость дисперсии наночастиц в водном растворе благодаря эффекту пространственного затруднения и высокой гидрофильности.
Гидрофобная часть B может представлять собой по меньшей мере одну углеводородную цепь, предпочтительно C6-C30 углеводородную цепь, предпочтительно C10-C20 углеводородную цепь. Углеводородная цепь может включать алифатическую углеводородную группу, имеющую 2 или больше атомов углерода (например, алкенильную или алкинильную группу), ароматическую углеводородную группу, имеющую 6 или больше атомов углерода (например, фенильную, нафтильную или аралкильную группу), или алициклическую углеводородную группу, имеющую 5 или больше атомов углерода (например, циклогексильную или норборненильную группу), в середине или на одном конце. С другой стороны, углеводородная цепь может включать разветвленную углеводородную цепь. Углеводородная цепь необязательно может включать в середине одну или больше двойных связей. Конкретные примеры таких углеводородных цепей могут включать монолаурат, монопальмитат, моностеарат и моноолеат.
Неионогенное поверхностно-активное вещество предпочтительно представляет собой поверхностно-активный полисорбат. Конкретно поверхностно-активный полисорбат может представлять собой полисорбат 20 (монолаурат полиоксиэтилен(20)сорбитана, твин 20), полисорбат 40 (монопальмитат полиоксиэтилен(20)сорбитана, твин 40), полисорбат 60 (моностеарат полиоксиэтилен(20)сорбитана, твин 60) или полисорбат 80 (моноолеат полиоксиэтилен(20)сорбитана, твин 80).
Полисорбат 60 (моностеарат полиоксиэтилен(20)сорбитана, твин 60) как неионогенное поверхностно-активное вещество имеет структуру, представленную формулой 1:
[Формула 1]
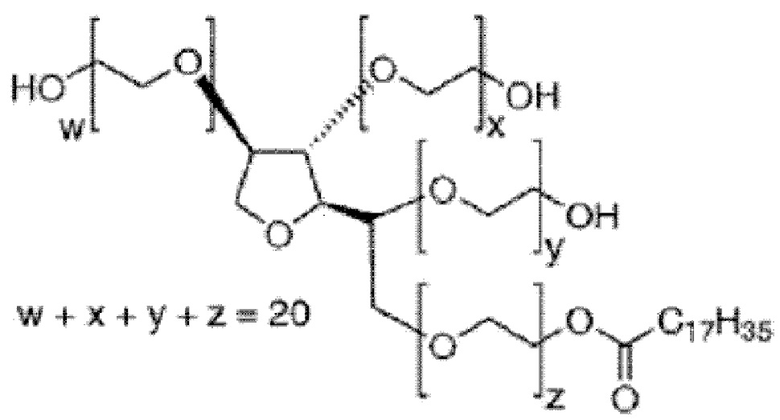 ,
,
в которой w, x, y и z являются целыми числами.
Принцип стабилизации дисперсии можно считать обусловленным гидрофобно-гидрофобным взаимодействием между гидрофобной цепью жирной кислоты на поверхности наночастиц и гидрофобными группами неионогенного поверхностно-активного вещества, водородной связью между гидрофильными группами неионогенного поверхностно-активного вещества и окружающими молекулами воды и эффектом пространственного затруднения.
Фиг.1 представляет собой схему, показывающую принцип стабилизации дисперсии наночастиц оксида железа поверхностно-активным полисорбатом как неионогенным поверхностно-активным веществом. Обращаясь к фиг.1, гидрофобная группа неионогенного поверхностно-активного вещества полисорбата взаимодействует и образует связь с гидрофобной группой жирной кислоты, присутствующей на поверхности наночастиц оксида железа. Гидрофильная группа неионогенного поверхностно-активного вещества, взаимодействующая с окружающими молекулами воды, в своей основе имеет полиалкиленгликолевые блоки, предпочтительно 2 или больше полиалкиленгликолевых блоков, предпочтительнее 3 или больше полиалкиленгликолевых блоков, каждый из которых имеет концевую группу –ОН. Полиалкиленгликолевые блоки образуют объемную концевую гидрофильную группу. Например, твин 60 формулы 1 имеет структуру, в которой разветвленная гидрофильная цепь, имеющая три концевых –ОН группы, и С17 гидрофобная цепь связываются в сложноэфирную группу. В результате мицеллярные структуры могут поддерживаться устойчивыми без агрегации даже после инкапсуляции наночастиц оксида железа благодаря эффекту пространственного затруднения и высокой гидрофильности.
Ядра могут быть инкапсулированы мицеллами путем добавления частиц ядер в раствор мицелл, содержащих неионогенное поверхностно-активное вещество, и равномерным диспергированием частиц ядер с помощью ультразвука. Неионогенное поверхностно-активное вещество предпочтительно используется в 15-25-кратном молярном избытке относительно гидрофобного материала на поверхности ядер. Если количество неионогенного поверхностно-активного вещества будет меньше нижнего предела (т.е., количество гидрофилизующего материала является небольшим), гидрофилизация протекает в состоянии, в котором наночастицы недостаточно диспергированы и агрегируют, приводя к низкому выходу. Между тем, если количество неионогенного поверхностно-активного вещества превышает верхний предел, наночастицы могут увеличиваться в диаметре или могут агрегировать во время гидрофилизация, что повлияет на последующее отделение наночастиц. Следовательно, количество неионогенного поверхностно-активного вещества, добавляемого во время гидрофилизации ядер, является важным фактором и нуждается в соответствующем регулировании до диапазона, определенного выше, в зависимости от размера наночастиц. Например, так как площадь поверхности наночастиц увеличивается с уменьшением размера наночастиц, количество гидрофобных групп жирной кислоты на поверхности ядер увеличивается. Таким образом, необходимо добавлять большее количество гидрофилизующего материала, взаимодействующего с жирной кислотой.
Гидрофилизованные наночастицы имеют общий диаметр 10 нм или меньше, предпочтительно 8 нм – 1 нм, предпочтительнее 8 нм – 1,5 нм, и PDI 0,2 или меньше, предпочтительно 0,01-0,2, предпочтительнее 0,1-0,2. Если диаметр и PDI превышают соответствующие верхние пределы, не ожидается существенный Т1-взвешенный эффект контраста, и трудно получить равномерное распределение в организме человека. Контрастное вещество по настоящему изобретению показывает эффект контраста схожий с эффектом контраста контрастного вещества на основе гадолиния, быстро распространяется в крови, может использоваться для изображения кровеносных сосудов в течение по меньшей мере 1 часа и после контрастирования может выводиться через почки и печень.
Настоящее изобретение также относится к платформе для мультиплексных анализов с эффектом контраста магнитно-резонансной визуализации Т1, включающей мелкие наночастицы оксида железа и мицеллы, инкапсулирующие частицы ядер, причем на поверхность ядер вводят линкерное соединение, и мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь.
Модификация поверхности ядер клик-соединением предоставляет платформу для мультиплексных анализов, допускающих множественное мечение. Линкер предпочтительно является вызывающим клик-реакцию соединением, предпочтительнее амфифильным соединением, содержащим гидрофобный фрагмент на одном своем конце и гидрофильный фрагмент, связанный с клик-реактивным материалом, на другом своем конце. Линкер может представлять собой, например, соединение с одноцепочечной (C12-C18) функциональной группой, такое как производное азадибензоциклооктина (например, ADIBO или DBCO). Примеры таких функциональных групп включают ADIBO-PEG4-C18, ADIBO-PEG2000-DSPE, DBCO-PEG4-C18, DBCO-PEG2000-DSPE, DBCO-SA, N3-PEG4-C18 и N3-PEG2000-DSPE. В частности, мицеллы с использованием DBCO-PEG2000-DSPE уменьшают поглощение наночастиц печенью и делают возможной циркуляцию наночастиц в крови до 2 часов.
Линкерное соединение можно внести на поверхность ядер путем смешивания 1-15 мол.%, предпочтительно 1-10 мол.;%, предпочтительнее 1-8 мол.% наночастиц, диспергированных в органическом растворителе, с клик-соединением, имеющим функциональную группу. Химическая клик-реакция выполняются в обычных условиях, не требующих высокой температуры, катализатора, кислой-щелочной среды и т.д., и ведет к весьма высокому выходу и скорости превращения.
Настоящее изобретение также относится к способу получения наночастиц для мультиплексных анализов, включающему предоставление ядер наночастиц оксида железа; модификацию частиц ядер вызывающим клик-реакцию соединением; предоставление раствора мицелл, включающих неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь; диспергирование модифицированных частиц ядер в мицеллярном растворе для придания модифицированным частицам ядер гидрофильности через инкапсуляцию с лигандом; и связывание функционализирующего материала, содержащего клик-реактивную часть, с поверхностью частиц ядер для модификации поверхности частиц ядер.
Согласно способу по настоящему изобретению поверхность ядер мелких наночастиц оксида железа модифицируется вызывающим клик-реакцию соединением, гидрофилизируется и связывается с функционализирующим материалом, содержащим клик-реактивную часть, для получения наночастиц для мультиплексных анализов, в которые вводятся различные функциональные группы. Гидрофилизация предпочтительно выполняется с использованием неионогенного поверхностно-активного вещества в 15-25-кратном молярном избытке относительно гидрофобного материала на поверхности ядер. Функционализирующий материал можно выбрать из группы, включающей нацеленные на заболевание агенты, хелатирующие агенты, флуоресцентные материалы и их смеси.
Желательно, чтобы способ также включал центрифугирование в градиенте плотности.
Центрифугирование в градиенте плотности представляет собой процесс, в котором образец помещают в раствор с градиентом плотности и центрифугируют, и получают нужные частицы. Центрифугирование в градиенте плотности позволяет эффективно разделять частицы различного размера, в отличие от фракционирования на колонке с низким выходом и дробного центрифугирования, вызывающего соосаждение частиц различного размера. Центрифугирование в градиенте плотности является способом разделения частиц с высокой чистотой на основе плотности. В центрифугировании в градиенте плотности используется раствор с градиентом плотности для разделения гидрофилизованных наночастиц и негидрофилизованных наночастиц, селективного отделения наночастиц, имеющих желательный размер и PDI, и очистки большого количества гидрофилизованных наночастиц.
В способе по настоящему изобретению стадии можно выполнять одновременно а не последовательно.
Настоящее изобретение также относится к способу получения наночастиц для мультиплексных анализов, включающему предоставление ядер наночастиц оксида железа; предоставление раствора мицелл, в котором неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь, смешано с амфифильным материалом, содержащим функционализирующую группу; и диспергирование частиц ядер в мицеллярном растворе, так что гидрофилизация частиц ядер через инкапсуляцию с лигандом и модификация поверхности частиц ядер выполняются одновременно. Согласно способу по настоящему изобретению поверхность ядер наночастиц можно модифицировать гидрофилизующим материалом и функционализирующим материалом в одностадийном процессе, в котором вызывающее клик-реакцию соединение и функционализирующий материал смешиваются с мицеллярным раствором во время гидрофилизации ядер без необходимости выполнения двух стадий. Как таковой, способ по настоящему изобретению выполняется простым путем, допуская возможность синтеза наночастиц для мультиплексных анализов в большом масштабе.
Согласно способу по настоящему изобретению ядра мелких наночастиц оксида железа, инкапсулированные мицеллами, являются мелкими и однородными по размеру и имеют однородный PDI 0,2 или меньше. Ядра становятся гидрофильными путем инкапсуляции мицеллами, включающими неионогенное поверхностно-активное вещество. Инкапсуляция ядер с использованием неионогенного поверхностно-активного вещества делает размер частиц однородным без существенного увеличения гидратированного диаметра даже после гидрофилизации и позволяет ядрам иметь однородный PDI 0,2 или меньше. Кроме того, наночастицы почти не агрегируют как in vitro, так и in vivo, что указывает на их хорошую устойчивость при хранении. Контрастное вещество Т1 для магнитно-резонасной визуализации согласно настоящему изобретению является новым веществом на основе мелких наночастиц оксида железа, которое может заменить известные контрастные вещества Т1 на основе гадолиния. Контрастное вещество Т1 на основе мелких наночастиц оксида железа согласно настоящему изобретению является безопасным для людей, быстро распространяется в крови и имеет однородный размер частиц, обеспечивающий его однородный эффект контраста. Кроме того, контрастное вещество Т1 по настоящему изобретению позволяет наблюдать изображение в течение по меньшей мере 1 часа и до 2 часов. Гидрофилизация наночастиц однородного размера (100 нм или меньше) снижает поглощение наночастиц ретикулоэндотелиальной системой печени с таким результатом, что контрастное вещество Т1 остается в кровотоке в течение продолжительного времени, не накапливается в организме человека и выводится через почки и печень. Таким образом, контрастное вещество Т1 по настоящему изобретению позволяет избежать проблем, встречающихся с обычными контрастными веществами на основе гадолиния.
Как описано выше, гидрофилизация эффективна при снижении поглощения наночастиц ретикулоэндотелиальной системой печени. Тот факт, что размер наночастиц определяет органы, в которых происходит поглощение наночастиц, и распределение наночастиц в организме человека, хорошо известен в технике. Наночастицы размером 50 нм или больше in vivo быстро накапливаются клетками Купфера в печени. Даже наночастицы с малыми ядрами имеют склонность к агрегации, если они недостаточно диспергированы. Такая агрегация увеличивает поглощение ядер наночастиц ретикулоэндотелиальной системой.
Настоящее изобретение также относится к платформе для мультиплексных анализов и способу получения наночастиц для мультиплексных анализов, в которых ядра модифицированы по поверхности с помощью гидрофилизующего материала и функционализирующего материала, достигая эффектов контраста Т1, и вводятся различные функциональные группы. Согласно настоящему изобретению, поверхность ядер наночастиц можно модифицировать гидрофилизующим материалом и функционализирующим материалом одностадийным процессом, в котором вызывающее клик-реакцию соединение и функционализирующий материал добавляют в мицеллярный раствор и смешивают во время гидрофилизации ядер. Как таковой, способ по настоящему изобретению выполняется простым путем. Кроме того, наночастицы можно разделить и очистить простым способом и получить с высоким выходом. Следовательно, способ по настоящему изобретению подходит для крупномасштабного производства наночастиц для мультиплексных анализов.
Следующие далее примеры можно изменить до некоторых других форм, и они не предназначены для ограничения объема настоящего изобретения. Указанные примеры приводятся для более полного пояснения настоящего изобретения для специалистов в данной области техники.
Пример 1-1. Получение 3-нм ультратонких наночастиц оксида железа
Смешивают 1,8 г (2 ммоль) олеата железа, 0,57 г (2 ммоль) олеиновой кислоты и 1,61 г (6 ммоль) олеилового спирта с 10 г простого дифенилового эфира. Смесь помещают в круглодонную колбу. В колбе создают вакуум при 80°C в течение ~1 часа, удаляя воздух. Затем создают инертную среду током аргона. Реакцию осуществляют, поднимая в то же время температуру до 250°C со скоростью 10°C/мин. Пока реакция протекает, реакционная смесь становится черного цвета. Реакция при 250°C в течение 30 мин дает 3-нм наночастицы, которые быстро охлаждают и промывают избытком ацетона. Полученный осадок диспергируют в хлороформе или гексане в качестве органического растворителя.
Пример 1-2. Получение 5-нм ультратонких наночастиц оксида железа
Смешивают 1,8 г (2 ммоль) олеата железа и 0,28 г (1 ммоль) олеиновой кислоты с 10 г октадецена. Смесь помещают в круглодонную колбу. В колбе создают вакуум при 80°C в течение ~1 часа, удаляя воздух. Затем создают инертную среду током аргона. Реакцию осуществляют, поднимая в то же время температуру до 317°C со скоростью 10°C/мин. Пока реакция протекает, реакционная смесь становится черного цвета. Реакция при 317°C в течение 30 мин дает ~5-нм наночастицы, которые быстро охлаждают и промывают избытком ацетона. Полученный осадок диспергируют в хлороформе или гексане как органическом растворителе.
Пример 1-3. Получение 10-нм ультратонких наночастиц оксида железа
Смешивают 1,8 г (2 ммоль) олеата железа и 0,28 г (1 ммоль) олеиновой кислоты с 10 г октадецена. Смесь помещают в круглодонную колбу. В колбе создают вакуум при 80°C в течение ~1 часа, удаляя воздух. Создают инертную среду током аргона. Реакцию осуществляют, поднимая в то же время температуру до 315°C со скоростью 10°C/мин. Пока реакция протекает, реакционная смесь становится черного цвета. Реакция при 315°C в течение 30 мин дает ~10-нм наночастицы, которые быстро охлаждают и промывают избытком ацетона. Полученный осадок диспергируют в хлороформе или гексане как органическом растворителе.
Пример 2. Гидрофилизация ультратонких наночастиц оксида железа
Ультратонкие наночастицы оксида железа (IONP), полученные в примерах 1-1 – 1-3, гидрофилизуют путем следующих далее стадий.
(1) Твердые IONP. Твердые IONP, синтезированные в каждом из примеров 1-1 – 1-3, сушат, взвешивают и диспергируют в хлороформе в концентрации 20 мг/мл.
(2) Ультратонкие 1,5-, 2,2-, 3-, 5- и 10-нм наночастицы оксида железа (IONP) гидрофилизуют твином 60 и олеиновой кислотой, которые используют в соотношении, указанном в таблице 1.
Таблица 1
В таблице 1 «ОА» представляет собой число молей олеиновой кислоты на поверхности наночастиц, и «Т60» представляет собой число молей твина 60. Молярное соотношение «Т60/ОА» составляет ~20, и то же самое применимо для всех наночастиц. Вычисленное соотношение показывает, что меньший размер наночастиц ведет к большему количеству ОА относительно сухой массы IONP, показывая, что должно быть использовано большее количество твина 60.
Количество ОА, вносимое на поверхность одного из ядер наночастиц оксида железа, вычисляют с помощью фактора f, который можно определить из экспериментальных величин для наночастиц, синтезированных в каждом из примеров 1-1 – 1-3. Эти значения фактора f приводятся в таблице 2.
Таблица 2
В таблице 2 «Mядро» соответствует массе компонента железа относительно общей сухой массы всех наночастиц железа, и «Mобщая» представляет собой общую сухую массу. Иными словами, массу чистого железа можно вычислить путем умножения общей массы на фактор f. Массу присоединенных к поверхности лигандов для определения числа молей ОА можно вычислить путем вычитания массы чистого железа из общей массы.
(3) Мицеллярный раствор получают с использованием количества твина 60, определенного в (2). Твин 60 растворяют в дистиллированной воде для получения 500-1000 мл 5-10% (об./об.) водного раствора твина 60 и обрабатывают ультразвуком при 60°С в течение 10 мин, пока раствор не станет прозрачным. С другой стороны, мицеллярный раствор можно получить путем перемешивания в термостате при 60°С.
(4) Наночастицы гидрофилизуют 5-10% (об./об.) мицеллярным раствором и равномерно диспергируют с использованием соникатора (ультразвукового диспергатора) (ультрасоникатора). Когда 100 мг (5 мл) 3-нм наночастиц диспергированы в хлороформе до концентрации 20 мг/мл, добавлены к 40 мл 10% (об./об.) мицеллярного раствора и обработаны ультразвуком при 60°С в течение 10 мин, непрозрачная коричневая (цвета латте) суспензия становится прозрачной и становится прозрачно-коричневой (цвет американо). В это время раствор, в котором происходит реакция, помещают в мешалку (устройство для перемешивания) при 60°С и затем перемешивают еще в течение 10 мин для полного удаления возможно оставшегося растворителя.
Пример 3. Модификация поверхности гидрофилизованных ультратонких наночастиц оксида железа с помощью клик-соединения
В данном примере гидрофилизованные ультратонкие наночастицы оксида железа модифицируют по поверхности с помощью клик-соединения путем следующих далее стадий.
(1) Твердые IONP. Твердые IONP, синтезированные в каждом из примеров 1-1 – 1-3, сушат, взвешивают и диспергируют в хлороформе в концентрации 20 мг/мл.
(2) Ультратонкие 1,5-, 2,2-, 3-, 5- и 10-нм IONP гидрофилизуют твином 60 и олеиновой кислотой, которые используют в соотношении, указанном в таблице 3, и модифицируют поверхность функциональными группами клик-соединения (DBCO), соотношения которого с твином 60 приводятся в таблице 3.
Таблица 3
В таблице 3 «ОА» представляет собой число молей олеиновой кислоты на поверхности наночастиц, и «Т60» представляет собой число молей твина 60. Молярное соотношение «Т60/ОА» составляет ~20, и то же самое применимо для всех наночастиц. Вычисленное соотношение показывает, что меньший размер наночастиц ведет к большему количеству ОА относительно сухой массы IONP, показывая, что должно быть использовано большее количество твина 60.
Используют 1-10 мол.% DSPE-PEG2000-DBCO для функционализации и модификации поверхности с помощью клик-соединения и инкапсуляции мицеллами. Число молей OA вычисляют так, как описано в примере 2.
(3) Мицеллярный раствор получают с использованием количеств твина 60 и клик-соединения, определенных в (2). Твин 60 растворяют в дистиллированной воде для получения 500-1000 мл 5-10% (об./об.) водного раствора твина 60, к мицеллярному раствору добавляют 1-10 мол.% DSPE-PEG2000-DBCO, и выполняют обработку ультразвуком при 60°С в течение 10 мин, пока раствор не станет прозрачным. Альтернативно, мицеллярный раствор можно получить путем перемешивания в термостате при 60°С.
(4) Наночастицы гидрофилизуют 5-10% (об./об.) мицеллярным раствором и равномерно диспергируют с использованием соникатора (ультрасоникатора). Когда 100 мг (5 мл) 3-нм наночастиц были диспергированы в хлороформе до концентрации 20 мг/мл, добавлены к 40 мл 10% (об./об.) мицеллярного раствора, к мицеллярному раствору добавляли 2 мол.% DSPE-PEG2000-DBCO относительно твина 60, и смесь обрабатывали ультразвуком при 60°С в течение 10 мин, непрозрачная коричневая (цвета латте) суспензия становилась прозрачной и становилась прозрачно-коричневой (цвет американо). В это время раствор, в котором происходит реакция, помещали в мешалку при 60°С и затем перемешивали еще в течение 10 мин для полного удаления возможно оставшегося растворителя.
Экспериментальный пример 1. Оценка зависимости устойчивости гидрофилизованных наночастиц оксида железа от размера in vitro и in vivo
В данном эксперименте оценивают in vitro и in vivo зависимость устойчивости от размера гидрофилизованных наночастиц оксида железа, полученных в примере 2.
Гидродинамические размеры гидрофилизованных наночастиц анализируют с использованием прибора DLS. Индекс полидисперсности (PDI) используют как меру однородности. Конкретно, после хранения в дистиллированной воде при комнатной температуре в течение определенного периода времени снова измеряют размеры 1,5-нм, 2,2-нм, 3-нм, 5-нм и 10-нм гидрофилизованных наночастиц оксида железа для определения того, сохраняется ли их устойчивость in vitro. Кроме того, такие же количества гидрофилизованных наночастиц диспергируют в сыворотке человека и хранят в холодильнике. Проводят определение осаждаются ли гидрофилизованные наночастицы во время хранения.
Устойчивость при хранении проверяют в течение ~1 месяца. Результаты приводятся на фиг.4. Наночастицы небольшого размера весьма устойчивы, но 10-нм наночастицы показывают склонность постепенно увеличиваться в размере, как потверждается на фиг.4. Полагают, что такие результаты связаны с тем, что больший размер ведет к лучшему осаждению.
Как подтверждается на фиг.5, 2,2-, 3- и 5-нм наночастицы даже после диспергирования в сыворотке человека и хранения в течение ~20 дней не показывают оседания или агрегации при наблюдении невооруженным глазом.
Приведенные выше результаты показывают, что гидрофилизованные наночастицы оксида железа, полученные способом по изобретению, высоко устойчивы in vitro и in vivo.
Экспериментальный пример 2. Разделение и очистка гидрофилизованных наночастиц оксида железа
В данном экспериментальном примере гидрофилизованные наночастицы и мицеллы выделяют и очищают из прозрачного раствора после гидрофилизации в примере 2. Разделение выполняют центрифугированием в градиенте плотности.
Конкретно, прозрачный раствор центрифугируют при 15000 об/мин при 4°С в течение 1 часа. В результате наночастицы, которые не участвовали в гидрофилизации, и негидрофилизованные наночастицы оседают и образуют на дне липкий осадок. Вышеописанные условия центрифугирования применяют к ≤5-нм гидрофилизованным наночастицам оксида железа. С другой стороны, <5-нм гидрофилизованные наночастицы оксида железа центрифугируют при 40000 об/мин при 4°С в течение 1-2 час.
Очистку выполняют с использованием для центрифугирования йодиксанола (Opti-Prep). Когда используют 10%, 30%, 40% и 60% (мас./об.) растворы йодиксанола (Opti-solution), в растворах образуются ленточные слои из-за различий в плотности (фиг.5). Когда фактическая величина PDI после разделения более высокая, чем ожидалась, часть раствора перед использованием диализуют до полного удаления йодиксанола (Opti-Prep). Мицеллы, которые не осаждаются при гидрофилизации, не удаляются диализом.
Экспериментальный пример 3. Получение и очистка гидрофилизованных наночастиц оксида железа в большом масштабе
В данном экспериментальном примере выполняют крупномасштабную гидрофилизацию для средних и больших экспериментов с животными или для оценки клинических и промышленных применений гидрофилизованных наночастиц оксида железа.
Размер ядер наночастиц до инкапсуляции фиксируют до 3 нм с последующей гидрофилизацией в одинаковых условиях для подтверждения выхода гидрофилизации и оценки размера после гидрофилизации. Тот же способ, что и ранее, выполняют пятикратно, строго соблюдая соотношение Т60/ОА, показанное в таблицах 1 и 3.
Результаты приводятся на фиг.7. Как можно видеть из фиг.7, в среднем получают высокие выходы ≥90%, показывающие, что настоящее изобретение предлагает весьма эффективный протокол гидрофилизации. В частности, так как данные каждого цикла показывают весьма высокие и схожие выходы даже когда гидрофилизация выполняется в больших масштабах (с использованием различных количеств исходных ядер), это, как предполагается, обеспечит большое преимущество для получения гидрофилизованных наночастиц оксида железа в промышленном масштабе в будущем.
Все гидрофилизованные наночастицы анализируют DLS. В результате не только выходы, но также размеры после гидрофилизации являются почти однородными ((А) на фиг.8). На (В), фиг.8, показаны 3-нм гидрофилизованные наночастицы, полученные в большом масштабе.
Экспериментальный пример 4. Подтверждение зависимого от размера распределения гидрофилизованных наночастиц оксида железа
В данном экспериментальном примере подтверждается зависимое от размера распределение in vivo гидрофилизованных наночастиц оксида железа. С этой целью получают изображения распределений in vivo гидрофилизованных наночастиц оксида железа, имеющих различные размеры, и оценивают достоверность изображений с помощью определения количества в медицинской радиологии.
Полученные в примере 2 2,2-, 3- и 5-нм гидрофилизованные наночастицы оксида железа хранят в течение ~2 месяцев, и выполняют эксперименты при трехкратном повторе (n=3) или большем. В каждом эксперименте гидрофилизованные наночастицы оксида железа метят Cu-64. Следуя протоколу изотопа, эксперименты проводят с интервалами 2 недели.
Результаты экспериментов приводятся на фиг.9. Как подтверждается на фиг.9, снимки MRI и снимки РЕТ очень хорошо соответствуют, показывая, что гидрофилизованный материал циркулирует, оставаясь хорошо присоединенным к поверхности меченных изотопом ядер.
Мечение изотопами выполняют TLC. Такое мечение также называют радиомечением. Принципиальная схема и данные по мечению изотопом приводятся на фиг.10. Устойчивость при хранении является мерой того сохраняется ли размер гидрофилизованных наночастиц (до 4 недель) даже после мечения изотопом. В это время также подтверждается устойчивость радиомечения.
В данных экспериментах схожесть данных РЕТ/MRI подтверждается даже после хранения в целом в течение 2 месяцев. Хотя это не показано, гидрофилизующий материал устойчиво связан с материалом ядер без отделения в течение ~1 года после получения гидрофилизованных наночастиц.
Количественные данные, приведенные на фиг.11, показывают, что сигналы РЕТ в каждый момент времени показывает тенденцию, подобную сигналам MRI.
Экспериментальный пример 5. Оценка применимости гидрофилизованных наночастиц оксида железа для наборов
В данном экспериментальном примере оценивают применимость гидрофилизованных наночастиц оксида железа для наборов. С этой целью после высушивания наночастиц из водного раствора в вакууме и повторного диспергирования сравнивают их размер и величины PDI.
Полученные в примере 2 3-нм гидрофилизованные наночастицы частично разводят и переносят в небольшой флакон. Водный раствор упаривают для удаления всех жидких компонентов. Как можно видеть на фиг.12, образуются светлые круговые полосы, и на дне небольшого флакона образуется твердая фаза. Твердую фазу повторно диспергируют в дистиллированной воде (DW) и переносят во флакон побольше. Размер и PDI гидрофилизованных наночастиц оксида железа оценивают DLS.
Берут 0,5 мл 3-нм гидрофилизованных наночастиц (в целом 87 мл), сушат и повторно диспергируют в 2,5 мл дистиллированной воды (DW). Фиг.13 показывает результаты DLS гидрофилизованных наночастиц. Размер гидрофилизованных наночастиц почти не изменяется по сравнению с размером до повторного диспергирования. Найдено, что гидрофилизованные наночастицы имеют PDI 0,2. Также Z-средний очень близок к исходному среднему значению, демонстрируя, что даже после повторного диспергирования могут сохраняться те же физические свойства.
Экспериментальный пример 6. Эксперименты на животных (кролики) на фармакологическое действие
В данном экспериментальном примере после введения кроликам 3-нм гидрофилизованных наночастиц оксида железа и гадолиния оценивают эффекты контраста в печени, нижней полой вене (IVC), левом желудочке (LV), аорте, почках и мозговом веществе почек кроликов.
Как видно на фиг.14, контраст MRI, усиленный использованием 3-нм гидрофилизованных наночастиц оксида железа, показывает примерно половину эффекта контраста, усиленного гадолинием. Иными словами, верхние изображения MRI, на которых круглые части сердца и кровеносные сосуды кажутся яркими, показывают, что эффект Т1 гидрофилизованных наночастиц не исчезает сразу после введения, в отличие от существующего контрастного вещества, и гидрофилизованные наночастиц хорошо циркулируют в кровотоке.
На фиг.15 показаны результаты испытания 1, 2 и 3, полученные после введения три раза 3-нм гидрофилизованных наночастиц оксида железа. В данном случае ось Х представляет время (с), и ось Y представляет сигнал MRI. Как можно видеть на фиг.15, контрастное вещество на основе гадолиния показывает сильные сигналы в кровеносных сосудах на начальной стадии инъекции. Затем контрастное вещество на основе гадолиния распределяется по органам и выводится через почки. Напротив, гидрофилизованные наночастицы оксида железа распределяются в кровеносных сосудах и с трудом просачиваются во внеклеточную жидкость, что определяется по степени усиления контраста в органах. Это означает, что 3-нм гидрофилизованные наночастицы оксида железа усиливают контраст сосудов в течение ~1-2 часов. В итоге 3-нм гидрофилизованные наночастицы оксида железа позволяют наблюдать изображение в течение длительного времени и, как ожидается, применимы для контрастного вещества Т1, которое таргетирует повреждения.








Группа изобретений относится к контрастному веществу Т1 для магнитно-резонансной томографии, содержащему ядра мелких наночастиц оксида железа, имеющих диаметр 6 нм или менее и индекс полидисперсности (PDI) 0,2 или меньше, и мицеллы, инкапсулирующие частицы ядер, причем мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь, также относится к платформе для мультиплексных анализов с помощью эффекта контраста Т1 магнитно-резонансной томографии, включающей ядра мелких наночастиц оксида железа, имеющих диаметр 6 нм или менее и индекс полидисперсности (PDI) 0,2 или меньше, и мицеллы, инкапсулирующие частицы ядер, причем на поверхность ядер вносят линкерное соединение, выбранное из группы ADIBO-PEG4-C18, ADIBO-PEG2000-DSPE, DBCO-PEG4-C18, DBCO-PEG2000-DSPE, DBCO-SA, N3-PEG4-C18 и N3-PEG2000-DSPE, а мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь, также относится к способу получения наночастиц для мультиплексных анализов, включающему предоставление ядер мелких наночастиц оксида железа, имеющих диаметр 6 нм или менее и индекс полидисперсности (PDI) 0,2 или меньше; модификацию частиц ядер линкерным соединением выбранным из группы ADIBO-PEG4-C18, ADIBO-PEG2000-DSPE, DBCO-PEG4-C18, DBCO-PEG2000-DSPE, DBCO-SA, N3-PEG4-C18 и N3-PEG2000-DSPE, вызывающим клик-реакцию; предоставление раствора мицелл, содержащего неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь; диспергирование модифицированных частиц ядер в мицеллярном растворе для придания модифицированным частицам ядер гидрофильности посредством инкапсуляции лигандом, в качестве которого используют органические кислотные группы С4-С25; и связывание функционализирующего материала, содержащего клик-реактивную часть, с поверхностью частиц ядер для модификации поверхности частиц ядер, и также относится к способу получения наночастиц для мультиплексных анализов, включающему предоставление ядер мелких наночастиц оксида железа, имеющих диаметр 6 нм или менее и индекс полидисперсности (PDI) 0,2 или меньше; предоставление раствора мицелл, в которых неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь, смешано с амфифильным материалом, содержащим функционализирующую группу, выбранным из группы, включающей нацеленные на заболевание агенты, хелатирующие агенты, флуоресцентные материалы и их смеси; и диспергирование частиц ядер в мицеллярном растворе, так что одновременно выполняется гидрофилизация частиц ядер посредством инкапсуляции лиганда, в качестве которого используют органические кислотные группы С4-С25; и модификация поверхности частиц ядер функционализирующим материалом. Группа изобретений обеспечивает ультратонкие наночастицы оксида железа, которые получают на основе комбинации метода синтеза однородных ядер и метода гидрофилизации поверхности и которые имеют однородный эффект контраста, сохраняя в то же время свою однородность in vivo, что, таким образом является подходящим для использования при получении контрастных веществ Т1, которые могут заменить обычные контрастные вещества на основе гадолиния. 4 н. и 11 з.п. ф-лы, 15 ил., 3 табл., 11 пр.
1. Контрастное вещество Т1 для магнитно-резонансной томографии, содержащее ядра мелких наночастиц оксида железа, имеющих диаметр 6 нм или менее и индекс полидисперсности (PDI) 0,2 или меньше, и мицеллы, инкапсулирующие частицы ядер, причем мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь.
2. Контрастное вещество Т1 по п.1, в котором неионогенное поверхностно-активное вещество является соединением, представленным формулой 1:
[Формула 1]
А-О-С(О)-В,
в которой А представляет собой гидрофильный фрагмент, включающий две или больше цепей, каждая из которых имеют одну или более концевых групп -OH и содержит -O-(CH2)n-, где n представляет собой целое число от 1 до 10, или C3-C5 алициклическую углеводородную группу, причем две или больше из них необязательно связаны друг с другом с образованием цепочечной структуры, и B представляет собой гидрофобный фрагмент, имеющий структуру С6-С30 углеводородной цепи.
3. Контрастное вещество Т1 по п.1, в котором ядра имеют диаметр 6 нм или меньше и индекс полидисперсности (PDI) 0,2 или меньше.
4. Контрастное вещество Т1 по п.1, в котором гидрофильный фрагмент содержит полиалкиленгликолевую цепь.
5. Контрастное вещество Т1 по п.4, в котором неионогенным поверхностно-активным веществом является полисорбат.
6. Контрастное вещество Т1 по п.1, имеющее общий диаметр 10 нм или меньше и PDI 0,2 или меньше.
7. Платформа для мультиплексных анализов с помощью эффекта контраста Т1 магнитно-резонансной томографии, включающая ядра мелких наночастиц оксида железа, имеющих диаметр 6 нм или менее и индекс полидисперсности (PDI) 0,2 или меньше, и мицеллы, инкапсулирующие частицы ядер, причем на поверхность ядер вносят линкерное соединение, выбранное из группы ADIBO-PEG4-C18, ADIBO-PEG2000-DSPE, DBCO-PEG4-C18, DBCO-PEG2000-DSPE, DBCO-SA, N3-PEG4-C18 и N3-PEG2000-DSPE, а мицеллы включают неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь.
8. Платформа по п.7, где линкерное соединение представляет собой соединение, вызывающее клик-реакцию.
9. Платформа по п.7, где линкерное соединение представляет собой амфифильное соединение, содержащее гидрофобный фрагмент на одном своем конце и гидрофильный фрагмент, связанный с клик-реактивным материалом, на другом конце.
10. Способ получения наночастиц для мультиплексных анализов, включающий предоставление ядер мелких наночастиц оксида железа, имеющих диаметр 6 нм или менее и индекс полидисперсности (PDI) 0,2 или меньше; модификацию частиц ядер линкерным соединением выбранным из группы ADIBO-PEG4-C18, ADIBO-PEG2000-DSPE, DBCO-PEG4-C18, DBCO-PEG2000-DSPE, DBCO-SA, N3-PEG4-C18 и N3-PEG2000-DSPE, вызывающим клик-реакцию; предоставление раствора мицелл, содержащего неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь; диспергирование модифицированных частиц ядер в мицеллярном растворе для придания модифицированным частицам ядер гидрофильности посредством инкапсуляции лигандом, в качестве которого используют органические кислотные группы С4-С25; и связывание функционализирующего материала, содержащего клик-реактивную часть, с поверхностью частиц ядер для модификации поверхности частиц ядер.
11. Способ по п.10, где неионогенное поверхностно-активное вещество для гидрофилизации используют в 15-25-кратном молярном избытке относительно гидрофобного материала на поверхности ядер.
12. Способ по п.10, где функционализирующий материал выбирают из группы, состоящей из агентов, нацеленных на заболевание, хелатирующих агентов, флуоресцентных материалов и их смесей.
13. Способ по п.10, дополнительно включающий центрифугирование в градиенте плотности.
14. Способ получения наночастиц для мультиплексных анализов, включающий предоставление ядер мелких наночастиц оксида железа, имеющих диаметр 6 нм или менее и индекс полидисперсности (PDI) 0,2 или меньше; предоставление раствора мицелл, в которых неионогенное поверхностно-активное вещество, состоящее из гидрофильного фрагмента, содержащего по меньшей мере две цепи, и гидрофобного фрагмента, содержащего по меньшей мере одну углеводородную цепь, смешано с амфифильным материалом, содержащим функционализирующую группу, выбранным из группы, включающей нацеленные на заболевание агенты, хелатирующие агенты, флуоресцентные материалы и их смеси; и диспергирование частиц ядер в мицеллярном растворе, так что одновременно выполняется гидрофилизация частиц ядер посредством инкапсуляции лиганда, в качестве которого используют органические кислотные группы С4-С25; и модификация поверхности частиц ядер функционализирующим материалом.
15. Способ по п.14, дополнительно включающий центрифугирование в градиенте плотности.
| US 2013164223 A1, 27.06.2013 | |||
| Lucas W | |||
| E | |||
| Starmans et al., Iron Oxide Nanoparticle-Micelles (ION-Micelles) for Sensitive (Molecular) Magnetic Particle Imaging and Magnetic Resonance Imaging / PLoS One, 2013, Vol.8, N.2, pp.1-9 | |||
| US 2013195755 A1, 01.08.2013 | |||
| Y | |||
| Bao et al., Magnetic Iron Oxide Nanoparticles as T1 Contrast Agents for Magnetic |
Авторы
Даты
2023-04-24—Публикация
2019-12-17—Подача