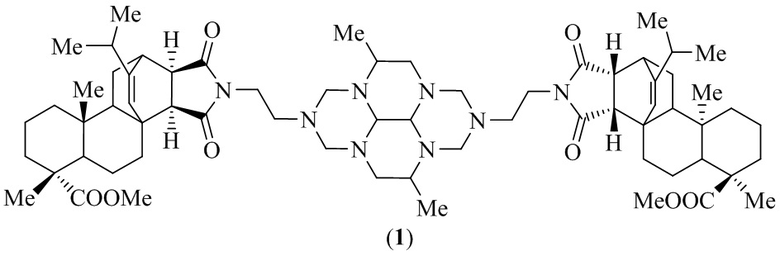
Предлагаемое изобретение относится к области синтеза соединений с биологической активностью, конкретно, к способу получения бис-аддукта имидо-амина метилового эфира малеопимаровой кислоты с диметил-гексаазапергидропиреновым спейсером (1) на основе каталитической реакции конденсации 2,6-диметил-1,4,5,8-тетраазадекалина с N,N,N',N'-тетраметилметандиамином и имидо-амином метилового эфира малеопимаровой кислоты (МЭМПК). Соединение (1) in vitro проявляет цитотоксический эффект в отношении клеточных линий аденокарциномы толстого кишечника (HTC-116), нейробластомы человека (SH-SY5Y), карциномы молочной железы (MCF-7), аденокарциномы легкого (A549), Т-клеточного лейкоза (Jurkat), моноцитарной лейкемии человека (THP-1) и может быть использовано в качестве цитотоксического средства.

Известен способ получения [M.P. Bei, A.P. Yuvchenko, N.V. Puchkova, Russ. J. Gen. Chem., 2015, 85, 1034] диимид-дикислот (2) взаимодействием малеопимаровой кислоты с пара- или мета-фенилендиаминами при кипячении в течение 8 часов в дихлорбензоле.

Известный способ не позволяет получать бис-аддукт имидо-амина метилового эфира малеопимаровой кислоты с диметил-гексаазапергидропиреновым спейсером (1).
Известен способ получения [Rakhimova, E.B.; Kirsanov, V.Yu.; Tret'yakova, E.V.; Khalilov, L.M.; Ibragimov, А.G.; Dzhemileva, L.U.; D'yakonov, V.A.; Dzhemilev, U.M. RSC Advances 2020, 10, 36, 21039] димерных гексаазапергидродибензотетраценов (3) циклоконденсацией аминопроизводных МЭМПК с формальдегидом и тетраазапергидротетраценом в присутствии в качестве катализатора цеолита Ymmm в Н-форме.

Известный способ не позволяет получать бис-аддукт имидо-амина метилового эфира малеопимаровой кислоты с диметил-гексаазапергидропиреновым спейсером (1).
Известен способ получения [Rakhimova, E.B.; Kirsanov, V.Yu.; Meshcheryakova, E.S.; Khalilov, L.M.; Kutepov, B.I.; Ibragimov, A.G.; Dzhemilev, U.M. Tetrahedron 2017, 73, 6880] диалкилзамещенных (4) и дициклоалкилзамещенных (5) 4,9-диметил-2,3а,5а,7,8а,10а-гексаазапергидропиренов межмолекулярной гетероциклизацией N,N-бис(метоксиметил)-N-алкиламинов или рециклизацией 1,3,5-трициклоалкил-1,3,5-триазинанов с 2,6-диметил-1,4,5,8-тетраазадекалином под действием катализаторов на основе солей d- и f-элементов.

Известный способ не позволяет получать бис-аддукт имидо-амина метилового эфира малеопимаровой кислоты с диметил-гексаазапергидропиреновым спейсером (1).
Известен способ получения [Rakhimova, E.B.; Kirsanov, V.Yu.; Ibragimov, A.G.; Dzhemilev, U.M. Russ. J. Org. Chem. 2018, 54, 1085] диарилзамещенных 4,9-диметил-2,3а,5а,7,8а,10а-гексаазапергидропиренов (6) циклоконденсацией ариламинов с формальдегидом и 2,6-диметил-1,4,5,8-тетраазадекалином в присутствии катализатора на основе Yb (III).

Известный способ не позволяет получать бис-аддукт имидо-амина метилового эфира малеопимаровой кислоты с диметил-гексаазапергидропиреновым спейсером (1).
Известна [Elena V. Tretyakova, Irina E. Smirnova, Oxana B. Kazakova, Genrikh A. Tolstikov, Nadejda P. Yavorskaya, Irina S. Golubeva, Rujena B. Pugacheva, Galina N. Apryshko, Vladimir V. Poroikov. Bioorganic & Medicinal Chemistry 2014, 22, 6481] противоопухолевая активность in vitro соединения (7).

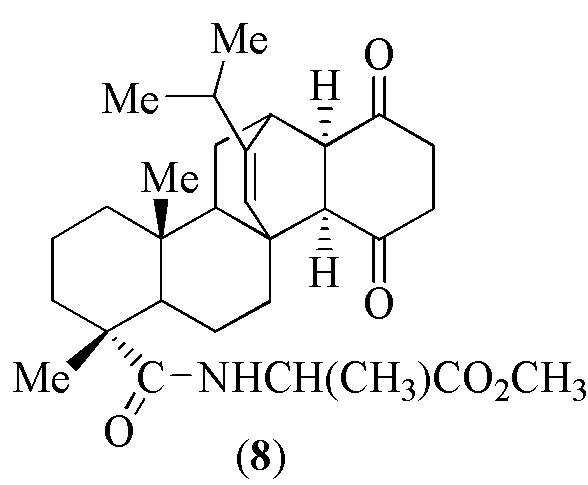
Известна [Elena V. Tretyakova, Irina E. Smirnova, Elena V. Salimova, Victor N. Odinokov. Bioorganic & Medicinal Chemistry 2015, 23, 6543] высокая активность соединения (8) в отношении вируса папилломы человека (штамм HPV-11).
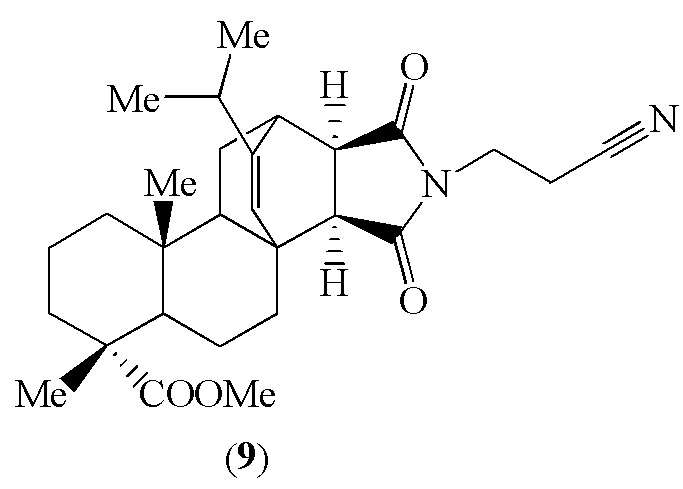
Известна [Е.В. Третьякова, Е.В. Салимова, Л.В. Парфенова. Биоорганическая химия, 2018, 44, 5, 554] умеренная противоопухолевая активность in vitro цианэтильного производного метилового эфира малеопимаровой кислоты (9) по отношению к клеткам рака предстательной железы (PC-3).
Синтезы указанных соединений или многостадийны или базируются на использовании дорогостоящих исходных реагентов.
Таким образом, в литературе отсутствуют сведения о способе получения бис-аддукта имидо-амина метилового эфира малеопимаровой кислоты с диметил-гексаазапергидропиреновым спейсером (1) и его биологических свойствах.
Предлагается новый способ получения бис-аддукта имидо-амина метилового эфира малеопимаровой кислоты с диметил-гексаазапергидропиреновым спейсером (1) в одну препаративную стадию из доступных исходных реагентов. Соединение формулы (1) может быть использовано в качестве средства с цитотоксической активностью.
Сущность способа заключается во взаимодействии 2,6-диметил-1,4,5,8-тетраазадекалина с N,N,N',N'-тетраметилметандиамином и имидо-амином МЭМПК в присутствии катализатора NiCl2⋅6H2O, взятых в мольном соотношении 2,6-диметил-1,4,5,8-тетраазадекалин : N,N,N',N'-тетраметилметандиамин : имидо-амин МЭМПК : NiCl2⋅6H2O = 1 : 4 : 2 : (0.03-0.07), предпочтительно 1 : 4 : 2 : 0.05. Реакционную смесь перемешивают 2.5-3.5 ч при температуре ~ 20°С и атмосферном давлении в среде CH3OH-H2O. Выход бис-аддукта имидо-амина МЭМПК с диметил-гексаазапергидропиреновым спейсером (1) составляет 14-24%. Реакция протекает по схеме:

Имидо-амин МЭМПК получают по методике, описанной в работе [H. Wang, H. Wang, G. Zhou, Polym. Int., 2011, 60, 557]. 2,6-Диметил-1,4,5,8-тетраазадекалин получают способом, описанным в работе [R. Mullera, W. Philipsborna, L. Schleiferh, P. Aped, B. Fuchs, Tetrahedron, 1991, 47, 1013]. Бис-аддукт имидо-амина МЭМПК с диметил-гексаазапергидропиреновым спейсером (1) образуется только лишь с участием 2,6-диметил-1,4,5,8-тетраазадекалина, тетраметилметандиамина и имидо-амина МЭМПК, взятых в мольном соотношении 1 : 4 : 2 (стехиометрические количества). При другом соотношении исходных реагентов снижается выход целевого продукта (1). Без катализатора реакция не проходит. Проведение указанной реакции в присутствии катализатора NiCl2⋅6H2O больше 7 мол. % не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора NiCl2⋅6H2O менее 3 мол. % снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20 оС. При температуре выше 20°С (например, 60°С) увеличиваются энергозатраты, а при температуре ниже 20°С (например, при 0°С) снижается скорость реакции. Опыты проводили в среде CH3OH-H2O, т.к. в них хорошо растворяются исходные соединения.
Цитотоксичность соединения (1) оценивали на линиях раковых клеток (HTC-116, SH-SY5Y, MCF-7, A549, Jurkat, THP-1, HepG2) и условно нормальных клетках человека (HEK293) методом МТТ теста (колориметрический тест для оценки метаболической активности клеток). Клетки инкубировали в присутствии соединения (1) в течение 48 ч. Контролем служил 5-фторурацил. Как видно из таблицы 1, соединение (1) ингибирует жизнеспособность раковых клеток при значениях IC50 от 37 до 73 мкМ в зависимости от тестируемой клеточной линии и проявляет умеренное цитотоксическое действие.
IC50/μM
IC50/μM
IC50/μM
IC50/μM
IC50/μM
IC50/μM
IC50/μM
IC50/μM
Существенные отличия предлагаемого способа:
В известном способе реакция идет с участием в качестве исходных реагентов 1,6,7,12-тетраазапергидротетрацена, формальдегида и аминопроизводных МЭМПК в присутствии в качестве катализатора цеолита Ymmm в Н-форме.
В предлагаемом способе реакция идет с участием в качестве исходных реагентов 2,6-диметил-1,4,5,8-тетраазадекалина, тетраметилметандиамина и имидо-амина МЭМПК в присутствии катализатора NiCl2⋅6H2O. В отличие от известного, предлагаемый способ позволяет получить бис-аддукт имидо-амина МЭМПК с диметил-гексаазапергидропиреновым спейсером (1) с цитотоксической активностью.
Способ поясняется примерами:
ПРИМЕР 1. В круглодонную колбу, установленную на магнитной мешалке, при комнатной температуре ~20°С помещают 0.17 г (1 ммоль) 2,6-диметил-1,4,5,8-тетраазадекалина в 5 мл H2O, 0.41 г (4.00 ммоль) тетраметилметандиамина и 0.012 г (0.05 ммоль) катализатора NiCl2⋅6H2O, затем добавляют 0.43 г (2.00 ммоль) имидо-амина МЭМПК в 10 мл MeOH. Реакционную смесь перемешивают 3 ч при комнатной температуре. Образующийся осадок отфильтровывают, дважды промывают метанолом (2x5 мл) и получают индивидуальный бис-аддукт имидо-амина МЭМПК с диметил-гексаазапергидропиреновым спейсером, а именно диметил-N',N''-[4,9-диметилоктагидро-1H,6H-2,3a,5a,7,8a,10a-гексаазапирен-2,7-диилбис(этан-N',N''-диил)]бис(13'-изопропил-4',10'-диметил-23',24'-диоксогексадекагидро-8',12'-этенонафто[2,1-е]изоиндол-4'-карбоксилат) с выходом 21%.
Примеры 2-5, подтверждающие способ, выполнены аналогично пр. 1 и приведены в табл. 2.
п/п
имидо-амин МЭМПК : NiCl2⋅6H2O, ммоль
час
Все опыты проводили в среде CH3OH-H2O
при комнатной температуре (~20°С).
Спектральные характеристики бис-аддукта имидо-амина МЭМПК с диметил-гексаазапергидропиреновым спейсером:
Спектр ЯМР1 H, δ, м.д. (J, Гц): 0.58 с (6H, CH3, Н-20′,20′′), 0.89-0.98 м (2H, CH2, Hax-1′,1′′; 12H, CH3, Н-16′,16′′,17′,17′′; 6H, CH3, Н-11,12), 1.15 с (6H, CH3, Н-19′,19′′), 1.16-1.79 м (20Н, CH2, Heq-1′,1′′, Hax,eq-2′,2′′,3′,3′′,6′,6′′,11′,11′′, Hax-7′,7′′; 4Н, CH, Н-5′,5′′,9′,9′′), 1.82-1.97 м (2H, CH2, На-5,10), 2.10-2.19 м (2H, CH, H-15′,15′′), 2.30-2.42 м (6H, CH2, Hb-5,10, H-26′,26′′; 6H, CH, H-22′,22′′, H-4,9, H-10b,10c), 2.50 д (2H, CH2, Heq-7′,7′′, 2J = 13), 2.73-2.78 м (2H, CH, H-21′,21′′), 2.88-3.05 м (2H, CH, H-12′,12′′, 4Н, CH2, Ha-1,3,6,8), 3.41-3.48 м (4H, CH2, H-27′,27′′), 3.51-3.58 м (2Н, CH2, Hb-1,6), 3.67 с (6H, OCH3, H-25′,25′′), 3.92-3.98 м (2Н, CH2, Hb-3,8), 5.37 с (2Н, CH, Н-14′,14′′).
Спектр ЯМР 13С, δ, м.д.: 15.63 (С-20′,20′′), 16.75 (С-11,12, С-19′,19′′), 17.04 (С-2′,2′′), 20.09 (С-16′,16′), 20.71 (С-17′,17′′), 21.78 (С-6′,6′′), 27.60 (С-11′,11′′), 32.65 (С-15′,15′′), 35.32 (С-7′,7′′), 35.57 (С-12′,12′′), 36.56 (С-27′,27′′), 36.69 (С-3′,3′′), 37.67 (С-10′,10′′), 38.16 (С-1′,1′′), 40.65 (С-8′,8′′), 45.01 (С-21′,21′′), 47.16 (С-4′,4′′), 49.53 (С-5′,5′′), 49.61 (С-26′,26′′), 51.06 (С-4,9), 51.95 (С-22′,22′′), 52.36 (С-25′,25′′), 54.15 (С-9′,9′′), 55.98 (С-5,10), 70.16 (С-3,8), 73.50 (С-1,6), 82.63 (C-10b,10c), 124.38 (C-14′,14′′), 146.95 (C-13′,13′′), 177.55 (C-24′,24′′), 178.65 (C-23′,23′′), 179.24 (C-18′,18′′).
MALDI TOF/TOF: m/z (%) = 1129.718 [M-H]+ (100) и 1169.917 [M+K]+ (100).

Спектры ЯМР (1Н, 13С) сняты на спектрометре Bruker Avance 500 (125.78 МГц для ядер 13С и 500.17 МГц для ядер 1Н) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCl3. Масс спектры получены на приборе MALDI TOF/TOF AUTOFLEX III фирмы Bruker.
Изобретение относится к области синтеза соединений с биологической активностью, конкретно к способу получения бис-аддукта имидо-амина метилового эфира малеопимаровой кислоты (МЭМПК) с диметил-гексаазапергидропиреновым спейсером формулы (1). Сущность способа заключается во взаимодействии 2,6-диметил-1,4,5,8-тетраазадекалина с N,N,N',N'-тетраметилметандиамином и имидо-амином МЭМПК в присутствии катализатора NiCl2⋅6H2O при мольном соотношении 2,6-диметил-1,4,5,8-тетраазадекалин:N,N,N',N'-тетраметилметандиамин:имидо-амин МЭМПК:NiCl2⋅6H2O=1:4:2:(0.03-0.07) в среде CH3OH-H2O при температуре ~20°С и атмосферном давлении в течение 2.5-3.5 ч. Выход бис-аддукта имидо-амина МЭМПК с диметил-гексаазапергидропиреновым спейсером (1) составляет 14-24%. Техническим результатом изобретения является получение бис-аддукта имидо-амина метилового эфира малеопимаровой кислоты с диметил-гексаазапергидропиреновым спейсером формулы (1), обладающего цитотоксической активностью по отношению к раковым клеткам человека (HTC-116, SH-SY5Y, MCF-7, A549, Jurkat, THP-1). 2 табл., 5 пр.
Способ получения бис-аддукта имидо-амина метилового эфира малеопимаровой кислоты (МЭМПК) с диметил-гексаазапергидропиреновым спейсером формулы (1)
 ,
,
отличающийся тем, что 2,6-диметил-1,4,5,8-тетраазадекалин подвергают взаимодействию с N,N,N',N'-тетраметилметандиамином и имидо-амином МЭМПК в среде CH3OH-H2O в присутствии катализатора NiCl2·6H2O при мольном соотношении 2,6-диметил-1,4,5,8-тетраазадекалин:N,N,N',N'-тетраметилметандиамин:имидо-амин МЭМПК:NiCl2·6H2O=1:4:2:(0.03-0.07) при комнатной (~20°С) температуре и атмосферном давлении в течение 2.5-3.5 ч.
| RAKHIMOVA E.B | |||
| et al | |||
| Synthesis, structure, and antitumor activity of 2,9- disubstituted perhydro 2,3a,7b,9,10a,14b-hexaazadibenzotetracenes, RSC Adv., 2020, vol.10, p.21039-21048 | |||
| СПОСОБ ПОЛУЧЕНИЯ 2,9-БИС-ЗАМЕЩЕННЫХ ТРАНС-2,3a,7b,9,10a,14b-ГЕКСААЗАПЕРГИДРОДИБЕНЗОТЕТРАЦЕНОВ НА ОСНОВЕ АМИНОПРОИЗВОДНЫХ МЕТИЛОВОГО ЭФИРА МАЛЕОПИМАРОВОЙ КИСЛОТЫ | 2019 |
|
RU2730493C1 |
| RAKHIMOVA E.B | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2023-04-24—Публикация
2023-01-29—Подача