Группа изобретений относится к области медицинской и органической а именно к новому полифункциональному соединению - бис{2-[(2Z)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоату формулы I и способу его получения, которые могут быть использованы в органическом синтезе и в медицине в качестве потенциального актопротекторного средства.

В патентной литературе описан метод синтеза фумарового моноэфира диэтиламиноэтанола IV из диэтиламиноэтанола (II) и малеинового ангидрида (III) в мольном соотношении 1:1 [Пат. 2600315 РФ. Бис{2-[(2Е)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоат и способ его получения]. Реакцию вели в дихлорэтане при 50-55°С. Последующее взаимодействие с 0.5 экв. янтарной кислоты V приводило к соответствующему сукцинату VI, представляющему собой вязкую некристаллизующуюся жидкость. Отличительной особенностью данного синтеза являлась смена конфигурации кратной связи с образованием производного фумаровой кислоты.

Из патентной и научно-технической литературы не выявлены ни способ получения нового, заявляемого авторами соединения, ни сама структура.
Задачей предполагаемой группы изобретений является создание нового неописанного в литературе соединения - бис{2-[(22)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоата (I).
Техническими результатами, на решение которых направлена группа изобретений, являются получение нового полифункционального соединения формулы I, которое потенциально может быть использовано в медицине в качестве актопротекторного средства; разработка простого способа его синтеза.
Поставленная задача осуществляется путем двустадийного синтеза согласно нижеприведенной схеме. На первой стадии диэтиламиноэтанол (II) медленно прикапывается к раствору малеинового ангидрида (III) в безводном этилацетате (массовая доля воды не более 0.05%) при 15-20°С с последующей кристаллизацией и фильтрованием малеинового моноэфира VII. На второй стадии велось образование соли эфира VII с янтарной кислотой в мольном отношении 2:1 в безводном этилацетате при температуре 15-20°С с последующим фильтрованием целевого продукта I, представляющего собой аморфный порошок белого цвета.

Способ получения бис{2-[(22)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоата I изучен и проведен в лабораторных условиях на стандартном товарном сырье. По сравнению с известным методом разработанный синтез отличается более мягкими условиями реакции и отсутствием изомеризации кратной связи.
Предполагаемая группа изобретений проиллюстрирована схемой и примерами практического осуществления.
Пример 1. Получение (2)-4-[2-(диэтиламино)этокси]-4-оксобут-2-еновой кислоты (VII). В колбу помещают 200 мл этилацетата (хч, ГОСТ 22300-76, массовая доля воды не более 0.05%) и 101.5 г (1.05 моль) малеинового ангидрида (хч, ГОСТ 11153-75), ведут перемешивание без доступа влаги до полного растворения ангидрида. Далее начинают медленное, в течение 30-60 минут, добавление 118.0 г (1.00 моль) диэтиламиноэтанола (for synthesis, производитель Sigma Aldrich) из капельной воронки при температуре реакционной массы 15-20°С. Смесь перемешивают в течение 60-90 минут и затем отгон 50 мл этилацетата в вакууме водоструйного насоса при температуре 20-25°С. После окончания отгона малеиновый полуэфир диэтиламиноэтанола VII перемешивают еще 60 минут для полноты кристаллизации и отфильтровывают на воронке Бюхнера. Осадок на фильтре промывают 50 мл этилацетата, отжимают и сушат в вакуум-сушильном шкафу при температуре 45-50°С и остаточном давлении 10-15 мм рт.ст. в течение 4 часов без доступа влаги. Масса вещества VII составляет 208.2 г, выход 95.7%, считая на диэтиламиноэтанол. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C10H17NO4. Найдено, %: С - 55.88, Н - 8.03, N - 6.41. Вычислено %: С - 55.80, Н - 7.96, N - 6.51. Структура соединения доказана с помощью спектроскопии ЯМР 1Н. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.16 (т, J=7.3 Гц, 6Н, СН3СН2), 2.98 (кв, J=7.3 Гц, 4Н, СН3СН2), 3.17 (т, J=5.3 Гц, 2Н, СН2СН2), 4.34 (т, J=5.3 Гц, 2Н, СН2СН2), 5.90 (д, J=11.8 Гц, 1Н, СН=СН), 6.36 (д, J=11.8 Гц, 1Н, СН=СН), 7.41 (уш. с, 1H, NH).
Пример 2. Получение бис{2-[(22)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоата (I). В колбу помещают 200 мл этилацетата (хч, ГОСТ 22300-76, массовая доля воды не более 0.05%), 208.2 г полуэфира VII и 56.6 г (0.48 моль) янтарной кислоты (хч, ГОСТ 6341-75), после чего перемешивают реакционную массу 3 часа при температуре 15-20°С. Затем суспензию продукта I в этилацетате фильтруют на воронке Бюхнера, осадок промывают на фильтре 50 мл этилацетата и сушат в вакуум-сушильном шкафу при температуре 45-50°С и остаточном давлении 10-15 мм рт.ст. в течение 4 часов без доступа влаги. Целевой продукт представляет собой белый аморфный порошок, выход 263.4 г (98.9%, считая на полуэфир VII), т.пл. 97-100°С.
Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C24H40N2O12. Найдено, %: С - 52.42, Н - 7.19, N - 5.07. Вычислено %: С - 52.55, Н - 7.35, N - 5.11.
Структура синтезированного вещества была доказана методами 1Н и 13С спектроскопии ЯМР, а также двумерной спектроскопией ЯМР [1Н,1Н]-NOESY. В спектре ЯМР 1Н раствора исследуемого соединения в безводном ДМСО-d6 в слабом поле присутствуют уширенный синглет кислых протонов в области 12.5 м.д. (2Н), а также дублеты олефиновых протонов с химическим сдвигом 5.88 (1Н) и 6.38 м.д. (1Н) и константой спин-спинового взаимодействия 11.7 Гц, что указывает на цис-конфигурацию двойной связи. Дополнительно на цис-конфигурацию указывает наличие кросс-сигнала между олефиновыми протонами в спектре ЯМР NOESY. В сильном поле протонного спектра находятся сигналы протонов этиленовой (4.34 м.д. (т, J=6.3 Гц, 2Н) и 3.40 м.д. (т, J=6.3 Гц, 2Н)) и этильных групп (2.98 м.д. (кв, J 7.0 Гц, 4Н) и 1.16 м.д. (т, J 7.0 Гц, 6Н)). Также в сильном поле обнаруживается синглет протонов аниона янтарной кислоты в области 2.05 м.д. с интегральной интенсивностью 2Н. В спектре ЯМР 13С в слабом поле присутствуют сигналы карбоксильных атомов углерода 166.13, 174.47, 177.40 м.д. и олефиновых атомов в области 118.53 и 141.63 м.д. Сигналы с химическими сдвигами 7.92, 47.56, 50.50 и 58.60 м.д. принадлежат атомам углерода этильных и этиленовой групп соответственно. Сигналы атомов углерода остатка янтарной кислоты имеют химический сдвиг 29.13 м.д.
Пример 3. Исследование актопротекторной активности соединения I. Исследования проводили на беспородных мышах-самцах массой 22-24 г. Эксперименты выполняли в соответствии с приказом Минздрава России от 01.04.2016 г. №199 н «Об утверждении правил надлежащей лабораторной практики», согласно утвержденному письменному протоколу. Животные были получены из ФГУП ПЛЖ «Рапполово» (Ленинградская область), прошли необходимый карантин и содержались в стандартных условиях сертифицированного вивария на обычном пищевом рационе, со свободным доступом к воде.
Предварительный отбор животных осуществляли с помощью методики челночного плавания, что позволило оценить начальную физическую работоспособность и сделать выборку максимально однородной перед рандомизацией по экспериментальным группам [Очерки спортивной фармакологии. Том 1. Векторы экстраполяции / Под ред. Н.Н. Каркищенко и В.В. Уйба. - М., СПб.: Айсинг.- 2013. - 132 с]. Соответствующих критериям отбора животных случайным образом разделили на три группы по 10 животных в каждой, две из которых подвергалась тренировкам (опытная и контрольная), а интактная группа - нет. Одна из тренировавшихся групп получала соединение I в дозе 75 мг/кг внутрижелудочно за 30 минут до начала каждой тренировки. Контрольная группа получала эквиобъемное количество 0,9% раствора натрия хлорида.
Тренировки проводили в специальной плавательной установке [Радько С.В., Оковитый С.В., Куликов А.Н., Чистякова Е.Ю. Модель оценки влияния фармакологических средств на динамику адаптации к физической нагрузке // Биомедицина. - 2016. - №3. - С.35-42]. Температура воды поддерживалась постоянно на уровне 30-32°С Плавательные тренировки проходили два раза в день с перерывом в один час, пять дней в неделю на протяжении четырех недель в одно и то же время. Продолжительность первых трех тренировок составляла один час один раз в день, для адаптации животных к нагрузке, в дальнейшем - полтора часа. По окончании тренировок проводили тест челночного плавания [Очерки спортивной фармакологии. Том 1. Векторы экстраполяции / Под ред. Н.Н. Каркищенко и В.В. Уйба. - М., СПб.: Айсинг. - 2013. - 132 с.]: оценивали время, необходимое животному для совершения отдельных заплывов, их количество, время плавания в целом и скорость плавания по времени прохождения 10, 20, 30 и 40 бассейнов. Статистическую обработку полученных данных проводили с помощью пакета программ «Statistica 6.0».
Проведенным экспериментом установлено, что исследуемое соединение I статистически значимо повышало физическую выносливость животных, увеличивая количество пройденных бассейнов в 1.91 раза. Это повышение выносливости достоверно отличалось от такового как в контроле, так и по сравнению с не тренировавшимися животными. При проведении факторного анализа было установлено, что повышение выносливости у животных на 21.97% было обусловлено тренировками и на 78.02% - соединением I.
Таким образом, Z-изомер более эффективен, увеличивая количество пройденный бассейнов в 1.91 раза против 1.52 для Е-изомера.
Проведенное исследование выявило актопротекторное действие нового соединения I. На фоне его применения произошло значительное увеличение физической выносливости при отсутствии влияния на скоростные показатели.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИС{2-[(2E)-4-ГИДРОКСИ-4-ОКСОБУТ-2-ЕНОИЛОКСИ]-N,N-ДИЭТИЛЭТАНАМИНИЯ} БУТАНДИОАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2600315C1 |
| НЕЙРОПРОТЕКТОРНОЕ СРЕДСТВО НА ОСНОВЕ БИС{ 2-[(2E)-4-ГИДРОКСИ-4-ОКСОБУТ-2-ЕНОИЛОКСИ]-N,N-ДИЭТИЛЭТАНАМИНИЯ} БУТАНДИОАТА | 2015 |
|
RU2588365C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ПОСЛЕДСТВИЙ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ И СПОСОБ ЕЁ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2018 |
|
RU2693633C1 |
| 2-((N,N'-Дифенилкарбамидимидоил)карбамоил)бензойная кислота, способ ее получения и антигипоксическое средство | 2022 |
|
RU2789695C1 |
| 1,3-Диоксо-N,N'-дифенилизоиндолин-2-карбоксимидамид, способ его получения и анальгезирующее средство | 2022 |
|
RU2800863C1 |
| 6-Оксо-3-фенил-2-(фениламино)-3,4,5,6-тетрагидропиримидин-4-карбоновая кислота и способ ее получения | 2022 |
|
RU2785763C1 |
| Способ получения 2-(5-оксо-2,4-дифенил-5,6-дигидро-4Н-1,3,4-тиадиазин-6-ил)уксусной кислоты | 2023 |
|
RU2831020C1 |
| АМИДСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ 2-ОКСИНДОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2017 |
|
RU2685501C1 |
| Замещенные 5-оксо-5,6-дигидро-4Н-1,3,4-тиадиазин-6-илуксусные кислоты, способ их получения и антигипергликемические средства на их основе | 2023 |
|
RU2822831C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕНЗОТИОФЕН-2-ИЛБОРОНАТА | 2018 |
|
RU2790014C2 |
Изобретение относится к области органической и медицинской химии, конкретно к бис{2-[(2Z)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоату формулы I, который может найти применение в качестве актопротекторного средства. Изобретение относится также к способу получения соединения формулы I. Данный способ включает взаимодействие малеинового ангидрида с дизтиламиноэтанолом и янтарной кислотой в мольном соотношении 1,05:1:0.5. При этом малеиновый ангидрид растворяют в безводном этилацетате, при температуре 15-20°С, медленно прикапывают диэтиламиноэтанол, кристаллизующийся малеиновый моноэфир диэтиламиноэтанола отфильтровывают и к нему добавляют янтарную кислоту в безводном этилацетате при температуре реакционной массы 15-20°С с образованием суспензии целевого продукта. Техническими результатами, на решение которых направлена группа изобретений, являются получение нового полифункционального соединения формулы I, которое потенциально может быть использовано в медицине в качестве актопротекторного средства, а также разработка простого способа его синтеза. 2 н. и 1 з.п. ф-лы, 3 пр.

1. Бис{2-[(22)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоат формулы I
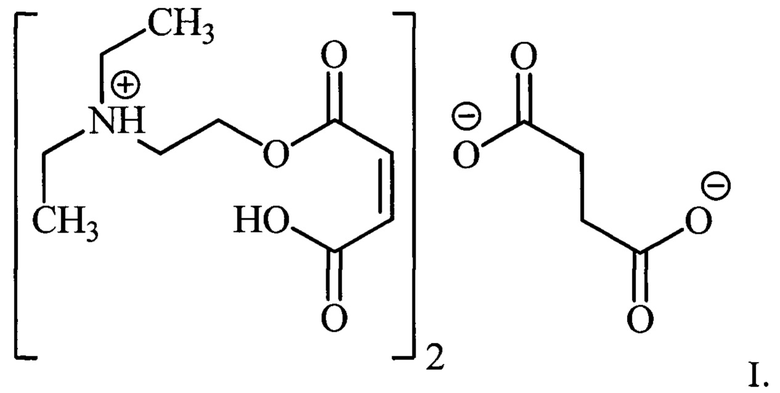
2. Способ получения бис{2-[(22)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоата формулы I

включающий взаимодействие малеинового ангидрида с дизтиламиноэтанолом и янтарной кислотой в мольном соотношении 1,05:1:0.5, отличающийся тем, что малеиновый ангидрид растворяют в безводном этилацетате, при температуре 15-20°С, медленно прикапывают диэтиламиноэтанол, кристаллизующийся малеиновый моноэфир диэтиламиноэтанола отфильтровывают и к нему добавляют янтарную кислоту в безводном этилацетате при температуре реакционной массы 15-20°С с образованием суспензии целевого продукта.
3. Способ получения бис{2-[(2Z)-4-гидрокси-4-оксобут-2-еноилокси]-N,N-диэтилэтанаминия} бутандиоата формулы I по п. 2, отличающийся тем, что для выделения целевого продукта суспензию в этилацетате фильтруют, осадок сушат в вакуум-сушильном шкафу при температуре 45-50°С и остаточном давлении 10-15 мм рт.ст. без доступа влаги, целевой продукт представляет собой аморфный порошок белого цвета.
| БИС{2-[(2E)-4-ГИДРОКСИ-4-ОКСОБУТ-2-ЕНОИЛОКСИ]-N,N-ДИЭТИЛЭТАНАМИНИЯ} БУТАНДИОАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2600315C1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ подпочвенного орошения с применением труб | 1921 |
|
SU139A1 |
| Антигипоксическое и актопротекторное средство на основе 2-(этилсульфанил)-1Н-бензимидазол-3-ия (2Е)-3-карбоксипроп-2-еноата | 2017 |
|
RU2673338C1 |
Авторы
Даты
2023-06-15—Публикация
2022-11-14—Подача