Область техники настоящего изобретения
Настоящее изобретение относится к области генетики. В частности, настоящее изобретение относится к применению набора хаускипингов, состоящего из по меньшей мере 3 хаускипингов, выбранных из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, для анализа экспрессии генов при болезни Паркинсона, где указанный набор хаускипингов стабильно экспрессируется в различных тканях головного мозга и периферической крови мышей, к набору праймеров и зондов для определения стабильной экспрессии указанного набора хаускипингов, а также к способу анализа экспрессии генов при болезни Паркинсона с использованием указанного набора хаускипингов.
Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который был подан на электронном носителе в машиночитаемом формате и посредством этого включен в настоящий документ посредством ссылки во всей своей полноте.
Включение посредством ссылки
Предпосылки к созданию настоящего изобретения были раскрыты авторами настоящего изобретения ранее в публикации Alieva, Anelya Kh, et al. "Housekeeping Genes for Parkinson's Disease in Humans and Mice" Cells, 2021. 10(9): 2252, опубликованной 30 августа 2021 г. Данный документ включен в настоящий документ посредством ссылки во всей своей полноте и не является обстоятельством, препятствующим признанию патентоспособности настоящего изобретения, так как настоящая заявка на выдачу патента на изобретение подана в федеральный орган исполнительной власти по интеллектуальной собственности до истечения шести месяцев со дня раскрытия информации. Все остальные публикации, патенты и заявки на выдачу патента, упомянутые в настоящем описании, включены в настоящий документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или заявка на выдачу патента была специально и отдельно указана как включенная посредством ссылки.
Предшествующий уровень техники настоящего изобретения
Болезнь Паркинсона (БП) представляет собой возрастзависимое нейродегенеративное заболевание, которое характеризуется избирательной гибелью дофаминергических нейронов компактной части черной субстанции с накоплением в них аномальной формы синаптического белка α-синуклеина, а также патологией нигростриатного дофаминергического пути. Результатом снижения уровня дофамина в полосатом теле при БП является ряд двигательных расстройств, таких как брадикинезия. мышечная ригидность и другие. Широкая распространенность БП, инвалидизация больных, большие финансовые затраты на лечение и реабилитацию делают это заболевание социально значимым.
Важной особенностью данного заболевания является длительный скрытый период, в связи с чем необходим поиск прогностических биомаркеров. Одним из методов выявления биомаркеров БП является изучение изменения экспрессии генов в периферической крови и тканях пациентов, находящихся на ранней стадии заболевания и не подвергавшихся лечению.
На сегодняшний день выявлен ряд генов, изменение экспрессии которых позволяет выявлять и/или прогнозировать БП.
Известно, что в дебюте БП процесс поражения дофаминергических структур протекает на протяжении длительного времени без явных клинических проявлений, что, вероятно, объясняется включением разнообразных компенсаторных механизмов. Симптомы заболевания возникают только на достаточно «продвинутой» стадии нейропатологии, когда в дегенерацию вовлекается более 50% дофаминергических нейронов в черной субстанции, а уровень дофамина в стриатуме снижается более чем на 70%. Очевидно, что это накладывает серьезные ограничения на возможности оказания действенной помощи пациентам. Вот почему в настоящее время усилия исследователей направлены на разработку доклинической диагностики и превентивного лечения БП.
Например, в международной патентной публикации WO 2005/067391 А2 раскрыты молекулярные маркеры для обнаружения, прогноза и наблюдения за БП, где указанные молекулярные маркеры представляют собой один или несколько генов с измененным паттерном экспрессии.
Активное изучение экспрессии генов продолжается в настоящее время. Наиболее простой и широко используемый метод для анализа экспрессии генов на уровне мРНК является полуколичественный подход, основанный на реакции обратной транскрипции (RT) и количественной ПЦР в режиме реального времени (qPCR). Этот метод считается золотым стандартом исследования изменения экспрессии генов на уровне мРНК в биомедицинских исследованиях. Критически важным аспектом этого метода, как и других полуколичественных методов, является наличие референсных генов в качестве внутреннего контроля нормализации экспрессионных данных для гена-кандидата. Исходя из этого можно заключить, что точное определение изменения экспрессии генов-кандидатов зависит от правильного выбора внутренних референсных генов. Такие гены называются хаускипингами.
Из уровня техники известен ряд документов, раскрывающих использование генов хаускипингов для нормализации экспрессионных данных для гена-кандидата, изменение экспрессии которых связано с развитием БП.
В документе Morató, Xavier, et al. "Ecto-GPR37: a potential biomarker for Parkinson's disease." Translational neurodegeneration, 2021, 10(1): 1-14, описана методика проведения ПЦР в реальном времени (RT-qPCR) при анализе экспрессии генов при БП в тканях головного мозга и спинномозговой жидкости мышей и человека.
Аналогичная методика ПЦР в реальном времени (RT-qPCR) для анализа экспрессии генов при БП описана в документе Garcia Esparcia, Paula, "Identification of a risk transcriptome and proteome in Parkinson's disease, Dementia with Lewy bodies and rapidly progressive Dementia with Lewy bodies", Doctoral Thesis in Biomedicine specialty Neuroscience School of Medicine, Barcelona, September 2016, где также применялся набор хаускипипг-гепов для нормализации экспрессионных данных для гена-кандидата.
В документе US 8257929 В2 раскрыты исследования изменения в экспрессии генов, связанных с БП, путем изучения мультирегиональной экспрессии генов в головном мозге без патологии и головном мозге при БП. В данном документе также определяются изменения в экспрессии генов, связанные с БП. путем изучения экспрессии генов нормальной крови и крови пациентов с БП с применением набора генов хаускипингов для нормализации экспрессионных данных для гена-кандидата.
В документе US 2015/086481 A1 раскрыт анализ экспрессии гена GUCY2C в головном мозге при БП. Для этого проводили ПЦР в реальном времени (RT-qPCR) для обогащения соответствующей РНК каждой линии также с использованием генов хаускипингов для нормализации транскриптов данных.
В документе Renton, Alan Edward Mayo, "Gene expression and genetic analyses in Parkinson's disease with and without dementia". Thesis for the degree of Doctor of Philosophy to University College London Department of Molecular Neuroscience Institute of Neurology Institute of Human Genetics and Health University College London, 2010, раскрыта методика анализа экспрессии мРНК целевого гена в нескольких областях головного мозга также с использованием генов хаускипингов для нормализации данных по экспрессии генов-кандидатов.
Важно отметить, что во всех процитированных источниках в качестве генов хаускипингов использовали уже известные для применения в качестве хаускипингов гены без проведения исследований по определению стабильности экспрессии выбранных генов хаускипингов. Однако процитированные источники подтверждают необходимое и важное значение генов хаускипингов для точного определения изменения экспрессии генов-кандидатов, связанных с БП.
Еще одним важнейшим шагом в данной области является разработка моделей доклинической и ранней клинической стадий БП на животных, что не только позволит получить новые фундаментальные знания о патогенезе болезни, но и будет способствовать поиску новых терапевтических стратегий.
Для изучения экспериментальных аспектов БП используются хорошо отработанные токсические модели на лабораторных животных, преимущественно на грызунах. Одной из наиболее часто используемых является модель, в которой БП индуцируется 1-метил-4-фенил-1,2,3,6-тетрагидропиридином (МФТП). Этот токсин вводится системно, легко проникает через гематоэнцефалический барьер, что приводит к симметричному поражению дофаминергических структур и достаточно точно отражает характер патологических изменений в центральной нервной системе, которые наблюдаются у больных БП.
При этом очевидно, что помимо разработки моделей доклинической и ранней клинической стадий БП на животных важнейшее значение имеет выявление для этих моделей генов хаускипингов, обладающих стабильной экспрессией.
Однако известно, что экспрессия наиболее распространенных хаускипингов может зависеть от внешних условий и изменяться при патологиях. К существенным недостаткам использования подобных хаускипингов в исследованиях является отсутствие их валидации в конкретных экспериментальных условиях, а также слепой перенос хаускипингов. подобранных для одного организма на другой, без сопутствующей тщательной проверки. Это, в свою очередь, может накладывать отпечаток на получаемые результаты и/или приводить к ложным результатам в оценке изменения экспрессии генов-кандидатов.
В связи с эти в данной области техники сохраняется потребность в определении генов хаускипингов, показывающих валидность и стабильность экспрессии у мышей с изучаемой патологией.
Краткое раскрытие настоящего изобретения
Поставленная на основании недостатков предшествующего уровня техники задача настоящего изобретения, состоящая в обнаружении генов хаускипингов, показывающих валидность и стабильность экспрессии у исследуемых объектов с изучаемой патологией, была решена авторами настоящего изобретения посредством обнаружения определенного набора хаускипингов для анализа экспрессии генов при болезни Паркинсона, стабильно экспрессирующихся в различных тканях головного мозга и периферической крови мышей.
Таким образом, одним объектом настоящего изобретения является применение набора хаускипингов, состоящего из по меньшей мере 3 хаускипингов, выбранных из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, для анализа экспрессии генов при болезни Паркинсона, где указанный набор хаускипингов стабильно экспрессируется в различных тканях головного мозга и периферической крови мышей.
Согласно одному варианту осуществления настоящего изобретения набор хаускипингов состоит из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars и стабильно экспрессируется в различных тканях головного мозга и периферической крови мышей.
Согласно другому варианту осуществления настоящего изобретения ткани головного мозга представляют собой головной мозг в целом.
Согласно другому варианту осуществления настоящего изобретения ткани головного мозга выбраны из группы, состоящей из кортекса, мозжечка, стриатума и черной субстанции.
Согласно другому варианту осуществления настоящего изобретения набор хаускипингов состоит из хаускипингов Aars, Psmd7 и Psmd6 и стабильно экспреесируется в головном мозге в целом.
Согласно другому варианту осуществления настоящего изобретения набор хаускипингов состоит из хаускипингов Polr2f Aars и Bcat2 и стабильно экспреесируется в кортексе.
Согласно другому варианту осуществления настоящего изобретения набор хаускипингов состоит из хаускипингов Psmd6, Aars и Polr2f и стабильно экспреесируется в мозжечке.
Согласно другому варианту осуществления настоящего изобретения набор хаускипингов состоит из хаускипингов Psmd7, Aars и Sars и стабильно экспреесируется в стриатуме.
Согласно другому варианту осуществления настоящего изобретения набор хаускипингов состоит из хаускипингов Psmd7, Aars и Bcat2 и стабильно экспреесируется в черной субстанции.
Согласно другому варианту осуществления настоящего изобретения набор хаускипингов состоит из хаускипингов Polr2f, Hprt и Sars и стабильно экспрессируется в периферической крови.
Другим объектом настоящего изобретения является набор праймеров и зондов для определения стабильной экспрессии набора хаускипингов. состоящего из по меньшей мере 3 хаускипингов, выбранных из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, в различных тканях головного мозга и периферической крови мышей, где набор праймеров и зондов представляет собой:

Другим объектом настоящего изобретения является способ анализа экспрессии генов при болезни Паркинсона. предусматривающий использование набора хаускипингов. состоящего из по меньшей мере 3 хаускипингов, выбранных из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, в различных тканях головною мозга и периферической крови мышей с применением указанного набора праймеров и зондов.
Согласно одному варианту осуществления заявленного способа набор хаускипингов состоит из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars и стабильно экспрессируется в различных тканях головного мозга и периферической крови мышей.
Согласно другому варианту осуществления заявленного способа ткани головного мозга представляют собой головной мозг в целом.
Согласно другому варианту осуществления заявленного способа ткани головного мозга выбраны из группы, состоящей из кортекса, мозжечка, стриатума и черной субстанции.
Согласно другому варианту осуществления заявленного способа набор хаускипингов состоит из хаускипингов Aars, Psmd7 и Psmd6 и стабильно экспрессируется в головном мозге в целом.
Согласно другому варианту осуществления заявленного способа набор хаускипингов состоит из хаускипингов Polr2f, Aars и Bcat2 и стабильно экспрессируется в кортексе.
Согласно другому варианту осуществления заявленного способа набор хаускипингов состоит из хаускипингов Psmd6, Aars и Polr2f и стабильно экспрессируется в мозжечке.
Согласно другому варианту осуществления заявленного способа набор хаускипингов состоит из хаускипингов Psmd7, Aars и Sars и стабильно экспрессируется в стриатуме.
Согласно другому варианту осуществления заявленного способа набор хаускипингов состоит из хаускипингов Psmd7, Aars и Bcat2 и стабильно экспрессируется в черной субстанции.
Согласно другому варианту осуществления заявленного способа набор хаускипингов состоит из хаускипингов Polr2f, Hprt ы Sars и стабильно экспрессируется в периферической крови.
Краткое описание чертежей
На фиг. 1 приведен пример обработки данных для анализа относительных уровней мРНК. Программное обеспечение RefFinder рассчитывает оценку референсных генов с использованием алгоритмов программ geNorm, Normfinder, BestKeeper и сравнительного метода ΔΔCt, а также значения Comprehensive Ranking. На основе этих оценок программа присваивает каждому гену соответствующую оценку и вычисляет среднее геометрическое их весов для общего окончательного рейтинга. Программа выбирает самый низкий балл среди рангов, присвоенных каждым алгоритмом отдельно, а затем присваивает окончательный общий балл. Чем ближе итоговая оценка к единице, тем стабильнее считается хаускипинг.
Подробное раскрытие настоящего изобретения
Определения
В контексте настоящего изобретения термин «хаускининг» или «МКС» означаем внутренний референсный ген, выполняющий роль внутреннего контроля нормализации экспрессионных данных для гена-кандидата. В качестве HKG чаще всего рассматриваются гены со стабильной экспрессией во всех биологических образцах, и чья экспрессия не изменяется в экспериментальных условиях или в условиях болезни. Хаускипингами считаются гены, контролирующие базовый метаболизм и отвечающие за выживаемость клетки, поддержание гомеостаза клетки и/или другие фундаментальные процессы в клетке.
В контексте настоящего изобретения термин «ген-кандидат» означает ген. изменение экспрессии которого должно быть обнаружено при использовании нормализации относительно экспрессии соответствующего хаускипинга.
В контексте настоящего изобретения термин «праймер» означает олигонуклеотид, способный выступать в роли точки инициации синтеза продукта удлинения праймера, представляющего собой комплементарную нить нуклеиновой кислоты (всех типов ДНК или РНК), в подходящих условиях амплификации (например, буфер, соль, температура и рН) в присутствии нуклеотидов и агента, полимеризующего нуклеиновые кислоты (например, ДНК-зависимую или РНК-зависимую полимеразу).
В контексте настоящего изобретения термин «прямой праймер» означает праймер, гибридизующийся (или отжигающийся) с последовательностью-мишенью (например, матричная нить). Фраза «обратный праймер» означает праймер, гибридизующийся (или отжигающийся) с комплементарной нитью последовательности-мишени. Прямой праймер гибридизуется ближе к 5'-концу последовательности мишени, чем обратный праймер.
В контексте настоящего изобретения термин «зонд» означает олигонуклеотид, способный селективно гибридизоваться по меньшей мере с частью последовательности-мишени в соответствующих условиях амплификации (например, амплифицированной части последовательности-мишени).
В контексте настоящего изобретения термин «набор праймеров и зондов» означает комбинацию, включающую два или более праймеров. которые в совокупности служат затравкой для амплификации последовательности-мишени или нуклеиновой кислоты-мишени, и по меньшей мере одного зонда, способного обнаружить последовательность-мишень или нуклеиновую кислоту-мишень. В общем случае, зонд гибридизуется с нитью продукта амплификации (или ампликона), что приводит к образованию гибрида продукта апмлификации с зондом, который можно обнаружить с помощью стандартных способов, известных из уровня техники.
В контексте настоящего изобретения термины «последовательность-мишень» или «нуклеиновая кислота-мишень» используются взаимозаменяемо и означают объект, чье присутствие или отсутствие необходимо обнаружить.
Раскрытие настоящего изобретения
В настоящее время проводится активное изучение экспрессии генов. Наиболее простой и широко используемый метод для анализа экспрессии генов на уровне мРНК является полуколичественный подход, основанный на реакции обратной транскрипции (RT) и количественной ПЦР в режиме реального времени (qPCR). Этот метод считается золотым стандартом исследования изменения экспрессии генов на уровне мРНК в биомедицинских исследованиях. Критически важным аспектом этого метода, как и других полуколичественных методов, является наличие референсных генов в качестве внутреннего контроля нормализации экспрессионных данных для гена-кандидата. Исходя из этого можно заключить, что точное определение изменения экспрессии генов-кандидатов зависит от правильного выбора внутренних референсных генов. Такие гены называются хаускипингами.
Однако в предшествующем уровне техники не раскрыты данные исследований, направленных на подтверждение валидности и стабильности экспрессии хаускипингов для анализа экспрессии генов при болезни Паркинсона у мышей, в частности в различных тканях головного мозга и периферической крови мышей.
С целью решения поставленной задачи настоящего изобретения авторами настоящего изобретения был осуществлен поиск, отбор и исследование наиболее стабильных хаускипингов для анализа экспрессии генов при болезни Паркинсона у мышей, в частности в различных тканях головного мозга и периферической крови мышей. Проведенные авторами настоящего изобретения исследования касались определения стабильности хаускипингов в основных тканях головного мозга мыши, как одного из главных объектов моделирования болезни Паркинсона. При этом была выбрана токсическая модель на основе введения МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридин). В частности, авторами настоящего изобретения для анализа была использована модель ранней симптомной стадии болезни Паркинсона на основе введения МФТП, аналогичная 1-2 стадии по шкале Хен-Яр у пациентов с болезнью Паркинсона.
Авторами настоящего изобретения впервые было проведено исследование стабильности экспрессии хаускипингов в различных тканях головного мозга и периферической крови мышеи с моделированием Паркинсон-подобного фенотипа на основе введения МФТП и в группе контроля. Цель проведенного исследования состояла в определении хаускипингов, действительно обладающих стабильными уровнями экспрессии вне зависимости от развития изучаемой патологии в организме, а также показывающих валидацию в конкретных экспериментальных условиях, что приводит к возможности слепого переноса хаускипингов. подобранных для одного организма на другой, без сопутствующей тщательной проверки.
На сегодняшний день как в литературе, так и в коммерческих панелях известны сотни референсных генов. При этом зачастую данные одного экспрессионного исследования не воспроизводят результаты других аналогичных работ, различия в получаемых результатах могут скрываться в выборе и стабильности хаускипингов. Ярким примером может служить сравнение результатов для хаускипинга Gapdh, который согласно более ранним сведениям был указан как один из наиболее стабильных хаускипингов, среди рассмотренных, однако, позже, в 2020 году та же группа ученых пришла к выводу, что Gapdh обладает весьма изменчивой экспрессией в процессе репрограммирования. Напротив, в более ранних работах Rps18 рассматривался как один из изменчивых хаускипингов, однако, в последующей работе Rps18 был отнесен к стабильным хаускипипгам.
Таким образом, анализ имеющихся сведений по используемым хаускипипгам не позволяет выявить хаускипинги, обладающие стабильной экспрессией и валидностыо, однако, в связи с отсутствием возможности исследовать все возможные хаускипинги. необходим для сужения ряда хаускипингов, которые могут быть включены в исследование по определению стабильной экспрессии и валидности.
По этой причине авторами настоящего изобретения для отбора кандидатов в хаускипинги был проведен скрининг данных в PubMed. Поиск в MeSH по ключевым терминам «housekeeping gene» (фильтр: Humans) позволил выявить 26399 публикаций, начиная с 2000 года. Поиск по ключевым словам «housekeeping PCR» (фильтр: Humans) позволил выявить 880 результатов, начиная с 2000 года. Поиск по ключевым словам "housekeeping real time PCR" (фильтр: Humans) позволил выявить 562 результата, начиная с 2000 года. Поиск по ключевым словам «housekeeping real time PCR brain» (фильтр: Humans) позволил выявить 29 результатов, начиная с 2001 года. Дальнейшее ограничение по области применения хаускипингов из этих 29 результатов выявило 4 результата, непосредственно связанные с анализом хаускипингов в неопухолевых образцах.
Кроме того, для отбора потенциальных хаускипингов авторами настоящего изобретения были использованы данные по анализу референсных генов в тканях головного мозга, нейрональной линии, дифференцированной из костных мезенхимальных стволовых клеток, и тканях человека. Используя данные, приведенные в отобранных 7 работах, был составлен список потенциальных генов-хаускипингов для дальнейшего анализа, состоящий из 542 генов.
Далее авторами настоящего изобретения был проведен еще один дополнительный скрининг публикаций по запросу «gene expression Parkinson's disease rna» (фильтр: human) в базе данных PubMed и было выявлено 715 публикаций. В рандомном порядке был проанализирован раздел «материалы и методы» для 100 публикаций и был составлен список референсных генов, которые используются в исследованиях по анализу экспрессии генов.
Далее авторами настоящего изобретения были сопоставлены два сформированных списка и для последующего исследования стабильности экспрессии и валидности были отобраны гены, входящие в оба списка. В результате проведенного анализа были отобраны хаускипинги ТВР, АСТВ, RPL30, GAPDH, YWHAZ, PPIA, В2М, HPRT, GUSB, SARS, AARS, PSMD6, PSMD7, POLR2F, POLR2A, PSMA5.
Далее авторами настоящего изобретения был проведен анализ отобранных хаускипингов с использованием установленных авторами настоящего изобретения подходов. Все потенциальные хаускипинги должны удовлетворять определенным условиям. Во-первых, в геноме не должно быть псевдогенов этих генов. Известно, что процессированные псевдогены, лишенные нитронов и являющиеся почти полными копиями зрелых мРНК соответствующих генов, составляют 70% от всех псевдогенов. В связи с этим нельзя быть уверенным, что подобранные системы праймеров будут абсолютно специфичны к целевой мРНК.
В результате биоинформатического анализа, проведенного авторами настоящего изобретения, были выявлены псевдогены у таких широко используемых хаускипингов, как АСТВ, GUSB, PPIA, YWHAZ и GAPDH. Так, например, АСТВ имеет 22 псевдогена, а GAPDH - 47. Псевдогены способны амплифицироваться вместе с кДНК, полученной из таргетной РНК. С одной стороны, решением данной проблемы может служить обработка ДНКазами, однако, при этом сильно снижается выход выделенной РНК. Такой метод малоприменим, когда целью исследования является анализ изменения уровней низкопредставленных транскриптов. С другой стороны, можно исключить амплификацию геномной ДНК путем подбора праймеров на межэкзонные спайки, таким образом будет экспрессироваться только целевая кДНК, полученная из зрелой РНК, лишенной нитронов. Однако, известно, что процессированные псевдогены, лишенные интронов, являются почти полными копиями зрелых мРНК соответствующих генов и составляют 70% от всех псевдогенов. В связи с этим нельзя быть уверенным, что подобранные системы праймеров будут абсолютно специфичны к целевой мРНК и целесообразным является не использовать в работе гены, имеющие псевдогены.
Остальные отобранные по результатам анализа литературы хаускипинги прошли биоинформатический анализ. При этом важно отметить, что для генов PSMD7 (NM_002811.5) и HPRT1 (NM_000194.3) были обнаружены псевдогены in silico, однако, экспериментального подтверждения их существования на данный момент нет, поэтому авторы настоящего изобретения предположили возможность отбора этих генов для дальнейшего анализа, и при этом отсеяли такие широко используемые в качестве хаускипингов гены, как ACTS, CUSB, PPIA, YWHAZ, RPL30 и GAPDH.
Вторым важным установленным авторами настоящего изобретения подходом было то, что под референсным геном подразумевается ген, экспрессия которого не изменяется в условиях изучаемой патологии, а также примерно одинакова в исследуемых тканях. В связи с этим, экспрессия всех выбранных хаускипингов была проанализирована с использованием BioGPS, и хаускипинг В2М был исключен из дальнейшего анализа по результатам данного анализа.
Авторы изобретения еще раз отмечают, что проведенный предшествующий основной исследовательской работе обзор литературы вызван известностью на сегодняшний день сотен референсных генов как в литературе, так и в коммерческих панелях. При этом раскрытые сведения представляют собой результаты аналитической работы, тогда как исследование стабильности экспрессии и валидности хаускипингов для анализа экспрессии генов при болезни Паркинсона у мышей, в частности в различных тканях головного мозга и периферической крови мышей, было впервые проведено авторами настоящего изобретения. Кроме того, как уже отмечено выше, авторами настоящего изобретения был выявлен свой уникальный подход при выявлении подлежащего дальнейшему исследованию ряда хаускипингов. Как уже указано выше, хаускипинг должен удовлетворять нескольким условиям. В частности, уровни экспрессии хаускипингов должны быть стабильны вне зависимости от развития изучаемой патологии в организме. При этом из имеющихся в данной области техники сведений авторами настоящего изобретения в ряд хаускипингов для исследования были включены хаускипинги PSMD7 (NM_002811.5) и HPRT (NM_000194.3), для которых обнаружены псевдогены in silica, что делает их включение в ряд хаускипингов для исследования неочевидным на основании установленного подхода к оценке хаускипингов.
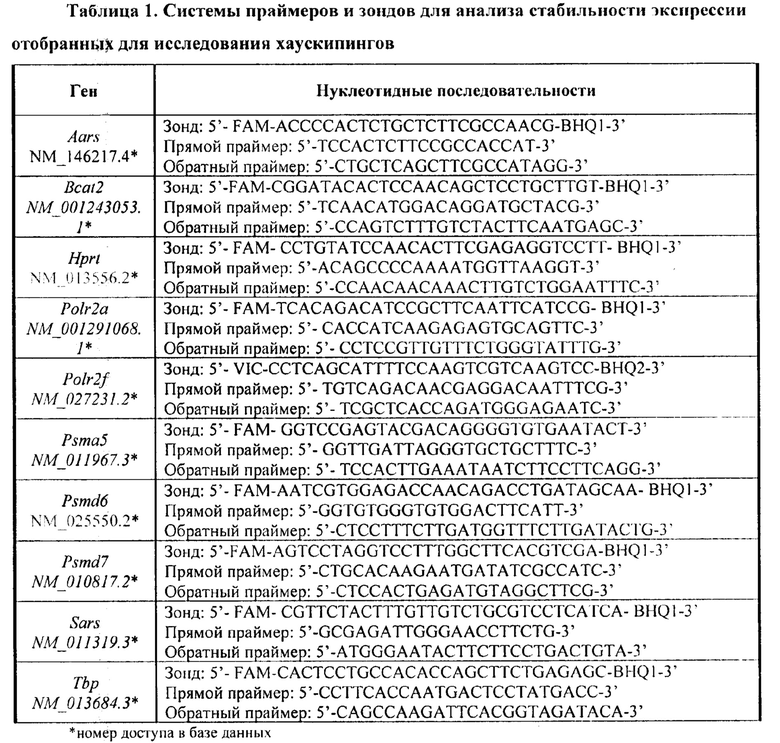
В результате авторами настоящего изобретения были отобраны хаускипинги POLR2F, POLR2A, PSMD6, PSMD7, HPRT, PSMA5, SARS, AARS, TBP и BCAT2, для которых авторами настоящего изобретения посредством системы TaqMan были разработаны системы праймеров и зондов для анализа стабильности экспрессии отобранных хаускипингов (таблица 1) и проведен анализ изменения их относительных уровней мРНК в образцах головного мозга и периферической крови мышей.
В результате исследования, впервые проведенного авторами настоящего изобретения с целью экспериментального выявления хаускипингов, которые показывают стабильную экспрессию и валидность при анализа экспрессии генов при болезни Паркинсона у мышей, в частности в определенных тканях головного мозга и периферической крови мышей, подробно описанного далее в разделе «Примеры», авторами настоящего изобретения неожиданно на основании ранее имеющихся аналитический данных был выявлен строго определенный набор хаускипингов Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, показывающих стабильную экспрессию и валидность у мышей, в частности в определенных тканях головного мозга и периферической крови мышей.
При этом, гены ТВР и ВСАТ2 неожиданным образом показали предельно низкий для их детекции уровень сигнала, в результате чего они были исключены из исследования.
При этом, неожиданным образом в данный набор хаускипингов вошли хаускипинги PSMD7 и HPRT, включение которых в исследование не следовало очевидным образом из проведенного авторами настоящего изобретения обзора литературы, тогда как хаускипинги Tbp и Polr2a не показали в ходе проведенного исследования стабильную экспрессию, несмотря на отсутствие в представленной для обзора литературе каких-либо сведений о нестабильной экспрессии данных хаускипингов.
Для полученного набора хаускипингов авторами настоящего изобретения посредством системы TaqMan был разработан набор праймеров и зондов для определения стабильной экспрессии набора хаускипингов Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, в различных тканях головного мозга и периферической крови мышей при анализе экспрессии генов при болезни Паркинсона (таблица 2).

В результате исследовательской работы авторам настоящего изобретения удалось не только выявить строго определенный набор хаускипингов Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, показывающих стабильную экспрессию и валидность в различных тканях головного мозга и периферической крови мышей, но и определить в пределах указанного набора более узкие наборы хаускипингов, в частности состоящие из грех хаускипингов, каждый из которых показывает стабильную экспрессию и валидность в определенных тканях головного мозга и периферической крови мышей, что позволяет далее проводить анализ изменения экспрессии генов-кандидатов для каждой конкретной клеточной линии.
Авторы настоящего изобретения исследовали стабильность экспрессии выбранного набора хаускипингов в различных тканях головного мозга и периферической крови мышей, и неожиданно обнаружили, что:
- в головном мозге в целом наиболее более стабильно экспрессируются хаускипинги Aars, Psmd7 и Psmd6,
- в кортексе наиболее более стабильно экспрессируются хаускипинги Polr2f, Aars и Bcat2,
- в мозжечке наиболее более стабильно экспрессируются хаускипинги Psmd6, Aars и Polr2f,
- в стриатуме наиболее более стабильно экспрессируются хаускипинги Psmd7, Aars и Sars,
- в черной субстанции наиболее более стабильно экспрессируются хаускипинги Psmd7, Aars и Bcat2,
- в периферической крови наиболее более стабильно экспрессируются хаускипинги Polr2f, Hprt и Sars.
В частности, ген Aars является наиболее стабильно экспрессирующимся хаускипингом в головном мозге в целом. Ген Psmd7 является наиболее стабильно экспрессирующимся хаускипингом в стриатуме и черной субстанции. В кортексе и периферической крови наиболее стабильно экспрессирующимся хаускипингом является ген Polr2f, в мозжечке - ген Psmd6.
Кроме того, в ходе проведенного авторами настоящего изобретения исследования ими было неожиданно обнаружено, что разработанный в результате указанного исследования строго определенный набор хаускипингов показывает стабильную экспрессию независимо от наличия патологического процесса.
Данные результаты авторам настоящего изобретения удалось получить благодаря тому, что в рамках проведенной ими исследовательской работе изначально было сделано заключение о важном значении стабильной экспрессии хаускипинга независимо от наличия патологического процесса.
Таким образом, авторами настоящего изобретения получен строго определенный набор хаускипингов Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, позволяющий проводить изучение патологического процесса, обусловленного патогенезом болезни Паркинсона, у мышей.
В результате неожиданно выявленного в ходе исследования набора хаускипингов Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, показывающего стабильную экспрессию при анализе экспрессии генов при болезни Паркинсона в различных тканях головного мозга и периферической крови мышей, а также посредством разработанного авторами настоящего изобретения набора праймеров и зондов для определения стабильной экспрессии указанного набора хаускипингов в различных тканях головного мозга и периферической крови мышей, авторами настоящего изобретения также был разработан способ анализа экспрессии генов при болезни Паркинсона, предусматривающий использование указанного набора хаускипингов в различных тканях головного мозга и периферической крови мышей с применением указанного набора праймеров и зондов.
Разработанный авторами настоящего изобретения набор праймеров и зондов, а также разработанный авторами настоящего изобретения способ анализа экспрессии генов при болезни Паркинсона обеспечивают эффективный анализ экспрессии генов при болезни Паркинсона благодаря использованию неожиданного выявленного в ходе исследования строго определенного набора хаускипингов Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, показывающих стабильную экспрессию и валидность у мышей, а также более узких в рамках данного набора наборов хаускипингов для проведения анализа экспрессии генов при болезни Паркинсона в определенных тканях головного мозга и периферической крови мышей.
Примеры
Список сокращений и обозначений
HKG - хаускипинг
Comprehensive score - комплексный балл
Gene rank - ранг гена
МФТП-1-метил-4-фенил-1,2,3,6-тетрагидропиридин
RT-qPCR - количественная ПЦР в режиме реального времени.
Пример 1. Определение набора хаускипингов, показывающих стабильную экспрессию и валидность у мышей, для проведения анализа экспрессии генов при болезни Паркинсона
Двадцать мышей C57BL/6 приобретали из специального лицензированного питомника, свободного от патогенов, Института биоорганической химии им. Шемякина и Овчинникова РАН. Восьминедельных мышей-самцов массой 22-25 г случайным образом разделяли для анализа на две группы: контрольную и экспериментальную. Каждая группа мышей состояла из 10 особей. Мышей помещали по 3-4 животных в клетку в стандартных условиях со свободным доступом к пище и воде с режимом свет:темнота 12:12 ч.
Моделирование паркинсон-подобного фенотипа с помощью МРТР
В этом исследовании использовали модель ранней симптоматической стадии болезни Паркинсона у мышей. Экспериментальные работы с лабораторными животными проводились в соответствии с Руководством по уходу за животными, утвержденным Этическим комитетом Института молекулярной генетики НИЦ «Курчатовский институт» (Москва, Россия), протокол 3/21 от 17 февраля 2021 г. У каждого животного для исследования после декапитации брали образцы 5,5±0,35 мг стриатума, коры и мозжечка, 1,4±0,22 мг черной субстанции и 477,8±80 мкл периферической крови.
Были предприняты все усилия, чтобы свести к минимуму потенциальные страдания и дискомфорт животных.
Экспрессионный анализ
Выделение РНК
Выделение тотальной РНК из тканей головного мозга проводили с использованием наборов RNAeasy Mini Kit (Qiagen, Германия) и Quick-RNA MiniPrep Kit™ (Zymo Research Corp., США).
Выделение общей РНК из 250 мкл каждого образца периферической крови человека и мыши проводили с использованием набора MiniPrep Kit для цельной РНК (Zymo Research Corp., США).
Концентрацию выделенной РНК из образцов измеряли с помощью набора Quant-iT RNA BR Assay Kit и флуориметра Qubit 3.0 (Invitrogen, США). Качество РНК контролировали с помощью автоматической системы электрофореза Experion (Bio-Rad Laboratories). Индекс качества РНК был выше 8,5 во всех выборках.
Все процедуры проводили согласно рекомендациям производителей.
Анализ изменения относительных уровней мРНК
Анализ экспрессии генов проводили с использованием ПЦР в реальном времени с зондами TaqMan. Все образцы обрабатывали как можно более равномерно, чтобы свести к минимуму любые случайные смещения. Одноцепочечную ДНК синтезировали с использованием 120 нг тотальной РНК, 100 нг тРНК Escherichia coli в качестве носителя, специфических праймеров и набора RevertAid Н Minus First Strand cDNA Synthesis Kit (Thermo Fischer Scientific, США) в соответствии с рекомендациями производителя. Каждую реакцию проводили с тремя повторениями.
Праймеры и зонды для ПЦР в реальном времени выбирали с помощью программы Beacon Designer 7.0.2 и нуклеотидных последовательностей генов человека, мышей и крыс. Последовательности специфичных для генов праймеров и зондов перечислены в таблице 1 выше.
кДНК, полученную в реакции обратной транскрипции, использовали в качестве матрицы для количественной ПЦР. Его разводили в 50 раз водным раствором тРНК из Escherichia coli (0,02 нг/мкл). ПЦР проводили с использованием системы StepOnePlus™ (Applied Biosystems, США), системы QuantStudio™ 3 (Thermo Fisher Scientific. США) и реагентов для ПЦР (Syntol, Россия). Температурный никл для образцов от мышей и людей выполняли следующим образом: 60 с при 50°С, 40 циклов по 15 с при 95°С и 40 с при 61°С; 30 с при 25°С. Термический цикл для образцов от крыс выполняли следующим образом: 600 с при 95°С и 45 циклов: 5 с при 95°С, а затем 10 с при 60°С. Реакцию повторяли три раза для каждой кДНК для корректировки различий в качестве образцов и эффективности обратной транскрипции.
Статистический анализ
Праймеры и зонды для анализа отбирали с помощью Beacon Designer 7.0 (Premier Biosoft International, США) и соответствующих последовательностей из базы данных NCBI. Специфичность праймеров и зондов проверяли с помощью Primer3, Primer-BLAST. Оценку экспрессии референсных генов проводили с использованием значений пороговых циклов амплификации и программного обеспечения RefFinder.
Программное обеспечение RefFinder рассчитывало оценку референсных генов с использованием алгоритмов программ geNorm, Normfinder, BestKeeper и сравнительного метода ΔΔCt.
На основе этих оценок программное обеспечение присваивало каждому гену соответствующую оценку и вычисляло среднее геометрическое их весов для общего окончательного рейтинга. Программа выбирает самый низкий балл среди рангов, присвоенных каждым алгоритмом отдельно, а затем присваивает окончательный общий балл. Чем ближе итоговая оценка к единице, тем стабильнее считается хаускипинг. Результаты представлены в таблице 3.

Результаты
Для выявления наиболее стабильных HKG в условиях болезни Паркинсона был проведен анализ стабильности HKG отдельно в группе контрольных мышей (таблица ЗА) и отдельно в группе мышей с МФТП-индуцированной моделью болезни Паркинсона (таблица 3В). Оценка стабильности проводилась на основе расчета комплексного балла для каждого гена в каждой ткани. В каждом конкретном случае (ткань и наличие/отсутствие патологии) наиболее стабильным является HKG, обладающий минимальным комплексным баллом. Так. например, наиболее оптимальным и стабильным HKG в головном мозге в целом, а также в трех других тканях головного мозга (мозжечок, стриатум и черная субстанция) в контрольной группе мышей является Psmd7, однако, в кортексе этот ген занимает 2 место, а на первом месте находится Aars1. При этом в группе экспериментальных животных с моделированием болезни Паркинсона в головном мозге в целом наиболее стабильным является Psmd6, однако, в кортексе и стриатуме он занимает лишь 4-е место, а в мозжечке и черной субстанции - 3-е место.
Результаты показывают, что стабильность экспрессии изучаемых хаускипингов различается в зависимости от наличия или отсутствия патологических процессов. Однако задача поставленного исследования состояла в определении хаускипингов, показывающих стабильную экспрессию независимо от наличия патологии. По этой причине возникла необходимость в проведении дальнейшего суммарного статистического анализа, с целью определения суммарного комплексного балла, значение которого позволит выявить хаускипинги, показывающие стабильную экспрессию независимо от наличия патологии.
Определение суммарного комплексного балла
Исходя из полученных результатов, что стабильность в различных тканях и в условиях наличия и отсутствия патологии различается, при проведении работ по экспрессионному анализу необходимо использовать хаускипинги, чья экспрессия наиболее стабильна в определенной ткани и при наличии, и при отсутствии патологии. Исходя из этого, был посчитан итоговый ранг хаускипингов, основанный на расчете суммарного комплексного балла (таблица 4). Суммарный комплексный балл для каждого хаускиппнга в каждой ткани был суммирован из комплексных баллов, полученных при анализе контрольной группы мышей (таблица 3А) и мышей с моделированием паркинсон-подобного фенотипа (таблица 3В).
Так, например, в головном мозге в целом вне зависимости от наличия или отсутствия патологии наиболее стабильно экспрессирующимся является Aars1 и занимает соответственно первое место (Gene rank=1) с суммарным комплексным баллом 4.21-2.21+2.20, где 2.21 представляет собой значение комплексного балла из столбика «мозг в целом» таблицы 3А, а 2.20 представляет собой значение комплексного балла из столбика «мозг в целом» таблицы 1В. Таким образом, ген с наиболее низким значением рассматривается как наиболее стабильно экспрессирующимся и занимает первое место в рейтинге (Gene rank=1).

Результаты
В результате проведенного исследования был определен набор хаускипингов, состоящий из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, которые показывают стабильную экспрессию и валидность у мышей независимо от наличия патологии. Выявление указанного набора хаускипингов является неожиданным результатом проведенного исследования, так как хаускипинги для исследования были в равной степени отобраны согласно установленному авторами настоящего изобретения подходу, за исключением лишь хаускипинга Psmd7, который был включен авторами настоящего изобретения в исследование, несмотря на то, что для него обнаружены псевдогены in silica. При этом в представленной для обзора литературе отсутствовали какие-либо сведения о нестабильной экспрессии хаускипингов, которые не вошли в выявленный согласно проведенному исследованию набор хаускипингов, показывающих стабильную экспрессию и валидность у мышей.
При этом проведение исследования для тканей головного мозга в целом, а также для кортекса, мозжечка, стриатума и черной субстанции и для периферической крови выявило, что:
- в головном мозге в целом наиболее более стабильно экспрессируются хаускипинги Aars, Psmd7 и Psmd6,
- в кортексе наиболее более стабильно экспрессируются хаускипинги Polr2f, Aars и Bcat2,
- в мозжечке наиболее более стабильно экспрессируются хаускипинги Psmd6, Aars и Polr2f,
- в стриатуме наиболее более стабильно экспрессируются хаускипинги Psmd7, Aars и Sars,
- в черной субстанции наиболее более стабильно экспрессируются хаускипинги Psmd7, Aars и Bcat2,
- в периферической крови наиболее более стабильно экспрессируются хаускипинги Polr2f, Hprt и Sars.
Указанные специфические для определенных тканей головного мозга и периферической крови результаты основаны на широко распространенном в данной области техники подходе, что при анализе изменений экспрессии генов необходимо учитывать как минимум два хаускипинга и следует учитывать гены, расположенные на 1-м, 2-м и максимум на 3-м месте на основании полученного ранга гена.
В целом, исходя из полученных данных, хаускипинг Aars имеет наиболее стабильную экспрессию среди всех изученных хаускипингов в головном мозге. Этот же ген занимает второе место по стабильности экспрессии в различных частях головного мозга. Занимая 2-е место во всем головном мозге, Psmd7 наиболее стабильно экспрессировался в стриатуме и черной субстанции. В кортексе наиболее стабильно экспрессировался хаускипинг Polr2f а в мозжечке - Psmd6. Примечательно, что первый из них также наиболее стабильно экспрессировался в периферической крови мышей.
Таким образом, авторам настоящего изобретения удалось выявить набор хаускипингов, состоящий из по меньшей мере 3 хаускипингов из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, для применения для анализа экспрессии генов при болезни Паркинсона, где указанный набор хаускипингов показывает стабильную экспрессию в различных тканях головного мозга и периферической крови мышей и показывает валидность, а также разработать набор праймеров и зондов для определения стабильной экспрессии набора хаускипингов, состоящего из по меньшей мере 3 хаускипингов из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, в различных тканях головного мозга и периферической крови мышей и способ анализа экспрессии генов при болезни Паркинсона, предусматривающий использование набора хаускипингов, состоящего из по меньшей мере 3 хаускипингов из группы, состоящей из Aars, Bcar2, Hprt, Polr2f, Psmd6, Psmd7, Sars, в различных тканях головного мозга и периферической крови мышей с применением разработанного набора праймеров и зондов, где разработанные набор праймеров и зондов и способ анализа экспрессии обеспечивают эффективный анализ экспрессии генов при болезни Паркинсона.
Перечень ссылочных источников
1. VanGuilder, H.D., K.Е. Vrana. and W.M. Freeman, Twenty-fire years of quantitative PGR fur gene expression analysis. Biotechniques, 2008. 44(5): p. 619-26.
2. Dheda, K., et al.. Validation of housekeeping genes for normalizing RNA expression in real-time PGR. Biotechniques, 2004. 37(1): p. 112-4, 116, 118-9.
3. Takagi, S., et al., Suitable reference genes for the analysis of direct hyperplasia in mice. Biochem Biophys Res Commun, 2008, 377(4): p. 1259-64.
4. Tatsumi, K., et al., Reference gene selection for real-time RT-PGR in regenerating mouse livers. Biochem Biophys Res Commun, 2008. 374(1): p. 106-10.
5. Vandesompele, J., et al., Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol, 2002. 3(7): p. RESEARCH0034.
6. Andersen, C.L., J.L. Jensen, and T.F. Orntoft, Normalization of real-lime quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets. Cancer Res. 2004. 64(15): p. 5245-50.
7. Nicot, N., et al., Housekeeping gene selection for real-time RT-PCR normalization in potato during biotic and abiotic stress. J Exp Bot, 2005. 56(421): p. 2907-14.
8. Salari, S. and M. Bagheri, In vivo, in vitro and pharmacologic models of Parkinson's disease. Physiol Res, 2019. 68(1): p. 17-24.
9. German, D.C., et al., The neurotoxin MPTP causes degeneration of specific nucleus A8, A9 and A10 dopaminergic neurons in the mouse. Neurodegeneration, 1996. 5(4): p. 299-312.
10. Meredith, G.E., et al., Modeling PD pathogenesis in mice: advantages of a chronic MPTP protocol. Parkinsonism Relat Disord. 2008. 14 Suppl 2: p. S112-5.
11. Ugrumov, M.V., el al., Modeling of presymptomatic and symptomatic stages of parkinsonism in mice. Neuroscience, 2011. 181: p. 175-88.
12. Chervoneva. I., et al., Selection of optimal reference genes for normalization in quantitative RT-PCR. BMC Bioinformatics, 2010. 11: p. 253.
13. Thellin, O., et al., A decade of improvements in quantification of gene expression and internal standard selection. Biotechnol Adv, 2009. 27(4): p. 323-33.
14. Panina, Y., et al., Validation of Common Housekeeping Genes as Reference for qPCR Gene Expression Analysis During iPS Reprogramming Process. Sci Rep, 2018. 8(1): p. 8716.
15. Panina, Y., A. Germond. and T.M. Watanabe, Analysis of the stability of 70 housekeeping genes during iPS reprogramming. Sci Rep, 2020. 10(1): p. 21711.
16. Maurer-Morelli, C.V., et al., A comparison between different reference genes for expression studies in human hippocampal tissue. J Neurosci Methods, 2012. 208(1): p. 44-7.
17. Penna, I., et al., Selection of candidate housekeeping genes for normalization in human postmortem brain samples. Int J Mol Sci, 2011. 12(9): p. 5461-70.
18. Gebhardt, P.M., H.A. Scott, and P.R. Dodd, Housekeepers for accurate transcript expression analysis in Alzheimer's disease autopsy brain tissue. Alzheimers Dement. 2010. 6(6): p. 465-74.
19. Swijsen, A., et al., Validation of reference genes for quantitative real-time PCR studies in the dentate gyrus after experimental febrile seizures. BMC Res Notes, 2012. 5: p. 685.
20. Harrison, P.J., et al. Human brain weight is correlated with expression of the 'housekeeping genes' beta-2-microglobulin (beta2M) and TATA-binding protein (TBP). Neuropathol Appl Neurobiol, 2010. 36(6): p. 498-504.
21. He, Y.X., et al., Selection of suitable reference genes for reverse transcription-quantitative polymerase chain reaction analysis of neuronal cells differentiated from hone mesenchymal stem cells. Mol Med Rep, 2015. 12(2): p. 2291-300.
22. Warrington, J.A., et al., Comparison of human adult and feted expression and identification of 535 housekeeping/maintenance genes. Physiol Genomics, 2000. 2(3): p. 143-7.
23. Chapman, J.R.; Waldenstrom, J. With Reference to Reference Genes: A Systematic-Review of Endogenous Controls in Gene Expression Studies. PloS one 2015, 10, e0141853, doi:10.1371/journal.pone.0141853.
24. Hoerndli, F.J.; Toigo, M.; Schild, A.; Gotz, J.; Day, P.J. Reference genes identified in SH-SY5Y cells using custom-made gene arrays with validation by quantitative polymerase chain reaction. Analytical biochemistry 2004, 335, 30-41, doi: 10.1016/j.ab.2004.08.028.
25. Alieva, A.; Filatova, E.V.; Karabanov, A.V.; Illarioshkin, S.N.; Slominsky, P.A.; Shadrina, M.I. Potential Biomarkers of the Earliest Clinical Stages of Parkinson's Disease. Parkinson's disease 2015, 294396, doi: 10.1155/2015/294396.
26. Sasidharan, R. and M. Gerstein. Genomics: protein fossils live on as R.XA. Nature. 2008. 453(7196): p. 729-31.
27. Torrents, D., et al., A genome-wide survey of human pseudogenes. Genome Res. 2003. 13(12): p. 2559-67.
28. Balaji, S. and A. Vanniarajan. Implication of Pseudo Reference Genes in Normalization of Data from Reverse Transcription-Quantitative PCR. Gene, 2020. 757: p. 144948.
29. The guide for the care and use of laboratory animals, ed. I.f.L.A. Research. 2011: 8th ed. Washington (DC): National Academies Press.
30. Suslov, O. and D.A. Steindler, PCR inhibition by reverse transcriptase leads to an overeslimalion of amplification efficiency. Nucleic Acids Res, 2005. 33(20): p. e 181.
31. NCBI Database. 15 July 2019]; Available from: https://www.ncbi.nlm.nih.gov/.
NCBI-Gene/ACTB pseudogenes. Available online: https://www.ncbi.nlm.nih.gov/gene/?Term=related_functional_gene_60%5Bgroup%5D (accessed on 08 June, 2021).
32. NCB-Gene/GUSB pseudogenes. Available online: https://www.ncbi.nlm.nih.gov/gene/?Term=related__functional_gene_2990%5Bgroup%5D (accessed on 08 June, 2021).
33. NCBI-Gene/PPIA pseudogenes. Available online: https://www.ncbi.nlm.nih.gov/gene/?Term=related_functional_gene_5478%5Bgroup%5D (accessed on 08 June, 2021).
34. NCBI-Gene/YWHAZ pseudogenes. Available online: https:/www.ncbi.nlm.nih.gov/gene/?Term=related_functional_gene_7534%5Bgroup%5D (accessed on 8 June. 2021).
35. NCBI-Gene/RPL30 pseudogenes. Available online: https://www.ncbi.nlm.nih.gov/gene/?Term=related_functional_gene_6156%5Bgroup%5D (accessed on 08 June, 2021).
36. NCBI-Gene/GAPDH pseudogenes. Available online: https://www.ncbi.nlm.nih.gov/gene/?Term=related_functional_gene_2597%5Bgroup%5D (accessed on 08 June, 2021).
37. BioGPS. Available online: http://biogps.org/#goto=genereport&id=567 (accessed on 08 June, 2021).
38. Primer3. 15 July 2019]; Available from: http://bioinfo.ut.ee/primer3.
39. Primer-BLAST. 15 July 2019]; Available from: https://www.ncbi.nlm.nih.gov/tools/primer-blast/.
40. Xie, F., et al., miRDeepFinder: a miRNA analysis tool for deep sequencing of plant small RNAs. Plant Mol Biol, 2012.
41. Pfaffl, M.W., et al., Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper-Excel-hased tool using pair-wise correlations. Biotechnol Lett, 2004. 26(6): p. 509-15.
42. Silver, N., et al., Selection of housekeeping genes for gene expression studies in human reticulocytes using real-time PCR. BMC Mol Biol, 2006. 7: p. 33.
43. A.B. Ставровская, Д.Н. Воронков, А.С. Гущина, А.С. Ольшанский, Н.Г. Ямщикова, «Особенности моделирования ранней клинической стадии болезни Паркинсона», Экспериментальная неврология, DOI: 10.2441 1/2071-5315-2018-12057
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Федеральное государственное бюджетное учреждение Институт молекулярной
генетики Национального исследовательского центра «Курчатовский институт»
<120> набор хаускипингов для анализа экспрессии генов при болезни Паркинсона
в различных тканях ГОЛОВНОГО мозга и периферической крови мышей и
его применение
Aars-зонд
5’- FAM-ACCCCACTCTGCTCTTCGCCAACG-BHQ1-3’
Aars-прямой праймер
5’-TCCACTCTTCCGCCACCAT-3’
Aars-обратный праймер
5’-CTGCTCAGCTTCGCCATAGG-3’
Bcat2-Зонд
5’-FAM-CGGATACACTCCAACAGCTCCTGCTTGT-BHQ1-3’
Bcat2-прямой праймер
5’-TCAACATGGACAGGATGCTACG-3’
Bcat2-обратный праймер
5’-CCAGTCTTTGTCTACTTCAATGAGC-3’
Hprt-зонд
5’- FAM- CCTGTATCCAACACTTCGAGAGGTCCTT- BHQ1-3’
Hprt-прямой праймер
5’-ACAGCCCCAAAATGGTTAAGGT-3’
Hprt-обратный праймер
5’-CCAACAACAAACTTGTCTGGAATTTC-3’
Polr2f-зонд
5’- VIC-CCTCAGCATTTTCCAAGTCGTCAAGTCC-BHQ2-3’
Polr2f-прямой праймер
5’- TGTCAGACAACGAGGACAATTTCG-3’
Polr2f-обратный праймер
5’- TCGCTCACCAGATGGGAGAATC-3’
Psmd6-зонд
5’- FAM-AATCGTGGAGACCAACAGACCTGATAGCAA- BHQ1-3’
Psmd6-прямой праймер
5’-GGTGTGGGTGTGGACTTCATT-3’
Psmd6-обратный праймер
5’-CTCCTTTCTTGATGGTTTCTTGATACTG-3’
Psmd7-зонд
5’-FAM-AGTCCTAGGTCCTTTGGCTTCACGTCGA-BHQ1-3’
Psmd7-прямой праймер
5’-CTGCACAAGAATGATATCGCCATC-3’
Psmd7-обратный праймер
5’-CTCCACTGAGATGTAGGCTTCG-3’
Sars-зонд
5’- FAM- CGTTCTACTTTGTTGTCTGCGTCCTCATCA- BHQ1-3’
Sars-прямой праймер
5’-GCGAGATTGGGAACCTTCTG-3’
Sars-обратный праймер
5’-ATGGGAATACTTCTTCCTGACTGTA-3’
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР ХАУСКИПИНГОВ ДЛЯ АНАЛИЗА ЭКСПРЕССИИ ГЕНОВ ПРИ БОЛЕЗНИ ПАРКИНСОНА В ПЕРИФЕРИЧЕСКОЙ КРОВИ ЧЕЛОВЕКА И ЕГО ПРИМЕНЕНИЕ | 2022 |
|
RU2798294C1 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ, СОДЕРЖАЩАЯ hGDNF ПОД КОНТРОЛЕМ ТЕМПЕРАТУРОЧУВСТВИТЕЛЬНОГО ПРОМОТОРА ДЛЯ РЕГУЛИРУЕМОЙ ЭКСПРЕССИИ НЕЙРОТРОФИЧЕСКОГО ФАКТОРА КАК В КЛЕТКАХ, ТАК И НЕПОСРЕДСТВЕННО В ОРГАНИЗМЕ МЛЕКОПИТАЮЩИХ | 2012 |
|
RU2527169C2 |
| КОМПОЗИЦИЯ И СПОСОБЫ ВЫСОКОЭФФЕКТИВНОГО ПЕРЕНОСА ГЕНОВ С ПОМОЩЬЮ ВАРИАНТОВ КАПСИДА AAV | 2013 |
|
RU2683497C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК МЛЕКОПИТАЮЩИХ, МОДИФИЦИРОВАННЫХ ГЕНОМ ФАКТОРА РОСТА НЕРВОВ ЧЕЛОВЕКА | 2011 |
|
RU2458984C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ТРАНСКРИПЦИИ ГЕНА, КОДИРУЮЩЕГО ХЕМОКИН CCL2 (МСР-1) ЧЕЛОВЕКА И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2522801C2 |
| СРЕДСТВО ЛЕЧЕНИЯ БОЛЕЗНИ ГЕНТИНГТОНА НА ОСНОВЕ AAV | 2017 |
|
RU2749971C2 |
| ГУМАНИЗИРОВАННЫЕ M-CSF МЫШИ | 2012 |
|
RU2577978C2 |
| ГУМАНИЗИРОВАННЫЕ M-CSF МЫШИ | 2020 |
|
RU2819731C2 |
| Препарат для стимулирования регенерации и нейропротекции нервной ткани и способ его использования | 2023 |
|
RU2828544C1 |
| АДЕНОАССОЦИИРОВАННЫЙ ВИРУСНЫЙ ВЕКТОР ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА, ЕГО ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ, А ТАКЖЕ СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА С ПОМОЩЬЮ ДАННОГО ВЕКТОРА | 2004 |
|
RU2335542C2 |

Настоящее изобретение относится к области генетики. Описан способ анализа экспрессии генов при болезни Паркинсона. Он предусматривает выделение РНК из образцов тканей головного мозга и периферической крови и применение набора праймеров и зондов для определения стабильности экспрессии набора хаускипингов. Набор состоит из по меньшей мере 3 хаускипингов, выбранных из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, в тканях головного мозга и периферической крови мышей. Технический результат заключается в определении хаускипингов для анализа экспрессии генов при болезни Паркинсона, показывающих валидность и стабильность экспрессии в различных тканях головного мозга и периферической крови мышей. 2 н. и 9 з.п. ф-лы, 1 ил., 5 табл., 1 пр.
1. Набор праймеров и зондов для определения стабильной экспрессии набора хаускипингов, состоящего из по меньшей мере 3 хаускипингов из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, в тканях головного мозга и периферической крови мышей при анализе экспрессии генов при болезни Паркинсона, где набор праймеров и зондов представляет собой:

2. Способ анализа экспрессии генов при болезни Паркинсона, предусматривающий выделение РНК из образцов тканей головного мозга и периферической крови и применение набора праймеров и зондов по п. 1 для определения стабильности экспрессии набора хаускипингов, состоящего из по меньшей мере 3 хаускипингов, выбранных из группы, состоящей из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars, в тканях головного мозга и периферической крови мышей.
3. Способ по п. 2, где набор хаускипингов состоит из Aars, Bcat2, Hprt, Polr2f, Psmd6, Psmd7, Sars и стабильно экспрессируется в тканях головного мозга и периферической крови мышей.
4. Способ по п. 2, где ткани головного мозга представляют собой головной мозг в целом.
5. Способ по п. 2, где ткани головного мозга выбраны из группы, состоящей из кортекса, мозжечка, стриатума и черной субстанции.
6. Способ по п. 2 или 4, где набор хаускипингов состоит из хаускипингов Aars, Psmd7 и Psmd6 и стабильно экспрессируется в головном мозге в целом.
7. Способ по п. 2 или 5, где набор хаускипингов состоит из хаускипингов Polr2f, Aars и Bcat2 и стабильно экспрессируется в кортексе.
8. Способ по п. 2 или 5, где набор хаускипингов состоит из хаускипингов Psmd6, Aars и Polr2f и стабильно экспрессируется в мозжечке.
9. Способ по п. 2 или 5, где набор хаускипингов состоит из хаускипингов Psmd7, Aars и Sars и стабильно экспрессируется в стриатуме.
10. Способ по п. 2 или 5, где набор хаускипингов состоит из хаускипингов Psmd7, Aars и Bcat2 и стабильно экспрессируется в черной субстанции.
11. Способ по п. 2, где набор хаускипингов состоит из хаускипингов Polr2f, Hprt и Sars и стабильно экспрессируется в периферической крови.
| ALIEVA A | |||
| et al., "VCP expression decrease as a biomarker of preclinical and early clinical stages of Parkinson’s disease", Scientific Reports, 21.01.2020, V.10: 827, P.1-9 | |||
| РУДЕНОК М.М | |||
| "Возможная роль генов, связанных с лизосомными болезнями накопления, в патогенезе болезни Паркинсона", Молекулярная биология, 2019, т | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
Авторы
Даты
2023-06-21—Публикация
2022-01-12—Подача