ОСНОВА ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение связано с экспрессирующим Аβ-пептид аденоассоциированным вирусным вектором, который может быть использован для лечения болезни Альцгеймера, а также его использования в качестве фармацевтического агента.
Предшествующий уровень техники.
Болезнь Альцгеймера характеризуется наличием в головном мозге старческих (невритных) бляшек, нейрофибриллярных сплетений, а также изменениями и потерей нейрональных клеток головного мозга. Считается, что отложения β-амилоида в старческих бляшках играют центральную роль в патогенезе болезни Альцгеймера. β-амилоидный пептид (Аβ), главный компонент подобных β-амилоидных отложений, продуцируется путем частичного расщепления β-амилоидного белка-предшественника (βAPP) β- и γ-секретазами нервных клеток.
Недавние опыты на трансгенных мышах с наследственной патологией Альцгеймера, сверхэкспрессирующих человеческий β-амилоидный белок-предшественник показали, что в результате введения Аβ-пептида вместе с адъювантом для иммунизации у таких мышей тормозится формирование старческих бляшек, а также уменьшается число существующих бляшек.
На настоящий момент предложены три основных теории, объясняющих возможные механизмы описанных выше процессов. Согласно первой теории антитела против Аβ, продуцирующиеся в организме в ответ на введение Аβ-пептида, связываются с агрегированными Аβ в старческих бляшках, и полученные комплексы фагоцитируются клетками микроглии, что приводит к исчезновению старческих бляшек. Антитела также связываются с секретируемым Аβ, и фагоцитоз полученных комплексов клетками микроглии приводит к снижению цитотоксичности Аβ в отношении нейрональных клеток. Это ведет к излечению от деменции и т.п. Согласно второй теории антитела против Аβ, продуцирующиеся в ответ на введение Аβ-пептида, связываются с Аβ посредством распознавания N-концевой аминокислоты последнего, что ведет к растворению агрегированных и нерастворимых форм Аβ, а также тормозит агрегацию и отложение секретируемого Аβ, что, в свою очередь, приводит к уменьшению отложений амилоида. Согласно третьей теории, так называемой «теории стока», антитела к Аβ не проходят через гематоэнцефалический барьер, а посредством связывания с Аβ в периферической крови и тканях приводят к диффузии Аβ из центральной нервной системы на периферию.
На основании вышеизложенных теорий был предпринят ряд попыток использовать вирусные векторы в разработке профилактических и терапевтических подходов. Так, было показано, что оральное введение мышам линии С57В1/6 аденовирусного вектора, содержащего кДНК Аβ, приводит к экспрессии Аβ в клетках верхнего отдела желудочно-кишечного тракта, и сывороточные анти-Аβ-антитела ингибируют агрегацию Аβ-пептида in vitro (Takeshi Tabira and Hideo Hara, Fiscal 2002 Welfare Science Research, "21 Century-Type Medical Pioneering/Promoting Research (Field of Dementia), Publication Report on Research Results" published by Incorporated Foundation, Japan Foundation for Longevity Science (Choju Kagaku Shinko Zaidan), March 2002, pp.49-54). Однако в этом сообщении не было упомянуто о каких-либо экспериментах на животных, подтверждающих терапевтический эффект in vivo.
Далее, известно, что цитокин TGF-β1 (трансформирующий фактор роста-β1) вызывает продукцию воспалительных цитокинов IL-1β (интерлейкин-1β), TNF-α (фактор некроза опухолей-α) в клетках сосудистого эндотелия. Также недавно сообщалось, что TGF-β1 вызывает ряд патологических изменений, напоминающих болезнь Альцгеймера, таких как цереброваскулярные амилоидные отложения и микроваскулярная дегенерация.
Терапевтические средства для лечения болезни Альцгеймера должны тормозить формирование старческих бляшек и отложений амилоида в центральной нервной системе и в то же время не должны ни проникать в другие органы, ни обладать побочными эффектами, такими как энцефалит. До сих пор не было сообщений ни об одном терапевтическом средстве, удовлетворяющем данным требованиям.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используя рекомбинантный аденоассоциированный вектор для экспрессии в клетках кишечника Аβ, индуцировавшего гуморальный иммунный ответ посредством синтеза анти-Аβ-антител, заявители обнаружили уменьшение отложений амилоида и торможение формирования старческих бляшек в мозге. Далее, заявителями не было обнаружено каких-либо воспалительных изменений в мозге и других органах, таких как почки, в результате применения рекомбинантного аденоассоциированного вектора. Настоящее изобретение основано на вышеописанных результатах.
В соответствии с этим целью согласно изобретению является представление аденоассоциированного вирусного вектора, экспрессирующего антиген Аβ, и содержащей упомянутый вектор фармацевтической композиции, которая может быть использована для лечения болезни Альцгеймера.
Согласно настоящему изобретению аденоассоциированный вирусный вектор - это аденоассоциированный вирусный вектор, способный экспрессировать пептидный фрагмент β-амилоидного пептида, содержащий сайт индукции гуморального иммунного ответа и ДНК, кодирующую соответствующий пептидный фрагмент в оперативной форме.
Далее, фармацевтическая композиция для лечения болезни Альцгеймера содержит согласно настоящему изобретению аденоассоциированный вирусный вектор согласно изобретению.
Согласно настоящему изобретению использование рекомбинантного аденоассоциированного вирусного вектора позволяет индуцировать гуморальный иммунный ответ без сопутствующей индукции клеточного иммунного ответа, а также позволяет замедлить формирование старческих бляшек и отложение амилоида в центральной нервной системе. Далее, с помощью упомянутого рекомбинантного аденоассоциированного вирусного вектора можно снизить концентрацию TGF-β в крови, а также затормозить прогрессию цереброваскулярных амилоидных отложений и замедлить прогресс микроваскулярной дегенерации. Также заявители предполагают возможность использования рекомбинантного аденоассоциированного вектора согласно изобретению в качестве препарата для чрезвычайно безопасного лечения болезни Альцгеймера, не обладающего побочными эффектами, такими как энцефалит и поражения печени.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
На Фигуре 1 показан объем продукции анти-Аβ-антител в сыворотке крови мышей, после орального введения аденоассоциированного вирусного вектора, экспрессирующего Аβ-43.
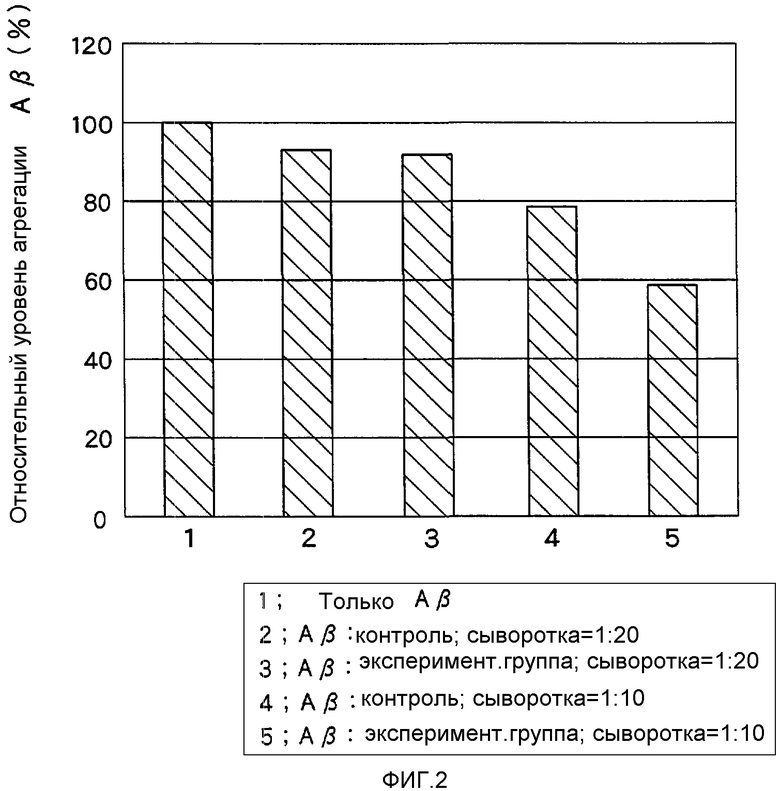
На Фигуре 2 показан супрессивный эффект мышиных сывороточных анти-Аβ-антител на агрегацию Aβ in vitro.
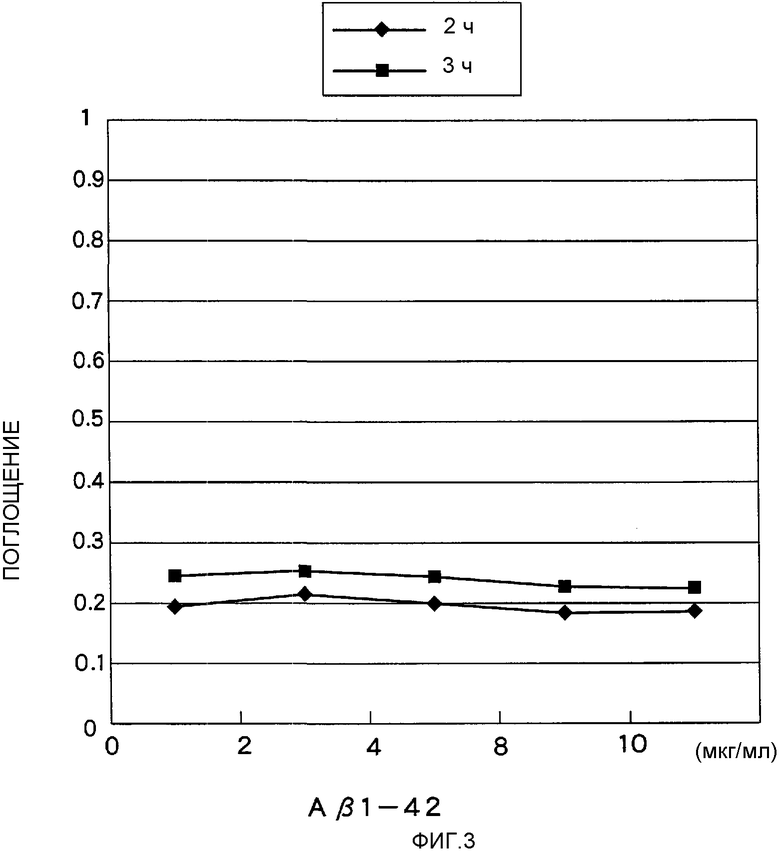
На Фигуре 3 показана пролиферация спленоцитов обработанных мышей в ответ на пептид Аβ42.
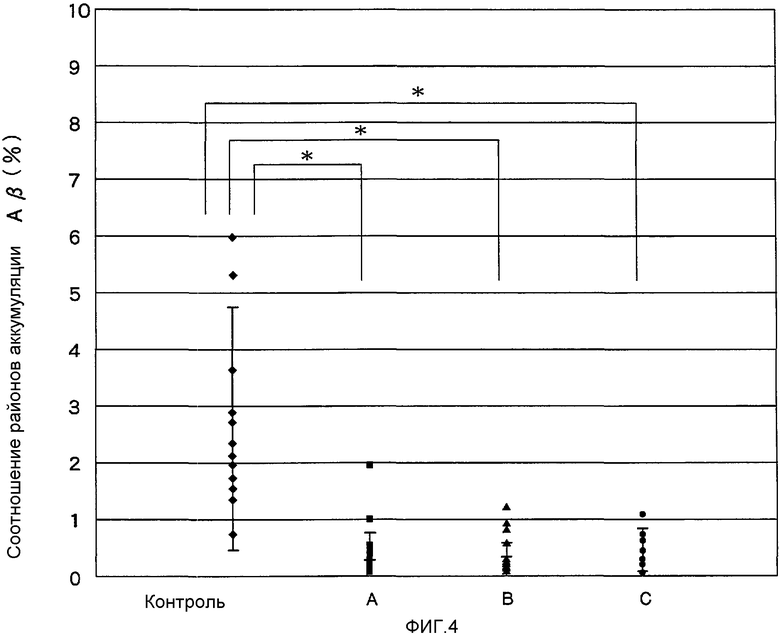
На Фигуре 4 показано среднее соотношение районов аккумуляции Аβ в коре лобных долей, теменных долях и гиппокампе мышей после орального введения аденоассоциированного вирусного вектора, экспрессирующего Аβ-43.
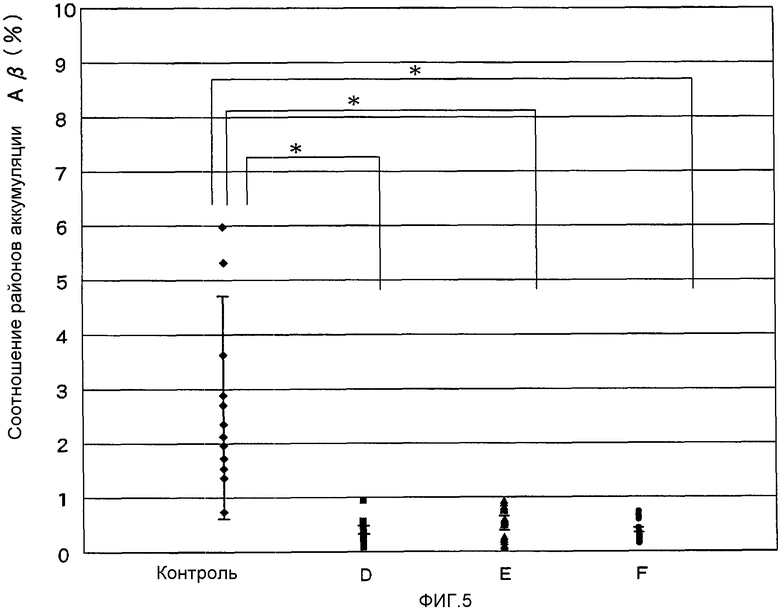
На Фигуре 5 показано среднее соотношение районов аккумуляции Аβ в коре лобных долей, теменных долях и гиппокампе мышей после орального введения аденоассоциированного вирусного вектора, экспрессирующего Аβ-21.
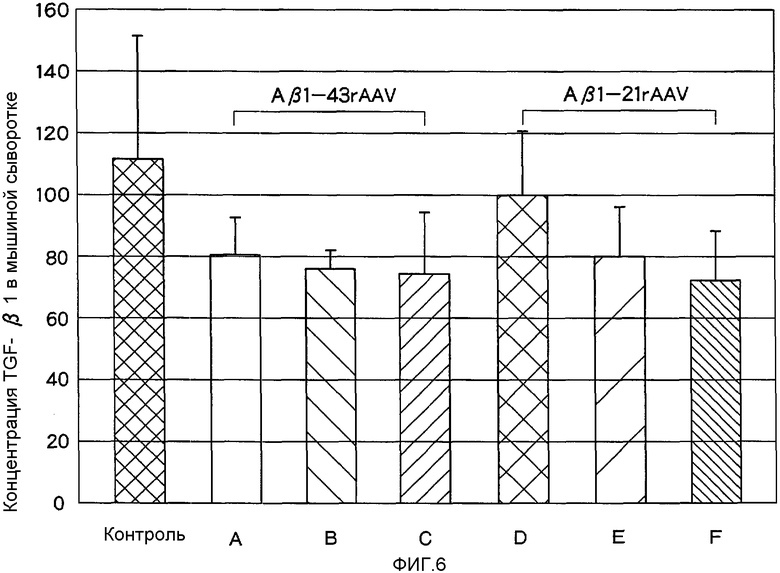
На Фигуре 6 показана концентрация ТФР-β1 в сыворотке крови мышей после орального введения аденоассоциированного вирусного вектора, экспрессирующего Аβ-43 или Аβ-21.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению аденоассоциированный вирусный вектор содержит ДНК, кодирующую пептидный фрагмент, содержащий сайт индукции гуморального иммунного ответа β-амилоидного пептида (Аβ-пептида) в оперативной форме, и, таким образом, упомянутый пептидный фрагмент может быть экспрессирован. Экспрессия «в оперативной форме» подразумевает то, что трансген (ДНК) вставлен в вектор таким образом, что упомянутый ген может быть экспрессирован под контролем подходящих регуляторных элементов (т.е. промоторов, энхансеров и терминаторов транскрипции).
Сайт индукции гуморального иммунного ответа Аβ-пептида может быть легко специфицирован любым специалистом в данной области. Так, вышеупомянутый сайт индукции гуморального иммунного ответа расположен в области с 4-го по 10-ый аминокислотный остаток Аβ-пептида (Аβ4-10). В соответствии с этим вышеупомянутый антигенный пептидный фрагмент экспрессируется аденоассоциированным вирусным вектором согласно изобретению, предпочтительно содержащим Аβ4-10.
Далее, образец аминокислотной последовательности Аβ4-10 представляет собой аминокислоты с 4-ой по 10-ую в аминокислотной последовательности, приведенной в SEQ ID NO:2. В соответствии с этим упомянутый антигенный пептидный фрагмент предпочтительно содержит аминокислоты с 4-ой по 10-ую в аминокислотной последовательности, приведенной в SEQ ID NO:2. Нуклеотидная последовательность ДНК, кодирующая эту аминокислотную последовательность, особым образом не ограничена; так, могут быть использованы нуклеотиды с 10-го по 30-ый, приведенные SEQ ID NO:1. Соответственно ДНК, кодирующая вышеупомянутый антигенный пептидный фрагмент, предпочтительно включает в себя нуклеотиды с 10-го по 30-ый согласно SEQ ID NO:1.
Согласно предпочтительному воплощению настоящего изобретения вышеупомянутый антигенный пептидный фрагмент содержит аминокислоты Аβ-пептида с 1-ой по 43-ю (Aβ1-43). Образец аминокислотной последовательности Aβ1-43 представляет собой аминокислотную последовательность, приведенную в SEQ ID NO:2; в соответствии с этим вышеупомянутый антигенный пептидный фрагмент предпочтительно включает в себя аминокислотную последовательность, приведенную в SEQ ID NO:2. Нуклеотидная последовательность ДНК, кодирующая эту аминокислотную последовательность, особым образом не ограничена; так, может быть использована нуклеотидная последовательность, приведенная в SEQ ID NO:1.
Согласно другому предпочтительному воплощению настоящего изобретения вышеупомянутый антигенный пептидный фрагмент включает в себя аминокислоты Аβ-пептида с 1-ой по 21-ую (Aβ1-21). Образец аминокислотной последовательности Aβ1-21 представляет собой аминокислотную последовательность, приведенную в SEQ ID NO:4; в соответствии с этим вышеупомянутый антигенный пептидный фрагмент предпочтительно включает в себя аминокислотную последовательность, приведенную в SEQ ID NO:4.
Нуклеотидная последовательность ДНК, кодирующая данную аминокислотную последовательность, особым образом не ограничена; так, может быть использована нуклеотидная последовательность, приведенная в SEQ ID NO:3. Соответственно ДНК, кодирующая вышеупомянутый антигенный пептидный фрагмент, преимущественно включает в себя нуклеотидную последовательность, приведенную в SEQ ID NO:3.
Вышеупомянутые аминокислотные последовательности Aβ1-43 и Aβ1-21 содержат не только сайт индукции гуморального иммунного ответа, но также последовательность, распознаваемую Т-клеточным рецептором; тем не менее, данные антигенные пептидные фрагменты прежде всего индуцируют продукцию антител и лишь в небольшой степени индуцируют клеточный иммунный ответ в случае их экспрессии в иммунной системе кишечной слизистой с помощью аденоассоциированного вирусного вектора согласно изобретению.
Для обеспечения эффективной презентации вышеупомянутого антигенного пептидного фрагмента, экспрессируемого аденоассоциированным вирусным вектором согласно изобретению в качестве антигена, данный антигенный пептидный фрагмент секретируется преимущественно во внеклеточное пространство после внутриклеточной экспрессии. В соответствии с этим согласно настоящему изобретению аденоассоциированный вирусный вектор предпочтительно содержит ДНК в оперативной форме, кодирующую сигнальный пептид, позволяющий вышеупомянутому антигенному пептидному фрагменту секретироваться во внеклеточное пространство. Использованное выше выражение «содержать в оперативной форме» подразумевает, что вышеупомянутый сигнальный пептид экспрессируется вместе с вышеупомянутым антигенным пептидным фрагментом, и в то же время данный экспрессированный антигенный пептидный фрагмент секретируется во внеклеточное пространство при помощи данного сигнального пептида. Методом интеграции ДНК, кодирующей вышеупомянутый сигнальный пептид в оперативной форме, в аденоассоциированный вирусный вектор согласно изобретению может быть любой метод, известный специалистам в данной области; так, это может быть химерный ген, в котором две молекулы ДНК связаны так, что данный сигнальный пептид экспрессируется вместе с данным антигенным пептидным фрагментом, связанным с N-концом вышеупомянутого сигнального пептида.
Вышеупомянутым сигнальным пептидом может быть любой сигнальный пептид, известный специалистам в данной области; тем не менее предпочтительно используется сигнальный пептид, локализованный в N-конце амилоидного белка-предшественника (АРР). Образец аминокислотной последовательности сигнального пептида АРР представляет собой аминокислотную последовательность, приведенную в SEQ ID NO:6; в соответствии с этим вышеупомянутый сигнальный пептид, экспрессируемый аденоассоциированным вектором согласно изобретению, предпочтительно включает в себя аминокислотную последовательность, приведенную в SEQ ID NO:6. Нуклеотидная последовательность ДНК, кодирующая данную аминокислотную последовательность, особым образом не ограничена; так, может быть использована нуклеотидная последовательность, приведенная в SEQ ID NO:5. Соответственно ДНК, кодирующая вышеупомянутый сигнальный пептид, преимущественно включает в себя нуклеотидную последовательность, приведенную в SEQ ID NO:5.
В соответствии с предпочтительным воплощением настоящего изобретения аденоассоциированный вирусный вектор согласно изобретению содержит ДНК, кодирующую химерный белок, в котором сигнальный пептид АРР связан с N-концом Aβ1-43. Образец аминокислотной последовательности данного химерного белка представляет собой аминокислотную последовательность, приведенную в SEQ ID NO:8, и образец нуклеотидной последовательности ДНК, кодирующей данный белок, представляет собой нуклеотиды с 9-го по 191-ый нуклеотидной последовательности, приведенной в SEQ ID NO:7.
Согласно другому предпочтительному воплощению настоящего изобретения аденоассоциированный вирусный вектор согласно изобретению содержит ДНК, кодирующую химерный белок, в котором сигнальный пептид АРР связан с N-концом Aβ1-21. Образец аминокислотной последовательности данного химерного белка представляет собой аминокислотную последовательность, приведенную в SEQ ID NO:10, и образец нуклеотидной последовательности ДНК, кодирующей данный белок, представляет собой нуклеотиды с 17-го по 133-ий нуклеотидной последовательности, приведенной в SEQ ID NO:9.
Далее, аденоассоциированный вирусный вектор согласно настоящему изобретению может содержать регуляторные элементы, такие как промоторы, энхансеры и терминаторы транскрипции, также в случае необходимости могут быть вставлены стартовые и «стоп»-кодоны.
Аденоассоциированный вирусный вектор согласно настоящему изобретению может быть получен стандартным методом, известным в данной области. Например, в патенте США №5858351 и цитированных в нем ссылках обсуждаются различные подходящие для генной терапии рекомбинантные аденоассоциированные векторы, а также способы конструирования и амплификации этих векторов (например, Kotin (1994) Human Gene Therapy 5:793-801 or Berns "Parvoviridae and their Replication" Fundamental Virology, the second edition compiled by Fields & Knipe).
Согласно наиболее распространенному способу конструирования аденоассоциированного вирусного вектора в первую очередь конструируют плазмиду, в которой представляющий интерес целевой ген вставляется между ITR аденоассоциированного вируса дикого типа (плазмидный вектор AAV). Кроме того, конструируют плазмиду, экспрессирующую ген Rep (ген, кодирующий белок инициации репликации) и ген Cap (ген, кодирующий белок вирусного капсида), а также плазмиду, экспрессирующую аденовирусные гены Е2А, Е4 и VA. Далее, все три плазмиды ко-трансфицируются в «упаковочные» клетки, экспрессирующие ген Е1, такие как клетки НЕК293, и полученные трансфектанты культивируются. С помощью данного подхода могут быть получены вирусные частицы аденоассоциированного вирусного вектора с высокой инфицирующей способностью по отношению к клеткам млекопитающих. Вышеописанный метод может быть легко воспроизведен при помощи коммерческих наборов, таких как AAV-Helper-Free System (Stratagene).
Аденоассоциированный вектор согласно настоящему изобретению может быть использован для лечения болезни Альцгеймера у млекопитающих. В соответствии с этим согласно настоящему изобретению предложен способ лечения болезни Альцгеймера, включающий в себя введение субъектам аденоассоциированного вирусного вектора согласно изобретению в терапевтически эффективных дозах, а также использование аденоассоциированного вирусного вектора согласно изобретению в дизайне терапевтических препаратов для лечения болезни Альцгеймера. Используемый здесь термин «терапия» предполагает не только лечение уже возникших патологических состояний, но также и предотвращение возможного развития подобных состояний в будущем. Вышеупомянутыми субъектами могут быть млекопитающие, такие как грызуны, псовые, кошачьи, крупный рогатый скот и приматы, в первую очередь человек.
Способами введения аденоассоциированного вирусного вектора согласно настоящему изобретению могут быть любые способы, используемые в области генной терапии - такие как внутрибрюшинная инъекция, интратрахеальное введение, интрабронхиальное введение и прямая интрабронхиальная инстилляция, подкожная инъекция, внутрикожное введение, внутриартериальная инфузия и внутривенная инъекция (см., Flotte and Carter, Gene Therapy 2:357-362 (1995)). Далее, преимуществом аденоассоциированных векторов является возможность их орального введения, поскольку они малочувствительны к агрессивному воздействию желудочного сока. Помимо этого оральное введение препарата обладает тем преимуществом, что субъекты могут принимать его самостоятельно.
Количеством введенного аденоассоциированного вектора может быть любая терапевтически эффективная доза, которая может быть легко подобрана специалистами в области генной терапии. Далее, нужная дозировка подбирается в соответствии с тяжестью патологических состояний, полом, возрастом, весом тела и образом жизни субъекта и т.д.; тем не менее, подобная дозировка подбирается соответствующим образом врачом или ветеринаром. Например, количество аденоассоциированного вирусного вектора для орального введения обычно составляет 0,5·1011-2·1012 вирусного генома/кг массы тела, предпочтительно 1·1011-1·1012 вирусного генома/кг массы тела, наиболее предпочтительно 1·1011-5·1011 вирусного генома/кг массы тела. Аденоассоциированный вектор согласно настоящему изобретению является фармацевтически безопасным в пределах вышеуказанных дозировок. Используемая здесь единица измерения «вирусный геном» подразумевает число молекул генома аденоассоциированного вирусного вектора (число вирусных частиц) и является известной специалистам в данной области единицей измерения количества аденоассоциированного вектора. Значение этой величины может быть определено путем разведения очищенного раствора аденоассоциированного вирусного вектора, последующей дот-блот-гибридизации и сравнения интенсивности сигнала разведенной пробы с интенсивностью сигнала плазмидной ДНК с известным числом молекул.
Согласно настоящему изобретению терапевтическая активность аденоассоциированного вирусного вектора против болезни Альцгеймера поддерживается на протяжении относительно большого периода времени после однократного введения субъекту. В частности, после однократного орального введения в вышеупомянутой дозировке антиген персистирует в клетках кишечного эпителия на протяжении как минимум шести месяцев, и индукция синтеза антител против данного антигена была подтверждена. В свете этих данных подходящий режим дозировки может быть подобран любым специалистом в данной области.
Аденоассоциированный вирусный вектор согласно настоящему изобретению может быть введен субъекту в виде фармацевтической композиции, содержащей данный вектор. В соответствии с этим согласно настоящему изобретению предложена фармацевтическая композиция для лечения болезни Альцгеймера, содержащая аденоассоциированный вирусный вектор согласно изобретению. В соответствии с предпочтительным воплощением согласно изобретению эта фармацевтическая композиция предназначена для орального введения.
Фармацевтическая композиция согласно настоящему изобретению может быть изготовлена любым известным в данной области способом в зависимости от способов введения и формы дозировки. Так, дозированные формы, такие как капсулы и растворы, могут быть использованы для изготовления фармацевтических композиций для орального введения. Таким образом, фармацевтическая композиция согласно настоящему изобретению может содержать фармацевтически подходящие носители, растворители, консерванты и т.д. в зависимости от индивидуальных дозированных форм.
ПРИМЕРЫ
Далее настоящее изобретение детально иллюстрируется нижеследующими примерами, которые, однако, не должны расцениваться как ограничивающие объем изобретения. В экспериментах были использованы трансгенные мыши АРР, являющиеся мышиной моделью болезни Альцгеймера (Тg2576, Taconic, Mayo Clinic).
Пример 1
Конструкция аденоассоциированного вирусного вектора, экспрессирующего сигнальную последовательность АРР+кДНК Aβ1-43
КДНК амилоида-β1-43 (Aβ1-43) была амплифицирована методом ПЦР с использованием человеческого амилоидного белка - предшественника (АРР) в качестве матрицы и нижеприведенных праймеров. Состав реакции ПЦР: буфер TAPS (25 мМ, рН 9,3), KCl (50 мМ), MgCl2 (2 мМ), 2-меркаптоэтанол (1 мМ), dNTP (100 мкМ), ДНК-матрица (50-100 нг) и праймеры (0,2 мкМ каждый). Параметры реакции ПЦР: 30 циклов, параметры цикла: 94°С 30 секунд, 68°С 1 минута, 72°С 3 минуты.
Праймеры
Прямой:
5'-GATGCAGAATTCCGACATGACTCAGGA-3' (SEQ ID NO:11),
Обратный:
5'-GTCTTAAGTCGCTATGACAACACCGCCC-3'
(SEQ ID NO:12, имеющая в 3'-конце сайт AflII)
Адаптор для АРР-секреторного сигнала, первая сигнальная последовательность в N-конце (SEQ ID NO:10), была получена путем прогревания нижеприведенных олигонуклеотидов в течение 3 минут при 90°С и дальнейшего отжига при комнатной температуре.
Олигонуклеотиды
Смысловой:
5'-GGTCTAGAATGCTGCCCGGTTTGGCACTGCTCCTGCTGGCCGCCTGGACGGCTCGGGCGCTT-3' (SEQ ID NO:13)
Антисмысловой:
5'-AGCGCCCGAGCCGTCCAGGCGGCCAGCAGGAGCAGTGCCAAACCGGGCAGCATTCTAGACC-3' (SEQ ID NO:14)
Адаптор для сигнала секреции АРР (имеющий неспаренный остаток Т в 3'-конце смысловой цепи) и амплифицированная методом ПЦР кДНК Aβ1-43 (имеющая неспаренный остаток А в 3'-конце антисмысловой цепи) были соединены вместе, и полученную ДНК в качестве матрицы и нижеприведенные праймеры использовали в реакции ПЦР для конструкции химерного гена, т.е. сигнальная последовательность АРР+кДНК Aβ1-43 (SEQ ID NO:7, имеющая сайт распознавания XbaI в отрезке нуклеотидов с 3-го по 8-ой в данной последовательности), в котором сигнальная последовательность АРР связана с 5'-концом кДНК Aβ1-43. Состав реакции ПЦР: буфер TAPS (25 мМ, рН 9,3), KCl (50 мМ), MgCl2 (2 мМ), 2-меркаптоэтанол (1 мМ), dNTP (100 мкМ), ДНК-матрица (50-100 нг) и праймеры (0,2 мкМ каждый). Параметры реакции ПЦР: 30 циклов, параметры цикла: 94°С 30 секунд, 68°С 1 минута, 72°С 3 минуты.
Праймеры
Прямой:
5'-GGTCTAGAATGCTGCCCGGTTTGGCAC-3'
(SEQ ID NO:15, имеющая на 5'-конце сайт XbaI)
Обратный:
5'-GTCTTAAGTCGCTATGACAACACCGCCC-3'
(SEQ ID NO:12, имеющая на 5'-конце сайт AflII)
Поскольку для эффективной упаковки в аденоассоциированный вирус целевая ДНК должна иметь подходящую длину (4,5-5,0 т.п.н.), PvuII-SalI-фрагмент ДНК плазмиды pBR322 был присоединен к вышеупомянутой химерной кДНК (сигнальная последовательность АРР+кДНК Aβ1-43 (XbaI-AflII/затупление)) в качестве нефункциональной «балластной» ДНК, и затем лигирован в стандартный аденоассоциированный вирусный вектор (pXXUF1) по XbaI-SalI-сайтам.
Далее, таким же образом, как в Примере 1, клетки НЕК293 были ко-трансфицированы кальций-фосфатным методом тремя плазмидными векторами, т.е. вышеупомянутым рекомбинантным pXXUF1, стандартной Rep/Cap-плазмидой и Е2А/Е4/VA-плазмидой, полученные клетки НЕК293 культивировали в большом объеме, после чего частицы аденоассоциированного вирусного вектора, содержащие сигнальную последовательность АРР+кДНК Aβ1-43, выделяли из клеточного лизата ультрацентрифугированием в CsCl.
Пример 2
Конструкция аденоассоциированного вирусного вектора, экспрессирующего сигнальную последовательность АРР+кДНК Aβ1-21
Химерную кДНК, содержащую сигнальную последовательность АРР+кДНК Aβ1-43 (XbaI-AflII/затупление), лигировали в плазмиду pBluescript (XbaI-Smal). Полученная ДНК в качестве матрицы и нижеприведенные праймеры использовали для проведения реакции ПЦР.
Праймеры
Прямой:
5'-TGGCGGCCGCTCTAGAATG-3'
(SEQ ID NO:16, имеющая на 5'-конце сайт NotI)
Обратный:
5'-CACATCTTAAGCAAAGAACACC-3' (SEQ ID NO:17)
Продукты ПЦР химерной кДНК, содержащей сигнальную последовательность АРР+кДНК Aβ1-21 (SEQ ID NO:9, имеющая рестрикционный сайт NotI на отрезке с 3-го по 10-ый нуклеотид в данной последовательности, а также рестрикционный сайт XbaI с 11-го по 16-ый нуклеотид в данной последовательности) подвергали двойной рестрикции (NotI-SalI) с последующим затупливанием концов, и полученные продукты лигировали в pXXUF1 (NotI-Sail) вместе с вышеупомянутым «балластным» PvuII-SalI-фрагментом ДНК плазмиды pBR322.
Далее, таким же образом, как в Примере 1, был получен аденоассоциированный вирусный вектор, содержащий сигнальную последовательность АРР+кДНК Aβ1-21.
Сравнительный пример 1
В качестве контроля был сконструирован аденоассоциированный вирус (GFPrAAV), экспрессирующий GFP (зеленый флуоресцирующий белок).
Тест 1
Вестерн-блот-анализ
Химерную кДНК, содержащую сигнальную последовательность АРР+кДНК Aβ1-43, лигировали в экспрессионный вектор pXXUF1 и полученным продуктом трансфицировали клетки НЕК293 (липофектамин 2000 (Invitrogen), 48 часов), после чего культуральный супернатант и клеточный лизат иммунопреципитировали с анти-Аβ-антителами (4G8), и полученные преципитаты подвергали ДСН-ПААГ-элетрофорезу. Далее, белки переносили на нитроцеллюлозную мембрану и выполняли детекцию Аβ с помощью анти-Аβ-антител. В результате было показано, что Аβ секретируется во внеклеточное пространство и формирует олигомеры, в то время как внутри клеток продуцируются большие количества мономерного Аβ-пептида массой 4 кДа.
Тест 2
Забор сыворотки крови у мышей
Мыши в возрасте 15 недель были подвергнуты однократному оральному введению аденоассоциированного вирусного вектора, полученного согласно Примеру 1 (5·1011 вирусного генома). Забор крови у экспериментальных мышей проводили через 1, 4 и 6 месяцев после введения вышеупомянутого аденоассоциированного вирусного вектора.
Определение анти-Аβ-антител в сыворотке крови мышей
Все лунки 96-луночного планшета (Nunc, MaxiSorp) обрабатывали Aβ1-42-пептидом (5 мг/мл) и блокировали 5%-ным раствором обезжиренного сухого молока в буфере TBS-T, после чего добавляли вышеописанные пробы сывороток крови экспериментальных мышей (в 500-кратном разведении) и выполняли определение при помощи меченных пероксидазой IgG против мышиных иммуноглобулинов. Титр антител определяли путем измерения оптического поглощения на ELISA-ридере. Результаты приведены на Фигуре 1.
Титр сывороточных антител достигал пика спустя один месяц после орального введения, антителообразование продолжалось вплоть до 6-го месяца после введения.
Тест 3
Тест на способность мышиных сывороток ингибировать агрегацию Аβ
Концентрацию Aβ1-40-пептида доводили до 120 мМ, инкубацию проводили при 37°С. Спустя 24 часа наблюдали начало агрегации Аβ. Мышиную сыворотку добавляли к данному агрегату в объемном отношении 1:10 и 1:20 и инкубировали при 37°С в течение одной недели. Тестирование на способность мышиной сыворотки ингибировать связывание/агрегацию Aβ1-40 выполняли с помощью спектрофотометрии (возбуждение при 445 нм; излучение при 490 нм) после добавления 2 мМ тиофлавина-Т. Результаты приведены на Фигуре 2.
Мышиная сыворотка, полученная спустя 6 месяцев после введения аденоассоциированного вирусного вектора согласно Тестовому Примеру 1, значительно ингибировала связывание/агрегацию Aβ1-40 по сравнению с контрольной мышиной сывороткой.
Тест 4
Экстракция ДНК из ткани и ПЦР
Сердце, легкие, селезенка, печень, верхний отдел желудочно-кишечного тракта и почки получали из мышей спустя 28 недель после орального введения аденоассоциированного вирусного вектора, полученного согласно Примеру 1, гомогенизировали в растворе Tris, после чего гомогенизаты подвергались протеолизу протеиназой К, и ДНК экстрагировали фенол/хлороформенным методом. Далее, из 5'-конца нуклеотидной последовательности промоторной области аденоассоциированного вирусного вектора (pXXUF1) и из 3'-конца данного вектора конструировали нижеприведенные праймеры для проведения реакции ПЦР. Состав реакции ПЦР: буфер TAPS (25 мМ, рН 9,3), KCl (50 мМ), MgCl2 (2 мМ), 2-меркаптоэтанол (1 мМ), dNTP (100 мкМ), ДНК-матрица (50-100 нг) и праймеры (0,2 мкМ каждый). Параметры реакции ПЦР: 30 циклов, параметры цикла: 94°С 1 минута, 68°С 20 секунд, 72°С 1 минута. Продукты ПЦР разделяли электрофорезом в 2% агарозном геле и окрашивали бромидом этидия.
Праймеры
Прямой:
5'-AGTGAACCGTCAGATCGC-3' (SEQ ID NO:18)
Обратный:
5'-CGGTATCAGCTCACTCAA-3' (SEQ ID NO:19)
Представляющая интерес полоса 500 п.н. детектировалась только в ампликонах проб ДНК, экстрагированных из верхнего отдела желудочно-кишечного тракта.
Тест 5
Пролиферативный ответ мышиных спленоцитов на Aβ1-42
Спленоциты получали из мышей спустя 28 недель после перорального введения аденоассоциированного вирусного вектора, полученного согласно Примеру 1, помещали в лунки 96-луночных плашек (5·104 клеток на лунку) и инкубировали 48 часов в культуральных растворах, содержащих различные концентрации Аβ1-42-пептида. После окончания культивирования добавляли соль тетразолия (WST-1). Поскольку тетразолиевые соли превращаются в формазановые красители под действием митохондриальной сукцинат-тетразолийредуктазы, которая активна лишь в жизнеспособных клетках, пролиферативный ответ оценивали путем измерения оптического поглощения раствора диформазанового красителя с использованием ELISA-ридера. Результаты приведены на Фигуре 3.
Спленоциты мышей после перорального введения аденоассоциированного вирусного вектора, полученного согласно Примеру 1, демонстрировали низкий пролиферативный ответ, не зависящий от концентраций Aβ1-42-пептида.
Тест 6
Окрашивание тканей, тест 1
Пробы тканей получали из мышей после перорального введения аденоассоциированного вирусного вектора, полученного согласно Примеру 1 (здесь и далее - «экспериментальная группа»), а также из интактных мышей того же возраста (здесь и далее - «контрольная группа») спустя 6 месяцев после введения (в возрасте 10 месяцев), и нижеприведенные эксперименты проводили с использованием замороженных секций тканей. Для детекции белка Аβ, старческих бляшек и т.д. в тканях последние обрабатывали 70% муравьиной кислотой, и эндогенную пероксидазу инактивировали 5% Н2O2. После обработки срезов анти-Аβ-антителами (4G8 в 1000-кратном разведении) или кроличьими анти-Аβ40-антителами (в 1000-кратном разведении), добавляли вторичные антитела, меченные пероксидазой, и выполняли DAB-окрашивание.
В контрольной группе наблюдали ассоциированное со старением отложение амилоида в головном мозге; оно было едва заметным у 6-месячных животных, однако к 10-му месяцу жизни у животных наблюдали значительное отложение амилоида, формирование старческих бляшек, и иногда - отложение амилоида в нейрональных клетках.
В то же время в экспериментальной группе наблюдали экспрессию белка Aβ в эпителиальных клетках верхнего отдела желудочно-кишечного тракта спустя 6 месяцев после введения (в возрасте 10 месяцев). В полученных спустя 6 месяцев после введения срезах головного мозга наблюдали значительное снижение количества амилоидных отложений и старческих бляшек по сравнению с контрольной группой. Результаты подсчета амилоидных бляшек в сагиттальных срезах мозга спустя 6 месяцев после введения приведены в Таблице 1.
Среднее число амилоидных бляшек в контрольной и экспериментальной группах - 76 и 8 соответственно (90% снижение числа бляшек в экспериментальной группе по сравнению с контрольной). Внутриклеточные амилоидные отложения, иногда наблюдаемые в мозговых срезах мышей контрольной группы, в экспериментальной группе наблюдали лишь в незначительной степени.
Тест 7
Окрашивание тканей, тест 2
Пробы тканей получали из мышей экспериментальной и контрольной групп спустя 6 месяцев после введения (в возрасте 10 месяцев) и нижеприведенные эксперименты проводили с использованием замороженных секций тканей таким же образом, как и в Тестовом Примере 6. Замороженные срезы окрашивали следующими антителами: анти-СD4, анти-СD86, анти-CD11b, анти-GFAP (астроциты) и анти-Iba-1 (микроглия) методом ABC для подтверждения наличия или отсутствия лимфоцитарных инфильтратов в центральной нервной системе. Результаты приведены в таблице 2.
Ткань мозга индивидуально окрашивали на Т-клеточный маркер CD4 и активирующую Т-клетки молекулу CD86, реакция на которые оказалась негативной как в контрольной, так и в экспериментальной группах. Ни в одной из групп не было также выявлено экспрессии маркера периферических макрофагов CD11b. Напротив, наблюдали значительную разницу в экспрессии GFAP между двумя группами. Наблюдали также увеличение активированных клеток микроглии (Iba-1-позитивных) в лобной и теменной долях головного мозга мышей экспериментальной группы.
Тест 8
Окрашивание тканей, тест 3
Пробы тканей получали из мышей после орального введения аденоассоциированного вируса, полученного согласно Примеру 2 (здесь и далее - «экспериментальная группа 2»), а также из контрольной группы мышей спустя 6 месяцев после введения (в возрасте 10 месяцев) и нежеприведенные эксперименты проводили с использованием замороженных секций тканей таким же образом, как описано в Тестовом Примере 6.
Анализ головного мозга мышей спустя 6 месяцев после введения (в возрасте 10 месяцев) показал, что отложение амилоида и количество старческих бляшек было значительно снижено в экспериментальной группе 2 по сравнению с контрольной группой.
Тест 9
Сравнение соотношения районов аккумуляции Аβ-1
Три группы по 4 мыши в каждой были подвергнуты однократному пероральному введению аденоассоциированного вирусного вектора, полученного согласно Примеру 1 (5·1011 вирусного генома), в возрасте 15 недель (здесь и далее - «группа А»), в возрасте 30 недель (здесь и далее - «группа В») и в возрасте 45 недель (здесь и далее - «группа С»). Далее, контрольная группа, состоящая из 6 мышей, была подвергнута однократному оральному введению PBS (0.1 мг/мышь) в возрасте 15 недель. Между 12-ой и 13-ой неделями жизни (возраст 52-56 недель) мыши были умерщвлены и индивидуальные срезы мозга были получены из коры лобных долей, теменных долей и гиппокампа. Данные срезы были окрашены таким же образом, как описано в Тестовом Примере 6, и были обследованы с помощью присоединенной к микроскопу камеры 3CCD для оценки районов аккумуляции Аβ в индивидуальных регионах. Далее, вычислялось отношение районов аккумуляции Aβ к общим индивидуальным сайтам. Результаты приведены на Фигуре 4.
В контрольной группе среднее отношение вышеупомянутого района аккумуляции Аβ к трем измеренным регионам составляло 2,64±1,46%. В то же время в группах А, В и С, подвергнутых введению в возрасте 15, 30 и 45 недель соответственно, вышеупомянутое отношение составляло 0,55±0,5%, 0,48±0,35% и 0,46±0,27% соответственно, причем каждое из полученных в трех группах отношений было значительно ниже, чем в контрольной группе однопараметрический дисперсионный анализ и Т-тест Стьюдента, р<0,001).
Тест 10
Сравнение соотношения районов аккумуляции Аβ-2
Три группы по 4 мыши в каждой были подвергнуты однократному оральному введению аденоассоциированного вирусного вектора, полученного согласно Примеру 2 (5·1011 вирусного генома), в возрасте 15 недель (здесь и далее - «группа D»), в возрасте 30 недель (здесь и далее - «группа Е») и в возрасте 45 недель (здесь и далее - «группа F»). Далее, индивидуальные срезы мозга получали также, как описано в Тестовом Примере 9, после чего вычисляли отношение районов аккумуляции Аβ к общим индивидуальным сайтам. Результаты приведены на Фигуре 5.
В группах D, Е и F, подвергнутых введению в возрасте 15, 30 и 45 недель соответственно, вышеупомянутое отношение составляло 0,39±0,27%, 0,45±0,30% и 0,37±0,20% соответственно, причем каждое из полученных в трех группах отношение было значительно ниже, чем в контрольной группе (однопараметрический дисперсионный анализ (ANOVA) и Т-тест Стьюдента, р<0,001).
Тест 11
Определение TGF-β1
Забор крови для получения сыворотки осуществлялся на аутопсии в сроки, указанные в Тестовых Примерах 9 и 10. Сывороточную концентрацию TGF-β1 измеряли методом ELISA при помощи Quantikine Mouse/Rat/Porcine TGF-β1 Immunoassay kit (R&D Systems). Результаты приведены на Фигуре 6.
В контрольной группе сывороточная концентрация TGF-β1 составляла 111,6±40,0 пг/мл. В то же время в группах А, В и С из Тестового Примера 9 концентрация TGF-β1 составляла 80,5±12,9 пг/мл, 76,0±6,3 пг/мл и 74,3±21,0 пг/мл соответственно. Полученные значения для всех трех групп были значительно ниже, чем в контрольной группе (однопараметрический дисперсионный анализ (ANOVA) и Т-тест Стьюдента, р<0,001).
Далее, в группах С, D и Е из Тестового Примера 10 концентрация TGF-β1 составляла 99,4±21,2 пг/мл, 80,2±17,2 пг/мл и 72,9±15,8 пг/мл соответственно. Полученные значения для всех трех групп были значительно ниже, чем в контрольной группе (однопараметрический дисперсионный анализ (ANOVA) и Т-тест Стьюдента, р<0,001).
| название | год | авторы | номер документа |
|---|---|---|---|
| АКТИВНАЯ ИММУНИЗАЦИЯ ДЛЯ СОЗДАНИЯ АНТИТЕЛ К РАСТВОРИМОМУ А-БЕТА | 2004 |
|
RU2390350C2 |
| СПОСОБ ОБНАРУЖЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2004 |
|
RU2380423C2 |
| СПОСОБЫ ОБНАРУЖЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2004 |
|
RU2483108C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2004 |
|
RU2385161C2 |
| СПОСОБ СКРИНИНГА ИНГИБИТОРОВ ГАММА-СЕКРЕТАЗЫ | 2004 |
|
RU2373284C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА-БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2571859C2 |
| АНТИТЕЛА К Aβ-ПЕПТИДУ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2341533C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К АМИЛОИДУ БЕТА | 2008 |
|
RU2567151C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ АМИЛОИДА БЕТА ПРИ ГЛАЗНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2542967C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К АМИЛОИДУ БЕТА | 2013 |
|
RU2668161C2 |
Изобретение относится к области молекулярной биологии, генетической инженерии и генной терапии. Получен аденоассоциированный вирусный вектор, содержащий в оперативной форме и способный экспрессировать пептидный фрагмент β-амилоидного пептида, содержащий сайт индукции гуморального иммунитета. Изобретение может быть использовано в терапии болезни Альцгеймера. 4 н. и 10 з.п. ф-лы, 6 ил., 2 табл.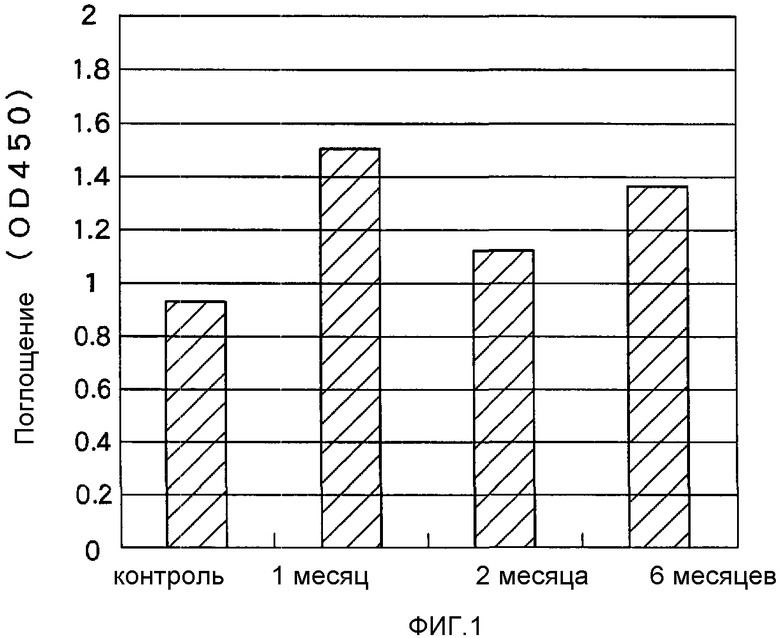
| STEINER H, ROMIG H, PESOLD В, PHILIPP U, BAADER M, CITRON M, LOETSCHER H, JACOBSEN H, HAASS C.Amyloidogenic function of the Alzheimer's disease-associated presenilin 1 in the absence of endoproteolysis.Biochemistry | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| AUSTIN L, ARENDASH GW, GORDON MN, DIAMOND DM, DICARLO G, DICKEY C, UGEN K, MORGAN D | |||
| Short-term | |||
Авторы
Даты
2008-10-10—Публикация
2004-06-11—Подача