Область техники, к которой относится изобретение
Настоящая заявка относится к поверхностным гликанам Clostridium perfringens и их применению в вакцинах, а также в диагностике и лечении инфекций, вызванных C. perfringens.
Предшествующий уровень техники
Clostridium perfringens представляет собой грамположительную токсин-продуцирующую анаэробную бактерию, которая является одной из наиболее распространенных причин болезней пищевого происхождения у людей (Grass et al. (2013)), а также отвечает за кишечные заболевания у многочисленных видов домашнего скота (Songer (1996); Uzal et al. (2010)). C. perfringens является основной причиной птичьего некротического энтерита (NE) (Al-Sheikhly et al. (1977a); Timbermont et al. (2010)), что создает значительную проблему в птицеводстве. Заболевание приводит к быстрой смерти в течение 24 часов после появления острой инфекции, в большинстве случаев исключая лечение (Caly et al. (2015), а субклинические инфекции связаны с хроническим повреждением слизистой оболочки кишечника, что приводит к снижению прироста массы и снижению эффективности кормления (Elwinger et al. (1998); Hofacre et al. (2003); Hofshagen et al. (1992); Kaldhusdal et al. (2001)). В совокупности, NE, по оценкам, несет ответственность за ежегодные убытки в 2 миллиарда долларов во всем мире для птицеводства (Van der Sluis (2000)). Кроме того, европейский запрет на профилактическое использование антибиотиков у сельскохозяйственных животных (Европейский Союз, нормативный акт (ЕС) № 1831/2003) привел к увеличению числа вспышек NE в европейских странах (Van Immerseel. et al. (2004)), что привело к потере 33% прибыли из-за стад, значительно зараженных C. perfringens, по сравнению со здоровыми стадами (Lovland et al. (2001)). Эти потери подчеркивают необходимость альтернативных стратегий профилактики вместо антибиотикотерапии.
Несмотря на важность C. perfringens в контексте животноводства и определение капсулярного полисахарида (CPS) в качестве основной антигенной детерминанты схемы типирования Хоббса (Hughes et al. (1976)), было проведено мало исследований для выявления и характеризации углеводных структур, присутствующих на поверхности этого организма. Только CPS-структуры из C. perfringens Hobbs 5, 9 и 10 были подробно исследованы, в результате чего было определено, что состав CPS Hobbs 9 представляет собой глюкозу (Glc), галактозу (Gal) и галактозамин (GalN) в cоотношении 1:1,6:1,1 в 1977 г. (Cherniak et al. (1977)), а полные структуры CPS Hobbs 5 и Hobbs 10 были определены методом ЯМР-спектроскопии в 1997 и 1998 годах, соответственно (Kalelkar et al. (1997); и Sheng et al. (1997)).
Кроме структур CPS многие грамположительные бактерии продуцируют тейхоевые кислоты (WTA) и липотейхоевые кислоты (LTA) клеточной стенки, но мало что было сделано для изучения наличия и потенциальной важности этих или других углеводных структур в C. perfringens. Richter et al. (2013) отметили наличие трех гомологов гена LTA-синтазы (ltaS) в геноме C. perfringens SM101 и продемонстрировали, что C. perfringens SM101 очень чувствителен к низкомолекулярному ингибитору синтеза LTA, что свидетельствует о том, что присутствие и важность LTA в C. perfringens, однако присутствие LTA не было продемонстрировано и не было структурно охарактеризовано в этой бактерии до самого недавнего времени, когда Vinogradov et al. (2017) сообщили, что C. perfringens ATCC 13124 продуцирует LTA с повторяющейся структурой β-ManNAc6PEtN-(1→4)-[β-ManNAc6PEtN-(1→4)]-β-ManNAc-(1→4)-β-ManNAc6PEtN[3-Ribf]-(1→4)-β-ManN-(1→4)-β-Glc-(1→1)-Gro.
Не существует известных вакцин на основе полисахаридов против C. perfringens. Стратегии вакцинации на сегодняшний день сосредоточены на использовании белковых антигенов, таких как детоксифицированные версии токсинов, продуцируемых C. perfringens (токсоид), и поверхностных и секретируемых белков C. perfringens, что приводит к различной степени защиты (Mot et al. (2014)). Из-за продуцирования более чем одного токсина штаммами C. perfringens, вызывающими заболевания скота, включая NE у кур, для эффективных стратегий белковых вакцин могут потребоваться многовалентные вакцины, содержащие более одного токсоида.
Коммерчески доступные вакцины против C. perfringens для домашней птицы (Netvax® (Merck Animal Health, Вайтхаус-Стейшен, Нью-Джерси) и автовакцины на токсоид Clostridium (Vacci-Vet™, Сент-Иасент, Квебек, Канада) основаны на токсоидах альфа-токсина, но с тех пор было показано, что токсин NetB играет более важную роль в патологии C. perfringens у кур. Кроме того, недавнее исследование вакцины NE показало, что значительные уровни защиты наблюдались только при использовании комбинации антигенов, полученных из альфа-токсина и NetB (Jiang et al. (2015)). Одним из основных соображений при разработке вакцины NE является то, что ее производство должно быть недорогим из-за низкой рыночной стоимости кур, и стратегии вакцинации, предусматривающие использование нескольких антигенов, а не одного антигена, могут оказаться чрезмерно дорогостоящими для использования у домашней птицы.
Сохраняется потребность в идентификации консервативной иммуногенной молекулы-мишени из C. perfringens, которая вызывает широко перекрестно-реактивный иммунный ответ для применения в качестве основного антигена в безопасной и эффективной вакцине против NE у кур, других заболеваний сельскохозяйственных животных и пищевого отравления человека, вызванное C. perfringens.
Эта справочная информация предоставляется заявителем с целью ознакомления с информацией, которая может иметь отношение к настоящему изобретению. Не было ни обязательного намерения, ни предположения, что какая-либо из предшествующей информации составляет предшествующий уровень техники в отношении настоящего изобретения.
Сущность изобретения
Настоящее изобретение основано на идентификации консервативного антигена C. perfringens, который включает полисахарид со структурой повторяющихся звеньев поли-β-1,4-ManNAc, изменяемой с помощью 6-связанного фосфоэтаноламина и 6-связанного фосфоглицерина. В общих чертах, изобретение включает иммуногенное гликановое соединение, включающее структуру повторяющихся звеньев поли-β-1,4-ManNAc, модифицированную, по меньшей мере, одним 6-связанным фосфоглицерином.
В одном аспекте изобретение может включать иммуногенный специфический поверхностный гликан Clostridium perfringens, который включает соединение формулы I в выделенной, синтезированной и/или очищенной форме, липид-связанной или свободной, или его аналог или модифицированную форму:
 … (I)
… (I)
где n≥1, Glc представляет собой глюкозу, ManNAc представляет собой N-ацетилманнозамин(2-ацетамидо-2,6-дидезоксиманнозу), ManN представляет собой маннозамин(2-амино-2-дезокси-D-маннопиранозу), Gro представляет собой глицерин, и где каждый из R1, R2, R3 и R4 содержит любой заместитель или модификацию, при условии, что по меньшей мере один из R1-R4 представляет собой фосфоглицерин (-PGro); R5 включает любую модификацию, такую как -ОН, а R6 содержит -H или -Ac. В одном воплощении один R5 в концевой копии повторяющейся структуры может включать сахар, такой как Ribf (рибофураноза).
В некоторых воплощениях гликан формулы I включает соединение, в котором по меньшей мере один из R1-R4 представляет собой PGro и по меньшей мере один, два или три из R1-R4 представляют собой фосфоэтаноламин или ОН.
В некоторых воплощениях гликан имеет структуру формулы II в выделенной, синтезированной и/или очищенной форме, липид-связанной или свободной, или его аналог или его модифицированную форму:
 …(II)
…(II)
В некоторых воплощениях соединение формулы I или II или его иммуногенный аналог или его модифицированную форму можно связать, например, с липидом или конъюгировать с одной аминокислотой, олигопептидом, пептидом или белком.
В другом аспекте изобретение может включать способ получения антитела или антисыворотки, включающий стадии получения соединения, несущего антигенную поверхностную структуру, включающую весь или часть гликана формулы I или II, инокуляцию животного соединением для стимуляции иммунного ответа на соединение, отбор сыворотки у указанного животного и необязательно очистку указанной сыворотки для получения антитела или антисыворотки, которая специфически связывается с гликаном. Антитело или антисыворотку можно использовать для диагностических целей, чтобы обнаружить присутствие C. perfringens у животного или человека, или в способе пассивной иммунизации, для лечения фактической или потенциальной инфекции C. perfringens.
Соединения по настоящему изобретению могут быть использованы в вакцинной композиции, совместно с адъювантом и без него, против C. perfringens, причем эта вакцинная композиция может быть введена домашней птице, такой как куры, или другим сельскохозяйственным животным. Соединения могут также применяться в составе вакцин для млекопитающих, таких как люди, поскольку C. perfringens также является основной причиной пищевого отравления человека при употреблении загрязненных пищевых продуктов, таких как говядина или птица. Соединения по настоящему изобретению также могут найти применение в гликоконъюгатных вакцинах и быть использованы для диагностических применений.
В другом аспекте изобретение может включать вакцину, которая содержит антигенное соединение, включающее весь или часть гликана формулы I или II, или его аналог или модифицированную форму, необязательно связанную с одной аминокислотой, олигопептидом, пептидом, белком или липидом, или переносимую на аттенуированной клетке C. perfringens или экспрессируемую на бактериях, сконструированных для гетерологичной экспрессии антигенного соединения.
В других аспектах изобретение может включать способы лечения или профилактики инфекции, вызванной организмом C. perfringens, с использованием композиции, включающей все или часть соединения формулы I или II или его иммуногенного аналога или его модифицированной формы в организме человека или животного. Вакцина в соответствии с настоящим изобретением может быть использована для улучшения продуктивности и здоровья животного путем введения указанной вакцины, описанной выше. Описанные в данном документе вакцины, антитела и антисыворотки также можно использовать для профилактики, лечения и диагностики у объектов, включая людей.
Краткое описание чертежей
На чертежах, показанных в описании, одинаковые элементы могут быть обозначены одинаковыми отссылочными номерами. Чертежи необязательно выполнены в масштабе с акцентом на принципах настоящего изобретения. Кроме того, каждое из изображенных воплощений является всего лишь одним из ряда возможных способов реализации, использующих фундаментальные концепции настоящего изобретения.
Фигура 1 представляет собой вестерн-иммуноблот, иллюстрирующий, что иммунодоминантный антиген на поверхности C. perfringens устойчив к протеиназе К.
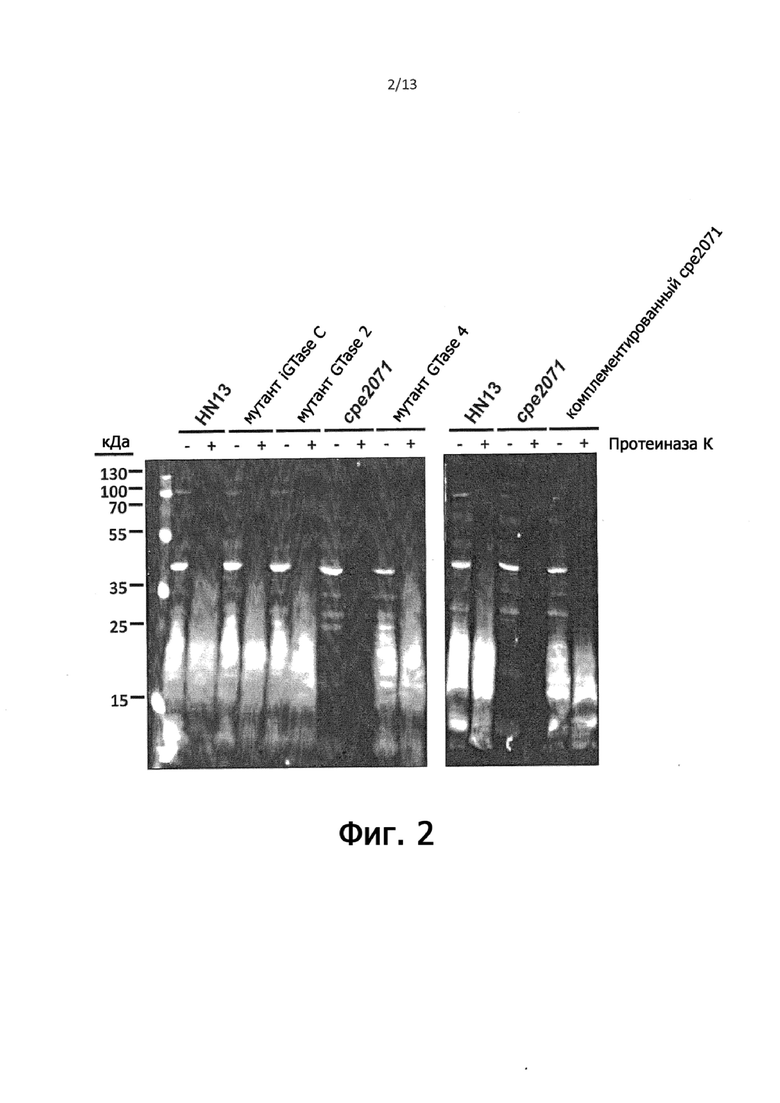
Фигура 2 представляет собой вестерн-иммуноблот, иллюстрирующий, что иммунодоминантный поверхностный антиген C. perfringens представляет собой полисахарид или гликолипид.
На фигуре 3 показаны вестерн-иммуноблоты, иллюстрирующие, что общий поверхностный полисахарид является иммунодоминантным как у кроликов, так и у кур, и что иммунный ответ на поверхностный полисахарид от C. perfringens HN13 является перекрестно-реактивным со всеми протестированными полевыми изолятами, тогда как антисыворотка против поверхностного полисахарида из C. perfringens JGS4143 перекрестно-реактивна только с небольшим количеством полевых изолятов, и что куриная анти-HN13 антисыворотка значительно менее перекрестно реагирует с полевыми изолятами после адсорбции на целых клетках мутанта C. perfringens HN13 cpe2237 (предполагаемый фосфоглицерин-минус мутант, изолят № 3).
Фигура 4 представляет собой вестерн-иммуноблот, иллюстрирующий, что иммунодоминантный поверхностный антиген не присутствует у других видов Clostridium.
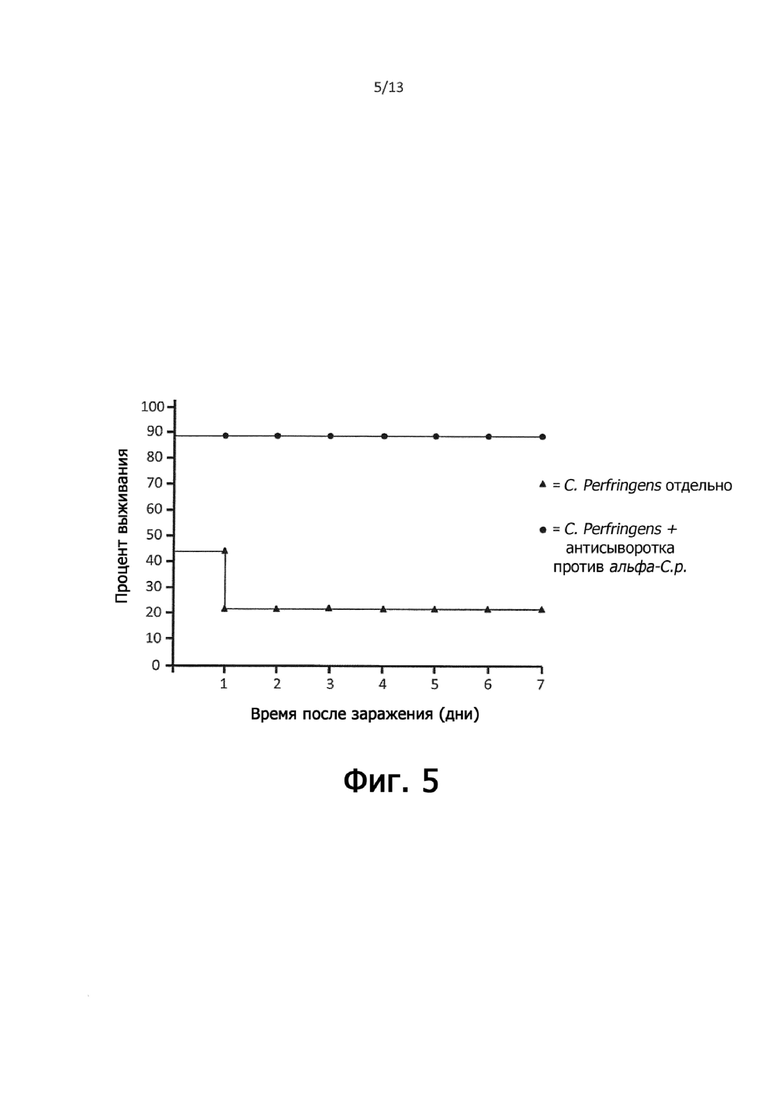
На фигуре 5 показан процент выживаемости цыплят леггорн, которым перорально вводили в желудок либо PBS, 1 × 109 клеток C. perfringens JGS4143 в PBS, либо совместно с 1 × 109 клеток C. perfringens JGS4143 в 1:100 анти-С. perfringens сыворотки: PBS.
На фигуре 6 показан процент выживания клеток C. perfringens JGS4143 в анализе опсонофагоцитоза с оценкой защитного потенциала куриной антисыворотки, индуцированной в отношении целых клеток C. perfringens HN13 по сравнению с наивной куриной сывороткой.
Фигура 7 представляет собой вестерн-иммуноблот, иллюстрирующий экстрагированный и выделенный иммунодоминантный антиген C. perfringens из штамма HN13 и штамма JGS4143 куриного NE.
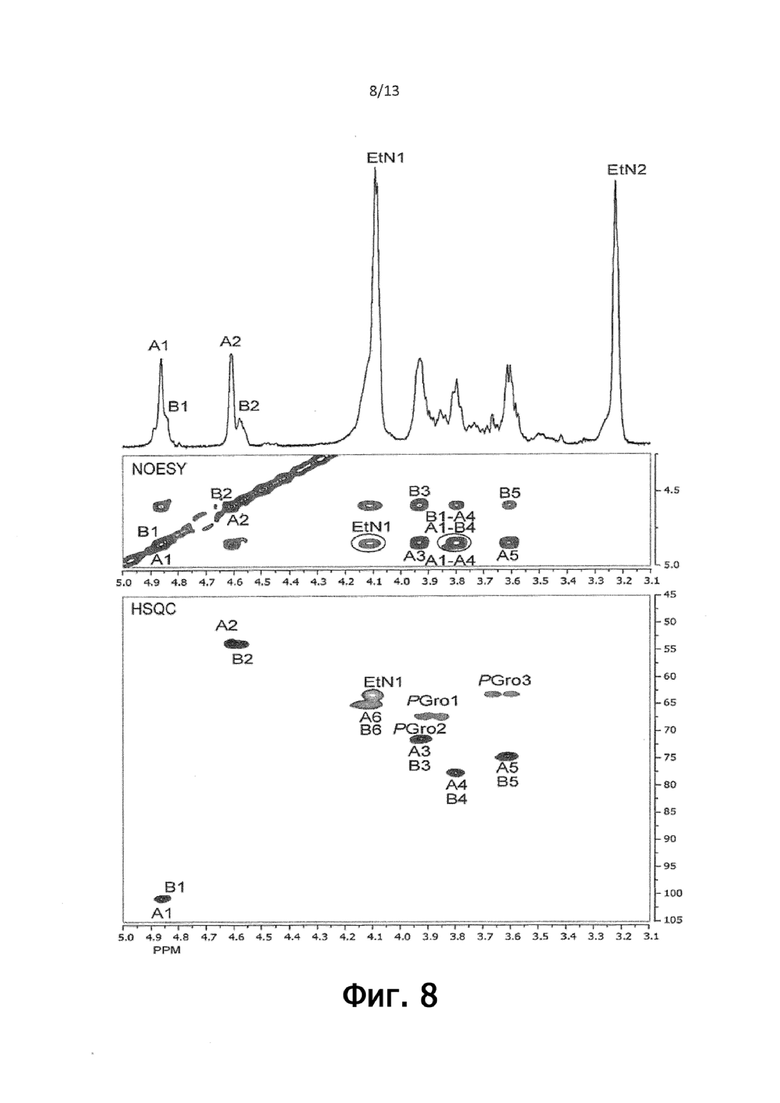
На фигуре 8 показаны данные ЯМР-спектроскопии деацилированного консервативного иммунодоминантного антигена из C. perfringens HN13, подтверждающие присутствие полисахарида со структурой повторяющихся звеньев тетрасахарида, модифицированного фосфоэтаноламином и фосфоглицерином формулы II.
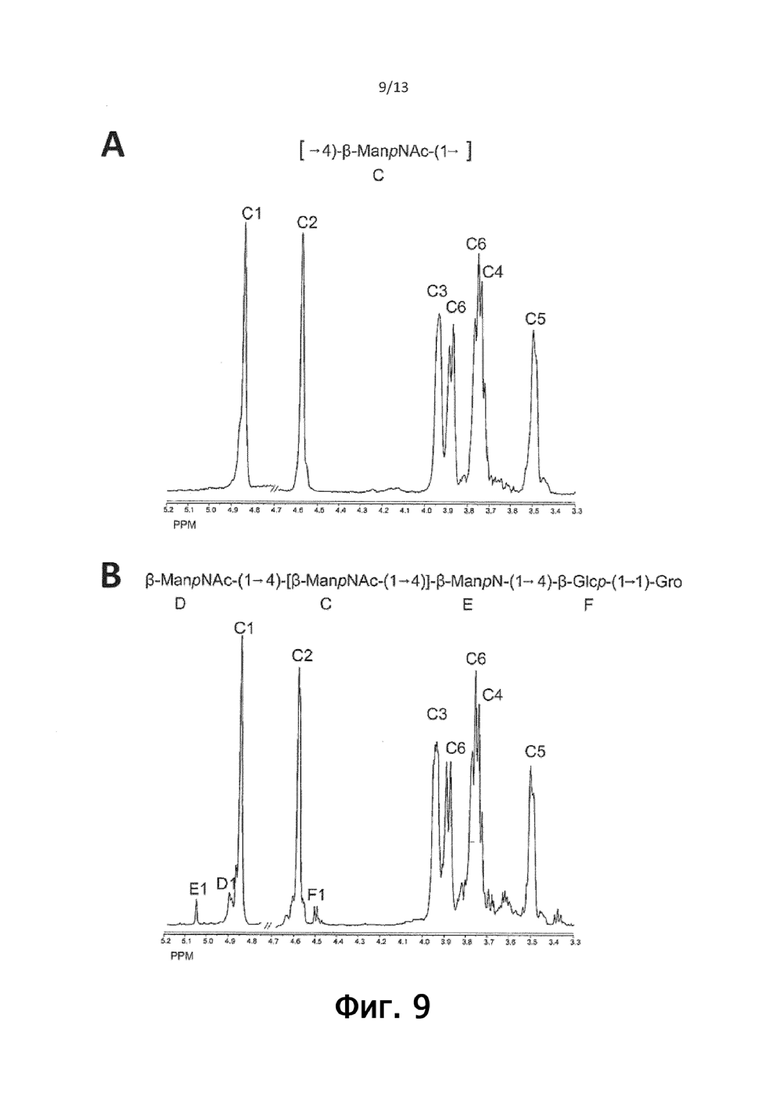
На фигуре 9 показаны данные ЯМР-спектроскопии A) высокомолекулярных и B) низкомолекулярных форм деацилированного и дефосфорилированного консервативного иммунодоминантного антигена из C. perfringens HN13, подтверждающие концевой дисахарид-глицерин на восстанавливающем конце тетрасахаридного повтора формулы II.
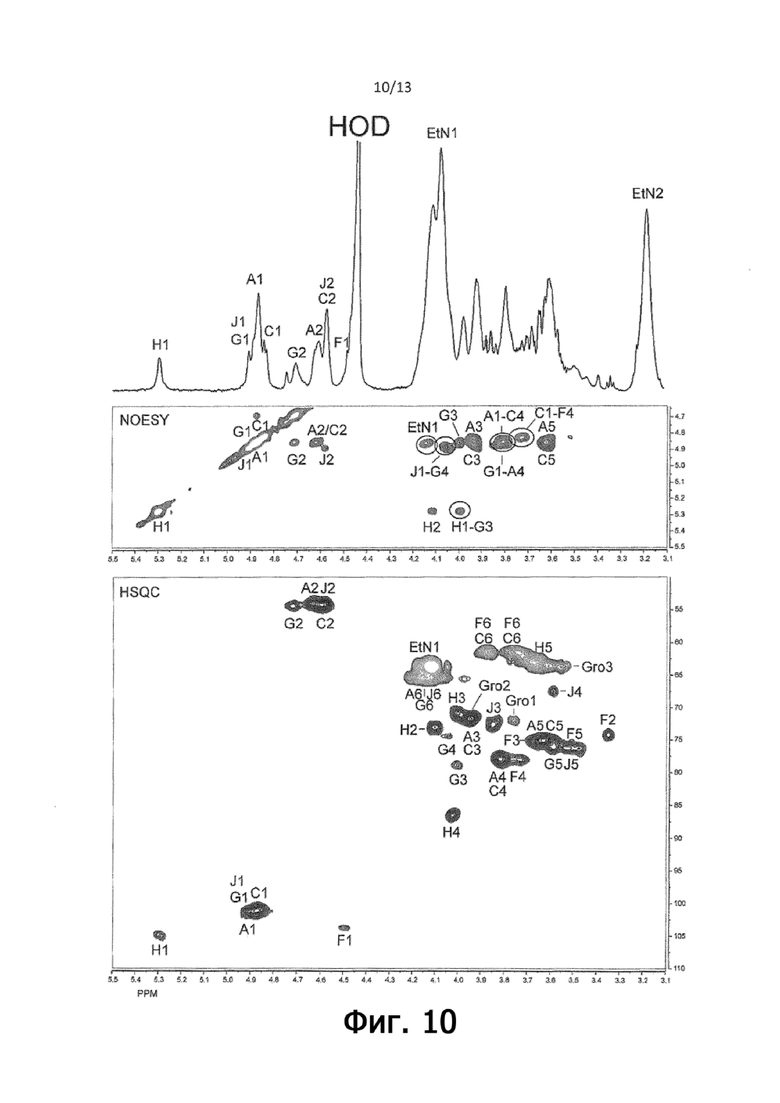
На фигуре 10 показаны данные ЯМР-спектроскопии делипидированного консервативного иммунодоминантного антигена из C. perfringens JGS4143, подтверждающие присутствие полисахарида, состоящего из структуры повторяющихся звеньев поли-ManNAc, модифицированных фосфоэтаноламином, кэпированного на невосстанавливающем конце трисахаридом, модифицированным PETN, и на восстанавливающем конце дисахарид-глицерина формулы III.
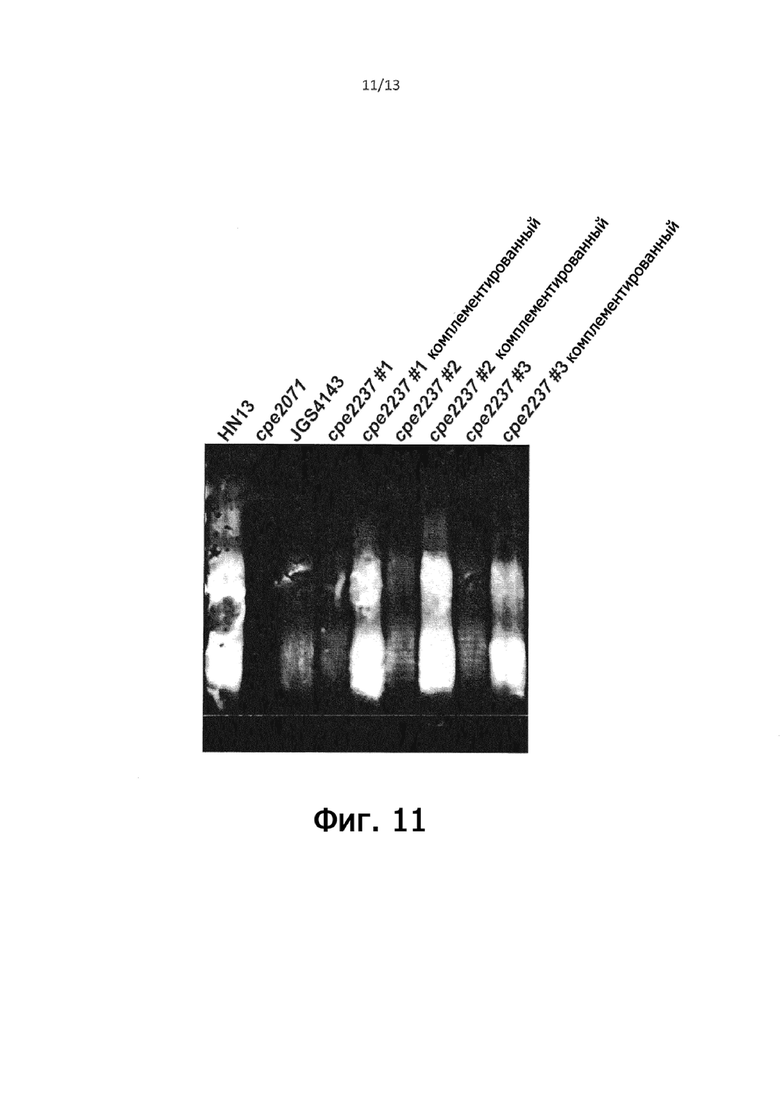
На фигуре 11 показан вестерн-иммуноблот, демонстрирующий, что мутант HN13 cpe2237 C. perfringens, у которого предположительно отсутствует фосфоглицерин, заметно менее иммунореактивен в отношении/к куриной анти-HN13 антисыворотки и что комплементация мутанта с копией гена cpe2237 in trans восстанавливает реактивность мутанта до уровней дикого типа, как показано для трех отдельных изолятов мутанта.
На фигуре 12 показана новая структура повторяющихся звеньев полисахаридных областей перекрестно-реактивного полисахаридного антигена С. perfringens с широким взаимодействием, описанного в формуле I, а также поверхностного перекрестно-реактивного полисахарида с широким взаимодействием из C. perfringens HN13 (формула II).
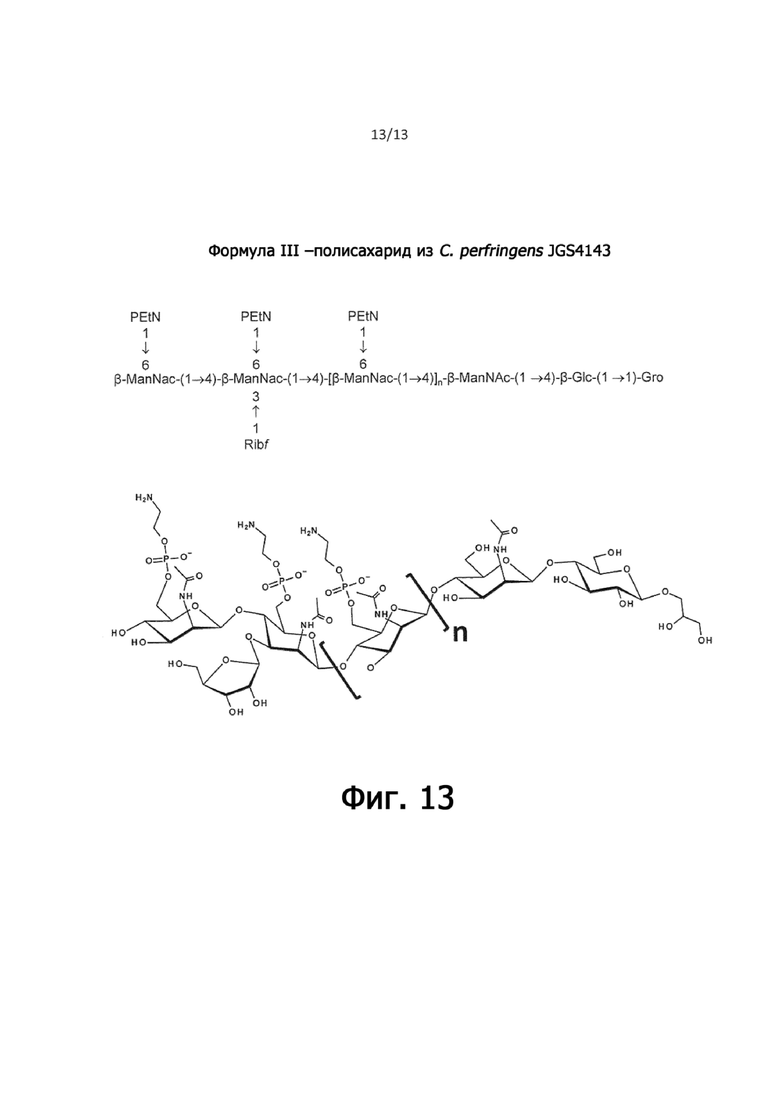
На фигуре 13 показана полисахаридная область полисахаридного антигена из JGS4143 (формула III), которая распознается анти-HN13 (формула II) антисывороткой, но не вызывает широкого перекрестно-реактивного иммунного ответа.
Подробное описание предпочтительного воплощения
Любой термин или выражение, явно не определенные в данном документе, должны иметь общепринятое определение, понятное специалисту в данной области.
Используемый в данном документе термин «гликан» представляет собой полисахаридное или олигосахаридное соединение, состоящее из множества моносахаридов, связанных гликозидной связью, или представляет собой полисахаридную или олигосахаридную часть гликоконъюгата, такого как гликопротеин, гликолипид или протеогликан.
Используемый в данном документе термин «антиген» представляет собой вещество, которое стимулирует выработку антител и может вызывать иммунный ответ. Термины «антиген» и «иммуноген» используются в данном документе взаимозаменяемо, хотя в строгом смысле иммуногены представляют собой вещества, которые вызывают ответ иммунной системы, тогда как антигены определяются как вещества, которые связываются со специфическими антителами. Антиген или его фрагмент может быть молекулой (то есть эпитопом), которая вступает в контакт с конкретным антителом. Когда гликопротеин или его фрагмент используют для иммунизации животного-хозяина, многочисленные области гликопротеина могут индуцировать выработку антител (т.е. вызывать иммунный ответ), которые специфически связываются с антигеном (заданные области или трехмерные структуры на гликопротеине).
Используемый в данном документе термин «модификация» представляет собой заместитель или замену в заместителе. «Заместитель» представляет собой атом или группу атомов, которые замещают атом водорода в химической структуре.
Изобретение относится к иммуногенному гликану со структурой повторяющихся звеньев поли-β-1,4-ManNAc, модифицированным по меньшей мере одним 6-связанным фосфоглицерином. Соответственно, в некоторых воплощениях изобретение может включать соединение, которое содержит соединение гликана формулы I или его иммуногенную часть, или его иммуногенный аналог или модифицированную форму:
 …(I)
…(I)
где n≥1, Glc представляет собой глюкозу, ManNAc представляет собой N-ацетилманнозамин(2-ацетамидо-2,6-дидезоксиманнозу), ManN представляет собой маннозамин(2-амино-2-дезокси-D-маннопиранозу), Gro представляет собой глицерин и где каждый из R1, R2, R3, R4 содержит любую модификацию, такую как ОН, фосфоэтаноламин (PEtN) или фосфоглицерин (PGro), при условии, что по меньшей мере один из R1-R4 представляет собой -PGro, R5 содержит любую модификацию, такую как -ОН, а R6 содержит -H или -Ac. В одном воплощении один R5 в концевой копии повторяющейся структуры может включать сахар, такой как Ribf (рибофураноза).
В некоторых воплощениях гликан включает соединение формулы II или его аналог, или модифицированную форму:
 …(II)
…(II)
где n≥1.
Полагают, что один или несколько антигенных эпитопов соединения формулы I в значительной степени консервативны в изолятах C. perfringens, что подтверждается перекрестной реактивностью антисыворотки, полученной против поверхностного полисахарида C. perfringens HN13 (формула II - фигура 12), который соответствует формуле I (таблица 1; панели A и B на фигуре 3; фигура 12) по сравнению с антигенным эпитопом (эпитопами) поверхностного гликана из C. perfringens JGS4143 (формула III - фигура 12), который не соответствует формуле I. Гликан формулы III распознается антисывороткой против HN13, но вызывает иммунный ответ, который плохо перекрестно реагирует с изолятами C. perfringens (таблица 1, панель C на фигуре 3; фигура 12).
Иммуногенное соединение, аналог или модифицированная форма формулы I или II необязательно связаны или связаны с липидом, одной аминокислотой, олигопептидом, пептидом или белком. Эта отдельная аминокислота может быть аспарагином, серином или треонином.
Консервативная структура формул I или II или их иммуногенные аналоги и их модифицированные формы включают все признаки, идентифицированные в данном документе как необходимые для индукции перекрестно-реактивного иммунного ответа, который распознает широкий спектр штаммов C. perfringens и, по всей вероятности, будет защитным с учетом способности антител против формулы I или II защищать цыплят от смерти, вызванной C. perfringens. Используемый согласно данному документу «аналог» или «модифицированная форма соединения» представляет собой соединение, которое по существу аналогично другому соединению, в котором по меньшей мере один компонент отличается, но которое является функциональным эквивалентом другого соединения. В этом случае аналог или модифицированная форма будет вызывать иммунный ответ, который перекрестно реагирует с соединением формулы I в подходящих условиях, таких как любые из описанных в примерах ниже. Например, гликан формулы III не является аналогом или модифицированной формой гликана формулы I или II, поскольку вызывает иммунный ответ, который плохо перекрестно реагирует с изолятами C. perfringens. В качестве примера, соединение, которое представляет собой аналог или модифицированную форму гликана формулы I или II, вызывающую иммунный ответ, который является реактивным по отношению по меньшей мере к 50% или предпочтительно по меньшей мере к 75% и более предпочтительно, по меньшей мере к 90% полевых изолятов, указанных в таблице 1 ниже.
Любое соединение, описанное или заявленное в настоящем документе, может быть химически конъюгировано с биомолекулой и/или экспрессировано в аттенуированном природном хозяине или гетерологичном хозяине в виде N-гликана, O-гликана, на липиде, на поверхности бактерий или на внешней поверхности мембранных везикул (OMV). Перенос к пептидам может быть опосредован N-OTазой или O-OTазой, коэкспрессируемых с гликаном, биосинтетическими генами и акцепторным пептидом, где перенос может происходить in vivo или in vitro с использованием очищенных компонентов. При конъюгации с липидом, липид может быть выделен и очищен из бактериального, архейного или эукариотического источника или может быть химически синтезирован. Связь гликанового соединения с липидом может быть опосредована через фосфатный, пирофосфатный линкер или через гликозидную связь.
Например, молекула-носитель может быть связана с иммуногенным гликаном ковалентной связью или ионным взаимодействием либо напрямую, либо с использованием линкера. Связывание может быть достигнуто путем химического сшивания, например, тиолового связывания. Белок-носитель или пептид могут быть связаны с гликаном посредством, например, О-связи гликана с остатком треонина в пептиде. Способы связывания гликанов с молекулами-носителями хорошо известны в данной области, как и способы получения гликоконъюгатных вакцин. В некоторых воплощениях конъюгированный с гликаном антиген получают конъюгированием рекомбинантно синтезированного гликана с белком-носителем.
В другом аспекте изобретение может включать вакцину и способ получения вакцины, где способ включает предоставление одного или нескольких гликанов формулы I или II и составление композиции вакцины. Гликан может быть связан с липидом, одной аминокислотой (такой как аспарагин, серин или треонин), олигопептидом, пептидом или белком и/или переноситься на аттенуированную клетку C. perfringens или экспрессироваться на бактерии, сконструированной для гетерологичной экспрессии гликана. Аттенуированные природные хозяева могут включать инактивированные клетки или клетки, сконструированные для удаления одного или нескольких токсинов или других факторов вирулентности (Thompson et al. 2006).
Вакцина представляет собой состав, который можно вводить объекту для индукции гуморального иммунного ответа (включая индукцию ответа растворимых антител) и/или клеточного иммунного ответа (включая индукцию цитотоксического ответа Т-лимфоцитов («CTL»)). Представленные в данном документе вакцины включают иммуногенный гликан и эффективны в индукции иммунного ответа против гликанового антигена. Гликан может быть в очищенной форме или конъюгированным с биомолекулой, или экспрессироваться и выводиться клеткой-хозяином, как описано выше. В результате описанные в данном документе вакцины предназначены для индукции иммунного ответа против C. perfringens и обеспечения защиты от инфекций C. perfringens. Соответственно, вакцина может быть введена любому животному, нуждающемуся в защите от заражения C. perfringens, такому как, без ограничения указанным, домашний скот, такой как крупный рогатый скот, овцы или домашняя птица (индюки, гуси, утки или куры), виды собачьих или кошачьих, или люди.
Вакцины могут дополнительно включать адъювант. Используемый в данном документе термин «адъювант» относится к любому соединению, которое при инъекции вместе с антигеном неспецифически усиливает иммунный ответ на этот антиген. Типичные адъюванты включают полный адъювант Фрейнда, неполный адъювант Фрейнда, адъювант Гербу (GMDP; C.C. Biotech Corp.), адъювант для домашней птицы RIBI (MPL; RIBI Immunochemical Research, Inc.), квасцы калия, фосфат алюминия, гидроксид алюминия, QS21 (Cambridge Biotech), адъювант Titer Max (CytRx), цистинфосфат гуанин (CpG) и адъювант Quil A. Другие соединения, которые могут иметь адъювантные свойства, включают связующие, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза или желатин; эксципиенты, такие как крахмал, лактоза или декстрины, разрыхлители, такие как альгиновая кислота, альгинат натрия, примогель, кукурузный крахмал и т.п.; смазывающие вещества, такие как стеарат магния или стеротекс; глиданты, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин, ароматизатор, такой как мята перечная, метилсалицилат или апельсиновый ароматизатор, и краситель.
Вакцины могут быть приготовлены с использованием фармацевтически приемлемого разбавителя. Типичные «разбавители» включают воду, физиологический солевой раствор, человеческий сывороточный альбумин, масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители, антибактериальные агенты, такие как бензиловый спирт, антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия, хелатирующие агенты, такие как этилен диамин-тетрауксусная кислота, буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования осмолярности, такие как хлорид натрия или декстроза. Типичные «носители» включают жидкие носители (такие как вода, физиологический раствор, культуральная среда, физиологический раствор, водная декстроза и гликоли) и твердые носители (такие как углеводы, например крахмал, глюкоза, лактоза, сахароза и декстраны, антиоксиданты, примером которых является аскорбиновая кислота и глутатион, а также гидролизованные белки.
Вакцины могут включать наполнитель. Термин «эксципиент» относится в данном документе к любому инертному веществу (например, гуммиарабику, сиропу, ланолину, крахмалу и т.д.), которое образует носитель для доставки антигена. Термин эксципиент включает вещества, которые в присутствии достаточного количества жидкости придают композиции качество адгезива, необходимое для приготовления пилюль или таблеток.
Вакцины могут быть лиофилизированы или могут быть в водной форме, например, в виде растворов или суспензиий. Жидкие составы этого типа позволяют вводить композиции непосредственно из их упакованной формы без необходимости восстановления в водной среде и, таким образом, являются идеальными для инъекций. Композиции могут быть представлены во флаконах или в готовых шприцах. Шприцы могут поставляться с иглами или без них. Шприц будет включать одну дозу композиции, тогда как флакон может включать одну дозу или несколько доз (например, 2 дозы).
Если вакцина требует восстановления, предоставляется набор, который может содержать два флакона или один готовый шприц и один флакон, причем содержимое шприца используется для восстановления содержимого флакона перед инъекцией.
Вакцина может быть введена и составлена для введения путем инъекции внутримышечным, внутрибрюшинным, внутрикожным или подкожным путем; или посредством введения через слизистую оболочку в ротовую полость/пищеварительную систему, дыхательные пути (например, интраназальным введением), мочеполовые пути. Хотя вакцину можно вводить в виде одной дозы, ее компоненты также можно вводить вместе в одно и то же время или в разное время. В дополнение к одному пути введения, можно использовать 2 разных пути введения.
В другом аспекте заявки предложен способ иммунизации животного, включающий стадию введения иммунологически эффективного количества вакцины объекту для получения иммунного ответа. В одном воплощении иммунный ответ включает продуцирование бактерицидных антител.
В других воплощениях предлагаются композиции и способы для пассивной иммунизации, содержащие антитело или его антигенсвязывающий фрагмент, специфичные для любого гликана, описанного в настоящем документе, который специфически связывается с гликаном. Используемый в данном документе термин «антитело» относится к любому иммуноглобулину или интактной молекуле, а также к их фрагментам, которые связываются с конкретным антигеном или эпитопом. Такие антитела включают, без ограничения указанным, поликлональные, моноклональные, химерные, гуманизированные, одноцепочечные, фрагменты Fab, Fab', F(ab')2, F(ab)' и/или F(v) части целого антитела и его варианта. В этот термин включены все изотипы, включая IgA, IgD, IgE, IgG и IgM. Используемый в данном документе термин «фрагмент антитела» относится к функционально эквивалентному фрагменту или части антитела, то есть к неполной или выделенной части полной последовательности антитела, которая сохраняет антигенсвязывающую способность (например, специфичность, аффинность и/или селективность) родительского антитела. Как хорошо известно в данной области, состав антител может включать моноклональные или поликлональные антитела.
Термины «специфичный для» или «специфически связывающий» используются взаимозаменяемо для обозначения взаимодействия между антителом и его соответствующим антигеном. Взаимодействие зависит от присутствия конкретной структуры соединения, распознаваемой связывающей молекулой (то есть антигеном или эпитопом). Для того чтобы связывание было специфичным, оно должно включать связывание антителом интересующего эпитопа(ов), а не фоновых антигенов, то есть обладать не более чем небольшой степенью перекрестной реактивности с другими антигенами (такими как другие белки или гликановые структуры, хозяйские клеточные белки и др.). Антитела или их антигенсвязывающие фрагменты, варианты или производные по настоящему изобретению также могут быть описаны или указаны с точки зрения их аффинности связывания с антигеном. Аффинность антитела к антигену может быть определено экспериментально с использованием способов, известных в данной области.
В другом аспекте изобретение может включать диагностические способы для обнаружения присутствия C. perfringens в образце или объекте. В некоторых воплощениях способы обнаружения присутствия C. perfringens у объекта включают получение биологического образца от объекта и анализ образца на присутствие гликана, описанного в данном документе, где присутствие этого гликана в образце указывает на наличие C. perfringens у объекта. В некоторых воплощениях анализ включает иммуноанализ.
Чтобы лучше понять изобретение, описанное в данном документе, приведены следующие примеры. Следует понимать, что эти примеры приведены только для иллюстративных целей. Следовательно, они никоим образом не должны ограничивать объем данного изобретения.
Пример 1
Штаммы Clostridium выращивали при 37°C в анаэробных условиях на анаэробной рабочей станции Whitley DG250 (Don Whitley Scientific, Фредерик, Мэриленд), в которую подавали 5% водорода, 5% CO2, 90% N2) и размножали в бульоне PGY (3% протеозопептон № 3, 2% декстрозы, 1% дрожжевого экстракта, 0,1% тиогликолята натрия) без перемешивания или на агаре PGY (бульон PGY, содержащий 1,5% агара). В таблице 1 перечислены штаммы и изоляты C. perfringens и их производные.
Таблица 1. Штаммы C. perfringens
Источник
Цельноклеточные лизаты C. perfringens, HN13, JGS4143 и SM101 получали для электрофореза в SDS-полиакриламидном геле (SDS-PAGE) и вестерн-иммуноблот-анализа следующим образом: штаммы высевали из запасов, хранимых при -80°С, на чашки с агаром PGY (с соответствующими антибиотиками) и выращивали в течение ночи. Для каждого штамма использовали одну колонию для инокуляции в 10 мл бульона PGY, которой давали возможность расти в течение 6 часов, которую собирали центрифугированием (13 000 × g, 10 минут), промывали фосфатно-солевым буфером (PBS) и ресуспендировали в PBS до OD600нм = 2,0. Клетки из 1 мл собирали центрифугированием, как указано выше, ресуспендировали в 100 мкл PBS и инкубировали с 2 мг мл-1 лизоцима при 37°С в течение 1 часа. Каждый образец объединяли с 67 мкл 4х буфера для образцов SDS-PAGE (Laemmli (1970)), нагревали до 95°С в течение 10 минут, давали остыть и затем анализировали с помощью SDS-PAGE по методу Laemmli (Laemmli (1970)) или инкубировали с 0,5 мг мл-1 протеиназы К при 55°С в течение 1 ч до анализа SDS-PAGE. После электрофореза образцы переносили электрофоретически на 0,2 мкм нитроцеллюлозную мембрану (Bio-Rad Laboratories Canada, Миссиссога, Онтарио) и подвергали вестерн-иммуноблот анализу (Burnette (1981)) с использованием поликлональной кроличьей антисыворотки, полученной против целых клеток C. perfringens HN13 (Dr SG Melville, Virginia Tech) в качестве первичного антитела (разведение 1:1000), и козьих анти-кроличьих IgG IRDye 680RD (LI-COR Biosciences, Линкольн, Небраска) в качестве вторичного антитела (1:15000), и визуализировали на инфракрасной системе визуализации LI-COR Odyssey (LI-COR Biosciences).
На фигуре 1 показан вестерн-иммуноблот лизатов цельных клеток штаммов C. perfringens HN13, JGS4143 и SM101 с использованием кроличьей антисыворотки, которую получали против цельных клеток C. perfringens HN13.
Реактивность у всех штаммов была одинаковой, с большим антигенным «шмером» и несколькими полосами с высокой молекулярной массой, независимо от обработки лизоцимом. Обработка протеиназой K приводила к потере нескольких высокомолекулярных полос, но большая реакционная способность «шмера» не изменялась, что указывает на то, что респонсивный антиген основан не на белке, что наводит на мысль, что антиген представляет собой полисахаридную, гликолипидную или липидную молекулу.
Таким образом, представляется, что C. perfringens, вероятно, продуцирует небелковую антигенную молекулу, которая доминирует в иммунном ответе.
Пример 2
Фигура 2 изображает анти-С. perfringens вестерн-иммуноблот цельноклеточных лизатов HN13 с обработкой протеиназой K и без нее, четырех разных мутантов по гликозилтрансферазе с транспозоном и мутанта по гликозилтрансферазе cpe2071, дополненного плазмидным геном cpe2071 (полученным, как описано в Примере 1). Цельноклеточные лизаты четырех мутантов по гликозилтрансферазы (выделенных из ранее описанной библиотеки с транспозонами C. perfringens HN13 (Liu et al. (2013)) проанализировали с помощью вестерн-иммуноблоттинга, при этом лизаты мутанта с нарушенным геном cpe2071 (штамм HLL8) не содержали антиген, устойчивый к протеиназе К, наблюдаемый в штамме дикого типа. Комплементация этого мутанта плазмидной копией гена cpe2071 привела к восстановлению резистентного к протеиназе K антигена, что подтверждает, что потеря этого антигена в мутанте cpe2071 была вызвана нарушением гена cpe2071. Учитывая, что cpe2071 кодирует полисахарид, а антиген устойчив к протеиназе К, антиген представляет собой либо полисахарид, либо содержащий полисахарид гликолипид.
Таким образом, согласно этому примеру, представляется, что иммунодоминантный поверхностный антиген C. perfringens, вероятно, представляет собой полисахарид или гликолипид с полисахаридным компонентом.
Пример 3
Клетки C. perfringens HN13 и JGS4143, фиксированные в формалине, получали следующим образом для внутримышечной (в.м.) инъекции курам. Клетки выращивали в течение ночи на чашках с PGY-агаром, как описано в Примере 1. Клетки из одного планшета собирали и ресуспендировали в 10 мл PBS, осаждали центрифугированием, ресуспендировали в 10 мл PBS, содержащем 1% (об./об.) формалина, и инкубировали при 4°C в течение 2 часов. Клетки промывали 4 раза в 2 мл PBS для удаления формалина и ресуспендировали в PBS до OD600нм 1,0. Суспензию клеток смешивали 1:1 либо с полным адъювантом Фрейнда (FCA, праймирующая инъекция), либо с неполным адъювантом Фрейнда (FIA, бустерная инъекция). Праймирующие инъекции (150 мкл × 2, в.м. в мышцу грудной железы) вводили бройлерам в 7-дневном возрасте, после чего вводили бустерные инъекции (150 мкл × 2, в.м. в мышцу грудной железы) в возрасте 21 дня. Кур забивали на 35 день и обескровливали. Крови позволяли сворачиваться при комнатной температуре в течение ночи, и на следующий день образцы центрифугировали при 13 000 g, а сыворотку отсасывали пипеткой и хранили при 4°C.
В общей сложности 32 полевых изолята C. perfringens получили от доктора Джона Прескотта (Университет Гуэлф, Гуэлф, Онтарио, Канада), состоящего из изолятов как от здоровых, так и от NE-цыплят, охватывающих ряд типов последовательностей (ST) мультилокусного секвенирования, а также два штамма, выделенных из некуриных инфекций (NE лошадей и собачий геморрагический гастроэнтерит) (таблица 1).
Цельноклеточные лизаты C. perfringens для электрофореза в SDS-полиакриламидном геле (SDS-PAGE) и вестерн-иммуноблот анализа готовили путем кипячения клеток в буфере SDS-PAGE, обработки протеиназой K и кипячения в буфере SDS-PAGE (как описано в Примере 1), затем разделяли с помощью SDS-PAGE и анализировали с помощью вестерн-иммуноблоттинга с использованием кроличьей анти-С. perfringens антисыворотки (которая была получена против C. perfringens HN13), а также куриной анти-C. perfringens антисыворотки против C. perfringens HN13 и JGS4143 (описано выше). Для удаления нежелательных сигналов от антигенов, отличных от представляющего интерес гликана, антисыворотки кролика и курицы, полученные против C. perfringens HN13, адсорбировали против целых клеток мутанта C. perfringens HN13 cpe2071 (штамм HLL8), который не продуцирует гликан, представляющий интерес. Куриную антисыворотку, полученную против C. perfringens JGS4143, использовали без какой-либо стадии адсорбции, так как на этом фоне не доступно ни одного гликан-минус мутанта. Адсорбцию проводили следующим образом: C. perfringens HN13 cpe2071 выращивали, как описано для лизатов цельных клеток, промывали PBS и доводили до OD600нм = 1,0 в PBS, осаждали центрифугированием аликвоты 4 × 1 мл, как описано выше. Первую аликвоту ресуспендировали в 100 мкл кроличьей или куриной анти-С. perfringens антисыворотки к HN13, инкубировали при комнатной температуре в течение 1 ч, осаждали центрифугированием и декантировали надосадочную жидкость. Этот процесс повторяли последовательно для каждой из 3 оставшихся аликвот клеток, используя надосадочную жидкость из предыдущего раунда для ресуспендирования клеток. Эту адсорбированную антисыворотку использовали в качестве первичного антитела, а козьи анти-кроличьи IgG IRDye 680RD использовали в качестве вторичного антитела, как описано в Примере 1.
На фигуре 3 изображены вестерн-иммуноблоты цельноклеточных лизатов полевых изолятов C. perfringens против JGS4143 и HN13 (+ve контроли) и мутанта HN13 cpe2071 (-ve контроль) с использованием адсорбированных кроличьих и куриных анти-C. perfringens HN13, а также неадсорбированной анти-С. perfringens JGS4143 антисывороток. Как для кроличьей, так и для куриной антисывороток, полученных против C. perfringens HN13, все штаммы проявляли реактивность, сходную с HN13 и JGS4143, что указывает на то, что эти штаммы продуцируют сходный или очень похожий гликан по сравнению с C. perfringens HN13. Следует отметить, что реактивность, соответствующая гликану, представляющему интерес, наблюдалась у полевых изолятов как NE, так и здоровых кур, а также конского NE (JP55) и изолята собачьего геморрагического гастроэнтерита (JP838), что указывает на то, что гликан, представляющий интерес, присутствует на изолятах C. perfringens независимо от вида хозяина или состояния болезни животных-хозяев. Напротив, куриная антисыворотка, полученная против C. perfringens JGS4143, была реактивной как с контролями лизата HN13, так и с JGS4143, но только 5 из полевых изолятов показали реактивность, при этом 3 изолята (20, 21 и 149) показали умеренную реактивность и еще 2 полевых изолята (10 и 11) оказались только слабо реактивными.
Таким образом, представляется, что поверхностный полисахаридный антиген из C. perfringens HN13 является конкретным примером гликана, соответствующего формуле I в настоящем документе (фигура 12), и является либо широко консервативным, либо имеет один или несколько эпитопов, которые вызывают широко перекрестно-реактивный иммунный ответ, в то время как поверхностный полисахаридный антиген из C. perfringens JGS4143 (фигура 12) является гораздо менее перекрестно-реактивными в типичных полевых изолятах C. perfringens.
Пример 4
Обработанные протеиназой К клеточные лизаты Clostridium cocleatum, Clostridium perfringens и Clostridium symbiosum получали таким же способом, который описан для клеточных лизатов C. perfringens в Примере 1. Не-C. perfringens лизаты, наряду с лизатами JGS4143 и HN13 в качестве положительных контролей и мутантным лизатом hpe13 cpe2071 в качестве отрицательного контроля, разделяли с помощью SDS-PAGE и анализировали с помощью вестерн-иммуноблоттинга с использованием кроличьей анти-C. perfringens антисыворотки, адсорбированной на цельных клетках мутанта C. perfringens HN13 cpe2071, как описано в Примере 3.
Фигура 4 изображает вестерн-иммуноблоты лизатов цельных клеток репрезентативных штаммов C. cocleatum, C. perfringens и C. symbiosum относительно JGS4143 и HN13 (+ve контроли) и мутанта HN13 cpe2071 (-ve контроль) с использованием анти-C. perfringens кроличьей антисыворотки, адсорбированной на цельных клетках мутанта HN13 cpe2071. Ни один из не-C. perfringens лизатов не продемонстрировал реактивность, соответствующую гликану, представляющему интерес, что указывает на то, что консервативный антиген C. perfringens не присутствует в этих родственных штаммах Clostridium.
Таким образом, в соответствии с этим примером представляется, что консервативный антиген C. perfringens, по-видимому, отсутствует у других видов Clostridium.
Пример 5
В экспериментах по пассивной защите цыплят-леггорнов в возрасте 1 дня заражали C. perfringens в присутствие и в отсутствие куриной анти-C. perfringens антисыворотки следующим образом. Для приготовления растворов для перорального зондового введения куриный штамм NE C. perfringens JGS4143 наносили на агар с PGY за день до зондового введения (день 0) и выращивали в течение ночи, как описано выше. В день принудительного кормления (день 1) клетки собирали в PBS, осаждали центрифугированием при 13000 g в течение 30 минут и дважды промывали PBS. Промытый клеточный осадок ресуспендировали до ~ 3,7 × 109 клеток на мл в PBS и отдельно готовили в разведении 1/10 высоко перекрестно-реактивной куриной анти-C. perfringens антисыворотки HN13 в PBS. Затем суспензию клеток C. perfringens JGS4143 смешивали 9:1 либо с PBS, либо с разведенной куриной анти-C. perfringens антисывороткой непосредственно перед зондовым введением, в зависимости от ситуации. Всего 9 птицам перорально вводили 300 мкл смеси C. perfringens/PBS без антисыворотки (1 × 109 клеток), 9 птицам перорально вводили 300 мкл смеси C. perfringens/PBS, содержащей антисыворотку (1 × 109 клеток) и 5 птицам перорально вводили только PBS в качестве контроля, и смертность птиц контролировали в течение 7 дней.
На фигуре 5 изображен процент выживания птиц в группах, которым перорально принудительно вводили C. perfringens JGS4143 отдельно, и совместно принудительно вводили JGS4143 с разведенной в соотношении 1:100 анти-С. perfringens антисывороткой. Через семь дней после принудительного введения выжило 100% птиц, которым перорально зондом вводили только PBS (не показано), только 22% выживших (2 из 9 птиц) наблюдали в группе, которой вводили только C. perfringens, и выживаемость 89% (8 из 9 птиц) наблюдалась в группе, которым совместно вводили С. perfringens и 1:100 анти-С. perfringens антисыворотки.
Пример 6
Для анализа опсонофагоцитоза клетки C. perfringens JGS4143 инкубировали с гепаринизированной куриной кровью и либо с наивной куриной сывороткой, либо с анти-С. perfringens HN13 антисывороткой в соответствии со способом, ранее описанным Goyette-Desjardins et al (2016) с модификациями, следующим образом. Чтобы подготовить бактериальные клетки для этого анализа, куриный штамм NE C. perfringens JGS4143 высевали на агаре PGY за день до забоя 5-недельного цыпленка-бройлера (день 34) в качестве источника свежей куриной крови и выращивали в течение ночи как описано выше. В день забоя и отбора крови (день 35) клетки собирали в PBS, осаждали центрифугированием при 13000×g в течение 30 минут и дважды промывали PBS. Промытый осадок клеток ресуспендировали до ~ 2,9×105 клеток на мл в среде RPMI 1640 с добавлением 5% инактивированной нагреванием куриной сыворотки, 10 мМ HEPES, 2 мМ L-глутамина и 50 М-меркаптоэтанола, и собирали кровь у одной отобранной курицы в пробирке с гепариновым покрытием для предотвращения коагуляции. Гепаринизированную кровь разводили 1/3 в обогащенной RPMI 1640, указанной выше. Разбавленную кровь (50 мкл) объединяли с 40 мкл либо наивной куриной сыворотки, либо куриной анти-С. perfringens HN13 антисыворотки в микропробирке с последующим добавлением 10 мкл суспензии C. perfringens JGS4143, что дает приблизительное значение MOI 0,015 для 2,9×103 бактериальных клеток в реакции и расчетное содержание лейкоцитов состовляло 1,9×105 лейкоцитов на основании литературных значений лейкоцитов в крови цыплят-бройлеров (Orawan and Aengwanich (2007)). Верхнюю часть пробирок прокалывали, используя стерильную иглу 25 калибра, и затем помещали в инкубатор с 5% CO2 при 37°C на 2 часа, после чего каждую реакцию объединяли с 80% стерильным глицерином и инкубировали при -80°C до готовности к рассеванию. Для подсчета клеток в каждой реакции образцы оттаивали на льду и 100 мкл аликвот 10-кратных серийных разведений высевали на агар PGY и инкубировали в анаэробных условиях в течение 18 часов. Процент уничтожения бактерий рассчитывали, используя следующую формулу: % убитых бактерий = [(количество клеток в реакции наивной куриной сыворотки - количество клеток, выделенных в реакции, представляющей интерес)/(количество клеток в реакции наивной куриной сыворотки)] ×100.
На фигуре 6 показан процент бактериального уничтожения, наблюдаемый в реакциях анализа на опсонофагоцитоз, содержащих куриную анти-С. perfringens HN13 антисыворотку с наблюдаемым медианным % бактериального уничтожения C. perfringens JGS4143, составляющим 29,5% с этой сывороткой.
Пример 7
Для экспериментов ЯМР штаммы Clostridium выращивали в бульоне PGY при 37°С с перемешиванием при 50 об/мин в ферментере BioFlo 115 (Eppendorf, Миссиссога, Онтарио), в который подавали N2 при скорости потока 1 л/мин. Среду предварительно нагревали и кондиционировали N2 в течение 1 часа до инокуляции 40 мл бульонной культурой в течение ночи. При необходимости в среду добавляли 30 мкг мл-1 эритромицина (Em).
Полисахарид из C. perfringens экстрагировали и очищали из 10-литровых ферментных культур C. perfringens HN13 и JGS4143 следующим образом: культуры инокулировали 40 мл ночной культуры и давали расти 6 ч (~ OD 2,0) перед сбором центрифугированием (13000 × g, 30 мин). Клетки промывали один раз PBS, ресуспендировали в 400 мл воды MilliQ и кипятили в течение 30 минут при перемешивании на горячей плите. Смесь охлаждали, клетки осаждали центрифугированием (как указано выше), надосадочную жидкость удаляли и осадок подвергали экстракции фенолом:горячей водой по способу Westphal и Jann (1965) с модификациями. Осадок ресуспендировали в 200 мл солевого раствора (125 мМ NaCl) и объединяли с 200 мл расплавленного фенола, предварительно нагретого на водяной бане при 70°С, и смесь инкубировали при перемешивании в течение 1 часа. Смесь охлаждали на льду, центрифугировали (13000 × g в течение 30 минут), чтобы отделить водную и фенольную фазы, и фенольную фазу диализовали против водопроводной воды в течение 5 дней и затем лиофилизировали. Лиофилизированный образец ресуспендировали в 100 мл воды MilliQ, подвергали центрифугированию при 13000 × g в течение 30 минут и затем помещали в ультрацентрифугу на 16 часов. После удаления надосадочной жидкости прозрачный осадок снова ресуспендировали в воде MilliQ и повторно переосаждали ультрацентрифугированием (как описано выше) для удаления остаточных следов надосадочной жидкости, ресуспендировали в 20 мл MilliQ и лиофилизировали. Выделенные соединения, использованные для ЯМР, сравнивали с устойчивыми к протеиназе К антигенными молекулами, как это наблюдалось на вестерн-иммуноблотах.
Фигура 7 изображает вестерн-иммуноблот очищенных антигенов по сравнению с расщепленными протеиназой К цельноклеточными лизатами HN13 и JGS4143 (+ve контроли) и мутантом HN13 cpe2071 (-ve контроль) с использованием кроличьей антисыворотки, полученной против C. perfringens HN13.
Анализ гликозильного состава очищенных поверхностных полисахаридов из C. perfringens HN13 и JGS4143
Состав гликолипидов, выделенных из этих двух штаммов (как описано выше), определяли комбинированной газовой хроматографией/масс-спектрометрией (GC-MS) пер-O-триметилсилильных производных моносахаридметилгликозидов, полученных кислотным метанолизом образцов, как описано Santander et al. (2013). Вкратце, лиофилизированные гликолипиды HN13 и JGS4143 нагревали с метанольной HCl в герметичной стеклянной пробирке с завинчивающейся крышкой в течение 18 часов при 80°C. После охлаждения и удаления растворителя в потоке азота образцы обрабатывали смесью метанола, пиридина и уксусного ангидрида в течение 30 минут. Растворители выпаривали и образцы дериватизировали с помощью Tri-Sil® (Pierce) при 80°C в течение 30 минут. GC/MS-анализ TMS метилгликозидов проводили на GC Agilent 7890A, сопряженном с MSD 5975C, с использованием капиллярной колонки из плавленого кварца Supelco Equity-1 (внутренний диаметр 30 м х 0,25 мм).
Анализ гликозильной композиции показал, что полисахарид HN13 содержит глицерин (Gro), глюкозу (Glc), следы N-ацетилманнозамина (ManNAc) и жирные кислоты: C20, C18, C16 и C14. Полисахарид JG4143 содержит рибозу (Rib), глюкозу (Glc), следы N-ацетилманнозамина (ManNAc) и жирные кислоты: C20, C18 и C16. Как показано и описано ниже, основным гликозильным остатком в гликолипиде является ManNAc, однако при использовании этого способа он в основном не наблюдается, поскольку большинство этих остатков замещено фосфоэтаноламином или фосфоглицерином (см. ниже).
Для приготовления образцов для ЯМР-спектроскопии все очищенные гликолипиды деацилировали следующим образом: лиофилизированные образцы растворяли в концентрированном NH4OH, инкубировали при 80°С в течение 1 часа, давали остыть и лиофилизировали. Лиофилизированный материал растворяли в дистиллированной воде и фракционировали на колонке BioGel P6, используя деионизированную воду в качестве элюента. Фракции собирали на основании отклика детектора показателя преломления, лиофилизировали и затем промывали 3 раза дихлорметаном для полного удаления свободных жирных кислот из образцов.
Для всех экспериментов по ЯМР лиофилизированные образцы растворяли в 0,2 мл D2O и переносили в пробирку 3 мм OD NMR. 1D-протонные спектры получали при 25°C со стандартным подавлением сигнала растворителя «Presat» на спектрометре Varian 600 МГц, оборудованном 3-миллиметровым холодным зондом (Varian, Inova Пало-Алто, Калифорния). Все спектры были получены с использованием стандартных последовательностей импульсов Varian. Данные ЯМР были обработаны с использованием программного обеспечения MNova (Mestrelab Research, Испания). Спектры привязывали относительно сигнала DSS (δH=0 ppm; δC=0 ppm).
ЯМР-спектроскопия поверхностного углевода из C. perfringens HN13:
Делипидированный полисахарид HN13 анализировали с помощью 1D/2D ЯМР-спектроскопии; анализов протонов, HSQC, COSY, TOCSY и NOESY. Это позволило определить протонные и углеродные химические сдвиги по каждому остатку, а также определить их связи, последовательность и положения замещения заместителей PEtN и PGro. Установленные химические сдвиги приведены в таблице 2 ниже.
Таблица 2
1Н и 13С ЯМР химические сдвиги полисахарида HN13, записанные в D2O при 30°С
101,1
54,0
71,7
77,9
74,9
65,4
101,1
54,1
71,7
77,9
74,9
65,4
63,3
41,4
67,6
71,7
63,4
Фигура 8 изображает спектры 1Н ЯМР, NOESY (200 мс) и gHSQC (D2O, 30С) деацилированного полисахарида из Clostridium perfringens HN13.
Спектр 1Н ЯМР (фигура 8, вверху) содержит два аномерных сигнала при δ 4,87 (остаток А) и δ 4,84 (остаток В) в соотношении 3:1, которые оба были обусловлены остатками β-ManpNAc, что показано их соответствующим химическим сдвигом в сторону слабого поля H-2, δ 4,61 и δ 4,58, и химическими сдвигами C-2 при δ 54,0 и 54,1 (фигура 3, посередине и снизу). Сигнал сильного поля при δ 2,06 установили группам NAc, присоединенным к С-2 каждого остатка ManNAc. Сильные взаимодействия между остатками NOE (фигура 3, посередине) между H-1 и H-3 и между H-1 и H-5 подтверждают β-конфигурацию этих остатков. Все остатки ManNAc были связаны (1 → 4) связями и были замещены в O-6 PEtN (остаток A) или PGro (остаток B). 4- и 6-замещение остатков A и B, соответственно, подтверждается химическими сдвигами 13C (фигура 8, внизу; таблица 2): A C-4 δ 77,9, A C-6 δ 65,4, B C-4 δ 77,9, B C-6 δ 65,4. Тот факт, что концевой остаток не наблюдался, указывает на то, что полисахарид имеет высокую молекулярную массу.
Чтобы получить больше информации о структуре, полисахарид HN13 дефосфорилировали путем растворения лиофилизированного делипидированного образца в 48% HF и инкубировали при 4°С в течение 48 часов с последующим выпариванием образца на льду и повторной лиофилизацией. Полученную смесь продуктов подвергали эксклюзионной хроматографии на колонке Bio-Gel P6 и получали две фракции, обозначенные F1 и F2. 1D/2D ЯМР-анализ позволил оценить протоны и атомы углеродов остатков обоих F1 и F2, а также связи и последовательности этих остатков (фигура 9; таблица 3).
Таблица 3
1Н и 13С ЯМР химические сдвиги дефосфорилированного полисахарида HN13 (фракция F1-F2), записанные в D2O при 25°C
100,6
54,0
71,6
77,3
76,3
61,1
100,6
54,4
73,0
67,8
77,7
61,5
97,6
55,2
69,4
76,6
75,9
61,1
103,5
74,1
74,9
79,1
75,6
61,1
72,0
71,9
63,5
* Фракция F1 содержала только эти химические сдвиги.
На фигуре 9 представлены 1H ЯМР-спектры (D2O, 25C) фракций F1 и F2, полученных с помощью хроматографии на Bio-Gel P6 дефосфорилированного полисахарида HN13. Эти данные показывают, что основа дефосфорилированного полисахарида F1 содержит только линейные цепи β-4-связанных остатков ManNAc (C). Все группы PEtN или PGro были удалены обработкой HF. 1D/2D ЯМР анализ низкомолекулярной фракции (F2) показал, что полисахарид HN13 имеет компонент →4)-β-ManN-(1→4)-β-Glc-(1→1)-Gro на своем восстанавливающем конце, за которым следуют β-4-связанные остатки ManNAc. Анализ MALDI-TOF-MS вместе с приведенными выше данными ЯМР подтвердил, что фракция F2 содержала вышеуказанный трисахаридный компонент с последующим последовательным удлинением с помощью β-4-связанных остатков ManNAc (таблица 4).
Таблица 4
Наблюдаемые массы и предлагаемые составы для ионов, полученные с помощью режима детекции положительно заряженных ионов фракции F2 Биогеля P6.
В совокупности эти данные показывают, что полисахарид HN13 состоит из полимера из повторяющихся остатков ManNac, модифицированного PGro или PEtN в соотношении 1:3, связанного с ManN-Glc-Gro на восстанавливающем конце (фигура 12), со структурой формулы II (показано выше).
ЯМР-спектроскопия поверхностного углевода из C. perfringens JGS4143:
Анализ 1D и 2D ЯМР (как описано для полисахарида HN13) позволил полностью распределить протоны и углероды для этих остатков (фигура 10; Таблица 5).
На фигуре 10 изображены спектры 1H ЯМР, NOESY (200 мс) и gHSQC (D2O, 60°C). Спектр 1H ЯМР полисахарида JGS4143 показал наличие спиновых систем, относящихся к: →4)-β-ManpNAcPEtN-(1→ (остаток A); →4)-β-ManpNAc-(1→ (остаток C); →4)-β-Glcp-(1→ (остаток F); →3,4)-β-ManpNAcPEtN-(1→ (остаток G); T-α-Ribf-(1→ (остаток H); T-β-ManpNAcPEtN-(1→ (остаток J)).
Таблица 5
Химические сдвиги ЯМР 1H и 13C полисахарида JGS4143, записанные в D2O при 60°C
101,1
54,0
71,7
77,9
74,9
65,2
100,7
54,0
71,6
77,9
76,1
61,2
103,4
73,9
74,8
77,8
76,1
61,2
100,8
54,0
78,6
74,1
75,0
65,2
104,6
72,8
70,5
86,2
62,6
101,1
54,3
72,8
67,4
76,2
65,2
71,7
71,7
63,5
63,4
41,4
Эти данные, в отличие от данных для полисахарида HN13, позволили идентифицировать концевой остаток ManNAc, а также компонент -4)-β-Glcp-(1→1)-Gro восстанавливающего конца. Сравнение этих данных ЯМР с данными для полисахарида HN13 (описанного выше) показало, что молекула представляла собой олигосахарид с β-4-связанным ManNAc-каркасом, который был в значительной степени замещен PEtN, как и в случае полисахарида HN13, но значительно отличалась от полисахарида HN13 в том смысле, что она лишена PGro и содержала α-Ribf, замещенный в O-3 одним из остатков ManNAc.
Эти данные указывают на то, что полисахарид JGS4143 состоит из полимера повторяющихся остатков ManNac, модифицированного PEtN и связанного с ManN-Glc-Gro на восстанавливающем конце, аналогично полисахариду HN13, но лишенного модификаций PGro, наблюдаемых в полисахариде HN13 и имеющем дополнительный разветвленный остаток α-Ribf в O-3 на остатке ManNAc, проксимальном к концевому остатку ManNAcPEtN (фигура 12), со структурой формулы III.
В совокупности эти данные указывают на то, что штаммы C. perfringens продуцируют общий класс поверхностных полисахаридов и что поверхностный полисахарид из C. perfringens HN13 представляет собой гликолипид с длинной полисахаридной цепью со структурой с повторяющимися звеньями из 1,4-связанного ManNAc, модифицированного с PGro или PEtN в соотношении 1:3, который содержит один или несколько эпитопов, общих для всех штаммов C. perfringens, протестированных на сегодняшний день. Напротив, C. perfringens JGS4143 продуцирует родственный гликолипид, который фракционируется аналогичным образом, и чья полисахаридная основа также является полимером из 1,4-связанных остатков ManNAc, модифицированных PEtN, но отличается от гликана HN13, главным образом, отсутствием модификаций PGro и более короткой длиной полимера.
Способность гликана HN13 вызывать иммунный ответ (как у кроликов, так и у кур), который широко перекрестно-реактивен ко всем протестированным полевым изолятам C. perfringens, в отличие от не перекрестно-реактивного гликана JGS (вызывающего иммунный ответ у кур, который является только перекрестно-реактивным с ~ 16% протестированных полевых изолятов), с учетом структурных особенностей выявленных структур для обоих гликанов, предполагает, что широко перекрестно-реактивный иммунный ответ на HN13 зависит, по меньшей мере, от наличия по меньшей мере одной модификации PGro и, возможно, отсутствие пентозы (α-Ribf), наблюдаемой в JGS4143.
Пример 8
Для получения мутанта C. perfringens HN13, в котором отсутствует фосфоглицериновый фрагмент, предполагаемые гены фосфоглицеролтрансферазы были идентифицированы путем исследования генома штамма 13 C. perfringens (taxid: 195102) на предмет генов, аннотированных для потенциальной роли в биосинтезе LTA или переносе фосфоглицерина с последующим анализом консервативных доменов кодированных генных продуктов (с использованием функции CD-поиска NCBI [https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi]), путем прогнозирования трансмембранных спиралей и ориентации в отношении мембраны (через сервер TMHMM [http://www.cbs.dtu.dk/services/TMHMM/]). Затем эти результаты сравнивались с результатами, полученными для известных фосфоглицерин- или фосфоэтаноламинтрансфераз (LtaS из Staphylococcus aureus [c2w5tA], Lpt3 [NMB2010] и Ltp6 [NMA0408] из Neisseria meningitidis, EptB из E.coli [NC_1000] и Lt3 из E. coli [NC_000]. из Haemophilus influenzae Rd [HI0275]), в результате чего были идентифицированы четыре гена с общими признаками. В Protein Homology/analogY Recognition Engine V2.0 (Phyre2; http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index) при анализе кандидатного генного продукта cep2237 во главе результатов оказалась фосфоглицеролтрансфераза LtaS, участвующая в биосинтезе липотейхоевой кислоты. Хромосомную делецию cpe2237 проводили в соответствии со способом Nariya et al. (2011), и вестерн-иммуноблот анализы лизатов цельных клеток (как описано в Примере 4) выявили, что утрата cpe2237 соответствовала сниженной реактивности с куриной анти-HN13 антисывороткой, но соответствовала повышенной реактивности с куриной анти-JGS4143 сывороткой. Отрицательное окрашивание лизатов дикого типа и мутантных лизатов (по методу Castellanos-Serra and Hardy (2006)) подтвердило, что эти результаты не были обусловлены различиями в количестве иммуногенного гликолипида, продуцируемого между диким типом и мутантом, и комплементация мутанта с помощью копии гена cpe2237 in trans (с использованием pKRAH1) восстановила реактивность в отношении обеих антисывороток до уровней дикого типа.
Постулируется, что ген cpe2237 является фосфоглицеролтрансферазой и что иммуногенный гликолипид в этом мутанте, следовательно, лишен модификаций PGro. Это приводит к потере сигналов, соответствующих PGro, в анализах ЯМР (например, 1H-13C HSQC и/или TOCSY, 1H-31P HSQC) как очищенного иммуногенного гликолипида из мутанта (описанного в Примере №), так и в HR-MAS-анализах целых клеток (как описано van Alphen et al (2014)). Также ожидается, что потеря PGro приведет к дифференциальному связыванию с человеческим интелектином-1 (hItln1), который, как сообщается, распознает глицеролфосфатные группы на бактериальных полисахаридных структурах (Wesener et al (2015)). Это делается либо путем проведения вестерн-иммуноблотинга цельноклеточных лизатов как Примере 3 с использованием hItln1 вместо первичного антитела и флуоресцентно меченного вторичного антитела против hItln1, либос помощью микроскопии целых клеток с использованием флуоресцентно меченного hItln1. Потеря PGro, коррелирующая со сниженной реактивностью к антисыворотке против HN13, указывает на то, что PGro является важным эпитопом, который вносит вклад в иммунный ответ на HN13, и подтверждает предположение, что PGro является важным эпитопом для вызова широко перекрестно-реактивного иммунного ответа иммунодоминантным гликолипидом.
Из описанного таким образом будет очевидно, что его можно варьировать разными путями. Такие изменения не должны рассматриваться как отклонение от сущности и объема изобретения, и все такие модификации, которые будут очевидны для специалиста в данной области техники, предназначены для включения в объем формулы изобретения, представленной ниже.
Толкование
Ссылки в описании на «одно воплощение», «воплощение» и т.д. указывают на то, что описанное воплощение может включать конкретный аспект, признак, структуру или характеристику, но не каждое воплощение обязательно включает этот аспект, признак, структуру или характеристику. Кроме того, такие фразы могут, но не обязательно, относиться к тому же воплощению, которое упоминается в других частях описания. Кроме того, когда конкретный аспект, признак, структура или характеристика описаны в связи с воплощением, специалисту в данной области техники известно, как повлиять или связать такой модуль, аспект, функцию, структуру или характеристику с другими воплощениями, явно или не явно описанными. Другими словами, любой модуль, элемент или признак может быть объединен с любым другим элементом или признаком в различных воплощениях, если нет явной или неотъемлемой несовместимости, или это специально не исключено.
В дальнейшем отмечается, что формула изобретения может быть изменена для исключения любого необязательного элемента. По существу, это утверждение предназначено служить в качестве отправной точки для применения такой исключающей терминологии, такой как «исключительно», «только» и т.п. в связи с перечислением элементов формулы изобретения или применением «отрицательного» ограничения. Термины «предпочтительно», «предпочтительный», «предпочитать», «необязательно», «может» и другие подобные термины используются для указания того, что упоминаемый элемент, условие или стадия являются необязательными (не требующимися) признаками изобретения.
Формы единственного числа включают ссылку на множественное число, если контекст явно не предписывает иное. Термин «и/или» означает любой из элементов, любую комбинацию элементов или все элементы, с которыми связан этот термин. Фраза «один или более» легко понятна специалисту в данной области техники, особенно когда она читается в контексте ее применения.
Термин «около» может относиться к изменению ± 5%, ± 10%, ± 20% или ± 25% от указанного значения. Например, «около 50» процентов может в некоторых вариантах иметь отклонение до 45-55 процентов. Для целочисленных диапазонов термин «около» может включать одно или два целых числа, больших и/или меньших, чем указанное целое число на каждом конце диапазона. Если в данном документе не указано иное, термин «около» предназначен для включения значений и диапазонов, близких к указанному диапазону, которые эквивалентны с точки зрения функциональности композиции или воплощения.
Как будет понятно специалисту в данной области техники, для любых и всех целей, в частности с точки зрения предоставления письменного описания, все диапазоны, приведенные в данном описании, также охватывают любые и все возможные поддиапазоны и комбинации их поддиапазонов, а также отдельные значения, составляющие диапазон, особенно целочисленные значения. Указанный диапазон включает каждое конкретное значение, целое число, десятичное число или единицу в пределах диапазона. Любой из перечисленных диапазонов может быть легко распознан как достаточно описывающий и позволяющий разделить один и тот же диапазон, по меньшей мере, на равные половины, трети, четверти, пятые или десятые доли. В качестве неограничивающего примера каждый диапазон, обсуждаемый в данном документе, может быть легко разбит на нижнюю треть, среднюю треть и верхнюю треть и т.д.
Как будет понятно специалисту в данной области, все формулировки, такие как «до», «по меньшей мере», «больше чем», «меньше чем», «больше чем», «или более» и т.п., включают приведенное число, и такие термины относятся к диапазонам, которые могут быть впоследствии разбиты на поддиапазоны, как обсуждалось выше. Таким же образом, все соотношения, указанные в данном документе, также включают все соотношения, попадающие в более широкое соотношение.
СПИСОК ЛИТЕРАТУРЫ
Все публикации, патенты и заявки на патенты, упомянутые в данном описании, указывают на уровень квалификации специалистов в данной области, к которой относится это изобретение, и включены в настоящий документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или патентные заявки были конкретно и индивидуально указаны, как включенные путем ссылки.
1. Grass, J.E., Gould, L.H. & Mahon, B.E. Epidemiology of foodborne disease outbreaks caused by Clostridium perfringens, United States, 1998-2010. Foodborne pathogens and disease 10, 131-136 (2013).
2. Songer, J.G. Clostridial enteric diseases of domestic animals. Clin Microbiol Rev 9, 216-234 (1996).
3. Uzal, F.A., Vidal, J.E., McClane, B.A. & Gurjar, A.A. Clostridium Perfringens Toxins Involved in Mammalian Veterinary Diseases. Open Toxinology J 2, 24-42 (2010).
4. Al-Sheikhly, F. & Truscott, R.B. The interaction of Clostridium perfringens and its toxins in the production of necrotic enteritis of chickens. Avian diseases 21, 256-263 (1977a).
5. Timbermont, L. et al. Control of Clostridium perfringens-induced necrotic enteritis in broilers by target-released butyric acid, fatty acids and essential oils. Avian Pathol 39, 117-121 (2010).
6. Caly, D.L., D'Inca, R., Auclair, E. & Drider, D. Alternatives to Antibiotics to Prevent Necrotic Enteritis in Broiler Chickens: A Microbiologist's Perspective. Frontiers in microbiology 6, 1336 (2015).
7. Elwinger, K., Berndtson, E., Engstrom, B., Fossum, O. & Waldenstedt, L. Effect of antibiotic growth promoters and anticoccidials on growth of Clostridium perfringens in the caeca and on performance of broiler chickens. Acta veterinaria Scandinavica 39, 433-441 (1998).
8. Hofacre, C.L., Beacorn, T., Collett, S. & Mathis, G. Using competitive exclusion, mannan-oligosaccharide and other intestinal products to control necrotic enteritis. J Appl Poultry Res 12, 60-64 (2003).
9. Hofshagen, M. & Kaldhusdal, M. Barley inclusion and avoparcin supplementation in broiler diets. 1. Effect on small intestinal bacterial flora and performance. Poultry science 71, 959-969 (1992).
10. Kaldhusdal, M., Schneitz, C., Hofshagen, M. & Skjerve, E. Reduced incidence of Clostridium perfringens-associated lesions and improved performance in broiler chickens treated with normal intestinal bacteria from adult fowl. Avian diseases 45, 149-156 (2001).
11. Van der Sluis, W. Clostridial enteritis is an often underestimated problem. World Poultry Journal 16, 43-43 (2000).
12. European-Union, Regulation (EC) No 1831/2003 of the European Parliament and of the Council. Official Journal of the European Union 46, 29-43 (2003).
13. Van Immerseel, F. et al. Clostridium perfringens in poultry: an emerging threat for animal and public health. Avian Pathol 33, 537-549 (2004).
14. Lovland, A. & Kaldhusdal, M. Severely impaired production performance in broiler flocks with high incidence of Clostridium perfringens-associated hepatitis. Avian Pathol 30, 73-81 (2001).
15. Hughes, J.A., Turnbull, P.C. & Stringer, M.F. A serotyping system for Clostridium welchii (C. perfringens) type A, and studies on the type-specific antigens. J Med Microbiol 9, 475-485 (1976).
16. Cherniak, R. & Frederick, H.M. Capsular polysaccharide of Clostridium perfringens Hobbs 9. Infection and immunity 15, 765-771 (1977).
17. Kalelkar, S., Glushka, J., van Halbeek, H., Morris, L.C. & Cherniak, R. Structure of the capsular polysaccharide of Clostridium perfringens Hobbs 5 as determined by NMR spectroscopy. Carbohydrate research 299, 119-128 (1997).
18. Sheng, S. & Cherniak, R. Structure of the capsular polysaccharide of Clostridium perfringens Hobbs 10 determined by NMR spectroscopy. Carbohydrate research 305, 65-72 (1997).
19. Richter, S.G. et al. Small molecule inhibitor of lipoteichoic acid synthesis is an antibiotic for Gram-positive bacteria. Proc Natl Acad Sci U S A 110, 3531-3536 (2013).
20. Mot, D., Timbermont, L., Haesebrouck, F., Ducatelle, R. & Van Immerseel, F. Progress and problems in vaccination against necrotic enteritis in broiler chickens. Avian Pathol 43, 290-300 (2014).
21. Jiang, Y. et al. Protection Against Necrotic Enteritis in Broiler Chickens by Regulated Delayed Lysis Salmonella Vaccines. Avian diseases 59, 475-485 (2015).
22. Liu, H., Bouillaut, L., Sonenshein, A.L. & Melville, S.B. Use of a mariner-based transposon mutagenesis system to isolate Clostridium perfringens mutants deficient in gliding motility. Journal of bacteriology 195, 629-636 (2013).
23. Barbara, A.J., Trinh, H.T., Glock, R.D. & Glenn Songer, J. Necrotic enteritis-producing strains of Clostridium perfringens displace non-necrotic enteritis strains from the gut of chicks. Veterinary microbiology 126, 377-382 (2008).
24. Gohari, I.M., Parreira, V., Kropinski, A., Boerlin, P. & Prescott, J.F. Association of NetF-positive type A Clostridium perfringens with necrotizing enteritis in neonatal foals. Journal of Equine Veterinary Science 39, S23 (2016).
25. Nariya, H., Miyata, S., Suzuki, M., Tamai, E. & Okabe, A. Development and application of a method for counterselectable in-frame deletion in Clostridium perfringens. Applied and environmental microbiology 77, 1375-1382 (2011).
26. Chalmers, G. et al. Multilocus sequence typing analysis of Clostridium perfringens isolates from necrotic enteritis outbreaks in broiler chicken populations. Journal of clinical microbiology 46, 3957-3964 (2008).
27. Laemmli, U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227, 680-685 (1970).
28. Burnette, W.N. "Western blotting": electrophoretic transfer of proteins from sodium dodecyl sulfate--polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A. Analytical biochemistry 112, 195-203 (1981).
29. Goyette-Desjardins, G. et al. Protection against Streptococcus suis Serotype 2 infection using a capsular polysaccharide glycoconjugate vaccine. Infect. Immun. 84:2059-2075. (2016)
30. Orawan, C. and Aengwanich. Blood cell characteristics, hematological values and average daily gained weight of Thai indigenous, Thai indigenous crossbred and broiler chickens. Pakistan Journal of Biological Sciences. 10:302-309. (2007)
31. Westphal, O., and K. Jann. Bacterial lipopolysaccharides: extraction with phenol-water and further applications of the procedure. Methods Carbohydr. Chem. 5:81-93. (1965)
32. Vinogradov, E., Aubry, A., and Logan, S.M. Structural characterization of wall and lipidated polysaccharides from Clostridium perfringens ATCC 13124, Carbohydr Res. 448:88-94 (2017).
33. Thompson DR Parreira VR, Kulkarni RR, Prescott JF. Live attenuated vaccine-based control of necrotic enteritis of broiler chickens, Vet Microbiol. 2006 Mar 10;113(1-2):25-34. Epub 2005 Nov 11.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ НЕКРОТИЧЕСКОГО ЭНТЕРИТА У ДОМАШНЕЙ ПТИЦЫ | 2018 |
|
RU2788096C2 |
| ВНЕШНИЙ КОРОВОЙ ЭПИТОП ЛИПОПОЛИСАХАРИДА Н. pylori | 2010 |
|
RU2558257C2 |
| Вакцина против кампилобактериоза | 2014 |
|
RU2671473C2 |
| РЕКОМБИНАНТНАЯ ВАКЦИНА ПРОТИВ ВИРУСА АФРИКАНСКОЙ КАТАРАЛЬНОЙ ЛИХОРАДКИ | 2007 |
|
RU2446823C2 |
| РЕКОМБИНАНТНЫЕ АТТЕНУИРОВАННЫЕ МИКРООРГАНИЗМЫ CLOSTRIDIUM И ВАКЦИНА | 2007 |
|
RU2445364C2 |
| МУТАНТ ЭНТЕРОТОКСИНА, ЭФФЕКТИВНЫЙ В КАЧЕСТВЕ НЕТОКСИЧНОГО ОРАЛЬНОГО СТИМУЛЯТОРА | 1995 |
|
RU2160606C2 |
| ПО СУЩЕСТВУ НЕТОКСИЧНЫЙ МУТЕИН АЛЬФА-ТОКСИНА Clostridium perfringens И КОДИРУЮЩАЯ ЕГО МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ | 2007 |
|
RU2593945C2 |
| КЛОСТРИДИАЛЬНЫЙ ТОКСИН NetB | 2008 |
|
RU2474587C2 |
| СПОСОБ ИММУНИЗАЦИИ ПТИЦЫ ПРОТИВ ИНФЕКЦИИ, ВЫЗВАННОЙ БАКТЕРИЯМИ CLOSTRIDIUM | 2007 |
|
RU2409385C2 |
| ПРЕЗЕНТИРУЕМЫЙ В SALMONELLA ENTERICA N-ГЛИКАН ИЗ C. JEJUNI И ЕГО ПРОИЗВОДНЫЕ | 2010 |
|
RU2507253C2 |

Группа изобретений относится к области иммунологии и фармацевтики, а именно к вакцине, содержащей иммуногенное гликановое соединение, направленной на лечение инфекции, вызванной C. perfringens. Раскрывается вакцина, содержащая иммуногенное гликановое соединение со структурой повторяющихся звеньев поли-β-1,4-ManNAc, модифицированное по меньшей мере одним 6-связанным фосфоглицерином, аттенуированную клетку C. perfringens, несущую указанный гликан или бактерию, сконструированную так, чтобы экспрессировать указанный гликан, и фармацевтически приемлемый разбавитель, носитель, эксципиент или адъювант. Кроме того, раскрывается способ лечения или профилактики инфекции, вызванной C. perfringens, путем введения указанной выше вакцины. Группа изобретений обеспечивает эффективный перекрестно-реактивный иммунный ответ, который распознает широкий спектр штаммов C. perfringens. 2 н. и 9 з.п. ф-лы, 13 ил., 5 табл., 8 пр.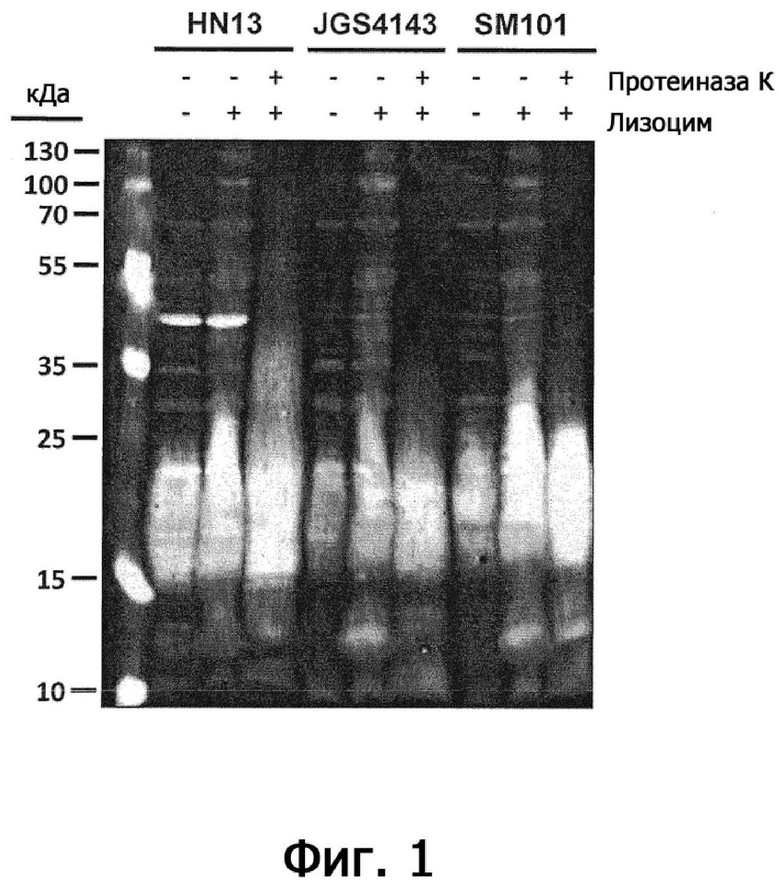
1. Вакцина, содержащая иммуногенное гликановое соединение со структурой повторяющихся звеньев поли-β-1,4-ManNAc, модифицированное по меньшей мере одним 6-связанным фосфоглицерином, аттенуированную клетку C. perfringens, несущую указанный гликан или бактерию, сконструированную так, чтобы экспрессировать указанный гликан, и фармацевтически приемлемый разбавитель, носитель, эксципиент или адъювант.
2. Вакцина по п. 1, где гликан включает соединение формулы I в выделенной, синтезированной и/или очищенной форме 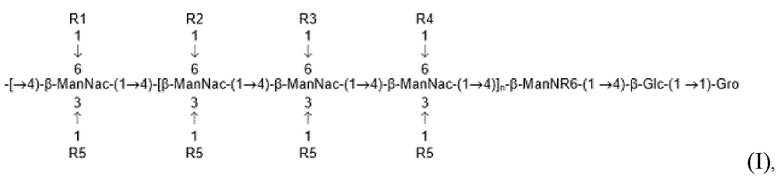
где n≥1;
каждый из R1, R2, R3 и R4 включает любую модификацию, при условии, что по меньшей мере один из них представляет собой фосфоглицерин (-PGro), R5 включает любую модификацию, а R6 включает -H или -Ac.
3. Вакцина по п. 2, в которой R5 представляет собой -ОН и/или R5 в концевой копии повторяющейся структуры включает сахар, такой как рибофураноза.
4. Вакцина по п. 2 или 3, в которой по меньшей мере один из R1-R4 представляет собой PGro и по меньшей мере один, два или три из числа R1-R4 представляют собой фосфоэтаноламин.
5. Вакцина по любому из пп. 2-4, в которой около 25% R1-R4 представляет собой -PGro.
6. Вакцина по п. 2, которая включает соединение формулы II, где n≥1:
7. Вакцина по любому из пп. 1-6, где гликан связан с липидом, одной аминокислотой, олигопептидом, пептидом или белком.
8. Вакцина по любому из пп. 1-6, где гликан химически конъюгирован с биомолекулой и экспрессируется в природном или гетерологичном хозяине в виде N-гликана, O-гликана, на липиде, на поверхности клетки или на внешней поверхности мембранных везикул (OMV).
9. Вакцина по п. 7, где гликан связан с липидом, где липид выделен и очищен из бактериального, архейного или эукариотического источника или химически синтезирован.
10. Вакцина по п. 9, в которой липид связан с гликаном через фосфатный, пирофосфатный линкер или гликозидную связь.
11. Способ лечения или профилактики инфекции, вызванной C. perfringens, путем введения вакцины по любому из пп. 1-10.
| VINOGRADOV E | |||
| Непрерывно-действующий дефекатор | 1927 |
|
SU13124A1 |
| Carbohydrate research, Pergamon, vol.448, 15.06.2017, pp.88-94 | |||
| NARIYA H | |||
| Development and Application of a Method for Counterselectable In-Frame Deletion in Clostridium perfringens | |||
| Applied and Environmental Microbiology, 2010, | |||
Авторы
Даты
2023-06-22—Публикация
2018-12-19—Подача