Исследование, описанное в этой заявке, было поддержано частично морским ведомством Соединенных Штатов, Грант N N00014-83-K-0192. Правительство имеет определенные права на данное изобретение.
1. Область изобретения
Данное изобретение относится к генетически определенному мутанту термолабильного энтеротоксина (LT) из E. coli и его применению в качестве орального стимулятора индукции антител слизистой оболочки и сыворотки. В мутантном LT заменена одна аминокислота, что приводит к потере наследственной токсичности, но сохранению интактных свойств стимулятора.
2. Предпосылки изобретения
Микробные патогены могут инфицировать хозяина разными путями. Они могут проникать через повреждения кожного покрова при травмах, вводиться переносчиками инфекции или через слизистую оболочку. Большинство патогенных организмов человека вызывают заболевание путем взаимодействия со слизистой оболочкой. Патогенные бактерии и вирусы, проникающие таким путем, сначала приходят в контакт со слизистой оболочкой, прикрепляясь и заселяя ее или поглощаясь особыми абсорбирующими клетками (M клетками) эпителия, которые покрывают пейеровы бляшки и другие лимфоидные фолликулы [Bockman and Cooper, 1973, Am. J. Anat. 136: 455-477, Owen et al., 1986, J. Infect. Dis. 153:1108-1118]. Организмы, проникшие в лимфоидные ткани, легко убиваются в лимфоидных фолликулах и таким образом превращаются в антигены, которые при взаимодействии с иммунными клетками в фолликулах вызывают потенциальную защитную иммунную реакцию (например, Vibrio cholerae). Другие патогенные организмы, которые не гибнут под действием местных защитных механизмов, попадают в фолликулы и затем вызывают локальное или общее заболевание (например, Salmonella spp., вирус полиомиелита, ротавирус в иммунологически толерантном хозяине).
Антитела класса секретируемых IgA (cIgA) против специфических вирусных детерминант в инфицированном организме играют важную роль в иммунной системе слизистой оболочки [Cebra et al., 1986, In: Vaccines 86, Brown et al. (ed.), Cold Spring Harbor Laboratory, New York. p.p. 129-133]. Во многих случаях удается предотвратить начальную инфекцию слизистой оболочки путем стимуляции в ней синтеза cIgA антител против соответствующих вирусных детерминант инфицирующего агента. Секретируемый IgA способен предотвратить первоначальное взаимодействие патогена со слизистой оболочкой путем блокирования процесса прикрепления и/или заселения, нейтрализации действующего токсина или предотвращения его проникновения в клетки-хозяина. Хотя были проведены обширные исследования с целью изучения роли клеточного иммунитета за счет антител сыворотки в защите от инфекционных агентов, гораздо меньше известно о регуляции, индукции и секреции cIgA. Парентерально введенные препараты инактивированных неразрушенных клеток или вирусов эффективно увеличивают защитное действие сывороточного IgG и реакции гиперчувствительности замедленного типа против организмов, патогенез которых характеризуется значительной сывороточной фазой (Salmonella typhi, Hepatitis B). Однако парентерально вводимые вакцины не эффективны в отношении увеличения синтезированного cIgA слизистой и не эффективны против бактерий, которые взаимодействуют со слизистой оболочкой и не внедряются (например, Vibrio cholerae). Однако недавние исследования показали, что парентерально вводимые вакцины могут быть эффективны по крайней мере против одного вируса - ротавируса, который главным образом реагирует со слизистой оболочкой [Conner et al., 1993, J. Virol. 67:6633-6641] . Предполагается, что защита обусловлена переносом антигенспецифического IgG на слизистую оболочку, где он нейтрализует вирус. Следовательно, для эффективной вакцинации важен такой механизм, который стимулирует как антитела сыворотки, так и антитела слизистой.
Оральная вакцинация может быть эффективной для индукции синтеза специфического cIgA, если антигены присутствуют в T- и B-лимфоцитах и вспомогательных клетках, содержащиеся в пейеровых бляшках, где преимущественно начинается развитие IgA B-клеток. Пейеровы бляшки содержат T-клетки-помощники (ТП), которые опосредуют прямое переключение синтеза c IgM на IgA в B-клетках. Бляшки содержат также T-клетки, которые инициируют терминальную дифференцировку B-клеток. Активированные антигеном B-клетки затем мигрируют в мезентеральные лимфатические узлы и дифференцируются, входят в грудной проток, затем в общую циркуляцию, после чего заселяют все секреторные ткани тела, включая собственную оболочку кишечника и дыхательный тракт. Затем IgA синтезируется зрелыми плазматическими клетками, образует комплекс со связанным с мембраной секреторным компонентом и переносится в слизистую оболочку, где этот комплекс готов к взаимодействию с внедряющимся патогенным агентом [Strober and Jacobs, 1985, In: Advances in host defense mechanisms. Vol. 4. Mucosal Immunity, Gallin and Fauci (ed.). Raven Press, New York. p. p. 1-30; Tomasi ind Plaut, 1985, In: Advances in host defense mechanisms. Vol. 4. Mucosal Immunity, Gallin and Fauci (ed.). Raven Press, New York. p. p. 31-61]. Существование этой общей иммунной системы слизистой оболочки частично объясняет потенциальную эффективность оральных вакцин и оральной иммунизации для защиты от патогенных организмов, которые вызывают инфекцию путем взаимодействия со слизистой оболочкой.
Были разработаны различные стратегические приемы оральной вакцинации, в том числе использование ослабленных мутантов бактерий (например, Salmonella spp. ) в качестве носителей гетерологичных антигенов [Cardenas and Clements, 1992, Clin. Microbiol. Rev, 5:328-342; Clements et al., 1992, In: Recombinant DNA Vaccines: Rationale and Strategy, Isaacson (ed.). Marcel Decker, New York. p. p. 293-321; Clements and Cardenas, 1990, Res. Microbiol. 141: 981-993; Clements and El-Morshidy, 1984, Infect. Immun. 46:564-569], инкапсулирование антигенов в микрошарики, сделанные из поли-DL-лактид-гликолида (PLG), белковоподобные полимеры - протеиноиды [Sanitago et al., 1993, 1993, Pharmaceutical Research 10:1243-1247], капсулы из желатина, различные образования из липосом [Alving, et al., 1986, Vaccine 4:166-172; Garcon and Six, 1993, J. Immunol. 146:3697-3702; Gould-Fogerite and Mannino, 1993, In: Liposome Technology 2nd Edition. Vol. III, Gregoriadis (ed.)], адсорбция на наночастицах, использование липофильных комплексов иммуностимуляторов (ISCOMS) [Mowat and Donachie, 1991, Immunology Today 12:383-385], и добавление бактериальных продуктов со свойствами известных стимуляторов [Clements et al. , 1988, Vaccine 6: 269-277; Elson, 1989, Immunology Today 146:29-33; Lycke and Holmgren, 1986, Immunology 59:301-308; Lycke et al., 1992, Eur. J. Immunol. 22:2277-2281]. Двумя продуктами метаболизма бактерий с наиболее сильным действием в качестве орального стимулятора являются - холерный токсин (ХТ), синтезируемый различными штаммами V. cholerae, и термолабильный энтеротоксин (ЛТ), синтезируемый некоторыми энтеротоксигенными штаммами Escherichia coli. Хотя LT и CT имеют ряд сходных свойств, эти молекулы имеют четко различающиеся биохимические и иммунологические особенности, которые делают их уникальными. Обширный понос при холере является результатом действия экзо-энтеротоксина, который активирует аденилатциклазу и вызывает последующее увеличение внутриклеточного уровня циклического 3'-, 5'-аденозинмонофосфата (цАМФ). Холерный энтеротоксин (ХТ) является белковым полимером с молекулярным весом 84.000 дальтон, состоящим из двух основных, не связанных ковалентно, иммунологически различных областей или доменов ("cholera-A" и "cholera-B") [Finkelstein and LoSpalluto, 1969, J. Exp. Med. 130: 185-202]. Домен с весом 56.000 дальтон или холерогеноид ответственен за присоединение токсина к мембранному рецептору клетки-хозяина - G м1 (галактозил-N-ацетилгалактозаминил-(сиалил)-галактозил-глюкозил церамид), который обнаружен на поверхности почти всех клеток эукариот. Холерогеноид состоит из пяти не связанных ковалентно субъединиц. Домен A (27.000 дальтон) ответственен за самые различные биологические действия токсина. Связь этих двух субъединиц с иммунологическими свойствами ХТ является источником значительных разногласий. С одной стороны, ХТ при оральном введении является превосходным иммуногеном, который провоцирует как синтез сывороточных антител против токсина, так и противотоксиновых антител слизистой. Это положение не является новым в том смысле, что у больных холерой, как известно, во время выздоровления развивается подъем титра антител против токсина [Finkelstein, 1975, Curr. Top. Microbiol. Immunol. 69:137-196]. Одним из ключевых результатов исследования природы этой реакции было наблюдение о том, что ХТ в отличие от других белковых антигенов не индуцирует оральную толерантность к ХТ [Elson and Ealding, 1984, J. Iminunol. 133: 2892-2897; Elson and Ealding, 1984, J. Immunol. 132: 2736-2741] . Это положение справедливо и тогда, когда B субъединицы давали в пищу мышам, что доказано в ходе испытаний холерной вакцины в Бангладеш, в которых при оральной иммунизации B субъединицами в комбинации с целыми клетками наблюдали подъем титра как антител против токсина в слизистой, так и соответствующих антител в сыворотке [Svennerholm et al., 1984, J. Infect. Dis. 149: 884-893]. Кроме описанного выше свойства ХТ как орального иммуногена он имеет ряд других иммунологических свойств. Как указано выше, Элсон и Эалдин [Elson and Ealding, 1984, J. Immunol. 133: 2892-2897] наблюдали, что при оральном введении ХТ не индуцирует к себе толерантность. Более того, одновременное оральное введение ХТ с растворимым белковым антигеном - гемоцианин из фиссуреллы (KLH) приводит к синтезу секретируемого IgA как против ХТ, так и против KLH и отмене индукции оральной толерантности против KLH. Эти результаты впоследствии были подтверждены и расширены Лайком и Холмгреном [Lycke and Holmgren, 1986, Immunology 25 59: 301-308]. Путаница возникла при попытке установить, какая из субъединиц A и B определяет функцию молекулы ХТ как стимулятора.
В основе этого лежат наблюдения, суммированные Элсоном [Elson, 1989, Immunology Today 146: 29-33]:
- ХТ, как и ХТ-B, не индуцирует оральную толерантность против себя [Elson and Ealding, 1984, J. Immunol. 133:2892-2897].
- ХТ не может предотвратить индукцию толерантности против других антигенов, с которыми он вводится одновременно, а также служит стимулятором для этих антигенов [Elson and Ealding, 1984, J. Immunol. 133: 2892-2897; Lycke and Holmgren, 1986, Immunology 59: 301-308].
- ХТ может действовать как стимулятор и для ХТ-B [Elson and Ealding, 1984, J. Immunol. 133: 2892-2897].
- агрегированный нагреванием ХТ имеет слабую токсичность, но является сильным оральным иммуногеном [Pierce et al. , 1983, Infect. Immun. 40: 1112-1118].
- ХТ-B может служить как иммунологический "носитель" в традиционном комплексе гаптен-носитель [Cebra et al., 1986, In: Vaccines 86, Brown et al. (ed. ). Cold Spring Harbor Laboratory, New York. p.p. 129-133; McKenzie and Halsay, 1984, J. Immunol. 133: 1818-1824].
На основании этих результатов ряд исследователей пришли к заключению, что B субъединица должна обладать некоей наследственной активностью стимулятора. Результаты Себра и др. [Cebra et al., 1986, In: Vaccines 86, Brown et al. (ed.). Cold Spring Harbor Laboratory, New York. p.p. 129-133], Лайка и Холмгрена [Lycke and Holmgren, 1986, Immunology 59: 301-308], и Линга и др. [Liang et al., 1988, J. Immunol. 141: 1495-1501] свидетельствуют против этого заключения. Себра и др. [Cebra et al., 1986, In: Vaccines 86, Brown et al. (ed.). Cold Spring Harbor Laboratory, New York. p.p. 129-133] показали, что очищенный ХТ-B приводит к увеличению количества B-клеток в пейеровых бляшках, синтезирующих антитела против холерного токсина, когда он вводится внутри дуоденально, но в отличие от ХТ-B не приводит к значительному увеличению количества B-клеток, коммитированных к синтезу IgA. Лайк и Холмгрен [Lycke and Holmgren, 1986, Immunology 59: 301-308] сравнивали ХТ и ХТ-B по их способности увеличивать иммунный ответ слизистой кишечника к KLH путем измерения количества клеток собственной оболочки кишечника, секретирующих иммуноглобулин в орально иммунизированных мышах. Они не обнаружили увеличения количества клеток, синтезирующих антитела против KLH в ответ на введение всех испытанных доз B-субъединиц. Наконец, Лианг и др. [Liang et al., 1988, J. Immunol. 141: 1495-1501] не обнаружили какой-либо стимулирующий эффект при оральном введении ХТ-B в виде конъюгата с инактивированным вирусом Сендай.
Когда у очищенной B субъединицы наблюдали активность стимулятора, это было обычно по одной из двух причин. Во-первых, при традиционных методах получения препаратов B субъединиц голотоксин подвергался диссоциации при Хроматографии с помощью гель-фильтрации в присутствии диссоциирующего агента (т. е. HC-гуанидина или формиевой кислоты). После этого выделенные субъединицы соединяли, а диссоциирующий агент удаляли. B-субъединицы, приготовленные с помощью этого метода, неизменно содержали небольшое количество A-субъединиц, поэтому при ренатурации восстанавливалось небольшое количество голотоксина. Вторая причина связана с определением иммунологического носителя. Подобно многим другим растворимым белкам, B-субъединицы могут служить в качестве переносчика для презентации антигена иммунной системы. Если этот антиген настолько мал, что является слабым иммуногеном, то он может стать сильным иммуногеном в традиционной конфигурации гаптен-носитель. Подобным образом происходит "теоретическое" иммунное усиление, связанное с B-субъединицей, особенно при оральном введении, при котором B-субъединица соединяется с поверхностью эпителиальных клеток и может иммобилизовать антиген для последующего представления лимфоидным тканям, связанным с кишечником. Однако любые потенциальные преимущества этого механизма стабилизации антигена могут быть сведены на нет в результате перераспределения антигена в толще соответствующей нелимфоидной ткани, т. е. на эпителиальных клетках кишечника. В плане реактивности слизистой оболочки лимфоидными участками здесь являются пейеровы бляшки, особенно для антигенспецифической, опосредуемой T-клетками активации B-клеток [Strober and Jacobs, 1985, In: Advances in host defence mechanisms. Vol. 4. Mucosal Immunity, Gallin and Fauci (ed.), Raven Press, New York. p. p. 1-30; Tomasi and Plaut, 1985, In: Advances in host defense mechanisms. Vol. 4. Mucosal Immunity, Gallin and Fauci (ed.). Raven Press, New York. p.p. 31-61; Brandtzaeg, 1989, Curr. Top. Microbiol. Immunol. 146: 13-25] . Так, события переключения изотипов c IgM-клеток на IgA-клетки происходят в пейеровых бляшках. Антигены, расположенные на поверхности эпителиальных клеток, могут участвовать в индуцируемой антигеном пролиферации B-клеток, при этом ворсинчатые эпителиальные клетки класса II могут действовать как антигенпрезентирующие клетки для активации T-клеток в секреторных сайтах, что приводит к увеличению продукции цитокинов, терминальной дифференцировке B-клеток, повышению экспрессии секреторного компонента и увеличению секреции антигенспецифического IgA [Tomasi, T.B., and A.G. Plaut. 1985, In: Advances in host defense mechanisms. Vol. 4. Mucosal Immunity, Gallin and Fauci (ed.), Raven Press, New York. p.p. 31-61]. Взаимосвязь этих событий отчетливо не определена для B-субъединицы как носителя других антигенов и термин "стимулятор", по-видимому, не подходит для такого эффекта.
Ясно, что свойство стимулятора локализуется в молекуле голотоксина, в которой B-субъединица необходима для распознавания рецептором и для облегчения проникновения в клетку A-субъединицы. A-субъединица также необходима для стимуляторной активности, по-видимому, благодаря ее ферментативной активности АДФ-рибозилирования и способности увеличивать внутриклеточный уровень с АМФ (см. ниже). B-субъединица самостоятельно может действовать как носитель других антигенов, при этом в составе конъюгата антиген в иммобилизированной форме взаимодействует с лимфоидными тканями, связанными с кишечником. Хотя LT и ХТ имеют много общих черт, это совершенно разные молекулы с отчетливо различающимися биохимическими и иммунологическими свойствами, что делает их уникальными. Сюда входят различия на 20% в гомологии нуклеотидной и аминокислотной последовательностей [Dallas and Falkow, 1980, Nature 288: 499-501] . Оба токсина имеют одинаковое количество и расположение субъединиц, сходный механизм биологического действия и одинаковую удельную активность в ряде тестов [Clements and Finkelstein, 1979, Infect. Immun. 24: 760-769; Clements et al., 1980, Infect. Immun. 24: 91-97].
Однако между этими молекулами имеются существенные различия, которые отражаются не только на их свойствах как энтеротоксинов, но и на их способности функционировать в качестве стимуляторов. В отличие от ХТ, продуцируемого V. cholerae, LT остается связанным с клеткой и освобождается из E.coli только в процессе лизиса [Clements and Finkelstein, 1979, Infect. Immun. 24: 760-769]. ХТ секретируется из вибриона сразу после синтеза и может быть легко идентифицирован в очищенном виде в культуральном супернатанте. Поэтому в отличие от ХТ LT не обладает полной биологической активностью сразу после выделения из клетки. В соответствии с A-B моделью бактериальных токсинов LT для приобретения полной активности нуждается в протеолизе и восстановлении дисульфидной связи. До протеолитического процессинга энзиматически активный A1 компонент не способен диссоциировать от A2 компонента и не может реагировать с субстратом (аденилатциклазы) на базолатеральной поверхности эпителиального клеточного слоя кишечника. То же самое справедливо и для ХТ, но протеазы осуществляют протеолиз токсина в культуральном супернатанте, где токсин контактирует с ферментом в процессе очистки. Вследствие неполной биологической активности LT в процессе очистки его трудно идентифицировать в этот период с помощью биологических тестов in vitro, например, с помощью теста на У-1 клетках надпочечника или теста проницаемости фактора.
Это различие в активации выделяемого материала приводит к различиям в пороговых реакциях LT и ХТ в биологических системах. Например, ХТ индуцирует заметное выделение жидкости в кишечнике мыши при дозе 5-10 мкг. LT индуцирует секрецию через ячеистую структуру кишечника мыши при дозе выше 100 мкг. В случае перевязанной подвздошной петли у кролика эти различия очень велики. Кроме того, было показано, что у приматов LT не индуцирует секрецию жидкости при дозах до 1 мг. Это в 200 раз больше дозы ХТ, при которой индуцируется позитивное движение жидкости у человека. После обработки протеолитическим ферментом с трипсиноподобной специфичностью молекула LT становится неотличимой от ХТ по тесту в биологической системе. Это было отчетливо показано Клементсом и Финкельштейном [Clements and Finkelstein, 1979, Infect. Iminun. 24: 760-769]. Помимо указанных выше различий, LT имеет необычное сродство к углеводородсодержащим структурам. Так, LT с молекулярным весом 90000 элюируется из колонки с Сефадексом (глюкоза) с кажущимся молекулярным весом 45000 и из колонки с Агарозой (галактоза) с кажущимся молекулярным весом, равным 0. То есть LT соединяется с галактозным матриксом и может быть элюирован из него в чистом виде только путем применения галактозы в качестве элюирующего материала. LT присоединяется к галактозе в колонке, используемой для очистки, но, что еще более важно, и к другим биомолекулам, содержащим галактозу, включая гликопротеиды и липополисахариды. Этими лектинподобными свойствами LT объясняется более широкое распространение рецепторов LT на клетках млекопитающих, чем рецепторов ХТ, которые связываются только с Gм1 клетками. Этим могут объясняться отмечаемые в публикациях различия в способности двух данных молекул индуцировать различные иммунные реакции, опосредуемые хелперными T-клетками [McGhee et al., 1994, Mucosal Immunology Update, Spring, 1994, Raven Press, New York. p. 21].
В этих исследованиях [McGhee et al., 1994, Mucosal Immunology Update, Spring 1994, Raven Press, New York. p. 21] было показано, что при оральной иммунизации мышей вакцинами, такими как столбнячный токсоид (СТ), ХТ как стимулятор слизистой селективно индуцируют клетки TH2 типа пейеровых бляшек и селезенки, как об этом свидетельствует синтез TH клетками IL-4 и IL-5, но не IL-2 или INF-гамма. (Более подробное описание синтеза этих цитокинов см. в обзоре Arai et al., 1990, Ann. Rev. Biochem. 59: 783-836). Важно, что при использовании ХТ в качестве стимулятора слизистой увеличивается также синтез антигенспецифического IgE наряду с синтезом IgA. Такое увеличение синтеза IgE очень хорошо согласуется с сохранением у ХТ активности активатора слизистой благодаря защите от индукции реакции гиперчувствительности немедленного типа. В отличие от этого LT при оральном введении в качестве стимулятора слизистой индуцирует как TH1, так TH2 клетки и преимущественно синтез только антигенспецифического IgA.
Эти два типа молекул во многом различаются по иммунологическим характеристикам, как это показано в исследованиях иммунодиффузии [Clements and Finkelstein, 1978, Infect. Immun. 21: 1036-1039; Clements and Finkelstein, 1978, Infect. Immun. 22: 709-713], в исследованиях нейтрализации in vitro, и частичной защиты против вызванной молекулой LT в составе E.coli диареи у добровольцев, получивших B-субъединицы в составе целых клеток холерной вакцины [Clemens et al., 1988, J. Infect. Dis. 158: 372-377].
В совокупности эти данные показывают, что LT и ХТ являются совершенно различными молекулами, несмотря на их кажущееся сходство, и что LT является пригодным для применения в качестве стимулятора, а ХТ - нет.
Открытие свойств LT как стимулятора было сделано в ходе исследования одним из авторов данного изобретения действия LT на развитие толерантности к орально вводимым антигенам. Учитывая наблюдаемые различия между этими двумя молекулами, было не ясно, влияет ли LT также и на индукцию оральной толерантности или же он проявляет эффект стимулятора, обнаруживаемый в случае ХТ. Поэтому авторы данного изобретения исследовали ряд параметров, включая действие LT на оральную толерантность к OVA и роль обеих субъединиц LT в этой реакции, эффект предварительной обработки OVA на способность LT действовать на толерантность к OVA, использование LT в качестве стимулятора в комбинации с двумя неродственными антигенами и влияние способа иммунизации на иммунную реакцию против OVA.
Результаты, полученные в этих исследованиях [Clements et al., 1988, Vaccine 6: 269-277; Clements et al., 1988, Abstract No. B91, 88th Ann. Meet. Am. Soc. Microbiol.], суммированы ниже:
1. Показано, что одновременное введение LT и OVA предотвращает индукцию толерантности к OVA и увеличивает синтез сывороточных анти-OVA IqG в 30-90 раз по сравнению с синтезом этих антител в животных, иммунизированных препаратами OVA и PBS, соответственно. Было показано, что этот эффект обусловлен действием ферментативно активной A-субъединицы токсина, так как одна только B-субъединица не способна действовать на индукцию толерантности.
2. У животных, которым скармливали LT с OVA после инициирования первичного воздействия OVA, синтезировался меньший уровень сывороточного IgG и анти-OVA igA слизистой по сравнению с уровнем этих антител у животных, которым скармливали LT с OVA при первой иммунизации. Это означает, что предварительное введение антигена уменьшает эффективность LT в установлении толерантности и снижает его способность действовать как стимулятор. LT не способен отменять толерантность, если она уже возникла. Было установлено, что тоже справедливо и для ХТ, если животные предварительно иммунизируются препаратами OVA до орального введения овальбумина плюс ХТ, и позволяет несколько прояснить важное наблюдение о том, что иммунный ответ против антигена в пище не увеличивается, если используется стимулятор.
3. Синтез сывороточного IgG и IgA слизистой у животных, получивших LT только однократно, что имеет место при первом введении антигена, эквивалентен их синтезу после трех иммунизаций препаратом OVA/LT. Это указывает на то, что коммитирование к иммунной реактивности происходит раньше, при первом введении антигена. Это показывает также, что прямая иммунная реакция, проявляющаяся в синтезе сывороточного IgG и IgA слизистой, может контролироваться независимо от того, вводится или нет парентерально доза для активной иммунизации.
4. Одновременное введение LT с двумя растворимыми белковыми антигенами приводит к индукции синтеза в сыворотке и слизистой антител против обоих антигенов, если животное перед этим не иммунизировали одним из них. Это было важным результатом, так как одно из возможных применений LT в качестве стимулятора может заключаться в индукции в слизистой синтеза антител против сложных антигенов, например убитых бактерий или вирусов, где важна способность развивать иммунный ответ одновременно на много антигенов.
Исследования Тамура и др. [Tamura et al., U.S. Patent N 5,182,109] показали, что введение LT и/или ХТ интраназально увеличивает титр антител против совместно введенных антигенов. Однако в цитируемой работе не исследовано, могут ли эти токсины индуцировать защитный иммунный ответ при оральном введении.
Ясно, что LT обладает важными свойствами иммунорегулятора, а именно служит как средство для предотвращения индукции толерантности к определенным антигенам и как стимулятор при оральном введении антигенов, а также усиливает продукцию сывороточных IgG антител и IgA антител слизистой против антигенов, с которыми он совместно вводится. Это дает возможность разрабатывать программы иммунизации против различных патогенных агентов, включая оральное введение убитых или ослабленных агентов или соответствующих вирулентных детерминант определенных агентов. Однако тот факт, что этот "токсин" может стимулировать секреторную реакцию ячеичной полости кишечника в результате протеолитического расщепления, например, протеазами кишечника, может затруднить исследование потенциальных возможностей его применения в соответствующих условиях. Эту проблему можно было бы разрешить, если бы удалось "детоксицировать" LT без изменения его стимуляторной активности. Чтобы понять, как это можно сделать, необходим дальнейший анализ механизма действия LT и ХТ и связи между структурой и функцией этих молекул. Как ранее установлено, LT и ХТ синтезируются как мультисубъединичные токсины, состоящие из A и B компонент. После первоначального взаимодействия с мембранными рецепторами клетки-хозяина B-субъединица облегчает проникновение A-субъединицы через мембрану клетки. При восстановлении тиолом A компонента диссоциирует на две меньшие полипептидные цепи. Одна из них - A1 цепь - катализирует АДФ-рибозилирование стимулирующего ГТФ-связывающего белка (Gs) в комплексе с ферментом аденилатциклаза на базолатеральной поверхности эпителиальных клеток и это приводит к увеличению внутриклеточного уровня цАМФ. Увеличение цАМФ вызывает выделение воды и электролитов в малый кишечник путем воздействия на два зависящих от цАМФ механизма транспорта ионов: 1) перенос NaCl через ворсинчатую каемку из эпителиальных клеток и 2) электрогенная, зависящая от Na+ секреция Cl- клетками крипты [Field, 1980, In: Secretory diarrhea. Field et al. (ed.), Waverly Press, Baltimore, p. 21-30]. A-субъединица является также важной частью, связанной с усилением иммунитета этими токсинами. Поэтому эта субъединица становится важным объектом для манипуляций, направленных на разделение токсических и иммунологических функций молекулы токсина. Из недавнего сообщения Лики и др. [Lycke et al., 1992, Eur. J. Immunol. 22: 2277-2281] становится ясно, что изменения, которые влияют на ферментативную активность АДФ-рибозилирования у токсина и изменяют его способность увеличивать внутриклеточный уровень цАМФ, подавляют также функцию этой молекулы как адъюванта. Следовательно, возникает необходимость исследовать другие подходы детоксикации токсина.
3. Краткое изложение изобретения
Данное изобретение относится к мутантной форме LT, которая утрачивает свое токсическое действие и АДФ-рибозилтрансферазную активность, сохраняет активность стимулятора иммунной реакции. Мутантная форма LT отличается от LT дикого типа заменой одной аминокислоты - Арг192 заменен на Гли192, в результате чего чувствительный к трипсину сайт утрачивает чувствительность к трипсину. Утрата протеолитического сайта предотвращает протеолитическое превращение A-субъединицы в ее токсическую форму. Нативный LT не токсичен сразу после выделения из бактерий, но потенциально способен приобретать полную токсичность под действием протеаз, которые содержатся в кишечнике млекопитающих. Найденная мутантная форма утрачивает эту потенциальную способность, превращаясь в токсическую форму путем протеолиза. Этот мутант (далее обозначаемый mLT) сохраняет способность увеличивать иммунный ответ животных (например, синтез IgG, IgA) на введение антигена, не связанного с LT или mLT, но не дает побочных токсических эффектов. Экспериментальные данные показывают, что mLT применим в качестве стимулятора иммунитета к орально вводимым антигенам; подобная иммунизация приводит к продукции сывороточных IgG и/или cIgA антител слизистой против антигенов, вводимых вместе с mLT. В данном изобретении дается метод индукции иммунного ответа в сыворотке или слизистой реципиента против того или иного орально вводимого антигена. Метод включает введение реципиенту необходимого количества mLT совместно с оральным введением достаточного количества антигена. Предпочтительно первоначально вводить дозу антигена и mLT одновременно.
Данный метод и составы обеспечивают усовершенствованный способ оральной вакцинации для развития синтеза сывороточных антител и антител слизистой против патогенных микроорганизмов. Реакция синтеза антител класса IgA против патогенных микроорганизмов, которые проникают и поражают организм через слизистую оболочку, может быть направлена на эту оболочку, тогда как значительное развитие синтеза сывороточных антител может предотвращать инфекцию патогенными микроорганизмами, против которых защищают сывороточные антитела. Данное изобретение применимо для любых специфических антигенов, где синтез специфических нейтрализующих антител позволяет преодолевать физиологическое состояние или заболевание, связанные с действием этого антигена.
В данном изобретении дается также состав, применимый в качестве компонента вакцины против энтеротоксических бактериальных организмов, экспрессирующих холероподобные энтеротоксины, а также метод его применения.
В изобретении дается также состав, применяемый в этих методах. В состав входит эффективная доза mLT в комбинации с эффективной дозой антигена.
4. Краткое описание фигур
Для более полного понимания данного изобретения ниже будет приведено детальное описание изобретения, примеров конкретного его применения и прилагаемых фигур:
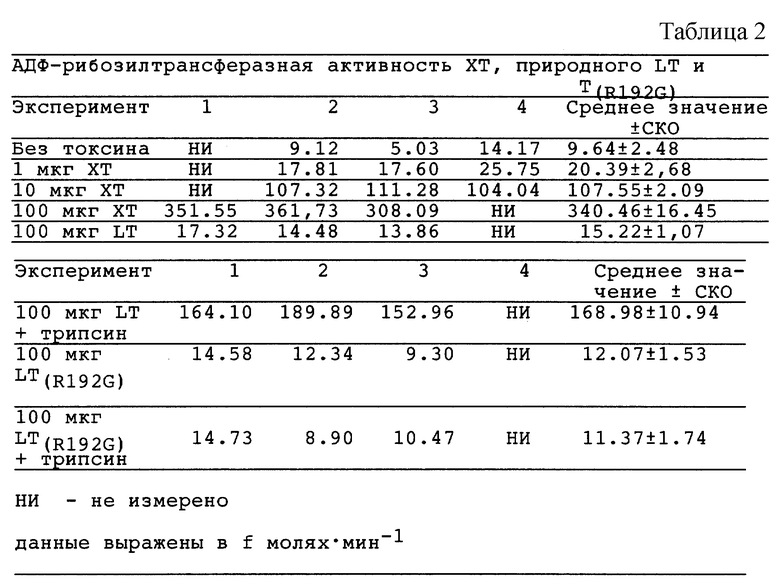
Фигура 1. Схематическая диаграмма плазмиды pBD94, которая кодирует субъединицы A и B под контролем lac промотора. Плазмида pBD94 содержит замену одного основания в кодоне для аминокислотного остатка в положении 192 A-субъединицы, кодирующего вместо Арг аминокислоту Гли, что не прерывает рамку считывания, но элиминирует протеолитический сайт. Приведены аминокислотные последовательности, соответствующие области чувствительности к трипсину и сайт аминокислотной замены Арг192 - Гли192.
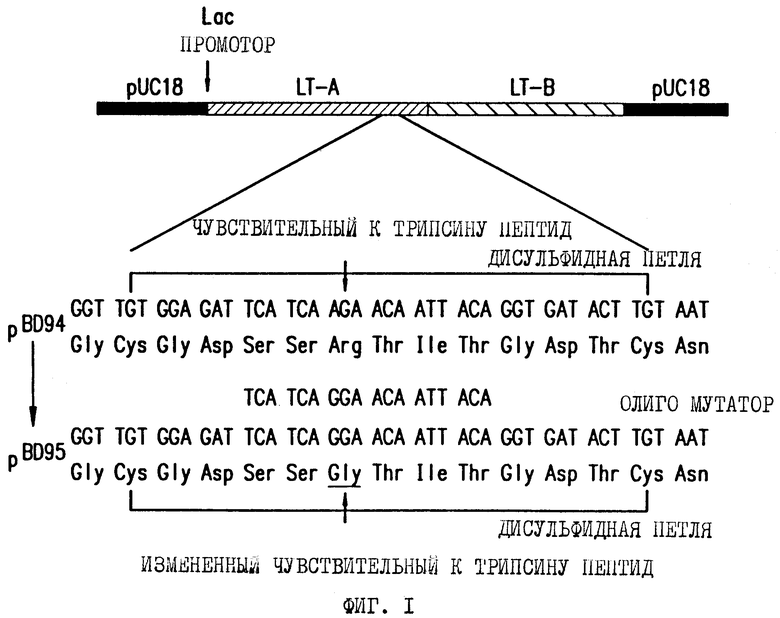
Фигура 2. Графическое представление дозовой зависимости уровня АДФ-рибозилагматина от количества ХТ.
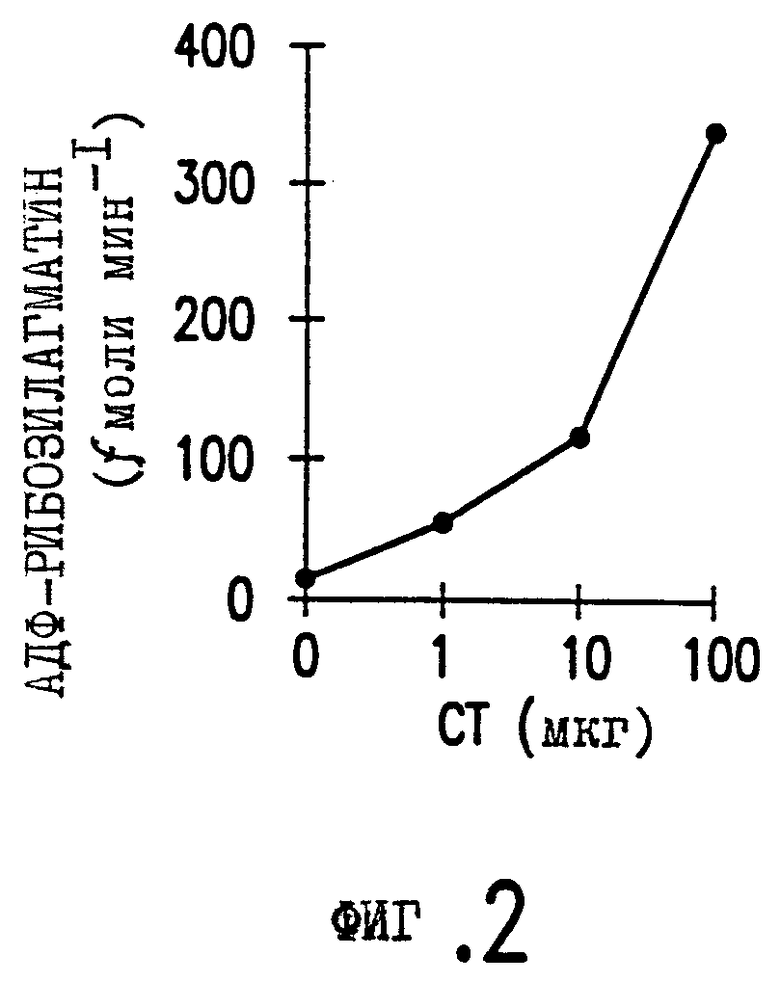
Фигура 3. Скопление жидкости после потребления 125 мкг природного LT, отсутствующее после скармливания 125 мкг mLT на мышь. Отношение кишечник - тело рассчитано путем деления веса кишечника на вес тела животного без кишечника.
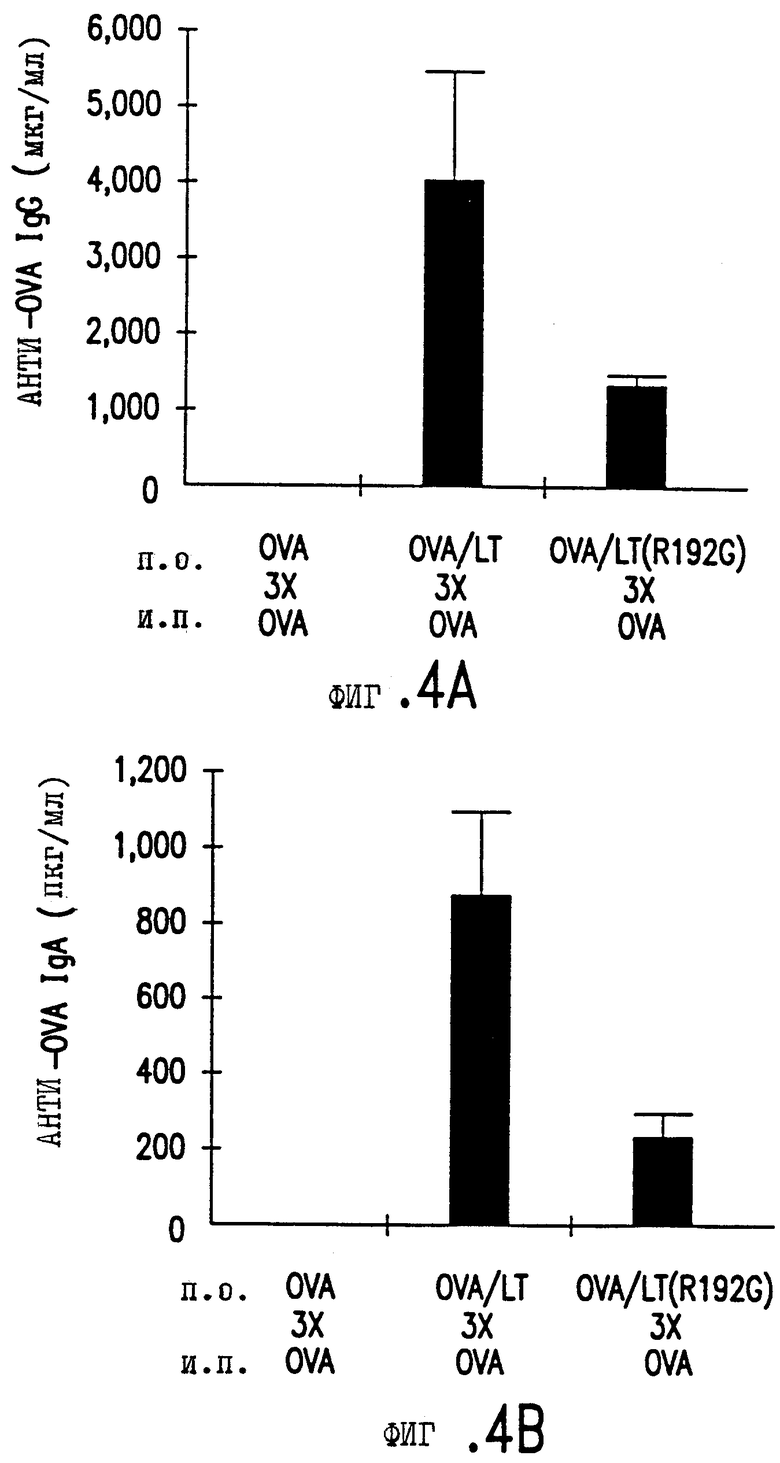
Фигура 4. Способность mLT действовать как иммуностимулятор. Фигура 4A, способность mLT индуцировать синтез сывороточных IgG антител в ответ на введение OVA.
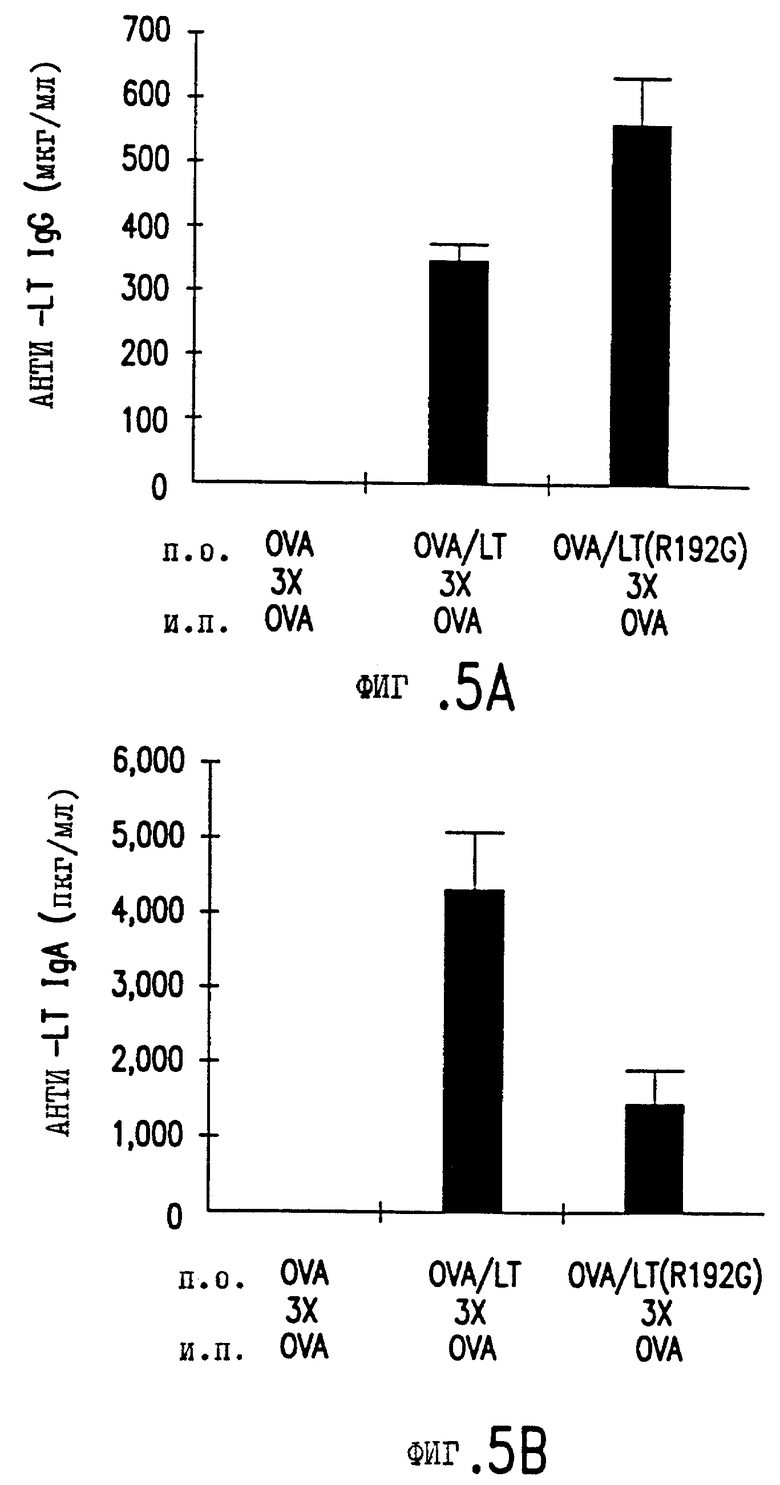
Фигура 5. Экспериментальное доказательство способности mLT предотвращать индукцию оральной толерантности к LT. Фигура 5A, способность mLT индуцировать синтез сывороточных IgG антител в ответ на введение LT.
5. Подробное описание изобретения
Данное изобретение включает состав и методы его применения для увеличения синтеза антител слизистой и сыворотки против антигенов, которые вводятся орально вместе с генетически измененным бактериальным токсином. Модифицированный токсин является формой термолабильного энтеротоксина (LT) из E.Coli, в котором с помощью метода генной инженерии удален сайт чувствительности к трипсину, что делает молекулу не токсичной, но не изменяет ее способность действовать как иммуностимулятор. Мутантный LT получил краткое обозначение "mLT". Это изобретение основано на открытии того, как иммуностимулятор mLT так же эффективен, как и LT. mLT не обладает ферментативной активностью АДФ-рибозилирования, поскольку его A-субъединица не подвергается протеолитическому процессингу. В отличие от опубликованных исследований Лайка и сотрудников, из которых следует, что утрата АДФ-рибозилирующей активности LT также устраняет способность молекулы функционировать как иммуностимулятор, описанный здесь mLT сохраняет активность иммуностимулятора, но, как показано в примерах, он не имеет активность АДФ-рибозилирования.
Новая мутантная форма термолабильного энтеротоксина из E.Coli - mLT, описанная здесь, ведет себя как стимулятор и увеличивает продукцию сывороточных IgG антител и IgA антител слизистой против антигенов, с которыми он вводится. Применение этого неожиданного открытия состоит в том, что эффективные дозы mLT можно использовать для разработки программы эффективной вакцинации против различных патогенов. В программу входит оральное введение эффективного количества mLT как стимулятора в смеси с убитыми или ослабленными патогенами или с соответствующими вирулентными детерминантами определенных патогенов без риска вызвать реальные или потенциальные побочные токсические эффекты, характерные при оральном введении ХТ или LT.
Данное изобретение изменяет прежнюю практику в том отношении, что оно может быть использовано в различных иммунологических приложениях, где можно было применять ХТ, LT или их субъединицы, но только теперь уже при использовании mLT нет реального или потенциального риска вызвать побочные действия, например диарею, характерную при применении ХТ и LT. В отличие от LT, который хотя и нетоксичен сразу после выделения, но сохраняет способность приобретать токсичность под действием протеаз, содержащихся в кишечнике млекопитающих, mLT не обладает способностью приобретать токсичность под действием протеаз.
Другое применение данного изобретения состоит в использовании его в качестве составной части вакцин против энтеротоксических организмов, которые экспрессируют холероподобные токсины. В данном изобретении показано, что mLT не вызывает орально индуцированной толерантности при его введении (см. ниже), поэтому mLT может функционировать как очень желательный компонент вакцин против энтеротоксических организмов. Современные технологии обеспечивают получение вакцин против организмов, экспрессирующих холероподобный токсин, в виде препаратов целых убитых клеток и B-субъединиц токсина. При замене B-субъединицы препаратом mLT в вакцине она улучшается в двух отношениях. Во-первых, mLT, который имеет две субъединицы A и B, индуцирует иммунный ответ не только к B, но и A-субъединице. Это обеспечивает большее количество эпитопов для эффективной нейтрализации. Во-вторых, активность стимулятора у mLT увеличивает иммунный ответ против компонента вакцины из убитых целых клеток.
Далее, другие исследователи [Hase et al. , 1994, Infect. Immun. 62: 3051-3057] показали, что A-субъединица, модифицированная так, что в результате изменения в ней активного сайта ферментативной активности АДФ-рибозилирования (в отличие от протеолитического сайта, который рассматривается в данном изобретении) она перестает быть токсичной, эта субъединица может индуцировать иммунный ответ против A-субъединицы дикого типа. Однако измененная таким образом A-субъединица утрачивает активность иммуностимулятора и поэтому становится менее желательной, чем mLT в качестве компоненты вакцины.
Кроме того, так как антитела против mLT перекрестно реагируют с LT и ХТ, mLT можно использовать в вакцинах против многих типов энтеротоксических бактериальных организмов, которые экспрессируют холероподобные токсины, например, Escherichia spp. и Vibrio spp.
5.1 Получение mLT
Токсин LT дикого типа кодируется природной плазмидой, содержащейся в штаммах энтеротоксических E.Coli, способных продуцировать этот токсин. Авторы данного изобретения ранее клонировали ген LT из E.Coli, полученных из человека, который имеет обозначение H10407. Этот субклон состоит из фрагмента ДНК величиной 5,2 к. п.о. из плазмиды H10407, встроенной в PstI сайт плазмиды pBR322 [Clements et al, 1983, Infect. Immun. 40: 653]. Эта рекомбинантная плазмида, обозначенная pDF82, всесторонне охарактеризована и экспрессируется под контролем природного промотора LT. Следующий этап в этом процессе состоял в постановке этого гена LT под контроль сильного промотора, в данном случае lac промотора в плазмиде pUC18. Это было дополнено выделением отдельно генов LT-A и LT-B и введением их с помощью рекомбинации в векторную плазмиду. Это было важным этапом, так как позволяло выделять достаточные количества LT и получать мутанты для последующего анализа. Эта плазмида, обозначенная через pBD94, представлена в виде диаграммы на фигуре 1.
В синтезируемых ХТ и LT содержится чувствительная к трипсину связка, которая соединяет участки A1 и A2. Чтобы молекула стала токсичной, у нее необходимо вырезать эту пептидную связку. То же справедливо для дифтерийного токсина - прототипа токсина A-B и для различных других бактериальных токсинов. Если связь между A1 и A2 не удалена бактериальными протеазами или протеазами в полости кишечника, то участок A1 не способен достичь мишень на базолатеральной поверхности эпителиальных клеток кишечника. В отличие от ХТ LT не обладает полной биологической активностью сразу после выделения из клеток. Для приобретения полной активности LT тоже нуждается в протеолизе, а протеолитическая активация не происходит внутри бактерии. Поэтому одним из способов изменения токсичности молекулы без изменения ферментативной активности АДФ-рибозилирования было бы удаление с помощью генетических манипуляций чувствительных к трипсину аминокислот, которые соединяют компоненты A1 и A2 в A-субъединице. Если молекулу нельзя расщепить с помощью протеолиза, она будет не токсичной. Однако необходимо было квалифицированно предсказать, что молекула при этом сохранит активность АДФ-рибозилирования. На фигуре 1 показана последовательность области петли, стягиваемой дисульфидными связями, которая разделяет участки A1 и A2. Внутри этой области имеется один остаток аргинина, который, как считают, является сайтом расщепления, необходимого для активации токсических свойств молекулы. Эта область была изменена с помощью сайтспецифического мутагенеза таким образом, чтобы сделать молекулу нечувствительной к протеолитическому расщеплению и, следовательно, нетоксичной.
Сайтспецифический мутагенез осуществляется путем гибридизации с одноцепочечной ДНК синтетического олигонуклеотида, который комплементарен одной одноцепочечной матрице за исключением неспариваемой области вблизи центра. Это именно та область, которую необходимо изменить. После гибридизации с одноцепочечной мишенью ДНК олигонуклеотид наращивается с помощью ДНК-полимеразы для получения двухцепочечной структуры. Затем брешь скрепляется ДНК-лигазой и двухцепочечную структуру трансформируют в бактерию-хозяина E.Coli. Теоретически выход мутантов с помощью этой процедуры составляет 50% в соответствии с полуконсервативным механизмом репликации ДНК. Практически выход намного меньше. Имеется однако ряд методов, позволяющих повысить выход и провести селекцию совершенно определенных мутантов. В примененной здесь системе использован второй мутагенный олигонуклеотид для получения измененных сайтов рестрикции в стратегии двойного мутагенеза.
Следующий этап состоял в замене Арг на другую аминокислоту (т.е., GGA= Gly заменяет AGA=Arg), таким образом, чтобы сохранить рамку считывания и устранить протеолитический сайт. Затем mLT очищали с помощью аффинной хроматографии на колонке с агарозой из мутанта (pBD95), подлинность которого подтверждали секвенированием. Могут быть применены другие методы очистки. Полученный мутант LT, обозначенный как LT(R192G), затем был исследован с помощью электрофореза в SDS-полиакриламидном геле на предмет изменения чувствительности связки к трипсину. Были исследованы как необработанные, так и обработанные трипсином образцы и проведено сравнение с природным (не модифицированным) LT. mLT не диссоциировал на участки A1 и A2 при инкубации с трипсином, что указывает на отсутствие чувствительности к протеазе.
5.2 Способ введения mLT и неродственных антигенов
Согласно данному изобретению mLT может быть введен вместе с каким-нибудь подходящим биологическим антигеном и/или вакциной, чтобы получить повышенный иммунный ответ к этому антигену и/или вакцине. Предпочтителен вариант одновременного введения mLT и антигена в виде фармацевтического состава, включающего эффективную дозу mLT и эффективную дозу антигена. Способ введения - оральный. Соответствующее количество mLT и антигена будет меняться в зависимости от идентичности используемого антигена и вида животного, подлежащего вакцинации. В одном из вариантов после первого введения mLT и антигена проводится ревакцинация нужным антигеном. В другом варианте ревакцинация не проводится. Время ревакцинации можно изменять в зависимости от типа антигена и вида животного. Изменения доз и времени ревакцинации для каждого данного вида животного и антигена легко подобрать в стандартных экспериментах. Ревакцинацию можно проводить одним антигеном или в комбинации с mLT. Способ введения при ревакцинации может быть либо оральным, либо нозальным, либо парентеральным; однако, если при ревакцинации используется mLT, предпочтительно оральное введение.
Методы и составы данного изобретения применимы как для молодых, так и зрелых особей позвоночных, в частности птиц, млекопитающих и человека. Используемые антигены, как примеры, а не ограничивающие список применимых, включают антигены из патогенных штаммов бактерий (Streptococcus pyogenes, Streptococcus pneumoniae, Neisseria gonorrheae, Neisseria meningitidis, Corynebacterium diphtheriae, Clostridium botulinum, Clostridium perfringens, Clostridium tetani, Hemophilus influenzae, Klebsiella pneumoniae, Klebsiella ozaenae, Klebsiella rhinoscleromotis, Staphylococcus aureus, Vibrio colerae, Escherichia coli, Pseudomonas aeruginosa, Campylobacter (Vibrio) fetus, Aeromonas hydrophila, Bacillus cereus, Edwardsiella tarda, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, Salmonella typhimurium, Treponema pallidum, Treponema pertenue, Treponema carateneum, Borrelia vincentii, Borrelia burgdorferi, Leptospira icterohemorrhagiae, Mycobacterium tuberculosis, Toxoplasma gondii, Pneumocystis carinii, Francisella tularensis, Brucella abortus, Brucella suis, Brucella melitensis, Mycoplasma spp., Rickettsia prowazeki, Rickettsia tsutsugumushi, Chlamydia spp.); патогенные грибы (Coccidioides immitis, Aspergillus fumigatus, Candida albicans, Blastomyces dermatitidis, Cryptococcus neoformans, Histoplasma capsulatum); простейшие (Entomoeba histolytica, Trichomonas tenas, Trichomonas hominis, Trichomonas vaginalis, Trypanosoma gambiense, Trypanosoma rhodesiense, Trypanosoma cruzi, Leishmania donovani, Leishmania tropica, Leishmania braziliensis, Pneumocystis pneumonia, Plasmodium vivax, Plasmodium falciparum, Plasmodium malaria); или гельминты (Enterobius vermicularis, Trichuris trichiura, Ascaris lumbricoides, Trichinella spiralis, Strongyloides stercoralis, Schistosoma japonicum, Schistosoma mansoni, Schistosoma haematobium), и нематоды. Все они поступают в иммунную систему или в форме неразрушенных клеток, или в форме фрагментов, выделенных из среды для культивирования указанных организмов, которая хорошо известна специалистам, или в виде защитных антигенов указанных организмов, полученных с помощью методов генной инженерии, или химического синтеза.
Другими приемлемыми антигенами могут быть патогенные вирусы (например: Poxviridae, Herpesviridae, Herpes Simplex virus 1, Herpes Simplex virus 2, Adenoviridae, Papovaviridae, Enteroviridae, Picornaviridae, Parvoviridae, Reoviridae, Retroviridae, вирусы гриппа, парагриппозные вирусы, вирусы эпидемического паротита, вирус кори, вирус дыхательного синцития, вирус коревой краснухи, Arboviridae, Rhabdoviridae, Arenaviridae, вирус гепатита A, вирус гепатита B, вирус гепатита C, вирус гепатита E, вирус не - A/не - B гепатита Rhinoviridae, Coronaviridae, Rotoviridae, и вирус иммунодефицита человека), которые поступают в иммунную систему или в виде целых частиц, или в виде фрагментов, выделенных из среды для культивирования, предназначенной для выращивания таких вирусов, известной специалистам, или же в форме защитных антигенов, получаемых с помощью методов генной инженерии или химическим синтезом.
К числу других приемлемых антигенов принадлежат вакцины. Примерами таких вакцин являются противогриппозная вакцина, противококлюшная вакцина, вакцина против столбнячного токсоида в комбинации с противококлюшной вакциной, вакцина против гепатита A, вакцина против гепатита B, вакцина против гепатита C, вакцина против гепатита E, вакцина против японского энцефалита, вакцина против герпеса, вакцина против кори, вакцина против коревой краснухи, вакцина против эпидемического паротита, смешанные вакцины от кори, эпидемического паротита, коревой краснухи, вакцина против вируса папилломы, вакцина против парвовируса, вакцина от вируса дыхательного синцития, вакцина от болезни Лайма, вакцина от вируса полиомиелита, вакцина от малярии, ветряной оспы, гонорреи, вакцина против HIV, бильгарциоза, вакцина от ротавируса, малярии, ветряной оспы, противоменингококковая вакцина и другие. Их можно получить с помощью общеизвестных процедур. Вообще такие вакцины состоят или из целого организма или вирусов, выращенных и очищенных с помощью методов, хорошо знакомых квалифицированным специалистам, или они состоят из соответствующих антигенов этих организмов или вирусов, которые получают с помощью генной инженерии или химическим синтезом. Неполная иллюстрация их продукции приводится ниже.
Противогриппозная вакцина: вакцина состоит из целой вирусной частицы или ее частей с гемагглютинином, нейроаминидазой, ядерным белком и белком остова частицы, которые образуются при очистке вируса, выращенного в яичном эмбрионе, с применением детергента или без него или же методом генной инженерии или химическим синтезом.
Вакцина против коклюша: вакцина состоит из целой частицы или ее частей с токсином вируса коклюша, гемагглютинином и K-агглютинином, которые получают из авирулентного токсина с помощью формалина, экстракции путем высаливания или ультрацентрифугированием из культурального бульона или бактериальных клеток или же методами генной инженерии или химического синтеза.
Дифтерийный или столбнячный токсоид, скомбинированный с противококлюшной вакциной: простое смешивание дифтерийной и противококлюшной вакцины.
Вакцина против японского энцефалита: целый вирус или его часть с белковым антигеном, которую получают путем культивирования вируса интрацеребрально в мыши и путем очистки вируса центрифугированием или этилэтанолом и его инактивации или же методом генной инженерии или химическим синтезом.
Вакцина против гепатита B: вакцина состоит из целой вирусной частицы или ее части с белковым антигеном, которые получают путем выделения и очистки HB антигена путем высаливания или ультрацентрифугированием из крови особи с гепатитом или же методами генной инженерии или химическим синтезом.
Вакцина против кори: вакцина состоит из целых вирусных частиц или фрагментов вируса, выращенного в культивируемых клетках куриного эмбриона или в яичном эмбрионе, или защитного антигена, полученного методом генной инженерии или химическим синтезом.
Вакцина против коревой краснухи: вакцина состоит из целого вируса или фрагмента вируса, выращенного в культивируемых клетках куриного эмбриона или в яичном эмбрионе, или из защитного антигена, полученного методами генной инженерии или химическим синтезом.
Вакцина против эпидемического паротита: вакцина состоит из целого вируса или его фрагмента, выращенных в культивируемых клетках кролика или в яичном эмбрионе, или же защитного антигена, полученного методами генной инженерии или химическим синтезом.
Смешанная вакцина против кори, коревой краснухи и эпидемического паротита: вакцину получают путем смешивания вакцин против кори, коревой краснухи и эпидемического паротита.
Вакцина против ротавируса: вакцина состоит из целого вируса или фрагмента вируса, выращенного в культивируемых клетках MA104, или вируса, выделенного из фекалия пациента, или же из защитного антигена, полученного методами генной инженерии или химическим синтезом.
Вакцина против микоплазмы: вакцина состоит из целых клеток микоплазмы или фрагментов клеток, выращенных в жидкой среде для культивирования микоплазмы, или из защитного антигена, полученного методами генной инженерии или химическим синтезом.
Условия, при которых может быть проведена эффективная вакцинация с помощью предложенного метода, очевидны для квалифицированных специалистов.
Составы препаратов вакцин данного изобретения могут быть приготовлены путем смешивания в необходимых пропорциях указанных выше антигенов и/или вакцин с mLT. Процедуру приготовления следует проводить в строго стерильных условиях, и каждый компонент также должен быть стерильным. Примеси природных пирогенов или аллергенов следует удалять по возможности полно. Для приготовления препаратов антигенов данного изобретения используемые антигены приготавливаются perse и отдельно от mLT.
Далее, в данное изобретение входит набор, состоящий из эффективной дозы антигена и эффективной дозы mLT как стимулятора. При использовании эти компоненты набора можно смешать перед введением орально, или компоненты можно вводить орально по отдельности через короткие интервалы времени.
Составы препаратов вакцин данного изобретения могут быть приготовлены либо в виде жидкости или с твердым фармацевтическим носителем, они могут быть в виде таблеток, капсул, порошка, гранул, суспензий или растворов. Составы могут также содержать необходимые консерванты, корригенты цвета, запаха и вкуса или агенты, замедляющие рассасывание. К потенциальным носителям, которые могут быть использованы при получении фармацевтических составов данного изобретения, относятся, например, желатиновые капсулы, сахара, производные целлюлозы, такие как карбометилцеллюлоза, желатин, тальк, стеарат магния, растительное масло, арахисовое масло и т.д., глицерин, сорбитол, агар и вода. Носители могут служить как связывающие для облегчения приготовления состава в виде таблеток, удобных для введения орально. Для длительного хранения составы препаратов вакцин данного изобретения могут быть высушены леофильно или с помощью других методов, хорошо известных специалистам. Для орального введения препараты вакцин могут быть переведены в суспензию в забуференный солевой раствор, молоко или другие физиологические жидкости. При необходимости эту среду можно сделать приятной путем добавления корригентов.
Перед введением состава препарата вакцины можно дать орально эффективную дозу вещества, нейтрализующего желудочные кислоты. Среди многих веществ для этой цели предпочтителен бикарбонат натрия. При других вариантах составы вакцины можно заключать в капсулы с оболочкой (т.е. капсулы, которые растворяются только после прохождения через желудок).
6. Примеры
Нижеследующие примеры даются только с целью иллюстрации, но ни коим образом ими не ограничиваются рамки данного изобретения.
6.1. Конструирование mLT
Хорошо известный токсин LT кодируется природной плазмидой, имеющейся у энтеротоксигенных штаммов E.Coli, способных синтезировать этот токсин. Авторы данного изобретения ранее клонировали ген LT из E.Coli, выделенной из человека, который обозначили как H10407. Этот субклон содержит фрагмент ДНК 5,2 к.п.о. из плазмиды энтеротоксина H10407, встроенный в PstI сайт плазмиды pBR322 [Clements et al., 1983, Infect. Immun. 40:653]. Эта рекомбинантная плазмида, обозначенная через pDF82, всесторонне охарактеризована и экспрессируется под контролем природного промотора LT. На следующем этапе этого процесса ген LT был поставлен под контроль сильного промотора, в данном случае lac промотора в плазмиду pUC18. После этого были отдельно изолированы гены LT-A и LT-B и их рекомбинировали вместе в векторную плазмиду. Это был важный этап, так как он позволил очистить требуемое количество LT и получить мутант для последующего анализа. Эта плазмида, обозначенная pDF94, показана на диаграмме фигуры 1. ХТ и LT синтезируются с чувствительной к трипсину связкой, которая соединяет участки A1 и A2. Чтобы токсин приобрел токсичность, необходимо вырезать эту пептидную связку. То же справедливо и для дифтерийного токсина, прототипа токсина A-B, а также многих других бактериальных токсинов. Если связка A1-A2 не удалена под действием бактериальных протеаз или протеаз внутренней полости кишечника, т.е. путем протеолитического процессинга, то участок A1 не может реагировать с мишенью на эпителиальных клетках базолатеральной поверхности кишечника. В отличие от ХТ LT не обладает полной биологической активностью сразу после выделения из клеток. Для полной активности необходим протеолиз LT, и внутри бактерии протеолитическая активация не происходит. Поэтому один из способов изменения токсичности молекулы без изменения ее ферментативной активности АДФ-рибозилирования может состоять в удалении с помощью генетических манипуляций, чувствительных к трипсину аминокислотных последовательностей, связывающих компоненты A1 и A2 субъединицы A. Если молекулу нельзя расщепить путем протеолиза, она не может стать токсичной. Однако профессионал должен уметь предсказать, что при этом молекула сохранит свою активность АДФ-рибозилирования и, следовательно, функцию как стимулятора.
На фигуре 1 показана последовательность области, соединяемой дисульфидными связями, которая разделяет участки A1 и A2. Внутри этой области есть один остаток аргинина, который, как считают, является сайтом расщепления, необходимого для активации токсических свойств молекулы. Эту область изменили с помощью сайтспецифического мутагенеза таким образом, чтобы сделать молекулу нечувствительной к протеолитическому расщеплению и, следовательно, не токсичной.
Сайтспецифический мутагенез осуществляется путем гибридизации с одноцепочечной ДНК синтетического олигонуклеотида, который комплементарен одной одноцепочечной матрице за исключением неспариваемой области вблизи центра. Это именно та область, которую необходимо изменить. После гибридизации с одноцепочечной мишенью ДНК олигонуклеотид наращивается с помощью ДНК-полимеразы для получения двухцепочечной структуры. Затем разрыв заполняется ДНК-лигазой и двухцепочечная структура используется для трансформации бактерии - хозяина E.Coli. Теоретически выход мутантов с помощью этой процедуры составляет 50% в соответствии с полуконсервативным механизмом репликации ДНК. Практически выход намного меньше. Имеется однако ряд методов, позволяющих повысить выход и провести селекцию совершенно определенных мутантов. В примененной здесь системе использован второй мутагенный олигонуклеотид для получения измененных сайтов рестрикции в стратегии двойного мутагенеза.
Следующий этап состоял в замене Арг на другую аминокислоту (т.е. GGA=Gly заменяет AGA=Arg), таким образом, чтобы сохранить рамку считывания и устранить протеолитический сайт. Затем mLT очищали с помощью аффинной хроматографии на колонке с агарозой из мутанта (pBD95), подлинность которого подтверждали секвенированием. Могут быть применены другие методы очистки. Полученный мутант LT, обозначенный как LT(R192G), затем был исследован с помощью электрофореза в SDS-полиакриламидном геле на предмет изменения чувствительности связей к трипсину. Были исследованы как необработанные, так и обработанные трипсином образцы и проведено сравнение с природным (не модифицированным) LT. mLT не диссоциировал на участки A1 и A2 при инкубации с трипсином, что указывает на отсутствие чувствительности к протеазе.
6.2. Действие mLT на клетки надпочечника У-1
Один из авторов данного изобретения предположил, что mLT не будет активным в тесте на клетках подпочечника У-1. Это предположение было основано на ранее полученных результатах [Clements and Finkelstein, 1979, Infect. Immun. 24: 760-769], согласно которым LT без разрыва более чем в 1000 раз менее активен в этом тесте, чем ХТ, и что обработка трипсином активирует LT до такого же уровня биологической активности, какой был у ХТ в данном тесте. Было сделано предположение, что остаточная активность LT, наблюдаемая в этом тесте в отсутствии активации трипсином, была обусловлена функцией остаточной протеазной активности, которую нельзя учесть. Например, это мог быть трипсин, использованный в процессе культивирования клеток надпочечника У-1. Поэтому предположили, что LT, у которого не могло быть разрыва, не был полностью активным в тесте на клетках надпочечника У-1. Результаты приведены в табл. 1.
Из табл. 1 видно, что LT сохраняет базовый уровень активности в тесте на У-1 клетках надпочечника, как если бы он не подвергался протеолитическому процессингу. Как видно из табл. 1, ХТ и природный LT, обработанный трипсином, имели одинаковый уровень активности (15 пкг) на У-1 клетках надпочечника. Напротив, mLT (48000 пкг) имел более чем в 1000 раз меньшую активность, чем ХТ или природный LT, и не активировался трипсином. Остаточная базовая активность несомненно отражает наличие другого, до сих пор неизвестного пути активации клеток надпочечника, отличного от того, для которого требуется разделение связи A1-A2.
6.3. Ферментативная активность АДФ-рибозилирования у mLT
Так как мутация замены Арг на Гли не изменяет ферметативный сайт участка A1, специалисты предположили, что mLT сохраняет ферментативную активность АДФ-рибозилирования. Для исследования этого свойства использовали НАД-агматин-АДФ-трансферазный тест [Moss et al., 1993, J. Biol. Chem. 268: 6383-6387] . Как видно из фигуры 2, ХТ вызывает зависящее от дозы увеличение уровня АДФ-рибозилагматина, обусловленное действием АДФ-рибозилтрансферазной активности этой молекулы.
Из табл. 2 виден неожиданный результат, что mLT не обнаруживает сколько-нибудь заметную ферментативную активность АДФ-рибозилирования, как без обработки, так и после обработки трипсином, даже в случае отсутствия замены ферментативного сайта молекулы, и это было видно по сохранению базового уровня активности в тесте на У-1 клетках надпочечника.
6.4. Энтеротоксическая активность mLT
Также было обнаружено, что mLT не имеет заметную ферментативную АДФ-рибозилированную активность как с, так и без активации трипсином, даже в случае, если бы ферментативный сайт не был бы заменен, и, поскольку в тесте на У-1 клетках надпочечника также сохраняется базовый уровень активности, было неясно, сохраняются ли у mLT свойства энтеротоксина. Будучи по своему строению идеальным стимулятором, mLT сохраняет способность действовать как иммуностимулятор, но утратил реальное или потенциальное действие, как, например, способность вызывать диарею, характерную для LT или ХТ. Из фигуры 3 видно, что mLT не индуцирует выделение жидкости на мышиной модели даже при дозе 125 мкг. Эта доза более чем в пять раз превышает эффективную дозу LT в данной модели. Важно, что при таком уровне дозы можно наблюдать потенциальную токсическую активность LT.
6.5. Активность mLT как стимулятора
Один из специалистов по этому вопросу предположил, что поскольку mLT не обладает заметной активностью АДФ-рибозилтрансферазы и не является энтеротоксином, он утратил и активность стимулятора. Это предположение основано на сообщении Лайка и др. [Lycke et al., 1992, Eur. J. Immunol. 22: 2277-2281], из которого было ясно, что изменения, которые влияют на ферментативную активность АДФ-рибозилирования у токсина, изменяют и его способность увеличивать внутриклеточный уровень цАМФ, также будут отменять его функцию как стимулятора. Как было показано выше, mLT не имеет ферментативную активность АДФ-рибозилирования и имеет лишь слабый базовый уровень активности на У-1 клетки надпочечника, а также не индуцирует жидкости в мышиной модели.
Для исследования активности mLT как стимулятора был выполнен следующий эксперимент. Иммунизировали три группы мышей BALB/c. Для введения препарата животным использовали тупоконечную иглу для подпитки. В нулевой день каждую группу иммунизировали орально следующим образом: Группа A получала 0.5 мл PBS, содержащего 5 мг OVA, Группа B получала 0.5 мл PBS, содержащего 5 мг OVA и 25 мкг природного LT, и Группа C получала 0.5 мл PBS, содержащего 5 мг OVA и 25 мкг mLT. Процедуру введения каждой группе повторяли на 7-й и 14-й день. На 21-й день всех животных ревакцинировали внутрибрюшинно 1 мкг OVA в 20% Маалоксе. Через неделю после этой ревакцинации животных забивали и определяли сывороточные IgG антитела и IgA антитела кишечника против OVA и LT с помощью ELISA.
Реагенты и антисыворотки для ELISA были получены из Sigma Chemical Co. Образцы для ELISA серийно разводили в PBS (pH 7.2) - 0.05% Tween 20 (PBS-TWEEN). Для определения антител против детерминант LT платы для микротитрования предварительно покрывали смесью ганглиозидов (Тип III) - 1.5 мкг на ячейку, затем вводили по 1 мкг на ячейку очищенный LT. Анти-OVA определяли на микроплатах, предварительно покрытых OVA - 10 мкг на ячейку. Сывороточный анти-LT и анти-OVA определяли с помощью кроличьих антисывороток против мышиного IgG, конъюгированных со щелочной фосфатазой. Анти-LT и анти-OVA слизистой испытывали с помощью козьих антисывороток против мышиного IgA (альфа-цепь специфических) с последующим проявлением с помощью кроличьих антисывороток, конъюгированных со щелочной фосфатазой. Реакцию останавливали 3HNaOH. Концентрацию IgG и IgA определяли по стандартной калибровочной кривой, построенной для очищенных миеломных белков (MOPC 315, gA(IgA12); MOPC 21, gG1: Litton Bionetics. Inc., Charleston, SC).
6.5.1 Сывороточные IgG анти-OVA
Как видно из фигуры 4A, у животных, иммунизированных препаратами OVA и LT, развивается гораздо более сильная реакция синтеза сывороточных IgG анти-OVA при последующей парентеральной иммунизацией OVA (нет заметного синтеза анти-OVA) (t-тест Стьюдента p = .031). Примечательно, что у животных, иммунизированных орально препаратами OVA и mLT, также развивается значительно более сильная реакция синтеза сывороточных IgG анти-OVA после последующей иммунизации парентерально препаратом OVA (1.338 мкг/мл), чем у животных, иммунизированных препаратом OVA с последующей иммунизацией парентерально препаратом OVA (нет заметного синтеза анти-OVA) (t-тест Стьюдента p = ,0007).
6.5.2 cIgA анти-OVA
Как видно из фигуры 4B, были получены близкие результаты при сравнении реакции синтеза IgA анти-OVA внутри групп животных. У животных, иммунизированных орально OVA и LT, развивалась гораздо более сильная реакция синтеза IgA анти-OVA слизистой после последующей парентеральной иммунизации OVA (869 нг/мл), чем у животных, иммунизированных только OVA с последующей иммунизацией парентерально OVA (нет синтеза анти-OVA) (t-тест Стьюдента p = ,0131). Как и выше, у животных, иммунизированных орально OVA и mLT, также развивалась гораздо более сильная реакция синтеза IgA анти-OVA слизистой после последующей парентеральной иммунизации OVA (230 нг/мл), чем у животных, иммунизированных только OVA с последующей иммунизацией парентерально OVA (нет заметного синтеза анти-OVA).
6.5.3 Сывороточные IgG анти-LТ
Была исследована способность LT и mLT увеличивать реакцию синтеза анти-LT антител у ряда животных. Это было важно в том отношении, что реакция служит показателем способности мутантного LT предотвращать индукцию толерантности к себе наряду с функционированием его как стимулятора для других белков. Как видно из фигуры 5A, у животных, иммунизированных орально OVA и LT развивалась гораздо более сильная реакция синтеза сывороточных IqG анти-LT после последующей парентеральной иммунизации OVA (342 мкг/мл), чем у животных, иммунизированных только OVA и затем иммунизированных парентерально OVA (нет заметного синтеза анти-LT) (t-тест Стьюдента p = ,00005). У животных, иммунизированных орально OVA и mLT, также развивалась гораздо более сильная реакция синтеза сывороточных IgG анти-LT после последующей иммунизации OVA (552 мкг/мл), чем у животных, иммунизированных только OVA и затем иммунизированных парентерально OVA (нет заметного синтеза анти-LT) (t-тест Стьюдента p = ,0026).
6.5.4 cIgA анти-LT слизистой
Как видно из фигуры 5B, близкие результаты были получены при сравнении синтезов IgA анти-LT внутри групп животных. У животных, иммунизированных орально OVA и LT, развивалась гораздо более сильная реакция синтеза IgA анти-LT после последующей парентеральной иммунизации OVA (4,328 нг/мл), чем у животных, иммунизированных только OVA и затем иммунизированных OVA (нет заметного синтеза анти-LT) (t-тест Стьюдента p = ,0047). Как и выше, у животных, получивших орально OVA и mLT, также развивалась гораздо более сильная реакция синтеза IgA анти-OVA после последующей иммунизации парентерально OVA (1,463 нг/мл), чем у животных, получивших только OVA и затем иммунизированных парентерально OVA (нет заметного синтеза анти-LT) (t-тест Стьюдента p = ,0323).
7. Банк микроорганизмов (см. табл. 3)
Следующая плазмида была помещена в Банк Американской коллекции клеточных культур (ATCC), Rockville, MD 18 августа, 1994 и зарегистрирована под указанным каталожным номером:
Плазмида - Каталожный номер
pBD95 в E.Coli LTR192G - MTCC 69683
Описанное и заявленное здесь изобретение, взятое во всей его полноте, не ограничивается конкретными приложениями сделанного открытия, так как последние служат только иллюстрацией разных аспектов данного изобретения. Любые адекватные приложения составляют часть всего изобретения в целом. В действительности, из вышеприведенного описания, иллюстрирующего приложения сделанного открытия, для специалистов становятся очевидными различные модификации изобретения.
Необходимо также иметь в виду, что все величины, характеризующие количество пар оснований и аминокислотных остатков, а также размеры нуклеотидов и пептидов, приведенных здесь, являются приблизительными и используются с целью описания.
Приведены ссылки на цитируемые публикации и публикации, содержащие материалы для данного изобретения.


Настоящее изобретение раскрывает методы и композиции для применения новой мутантной формы термолабильного энтеротоксина из E.сoli, в котором аргинин в положении 192 заменен глицином, который утратил токсичность, но сохранил иммунологическую активность. Этот энтеротоксин используется в комбинации с непосредственным антигеном для получения усиленной иммунной реакции против вышеуказанного антигена при введении в виде составной части орального препарата вакцины. 5 с. и 13 з.п.ф-лы, 5 ил., 3 табл.
| US 5182109, 26.01.1993 | |||
| Адъювант | 1975 |
|
SU596241A1 |
| Способ иммунокоррекции при затяжных формах гепатита | 1989 |
|
SU1678373A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
Авторы
Даты
2000-12-20—Публикация
1995-07-18—Подача