УРОВЕНЬ ТЕХНИКИ
[1] Настоящее изобретение описывает полипептиды, пригодные для изготовления вакцины против некротического энтерита у домашней птицы. Более конкретно, настоящее изобретение относится к полипептиду пилуса Clostridium perfringens, пригодному для изготовления вакцины против некротического энтерита, связанного с инфекцией Clostridium perfringens у домашней птицы.
[2] Некротический энтерит является кишечным заболеванием домашней птицы, например бройлерных цыплят, потери птицеводческой промышленности от которого в 2015 году оцениваются в 6 миллиардов долларов США. Некротический энтерит вызывают главным образом некоторые штаммы А типа бактерии Clostridium perfringens, которые производят NetB порообразующий токсин, и которые разрастаясь прирастают к слизистой оболочке кишечника, в результате чего образуются характерные повреждения, свойственные этому заболеванию. Clostridium perfringens является обычным обитателем кишечного тракта, и в основном только те штаммы, которые несут NetB токсин, могут вызывать некротический энтерит. Некротический энтерит главным образом контролируют с помощью антибиотиков, которые вводят в корм, однако эта практика ускоренными темпами прекращается из-за риска потенциального распространения резистентности к противомикробным препаратам, и в настоящее время исключена из производства в некоторых странах. Вследствие этого, как с финансовой, так и с точки зрения здравоохранения является важным найти альтернативный подход к контролю некротического энтерита, например, разработать вакцину.
[3] Адгезионный генетический локус (VR-10B) бактерий Clostridium perfringens был недавно идентифицирован через его ассоциацию с NetB-позитивными штаммами (Lepp D, Gong J, Songer JG, Boerlin P, Parreira VR, Prescott JF. 2013. Identification of Accessory Genome Regions in Poultry Clostridium perfringens Isolates Carrying the netB Plasmid. Journal of Bacteriology 195: 1152-1166). Идентифицированный генетический локус был обнаружен в 87% netB-позитивных и 42% netB-негативных изолятах из 54 исследованных изолятов домашней птицы. Позже было показано, что этот генетический локус (впоследствии переименованный в коллаген-адгезионный (СА) локус) вовлечен в связывание коллагена и является необходимым для патогенеза некротического энтерита (Wade В, Keyburn AL, Haring V, Ford М, Rood JI, Moore RJ: The adherent abilities of Clostridium perfringens strains are critical for the pathogenesis of avian necrotic enteritis. Vet Microbiol 2016, 197: 53-61; Wade B, Keyburn AL, Seemann T, Rood JI, Moore RJ: Binding of Clostridium perfringens to collagen correlates with the ability to cause necrotic enteritis in chickens. Vet Microbiol 2015, 180: 299-303.).
[4] Многие белки Clostridium perfringens ранее рассматривались как потенциальные кандидаты для вакцины. Однако эти белки в лучшем случае обеспечивают частичную защиту от некротического энтерита. Кроме того, многие из этих белков не являются специфичными к вызывающим некротический энтерит штаммам бактерий, и их роль в патогенезе некротического энтерита неизвестна. Таким образом, является желательным идентифицировать альтернативные полипептиды Clostridium perfringens, которые могут послужить кандидатами для производства вакцины против некротического энтерита.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[5] В одном аспекте данное изобретение описывает выделенный полипептид пилуса Clostridium perfringens. В другом аспекте данное изобретение описывает иммуногенный полипептид, выбираемый из выделенного полипептида пилуса Clostridium perfringens, варианта полипептида пилуса, фрагмента полипептида пилуса и фрагмента варианта, при этом упомянутые полипептид пилуса, вариант, фрагмент полипептида и фрагмент варианта являются иммуногенными у домашней птицы. По меньшей мере в одном варианте осуществления данного изобретения, полипептид пилуса является CnaA полипептидом. По меньшей мере в одном варианте осуществления данного изобретения, полипептид пилуса является FimA полипептидом. По меньшей мере в одном варианте осуществления данного изобретения полипептид пилуса является FimB полипептидом. По меньшей мере в одном варианте осуществления данного изобретения полипептид пилуса является скомплектованным пилусом.
[6] В другом аспекте данное изобретение описывает полинуклеотид, включающий последовательность, кодирующую выделенный полипепгид пилуса Clostridium perfringens или иммуногенный полипептид согласно описанию, содержащемуся в этом документе. В другом аспекте, данное изобретение описывает вектор, включающий полинуклеотид. обладающий последовательностью, кодирующей выделенный полипептид пилуса Clostridium perfringens или иммуногенный полипептид согласно описанию, содержащемуся в этом документе, при этом упомянутый вектор сконфигурирован для экспрессии выделенного полипептида пилуса Clostridium perfringens или иммуногенного полипептида в клетке-хозяине.
[7] В другом аспекте данное изобретение описывает вакцину для лечения или предотвращения некротического энтерита у домашней птицы, при этом вакцина включает иммуногенный полипептид согласно описанию, содержащемуся в этом документе. В другом аспекте, данное изобретение описывает вакцину для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы, при этом вакцина включает иммуногенный полипептид согласно описанию, содержащемуся в этом документе.
[8] В другом аспекте данное изобретение описывает применение иммуногенного полипептида согласно описанию, содержащемуся в этом документе, для изготовления медикамента для лечения или предотвращения некротического энтерита у домашней птицы, или для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы.
[9] В другом аспекте данное изобретение описывает способ лечения или предотвращения некротического энтерита у домашней птицы, или лечения или предотвращения инфекции Clostridium perfringens у домашней птицы, включающий введение эффективного количества иммуногенного полипептида согласно описанию, содержащемуся в этом документе, или его вакцины, домашней птице.
[10] В другом аспекте данное изобретение описывает применение иммуногенного полипептида согласно описанию, содержащемуся в этом документе, в качестве вакцины для лечения или предотвращения некротического энтерита у домашней птицы, или для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы.
[11] В другом аспекте данное изобретение описывает антитело, селективно связывающееся с иммуногенным полипептидом согласно описанию, содержащемуся в этом документе. В другом аспекте данное изобретение описывает способ обнаружения инфекции Clostridium perfringens у домашней птицы путем получения биологического образца у домашней птицы и обнаружения в биологическом образце присутствия антитела, селективно связывающегося с иммуногенным полипептидом согласно описанию, содержащемуся в этом документе. В другом аспекте данное изобретение описывает способ обнаружения иммуногенного полипептида согласно описанию, содержащемуся в этом документе, включающий взаимодействие иммуногенного полипептида с антителом, селективно связывающимся с иммуногенным полипептидом, и обнаружение связывания иммуногенного полипептида с антителом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[12] Дальнейшие признаки данного изобретения станут очевидны из последующего описания, сопровождающегося чертежами, на которых изображено следующее.
[13] На Фиг. 1 изображена диаграмма 5,2 тысяч пар нуклеотидов Clostridium perfringens VR-10B хромосомного локуса.
[14] На Фиг. 2А изображена фотография, иллюстрирующая разделение рекомбинантного меченного гистидином пилусного элементного полипептида CnaA в ходе электрофореза с натрий додецил сульфат-полиакриламидным гелем (SDS-PAGE), визуализированное с помощью окрашивания Кумасси.
[15] На Фиг. 2В изображена фотография, иллюстрирующая разделение рекомбинантного пилусного элементного полипептида FimA путем SDS-PAGE, визуализированное с помощью окрашивания Кумасси.
[16] На Фиг. 2С изображена фотография, иллюстрирующая разделение рекомбинантного пилусного элементного полипептида FimB путем SDS-PAGE, визуализированное с помощью окрашивания Кумасси.
[17] На Фиг. 2D изображена фотография, иллюстрирующая визуализацию путем SDS-PAGE и с помощью окрашивания Кумасси смешанных фракций CnaA, FimA и FimB, после упаривания и обессоливания.
[18] На Фиг. 3А изображен график, иллюстрирующий ответ сывороточного IgY антитела (абсорбция при 405 нм) на CnaA рекомбинантный полипептид кур, иммунизированных при первой вакцинации или только адъювантом, или CnaA. Каждая точка обозначает отдельного индивидуума, а горизонтальная линия обозначает среднее значение. Значок * обозначает значительное отличие от до-иммунизированного образца (d8) из каждой группы при уровне р<0,05, значок ** обозначает значительное отличие при уровне р<0,01, и *** обозначает значительное отличие при уровне р<0,001 при измерении по тесту Таки (Tukey, J. "Comparing Individual Means in the Analysis of Variance". Biometrics (1949) 5(2): 99-114).
[19] На Фиг. 3В изображен график, иллюстрирующий ответ сывороточного IgY антитела (абсорбция при 405 нм) на FimA рекомбинантный полипептид птиц, иммунизированных или только адъювантом, или FimA в тесте по Фиг. 3А. Каждая точка обозначает отдельного индивидуума, а горизонтальная линия обозначает среднее значение. Значок * обозначает значительное отличие от до-иммунизированного образца (d8) из каждой группы при уровне р<0,05, значок ** обозначает значительное отличие при уровне р<0,01, и *** обозначает значительное отличие при уровне р<0,001 при измерении по тесту Таки.
[20] На Фиг. 4 изображен график, иллюстрирующий значение оценки повреждения от некротического энтерита (NE) у групп цыплят, иммунизированных только адъювантом, или CnaA, или FimA в тесте по Фиг. 3А, с последующим введением с пищей Clostridium perfringens штамма СР1. Каждая точка обозначает отдельного индивидуума, а горизонтальная линия обозначает среднее значение оценки повреждения от некротического энтерита.
[21] На Фиг. 5А изображен график, иллюстрирующий ответ сывороточного антитела IgY (абсорбция при 405 нм) на CnaA рекомбинантный полипептид цыплят, иммунизированных только адъювантом, только CnaA, или комбинацией CnaA, FimA и FimB (Comb) при второй вакцинации. Каждая точка обозначает отдельного индивидуума, а горизонтальная линия обозначает среднее значение. Значок * обозначает значительное отличие от до-иммунизированного образца (d7) из каждой группы при уровне р<0,05, значок ** обозначает значительное отличие при уровне р<0,01, и *** обозначает значительное отличие при уровне р<0,001 при измерении по тесту Таки.
[22] На Фиг. 5 В изображен график, иллюстрирующий ответ сывороточного антитела IgY (абсорбция при 405 нм) на FimA рекомбинантный полипептид цыплят, иммунизированных только адъювантом или комбинацией CnaA, FimA и FimB (Comb), в тесте по Фиг 5А. Каждая точка обозначает отдельного индивидуума, а горизонтальная линия обозначает среднее значение. Значок * обозначает значительное отличие от до-иммунизированного образца (d7) из каждой группы при уровне р<0,05, значок ** обозначает значительное отличие при уровне р<0,01, и *** обозначает значительное отличие при уровне р<0,001 при измерении по тесту Таки.
[23] На Фиг. 5С изображен график, иллюстрирующий ответ сывороточного антитела IgY (абсорбция при 405 нм) рекомбинантный полипептид цыплят, иммунизированных только адъювантом, только FimB, или комбинацией CnaA, FimA и FimB (Comb), в тесте по Фиг 5А. Каждая точка обозначает отдельного индивидуума, а горизонтальная линия обозначает среднее значение. Значок * обозначает значительное отличие от до-иммунизированного образца (d7) из каждой группы при уровне р<0,05, значок ** обозначает значительное отличие при уровне р<0,01, и *** обозначает значительное отличие при уровне р<0,001 при измерении по тесту Таки.
[24] На Фиг. 6 изображен график, иллюстрирующий значение оценки повреждения от некротического энтерита (NE) у групп цыплят, иммунизированных только адъювантом, CnaA, FimB, или комбинацией CnaA, FimA и FimB (Comb), в тесте по Фиг. 5А, с последующим введением с пищей Clostridium perfringens штамма СР1. Каждая точка обозначает отдельного индивидуума, а горизонтальная линия обозначает среднее значение оценки повреждения от некротического энтерита. Буквы (а, b) обозначают существенно различные группы (Таки; р<0,01).
[25] На Фиг. 7 изображен график, иллюстрирующий значение оценки повреждения от некротического энтерита (NE) у групп цыплят после введения с пищей Clostridium perfringens штамма CP1 или нуль-мутантов СР1 генов элемента пилуса fimA и fimB (СР1ΔfimA и CP1ΔfimB). Линии обозначают средние значения оценки повреждения от некротического энтерита.
[26] На Фиг. 8А изображена фотография, иллюстрирующая разделение с помощью SDS-PAGE поверхностных полипептидов, экстрагированных из Clostridium perfringens штамма СР1 или нуль-мутантов СР1 генов каждого из элементов пилуса спаА, fimA и fimB (СР1ΔcnaA СР1ΔfimA и СР1ΔfimB), визуализированное с помощью окрашивания Кумасси.
[27] На Фиг. 8 В изображена фотография, иллюстрирующая Вестерн-блот анализ разделенных с помощью SDS-PAGE поверхностных полипептидов, экстрагированных из Clostridium perfringens штамма СР1 или нуль-мутантов СР1 генов каждого из элементов пилуса слаД fimA и fimB (СР1ΔcnaA СР1ΔfimA и СР1ΔfimB), обнаруженных с помощью анти-FimA антител, полученных из сыворотки цыплят в качестве первичного антитела.
[28] На Фиг. 8С изображена фотография, иллюстрирующая Вестерн-блот анализ разделенных с помощью SDS-PAGE поверхностных полипептидов, экстрагированных из Clostridium perfringens штамма СР1 или нуль-мутантов СР1 генов каждого из элементов пилуса cnaA, fimA и fimB (СР1ΔcnaA СР1ΔfimA и СР1ΔfimB), обнаруженных с помощью анти-FimA антител, выращенных у кроликов в качестве первичного антитела.
[29] На Фиг. 9А изображена фотография, иллюстрирующая разделение с помощью SDS-PAGE поверхностных полипептидов, экстрагированных из различных штаммов Clostridium perfringens, визуализированное с помощью окрашивания Кумасси.
[30] На Фиг. 9В изображена фотография, иллюстрирующая Вестерн-блот анализ разделенных с помощью SDS-PAGE поверхностных полипептидов, экстрагированных из различных штаммов Clostridium perfringens, визуализированный с помощью анти-FimA антител, полученных из сыворотки цыплят в качестве первичного антитела.
[31] На Фиг. 10 изображена серия фотографий, полученных с помощью трансмиссионной электронной микроскопии, клеток Clostridium perfringens штамма СР1 или нуль-мутантов СР1 СР1ΔfimA, и СР1ΔfimB, меченных частицами золота, с использованием кроличьего анти-FimA антитела в качестве первичного антитела, и 6 нм меченного коллоидным золотом козьего антитела к кроличьему IgG в качестве вторичного антитела.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[32] Авторы изобретения обнаружили, что VR-10B генетический локус, обнаруженный в штаммах Clostridium perfringens, ассоциирующихся с некротическим энтеритом у домашней птицы (Lepp D et al, Journal of Bacteriology (2013) 195: 1152-1166), содержит шесть возможных генов, которые, как оказалось, кодируют адгезивный пилус: три гена (cnaA, fimA и fimB) кодирующие структурные элементы пилуса, и гены, кодирующие две сортазы и сигнальную пепсидазу, предположительно вовлеченную в сборку пилуса. Диаграммное изображение локуса VR-10B показано на Фиг 1.
[33] Пилус является волосообразной структурой, присутствующей на поверхности многих бактерий, и часто вовлечен в вирулентность. Этот тип пилуса состоит из ковалентно связанных главных и второстепенных полипептидных элементов, образующих структуру клеточной поверхности длиной приблизительно 1 мкм. Пилусы широко изучались у грамотрицательных бактерий, но недавно было показано, что некоторые грамположительные штаммы, включая Corynebacterium diphtheriae, Streptococcus pneumoniae, и Streptococcus pyogenes, производят специфический вид пилусов, который собирается сортазными ферментами. Этот вид адгезивных грамположительных пилусов собирается на клеточной поверхности путем ковалентного связывания элементов пилуса конститутивными и пилус-специфичными сортазными ферментами, и в итоге ковалентно присоединяется к пептидогликану клеточной стенки с образованием скомплектованного пилуса.
[34] Без привязки к какой-либо теории, предполагается что полипептид пилуса Clostridium perfringenss описанный в этом документе, по ряду причин может быть целесообразной и многообещающей мишенью для разработки вакцины против некротического энтерита. Генный локус присутствует главным образом у вызывающих некротический энтерит штаммов Clostridium perfringens. Таким образом предполагается, что иммунный ответ, вызываемый белком иммуногенного пилуса, специфично нацелен на штаммы Clostridium perfringens, вызывающие заболевание. Кроме того, пилусы присутствуют на поверхности бактериальных клеток и часто вовлечены в присоединение к хозяину во время патогенеза бактериальных инфекций, что может подвергнуть пилусы действию иммунной системы хозяина. Далее, возможно благодаря свой роли в развитии болезни и расположению на клеточной поверхности бактерии, пилусы успешно использовались для разработки вакцин против ряда других инфекционных заболеваний.
[35] Таким образом, в одном аспекте данное изобретение описывает иммуногенный полипептид, выбираемый из выделенного полипептида пилуса Clostridium perfringens, варианта полипептида пилуса; фрагмента полипептида пилуса; и фрагмента варианта, при этом полипептид пилуса, вариант, фрагмент полипептида и фрагмент варианта являются иммуногенными у домашней птицы.
[36] При употреблении в этом тексте, термин "домашняя птица" используется для обозначения видов птиц или кур, которых вырастили в рамках сельскохозяйственного животноводства для производства, не ограничиваясь этим, мяса, яиц и перьев. Домашняя птица включает, не ограничиваясь этим, цыплят, кур, индюшек, уток, гусей, куропаток, страусов, фазанов и других сельскохозяйственных птиц или кур. В особенности включенной является домашняя птица, восприимчивая к некротическому энтериту, вызываемому инфекцией Clostridium perfringens. По меньшей мере в одном варианте осуществления данного изобретения, домашняя птица является бройлерами или цыплятами, выращенными для получения мяса.
[37] При употреблении в этом тексте, термин "полипептид" используется для обозначения вещества, содержащего два или более аминокислотных остатка, соединенных пептидными связями. Полипептиды включают, не ограничиваясь этим, олигопептиды или полипептиды, в которых два или более аминокислотных остатка последовательно связаны друг с другом ковалентными пептидными связями с образованием одной полипептидной цепи, и белки, включающие две или более полипептидных цепи, нековалентно ассоциированных друг с другом, или связанных друг с другом иными ковалентными связями, нежели пептидные связи, включая, но не ограничиваясь этим, дисульфидные связи и изопептидные связи. При употреблении в этом тексте, термин "изопептидная связь" используется для обозначения амидной связи, образованной между аминогруппой одной аминокислоты и карбоксильной группой второй аминокислоты, при этом по меньшей мере одна из этих аминогруппы и карбоксигруппы находится на боковой цепи соответствующей аминокислоты.
[38] При употреблении в этом тексте, термин "полипептид пилуса Clostridium perfringens" используется для обозначения полипептида, который обладает функцией пилуса или элемента пилуса, и который кодируется одним или несколькими генами из штамма Clostridium perfringens, ассоциируемого с некротическим энтеритом у домашней птицы. По меньшей мере в одном варианте осуществления данного изобретения, этот ген является геном cnaA, геном fimA или геном fimB, обнаруживаемом в генетическом локусе VR-10B, идентифицированном в Lepp D et al, Journal of Bacteriology (2013) 195: 1152-1166, как показано на диаграмме на Фиг. 1.
[39] При употреблении в этом тексте, термин "вариант", при употреблении со ссылкой на полипептид, призван обозначать полипептид, отличающийся по своей аминокислотной последовательности от последовательности референсного полипептида, с которым вариант сравнивают по одному или нескольким аминокислотным остаткам. Различия между последовательностью варианта и последовательностью референсного полипептида могут включать замещение одного или нескольких аминокислотных остатков другими аминокислотными остатками, внедрение аминокислотных остатков, или удаление аминокислотных остатков. В некоторых вариантах осуществления данного изобретения, вариант может отличаться от референсного полипептида консервативным замещением одного или нескольких аминокислотных остатков другими аминокислотными остатками, которые могут обладать схожими свойствами, включая, но не ограничиваясь этим, заряд, размер и гидрофильность, с аминокислотными остатками, которые они замещают. В некоторых вариантах осуществления данного изобретения, варианты могут полностью или частично сохранять одну или несколько биологических функций референсного полипептида, включая, но не ограничиваясь этим, иммуногенность. По меньшей мере в одном варианте осуществления данного изобретения, референсный полипептид является выделенным полипептидом пилуса Clostridium perfringens согласно описанию, содержащемуся в этом документе.
[40] По меньшей мере в одном варианте осуществления данного изобретения, последовательность варианта может быть на по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% или на по меньшей мере 99,9% идентична последовательности референсного полипептида. При употреблении в этом тексте, термин "процентная идентичность" или "% идентичность" при употреблении в отношении последовательности полипептида или полинуклеотида, используется для обозначения процентного содержания от общего количества аминокислотых или нуклеотидных остатков, соответственно, в последовательности, которые идентичны таким же в соответствующей позиции последовательности референсного полипептида или полинуклеотида. По меньшей мере в одном варианте осуществления данного изобретения, если длина последовательности варианта и длина референсной последовательности не идентичны, процентную идентичность можно вычислить на основании общего количества остатков в последовательности варианта или на основании общего количества остатков в референсной последовательности. Процентную идентичность можно вычислить с помощью различных алгоритмов выравнивания локальных или глобальных последовательностей, хорошо известных специалисту в этой области, включая, но не ограничиваясь этим, алгоритм Смита-Ватермана и алгоритм Нидлемана-Вунша. Программы, использующие эти или другие подходящие алгоритмы включают, не ограничиваясь этим, BLAST (Basic Local Alignment Search Tool, средство поиска основного локального выравнивания) и другие подобные программы, хорошо известные специалисту в данной области.
[41] При употреблении в этом тексте, термин "фрагмент", при использовании в отношении полипептида или варианта, призван обозначать меньший полипептид, содержащий меньше аминокислотных остатков, чем полипептид или вариант, и обладающий последовательностью, идентичной части последовательности полипептида или варианта. По меньшей мере в одном варианте осуществления данного изобретения, фрагмент сохраняет одну или несколько биологических активностей полипептида или варианта, включая, но не ограничиваясь этим, иммуногенность. По меньшей мере в одном варианте осуществления данного изобретения, фрагмент включает эпитоп полипептида или варианта. По меньшей мере в одном варианте осуществления данного изобретения, фрагмент имеет длину по меньшей мере 6 аминокислот, или имеет длину по меньшей мере 7 аминокислот, или имеет длину по меньшей мере 8 аминокислот, или имеет длину по меньшей мере 9 аминокислот, или имеет длину по меньшей мере 10 аминокислот.
[42] При употреблении в этом тексте, термин "иммуногенный" призван обозначать агент, включая, но не ограничиваясь этим, полипептид или полинуклеотид, или его фрагмент, способный вызывать иммунозащитный ответ у субъекта, которому введен иммуногенный агент. При употреблении в этом тексте, термин "иммунозащитный ответ" призван обозначать иммунный ответ, который предотвращает, уменьшает или устранят один или несколько симптомов заболевания у инфицированного субъекта.
[43] Описываемый здесь иммуногенный полипептид, включая описываемый здесь выделенный полипептид пилуса Clostridium perfringens, вариант полипептида пилуса, фрагмент полипептида пилуса и фрагмент варианта, являются иммуногенными для домашней птицы. Таким образом, по меньшей мере в одном варианте осуществления данного изобретения, домашняя птица, иммунизированная одним или несколькими описываемыми здесь выделенным полипептидом пилуса Clostridium perfringens, вариантом полипептида пилуса, фрагментом полипептида пилуса и фрагментом варианта, будет демонстрировать иммунозащитный ответ в качестве реакции на одну или несколько клеток Clostridium perfringens, скомплектованный пилус Clostridium perfringens, полипептид пилуса Clostridium perfringens, фрагмент полипептида пилуса Clostridium perfringens, или часть клетки Clostridium perfringens, включая, но не ограничиваясь этим, клеточную мембрану или ее часть, или клеточную стенку или ее часть, несущую один или несколько скомплектованных пилусов Clostridium perfringens, полипептид пилуса Clostridium perfringens или фрагмент полипептида пилуса Clostridium perfringens.
[44] В другом аспекте данное изобретение описывает полинуклеотид, включающий последовательность, кодирующую выделенный полипептид пилуса Clostridium perfringens или иммуногенный полипептид согласно описанию, содержащемуся в этом документе. По меньшей мере в одном варианте осуществления данного изобретения, полинуклеотид является мессенджером РНК (иРНК), и обладает последовательностью, которая может быть транслирована для создания выделенного полипептида пилуса Clostridium perfringens или иммуногенного полипептида. По меньшей мере в одном варианте осуществления данного изобретения, полинуклеотид является ДНК, по меньшей мере одна нить которой может быть считана для производства иРНК, которую в свою очередь можно транслировать для создания выделенного полипептида пилуса Clostridium perfringens или иммуногенного полипептида. По меньшей мере в одном варианте осуществления данного изобретения, ДНК может быть экспрессирована биохимической системой, включая, но не ограничиваясь этим, клетку, для производства выделенного полипептида пилуса Clostridium perfringens или иммуногенного полипептида. В по меньшей мере одном таком варианте осуществления данного изобретения, ДНК может быть включена в вектор, сконфигурированный для экспрессии ДНК в клетке-хозяине, как хорошо известно специалисту в данной области.
[45] По меньшей мере в одном варианте осуществления данного изобретения, полинуклеотид может включать вариант полинуклеотидной последовательности, который гибридизуется в полинуклеотид, включающий последовательность, кодирующую выделенный полипептид пилуса Clostridium perfringens или иммуногенный полипептид согласно описанию, содержащемуся в этом документе по меньшей мере в средне-жестких условиях. Под "по меньшей мере средне-жесткими условиями гибридизации" имеются в виду такие условия, которые способствуют селективной гибридизации между двумя молекулами комплементарных аминокислот в растворе. Гибридизация может происходить у всей или у части последовательности молекулы нуклеиновой кислоты. Гибридизующаяся часть в основном имеет длину по меньшей мере 15 (например, 20, 25, 30, 40 или 50) нуклеотидов. Специалисты в данной области понимают, что стабильность дуплекса или гибрида нуклеиновой кислоты, определяется температурой плавления (Tm), которая в натрийсодержащих буферных растворах является функцией от концентрации ионов натрия ([Na+]) и температуры (Tm=81,5°С - 16,6 (Log10 [Na+])+0,41(%(G+C) - 600/I), где %G+C является процентным содержанием нуклеотидов цитозина и гуанина в нуклеиновой кислоте, и I является длиной нуклеиновой кислоты в основных парах, или подобное уравнение). Соответственно, параметрами жидкой среды, определяющими стабильность гибрида, являются температура и концентрация ионов натрия. Для идентификации молекул похожих, но не идентичных известной молекуле нуклеиновой кислоты, можно допустить 1% несовпадение, что выразится в понижении Tm на приблизительно 1°С. Например, если ищутся молекулы нуклеиновой кислоты с идентичностью >95%, финальную температуру раствора можно понизить на примерно 5°С. Основываясь на этих соображениях, специалисты в данной области смогут с легкостью выбрать подходящие условия гибридизации.
[46] В некоторых вариантах осуществления данного изобретения выбирают жесткие условия гибридизации. В качестве примера жестких условий гибридизации можно использовать следующие: гибридизация с помощью 5х хлорид натрия/цитрат натрия (SSC)/5x раствор Денхардта/1,0% додецилсульфат натрия (SDS) при Tm - 5°С на основе выше приведенного уравнения, с последующим промыванием 0,2х SSC/0.1% SDS при 60°С. Гибридизационные условия средней жесткости включают стадию промывания в 3х SSC при 42°С. Однако нужно понимать, что эквивалентные по жесткости условия можно достичь, используя альтернативные буферные растворы, соли и температуры. Дополнительную информацию на тему условий гибридизации можно найти в: Current Protocols in Molecular Biology, John Wiley & Sons, N.Y., 2002, и в: Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, 2001.
[47] По меньшей мере в одном варианте осуществления данного изобретения, выделенный полипептид пилуса Clostridium perfringens является CnaA полипептидом. По меньшей мере в одном варианте осуществления данного изобретения, CnaA полипептид имеет аминокислотную последовательность, выбираемую из SEQ ID NO: 10 и SEQ ID NO: 13. По меньшей мере в одном варианте осуществления данного изобретения, CnaA полипептид закодирован полинуклеотидом, обладающим последовательностью, выбираемой из SEQ ID NO: 1, SEQ ID NO: 4 и SEQ ID NO: 7. По меньшей мере в одном варианте осуществления данного изобретения, CnaA полипептид закодирован полинуклеотидом, который гибридизуется по меньшей мере в средне-жестких условиях в полинуклеотид, обладающий последовательностью, выбираемой из SEQ ID NO: 1, SEQ ID NO: 4 и SEQ ID NO: 7. По меньшей мере в одном варианте осуществления данного изобретения, когда полипептид пилуса является CnaA полипептидом, вариант обладает по меньшей мере 75%, 80%, 85%, 90%, 95%, 99% или 99.9% идентичностью последовательности с аминокислотной последовательностью, выбираемой из SEQ ID NO: 10 и SEQ ID NO: 13.
[48] По меньшей мере в одном варианте осуществления данного изобретения, выделенный полипептид пилуса Clostridium perfringens является FimA полипептидом. По меньшей мере в одном варианте осуществления данного изобретения, FimA полипептид имеет аминокислотную последовательность, выбираемую из SEQ ID NO: 11 и SEQ ID NO: 14. По меньшей мере в одном варианте осуществления данного изобретения, FimA полипептид закодирован полинуклеотидом, обладающим последовательностью, выбираемой из SEQ ID NO: 2, SEQ ID NO: 5 и SEQ ID NO: 8: По меньшей мере в одном варианте осуществления данного изобретения, FimA полипептид закодирован полинуклеотидом, который гибридизуется по меньшей мере в средне-жестких условиях в полинуклеотид, обладающий последовательностью, выбираемой из SEQ ID NO: 2, SEQ ID NO: 5 и SEQ ID NO: 8. По меньшей мере в одном варианте осуществления данного изобретения, если полипептид пилуса является FimA полипептидом, вариант обладает по меньшей мере 75%, 80%, 85%, 90%, 95%, 99% или 99.9% идентичностью последовательности с аминокислотной последовательностью, выбираемой из SEQ ID NO: 11 и SEQ ID NO: 14.
[49] По меньшей мере в одном варианте осуществления данного изобретения, выделенный полипептид пилуса Clostridium perfringens является FimB полипептидом. По меньшей мере в одном варианте осуществления данного изобретения, FimB полипептид имеет аминокислотную последовательность, выбираемую из SEQ ID NO: 12 и SEQ ID NO: 15. По меньшей мере в одном варианте осуществления данного изобретения, FimB полипептид закодирован полинуклеотидом, обладающим последовательностью, выбираемой из SEQ ID NO: 3, SEQ ID NO: 6 и SEQ ID NO: 9. По меньшей мере в одном варианте осуществления данного изобретения, FimB полипептид закодирован полинуклеотидом, который гибридизуется по меньшей мере в средне-жестких условиях в полинуклеотид, обладающий последовательностью, выбираемой из SEQ ID NO: 3, SEQ ID NO: 6 и SEQ ID NO: 9. По меньшей мере в одном варианте осуществления данного изобретения, если полипептид пилуса является FimB полипептидом, вариант обладает по меньшей мере 75%, 80%, 85%, 90%, 95%, 99% или 99.9% идентичностью последовательности с аминокислотной последовательностью, выбираемой из SEQ ID NO: 12 и SEQ ID NO: 15.
[50] По меньшей мере в одном варианте осуществления данного изобретения, выделенный полипептид пилуса Clostridium perfringens является скомплектованным пилусом. По меньшей мере в одном варианте осуществления данного изобретения, скомплектованный пилус включает один или несколько элементов, каждый из которых индивидуально выбирают из CnaA полипептида, FimA полипептида, и FimB полипептида. По меньшей мере в одном варианте осуществления данного изобретения, один или несколько элементов являются ковалентно связанным друг с другом. По меньшей мере в одном варианте осуществления данного изобретения, скомплектованный пилус является пилусом, выделенным из клетки Clostridium perfringens, или ее частью, включая, но не ограничиваясь этим, клеточную мембрану или ее часть, или клеточную стенку или ее часть. По меньшей мере в одном варианте осуществления данного изобретения, скомплектованный пилус является фрагментом пилуса, выделенного из клетки Clostridium perfringens, или ее части, включая, но не ограничиваясь этим, клеточную мембрану или ее часть, или клеточную стенку или ее часть, при этом фрагмент включает один или несколько элементов, каждый из которых индивидуально выбирают из CnaA полипептида, FimA полипептида, и FimB полипептида.
[51] По меньшей мере в одном варианте осуществления данного изобретения, выделенный полипептид пилуса Clostridium perfringens может являться выделенным из культуры Clostridium perfringens. Таким образом, по меньшей мере в одном варианте осуществления данного изобретения, выделенный полипептид пилуса Clostridium perfringens может являться частью состава, содержащего одну или несколько частей клетки Clostridium perfringens, включая, но не ограничиваясь этим, клеточную мембрану или ее часть, или клеточную стенку или ее часть, которые несут полипептид пилуса или его фрагмент согласно описанию, содержащемуся в этом документе. По меньшей мере в одном варианте осуществления данного изобретения, выделенный полипептид пилуса Clostridium perfringens может быть рекомбинантно произведен путем экспрессии в подходящей клетке-хозяине вектора, включающего полинуклеотид с последовательность, кодирующей полипептид пилуса. По меньшей мере в одном варианте осуществления данного изобретения, если полипептид пилуса является скомплектованным пилусом, скомплектованный пилус может быть рекомбинантно произведен путем экспрессии в подходящей клетке-хозяине вектора, включающего полинуклеотид, с последовательностью, кодирующей гены и другие нуклеотидные последовательности, необходимые для сборки скомплектованного пилуса. Кроме того, выделенный полипептид пилуса Clostridium perfringens может быть по меньшей мере частично очищен после выделения или рекомбинантного производства. Подходящие векторы и клетки-хозяева, включая, но не ограничиваясь этим, прокариотические и эукариотические клетки-хозяева, адаптированные для производства рекомбинантных полипептидов, и способы выделения или рекомбинантного производства таких полипептидов, включая способы по меньшей мере частичного очищения таких полипептидов, хорошо известны специалистам в данной области или мог быть с легкостью найдены и выбраны соответствующим специалистом в ходе не более чем рутинного эксперимента.
[52] В другом аспекте, данное изобретение описывает вакцину для лечения или предотвращения некротического энтерита у домашней птицы, или для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы, при этом вакцина включает по меньшей мере один иммуногенный полипептид согласно описанию, содержащемуся в этом документе. При употреблении в этом тексте, термин "вакцина" призван обозначать иммуногенный препарат, применяемый для предотвращения, лечения или уменьшения эффекта от инфекции, вызываемой Clostridium perfringens. В составе вакцины в основном содержится иммунологически эффективное количество иммуногенного агента, и также могут содержаться или не содержаться адъюванты. В случае данной вакцины, иммуногенный агент может быть иммуногенным полипептидом согласно описанию, содержащемуся в этом документе.
[53] При употреблении в этом тексте, термин "адъювант" призван обозначать агент, эффективный для улучшения иммунного ответа на иммуногенный агент у субъекта, вакцинированного вакциной, включающей иммуногенный агент. Подходящие адъюванты хорошо известны специалистам в данной области и включают, не ограничиваясь этим, неорганические вещества, включая, но не ограничиваясь этим, квасцы, гидроксид алюминия и другие алюминийсодержащие соединения; сапонины, включая, но не ограничиваясь этим, Quil-A™; полные и неполные адъюванты Фройнда; липидные и содержащие минеральное масло адъюванты, включая, но не ограничиваясь этим, эмульсии типа «масло в воде»; полисахаридные адъюванты; белковые адъюванты; иммуномодуляторы; адъюванты, полученные из мертвых или ослабленных бактериальных клеток; и другие подходящие адъюванты, известные специалистам в данной области.
[54] Вакцины могут иметь в составе один или несколько фармацевтически приемлемых носителей. При употреблении в этом тексте, термин "фармацевтически приемлемый" призван обозначать в отношении молекул и композиций то, что они являются физиологически допустимыми и в целом не вызывают неблагоприятных реакций при введении животному или человеку. Предпочтительным образом, при употреблении в этом тексте, термин "фармацевтически приемлемый" означает одобренный регулятивным органом федерального или местного правительства или включенный в Фармакопею США или другую признанную фармакопею для применения в отношении животных или людей. При употреблении в этом тексте, термин "носитель" призван обозначать растворитель, адъювант, наполнитель или носитель, который вводится вместе с соединением. Подходящие носители хорошо известны специалистам в данной области и, по меньшей мере в одном варианте осуществления данного изобретения, описаны в "Remington's Pharmaceutical Sciences" by E.W. Martin, 18th Edition, или в других изданиях.
[55] Вакцины могут быть изготовлены для введения любым удобными способом, известным в данной области, включая, но не ограничиваясь этим, перорально, ректально, назально, трасмукозально, трансдермально, парентерально, интравенозно, внутримышечно, подкожно, in ovo, или любым другим известным способом. По меньшей мере в одном варианте осуществления данного изобретения, подразумевается что вакцина может вводиться перорально. Без привязки к конкретной теории полагается, что пероральная вакцинация может напрямую воздействовать на кишечные лимфоидные ткани в местах, инфицированных ассоциирующимися с некротическим энтеритом штаммами Clostridium perfringens. По меньшей мере в одном варианте осуществления данного изобретения полагается, что приплод может быть иммунизирован путем вакцинирования матери и последующего переноса материнского иммунитета, включая, но не ограничиваясь этим, материнские антитела, приплоду.
[56] В другом аспекте, данное изобретение описывает применение иммуногенного полипептида согласно описанию, содержащемуся в этом документе, для изготовления медикамента для лечения или предотвращения некротического энтерита у домашней птицы или для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы. Медикамент может быть вакциной, согласно описанию, содержащемуся в этом документе.
[57] В другом аспекте, данное изобретение описывает способ лечения или предотвращения некротического энтерита у домашней птицы, или лечения или предотвращения инфекции Clostridium perfringens у домашней птицы, включающий введение эффективного количества иммуногенного полипептида или вакцины согласно описанию, содержащемуся в этом документе, домашней птице. Введение может производиться способами, хорошо известными в данной области, включая, но не ограничиваясь этим, перорально, ректально, назально, парентерально, внутривенно, внутримышечно, подкожно или другими способами. По меньшей мере в одном варианте осуществления данного изобретения, ведение может производиться путем подкожной инъекции. По меньшей мере в одном варианте осуществления данного изобретения, введение осуществляется перорально. По меньшей мере в одном варианте осуществления данного изобретения, вакцину вводят домашней птице более одного раза для проведения первичной иммунизации с последующими одной или несколькими усиливающими иммунизациями, как это известно в данной области. По меньшей мере в одном варианте осуществления данного изобретения, одну или несколько первичных иммунизации и одну или несколько усиливающих иммунизаций проводят домашней птице после исчезновения у нее материнских антител. В по меньшей мере одном таком варианте осуществления данного изобретения, одну или несколько первичных иммунизаций и одну или несколько усиливающих иммунизаций проводят домашней птице не ранее чем через приблизительно 10 дней после вылупления.
[58] В другом аспекте, данное изобретение описывает применение иммуногенного полипептида согласно описанию, содержащемуся в этом документе, в качестве вакцины для лечения или предотвращения некротического энтерита у домашней птицы, или для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы.
[59] Дальнейший аспект данного изобретения описывает антитело, которое селективно связывается с иммуногенным полипептидом согласно описанию, содержащемуся в этом документе. По меньшей мере в одном варианте осуществления данного изобретения, это антитело является антителом домашней птицы. По меньшей мере в одном варианте осуществления данного изобретения, антитело может быть поликлональным антителом, моноклональным антителом, химерным антителом, одноцепочным антителом или фрагментом антитела, сохраняющим свойство селективного связывания с иммуногенным полипептидом согласно описанию, содержащемуся в этом документе. Термин "фрагмент антитела" при использовании в этом документе включает, не ограничиваясь этим, Fab, Fab', F(ab')2, scFv, dsFv, ds-scFv, димеры, минитела, диатела, и мультимеры, и диспецифичные фрагменты антител. Антитела могут быть фрагментированы с помощью стандартных методик. Например, F(ab')2 фрагменты могут быть получены после обработки антитела пепсином. Образующийся фрагмент F(ab')2 можно обработать для восстановления дисульфидных мостиков с получением фрагментов Fab'. Усвоение папаина может приводить к образованию фрагментов Fab, Fab, Fab' и F(ab')2, scFv, dsFv, ds-scFv, димеры, минитела, диатела, диспецифичные фрагменты антител и другие фрагменты также можно синтезировать рекомбинантными способами.
[60] Способы получения и описания таких антител и их фрагментов хорошо известны специалистам в данной области и могут быть с легкостью осуществлены специалистом в данной области без особого труда. Например, поликлональную иммунную сыворотку или моноклональные антитела можно синтезировать с помощью стандартных способов. Млекопитающее (например мышь, хомяка или кролика), птицу (например домашнюю птицу) или другое животное можно иммунизировать иммуногенной формой иммуногенного полипептида по данному изобретению, который вызывает у млекопитающего иммунный ответ. Способы придания иммуногенности пептиду включают конъюгацию с носителями и другие способы, хорошо известные в данной области. Например, пептид можно вводить в присутствии адъюванта. За ходом иммунизации можно наблюдать, проводя обнаружение антител в плазме или сыворотке. Для оценки уровня антител можно применять стандартную ELISA или другие способы иммуноанализа с использованием иммуногенного агента в качестве антигена. После иммунизации можно получить иммунную сыворотку и при желании выделить из нее поликлональные антитела.
[61] Для производства моноклональных антител, клетки, производящие антитела (лимфоциты) можно собрать у иммунизированного животного и слить с клетками миеломы с помощью стандартных способов слияния клеток, и таким образом иммортализируя эти клетки и получая гибридомные клетки. Такие способы хорошо известны специалистам в данной области. Гибридомные клетки можно подвергнуть иммунохимическому скринингу для производства антител, специфически реагирующих с иммуногенными полипептидами согласно описанию, содержащемуся в этом документе, и выделить моноклональные антитела. Таким образом, данное изобретение также включает гибридомные клетки, выделяющие моноклональные антитела, обладающие специфичностью к иммуногенному полипептиду согласно описанию, содержащемуся в этом документе.
[62] Специфические антитела, или фрагменты антител, реагирующие на иммуногенный полипептид согласно описанию, содержащемуся в этом документе, также могут быть получены путем скрининга экспрессионных библиотек, кодирующих иммуноглобулиновые гены, или частей, экспрессироанные в бактериях с пептидами, полученными из молекулы нуклеиновой кислоты согласно описанию, содержащемуся в этом документе. Например, в бактериях с помощью фаговых экспрессионных библиотек можно экспрессировать полные Fab фрагменты, VH области и FV области.
[63] В другом аспекте, данное изобретение описывает способ обнаружения инфицирования домашней птицы штаммом Clostridium perfringens, ассоциирующимся с некротическим энтеритом, который включает получение биологического образца домашней птицы и обнаружение в биологическом образце присутствия антител, которые селективно связываются иммуногенным полипептидом согласно описанию, содержащемуся в этом документе. По меньшей мере в одном варианте осуществления данного изобретения, биологический образец является образцом крови. По меньшей мере в одном варианте осуществления данного изобретения, образец является образцом фекалий. По меньшей мере в одном варианте осуществления данного изобретения, обнаружение включает измерение количества или концентрации антитела, присутствующего в биологическом образце, с помощью способов, хорошо известным специалистам в данной области.
[64] В другом аспекте данное изобретение описывает способ обнаружения иммуногенного полипептида согласно описанию, содержащемуся в этом документе, включающий взаимодействие иммуногенного полипептида с антителом, которое селективно связывается с иммуногенным полипептидом и обнаружение связывания иммуногенного полипептида с антителом. По меньшей мере в одном варианте осуществления данного изобретения, иммуногенный полипептид может быть выделенным полипептидом пилуса Clostridium perfringens согласно описанию, содержащемуся в этом документе. По меньшей мере в одном варианте осуществления данного изобретения, иммуногенный полипептид может быть скомплектованным пилусом, присоединенным к поверхности клетки бактерии Clostridium perfringens. Такие варианты применения данного способа могут быть пригодны для идентификации и обнаружения штаммов Clostridium perfringens, способных вызывать некротический энтерит у домашней птицы.
[65] При употреблении в этом тексте, термины "примерно" или "приблизительно" применительно к числовым значениям или интервалам значений обозначают то, что упомянутые значения могут отличаться с допустимой долей погрешности качества измерения, обусловленной природой или точностью измерения, при этом это отличие считается в данной области эквивалентным упомянутым значениям и обеспечивает такую же функцию или результат. Например, степень погрешности может обозначаться количеством значимых цифр, относящихся к измерению, как принято в данной области техники, и включать, не ограничиваясь этим, вариацию ±1 в наиболее точной значимой цифре, относящейся к измерению. Обычные примеры долей погрешности находятся в пределах 20 процентов (%), предпочтительно в пределах 10%, и более предпочтительно в пределах 5% от указанного значения или интервала значений. Альтернативным образом, и в особенности в отношении биологических систем, термины "примерно" и "приблизительно" могут означать значения, находящиеся в интервале порядка величины, предпочтительным образом в пределах 5-кратного, и более предпочтительным образом в пределах 2-кратного порядка от данного значения. Численные значения, приведенные в этом документе, являются приблизительными, если не указано иначе, что означает что термины "примерно" или "приблизительно" могут предполагаться, если не указаны в явном виде.
[66] При употреблении в этом тексте, термин "существенно" относится к полной или почти полной мере или степени действия, характеристики, свойства, состояния, структуры, объекта или результата. Например, две субстанции, обладающие "существенно" одинаковыми свойствами, будут обладать полностью идентичными свойствами или будут обладать свойствами настолько близкими к полностью идентичным, что разница будет неизмерима или несущественна. Точная допустимая степень отклонения от абсолютной идентичности может в некоторых случаях зависеть от специфического контекста. Однако, в целом близость идентичности будет такой, чтобы обеспечить такой же общий результат, как если бы идентичность была абсолютной и полной. Применение термина "существенно" равным образом допустимо в негативной коннотации в отношении полного или почти полного отсутствия действия, характеристики, свойства, состояния, структуры, объекта или результата.
Примеры
[67] Другие признаки данного изобретения станет очевидны из последующих неограничивающих примеров, которые наглядно иллюстрируют принципы данного изобретения.
Пример 1: Производство очищенных рекомбинантных пилус-ассоциированных полипептидов из Clostridium perfringens
[68] Кодирующие участки для трех пилусных элементов (сnаА, fimA и fimB) были кодон-оптимизированы и обрезаны для исключения предсказанных N-терминальных сигнальных пептидов и С-терминальных клеточных сортирующих сигнальных LPXTG трансмембранных доменов. С-терминальный домен является гидрофобным участком, предсказанным к удалению во время сборки пилуса. Укороченные кодон-оптимизированные кодирующие участки были синтезированы (Integrated DNA Technologies, Coralville, USA), клонированы в рЕТ28а экспрессионный ветор (MilliporeSigma, Etobicoke, Ontario, Canada) с помощью In-Fusion™ клонирования в соответствии с инструкциями производителя (Takara Bio USA, Mountain View, California, USA), верифицированы в отношении последовательностей, и затем трансформированы в клетки Е. coli BL21. Трансформированные колонии выращивали при 37°С в течение 18 ч со встряхиванием в 1 л LB с питательным раствором с 50 мкг/мл канамицина и 1mM IPTG. Культуру отцентрифугировали и повторно суспендировали в 20 мл связывающего буфера (20mM NaPO4, 0,5М NaCl, 30mM имидазола) и лизровали ультразвуком в течение 10 минут на льду (10 с импульсы, 20 с паузы). Клеточный лизат очистили в естественных условиях на HisTrap™ FF Crude колонке (GE Healthcare, Montreal, Canada) с использованием градиента от 50 до 500 mM имидазола на  ™ prime plus системе. Собрали фракции 1 мл, и фракции, демонстрирующие пик при 280 нм смешали и сконцентрировали с помощью Pierce™ Protein Concentrators (срез молекулярной массы на 9К) (Fisher Scientific, Unionville, Ontario, Canada) и обессолили с помощью Zeba™ Spin 7К обессоливающих колоннах с обрезкой молекулярной массы (Fisher Scientific). Количественное измерение очищенных белков произвели с помощью ВСА (бицинхониновая кислота) Protein Assay kit (Fisher) согласно инструкциям производителя. Полипептиды визуализировали с помощью SDS-PAGE и окрашивания Комасси.
™ prime plus системе. Собрали фракции 1 мл, и фракции, демонстрирующие пик при 280 нм смешали и сконцентрировали с помощью Pierce™ Protein Concentrators (срез молекулярной массы на 9К) (Fisher Scientific, Unionville, Ontario, Canada) и обессолили с помощью Zeba™ Spin 7К обессоливающих колоннах с обрезкой молекулярной массы (Fisher Scientific). Количественное измерение очищенных белков произвели с помощью ВСА (бицинхониновая кислота) Protein Assay kit (Fisher) согласно инструкциям производителя. Полипептиды визуализировали с помощью SDS-PAGE и окрашивания Комасси.
[69] Укороченные последовательности показали высокие уровни экспрессии меченных гистидином (His) полипептидов, как видно на SDS-PAGE гелях на Фиг. 2А (CnaA), 2 В (FimA), 2С (FimB) и 2D (смешанные фракции CnaA, FimA и FimB, после концентрации и обессаливания). Такие повышенные уровни экспрессии могут иметь причиной повышенную растворимость получающихся пептидов.
[70] В Таблице 1 показаны последовательности полных, кодон-оптимизированных и укороченных генных последовательностей вместе с последовательностями полных элементов полипептидов и экспрессированных укороченных и His-меченных элементов полипептидов.




Пример 2: Получение нуль-мутантов элемента пилуса Clostridium perfringens штамма СР1
[71] Три гена элемента пилуса (сnаА, fimA и fimB) был деактивированы в вирулетном Clostridium perfringens штамме СР1 путем ClosTron мутагенеза (Heap, J.T., et al, Methods Mol. Biol. (2010), 646: 165-182), в основном как было описано ранее (Yu, Q., Lepp, D., Mehdizadeh Gohari, I., Wu, Т., Zhou, H., Yin, X., Yu, H., Prescott, J.F., Nie, S.P., Xie, M.Y., Gong, J., 2017. The Agr-like quorum sensing system is required for necrotic enteritis pathogenesis in poultry caused by Clostridium perfringens. Infection и Immunity 85(6): e00975-16), для производства CP1 нуль-мутантов каждого их генов элемента пилуса (CP1ΔcnaA, СР1ΔfimA, и СР1ΔfimB). Вкратце, ClosTron нацеленные на интрон участки были подготовлены для внедрения на следующие позиции генов с использованием алгоритма Perutka реализованного на www.clostron.com: пара нуклеотидов (bp) 183 кодирующей нити сnаА, bp 231 кодирующей нити fimA, и bp 273 кодирующей нити fimB. нацеленные на интрон участки были синтезированы и клонированы в ClosTron плазмид pMTL007C-E2 с помощью DNA 2.0 (Menlo Park, СА, USA). Полученные плазмоиды были раздельно электропорированы в СР1 как было описано ранее с небольшими модификациями (Jiraskova A, Vitek L, Fevery J, Ruml T, Branny P. 2005. Rapid protocol for electroporation of Clostridium perfringens. J Microbiol Methods 62:125-127). Вкратце, после выращивания при 37°С в анаэробных условиях в течение ночи в 5 мл TGY питательной среды (3% триптона, 2% глюкозы, 1% дрожжевого экстракта), СР1 субкультивировали в 50 мл TGY и выращивали в экспоненциальную фазу (оптическая плотность при 600 нм [OD600], 0,8). Клетки собрали с помощью центрифугирования при 6000 g в течение 10 минут при 20°С и однократно промыли в 10 мл сахарозном электропоральном буферном растворе (SEB) (272 mM сахарозы, 1 mM MgCl2, 5 mM Na2HPO4, рН 7,4) и затем ресуспендировали в 5 мл SEB. Аликвоты (0,2 мл) смешали с 2 мкг концентрированного плазмидного ДНК в охлажденных кюветах (0,2-см зазор), и плазмидную ДНК ввели в клетки путем электропорации (1,000 V, 25F) с помощью аппарата Bio-Rad GenePulser Xcell (Bio-Rad, Hercules, CA, USA). Сразу после трансформации смесь перенесли в 1 мл TGY питательного раствора и анаэробно инкубировали при 37°С в течение 3 ч, с последующим посевом на TGY агаре с 15 мкг/мл тиамфеникола в анаэробных условиях при 37°С в течение ночи для селекции трансформантов. Полученные колонии субкультивировали на TGY агаре с содержанием 10 мкг/мл эритромицина для селекции интегрантов, и затем пересеивали в течение непрерывных 10 дней для лечения шаттл-вектора. Клоны, устойчивые к эритромицину, но чувствительные к тиамфениколу, выбрали для следующих анализов.
Пример 3: Испытания на животных
[72] Для оценки способности трех очищенных His-меченных рекомбинантных пилусных элементов защищать от некротического энтерита (NE) в куриной модели было проведено два эксперимента по вакцинации. Коммерчески доступных однодневных цыплят мужского пола породы White Plymouth Rock случайным образом разделили на экспериментальные группы (n=15-17) и поместили в отдельные помещения изоляционного корпуса. Описание экспериментов показано в Таблице 2. Дополнительно, мутанты CP1ΔfimA, и CP1ΔfimS проверили на вирулентность в этой же модели.

Эксперимент 1:
[73] Первый эксперимент включал три группы по 18 птиц, вакцинированных только адъювантом, CnaA или FimA. Каждой птице инъецировали внутримышечно (i.m.) в грудную мышцу 200 мкл фосфатно-буферного раствора (PBS) содержащего Quil-A™ адъювант (50 мкг) и рекомбинантный полипептид пилуса (50 мкг) в дни 8 и 20, и птиц умертвили в день 31.
[74] У пяти птиц из каждой группы брали сыворотку в день 8 (перед иммунизацией), и в дни 20 и 31 (после иммунизации). Сывороточные титры IgY на CnaA и FimA определяли с помощью ELISA (твердофазный иммуноферментный анализ). С.perfringens рекомбинантные пилусные полипептиды разбавили до 10 мкг/мл в 50 mM карбонат/бикрабонатном посадочном буферном растворе с рН 9,6, и добавили по 100 мкл в каждую лунку 96-луночного планшета MaxiSorp™ Immuno plate (Fisher Scientific). Лунки инкубировали в течение 1 ч при 37°С, и далее в течение ночи при 4°С, трижды промыли промывочным буферным раствором (PBS с содержанием 0,05% Tween 20), и блокировали в промывочном буферном растворе содержащем 1% альбумина бычьей сыворотки (BSA) (Sigma) в течение 2 ч при 37°С. Двукратные серийные разбавления каждого образца сыворотки разбавили в промывочном буферном растворе содержащем 1% BSA (1/64 -1/65,536) инкубировали в отдельных лунках в течение 2 ч при 37°С и затем промыли три раза в промывочном буферном растворе. Лунки инкубировали с поликлональным конъюгированным с пероксидазой хрена (HRP) козьим антителом к IgY цыпленка, разбавленным 1:5000 в промывочном буферном растворе, в течение 1 ч при комнатной температуре, и затем промыли трижды в промывочном буферном растворе. Субстратный раствор (0,2 мг/мл 2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота (ABTS) (Sigma) в 1Х ABTS буферном растворе (Sigma)) добавили к каждой лунке и инкубировали в течение 30 минут при комнатной температуре. После окончания реакции с помощью 0,5% додецил сульфата натрия (SDS), абсорбцию измерили с помощью BioTek™ планшет-ридера при 405 нм. Титры определили как значение log2 наименьшего сывороточного разбавления с абсорбцией более чем в два раза превышающей таковую у контрольных лунок, в которых PBS с содержанием 1% BSA использовали вместо сыворотки. Статистические различия между титрами до и после вакцинации для каждого антигена среди различных групп вакцинирования определили с помощью однофакторного анализа ANOVA с последующим ретроспективным анализом Туки.
[75] Результаты показаны на Фиг. 3А и В, соответственно. Средний сывороточный ответ на CnaA в CnaA-иммунизированной группе был существенно выше при d31 по сравнению с до-иммунизированными птицами (d8), однако общее увеличение было небольшим. В FimA-иммунизированной группе, средний ответ на FimA увеличился после иммунизации незначительно. Однако, две птицы продемонстрировали высокий титр d31.
[76] Птицы получали стартерный рацион без антибиотиков, содержащий 20% белка, до экспериментального инициирования некротического энтерита (NE). В день 27 птицы постились 24 ч, и затем переводились на стартовый индюшачий рацион без антибиотиков (28% белка), содержащий культуру С.perfringens СР1 в дни 28 и 29 перед эвтаназией в день 31. Инфицированный рацион готовили ежедневно утром и вечером путем смешивания с культурой С.perfringens СР1, выращенной в среде жидкого тиогликолята (FTG) (Difco) при 37°С в течение 15 ч или 24 ч, соответственно, в соотношении 2:1 (объем/масса). После эвтаназии тонкий кишечник (от двенадцатиперстной кишки до подвздошной кишки) птиц макроскопически изучали на наличие повреждений некротического энтерита и оценивали по шкале от 1 до 6 с применением системы, описанной Keyburn et al (Keyburn AL, Boyce JD, Vaz P, Bannam TL, Ford ME, Parker D, Di Rubbo A, Rood JI, Moore RJ. 2008. NetB, a new toxin that is associated with avian necrotic enteritis caused by Clostridium perfringens. PLoS Pathog. 4:e26) как описано ниже:
0, нет повреждений;
1, тонкие или хрупкие стенки;
2, точечный некроз или изъязвление (1-5 очагов);
3, точечный некроз или изъязвление (6-15 очагов);
4, точечный некроз или изъязвление (16 или более очагов);
5, пятна некроза длиной 2-3 см;
6, распространенный типичный некроз.
[77] Статистическую разницу между оценкой некротического энтерита (NE) между разными группами определяли с помощью однофакторного анализа ANOVA с последующим ретроспективным анализом Туки. Результаты, показанные на Фиг. 4, свидетельствуют о том что во всех группах наблюдалась одинаково высокая оценка повреждений. Средняя оценка некротического энтерита для контрольной группы (только адъювант), CnaA-иммунизированной группы и FimA-иммунизированной группы были 3,1, 3,0 и 3,3, соответственно.
[78] Без привязки к конкретной теории, можно предположить, что иммунизация в день 8 могла наложиться на влияние материнских антител, и могло не оказаться достаточно времени чтобы иммунизация в день 20 создала достаточный иммунный ответ перед введением С.perfringens СР1. Поэтому был проведен второй эксперимент, включающий дополнительную иммунизацию до введения С.perfringens СР1.
Эксперимент 2:
[79] Второй эксперимент включал четыре группы по 18 птиц, подкожно (s.c.) вакцинированных только адъювантом, CnaA, FimA, или комбинацией CnaA, FimA и FimB. В этом эксперименте каждой птице подкожно иммунизировали 50 мкг рекомбинантного полипептида, комбинированного с 50 мкг Quil-A™ адъюванта в дни 7, 14 и 19, и для измерения титра антител сыворотку брали в дни 7, 19 и 29. Птицам вместе с кормом ввели Clostridium perfringens штамм СР1 в дни 26 и 27 как был описано в Эксперименте 1, и на день 29 птиц умертвили и провели оценку кишечного поражения.
[80] Значительный (р<0,001) ответ сывороточного антитела (IgY) наблюдался в оба дня 19 и 29 во всех иммунизированных группах в сравнении с до-иммунизированным контролем (за исключением группы, иммунизированной FimB в день 19), и величина ответа была также намного больше, чем в Эксперименте 1. Результаты показаны на Фиг. 5А (анти-CnaA сывороточный ответ), 5 В (анти-FimA сывороточный ответ) и 5С (анти-FimB сывороточный ответ).
[81] Кроме того, как видно на Фиг. 6, обе CnaA- и FimB-иммунизированные группы получили значительно более низкие оценки некротического энтерита (2 и 2,06, соответственно) по сравнению с адъювантным контролем (3,75), при измерении и подсчете аналогично Эксперименту 1, что означает что эти антигены предоставляют по меньшей мере частичную защиту от некротического энтерита. Для FimB антигена количество птиц со значительным повреждением (оценка некротического энтерита >2) было 33,3% в сравнении с 93,7% в контрольной группе. Иммунизация комбинированными элементами не привела к уменьшению тяжести заболевания (средняя оценка некротического энтерита =3,7), несмотря на вызванный сильный сывороточный ответ против всех трех элементов, как видно на Фиг. 5А-С.
Стимуляция цыплят нуль-мутантами элемента пилуса СР1 штамма Clostridium perfringens
[82] Три группы по 18 птиц из Эксперимента 2, которые не были иммунизированы, стимулировали введением с кормом дважды в день в дни 26 и 27 СР1, СР1ΔfimA или СР1ΔfimB, приготовленных как было описано в Примере 2. В день 29 птиц подвергли эвтаназии и произвели оценку повреждений некротического энтерита как было описано в Примере 3. Как видно из результатов на Фиг. 7, ни СР1ΔfimA, ни СР1ΔfimB мутантные штаммы не вызвали заболевание у стимулированных птиц, что означает что для патогенеза некротического энтерита необходим функциональный пилус.
Пример 4: Исследование полипептидов поверхности пилуса Clostridium perfringens
Мутанты элемента пилуса Clostridium perfringens штамма СР1 и СР1: [83] Поверхностные полипептиды экстрагировали из Clostridium perfringens штамма СР1 и мутантов элемента пилуса СР1ΔcnaA CP1ΔfimA и CP1ΔfimB описанных в Примере 3, по методу Chang, С, Huang, I.-H., Hendrickx, А.Р.А., Ton-That, Н. 2013. Visualization of Gram-positive Bacterial Pili, In: Delcour, H.A. (Ed.) Bacterial Cell Surfaces: Methods и Protocols. Humana Press, Totowa, NJ, 77-95. Штаммы выращивали в течение ночи в TGY среде (3% триптона, 2% глюкозы, 1% дрожжевого экстракта) в анаэробных условиях при 37°С, субкультивировали 1:100 в 10 мл TGY среды и выращивали до OD600 ~ 1- Клетки отделили центрифугированием при 6000 × g в течение 5 минут и однократно промыли в SMM буферном растворе с рН 6,8 (0,5М сахарозы, 10mM MgCl2, 10mM малеата). Бактериальную таблетку ресуспендировали в 1 мл SMM буферного раствора, к которому добавили 60 мкл 511/мкл мутанолизина (Sigma) в мурамидазном буферном растворе (2mM уксусной кислоты, 48mM ацетата натрия) и 10 мкл 0,1М фенил метилсульфонил фториде (PMSF) (Sigma). Через по меньшей мере 4 ч инкубации при 37°С с постоянным вращением, протопласты отцентрифугировали при 20000 × g в течение 5 минут, и удалили надосадочную фракцию, содержащую белки клеточной стенки. Белки высадили путем добавления 81 мкл 100% (масса/объем) трихлоруксусной кислоты (ТСА) (Sigma) на мл и инкубировали при 4°С в течение ночи. После центрифугирования при 20000 × g при 4°С в течение 20 минут, белковую таблетку промыли ацетоном и медленно ресуспендировали в 50 мкл буферного раствора (62,5 mM Tris-HCl, рН 6,8, 2% SDS, 20% глицерол, 4% β-меркаптоэтанола, 3М мочевины, 0,01% бромфенола синего) при комнатной температуре в течение по меньшей мере 15 минут.
[84] Экстракты белков оболочки (5 мкл) загрузили в Novex™ NuPAGE™ 3-8% триацетатный гель (Fisher Scientific) и подвергали электрофорезу при 150V в течение 1 ч. Гели окрасили Bio-Safe™ красителем Комасси (BioRad), или перенесли на поливинилен дифторидную (PVDF) мембрану при 350V в течение 1 ч в 1Х трансферном буфере (48 mM Tris, 39 mM глицин, 20% метанол, 0,1% SDS). Обнаружение хемилюминисценции проводили с помощью набора Western Breeze™ Chemiluminescent kit (Life Technologies) согласно инструкциям производителя, используя анти-FimA сыворотку цыплят (1:200) в качестве первичного антитела, и вторичное козье антитело к IgY цыпленка, конъюгированное с щелочной фосфатазой (АР) (1:2000). Сыворотку, используемую как первичный Ab получили от FimA-иммунизированных цыплят из Эксперимента 1 (Пример 3), которые впоследствии показывали высокий анти-FimA титр или поликлональные антитела, выращенные у кроликов против рекомбинантных пилусных полипептидов, описанных в Примере 1. Результаты показаны на Фиг. 8А-С.
[85] Известно, что вестерн-блоттинг анализ разделенных с помощью SDS-PAGE зависимых от сортазы пилусов может произвести выокомолекулярный (HMW) ступенчатый шаблон, отражающий различные длины полимеров в зависимости от механизма, с помощью которого пилус комплектуется на клеточной поверхности. Элементы пилуса ковалентно связаны домашними и пилус-специфичными сортазными ферментами, что приводит к росту гетерополимерной структуры, которая в результате ковалентно связывается с пептидогликаном клеточной стенки. Прекращение сборки и тем самым длины полимера является непостоянным, приводя к образованию характерного высокомолекулярного ступенчатого шаблона, если визуализировать эти пилусы с помощью вестерн-блоттинга. Как показано на Фиг. 8В и С, ступенчатый шаблон, свидетельствующий о пилусной структуре, наблюдался в случае вестерн-блоттинга поверхностных полипептидов, экстрагированных из Clostridium perfringens штамма СР1, но не в случае соответствующего вестерн-блоттинга поверхностных полипептидов, экстрагированных из мутировавших штаммов, равно при визуализации с антителами, полученными из сыворотки кур или выращенные у кроликов.
Различные штаммы Clostridium perfringens:
[86] Экстракцию поверхностных полипептидов из пяти изолятов С.perfringens из происходящих от домашней птицы (СР1, JGS4141 и JGS4120) или не происходящих от домашней птицы (Strain 13, АТСС13124) источников провели согласно вышеприведенному описанию. Экстракты поверхностных белков (5 мкл) загрузили на два Novex™ NuPAGE™ 3-8% трисацетатных геля (Fisher Scientific) и подвергали электрофорезу при 150V в течение 1 ч. Один гель использовали для окрашивания Bio-Safe™ красителем Комасси (BioRad), второй гель перенесли на поливинилен дифторидную (PVDF) мембрану при 350V в течение 1 ч в 1Х трансферном буферном растворе (48 mM Tris, 39 тМ глицин, 20% метанол, 0,1% SDS). Обнаружение хемолюминисценции проводили с помощью набора Western Breeze™ Chemiluminescent kit (Life Technologies) согласно инструкциям производителя, используя анти-FimA сыворотку цыплят (1:200) в качестве первичного антитела и козье вторичное антитело к IgY цыпленка, конъюгированное с щелочной фосфатазой (АР) (1:2000). Сыворотку, используемую как первичный Ab получили от FimA-иммунизированных цыплят, которые впоследствии показали высокий анти-FimA титр.
[87] Результаты показаны на Фиг. 9А-В. Присутствие (+) или отсутствие (-) генетического локуса (VR-10B (СА) локус) в отношении генов элемента пилуса спаА, fimA и fimB в каждом штамме Clostridium perfringens ранее определили как с помощью микроматричного анализа, так и с помощью полимеразной цепной реакции (PCR) (Lepp D et al, Journal of Bacteriology (2013) 195: 1152-1166). Как видно на Фиг. 9А-В, штаммы, несущие генетический локус пилуса в своих геномах (JGS4141 и СР1), продемонстрировали характерный ступенчатый шаблон пилусной структуры выделенных поверхностных полипептидов (обозначено вертикальной линией справа от изображения геля на Фиг. 9 В), если вестерн-блоттинг визуализировали с анти-FimA антителом цыплят, тогда как другие штаммы, не несущие генетический локус пилуса в своем геноме, не показали такого шаблона. Визуализация линий меньшей молекулярной массы в экстрактах вероятно вызвана посторонними антителами, присутствующими в сыворотке цыплят. Ни в одном из экстрактов не было видно линии, соответствующей самому FimA полипептиду, ожидаемое местоположение которой указано стрелкой справа от изображения геля на Фиг 9 В. Это не удивительно, так как белки, ассоциированные с поверхностью, не включают FimA мономер, который присутствует только в клетках.
Маркировка коллоидным золотом мутантов элементов пилуса Clostridium perfringens штаммов СР1 и СР1:
[88] Клетки Clostridium perfringens штамма СР1 или СР1 нуль-мутантов CP1ΔfimA, и CP1ΔfimB пометили частицами золота с использованием методики нанесения коллоидного золота с включением кроличьего анти-FimA в качестве первичного антитела и 6 нм Colloidal Gold-AffiniPure™ Goat Anti-Rabbit IgG (H+L) (min X Hu.Ms.Rat Sr Prot) (Cedarlane) в качестве вторичного антитела, и анализировали с помощью трансмиссионной электронной микроскопии, в целом как было описано ранее (Chang, С, Huang, I.-H., Hendrickx, А.Р.А., Ton-That, Н. 2013. Visualization of Gram-positive Bacterial Pili, In: Delcour, H.A. (Ed.) Bacterial Cell Surfaces: Methods и Protocols. Humana Press, Totowa, NJ, 77-95). Как видно на Фиг. 10, клетки природного СР1 штамма демонстрируют присутствие пилусной структуры на поверхности клетки, тогда как у клеток СР1ΔfimA, и СР1ΔfimB мутантов такие структуры отсутствуют.
[89] Варианты осуществления изобретения, описанные в этом документе, являются иллюстративными в отношении описанных композиций и способов, и не должны рассматриваться как ограничивающие объем данного изобретения. Различные модификации и изменения, в целом не противоречащие описанию изобретения и очевидные для специалиста в данной области, также являются включенными в объем данного изобретения. Приведенная ниже формула изобретения не является ограничивающей данное изобретение рамками вариантов его осуществления, описанных в примерах, но должна интерпретироваться в самом широком смысле в соответствии с описанием изобретения в целом.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЕЕ ВЕЛИЧЕСТВО КОРОЛЕВА КАНАДЫ ПО ПРАВУ В ЛИЦЕ
МИНИСТРА СЕЛЬСКОГО ХОЗЯЙСТВА И СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПРОДУКЦИИ
<120> ВАКЦИНА ПРОТИВ НЕКРОТИЧЕСКОГО ЭНТЕРИТА У ДОМАШНЕЙ ПТИЦЫ
<130> 3688-157
<150> US 62/513,001
<151> 2017-05-31
<160> 15
<170> Патент в версии 3.5
<210> 1
<211> 2091
<212> ДНК
<213> Clostridium perfringens
<400> 1
atgaaaataa ataaaaaaat ttttagcatg ctatttatgg ttattgtact ttttacatgc 60
atatcatcaa atttttctgt ttctgcttct tctattcaaa gaggaagaga tatcagtaat 120
gaggtagtta caagcctagt ggctactcca aatagtataa atgatggtgg aaacgttcag 180
gttcgtttgg aatttaaaga aaatcatcaa agaaatatac aaagtggaga tactataact 240
gtcaaatgga caaattcagg ggaagtattt tttgaaggat atgaaaaaac aattccactt 300
tatataaaag accaaaatgt tggtcaagca gtaatagaga aaacaggtgc aacacttaca 360
tttaatgata aaatagataa attagatgat gttggtggat gggcaacatt tactttgcaa 420
ggaagaaaca ttacctcagg taatcatgaa cacacaggaa tagcatatat tatatctggt 480
tcaaagcggg cagatgtaaa tataaccaaa ccagaatcag gtacaactag tgtattctat 540
tataaaacag gtagtatgta taccaatgat acaaatcatg tcaattggtg gttactggtg 600
aatccaagca aggtatattc tgaaaaaaac gtttatattc aagatgaaat ccaaggcgga 660
caaacattag aacctgattc ttttgaaata gtagtaactt ggtatgatgg ttatgtagaa 720
aagtttaaag gaaaagaagc gataagggaa ttccataata aatatccaaa ttcaaatata 780
tcggtatcag aaaataaaat aacagtaaac atttcacaag aggattccac acaaaagttt 840
attaatattt tttataaaac taagattaca aatccgaaac aaaaagaatt cgttaataat 900
acaaaagcat ggtttaaaga gtataataag ccagctgtaa atggagaatc ctttaaccat 960
agcgtacaaa atattaatgc agatgctgga gttaatggaa ctgtaaaagg cgaattaaaa 1020
atcataaaaa cattaaaaga taaaagtatt ccaattaaag atgttcagtt taagatgaga 1080
agagttgata atacagttat caaagatggt aaaaaagaat tattactaac aactgatgat 1140
aaaggtattg caaatgtaaa aggtcttcct gtaggaaaat atgaagtaaa agagatttca 1200
gctccagaat ggattgcttt taatcctctt attgcaccaa aattggaatt cacaatatca 1260
gatcaggaca cagaaggcaa attgtgggct gttgaaaatg aattaaagac aatttcaatt 1320
ccggttgaaa aggtctgggt aggacaaact agtgaacgag cagaaatcaa gctttttgca 1380
gatggtattg aagtagacaa agtgatttta aatgcagata acaattggaa acacacattt 1440
gaaaataaac ctgaatataa ttcagaaaca aaacagaaaa tcaattattc tgtgtcagag 1500
acaactattt ctggatatga aagcaatatc acaggcgatg ctaagaatgg ttttattgta 1560
accaatacag aacttcctga tttgactatt ggtaaagaag ttataggaga attgggtgac 1620
aagacgaagg tatttaactt tgagcttaca ttaaagcaag cagatggaaa gcctatcaat 1680
ggtaaattta attacattgg tagtgtagat gacaggtaca aaaaagaaag cataaagcct 1740
tctgatggtg agattacttt tatagaagga aaagcaacta taactttatc acatggacaa 1800
gagattacaa tcaaggattt accatatggg gttacatata aagttatgga aaaagaagct 1860
aatgaaaatg gctatttaac tacctataat ggaaataacg aagtcacaac aggtgaattg 1920
aaacaggata caaaagtaca ggtagttaac aacaaagagt ttgttccaac aactggtata 1980
tcaaccacaa cagagcaagg tacaatggtt ggaatggtga ttttttctat aggaatactt 2040
atggtcatga ttgtagttct tttacaattg aataaaggac tgaaaagatg a 2091
<210> 2
<211> 1074
<212> ДНК
<213> Clostridium perfringens
<400> 2
atgataaaca agaaaaaatt aagtgcatta ttattaagtg gagcaatgtt tatgagtatg 60
aatacaaatg tattcgcatc aaatttacct tctggagggg tagaaggtac agaacagaat 120
cctgcaaaag caacaattac aaagaatttt gaatttccag aaggtattaa tacacctagt 180
gcaacattca agtttacagc agaaaaaata actaatgatg cgccagatgc aacaattgga 240
gatattaatt atacacaagg ggataatgga actttatcaa atggaaaata tagtgtaaag 300
aaaacaactg aaattacttt tggaaatttc ccacatgcag gagaatatga ttataatgta 360
aaagaaacga atgagggagt aggtggtatt acatatgata caaaagaata caaagttcat 420
gtgtatgttg caaatagtaa cgctatggat ggaaaaactt atgtaaaagc cattacatca 480
gaaaatggag gtgaaaaagc tccaattgag tttgttaata catataaaaa ggacacttct 540
ttacttatag aaaagaatgt aataggagat ttagctgact taacaaaaca gtttgagttt 600
cagattaatt taaaaaaatc agcaacatct gacataacaa aattcgaagg aaatattatt 660
agaaaagatg gtaaaataga gcctgtaaca tatacagctg aaaatacaga aacttttaaa 720
ttagcaaatg gagataaact taagtttgaa agtattccag caggaacaaa atatgaagta 780
aaagagatag gtgctagtga tggatataca ccttctataa cagtaattga aaatggaaat 840
gagacttcta ataatcgtac ggtagctgaa aaagatggta tatcatctaa gtcaaattct 900
aatgataact taattggtga aggtgaaaac aaagtaacat ttacaaacac atataatgac 960
aaacctatca caggtattgt tatgaataat attccattta ttctaatgat tagttttgct 1020
gtccttggat ttggtgcttt agctattata aaaagacgta aaactataag ataa 1074
<210> 3
<211> 660
<212> ДНК
<213> Clostridium perfringens
<400> 3
atggaaacaa agaaaataag aaacaaaatc cttatggcta tcgtagcatt gagctttata 60
ttgcttccaa acactagagt atatgctact gaaaatacag caaatattcc tttgatagtt 120
agacaggaat ttaatgtata tacgaaagat tcaaaagcaa tagacatgat tggaaaatac 180
gagctaaagg caataagtga aaatgcccct atgccagaag aaagtaaaaa tggaagtttt 240
atctttaata tagatggaaa tgataagcag tttactattc cattagctta tacacatggt 300
ggtgtgtata tctatcaaat tcaacagata acgcaatcta aagataatta catatatgat 360
aaaaatagct ataagataac tgtatatgta aaaaatgcag aaaataatca tttaatacca 420
caaattattg tgaaaaatga aaataatgaa aaatgtgaag aaatatgttt ttataacatt 480
tacaaacaaa aaaataaaat taatgagatt tctaaaacac catataagcc aaatggaata 540
aatgttccta aaacaggcga taccacaaac attggatttt atattgtaat acttataatt 600
tcacttggat tacttgtggt attgaaatgg aaagaatata aaaagagaaa aaaagaataa 660
<210> 4
<211> 2088
<212> ДНК
<213> Искусственная последовательность
<220>
<223> cnaA кодон-оптимизированный
<400> 4
atgaagatca acaagaagat cttcagcatg ttatttatgg tcattgtgct gttcacctgt 60
atcagctcta acttcagtgt gagcgcgtca agcatccagc gcggccggga catcagcaac 120
gaggtggtga catcgctcgt agctaccccg aatagcatca acgatggtgg taacgtccaa 180
gtgcgtctgg aatttaaaga gaatcaccag cggaacattc agtccggcga cacgattacg 240
gtcaaatgga ctaactcagg tgaggtcttt tttgaaggct acgaaaaaac catcccgctg 300
tatatcaagg atcagaacgt tggccaggcg gttattgaaa aaaccggtgc aacattaaca 360
ttcaacgata agatcgacaa attagatgat gtcggcggct gggccacatt cacgctccag 420
ggtcgcaata ttacttcagg aaatcatgag catactggta ttgcgtacat tatctcgggt 480
agcaaacgtg cggacgttaa catcacaaaa cctgaatccg gaacaacgtc tgtgttttac 540
tacaagacgg gttcgatgta caccaatgac acaaatcatg tgaattggtg gctgctggtt 600
aacccgagca aagtatactc tgagaaaaat gtctatattc aggatgaaat tcaaggcggt 660
cagaccctgg agccggacag ttttgaaatc gtcgttacat ggtacgatgg ttatgtggaa 720
aaatttaaag gtaaagaagc gatccgggag ttccacaata aatatccgaa tagtaatatc 780
tcggtcagtg aaaataaaat cacggtaaat atttcgcaag aagattccac ccaaaaattc 840
attaacatct tttacaagac taaaatcacc aacccgaagc agaaagaatt tgtaaacaac 900
accaaagcct ggttcaaaga gtacaataag ccggcggtta acggtgaaag ttttaatcac 960
agtgtgcaga atatcaacgc agatgccggg gtaaatggta ctgttaaagg tgaattgaaa 1020
attatcaaaa ccctgaaaga taaaagtatt ccgatcaagg atgtgcagtt taagatgcgc 1080
cgcgtggata ataccgttat taaagacggc aagaaagagc tgctgttgac cacagatgat 1140
aaagggattg caaacgtgaa aggtctgcca gtcgggaaat acgaagtcaa agaaatcagt 1200
gcgcctgagt ggatcgcctt caatccactg attgcgccca aacttgaatt tacgatcagc 1260
gatcaagaca cagaggggaa attatgggca gtggaaaacg aactcaaaac catctcgatt 1320
ccggtcgaaa aagtctgggt aggtcagacg agtgaacggg cggagatcaa actgtttgcg 1380
gatggaattg aagttgataa ggtgatcctg aacgcggata ataattggaa gcacaccttt 1440
gagaataaac ccgaatataa ctccgagact aaacaaaaaa tcaactatag tgtgagcgaa 1500
actaccatca gtggctatga atcaaatatt actggcgatg cgaaaaacgg atttattgtc 1560
accaacacag aactgcctga tttgacgatc gggaaagagg taatcggcga actcggcgat 1620
aaaaccaagg tattcaactt tgaactgaca cttaagcagg ctgacggaaa gcccattaac 1680
gggaaattta actatattgg ttcggtggat gatcgttata agaaggaatc gattaagcct 1740
agcgatgggg aaattacgtt catcgaggga aaagcaacga ttaccctctc ccacggacaa 1800
gagatcacca ttaaggacct tccgtatggt gtgacctata aagtcatgga aaaagaagcc 1860
aacgagaatg gatatttaac cacttacaac ggaaataacg aagtcaccac cggggagttg 1920
aaacaggata cgaaagtaca agtggttaat aataaagaat tcgtcccgac aaccgggatc 1980
agcaccacca ccgaacaggg aaccatggtc gggatggtga tctttagcat cggtattctc 2040
atggtaatga ttgtcgttct gctgcagctg aataaaggac tgaaacgc 2088
<210> 5
<211> 1086
<212> ДНК
<213> Искусственная последовательность
<220>
<223> fimA кодон-оптимизированный
<400> 5
atgattaata aaaagaaact gtcggcgctg ctcttaagcg gggccatgtt tatgagcatg 60
aacacgaatg tgttcgcgtc taacctccca tcgggtggtg tggagggcac cgaacaaaac 120
ccagcgaaag cgacaatcac gaaaaacttc gagtttccgg aaggtattaa tacacccagc 180
gcgacattca aatttaccgc cgaaaaaatt accaacgatg cgccggatgc tactattggc 240
gacatcaatt atacccaagg tgataatggg acgttaagca atggcaaata cagtgtgaaa 300
aagactaccg agattacctt cgggaacttc ccgcatgctg gtgagtatga ttataacgtc 360
aaagaaacca atgaaggcgt gggtggcatt acttacgata cgaaagaata taaagttcat 420
gtgtatgtgg ccaactcaaa tgcgatggac ggtaagacat atgttaaagc gattactagc 480
gaaaatggcg gggaaaaagc accgatcgaa ttcgttaaca cctataaaaa agatacgtcg 540
ttactgattg aaaaaaatgt aattggcgat ctggcagacc tcaccaaaca gtttgagttt 600
caaatcaact tgaaaaagag cgcgactagt gatattacca agtttgaagg taacattatt 660
cgcaaagacg gtaagattga acccgtgacc tataccgcgg aaaataccga gacctttaag 720
ttagccaacg gagacaagtt aaaattcgag tccatccccg ccggtacaaa atatgaagtc 780
aaggaaatcg gggcgagcga tgggtacacg ccctcaatca ccgttatcga aaatggcaac 840
gaaacctcaa ataaccgcac tgtagccgaa aaagatggaa tctctagcaa aagcaactcg 900
aacgacaatt taatcggcga aggcgaaaat aaagtgacct ttaccaatac gtacaacgat 960
aaaccaatca cgggaatcgt aatgaataat attccgttca ttcttatgat tagctttgcc 1020
gttcttggct tcggtgcatt agcgatcatt aaacgccgca aaaccatccg ccccatcgat 1080
acgcgt 1086
<210> 6
<211> 624
<212> ДНК
<213> Искусственная последовательность
<220>
<223> fimB кодон-оптимизированный
<400> 6
atggctattg ttgctttgtc atttatcctg ctcccgaata cccgggtcta tgcgacggag 60
aacaccgcta atatcccgtt aattgtacgc caagaattta atgtttacac taaagattct 120
aaagccattg acatgatcgg aaaatatgaa ttaaaagcca tttctgagaa cgctcccatg 180
ccggaggaat caaaaaatgg tagctttatt tttaacatcg acggtaatga taaacagttt 240
actattccgc tggcgtacac tcacggtggc gtctacatct atcaaatcca gcaaattacc 300
cagagcaagg ataactacat ctacgataaa aacagctata aaatcacggt atatgtcaag 360
aacgcagaaa acaatcatct gatcccgcag attattgtaa aaaatgagaa caatgaaaaa 420
tgtgaagaaa tctgcttcta caatatctac aaacagaaaa acaagatcaa tgagatctct 480
aaaaccccct ataagccgaa tggtattaat gtcccgaaaa cgggtgatac cacgaacatc 540
ggattctaca ttgtgatctt gattatttcc ctgggcctgc tggtggtctt gaagtggaaa 600
gaatataaaa aacgtaagaa ggaa 624
<210> 7
<211> 1887
<212> ДНК
<213> Искусственная последовательность
<220>
<223> cnaA укороченный
<400> 7
tcaagcatcc agcgcggccg ggacatcagc aacgaggtgg tgacatcgct cgtagctacc 60
ccgaatagca tcaacgatgg tggtaacgtc caagtgcgtc tggaatttaa agagaatcac 120
cagcggaaca ttcagtccgg cgacacgatt acggtcaaat ggactaactc aggtgaggtc 180
ttttttgaag gctacgaaaa aaccatcccg ctgtatatca aggatcagaa cgttggccag 240
gcggttattg aaaaaaccgg tgcaacatta acattcaacg ataagatcga caaattagat 300
gatgtcggcg gctgggccac attcacgctc cagggtcgca atattacttc aggaaatcat 360
gagcatactg gtattgcgta cattatctcg ggtagcaaac gtgcggacgt taacatcaca 420
aaacctgaat ccggaacaac gtctgtgttt tactacaaga cgggttcgat gtacaccaat 480
gacacaaatc atgtgaattg gtggctgctg gttaacccga gcaaagtata ctctgagaaa 540
aatgtctata ttcaggatga aattcaaggc ggtcagaccc tggagccgga cagttttgaa 600
atcgtcgtta catggtacga tggttatgtg gaaaaattta aaggtaaaga agcgatccgg 660
gagttccaca ataaatatcc gaatagtaat atctcggtca gtgaaaataa aatcacggta 720
aatatttcgc aagaagattc cacccaaaaa ttcattaaca tcttttacaa gactaaaatc 780
accaacccga agcagaaaga atttgtaaac aacaccaaag cctggttcaa agagtacaat 840
aagccggcgg ttaacggtga aagttttaat cacagtgtgc agaatatcaa cgcagatgcc 900
ggggtaaatg gtactgttaa aggtgaattg aaaattatca aaaccctgaa agataaaagt 960
attccgatca aggatgtgca gtttaagatg cgccgcgtgg ataataccgt tattaaagac 1020
ggcaagaaag agctgctgtt gaccacagat gataaaggga ttgcaaacgt gaaaggtctg 1080
ccagtcggga aatacgaagt caaagaaatc agtgcgcctg agtggatcgc cttcaatcca 1140
ctgattgcgc ccaaacttga atttacgatc agcgatcaag acacagaggg gaaattatgg 1200
gcagtggaaa acgaactcaa aaccatctcg attccggtcg aaaaagtctg ggtaggtcag 1260
acgagtgaac gggcggagat caaactgttt gcggatggaa ttgaagttga taaggtgatc 1320
ctgaacgcgg ataataattg gaagcacacc tttgagaata aacccgaata taactccgag 1380
actaaacaaa aaatcaacta tagtgtgagc gaaactacca tcagtggcta tgaatcaaat 1440
attactggcg atgcgaaaaa cggatttatt gtcaccaaca cagaactgcc tgatttgacg 1500
atcgggaaag aggtaatcgg cgaactcggc gataaaacca aggtattcaa ctttgaactg 1560
acacttaagc aggctgacgg aaagcccatt aacgggaaat ttaactatat tggttcggtg 1620
gatgatcgtt ataagaagga atcgattaag cctagcgatg gggaaattac gttcatcgag 1680
ggaaaagcaa cgattaccct ctcccacgga caagagatca ccattaagga ccttccgtat 1740
ggtgtgacct ataaagtcat ggaaaaagaa gccaacgaga atggatattt aaccacttac 1800
aacggaaata acgaagtcac caccggggag ttgaaacagg atacgaaagt acaagtggtt 1860
aataataaag aattcgtccc gacaacc 1887
<210> 8
<211> 894
<212> ДНК
<213> Искусственная последовательность
<220>
<223> fimA укороченный
<400> 8
tctaacctcc catcgggtgg tgtggagggc accgaacaaa acccagcgaa agcgacaatc 60
acgaaaaact tcgagtttcc ggaaggtatt aatacaccca gcgcgacatt caaatttacc 120
gccgaaaaaa ttaccaacga tgcgccggat gctactattg gcgacatcaa ttatacccaa 180
ggtgataatg ggacgttaag caatggcaaa tacagtgtga aaaagactac cgagattacc 240
ttcgggaact tcccgcatgc tggtgagtat gattataacg tcaaagaaac caatgaaggc 300
gtgggtggca ttacttacga tacgaaagaa tataaagttc atgtgtatgt ggccaactca 360
aatgcgatgg acggtaagac atatgttaaa gcgattacta gcgaaaatgg cggggaaaaa 420
gcaccgatcg aattcgttaa cacctataaa aaagatacgt cgttactgat tgaaaaaaat 480
gtaattggcg atctggcaga cctcaccaaa cagtttgagt ttcaaatcaa cttgaaaaag 540
agcgcgacta gtgatattac caagtttgaa ggtaacatta ttcgcaaaga cggtaagatt 600
gaacccgtga cctataccgc ggaaaatacc gagaccttta agttagccaa cggagacaag 660
ttaaaattcg agtccatccc cgccggtaca aaatatgaag tcaaggaaat cggggcgagc 720
gatgggtaca cgccctcaat caccgttatc gaaaatggca acgaaacctc aaataaccgc 780
actgtagccg aaaaagatgg aatctctagc aaaagcaact cgaacgacaa tttaatcggc 840
gaaggcgaaa ataaagtgac ctttaccaat acgtacaacg ataaaccaat cacg 894
<210> 9
<211> 468
<212> ДНК
<213> Искусственная последовательность
<220>
<223> fimB укороченный
<400> 9
acggagaaca ccgctaatat cccgttaatt gtacgccaag aatttaatgt ttacactaaa 60
gattctaaag ccattgacat gatcggaaaa tatgaattaa aagccatttc tgagaacgct 120
cccatgccgg aggaatcaaa aaatggtagc tttattttta acatcgacgg taatgataaa 180
cagtttacta ttccgctggc gtacactcac ggtggcgtct acatctatca aatccagcaa 240
attacccaga gcaaggataa ctacatctac gataaaaaca gctataaaat cacggtatat 300
gtcaagaacg cagaaaacaa tcatctgatc ccgcagatta ttgtaaaaaa tgagaacaat 360
gaaaaatgtg aagaaatctg cttctacaat atctacaaac agaaaaacaa gatcaatgag 420
atctctaaaa ccccctataa gccgaatggt attaatgtcc cgaaaacg 468
<210> 10
<211> 696
<212> PRT
<213> Clostridium perfringens
<400> 10
Met Lys Ile Asn Lys Lys Ile Phe Ser Met Leu Phe Met Val Ile Val
1 5 10 15
Leu Phe Thr Cys Ile Ser Ser Asn Phe Ser Val Ser Ala Ser Ser Ile
20 25 30
Gln Arg Gly Arg Asp Ile Ser Asn Glu Val Val Thr Ser Leu Val Ala
35 40 45
Thr Pro Asn Ser Ile Asn Asp Gly Gly Asn Val Gln Val Arg Leu Glu
50 55 60
Phe Lys Glu Asn His Gln Arg Asn Ile Gln Ser Gly Asp Thr Ile Thr
65 70 75 80
Val Lys Trp Thr Asn Ser Gly Glu Val Phe Phe Glu Gly Tyr Glu Lys
85 90 95
Thr Ile Pro Leu Tyr Ile Lys Asp Gln Asn Val Gly Gln Ala Val Ile
100 105 110
Glu Lys Thr Gly Ala Thr Leu Thr Phe Asn Asp Lys Ile Asp Lys Leu
115 120 125
Asp Asp Val Gly Gly Trp Ala Thr Phe Thr Leu Gln Gly Arg Asn Ile
130 135 140
Thr Ser Gly Asn His Glu His Thr Gly Ile Ala Tyr Ile Ile Ser Gly
145 150 155 160
Ser Lys Arg Ala Asp Val Asn Ile Thr Lys Pro Glu Ser Gly Thr Thr
165 170 175
Ser Val Phe Tyr Tyr Lys Thr Gly Ser Met Tyr Thr Asn Asp Thr Asn
180 185 190
His Val Asn Trp Trp Leu Leu Val Asn Pro Ser Lys Val Tyr Ser Glu
195 200 205
Lys Asn Val Tyr Ile Gln Asp Glu Ile Gln Gly Gly Gln Thr Leu Glu
210 215 220
Pro Asp Ser Phe Glu Ile Val Val Thr Trp Tyr Asp Gly Tyr Val Glu
225 230 235 240
Lys Phe Lys Gly Lys Glu Ala Ile Arg Glu Phe His Asn Lys Tyr Pro
245 250 255
Asn Ser Asn Ile Ser Val Ser Glu Asn Lys Ile Thr Val Asn Ile Ser
260 265 270
Gln Glu Asp Ser Thr Gln Lys Phe Ile Asn Ile Phe Tyr Lys Thr Lys
275 280 285
Ile Thr Asn Pro Lys Gln Lys Glu Phe Val Asn Asn Thr Lys Ala Trp
290 295 300
Phe Lys Glu Tyr Asn Lys Pro Ala Val Asn Gly Glu Ser Phe Asn His
305 310 315 320
Ser Val Gln Asn Ile Asn Ala Asp Ala Gly Val Asn Gly Thr Val Lys
325 330 335
Gly Glu Leu Lys Ile Ile Lys Thr Leu Lys Asp Lys Ser Ile Pro Ile
340 345 350
Lys Asp Val Gln Phe Lys Met Arg Arg Val Asp Asn Thr Val Ile Lys
355 360 365
Asp Gly Lys Lys Glu Leu Leu Leu Thr Thr Asp Asp Lys Gly Ile Ala
370 375 380
Asn Val Lys Gly Leu Pro Val Gly Lys Tyr Glu Val Lys Glu Ile Ser
385 390 395 400
Ala Pro Glu Trp Ile Ala Phe Asn Pro Leu Ile Ala Pro Lys Leu Glu
405 410 415
Phe Thr Ile Ser Asp Gln Asp Thr Glu Gly Lys Leu Trp Ala Val Glu
420 425 430
Asn Glu Leu Lys Thr Ile Ser Ile Pro Val Glu Lys Val Trp Val Gly
435 440 445
Gln Thr Ser Glu Arg Ala Glu Ile Lys Leu Phe Ala Asp Gly Ile Glu
450 455 460
Val Asp Lys Val Ile Leu Asn Ala Asp Asn Asn Trp Lys His Thr Phe
465 470 475 480
Glu Asn Lys Pro Glu Tyr Asn Ser Glu Thr Lys Gln Lys Ile Asn Tyr
485 490 495
Ser Val Ser Glu Thr Thr Ile Ser Gly Tyr Glu Ser Asn Ile Thr Gly
500 505 510
Asp Ala Lys Asn Gly Phe Ile Val Thr Asn Thr Glu Leu Pro Asp Leu
515 520 525
Thr Ile Gly Lys Glu Val Ile Gly Glu Leu Gly Asp Lys Thr Lys Val
530 535 540
Phe Asn Phe Glu Leu Thr Leu Lys Gln Ala Asp Gly Lys Pro Ile Asn
545 550 555 560
Gly Lys Phe Asn Tyr Ile Gly Ser Val Asp Asp Arg Tyr Lys Lys Glu
565 570 575
Ser Ile Lys Pro Ser Asp Gly Glu Ile Thr Phe Ile Glu Gly Lys Ala
580 585 590
Thr Ile Thr Leu Ser His Gly Gln Glu Ile Thr Ile Lys Asp Leu Pro
595 600 605
Tyr Gly Val Thr Tyr Lys Val Met Glu Lys Glu Ala Asn Glu Asn Gly
610 615 620
Tyr Leu Thr Thr Tyr Asn Gly Asn Asn Glu Val Thr Thr Gly Glu Leu
625 630 635 640
Lys Gln Asp Thr Lys Val Gln Val Val Asn Asn Lys Glu Phe Val Pro
645 650 655
Thr Thr Gly Ile Ser Thr Thr Thr Glu Gln Gly Thr Met Val Gly Met
660 665 670
Val Ile Phe Ser Ile Gly Ile Leu Met Val Met Ile Val Val Leu Leu
675 680 685
Gln Leu Asn Lys Gly Leu Lys Arg
690 695
<210> 11
<211> 357
<212> PRT
<213> Clostridium perfringens
<400> 11
Met Ile Asn Lys Lys Lys Leu Ser Ala Leu Leu Leu Ser Gly Ala Met
1 5 10 15
Phe Met Ser Met Asn Thr Asn Val Phe Ala Ser Asn Leu Pro Ser Gly
20 25 30
Gly Val Glu Gly Thr Glu Gln Asn Pro Ala Lys Ala Thr Ile Thr Lys
35 40 45
Asn Phe Glu Phe Pro Glu Gly Ile Asn Thr Pro Ser Ala Thr Phe Lys
50 55 60
Phe Thr Ala Glu Lys Ile Thr Asn Asp Ala Pro Asp Ala Thr Ile Gly
65 70 75 80
Asp Ile Asn Tyr Thr Gln Gly Asp Asn Gly Thr Leu Ser Asn Gly Lys
85 90 95
Tyr Ser Val Lys Lys Thr Thr Glu Ile Thr Phe Gly Asn Phe Pro His
100 105 110
Ala Gly Glu Tyr Asp Tyr Asn Val Lys Glu Thr Asn Glu Gly Val Gly
115 120 125
Gly Ile Thr Tyr Asp Thr Lys Glu Tyr Lys Val His Val Tyr Val Ala
130 135 140
Asn Ser Asn Ala Met Asp Gly Lys Thr Tyr Val Lys Ala Ile Thr Ser
145 150 155 160
Glu Asn Gly Gly Glu Lys Ala Pro Ile Glu Phe Val Asn Thr Tyr Lys
165 170 175
Lys Asp Thr Ser Leu Leu Ile Glu Lys Asn Val Ile Gly Asp Leu Ala
180 185 190
Asp Leu Thr Lys Gln Phe Glu Phe Gln Ile Asn Leu Lys Lys Ser Ala
195 200 205
Thr Ser Asp Ile Thr Lys Phe Glu Gly Asn Ile Ile Arg Lys Asp Gly
210 215 220
Lys Ile Glu Pro Val Thr Tyr Thr Ala Glu Asn Thr Glu Thr Phe Lys
225 230 235 240
Leu Ala Asn Gly Asp Lys Leu Lys Phe Glu Ser Ile Pro Ala Gly Thr
245 250 255
Lys Tyr Glu Val Lys Glu Ile Gly Ala Ser Asp Gly Tyr Thr Pro Ser
260 265 270
Ile Thr Val Ile Glu Asn Gly Asn Glu Thr Ser Asn Asn Arg Thr Val
275 280 285
Ala Glu Lys Asp Gly Ile Ser Ser Lys Ser Asn Ser Asn Asp Asn Leu
290 295 300
Ile Gly Glu Gly Glu Asn Lys Val Thr Phe Thr Asn Thr Tyr Asn Asp
305 310 315 320
Lys Pro Ile Thr Gly Ile Val Met Asn Asn Ile Pro Phe Ile Leu Met
325 330 335
Ile Ser Phe Ala Val Leu Gly Phe Gly Ala Leu Ala Ile Ile Lys Arg
340 345 350
Arg Lys Thr Ile Arg
355
<210> 12
<211> 219
<212> PRT
<213> Clostridium perfringens
<400> 12
Met Glu Thr Lys Lys Ile Arg Asn Lys Ile Leu Met Ala Ile Val Ala
1 5 10 15
Leu Ser Phe Ile Leu Leu Pro Asn Thr Arg Val Tyr Ala Thr Glu Asn
20 25 30
Thr Ala Asn Ile Pro Leu Ile Val Arg Gln Glu Phe Asn Val Tyr Thr
35 40 45
Lys Asp Ser Lys Ala Ile Asp Met Ile Gly Lys Tyr Glu Leu Lys Ala
50 55 60
Ile Ser Glu Asn Ala Pro Met Pro Glu Glu Ser Lys Asn Gly Ser Phe
65 70 75 80
Ile Phe Asn Ile Asp Gly Asn Asp Lys Gln Phe Thr Ile Pro Leu Ala
85 90 95
Tyr Thr His Gly Gly Val Tyr Ile Tyr Gln Ile Gln Gln Ile Thr Gln
100 105 110
Ser Lys Asp Asn Tyr Ile Tyr Asp Lys Asn Ser Tyr Lys Ile Thr Val
115 120 125
Tyr Val Lys Asn Ala Glu Asn Asn His Leu Ile Pro Gln Ile Ile Val
130 135 140
Lys Asn Glu Asn Asn Glu Lys Cys Glu Glu Ile Cys Phe Tyr Asn Ile
145 150 155 160
Tyr Lys Gln Lys Asn Lys Ile Asn Glu Ile Ser Lys Thr Pro Tyr Lys
165 170 175
Pro Asn Gly Ile Asn Val Pro Lys Thr Gly Asp Thr Thr Asn Ile Gly
180 185 190
Phe Tyr Ile Val Ile Leu Ile Ile Ser Leu Gly Leu Leu Val Val Leu
195 200 205
Lys Trp Lys Glu Tyr Lys Lys Arg Lys Lys Glu
210 215
<210> 13
<211> 680
<212> PRT
<213> Искусственная последовательность
<220>
<223> cnaA экспрессированный His-меченный
<400> 13
Met Gly Ser Ser His His His His His His Ser Ser Gly Leu Val Pro
1 5 10 15
Arg Gly Ser His Met Ala Ser Met Thr Gly Gly Gln Gln Met Gly Arg
20 25 30
Gly Ser Glu Phe Ser Ser Ile Gln Arg Gly Arg Asp Ile Ser Asn Glu
35 40 45
Val Val Thr Ser Leu Val Ala Thr Pro Asn Ser Ile Asn Asp Gly Gly
50 55 60
Asn Val Gln Val Arg Leu Glu Phe Lys Glu Asn His Gln Arg Asn Ile
65 70 75 80
Gln Ser Gly Asp Thr Ile Thr Val Lys Trp Thr Asn Ser Gly Glu Val
85 90 95
Phe Phe Glu Gly Tyr Glu Lys Thr Ile Pro Leu Tyr Ile Lys Asp Gln
100 105 110
Asn Val Gly Gln Ala Val Ile Glu Lys Thr Gly Ala Thr Leu Thr Phe
115 120 125
Asn Asp Lys Ile Asp Lys Leu Asp Asp Val Gly Gly Trp Ala Thr Phe
130 135 140
Thr Leu Gln Gly Arg Asn Ile Thr Ser Gly Asn His Glu His Thr Gly
145 150 155 160
Ile Ala Tyr Ile Ile Ser Gly Ser Lys Arg Ala Asp Val Asn Ile Thr
165 170 175
Lys Pro Glu Ser Gly Thr Thr Ser Val Phe Tyr Tyr Lys Thr Gly Ser
180 185 190
Met Tyr Thr Asn Asp Thr Asn His Val Asn Trp Trp Leu Leu Val Asn
195 200 205
Pro Ser Lys Val Tyr Ser Glu Lys Asn Val Tyr Ile Gln Asp Glu Ile
210 215 220
Gln Gly Gly Gln Thr Leu Glu Pro Asp Ser Phe Glu Ile Val Val Thr
225 230 235 240
Trp Tyr Asp Gly Tyr Val Glu Lys Phe Lys Gly Lys Glu Ala Ile Arg
245 250 255
Glu Phe His Asn Lys Tyr Pro Asn Ser Asn Ile Ser Val Ser Glu Asn
260 265 270
Lys Ile Thr Val Asn Ile Ser Gln Glu Asp Ser Thr Gln Lys Phe Ile
275 280 285
Asn Ile Phe Tyr Lys Thr Lys Ile Thr Asn Pro Lys Gln Lys Glu Phe
290 295 300
Val Asn Asn Thr Lys Ala Trp Phe Lys Glu Tyr Asn Lys Pro Ala Val
305 310 315 320
Asn Gly Glu Ser Phe Asn His Ser Val Gln Asn Ile Asn Ala Asp Ala
325 330 335
Gly Val Asn Gly Thr Val Lys Gly Glu Leu Lys Ile Ile Lys Thr Leu
340 345 350
Lys Asp Lys Ser Ile Pro Ile Lys Asp Val Gln Phe Lys Met Arg Arg
355 360 365
Val Asp Asn Thr Val Ile Lys Asp Gly Lys Lys Glu Leu Leu Leu Thr
370 375 380
Thr Asp Asp Lys Gly Ile Ala Asn Val Lys Gly Leu Pro Val Gly Lys
385 390 395 400
Tyr Glu Val Lys Glu Ile Ser Ala Pro Glu Trp Ile Ala Phe Asn Pro
405 410 415
Leu Ile Ala Pro Lys Leu Glu Phe Thr Ile Ser Asp Gln Asp Thr Glu
420 425 430
Gly Lys Leu Trp Ala Val Glu Asn Glu Leu Lys Thr Ile Ser Ile Pro
435 440 445
Val Glu Lys Val Trp Val Gly Gln Thr Ser Glu Arg Ala Glu Ile Lys
450 455 460
Leu Phe Ala Asp Gly Ile Glu Val Asp Lys Val Ile Leu Asn Ala Asp
465 470 475 480
Asn Asn Trp Lys His Thr Phe Glu Asn Lys Pro Glu Tyr Asn Ser Glu
485 490 495
Thr Lys Gln Lys Ile Asn Tyr Ser Val Ser Glu Thr Thr Ile Ser Gly
500 505 510
Tyr Glu Ser Asn Ile Thr Gly Asp Ala Lys Asn Gly Phe Ile Val Thr
515 520 525
Asn Thr Glu Leu Pro Asp Leu Thr Ile Gly Lys Glu Val Ile Gly Glu
530 535 540
Leu Gly Asp Lys Thr Lys Val Phe Asn Phe Glu Leu Thr Leu Lys Gln
545 550 555 560
Ala Asp Gly Lys Pro Ile Asn Gly Lys Phe Asn Tyr Ile Gly Ser Val
565 570 575
Asp Asp Arg Tyr Lys Lys Glu Ser Ile Lys Pro Ser Asp Gly Glu Ile
580 585 590
Thr Phe Ile Glu Gly Lys Ala Thr Ile Thr Leu Ser His Gly Gln Glu
595 600 605
Ile Thr Ile Lys Asp Leu Pro Tyr Gly Val Thr Tyr Lys Val Met Glu
610 615 620
Lys Glu Ala Asn Glu Asn Gly Tyr Leu Thr Thr Tyr Asn Gly Asn Asn
625 630 635 640
Glu Val Thr Thr Gly Glu Leu Lys Gln Asp Thr Lys Val Gln Val Val
645 650 655
Asn Asn Lys Glu Phe Val Pro Thr Thr Val Asp Lys Leu Ala Ala Ala
660 665 670
Leu Glu His His His His His His
675 680
<210> 14
<211> 349
<212> PRT
<213> Искусственная последовательность
<220>
<223> fimA экспрессированный His-меченный
<400> 14
Met Gly Ser Ser His His His His His His Ser Ser Gly Leu Val Pro
1 5 10 15
Arg Gly Ser His Met Ala Ser Met Thr Gly Gly Gln Gln Met Gly Arg
20 25 30
Gly Ser Glu Phe Ser Asn Leu Pro Ser Gly Gly Val Glu Gly Thr Glu
35 40 45
Gln Asn Pro Ala Lys Ala Thr Ile Thr Lys Asn Phe Glu Phe Pro Glu
50 55 60
Gly Ile Asn Thr Pro Ser Ala Thr Phe Lys Phe Thr Ala Glu Lys Ile
65 70 75 80
Thr Asn Asp Ala Pro Asp Ala Thr Ile Gly Asp Ile Asn Tyr Thr Gln
85 90 95
Gly Asp Asn Gly Thr Leu Ser Asn Gly Lys Tyr Ser Val Lys Lys Thr
100 105 110
Thr Glu Ile Thr Phe Gly Asn Phe Pro His Ala Gly Glu Tyr Asp Tyr
115 120 125
Asn Val Lys Glu Thr Asn Glu Gly Val Gly Gly Ile Thr Tyr Asp Thr
130 135 140
Lys Glu Tyr Lys Val His Val Tyr Val Ala Asn Ser Asn Ala Met Asp
145 150 155 160
Gly Lys Thr Tyr Val Lys Ala Ile Thr Ser Glu Asn Gly Gly Glu Lys
165 170 175
Ala Pro Ile Glu Phe Val Asn Thr Tyr Lys Lys Asp Thr Ser Leu Leu
180 185 190
Ile Glu Lys Asn Val Ile Gly Asp Leu Ala Asp Leu Thr Lys Gln Phe
195 200 205
Glu Phe Gln Ile Asn Leu Lys Lys Ser Ala Thr Ser Asp Ile Thr Lys
210 215 220
Phe Glu Gly Asn Ile Ile Arg Lys Asp Gly Lys Ile Glu Pro Val Thr
225 230 235 240
Tyr Thr Ala Glu Asn Thr Glu Thr Phe Lys Leu Ala Asn Gly Asp Lys
245 250 255
Leu Lys Phe Glu Ser Ile Pro Ala Gly Thr Lys Tyr Glu Val Lys Glu
260 265 270
Ile Gly Ala Ser Asp Gly Tyr Thr Pro Ser Ile Thr Val Ile Glu Asn
275 280 285
Gly Asn Glu Thr Ser Asn Asn Arg Thr Val Ala Glu Lys Asp Gly Ile
290 295 300
Ser Ser Lys Ser Asn Ser Asn Asp Asn Leu Ile Gly Glu Gly Glu Asn
305 310 315 320
Lys Val Thr Phe Thr Asn Thr Tyr Asn Asp Lys Pro Ile Thr Val Asp
325 330 335
Lys Leu Ala Ala Ala Leu Glu His His His His His His
340 345
<210> 15
<211> 207
<212> PRT
<213> Искусственная последовательность
<220>
<223> fimB экспрессированный His-меченный
<400> 15
Met Gly Ser Ser His His His His His His Ser Ser Gly Leu Val Pro
1 5 10 15
Arg Gly Ser His Met Ala Ser Met Thr Gly Gly Gln Gln Met Gly Arg
20 25 30
Gly Ser Glu Phe Thr Glu Asn Thr Ala Asn Ile Pro Leu Ile Val Arg
35 40 45
Gln Glu Phe Asn Val Tyr Thr Lys Asp Ser Lys Ala Ile Asp Met Ile
50 55 60
Gly Lys Tyr Glu Leu Lys Ala Ile Ser Glu Asn Ala Pro Met Pro Glu
65 70 75 80
Glu Ser Lys Asn Gly Ser Phe Ile Phe Asn Ile Asp Gly Asn Asp Lys
85 90 95
Gln Phe Thr Ile Pro Leu Ala Tyr Thr His Gly Gly Val Tyr Ile Tyr
100 105 110
Gln Ile Gln Gln Ile Thr Gln Ser Lys Asp Asn Tyr Ile Tyr Asp Lys
115 120 125
Asn Ser Tyr Lys Ile Thr Val Tyr Val Lys Asn Ala Glu Asn Asn His
130 135 140
Leu Ile Pro Gln Ile Ile Val Lys Asn Glu Asn Asn Glu Lys Cys Glu
145 150 155 160
Glu Ile Cys Phe Tyr Asn Ile Tyr Lys Gln Lys Asn Lys Ile Asn Glu
165 170 175
Ile Ser Lys Thr Pro Tyr Lys Pro Asn Gly Ile Asn Val Pro Lys Thr
180 185 190
Val Asp Lys Leu Ala Ala Ala Leu Glu His His His His His His
195 200 205
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНЫЕ ВЕКТОРЫ, ЭКСПРЕССИРУЮЩИЕ АНТИГЕНЫ ВИРУСА ПТИЧЬЕГО ГРИППА, И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2761869C2 |
| ВАКЦИНА ПРОТИВ АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ | 2020 |
|
RU2819672C2 |
| КОНСТРУКЦИИ ДНК-АНТИТЕЛ ДЛЯ ПРИМЕНЕНИЯ ПРОТИВ БОЛЕЗНИ ЛАЙМА | 2017 |
|
RU2813829C2 |
| СКОНСТРУИРОВАННЫЙ БОТУЛИНИЧЕСКИЙ НЕЙРОТОКСИН | 2017 |
|
RU2789302C2 |
| ВЕКТОРЫ AAV, НАЦЕЛЕННЫЕ НА ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ | 2015 |
|
RU2727015C2 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2802222C2 |
| ОПТИМИЗИРОВАННЫЙ ПОЛИПЕПТИД ДЛЯ СУБЪЕДИНИЧНОЙ ВАКЦИНЫ ПРОТИВ РЕОВИРУСА ПТИЦ | 2017 |
|
RU2742250C2 |
| СКОНСТРУИРОВАННЫЙ БОТУЛИНИЧЕСКИЙ НЕЙРОТОКСИН | 2016 |
|
RU2746736C2 |
| КОМПОЗИЦИИ И СПОСОБЫ РЕДАКТИРОВАНИЯ ГЕНОВ | 2019 |
|
RU2804665C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИЗБИРАТЕЛЬНОЙ ЭКСПРЕССИИ БЕЛКА | 2017 |
|
RU2795467C2 |
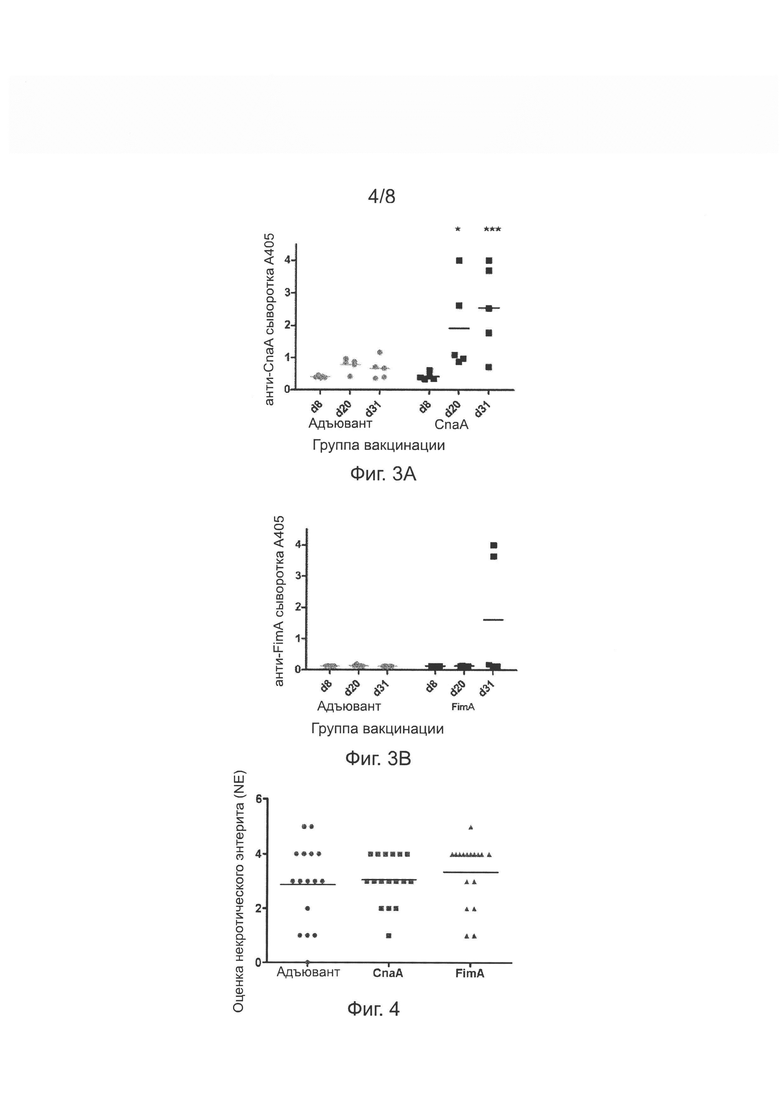
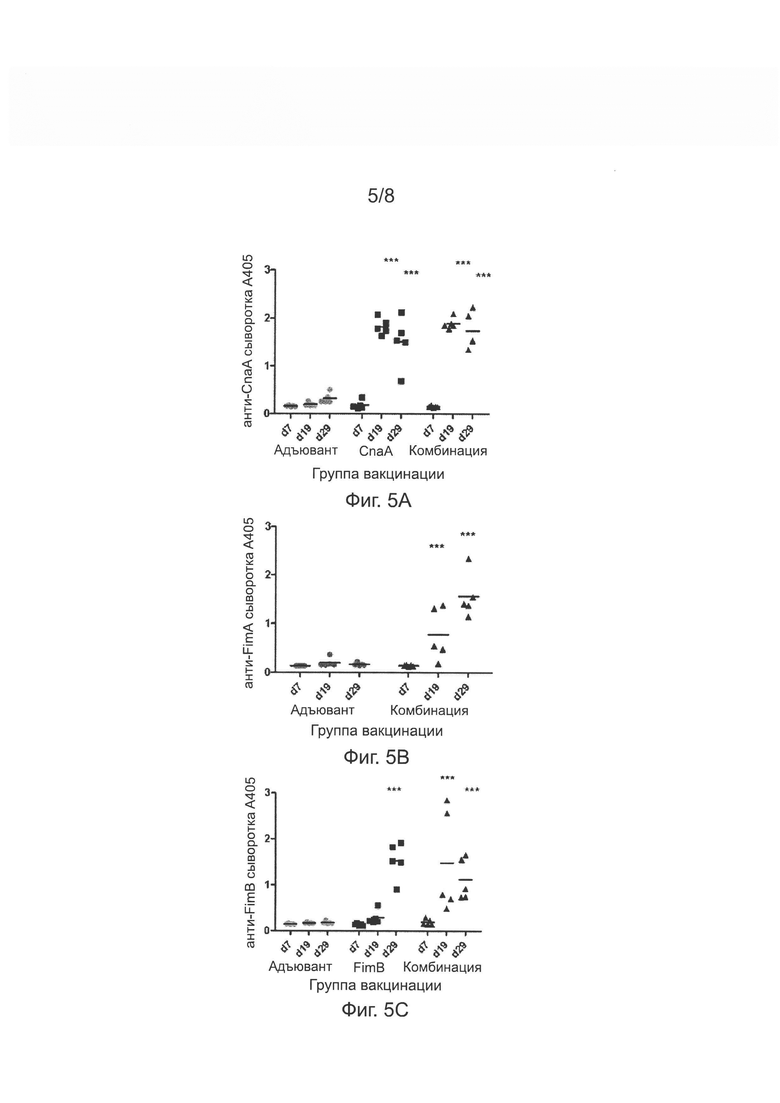
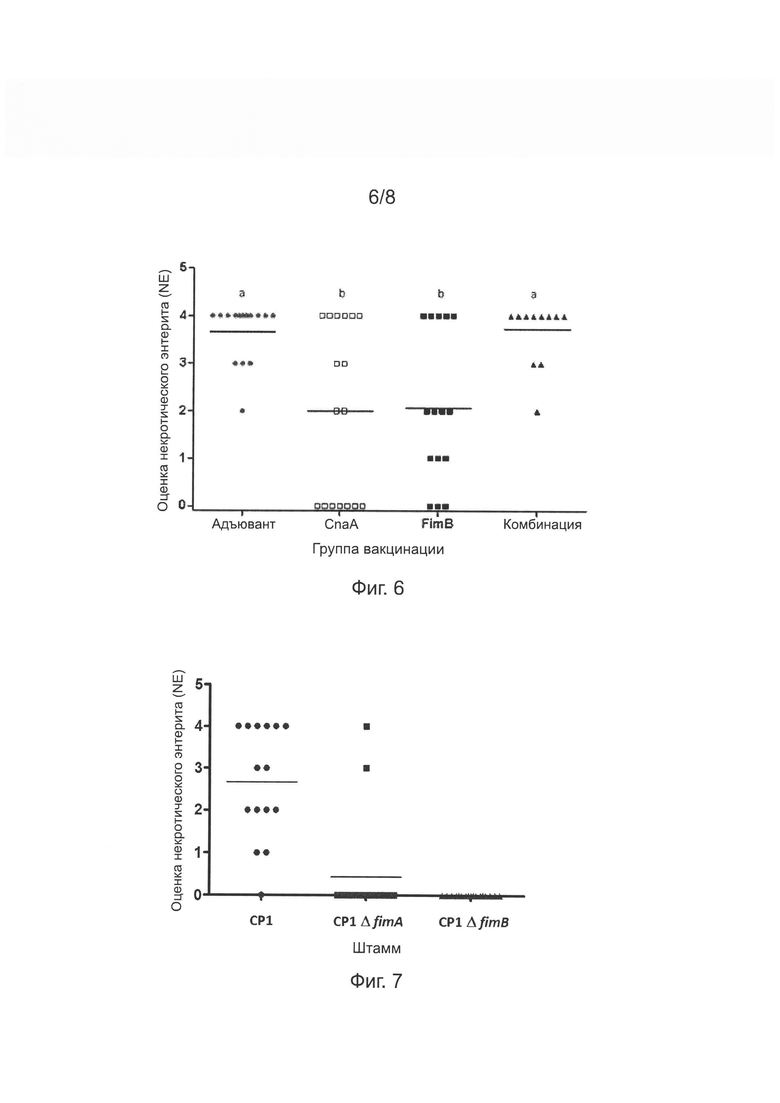
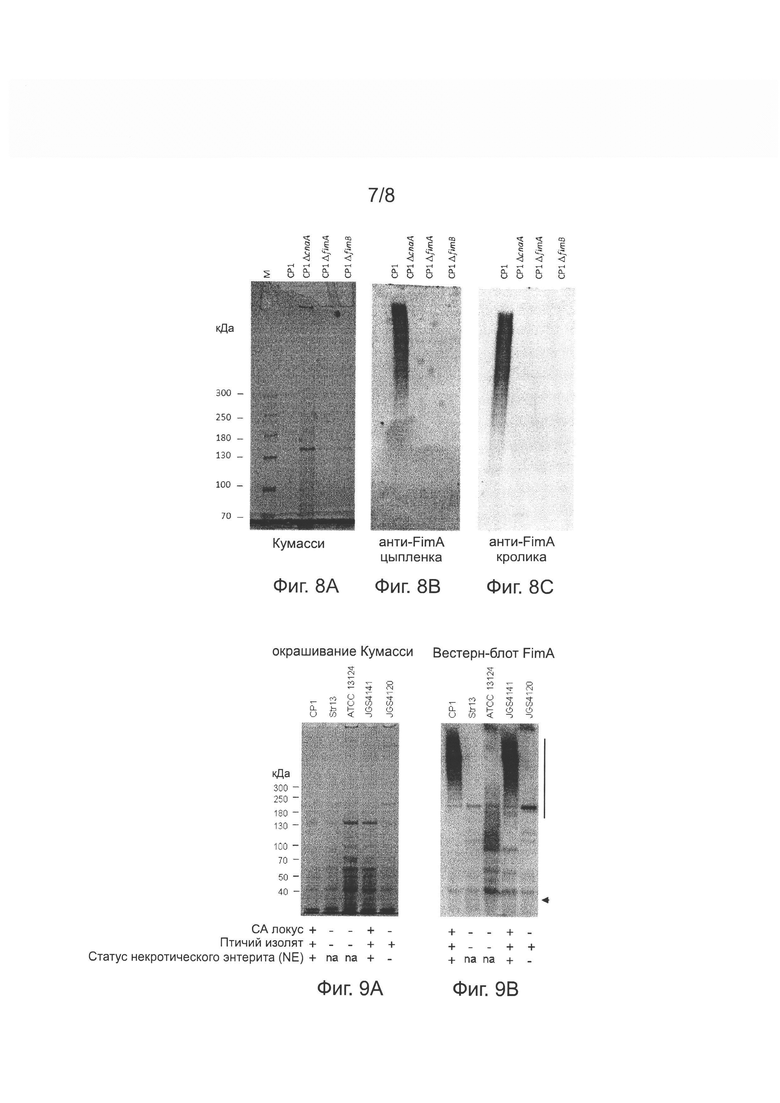
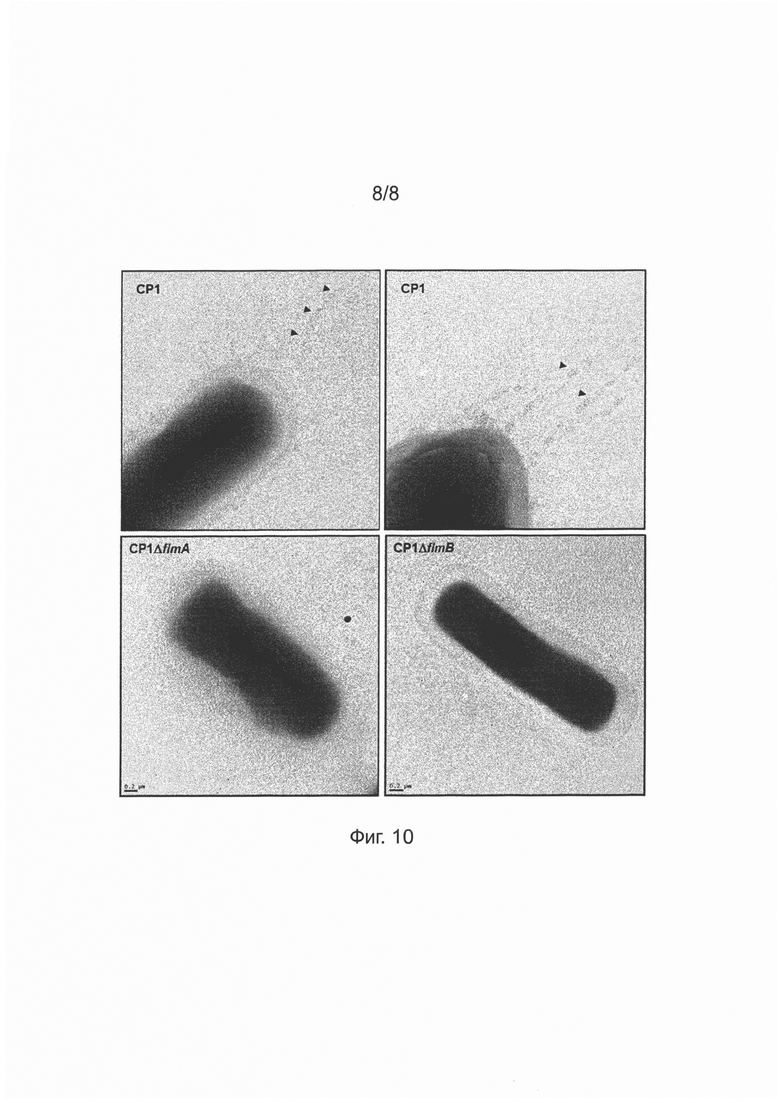
Изобретение относится к биотехнологии, ветеринарии. Представлены: выделенный полипептид пилуса Clostridium perfringens, иммуногенный полипептид, вакцина для лечения или предотвращения некротического энтерита у домашней птицы, применение иммуногенного полипептида, способ лечения или предотвращения некротического энтерита у домашней птицы. Заявленные полипептиды являются пригодными для изготовления вакцины для лечения или предотвращения энтерического некроза у домашней птицы. 10 н. и 4 з.п. ф-лы, 19 ил., 2 табл., 4 пр.
1. Выделенный полипептид пилуса Clostridium perfringens для применения при лечении или предотвращении некротического энтерита или инфекции Clostridium perfringens у домашней птицы, в котором полипептид пилуса является скомплектованным зависимым от сортазы пилусом или его элементом, в котором полипептид пилуса кодируется одним или несколькими генами в генетическом локусе VR-10B, и в котором:
полипептид пилуса является CnaA полипептидом, обладающим аминокислотной последовательностью, выбираемой из SEQ ID NO: 10 и SEQ ID NO: 13; или кодированным полинуклеотидом, обладающим аминокислотной последовательностью, выбираемой из SEQ ID NO: 1, SEQ ID NO: 4 и SEQ ID NO: 7; или
полипептид пилуса является FimA полипептидом, обладающим аминокислотной последовательностью, выбираемой из SEQ ID NO: 11 и SEQ ID NO: 14; или кодированным полинуклеотидом, обладающим аминокислотной последовательностью, выбираемой из SEQ ID NO: 2, SEQ ID NO: 5 и SEQ ID NO: 8; или
полипептид пилуса является FimB полипептидом, обладающим аминокислотной последовательностью, выбираемой из SEQ ID NO: 12 и SEQ ID NO: 15; или кодированным полинуклеотидом, обладающим аминокислотной последовательностью, выбираемой из SEQ ID NO: 3, SEQ ID NO: 6 и SEQ ID NO: 9; или
полипептид пилуса является скомплектованным пилусом, включающим один или несколько элементов, каждый из которых индивидуально выбран из CnaA полипептида, FimA полипептида и FimB полипептида.
2. Выделенный полипептид пилуса Clostridium perfringens для применения по п. 1, в котором полипептид пилуса является CnaA полипептидом.
3. Выделенный полипептид пилуса Clostridium perfringens для применения по п. 1, в котором полипептид пилуса является FimA полипептидом.
4. Выделенный полипептид пилуса Clostridium perfringens для применения по п. 1, в котором полипептид пилуса является FimB полипептидом.
5. Выделенный полипептид пилуса Clostridium perfringens для применения по п. 1, в котором полипептид пилуса является скомплектованным пилусом.
6. Иммуногенный полипептид для применения при лечении или предотвращении некротического энтерита или инфекции Clostridium perfringens у домашней птицы, выбранный из выделенного полипептида пилуса Clostridium perfringens по любому из пп. 1-5, варианта полипептида пилуса; фрагмента полипептида пилуса и фрагмента варианта, в котором полипептид пилуса, вариант, фрагмент полипептида и фрагмент варианта являются иммуногенными у домашней птицы, в котором вариант обладает по меньшей мере 95%, по меньшей мере 99% или по меньшей мере 99,9% идентичностью последовательности с CnaA полипептидом, FimA полипептидом или FimB полипептидом.
7. Вакцина для лечения или предотвращения некротического энтерита у домашней птицы, включающая эффективное количество по меньшей мере одного иммуногенного полипептида по п. 6.
8. Вакцина для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы, включающая эффективное количество по меньшей мере одного иммуногенного полипептида по п. 6.
9. Применение иммуногенного полипептида по п. 6 для изготовления медикамента для лечения или предотвращения некротического энтерита у домашней птицы.
10. Применение иммуногенного полипептида по п. 6 для изготовления медикамента для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы.
11. Способ лечения или предотвращения некротического энтерита у домашней птицы, включающий введение домашней птице эффективного количества иммуногенного полипептида по п. 6 или эффективного количества вакцины по п. 7.
12. Способ лечения или предотвращения инфекции Clostridium perfringens у домашней птицы, включающий введение домашней птице эффективного количества иммуногенного полипептида по п. 6 или эффективного количества вакцины по п. 8.
13. Применение иммуногенного полипептида по п. 6 в качестве вакцины для лечения или предотвращения некротического энтерита у домашней птицы.
14. Применение иммуногенного полипептида по п. 6 в качестве вакцины для лечения или предотвращения инфекции Clostridium perfringens у домашней птицы.
| "Putative collagen adhesion [Clostridium perfringens]", GenBank Protein Accession No | |||
| Прибор для отделения охлаждающей воды от пара | 1937 |
|
SU54440A1 |
| Прибор для отделения охлаждающей воды от пара | 1937 |
|
SU54440A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Способ искусственной инкубации яиц | 1930 |
|
SU25808A1 |
Авторы
Даты
2023-01-16—Публикация
2018-05-31—Подача