Изобретение относится к области медицины, а именно к методам медицинской диагностики, и может быть использовано для определения восстановленного глутатиона (вГлн), глутатиондисульфида (оГлн) в венозной крови.
Для определения глутатиона был разработан подход, основанный на высокоэффективной жидкостной хроматографии с флуоресцентным детектированием, сопровождающийся дериватизацией ортофталевым диальдегидом (Paroni R, De Vecchi Е, Cighetti G, Arcelloni С, Fermo I, Grossi A, Bonini P. HPLC with o-phthalaldehyde precolumn derivatization to measure total, oxidized, and protein-bound glutathione in blood, plasma, and tissue. Clin Chem. 1995 Mar; 41(3): 448-54.). Кровь собирали в пробирки с гепарином и буфером, содержащем N-этилмалеимид (для определения оГлн) или без него (для определения оГлн). Немедленно смесь гемолизировали 10-кратным объемом воды. Затем пробу подвергали восстановлению избытком дитиотреитола и осаждали белки трихлоруксусной кислотой. После центрифугирования супернатант вводили в хроматограф, оснащенный функцией автоматической предколоночной дериватизации, где он смешивался с раствором ортофталевого диальдегида. Разделение аналитов проводили на обращенной фазе в изократическом режиме.
Хотя этот подход является высокочувствительным (предел обнаружения 0,025 мкмоль/л) и довольно производительным методом (около 12 мин/анализ), он имеет ряд существенных недостатков. Во-первых, он требует неотложной пробоподготовки, что трудноосуществимо в условиях работы клинических лабораторий. Во-вторых, при его использовании возникают проблемы с разделением глутатиона, поскольку глутатион обладает высокой гидрофильностью и его производное плохо удерживается на обращенной фазе. В третьих, данный подход не позволяет одновременно определять вГлн и оГлн, т.е. один образец крови необходимо анализировать два раза. Наконец, высокая стоимость оборудования, его обслуживания и высокие требования к чистоте реактивов ограничивают применение высокоэффективной жидкостной хроматографии.
Наиболее близким является способ определения глутатиона в цельной крови, включающий забор венозной крови, проведение гемолиза, осаждение белков, капиллярный электрофорез со спектрофотометрическим детектированием пиков при длине волны 200 нм с обработкой результатов анализа, по результатам которого судят о концентрации восстановленной и окисленной форм глутатиона (Hempe JM, Ory-Ascani J. Simultaneous analysis of reduced glutathione and glutathione disulfide by capillary zone electrophoresis. Electrophoresis. 2014 Apr; 35(7): 967-71. doi: 10.1002/elps.201300450). В этом способе в качестве антикоагулянта используют трицитрат натрия, для гемолиза и осаждения белков используют метафосфорную кислоту с последующим многократным разбавлением пробы. При проведении капиллярного электрофореза используется фоновый электролит с щелочным рН (75 ммоль/л борная кислота, 25 ммоль/л бис-Трис рН 7,8) и не используется внутренний стандарт.
Недостатками этого способа являются:
- использование антикоагулянта трицитрата натрия, при котором наблюдается снижение редокс-статуса глутатиона крови при ее хранении;
- возможность быстрого гидролиза аналитов на стадии гемолиза и окисления вГлн при долговременном хранении обработанных образцов т.к. не проводится его химическая стабилизация, - необходимость многократного разведения образца перед анализом, что снижает чувствительность;
- возможность окисления вГлн в процессе электрофореза вследствие щелочного рН фонового электролита;
- отсутствие внутреннего стандарта.
Задачей предлагаемого изобретения является разработка электрофоретического способа обеспечивающего повышение правильности, достоверности, воспроизводимости результатов определения вГлн и оГлн венозной крови, за счет введения внутреннего стандарта, химической стабилизации глутатиона, повышения чувствительности определения аналитов, экстракционного извлечения аналитов и их концентрирования в капилляре.
Поставленная задача достигается тем, что способ предусматривает забор венозной крови, проведение гемолиза, осаждение белков, капиллярный электрофорез со спектрофотометрическим детектированием пиков при длине волны 200 нм с обработкой результатов анализа, по результатам которого судят о концентрации восстановленной и окисленной форм глутатиона. Новым является то, что при проведении гемолиза в пробу венозной крови добавляют воду, ацетонитрил с N-этилмалеимидом в концентрации 10-30 ммоль/л, и этанол в соотношении 2:1:3:3 соответственно, перемешивают, центрифугируют. После этого добавляют глициласпарагина в воде в концентрации 1 ммоль/л и диэтиловый эфир в количестве 0,2 и 1,08 объема супернатанта соответственно. Осуществляют центрифугирование, затем к выделенному осадочному остатку добавляют воду в объеме 75% от объема пробы венозной крови. При этом при проведении капиллярного электрофореза сначала в капилляр с внутренним диаметром 50 мкм полной длинной 39,5-42,5 см последовательно вводят по 5% от объема капилляра раствор лимонной кислоты в концентрации 75 ммоль/л, подготовленную пробу, а после этого вводят трицитрат натрия в концентрации 75 ммоль/л, при этом электрофорез проводят с напряжением - 12-14 кВ. В качестве фонового электролита используют 75 ммоль/л цитрат натрия с рН 5,8, содержащий 200 мкмоль/л цетилтриметиламмония бромида и 5 мкмоль/л додецилсульфата натрия.
Данный способ имеет ряд существенных преимуществ перед прототипом. Так как гемолиз и осаждение белков проводятся одновременно смешиванием крови в смеси с ацетонитрилом и этанолом, а не с кислотой, которая в дальнейшем мешает анализу, то не возникает необходимости в дальнейшем многократно разбавлять пробу теряя тем самым в чувствительности. Дериватизация вГлн N-этилмалеимидом предотвращает его окисление в крови, тем самым предотвращая его переход в оГлн. Жидкофазная экстракция позволяет дополнительно очистить пробу и избежать ее многократного разбавления. Комплексный ввод пробы в капилляр (кислота/проба/соль кислоты) обеспечивает концентрирование аналитов под действием электрического поля в градиенте рН, что позволяет существенно повысить чувствительность определения. Так, данный способ позволил достичь предела количественного определения на уровне 1,5 мкмоль/л. Использование глициласпарагина в качестве внутреннего стандарта позволило повысить правильность и воспроизводимость анализа. Данный способ показал правильность на уровне 103-104% и воспроизводимость 2,6% для вГлн и 3,2% для оГлн на уровне их физиологических концентраций.
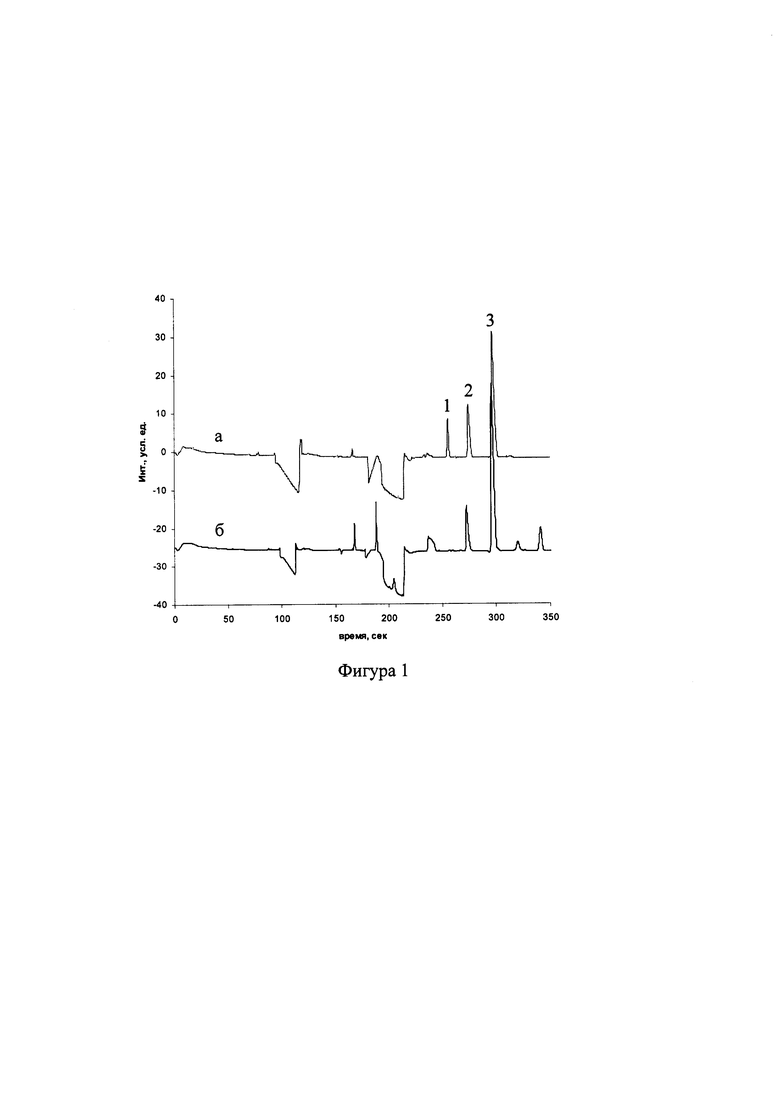
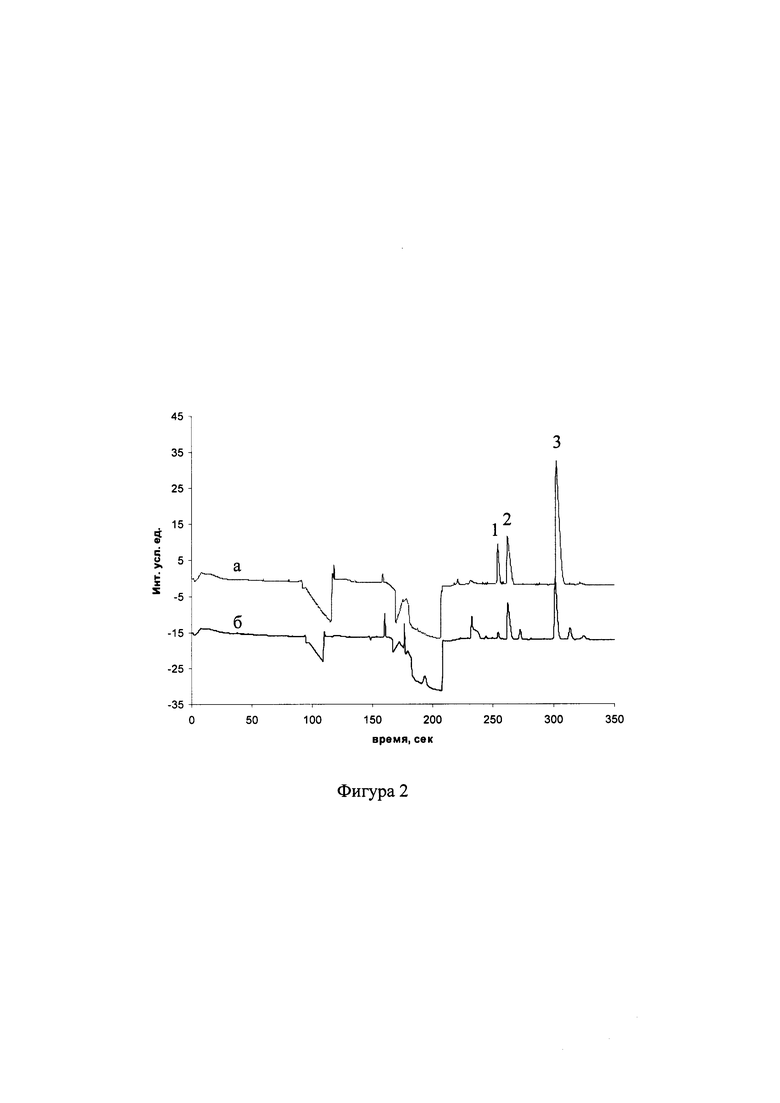
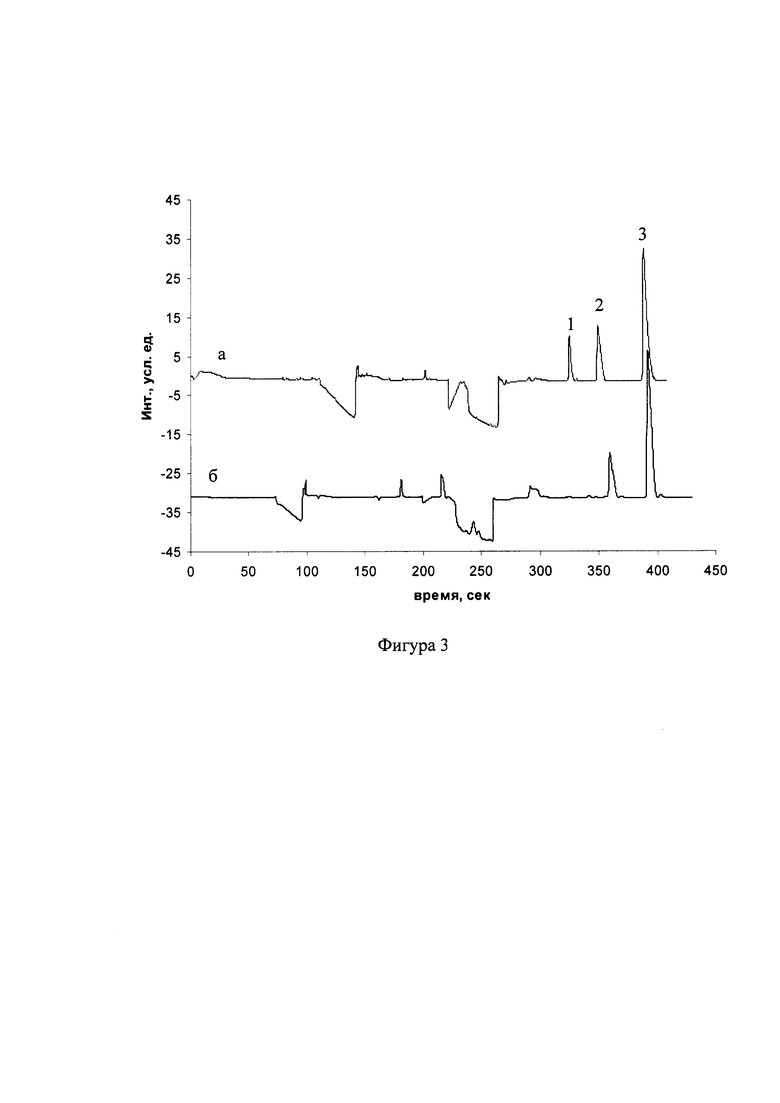
На фиг. 1, 2, 3 представлены электрофореграммы образцов крови к примерам 1,2,3 соответственно.
Осуществление способа показано на конкретных клинических примерах.
Пример 1.
Больной А., здоровый доброволец 25 лет.
Для определения окисленного и восстановленного глутатиона, его редокс-статуса, в качестве контроля, были проведены исследования по предлагаемому способу.
Венозную кровь собрали в вакуумную пробирку K3EDTA объемом 3 мл и для подавления окисления пробы по известной методике (Williams RH, Maggiore JA, Reynolds RD, Helgason CM. Novel approach for the determination of the redox status of homocysteine and other aminothiols in plasma from healthy subjects and patients with ischemic stroke. Clin Chem. 2001 Jun; 47(6): 1031-9.) добавили 350 мкл цитрата натрия в концентрации 500 ммоль/л с рН 4.3.
При проведении гемолиза в 1,5 мл пробирке в пробу крови объемом 200 мкл добавили воду 100 мкл, ацетонитрил с 30 ммоль/л N-этилмалеимидом 300 мкл, и этанол 300 мкл.
Пробу перемешивали 1 мин, центрифугировали при 15000 g 5 мин при комнатной температуре для осаждения белков, затем переносили 250 мкл супернатанта в пробирку 0,6 мл. К супернатанту добавили 50 мкл 1 ммоль/л глициласпарагина и 270 мкл диэтилового эфира, смесь перемешивали 1 мин и центрифугировали при 3000 g 2 мин при комнатной температуре.
Отбросив верхнюю фазу, нижнюю испаряли под вакуумом 25 мин при 45°С с использованием эксикатора, а после выделенный осадочный остаток перерастворяли в 150 мкл воды.
Далее полученный образец переносили в пробоотборник прибора капиллярного электрофореза ("Капель-205", Люмэкс, Россия). При проведении капиллярного электрофореза сначала в кварцевый капилляр с внутренним диаметром 50 мкм и полной/эффективной длинной 39,5/33 см вводили раствор 75 ммоль/л лимонной кислоты, затем полученный образец и раствор 75 ммоль/л трицитрата натрия. Объем ввода каждого из компонентов составлял 1000 мбар сек.
Температура капилляра поддерживалась на уровне 25°С (как правило), фотометрическое детектирование проводили при 200 нм.
Разделение аналитов проводили в режиме обращенного поля с напряжением - 14 кВ в течение 5,5 мин.
В качестве фонового электролита использовали буфер: 75 ммоль/л цитрата натрия с рН 5,8, содержащий 200 мкмоль/л цетилтриметиламмония бромида и 5 мкмоль/л додецилсульфата натрия.
Расчет концентрации аналитов производили в соответствии с документацией, прилагаемой к программному обеспечению "Эльфоран" по отношению площади пиков аналит/стандарт с использованием линейного градуировочного уравнения, получаемого анализом модельных смесей аналитов с глициласпарагином (Программное обеспечение «Эльфоран» для систем капиллярного электрофореза «Капель-205». Руководство пользователя. Санкт-Петербург, 2019, 107 с). Расчет редокс-статуса (RS) глутатиона производили по формуле:

На фиг. 1 представлены электрофореграммы (при проведении капиллярного электрофореза со спектрофотометрическим детектированием пиков) модельной смеси ("а"), содержащей 0,5 ммоль/л вГлн, 0,125 ммоль/л оГлн и 1 ммоль/л глициласпарагина и образца венозной крови добровольца ("б"), по которой определены концентрации вГлн=836 мкмоль/л, оГлн=3,1 мкмоль/л, редокс-статус глутатиона составил 534. Цифрами обозначены пики оГлн (1), глициласпарагина (2) и вГлн (3).
Пример. 2
Больной К., 67 лет, поступил с диагнозом Новая коронавирусная инфекция. ДН1.
Был произведен анализ венозной крови для определения оГлн и вГлн, редокс-статуса аналогично примеру 1. Однако для гемолиза при этом использовали ацетонитрил, содержащий 10 ммоль/л N-этилмалеимида. На фиг. 2 представлены электрофореграммы (при проведении капиллярного электрофореза со спектрофотометрическим детектированием пиков) модельной смеси ("а"), содержащей 0,5 ммоль/л вГлн, 0,125 ммоль/л оГлн и 1 ммоль/л глициласпарагина и образца венозной крови пациента ("б"), по которой определены концентрации вГлн=299 мкмоль/л, оГлн=31 мкмоль/л, Редокс-статус глутатиона составил 19,2. Цифрами обозначены пики оГлн (1), глициласпарагина (2) и вГлн (3).
Пример. 3
Больной С., 55 лет, поступил с диагнозом ИБС. Стенокардия напряжения 2ФК.
Был произведен анализ венозной крови для определения оГлн и вГлн, редокс-статуса аналогично примеру 1. При этом объем ввода в капилляр раствора 75 ммоль/л лимонной кислоты, образца и раствора 75 ммоль/л трицитрата натрия составлял 1100 мбар-сек, а капиллярный электрофорез проводили в капилляре с полной/эффективной длинной 42,5/36 см при напряжении -12 кВ в течение 7 мин. На фиг. 3 представлены электрофореграммы (при проведении капиллярного электрофореза со спектрофотометрическим детектированием пиков) модельной смеси ("а"), содержащей 0,5 ммоль/л вГлн, 0,125 ммоль/л оГлн и 1 ммоль/л глициласпарагина и образца венозной крови пациента ("б"), по которой определены концентрации вГлн=742 мкмоль/л, оГлн=3,5 мкмоль/л, редокс-статус глутатиона составил 426. Цифрами обозначены пики оГлн (1), глициласпарагина (2) и вГлн (3).
Пример. 4
Больной С., 55 лет, поступил с диагнозом ИБС. Стенокардия напряжения 2ФК. Состояние после хирургической реваскуляризации миокарда.
Был произведен анализ венозной крови для определения оГлн и вГлн, редокс-статуса аналогично примеру 3, после операции на 4 день.
Получены значения вГлн=747 мкмоль/л и оГлн=2,6 мкмоль/л, редокс-статус - 608.
По данной методике было исследовано 75 пациентов с новой коронавирусной инфекцией, 35 пациентов с сердечно-сосудистой патологией, группа контроля составила 24 добровольца. Было показано нарушение гомеостаза глутатиона в форме снижения его редокс статуса у пациентов с ИБС и новой коронавирусной инфекцией, по сравнению с группой добровольцев.
Данный способ может быть использован в диагностике и мониторинге тяжести течения новой коронавирусной инфекции, а также при наблюдении за восстановлением организма после проведения операционных вмешательств на сердце или для диагностики риска постоперационных осложнений.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ | 2007 |
|
RU2341306C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ОБЪЕКТА ПУТЕМ ПОСТРОЕНИЯ ЕГО ХАРАКТЕРИСТИЧЕСКОГО ЭЛЕКТРОФОРЕТИЧЕСКОГО ПРОФИЛЯ | 2006 |
|
RU2327978C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ МИКРОЦИРКУЛЯЦИИ ПОРАЖЕННЫХ ТКАНЕЙ | 2008 |
|
RU2397788C2 |
| СПОСОБ СОВМЕСТНОГО ОПРЕДЕЛЕНИЯ ИОНОВ Cu(II), Pb(II), Fe(III) И Bi(III) МЕТОДОМ КАПИЛЛЯРНОГО ЗОННОГО ЭЛЕКТРОФОРЕЗА | 2012 |
|
RU2535009C2 |
| Способ определения родственных примесей в 4,4'-(пропандиамидо)дибензоате натрия с методом капиллярного электрофореза | 2020 |
|
RU2721908C1 |
| СПОСОБ ДИАГНОСТИКИ МОЧЕКАМЕННОЙ БОЛЕЗНИ | 2011 |
|
RU2484468C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ДИАЛИЗНОЙ ТЕРАПИИ ПРИ ДЕТОКСИКАЦИИ | 2014 |
|
RU2569755C1 |
| Способ диагностики мочекаменной болезни | 2017 |
|
RU2666948C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ ПРИ ПРОВЕДЕНИИ ЭКСТРАКОРПОРАЛЬНОЙ ТЕРАПИИ | 2008 |
|
RU2377566C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГОМОЦИСТЕИНА В ПРОБЕ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1993 |
|
RU2121001C1 |
Изобретение относится к области медицины. Раскрыт способ определения глутатиона в цельной крови, включающий забор венозной крови, проведение гемолиза, осаждение белков, капиллярный электрофорез со спектрофотометрическим детектированием пиков при длине волны 200 нм с обработкой результатов анализа, по результатам которого судят о концентрации восстановленной и окисленной форм глутатиона, при этом при проведении гемолиза в пробу венозной крови добавляют воду, ацетонитрил с N-этилмалеимидом в концентрации 10-30 ммоль/л и этанол в соотношении 2:1:3:3 соответственно, перемешивают, центрифугируют, а после этого добавляют глициласпарагин в воде в концентрации 1 ммоль/л и диэтиловый эфир в количестве 0,2 и 1,08 объема супернатанта соответственно, осуществляют центрифугирование, затем к выделенному осадочному остатку добавляют воду в объеме 75% от объема пробы венозной крови, при этом при проведении капиллярного электрофореза сначала в капилляр с внутренним диаметром 50 мкм полной длиной 39,5-42,5 см последовательно вводят по 5% от объема капилляра раствор лимонной кислоты в концентрации 75 ммоль/л, подготовленную пробу, а после этого вводят трицитрат натрия в концентрации 75 ммоль/л, при этом электрофорез проводят с напряжением - 12-14 кВ, в качестве фонового электролита используют 75 ммоль/л цитрата натрия с рН 5,8, содержащего 200 мкмоль/л цетилтриметиламмония бромида и 5 мкмоль/л додецилсульфата натрия. Изобретение обеспечивает повышение правильности, достоверности и воспроизводимости результатов анализа. 3 ил., 4 пр.
Способ определения глутатиона в цельной крови, включающий забор венозной крови, проведение гемолиза, осаждение белков, капиллярный электрофорез со спектрофотометрическим детектированием пиков при длине волны 200 нм с обработкой результатов анализа, по результатам которого судят о концентрации восстановленной и окисленной форм глутатиона, отличающийся тем, что при проведении гемолиза в пробу венозной крови добавляют воду, ацетонитрил с N-этилмалеимидом в концентрации 10-30 ммоль/л и этанол в соотношении 2:1:3:3 соответственно, перемешивают, центрифугируют, а после этого добавляют глициласпарагин в воде в концентрации 1 ммоль/л и диэтиловый эфир в количестве 0,2 и 1,08 объема супернатанта соответственно, осуществляют центрифугирование, затем к выделенному осадочному остатку добавляют воду в объеме 75% от объема пробы венозной крови, при этом при проведении капиллярного электрофореза сначала в капилляр с внутренним диаметром 50 мкм полной длиной 39,5-42,5 см последовательно вводят по 5% от объема капилляра раствор лимонной кислоты в концентрации 75 ммоль/л, подготовленную пробу, а после этого вводят трицитрат натрия в концентрации 75 ммоль/л, при этом электрофорез проводят с напряжением - 12-14 кВ, в качестве фонового электролита используют 75 ммоль/л цитрата натрия с рН 5,8, содержащего 200 мкмоль/л цетилтриметиламмония бромида и 5 мкмоль/л додецилсульфата натрия.
| HEMPE J.M | |||
| et al | |||
| Simultaneous analysis of reduced glutathione and glutathione disulfide by capillary zone electrophoresis // Electrophoresis, 2014, V.35, pp.967-971 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЛУТАТИОНА В ЭРИТРОЦИТАХ ПЕРИФЕРИЧЕСКОЙ КРОВИ | 2013 |
|
RU2526832C1 |
| CN 105241942 B, 02.01.2018 | |||
| KOWALSKA K | |||
| et al | |||
| The Application of Capillary Electrophoresis in the Determination of Glutathione in Healthy Women’s Blood | |||
Авторы
Даты
2023-07-13—Публикация
2022-12-23—Подача