Изобретение относится к области медицины, а именно к методам медицинской диагностики, и может быть использовано в лабораторно-диагностической практике для определения глутатиона в эритроцитах периферической крови как в норме, так и при патологических состояниях организма, в том числе анемии.
Известно, что глутатион - серосодержащий трипептид (L-гамма-глутамил-L-цистеинилглицин), биосинтез и катаболизм которого описывается глутамильным циклом. Глутатион имеет универсальное распространение в тканях организма, но больше всего его в центральной нервной системе, печени, почках и эритроцитах периферической крови. Он присутствует как в восстановленной, так и в окисленной форме и представляет собой основной клеточный фонд мобильных сульфгидрильных групп, так как окисленная его форма (глутатиондисульфид) составляет всего 1-3% общего его количества (1, 10). Функции глутатиона весьма разнообразны: восстановление и изомеризация дисульфидных связей, влияние на активность ферментов и других белков, поддержание мембранных функций, коферментные функции, участие в обмене эйкозаноидов, резервирование цистеина, влияние на биосинтез нуклеиновых кислот и белков, сохранение нативных свойств гемоглобина (4, 5, 6, 7, 8), но ключевая его роль определяется защитой клетки от оксидативного стресса (3, 5, 6). Следует отметить, что регуляция восстановления глутатиона и, следовательно, его рециклирования в тканевых и клеточных структурах обеспечиваются глутатионпероксидазой, глутатионтрансферазой, глутатионредуктазой и НАДФН. Восстановление с помощью глутатионпероксидазы и глутатионтрансферазы гидропероксидов предупреждает прогрессирование пероксидации и появление ее вторичных метаболитов. В обезвреживании вторичных продуктов пероксидации и других окисленных веществ главную роль играют глутатионтрансферазы. Они конъюгируют с глутатионом, инактивируя токсичные продукты перекисного окисления липидов.
Следовательно, глутатионовая антипероксидазная система защищает клетки, в том числе и эритроциты, от оксидативного стресса, и обычно только при ее недостаточности или истощении возникают серьезные мембранные повреждения. Разумеется, с точки зрения опасности развития целого ряда патологий, объединяемых в группу свободнорадикальных патологий, в том числе анемий, необходима своевременная диагностика формирующейся несостоятельности системы глутатиона.
Выявление недостаточности пула глутатиона в эритроцитах периферической крови имеет решающее значение для профилактики анемий. Однако реальные возможности оценки данного состояния ограничены отсутствием адекватных способов диагностики. Известные способы определения содержания глутатиона в эритроцитах основаны на анализе данных биохимических показателей в гидролизате клеток и тканевых структур (2). Однако все известные способы могут выявить только уже сформированные изменения в системе глутатиона, являющиеся критерием патологического состояния организма. Это приводит к тому, что скрытая несостоятельность антиокислительной системы переходит в клиническую форму, сопровождается угрозой развития анемии и может вызвать различного рода осложнения, требующие адекватной терапии.
В настоящее время из методов количественного определения глутатиона в различных биологических объектах используются спектрофотометрические и гистохимические методы исследования.
Спектрофотометрический метод количественного определения глутатиона основан на способности реактива Элмана или 5,5-дитиобис(2-нитробензойной) кислоты (ДТНБ) образовывать окрашенное соединение SH-группами глутатиона. Образующийся 5-тио-2-нитробензойный анион имеет интенсивную окраску желтого цвета, спектр поглощения которого определяют при λ=412 нм (11).
Недостатком известного способа является то, что данный метод обладает достаточно низкой чувствительностью и требует наличия дорогостоящего оборудования и реактивов для пробоподготовки.
Перспективно для диагностических целей использовать гистохимический метод выявления в нативных эритроцитах продуктов реакции на глутатион.
Прототипом является гистохимическое определение глутатиона в биологических объектах (9).
Сущность методики состоит в обработке замороженных тканевых срезов, предварительно фиксированных в 20% уксусной кислоте, в течение 3-4 минут свежим раствором нитропруссида натрия с последующей обработкой быстро высушенных срезов парами аммиака и крепкой заморозкой льдом или твердым углекислым газом. Срезы исследуют в замороженном виде на предметном стекле при температуре 50°С.
Недостатками метода являются:
- он требует специального оборудования и условий для изучения препаратов;
- нестабильность окраски продуктов реакции;
- не применим для определения глутатиона в эритроцитах из-за использования 20% уксусной кислоты, так как она выступает в роли гемолитика.
Новая техническая задача - разработка гистохимического способа количественного и качественного определения глутатиона в нативных эритроцитах.
В основе предлагаемого способа лежит повышение точности функциональной и количественной оценки продуктов реакции на глутатион в нативных эритроцитах.
Поставленная задача достигается тем, что взвесь эритроцитов, после взятия крови из вены в стандартную пробирку с коагулянтом, помещают в раствор, состоящий из 10% нитропрусида натрия с добавлением 2% аммиака в объемном соотношении 1:1, инкубируют 10 минут при комнатной температуре. После окрашивания делают монослойный мазок на центрифуге «Stat Spin 2» (США). Приготовленный мазок фиксируют в 96° этиловом спирте, проводят через спирт-ксилол - ксилол - бальзам и заключают под покровное стекло. Продукт реакции фиолетового цвета, визуализируется в виде гранул, стабилен. Функциональное состояние и количество глутатиона определяют методом компьютерной цитофотометрии, производя расчет относительной плотности продуктов реакции в условных единицах (усл. ед.), приходящихся на 1 эритроцит, с учетом числа окрашенных гранул.
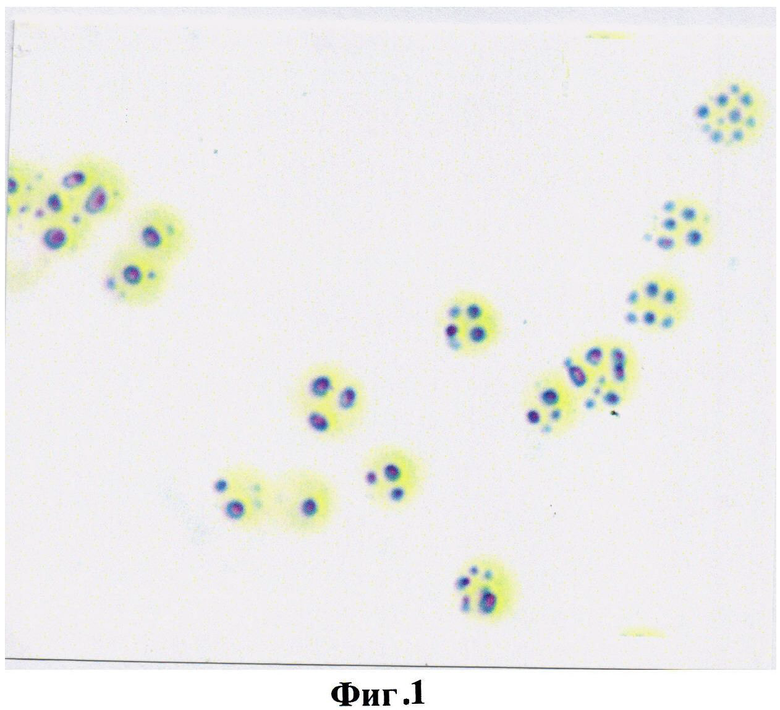
В норме в эритроцитах периферической крови практически здоровых людей на 100 эритроцитов выявлялось от 5 до 7 окрашенных гранул продукта реакции на глутатион, что в условных единицах оптической плотности составило 57,8±2,36 и свидетельствовало о высокой функциональной антиокислительной активности тиола (фиг.1).
Таким образом, заявляемый способ по сравнению с другими методами позволяет получить дополнительную информацию о функциональном состоянии и количестве глутатиона в нативных эритроцитах, что позволяет на ранних стадиях клинических проявлений заболеваний, сопряженных с развитием свободнорадикальных патологий, прогнозировать нарушения структуры клеток и развитие анемии.
Практическая значимость способа определяется возможностями формирования групп риска и определения показаний к проведению ранней профилактики анемических состояний.
Возможность достижения цели изобретения доказывается следующими примерами.
Пример 1. Б., 25 лет, поступила в акушерское отделение патологии беременных при ФГБУ «ДНЦ ФПД» СО РАМП на сроке гестации 10 недель.
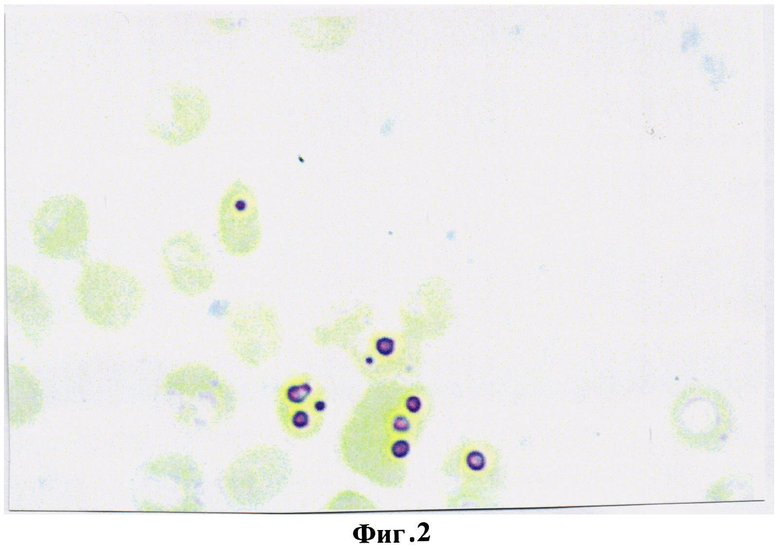
По результатам первичного обследования уровень гемоглобина в крови составил 110 г/л. При исследовании эритроцитов периферической крови на выявление глутатиона предложенным гистохимическим способом определено, что количество продуктов реакции на 1 эритроцит уменьшалось до 2-3 гранул и составило 23,5±1,45 усл. ед. (фиг.2). Диагностировано функционально нестабильное состояние эритроцитов, снижение их антиокислительной активности и сделан прогноз развития анемии легкой степени тяжести, который подтвердился при проведении дополнительных клинических исследований и определялся в снижении общего числа эритроцитов до 3,6·1012, количества дискоцитов до 83% и повышении доли эхиноцитов и дегенеративных форм, соответственно, до 13% и 4%.
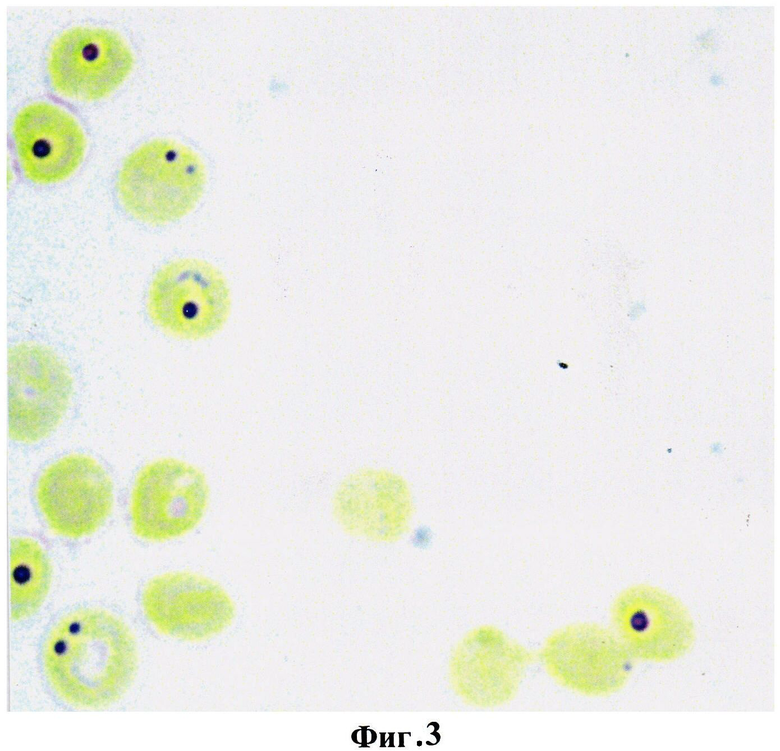
Пример 2. В., 27 лет, поступила в акушерское отделение патологии беременных при ФГБУ «ДНЦ ФПД» СО РАМН на сроке 11 недель. По результатам первичного обследования уровень гемоглобина в крови составил 100 г/л. При исследовании эритроцитов периферической крови на выявление глутатиона предложенным гистохимическим способом определено, что количество продуктов реакции на 1 эритроцит уменьшалось до 1-2 гранул и составило 17,8±1,16 усл. ед. Диагностировано функционально нестабильное состояние эритроцитов, значительное снижение их антиокислительной активности и сделан прогноз развития анемии средней степени тяжести, который подтвердился при проведении дополнительных клинических исследований и определялся в снижении количества общего числа эритроцитов до 3,4·1012 и дискоцитов до 74% и повышении доли эхиноцитов и дегенеративных форм, соответственно, до 16% и 10%.
Приведенные примеры показывают, что только при проведении гистохимической реакции на определение глутатиона можно адекватно оценить функциональное состояние отдельно взятого эритроцита, его антиокислительную функцию как в норме, так и при анемических состояниях.
Предложенный способ определения глутатиона отличается простотой, не требует больших трудозатрат, значительного количества реактивов и отличается высокой экспрессностью и чувствительностью и может широко применяться при проведении научно-исследовательских работ и в лабораторно-диагностической практике для получения достоверных результатов при идентификации биохимических механизмов формирования патологических состояний, в том числе анемии.
На фигуре 1 изображена реакция на глутатион в эритроцитах практически здоровых людей. Количество продуктов реакции на глутатион на 1 эритроцит 5-7 гранул, что в условных единицах оптической плотности составило 57,8±2,36.
На фигуре 2 изображена реакция на глутатион в эритроцитах беременной с легкой степенью тяжести анемии. Количество продуктов реакции на глутатион в 1 эритроците 2-3 гранулы, что в условных единицах оптической плотности составило 23,5±1,45.
На фигуре 3 изображена реакция на глутатион в эритроцитах беременной со средней степенью тяжести анемии. Количество продуктов реакции на глутатион на 1 эритроцит 1-2 гранулы, что в условных единицах оптической плотности не превышало 17,8±1,16.
Литература
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М. 1998. 750 с.
2. Верлан Н.В. Система глутатиона при лечении мексидолом у больных хронической церебральной ишемией // Бюллетень ВСНЦ СО РАМН. 2005. №5 (43). С.186-188.
3. Владимиров Ю.А. Активные формы кислорода и азота: значение для диагностики, профилактики и терапии // Биохимия. 2004. Т.69. Вып.1. С.53-66.
4. Глушков С.И. Нарушение системы глутатиона и их роль в патогенезе острых интоксикаций ксенобиотиками с различными механизмами токсического действия. Дисс.… док. мед. наук. СПб. 2006.
5. Кулинский В.И., Колесниченко Л.С. Биологическая роль глутатиона // Успехи совр. биологии. 1990. T.110. Вып.1(4). С.157-179.
6. Кулинский В.И. Биохимические аспекты воспаления // Биохимия. 2007. Т.72. №7. С.733-746.
7. Кулинский В.И., Колесниченко Л.С. Глутатион митохондрий // Биохимия. Т.72. №7. С.856-859.
8. Мазо В.К. Глутатион как компонент антиоксидантной системы желудочно-кишечного тракта // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1998. №1. С.47-53.
9. Роскин Г.И. Гистохимия. М.: Советская наука. 1954. 447 с.
10. Уайт А., Хендлер Ф., Смит Э., Хилл Р., Леман И. Основы биохимии. В 3-х томах. М. 1981. 1878 с.
11. Ellman G.L. Tissue sulfhydryl groups // Arch. Biochem. Biophys. 1959. Vol.82. P. 70-81.
Изобретение относится к области медицины, а именно к методам медицинской диагностики, и может быть использовано в лабораторно-диагностической практике для определения глутатиона в эритроцитах периферической крови как в норме, так и при патологических состояниях организма, в том числе анемии. Проводят функциональную и количественную оценку продуктов реакции на глутатион в нативных эритроцитах путем обработки взвеси эритроцитов раствором 10% нитропрусида натрия с добавлением 2% аммиака в объемном соотношении 1:1 в течение 10 минут при комнатной температуре с последующей фиксацией мазка в 96° спирте - спирт-ксилоле - ксилоле - бальзаме, заключенным под покровное стекло, и выявления продуктов реакции на глутатион методом компьютерной цитофотометрии по относительной плотности продуктов реакции в условных единицах, приходящихся на 1 эритроцит, с учетом числа окрашенных гранул. Способ обеспечивает повышение точности оценки функциональной активности и количества глутатиона в нативных эритроцитах для решения диагностических и научно-исследовательских задач. 3 ил., 2 пр.
Способ определения глутатиона в эритроцитах периферической крови, включающий оценку функционального состояния и активности продуктов реакции на глутатион в нативных эритроцитах путем обработки взвеси эритроцитов раствором 10% нитропрусида натрия с добавлением 2% аммиака в объемном соотношении 1:1 в течение 10 минут при комнатной температуре с последующей фиксацией мазка в 96° спирте - спирт-ксилоле - ксилоле - бальзаме, заключенным под покровное стекло, и выявления продуктов реакции на глутатион методом компьютерной цитофотометрии по относительной плотности продуктов реакции в условных единицах, приходящихся на 1 эритроцит, с учетом числа окрашенных гранул.
| Luz, R | |||
| Cassia Silva; Damos, Flavio Santos et al | |||
| Electrocatalytic determination of reduced glutathione in human erythrocytes // Analytical and Bioanalytical Chemistry | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| V | |||
| Аппарат для получения газа под высоким давлением для работы в поршневом или турбинном двигателе | 1922 |
|
SU387A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| P | |||
| Устройство для управления высотой тона, получаемого в электромузыкальном катодном приборе | 1922 |
|
SU1891A1 |
| Мальцев Г.Ю | |||
| и др | |||
| Методы определения содержания глутатиона и активности глутатионпероксидазы в эритроцитах | |||
| Гигиена и санитария | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
Авторы
Даты
2014-08-27—Публикация
2013-06-25—Подача