ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу очистки подвидов фактора VIII (FVIII) из композиции, содержащей FVIII, включающему стадию анионообменной хроматографии, стадию эксклюзионной хроматографии и стадию концентрирования. Изобретение также относится к композиции, содержащей очищенные подвиды FVIII.
УРОВЕНЬ ТЕХНИКИ
Гемостаз представляет собой процесс, включающий все реакции, направленные на остановку потери крови после травмы или повреждения ткани. Он включает три основных стадии:
1. Вазоконстрикцию, означающую сужение пораженного кровеносного сосуда посредством сокращения близлежащих мышечных волокон для снижения кровотока и, таким образом, снижения острой потери крови.
2. Образование тромбоцитарной пробки для временного запечатывания стенки поврежденного сосуда, что происходит в первую минуту после повреждения и, в основном, является результатом контакта с нижележащим коллагеном соединительной ткани, опосредованного фактором фон Виллебранда (Clemetson, 2012).
3. Свертывание, представляющее собой активацию факторов свертывания крови и, в конечном итоге, активацию тромбина, образование фибрина и, таким образом, стабилизацию тромба. Активация происходит и усиливается подобно каскаду и, таким образом, повышает активность каждого последующего фактора свертывания в каскаде.
Факторы свертывания крови, в основном, являются сериновыми протеазами, за редким исключением. Им являются FVIII и FV, действующие в качестве кофакторов и не выполняющие ферментативную функцию. Факторы свертывания крови, как правило, обозначают прописной буквой F, за которой следуют римские цифры, например, FVII. Когда факторы свертывания крови становятся активированными, их зачастую дополнительно обозначают строчной буквой "a" для обозначения их превращения из неактивного профермента в активную сериновую протеазу, например, FVIIa. Сам каскад свертывания можно разделить на два разных пути, сходящихся на основополагающей стадии активации тромбина.
Путь тканевого фактора также известен как внешний путь, и он начинается с воздействия тканевого фактора, трансмембранного белка массой 47 кДа, локализованного на поверхности клеток субэндотелиальных тканей. После повреждения ткани фактор FVII образует комплекс с тканевым фактором и, таким образом, активируется. Этот комплекс, также обозначаемый как внешний теназный комплекс, в свою очередь, активирует факторы FIX в FIXa и FX в FXa, соответственно. Второй путь назван контактным путем активации или внутренним путем и играет лишь незначительную роль в образовании тромба. Контактный путь активации изначально включает факторы FXII, FXI и FIX. Активный фактор FIXa образует так называемый внутренний теназный комплекс с его активным кофактором FVIIIa, ионами кальция и фосфолипидами. Теназный комплекс способен активировать фактор FX в FXa (обзор см. на фигуре 1).
Фактор FXa, активированный путем тканевого фактора или контактным путем активации, активирует FV в FVa. Оба фактора, FXa и FVa, вместе с ионами кальция в качестве кофактора действуют на протромбин так, что образуется тромбин. И путь тканевого фактора и контактный путь активации сходятся в этой точке. В эту исходную фазу образуется лишь небольшое количество тромбина, несомненно, неспособное преобразовать достаточно фибриногена в фибрин для образования стабильного фибринового сгустка. Но тромбин является частью петли прямой связи, катализируя свое собственное образование. Тромбин активирует FV, FXI и приводит к высвобождению FVIII из vWF, циркулирующего в качестве неактивного комплекса в кровотоке. Таким образом, FVIII активируется в FVIIIa. Как упомянуто выше, FXIa активирует FIX, образующий внутренний теназный комплекс с FVIIIa и ионами кальция. Теназный комплекс активирует большие количества FX, что приводит к продукции даже большего количества тромбина. Тромбин необходим для ключевых целей свертывания, превращения фибриногена в фибрин в предварительном тромбе для его стабилизации и укрепления. Кроме того, тромбин активирует FXIII в FXIIIa, функцией которого является перекрестная сшивка фибрина в тромбе.
Фактор свертывания крови VIII является одним из наиболее крупных факторов свертывания крови. Нативный одноцепочечный FVIII, как правило, содержит 2332 аминокислоты, и его молекулярная масса составляет приблизительно 300 кДа (ExPASy, 2016). Как показано на фигуре 2A, FVIII состоит из шести доменов, обозначаемых как A1-A2-B-A3-C1-C2.
Нативный фактор свертывания крови FVIII синтезируется в виде единой полипептидной цепи в гепатоцитах, клетках почки, эндотелиальных клетках и лимфатической ткани. Под воздействием внутриклеточной протеазы фурина FVIII расщепляется на две цепи, одну тяжелую цепь и одну легкую цепь. По всей длине одноцепочечного FVIII доступны разные положения, к которым протеаза фурин может присоединяться и которые может расщеплять. Это приводит к образованию некоторого количества гетерогенных активных подвидов FVIII, каждый из которых содержит одну тяжелую и одну легкую цепь. Длина тяжелой и легкой цепи варьируется в зависимости от степени укорочения B-домена. Легкая цепь без B-домена состоит из доменов A3-C1-C2, в то время как удлиненная легкая цепь все еще содержит часть B-домена. Молекулярные массы вариантов легкой цепь составляют 80 кДа для стандартной легкой цепи и 120 кДа для удлиненной легкой цепи, соответственно. Тяжелая цепь FVIII может выглядеть как полноразмерный вариант (180 кДа), в котором все еще сохраняется часть B-домена, а также укороченные варианты (150 кДа и 110 кДа) со сниженными количествами B-домена и тяжелая цепь без B-домена (90 кДа), вообще не содержащая B-домен. Домены A1 и A2 являются частью каждого из описанных вариантов тяжелой цепи.
После секреции FVIII циркулирует в кровотоке в виде неактивной формы, нековалентно связанной с vWF, крупным мультимерным гликопротеином. Участок связывания vWF является сильно кислой областью (показана на фигуре 2A в виде незакрашенного пространства между обозначениями доменов), локализованной вблизи N-конца легкой цепи 80 кДа (OBrien and Tuddenham, 1997). FVIII высвобождается из vWF после удаления этой кислой области тромбином. Две дополнительные кислые области находятся между доменами A1 и A2 и между A2 и B, соответственно. Тромбин также вызывает расщепление этих кислых областей, таким образом, разделяя домены A1, A2 и B. Затем образуется активная форма FVIII в виде гетеротримерной молекулы, содержащей домены A1, A2 и легкую цепь A3-C1-C2, B-домен не является частью активной молекулы FVIII. Активная молекула FVIII инактивируется посредством расщепления домена A2 активным протеином C. Инактивированный FVIII быстро выводится из кровотока.
Каждый A-домен содержит приблизительно 330 аминокислот и образует две высококонсервативные β-бочки. Тяжелая цепь и легкая цепь соединены двухвалентным ионом металла, связанным с доменами A1 и A3. Домен A2 содержит специфический участок связывания FIXa. Участок связывания неактивного FX находится в домене A1. Таким образом, активный FVIIIa может действовать в качестве медиатора между FIXa и FX. Сам FVIIIa не имеет ферментативной активности. B-домен является наиболее крупным из всех доменов FVIII. Он является высоко гликозилированным и по меньшей мере частично удаляется во время внутриклеточного процессинга протеазой фурином. По-видимому, он играет роль во внутриклеточном транспорте, таргетинге и секреции FVIII. Хотя A- и C-домены образуют глобулярные структуры, B-домен остается, главным образом, несвернутым в виде линейной структуры. Видимо, он также играет основную роль в предотвращении образования внутриклеточных агрегатов по причине его высоко полярного гликозилирования и взаимодействия с шаперонами (Pipe et al., 1998). В FVIII есть два C-доменами, каждый из которых содержит приблизительно 150-160 аминокислот. Оба из них находятся на C-конце единой цепи FVIII. Части C2-домена образуют гидрофобную область, действующую в качестве фосфолипид-связывающего участка, и важны для образования теназного комплекса во время свертывания крови (Mazurkiewicz-Pisarek et al., 2016). По-видимому, C1-домен влияет на силу связывания с vWF (Liu et al., 2000).
В целом, фактор VIII человека (FVIII) является гликопротеином плазмы, играющим важную роль в каскаде свертывания крови, служа в качестве кофактора для фактора IXa при превращении фактора X в фактор Xa (Toole et al., 1984, Vehar et al., 1984). FVIII, главным образом, продуцируется синусоидальными клетками печени (Do et al., 1999) в виде крупного одноцепочечного белка (2332 аминокислоты), имеющего доменную структуру NH2-A1-a1-A2-a2-B-a3-A3-C1-C2-COOH. Переменный внутри- и внеклеточный процессинг B-домена приводит к образованию смеси гетеродимерных молекул, циркулирующих в плазме. Таким образом, FVIII содержит легкую цепь (LC) постоянного размера (a3-A3-C1-C2) и тяжелую цепь (HC), как минимум, состоящую из доменов A1-a1-A2-a2, но имеющую переменный размер в результате наличия всего смежного B-домена или его части (Jankowski et al, 2007) (фигура 2B). HC и LC соединены посредством нековалентного связывания, для которого необходим двухвалентный ион металла (Kaufman et al., 1988, Fay et al., 2006). FVIII циркулирует в комплексе с фактором фон Виллебранда (vWF) (Krishnaswamy et al., 2015, Pipe et al., 2016). Тромбин превращает FVIII в его активную форму (FVIIIa) посредством специфического расщепления и HC, и LC (Lenting et al., 1998). Во время этого протеолитического процесса B-домен удаляется полностью (Myles et al., 2002).
B-домен FVIII не имеет гомологии аминокислотной последовательности в отношении других известных белков, он сильно гликозилирован и необязателен для прокоагулянтной активности (Fay et al., 2006, Toole et al., 1986). Однако, показано, что он оказывает функциональное влияние на всем протяжении срока действия FVIII, что подробно описано S.W. Pipe (Pipe et al., 2009). B-домен может играть основную роль во внутриклеточном процессинге и транспорте FVIII посредством взаимодействия с шаперонами для способствования правильному фолдингу белков (Pipe et al., 1998) и с рецепторами карго-специфической сортировки, в основном, с помощью молекул углеводов, для повышения эффективности секреции (Pipe et al., 2005, Zhang et al., 2005). Кроме того, вероятно, это предотвращает преждевременный протеолиз (Khrenov et al., 2006) и снижает аффинность неактивного FVIII к активированным тромбоцитам (Li et al., 1997), таким образом, сохраняя циркулирующий FVIII. B-домен имеет небольшой эффект в отношении общей вторичной структуры FVIII в растворе (Grushin et al., 2014). Трехмерные структуры, доступные исключительно для BDD-rFVIII (Shen et al., 2008, Ngo et al., 2008), свидетельствуют о трудности кристаллизации B-домена. Недавно выдвинуто предположение о стабилизирующей функции B-домена в неактивирующих условиях, т.к. показано, что он сильно связан с кором молекулы FVIII при низких концентрациях Ca2+ (Bonazza et al., 2015).
Нарушение свертывания определяют как любое нарушение процесса образования тромба после повреждения, травмы или хирургического вмешательства. Может быть затронут любой компонент каскада свертывания крови, т.е. факторов свертывания крови или связанных с ними процессов, таких как образование временной тромбоцитарной пробки. Все нарушения свертывания имеют общую черту, состоящую в том, что образование тромба не происходит или происходит лишь частично, что приводит к спонтанным и/или обширным кровотечениям. Эти заболевания могут быть наследственными или приобретенными, например, при использовании лекарственного средства или при других заболеваниях. Ниже приведено несколько примеров нарушений свертывания.
1. Болезнь фон Виллебранда вызвана недостаточностью фактора фон Виллебранда. В результате, опосредованная vWF адгезия тромбоцитов не происходит надлежащим образом.
2. Гемофилия A возникает по причине недостаточности фактора свертывания крови VIII. Временная адгезия тромбоцитов и фаза инициации свертывания являются функциональными, но в фазу усиления процесса свертывания не может происходить крупномасштабное образование тромбина.
3. Гемофилия B представляет собой недостаточность фактора IX, приводящую к симптомам, схожим с гемофилией A. Внутренний теназный комплекс не может образоваться, и, таким образом, фактор FX остается, в основном, неактивным, что приводит к неэффективной активации тромбина и недостаточному образованию фибрина.
Гемофилия A является наследственным нарушением свертывания, вызванным недостаточностью фактора свертывания FVIII. Поражаемый ген F8A локализован на X хромосоме. Таким образом, она является сцепленным с полом, рецессивным заболеванием, в основном, поражающим мужскую зародышевую линию. Наиболее распространенной причиной является крупная инверсия с транслокацией экзонов 1-22 вследствие гомологичной рекомбинации (Mazurkiewicz-Pisarek et al., 2016). Другими причинами возникновения гемофилии A является точечная мутация и реже наблюдаемые небольшие делеции, инсерции и инверсии. В результате, белок FVIII вообще не экспрессируется или экспрессия белка приводит к образованию нефункциональных белков. В случае повреждения первичный гемостаз, означающий адгезию тромбоцитов к нижележащей соединительной ткани, надлежащим образом опосредован функциями vWF. Отсутствие функционального FVIII приводит к проблемам во время фазы усиления каскада свертывания крови. Внутренний теназный комплекс, содержащий FIXa, FVIIIa, ионы кальция и фосфолипиды, не может образовываться и, таким образом, не может активировать фактор FX в FXa, что является его основной функцией. Следствием этого является отсутствие активного тромбина, необходимого для расщепления фибриногена. Нерастворимая в воде молекула фибрина, которая будет укреплять тромб, не образуется, и, таким образом, тромб является очень нестабильным и склонен к разрушению. В целом, дефект или недостаточности FVIII приводят к гемофилии A, являющейся наиболее распространенным из тяжелых нарушений свертывания (Mannucci et al., 2004).
Гемофилию A разделяют на три формы по тяжести, классифицируемой по количеству функционального фактора FVIII, находящегося в крови. Количество функционального FVIII определяют по его активности, которую можно определять с помощью двухстадийного анализа свертывания или, более предпочтительно, хромогенного анализа. Основной принцип хромогенного анализа описан ниже. Пациентов с активностью фактора VIII 5-40 МЕ/дл, соответствующей 5-40% активности FVIII у пациентов без гемофилии A, как правило, считают пациентами с гемофилией A слабого типа. Почти отсутствуют спонтанные кровотечения, но кровотечение после хирургического вмешательства очень распространено. Умеренный тип гемофилии A определяют по активности FVIII 1-5 МЕ/дл (1-5% от нормы). Спонтанные кровотечения происходят редко, иногда происходят кровотечения в суставах, но не у всех пациентов с умеренным типом. У пациентов с тяжелым типом гемофилии A наблюдают менее 1 МЕ/дл функционального FVIII (<1% от нормы). Эти пациенты страдают спонтанными кровотечениями в мышцах при физической активности и внутрисуставными кровотечениями. Рецидивирующие кровотечения в суставах могут приводить к воспалению, а затем и артропатии и функциональному нарушению (Valentino, 2010).
Для профилактики прогрессирования заболевания у пациентов с гемофилией A и связанных с ним последствий, которые будут угрожать их жизни и снижать качество их жизни, необходимо обеспечить доступ к эффективной терапии. Некоторые примеры общеупотребительных, а также новых и находящихся в стадии разработки лекарственных средств приведены далее.
Введение недостающего фактора свертывания крови, например, FVIII, называют замещением или заместительной терапией. Ее используют для профилактики и в качестве терапии по требованию в случае острого кровотечения. Профилактику необходимо начинать настолько рано, насколько это возможно, для предотвращения связанного с заболеванием разрушения суставов. Существует две разные группы заместительных лекарственных средств. Полученный из плазмы FVIII выделяют из больших пулов плазмы, затем лиофилизируют и, таким образом, концентрируют. Однако существует по меньшей мере теоретический риск распространения возбудителей инфекции, таких как вирусы или прионы, связанный с этими лекарственными средствами. Рекомбинантный FVIII считают гораздо более безопасным, т.к. его получают и продуцируют в линиях клеток млекопитающего, и он не контактирует с плазмой человека. Независимо от источника антигемофильного фактора FVIII, сохраняются его основные недостатки, а именно короткое время полужизни и возникновение антител против этих лекарственных средств. Типичное время полужизни FVIII в крови составляет приблизительно 8-12 часов, что делает необходимым очень частое введение, составляющее 2-3 раза в неделю. Другим недостатком является возникновение антител, быстро инициирующих иммунный ответ и, таким образом, деградацию этих заместительных лекарственных средств.
Новые подходы направлены на повышение времени полужизни. Добавление полимеров полиэтиленгликоля к FVIII или слияние FVIII с белками с большим временем полужизни, таким как альбумин человека или Fc-область IgG, приводит к повышению времени полужизни, но улучшение является в среднем всего 1,5-кратным по сравнению с нативным фактором FVIII (Peyvandi et al., 2016).
Как указано выше, технология рекомбинантных белков привела к разработке и получению продуктов рекомбинантного FVIII (rFVIII) для лечения гемофилии A с помощью заместительной терапии белками. Эти продукты, в основном, отличают друг от друга по наличию или отсутствию B-домена, обозначая как полноразмерный (FL-)rFVIII и (BDD-)rFVIII с делецией B-домена, соответственно (Jankowski et al., 2007, D'Amici et al., 2010, Thim et al., 2010, Peters et al., 2013, Kannicht et al.,2013).
FVIII, являясь белковым терапевтическим средством, подвержен тем же рискам, что и другие терапевтические средства на основе белков, в частности, склонности к агрегации во время производства, хранения на складе и эксплуатации в клинике (Joubert et al., 2011, Roberts et al., 2014). Для белковых терапевтических средств в клинических условиях показано, что наличие агрегатов может индуцировать нежелательные иммунные ответы у пациентов, что может влиять на эффективность терапевтических средств (Moussa et al., 2016, Hermeling et al., 2003, van Beers et al., 2010, Barnard et al., 2013, Robbins et al., 1987a, Robbins et al., 1987b, Maislos et al., 1986, Ahmadi et al., 2015, Joubert et al., 2012).
Незаместительная терапия следует другим стратегиям. В следующих двух подходах пытаются скорее улучшать гемостаз, а не заменять отсутствующие факторы свертывания. Моноклональные антитела против ингибитора пути тканевого фактора (TFPI) снижают ингибиторный эффект TFPI и, таким образом, поддерживают путь тканевого фактора в активном состоянии. Вторая стратегия позволяет обходить отсутствие FVIII посредством биспецифических антител, способных связываться с FIXa и FX и, таким образом, имитирующих кофакторную роль FVIIIa. Искусственный теназный комплекс, состоящий из FIXa-биспецифического антитела-FX, может образовываться и активировать фактор FX в FXa. Полностью иным подходом является генная терапия. Т.к. она направлена на устойчивое снижение тяжести, она является больше излечивающей, чем профилактической. Используют вирусные векторы для доставки и встраивания функциональных генов F8 в гепатоциты, место продукции FVIII, для замены нефункционального гена F8 и экспрессии функционального фактора свертывания FVIII.
Рекомбинантный продукт FVIII ADVATE является одним из наиболее исследуемых и чаще всего используемых заместительных лекарственных средств для терапии гемофилии A с низкой частотой побочных эффектов и нежелательных явлений (в соответствии с одобрением FDA 2003 года). Таким образом, его считают безопасным, а также эффективным лекарственным средством.
Для дальнейшего исследования сходства рекомбинантного антигемофильного FVIII, получаемого в культуре клеток млекопитающего, с полученным из плазмы FVIII человека в терминах композиции, и для характеризации свойств, а также характеристик всех основных подвидов необходимо получать соответствующие количество каждого подвида FVIII с достаточной чистотой. Один или более из этих очищенных подвидов FVIII или их смесь также можно использовать в терапии.
Таким образом, настоящее изобретение относится к стратегии очистки на основе хроматографических стадий. Предпочтительно, с помощью стратегии очистки можно достигать следующего:
1. Получать достаточное количество каждого подвида FVIII.
2. Достигать достаточной концентрации белка подвида FVIII в конечном составе.
3. Получать конечный состав, где количество других подвидов FVIII, считающихся примесями, является достаточно низким, например, для того, чтобы приводить к надежным результатам в последующих иммунологических исследованиях. Конечный продукт должен быть стерильным и не содержать биологические загрязнения.
4. Конечные фракции подвидов FVIII предоставляют в определенной матрице, например, матрице с определенным pH, содержащей буферные компоненты, включающие соли, а также поверхностно-активное вещество.
5. Кроме того, стадии способа, которые, как оценивают, можно использовать в настоящем изобретении, легко можно доводить до препаративного масштаба для обеспечения получения достаточного количества продукта.
Настоящее изобретение относится к ранним фазам разработки в форме экспериментов по определению осуществимости на хроматографических колонках небольшого масштаба, а также к доведению способа до препаративного масштаба и конечной схеме получения каждого подвида FVIII.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение соответствует описанным выше потребностям и позволяет решить указанные выше проблемы, существующие в этой области, с помощью описанных ниже вариантов осуществления.
В частности, с целью разработки способа очистки подвидов фактора VIII из композиции, содержащей фактор VIII, авторы настоящего изобретения обнаружили, что используя две стадии хроматографии, а именно стадию анионообменной хроматографии и стадию эксклюзионной хроматографии, с последующей стадией концентрирования, которая может являться еще одной стадией анионообменной хроматографии, получали композицию, содержащую указанные подвиды фактора VIII с высокой чистотой и высокой концентрацией. Неожиданно, авторы настоящего изобретения дополнительно обнаружили, что обработка протеазой фурином композиции, содержащей фактор VIII, а также осуществление первой стадии анионообменной хроматографии посредством элюирования в линейном градиенте с использованием увеличенной длины градиента дополнительно улучшали разделение подвидов фактора VIII во время хроматографии и, таким образом, приводили к получению композиции, содержащей указанные подвиды фактора VIII даже с более высокой чистотой и концентрацией.
В дополнительных экспериментах авторы настоящего изобретения охарактеризовывали очищенные подвиды фактора VIII, полученные по настоящему изобретению. Неожиданно, авторы настоящего изобретения обнаружили, что все очищенные виды rFVIII и их смесь демонстрировали повышенную активность по сравнению с неочищенным исходным материалом. Кроме того, авторы настоящего изобретения обнаружили, что подвиды фактора VIII, содержащие 70% B-домена, демонстрировали значимо более низкую склонность к агрегации и более высокую склонность к образованию олигомеров, чем подвиды фактора VIII, в которых отсутствует полный B-домен. Таким образом, очищенные подвиды фактора VIII, полученные способом по настоящему изобретению, теоретически можно составлять в фармацевтически активной композиции (т.е. лекарственном средстве) с улучшенными свойствами. Фармацевтически активная композиция может содержать один очищенный подвид FVIII. Альтернативно, можно смешивать два или более очищенных подвида FVIII, например, в том же соотношении подвидов FVIII, что и в pdFVIII, или в продуктах rFVIII, в настоящее время используемых для лечения пациентов. Такую фармацевтически активную композицию можно использовать для лечения пациентов с нарушениями свертывания, такими как гемофилия A.
В дополнительных экспериментах авторы настоящего изобретения неожиданно обнаружили, что обработка рекомбинантного FVIII фурином повышает активность FVIII даже в отсутствие очистки подвидов.
В целом, настоящее изобретение относится к улучшенным способам очистки подвидов фактора VIII из композиции, содержащей фактор VIII, с помощью предпочтительных вариантов осуществления, указанных ниже как пп. 1-86:
1. Способ очистки подвидов фактора VIII (FVIII) из композиции, содержащей FVIII, включающий стадии:
(1) подвергания композиции, содержащей FVIII, анионообменной хроматографии и сбора элюата, содержащего указанные подвиды FVIII;
(2) подвергания элюата, полученного на стадии (1) и содержащего указанные подвиды FVIII, эксклюзионной хроматографии и сбора элюата, содержащего указанные подвиды FVIII; и
(3) концентрирования элюата, полученного на стадии (2) и содержащего указанные подвиды FVIII.
2. Способ по п. 1, где стадия концентрирования (3) является стадией подвергания элюата, полученного на стадии (2) и содержащего указанные подвиды FVIII, анионообменной хроматографии и сбора элюата, содержащего указанные подвиды FVIII.
3. Способ по п. 1 или 2, где FVIII является рекомбинантным FVIII (rFVIII), и подвиды FVIII являются подвидами рекомбинантного FVIII (rFVIII).
4. Способ по любому из пп. 1-3, где подвиды FVIII представляют собой тяжелую цепь FVIII, соединенную с легкой цепью FVIII.
5. Способ по любому из пп. 1-4, где подвиды FVIII представляют собой тяжелую цепь FVIII массой 180 кДа, соединенную с легкой цепью FVIII.
6. Способ по любому из пп. 1-4, где подвиды FVIII представляют собой тяжелую цепь FVIII массой 150 кДа, соединенную с легкой цепью FVIII.
7. Способ по любому из пп. 1-4, где подвиды FVIII представляют собой тяжелую цепь FVIII массой 110 кДа, соединенную с легкой цепью FVIII.
8. Способ по любому из пп. 1-4, где подвиды FVIII представляют собой тяжелую цепь FVIII массой 90 кДа, соединенную с легкой цепью FVIII.
9. Способ по любому из пп. 1-8, где на стадии (1) для анионообменной хроматографии используют Q-смолу высокого разрешения с размером частиц менее 20 мкм.
10. Способ по п. 9, где Q-смола высокого разрешения с размером частиц менее 20 мкм является смолой MonoQ.
11. Способ по любому из пп. 1-10, где на стадии (2) для эксклюзионной хроматографии используют смолу для эксклюзионной хроматографии с диапазоном разрешения от 10000 Да до 60000 Да.
12. Способ по п. 11, где смола для эксклюзионной хроматографии с диапазоном разрешения от 10000 Да до 60000 Да является смолой Superdex 200 Prep Grade.
13. Способ по любому из пп. 2-12, где на стадии (3) для анионообменной хроматографии используют смолу SourceQ.
14. Способ по любому из пп. 1-13, где способ дополнительно включает следующую стадию (0) перед стадией (1):
(0) подверганиф FVIII, содержащегося в композиции, обработке протеазой фурином.
15. Способ по п. 14, где обработку протеазой фурином осуществляют с использованием фурина в конечной концентрации более 100 МЕ/мл.
16. Способ по п. 14 или 15, где способ дополнительно включает следующую стадию (0') после стадии (0):
(0') фильтрацию композиции, содержащей FVIII, через фильтр с размером пор приблизительно 0,2 мкм.
17. Способ по любому из пп. 14-16, где легкая цепь FVIII представляет собой легкую цепь FVIII массой 80 кДа.
18. Способ по любому из пп. 1-17, где элюирование на стадии (1) осуществляют посредством элюирования в линейном градиенте.
19. Способ по п. 18, где на стадии (1) градиент при элюировании в линейном градиенте имеет длину по меньшей мере приблизительно 16 объемов колонки.
20. Способ по п. 18, где на стадии (1) градиент при элюировании в линейном градиенте имеет длину по меньшей мере приблизительно 24 объема колонки.
21. Способ по п. 18, где на стадии (1) градиент при элюировании в линейном градиенте имеет длину по меньшей мере приблизительно 32 объема колонки.
22. Способ по любому из пп. 1-21, где на стадии (1) элюирование осуществляют с использованием буфера, содержащего этиленгликоль.
23. Способ по п. 22, где на стадии (1) элюирование осуществляют с использованием буфера, содержащего этиленгликоль, в концентрации приблизительно 10% (об./об.).
24. Способ по любому из пп. 1-23, где стадию (2) заменяют стадией:
(2) подвергания элюата, полученного на стадии (1) и содержащего указанные подвиды FVIII, хроматографии гидрофобных взаимодействий.
25. Способ по п. 24, где способ дополнительно включает следующую стадию (1') перед стадией (2):
(1') подвергания подвидов FVIII, содержащихся в элюате, полученном на стадии (1), обработке протеазой фурином.
26. Способ по п. 25, где обработку протеазой фурином осуществляют с использованием фурина в конечной концентрации более 100 МЕ/мл.
27. Способ по п. 25 или 26, где способ дополнительно включает следующую стадию (1'') после стадии (1'):
(1'') фильтрации элюата, содержащего указанные подвиды FVIII, через фильтр с размером пор приблизительно 0,2 мкм.
28. Способ по любому из пп. 25-27, где легкая цепь FVIII представляет собой легкую цепь FVIII массой 80 кДа.
29. Способ по любому из пп. 24-28, где хроматография гидрофобных взаимодействий является отрицательной хроматографией.
30. Способ по любому из пп. 24-29, где подвиды FVIII представляют собой тяжелую цепь FVIII массой 150 кДа, соединенную с легкой цепью FVIII.
31. Способ по любому из пп. 24-29, где подвиды FVIII представляют собой тяжелую цепь FVIII массой 180 кДа, соединенную с легкой цепью FVIII.
32. Способ по любому из пп. 2-31, где элюирование на стадии (3) осуществляют с помощью стадии элюирования в градиенте.
33. Способ по любому из пп. 1-4, 9, 10, 13-23 или 32, где подвиды FVIII представляют собой тяжелую цепь FVIII массой 90 кДа, где стадию (2) способа пропускают, и где на стадии (3) элюатом, полученном на стадии (1) и содержащим указанные подвиды FVIII, заменяют элюат, полученный на стадии (2) и содержащий указанные подвиды FVIII.
34. Композиция, содержащая очищенные подвиды FVIII, получаемые по любому из пп. 1-33.
35. Композиция, содержащая очищенные подвиды FVIII по п. 34, где массовое соотношение очищенных подвидов FVIII и всех других подвидов FVIII в композиции составляет по меньшей мере 9.
36. Композиция, содержащая очищенные подвиды FVIII по п. 34, где массовое соотношение очищенных подвидов FVIII и всех других подвидов FVIII в композиции составляет по меньшей мере 8.
37. Композиция, содержащая очищенные подвиды FVIII по любому из пп. 34-36, где концентрация очищенных подвидов FVIII составляет по меньшей мере 0,1 мг/мл.
38. Композиция, содержащая очищенные подвиды FVIII по любому из пп. 34-36, где концентрация очищенных подвидов FVIII составляет по меньшей мере 0,3 мг/мл.
39. Композиция, содержащая очищенные подвиды фактора VIII (FVIII).
40. Композиция по п. 39, где FVIII является рекомбинантным FVIII (rFVIII), и подвиды FVIII являются подвидами рекомбинантного FVIII (rFVIII).
41. Композиция по п. 39 или 40, где подвиды FVIII представляют собой тяжелую цепь FVIII массой 180 кДа, соединенную с легкой цепью FVIII, тяжелую цепь FVIII массой 150 кДа, соединенную с легкой цепью FVIII, тяжелую цепь FVIII массой 110 кДа, соединенную с легкой цепью FVIII, или тяжелую цепь FVIII массой 90 кДа, соединенную с легкой цепью FVIII.
42. Композиция по любому из пп. 39-41, где массовое соотношение очищенных подвидов FVIII и всех других подвидов FVIII в композиции составляет по меньшей мере 9 или по меньшей мере 8.
43. Композиция по любому из пп. 39-42, где концентрация очищенных подвидов FVIII составляет по меньшей мере 0,1 мг/мл или по меньшей мере 0,3 мг/мл.
44. Композиция по любому из пп. 34-43 для применения в качестве лекарственного средства.
45. Композиция по любому из пп. 34-44 для применения в лечении нарушения свертывания.
46. Композиция по любому из пп. 34-45 для применения в лечении гемофилии A.
47. Способ очистки белка или субъединицы белка из композиции, содержащей несколько белков или несколько субъединиц белка, включающий стадии:
(1) подвергания композиции, содержащей белок или субъединицу белка, анионообменной хроматографии и сбора элюата, содержащего указанный белок или субъединицу белка;
(2) подвергания элюата, полученного на стадии (1) и содержащего указанный белок или субъединицу белка, эксклюзионной хроматографии и сбора элюата, содержащего указанный белок или субъединицу белка; и
(3) концентрирования элюата, полученного на стадии (2) и содержащего указанный белок или субъединицу белка.
48. Способ по п. 47, где стадия концентрирования (3) является стадией подвергания элюата, полученного на стадии (2) и содержащего указанный белок или субъединицу белка, анионообменной хроматографии и сбора элюата, содержащего указанный белок или субъединицу белка.
49. Способ по п. 47 или 48, где белок или субъединица белка является рекомбинантным белком или рекомбинантной субъединицей белка.
50. Способ по любому из пп. 47-49, где на стадии (1) для анионообменной хроматографии используют Q-смолу высокого разрешения с размером частиц менее 20 мкм.
51. Способ по п. 50, где Q-смола высокого разрешения с размером частиц менее 20 мкм является смолой MonoQ.
52. Способ по любому из пп. 47-51, где на стадии (2) для эксклюзионной хроматографии используют смолу для эксклюзионной хроматографии с диапазоном разрешения от 10000 Да до 60000 Да.
53. Способ по п. 52, где смола для эксклюзионной хроматографии с диапазоном разрешения от 10000 Да до 60000 Да является смолой Superdex 200 Prep Grade.
54. Способ по любому из пп. 48-53, где на стадии (3) для анионообменной хроматографии используют смолу SourceQ.
55. Способ по любому из пп. 47-54, где способ дополнительно включает следующую стадию (0) перед стадией (1):
(0) подвергания белка или субъединицы белка, содержащейся в композиции, обработке протеазой фурином.
56. Способ по п. 55, где обработку протеазой фурином осуществляют с использованием фурина в конечной концентрации более 100 МЕ/мл.
57. Способ по п. 55 или 56, где способ дополнительно включает следующую стадию (0') после стадии (0):
(0') фильтрацию композиции, содержащей белок или субъединицу белка, через фильтр с размером пор приблизительно 0,2 мкм.
58. Способ по любому из пп. 47-57, где элюирование на стадии (1) осуществляют посредством элюирования в линейном градиенте.
59. Способ по п. 58, где на стадии (1) градиент при элюировании в линейном градиенте имеет длину по меньшей мере приблизительно 16 объемов колонки.
60. Способ по п. 58, где на стадии (1) градиент при элюировании в линейном градиенте имеет длину по меньшей мере приблизительно 24 объемов колонки.
61. Способ по п. 58, где на стадии (1) градиент при элюировании в линейном градиенте имеет длину по меньшей мере приблизительно 32 объема колонки.
62. Способ по любому из пп. 47-61, где на стадии (1) элюирование осуществляют с использованием буфера, содержащего этиленгликоль.
63. Способ по п. 62, где на стадии (1) элюирование осуществляют с использованием буфера, содержащего этиленгликоль в концентрации приблизительно 10% (об./об.).
64. Способ по любому из пп. 47-63, где стадию (2) заменяют стадией:
(2) подвергания элюата, полученного на стадии (1) и содержащего указанный белок или субъединицу белка, хроматографии гидрофобных взаимодействий.
65. Способ по п. 64, где способ дополнительно включает следующую стадию (1') перед стадией (2):
(1') подвергания белка или субъединицы белка, содержащихся в элюате, полученном стадии (1), обработке протеазой фурином.
66. Способ по п. 65, где обработку протеазой фурином осуществляют с использованием фурина в конечной концентрации более 100 МЕ/мл.
67. Способ по п. 65 или 66, где способ дополнительно включает следующую стадию (1'') после стадии (1'):
(1'') фильтрацию элюата, содержащего указанный белок или субъединицу белка, через фильтр с размером пор приблизительно 0,2 мкм.
68. Способ по любому из пп. 64-67, где хроматография гидрофобных взаимодействий является отрицательной хроматографией.
69. Способ по любому из пп. 47-68, где элюирование на стадии (3) осуществляют посредством стадии элюирования в градиенте.
70. Способ по любому из пп. 47-51, 54-63 или 69, где стадию (2) способа пропускают, и где на стадии (3) элюатом, полученном на стадии (1) и содержащим указанный белок или субъединицу белка, заменяют элюат, полученный на стадии (2) и содержащий указанный белок или субъединицу белка.
71. Композиция, содержащая очищенный белок или субъединицу белка, получаемые по любому из пп. 47-71.
72. Композиция, содержащая очищенный белок или субъединицу белка по п. 71, где массовое соотношение очищенного белка или субъединицы белка и всех других белков или субъединиц белка в композиции составляет по меньшей мере 9.
73. Композиция, содержащая очищенный белок или субъединицу белка по п. 71, где массовое соотношение очищенного белка или субъединицы белка и всех других белков или субъединиц белка в композиции составляет по меньшей мере 8.
74. Композиция, содержащая очищенный белок или субъединицу белка по любому из пп. 71-73, где концентрация очищенного белка или субъединицы белка составляет по меньшей мере 0,1 мг/мл.
75. Композиция, содержащая очищенный белок или субъединицу белка по любому из пп. 71-73, где концентрация очищенного белка или субъединицы белка составляет по меньшей мере 0,3 мг/мл.
76. Композиция по любому из пп. 71-75 для применения в качестве лекарственного средства.
77. Способ подвергания фактора VIII (FVIII) обработке протеазой фурином.
78. Способ по п. 77, где FVIII является рекомбинантным FVIII (rFVIII).
79. Способ по п. 77 или 78, где FVIII содержит одноцепочечный FVIII.
80. Способ по любому из пп. 77-79, где обработку протеазой фурином осуществляют с использованием фурина в конечной концентрации более 100 МЕ/мл.
81. Способ по любому из пп. 77-80, где способ дополнительно включает стадию отделения протеазы фурина от FVIII.
82. Способ по любому из пп. 77-81, где способ предназначен для повышения активности FVIII.
83. Композиция, содержащая FVIII, где FVIII получают по любому из пп. 77-82.
84. Композиция, содержащая FVIII, по п. 83 для применения в качестве лекарственного средства.
85. Композиция, содержащая FVIII, по п. 83 или 84 для применения в лечении нарушения свертывания.
86. Композиция, содержащая FVIII, по любому из пп. 83-85 для применения в лечении гемофилии A.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Каскад свертывания крови, включающий зависящий от тканевого фактора или внешний путь на правой стороне и путь контактной активации или внутренний путь на левой стороне, при этом черными стрелками указана активация соответствующего фактора свертывания и короткими штриховыми пунктирными линиями отмечена "прямая связь" и "инактивация", означающая прямой инактивирующий эффект, соответственно. Иллюстрация основана на Schaller et al. (2008).
Фигура 2:(A) Схематическое изображение одноцепочечной молекулы фактора VIII (сверху), полученных из нее фрагментой тяжелой цепи (слева) и фрагментов легкой цепи (справа). Иллюстрации основаны на Schaller et al., 2008. Конкретные домены белка A1, A2, B, A3 и C1, а также C2 показаны разными оттенками серого. B-домен в разной степени распределен по фрагментам тяжелой и легкой цепи. Белые пространства между закрашенными областями доменов соответствуют очень кислым последовательностям с другими функциями. (B) Гетерогенность и молекулы FVIII. Доменная структура FVIII. Пределами обозначены основные виды домена HC/B с терминирующими аминокислотами, присутствующими в FL-FVIII.
Фигура 3: Схематическое изображение трех наиболее распространенных типов режимов элюирования, представляющие собой (1) изократическое элюирование, показанное штрихпунктирной линией, (2) ступенчатое элюирование, показанное короткой штриховой пунктирной линией и (3) элюирование в градиенте, показанное сплошной линией.
Фигура 4: Хроматограмма фазы элюирования молекулярных подвидов FVIII на смоле для AIEX Mono 10Q, разделяемых с помощью стандартных буферов QA1 и QB1 при pH 6,7. Градиент: 135,0-750,0 мМ хлорида натрия в восьми объемах колонки. Размеры колонки: внутренний диаметр 0,5 см × высота слоя 5,0 см, объем колонки 0,98 мл.
Фигура 5: Электрофорез в ПААГ в присутствии SDS при разделении молекулярных подвидов FVIII на смоле Mono 10Q, разделяемых с помощью стандартных буферов QA1 и QB1 при pH 6,7. Градиент: 135,0-750,0 мМ хлорида натрия в восьми объемах колонки. M) Маркер молекулярной массы, AS) Стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие молекулы тяжелых и легких цепей, SB) Буфер для образца, фракции B7-C8, NE) Пост-элюат. Снизу вверх: Полноразмерная единая цепь (300 кДа), тяжелая цепь массой 180 кДа, укороченная тяжелая цепь массой 150 кДа, удлиненная легкая цепь массой 120 кДа, укороченная тяжелая цепь массой 110 кДа, тяжелая цепь без B-домена массой 90 кДа, легкая цепь массой 80 кДа.
Фигура 6: Наложение разделения молекулярных подвидов FVIII на смоле для AIEX Mono 10Q, разделенных с помощью стандартных буферов QA1 и QB1 при pH 6,7. (1) Градиент: 135,0-750,0 мМ хлорида натрия в восьми объемах колонки, длинная штриховая пунктирная линия: электропроводность, сплошная линия: поглощение при 280 нм. (2) Градиент: 135,0-750,0 мМ хлорида натрия в 16 объемах колонки, короткая штриховая пунктирная линия: электропроводность, точечная пунктирная линия: поглощение при 280 нм. Размеры колонки: внутренний диаметр 0,5 см × высота слоя 5,0 см, объем колонки 0,98 мл.
Фигура 7: Наложение разделения молекулярных подвидов FVIII на смоле для AIEX Mono10Q при pH 6,7. Сплошная линия: градиент: 135,0-750,0 мМ хлорида натрия в 16 объемах колонки с использованием стандартных буферов QA1 и QB1, длинная штриховая пунктирная линия: градиент: 135,0-750,0 мМ хлорида натрия в 32 объемах колонки с буферами QA1 и QB, содержащими 10% этиленгликоля. Размеры колонки: внутренний диаметр 0,5 см × высота слоя 5,0 см, объем колонки 0,98 мл.
Фигура 8: Наложение разделения обработанных фурином и необработанных фурином молекулярных подвидов FVIII на смоле для AIEX Mono 10Q, разделенных с помощью стандартных буферов QA1 и QB1 при pH 6,7. Градиент: 135,0-750,0 мМ хлорида натрия в 16 объемах колонки. (1) Образец без обработки фурином: короткая штриховая пунктирная линия: электропроводность, длинная штриховая пунктирная линия: поглощение при 280 нм, (2) образец, обработанный фурином: точечная пунктирная линия: электропроводность, сплошная линия: поглощение при 280 нм. Размеры колонки: внутренний диаметр 0,5 см × высота слоя 5,0 см, объем колонки 0,98 мл.
Фигура 9: Хроматограмма фазы элюирования обработанных фурином молекулярных подвидов FVIII на смоле для AIEX Mono 10Q, разделенных с помощью стандартных буферов QA1 и QB1 при pH 6,7. Градиент: 135,0-750,0 мМ хлорида натрия в 16 объемах колонки. Размеры колонки: внутренний диаметр 0,5 см × высота слоя 5,0 см, объем колонки 0,98 мл.
Фигура 10: Электрофорез в ПААГ в присутствии SDS для разделения обработанных фурином молекулярных подвидов FVIII на смоле для AIEX Mono 10Q, разделенных с помощью стандартных буферов QA1 и QB1 при pH 6,7. Градиент: 135,0-750,0 мМ хлорида натрия в 16 объемах колонки. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, L) введение, FT) фильтрат, W1) фаза промывки 1, W2) фаза промывки 2, W3) фаза промывки 3, VE) пре-элюат, фракции B5-C7.
Фигура 11: Электрофорез в ПААГ в присутствии SDS для разделения обработанных фурином молекулярных подвидов FVIII на смоле для AIEX Mono 10Q, разделенных с помощью стандартных буферов QA1 и QB1 при pH 6,7. Градиент: 135,0-750,0 мМ хлорида натрия в 16 объемах колонки. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, фракции C8-D12, NE) пост-элюат.
Фигура 12: Заключительная очистка укороченного фрагмента тяжелой цепи массой 110 кДа посредством эксклюзионной хроматографии на Superdex 200 Increase с разделением с помощью буфера приблизительно 300 мМ хлорида натрия при pH 6,7. Размеры колонки: внутренний диаметр 1,0 см × высота слоя 30,0 см, объем колонки 23,56 мл.
Фигура 13: Электрофорез в ПААГ в присутствии SDS для стадии SEC для очистки укороченного фрагмента тяжелой цепи массой 110 кДа и соответствующего исходного материала (фракции G4, G5 и G6), полученных с помощью анионообменной хроматографии на MonoQ. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержаий все соответствующие виды тяжелых и легких цепей, фракции C4-E2.
Фигура 14: Заключительная очистка полноразмерной тяжелой цепи массой 180 кДа посредством эксклюзионной хроматографии на Superdex 200 Increase с разделением с помощью буфера приблизительно 300 мМ хлорида натрия при pH 6,7. Размеры колонки: внутренний диаметр 1,0 см × высота слоя 30,0 см, объем колонки 23,56 мл.
Фигура 15: Электрофорез в ПААГ в присутствии SDS для стадии SEC для очистки полноразмерного фрагмента тяжелой цепи массой 180 кДа и соответствующего исходного материала (фракции F4, F5 и F6), полученных с помощью анионообменной хроматографии на MonoQ. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, фракции C4-D9.
Фигура 16: Хроматограмма фазы двухмерного элюирования молекулярных подвидов FVIII, разделенных с помощью высокоэффективной фенил-сефарозы. 1. Градиент: 680,0-0,0 мМ хлорида натрия в 20 объемах колонки, 2. Градиент: 0-50% этиленгликоля в 16 объемах колонки. Размеры колонки: внутренний диаметр 0,5 см × высота слоя 5,0 см, объем колонки 0,98 мл.
Фигура 17: Электрофорез в ПААГ в присутствии SDS для стадии двухмерной HIC для очистки молекулярных подвидов FVIII из обработанного фурином исходного материала B14390000-30. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, FT) фильтрат, фракции A5-B12. Продолжение фигуры см. на фигуре 18.
Фигура 18: Электрофорез в ПААГ в присутствии SDS для стадии двухмерной HIC для очистки молекулярных подвидов FVIII из обработанного фурином исходного материала B14390000-10. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, фракции C2-G6.
Фигура 19: Хроматограмма фазы одномерного элюирования молекулярных подвидов FVIII, разделенных с помощью высокоэффективной фенил-сефарозы. Градиент: 680,0-0,0 мМ хлорида натрия в 40 объемах колонки. Размеры колонки: внутренний диаметр 0,5 см × высота слоя 5,0 см, объем колонки 0,98 мл.
Фигура 20: Электрофорез в ПААГ в присутствии SDS для стадии одномерной HIC для очистки укороченного фрагмента тяжелой цепи массой 150 кДа из обработанного фурином исходного материала B14390000-10. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, FT) фильтрат, фракции B2-G11.
Фигура 21: Хроматограмма фаз отрицательной промывки и элюирования молекулярных подвидов FVIII, разделенных с помощью высокоэффективной фенил-сефарозы. Фаза промывки: 860 мМ хлорида натрия на 30 объемов колонки, стадия элюирования: 0 мМ хлорида натрия на 10 объемов колонки. Размеры колонки: внутренний диаметр 0,5 см × высота слоя 5,0 см, объем колонки 0,98 мл.
Фигура 22: Электрофорез в ПААГ в присутствии SDS для стадии отрицательной HIC для очистки укороченного фрагмента тяжелой цепи массой 150 кДа. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, фракции A10-C12.
Фигура 23: Блок-схема способа препаративной очистки молекулярных подвидов FVIII. Стратегия очистки для подвидов с молекулярной массой 180 кДа, 150 кДа и 110 кДа включает две стадии очистки посредством AIEX (MonoQ) и SEC (Superdex 200) и конечную стадию концентрирования посредством AIEX (SourceQ). Фрагмент тяжелой цепи без B-домена не требует дополнительной очистки посредством эксклюзионной хроматографии, и, таким образом, его подвергают AIEX на MonoQ, а затем концентрируют посредством AIEX на SourceQ.
Фигура 24: Хроматограмма фазы элюирования анионообменной хроматографии препаративного масштаба молекулярных подвидов FVIII, разделенных на смоле MonoQ. Элюирование в градиенте: 135-750 мМ хлорида натрия в 32 объемах колонки. Размеры колонки: внутренний диаметр 1,6 см × высота слоя 10,0 см, объем колонки 20,160 мл. Объем фракций: E1: 22,6 мл, E2: 31,5 мл, E3: 34,6 мл, E4: 43,7 мл, E5: 28,9 мл, E6:22,9 мл, E7: 26,1 мл, E8: 53,1 мл.
Фигура 25: Электрофорез в ПААГ в присутствии SDS для стадии препаративной анионообменной хроматографии для очистки молекулярных подвидов FVIII. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, L1) введение перед фильтрацией, L2) введение после фильтрации, FT) фильтрат, W1) стадия промывки 1, W2) стадия промывки 2, W3) стадия промывки 3, VB) пре-элюат, E1-E8) совокупность элюата 1-8, NE) пост-элюат 1, PE) пост-элюат 2.
Фигура 26: Хроматограмма фазы элюирования анионообменной хроматографии препаративного масштаба молекулярных подвидов FVIII, разделенных на смоле MonoQ. Элюирование в градиенте: 135-750 мМ хлорида натрия в 32 объемах колонки. Размеры колонки: внутренний диаметр 1,6 см × высота слоя 10,0 см, объем колонки 20,160 мл. Объем фракций: E1: 114,9 мл, E2: 24,0 мл, E3: 22,8 мл, E4: 83,6 мл.
Фигура 27: Электрофорез в ПААГ в присутствии SDS для стадии анионообменной хроматографии препаративного масштаба для очистки молекулярных подвидов FVIII. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, L1) введение перед фильтрацией, L2) введение после фильтрации, FT) фильтрат, W1) стадия промывки 1, W2) стадия промывки 2, фракции 1.E6-3.B5, PE) пост-элюат.
Фигура 28: Хроматограмма эксклюзионной хроматографии препаративного масштаба для очистки полноразмерной тяжелой цепи массой 180 кДа. Размеры колонки: внутренний диаметр 5,0 см × высота слоя 94,4 см, объем колонки 1853,54 мл. Объем фракции E1: 70,0 мл.
Фигура 29: Электрофорез в ПААГ в присутствии SDS для стадии эксклюзионной хроматографии препаративного масштаба для очистки полноразмерной тяжелой цепи массой 180 кДа, полученной посредством препаративной анионообменной хроматографии на MonoQ. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, фракции B5-D1.
Фигура 30: Хроматограмма фазы элюирования анионообменной хроматографии препаративного масштаба полноразмерной тяжелой цепи массой 180 кДа, концентрируемой на смоле SourceQ. Ступенчатое элюирование: 300 мМ хлорида натрия. Размеры колонки: внутренний диаметр 1,0 см × высота слоя 3,9 см, объем колонки 3,06 мл. Объем фракции E1: 6,98 мл.
Фигура 31: Электрофорез в ПААГ в присутствии SDS для стадии AIEX на SourceQ для концентрирования полноразмерной тяжелой цепи массой 180 кДа, полученной посредством эксклюзионной хроматографии препаративного масштаба, окрашивание серебром (слева) и вестерн-блоттинг FVIII (справа). M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, L) введение, SB) буфер для образцов, FT) фильтрат, W) фаза промывки, VE) пре-элюат, E1) совокупность элюата в разведении 1:198 (окрашивание серебром) и разведении 1:264 (вестерн-блоттинг FVIII), E2) совокупность элюата в разведении 1:66 (окрашивание серебром) и разведении 1:88 (вестерн-блоттинг FVIII), NE) пост-элюат.
Фигура 32: Сравнение характеристик (1) колонки для SEC небольшого масштаба Superdex 200 Increase (сплошная линия) и колонки для SEC препаративного масштаба Superdex 200 Prep Grade (длинная штриховая пунктирная линия). На обеих кривых показаны соответствующие фазы элюирования полноразмерной тяжелой цепи с молекулярной массой 180 кДа. Размеры колонки: (1) внутренний диаметр 1,0 см × высота слоя 30,0 см, объем колонки 23,56 мл, (2) внутренний диаметр 5,0 см × высота слоя 94,4 см, объем колонки 1853,54 мл.
Фигура 33: Хроматограмма эксклюзионной хроматографии препаративного масштаба для очистки укороченного фрагмента тяжелой цепи массой 150 кДа. Размеры колонки: внутренний диаметр 5,0 см × высота слоя 94,4 см, объем колонки 1853,54 мл. Объем фракций: C1: 15,80 мл, C2: 15,75 мл, C3: 15,74 мл, E2: 45,69 мл.
Фигура 34: Электрофорез в ПААГ в присутствии SDS для стадии эксклюзионной хроматографии препаративного масштаба для очистки укороченного фрагмента тяжелой цепи массой 150 кДа, полученного посредством препаративной анионообменной хроматографии на MonoQ. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, SB) буфер для образцов, фракции B7-D1.
Фигура 35: Хроматограмма фазы элюирования анионообменной хроматографии препаративного масштаба полноразмерной тяжелой цепи массой 150 кДа, концентрируемой на смоле SourceQ. Ступенчатое элюирование: 300 мМ хлорида натрия. Размеры колонки: внутренний диаметр 1,0 см × высота слоя 3,9 см, объем колонки 3,06 мл. Объем фракции E1: ~7,5 мл.
Фигура 36: Электрофорез в ПААГ в присутствии SDS стадии AIEX на SourceQ для концентрирования укороченного фрагмента тяжелой цепи массой 150 кДа, полученного посредством эксклюзионной хроматографии препаративного масштаба, окрашивание серебром (слева) и вестерн-блоттинг FVIII (справа). M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, L) введение, SB) буфер для образцов, FT) фильтрат, W) фаза промывки, VE) пре-элюат, E1) совокупность элюата в разведении 1:120 (окрашивание серебром) и разведении 1:160 (вестерн-блоттинг FVIII), E2) совокупность элюата в разведении 1:40 (окрашивание серебром) и разведении 1:53 (вестерн-блоттинг FVIII), NE) пост-элюат.
Фигура 37: Хроматограмма эксклюзионной хроматографии препаративного масштаба для очистки укороченного фрагмента тяжелой цепи массой 110 кДа. Размеры колонки: внутренний диаметр 5,0 см × высота слоя 94,4 см, объем колонки 1853,54 мл. Объем фракций: B10-C1: 140 мл, C2-C3: 70 мл, C4: 35 мл, C5: 35 мл, C6: 35 мл, C7-C8: 70 мл.
Фигура 38: Электрофорез в ПААГ в присутствии SDS для стадии эксклюзионной хроматографии препаративного масштаба для очистки укороченного фрагмента тяжелой цепи массой 110 кДа, полученного посредством препаративной анионообменной хроматографии на MonoQ. M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, фракции B9-C10.
Фигура 39: Хроматограмма фазы элюирования анионообменной хроматографии препаративного масштаба полноразмерной тяжелой цепи массой 110 кДа, концентрируемой на смоле SourceQ. Ступенчатое элюирование: 300 мМ хлорида натрия. Размеры колонки: внутренний диаметр 1,0 см × высота слоя 3,9 см, объем колонки 3,06 мл. Объем фракции E1: 7,20 мл.
Фигура 40: Электрофорез в ПААГ в присутствии SDS для стадии AIEX на SourceQ для концентрирования укороченного фрагмента тяжелой цепи массой 110 кДа, полученного посредством эксклюзионной хроматографии препаративного масштаба, окрашивание серебром (слева) и вестерн-блоттинг FVIII (справа). M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, L) введение, FT) фильтрат, W) фаза промывки, VE) пре-элюат, E1) совокупность элюата в разведении 1:147 (окрашивание серебром) и разведении 1:196 (вестерн-блоттинг FVIII), E2) совокупность элюата в разведении 1:49 (окрашивание серебром) и разведении 1:65 (вестерн-блоттинг FVIII), NE) пост-элюат.
Фигура 41: Хроматограмма фазы элюирования анионообменной хроматографии препаративного масштаба полноразмерной тяжелой цепи массой 90 кДа, концентрируемой на смоле SourceQ. Ступенчатое элюирование: 300 мМ хлорида натрия. Размеры колонки: внутренний диаметр 1,0 см × высота слоя 8,9 см, объем колонки 7,0 мл. Объем фракции E1: 18,37 мл.
Фигура 42: Электрофорез в ПААГ в присутствии SDS для стадии AIEX на SourceQ для концентрирования фрагмента тяжелой цепи без B-домена 90 кДа массой, полученного посредством эксклюзионной хроматографии препаративного масштаба, окрашивание серебром (слева) и вестерн-блоттинг FVIII (справа). M) маркер молекулярной массы, AS) стандарт коммерчески доступного лекарственного средства FVIII, содержащий все соответствующие виды тяжелых и легких цепей, SB) буфер для образцов L) введение, FT) фильтрат, W) фаза промывки, E1) совокупность элюата в разведении 1:99 (окрашивание серебром) и разведении 1:132 (вестерн-блоттинг FVIII), E2) совокупность элюата в разведении 1:33 (окрашивание серебром) и разведении 1:44 (вестерн-блоттинг FVIII), NE) пост-элюат.
Фигура 43: Обобщение способа препаративной очистки молекулярных подвидов FVIII. Слева направо: полноразмерный фрагмент тяжелой цепи массой 180 кДа, укороченный фрагмент тяжелой цепи массой 150 кДа, укороченный фрагмент тяжелой цепи массой 110 кДа, фрагмент тяжелой цепи без B-домена массой 90 кДа.
Фигура 44: Гетерогенность и молекулы FVIII. (Слева) Окрашенный серебром гель ПААГ с SDS с FL-rFVIII (1), pdFVIII (2), очищенный вид rFVIII B70-rFVIII (3), B20-rFVIII (4), BDD-rFVIII (5) и (справа) архивные партии FL-rFVIII, полученные в 2005 году (1), 2007 году (2), 2008 году (3), 2012 году (4), 2013 году (5), 2014 году (6) и 2015 году (7); HC, тяжелая цепь; LC, легкая цепь; Mm, неокрашенный белковый стандарт Precision Plus (Bio-Rad).
Фигура 45: Агрегация rFVIII при повышенной температуре. Термически индуцированные агрегаты FL-rFVIII (точечная пунктирная линия), B70-rFVIII (точечная и короткая штриховая пунктирная линия), B20-rFVIII (короткая штриховая пунктирная линия) и BDD-rFVIII (сплошная линия) анализировали посредством DLS. На вклейке изображены соответствующие образцы, анализируемые посредством ВЭЖХ-SEC.
Фигура 46: Пути образования олигомеров и агрегатов rFVIII. FL-rFVIII (точечная пунктирная линия, C), B70-rFVIII (точечная и короткая штриховая пунктирная линия), B20-rFVIII (короткая штриховая пунктирная линия), BDD-rFVIII (сплошная линия, D) и pdFVIII (штрихпунктирная линия с двумя точками и короткая штриховая пунктирная линия, E) инкубировали при 45°C в течение 24 часов. Количество олигомеров (A), агрегатов (B) и мономеров (F) непрерывно анализировали посредством ВЭЖХ-SEC и строили его график относительно времени инкубации.
Фигура 47: Связывание флуоресцентного красителя ThT с олигомерами и агрегатами FVIII. Способность ThT связываться с белковыми олигомерами и агрегатами выражают как соотношение флуоресцентных сигналов при возбуждении при 440 и 280 нм после 24 ч. инкубации при 45°C. n=2-4, планками погрешностей указаны значения SD.
Фигура 48: Гомологичная инициация агрегации rFVIII. Затравку получали посредством инкубации BDD-rFVIII, B70-rFVIII и FL-rFVIII в течение 2, 5, 8 или 18 ч. при 45°C. Образцы BDD-rFVII (A), B70-rFVIII (B) и FL-rFVIII (C) смешивали в соотношении 1:1 с соответствующей уже образовавшейся затравкой и инкубировали при 45°C в течение 24 ч. Количество олигомеров (левые панели) и агрегатов (правые панели) непрерывно анализировали посредством ВЭЖХ-SEC и строили его график относительно времени инкубации.
Фигура 49: Образование белка, содержащего невидимые невооруженным глазом частицы. Образцы FVIII (0,244 мкМ) подвергали встряхиванию и воздействию напряжения сдвига, а затем анализу частиц на основе проточной цитометрии. Статистические различия определяли с использованием непарного t-критерия Стьюдента. Определяли, что концентрации белковых частиц значимо отличаются для BDD-rFVIII по сравнению с FL-rFVIII (P=0,0002) и pdFVIII (P=0,0010), а также B20-rFVIII по сравнению с FL-rFVIII (P<0,0001) и pdFVIII (P<0,0001); n=4-6, планками погрешностей указаны значения SD.
Фигура 50: Схематическая модель образования олигомеров и агрегатов после подвергания rFVIII термическому стрессу. FL-rFVIII изображен в виде гетерогенной смеси видов rFVIII, но точное соотношение видов не отражено. Длиной стрелок указано различие скоростей олигомеризации и агрегации FL-rFVIII и BDD-rFVIII.
Фигура 51: Профили эксклюзионной хроматографии высокоочищенного pdFVIII, FL-rFVIII и очищенных молекул rFVIII в эквимолярных концентрациях (0,122 мкМ).
Фигура 52: Тепловая карта HDX-MS B70-rFVIII. Измеряли кинетику HDX-MS 120 пептидов после инкубации в течение 3 сек, 10 сек, 30 сек, 2 мин, 10 мин, 60 мин и 3 ч. Уровнями серого указан % включения дейтерия.
Фигура 53: Композиция агрегатов FL-rFVIII. Окрашенные серебром гели ПААГ с SDS нативного FL-rFVIII (1) и очищенные агрегаты FL-rFVIII (2); Mm, неокрашенный белковый стандарт Precision Plus (Bio-Rad).
Фигура 54: (A) Одностадийная активность свертывания FVIII. Серой линией указан уровень активности SOS-E, представлявшего собой исходный материал для очистки видов FVIII. Образцы измеряли в двух параллелях. Планками погрешностей указаны значения SD. (B) Хромогенная активность FVIII. Серой линией указан уровень активности SOS-E, представлявшего собой исходный материал для очистки видов FVIII. Образцы измеряли в двух параллелях. Планками погрешностей указаны значения SD.
Фигура 55: Тромбиновый пик и время ожидания для видов FVIII. Серой линией указан уровень активности SOS-E, представлявшего собой исходный материал для очистки видов FVIII.
Фигура 56: Окрашенный серебром ПААГ с SDS с продуктами FVIII.
Фигура 57: Окрашенный серебром ПААГ с SDS с FL-rFVIII после обработки фурином. Гель NuPAGE размера миди с 3-8% Трис-ацетата (1,0 мм; 20 лунок, Invitrogen кат. № WG1602BOX). Образцы инкубировали 1:2 со снижением LDS-SB в течение 1 ч. при 37°C. Добавляли 20 мкл/100 мкл 750 мМ раствора йодацетамида. Гель прогоняли в течение 70 мин при 150 В (постоянном) и окрашивали серебром.
Фигура 58: Электрофорез FL-rFVIII в ПААГ с SDS и вестерн-блоттинг с антителом против FVIII после обработки фурином. Гель NuPAGE размера миди с 3-8% Трис-ацетата (1,0 мм; 20 лунок, Invitrogen кат. № WG1602BOX). Образцы инкубировали 1:2 со снижением LDS-SB в течение 1 ч. при 37°C. Добавляли 20 мкл/100 мкл 750 мМ раствора йодацетамида. Гель прогоняли в течение 70 мин при 150 В (постоянном). Вестерн-блоттинг: 1-ое антитело: антитело овцы против FVIII:C, 2-ое антитело: антитело осла против IgG овцы с ALP.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если ниже не указано иначе, термины, используемые в настоящем изобретении, следует понимать в соответствии с их распространенным значением, известным специалисту в этой области.
Все публикации, патенты и патентные заявки, процитированные в настоящем описании, включены в него, таким образом, в качестве ссылки в полном объеме для всех целей.
В рамках изобретения каждое упоминание термина "содержащий", необязательно, можно заменять термином "состоящий из".
В настоящем описании используют следующие сокращения:
Как показано на фигуре 2A, полноразмерный одноцепочечный фактор VIII (FVIII) содержит шесть основных доменов, обозначенных как A1, A2, B, A3, C1 и C2. Во время биосинтеза одноцепочечный FVIII расщепляется на две цепи, одну тяжелую цепь и одну легкую цепь. Наличие различных положений расщепления на всем протяжении одноцепочечного FVIII приводит к образованию четырех вариантов тяжелой цепи и двух вариантов легкой цепи: полноразмерного варианта тяжелой цепи (180 кДа), укороченных вариантов тяжелой цепи (150 кДа и 110 кДа) и варианта тяжелой цепи без B-домена (90 кДа), стандартной легкой цепи (80 кДа) и удлиненной легкой цепи (120 кДа). В настоящем описании варианты тяжелой цепи, главным образом, будут обозначать как тяжелую цепь FVIII массой 180 кДа или B100-FVIII, тяжелую цепь FVIII массой 150 кДа или B70-FVIII, тяжелую цепь FVIII массой 110 кДа или B20-FVIII и тяжелую цепь FVIII массой 90 кДа или BDD-FVIII. Связывание одного из этих вариантов тяжелой цепи с одной из легкой цепей приводит к образованию гетерогенных подвидов FVIII, каждый из которых содержит одну тяжелую и одну легкую цепь.
В рамках изобретения термин "композиция, содержащая FVIII" относится к композиции, где все FVIII определяют следующим образом. Если не указано иначе, в рамках изобретения термин "фактор VIII" или "FVIII" относится к природно процессируемому FVIII, содержащему несколько гетерогенных подвидов FVIII. Однако, даже после природного процессинга FVIII может содержать остаточный одноцепочечный (т.е. нерасщепленный) FVIII (см. ниже). Если природный процессинг неэффективен, FVIII даже может содержать, главным образом, одноцепочечный FVIII. Таким образом, в рамках изобретения термин "фактор VIII" или "FVIII" также относится к природно процессируемому FVIII, содержащему остаточный одноцепочечный FVIII или даже, главным образом, одноцепочечный FVIII.
Как известно специалисту в этой области, термин "полноразмерный rFVIII" в рамках изобретения относится к rFVIII, экспрессирующемуся с полноразмерной кДНК FVIII. Как описано выше, полноразмерный rFVIII состоит из гетерогенной смеси подвидов rFVIII.
Как известно специалисту в этой области, молекулярные массы различных тяжелых цепей FVIII, т.е. 180 кДа, 150 кДа, 110 кДа и 90 кДа, а также молекулярные массы легких цепей FVIII, т.е. 80 кДа и 120 кДа, являются "кажущимися молекулярными массами", как видно на ПААГ с SDS. При необходимости, специалисту в этой области будет известно, как можно вычислять "истинные молекулярные массы" с учетом известных аминокислотных последовательностей отдельных тяжелых и легких цепей FVIII.
Как будет понятно специалисту в этой области, в рамках изобретения термин "одноцепочечный FVIII", как правило, относится к нерасщепленному FVIII. Единая цепь может содержать все домены фактора VIII, как показано на фигуре 2A. Однако, также можно получать FVIII, в котором отсутствуют некоторые домены, один домен или часть домена, присутствующие в полноразмерном FVIII. В этом случае термин "одноцепочечный FVIII" все равно относится к нерасщепленному продукту FVIII, в котором отсутствуют некоторые домены, один домен или часть домена, соответственно.
Как будет понятно специалисту в этой области, в способе очистки подвидов FVIII по настоящему изобретению композиция, содержащая FVIII, предпочтительно, является раствором, хотя композиция также может являться твердой, растворяемой перед осуществлением способа по настоящему изобретению. Как описано выше, внутриклеточное образование FVIII, как правило, приводит к образованию ряда гетерогенных активных подвидов FVIII. Таким образом, как будет понятно специалисту в этой области, композиция, содержащая FVIII, содержит несколько подвидов FVIII.
В рамках изобретения термин "массовое соотношение" относится к соотношению масс. Например, массовое соотношение очищенных подвидов FVIII в композиции и всех других подвидов FVIII в композиции вычисляют, разделяя массу очищенных подвидов FVIII в композиции на массу всех других подвидов FVIII в композиции.
Как будет понятно специалисту в этой области, способ очистки подвидов FVIII по настоящему изобретению относится к повышению массового соотношения подвидов FVIII и всех других подвидов FVIII, содержащихся в композиции. Композиция, содержащая FVIII, используемый в качестве исходного материала для способа по настоящему изобретению, может содержать иной буфер и иметь иной объем, чем композиция, содержащая очищенные подвиды FVIII, после осуществления способа по настоящему изобретению. Несмотря на это, для оценки повышения массового соотношения (т.е. для оценки очистки) посредством осуществления способа по настоящему изобретению массу подвидов FVIII определяют в композиции, содержащей FVIII и используемой в качестве исходного материала для способа по настоящему изобретению, и в композиции после осуществления способа по настоящему изобретению. Кроме того, массу всех других подвидов определяют в композиции, содержащей FVIII и используемой в качестве исходного материала для способа по настоящему изобретению, и в композиции после осуществления способа по настоящему изобретению. Затем можно вычислять массовое соотношение подвидов FVIII и всех других подвидов FVIII в композиции, содержащей FVIII, используемый в качестве исходного материала для способа по настоящему изобретению, и в композиции после осуществления способа по настоящему изобретению, и можно определять повышение массового соотношения.
Для определения массового соотношения подвидов FVIII и всех других подвидов FVIII в композиции массу подвидов FVIII определяют посредством обращенно-фазовой ВЭЖХ C4, как описано ниже. Как будет понятно специалисту в этой области, с использованием обращенно-фазовой ВЭЖХ C4 определяют площади под кривой и, таким образом, концентрации подвидов FVIII в композиции (см. ниже). В растворе с указанным объемом соотношение концентрации подвидов FVIII и концентрации всех других подвидов FVIII равно массовому соотношению подвидов FVIII и всех других подвидов FVIII. Таким образом, в настоящем изобретении соотношение площадей под кривой и, таким образом, соотношение концентраций используют для оценки повышения массового соотношения подвидов FVIII и всех других подвидов FVIII, содержащихся в композиции.
Как указано выше, подвиды FVIII, как правило, содержат одну тяжелую цепь и одну легкую цепь, соединенные друг с другом. Таким образом, в способе очистки подвидов FVIII по настоящему изобретению композиция, содержащая FVIII и используемая в качестве исходного материала, и композиция, содержащая очищенные подвиды FVIII после осуществления способа по настоящему изобретению, предпочтительно, содержат подвиды FVIII, состоящие из одной тяжелой цепи и одной легкой цепи. Однако, также возможно, что тяжелая цепь FVIII и легкая цепь FVIII диссоциируют до или во время осуществления способа по настоящему изобретению. Таким образом, в альтернативном варианте осуществления способа по настоящему изобретению после осуществления способа по настоящему изобретению очищенные подвиды FVIII содержат одну тяжелую цепь, но не содержат легкую цепь. В таком варианте осуществления композиция, содержащая FVIII и используемая в качестве исходного материала для способа по настоящему изобретению, может содержать один или более подвидов FVIII, состоящих из одной тяжелой цепи, но не содержащих легкую цепь, или из одной тяжелой цепи, соединенной с одной легкой цепью. Разумеется, если композиция, содержащая FVIII, используемый в качестве исходного материала для способа по настоящему изобретению, содержит подвиды FVIII, состоящие из одной тяжелой цепи, но не содержащие легкую цепь, диссоциировавшие легкие цепи все равно могут присутствовать в композиции.
В настоящем описании термин "вид FVIII", как правило, используют в качестве эквивалента термина "подвид FVIII". Однако специалисту в этой области будет очевидно, что иногда в рамках изобретения термин "вид FVIII" также может относиться к одной тяжелой или легкой цепи FVIII.
Как будет понятно специалисту в этой области, отдельные стадии способа по настоящему изобретению можно повторять до перехода к следующей стадии. В таком варианте осуществления растворы (например, хроматографические элюаты), полученные при каждом повторении одной и той же стадии, можно объединять, а затем использовать в качестве исходного материала для следующей стадии.
Предпочтительно, FVIII по настоящему изобретению является FVIII человека, и подвиды FVIII, подлежащие очистке, являются подвидами FVIII человека.
Предпочтительно, FVIII по настоящему изобретению является рекомбинантным FVIII, и подвиды FVIII, подлежащие очистке, являются подвидами рекомбинантного FVIII. Однако, также возможно, что FVIII по настоящему изобретению является полученным из плазмы (pd)FVIII, и что подвиды FVIII, подлежащие очистке, являются подвидами полученного из плазмы (pd)FVIII.
По существу, любую композицию, содержащую фактор VIII, можно использовать в качестве исходного материала для осуществления способа очистки подвидов фактора VIII по настоящему изобретению.
Например, в способе по настоящему изобретению можно использовать рекомбинантный антигемофильный фактор VIII ADVATE человека (Baxalta) или нерасфасованное лекарственное вещество (BDS) ADVATE. ADVATE альтернативно обозначают как октоког альфа, и дополнительную информацию о ADVATE можно найти, например, в Keating et al. (Keating et al., 2012; включенной в настоящее описание в полном объеме). Во время производства ADVATE рекомбинантный FVIII секретируется посредством везикулярного транспорта и, таким образом, обогащен в ферментационном супернатанте. После очистки совокупность продукта rFVIII подвергают глубокой заморозке при -80°C, и ее будут обозначать в настоящем описании как нерасфасованное лекарственное вещество (BDS) ADVATE. Примечательно, что ADVATE/BDS ADVATE содержит ряд гетерогенных подвидов FVIII.
Альтернативно, в качестве исходного материала в способе по настоящему изобретению можно использовать элюаты, такие как SOS-E. SOS-E получают как BDS ADVATE, описанное выше, но без конечной стадии очистки.
Альтернативно, в качестве исходного материала в способе по настоящему изобретению можно использовать другие композиции, содержащие полноразмерный FVIII (FL-FVIII) человека. Примечательно, что, как описано выше, во время биосинтеза одноцепочечный FVIII процессируется на разные тяжелые и легкие цепи. Таким образом, FL-FVIII, который можно использовать в качестве исходного материала для способа по настоящему изобретению, как правило, содержит ряд гетерогенных подвидов FVIII, каждый из которых содержит одну тяжелую и одну легкую цепь.
В способе по настоящему изобретению обработка протеазой фурином композиции, содержащей фактор VIII, улучшает разделение подвидов фактора VIII во время хроматографии, что приводит к получению композиции, содержащей указанные подвиды фактора VIII даже с более высокой чистотой и концентрацией. Обработку фурином осуществляют, как известно специалисту в этой области. Например, обработку фурином можно осуществлять посредством смешивания композиции, содержащей FVIII, с фурином или нанесения композиции, содержащей FVIII, на колонку, содержащую фурин. Например, фурин можно иммобилизовать в колонке, а затем композицию, содержащую FVIII, можно наносить на колонку. Альтернативно, FVIII можно связывать с колонкой, а затем можно наносить фурин на колонку. В настоящем изобретении, при обработке FVIII, содержащегося в композиции, протеазой фурином конечная концентрация фурина, предпочтительно, составляет более 100 МЕ/мл. В рамках изобретения термин "конечная концентрация" относится к концентрации фурина во время инкубации композиции, содержащей FVIII, с фурином, т.е. после смешивания композиции, содержащей FVIII, с фурином.
Во время обработки протеазой фурином основная часть удлиненной легкой цепи FVIII (120 кДа), которая может содержаться в FVIII-содержащей композиции, расщепляется с образованием стандартной легкой цепи (80 кДа). Таким образом, если способ по настоящему изобретению включает обработку протеазой фурином, очищенные подвиды FVIII, предпочтительно, содержат легкую цепь FVIII массой 80 кДа и почти не содержат легкую цепь FVIII массой 120 кДа. Термин "почти не содержат легкую цепь FVIII массой 120 кДа" относится к массе легкой цепи FVIII массой 120 кДа менее 5%, предпочтительно - менее 1% от общей массы всей легкой цепи FVIII в очищенных подвидов FVIII.
В способе по настоящему изобретению для очистки подвидов FVIII осуществляют несколько стадий хроматографии. Каждая из этих стадий хроматографии включает "сбор элюата, содержащего указанные подвиды FVIII". В рамках изобретения термин "сбор элюата, содержащего указанные подвиды FVIII", как правило, означает, что собирают лишь фракцию элюата, т.е. фракцию, содержащую подвиды FVIII, подлежащие очистке. Указанная фракция, содержащая подвиды FVIII, подлежащие очистке, может не содержать все из подвидов FVIII, подлежащих очистке и присутствующих в элюате. Скорее фракцию, содержащую подвиды FVIII, подлежащие очистке, выбирают так, чтобы она содержала максимальное количество подвидов FVIII, подлежащих очистке, но при этом минимальное количество других подвидов FVIII. Специалисту в этой области будут известны различные способы выбора фракции, содержащей максимальное количество подвидов FVIII, подлежащих очистке, но при этом минимальное количество других подвидов FVIII. Например, можно собирать элюат в ряд отдельных аликвот разного объема. Затем можно определять концентрацию подвидов FVIII, подлежащих очистке, и концентрацию всех других подвидов FVIII в каждой аликвоте известными способами, такими как спектрофотометрическое определение концентрации белка, электрофорез в полиакриламидном геле с окрашиванием серебром и/или вестерн-блоттингом или хроматография. И наконец, аликвоты, содержащие наибольшие количества подвидов FVIII, подлежащих очистке, но при этом наименьшие количества других подвидов FVIII, можно выбирать в качестве фракции, содержащей подвиды FVIII, подлежащие очистке. Эти аликвоты можно объединять и использовать в качестве элюата, содержащего подвиды FVIII по настоящему изобретению.
Как будет понятно специалисту в этой области, способ выбора аликвот, содержащих наибольшие количества подвидов FVIII, подлежащих очистке, но при этом наименьшие количества других подвидов FVIII, будет влиять на чистоту и концентрацию очищенных подвидов FVIII, полученных способом по настоящему изобретению. Например, любое исключение аликвот, содержащих подвиды FVIII, подлежащие очистке, из элюата, содержащего подвиды FVIII по настоящему изобретению, будет приводить к снижению концентрации очищенных подвидов FVIII, полученных способом по настоящему изобретению. Кроме того, включение аликвот, содержащих значительные количества других подвидов FVIII, будет снижать чистоту очищенных подвидов FVIII, полученных способом по настоящему изобретению. Таким образом, в зависимости от желаемой концентрации и чистоты очищенных подвидов FVIII, полученных способом по настоящему изобретению, специалист в этой области может определять, какие аликвоты необходимо выбрать в качестве фракции, содержащей подвиды FVIII, подлежащие очистке.
Как будет понятно специалисту в этой области, после того, как элюат, содержащий подвиды FVIII, подлежащие очистке, однократно или ограниченное количество раз подвергали определению способом по настоящему изобретению, способ можно повторять без определения элюата, содержащего подвиды FVIII, подлежащие очистке. В таком варианте осуществления элюат, содержащий подвиды FVIII, подлежащие очистке, выбирают с учетом предшествующего определения элюата, содержащего подвиды FVIII, подлежащие очистке, и собирают этот же элюат. Разумеется, даже если способ по настоящему изобретению осуществляют без определения элюата, содержащего подвиды FVIII, подлежащие очистке, выбор фракции, содержащей максимальное количество подвидов FVIII, подлежащих очистке, но при этом минимальное количество других подвидов FVIII, можно подвергать мониторингу, например, с использованием хроматограмм.
Способ очистки подвидов FVIII по настоящему изобретению включает несколько стадий хроматографии. Как известно специалисту в этой области, существуют разные режимы осуществления хроматографии в способах по настоящему изобретению. Например, очистку образцов, содержащих только один или два продукта с немногочисленными примесями и очень разными характеристиками на соответствующей смоле можно осуществлять с использованием режима изократического элюирования или ступенчатого элюирования в градиенте, и результаты могут показаться достаточными. В то время как изократическое элюирование осуществляют с использованием неизменной смеси элюентов на всем протяжении фазы элюирования, при ступенчатом элюировании постепенно увеличивается фракция одного элюента.
Как указано выше, композиция типичного полноразмерного рекомбинантного FVIII является очень гетерогенной, т.к. она содержит все возможные фрагменты тяжелой цепи и легкой цепи. Кроме того, все подвиды демонстрируют более или менее схожие характеристики, т.к. их получают из одной и той же одноцепочечной молекулы. Таким образом, как правило, изократические элюирование не приводит к удовлетворительным результатам. Предпочтительно, способом для очистки подвидов FVIII в соответствии со способами по настоящему изобретению является элюирование в линейном градиента. Далее приведено краткое неограничивающее описание, включающее общий принцип элюирования в линейном градиенте, а также преимущества и недостатки по сравнению с другими типами элюирования (также см. фигуру 3).
В отличие от режима изократического элюирования, относительные количества двух элюентов при элюировании в линейном градиенте варьируются с течением времени. Элюирование в линейном градиенте зачастую начинают с низкого процента сильного элюента. Затем его количество непрерывно повышают, таким образом, снижая фракцию слабого элюента. Таким образом, усиливают приводящее к элюированию свойство фазы элюента, например, полярность при ионообменной хроматография, с течением времени. Длина и угол наклона градиента обратно пропорциональны друг другу. Чем круче наклон, тем меньше длина градиента и, таким образом, фаза элюирования. Длину градиента чаще всего выражают как величину, кратную объему колонки. Угол наклона градиента оказывает значительное влияние на характеристики элюирования. Вещества со слабыми аффинностями будут элюировать в начале градиента, в то время как для веществ с сильными аффинностями необходимы большие количества сильного элюента для разрыва их связи с неподвижной фазой.
Элюирование в линейном градиенте преимущественно подходит для смесей схожих молекул. В отличие от других типов элюирования, режим линейного элюирования охватывает весь диапазон условий. Это приводит к тому, что в определенный момент времени обеспечивают соответствующие условия элюирования некоторой молекулы. Даже если две молекулы демонстрируют значительное сходство, их различия вызывают по меньшей мере немного разные характеристики элюирования. Сглаживание угла наклона градиента может помочь разрешить эти два вещества по меньшей мере частично посредством элюирования более слабого связывающего вещества, в то время как вещество с высокой аффинностью остается связанным. В основном, это делает элюирование в линейном градиенте очень надежным способом с множеством областей использования. Но сглаживание углов наклона градиента имеет свои недостатки. Чем более гладкий градиент, тем больше подвижной фазы проходит через колонку, таким образом, приводя к большим общим объемам. Это увеличивает длительность элюирования конкретного вещества, и для этого необходимо больше элюата, что, таким образом, делает вещество более разведенным в конечной фракции элюата. На хроматограмме наблюдают так называемое размывание пика. И наоборот, с помощью линейных градиентов также можно минимизировать размывание пика по сравнению с изократическим элюированием. Изократическое элюирование может вызывать элюирование молекул в больших диапазонах в форме широких пиков. Если характеристики элюирования известны, можно использовать более крутой линейный градиент для ускорения элюирования отдельных веществ. Получаемые пики являются более острыми, и фракции элюата являются более концентрированными.
Различные стадии хроматографии в способах по настоящему изобретению осуществляют, как известно специалисту в этой области. Далее описаны предпочтительные варианты осуществления разных стадий хроматографии, осуществляемых в способах по настоящему изобретению. Однако изобретение не ограничено этими вариантами осуществления.
Как будет понятно специалисту в этой области, способы по настоящему изобретению можно осуществлять в небольшом масштабе или в крупном (т.е. препаративном) масштабе. В небольшом масштабе способы можно осуществлять в различных условиях для определения оптимальных условий, которые затем можно использовать в крупном масштабе. Ниже приведены условия, которые авторы настоящего изобретения нашли особенно подходящими. Однако изобретение ими не ограничено.
Перед всеми хроматографическими опытами по настоящему изобретению хроматографическую систему можно обрабатывать 1 M гидроксида натрия, 1 M уксусной кислоты и, наконец, MilliQ для очистки. Кроме того, насосы системы и насос для образца можно продувать для удаления запертого воздуха из корпуса насоса. И наконец, все входные отверстия можно промывать соответствующими буферами.
Первая стадия хроматографии в способах по настоящему изобретению:
В способе очистки подвидов фактора VIII по настоящему изобретению первая стадия хроматографии является стадией анионообменной хроматографии. Авторы настоящего изобретения неожиданно обнаружили, что ее высокое разрешение обеспечивает высокую разделяющую способность.
В небольшом масштабе можно осуществлять несколько опытов с использованием смол MonoQ в разных условиях для оценки наиболее подходящей комбинации параметров. Такие опыты можно осуществлять, например, с помощью систем  Avant 25 или
Avant 25 или  Pure 25 при 4°C с использованием колонки MonoQ небольшого масштаба с объемом колонки 0,982 мл. Таким образом, достигают приблизительного разделения подвидов FVIII.
Pure 25 при 4°C с использованием колонки MonoQ небольшого масштаба с объемом колонки 0,982 мл. Таким образом, достигают приблизительного разделения подвидов FVIII.
Как будет понятно специалисту в этой области, для (первой) стадии анионообменной хроматографии в способах по настоящему изобретению можно использовать стандартную буферную систему MonoQ и стандартные условия. Примеры буферов MonoQ, которые можно использовать в способах по настоящему изобретению, приведены в таблице 9. Исходный материал может представлять собой композицию, содержащую FL-rFVIII, например, композицию, обозначенную как элюат SourceS (SOS-E). SOS-E элюируют в условиях с высокой ионной силой и хранят при <-60°C. Во избежание утраты активности исходный материал, предпочтительно, медленно размораживают при комнатной температуре. Затем нативный образец можно разводить с коэффициентом разведения 4 буфером с низкой ионной силой, например, буфером QA1. Это в достаточной степени снижает электропроводность и, таким образом, делает возможным связывание продукта со смолой MonoQ. Раствор образца в конечном итоге можно стерилизовать фильтрацией с использованием мембранного фильтра 0,2 мкм во избежание потенциальной контаминации или блокирования слоя колонки. В следующей таблице показан пример общей схемы хроматографии, включающей информацию о буферах, градиенте, скорости линейного потока и продолжительности обработки, а также объеме колонки и направлении потока для каждой хроматографической стадии.
Таблица 1: Пример схемы анионообменной хроматографии на MonoQ небольшого масштаба, где приведена информация об использованных буферах и растворах, параметрах входных отверстий, скорости линейного потока, времени удержания, используемом объеме колонки, направлении потока в колонке и параметрах выходных отверстий для каждой стадии. Соответствующий объем образца зависит от способа получения образца.
Далее описан примерный ("стандартный") вариант осуществления хроматографии в небольшом масштабе на первой стадии способа по настоящему изобретению. Как будет понятно специалисту в этой области, все условия представляют исключительно предпочтительные параметры и условия без ограничения изобретения. Кроме того, все указанные параметры и условия можно комбинировать с любыми другими указанными параметрами и условиями для осуществления первой стадии хроматографии способами по настоящему изобретению. Сначала колонку, предпочтительно, подвергают интенсивному уравновешиванию, состоящему из четырех отдельных стадий. Колонку промывают шестью объемами колонки буфера OC1, являющегося щелочным раствором с высокой ионной силой, с последующей стадией промывки ультрачистой водой для удаления буфера OC1 из колонки. Обработка буфером OC1 гарантирует, что все группы четвертичного аммония из смолы MonoQ соединяются с соответствующим противоионом, в этом случае являющимся одновалентным хлорид-ионом. Обмен ионов, подобных гидроксиду, возникающих при предшествующей консервации или любой другой оставшейся молекулы для хлорида, предпочтительно, происходит в щелочных условиях. Для подготовки колонки к конечной композиции буфера смолу можно уравновешивать пятью объемами колонки смеси 65% QA1 и 35% QB1. Оба являются 50 мМ буферами Трис, но отличаются концентрацией хлорида натрия. Кроме того, оба буфера содержат 5 мМ хлорида кальция и 0,1% полисорбата 80, необходимые для стабилизации белковой структуры и предотвращения адсорбции к отрицательно заряженным поверхностям, соответственно. Уже упомянутое соотношение буферов QA1 и QB1 приводит к молярности хлорида натрия приблизительно 260 мМ. Четвертую и фактическую стадию уравновешивания, предпочтительно, осуществляют исключительно с использованием буфера QA1. Т.к. она является последней стадией перед введением образца через колонку пропускают общий объем в десять объемов колонки для обеспечения низкой электропроводности и почти нейтрального pH, т.к. и то, и другое необходимо для связывания молекул FVIII со смолой. Образец можно подготавливать, как описано выше, а затем вводить в колонку с использованием насоса для образца и пневматического датчика. Нагрузка колонки составляет приблизительно 18500 МЕ/мл смолы MonoQ. Получаемый фильтрат можно собирать с помощью выходного клапана и использовать для дальнейшего анализа оставшегося несвязанного продукта. Раствор несвязанного образца можно удалить из колонки с помощью стадии промывки с использованием четырех объемов колонки буфера QA1. Минорные примеси можно удалять с помощью низких концентраций соли. Таким образом, предпочтительно, осуществляют две стадии промывки, обе десятью объемами колонки, с помощью 13% и 18% буфера QB1. Все эти стадии, описанные выше, можно осуществлять со скоростью линейного потока 35,71 см/ч., соответствующей продолжительности обработки 8,40 минут. Скорость потока во время элюирования в линейном градиенте, предпочтительно, снижают до 20,0 см/ч. и повышают концентрацию буфера QB1 с 18% до 100% за восемь объемов колонки. Это приводит к градиенту электропроводности, начинающемуся с 20 мСм/см и заканчивающемуся приблизительно 80 мСм/см. Этот уровень можно поддерживать еще пятью объемами колонки при почти той же скорости потока для удаления оставшихся, в конечном итоге, подвидов FVIII. Получаемое на всех трех стадиях промывки, а также стадиях элюирования в градиенте и линейного элюирования можно соединять в коллекторе фракций в подходящих объемах фракций для последующего забора проб. После завершения элюирования колонку необходимо регенерировать для удаления всех типов оставшихся веществ из смолы, в основном, белков и пептидов. Последовательность из MilliQ, 75% уксусной кислоты, MilliQ и 1 M гидроксида натрия, каждую стадия с пятью объемами колонки, предпочтительно, повторяют дважды и в конечном итоге завершают другой стадией промывки MilliQ. Поток является восходящим, т.к. предполагают, что связывание происходит в верхних областях колонки по причине значительной связывающей способности смолы MonoQ. Предела этой способности практически никогда нельзя достигнуть. Однако при нисходящем режиме в фазе регенерации будет происходить лишь транспорт примесей из одного участка связывания к следующему, пока он, наконец, не будет удален на выходе из колонки. В отличие от этого, в восходящем режиме примеси удаляют гораздо эффективнее. Кроме того, посредством очистки колонки предотвращают биологическую контаминацию бактериями или водорослями. Скорость линейного потока во время цикла регенерации зависит от соответствующего раствора. Максимальную скорость линейного потока 60,48 см/ч. используют только для MilliQ из-за ее низкой вязкости. 75% уксусная кислота является гораздо более вязкой и может вызывать проблемы с давлением в колонке. Для предотвращения этого ее поток можно замедлять до 19,05 см/ч., что представляет собой приблизительно треть от максимальной скорости потока. Стадии с использованием 1 M раствора гидроксида натрия, предпочтительно, осуществляют при промежуточных скоростях потока. Конечной стадией может являться консервация колонки. Смолы MonoQ хранят в 10 мМ растворе гидроксида натрия для поддержания ее стерильности или по меньшей мере предотвращения микробиологического обрастания. Колонку можно промывать пятью объемами колонки 10 мМ раствора гидроксида натрия в нисходящем режиме с промежуточной скоростью потока 38,10 см/ч.
На первой стадии хроматографии в соответствии со способами по настоящему изобретению предпочтительно увеличивать длину градиента в фазе элюирования. Авторы настоящего изобретения неожиданно обнаружили, что это усиливает разделение подвидов FVIII. Стандартную длину линейного градиента устанавливают на восемь объемов колонки, как описано выше. Получаемый градиент является относительно крутым и имеет небольшую продолжительность, т.к. электропроводность достигает своего целевого значения всего за восемь объемов колонки. Удвоение длины градиента до 16 объемов колонки приводит к в два раза более сглаженному повышению электропроводности. Сама буферная система и другие фазы не требуют дополнительной модификации.
В предпочтительном варианте осуществления можно осуществлять созревание с помощью протеазы фуриан перед первой стадией хроматографии в способе по настоящему изобретению. Протеаза фурин, как правило, отвечает за расщепление пропептидов и незрелых белков до соответствующих активных форм. Авторы настоящего изобретения неожиданно обнаружили, что инкубация образца с некоторым количеством активного фурина приводит к снижению гетерогенности и, таким образом, к разным характеристикам во время элюирования. Таким образом, предпочтительно включать созревание в стандартное получение образца. В таком варианте осуществления нативный образец можно разводить с коэффициентом разведения 2, например, буфером QA1 комнатной температуры, для снижения его ионной силы и повышения температуры раствора. И то, и другое необходимо для того, чтобы фермент проявил правильную функцию и активность. Затем можно добавлять некоторое количество раствора фермента таким образом, чтобы концентрация в этот момент составила по меньшей мере 100 МЕ/мл разведенного раствора образца. После инкубации, например, по меньшей мере в течение четырех часов при комнатной температуре, можно осуществлять другую стадию разведения (1:2) холодным буфером QA1 для прекращения ферментативной реакции и для дальнейшего снижения электропроводности образца. Обе стадии разведения могут соответствовать общему коэффициенту разведения 4. В конечном итоге раствор образца можно фильтровать через стерильную капсулу фильтра 0,2 мкм для удаления твердых частиц и предотвращения повреждения колонки. В дополнение к обработке протеазой фурином, предпочтительно использовать подход увеличения длины градиента, как описано выше. Можно сохранять длину градиента в 16 объемов колонки для фазы элюирования.
В дополнительном варианте осуществления первой стадии хроматографии в соответствии со способами по настоящему изобретению достигают разделения подвидов FVIII посредством дальнейшего увеличения длины градиента и использования этиленгликоля в качестве добавки в фазе элюирования. Схема хроматографии может являться, по существу, идентичной схеме, приведенной в таблице 1, за исключением длины градиента и композиция буфера. Обработанный протеазой фурином и разведенный образец можно вводить в колонку, а затем осуществлять промывку четырьмя объемами колонки исходного буфера QA1. Следующие две стадии промывки можно осуществлять с использованием буферов QA1 и QB1, содержащих этиленгликоль. Затем можно осуществлять элюирование, повышая процентную долю содержащего этиленгликоль буфера QB1 с 18% до 100% с длиной градиента, повышенной до 32 объемов колонки. С помощью увеличенной длины градиента дополнительно расширяют распределение пиков подвидов FVIII. Этиленгликоль снижает электропроводность буферов во время элюирования. Его можно добавлять для повышения разрешения, используя гидрофобные свойства целевых белков.
Далее описывают пример того, как можно осуществлять крупномасштабную (препаративную) хроматографию на первой стадии способа по настоящему изобретению. Как будет понятно специалисту в этой области, все условия представляют собой исключительно предпочтительные параметры и условия, не ограничивающие изобретение. Кроме того, все указанные параметры и условия можно комбинировать с любыми другими указанными параметрами и условиями для осуществления первой стадии хроматографии способами по настоящему изобретению. Препаративную анионообменную хроматографию в качестве первой стадии крупномасштабной очистки подвидов FVIII можно осуществлять с помощью колонки с MonoQ препаративного масштаба с использованием объема колонки приблизительно 20 мл. Дополнительная информация, касающаяся смолы MonoQ и соответствующей конструкции колонки, приведена ниже. Препаративные опыты можно осуществлять в условиях, схожих с описанными выше. Таким образом, предпочтительные варианты осуществления, описанные для опытов небольшого масштаба, также являются предпочтительными вариантами осуществления препаративных опытов. Несмотря на это, некоторые параметры, оцениваемые как полезные, предпочтительно, воплощены в примере схемы хроматографии для препаративных опытов с MonoQ, что представлено в следующей таблице.
Выход 6
Таблица 2: Пример схемы анионообменной хроматографии на MonoQ препаративного масштаба, где приведена информация об использованных буферах и растворах, параметрах входных отверстий, скорости линейного потока, времени удержания, используемом объеме колонки, направлении потока в колонке и параметрах выходных отверстий для каждой стадии. Соответствующий объем образца зависит от способа получения образца.
Аналогично опытам в небольшом масштабе, SOS-E можно использовать в качестве исходного материала для препаративных опытов. Нагрузку колонки можно устанавливать на 20000 МЕ/мл смолы MonoQ. Предпочтительно, необходимое количество, соответствующее нагрузке колонки, медленно размораживают, а затем разводят, например, буфером QA1 комнатной температуры, с коэффициентом разведения 2. Созревание с помощью протеазы фурина можно осуществлять при уровне активности ≥100 МЕ/мл раствора разведенного образца, например, в течение по меньшей мере четырех часов при комнатной температуре. Подвергнутый созреванию с помощью фурина раствор образца можно снова разводить буфером QA1 с коэффициентом разведения 2, таким образом, что общее разведение составляет 1:4. В этот раз используемый буфер QA1, предпочтительно, охлаждают до 4°C для снижения активности фурина посредством снижения температуры раствора. Раствор образца в конечном итоге можно фильтровать через стерильный модуль фильтра 0,2 мкм при скорости потока 50 мл/мин с использованием перистальтического насоса и стерильных силиконовых трубок. Может иметь место различие в буферной композиции исходных материалов, например, по причине того, что их получают с помощью разных хроматографических стадий. Например, в настоящем изобретении очистка совокупности подвидов массой 90 кДа, обозначенных как F8_AD2_90кДа, делает необходимой разработку модифицированного способа получения образца. Если нет значения хромогенной активности, доступного для исходного материала без значительного количества иного белка, чем FVIII, активность можно приблизительно получать из концентрации белка с использованием приблизительной специфической активности 5000 МЕ/мг белка. Пример приведен ниже:

В этом случае 4000 МЕ/мл гораздо меньше верхнего предела нагрузки колонки 20000 МЕ/мл, таким образом, всю совокупность образца можно вводить в колонку за один опыт. Таким образом, образец можно размораживать, а затем разводить, например, буфером QA1 и буфером SA3 комнатной температуры, до достижения электропроводности 11 мСм/см и значения pH 6,5. Соотношение объема нативного образца, буфера QA1 и буфера SA3 составляет приблизительно 1:4:2,9. Это гарантирует схожие условия в отношении композиции буфера, электропроводности и значений pH, если начинают с элюата SourceS. Созревание с помощью фурина и стерилизацию фильтрацией, предпочтительно, не осуществляют, если материал уже пропустили через полный цикл очистки, и, таким образом, он должен быть уже очень чистым. Общие стадии хроматографии и буферы можно оставлять неизменными. Уравновешивание колонки можно начинать с шести объемов колонки щелочного буфера OC1 при скорости линейного потока 71,0 см/ч. Скорость линейного потока можно поддерживать до фазы элюирования в градиенте. Затем для удаления щелочного буфера OC1 в колонку можно вводить два объема колонки ультрачистой воды. Текущее уравновешивание колонки можно осуществлять аналогично стандартному способу. Сначала в колонку можно вводить пять объемов колонки смеси, содержащей 65% буфера QA1 и 35% буфера QB1, а затем десять объемов колонки буфера QA1 для достижения правильных условий на введения образца. Введение образца можно осуществлять посредством прямого введения в колонку с использованием насоса для образца и пневматического датчика. Проходящую жидкость можно собирать для дальнейшего анализа несвязавшихся компонентов образца. Затем несвязавшийся образец можно вымывать четырьмя объемами колонки буфера QA1. Слабо связывающиеся компоненты образца можно элюировать с помощью двух стадий промывки с использованием ступенчатых градиентов 13% и 18% QB1 в буфере QA1, соответственно. Обе имеют длину фазы в десять объемов колонки, и их можно осуществлять при скорости линейного потока 71,0 см/ч. При самом элюировании в линейном градиенте повышают количество элюирующего буфера QB1 с 18% до 100% в 32 объемах колонки. Предпочтительно, используют увеличенную длину градиента из-за результатов, полученных в опытах небольшого масштаба. Скорость потока во время фазы элюирования, предпочтительно, снижают до 40,0 см/ч. Еще пять объемов колонки буфера QB1 при скорости линейного потока 39,0 см/ч. предназначены для удаления белка, все еще связанного с колонкой. Регенерацию колонки можно осуществлять почти идентично стандартным фазам регенерации, описанным выше. Для предотвращения возникновения условий высокого давления при использовании раствора с низкой вязкостью, подобного ультрачистой воде, после раствора с высокой вязкостью, такого как 75% уксусная кислота, последующую фазу можно осуществлять с одним объемом колонки с более низкой скоростью линейного потока по сравнению с предшествующей фазой перед повышением скорости потока. Регенерацию колонки можно осуществлять в восходящем режиме. В конечном итоге колонку можно хранить в 10 мМ растворе гидроксида натрия. Препаративные опыты с MonoQ можно осуществлять с помощью систем  Pure 150. Получаемое во всех фазах, начиная с введения образца и заканчивая фазой линейного элюирования, можно собирать с помощью разных выходных отверстий и коллектора фракций. Получаемое в первой части и в конце фазы элюирования в линейном градиенте можно объединять в выходных положениях, в то время как получаемое в диапазоне, в котором продукт в конечном итоге элюируют, предпочтительно, собирают в небольших фракциях с помощью коллектора фракций для последующего объединения.
Pure 150. Получаемое во всех фазах, начиная с введения образца и заканчивая фазой линейного элюирования, можно собирать с помощью разных выходных отверстий и коллектора фракций. Получаемое в первой части и в конце фазы элюирования в линейном градиенте можно объединять в выходных положениях, в то время как получаемое в диапазоне, в котором продукт в конечном итоге элюируют, предпочтительно, собирают в небольших фракциях с помощью коллектора фракций для последующего объединения.
Вторая стадия хроматографии в способах по настоящему изобретению:
Далее описывают пример того, как можно осуществлять хроматографию в небольшом масштабе на второй стадии способа по настоящему изобретению. Как будет понятно специалисту в этой области, все условия представляют собой исключительно предпочтительные параметры и условия, не ограничивающие изобретение. Кроме того, все указанные параметры и условия можно комбинировать с любыми другими указанными параметрами и условиями для осуществления второй стадии хроматографии в соответствии со способами по настоящему изобретению. Эксклюзионная хроматография в качестве второй стадии хроматографии в способах по настоящему изобретению служит в качестве стадии для дальнейшей очистки элюатов, полученных посредством анионообменной хроматографии на колонках с MonoQ. Ее также можно обозначать как заключительную стадию для удаления минорных примесей. Разработку общего способа эксклюзионной хроматографии можно осуществлять с использованием упакованной колонки Superdex Increaese 200 с высотой слоя 30 см и приблизительным объемом колонки 23,5 мл. Эксклюзионная хроматография основана на разных объемах геля, доступного для молекулы в зависимости от ее размера. Таким образом, смолы для SEC не несут каких-либо функциональных групп, связывающих или удерживающих целевой белок. Таким образом, необходимо иметь не специальный уравновешивающий или элюирующий буфер, а скорее буфер, служащий в качестве подвижного буфера во время фазы уравновешивания, введения образца и элюирования. Подвижный буфер для SEC, предпочтительно, состоит из 20% буфера QA1 и 80% буфера QB2 для достижения концентрации приблизительно 300 мМ хлорида натрия. Это является тем же диапазоном концентрации соли, в котором продукт, предпочтительно, элюируют из смол MonoQ. Общую схему хроматографии можно найти в таблице 3. Первую фазу уравновешивания используют для удаления 20% этанола, в котором как правило, хранят колонку. Таким образом, можно осуществлять промывку 1,5 объемами колонки MilliQ при 20,0 см/ч., что соответствует продолжительности обработки 90 минут. Затем колонку можно уравновешивать подвижным буфером для SEC в двух объемах колонки при скорости линейного потока 45,0 см/ч. Эта скорость также может являться скоростью потока по умолчанию для всех стадий, за исключением консервации колонки. Тестировали более высокие скорости потока, но они оказались неподходящими из-за условий высокого давления, которые они иногда вызывают. Рекомендуемые объемы образцов находятся в диапазоне от 25 мкл до 500 мкл для достижения удовлетворительных результатов разделения. Такие небольшие объемы образцов можно вводить с использованием петли-капилляра. Образец можно вымывать 1,5 объемами колонки подвижного буфера во время фазы элюирования, во время которой на самом деле происходит разделение. Этот объем собирают в небольших фракциях с использованием коллектора фракций. Затем колонку можно подвергать кратковременной фазе регенерации, включающей два объема колонки 0,5 M раствора гидроксида натрия и два объема колонки ультрачистой воды при скорости потока по умолчанию. В конечном итоге для консервации колонку можно промывать двумя объемами колонки 20% этанола при сниженной скорости линейного потока 20,0 см/ч.
Таблица 3: Пример схемы эксклюзионной хроматографии небольшого масштаба на смоле Superdex 200 Increase, где указана информация об используемых буферах и растворах, параметрах входных отверстий, скорости линейного потока, времени удержания, используемом объеме колонки, направлении потока в колонке и параметрах выходных отверстий для каждой стадии.
Далее описывают пример осуществления крупномасштабной (препаративной) хроматографии на второй стадии способа по настоящему изобретению. Как будет понятно специалисту в этой области, все условия представляют собой исключительно предпочтительные параметры и условия, не ограничивающие изобретение. Кроме того, все указанные параметры и условия можно комбинировать с любыми другими указанными параметрами и условиями для осуществления второй стадии хроматографии в соответствии со способами по настоящему изобретению. Способ эксклюзионной хроматографии препаративного масштаба основан на способе небольшого масштаба, описанном выше, и, таким образом, большинство параметров остается постоянным. Т.к. высота слоя колонок для SEC препаративного масштаба составляет почти 100 см, он является гораздо более чувствительным к сдавлению гелевого слоя. Таким образом, необходимо значительно снижать скорость потока во избежание условий избыточного давления и потенциального повреждения колонки. Первую стадию уравновешивания используют для удаления раствора для консервации, как правило, представляющего собой 0,1 M гидроксид натрия, но в некоторых случаях также используют 20% раствор этанола. С этой целью можно промывать колонку одним объемом колонки ультрачистой воды со сниженной скоростью потока перед фактической фазой уравновешивания. Эту фазу можно осуществлять с помощью двух объемов колонки уравновешивающего/элюирующего буфера для SEC со скоростью потока 9,5 см/ч., что соответствует продолжительности обработки 596,21 минут. Все последующие стадии, предпочтительно, осуществляют при скорости потока по умолчанию 10,7 см/ч., эквивалентной времени удержания 529,35 минут. Образец элюата MonoQ приблизительно 30-35 мл, содержащий желаемые подвиды FVIII, можно медленно размораживать при комнатной температуре и напрямую вводить в колонку с помощью петли Superloop 50 мл. Исходная фаза элюирования, предпочтительно, используемая в экспериментах небольшого масштаба, составляет 1,5 объемов колонки и полностью фракционирована. Размер колонки препаративного масштаба делает необходимым разделение исходной фазы элюирования на три разные фазы элюирования для сбора в интересующем диапазоне элюирования в соответствующие фракции. Аналогично другим фазам элюирования, первую фазу, предпочтительно, осуществляют с помощью уравновешивающего/элюирующего буфера для SEC при скорости потока по умолчанию для 0,24 объемов колонки, собираемых через выходной клапан. Фактическое элюирование продукта должно происходить во вторую фазу элюирования. Общий объем в 0,49 объемов колонки можно собирать в 55 фракциях по ~16,5 мл каждая. Третья фаза элюирования может представлять собой 0,77 объемов колонки, и, аналогично первой фазе элюирования, ее полностью собирают через выходной клапан. Все три фазы элюирования вместе могут составлять 1,5 объемов колонки, что эквивалентно исходному предпочтительному способу элюирования в экспериментах небольшого масштаба. Затем осуществляют кратковременную регенерацию колонки, включающую обработку 0,5 M гидроксидом натрия и ультрачистой водой. Каждая из двух фаз может составлять два объема колонки, и ее осуществляют при скорости потока по умолчанию 10,7 см/ч. В конечном итоге колонку можно промывать 1,5 объемами колонки 0,1 M раствора гидроксида натрия для консервации. Регенерацию колонки и консервацию колонки в конечном итоге можно пропускать, если последовательно очищают две или более партий одних и тех же подвидов FVIII. В таких случаях можно осуществлять повторное уравновешивание уравновешивающим/элюирующим буфером для SEC непосредственно после третьей фазы элюирования.
Таблица 4: Пример схемы эксклюзионной хроматографии препаративного масштаба на смоле Superdex 200 Prep Grade, где указана информация об используемых буферах и растворах, параметрах входных отверстий, скорости линейного потока, времени удержания, используемом объеме колонки, направлении потока в колонке и параметрах выходных отверстий для каждой стадии.
В другом варианте осуществления второй стадии хроматографии в способах по настоящему изобретению осуществляют хроматографию гидрофобных взаимодействий в качестве альтернативного способа разделения подвидов массой 150 кДа и 180 кДа. Опыты можно осуществлять на колонке с высокоэффективной фенил-сефарозой 1,0 мл с помощью системы  Avant 25 при комнатной температуре. Можно варьировать и тестировать различные параметры и условия. Пример схемы хроматографии для опыта в стандартных условиях приведен в таблице 5. Т.к. механизм хроматографии гидрофобных взаимодействий противоположен ионообменной хроматографии, связывание образца происходит в условиях высокой концентрации соли, в то время как элюирование вызвано низкой электропроводностью. Стандартная схема представляет собой двухмерную хроматографию с использованием двух последовательных линейных градиентов элюирующих буферов разной силы. Далее описывают пример того, как можно осуществлять хроматографию гидрофобных взаимодействий на второй стадии способа по настоящему изобретению. Как будет понятно специалисту в этой области, все условия представляют собой исключительно предпочтительные параметры и условия, не ограничивающие изобретение. Кроме того, все указанные параметры и условия можно комбинировать с любыми другими указанными параметрами и условиями для осуществления второй стадии хроматографии в соответствии со способами по настоящему изобретению. Верхний предел нагрузки колонки можно определять как 10000 МЕ/мл смолы, и можно выбирать фактическую нагрузку колонки даже ниже этого предела. Некоторое количество, например, элюата SourceS, предпочтительно, медленно размораживают при комнатной температуре. Затем можно добавлять протеазу фурин в таком количестве, чтобы активность фурина составляла более 100 МЕ/мл раствора образца. После созревания с помощью фурина при комнатной температуре в течение четырех часов образец можно разводить буфером A для HIC с коэффициентом разведения 2. Это необходимо для повышения концентрации соли и связывания образца. Конечной стадией подготовки образца может являться стерильная фильтрация через фильтровальный диск 0,2 мкм. 20% раствор этанола является общеупотребительным для консервации колонки. Колонку сначала можно промывать двумя объемами колонки уравновешивающего буфера E1 для HIC для удаления этанола из колонки. Это можно осуществлять при скорости линейного потока 10 см/ч. Затем колонку можно уравновешивать пятью объемами колонки содержащего этиленгликоль буфера D и пятью объемами колонки уравновешивающего буфера E1 с высоким содержанием соли. Скорость линейного потока 20 см/ч. можно использовать в качестве скорости потока по умолчанию для этих двух стадий, а также всех последующих стадий. После уравновешивания колонки в условиях высокой концентрации соли можно вводить образец. Гидрофобные области на поверхности белка склонны связываться с гидрофобными фенильными группами на смоле во избежание контакта с высоко полярной окружающей водной фазой. Введение образца можно осуществлять с помощью насоса для образца и пневматического датчика до прохождения всего объема образца через колонку. Фракцию фильтрата можно собирать через выходное положение. После промывки колонки пятью объемами колонки уравновешивающего буфера E1 можно начинать фазу элюирования. Сначала процентную долю элюирующего буфера C можно повышать с 0 до 100% в 20 объемах колонки. Этот уровень, предпочтительно, сохраняют для дополнительных пяти объемов колонки до начала второй части элюирования. Уровень содержащего этиленгликоль буфера D можно повышать до 100% в 16 объемах колонки и поддерживать еще для пяти объемов колонки. Получаемое в полную фазу элюирования, включающую оба градиента, можно собирать в небольшие фракции с использованием коллектора фракций. Колонку можно регенировать с помощью последовательности ультрачистой воды, изопропилового спирта, ультрачистой воды, 1 M раствора гидроксида натрия и в конечном итоге ультрачистой воды. Затем колонку можно промывать пятью объемами колонки 20% раствора этанола для консервации.
Avant 25 при комнатной температуре. Можно варьировать и тестировать различные параметры и условия. Пример схемы хроматографии для опыта в стандартных условиях приведен в таблице 5. Т.к. механизм хроматографии гидрофобных взаимодействий противоположен ионообменной хроматографии, связывание образца происходит в условиях высокой концентрации соли, в то время как элюирование вызвано низкой электропроводностью. Стандартная схема представляет собой двухмерную хроматографию с использованием двух последовательных линейных градиентов элюирующих буферов разной силы. Далее описывают пример того, как можно осуществлять хроматографию гидрофобных взаимодействий на второй стадии способа по настоящему изобретению. Как будет понятно специалисту в этой области, все условия представляют собой исключительно предпочтительные параметры и условия, не ограничивающие изобретение. Кроме того, все указанные параметры и условия можно комбинировать с любыми другими указанными параметрами и условиями для осуществления второй стадии хроматографии в соответствии со способами по настоящему изобретению. Верхний предел нагрузки колонки можно определять как 10000 МЕ/мл смолы, и можно выбирать фактическую нагрузку колонки даже ниже этого предела. Некоторое количество, например, элюата SourceS, предпочтительно, медленно размораживают при комнатной температуре. Затем можно добавлять протеазу фурин в таком количестве, чтобы активность фурина составляла более 100 МЕ/мл раствора образца. После созревания с помощью фурина при комнатной температуре в течение четырех часов образец можно разводить буфером A для HIC с коэффициентом разведения 2. Это необходимо для повышения концентрации соли и связывания образца. Конечной стадией подготовки образца может являться стерильная фильтрация через фильтровальный диск 0,2 мкм. 20% раствор этанола является общеупотребительным для консервации колонки. Колонку сначала можно промывать двумя объемами колонки уравновешивающего буфера E1 для HIC для удаления этанола из колонки. Это можно осуществлять при скорости линейного потока 10 см/ч. Затем колонку можно уравновешивать пятью объемами колонки содержащего этиленгликоль буфера D и пятью объемами колонки уравновешивающего буфера E1 с высоким содержанием соли. Скорость линейного потока 20 см/ч. можно использовать в качестве скорости потока по умолчанию для этих двух стадий, а также всех последующих стадий. После уравновешивания колонки в условиях высокой концентрации соли можно вводить образец. Гидрофобные области на поверхности белка склонны связываться с гидрофобными фенильными группами на смоле во избежание контакта с высоко полярной окружающей водной фазой. Введение образца можно осуществлять с помощью насоса для образца и пневматического датчика до прохождения всего объема образца через колонку. Фракцию фильтрата можно собирать через выходное положение. После промывки колонки пятью объемами колонки уравновешивающего буфера E1 можно начинать фазу элюирования. Сначала процентную долю элюирующего буфера C можно повышать с 0 до 100% в 20 объемах колонки. Этот уровень, предпочтительно, сохраняют для дополнительных пяти объемов колонки до начала второй части элюирования. Уровень содержащего этиленгликоль буфера D можно повышать до 100% в 16 объемах колонки и поддерживать еще для пяти объемов колонки. Получаемое в полную фазу элюирования, включающую оба градиента, можно собирать в небольшие фракции с использованием коллектора фракций. Колонку можно регенировать с помощью последовательности ультрачистой воды, изопропилового спирта, ультрачистой воды, 1 M раствора гидроксида натрия и в конечном итоге ультрачистой воды. Затем колонку можно промывать пятью объемами колонки 20% раствора этанола для консервации.
В другом варианте осуществления стадии хроматографии гидрофобных взаимодействий в способах по настоящему изобретению корректируют буферы и увеличивают длину градиента. Хотя общий способ схож с описанным выше вариантом осуществления, в этом варианте осуществления, предпочтительно, варьируют некоторые параметры. Предпочтительно, используют новый уравновешивающий буфер с молярностью хлорида натрия 750 мМ и обозначают его как буфер E2 для HIC, его электропроводность составляет приблизительно 71 мСм/см. Исходный материал можно заменять совокупностью элюата MonoQ, обогащенной подвидами массой 150 кДа. Если такой образец уже обработали протеазой фурином перед введением в колонку с MonoQ, второе созревание с помощью фурина не является необходимым. Электропроводность растворов образцов, предпочтительно, повышают до приблизительно 71 мСм/см с помощью буфера A для HIC и 2 M раствора хлорида натрия для его доведения до того же уровня, что и у уравновешивающего буфера. Уравновешивание колонки, введение образца и регенерацию колонки можно осуществлять стандартным способом. Фазу промывки после введения образца, предпочтительно, осуществляют с помощью удвоенного объема в десять объемов колонки с использованием нового уравновешивающего буфера E2. Сама фаза элюирования, предпочтительно, состоит только из одного градиента с использованием элюирующего буфера C, несодержащего хлорид натрия. Количество буфера C, предпочтительно гораздо более плавно повышают до 100% при увеличенной длине градиента в 40 объемов колонки. Уровень 100% буфера C можно поддерживать еще для пяти объемов колонки. Сразу после этого колонку можно подвергать обычной регенерации. Предпочтительно, больше не используют второй градиент с использованием содержащего этиленгликоль буфера D.
В предпочтительном варианте осуществления второй стадии хроматографии в способах по настоящему изобретению, хроматография гидрофобных взаимодействий является отрицательной хроматографией. Отрицательная хроматография направлена на связывание примесей, а не продукта. В настоящем изобретении предполагают, что оставшиеся подвиды, иные, чем подвиды массой 150 кДа, будут связываться с колонкой, в то время как считают, что подвиды массой 150 кДа будут более или менее проходить через колонку и подвергаться элюированию во фракции фильтрата. Способ отрицательной хроматографии в достаточной степени отличается от других подходов HIC, и пример способа приведен в таблице 5. Далее описывают пример того, как можно осуществлять отрицательную хроматографию во второй стадии способа по настоящему изобретению. Как будет понятно специалисту в этой области, все условия представляют собой исключительно предпочтительные параметры и условия, не ограничивающие изобретение. Кроме того, все указанные параметры и условия можно комбинировать с любыми другими указанными параметрами и условиями для осуществления второй стадии хроматографии в соответствии со способами по настоящему изобретению. Образец может представлять собой обогащенную подвидами массой 150 кДа совокупность элюата MonoQ, полученную на стадии препаративной очистки. Раствор образца, предпочтительно, размораживают и разводят тем же количеством буфера A комнатной температуры (разведение 1:2). Затем можно дополнительно повышать электропроводность до 70,0 мСм/см с использованием буфера G с высоким содержанием соли. Уравновешивающий буфер E2 схожим образом можно доводить до уровня электропроводности 75,0 мСм/см, добавляя буфер G. Колонку можно уравновешивать стандартным способом. Разведенный и скорректированный элюат MonoQ можно напрямую вводить в колонку с использованием насоса для образца. Можно значительно превышать максимальную нагрузку колонки, в случае чего в некоторый момент, вероятно, будут наблюдать утечку. Фазу промывки, предпочтительно, увеличивают до 30 объемов колонки, т.к. она является стадией, на которой ожидают, что продукт будет вымываться из колонки. Получаемое в фазе промывки можно собирать в небольшие фракции для подробного анализа отдельных фракций. Для элюирования колонки, ее можно промывать десятью объемами колонки элюирующего буфера C для удаления всего связавшегося белка. Регенерацию колонки можно осуществлять стандартным способом.
образец
Таблица 5: Пример схемы хроматографии гидрофобных взаимодействий небольшого масштаба, осуществленной на высокоэффективной фенил-сефарозе, где указана информация об используемых буферах и растворах, параметрах входных отверстий, скорости линейного потока, времени удержания, используемом объеме колонки, направлении потока в колонке и параметрах выходных отверстий для каждой стадии. Соответствующий объем образца зависит от способа получения образца.
Стадия концентрирования в способах по настоящему изобретению (например, третья стадия хроматографии)
На стадии концентрирования в соответствии со способами по настоящему изобретению для концентрирования можно осуществлять анионообменную хроматографию. Анионообменная смола SourceQ схожа со смолой MonoQ. Функциональные группы являются идентичными, но частицы SourceQ в три раза крупнее частиц MonoQ, таким образом, разрешение в случае смолы SourceQ является более низким. В настоящем изобретении анионный обменник SourceQ можно использовать на конечной стадии препаративной очистки подвидов FVIII. Но вместо дальнейшей очистки элюатов, полученных посредством эксклюзионной хроматографии, эту стадию можно использовать для концентрирования. Элюаты MonoQ сильно разводят во время препаративной эксклюзионной хроматографии, что делает необходимой стадию концентрирования. Общий способ включает уравновешивание колонки, введение образца, фазу ступенчатого элюирования, направленную на быстрое элюирование всего белка в небольшом объеме и в конечном итоге регенерацию и консервацию колонки. Существуют две колонки SourceQ, доступные для концентрирования элюатов посредством SEC. Т.к. связывающая способность смол SourceQ сравнима с таковой у смол MonoQ, имеющих очень высокую связывающую способность, в большинстве случаев достаточно использовать небольшую колонку SourceQ с объемом колонки приблизительно 3 мл. Предпочтительная схема хроматографии, представленная в таблице 6, относится к небольшой колонке SourceQ. Но некоторые совокупности продукта могут потребовать использования более крупной колонки SourceQ с объемом колонки 7 мл из-за высоких концентраций белков в них. Схема хроматографии для более крупной колонки в принципе схожа со схемой, представленной в таблице 6. Скорость линейного потока масштабируют в зависимости от свойств соответствующей колонки таким образом, что продолжительность обработки остается постоянной.
образец
Таблица 6: Пример схемы анионообменной хроматографии на SourceQ препаративного масштаба, где указана информация об используемых буферах и растворах, параметрах входных отверстий, скорости линейного потока, времени удержания, используемом объеме колонки, направлении потока в колонке и параметрах выходных отверстий для каждой стадии. Соответствующий объем образца зависит от способа получения образца.
Далее описывают пример того, как можно осуществлять хроматографию на третьей стадии способа по настоящему изобретению. Как будет понятно специалисту в этой области, все условия представляют собой исключительно предпочтительные параметры и условия, не ограничивающие изобретение. Кроме того, все указанные параметры и условия можно комбинировать с любыми другими указанными параметрами и условиями для осуществления хроматографии на третьей стадии хроматографии в соответствии со способами по настоящему изобретению. Уравновешивание можно начинать с 6,8 объемов колонки щелочного буфера OC1 при сниженной скорости линейного потока 29,8 см/ч. для связывания функциональных групп с хлоридом в качестве противоиона. Затем буфер OC1 можно удалять, промывая колонку двумя объемами колонки MilliQ при скорости потока 78,8 см/ч., что соответствует продолжительности обработки 2,97 минут. Затем колонку можно обрабатывать смесью буфера 30% QA1 и 70% QB2 для пяти объемы колонки. Эта смесь содержит приблизительно 260 мМ хлорида натрия и предотвращает вымывание хлоридных противоионов из функциональных групп при замене буферной системы. Четвертую фазу уравновешивания можно осуществлять исключительно с использованием буфера QA1. Можно вводить в колонку десять объемов колонки со скоростью потока 2,97 см/ч. для создания в ней подходящих условий для введения образца. Введение образца осуществляют только в условиях низкой электропроводности. Препаративную эксклюзионную хроматографию, предпочтительно, осуществляют при промежуточных концентрациях хлорида натрия, приводящих к уровням электропроводности приблизительно 30 мСм/см, что будет предотвращать связывание образца с колонкой SourceQ. Таким образом, необходимо снижать уровень электропроводности, добавляя буфер QA1 до достижения 11 мСм/см или менее. Это может вызывать приблизительно пятикратное повышение объема образца. Образец можно вводить в колонку с использованием насоса для образца и пневматического датчика при скорости линейного потока 78,8 см/ч. Затем колонку можно промывать четырьмя объемами колонки буфера QA1 до начала фазы элюирования. Предпочтительно, элюирование осуществляют с использованием ступенчатого градиента 80% буфера QB2 и 20% буфера QA1 на четыре объема колонки. Это коррелирует с концентрацией хлорида натрия 300 мМ или электропроводностью 30 мСм/см. Таким образом, целевой белок быстро элюируют в небольшом объеме. Фракции можно собирать в коллекторе фракций. Соответствующие фракции можно объединять так, чтобы достигать подходящей концентрации белка. Второй уровень элюирования, предпочтительно, осуществляют с использованием 100% буфера QB2, что соответствует концентрации 375 мМ хлорида натрия. Затем колонку можно регенерировать с помощью последовательности ультрачистой воды, 50% уксусной кислоты, ультрачистой воды, 1 M гидроксида натрия и в конечном итоге снова ультрачистой воды, каждое в 5,5 объемах колонки при различных скоростях потока в соответствии с их вязкостями. Условий противомикробной консервации можно достигать, промывая колонку пятью объемами колонки 10 мМ гидроксида натрия.
Как будет понятно специалисту в этой области, для осуществления способов по настоящему изобретению можно использовать любую подходящую хроматографическую систему. Например, очистку небольшого масштаба и крупного масштаба можно осуществлять с помощью систем  FPLC (быстрой жидкостной хроматографии белков). Системы
FPLC (быстрой жидкостной хроматографии белков). Системы  Pure 25 и
Pure 25 и  Avant 25 подходят для колонок небольшого масштаба и низких скоростей потока, в то время как системы
Avant 25 подходят для колонок небольшого масштаба и низких скоростей потока, в то время как системы  Pure 150 используют для очистки больших количеств белков, и они соответствуют большим диаметрам колонок, а также более высоким скоростям потока. Всеми хроматографами
Pure 150 используют для очистки больших количеств белков, и они соответствуют большим диаметрам колонок, а также более высоким скоростям потока. Всеми хроматографами  можно управлять с помощью пакета программ UNICORN.
можно управлять с помощью пакета программ UNICORN.
дивинилбензен
дивинилбензен
Таблица 7: Информация о хроматографических смолах, которые можно использовать для стадий анионообменной хроматографии, эксклюзионной хроматографии и хроматографии гидрофобных взаимодействий по настоящему изобретению.
YMC
YMC
Таблица 8: Информация о типах конструкции хроматографических колонок, размерах и параметрах упаковки, которые можно использовать в способах по настоящему изобретению. Код колонки представляет собой произвольно определенную метку для разных колонок, которую можно использовать в способах по настоящему изобретению и которую используют далее для описания соответствующей комбинации конструкции колонки и смолы. Названия производителей относятся к конструкции колонки и могут не быть идентичными производителям смол.
Таблица 9: Общие буферы и растворы, а также буферы, которые можно специально использовать для хроматографических опытов. Последние указаны в разделах с соответствующим типом хроматографии. В настоящем описании используют указанные сокращения.
Как будет понятно специалисту в этой области, конечная стадия концентрирования в способах по настоящему изобретению не обязательно является стадией хроматографии. Специалисту в этой области будут известны многочисленные подходящие альтернативы для концентрирования элюата, содержащего подвиды FVIII, из предшествующей (второй) стадии хроматографии по настоящему изобретению. Например, для концентрирования можно использовать ультрафильтрацию.
Как будет понятно специалисту в этой области, способ очистки подвидов FVIII по настоящему изобретению также можно использовать для очистки других белков или субъединиц белков из композиции, содержащей несколько белков или субъединиц белков с высокой чистотой. Разумеется, композиции, содержащие очищенные белки или субъединицы белков затем можно использовать, например, в качестве лекарственного средства.
Неожиданно, авторы настоящего изобретения также обнаружили, что обработка фурином рекомбинантного FVIII повышает активность FVIII даже без очистки подвидов. Такую обработку фурином FVIII можно осуществлять, как описано выше для обработки фурином как части способа очистки подвидов FVIII. Предпочтительно, рекомбинантный FVIII, содержащий одноцепочечный (т.е. нерасщепленный) FVIII, подвергают обработке фурином без очистки подвидов по настоящему изобретению. Такую обработку фурином можно осуществлять с использованием фурина в конечной концентрации более 50 МЕ/мл, более 100 МЕ/мл, более 200 МЕ/мл или более 300 МЕ/мл, но, предпочтительно, ее осуществляют с использованием фурина в конечной концентрации более 100 МЕ/мл. Обработку фурином можно осуществлять в течение 1 ч. при комнатной температуре, т.е. приблизительно 21°C. После обработки фурином, его можно отделять от FVIII. Обработанный фурином FVIII можно использовать в качестве лекарственного средства, например, для лечения пациентов с нарушениями свертывания, такими как гемофилия A.
Как известно специалисту в этой области, существуют разные доступные способы определения концентрации белка в водных растворах. Спектрофотометрическое измерение в ультрафиолетовом диапазоне при 280 нм подходит для высокоочищенного раствора белка, и, таким образом, его предпочтительно использовать в настоящем изобретении. По закону Бугера-Ламберта-Бера
измеряемое поглощение A является линейной функцией концентрации белка c (M), длины пути в кювете l (см) и коэффициента экстинкции ε (M-1см-1). В основе поглощения в растворах белков при 280 нм лежит содержание ароматических аминокислот триптофана и тирозина, а также цистина, т.е. дисульфидных связей, вносящих вклад в общее поглощение в меньшей степени. Фенилаланин вносит вклад в поглощение только при меньших длинах волн и, таким образом, не важен для измерений УФ при 280 нм. Для определения концентраций белков в водных растворах необходимо определять коэффициент экстинкции для конкретного белка, в основном, зависящий от композиции аминокислот и количества ароматических аминокислот и цистина. Из-за гетерогенной композиции рекомбинантного FVIII (см. выше), для вычисления концентрации белка в случае очищенных фракций подвидов необходимы конкретные коэффициенты экстинкции для каждого подвида FVIII. Вычисление конкретных коэффициентов экстинкции этих подвидов при концентрации белка 1 мг/мл можно найти ниже. Для дальнейшего упрощения вычисления концентрации белка вычисляли переводные коэффициенты с учетом конкретных коэффициентов экстинкции этих подвидов. Само измерение осуществляют относительно пустого раствора, содержащего идентичную композицию буфера в качестве образца. Степень поглощения можно преобразовывать в соответствующую концентрацию белка, используя указанное выше уравнение. Концентрацию белка в качестве целевого значения в этом способе, например, используют в качестве меры того, насколько эффективна стадия хроматографического концентрирования.
Как известно специалисту в этой области, электрофорез в полиакриламидном геле является способом, используемым для разделения биологических макромолекул, например, белков, в зависимости от их размера, конформации и заряда. Использование додецилсульфата натрия (SDS) или додецилсульфата лития (LDS) вызывает повреждение вторичной и третичной структур посредством комплексирования и, таким образом, линеаризацию белка. Восстановители, такие как дитиотреитол (DTT) и йодацетамид, используют для разделения дисульфидных связей и предотвращения их повторного образования. Кроме того, связывание SDS приводит к отрицательному суммарному заряду полипептидных цепей, благодаря чему разделение зависит только от молекулярной массы белков. Сам гель состоит из мономеров акриламида и перекрестно сшитого бисакриламида, при этом плотность и размер пор геля определяется концентрацией бисакриламида. При приложении электрического поля к гелю белки мигрируют в сторону положительного полюса (т.е. анода) с разной скоростью в зависимости от их фактической массы. Последующее окрашивание делает разделенные фракции белков видимыми и доступными для дальнейшей обработки или интерпретации. Электрофорез в полиакриламидном геле позволяет сделать качественные выводы о чистоте и концентрации используемых образцов. Специалисту в этой области будут известны различные способы осуществления электрофореза в полиакриламидном геле, а также соответствующие способы окрашивания. Например, электрофорез в полиакриламидном геле, а также соответствующие способы окрашивания можно осуществлять с использованием материалов с Трис-ацетатным буфером в восстановительных условиях. Примеры материалов и общих условий приведены в следующей таблице.
Восстановитель NuPAGE
Invitrogen NP0009
Таблица 10: Примеры материалов и буферов для электрофореза в полиакриламидном геле. Все буферы, а также сам полиакриламидный гель являются готовыми к использованию материалами, производимыми Thermo Fisher Scientific под торговым названием Invitrogen. Указаны соответствующие номера в каталогах.
Как известно специалисту в этой области, окрашивание серебром после электрофореза в геле является быстрым и очень чувствительным способом детекции белковых полос. Его основным принципом является связывание ионов серебра с поверхностью белков и последующее восстановление до чистого металлического серебра, что приводит к получению темных белковых полос. Избыток ионов серебра необходимо удалять после проявки во избежание возникновения неспецифических сигналов. Основные способы окрашивания также могут включать стадии подготовки, такие как удаление мешающих ионов, повышение чувствительности и контраста, и несколько стадий промывки. Окрашивание серебром является неспецифическим способом, которым окрашивают любой белок, присутствующий в образце. Таким образом, его можно использовать для оценки чистоты в настоящем изобретении.
Как известно специалисту в этой области, вестерн-блоттинг является даже более чувствительным способом детекции белковых полос. Кроме того, он также является специфическим в отношении конкретного типа белка, что позволяет различать целевой белок и примеси. После разделения белков при электрофорезе в геле, их переносят на мембрану. Этого можно достигать разными способами. Наиболее известным является электроблоттинг, в котором для стимуляции миграции белков к мембране используют электрическое поле. Проявка включает использование двух разных антител. Для предотвращения неспецифического связывания антитела с поверхностью мембраны необходимо блокировать мембрану бычьим сывороточным альбумином или обезжиренным сухим молоком. Первичное антитело является высокоспецифичным в отношении целевого белка (например, фактора свертывания крови FVIII). Вторичное антитело соединено с щелочной фосфатазой (ALP) и направлено против первичного антитела. После связывания обоих антител добавляют ALP-специфический субстрат, который затем превращается в нерастворимую, окрашенную форму, осаждающуюся в непосредственной близости с иммобилизованным FVIII.
Как известно специалисту в этой области, хромогенный анализ FVIII основан на образовании хромогенного продукта, появление которого можно отслеживать с помощью спектрофотометрического измерения при 405 нм. В таком анализе образец FVIII смешивают с раствором тромбина, фосфолипидов, FIXa и Ca2+. Неактивный FVIII активируется до своей активной формы FVIIIa под действием тромбина и образует комплекс, содержащий FVIIIa, FIXa, фосфолипиды и кальций. Этот комплекс может активировать FX до активного FXa, который, в свою очередь, приводит к деградации хромогенного субстрата. В этой реакции высвобождается пара-нитроанилин, образование которого можно отслеживать посредством фотометрического измерения при 405 нм. Повышение экстинкции прямо пропорционально количеству FXa, которое, в свою очередь, прямо пропорционально количеству FVIII в образце. В настоящем изобретении хромогенные анализы активности можно осуществлять, как известно в этой области. Например, анализ активности FVIII можно осуществлять с использованием коммерчески доступных реагентов (Siemens, Germany) с помощью автоматизированного анализатора свертывания (BCS XP, Siemens). На первой стадии хромогенного анализа образец, содержащий неизвестное количество функционального FVIII, можно добавлять в реакционную смесь, состоящую из тромбина, активированного FIX (FIXa), фосфолипидов, FX и буфера, содержащего кальций. FVIII активируется тромбином. Активированный FVIII (FVIIIa) образует комплекс с фосфолипидами, FIXa и кальцием, приводящий к активации фактора X (FXa). На второй стадии хромогенного анализа FXa можно измерять по расщеплению FXa-специфического пептидного нитроанилидного субстрата. Образуется p-нитроанилин, придавая раствору окраску, которую можно измерять фотометрически по поглощению при 405 нм. Получаемая окраска прямо пропорциональна количеству функционального FVIII, присутствующего в образце. Референсным стандартом может являться полноразмерный FVIII, калиброванный по международному стандарту ВОЗ.
Одностадийные анализы свертывания можно осуществлять, как известно в этой области. Например, активность FVIII посредством одностадийного анализа свертывания можно определять с использованием коммерчески доступного реагента aPTT, актина FSL (Siemens, Germany) с помощью автоматизированного анализатора свертывания (BCS XP, Siemens, Germany). Образец, содержащий неизвестное количество функционального FVIII, можно смешивать с плазмой человека без FVIII и активатором. После инкубации при +37°C свертывание можно инициировать добавлением хлорида кальция и регистрировать время до образования тромба. Время свертывания обратно пропорционально концентрации FVIII в образце. Результаты можно приводить в МЕ FVIII/мл с использованием референсной кривой. Референсный стандарт может являться полноразмерным rFVIII, отслеживаемый по международному стандарту ВОЗ.
Анализы инициируемой тканевым фактором генерации тромбина можно осуществлять, как известно в этой области. Например, калиброванная автоматизированная тромбограмма (CAT), тип теста генерации тромбина (TGA), является глобальным анализом гемостаза, все больше используемым в клинических исследованиях в качестве параметра эффективности ex vivo и исследовательского инструмента. С помощью тромбограммы описывают концентрацию тромбина в сворачивающейся плазме, и, таким образом, она представляет собой функциональный тест системы гемостаза в условиях, близких к физиологическим. Анализ основан на измерении флуоресценции, генерируемой при расщеплении флуорогенного субстрата Z-G-G-R-AMC под действием тромбина с течением времени после инициации свертывания тканевым фактором. Анализ осуществляют с помощью Thrombograph™, 96-луночного флуориметра для планшетов, и используют калибратор тромбина, необходимый для коррекции по эффекту внутреннего фильтра, межиндивидуальной вариабельности цвета плазмы, истощению субстрата и инструментальным различиям.
Следующие параметры CAT характеризуют гемостатическое состояние образца плазмы:
Время ожидания [мин]: соответствует времени свертывания, инициации образования тромбина
Время до достижения пика [мин]: время до образования максимального количества тромбина
Тромбиновый пик [нМ]: максимальная концентрация образовавшегося тромбина
Эндогенный тромбиновый потенциал (ETP) [нМ мин]: площадь под кривой образования тромбина, соответствующая общему количеству образовавшегося тромбина.
Как известно специалисту в этой области, твердофазный иммуноферментный анализ представляет собой иммунологический подход, в котором используют антитела и цветную реакцию, как правило, опосредованную ферментами, для детекции и количественного анализа антигена. Антигены можно иммобилизовать непосредственно на поверхности 96-луночного планшета с глубокими лунками, или они связываются антителом, иммобилизованным на поверхности перед нанесением образца. В каждом случае антиген иммобилизуют таким образом, что вторичное антиген-специфическое антитело может присоединяться к антигену. Во многих случаях вторичное антитело конъюгируют с ферментом, способным превращать бесцветный субстрат в окрашенное вещество, которое можно определять посредством фотометрического измерения. Таким образом, он является количественным способом, с помощью которого получают информацию об активности белка FVIII в соответствующем образце. Для интерпретации результатов необходима стандартная кривая, полученная в идентичных условиях.
Если в способах по настоящему изобретению используют рекомбинантный белок (например, rFVIII), полученный в клетках CHO, для интерпретации качества исходных материалов можно использовать определение содержание белков клетки-хозяина CHO. В связи с этим, 96-луночный планшет с глубокими лунками можно покрывать CHO-специфическим поликлональным антителом IgG козы. Добавление разных разведений раствора образца приводит к образованию иммунного комплекса, содержащего первичное антитело против CHO и антиген. Избыток белков образца можно удалить посредством промывки. Вторичное HRP-конъюгированное поликлональное антитело козы против CHO распознает иммунный комплекс. После связывания и еще одной дополнительной стадии промывки можно добавлять раствор субстрата. Он содержит орто-фенилендиамин, преобразуемый в желто-оранжевый 2,3-диаминофеназин при катализе пероксидазой хрена. Степень окрашивания прямо пропорциональна количеству белков клетки-хозяина CHO в образце, и ее можно определять при 490 нм посредством фотометрического измерения.
Как известно специалисту в этой области, основной принцип ELISA антигена vWF схож с описанным выше. Для иммобилизации vWF, присутствующего в образце, используют антитело кролика против vWF человека. Вторичное HRP-конъюгированное антитело кролика против vWF человека связывается с иммунным комплексом. После стадии промывки добавляют раствор орто-фенилендиамина, и он превращается в 2,3-диаминофеназин при катализе пероксидазой хрена. Детекция схожа с ELISA антигенов CHO, описанным выше.
Как известно специалисту в этой области, для аналитического разделения, идентификации и количественного анализа всех компонентов в образце можно использовать высокоэффективную жидкостную хроматографию (ВЭЖХ). Хотя общепринятую жидкостную хроматографию осуществляют при низком давлении, ВЭЖХ осуществляют в условиях высокого давления. Термин "обращенная фаза" относится к гидрофобным свойствам неподвижной фазы, что противоположно традиционно называемой "нормальной фазе" при использовании полярных стационарных смол, таких как силикагели. Обращенно-фазовые смолы получают посредством алкилирования силикагелевых матриц углеводными цепями различной длины, как правило, в диапазоне от четырех до восемнадцати атомов углерода (C4-C18). Типичные элюенты являются полярными водными растворами солей или кислот, с одной стороны, и неполярными органическими растворителями, такими как ацетонитрил или метанол, с другой стороны. Разделение подвидов фактора свертывания крови FVIII, предпочтительно, осуществляют на обращенно-фазовой колонке C4 (Jupiter® 5 m C4 300  , колонке LC 150×2 мм, Phenomenex) с использованием 0,1% трифторуксусной кислоты (TFA) в воде в качестве элюента A и 0,085% TFA в ацетонитриле в качестве элюента B с повышением процентной доли элюента B во время элюирования, как показано в следующей таблице.
, колонке LC 150×2 мм, Phenomenex) с использованием 0,1% трифторуксусной кислоты (TFA) в воде в качестве элюента A и 0,085% TFA в ацетонитриле в качестве элюента B с повышением процентной доли элюента B во время элюирования, как показано в следующей таблице.
Таблица 11: Предпочтительные условия и параметры для обращенно-фазовой высокоэффективной жидкостной хроматографии C4 молекулярных подвидов FVIII. Процентная доля A и процентная доля B относятся к процентным долям фракций двух подвижных фаз, используемых для разделения. (A) 0,1% трифторуксусной кислоты в ультрачистой воде, (B) 0,085% трифторуксусной кислоты в ацетонитриле.
Количество впрыскиваемого образца, предпочтительно, соответствует 15 мкг или 75 МЕ белка, соответственно. Т.к. гидрофобные взаимодействия зависят от температуры, колонку, предпочтительно, нагревают до 60°C для повышения разрешения. Элюируемые белки, предпочтительно, определяют с помощью детектора с фотодиодной матрицей при 214 нм, что соответствует длине волны возбуждения пептидной связи. С помощью самой обращенно-фазовой ВЭЖХ осуществляют разделение белков по их разной гидрофобности. Режим детекции является спектрофотометрическим. И разделение, и детекция позволяют измерять интенсивности поглощения по-разному элюируемых белков и, после интегрирования площади под кривой, вычислять соответствующую концентрацию белка. Это имеет большое значение, т.к. ее можно использовать в качестве меры качества разделения в настоящем изобретении, и ее используют для определения массового соотношения подвидов FVIII, как описано выше.
Как известно специалисту в этой области, вычисление коэффициентов молярной экстинкции для каждого подвида FVIII, а также полноразмерной одноцепочечной молекулы, является приблизительным, основанным на фактических свойствах соответствующей молекулы. Общую информацию, приведенную в таблице 12, можно получать с помощью инструмента ProtParam (регистрационный номер P00451), предоставляемого биоинформатическим порталом ExPASy. Она включает количество аминокислот, теоретическую изоэлектрическую точку, молекулярную массу аминокислотного остова и приблизительные коэффициенты экстинкции для раствора 1 г/л подвидов FVIII при длине волны 280 нм. Гликозилирование и другие посттрансляционные модификации не включены в данные о молекулярной массе аминокислотного остова. Теоретический молярный коэффициент экстинкции для молекулы можно получать из следующего уравнения.
Количество трех аминокислот, вносящих вклад в поглощение света при 280 нм, ими являются тирозин, триптофан и цистеин, умножают на соответствующие на коэффициенты молярной экстинкции. Сумма всех трех произведений равна общему коэффициенту экстинкции молекулы для концентрации 1 г/л. Вычисление не включает посттрансляционные модификации, такие как гликозилирование и сульфатирование тирозина. Кроме того, предполагают, что все остатки цистеина образуют цистин, т.к. цистин вносит вклад в поглощение света, а цистеин - нет. При оценке не принимают во внимание точную локализацию остатков тирозина, триптофана и цистина в свернутом белке и, таким образом, возникающее влияние окружающей среды. Каждая тяжелая цепь FVIII связана с легкой цепью массой 80 кДа или удлиненной легкой цепью массой 120 кДа. Предполагают, что раствор, содержащий один вид тяжелой цепи и один вид легкой цепи, содержит по 50% каждого из них. И виды тяжелой цепи, и виды легкой цепи имеют свои разные коэффициенты поглощения света, вносящие вклад в общее поглощение раствора как функции их массовой доли. Массовую долю вычисляют как отношение соответствующей молекулярной массы аминокислотного остова одного подвида и общей молекулярной массы обоих подвидов.ω

Таблица 12: Общая информация о молекулярных подвидах FVIII: количество аминокислот, теоретическая изоэлектрическая точка, молекулярная масса аминокислотного остова (гликозилирование не включено), процентная доля относительно полноразмерной единой цепи и коэффициенты экстинкции при 280 нм.
Комбинация тяжелой цепи массой 180 кДа и легкой цепи массой 80 кДа приводит к получению массовых долей 0,65 и 0,35, соответственно.

Это означает, что тяжелая цепь массой 180 кДа с конкретным коэффициентом экстинкции 1,066 M-1см-1 вносит вклад 65% в общее поглощение раствора. В отличие от нее, легкая цепь массой 80 кДа вносит меньший вклад, всего лишь 35%, с коэффициентом экстинкции 1,617 M-1см-1. Сумма произведений массовых долей и коэффициентов экстинкции ε конкретных подвидов для тяжелой и легкой цепи приводит к получению общего коэффициента экстинкции εобщий для раствора белка 1 г/л.

Таким образом, раствор белка, содержащий тяжелую цепь массой 180 кДа, связанную с легкой цепью массой 80 кДа, имеет приблизительный коэффициент экстинкции, соответствующий следующему уравнению.
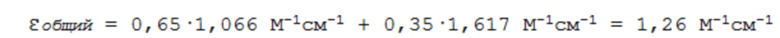
Общий коэффициент экстинкции εобщий для растворов, содержащих каждый из четырех вариантов тяжелой цепи (180 кДа, 150 кДа, 110 кДа и 90 кДа) в комбинации с легкой цепью массой 80 кДа, можно вычислять тем же способом. Результаты представлены в таблице 13.
Таблица 13: Вычисление специфических для подвидов FVIII значений относительного поглощения, полученных из массовых долей 50% тяжелой цепи и 50% легкой цепи в смеси и соответствующих коэффициентов экстинкции.
Как будет понятно специалисту в этой области, для осуществления способов по настоящему изобретению можно использовать любое подходящее лабораторное оборудование. Однако в следующей таблице приведены примеры небольшого лабораторного оборудования, которое можно использовать в способах по настоящему изобретению. Список примеров включает оборудование для получения буферов, подготовки образцов, самих хроматографических экспериментов, а также анализа и консервации. Представлена некоторая соответствующая информация, касающаяся производителя, кода продукта, диапазона измерений и т.д.
Таблица 14: Пример списка общего лабораторного оборудования, которое можно использовать в способе по настоящему изобретению. Представлена некоторая соответствующая информация, касающаяся производителя, кода продукта, диапазона измерений и т.д.
Далее настоящее изобретение будет проиллюстрировано неограничивающими примерами.
ПРИМЕРЫ
Если не указано иначе, все стадии способа в следующих примерах 1-16 осуществляли по соответствующим (предпочтительным) вариантам осуществления, подробно описанным выше в разделе "Подробное описание изобретения".
Пример 1: Исходный материал для очистки подвидов FVIII
Почти все из следующих экспериментов по очистке осуществляли с использованием элюата SourceS (SOS-E), содержащего FL-rFVIII и обозначаемого как B14390000-30. SOS-E получают в виде BDS ADVATE, но без конечной стадии очистки.
Второй исходный материал, используемый только в одной крупномасштабной очистке, представляет собой совокупность различных пост-элюатов MonoQ и SourceQ, содержащих обогащенный подвид FVIII массой 90 кДа в низкой концентрации. Отдельные пост-элюаты объединяли для получения большой совокупности продукта. Эту совокупность обозначают как F8_AD2_90кДа.
Пример 2: Очистка подвидов FVIII небольшого масштаба - первая стадия хроматографии
Независимо от общего типа хроматографии - анионообменной хроматографии с использованием смол MonoQ или эксклюзионной хроматографии на смолах Superdex 200 - результаты, полученные во время следующих экспериментов небольшого масштаба, используют для крупномасштабного способа со стадиями препаративной очистки. Результаты важны для конфигурации соответствующего способа хроматографии.
Т.к. анионообменная хроматография является первой стадией очистки подвидов FVIII, она представляет большой интерес для уточнения условий эксплуатации. MonoQ в качестве аналитической смолы для AIEX с монодисперсными частицами размером 10 мкм и почти однородной формой демонстрирует лучшее разрешение и наиболее многообещающие свойства разделения. Таким образом, эту стадию подвергали обширному тестированию параметров и изменениям, включая подготовку образцов.
На фигуре 4 показана хроматограмма необработанного фурином элюата SourceS B14390000-30, разделяемого в стандартных условиях. Фаза элюирования имела длину восемь объемов колонки, и ее осуществляли с использованием стандартных буферов QA1 и QB1. Элюирование начинается относительно рано с первым повышением электропроводности. Наблюдали несколько размытых пиков, а также очень выделяющийся пик, распознаваемый сразу после повышения интенсивности сигнала УФ. Известно, что они соответствуют по-разному заряженным вариантам полноразмерной тяжелой цепи (180 кДа), наиболее вероятно, являющихся результатом разного гликозилирования в области B-домена, а также комбинациям удлиненной легкой цепи с другими подвидами тяжелой цепи. Лежащий в основе этого механизм еще не понятен полностью, но гидрофобные взаимодействия также могут быть причиной этих конкретных характеристик элюирования. Наиболее выделяющийся пик, элюируемый во фракциях №№ B8 и B9, можно видеть на соответствующем изображении ПААГ с SDS (фигура 5). В основном, он состоит из полноразмерного фрагмента тяжелой цепи массой 180 кДа. Но есть и некоторое количество полноразмерное единой цепи, которую можно видеть выше положения маркера 250 кДа наверху геля. В нижних частях геля наблюдают интенсивный сигнал немного выше 100 кДа, соответствующий удлиненной легкой цепи массой 120 кДа. Непосредственно ниже находятся следы подвида укороченной тяжелой цепи массой 110 кДа. Другую выраженную полосу можно видеть около 75 кДа. Она соответствует фрагменту легкой цепи массой 80 кДа.
Наблюдают другой выраженный пик, собираемый во фракции B10. Его композиция на ПААГ с SDS достаточно схожа с описанным выше. По-видимому, она, в основном, состоит из смеси полноразмерной тяжелой цепи массой 180 кДа, а также удлиненной легкой цепи массой 120 кДа и легкой цепи массой 80 кДа с меньшим количеством фрагмента тяжелой цепи массой 110 кДа и полноразмерной диной цепи. Но, кроме того, фракции B11 и B12 также имеют слабый сигнал в области 150 кДа. Он соответствует подвидам укороченной тяжелой цепи массой 150 кДа, идентифицируемым в виде небольшого плеча на нисходящей стороне пика на хроматограмме.
Следующим представляющим интерес пунктом на хроматограмме является небольшой пик с приблизительной интенсивностью 100 мЕА, что не является базовым уровнем, отделенный от левого соседнего с ним пика. Во фракциях C1 и C2 определяли максимальное количество подвидов тяжелой цепи массой 110 кДа по сравнению с другими фракциями. В этих фракциях также определяют некоторое количество подвидов массой 180 кДа, т.к. разрешение смол является недостаточным для разделения обоих пиков. Несмотря на это, определяют небольшой пик, соответствующий укороченному фрагменту тяжелой цепи массой 110 кДа. И наконец, определяют небольшой двойной пик с интенсивностью приблизительно 40 мЕА во фракциях C4-C6. Этот пик соответствует тяжелой цепи без B-домена массой 90 кДа, что видно на ПААГ с SDS. Таким образом, общая последовательность элюирования с повышением электропроводности является следующей:
1. По-разному заряженные варианты подвидов тяжелой цепи, в основном, полноразмерный фрагмент массой 180 кДа, одноцепочечный FVIII и разные комбинации удлиненной легкой цепи вместе с другими подвидами
2. Полноразмерная тяжелая цепь (180 кДа)
3. Тяжелая цепь с частичным укорочением B-домена (150 кДа)
4. Тяжелая цепь с частичным укорочением B-домена (110 кДа)
5. Тяжелая цепь без B-домена (90 кДа)
Пример 3: Очистка подвидов FVIII небольшого масштаба - оптимизация длины градиента на первой стадии хроматографии
Более плавный градиент является эквивалентном лучшего разделения по причине более медленного повышения процента сильного элюента. На фигуре 6 показано наложение двух разных экспериментов по определению осуществимости, один из которых проводят с использованием градиента в восемь объемов колонки, указанного сплошной линией для УФ-сигнала и длинной штриховой пунктирной линией для электропроводности, в то время как другой осуществляют с использованием градиента в 16 объемов колонки, показанного точечной пунктирной линией для УФ-сигнала и короткой штриховой пунктирной линией для соответствующего сигнала электропроводности. Четко видно, что электропроводность повышается гораздо медленнее во время элюирования 16 объемами колонки по сравнению с элюированием восьмью объемами колонки. Соответствующие УФ-сигналы схожи своим общим паттерном, но характеристики элюирования явно отличаются. Кривая, обозначенная точечной пунктирной линией, соответствующая УФ-сиганалам при элюировании 16 объемами колонки, расширяется, и небольшое плечо, соответствующее подвидам массой 150 кДа, видно лучше, чем на кривой УФ для восьми объемов колонки. Т.к. объем, в котором собирают фазу элюирования, в случае элюирования 16 объемами колонки в два раза превышает объем при элюировании восьмью объемами колонки, также вероятно, что некоторые из этих структур можно собирать в разных фракциях. Наиболее выраженное различие можно видеть в области, в которой, как правило, склонны элюироваться из колонки укороченные подвиды массой 150 кДа с B-доменом. Эта область до некоторой степени является короткой в фазе элюирования восьмью объемами колонки. По-видимому, интенсивность сигнала полноразмерной тяжелой цепи массой 180 кДа быстро снижается, а затем снова повышается, т.к. происходит элюирование подвидов массой 110 кДа. В отличие от этого, в фазе элюирования 16 объемами колонки разрешают подвиды массой 150 кДа. Разделение может быть совсем неудовлетворительным, но на нисходящей стороне пика полноразмерной тяжелой цепи массой 180 кДа видно небольшое плечо. Причиной этого является то, что в условиях неуклонно повышающейся электропроводности некоторая точка, в которой элюируют полноразмерную тяжелую цепь массой 180 кДа, в то время как укороченная цепь массой 150 кДа с B-доменом остается связанной, сохраняется в течение большего периода времени.
На фигуре 7 показано наложение двух кривых УФ, полученных в фазе элюирования 16 объемами колонки, показанной сплошной линией, и 32 объемами колонки с 10% этиленгликоля в качестве добавки, показанной длинной штриховой пунктирной линией. Перед введением оба образца обрабатывали протеазой фурином. В фазе элюирования четко виден эффект размывания пика в два раза относительно исходного. Плечо, возникающее при элюировании укороченной тяжелой цепи массой 150 кДа с B-доменом в фазе элюирования 32 объемами колонки, является более выраженным, чем в фазе элюирования 16 объемами колонки. Кроме того, ее объем в два раза превышает таковой для элюирования 16 объемами колонки, и, таким образом, учитывая, что фракционирование происходит при достаточных объемах фракций, должна быть возможность получения обогащенной совокупности продукта массой 150 кДа, подходящей для дальнейшей очистки.
Пример 4: Очистка подвидов FVIII в небольшом масштабе - обработка протеазой фурином перед первой стадией хроматографии
Протеаза фурин является протеолитическим ферментом, отвечающим за внутриклеточный процессинг FVIII. Есть разные положения по всей длине последовательности FVIII, к которым фурин может присоединяться и расщеплять свой субстрат. Т.к. FVIII, даже если он получен из рекомбинантного источника, не полностью процессирован, наблюдают высокую степень гетерогенности. Не только B-домен вносит вклад в гетерогенность. Разные типы гликозилирования также могут влиять на то, как конкретная молекула FVIII ведет себя во время элюирования. Это особенно значимо для полноразмерной тяжелой цепи массой 180 кДа. Этот подвид все еще содержит целый B-домен, являющийся высокогликозилированным (Pipe et al.(1998)). По-видимому, разные типы гликозилирования и, таким образом, по-разному заряженные области на поверхности белка являются причиной того, почему полноразмерную тяжелую цепь не только элюируют в виде единого пика, но и в виде двух разных пиков.
На фигуре 8 показано наложение кривых УФ обработанного фурином образца (сплошная линия) и образца, необработанного протеазой фурином перед введением образца (длинная штриховая пунктирная линия). Оба опыта осуществляли с использованием фазы элюирования 16 объемами колонки, о чем свидетельствует значительное сходство кривых электропроводности. Единственным различием является тип подготовки образца, включающий созревание с помощью фурина или нет. Во-первых, очевидно, что происходит значительное снижение интенсивности пика обработанного фурином образца в первой половине фазы элюирования. Эта область, в основном, соответствует по-разному заряженным вариантам тяжелой цепи в комбинации с удлиненной легкой цепью. Кроме того, наиболее выраженный пик необработанного фурином образца почти полностью исчезает на сплошной кривой. В свою очередь, типичный пик полноразмерной тяжелой цепи значительно повышен. По-видимому, созревание с помощью фурина также повышает интенсивность других подвидов. Даже интенсивность подвидов без B-домена массой 90 кДа и подвидов 110 кДа, является более высокой по сравнению с необработанным фурином образцом.
Элюирование обработанного фурином образца показано на фигуре 9. Почти каждую фракцию подвергали анализу посредством электрофореза ПААГ в присутствии SDS (фигуры 10 и 11) для определения их соответствующих композиций. Фракции №№ B5-C7 выглядят фактически однородными в терминах их композиции. Хотя эта область содержит отдельные пики на хроматограмме, все из них явно состоят из вариантов полноразмерной тяжелой цепи с разным гликозилированием, которые не отличаются на ПААГ с SDS. Что касается восходящей стороны следующего, наиболее интенсивного пика, здесь уже есть некоторые фракции (C8-C10) полноразмерного фрагмента тяжелой цепи (180 кДа), которые кажутся достаточно чистыми для дальнейшей очистки. Нисходящая часть пика, как и обычно, соответствует укороченному фрагменту тяжелой цепи массой 150 кДа, но оба вида появляются на большем расстоянии друг от друга по сравнению со стандартным разделением без созревания с помощью фурина. Укороченные подвиды массой 110 кДа, в особенности фракции D4 и D5, хорошо разделены и содержат лишь минорные количества других подвидов. Тяжелая цепь без B-домена массой 90 кДа полностью разделена и даже может быть готова для концентрирования. Одно из наиболее явных различий касается распределения вариантов легкой цепи. Как можно видеть на всем геле, не осталось следов удлиненной легкой цепи массой 120 кДа. Очевидно, что она была процессирована протеазой фурином, что привело к получению почти исключительно фрагментов легкой цепи массой 80 кДа, что значительно снижает гетерогенность исходного материала.
Осуществляли некоторые модификации для следующей крупномасштабной (препаративной) очистки:
1. Для снижения гетерогенности и улучшения общего разделения подвидов FVIII образец обрабатывают >100 МЕ/мл протеазы фурина перед введением образца.
2. Длину элюирования в линейном градиенте повышают в четыре раза до 32 объемов колонки. Повышенное расхождение подвид-специфичных пиков во второй половине элюирования, по-видимому, позволяет преодолеть эффекты разведения фракций.
Пример 5: Очистка подвидов FVIII в небольшом масштабе - вторая стадия хроматографии
Эксклюзионную хроматографию используют в качестве стадии заключительной очистки для удаления минорных примесей из совокупности, уже содержащей желаемый продукт высокой чистоты. Ее также можно использовать в качестве второй стадии очистки молекулярных подвидов FVIII после стадии анионообменной хроматографии на MonoQ. Таким образом, каждый образец, подлежащий очистке посредством эксклюзионной хроматографии, исходно получают посредством анионообменной хроматографии и последующего объединения фракций, содержащих желаемые подвиды. Учитывая, что удлиненную легкую цепь массой 120 кДа полностью удаляют во время созревания с помощью фурина, каждый вариант тяжелой цепи, присутствующий в соответствующем образце, должен связываться исключительно с легкой цепью массой 80 кДа. Таким образом, среднее различие молекулярной массы среди всех подвидов составляет приблизительно 50 кДа, чего должно быть достаточно для достижения удовлетворительных результатов.
Пример 6: Очистка подвидов небольшого масштаба FVIII - очистка укороченного фрагмента тяжелой цепи на второй стадии хроматографии
На правой стороне фигуры 13 показан ПААГ с SDS для более раннего опыта анионообменной хроматографии на MonoQ. Т.к. фракции G4, G5 и G6 содержат тяжелую цепь массой 110 кДа с достаточной чистотой, их объединяли и использовали для дальнейшей очистки посредством эксклюзионной хроматографии. Соответствующую хроматограмму, а также окрашенный серебром электрофоретический гель с большинством фракций можно видеть на фигуре 12 и левой стороне фигуры 13, соответственно. Все четыре подвида тяжелой цепи явно присутствуют в образце, но их элюируют из колонки в разные моменты времени по причине их разных молекулярных масс и размеров. Полноразмерная тяжелая цепь (180 кДа) является наиболее крупным из всех подвидов FVIII. Таким образом, она может достигать наименьшего объема из всех подвидов и подвергаться элюированию первым из всех, что можно видеть как фракции C4-C7 на геле. Во фракциях C9-C11 виден второй пик, соответствующий укороченной тяжелой цепи массой 150 кДа. Наиболее выраженный пик, как и ожидали, соответствует укороченному фрагменту тяжелой цепи 110 кДа, которая начинает элюироваться во фракции D1 и продолжает до фракции D9. Фрагменты массой 150 кДа и 110 кДа четко отделены друг от друга, но также видно, что следы тяжелой цепи без B-домена 90 кДа загрязняют фракцию D5 и последующие. Подвиды массой 110 кДа и 90 кДа, по-видимому, могут проникать через поры схожего размера, что неудивительно, учитывая их различия в молекулярной массе всего в 20 кДа. Однако интенсивность в случае подвидов без B-домена массой 90 кДа является очень низкой по сравнению с целевым белком массой 110 кДа, и фракции D2, D3 и D4 выглядят абсолютно чистыми.
Пример 7: Очистка подвидов FVIII небольшого масштаба - очистка полноразмерной тяжелой цепи на второй стадии хроматографии
Элюат анионообменной хроматографии служит в качестве исходного материала для дальнейшей очистки и заключительной очистки полноразмерного фрагмента тяжелой цепи. Фракции F4, F5 и F6, показанные на фигуре 15, в основном, состоят из подвидов массой 180 кДа. Минорные примеси представляют собой укороченную тяжелую цепь (110 кДа) и фрагмент тяжелой цепи без B-домена (90 кДа), но также, в меньшей степени, укороченного варианта тяжелой цепи массой 150 кДа. Эти фракции объединяли и использовали для эксклюзионной хроматографии. Соответствующая хроматограмма показана на фигуре 14, а соответствующий ПААГ с SDS показан на левой стороне фигуры 15. Концентрация белка в этом эксперименте, как правило, является более высокой по сравнению с результатами очистки укороченного фрагмента тяжелой цепи массой 110 кДа. Таким образом, поглощение является более высоким, и сигналы при электрофорезе в ПААГ в присутствии SDS являются более интенсивными. Как указано выше, полноразмерный фрагмент массой 180 кДа является первым подвидом, элюируемым из колонки. Он выглядит как крупный пик с поглощением приблизительно 70 мЕА на хроматограмме во фракциях C4-D1. На соответствующем окрашенном серебром ПААГ с SDS четко видно, что этот пик соответствует исключительно полноразмерной тяжелой цепи массой 180 кДа, но также есть контаминация укороченной тяжелой цепью массой 150 кДа во фракциях C10-D1. Несмотря на это, первая половина пика (фракции C4-C9) выглядит определенно чистой. Укороченная тяжелая цепь массой 150 кДа видна только на электрофоретическом геле, но не на хроматограмме, причиной чего может являться то, что ее небольшое количество элюируют в момент, в который все еще элюируют полноразмерный фрагмент массой 180 кДа. Укороченный фрагмент тяжелой цепи массой 110 кДа, а также фрагмент тяжелой цепи без B-домена можно получать в виде конкретных пиков с достаточно низкой интенсивностью. Оба также видны на ПААГ с SDS во фракциях D3-D8 и D6-D9, соответственно. Как уже было видно в примере 6, имеет место достаточное разделение видов массой 150 кДа и 110 кДа. Полноразмерную тяжелую цепь и тяжелую цепь массой 150 кДа разделяли не так хорошо, что делает необходимым тщательное объединение фракций для получения совокупностей чистых продуктов. То же самое верно для видов массой 110 кДа и тяжелой цепи без B-домена массой 90 кДа. Они не разделены полностью, и в этом случае также необходимо тщательное объединение фракций.
Пример 8: Очистка подвидов FVIII небольшого масштаба - хроматография гидрофобных взаимодействий на второй стадии хроматографии
Подход хроматографии гидрофобных взаимодействий тестировали в фазе небольшого масштаба в качестве возможного альтернативного способа разделения полноразмерной тяжелой цепи (180 кДа) и укороченного фрагмента тяжелой цепи (150 кДа), характеристики которых при анионообменной хроматографии схожи, что делает их разделение достаточно трудным.
Хроматограмма фазы двухмерного элюирования обработанного фурином элюата SourceS показана на фигуре 16. Общий способ двухмерной хроматографии гидрофобных взаимодействий осуществляют по соответствующим (предпочтительным) вариантам осуществления, подробно описанным выше в разделе "Подробное описание изобретения". После завершения введения образца осуществляют кратковременную фазу промывки уравновешивающим буфером. Разница электропроводности составляет всего приблизительно 2 мСм/см, но этого, по-видимому, достаточно, чтобы вызвать повышение УФ-сигнала. Это первое плечо, составляющее всего приблизительно 4 мЕА поглощения УФ, можно видеть на соответствующих ПААГ с (фигуры 17 и 18) в виде фракций №№ A5-B4. В основном, они соответствуют подвидам укороченной тяжелой цепи массой 150 кДа, что свидетельствует о том, что они связываются слабее всего, и их элюируют уже при небольшом снижении электропроводности.
Сама фаза элюирования включает два линейных градиента, смежных друг с другом. Первый элюирующий буфер не содержит хлорид натрия, что приводит к быстрому начальному снижению электропроводности. После достижения некоторого уровня электропроводности приблизительно 3 мСм/см в колонку вводят второй элюирующий буфер. Он содержит этиленгликоль и, таким образом, даже еще больше снижает электропроводность до менее 1 мСм/см. Пик элюирования не является таким определенным, как в случае смолы MonoQ. Скорее он представляет собой переход широко элюируемых белков, не отделяемых четко друг от друга. Фактическая композиция фракций во время элюирования видна только на ПААГ с SDS. УФ-сигнал резко повышается с началом первого градиента, что приводит к очень размытому пику с плечом на нисходящей стороне, распространяющемуся до начала второго градиента. На ПААГ с SDS показано, что эта область элюирования, в основном, соответствует полноразмерному фрагменту тяжелой цепи (180 кДа), а также укороченному фрагменту тяжелой цепи массой 110 кДа и фрагменту без B-домена массой 90 кДа, все из которых начинают высвобождаться более или менее в одно время. Плечо в случае фракций C12-D6 может соответствовать укороченному фрагменту массой 110 кДа, по-видимому, элюируемому второй раз в этот момент времени. Второй градиент с содержащим этиленгликоль элюирующим буфером приводит к неструктурированному паттерну неуклонно снижающихся УФ-сигналов. Как известно из более ранних экспериментов, эта область соответствует элюированию небольших количеств подвидов массой 180 кДа, 110 кДа и 90 кДа. Соответствующая легкая цепь массой 80 кДа распределяется по всей фазе элюирования. Ее интенсивность варьируется относительно общей интенсивности УФ-сигнала. И наконец, заметно, что укороченный фрагмент тяжелой цепи массой 150 кДа смещается вперед, т.к. его элюируют раньше других уже во время фазы промывки. При самом элюировании, по существу, не разделяют другие подвиды, т.к. их элюируют более или менее тем же образом, как их вводили в колонку.
Учитывая результаты эксперимента по двухмерной HIC, следующей основной целью является отделение укороченного вида тяжелой цепи массой 150 кДа от других видов, в частности, полноразмерного фрагмента. Таким образом, следующий способ одномерного элюирования получают из двухмерной хроматографии гидрофобных взаимодействий, описанной выше. Фазу второго линейного градиента с использованием буфера с этиленгликолем пропускают, т.к., по существу, она не вносит вклад в разделение подвидов FVIII. Вместо этого фазу промывки после введения образца удваивают до десяти объемов колонки и фактическую фазу элюирования увеличивают до 40 объемов колонки для усиления разделения. Кроме того, значительно снижают нагрузку колонки. В результате снижаются общие интенсивности УФ-сигналов (фигура 19). Как видно на фигуре 20, отделение укороченного фрагмента тяжелой цепи массой 150 кДа от смежного полноразмерного фрагмента тяжелой цепи массой 180 кДа не улучшается значимо. Кроме того, собранные фракции являются сильно разведенными, и выход является, по-видимому, таким низким, что препаративный способ будет очень неэффективным.
Пример 9: Очистка подвидов FVIII небольшого масштаба - отрицательная хроматография гидрофобных взаимодействий на второй стадии хроматографии
Подход отрицательной хроматографии направлен на вымывание укороченного фрагмента тяжелой цепи массой 150 кДа во время утечки и фазы промывки, в то время как считают, что другие подвиды остаются связанными с колонкой. Предполагают, что эти подвиды связываются так слабо, что они могут спонтанно высвобождаться просто при движении проходящей подвижной фазы. Обогащенную подвидами массой 150 кДа совокупность элюата MonoQ используют в качестве нагрузки, электропроводность которой повышают для связывания с колонкой. По этой причине исходную фазу промывки значительно удлиняют. На фигуре 21 показано, что емкость колонки превышена приблизительно на фракции A9. В этот момент возникает утечка, что приводит к повышению УФ-сигнала.
Электрофорез в ПААГ в присутствие SDS (фигуре 22) показал, что даже утечка (фракции A10-A12) содержит высокоочищенный укороченный фрагмент тяжелой цепи массой 150 кДа. УФ-сигнал снижается с началом фазы промывки на фракции B1 и до конца фазы. Соответствующие фракции на ПААГ с SDS (B1-C2), в основном, соответствуют укороченному фрагменту тяжелой цепи массой 150 кДа, хотя также наблюдают следы подвидов массой 110 кДа и 90 кДа и даже удлиненной легкой цепи массой 120 кДа, что может являться результатом неполного созревания с помощью фурина перед стадией очистки на MonoQ. Само элюирование осуществляют в виде быстрой стадии с использованием 100% элюирующего буфера. Это приводит к быстрому элюированию всех оставшихся белков FVIII из колонки. Примечательно, что почти все количество полноразмерного фрагмента тяжелой цепи массой 180 кДа элюируют в этот момент времени, а не ранее. По-видимому, он связывается гораздо сильнее, чем другие, т.к. во время утечки и фазы промывки не обнаруживают подвиды массой 180 кДа. Оба подвида легко можно разделять в отрицательном режиме, достигая удовлетворительного результата.
Пример 10: Крупномасштабная (препаративная) очистка подвидов FVIII
Очистка подвидов FVIII препаративного масштаба включает исходную стадию анионообменной хроматографии на MonoQ для обогащения желаемого фрагмента тяжелой цепи с последующей заключительной стадией на колонке для крупномасштабной эксклюзионной хроматографии, разделяющая способность которой является достаточной для отделения других подвидов, считающихся примесями. Фрагмент тяжелой цепи без B-домена (90 кДа) является исключением, т.к. для этого подвида стадию эксклюзионной хроматографии пропускают. Он уже очищен до удовлетворительной степени на стадии AIEX на MonoQ и не требует дополнительной заключительной очистки. Конечной стадией для всех четырех разных подвидов является концентрирование из-за сильного разведения во время эксклюзионной хроматографии. Его осуществляют с помощью еще одной стадии AIEX на анионообменной смоле SourceQ.
На фигуре 23 представлен обзор всего способа для соответствующих подвидов FVIII.
Пример 11: Крупномасштабная (препаративная) очистка подвидов FVIII - первая стадия хроматографии
Анионообменная хроматография является первичной стадией очистки молекулярных подвидов FVIII, и с помощью нее достигают приблизительного разделения всех четырех фрагментов тяжелой цепи таким образом, что подходящие фракции можно объединять для дальнейшей очистки. На фигуре 24 показана первая хроматограмма фазы элюирования стадии AIEX на колонке MonoQ крупного масштаба. Исходный материал B14390000-30 разделяют модифицированным стандартным способом, описанным выше, и получают характерный паттерн элюирования, уже известный из экспериментов небольшого масштаба. Получаемое в фазе элюирования объединяют в восьми совокупностях продукта, каждая из которых содержит конкретный фрагмент тяжелой цепи в очищенной и обогащенной форме. Как известно, в первую половину элюирования доминируют по-разному гликозилированные полноразмерные варианты тяжелой цепи, элюируемые в виде более или менее отдельных пиков. Эти пики, которые легко можно отличать от соседних пиков, используют для совокупностей отдельных продуктов, но не подвергают дальнейшей оценке.
В таблице 15 показано, как осуществляют объединение фракций, и что первые четыре совокупности продуктов E1-E4 соответствуют по-разному гликозилированным вариантам полноразмерной тяжелой цепи. Наиболее многочисленную полноразмерную тяжелую цепь собирают в совокупности продукта E5, содержащей фракции 2.C2-2.D3 и достигают приблизительной концентрации белка 0,689 мг/мл. С помощью электрофореза в ПААГ в присутствии SDS, показанного на фигуре 25, также подтверждают чистоту совокупности продукта E5, и дополнительно показано, что этот вариант полноразмерной тяжелой цепи является наиболее выделяющимся, т.к. его концентрация является наиболее высокой. Кроме того, все другие варианты полноразмерной тяжелой цепи (E1-E4) демонстрируют почти тот же паттерн при электрофорезе в ПААГ в присутствии SDS, наблюдают лишь небольшое различие в положении соответствующих полос, что подтверждает предположение о разном гликозилировании B-домена. Фракции №№ 2.D7-2.E6 содержат укороченный фрагмент тяжелой цепи с молекулярной массой 150 кДа, но из более ранних экспериментов известно, что эта фракция, как правило, контаминирована полноразмерной тяжелой цепью, что также видно на изображении ПААГ с SDS. Совокупности продукта E6 соответствуют две полосы ~180 кДа и ~150 кДа с относительно схожей интенсивности, что свидетельствует о сравнимых количествах обоих. Фракции 2.D4, 2.D5 и 2.D6 не используют для какой-либо из обеих смежных совокупностей продукта, т.к. эти фракции содержат смесь подвидов массой 180 кДа и 150 кДа, которые будут контаминировать любую из них. Совокупность продукта E7 состоит из фракций 2.E7-3.A7 и содержит укороченный фрагмент тяжелой цепи массой 110 кДа. Соответствующий пик на хроматограмме является гораздо лучше отделенным от предшествующих пиков, и на ПААГ с SDS также виден, в основном, укороченный фрагмент тяжелой цепи, соответствующий приблизительно 110 кДа, хотя также определяют следы полноразмерной тяжелой цепи. Восьмая совокупность продукта содержит фрагмент тяжелой цепи без B-домена с молекулярной массой 90 кДа, собираемый в фракциях 3.B8-3.E1.
На хроматограмме видно, что пики подвидов массой 90 кДа являются достаточно низкими, и, таким образом, неудивительно, что концентрация белка в этой совокупности продукта, составляющая 0,025 мг/мл, является очень низкой. С другой стороны, эти пики представляют собой базовую линию, отделенную от всего того, что уже элюировали, и, таким образом, чистота этой фракции является удовлетворительной. Фактически, это позволяет пропускать стадию заключительной очистки посредством эксклюзионной хроматографии и переходить сразу к концентрированию. В то же время, очевидно, что в исходном материале присутствуют очень отличающиеся количества четырех подвидов, и простое их разделение является не единственной проблемой. Т.к. в исходном материале содержится избыток полноразмерной тяжелой цепи, сбор достаточного количества менее избыточных подвидов кажется достаточно сложным. В этом опыте совокупность продукта E6, содержащую достаточное количество укороченного фрагмента тяжелой цепи массой 150 кДа, выбирают для последующей очистки на колонке для эксклюзионной хроматографии препаративного масштаба. В отличие от этого, совокупность продукта E8, содержащую фрагмент тяжелой цепи без B-домена массой 90 кДа, будут напрямую концентрировать с помощью стадии AIEX на SourceQ, пропускают любой другой тип очистки или заключительной очистки. Соответствующие результаты будут описаны далее.
Таблица 15: Схема объединения для стадии очистки посредством AIEX элюата SourceS B14390000-30 на колонке с MonoQ препаративного масштаба, показанная на фигуре 24.
Таблица 16: Схема объединения для стадии очистки посредством AIEX элюата SourceS B14390000-30 на колонке с MonoQ препаративного масштаба, показанная на фигуре 26.
Второй пример фазы элюирования AIEX препаративного масштаба показан на фигуре 26 и фигуре 27 для соответствующего изображения ПААГ с SDS. Общий способ объединения, в целом, не отличается от описанного выше способа. Обзор объединенных фракций и соответствующих концентраций белков можно найти в таблице 16.
Совокупности продукта, обозначенные как E2 и E3, содержат полноразмерную тяжелую цепь и укороченный фрагмент тяжелой цепи массой 110 кДа и представляют собой интересующие фракции для дальнейшей очистки и заключительной очистки на стадии эксклюзионной хроматографии препаративного масштаба. Не все фракции видны при электрофорезе в ПААГ в присутствии SDS, и, таким образом, фракции, используемые для объединения, частично определяют оптическими способами. Вместо этого, доступны данные анализа обращенно-фазовой ВЭЖХ C4 (таблица 17), дающие представление о композиции совокупностей продукта E2 и E3. Эти данные свидетельствуют о том, что совокупность продукта E2 полноразмерной тяжелой цепи уже содержит приблизительно 91% целевого белка, включающие все варианты полноразмерной тяжелой цепи массой 180 кДа, а также обоих вариантов легкой цепи. Совокупность продукта E3 не демонстрирует равную чистоту после первой стадии AIEX, но 82,5% целевого белка с концентрацией белка 0,119 мг/мл, по-видимому, является хорошей основной для дальнейшей обработки.
Таблица 17: Композиция совокупностей продукта E2 (полноразмерной тяжелой цепи) и E3 (укороченного фрагмента тяжелой цепи с молекулярной массой 110 кДа), определенная посредством анализа обращенно-фазовой ВЭЖХ C4. Совокупность продукта E2 содержит приблизительно 91% целевого белка, включающие все полноразмерные фрагменты тяжелой цепи, а также оба варианта легкой цепи. Совокупность продукта E3 содержит приблизительно 82,5% целевого белка относительно укороченного фрагмента тяжелой цепи массой 110 кДа и обоих вариантов легкой цепи.
Пример 12: Крупномасштабная (препаративная) очистка подвидов FVIII - очистка и концентрирование полноразмерной тяжелой цепи (180 кДа) на второй и третьей стадии хроматографии
Как показано на блок-схеме способа на фигуре 23, очистка полноразмерной тяжелой цепи состоит из трех стадий AIEX и SEC в качестве стадий истинной очистки и еще одной стадии AIEX для концентрирования. Основываясь на оценке электрофореза в ПААГ в присутствии SDS после первой очистки посредством AIEX, выбирают наиболее перспективные фракции, демонстрирующие высокое содержание белка и низкие доли примесей, объединяют их и вводят в колонку для препаративной SEC. Собранный продукт эксклюзионной хроматографии далее вводят в колонку с SourceQ и, в конечном итоге, концентрируют посредством ступенчатого элюирования. Соответствующие результаты будут описаны далее.
На фигуре 28 показана последующая очистка совокупности продукта E2 AIEX, содержащей обогащенную полноразмерную тяжелую цепь массой 180 кДа, на колонке для крупномасштабной эксклюзионной хроматографии. Общий способ SEC препаративного масштаба можно найти в соответствующем варианте осуществления в разделе "Подробное описание изобретения" выше. Считают, что минорные примеси соответствуют укороченному фрагменту тяжелой цепи массой 150 кДа, который невозможно полностью отделить посредством AIEX. Наиболее выделяющийся пик на хроматограмме соответствует интенсивности поглощения приблизительно 50 мЕА и начинает элюироваться в фракции 1.B5. На изображении окрашенного серебром ПААГ с SDS (фигура 29) показано, что фракции 1.B5-1.B11, в основном, состоят из желаемой полноразмерной тяжелой цепи (180 кДа) вместе с легкой цепью массой 80 кДа. Укороченный фрагмент тяжелой цепи массой 150 кДа элюируют в фракциях 1.C1-1.C4, которые нельзя определить на хроматограмме. Он выглядит больше как размывание пика подвидов массой 180 кДа, но фактически представляет собой подвиды массой 150 кДа. На изображении ПААГ с SDS также видно, что подвиды с молекулярной массой 180 кДа и 150 кДа склонны перекрываться в задних фракциях целевого пика, что делает их неподходящими для объединения. Два пика с достаточно низкими интенсивностями появляются в фракциях 1.C6-1.C9 и 1.C10-1.D3, соответственно. Эти пики соответствуют укороченному фрагменту тяжелой цепи массой 110 кДа и фрагменту тяжелой цепи без B-домена, и оба из них четко отделяются от пика желаемой полноразмерной тяжелой цепи.
Т.к. эксклюзионная хроматография является конечной стадией истинной очистки, необходимо тщательно подходить к вопросу о том, какие фракции следует включать в конечную совокупность продукта. С одной стороны, пропуск фракций в начале и конце целевого пика может снижать вероятность попадания других подвидов в совокупность продукта, но с другой стороны это значительно снижает выход, т.к. каждая фракция, неиспользуемая для объединения, равна потере приблизительно 1 мг общего белка или даже больше. Совокупность продукта, включающая фракции 1.B7-1.B10, вероятно, представляет собой лучший компромисс между достижением приемлемой чистоты и поддержанием эффективности способа. Этот пик продукта обозначают как E1, и его наиболее значимые параметры указаны в таблицах 18 и 19.
Конечный объем образца составляет приблизительно 70 мл при концентрации белка 0,134 мг/мл, что дает приблизительно 10 мг белка полноразмерной тяжелой цепи FVIII. Чистота лишь немного повышается до 92% целевого белка, при этом укороченная тяжелая цепь массой 150 кДа все еще представляет собой основной источник контаминации (5,71%).
Таблица 18: Схема объединения для стадии очистки посредством SEC совокупности элюата E2 AIEX (полноразмерной тяжелой цепи массой180 кДа) на колонке для эксклюзионной хроматографии препаративного масштаба.
Таблица 19: Композиция совокупности продукта E1 (полноразмерной тяжелой цепи), полученной посредством эксклюзионной хроматографии препаративного масштаба, определяемая посредством анализа обращенно-фазовой ВЭЖХ C4.
Из-за разведения на колонке для SEC необходимо осуществлять стадию концентрирования разведенных элюатов для достижения желаемой конечной концентрации >0,3 мг/мл. Разведенные фракции подвергают еще одной стадии анионообменной хроматографии на смоле Source30Q. Ступенчатый градиент, по своей композиции эквивалентный желаемой конечной композиции буфера, приводит к незамедлительному элюированию всего продукта, связанного с колонкой. Совокупность продукта E1, содержащую фракции SEC 1.B7-1.B10, используют для второй стадии AIEX для концентрирования и элюируют в ступенчатом градиенте, как показано на фигуре 30. Вообще не наблюдали эффекта разделения, вместо этого, весь белок элюировали, начиная с фракции 1.A6 и наблюдая размывание пика до фракции 1.B7. Таким образом, все фракции 1.A6-1.B8 объединяют в конечную совокупность продукта, что приводит к объему продукта приблизительно 7 мл. При последующем измерении УФ для определения концентрации белка получают значение приблизительно 0,982 мг/мл, что соответствует 6,85 мг общего белка. На фигуре 31 показаны два изображения электрофореза в геле в присутствии SDS с проявкой окрашивания серебром на левой стороне и вестерн-блоттингом aFVIII на правой стороне. На обоих из них показан исключительно полноразмерный фрагмент тяжелой цепи в комбинации с вариантом легкой цепи 80 кДа, но никаких других сигналов между ними. Данные обращенно-фазовой ВЭЖХ C4 также свидетельствуют о получении удовлетворительных результатов, как показано в таблице 20. Раствор конечного продукта полноразмерной тяжелой цепи массой 180 кДа содержит 94,52% целевого белка, включая все варианты полноразмерной тяжелой цепи и оба варианта легкой цепи. Для сравнения, лишь менее 6% всего количества белка представляют собой примеси, в основном, соответствующие укороченной тяжелой цепи с 3,28% и 1,76% видов массой 150 кДа и 110 кДа, соответственно.
Таблица 20: Композиция совокупности продукта E1 (полноразмерной тяжелой цепи), полученной посредством AIEX препаративного масштаба на SourceQ, определяемая посредством анализа обращенно-фазовой ВЭЖХ C4.
Этот способ очистки полноразмерной тяжелой цепи повторяли несколько раз для получения желаемого количества белка. Соответствующие данные не представлены.
Т.к. хроматографические смолы, используемые в экспериментах небольшого масштаба и способе препаративной очистки, немного отличаются, интерес представляет оценка различий характеристик и разрешения. На фигуре 32 показано наложение опыта по определению осуществимости и препаративной очистки полноразмерной тяжелой цепи массой 180 кДа, осуществляемых в сравнимых условиях. Подвижные буферы, вводимый образец, продолжительность обработки и длительность фазы элюирования схожи для обоих опытов.
Способы включают фазы элюирования в 1,5 объемах колонки, что делает простым их сравнение, учитывая, что ось x преобразуют в объемы колонки. Кривые сдвинуты таким образом, что обе имеют одну и ту же начальную точку, в этом случае представляющей собой конец стадии впрыскивания. Элюирование в опыте по определению осуществимости, показанное сплошной линией, начинается приблизительно на 0,36 CV, в то время как в препаративном опыте, показанном короткой штриховой пунктирной линией, наблюдают небольшую задержку на 0,02 CV. Различие является незначительным, и, учитывая очень разные размеры колонок и пропускаемых объемов буферов, кажется, не имеет смысла делать заявления на основе значений. Несмотря на это, обе кривые кажутся идентичными в отношении общей формы и количества объемов колонки, необходимого для элюирования первого фрагмента, полноразмерной тяжелой цепи массой 180 кДа. В этом случае, колонка Superdex 200 Increase соответствует приблизительно трети длины колонки Superdex 200 Prep Grade, что означает, что эффективность разделения Superdex 200 Increase приблизительно в три раза лучше Superdex200 Prep Grade. Однако, увеличение масштаба не осуществляли в соответствии с каким-либо постоянным значением, но вместо этого оно зависело от доступности колонок этого размера. Таким образом, даже более благоприятно, что обе смолы с соответствующей геометрией обладают более или менее схожими характеристиками, т.к. это делает эксперименты SEC по определению осуществимости сравнимыми с препаративной эксклюзионной очисткой.
Пример 13: Крупномасштабная (препаративная) очистка подвидов FVIII - очистка и концентрирование укороченного фрагмента тяжелой цепи (150 кДа) на второй и третьей стадии хроматографии
Способ очистки укороченного фрагмента тяжелой цепи массой 150 кДа, по существу, схож со способом, используемым для очистки полноразмерной тяжелой цепи, описанным в предыдущих разделах. Т.к. типичное плечо, как правило, соответствующее подвидам массой 150 кДа, приводит к получению гораздо меньшего количества фракций с достаточной чистотой, довольно трудно очистить достаточные количества этого типа подвидов FVIII. Учитывая необходимое количество опытов и общее количество каждого подвида в конце, на фигуре 43 показано, что за то же количество опытов получают лишь приблизительно одну десятую укороченного фрагмента тяжелой цепи (6,74 мг) по сравнению с полноразмерной тяжелой цепью (62,97 мг).
Очистка подвидов укороченной тяжелой цепи с молекулярной массой 150 кДа (совокупность продукта E6 AIEX на MonoQ) посредством эксклюзионной хроматографии показана на фигуре 33. Общий профиль элюирования отличается от профиля при очистке полноразмерного фрагмента тяжелой цепи. Т.к. его молекулярная масса на 30 кДа меньше массы полноразмерной тяжелой цепи, он может достигать большего количества пор и, таким образом, большего объема смолы. Его элюирование происходит где-то между подвидами массой 180 кДа и укороченным фрагментом тяжелой цепи массой 110 кДа, но т.к. для этого фрагмента не проводили какие-либо эксперименты по определению осуществимости, точные характеристики элюирования неизвестны. На всем протяжении фазы элюирования появлялись различные пики с разными интенсивностями. УФ-сигнал начинает повышаться во фракции 1.B4 и дает двойную, подобную пику структуру с максимальными интенсивностями, определяемыми во фракциях 1.B6 и 1.B9. Как определяли с помощью электрофореза в ПААГ в присутствии SDS, оба пика соответствуют остаткам полноразмерной тяжелой цепи (180 кДа) (см. фигура 34). Хотя существуют разные типы полноразмерных фрагментов тяжелой цепи по причине разного гликозилирования B-домена, неизвестно, почему их элюируют в виде более или менее отдельных пиков при эксклюзионной хроматографии. Кроме того, при элюировании обогащенных подвидов массой 180 кДа не наблюдали отдельные пики полноразмерной тяжелой цепи. Фракции 1.B10-1.C5 содержат пик с наибольшей интенсивностью, очевидно соответствующий желаемому укороченному фрагменту тяжелой цепи массой 150 кДа. Но количество фракций, содержащих исключительно желаемый фрагмент и при этом имеющих удовлетворительные концентрации белка, крайне ограничено. Фракция 1.B11 все еще контаминирована полноразмерной тяжелой цепью массой 180 кДа, но следующие фракции выглядят почти чистыми, хотя фракция 1.C5 имеет низкую концентрацию белка и содержит некоторое количество детектируемой удлиненной легкой цепи массой 120 кДа. Элюирование укороченного фрагмента тяжелой цепи 110 кДа начинается во фракции 1.C6, а затем смешивается с тяжелой цепью без B-домена, что не выглядит как отдельный пик. Из-за высоких концентраций белка и, таким образом, низкой контаминации другими подвидами, фракции 1.C1, 1.C2 и 1.C3 выбирают для использования в качестве совокупности продукта, обозначаемой как E2. Учитывая измерения концентрации белка для отдельных фракций, вычисляют, что вся совокупность имеет общее количество белка 2,67 мг при довольно низкой концентрации белка.
Таблица 21: Схема объединения для стадии очистки SEC совокупности элюата E6 AIEX на колонке для эксклюзионной хроматографии препаративного масштаба. Значения объема и общего белка не определяют с помощью отдельного измерения, а скорее представляют в виде суммы значений конкретных фракций, используемых для объединения.
Для концентрирования ранее подвергнутых заключительной очистке препаративной SEC фракции E2 и другой схожей совокупности элюата SEC укороченного фрагмента тяжелой цепи массой 150 кДа, их объединяют и подвергают стадии AIEX на SourceQ. Помимо этого, все параметры оставляют постоянными таким образом, что элюирование, как и обычно, начинают с фракции 1.A6 и продолжают до фракции 1.B7 при размывании пика, как показано на хроматограмме на фигуре 35. Высота пика составляет приблизительно 1200 мЕА, что является результатом большего количества нагружаемого белка в результате концентрирования двух совокупностей элюата SEC за одну стадию AIEX вместо одной совокупности. Т.к. основным приоритетом являлась как можно меньшая потеря продукта, все фракции с поглощением УФ (1.A6-1.B8) используют для объединения продукта.
Соответствующий электрофорез в геле в присутствии SDS показан на фигуре 36 с проявкой окрашивания серебром на левой стороне и вестерн-блоттингом FVIII на правой стороне, где обозначения E1 и E2 соответствуют двум разведениям (1:40 и 1:120 для проявки окрашивания серебром и 1:53 и 1:160 для вестерн-блоттинга FVIII) конечной совокупности продукта. При проявке окрашивания серебром не определяли каких-либо дополнительных полос, что свидетельствует о том, что композиция состоит исключительно из укороченных видов тяжелой цепи массой 150 кДа в комбинации с вариантом легкой цепи массой 80 кДа. В отличие от этого, вестерн-блоттинг FVIII является гораздо более чувствительным, и наблюдают низкое окрашивание в области 180 кДа, что позволяет предполагать, что все еще остались по меньшей мере минорные примеси полноразмерной тяжелой цепи. Как уже описано в обсуждении стадии эксклюзионной хроматографии укороченных видов тяжелой цепи массой 150 кДа, выход одной последовательности очистки для этого подвида является довольно низким. Количество всего 2,5 мг можно очищать на стадии SEC после одного пропускания. Таким образом, необходимо повторять соответствующую последовательности очистки несколько раз для очистки необходимого количества 10 мг чистой укороченной тяжелой цепи FVIII массой 150 кДа. Эти опыты осуществляют тем же способом, и далее их не описывают, т.к. результаты те же. Всего четыре совокупности элюата SEC концентрируют за две последовательные стадии AIEX на Source30Q, а затем объединяют в одну конечную совокупность продукта, анализируемую посредством обращенно-фазовой ВЭЖХ C4.
Соответствующие данные представлены в таблице 22, при этом удлиненная легкая цепь, легкая цепь и тяжелая цепь массой 150 кДа указаны как виды целевого белка, в то время как все другие подвиды считают примесями. Процент целевого белка составляет приблизительно 92%, что означает, что цели получить менее 10% других подвидов можно достичь для конечной совокупности продукта укороченного фрагмента тяжелой цепи с молекулярной массой 150 кДа.
Таблица 22: Композиция конечной совокупности продукта E1 для укороченного фрагмента тяжелой цепи массой 150 кДа, полученной в двух опытах AIEX препаративного масштаба на SourceQ, определяемая посредством анализа обращенно-фазовой ВЭЖХ C4.
Пример 14: Крупномасштабная (препаративная) очистка подвидов FVIII - очистка и концентрирование укороченного фрагмента тяжелой цепи (110 кДа) на второй и третьей стадии хроматографии
Подвиды укороченной тяжелой цепи с молекулярной массой 110 кДа очищают стандартным способом, уже использованным для подвидов FVIII массой 180 кДа и 150 кДа. Т.к. пик желаемого фрагмента гораздо лучше отделен от соседних пиков на первой стадии AIEX и при эксклюзионной хроматографии, по-видимому, гораздо проще выбрать и объединить удобные фракции. Результаты представлены в следующих.
Дальнейшую заключительную очистку совокупности продукта E3 AIEX на MonoQ, содержащей укороченные подвиды тяжелой цепи массой 110 кДа, считают незатруднительной. Тяжелую цепь без B-домена массой 90 кДа уже достаточно отделили на стадии очистки посредством AIEX на MonoQ, и ожидают, что осталось лишь небольшое ее количество. На хроматограмме на фигуре 37 показаны три пика низкой интенсивности в начале. Два из них во фракциях 1.B10-1.C1 соответствуют полноразмерным вариантам тяжелой цепи, как показано на электрофоретическом геле (фигура 38). Следующий пик во фракциях 1.C2 и 1.C3 соответствует незначительным количествам укороченного фрагмента тяжелой цепи массой 150 кДа. Наиболее интенсивный пик со значениями поглощения приблизительно 10-11 мЕА соответствует укороченному фрагменту тяжелой цепи массой 110 кДа. На электрофоретическом геле с SDS показаны три фракции, содержащие желаемые подвиды, а именно 1.C4, 1.C5 и 1.C6. Фракция 1.C4 соответствует восходящей части пика, которая кажется уже относительно чистой. Максимум пика приходится на фракцию 1.C5, демонстрирующую высокую концентрацию белка и, в то же время, удовлетворительную чистоту. Нисходящая сторона пика соответствует фракции 1.C6, которая уже содержит незначительные количества фрагмента тяжелой цепи без B-домена (90 кДа).
На хроматограмме также можно видеть, что этот подвид выглядит как плечо основного пика и, таким образом, по-видимому, контаминирует нисходящую часть пика продукта. В таблице 23 показаны концентрации белка и общее количество белка во фракциях №№ 1.C4, 1.C5 и 1.C6, включающих пик продукта. Т.к. фракции 1.C4 и 1.C6 содержат незначительные количества белка, кажется нецелесообразным использовать эти фракции для объединения из-за потенциального риска контаминации. В результате, только фракцию 1.C5 будут использовать для стадии концентрирования посредством AIEX на колонке с SourceQ. Данные анализа обращенно-фазовой ВЭЖХ C4 приведены в таблице 24, и четко подтверждают правильность решения выбросить фракции 1.C4 и 1.C6, т.к. сама фракция 1.C5 содержит 8,82% примесей.
Таблица 23: Схема объединения стадии очистки SEC совокупности элюата E3 AIEX на колонке для эксклюзионной хроматографии препаративного масштаба. Для последующей стадии концентрирования на стадии AIEX на SourceQ используют только фракцию 1.C5, в то время как фракции 1.C4 и 1.C6 выбрасывают.
Таблица 24: Композиция фракции 1.C5, полученной посредством эксклюзионной хроматографии препаративного масштаба, определяемая посредством анализа обращенно-фазовой ВЭЖХ C4.
Хроматограмму стадии концентрирования посредством AIEX для укороченного фрагмента тяжелой цепи массой 110 кДа можно видеть на фигуре 39. Элюат совокупности трех конкретных опытов эксклюзионной хроматографии объединяют и концентрируют одновременно. Электропроводность сначала находится на стабильном уровне приблизительно 5 мСм/см, пока ее резко не повышают до ~30 мСм/см для быстрого элюирования всего связавшегося образца. Как видно на кривой УФ, образец начинают элюировать во фракции 1.A7, и он достигает своего максимального поглощения приблизительно 1100 мЕА во фракции 1.A9. Поглощение быстро падает во фракциях 1.A10-1.A12, а затем переходит в длинную фазу размывания, в конечном итоге достигая исходного уровня во фракции 1.B6. Фракции 1.A7-1.B8 используют для конечного объединения продукта.
Т.к. образец уже подвергали двум разным стадиям очистки, он должен содержать только укороченный фрагмент тяжелой цепи массой 110 кДа. Это также показано на фигуре 40, где приведено изображение окрашенного серебром ПААГ с SDS на левой стороне и вестерн-блоттинг FVIII на правой стороне.
На обоих виден исключительно укороченный фрагмент тяжелой цепи массой 110 кДа в комбинации с вариантом легкой цепи массой 80 кДа в нагрузке, которые исследовали перед введением в колонку. В других фракциях, а именно фильтрате, фазе промывки и первых фракциях фазы элюирования, не используемых для объединения продукта (обозначаемые как VE), не наблюдают значимые количества продукта. Это означает, что емкость колонок была достаточно высокой для связывания всего количества образца. Вторую стадию концентрирования осуществляют аналогичным образом и оба элюата объединяют в одну конечную совокупность продукта, состоящую исключительно из укороченного фрагмента тяжелой цепи массой 110 кДа. Два разных разведения, 1:147 (P1) и 1:49 (P2) для окрашивания серебром и 1:196 (P1) и 1:65 (P2) для вестерн-блоттинга FVIII, этой совокупности продукта можно видеть как почти чистый укороченный фрагмент тяжелой цепи массой 110 кДа. На изображении окрашивания серебром не видно каких-либо других подвидов, в то время как на изображении вестерн-блоттинг FVIII виден низкий сигнал полноразмерной тяжелой цепи для разведения P2. В таблице 25 приведены соответствующие аналитические данные, касающиеся композиции конечной совокупности продукта, включающей все концентрированные совокупности элюата SEC. Доля целевого белка в конечной совокупности составляет 93,7%, включая удлиненную легкую цепь массой 120 кДа и вариант легкой цепи массой 80 кДа, а также укороченный вариант тяжелой цепи массой 110 кДа. Доля примесей составляет 6,3%, что меньше 10%.
Таблица 25: Композиция совокупности продукта E1, содержащей укороченный фрагмент тяжелой цепи массой 110 кДа, полученный посредством AIEX препаративного масштаба на SourceQ, определенная посредством анализа обращенно-фазовой ВЭЖХ C4. Конечная совокупность продукта состоит из элюатов двух опытов AIEX на SourceQ, используемых для концентрирования пяти совокупностей элюатов эксклюзионной хроматографии.
Пример 15: Крупномасштабная (препаративная) очистка подвидов FVIII - концентрирование фрагмента тяжелой цепи без B-домена (90 кДа) на третьей стадии хроматографии
Фрагмент тяжелой цепи без B-домена является самым малочисленным подвидом FVIII в исходном материале B1439000-30. Для получения удовлетворительного количества этого подвида необходимо осуществлять огромное количество очисток посредством AIEX, для чего потребуется большой объем этого исходного материала, доступность которого довольно ограничена. Вследствие этого, для этой цели используют второй исходный материал, обозначенный как F8_AD2_90кДа, с приблизительным содержанием подвидов массой 90 кДа ~38%. Независимо от источника, заключительную стадию эксклюзионной хроматографии пропускают и концентрируют растворы напрямую на колонке SourceQ. Доступны две колонки разных размеров, т.к. объем и общее содержание белка в обоих исходных материалах превышает емкость колонки с SourceQ небольшого размера, будут использовать более крупную из них с объемом колонки 7,0 мл. Последующее будет ограничено результатами очистки полученного B14390000-30 вида тяжелой цепи без B-домена.
Как указано выше, фрагмент тяжелой цепи без B-домена массой 90 кДа почти полностью отделен от других подвидов на стадии AIEX на MonoQ и, таким образом, для него не требуется какая-либо дополнительная очистка или заключительная очистка посредством эксклюзионной хроматографии. Т.к. он уже сильно разведен, это также приводит к получению недостаточного его количества при эксклюзионной хроматографии и, кроме того, будет вызывать большие потери этого конкретного фрагмента. Типичная совокупность продукта AIEX на MonoQ вида без B-домена массой 90 кДа, такая как совокупность продукта E8, описанная в примере 11, содержит лишь 0,025 мг/мл белка и, таким образом, делает необходимым концентрирование большего количества таких совокупностей продукта для достижения желаемого количества 10 мг целевого белка. На фигуре 41 показана фаза элюирования опыта AIEX на SourceQ для одновременного концентрирования шести совокупностей элюата MonoQ. Небольшая колонка SourceQ с объемом колонки ~3 мл больше не подходит, т.к. значительно увеличившиеся объемы продукта будут вызывать слишком большое увеличение времени удержания при комнатной температуре. Таким образом, неизбежно пришлось увеличить объем колонки приблизительно в два раза до ~7 мл для сохранения времени удержания в приемлемом диапазоне. Само элюирование схоже с элюированием, описанным выше, хотя пики выглядят более размытыми. Как уже можно было наблюдать в фазах элюирования анионообменной хроматографии на MonoQ, фрагмент тяжелой цепи без B-домена элюируют последним, т.к. для его высвобождения необходима наиболее высокая электропроводность из всех подвидов. Ступенчатый градиент на стадии AIEX на SourceQ может не проводить к достижению электропроводности, достаточно высокой для быстрого элюирования фрагмента без B-домена. Вместо, этого необходимы большие объемы элюирующего буфера для удаления всего белка из смолы, что, таким образом, вызывает размывание пиков. Однако, фракции 1.A11-1.D12 используют для конечной совокупности продукта, имеющей концентрацию белка 0,493 мг/мл и общее количество белка 9,06 мг. Соответствующий электрофоретический гель с SDS показан на фигуре 42 в виде изображения окрашенного серебром геля на левой стороне и вестерн-блоттинга FVIII на правой стороне. Хотя изображение окрашивания серебром выглядит достаточно чистым, на изображении гораздо более чувствительного вестерн-блоттинга FVIII можно видеть, что все еще остается значительное количество полноразмерной тяжелой цепи в нагрузке и разведениях совокупности элюата. С помощью анализа обращенно-фазовой ВЭЖХ C4 подтверждают, что в конечной совокупности продукта все еще присутствует 3,84% полноразмерной тяжелой цепи, но 94,49% целевого белка соответствуют целевой чистоте <10% других подвидов. Эту очистку полноразмерной тяжелой цепи повторяли несколько раз для получения желаемого количества белка.
Таблица 26: Композиция совокупности продукта E1 (фрагмента тяжелой цепи без B-домена массой 90 кДа), полученной на стадии концентрировании посредством AIEX препаративного масштаба для шести опытов AIEX, определяемая посредством анализа C4 обращенно-фазовой ВЭЖХ.
Пример 16: Обобщенные результаты крупномасштабной (препаративной) очистки
Способ препаративной очистки подвидов FVIII включает стадию AIEX на MonoQ для начального разделения, стадию SEC на смоле Superdex 200 для заключительной очистки и, наконец, стадию концентрирования на анионообменной смоле Source30Q. Полноразмерную цепь, а также два укороченных фрагмента необходимо проводить через эти три стадии для правильной очистки. Фрагмент без B-домена представляет собой легкое для очистки исключение, в случае которого пропускают стадию заключительной очистки и просто подвергают стадиям анионообменной хроматографии. На фигуре 43 представлен обзор полной программы очистки по настоящему изобретению. Для полноразмерной тяжелой цепи с молекулярной массой 180 кДа, включая все по-разному гликозилированные варианты, необходимо всего четыре опыта по очистке посредством AIEX, три опыта SEC и три опыта AIEX для концентрирования. Посредством этого получают 62,97 мг целевого белка, включая все полноразмерные варианты тяжелой цепи, а также оба варианта легкой цепи. Процентная доля примесей составляет 6,84%, или, другими словами, конечная совокупность продукта имеет чистоту 93,16%, что соответствует целевому количеству и чистоте белка. Примеси, в основном, возникают из двух укороченных видов тяжелой цепи. Укороченный фрагмент тяжелой цепи массой 150 кДа является одним из самых трудных для очистки. Для получения довольно небольшого количества 6,74 мг целевого белка, включая укороченный вид тяжелой цепи (150 кДа) и оба варианта легкой цепи, было необходимо всего четыре опыта AIEX на MonoQ, четыре опыта SEC для заключительной очистки и два опыта AIEX для концентрирования. Можно поддерживать процентную долю примесей ниже 10% (8,04%), почти полностью возникающих из полноразмерной тяжелой цепи, что соответствует цели. Укороченную тяжелую цепь массой 110 кДа очищали с помощью пяти опытов очистки посредством AIEX с последующими пятью опытами SEC для заключительной очистки и, в конечном итоге, двумя опытами AIEX для концентрирования. Конечные 8,57 мг укороченного фрагмента тяжелой цепи массой 110 кДа содержат 6,31% примесей, соответствующих всем другим подвидами. Для фрагмента тяжелой цепи без B-домена необходимы семь опытов AIEX и два опыта AIEX для концентрирования на колонке крупного масштаба с Source30Q. Этот способ очистки приводит к получению общего количества белка 15,31 мг, включая варианты подвида массой 90 кДа в комбинации с двумя вариантами легкой цепи. Процентная доля примесей составляет точно 5,00%, что представляет собой наименьшую процентную долю примесей всех подвидов, хотя и не осуществляли промежуточную стадию заключительной очистки. Таким образом, достигнуты обе цели для фрагмента тяжелой цепи без B-домена. В заключение необходимо отметить, что для всех подвидов можно достичь цели, касающейся предела в <10% примесей. Общее количество белка является удовлетворительным в случае полноразмерного фрагмента тяжелой цепи из-за его избыточности в исходном материале, но и результаты для фрагмента тяжелой цепи без B-домена находятся в приемлемом диапазоне.
Концентрация белка во всех четырех конечных совокупностях продукта составляет 0,974 мг/мл для полноразмерной тяжелой цепи, 0,568 мг/мл для укороченного фрагмента тяжелой цепи массой 150 кДа, 0,640 мг/мл для укороченного фрагмента тяжелой цепи массой 110 кДа и 0,537 мг/мл для фрагмента тяжелой цепи без B-домена. Таким образом, превышают целевой предел 0,3 мг/мл для всех совокупностей продукта. Кроме того, все виды продукта получали в желаемой буферной матрице.
В заключение необходимо отметить, что эксперименты в небольшом масштабе, в которых разные условия и параметры тестировали на четырех разных смолах, были очень важны для увеличения масштаба и способа конечной очистки. Эта конечная стратегия привела к удовлетворительным результатам. В частности, укороченный фрагмент тяжелой цепи с молекулярной массой 150 кДа достаточно трудно очистить. Кроме того, из-за низкого его содержания для этой цели также необходимо большое количество исходного материала. Несмотря на это, можно получить почти 7,0 мг этого фрагмента, что является хорошим результатом. Стратегия конечной очистки представляет собой простой способ очистки всех четырех подвидов. В таблице 27 приведены результаты по настоящему изобретению и их оценка в соответствии с предварительными условиями.
Таблица 27: Краткое изложение конечных результатов экспериментов и их оценка в соответствии с целями. Общее количество, чистота и концентрация белка приведены для всех целевых фракций, а также соответствующая их оценка, указывающая на то, смогли ли достигнуть или частично достигнуть поставленных целей.
Исходно хроматографию гидрофобных взаимодействий считали альтернативой стадии AIEX на MonoQ, т.к. с помощью нее можно элюировать укороченную тяжелую цепь массой 150 кДа с большим отделением от полноразмерной тяжелой цепи. Первые эксперименты показали, что так и происходит, но содержание подвидов массой 150 кДа кажется относительно низким для очистки. Возможным решением являлось включение отрицательной HIC в качестве альтернативы эксклюзионной хроматографии. Осуществляли один эксперимент, он был успешным и показал, что обогащенную подвидами 150 кДа совокупность можно очищать до удовлетворительной степени. В дополнительных экспериментах можно определять подходящие условия, касающиеся уровня электропроводности, как считают, оказывающего наибольшее влияние на характеристики связывания.
В конечном итоге достигали целей и получали новый и эффективный способ очистки подвидов FVIII, в также новый подход для замены стадии эксклюзионной хроматографии. Кроме того, получение растворов чистых белков всех четырех подвидов является краеугольным камнем для дальнейших исследования природы молекулярных подвидов FVIII. Кроме того, очищенные подвиды FVIII или их смесь можно использовать для лечения нарушений свертывания.
Пример 17: Функциональная характеризация очищенных подвидов FVIII - материалы и способы
Далее приведены подробности экспериментов для всех примеров, относящихся к "Функциональной характеризации очищенных подвидов FVIII".
Образцы FVIII и химические реагенты
FL-rFVIII (промежуточный материал при получении коммерчески доступного продукта FL-rFVIII, 0,23 мг/мл), полученный в клетках яичника китайского хомяка (CHO), архивные партии FL-rFVIII и коммерчески доступный лиофилизированный продукт FVIII плазмы получали в Shire, Vienna, Austria. Химические реагенты приобретали в Sigma Aldrich, MO, USA. Если не указано иначе, термин "FL-rFVIII" относится к FL-rFVIII человека, и "pdFVIII" относится к pdFVIII человека.
Очистка молекулярных видов pdFVIII и rFVIII
pdFVIII без vWF получали посредством очистки из коммерчески доступного лиофилизированного продукта FVIII плазмы. С помощью буферного раствора осуществляли восстановление множества флаконов с последующим объединением для получения гомогенного исходного материала. Разделение vWF и FVIII индуцировали химически. Захват FVIII осуществляли на аффинной колонке с антителом против FVIII. Дальнейшего истощения vWF достигали посредством хроматографии на сильной катионообменной смоле. И наконец, осуществляли дополнительную стадию заключительной очистки на сильной анионообменной смоле для замены буфера и концентрирования.
Из FL-rFVIII выделяли молекулярные виды rFVIII с разной степенью укорочения B-домена. Для предварительного разделения молекул использовали стадию анионообменной хроматографии высокого разрешения с плавным градиентом. Затем получали совокупности с обогащенными подвидами и дополнительно очищали посредством препаративной эксклюзионной хроматографии с последующим концентрированием и заменой буфера на сильной анионообменной смоле.
Электрофорез в ПААГ в присутствии SDS
Электрофорез в ПААГ в присутствии SDS осуществляли с использованием системы Novex NuPAGE SDS-PAGE (ThermoFisher Scientific, MA, USA). Образцы (каждый по 50 мкл) смешивали с 20 мкл 0,5 M йодацетамида и инкубировали в течение 30 мин при 37°C. Затем в реакционную смесь добавляли 15 мкл деионизированной воды, 25 мкл буфера для образцов NuPAGE с LDS и 10 мкл восстановителя NuPAGE и продолжали инкубацию в течение 30 мин при 37°C. Десять мкл (30 нг) каждого образца и 2 мкл неокрашенного белкового стандарта Precision Plus (Bio-Rad, CA, USA) наносили на гель NuPAGE размера мини с 7% Трис-ацетата. Электрофорез проводили в течение 90 мин при 150 В. Белковые полосы визуализировали с помощью набора для окрашивания серебром SilverQuest (ThermoFisher Scientific).
Анализ белков in silico
Для вычисления средней гидропатичности B-домена использовали инструмент BioAnnotator из Vector NTI Advance 11.
Масс-спектрометрия водородно-дейтериевого обмена
Для характеризации структурных мотивов rFVIII осуществляли масс-спектрометрию водородно-дейтериевого обмена (HDX-MS). Локальную кинетику амида при HDX в конструкции белка отслеживали после времени инкубации 3 сек, 10 сек, 30 сек, 2 мин 10 мин, 60 мин, 3 ч. и 3 дней. Все реакции HDX осуществляли при комнатной температуре (22°C), за исключением инкубации в течение 3 сек, которую осуществляли при 6°C. Реакцию мечения HDX инициировали посредством смешивания молекул rFVIII B70-rFVII с дейтериевым буфером (50 мМ буфера Трис, pH 6,7, содержащего 5 мМ CaCl2 и 260 мМ NaCl). Реакцию останавливали посредством добавления ледяного 100 мМ фосфатного буфера, pH 2,3, содержащего 100 мМ Трис(2-карбоксиэтил)фосфина и 3,3 M мочевины, и последующего быстрого замораживания в жидком азота. Дейтериевые образцы расщепляли с использованием колонки для ВЭЖХ (2,1×30 мм) (ACE, Aberdeen, UK) с пепсин-агарозой из слизистой оболочки желудка свиней (Sigma-Aldrich) и обессаливали на пре-колонке C18 2×10 мм (ACE). Обработанные пепсином пептиды подвергали жидкостной хроматографии с MS (LC-MS) с использованием колонки 2×50 мм HALO C18/1,8 мкМ (AMT, DE, USA). Пептиды элюировали с помощью градиента ацетонитрила и анализировали с помощью масс-спектрометра Orbitrap XL (разрешение 60000 при m/z 400) (ThermoFisher Scientific). Идентификацию обработанных пепсином пептидов осуществляли посредством 3 независимых анализов LC-MS/MS образца белка без дейтерия тем же способом, что и для образцов с дейтерием.
Хромогенная активность FVIII
Измерение активности FVIII осуществляли с помощью коммерчески доступного набора для хромогенного анализа активности FVIII (Siemens Healthcare, Erlangen, Germany) на автоматизированной анализаторе свертывания (BCS XP) (Siemens Healthcare). В кратком изложении, образцы, содержащие неизвестное количество функционального FVIII, добавляли в реакционную смесь, состоящую из тромбина, активированного фактора свертывания IX (FIXa), фосфолипида, фактора свертывания X (FX) и буфера, содержащего кальций. После расщепления тромбином FVIIIa образовывал комплекс с фосфолипидами, FIXa и кальцием, что приводило к активации FX. Активированный FX (FXa) измеряли фотометрически по расщеплению FXa-специфического хромогенного субстрата p-нитроанилина, и он был прямо пропорционален количеству функционального FVIII, присутствующего в образце. Референсным стандартом был коммерчески доступный FL-rFVIII (Shire), калиброванный по международному стандарту ВОЗ.
Получение агрегатов FVIII
Все образцы FVIII подвергали диализу против PBS, содержащего 0,9 мМ CaCl2 и 0,5 мМ MgCl2 (PBS++), и разводили до концентрации белка 0,122 мкМ, 0,244 мкМ или 0,61 мкМ. Для обеспечения воспроизводимости все эксперименты осуществляли по меньшей мере дважды.
Температурозависимая агрегация
Все образцы FVIII с концентрациями белка 0,122 мкМ в случае анализа высокоэффективной эксклюзионной хроматографии (ВЭЖХ-SEC) или 0,61 мкМ в случае анализа динамического светорассеяния (DLS) инкубировали при 25°C, 30°C, 35°C, 40°C, 45°C или 50°C в течение 20 ч. в полистироловых 96-луночных микропланшетах (Corning, NY, USA), закрытых с помощью устройства для заклеивания планшетов, в ридере Synergy H4 Hybrid Reader (BioTek, VT, USA) со средним встряхиванием в течение 20 сек каждые 10 мин. Затем образцы замораживали при -80°C до последующего анализа DLS и ВЭЖХ-SEC.
Зависящая от времени агрегация при 45°C
Все образцы FVIII (0,122 мкМ) инкубировали при 45°C в течение 24 ч. в полистироловых 96-луночных микропланшетах (Corning), закрытых с помощью устройства для заклеивания планшетов, в термошейкере PST-60HL Plus (Biosan, MI, USA). Образцы отбирали с разными временными интервалами и сразу замораживали при -80°C до анализа посредством ВЭЖХ-SEC.
Однородная инициация агрегации FVIII
Для получения затравки образцы FVIII (0,122 мкМ) инкубировали в течение 2, 5, 8 или 18 ч. при 45°C в полистироловых 96-луночных микропланшетах (Corning), закрытых с помощью устройства для заклеивания планшетов, в термошейкере PST-60HL Plus (Biosan). Нативные образцы FVIII (0,122 мкМ) смешивали с соответствующей затравкой в соотношении 1:1 и осуществляли зависящую от времени агрегацию при 45°C. Образцы хранили при -80°C до анализа ВЭЖХ-SEC.
Агрегация, индуцируемая встряхиванием и напряжением сдвига
Растворы FVIII с концентрацией белка 0,244 мкМ встряхивали руками в течение 10 мин в одноразовом шприце Omnifix (Braun, Melsungen, Germany). Напряжения сдвига достигали посредством впрыскивания раствора через инфузионные системы с иглами-бабочками с защитой игл (23G× ''; L=35 см, V=0,25 мл) от Terumo Europe, Belgium. Эти хорошо контролируемые стрессовые условия должны представлять собой потенциальное неправильное обращение с продуктами rFVIII во время восстановления и использования. Все образцы после воздействия стрессовых условий хранили при -80°C до анализа частиц на основе проточной цитометрии.
''; L=35 см, V=0,25 мл) от Terumo Europe, Belgium. Эти хорошо контролируемые стрессовые условия должны представлять собой потенциальное неправильное обращение с продуктами rFVIII во время восстановления и использования. Все образцы после воздействия стрессовых условий хранили при -80°C до анализа частиц на основе проточной цитометрии.
Динамическое светорассеяние
DLS осуществляли с использованием Malvern NanoZetasizer ZSP (Malvern Instruments, Malvern, UK). Все образцы (0,244 мкМ) центрифугировали (Centrifuge 5415C) (Eppendorf, Vienna, Austria) при 10000 об./мин. в течение 5 мин и 60 мкл образца помещали в одноразовую микрокювету ZEN0040. Рабочую температуру устанавливали на 25°C при времени уравновешивания 2 мин. Угол устанавливали на 173° обратного рассеяния для определения гидродинамического диаметра белка. Этот параметр использовали для анализа эффективного размера белков посредством DLS. Осуществляли по меньшей мере три опыта для получения среднего результата.
Высокоэффективная эксклюзионная хроматография
ВЭЖХ-SEC осуществляли при комнатной температуре с использованием колонки TSKgel G4000SWxl (7,8×300 мм) (Tosoh Bioscience, Tokio, Japan) и колонки TSK guard (6×40 мм) (Tosoh Bioscience), соединенных с системой ВЭЖХ 1260 Infinity (Agilent Technologies, Santa Clara, CA, USA). SEC осуществляли в изократических условиях при скорости потока 0,3 мл/мин с использованием водного буфера, состоящего из 50 мМ Трис-HCl, 5 мМ CaCl2, 400 мМ NaCl и 0,05% NaN3, pH 7,0. Объем образца 100 мкл (концентрация белка 0,122 мкМ) смешивали с 3 мкл 1 мМ тиофлавина T (ThT), а затем вводили в колонку. Для мониторинга элюирования белка с использованием флуоресцентной детекции длины волн возбуждения и испускания устанавливали на 280 нм и нулевой порядок, соответственно. Флуоресценцию ThT подвергали мониторингу с использованием возбуждения при 440 нм и испускания при длине волны нулевого порядка. Пики, элюируемые с мертвым объемом (время удержания 18,0-21,2 мин), с временем удержания 21,2-27,0 мин и 27,0-43,0 мин обозначали как растворимые агрегаты белков, олигомеры и мономеры, соответственно. Количество агрегатов, олигомеров и мономеров вычисляли как процентную долю общей площади всех пиков на хроматограмме. Связывание ThT вычисляли как соотношение сигналов флуоресценции ThT и самого белка. Стандарт для гель-фильтрации на основе белка (Bio-Rad) использовали для анализа образца для мониторинга оптимальных характеристик колонки. Все образцы анализировали в случайном порядке.
Аппроксимация кривой и статистический анализа
Аппроксимацию кривой осуществляли с помощью GraphPad Prism 6. Кинетические константы скорости для образования олигомера (kолиго [ч.-1]) получали посредством аппроксимации данных к однофазной модели ассоциации в соответствии со следующим уравнением: y=y0+(плато-y0)*[1-exp(-kолиго*x)]; y=количество олигомера [%]; x=время [ч.]; y0=значение y, когда x равно нулю; плато=значение y при времени, равном бесконечности. Скорости образования агрегатов (kагг [ч.-1]) получали посредством аппроксимации данных к сигмоидальной модели Больцмана в соответствии со следующим уравнением: y=yмин+(yмакс-yмин)/(1+exp[(x1/2-x)/(1/kagg)]; y=количество агрегата [%]; yмин=y во время лаг-фазы; yмакс=y после окончания агрегации; x=время [ч.]; x1/2=время при полумаксимальном y (Uversky et al., 2001).
Статистические различия определяли с помощью GraphPad Prism 6 с использованием непарного t-критерия Стьюдента.
Анализ частиц на основе проточной цитометрии
Способ анализа частиц на основе проточной цитометрии использовали для определения и характеризации невидимых невооруженным глазом частиц. Способ на основе проточной цитометрии представляет собой использование комбинации калибровочных бус (карбоксилатных бус с диапазоном размеров Fluoresbrite® YG) (Polyscience Inc., PA, USA), аналитических бус (CountBright™ Absolute Counting Beads) (Invitrogen Corp., CA, USA) и флуоресцентных зондов для характеризации невидимых невооруженным глазом частиц. Для различения белка и белок-содержащих частиц и небелковых невидимых невооруженным глазом частиц образцы окрашивали флуоресцентным красителем, дикалиевой солью 4,4′-дианилино-1,1′-бинафтил-5,5′-дисульфоновой кислоты (Bis-ANS). Способ подробно описан в литературе (Lubich et al., 2015).
Пример 18: Функциональная характеризация очищенных подвидов FVIII - Схожая гетерогенность pdFVIII и FL-rFVIII
Целью следующих экспериментов было исследование влияния B-домена и природной гетерогенности, являющейся результатом наличия B-домена в FL-rFVIII и полученном из плазмы (pd)FVIII, на стабильность и агрегацию белка. Исследовали структурные характеристики B-домена и сравнивали способность FL-rFVIII, pdFVIII и очищенных молекулярных видов rFVIII с переменным содержанием B-домена выдерживать физический стресс, а также изучали характеристики их агрегации. Основываясь на наблюдениях, строили схематическую модель агрегации FL-rFVIII и BDD-rFVIII и выдвигали предположения о новой роли B-домена и молекулярной гетерогенности в обеспечении стабильности молекулы FVIII.
Схематический обзор мультидоменной структуры FVIII показан на фигуре 2B. Пределами обозначены молекулярные виды, являющиеся результатом комплексного посттрансляционного процессинга B-домена FL-FVIII. Молекулярные виды rFVIII, содержащие 100% (B100-), 70% (B70-), 20% (B20-) или 0% (BDD-rFVIII) B-домена, представляют собой основные виды FVIII, обнаруживаемые в FL-rFVIII (Jankowski et al., 2007, внутренние аналитические данные не представлены). Процент содержания B-домена вычисляли с учетом кажущихся молекулярных масс соответствующей HC rFVIII. Часть B-домена, проходящая от аминокислоты Arg1313 до Arg1648, вероятнее всего, подвергается полному удалению после расщепления, т.к. ее не обнаруживали ни в одном секретируемом виде HC FVIII (Jankowski et al., 2007).
pdFVIII выделяли из объединенной плазмы человека, достигая наибольшей чистоты с помощью комбинации аффинной хроматографии и ионообменной хроматографии. Количество vWF снижали до 7,5 мкг vWF/мг FVIII. Практически идентичные гетерогенные белковые профили определяли для pdFVIII и полученного с помощью CHO FL-rFVIII на окрашенном серебром ПААГ с SDS (левое изображение на фигуре 44, дорожки 1-2). В обоих случаях определяли наиболее интенсивную полосу в области приблизительно 200 кДа, соответствующую гликозилированным видам B100-HC, и несколько укороченных видов HC/B-домена с более низкой молекулярной массой, мигрирующих в гелях на сравнимых уровнях в FL-rFVIII и pdFVIII. На профилях SEC дополнительно определяли наличие основных молекулярных видов FVIII и в FL-rFVIII, и в pdFVIII (фигура 51). Кроме того, гетерогенность FL-rFVIII оставалась постоянной в архивных партиях, полученных в 2005-2015 гг. (правое изображение на фигуре 44).
Пример 19: Функциональная характеризация очищенных подвидов FVIII - Очистка и характеризация молекулярных видов rFVIII
Т.к. молекулярные виды FVIII очищали из полученного из CHO FL-rFVIII, используя способы эксклюзионной и ионообменной хроматографии. BDD-rFVIII, B20-rFVIII и B70-rFVIII выделяли с чистотой 95%, 94% и 92% с учетом анализа ВЭЖХ C4, соответственно (данные не представлены). В то время как для LC каждого вида определяли постоянную полосу, соответствующую кажущейся молекулярной массе 75 кДа, HC B70-rFVIII, B20-rFVIII и BDD-rFVIII из-за разных количеств B-домена демонстрировали кажущиеся молекулярные массы 150, 110 и 90 кДа на ПААГ с SDS, соответственно (левое изображение на фигуре 44, дорожки 3-5). Целостность очищенных видов rFVIII дополнительно определяли посредством ВЭЖХ-SEC (фигура 51). B100-FVIII не использовали в дальнейшем.
Пример 20: Функциональная характеризация очищенных подвидов FVIII - структурные характеристики B-домена
B-домен имеет аминокислотную последовательность с низкой общей гидрофобностью. Вычисляли общую гидропатичность по Кайту и Дулитлу (Kyte et al., 1982) 0,751 для общей аминокислотной последовательности B-домена. Кластеры низкой гидрофобности равномерно распределены по последовательности B-домена. Последовательности B-домена в B100-, B70- и B20-rFVIII демонстрируют схожие средние значения гидропатичности -0,779, -0,741 и -0,896, соответственно. Низкая гидрофобность, как правило, характерна для нативно несвернутых белков, как подробно описано Uversky (Uversky et al., 2002).
Молекулярный вид FVIII B70-rFVIII подвергали масс-спектрометрии водородно-дейтериевого обмена (HDX-MS). В этом подходе используют то, что воздействие D2O на белок индуцирует быстрый амидный HDX в неупорядоченных областях, в то время как плотно свернутые элементы являются гораздо более защищенными от встраивания дейтерия, что приводит к медленному обмену изотопов (Konermann et al., 2011). Измеряли кинетику HDX-MS 120 пептидов из B70-rFVIII, охватывающих 63% общей последовательности белка и 37% последовательности B-домена B70-rFVIII (фигура 52). Все пептиды, полученные из последовательностей, принадлежащих B-домену, демонстрировали очень быструю кинетику встраивания дейтерия. Даже при наименьшем времени инкубации 3 сек во все пептиды встраивалось то же количество дейтерия, что и в соответствующий полностью дейтерированный образец после 3 дней мечения.
Данные HDX-MS вместе с характеристиками аминокислотной последовательности свидетельствуют о том, что у B-домена B70-rFVIII отсутствует вторичная структура, но он является по своей природе неупорядоченным и гибким. Учитывая анализ in silico, описанный выше, можно ожидать схожее воздействие растворителя и гибкость для всего B-домена и нескольких укороченных форм B-домена, присутствующих в молекулярных видах FVIII.
Результаты анализа кинетики HDX последовательности HC без B-домена (фигура 52) хорошо соответствуют опубликованной кристаллической структуре FVIII, на которой видны упорядоченные структурные элементы, прерываемые неупорядоченной поверхностной петлей в домене A1 и гибкой линкерной областью между доменами A1 и A2 (Shen et al., 2008).
Пример 21: Функциональная характеризация очищенных подвидов FVIII - Характеристики агрегации молекулярных видов FL-rFVIII и rFVIII при повышенных температурах
Исследовали характеристики температурозависимой агрегации FL-rFVIII, B70-rFVIII, B20-rFVIII и BDD-rFVIII. Образцы подвергали воздействию повышенных температур (25-50°C) и анализировали посредством DLS и ВЭЖХ-SEC (фигура 45). Z-среднее, описывающее взвешенный по интенсивности гидродинамический диаметр агрегатов белков, не изменялось при 25-35°C для видов FL-rFVIII и rFVIII. Начиная с 40°C, наблюдали повышение Z-среднего для всех тестируемых образцов, однако, с четкими различиями между образцами rFVIII. В то время как, кратное повышение среднего размера агрегатов, наблюдаемое при 25-50°C, составляло 9,2 для BDD-rFVIII и 6,4 для B20-rFVIII, оно достигало лишь 3,4 для B70-rFVIII и 2,5 для FL-rFVIII. Агрегаты BDD-rFVIII, определяемые после инкубации в течение 20 часов при 45°C и 50°C, были в 2,5 и 3,1 раза больше по размеру, соответственно, чем агрегаты FL-rFVIII.
Ту же тенденцию характеристик агрегации, определяемых посредством DLS, наблюдали после анализа агрегатов rFVIII посредством ВЭЖХ-SEC (фигура 45, вклейка).
Показано, что агрегаты FL-rFVIII, отделенные от мономеров FL-rFVIII посредством ВЭЖХ-SEC, содержат каждый молекулярный вид rFVIII в соотношении, схожем с нативным FL-rFVIII, по результатам анализа электрофореза в ПААГ в присутствии SDS (фигура 53).
В целом, после воздействия повышенных температур средний размер агрегата повышался, т.к. содержание B-домена снижалось (порядок склонности к агрегации BDD-rFVIII>B20-rFVIII>B70-rFVIII>FL-rFVIII). FL-rFVIII, представляющий собой гетерогенную смесь молекулярных видов rFVIII, демонстрировал наименьшую склонности к образованию агрегатов из всех тестируемых образцов rFVIII.
Пример 22: Функциональная характеризация очищенных подвидов FVIII - пути агрегации FVIII зависят от молекулярной гетерогенности и содержания B-домена
Подробный анализ зависящей от времени агрегации осуществляли при 45°C, температуре, при которой, как описано, начинаются конформационные изменения в молекуле FVIII (Grillo et al., 2001, Ramani et al., 2005a). Анализ кинетики агрегации при 45°C с последующей ВЭЖХ-SEC показал четкие различия путей образования агрегатов и олигомеров между молекулярными видами rFVIII и FL-rFVIII (фигура 46). Учитывая эксклюзионный предел используемой колонки, агрегаты определяли в виде растворимых агрегатов белков с диапазоном размеров 50-100 нм, элюируемых с мертвым объемом. Олигомеры (время удержания: 21,2-27,0 мин) определяли как белковоподобные структуры с диапазоном размеров 10-50 нм, задерживаемых эксклюзионной колонкой, но элюируемых перед мономерами белка (время удержания: 27,0-43,0). Образование олигомеров во всех образцах FVIII соответствовало кривой однофазной ассоциации, однако, чем меньше B-домена содержала анализируемая молекул, тем быстрее образовывались олигомеры (фигура 46A). Вычисленные константы скорости образования олигомеров (kолиго) FL-rFVIII, B70-rFVIII, B20-rFVIII и BDD-rFVIII составляли 0,13±0,02, 0,12±0,05, 0,35±0,24 и 0,70±0,24 ч.-1, соответственно. Кривые агрегации имели сигмоидальную форму с различными скоростями образования агрегатов (kагг), и снова, четко зависящими от содержания B-домена (фигура 46B). В отсутствие B-домена агрегаты образовывались быстрее и более избыточно; kагг(FL-rFVIII)=0,11±0,00 ч.-1, kагг(B70-rFVIII)=0,18±0,02 ч.-1, kагг(B20-rFVIII)=0,21±0,07 ч.-1, kагг(BDD-rFVIII)=0,21±0,08 ч.-1. Хотя количество олигомеров BDD-rFVIII повышалось до максимума 22% через 8 ч., а затем непрерывно снижалось, количество агрегатов BDD-rFVIII чрезмерно повышалось после 1-часовой лаг-фазы вплоть до 48% после 24 ч. инкубации (фигура 46D). Наибольшее значение содержания олигомеров B20-rFVIII (31%) определяли после 17 ч., концентрация агрегатов B20-rFVIII (31%) оставалась одинаковой после 24 ч. Хотя образовывалось 33% олигомеров B70-rFVIII и 44% олигомеров FL-rFVIII на уровнях плато после 22-24ч., к концу времени инкубации определяли низкое содержание агрегатов всего 17% и 11% для B70-rFVIII и FL-rFVIII, соответственно. Пути агрегации FL-rFVIII и BDD-rFVIII являлись наиболее неблагоприятными, как показано на фигуре 46C и D, соответственно. Агрегация pdFVIII (фигура 46E) соответствовала пути, очень схожему с FL-rFVIII, при этом константы скорости являлись следующими: kолиго(pdFVIII)=0,24±0,04 и kагг(pdFVIII)=0,15±0,03 ч.-1. В соответствии со скоростями образования олигомеров и агрегатов, потеря мономеров BDD-rFVIII была более быстрой по сравнению с FL-rFVIII и pdFVIII (фигура 46F). Активность FVIII в каждом тестируемом образце снижалась в соответствии со снижением концентрации мономеров (данные не представлены).
В целом, склонность к образованию олигомеров повышалась с повышением содержания B-домена, в то время как склонность к образованию агрегатов являлась обратной, и оба из гетерогенного FL-rFVIII и pdFVIII демонстрировали очень схожую, но гораздо меньшую тенденцию к образованию агрегатов, чем любые очищенные гомогенные молекулярные виды rFVIII.
Пример 23: Функциональная характеризация очищенных подвидов FVIII - Расходящиеся пути агрегации, запускаемые структурными различиями агрегатов
Для исследования причины определенных различий характеристик агрегации флуоресценцию ThT после связывания с олигомерами и агрегатами молекулярных видов rFVIII, FL-rFVIII и pdFVIII после инкубации при 45°C в течение 24 ч. анализировали посредством ВЭЖХ-SEC. ThT является общеупотребительным флуоресцентным красителем, демонстрирующим повышенную флуоресценцию после связывания со структурами, богатыми перекрестными β-листами (Biancalana et al., 2010). Способность ThT к связыванию с агрегированными структурами белка FVIII выражали как соотношение ThT и собственной флуоресценции белка (фигура 47). Наблюдали повышенное связывание ThT с олигомерами BDD-rFVIII по сравнению с олигомерами видов, содержащих B-домен, (B20-rFVIII и B70rFVIII), а также с FL-rFVIII и pdFVIII. Агрегаты BDD-rFVIII демонстрировали более чем 3-кратную способность к связыванию ThT по сравнению с FL-rFVIII и pdFVIII. Кроме того, флуоресценция ThT в агрегатах B20-rFVIII была больше, чем наблюдаемая для агрегатов B70-rFVIII. Измеряемая флуоресценция после связывания ThT с олигомерами и агрегатами FL-rFVIII и pdFVIII была очень схожей (фигура 47). Для соотношений флуоресценции ThT и сигналов поглощения белка при 280 нм наблюдали те же различия в связывании ThT между тестируемыми образцами FVIII, что и для соотношений ThT/собственной флуоресценции белка. Связывание ThT с мономерами в анализируемом образце FVIII не определяли.
Пример 24: Функциональная характеризация очищенных подвидов FVIII - Гомологичная инициация агрегации FVIII
Известно, что агрегаты, содержащие перекрестные β-листы, служат в качестве затравки, инициирующей дальнейшую агрегацию белка после воздействия стрессовых условий (Gsponer et al., 2006, Jarrett et al, 1993). Исследовали способность агрегировавших BDD-rFVIII, B70-rFVIII и FL-rFVIII (45°C в течение 2, 5, 8 или 18 ч.) инициировать процесс агрегации соответствующего образца. На фигуре 48 показано зависящее от времени образование олигомеров и агрегатов образцов FVIII, содержащих 50% уже образованной затравки по сравнению с образцами FVIII без затравки. Гомологичная инициация в случае B70-rFVIII и гетерогенного FL-rFVIII (фигура 48B и C, соответственно) не изменяла характеристики олигомеризации и агрегации. В случае молекулярных видов rFVIII без B-домена наблюдали иной механизм. После исходного быстрого образования олигомеров BDD-rFVIII кривые сглаживались при добавлении гомологичной затравки, и, в конечном итоге, достигали насыщающей концентрации олигомера 10%. Лаг-фаза образования агрегатов BDD-rFVIII снижалась в зависимости от типа добавляемой затравки. После добавления затравки, полученной посредством инкубации в течение 8 или 18 ч. при 45°C, лаг-фаза кривых агрегации BDD-rFVIII полностью исчезала (фигура 48A). Уменьшение лаг-фазы является типичной характеристикой зависимой от нуклеации полимеризации, описанной ранее для ряда белков, включая биотерапевтический инсулин (Arosio et al., 2015, Surmacz-Chwedoruk et al., 2014).
Агрегаты BDD-rFVIII, богатые перекрестными β-листами, были эффективными в гомологичной инициации дальнейшей агрегации белка. Явление, не наблюдаемое ни для B70-rFVIII, ни для FL-rFVIII, оба из которых не образуют агрегаты, положительные по перекрестным β-листам. Примечательно, что FL-rFVIII, даже благодаря своей природной гетерогенности также содержащий небольшую часть BDD-rFVIII, является наименее склонным к агрегации и инициации по сравнению с однокомпонентными молекулярными видами rFVIII.
Пример 25: Функциональная характеризация очищенных подвидов FVIII - Образование невидимых невооруженным взглядом частиц FVIII при встряхивании и воздействии напряжения сдвига
Клинически значимые стрессовые условия симулировали, используя встряхивание и напряжение сдвига по отношению к FL-rFVIII, pdFVIII и молекулярным видам rFVIII. Индуцированные, невидимые невооруженным взглядом белок-содержащие частицы размером 0,75-70 мкМ выходят за пределы аналитического диапазона ВЭЖХ-SEC, и их определяли способом на основе проточной цитометрии (Lubich et al., 2015, Nishi et al., 2014). Определяемые концентрации невидимых невооруженным взглядом белок-содержащие частицы достигали схожих уровней в случае FL-rFVIII и pdFVIII в диапазоне 2,4-4,2×106 частиц/мл (средние значения 3,1×106 частиц/мл и 3,2×106 частиц/мл, соответственно) после подвергания воздействию встряхивания и напряжения сдвига. В случае BDD-rFVIII определяли значительно более высокую концентрацию (среднее значение 6,0×106 частиц/мл; диапазон 4,9-6,9×106 частиц/мл). Концентрация невидимых невооруженным взглядом белок-содержащих частиц в случае молекулярных видов с укороченным B-доменом зависела от содержания B-домена в соответствующем виде и была более высокой в случае B20-rFVIII (среднее значение 5,5×106 частиц/мл), чем B70-rFVIII (среднее значение 3,9×106 частиц/мл) (фигура 49). Неподвергнутые стрессу образцы имели концентрации невидимых невооруженным взглядом белок-содержащих частиц в диапазоне 0,4-4,6×104 частиц/мл.
Пример 26: Функциональная характеризация очищенных подвидов FVIII - Обсуждение результатов
В представленных выше примерах исследовали гетерогенность, стабильность и характеристики агрегации FL-rFVIII человека, экспрессируемого в клетках CHO, и сравнивали их с высокоочищенным pdFVIII человека, при этом очищенные молекулярные виды rFVIII содержали разное количество B-домена. Исследовали структурные характеристики B-домена и его потенциальную роли в стабилизации молекулы FVIII.
Данные свидетельствуют о том, что FL-rFVIII, продуцируемый в линии клеток CHO, демонстрирует природную гетерогенность, схожую с pdFVIII, и содержит все молекулярные виды B-домена, также присутствующие в pdFVIII. Хотя это еще не до конца ясно, процессинг B-домена во время секреции FL-rFVIII является согласованным, на что указывают идентичные профили гетерогенного белка в архивных образцах FL-rFVIII, полученных с помощью линии клеток CHO и использованных в этих экспериментах, и идентичных pdFVIII. Примечательно, что FL-rFVIII, продуцируемый в линии клеток новорожденного хомяка, демонстрирует немного отличающийся белковый профиль по сравнению с полученным в линии клеток CHO FL-rFVIII и pdFVIII (Jankowski et al., 2007). В основном, гетерогенность FVIII, даже с небольшими отличиями в точной длине укорочения HC/B-домен, является независящей от вида характеристикой. Это наблюдали в случае pdFVIII и FL-rFVIII человека в этих экспериментах и предыдущей работе (Jankowski et al., 2007), а также для pdFVIII свиньи (Lollar et al., 1988). В отличие от этого, BDD-rFVIII, анализируемый в этих экспериментах, а также имеющиеся на рынке продукты BDD-rFVIII демонстрируют гомогенный, выглядящий почти искусственным белковый профиль и, таким образом, значительные различия по сравнению с гетерогенным pdFVIII (D'Amici et al., 2010;Thim et al., 2010;Peters et al., 2013).
Исследовали роль гетерогенности и влияние B-домена на агрегацию FVIII. Ранее показано, что FL-rFVIII склонен к агрегации по причине небольших структурных изменений третичных структур, начинающихся при 45°C (Grillo et al., 2001), и к инициации агрегации в результате конформационных изменений в липид-связывающей области домена C2 (Ramani et al., 2005a). В настоящем изобретении показано, что при повышении температуры гетерогенный FL-rFVIII демонстрировал наименьшую склонность к агрегации, в то время как, гомогенный BDD-rFVIII интенсивно агрегировал, а также образовывал гораздо более крупные агрегаты. Тенденцию к усиленной агрегации наблюдали со снижением содержания B-домена в молекулярных видах rFVIII. Подробный анализ зависимости от времени образования олигомеров и агрегатов при термическом стрессе (45°C) показал расхождение путей в разных образцах FVIII. Медленное образование олигомеров в подвергнутых термическому стрессу FL-rFVIII и pdFVIII почти ингибировало агрегацию. В случае BDD-rFVIII наблюдали гораздо более быстрое образование олигомеров, а также более быструю агрегацию. Молекулярные виды rFVIII были склонны к олигомеризации или агрегации, зависящей от количества оставшегося B-домена. В термически индуцированных олигомерах и агрегатах BDD-rFVIII определяли ThT-положительные, богатые перекрестными β-листами структуры, но оно имело меньшую степень или даже отсутствовало в FVIII, содержащем B-домен. Наиболее вероятно, что перекрестные β-листы в олигомерах BDD-rFVIII запускают быструю и обширную агрегацию, что позволяет объяснить расхождение характеристик агрегации BDD-rFVIII и FL-rFVIII. Кроме того, эффективная гомологичная инициация агрегации BDD-rFVIII, ненаблюдаемая в любом другом анализируемом образце FVIII, вероятнее всего возникает в результате этих структурных различий.
Учитывая результаты, полученные для термически индуцируемой агрегации в настоящем изобретении, строили схематическую модель, описывающую расхождение путей образования олигомеров и агрегатов BDD-rFVIII и FL-rFVIII (фигура 50). Хотя начальный исходный материал в случае FL-rFVIII представляет собой гетерогенную смесь всех видов rFVIII, BDD-rFVIII существует исключительно в качестве единственного вида. Длиной стрелок на изображении модели обозначены скорости образования олигомеров и агрегатов, являющиеся гораздо более высокими в случае BDD-rFVIII по сравнению с FL-rFVIII. Хотя BDD-rFVIII образует упорядоченные, крупные, богатые перекрестными β-листами агрегаты, агрегаты FL-rFVIII не имеют повторяющейся природы, т.к. состоят из разных видов и имеют меньший размер. Сборка растворимых белков а упорядоченные структуры, содержащие перекрестные β-листы, является важным явлением в случае множества нейродегенеративных заболеваний человека, таких как болезнь Альцгеймера, болезнь Паркинсона или губчатая энцефалопатия (Chiti et al., 2006). Быстрое развитие таких нарушений после определения клинических симптомов ассоциировано со способностью соответствующих накопленных агрегатов белков служить в качестве затравки (Jarrett et al., 1993).
В рамках изобретения было выяснено, что B-домен является обращенным к растворителю, неупорядоченным и гибким, кроме того, он демонстрирует низкую гидрофобность. Эти наблюдения позволяют предположить наличие защищающей от агрегации функции B-домена в отношении FVIII, схожей с наблюдаемым для других белков со значительными неупорядоченными сегментами, таких как α-синуклеин. Показано, что нативно несвернутая, высокозаряженная C-концевая область α-синуклеина важна для стабилизации и предотвращения агрегации белка. Укороченные на C-конце фрагменты α-синуклеина агрегировали быстрее полноразмерного белка. Агрегация укороченных фрагментов четко зависела от длины C-концевой области и была тем меньше, чем выше содержание неупорядоченной области (Murray et al., 2003; Serpell et al., 2000; Hoyer et al., 2004).
Примечательно, что наименьшую склонность к агрегации среди всех тестируемых образцов FVIII в настоящем изобретении наблюдали для гетерогенного FL-rFVIII, состоящего из смеси видов rFVIII, содержащих B-домен, содержащих укороченный B-домен и несодержащих B-домен. Гетерогенность вызывает низкое сходство последовательности между отдельными видами rFVIII. Фактически, в предшествующих исследованиях уже показано, что такое разнообразие последовательностей среди белков важно для снижения склонности к агрегации и инициации агрегации. Результаты, полученные Wright с соавт. и касающиеся характеристик агрегации мультидоменного белка титина, свидетельствовали о том, что эффективность соагрегации между разными доменами значительно снижается со снижением идентичности последовательности, и, кроме того, они заявляли о том, что поддержание низкой идентичности последовательности между белками является важной эволюционной характеристикой, сильно ингибирующей агрегацию в насыщенном окружении живой системы (Wright et al., 2005). Аналогично, показано, что эффективность образования фибрилл затравки в лизоцимах в значительной степени зависит от сходства их последовательностей, чем ниже идентичность последовательностей, тем меньше эффективность затравки (Krebs et al., 2004). Эти наблюдения хорошо коррелируют с результатами по настоящему изобретению, четко демонстрируя более низкую склонность к агрегации и эффективность затравки гетерогенного FL-rFVIII по сравнению с гомогенными видами rFVIII.
Кроме того, в рамках изобретения исследовали влияние встряхивания и напряжения сдвига на агрегацию FVIII. Эти клинически значимые стрессовые условия имитируют потенциальное неправильное обращение пациентов с терапевтическими продуктами FVIII и могут способствовать взаимодействию белков с силиконовым маслом, зачастую присутствующим на внутренних поверхностях шприцов для облегчения плавного движения поршня (Lubich et al., 2015, Thirumangalathu et al., 2009, Gerhardt et al., 2014). Это приводит к образованию невидимых невооруженным взглядом белок-содержащих частиц, как правило, имеющих диапазон размеров 0,1-50 мкМ (den Engelsman et al., 2011). В рамках изобретения образование невидимых невооруженным взглядом белок-содержащих частиц после встряхивание и воздействия напряжения сдвига, аналогично наблюдаемому в случае термически индуцированной агрегации, четко зависело от содержания B-домена. Концентрации частиц в FL-rFVIII и pdFVIII достигали схожих уровней, в то время как значимо больше частиц определяли в BDD-rFVIII.
В рамках изобретения показано, что агрегация FVIII зависит от двух основных параметров, которые, в свою очередь, могут влиять друг на друга, таких как (i) содержание B-домена, имеющего стабилизирующий эффект в отношении молекулы FVIII посредством предотвращения образования богатых перекрестными β-листами и служащих в качестве затравки агрегатов, и (ii) гетерогенность, приводящая к супрессии агрегации из-за возникновения разнообразия последовательностей. Как описано в литературе ранее, гликозилирование значительно влияло на стабильность FL-rFVIII, о чем свидетельствует сниженная устойчивость к агрегации дегликозилированного FL-rFVIII (Kosloski et al., 2009). Учитывая, что ~80% участков N-гликозилирования распределены по B-домену (Fay et al., 2006), кажется вероятным, что делеция этого домена делает белок более склонным к агрегации. Производство и составление являются дополнительными критическими факторами, влияющими на агрегацию FVIII и белковых терапевтических средств в целом (Eon-Duval et al, 2012). Работники здравоохранения должны быть хорошо проинформированы об этих качественных различиях и обусловленных ими потенциальных проблемах с безопасностью для пациентов.
Агрегаты белков не только влияют на стабильность и срок годности белковых лекарственных средств, но также повышают их иммуногенность (Eon-Duval et al, 2012). Повторяющаяся природа агрегатов белков может распознаваться рецепторами опознавания паттерна или рецепторами перекрестно-сшитого антигена на иммунной клетке. Образующиеся антитела против лекарственных средств могут иметь нейтрализующий эффект в отношении белка, что, в свою очередь, может влиять на его активность или фармакокинетику и, в частности, в случае терапевтических средств, относящихся к эндогенному белку, может приводить к риску в отношении безопасности для пациента (Moussa et al., 2016). Ингибиторные антитела образуются у приблизительно одной пятой пациентов с гемофилией A, которых лечили FVIII (Gouw et al., 2013; Hay et al., 1998). Ранее исследовали влияние агрегатов FVIII в индуцировании ингибиторных антител в модели гемофилии A на мышах. Показано, что агрегаты белков по-разному модулируют иммуногенность FVIII в моделях in vivo в зависимости от природы агрегатов и того, как они образовывались(Ramani et al., 2005b; Pisal et al., 2012). Однако, до настоящего времени нет данных о том, как агрегаты белков в продуктах FVIII модулируют иммуногенность биотерапевтического средства у людей, и о том, какие иммуногенные свойства могут иметь олигомеры и агрегаты FVIII, охарактеризованные в этом исследовании.
В целом, в рамках изобретения показана схожая гетерогенность белков FL-rFVIII и pdFVIII и выдвинуто предположение о благоприятном эффекте гетерогенности посредством снижения склонности белка к агрегации после воздействия физического стресса. Кроме того, определена новая роль B-домена в обеспечении стабильности молекулы FVIII посредством модуляции пути агрегации белков и защиты FVIII от избыточной агрегации.
Описанные выше результаты можно использовать в будущем дизайне новых терапевтических средств на основе FVIII для улучшения их стабильности, срока годности и, что наиболее важно, их безопасности.
Пример 27: Определение концентраций белков видов FVIII
Далее приведен пример того, как можно определять концентрации белков видов FVIII.
Вычисление коэффициентов поглощения FVIII при 280 нм:
Используя аминокислотные последовательности вычисляли коэффициенты экстинкции при 280 нм, предполагая, что все цистеины находятся в дисульфидных связях. В вычисление не включали сульфатирование тирозина.
Коэффициенты поглощения представляют собой теоретическое поглощение 1 мг/мл раствора указанного белка.
Коэффициент поглощения SOS-E вычисляли с учетом соотношения видов, присутствующих в ADVATE, как известно из аналитических данных хроматографии C4. Коэффициенты поглощения pdFVIII и смеси подвидов FVIII считали теми же, что и для SOS-E.
50% легкой цепи
50% легкой цепи
50% легкой цепи
50% легкой цепи
50% легкой цепи
Таблица 28: Коэффициенты поглощения при 280 нм в образцах FVIII
Определение концентраций белков FVIII:
Поглощение в образцах FVIII при 280 нм определяли спектрофотометрически. Концентрацию вычисляли следующим образом:
Концентрация (мг/мл) = измеренное поглощение/коэффициент поглощения при 280 нм
Пример 28: Активность очищенных видов рекомбинантного FVIII и их смесей
Активности очищенных видов рекомбинантного FVIII (rFVIII) и его смесей измеряли и сравнивали с активностми FL-rFVIII (SOS-E) и полученного из плазмы (pd)FVIII.
Активность образцов FVIII измеряли с помощью:
• хромогенного анализа активности
• одностадийного анализа свертывания
• анализа инициируемой тканевым фактором генерации тромбина с помощью калиброванной автоматизированной тромбограммы
Образцы FVIII:
• очищенные виды rFVIII (90 кДа, 110 кДа, 150 кДа, 180 кДа)
• смесь: смесь видов массой 90 кДа, 110 кДа, 150 кДа и 180 кДа в таких молярных соотношениях, как в ADVATE (на основе аналитических данных хроматографии C4)
• SOS-E: FL-rFVIII, исходный материал для очистки видов
• pdFVIII
Все образцы разводили до 0,244 мкМ в буфере с определенным pH, содержащим буферные компоненты, включающие соли, а также поверхностно-активное вещество. Из-за различий видов FVIII в размере и молекулярной массе концентрации (мкг/мл) видов при молярности 0,244 мкМ являлись следующими:
Описание способов:
Одностадийный анализ свертывания
Активность FVIII определяли посредством одностадийного анализа свертывания с помощью коммерчески доступного реагента aPTT, актина FSL (Siemens, Germany) и автоматизированного анализатора свертывания (BCS XP, Siemens, Germany). Образец, содержащий неизвестное количество функционального FVIII, смешивают с плазмой человека без FVIII и активатором. После инкубации при +37°C свертывание инициируют посредством добавления хлорида кальция и регистрируют время до образования тромба. Время свертывания обратно пропорционально концентрации FVIII в образце. Результаты приведены в МЕ FVIII/мл с учетом референсной кривой. Референсным стандартом являлся полноразмерный rFVIII, отслеживаемый по международному стандарту ВОЗ.
Хромогенный анализ активности
Анализ активности FVIII осуществляли с использованием коммерчески доступных реагентов (Siemens, Germany) и автоматизированного анализатора свертывания (BCS XP, Siemens). На первой стадии хромогенного анализа образец, содержащий неизвестное количество функционального FVIII, добавляют в реакционную смесь, состоящую из тромбина, активированного FIX (FIXa), фосфолипида, FX и буфера, содержащего кальций. FVIII активируется тромбином. Активированный FVIII (FVIIIa) образует комплекс с фосфолипидами, FIXa и кальцием, что приводит к активации фактора X (FXa). На второй стадии хромогенного анализа FXa измеряют по расщеплению FXa-специфического пептидного нитроанилидного субстрата. Получают p-нитроанилин, дающий окраску, которую можно измерять фотометрически по поглощению при 405 нм. Получаемая окраска прямо пропорциональна количеству функционального FVIII, присутствующего в образце. Референсным стандартом являлся полноразмерный FVIII, калиброванный по международному стандарту ВОЗ.
Анализ инициируемой тканевым фактором генерации тромбина
Калиброванная автоматизированная тромбограмма (CAT), тип теста генерации тромбина (TGA), является глобальным анализом гемостаза, все больше используемым в клинических исследованиях в качестве параметра эффективности ex vivo и исследовательского инструмента. С помощью тромбограммы описывают концентрацию тромбина в сворачивающейся плазме, и, таким образом, она представляет собой функциональный тест системы гемостаза в условиях, близких к физиологическим. Анализ основан на измерении флуоресценции, генерируемой при расщеплении флуорогенного субстрата Z-G-G-R-AMC под действием тромбина с течением времени после инициации свертывания тканевым фактором. Анализ осуществляют с помощью Thrombograph™, 96-луночного флуориметра для планшетов, и используют калибратор тромбина, необходимый для коррекции по эффекту внутреннего фильтра, межиндивидуальной вариабельности цвета плазмы, истощению субстрата и инструментальным различиям.
Следующие параметры CAT характеризуют гемостатическое состояние образца плазмы:
• Время ожидания [мин]: соответствует времени свертывания, инициации образования тромбина
• Время до достижения пика [мин]: время до образования максимального количества тромбина
• Тромбиновый пик [нМ]: максимальная концентрация образовавшегося тромбина
• Эндогенный тромбиновый потенциал (ETP) [нМ мин]: площадь под кривой образования тромбина, соответствующая общему количеству образовавшегося тромбина.
Образование тромбина в случае разных видов rFVIII и их смесей измеряли в плазме пациентов с гемофилией A с помощью калиброванной автоматизированной тромбограммы (CAT). Разведения образцов видов и смесей rFVIII подготавливали в буфере для образцов (25 мМ HEPES, 175 мМ NaCl, pH 7,4, 5 мг/мл BSA). Образцы разводили для получения концентрации 0,0625 -1 нМ rFVIII в плазме. В 96-луночном планшете для микротитрования (Immulon 2HB, Thermo Labsystems, Waltham, MA USA) комбинировали следующие компоненты: 10 мкл разведений образцов rFVIII, 10 мкл смеси тканевого фактора (TF) и фосфолипидов (PL) с конечными концентрациями 1 пМ TF и 4 мкМ PL (PPP-Reagent Low Thrombinoscope, Maastricht, Netherlands) и 80 мкл совокупности обедненной тромбоцитами плазмы (PPP) от пациентов с гемофилией A (FVIII <1%, George King Biomedical). PPP предварительно обрабатывали ингибитором трипсина из семян кукурузы (Haematologic Technologies Inc) в количестве 62 мкг/мл во избежание предварительной активации плазмы. Реакцию начинали посредством добавления 20 мкл флуорогенного субстрата Z-G-G-R-AMC и хлорида кальция (FluCa Kit, Thrombinoscope). Флуоресценцию определяли с использованием Fluoroskan Ascent (Thermo Lab Systems). Образование тромбина вычисляли с использованием программного обеспечения Thrombinoscope (Thrombinoscope). Анализ с помощью программного обеспечения Thrombinoscope приводил к получению кривых образования тромбина с временем (мин) по оси x и количеством тромбина (нМ) по оси y. С помощью программного обеспечения определяли следующие параметры: время ожидания (мин; время до начала исходного образования тромбина); эндогенный тромбиновый потенциал (ETP; нМ; площадь под кривой образования тромбина - отражает общее количество тромбина, образующегося за время анализа); тромбиновый пик (нМ; наибольшее количество тромбина, образовавшегося в любой момент анализа), время до достижения пика (мин; время до образования максимального количества тромбина в любой момент анализа). Тромбиновый пик выбирали в качестве основного параметра для сравнения активности образования тромбина в разных образцах rFVIII при разных концентрациях.
Результаты:
Одностадийный анализ свертывающей активности образцов FVIII при концентрации 0,244 мМ и ее сравнение показаны на фигуре 54A. Хромогенная активность образцов FVIII при концентрации 0,244 мМ и ее сравнение показаны на фигуре 54B. Тромбиновые пики и время ожидания для образцов FVIII при концентрации 0,25 мМ, 0,5 мМ и 1 мМ и их сравнение показаны на фигуре 55. Эти результаты свидетельствуют о том, что все очищенные виды rFVIII и их смеси демонстрировали повышенную активность по сравнению с SOS-E в хромогенном анализе и одностадийном анализе свертывающей активности FVIII. pdFVIII демонстрировал активность, схожую с SOS-E, в хромогенном анализе активности, но повышенную активность в одностадийном анализе свертывания. Все очищенные виды rFVIII, их смеси и pdFVIII демонстрировали повышенные тромбиновые пики по сравнению с SOS-E в анализе инициируемой TF генерации тромбина. Все тестируемые образцы демонстрировали сниженное время ожидания по сравнению с SOS-E.
Пример 29: Созревание с помощью фурина ADVATE BDS и промежуточных продуктов
На фигуре 56 неожиданно показано, что одноцепочечный FVIII присутствует в различных коммерчески доступных продуктах FVIII. Таким образом, тестировали то, будет ли созревание с помощью фурина приводить к повышенной активности FL-rFVIII. Далее описаны образцы и их подготовка:
Образцы:
SOS-E: Промежуточный продукт ADVATE без конечной стадии заключительной очистки
ADVATE BDS
Буфер: отрицательный контроль
Подготовка образцов:
A: Нативный образец
B: Нативный образец+100 мкл стока фурина+22,4 мкл Milli-Q
C: Нативный образец+100 мкл буфера для фурина+22,4 мкл Milli-Q
D: Нативный образец+100 мкл стока фурина+22,4 мкл стока ингибитора
E: Нативный образец+100 мкл буфера для фурина+22,4 мкл стока ингибитора
Общий объем B-E был равным, таким образом, можно осуществлять прямое сравнение. Использовали rFurin BDS. Буфер для фурина был эквивалентен стоку фурина, но без фурина. Сток ингибитора: 100 мМ гидрохлорида бензамидина.
В следующей таблице представлены результаты хромогенных анализов активности, которые осуществляли с использованием описанных выше образцов.
Таблица 29: Результаты хромогенных анализов активности.
На фигуре 57 показан окрашенный серебром ПААГ с SDS с образцами, подготовленными, как описано выше. На фигуре 58 показан анализ вестерн-блоттинга ПААГ с SDS с образцами, подготовленными, как описано выше.
Описанные выше результаты свидетельствуют о том, что полноразмерный FVIII, а также удлиненную легкую цепь можно подвергать дополнительному созреванию посредством добавления фурина с активностью 200-300 МЕ/мл. Таким образом, хромогенную активность повышают на приблизительно 17-19%. На ПААГ с SDS четко видно созревание полноразмерного FVIII, а также удлиненной легкой цепи.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Способы по настоящему изобретению можно использовать, например, для промышленных способов производства. Продукты по настоящему изобретению можно использовать, например, для производства лекарственных средств. Таким образом, настоящее изобретение является промышленно применимым.
ССЫЛКИ
Ahmadi M, Bryson CJ, Cloake EA, Welch K, Filipe V, Romeijn S, et al. Small amounts of sub-visible aggregates enhance the immunogenic potential of monoclonal antibody therapeutics. Pharm Res. 2015;32(4):1383-94.
Arosio P, Knowles TP, Linse S. On the lag phase in amyloid fibril formation. Phys Chem Chem Phys. 2015;17(12):7606-18.
Barnard JG, Babcock K, Carpenter JF. Characterization and quantitation of aggregates and particles in interferon-beta products: potential links between product quality attributes and immunogenicity. J Pharm Sci. 2013;102(3):915-28.
Biancalana M, Koide S. Molecular mechanism of thioflavin-T binding to amyloid fibrils. Biochim Biophys Acta. 2010;1804(7):1405-12.
Bonazza K, Rottensteiner H, Schrenk G, Fiedler C, Scheiflinger F, Allmaier G, et al. Ca2+ concentration-dependent conformational change of FVIII B-domain observed by atomic force microscopy. Anal Bioanal Chem. 2015;407(20):6051-6.
Chiti F, Dobson CM. Protein misfolding, functional amyloid, and human disease. Annu Rev Biochem. 2006;76:333-66.
Clemetson, K. J. (2012). Platelets and primary haemostasis. ThrombosisResearch, 129(3):220-224.
D'Amici GM, Timperio AM, Gevi F, Grazzini G, Zolla L. Recombinant clotting factor VIII concentrates: Heterogeneity and high-purity evaluation. Electrophoresis. 2010;31(16):2730-9.
den Engelsman J, Garidel P, Smulders R, Koll H, Smith B, Bassarab S, et al. Strategies for the assessment of protein aggregates in pharmaceutical biotech product development. Pharm Res. 2011;28(4):920-33.
Do H, Healey JF, Waller EK, Lollar P. Expression of factor VIII by murine liver sinusoidal endothelial cells. J Biol Chem. 1999;274(28):19587-92.
Eon-Duval A, Broly H, Gleixner R. Quality attributes of recombinant therapeutic proteins: an assessment of impact on safety and efficacy as part of a quality by design development approach. Biotechnol Prog. 2012;28(3):608-22.
ExPASy (2016). Регистрационный номер ProtParam P00451. http://web.expasy.org/cgi-bin/protparam/protparam. [онлайн; доступно 12 сентября 2016 года]
Одобрение FDA (2003). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов - Краткое обоснование решения о регистрации, стр. 18-20. http://www.fda.gov/downloads/BiologicsBloodVaccines/BloodBloodProducts/ApprovedProducts/LicensedProductsBLAs/FractionatedPlasmaProducts/ucm093516.pdf. [Online; accessed 12-September-2016].
Fay PJ. Factor VIII structure and function. Int J Hematol. 2006;83(2):103-8.
Gerhardt A, McGraw NR, Schwartz DK, Bee JS, Carpenter JF, Randolph TW. Protein aggregation and particle formation in prefilled glass syringes. J Pharm Sci. 2014;103(6):1601-12.
Gouw SC, van der Bom JG, Ljung R, Escuriola C, Cid AR, Claeyssens-Donadel S, et al. Factor VIII products and inhibitor development in severe hemophilia A. N Engl J Med. 2013;368(3):231-9.
Grillo AO, Edwards K-LT, Kashi RS, Shipley KM, Hu L, Besman MJ, et al. Conformational Origin of the Aggregation of Recombinant Human Factor VIII. Biochemistry. 2001;40(2):586-95.
Grushin K, Miller J, Dalm D, Parker ET, Healey JF, Lollar P, et al. Lack of recombinant factor VIII B-domain induces phospholipid vesicle aggregation: implications for the immunogenicity of factor VIII. Haemophilia. 2014;20(5):723-31.
Gsponer J, Vendruscolo M. Theoretical approaches to protein aggregation. Protein Pept Lett. 2006;13:287-93.
Hay CR. Factor VIII inhibitors in mild and moderate-severity haemophilia A. Haemophilia. 1998;4(4):558-63.
Hermeling S, Schellekens H, Crommelin DJ, Jiskoot W. Micelle-associated protein in epoetin formulations: A risk factor for immunogenicity? Pharm Res. 2003;20(12):1903-7.
Hoyer W, Cherny D, Subramaniam V, Jovin TM. Impact of the acidic C-terminal region comprising amino acids 109-140 on alpha-synuclein aggregation in vitro. Biochemistry. 2004;43(51):16233-42.
Jankowski MA, Patel H, Rouse JC, Marzilli LA, Weston SB, Sharpe PJ. Defining 'full-length' recombinant factor VIII: a comparative structural analysis. Haemophilia. 2007;13(1):30-7.
Jarrett JT, Lansbury Jr. PT. Seeding “one-dimensional crystallization” of amyloid: A pathogenic mechanism in Alzheimer's disease and scrapie? Cell. 1993;73(6):1055-8.
Joubert MK, Hokom M, Eakin C, Zhou L, Deshpande M, Baker MP, et al. Highly aggregated antibody therapeutics can enhance the in vitro innate and late-stage T-cell immune responses. J Biol Chem. 2012;287(30):25266-79.
Joubert MK, Luo Q, Nashed-Samuel Y, Wypych J, Narhi LO. Classification and characterization of therapeutic antibody aggregates. J Biol Chem. 2011;286(28):25118-33.
Kannicht C, Ramstrom M, Kohla G, Tiemeyer M, Casademunt E, Walter O, et al. Characterisation of the post-translational modifications of a novel, human cell line-derived recombinant human factor VIII. Thromb Res. 2013;131(1):78-88.
Kaufman RJ, Wasley LC, Dorner AJ. Synthesis, processing, and secretion of recombinant human factor VIII expressed in mammalian cells. J Biol Chem. 1988;5(263):6352-62.
Keating GM, Dhillon S. Octocog alfa (Advate®): a guide to its use in hemophilia A. BioDrugs 2012;26(4): 269-273.
Khrenov AV, Ananyeva NM, Saenko EL. Role of the B domain in proteolytic inactivation of activated coagulation factor VIII by activated protein C and activated factor X. Blood Coagul Fibrinolysis. 2006;17(5):379-88.
Konermann L, Pan J, Liu YH. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chem Soc Rev. 2011;40(3):1224-34.
Kosloski MP, Miclea RD, Balu-Iyer SV. Role of glycosylation in conformational stability, activity, macromolecular interaction and immunogenicity of recombinant human factor VIII. AAPS J. 2009;11(3):424-31.
Krebs MR, Morozova-Roche LA, Daniel K, Robinson CV, Dobson CM. Observation of sequence specificity in the seeding of protein amyloid fibrils. Protein Sci. 2004;13(7):1933-8.
Krishnaswamy S. FVIII-VWF dos-a-dos. Blood. 2015;126(8):923-4.
Kyte J, Doolittle RF. A simple method for displaying the hydropathic character of a protein. J Mol Biol. 1982;157(1):105-32.
Lenting PJ, van Mourik JA, Mertens K. The life cycle of coagulation factor VIII in view of its structure and function. Blood. 1998;92(11):3983-96.
Li X, Gabriel DA. The physical exchange of factor VIII (FVIII) between von Willebrand factor and activated platelets and the effect of the FVIII B-domain on platelet binding. Biochemistry. 1997;36(35):10760-7.
Liu, M., Shen, B., Nakaya, S., Pratt, K., Fujikawa, K., Davie, E., Stoddard, B., and Thompson, A. (2000). Hemophilic factor VIII C1-and C2-domainmissense mutations and their modeling to the 1.5-angstrom human C2-domain crystal structure. Blood Journal, 96(3):979-987.
Lollar P, Hill-Eubanks DC, Parker CG. Association of the factor VIII light chain with von Willebrand factor. J Biol Chem. 1988;263(21):10451-5.
Lubich C, Malisauskas M, Prenninger T, Wurz T, Matthiessen P, Turecek PL, et al. A Flow-Cytometry-Based Approach to Facilitate Quantification, Size Estimation and Characterization of Sub-visible Particles in Protein Solutions. Pharm Res. 2015;32(9):2863-76.
Maislos M, Mead PM, Gaynor DH, Robbins DC. The source of the circulating aggregate of insulin in type I diabetic patients is therapeutic insulin. J Clin Invest. 1986;77(7):717-23.
Mannucci PM, Duga S, Peyvandi F. Recessively inherited coagulation disorders. Blood. 2004;104(5):1243-52.
Mazurkiewicz-Pisarek, A., Pucienniczak, G., Ciach, T., and Pucienniczak, A.(2016). The factor VIII protein and its function. Acta Biochimica Polonica,63(1):11-16.
Moussa EM, Panchal JP, Moorthy BS, Blum JS, Joubert MK, Narhi LO, et al. Immunogenicity of therapeutic protein aggregates. J Pharm Sci. 2016;105(2):417-30.
Murray IVJ, Giasson BI, Quinn SM, Koppaka V, Axelsen PH, Ischiropoulos H, et al. Role of alpha-synuclein carboxy-terminus on fibril formation in vitro. Biochemistry. 2003;42(28):8530-40.
Myles T, Yun TH, Leung LL. Structural requirements for the activation of human factor VIII by thrombin. Blood. 2002;100(8):2820-6.
Ngo JC, Huang M, Roth DA, Furie BC, Furie B. Crystal structure of human factor VIII: implications for the formation of the factor IXa-factor VIIIa complex. Structure. 2008;16(4):597-606.
Nishi H,  ,
,  , Winter G. Label-free flow cytometry analysis of subvisible aggregates in liquid IgG1 antibody formulations. J Pharm Sci. 2014;103(1):90-9.
, Winter G. Label-free flow cytometry analysis of subvisible aggregates in liquid IgG1 antibody formulations. J Pharm Sci. 2014;103(1):90-9.
OBrien, D. and Tuddenham, E. (1997). The structure and function of factor VIII. Journal of Haemostasis and Thrombosis, pages 333-348.
Peters RT, Toby G, Lu Q, Liu T, Kulman JD, Low SC, et al. Biochemical and functional characterization of a recombinant monomeric factor VIII-Fc fusion protein. J Thromb Haemost. 2013;11(1):132-41.
Peyvandi, F., Garagiola, I., and Young, G. (2016). The past and future of haemophilia: diagnosis, treatments, and its complications. The Lancet, pages 1-11.
Pipe, S., Morris, J., Shah, J., and Kaufman, R. (1998). Differential interactionof coagulation factor VIII and factor V with protein chaperones calnexinand calreticulin. The Journal of Biological Chemistry, 273(14):8537-8544.
Pipe SW, Miao HZ, Kucab PF, McVey JH, Kaufman RJ. The secretion efficiency of factor VIII can be regulated by the size and oligosaccharide content of the B domain. Blood. 2005;106:Abstract 687.
Pipe SW. Functional roles of the factor VIII B domain. Haemophilia. 2009;15(6):1187-96.
Pipe SW, Montgomery RR, Pratt KP, Lenting PJ, Lillicrap D. Life in the shadow of a dominant partner: the FVIII-VWF association and its clinical implications for hemophilia A. Blood. 2016;128(16):2007-16.
Pisal DS, Kosloski MP, Middaugh CR, Bankert RB, Balu-Iyer SV. Native-like aggregates of factor VIII are immunogenic in von Willebrand factor deficient and hemophilia a mice. J Pharm Sci. 2012;101(6):2055-65.
Ramani K, Purohit VS, Miclea RD, Middaugh CR, Balasubramanian SV. Lipid binding region (2303-2332) is involved in aggregation of recombinant human FVIII (rFVIII). J Pharm Sci. 2005a;94(6):1288-99.
Ramani K, Purohit V, Middaugh CR, Balasubramanian SV. Aggregation kinetics of recombinant human FVIII (rFVIII). J Pharm Sci. 2005b;94(9):2023-9.
Robbins DC, Cooper SM, Fineberg SE, Mead PM. Antibodies to covalent aggregates of insulin in blood of insulin-using diabetic patients. Diabetes. 1987a;36(7):838-41.
Robbins DC, Mead PM. Free covalent aggregates of therapeutic insulin in blood of insulin-dependent diabetes. Diabetes. 1987b;36:147-51.
Roberts CJ. Therapeutic protein aggregation: mechanisms, design, and control. Trends Biotechnol. 2014;32(7):372-80.
Schaller, J., Gerber, S., Kaempfer, U., Lejon, S., and Trachsel, C. (2008).Human Blood Plasma Proteins - Structure and Function. John Wiley and Sons Ltd., pages 96-106.
Serpell LC, Berriman J, Jakes R, Goedert M, Crowther RA. Fiber diffraction of synthetic alpha-synuclein filaments shows amyloid-like cross-beta conformation. Proc Natl Acad Sci U S A. 2000;97(9):4897-902.
Shen BW, Spiegel PC, Chang CH, Huh JW, Lee JS, Kim J, et al. The tertiary structure and domain organization of coagulation factor VIII. Blood. 2008;111(3):1240-7.
Surmacz-Chwedoruk W, Malka I, Bozycki L, Nieznanska H, Dzwolak W. On the heat stability of amyloid-based biological activity: insights from thermal degradation of insulin fibrils. PLoS One. 2014;9(1):e86320.
Thim L, Vandahl B, Karlsson J, Klausen NK, Pedersen J, Krogh TN, et al. Purification and characterization of a new recombinant factor VIII (N8). Haemophilia. 2010;16(2):349-59.
Thirumangalathu R, Krishnan S, Ricci MS, Brems DN, Randolph TW, Carpenter JF. Silicone oil- and agitation-induced aggregation of a monoclonal antibody in aqueous solution. J Pharm Sci. 2009;98(9):3167-81.
Toole JJ, Knopf JL, Wozney JM, Sultzman LA, Buecker JL, Pittman DD, et al. Molecular cloning of a cDNA encoding human antihaemophilic factor. Nature. 1984;312(5992):342-7.
Toole JJ, Pittman DD, Orr EC, Murtha P, Wasley LC, Kaufman RJ. A large region (approximately equal to 95 kDa) of human factor VIII is dispensable for in vitro procoagulant activity. Proc Natl Acad Sci USA. 1986;83(16):5939-42.
Unicorn 6.4 (2016). Пакет программ Unicorn 6.4, GE Healthcare LifeSciences. http://www.fda.gov/downloads/BiologicsBloodVaccines/BloodBloodProducts/ApprovedProducts/LicensedProductsBLAs/FractionatedPlasmaProducts/ucm093516.pdf. [доступно 17 марта 2016 года, Baxalta Innovations GmbH].
Uversky VN. What does it mean to be natively unfolded? Eur J Biochem. 2002;269(1):2-12.
Uversky VN, Li J, Fink AL. Evidence for a partially folded intermediate in alpha-synuclein fibril formation. J Biol Chem. 2001;276(14):10737-44.
van Beers MM, Jiskoot W, Schellekens H. On the role of aggregates in the immunogenicity of recombinant human interferon beta in patients with multiple sclerosis. J Interferon Cytokine Res. 2010;30(10):767-75
Valentino, L. (2010). Blood-induced joint disease: the pathophysiology of hemophilic arthropathy. Journal of Thrombosis and Haemostasis, 8(9):1895-1902.
Vehar GA, Keyt B, Eaton D, Rodriguez H, O'Brien DP, Rotblat F, et al. Structure of human factor VIII. Nature. 1984;312(5992):337-42.
Wright CF, Teichmann SA, Clarke J, Dobson CM. The importance of sequence diversity in the aggregation and evolution of proteins. Nature. 2005;438(7069):878-81.
Zhang B, Kaufman RJ, Ginsburg D. LMAN1 and MCFD2 form a cargo receptor complex and interact with coagulation factor VIII in the early secretory pathway. J Biol Chem. 2005;280(27):25881-6.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> БАКСАЛТА ИНКОРПОРЕЙТЕД
БАКСАЛТА ГМБХ
<120> ОЧИСТКА ПОДВИДОВ ФАКТОРА VIII
<130> 206380
<140> PCT/EP2018/066753
<141> 2018-06-22
<150> EP 17 177 749.3
<151> 2017-06-23
<160> 1
<170> BiSSAP 1.3.6
<210> 1
<211> 1660
<212> БЕЛОК
<213> Homo sapiens
<220>
<223> B70-rFVIII
<400> 1
Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser Trp Asp Tyr
1 5 10 15
Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg Phe Pro Pro
20 25 30
Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val Tyr Lys Lys
35 40 45
Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile Ala Lys Pro
50 55 60
Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln Ala Glu Val
65 70 75 80
Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser His Pro Val
85 90 95
Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser Glu Gly Ala
100 105 110
Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp Asp Lys Val
115 120 125
Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu Lys Glu Asn
130 135 140
Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser Tyr Leu Ser
145 150 155 160
His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile Gly Ala Leu
165 170 175
Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr Gln Thr Leu
180 185 190
His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly Lys Ser Trp
195 200 205
His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp Ala Ala Ser
210 215 220
Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr Val Asn Arg
225 230 235 240
Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val Tyr Trp His
245 250 255
Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile Phe Leu Glu
260 265 270
Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser Leu Glu Ile
275 280 285
Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met Asp Leu Gly
290 295 300
Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His Asp Gly Met
305 310 315 320
Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro Gln Leu Arg
325 330 335
Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp Leu Thr Asp
340 345 350
Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser Pro Ser Phe
355 360 365
Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr Trp Val His
370 375 380
Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro Leu Val Leu
385 390 395 400
Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn Asn Gly Pro
405 410 415
Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met Ala Tyr Thr
420 425 430
Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu Ser Gly Ile
435 440 445
Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu Leu Ile Ile
450 455 460
Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro His Gly Ile
465 470 475 480
Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys Gly Val Lys
485 490 495
His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe Lys Tyr Lys
500 505 510
Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp Pro Arg Cys
515 520 525
Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg Asp Leu Ala
530 535 540
Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu Ser Val Asp
545 550 555 560
Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val Ile Leu Phe
565 570 575
Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu Asn Ile Gln
580 585 590
Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp Pro Glu Phe
595 600 605
Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val Phe Asp Ser
610 615 620
Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp Tyr Ile Leu
625 630 635 640
Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe Ser Gly Tyr
645 650 655
Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr Leu Phe Pro
660 665 670
Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro Gly Leu Trp
675 680 685
Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly Met Thr Ala
690 695 700
Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp Tyr Tyr Glu
705 710 715 720
Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys Asn Asn Ala
725 730 735
Ile Glu Pro Arg Ser Phe Ser Gln Asn Ser Arg His Pro Ser Thr Arg
740 745 750
Gln Lys Gln Phe Asn Ala Thr Thr Ile Pro Glu Asn Asp Ile Glu Lys
755 760 765
Thr Asp Pro Trp Phe Ala His Arg Thr Pro Met Pro Lys Ile Gln Asn
770 775 780
Val Ser Ser Ser Asp Leu Leu Met Leu Leu Arg Gln Ser Pro Thr Pro
785 790 795 800
His Gly Leu Ser Leu Ser Asp Leu Gln Glu Ala Lys Tyr Glu Thr Phe
805 810 815
Ser Asp Asp Pro Ser Pro Gly Ala Ile Asp Ser Asn Asn Ser Leu Ser
820 825 830
Glu Met Thr His Phe Arg Pro Gln Leu His His Ser Gly Asp Met Val
835 840 845
Phe Thr Pro Glu Ser Gly Leu Gln Leu Arg Leu Asn Glu Lys Leu Gly
850 855 860
Thr Thr Ala Ala Thr Glu Leu Lys Lys Leu Asp Phe Lys Val Ser Ser
865 870 875 880
Thr Ser Asn Asn Leu Ile Ser Thr Ile Pro Ser Asp Asn Leu Ala Ala
885 890 895
Gly Thr Asp Asn Thr Ser Ser Leu Gly Pro Pro Ser Met Pro Val His
900 905 910
Tyr Asp Ser Gln Leu Asp Thr Thr Leu Phe Gly Lys Lys Ser Ser Pro
915 920 925
Leu Thr Glu Ser Gly Gly Pro Leu Ser Leu Ser Glu Glu Asn Asn Asp
930 935 940
Ser Lys Leu Leu Glu Ser Gly Leu Met Asn Ser Gln Glu Ser Ser Trp
945 950 955 960
Gly Lys Asn Val Ser Ser Thr Glu Ser Gly Arg Leu Phe Lys Gly Lys
965 970 975
Glu Ile Thr Arg Thr Thr Leu Gln Ser Asp Gln Glu Glu Ile Asp Tyr
980 985 990
Asp Asp Thr Ile Ser Val Glu Met Lys Lys Glu Asp Phe Asp Ile Tyr
995 1000 1005
Asp Glu Asp Glu Asn Gln Ser Pro Arg Ser Phe Gln Lys Lys Thr Arg
1010 1015 1020
His Tyr Phe Ile Ala Ala Val Glu Arg Leu Trp Asp Tyr Gly Met Ser
1025 1030 1035 1040
Ser Ser Pro His Val Leu Arg Asn Arg Ala Gln Ser Gly Ser Val Pro
1045 1050 1055
Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr Asp Gly Ser Phe Thr
1060 1065 1070
Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His Leu Gly Leu Leu Gly
1075 1080 1085
Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile Met Val Thr Phe Arg
1090 1095 1100
Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser Ser Leu Ile Ser Tyr
1105 1110 1115 1120
Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg Lys Asn Phe Val Lys
1125 1130 1135
Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys Val Gln His His Met Ala
1140 1145 1150
Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala Trp Ala Tyr Phe Ser Asp
1155 1160 1165
Val Asp Leu Glu Lys Asp Val His Ser Gly Leu Ile Gly Pro Leu Leu
1170 1175 1180
Val Cys His Thr Asn Thr Leu Asn Pro Ala His Gly Arg Gln Val Thr
1185 1190 1195 1200
Val Gln Glu Phe Ala Leu Phe Phe Thr Ile Phe Asp Glu Thr Lys Ser
1205 1210 1215
Trp Tyr Phe Thr Glu Asn Met Glu Arg Asn Cys Arg Ala Pro Cys Asn
1220 1225 1230
Ile Gln Met Glu Asp Pro Thr Phe Lys Glu Asn Tyr Arg Phe His Ala
1235 1240 1245
Ile Asn Gly Tyr Ile Met Asp Thr Leu Pro Gly Leu Val Met Ala Gln
1250 1255 1260
Asp Gln Arg Ile Arg Trp Tyr Leu Leu Ser Met Gly Ser Asn Glu Asn
1265 1270 1275 1280
Ile His Ser Ile His Phe Ser Gly His Val Phe Thr Val Arg Lys Lys
1285 1290 1295
Glu Glu Tyr Lys Met Ala Leu Tyr Asn Leu Tyr Pro Gly Val Phe Glu
1300 1305 1310
Thr Val Glu Met Leu Pro Ser Lys Ala Gly Ile Trp Arg Val Glu Cys
1315 1320 1325
Leu Ile Gly Glu His Leu His Ala Gly Met Ser Thr Leu Phe Leu Val
1330 1335 1340
Tyr Ser Asn Lys Cys Gln Thr Pro Leu Gly Met Ala Ser Gly His Ile
1345 1350 1355 1360
Arg Asp Phe Gln Ile Thr Ala Ser Gly Gln Tyr Gly Gln Trp Ala Pro
1365 1370 1375
Lys Leu Ala Arg Leu His Tyr Ser Gly Ser Ile Asn Ala Trp Ser Thr
1380 1385 1390
Lys Glu Pro Phe Ser Trp Ile Lys Val Asp Leu Leu Ala Pro Met Ile
1395 1400 1405
Ile His Gly Ile Lys Thr Gln Gly Ala Arg Gln Lys Phe Ser Ser Leu
1410 1415 1420
Tyr Ile Ser Gln Phe Ile Ile Met Tyr Ser Leu Asp Gly Lys Lys Trp
1425 1430 1435 1440
Gln Thr Tyr Arg Gly Asn Ser Thr Gly Thr Leu Met Val Phe Phe Gly
1445 1450 1455
Asn Val Asp Ser Ser Gly Ile Lys His Asn Ile Phe Asn Pro Pro Ile
1460 1465 1470
Ile Ala Arg Tyr Ile Arg Leu His Pro Thr His Tyr Ser Ile Arg Ser
1475 1480 1485
Thr Leu Arg Met Glu Leu Met Gly Cys Asp Leu Asn Ser Cys Ser Met
1490 1495 1500
Pro Leu Gly Met Glu Ser Lys Ala Ile Ser Asp Ala Gln Ile Thr Ala
1505 1510 1515 1520
Ser Ser Tyr Phe Thr Asn Met Phe Ala Thr Trp Ser Pro Ser Lys Ala
1525 1530 1535
Arg Leu His Leu Gln Gly Arg Ser Asn Ala Trp Arg Pro Gln Val Asn
1540 1545 1550
Asn Pro Lys Glu Trp Leu Gln Val Asp Phe Gln Lys Thr Met Lys Val
1555 1560 1565
Thr Gly Val Thr Thr Gln Gly Val Lys Ser Leu Leu Thr Ser Met Tyr
1570 1575 1580
Val Lys Glu Phe Leu Ile Ser Ser Ser Gln Asp Gly His Gln Trp Thr
1585 1590 1595 1600
Leu Phe Phe Gln Asn Gly Lys Val Lys Val Phe Gln Gly Asn Gln Asp
1605 1610 1615
Ser Phe Thr Pro Val Val Asn Ser Leu Asp Pro Pro Leu Leu Thr Arg
1620 1625 1630
Tyr Leu Arg Ile His Pro Gln Ser Trp Val His Gln Ile Ala Leu Arg
1635 1640 1645
Met Glu Val Leu Gly Cys Glu Ala Gln Asp Leu Tyr
1650 1655 1660
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ, СОДЕРЖАЩИЙ ФАКТОР VIII И ПЕПТИДЫ ФАКТОРА ФОН ВИЛЛЕБРАНДА | 2015 |
|
RU2714154C2 |
| УЛУЧШЕННЫЙ БЕЛОК СЛИЯНИЯ FVIII И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2789085C2 |
| ВЫСОКОГЛИКОЗИЛИРОВАННЫЙ СЛИТЫЙ БЕЛОК НА ОСНОВЕ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ ЧЕЛОВЕКА VIII, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2722374C1 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2795973C1 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2785994C1 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2788949C1 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2778325C1 |
| ВАРИАНТЫ И ИЗОФОРМЫ АНТИТЕЛ С ПОНИЖЕННОЙ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2813990C2 |
| Отделение антител с тремя легкими цепями при помощи катионообменной хроматографии | 2018 |
|
RU2795432C2 |
| Антитело моноклональное мышиное 1Е10 и антитело рекомбинантное химерное (мышь-человек) xi1E10, нейтрализующие летальный токсин Bacillus anthracis, и штамм гибридных культивируемых клеток животных Mus musculus 1E10 | 2020 |
|
RU2745116C1 |
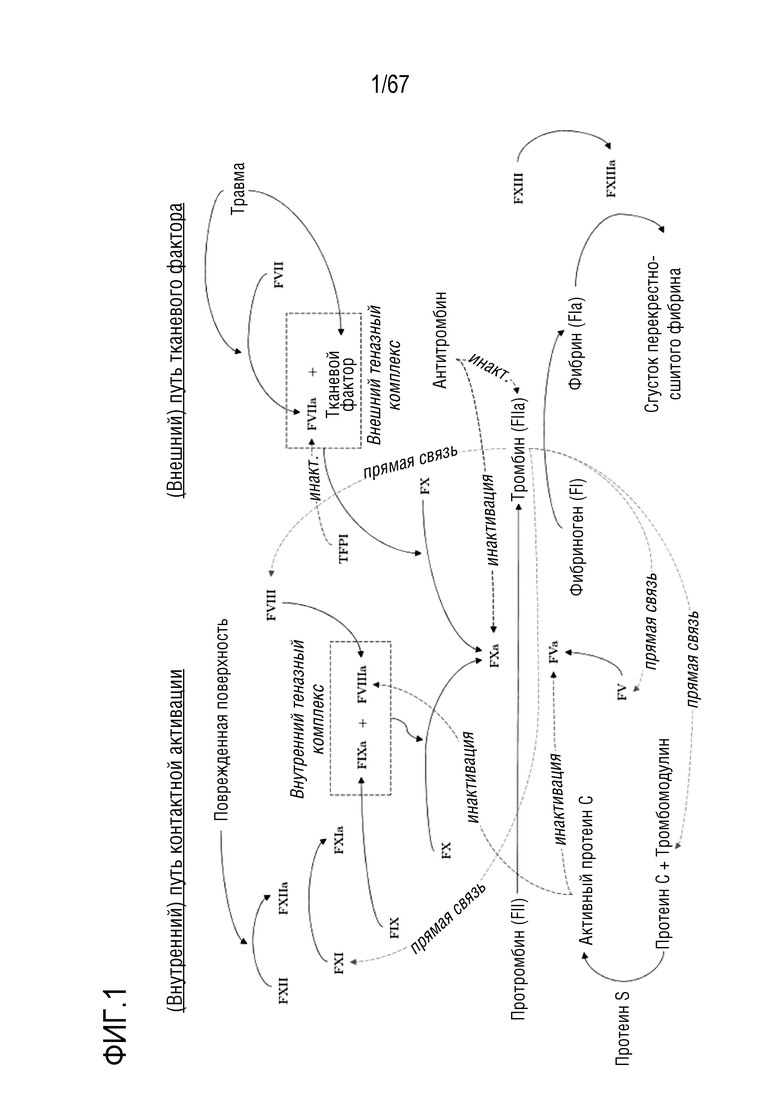
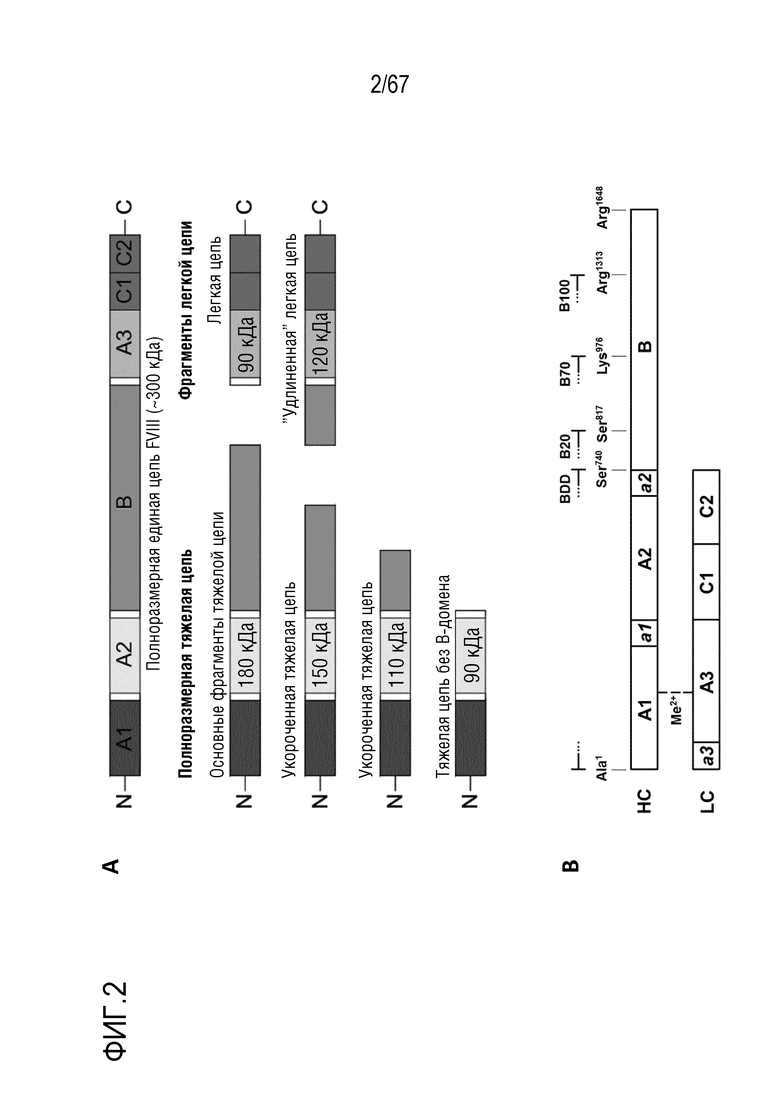
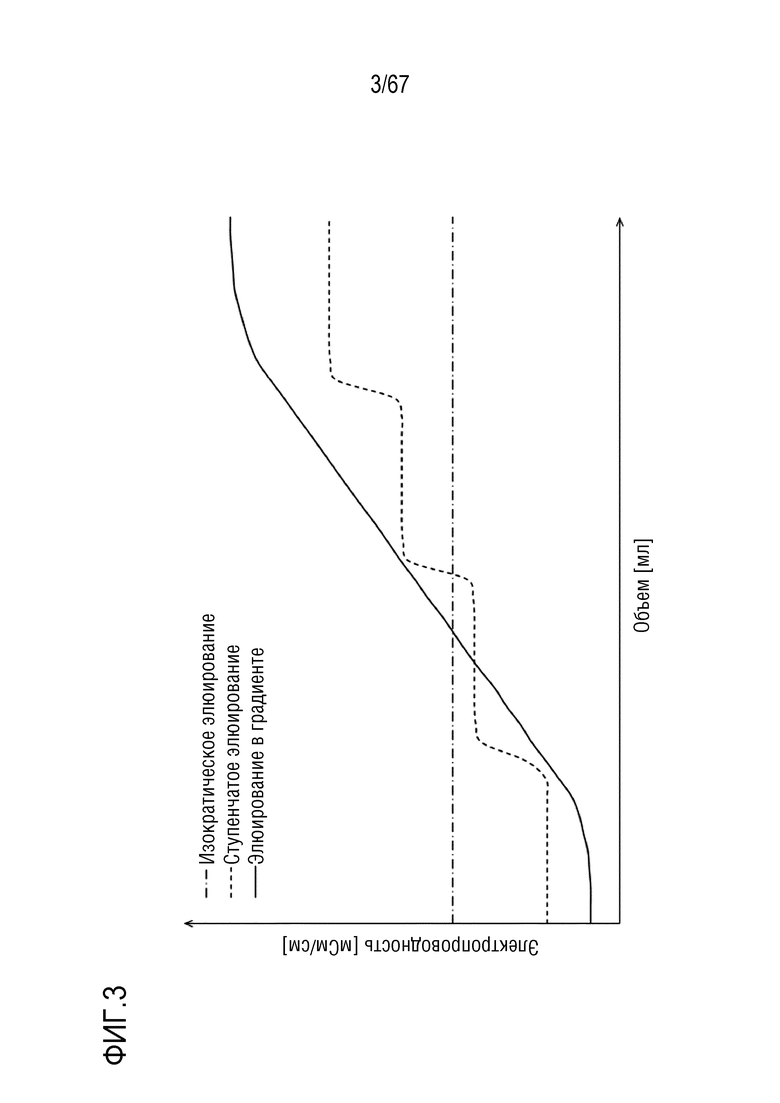
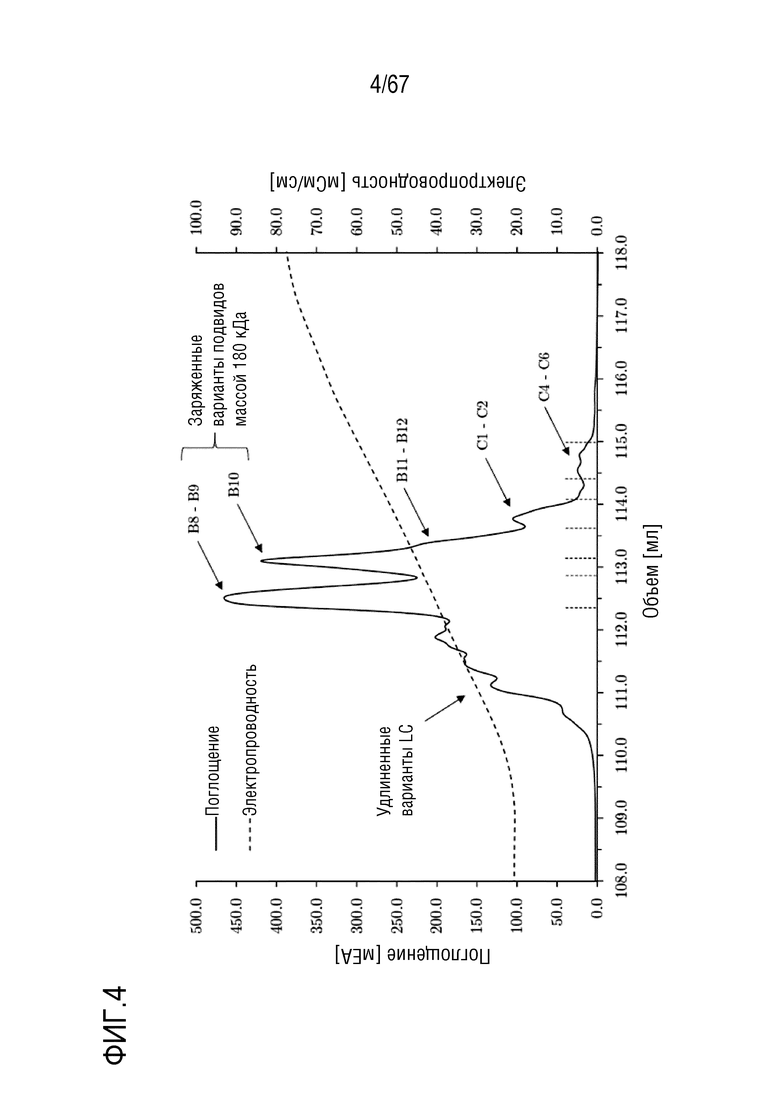
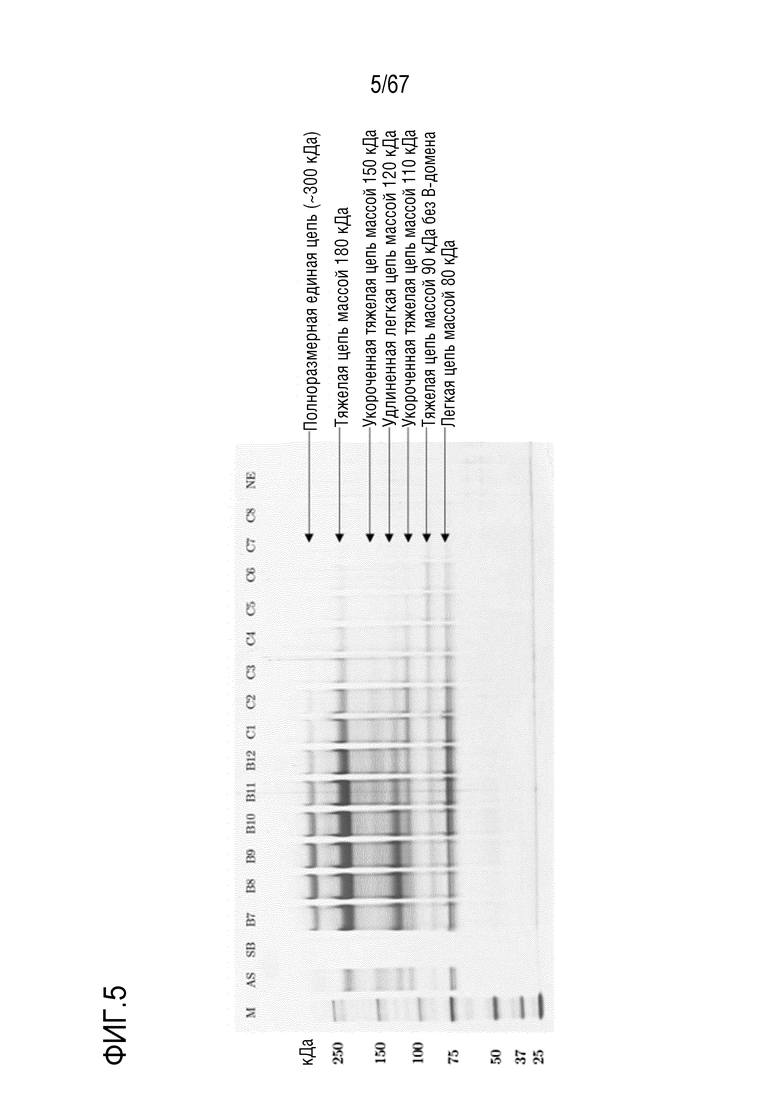
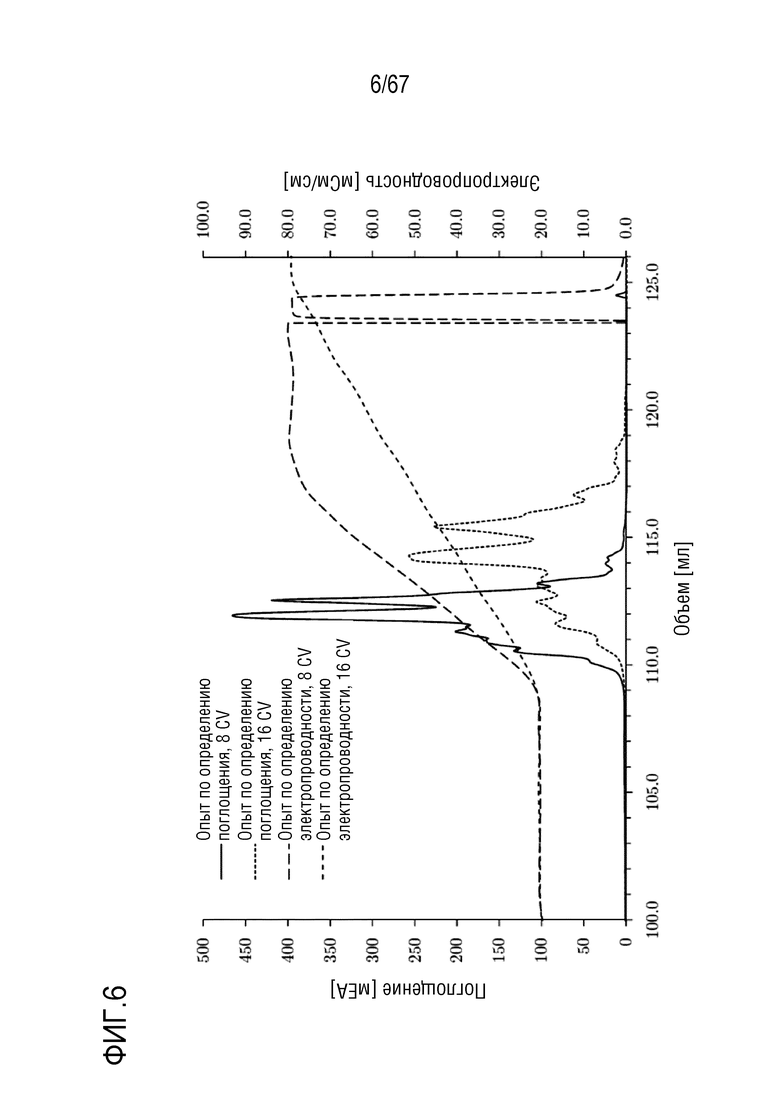
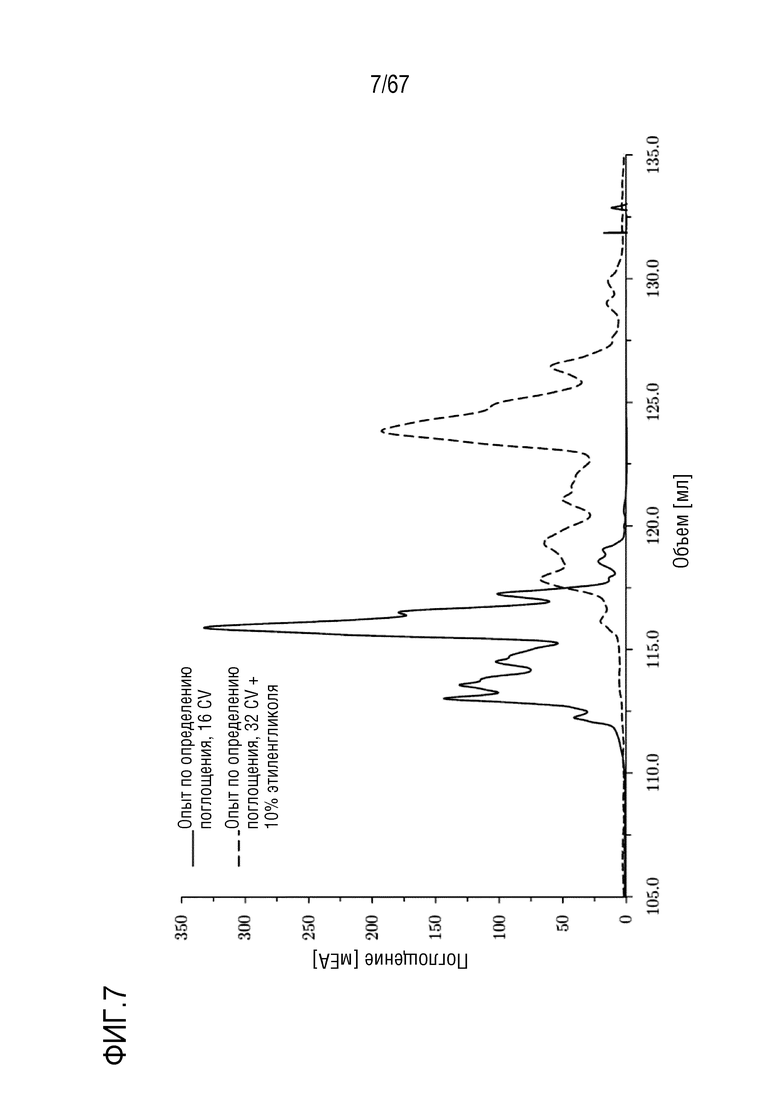
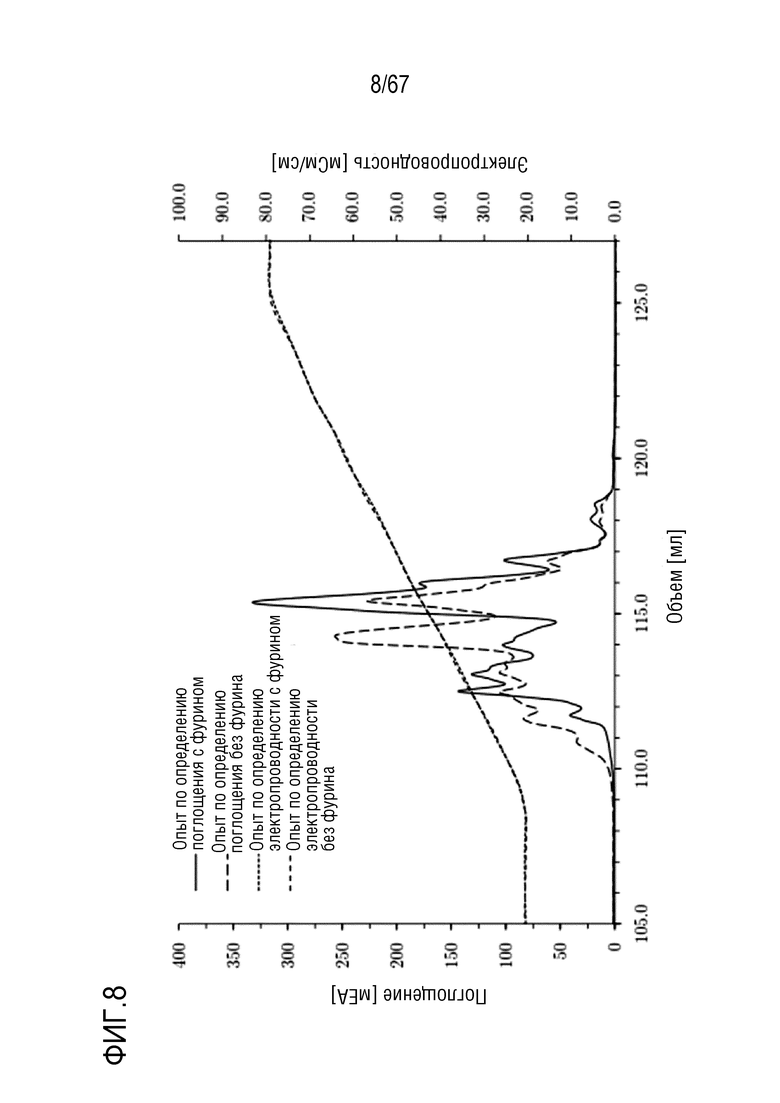
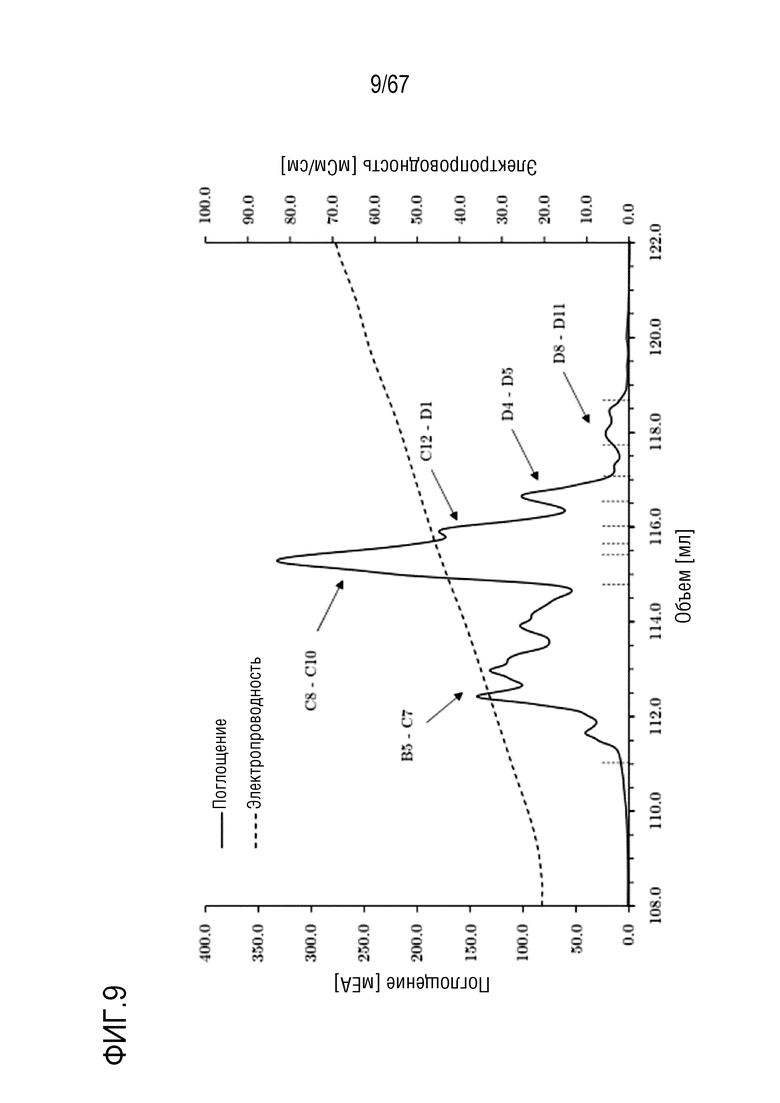
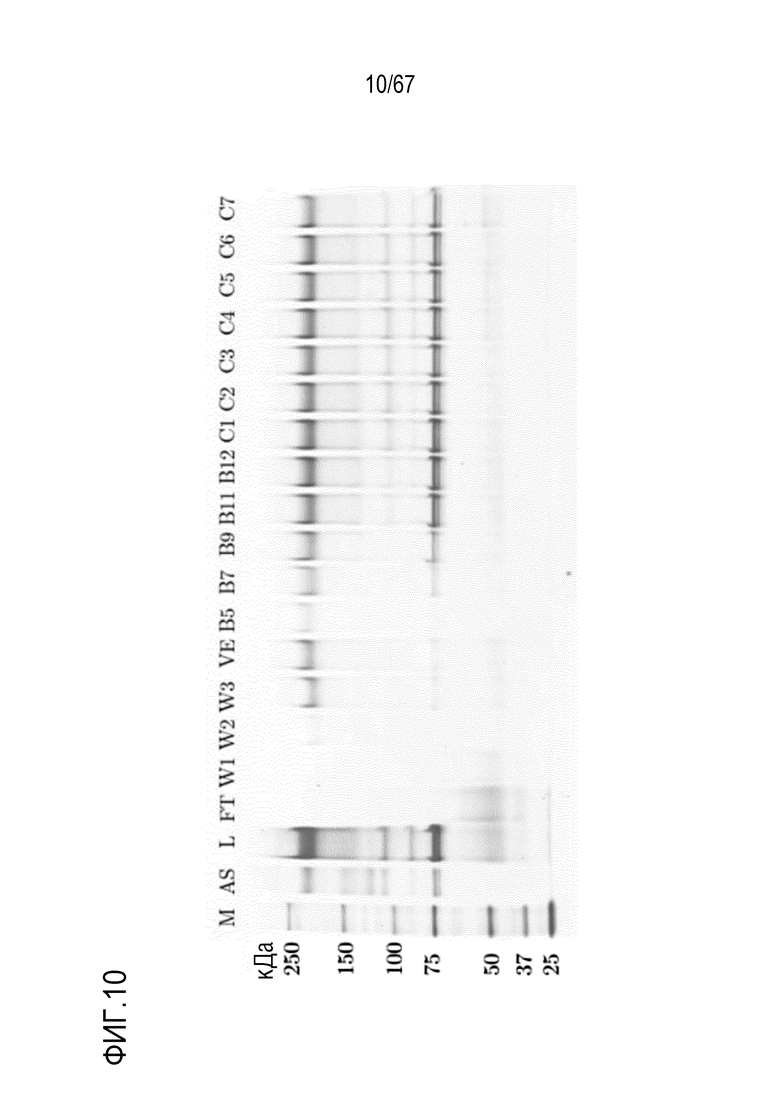
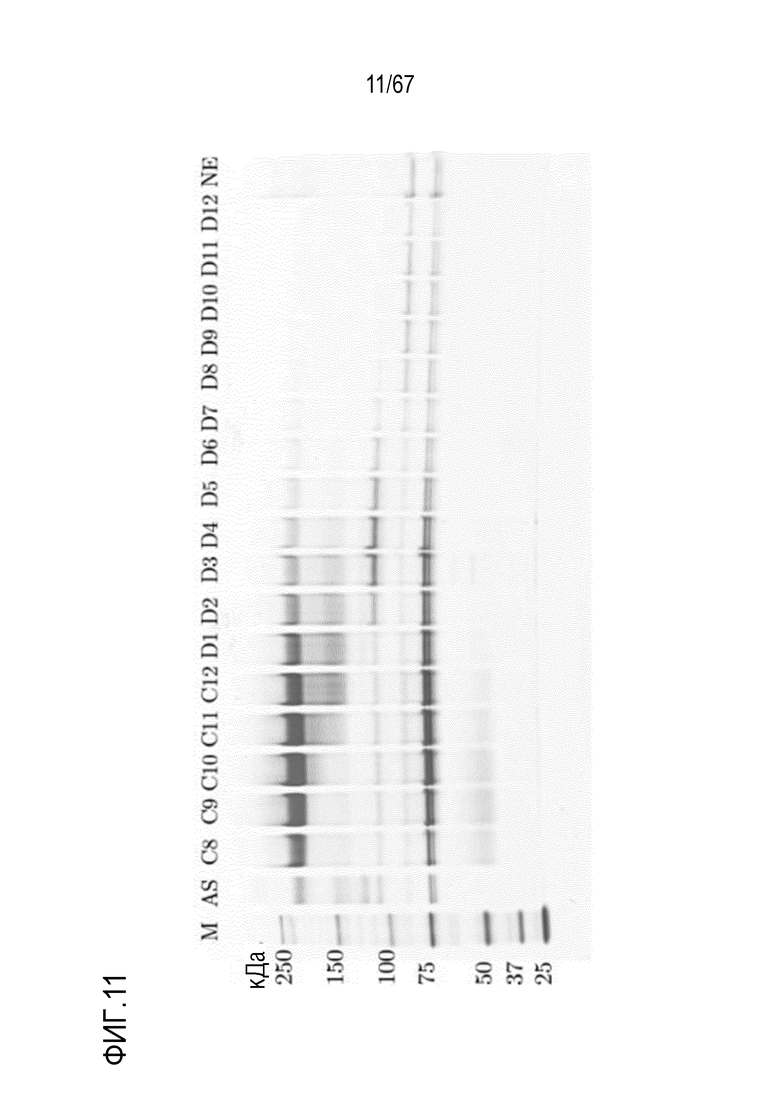
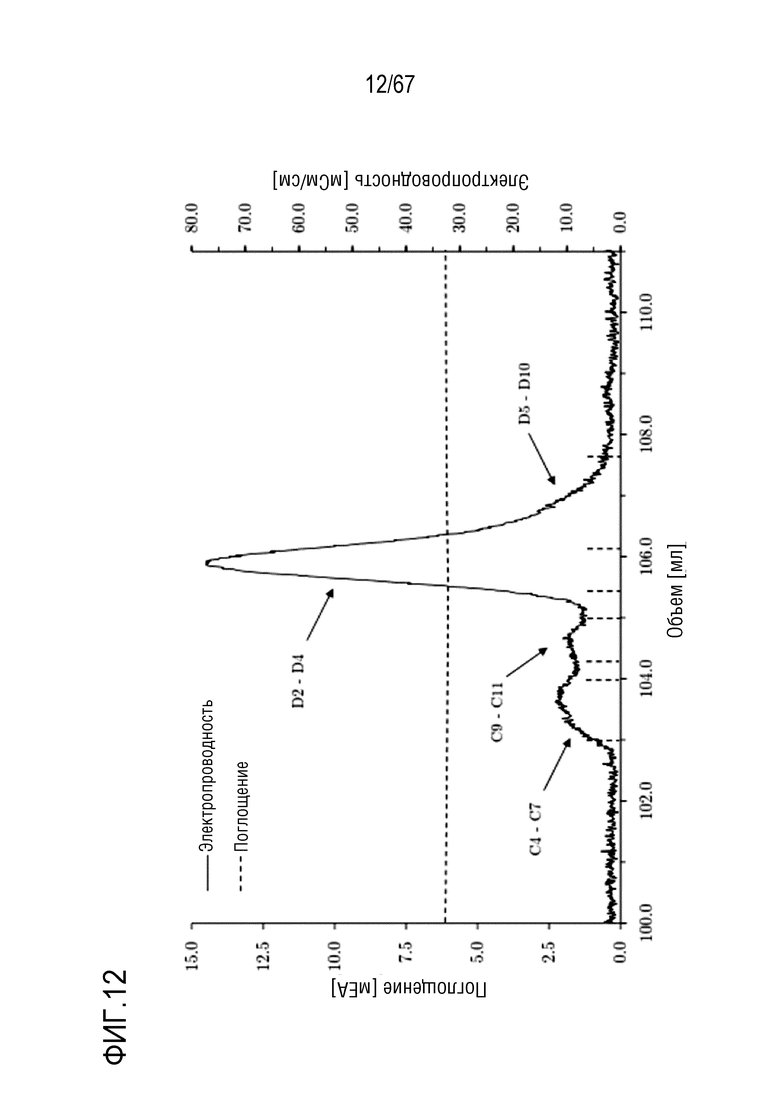
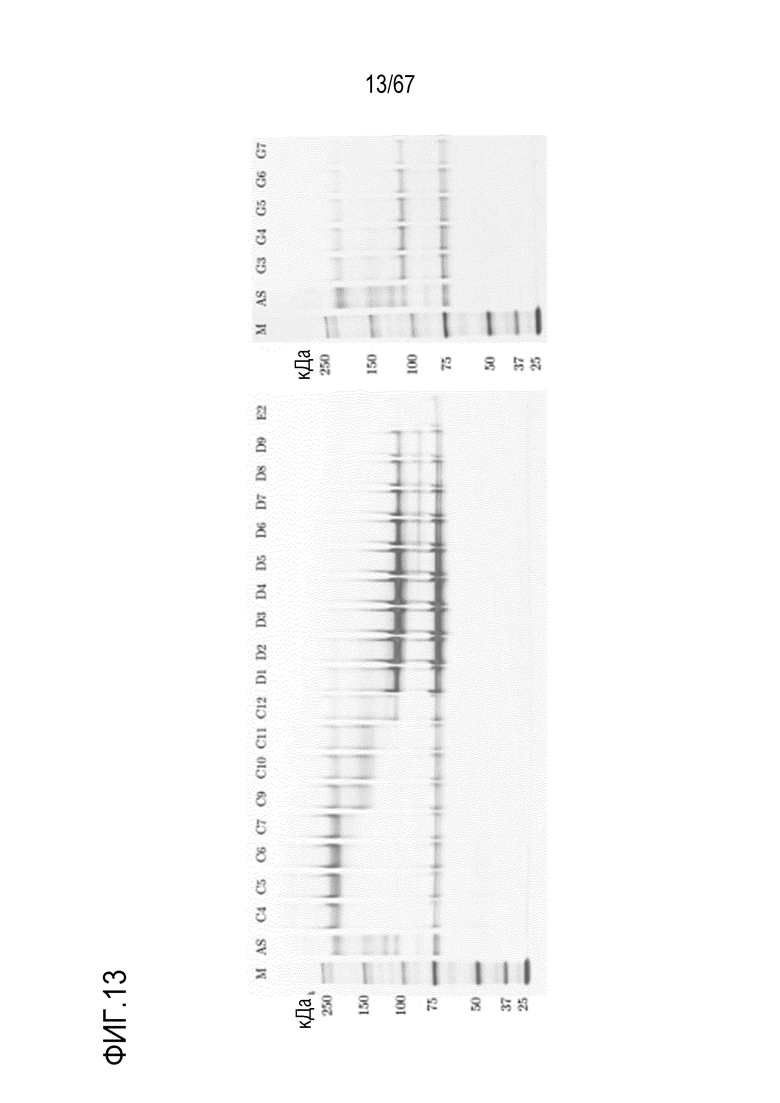
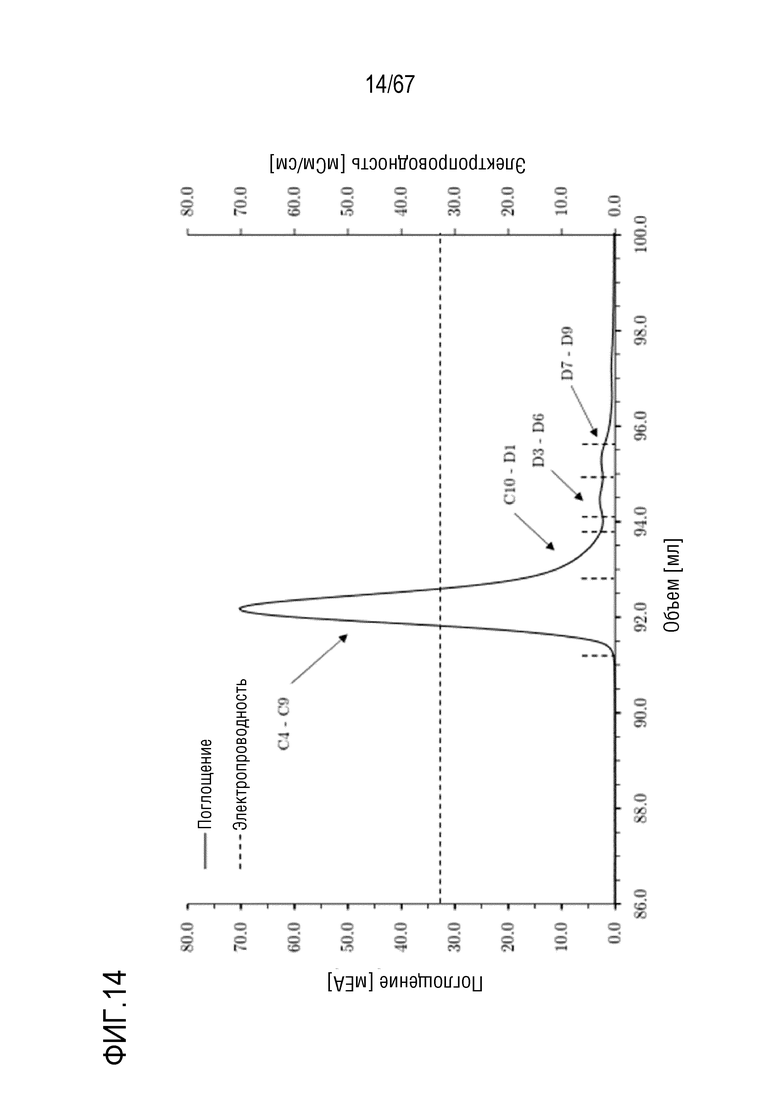
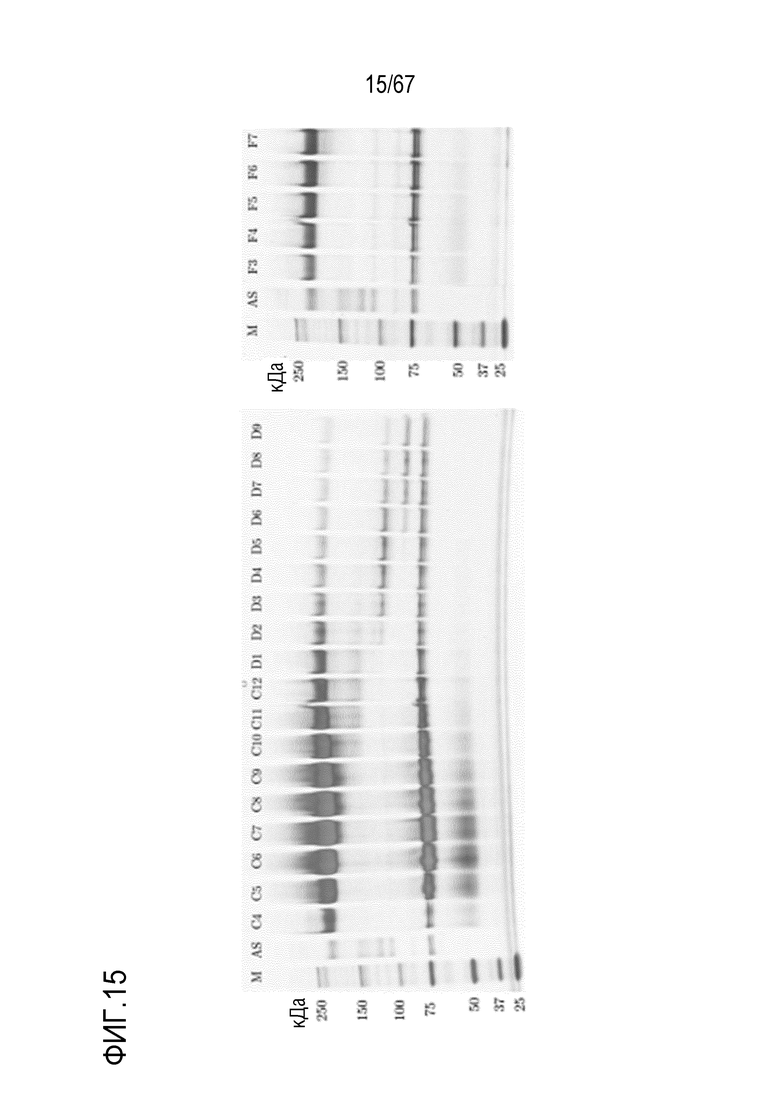
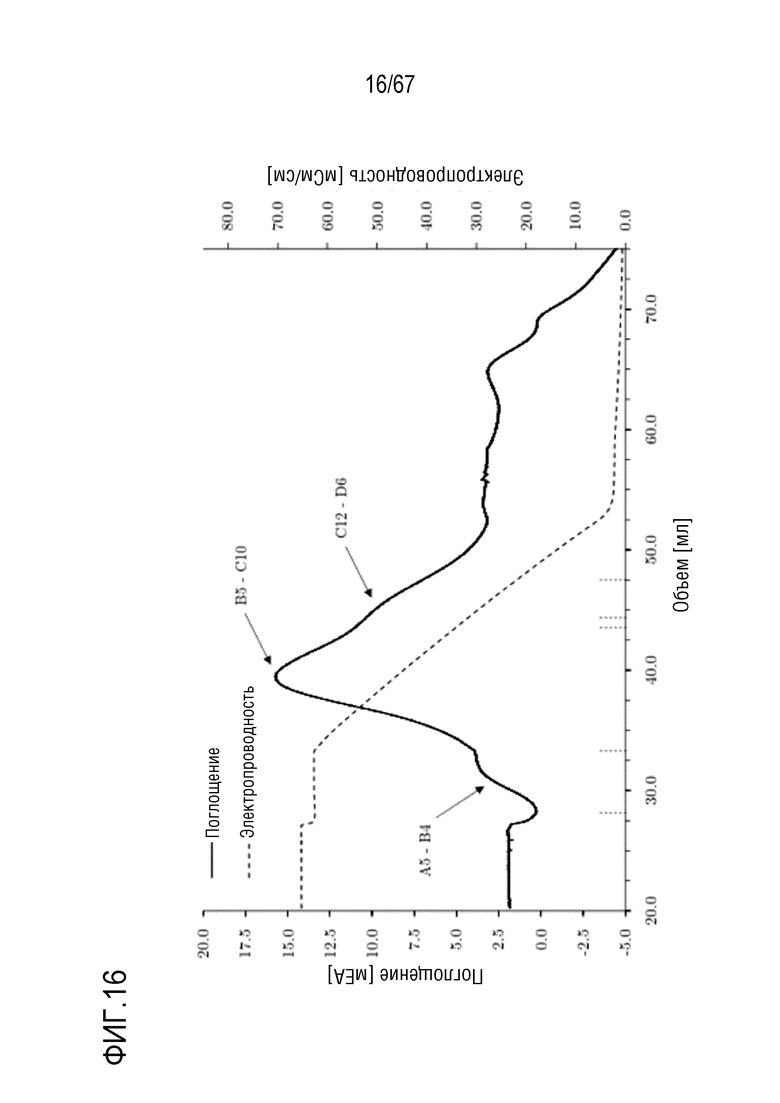
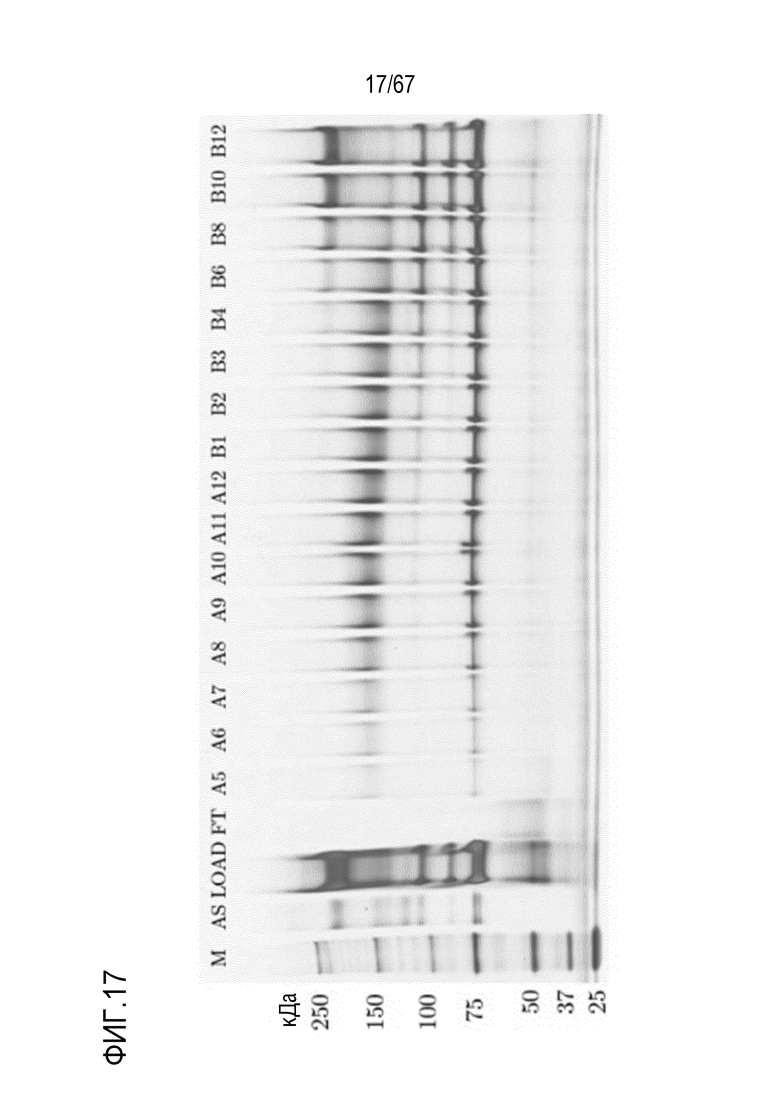
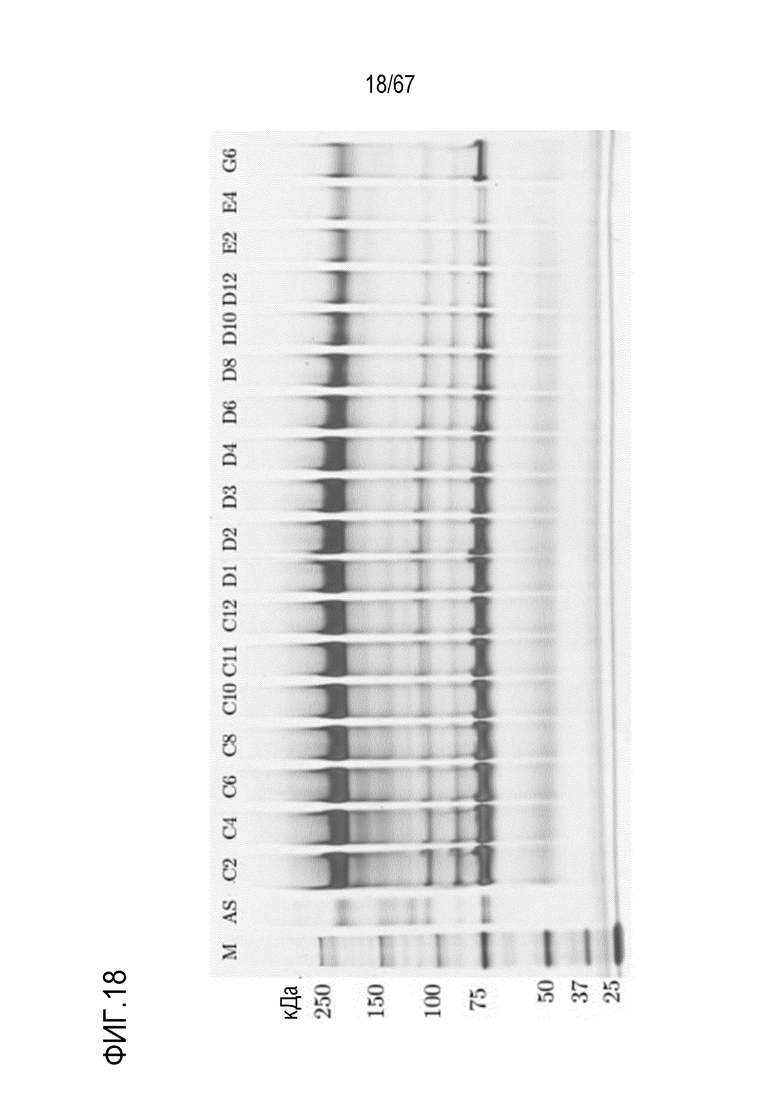
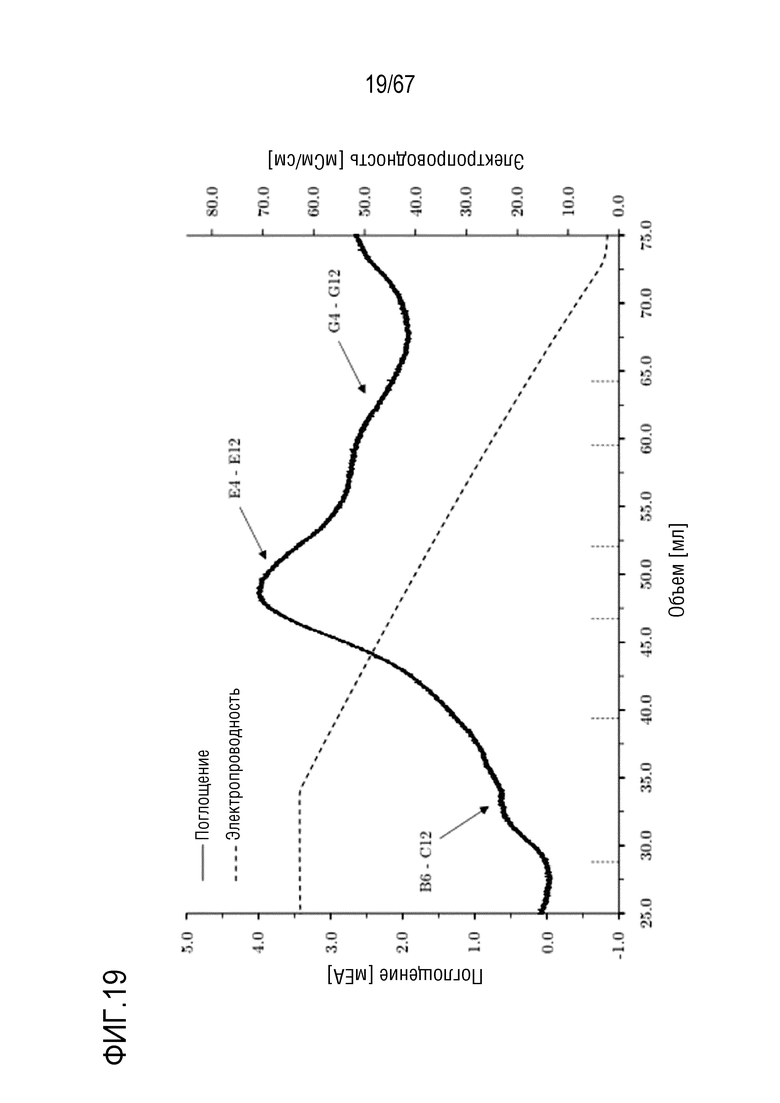
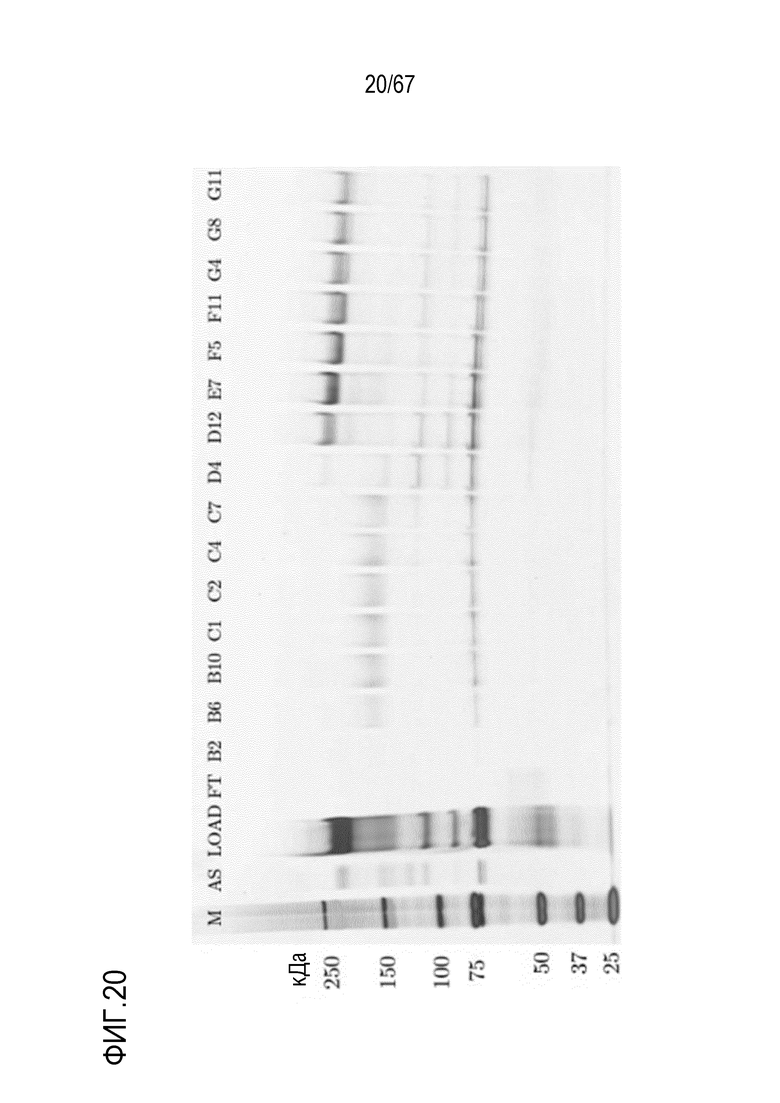
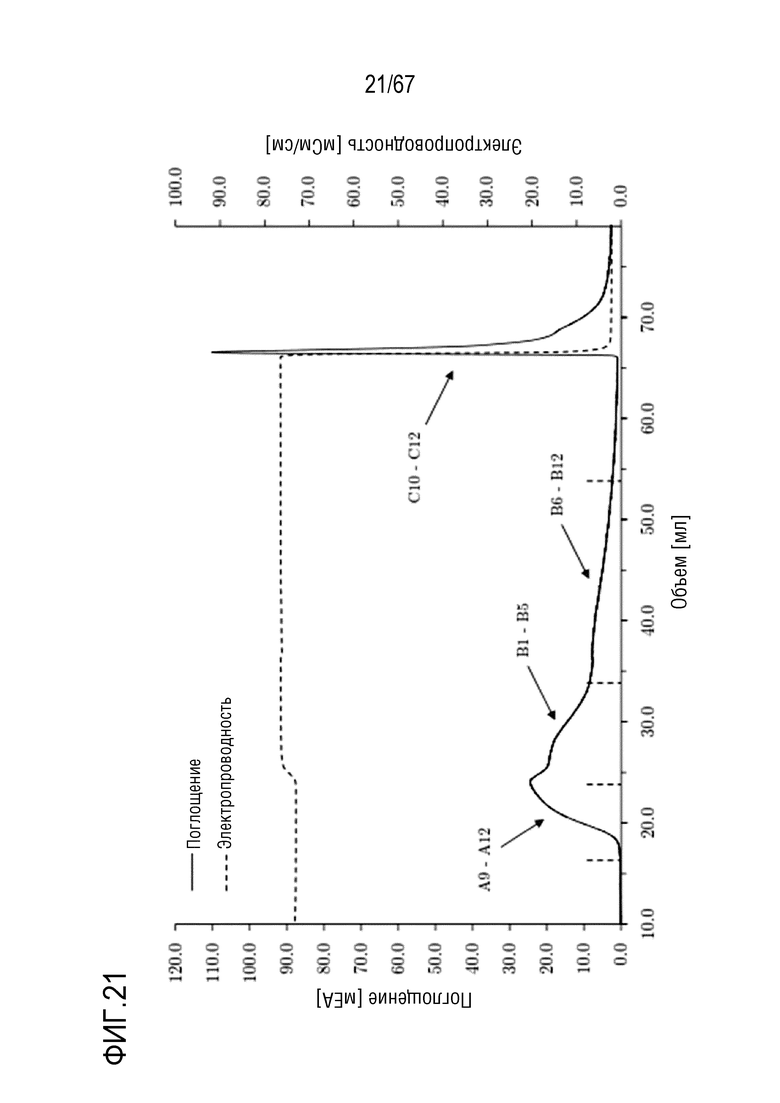
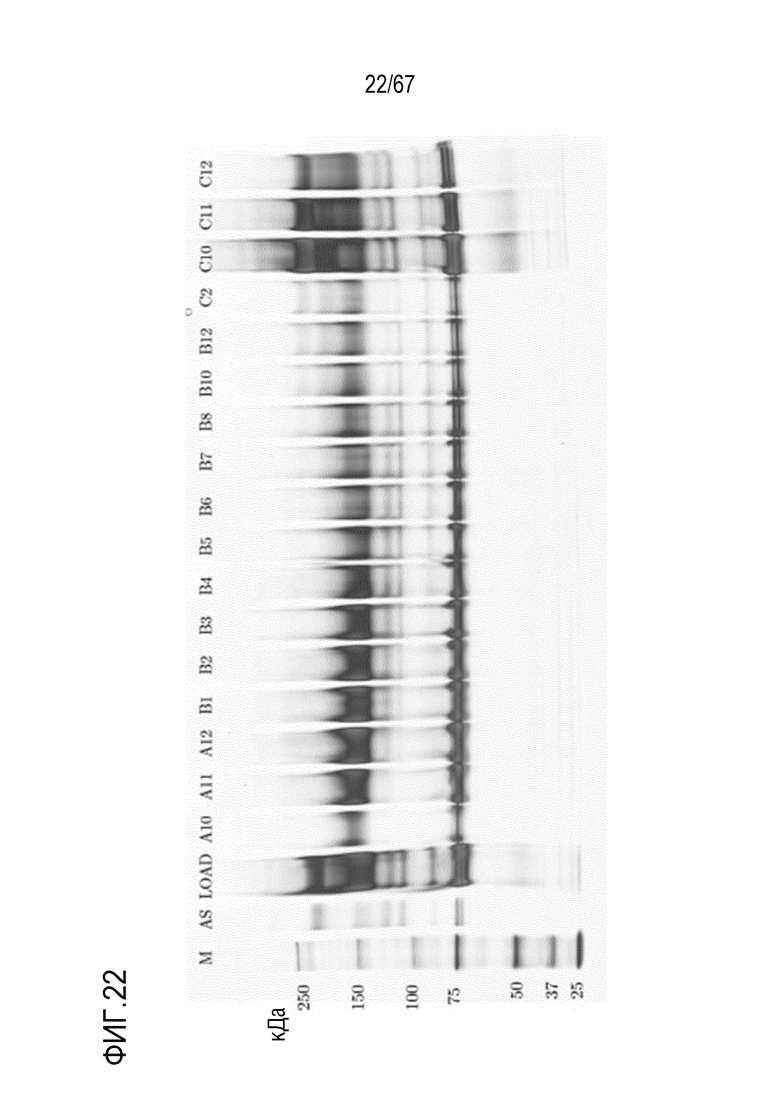
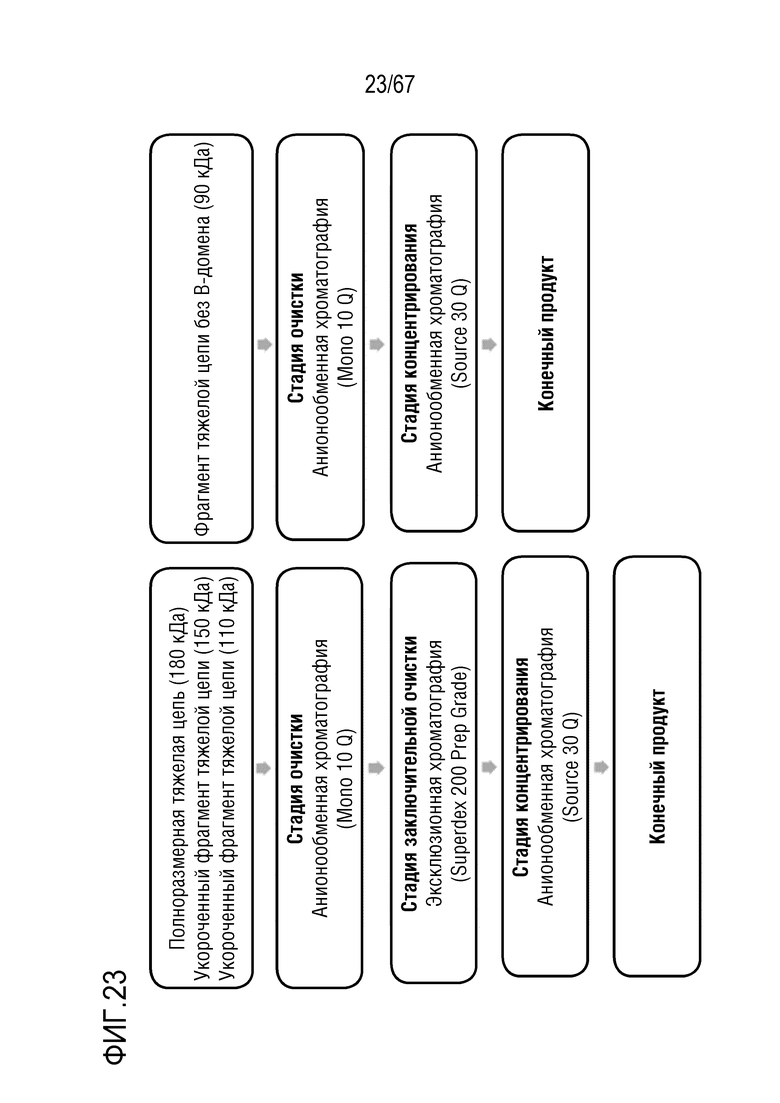
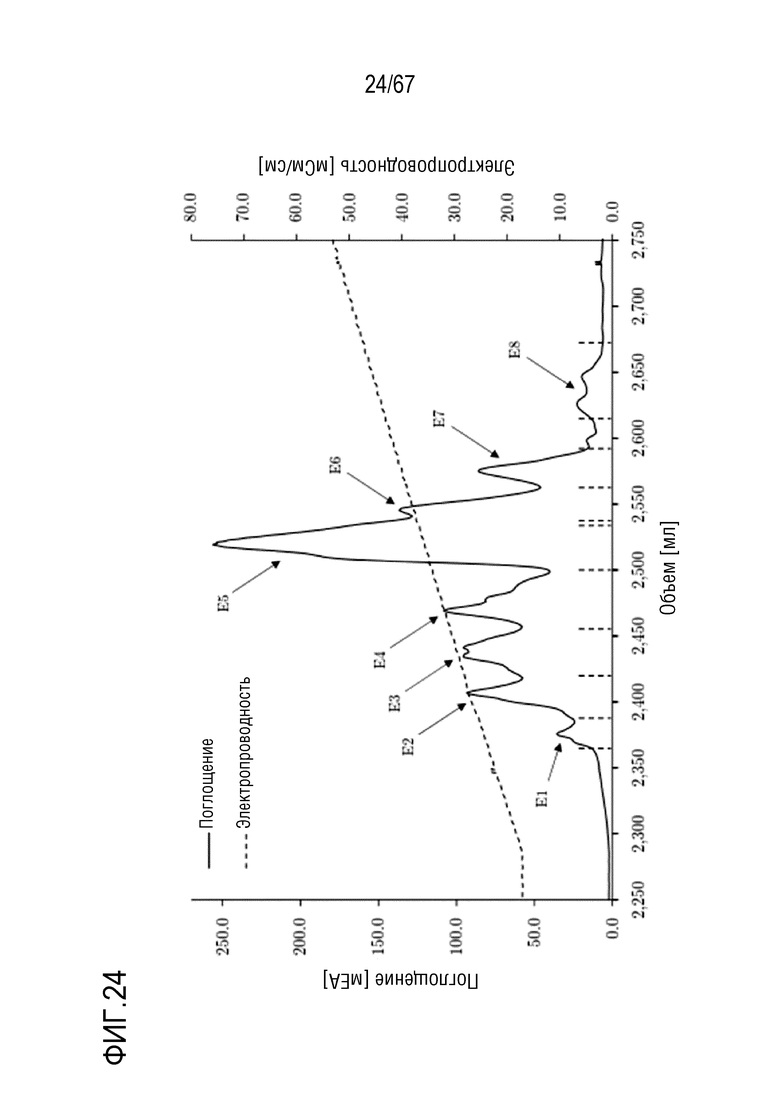
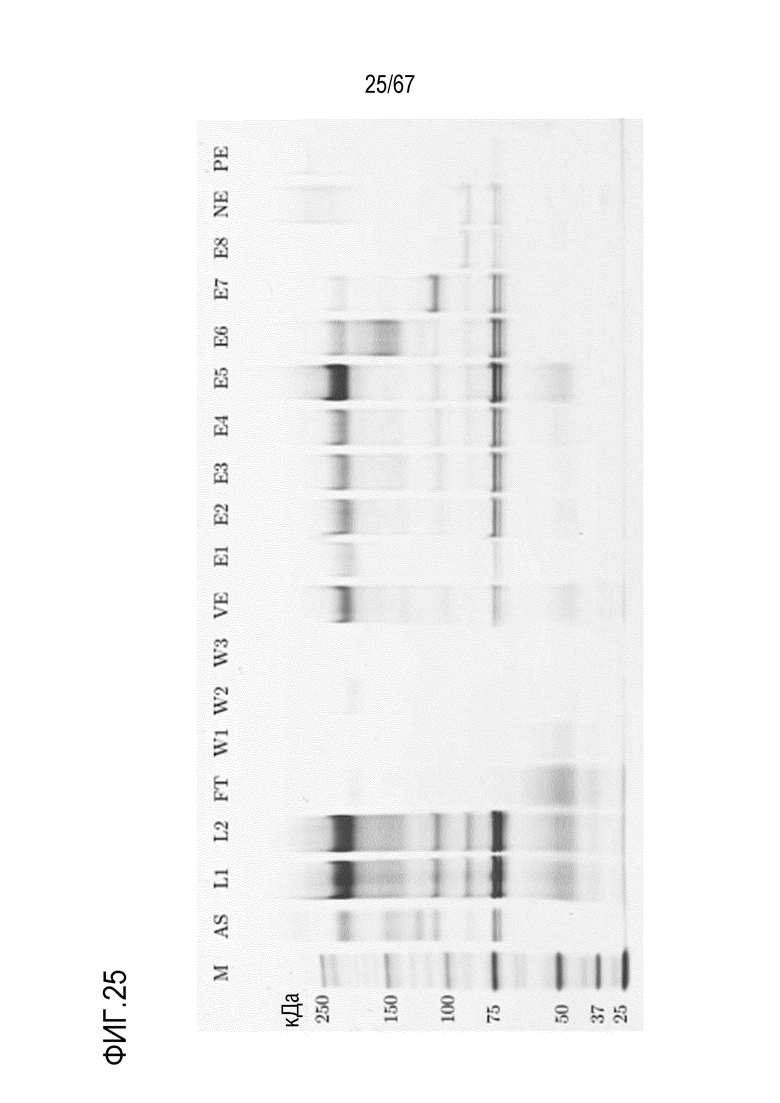
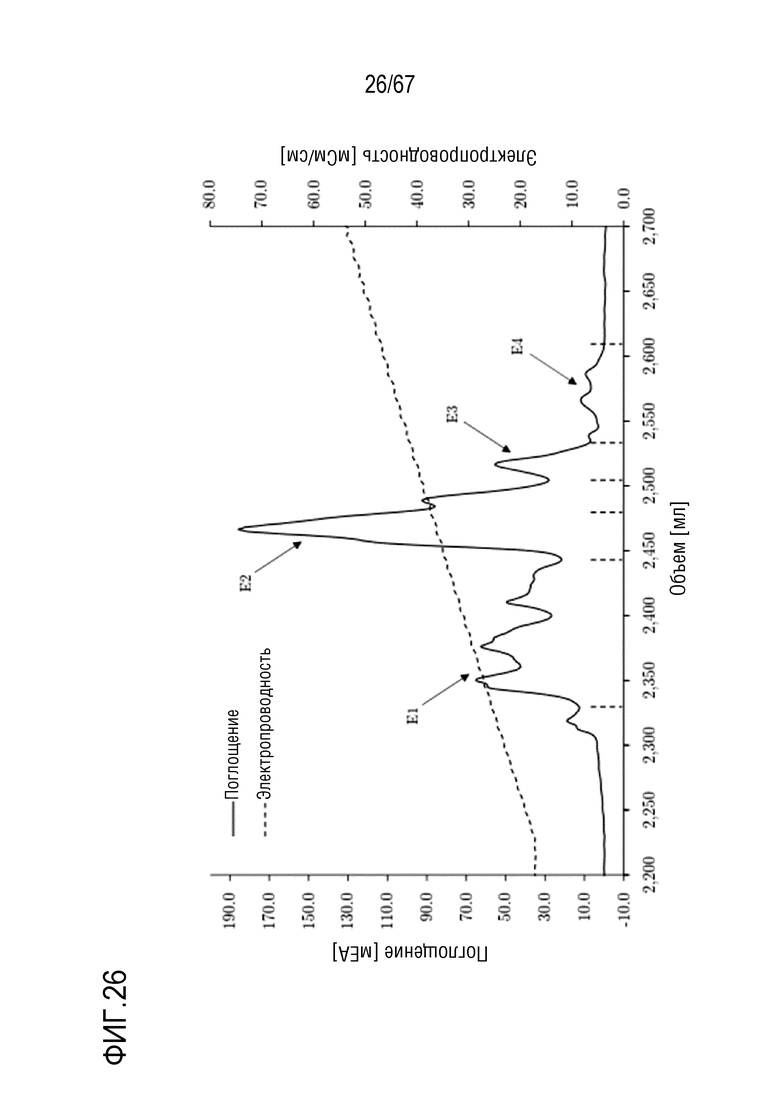
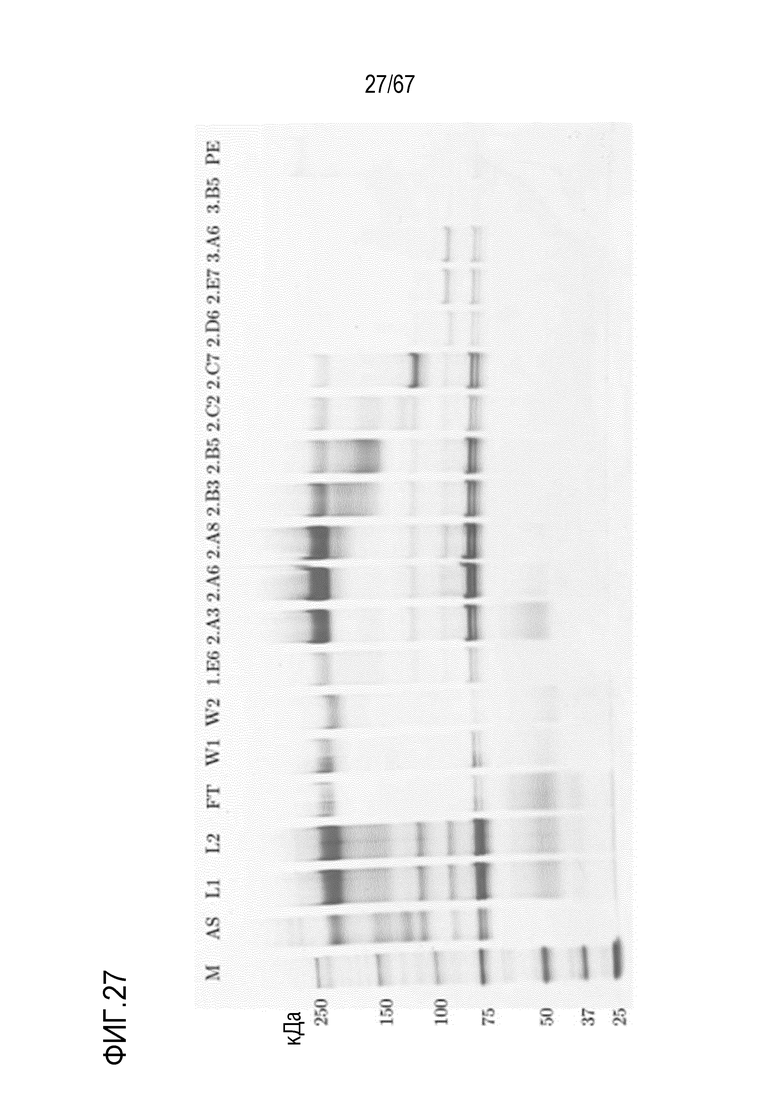
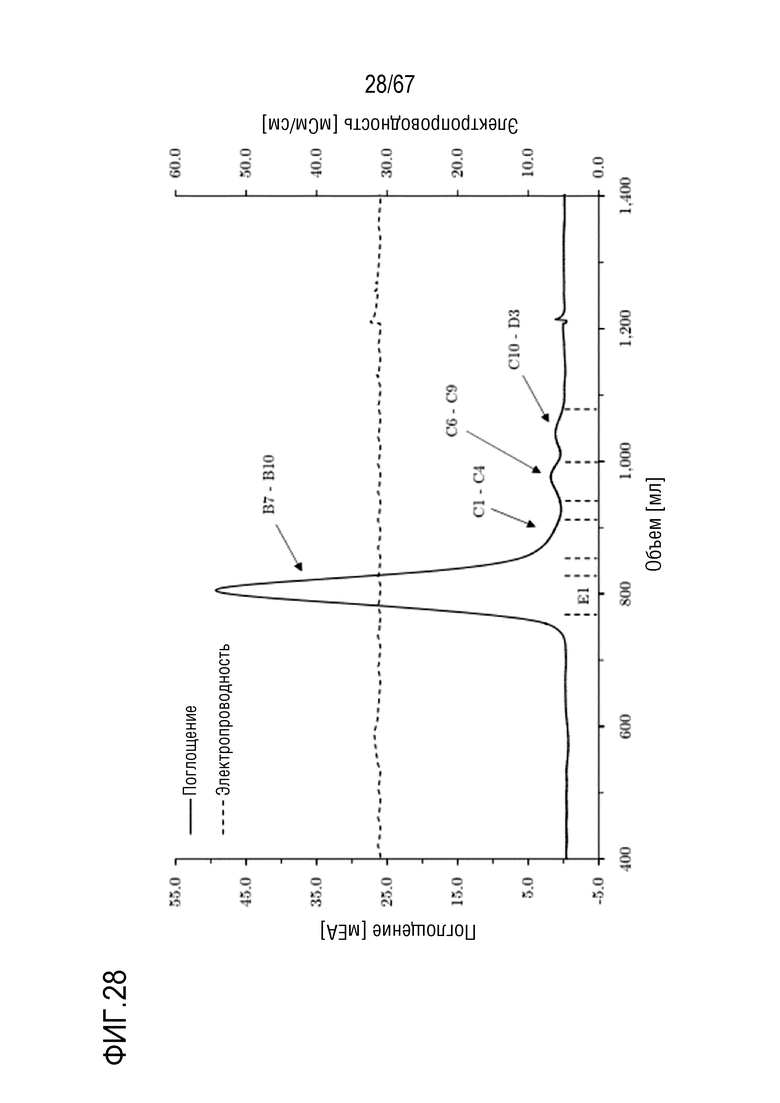
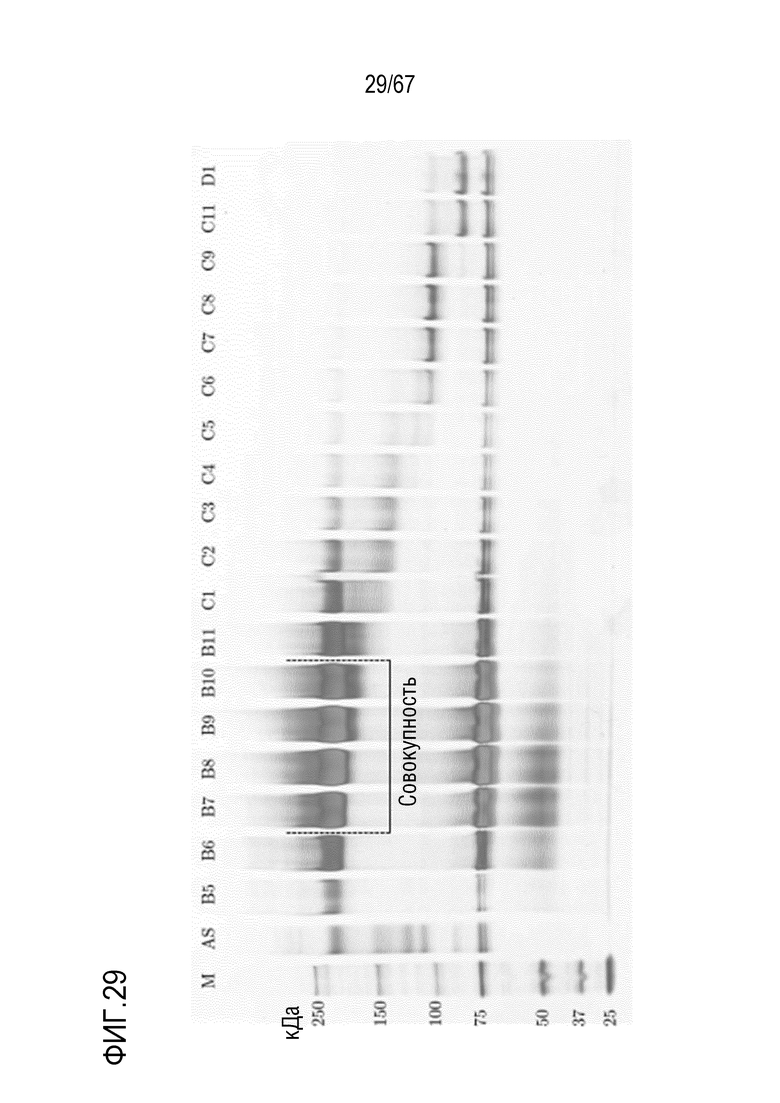
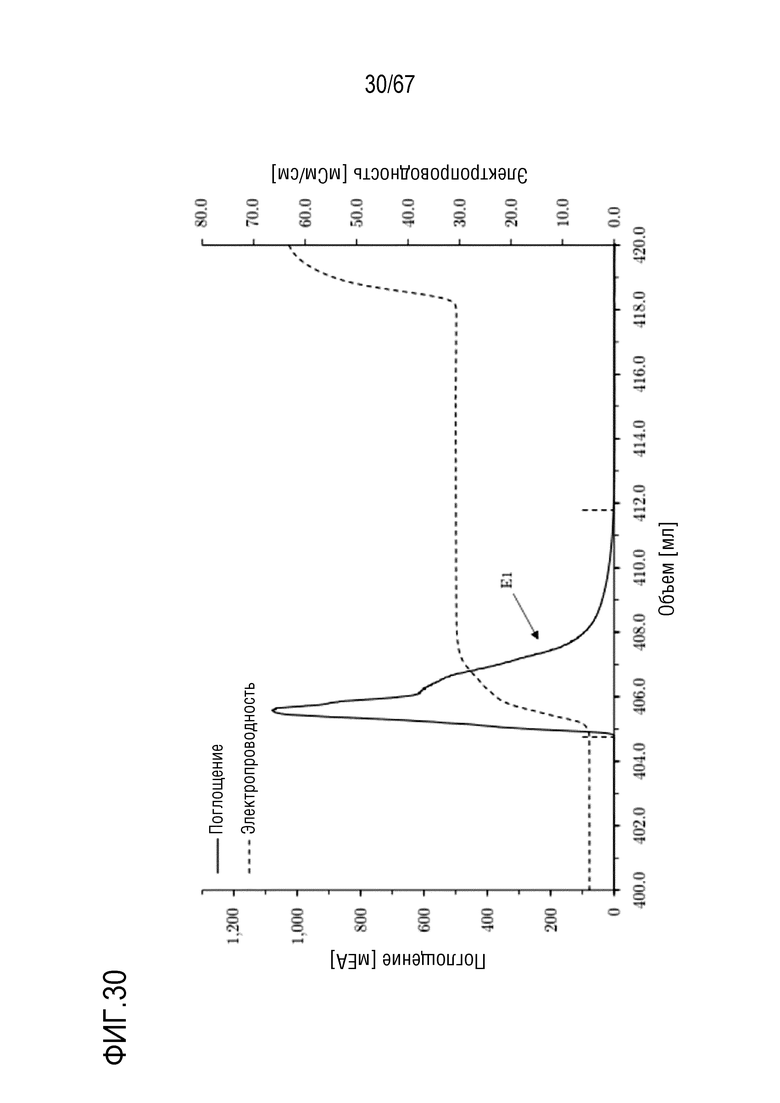
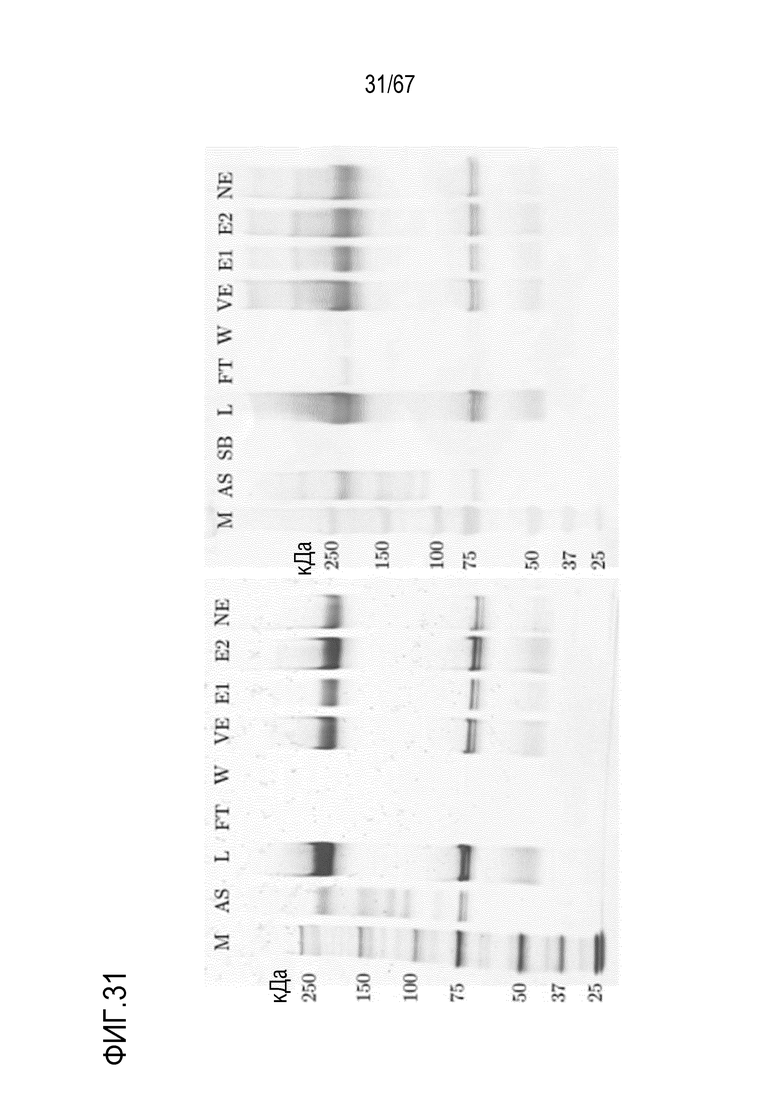
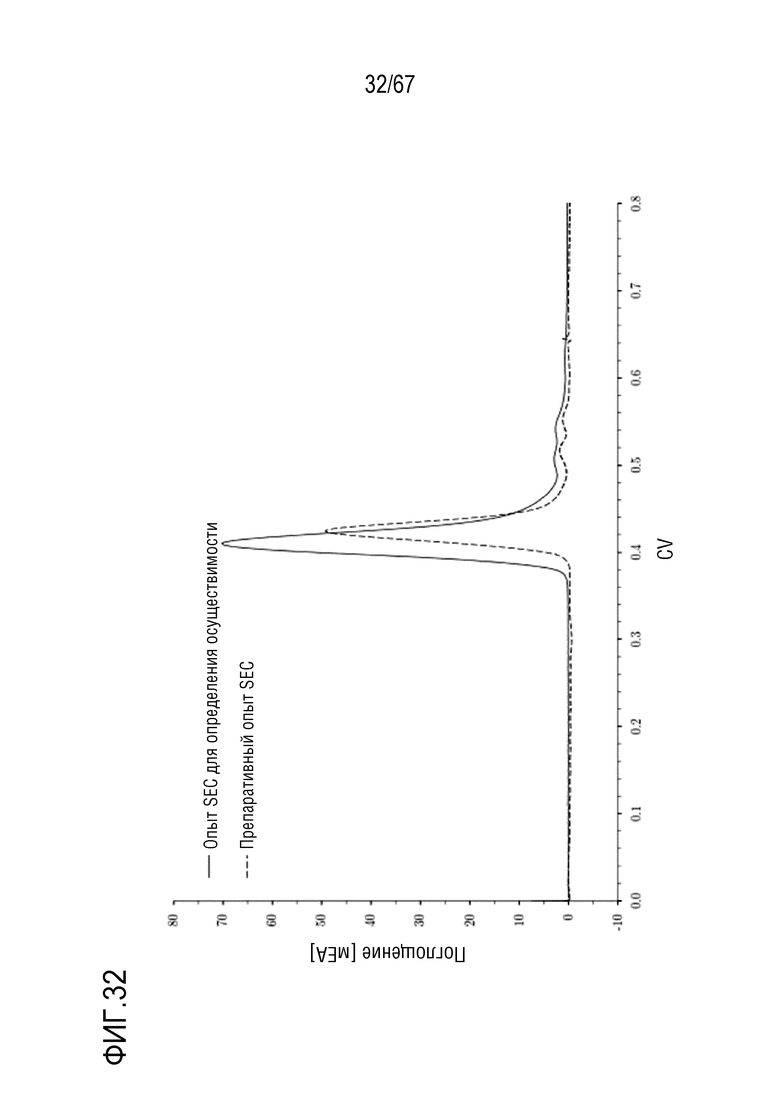
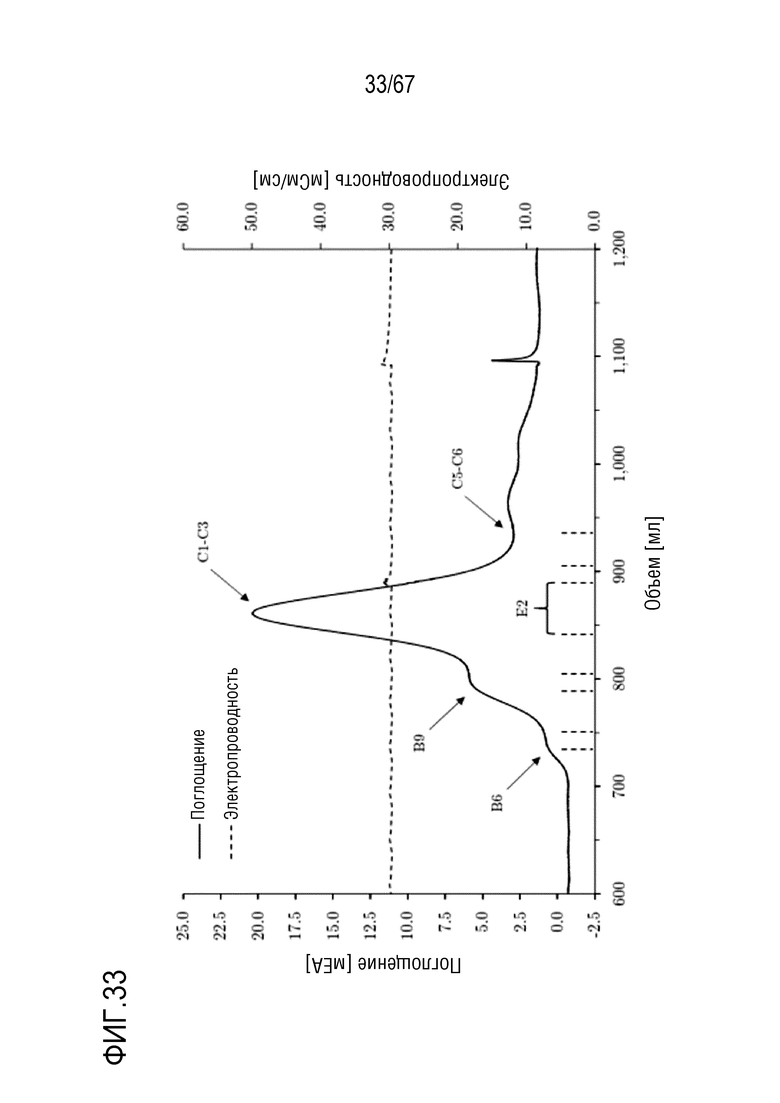
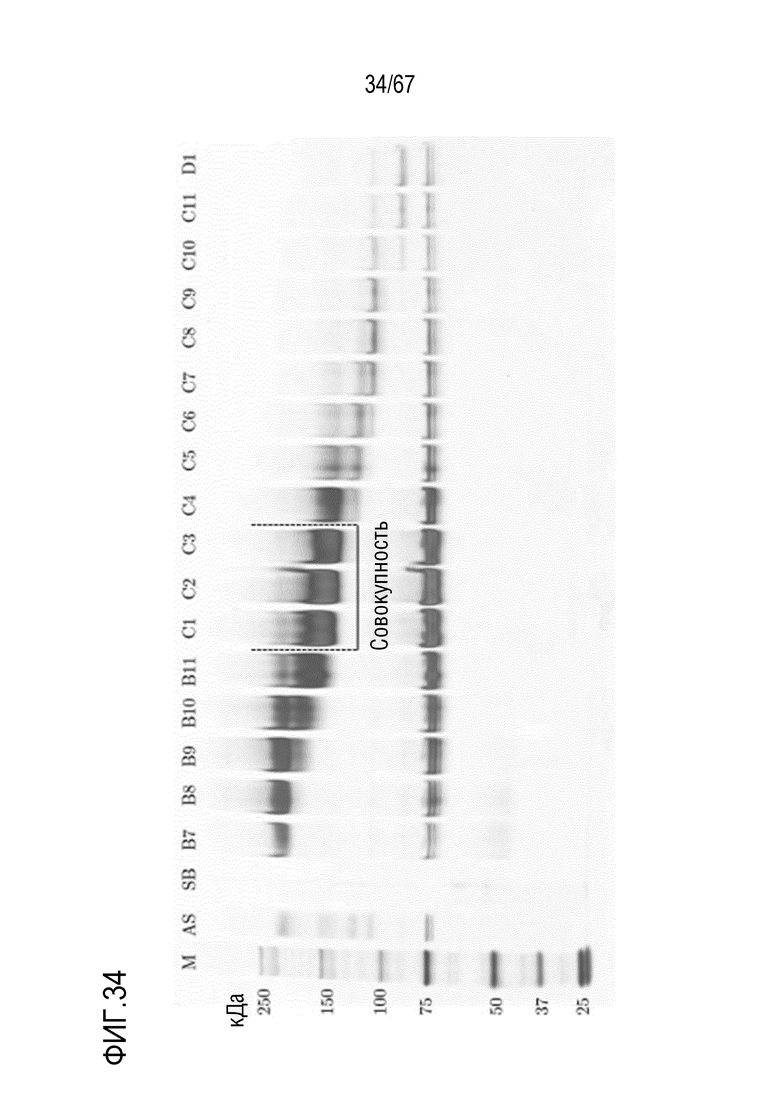
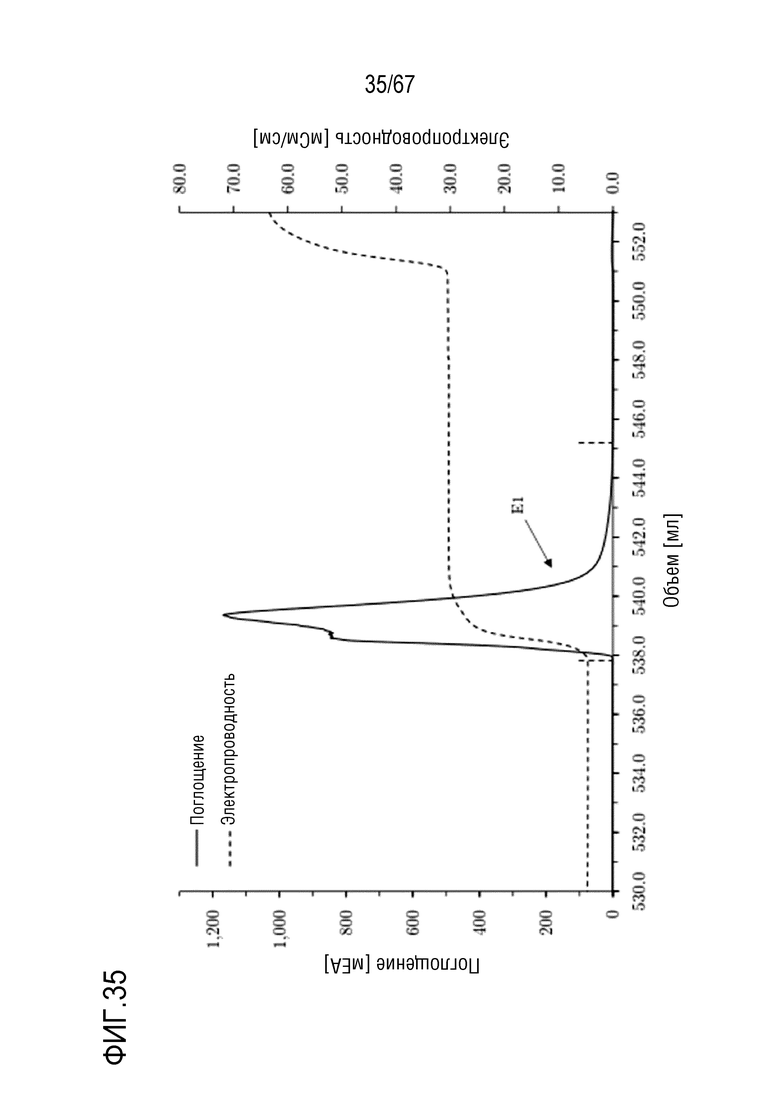
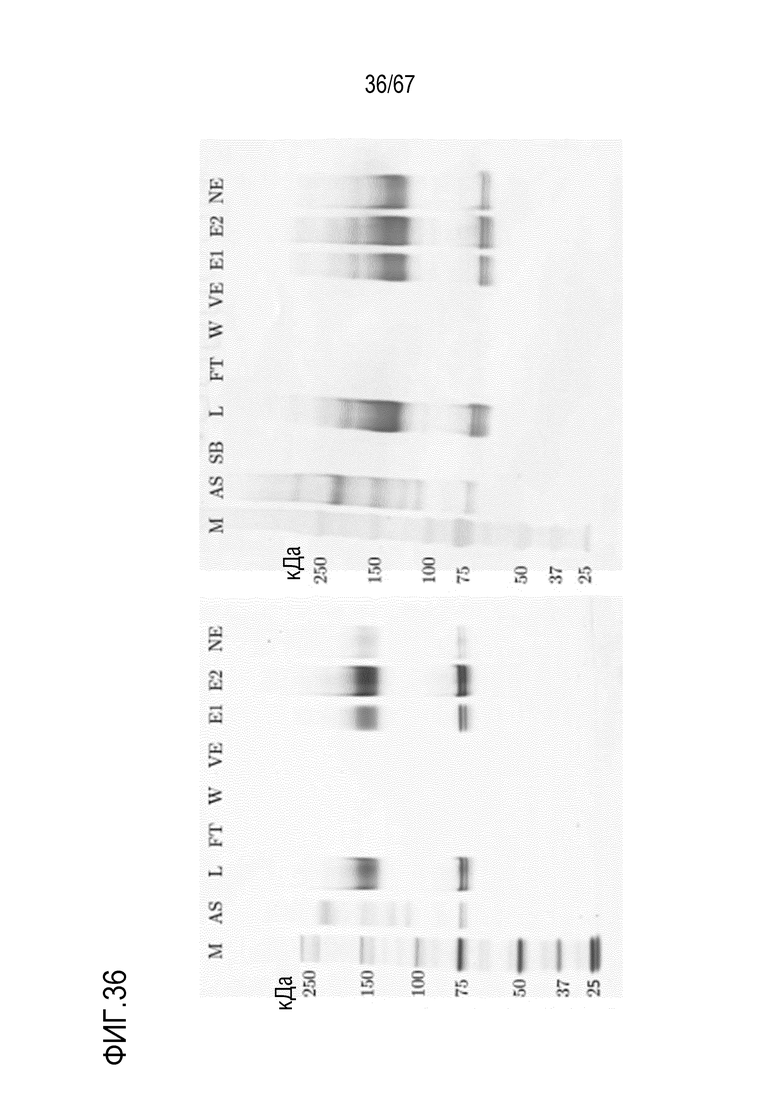
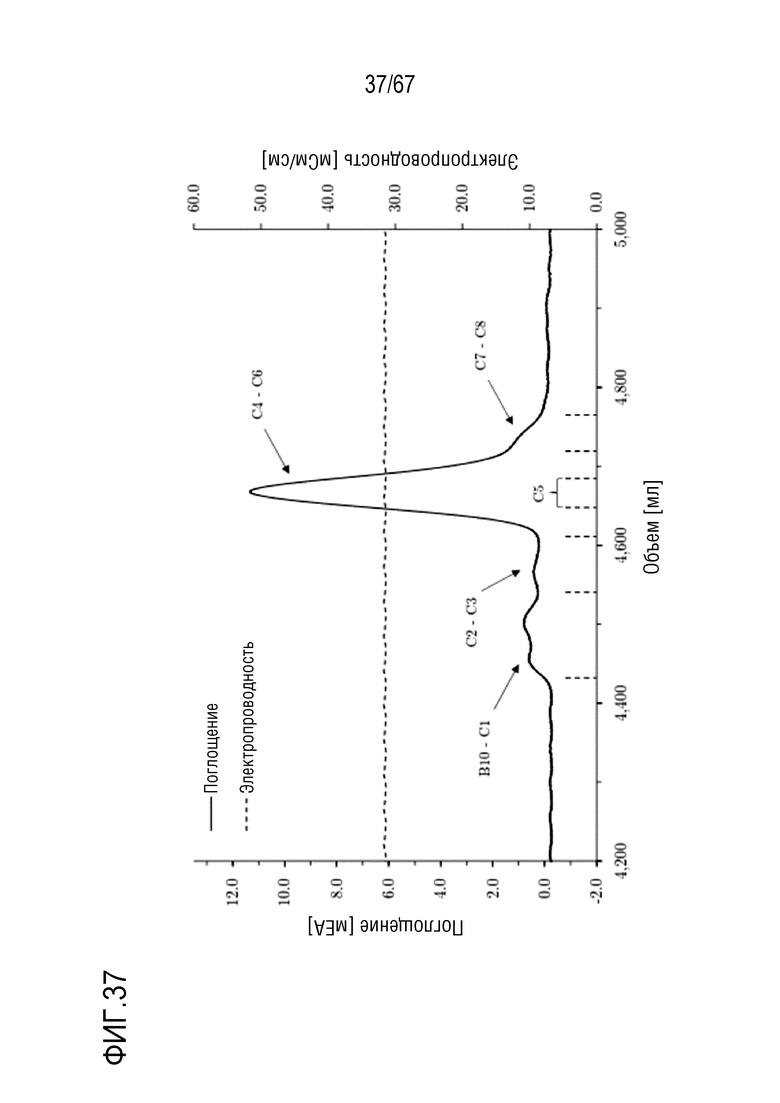
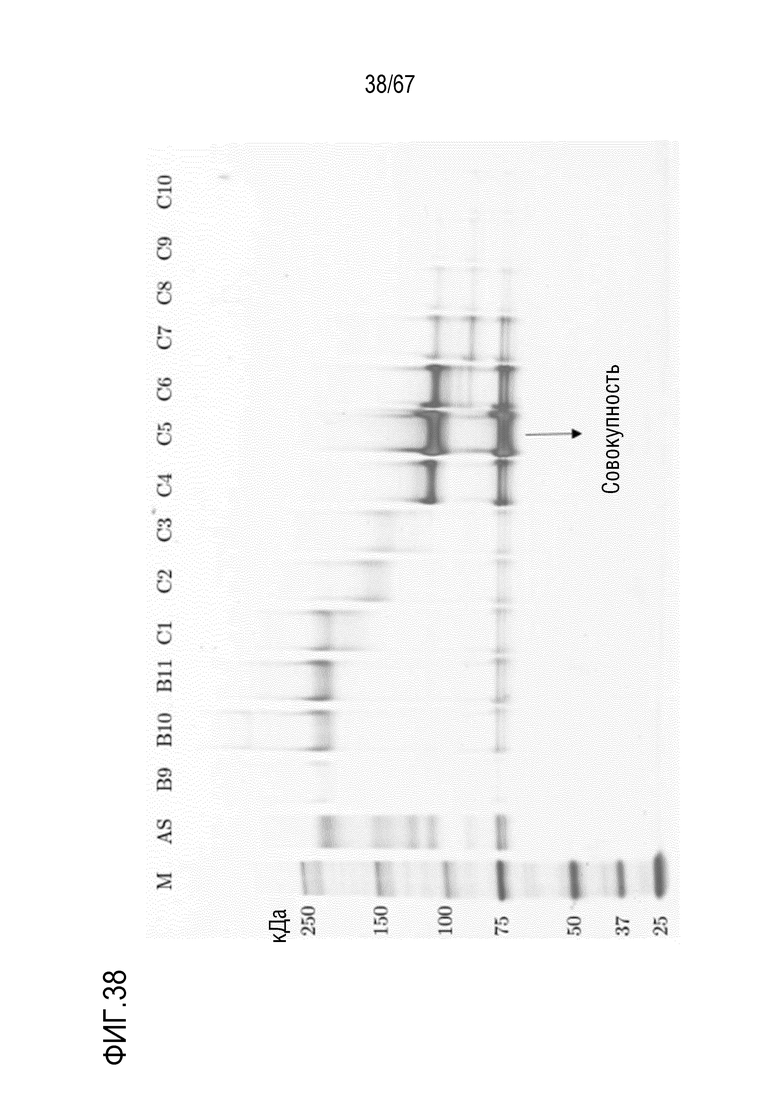
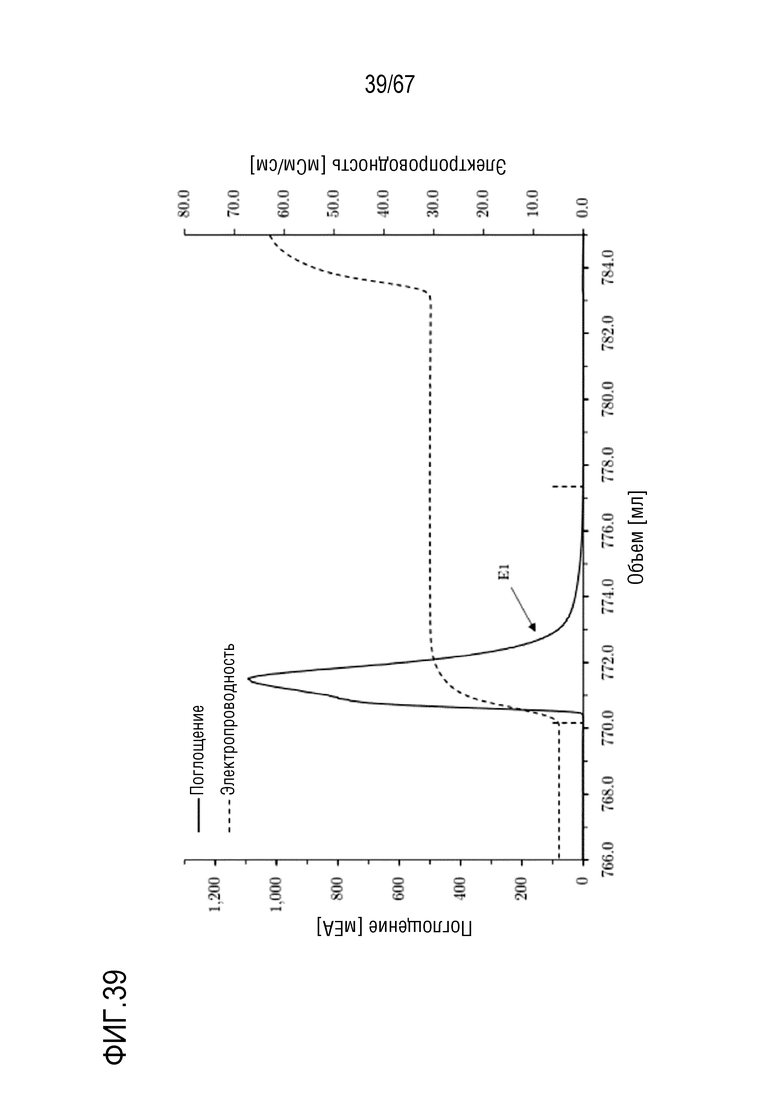
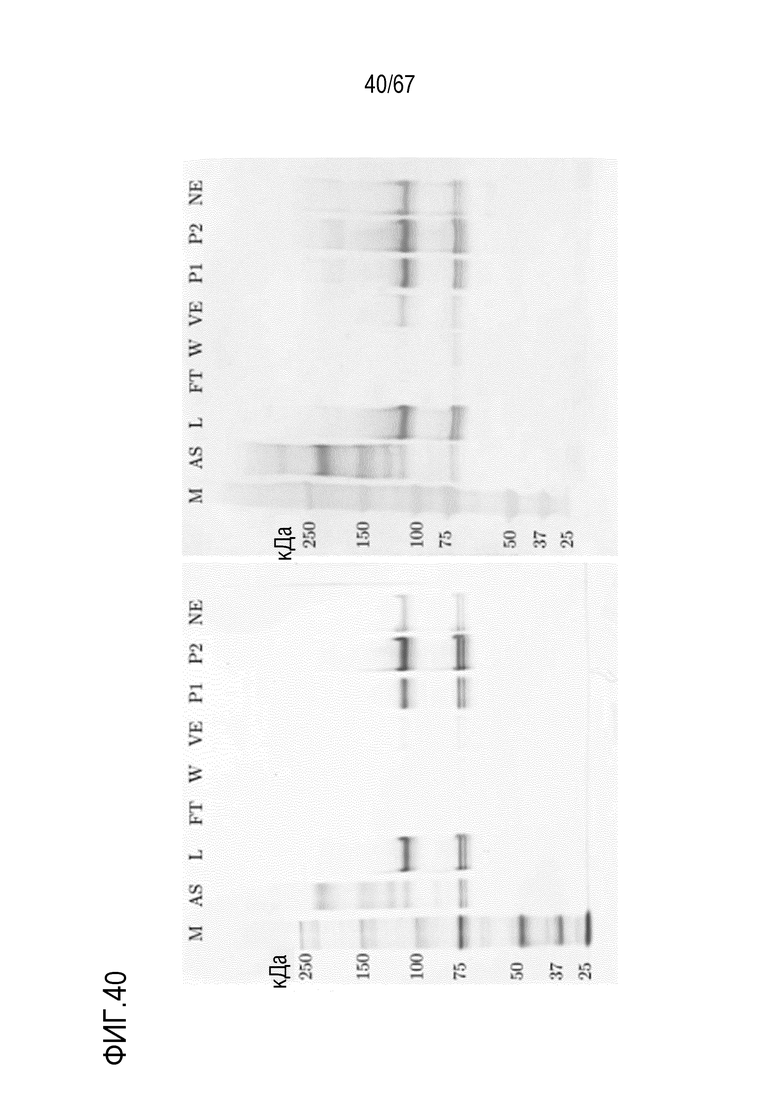
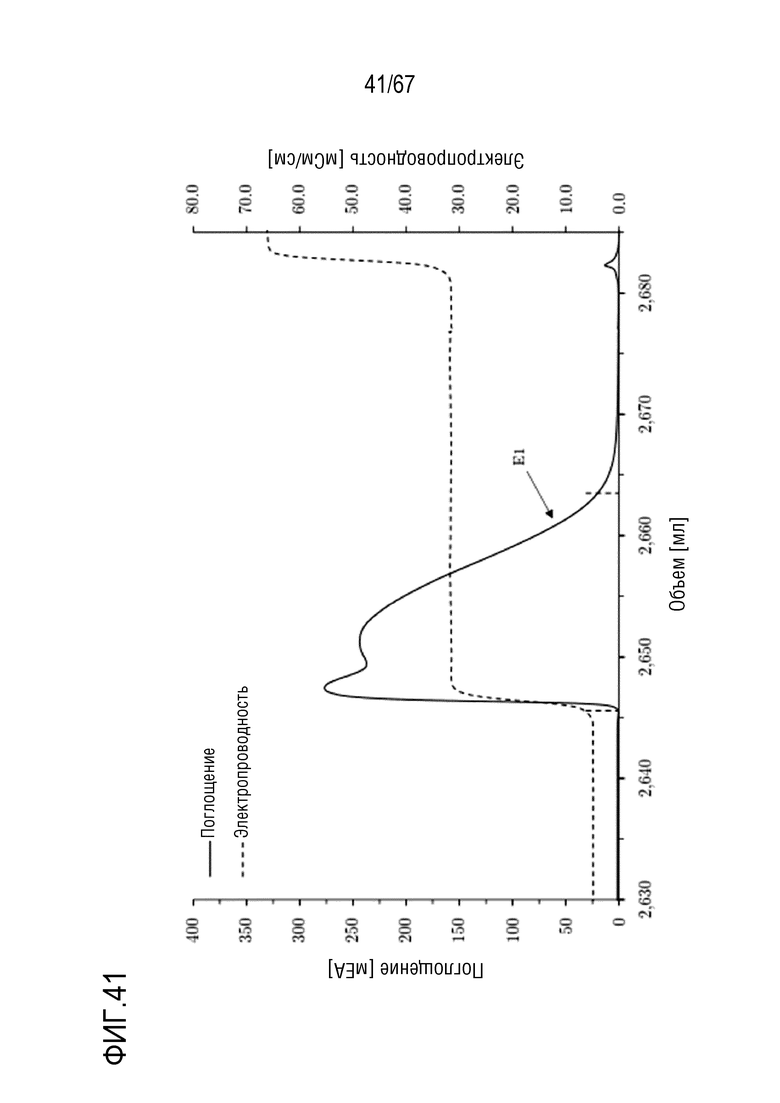
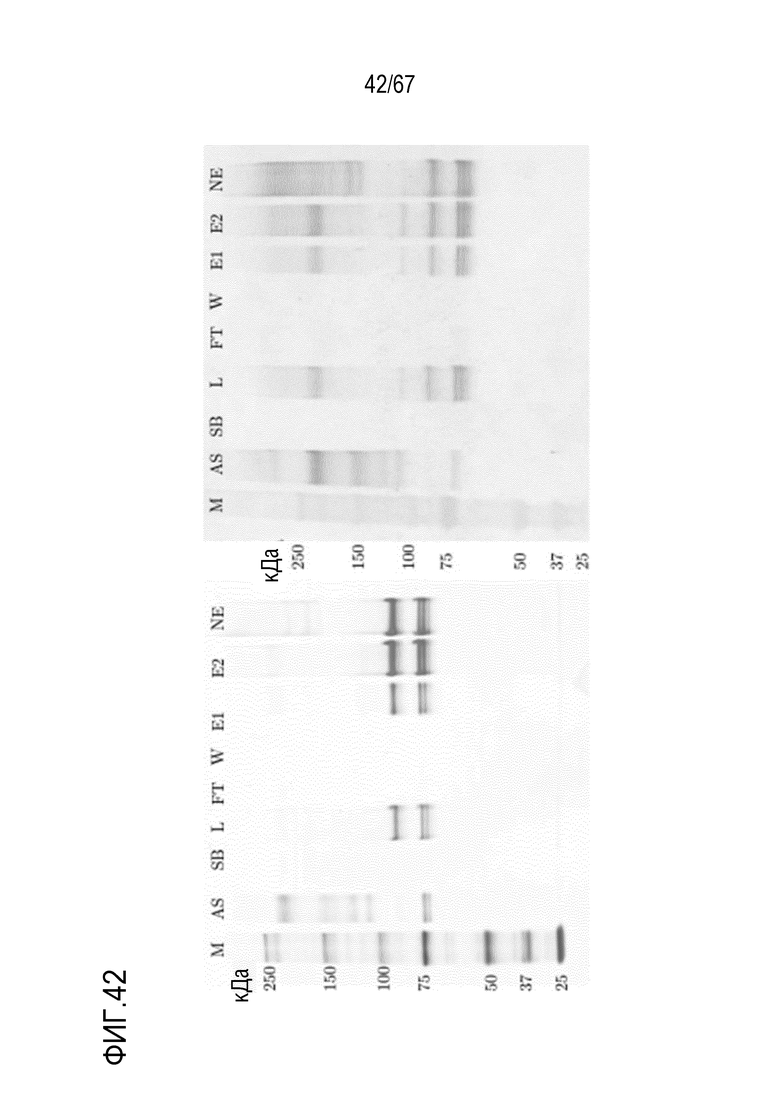
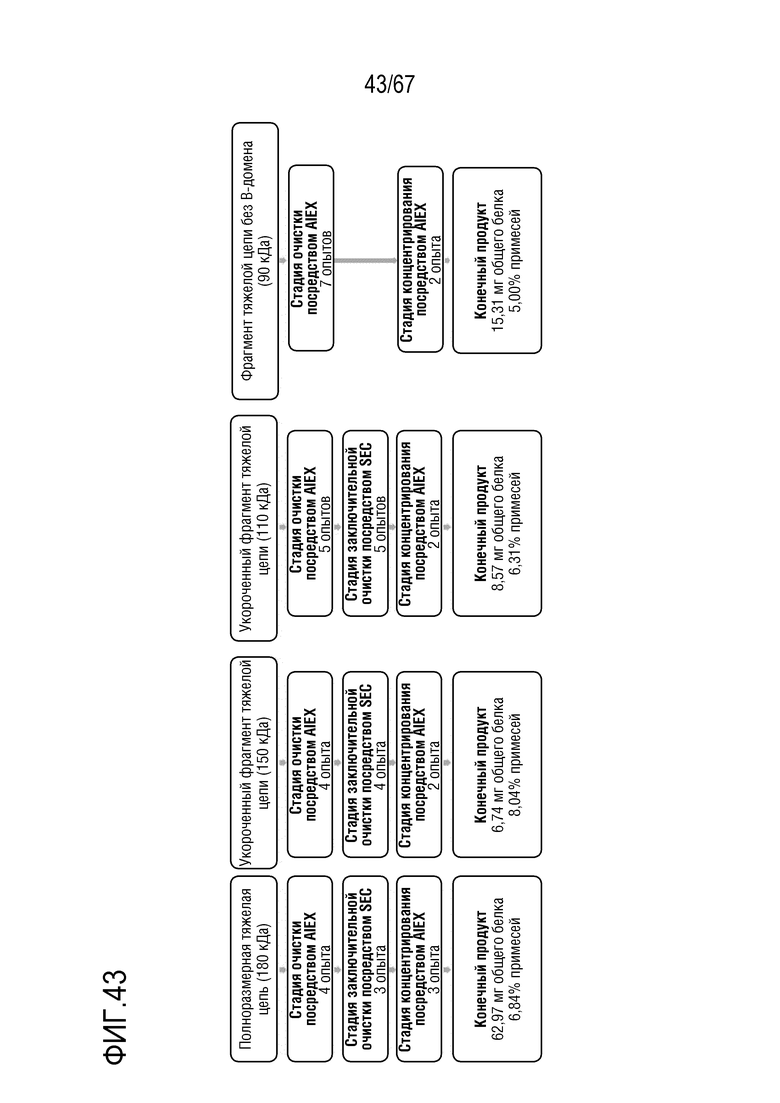

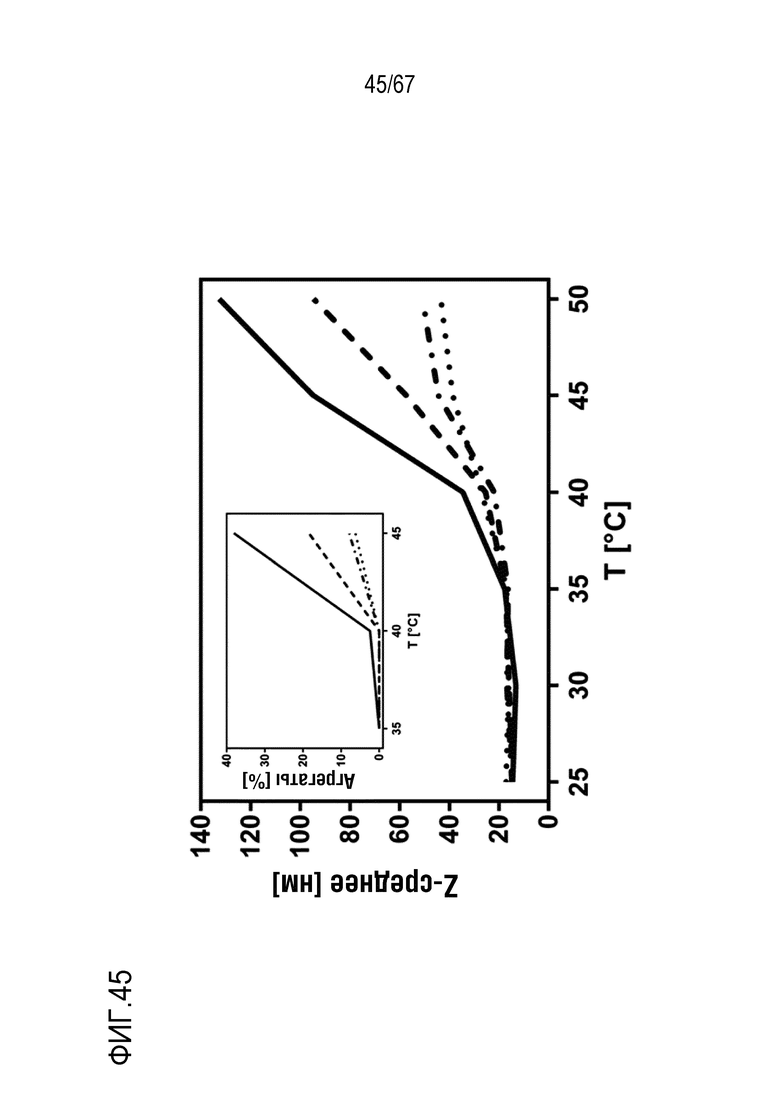
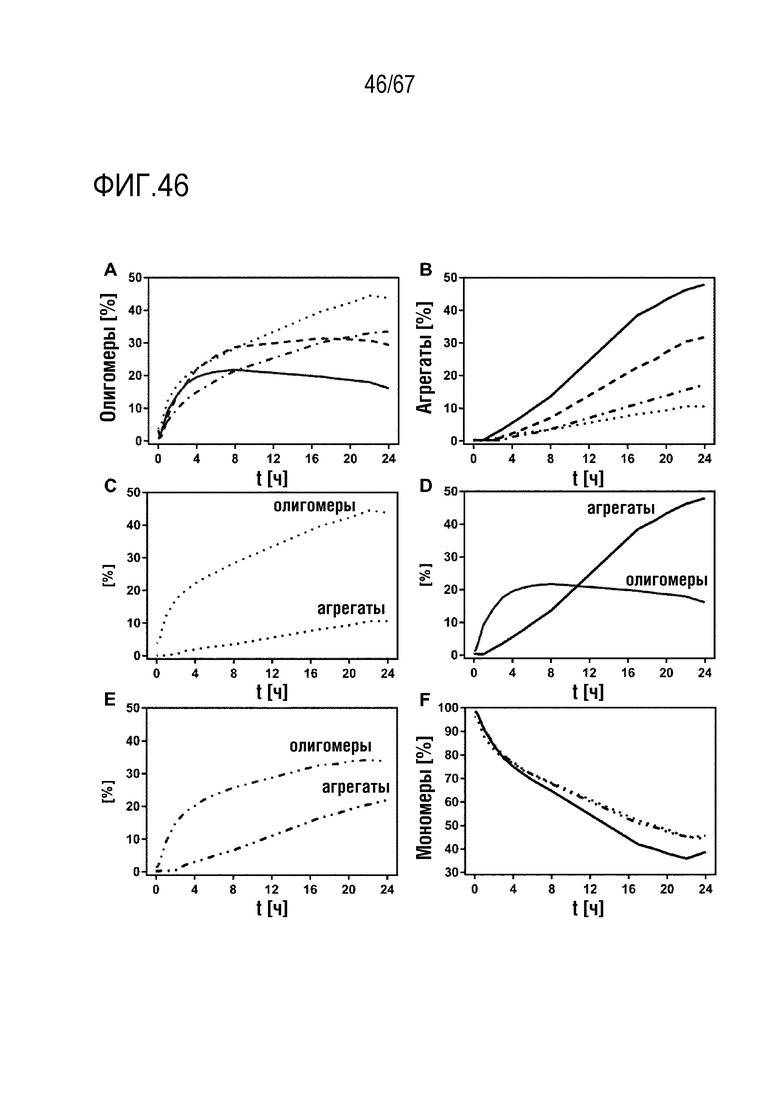
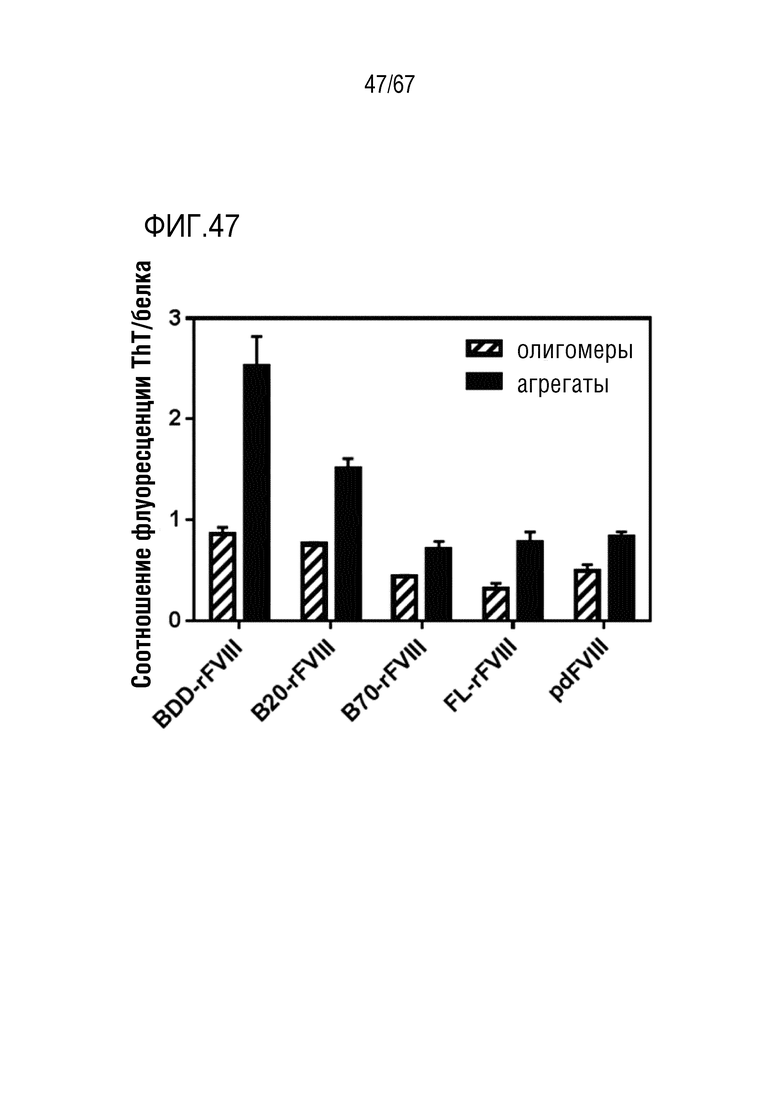
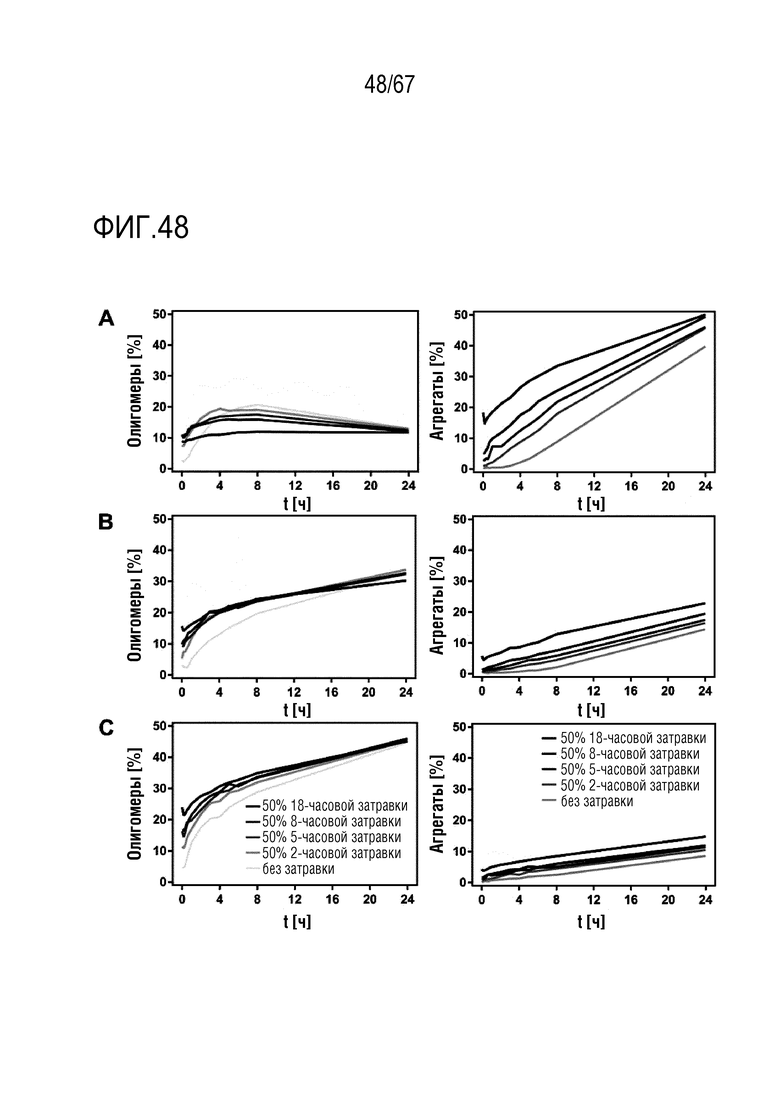
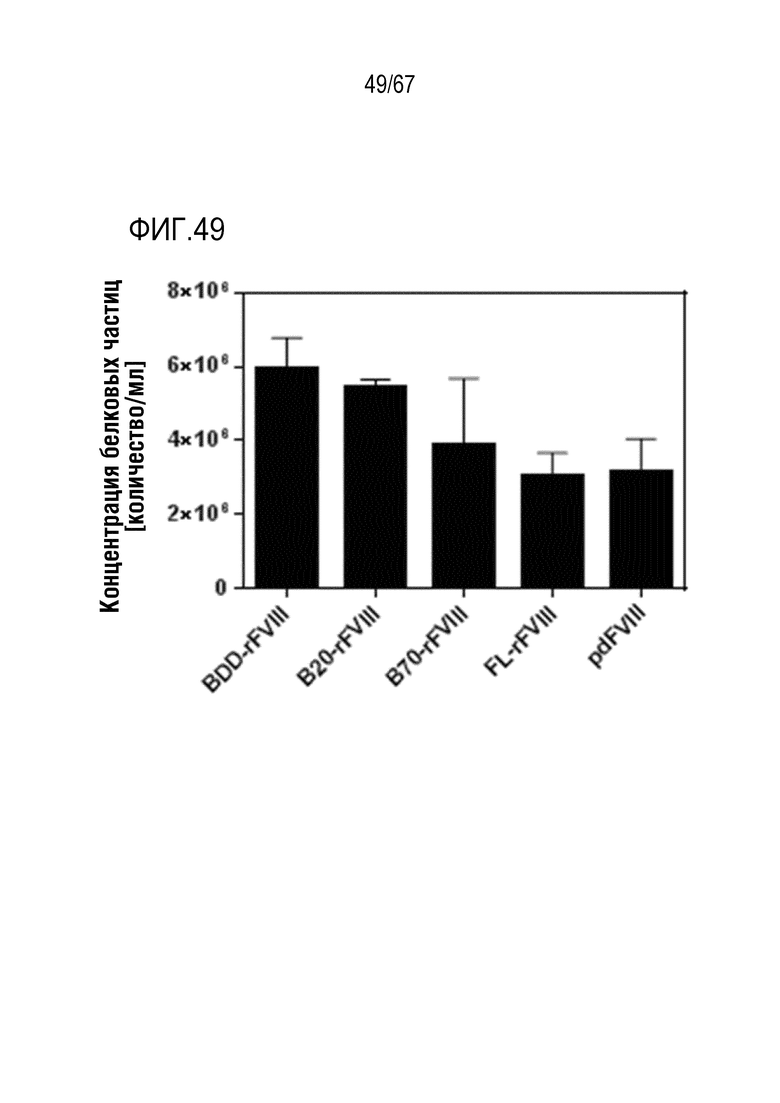
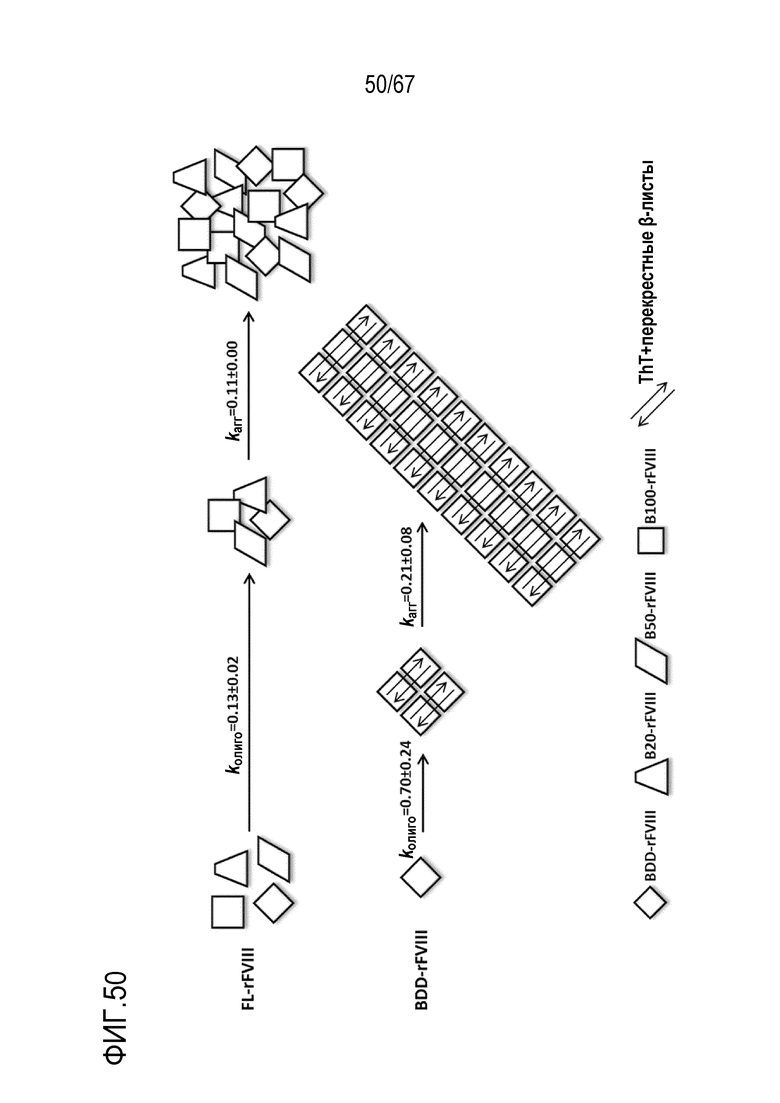
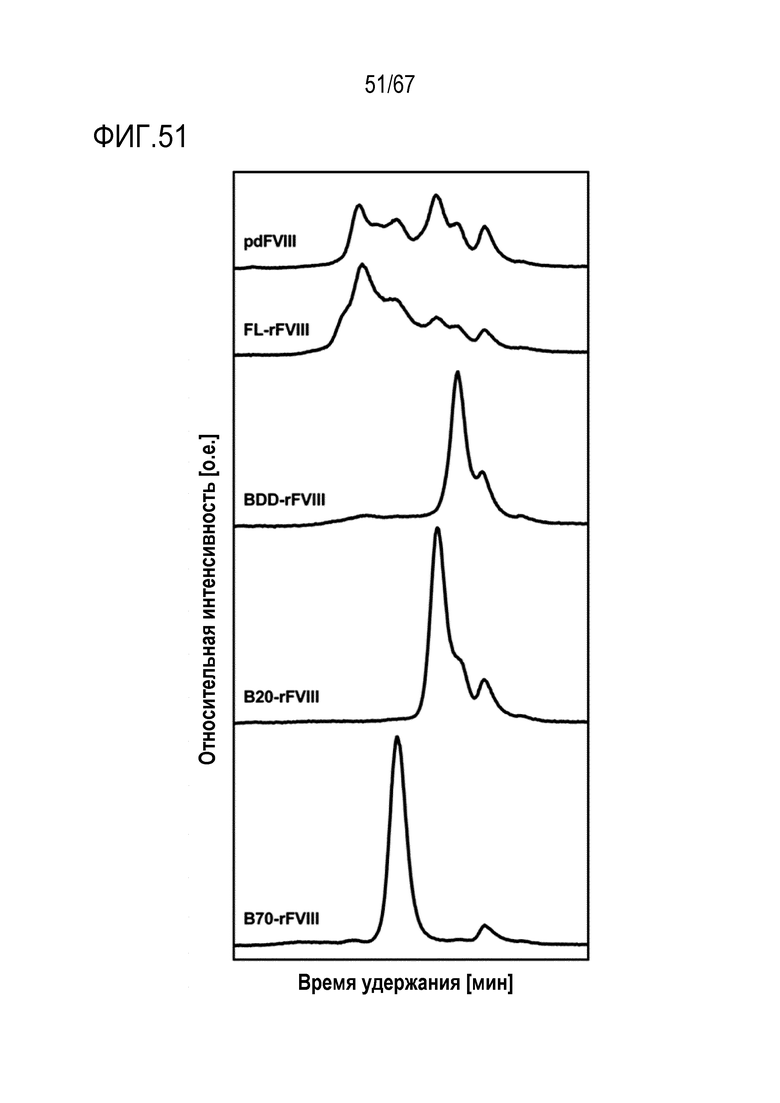
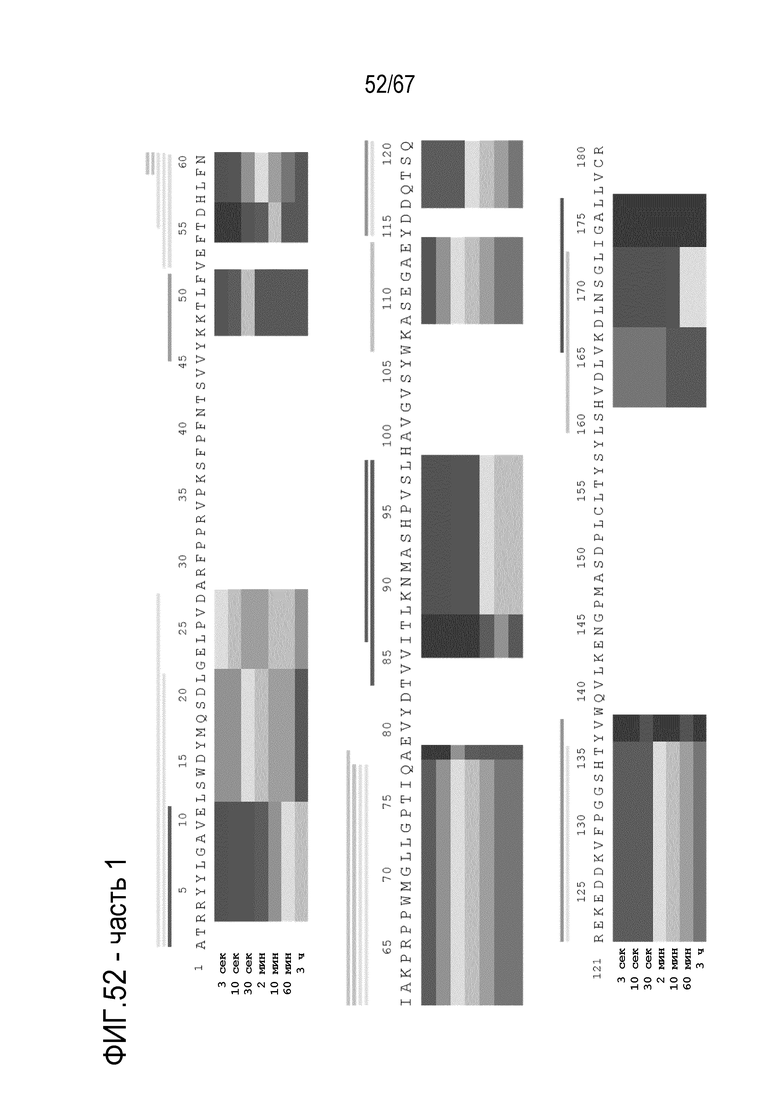
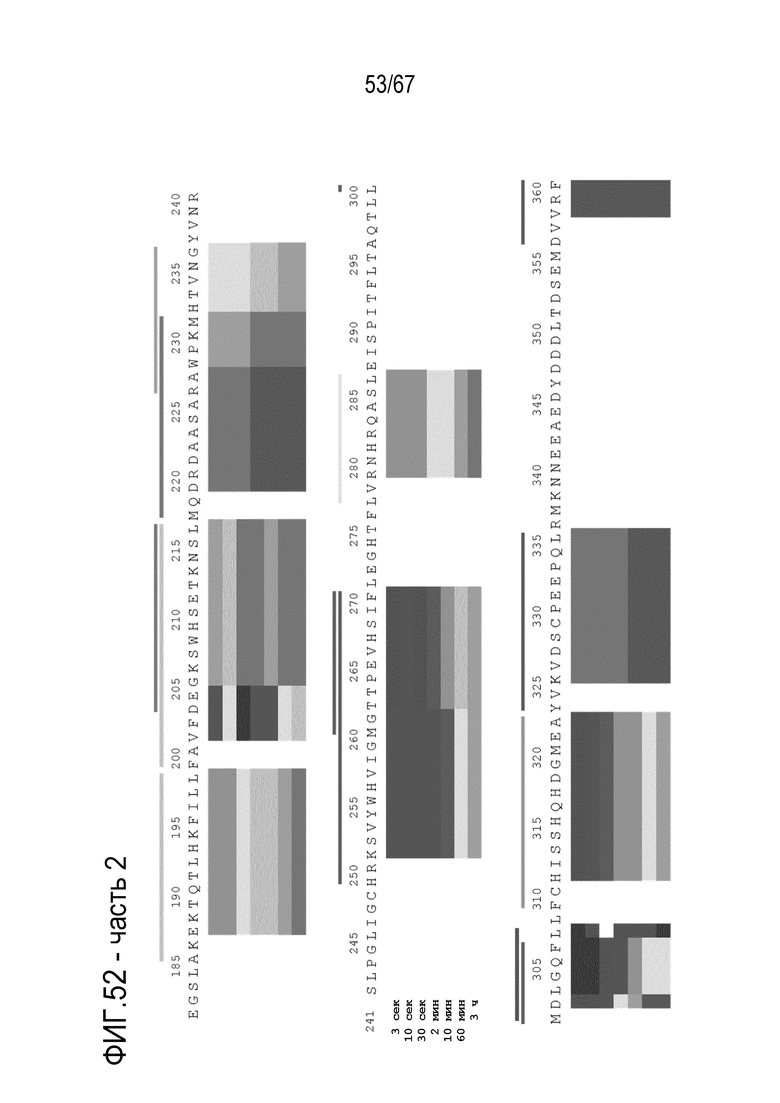



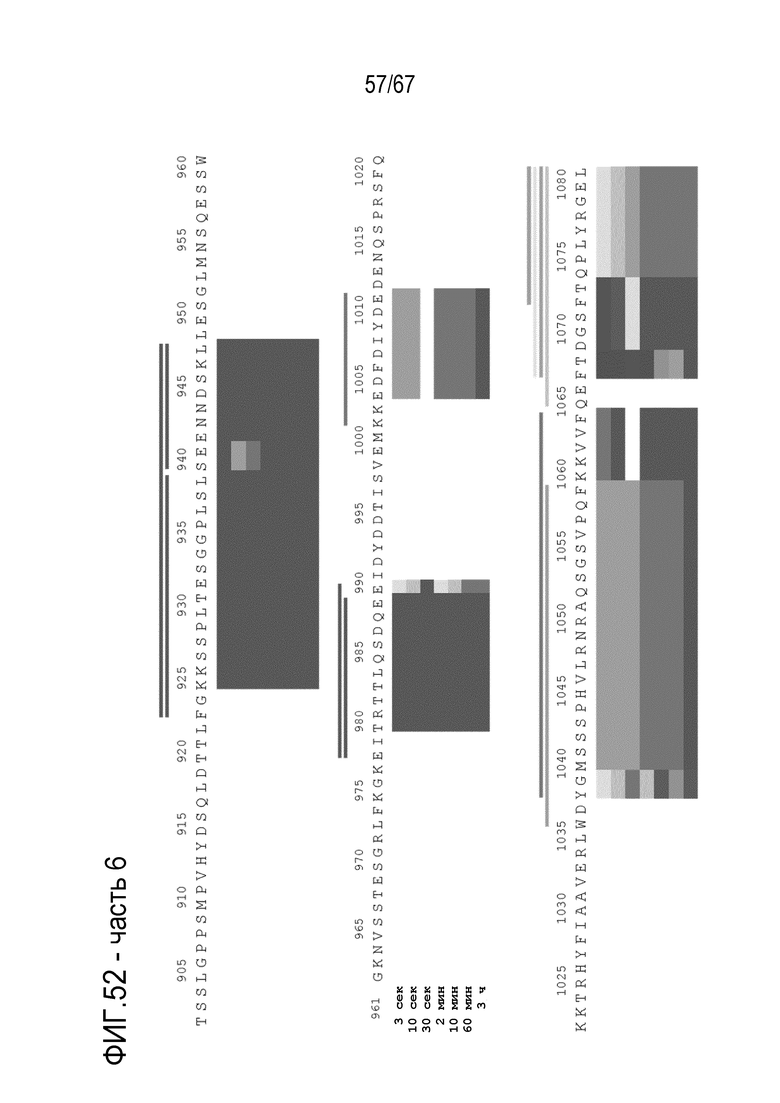




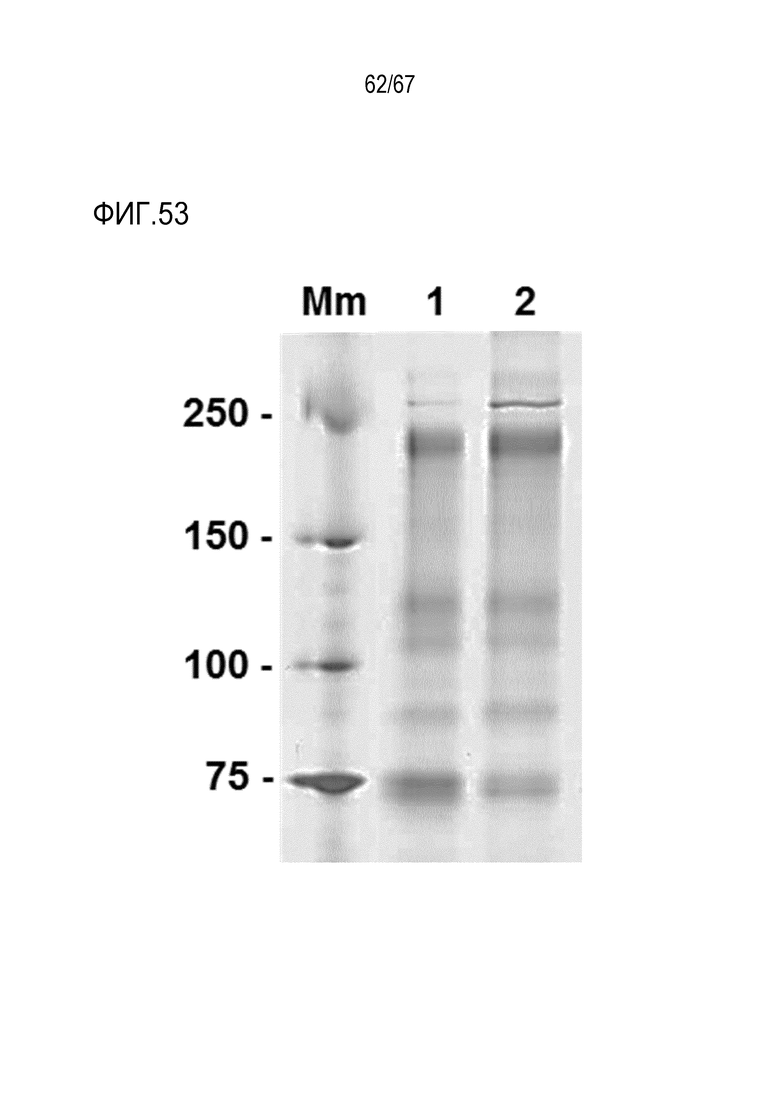
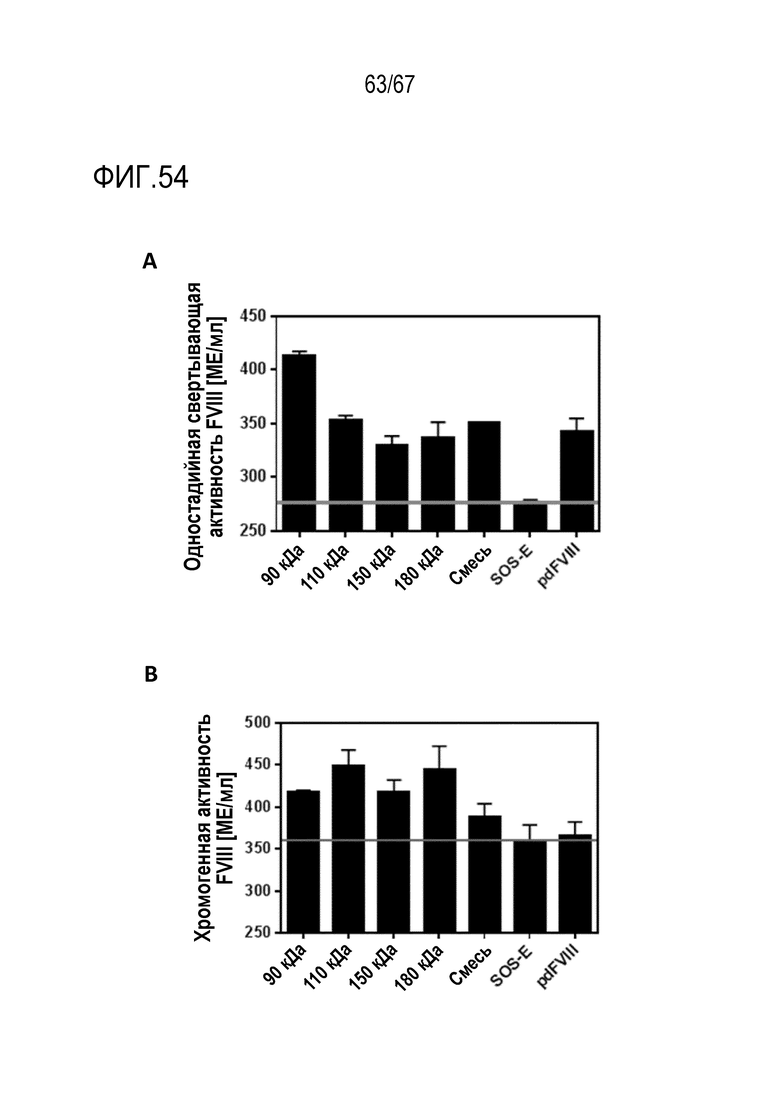
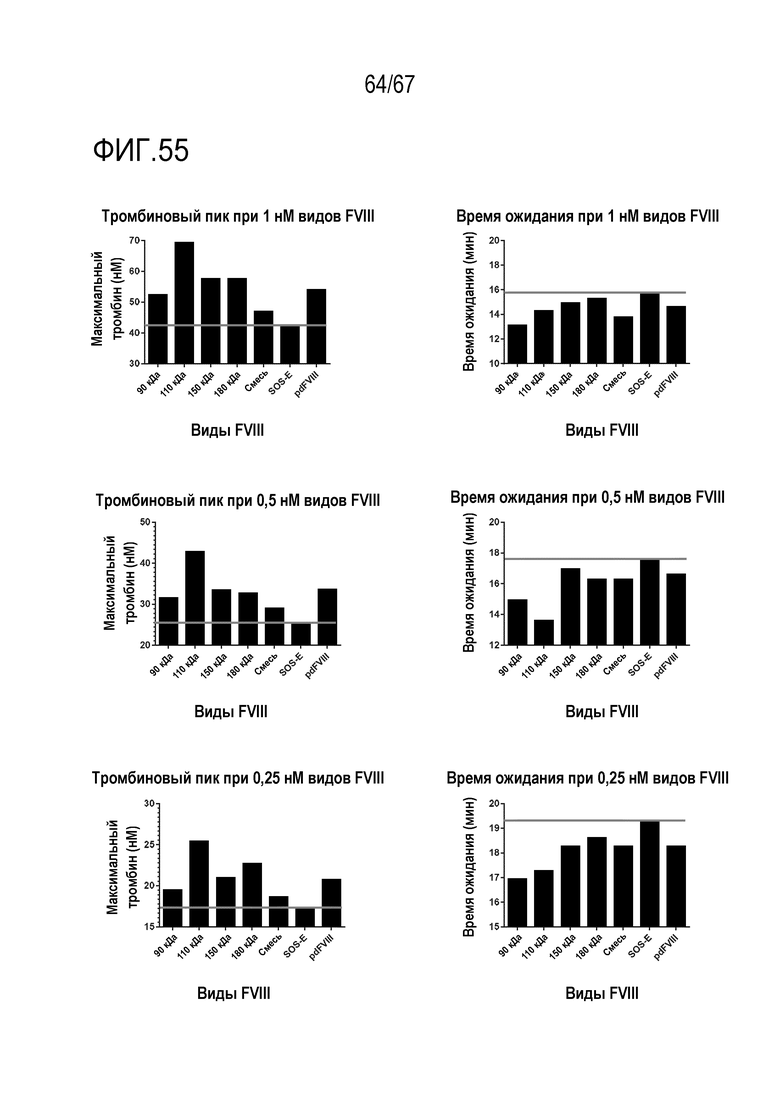

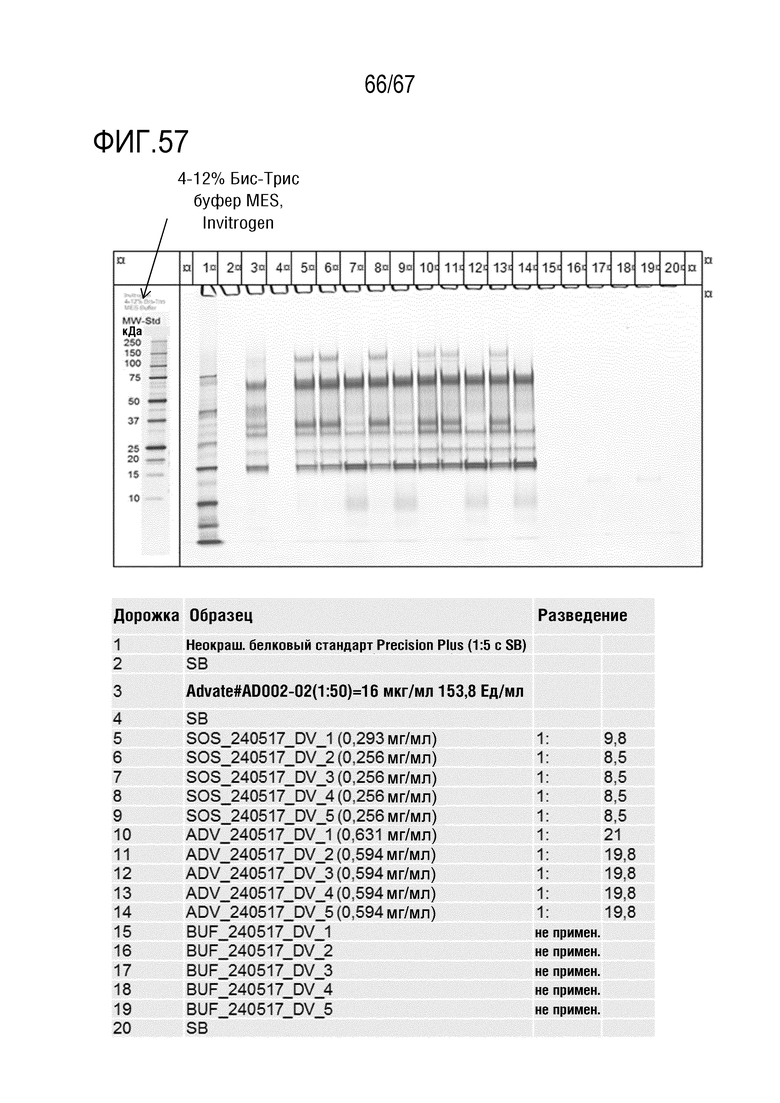

Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ очистки подвида Фактора VIII (FVIII) (варианты), где подвид FVIII определен как единственная тяжелая цепь FVIII, которая связана с единственной легкой цепью FVIII. В одном из вариантов способ включает стадии: (1) проведение анионообменной хроматографии с композицией, содержащей несколько подвидов FVIII, и сбор фракции элюата, содержащей указанный очищаемый подвид FVIII, (2) проведение эксклюзионной хроматографии фракции элюата, полученной на стадии (1), содержащей указанные подвиды FVIII, и сбор элюата, содержащего указанный очищаемый подвид FVIII; и (3) концентрирование фракции элюата, полученной на стадии (2), содержащей указанный очищаемый подвид FVIII. Изобретение расширяет арсенал способов очистки подвида FVIII. 3 н. и 9 з.п. ф-лы, 58 ил., 29 табл., 29 пр.
1. Способ очистки подвида Фактора VIII (FVIII) из композиции, содержащей несколько подвидов FVIII,
где подвид FVIII определен как единственная тяжелая цепь FVIII, которая связана с единственной легкой цепью FVIII,
где указанный способ включает стадии:
(1) проведение анионообменной хроматографии с композицией, содержащей несколько подвидов FVIII, и сбор фракции элюата, содержащей указанный очищаемый подвид FVIII,
где элюирование осуществляют посредством элюирования в линейном градиенте, и
где градиент элюирования в линейном градиенте имеет длину по меньшей мере приблизительно 16 объемов колонки,
(2) проведение эксклюзионной хроматографии фракции элюата, полученной на стадии (1), содержащей указанные подвиды FVIII, и сбор элюата, содержащего указанный очищаемый подвид FVIII; и
(3) концентрирование фракции элюата, полученной на стадии (2), содержащей указанный очищаемый подвид FVIII;
посредством чего массовое отношение указанного очищаемого подвида FVIII и всех других подвидов FVIII в композиции повышается,
где указанные другие подвиды FVIII содержат тяжелую цепь FVIII и/или легкую цепь FVIII, которые отличаются от тяжелой цепи и/или легкой цепи указанного очищаемого подвида FVIII.
2. Способ по п.1, где стадия концентрирования (3) является стадией проведения анионообменной хроматографии фракции элюата, полученной на стадии (2), содержащей указанный очищаемый подвид FVIII, и сбором фракции элюата, содержащей указанный очищаемый подвид FVIII.
3. Способ по п.2, где на стадии (3) для анионообменной хроматографии используют смолу Source Q.
4. Способ по любому из пп.1-3, где подвиды FVIII представляют собой подвиды рекомбинантного FVIII (rFVIII).
5. Способ по любому из пп.1-4, где очищаемый подвид FVIII представляет собой тяжелую цепь FVIII с 180 кДа, связанную с легкой цепью FVIII, или тяжелую цепь FVIII с 150 кДа, связанную с легкой цепью FVIII, или тяжелую цепь FVIII с 110 кДа, связанную с легкой цепью FVIII, или тяжелую цепь FVIII с 90 кДа, связанную с легкой цепью FVIII.
6. Способ по любому из пп.1-5, где на стадии (1) для анионообменной хроматографии используют Q-смолу высокого разрешения с размером частиц менее 20 мкм.
7. Способ по любому из пп.1-6, где на стадии (2) для эксклюзионной хроматографии используют смолу для эксклюзионной хроматографии с диапазоном разрешения от 10000 Да до 60000 Да.
8. Способ по любому из пп.1-7, где способ дополнительно включает перед стадией (1) стадию (0) которая представляет собой:
(0) обработку протеазой фурином нескольких подвидов FVIII, содержащихся в композиции.
9. Способ по п.8, где легкая цепь FVIII представляет собой легкую цепь FVIII с 80 кДа.
10. Способ по любому из пп.1-9, где на стадии (1) градиент элюирования в линейном градиенте имеет длину по меньшей мере приблизительно 24 объема колонки или по меньшей мере приблизительно 32 объема колонки.
11. Способ очистки подвида Фактора VIII (FVIII) из композиции, содержащей несколько подвидов FVIII,
где подвид FVIII определен как единственная тяжелая цепь FVIII, которая связана с единственной легкой цепью FVIII,
где указанный способ включает стадии:
(1) проведение анионообменной хроматографии с композицией, содержащей несколько подвидов FVIII, и сбор фракции элюата, содержащей указанный очищаемый подвид FVIII,
где элюирование осуществляют посредством элюирования в линейном градиенте, и
где градиент элюирования в линейном градиенте имеет длину по меньшей мере приблизительно 16 объемов колонки,
(2) проведение хроматографии гидрофобных взаимодействий с фракцией элюата, полученной на стадии (1), содержащей указанный очищаемый подвид FVIII, и сбор фракции элюата, содержащей указанный очищаемый подвид FVII,
где хроматография гидрофобных взаимодействий является отрицательной хроматографией; и
(3) концентрирование фракции элюата, полученной на стадии (2), содержащей указанный очищаемый подвид FVIII;
посредством чего массовое отношение указанного очищаемого подвида FVIII и всех других подвидов FVIII в композиции повышается,
где указанные другие подвиды FVIII содержат тяжелую цепь FVIII и/или легкую цепь FVIII, которые отличаются от тяжелой цепи и/или легкой цепи указанного очищаемого подвида FVIII.
12. Способ очистки подвида Фактора VIII (FVIII) из композиции, содержащей несколько подвидов FVIII,
где подвид FVIII определен как единственная тяжелая цепь FVIII, которая связана с единственной легкой цепью FVIII,
где указанный способ включает стадии:
(1) проведение анионообменной хроматографии с композицией, содержащей несколько подвидов FVIII, и сбор фракции элюата, содержащей указанный очищаемый подвид FVIII,
где элюирование осуществляют посредством элюирования в линейном градиенте, и
где градиент элюирования в линейном градиенте имеет длину по меньшей мере приблизительно 16 объемов колонки; и
(2) концентрирование фракции элюата, полученной на стадии (1), содержащей указанный очищаемый подвид FVIII;
посредством чего массовое отношение указанного очищаемого подвида FVIII и всех других подвидов FVIII в композиции повышается,
где указанный очищаемый подвид FVIII представляет собой тяжелую цепь FVIII с массой 90 кДа, которая связана с легкой цепью FVIII, и
где указанные другие подвиды FVIII содержат тяжелую цепь FVIII и/или легкую цепь FVIII, которые отличаются от тяжелой цепи и/или легкой цепи указанного очищаемого подвида FVIII.
| Выделение и очистка белков | |||
| Методическое пособие по курсу "Химия и биохимия белков и ферментов" | |||
| В.В | |||
| Сова, М.И | |||
| Кусайкин | |||
| - Владивосток: Изд-во Дальневост | |||
| Ун-та, 2006 | |||
| Хроматографические методы очистки белков | |||
| Учебно-методическое пособие | |||
| Ибрагимов А.Н., и др | |||
| Казань: ФГАОУ ВПО КФУ, 2013 | |||
| СПОСОБ ОЧИСТКИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ VIII | 2009 |
|
RU2567811C2 |
| ТАРЕЛЬЧАТАЯ ПЕРЕГОННАЯ ИЛИ РЕКТИФИКАЦИОННАЯ КОЛОННА | 1939 |
|
SU62456A1 |
| US | |||
Авторы
Даты
2023-07-21—Публикация
2018-06-22—Подача