ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет и преимущество предварительной заявки на патент США №63/065012, поданной 13 августа 2020 г., содержание которой включено в настоящий документ посредством ссылки во всей своей полноте. Данная заявка испрашивает приоритет и преимущество по предварительной заявке на патент США №62/944635, поданной 6 декабря 2019 г.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и полностью включен в данный документ посредством ссылки. Указанная копия ASCII, созданная 26 августа 2021 г., называется 070816-02409_SL.txt и имеет размер 148919 байт.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в общем относится к композициям против VEGF и способам их получения.
УРОВЕНЬ ТЕХНИКИ
Биофармацевтические композиции на основе белка стали важными продуктами для исследований, лечения офтальмологических заболеваний, рака, аутоиммунного заболевания и инфекции, а также других заболеваний и расстройств. Биофармацевтические препараты представляют собой один из наиболее быстро растущих сегментов производства фармацевтической промышленности.
Был идентифицирован класс димерных митогенов, происходящих из клеток, с селективностью в отношении эндотелиальных клеток сосудов, и он был обозначен как фактор роста эндотелиальных клеток сосудов (VEGF).
Устойчивый ангиогенез может вызывать или обострять определенные заболевания, такие как псориаз, ревматоидный артрит, гемангиомы, ангиофибромы, диабетическая ретинопатия и неоваскулярная глаукома. Ингибитор активности VEGF может быть полезен в качестве лечения таких заболеваний и другого VEGF-индуцированного патологического ангиогенеза и состояний проницаемости сосудов, таких как васкуляризация опухоли. Ангиопоэтины и члены семейства факторов роста эндотелия сосудов (VEGF) являются единственными факторами роста, которые, как считается, в значительной степени специфичны для эндотелиальных клеток сосудов.
Некоторые заболевания глаз связаны с патологическим ангиогенезом. Например, развитие возрастной макулярной дистрофии (AMD) связано с процессом, называемым хориоидальной неоваскуляризацией (CNV). Утечка из CNV вызывает отек желтого пятна и скопление жидкости под желтым пятном, что приводит к потере зрения. Диабетический макулярный отек (DME) представляет собой еще одно заболевание глаз с ангиогенным компонентом. DME является наиболее частой причиной умеренной потери зрения у пациентов с диабетом и частым осложнением диабетической ретинопатии, заболеванием, поражающим кровеносные сосуды сетчатки. Клинически значимый DME возникает, если жидкость просачивается в центр желтого пятна, светочувствительной части сетчатки, отвечающей за острое и прямое зрение. Жидкость в желтом пятне может вызвать серьезную потерю зрения или слепоту.
Различные ингибиторы VEGF, такие как ловушка для VEGF EYLEA((Айлия) (афлиберцепт), были одобрены для лечения таких заболеваний глаз.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к белкам против VEGF, включая белок-ловушку для VEGF афлиберцепт, который представляет собой слитый белок. Настоящее изобретение также относится к новому белку против VEGF, афлиберцепт MiniTrap или VEGF MiniTrap (все вместе именуемые MiniTrap, если не указано иное). В данном документе раскрыты способы получения данных белков против VEGF, включая условия получения, которые обеспечивают эффективные и действенные способы получения представляющих интерес белков. В одном аспекте настоящее изобретение направлено на применение химически определенной среды (ХОС) для получения белков против VEGF. В конкретном аспекте представляющие интерес ХОС представляют собой те ХОС, которые при использовании обеспечивают образец белка, в котором образец имеет желто-коричневый цвет и может содержать окисленные формы. Кроме того, в настоящей заявке описаны белковые варианты афлиберцепта и VEGF MiniTrap вместе с сопутствующими способами получения.
Получение афлиберцепта
В настоящем изобретении описано производство афлиберцепта с использованием среды для культивирования клеток. В одном варианте осуществления среда для культивирования клеток представляет собой химически определенную среду («ХОС»). ХОС часто применяют вследствие того, что она представляет собой не содержащую белков химически определенную формулу, не содержащую компонентов животного происхождения, и существует определенность в отношении состава среды. В другом варианте осуществления среда для культивирования клеток представляет собой среду с гидролизатом сои.
В одном варианте осуществления способ получения рекомбинантного белка включает (a) обеспечение клетки-хозяина, генетически сконструированной для экспрессии рекомбинантного белка, представляющего интерес; (b) культивирование клетки-хозяина в ХОС в подходящих условиях, в которых клетка экспрессирует рекомбинантный белок, представляющий интерес; и (c) сбор препарата рекомбинантного белка, представляющего интерес, продуцируемого клеткой. В одном аспекте рекомбинантный белок, представляющий интерес, представляет собой белок против VEGF. В конкретном аспекте белок против VEGF выбран из группы, состоящей из афлиберцепта и рекомбинантного MiniTrap (примеры которых раскрыты в патенте США №7279159), scFv афлиберцепт и другие белки против VEGF. В предпочтительном аспекте рекомбинантный белок, представляющий интерес, представляет собой афлиберцепт.
В одном аспекте настоящего варианта осуществления афлиберцепт экспрессируется в подходящей клетке-хозяине. Неограничивающие примеры таких клеток-хозяев включают без ограничения CHO, CHO K1, EESYR®, NICE®, NS0, Sp2/0, эмбриональные клетки почек и BHK.
Подходящие ХОС включают среду Игла в модификации Дульбекко (DME), питательную смесь Хема, среду Excell и среду IS CHO-CD. Другие ХОС, известные специалистам в данной области, также рассматриваются как входящие в объем настоящего изобретения. В конкретном аспекте подходящая ХОС представляет собой ХОС1B (Regeneron) или усовершенствованную среду Excell (SAFC).
В одном варианте осуществления очищенный от примесей образец сбора из культуры ХОС, содержащий афлиберцепт, подвергают процедуре хроматографии для захвата. В одном аспекте стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, белка A. В следующем аспекте элюат аффинной процедуры имеет определенный цвет, например, элюат может иметь желто-коричневый цвет.В соответствии с более подробным описанием ниже, цвет можно оценивать с использованием (i) европейского эталона цвета «BY», в котором произведен качественный визуальный осмотр, или (ii) колориметрического анализа, CIE L*, a*, b* (или CIELAB), который является более количественным, чем система BY. Тем не менее, в любом случае, оценка цвета между несколькими образцами должна быть нормализована относительно концентрации белка с целью обеспечения информативной оценки. Например, относительно примера 9 ниже, элюат белка A имеет значение «b*» около 2,52, что соответствует значению BY примерно BY5 (при измерении в концентрации белка 5 г/л в элюате белка A). Если цвет элюата белка A следует сравнивать с другим образцом, то сравнение следует выполнять в отношении той же концентрации белка. Значение b* в цветовом пространстве CIELAB применяют для выражения окраски образцов и охватывает диапазон от синего (-) до желтого (+). Более высокое значение b* одного образца по сравнению с другим указывает на более интенсивное желто-коричневое окрашивание в образце по сравнению с другим.
В одном варианте осуществления афлиберцепт получают из клетки-хозяина, генетически сконструированной для экспрессии афлиберцепта с использованием ХОС. В одном аспекте также получают другие виды или варианты афлиберцепта. Данные варианты включают изоформы афлиберцепта, которые содержат один или более окисленных аминокислотных остатков, в общем называемых оксо-варианты. Очищенный от примесей образец сбора, полученный с использованием ХОС, содержащий афлиберцепт, а также его оксо-варианты, можно подвергать процедуре хроматографии для захвата. В одном аспекте стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, колонки с белком A. Если образец, извлеченный из аффинного элюата, который может демонстрировать желто-коричневый цвет или не демонстрировать его, анализируют с использованием, например, жидкостной хроматографии - масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более окисленных вариантов афлиберцепта. Показано, что некоторые аминокислотные остатки модифицированного афлиберцепта окисляются, включая без ограничения остатки гистидина и/или триптофана. В одном аспекте варианты могут включать окисление одного или более остатков метионина, а также других остатки, см. ниже.
В другом аспекте варианты могут включать окисление одного или более остатков триптофана с образованием N-формилкинуренина. В следующем аспекте варианты могут включать окисление одного или более остатков триптофана с образованием моно-гидроксилтриптофана. В конкретном аспекте белковые варианты могут включать окисление одного или более остатков триптофана с образованием ди-гидроксилтриптофана. В конкретном аспекте белковые варианты могут включать окисление одного или более остатков триптофана с образованием три-гидроксилтриптофана.
В другом аспекте варианты могут включать одну или более модификаций, выбранных из группы, состоящей из дезамидирования, например, одного или более аспарагинов; одной или более аспарагиновых кислот, преобразованных в изо-аспартат и/или Asn; окисления одного или более метионинов; окисления одного или более триптофанов в N-формилкинуренине; окисления одного или более триптофанов в моно-гидроксилтриптофане; окисления одного или более триптофанов в ди-гидроксилтриптофане; окисления одного или более триптофанов в три-гидроксилтриптофане; 3-дезоксиглюкозонирования Arg одного или более аргининов; удаление C-концевого глицина; и наличия одного или более не гликозилированных гликозидов.
В другом варианте осуществления настоящее изобретение направлено на способы получения афлиберцепта. В одном аспекте очищенный от примесей образец сбора, содержащий афлиберцепт, и его варианты подвергают стадии захвата, например, аффинной хроматографии с белком A. После стадии аффинности аффинный элюат можно подвергать ионообменной хроматографии. Ионообменная хроматография может представлять собой либо катионо-, либо анионообменную хроматографию. Также предполагается, что в объем настоящего варианта осуществления входит смешанная или мультимодальная хроматография, а также другие хроматографические процедуры, которые дополнительно обсуждаются ниже. В конкретном аспекте ионообменная хроматография представляет собой анионообменную хроматографию (AEX). Подходящие условия для применения AEX включают без ограничения трис-гидрохлорид при pH от около 8,3 до около 8,6. После уравновешивания с использованием, например, трис-гидрохлорида при pH от около 8,3 до около 8,6, в колонку AEX загружают образец. После загрузки колонки ее можно промыть один или более раз, с использованием, например, уравновешивающего буфера. В конкретном аспекте применяемые условия могут обеспечивать дифференциальное хроматографическое поведение афлиберцепта и его окисленных вариантов, так что фракция, содержащая афлиберцепт при отсутствии значительных количеств оксо-вариантов может быть собрана в проточной фракции, тогда как значительная доля оксо-вариантов сохраняются на твердой фазе колонки AEX и может быть получена при очистке колонны - см. пример 2 ниже, фиг. 11. Ссылаясь на фиг. 11 и пример 2, изменения оксо-вариантов можно наблюдать между различными стадиями производства. Например, данное изменение может быть проиллюстрировано данными в разделе «Уровень окисления триптофана (%)», в частности, в колонке «W138(+16)». Может наблюдаться, что оксо-варианты (в частности, оксо-триптофан) проходят от около 0,131% в загрузочном образце до около 0,070% в проточном образце после хроматографии AEX (разделение AEX 2), что указывает на то, что происходит снижение оксо-вариантов афлиберцепта с использованием AEX.
Применение ионного обмена можно применять для уменьшения или сведения к минимуму цвета. В одном аспекте настоящего варианта осуществления очищенный от примесей образец сбора подвергают хроматография для захвата, например, с использованием аффинной хроматографии с белком A. Аффинную колонку элюируют и она имеет первый цвет с присвоенным ему конкретным значением BY и/или b *. Затем данный элюат белка A подвергают ионообменной хроматографии, например, анионообменной хроматографии (AEX). Ионообменную колонку промывают и проточную часть собирают, и она имеет второй цвет с присвоенным ему конкретным значением BY и/или b*. В конкретном аспекте значение цвета (либо «BY», либо «b*») первого цвета отличается от второго цвета. В следующем аспекте первый цвет элюата белка A имеет более желто-коричневый цвет по сравнению со вторым цветом проточной части AEX, что отражено соответствующим значением BY и/или b*. Обычно наблюдается уменьшение желто-коричневого цвета второго цвета после AEX, по сравнению с первым цветом элюата белка A. Например, применение анионного обмена снижало желто-коричневый цвет, наблюдаемый в образце элюата белка A от значения b* около 3,06 (первый цвет) до около 0,96 (второй цвет) после AEX - см. пример 2, таблица 2-3 ниже.
В одном аспекте варианта осуществления pH обоих буферов для уравновешивания и промывки колонки AEX может составлять от около 8,30 до около 8,60. В другом аспекте проводимость обоих из буферов для уравновешивания и промывки для колонки AEX может составлять от около 1,50 до около 3,00 мСм/см.
В одном аспекте варианта осуществления буферы для уравновешивания и промывки могут представлять собой 50 ммоль трис-гидрохлорида. В одном аспекте буфер для очистки содержит 2 моль хлорида натрия или 1 н. гидроксида натрия или обоих (см. таблицу 2-2).
Настоящий вариант осуществления может включать добавление одной или более стадий, без определенного порядка, например, хроматографии с гидрофобным взаимодействием (HIC), аффинной хроматографии, многомодальной хроматографии, вирусной инактивации (например, с использованием низкого pH), вирусной фильтрации и/или ультра-/диафильтрации, а также других хорошо известных хроматографических стадий.
В одном варианте осуществления белок против VEGF гликозилирован на одном или более аспарагинов следующим образом: гликозилирование G0-GlcNAc; гликозилирование G1-GlcNAc; гликозилирование G1S-GlcNAc; гликозилирование G0; гликозилирование G1; гликозилирование G1S; гликозилирование G2; гликозилирование G2S; гликозилирование G2S2; гликозилирование G0F; гликозилирование G2F2S; гликозилирование G2F2S2; гликозилирование G1F; гликозилирование G1FS; гликозилирование G2F; гликозилирование G2FS; гликозилирование G2FS2; гликозилирование G3FS; гликозилирование G3FS3; гликозилирование G0-2GlcNAc; гликозилирование Man4; гликозилирование Man4_A1G1; гликозилирование Man4_A1G1S1; гликозилирование Man5; гликозилирование Man5_A1G1; гликозилирование Man5_A1G1S1; гликозилирование Man6; гликозилирование Man6_G0+фосфат; гликозилирование Man6+фосфат; и/или гликозилирование Man7. В одном аспекте белок против VEGF может представлять собой афлиберцепт, антитело к VEGF или MiniTrap VEGF.
В одном аспекте профиль гликозилирования композиции белка против VEGF является следующим: от около 40% до около 50% общего количества фукозилированных гликанов, от около 30% до около 55% общего количества сиалированных гликанов, от около 6% до около 15% маннозы-5, и от около 60% до около 79% галактозилированных гликанов (см. пример 6). В одном аспекте белок против VEGF имеет гликозилирование Man5 на около 32,4% остатков аспарагина 123 и/или около 27,1% остатков аспарагина 196.
В одном варианте осуществления способ может дополнительно включать составление лекарственного вещества с использованием фармацевтически приемлемого вспомогательного вещества. В одном аспекте варианта осуществления фармацевтически приемлемое вспомогательное вещество может быть выбрано из следующего: вода, буферные средства, сахар, соль, поверхностно-активное вещество, аминокислота, полиол, хелатирующее средство, эмульгатор и консервант.Другие хорошо известные специалисту в данной области вспомогательные вещества находятся в рамках данного варианта осуществления.
В одном аспекте варианта осуществления состав может подходить для введения субъекту-человеку. В частности, введение можно осуществлять посредством интравитреальной инъекции. В одном аспекте состав может иметь от около 40 до около 200 мг/мл белка, представляющего интерес.
Состав можно применять как способ лечения или предупреждения ангиогенных заболеваний глаз, которые могут включать: возрастную макулярную дистрофию (например, влажную или сухую), макулярный отек, макулярный отек после окклюзии вены сетчатки, окклюзию вены сетчатки (RVO), окклюзию центральной вены сетчатки (CRVO), окклюзию вены ветки сетчатки (BRVO), диабетический макулярный отек (DME), хориоидальную неоваскуляризацию (CNV), неоваскуляризацию радужной оболочки, неоваскулярную глаукому, послеоперационный фиброз при глаукоме, пролиферативную витреоретинопатию (PVR), неоваскуляризацию диска зрительного нерва, неоваскуляризацию роговицы, неоваскуляризацию сетчатки, неоваскуляризацию стекловидного тела, паннус, крыловидную плеву, сосудистую ретинопатию, диабетическую ретинопатию у субъекта с диабетическим макулярным отеком; или диабетические ретинопатии (например, непролиферативную диабетическую ретинопатию (например, характеризующуюся уровнем по шкале тяжести диабетической ретинопатии (DRSS) около 47 или 53), или пролиферативную диабетическую ретинопатию; например, у субъекта, не страдающего DME).
Получение MiniTrap VEGF
В настоящем изобретении описано получение модифицированной версии афлиберцепта, причем часть Fc удалена или отсутствует, и она называется афлиберцепт MiniTrap или MiniTrap VEGF. Данная MiniTrap может быть получена в клеточной культуральной среде, включающей среду с химически определенным составом (ХОС) или среду с гидролизатом сои.
В одном варианте осуществления MiniTrap получают с использованием ХОС. В одном аспекте получения MiniTrap полноразмерный афлиберцепт получают с использованием подходящего хозяина и в подходящих условиях и его дополнительно обрабатывают, посредством чего часть Fc ферментативно удаляют с получением таким образом MiniTrap.В качестве альтернативы, ген, кодирующий MiniTrap (например, нуклеотидная последовательность, кодирующая афлиберцепт в отсутствие его части Fc), может быть получен в подходящих условиях с использованием подходящей клетки-хозяина.
В одном варианте осуществления способ производства MiniTrap включает получение полноразмерного слитого белка афлиберцепта с последующим отщеплением области Fc. В одном аспекте способ включает получение рекомбинантного белка, а именно полноразмерного слитого белка афлиберцепта (см. патент США №7279159, полное содержание которого включено в настоящий документ посредством ссылки), включающее (a) обеспечение клетки-хозяина, генетически сконструированной для экспрессии полноразмерного афлиберцепта; (b) культивирование клетки-хозяина в ХОС в подходящих условиях, в которой клетка экспрессирует полноразмерный афлиберцепт; (c) сбор препарата полноразмерного афлиберцепта, произведенного клеткой; и (d) подвергание полноразмерного афлиберцепта ферментативному отщеплению, специфичному для удаления части Fc слитого белка. В другом аспекте нуклеотидная последовательность, кодирующая афлиберцепт в отсутствие его части Fc, экспрессируется из подходящей клетки-хозяина в подходящих условиях, хорошо известных специалисту в данной области (см. патент США №7279159).
В одном аспекте настоящего варианта осуществления афлиберцепт экспрессируется в подходящей клетке-хозяине. Неограничивающие примеры таких клеток-хозяев включают без ограничения CHO, CHO K1, EESYR®, NICE®, NS0, Sp2/0, эмбриональные клетки почек и BHK.
Подходящие ХОС включают среду Игла в модификации Дульбекко (DME), питательную смесь Хема, среду EX-CELL (SAFC) и среду IS CHO-CD (Irvine). Другие ХОС, известные специалистам в данной области, также рассматриваются как входящие в объем настоящего изобретения. В конкретном аспекте подходящая ХОС представляет собой ХОС1B (Regeneron) или среду Excell (SAFC).
В одном аспекте в ходе получения MiniTrap образец, содержащий белок, представляющий интерес (т.е., слитый белок афлиберцепта и/или MiniTrap), вместе с его вариантами (включая оксо-варианты), может демонстрировать определенные цветовые свойства - желто-коричневый цвет.Например, образец элюата со стадии аффинной хроматографии может демонстрировать определенный желто-коричневый цвет, измеренный с использованием системы BY и/или b* (см. примеры 2 и 9 ниже). Иллюстративные источники для «образца» могут включать аффинную хроматографию, например, белок A, элюат; образец может быть получен из проточной фракции процедуры ионообменной хроматографии; он также может быть получен в результате очистки ионообменной колонки - существуют и другие источники в ходе производственного процесса, хорошо известные специалистам в данной области, из которых можно анализировать образец. Как указано выше и дополнительно описано ниже, цвет можно оценивать с использованием (i) европейского эталона цвета «BY», в котором выполняют качественный визуальный осмотр или (ii) колориметрического анализа, CIELAB, который является более количественным, чем система BY. Тем не менее, в любом случае, оценка цвета между несколькими образцами должна быть нормализована, например, с использованием концентрации белка с целью обеспечения информативной оценки между образцами.
В одном аспекте настоящего варианта осуществления полноразмерный слитый белок афлиберцепта можно подвергать ферментативной обработке (“активность отщепления”) с целью образования MiniTrap VEGF, например, с использованием протеолитического расщепление с использованием протеазы или ее ферментативно активного варианта. В одном аспекте данного варианта осуществления протеаза может представлять собой иммуноглобулин-разлагающий фермент пиогенного стрептококка (IdeS). В другом аспекте протеаза может представлять собой тромбин трипсин, эндопротеазу Arg-C, эндопротеазу Asp-N, эндопротеазу Glu-C, протеазу T внешней мембраны (OmpT), IdeS, химотрипсин, пепсин, термолизин, папаин, проназу или протеазу от Aspergillus Saitoi. В одном аспекте протеаза может представлять собой цистеиновую протеазу. В конкретном аспекте варианта осуществления протеаза может представлять собой IdeS. В другом аспекте протеаза может представлять собой вариант IdeS. Неограничивающие примеры вариантов IdeS описаны ниже и включают полипептид, имеющий аминокислотную последовательность, изложенную в группе, состоящей из SEQ ID NO.: 2, SEQ ID NO.: 3, SEQ ID NO.: 4, SEQ ID NO.: 5, SEQ ID NO.: 6, SEQ ID NO.: 7, SEQ ID NO.: 8, SEQ ID NO.: 9, SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12, SEQ ID NO.: 13, SEQ ID NO.: 14, SEQ ID NO.: 15 и SEQ ID NO.: 16. В одном аспекте протеаза может быть иммобилизована на агарозе или другой подходящей матрице.
В одном аспекте белок, представляющий интерес (вместе с его вариантами), получают с использованием ХОС. В конкретном аспекте белок, представляющий интерес, включает афлиберцепт или MiniTrap.Варианты включают один или более окисленных аминокислотных остатков, в общем называемых оксо-вариантами. Примеры окисленных остатков включают без ограничения один или более остатков гистидина, и/или триптофана. Другие окисленные остатки были обнаружены посредством ЖХ-МС и описаны ниже, например, окисленный метионин. Последующую хроматографию, например, AEX, можно применять для выделения данных оксо-вариантов из белка, представляющего интерес, в указанном образце и они описаны в данном документе.
В одном аспекте варианты могут включать окисление одного или более остатков триптофана с образованием N-формилкинуренинов. В следующем аспекте варианты могут включать окисление одного или более остатков триптофана с образованием моно-гидроксилтриптофана. В конкретном аспекте белковые варианты могут включать окисление одного или более остатков триптофана с образованием ди-гидроксилтриптофана. В конкретном аспекте белковые варианты могут включать окисление одного или более остатков триптофана с образованием три-гидроксилтриптофана.
В другом аспекте оксо-варианты могут включать одну или более модификаций, выбранных из группы, состоящей из дезамидирования, например, одного или более остатков аспарагина; одной или более аспарагиновых кислот, преобразованных в изо-аспартат и/или аспарагин; окисления одного или более остатков метионина; окисления одного или более остатков триптофана в N-формилкинуренине; окисления одного или более остатков триптофана в моно-гидроксилтриптофане; окисления одного или более остатков триптофана в ди-гидроксилтриптофане; окисления одного или более остатков триптофана из три-гидроксилтриптофана; 3-дезоксиглюкозонирования Arg одного или более остатков аргинина; удаления C-концевого глицина; и наличия одного или более не гликозилированных гликозидов.
В одном варианте осуществления способ производства белка MiniTrap включает (a) захват полноразмерного слитого белка афлиберцепта на первой хроматографической платформе и (b) отщепление афлиберцепта с образованием таким образом белка MiniTrap, т.е., афлиберцепта в отсутствие домена Fc. В одном аспекте первая хроматографическая подложка содержит среду для аффинной хроматографии, ионообменную среду для хроматографии, или среду для хроматографии с гидрофобным взаимодействием. В конкретном аспекте первая хроматографическая платформа содержит платформу для аффинной хроматографии, например, белок A. В следующем аспекте белок стадии захвата (a) элюируют из первой хроматографической платформы перед стадией отщепления (b). В следующем аспекте вторая стадия захвата следует за стадией отщепления (b). В конкретном аспекте данную вторую стадию захвата можно осуществлять с использованием аффинной хроматографии, такой как аффинная хроматография с белком A. Проточная часть данной второй стадии захвата (содержащая MiniTrap) имеет первый цвет, например, желто-коричневый цвет и измеряется с определенным значением BY и/или b* - см., например, пример 9 ниже. Кроме того, анализ ЖХ-МС данной второй проточной части захвата может демонстрировать наличие оксо-вариантов, причем один или более остатков MiniTrap окислены (см. пример 9 ниже).
В следующем аспекте вторую проточную часть захвата можно подвергать ионообменной хроматографии, например, AEX. Данную колонку AEX можно промывать с использованием подходящего буфера и может быть собрана проточная фракция AEX, содержащая в основном MiniTrap.Данная проточная фракция AEX может иметь второй цвет, который имеет желто-коричневую окраску с определенным значением BY и/или b*. В следующем аспекте первый цвет (проточная фракция из второй стадии захвата) и второй цвет (проточная фракция из ионообменной процедуры) имеют различные цвета, измеренные либо посредством системы BY, либо b*. В одном аспекте второй цвет имеет сниженный желто-коричневый цвет по сравнению с первым цветом с использованием либо значения BY, либо b*, а затем AEX.
В другом варианте осуществления активность отщепления на стадии (b) можно осуществлять с использованием хроматографической колонки, причем активность отщепления, например, ферментативная активность, прикреплена или иммобилизована в матрице колонки. Колонка, применяемая на стадии (b), может содержать одну или более протеаз, упоминавшихся и более подробно описанных ниже.
В одном варианте осуществления процедура ионообменной хроматографии может включать среду для анионообменной (AEX) хроматографии. В другом аспекте среда для ионообменной хроматографии включает среду для катионообменной (CEX) хроматографии. Подходящие условия для применения AEX включают без ограничения трис-гидрохлорид при pH от около 8,3 до около 8,6. После уравновешивания с использованием, например, трис-гидрохлорида при pH от около 8,3 до около 8,6, в колонку AEX загружают образец. После загрузки колонки ее можно промыть один или более раз, с использованием, например, уравновешивающего буфера. В конкретном аспекте применяемые условия могут обеспечивать дифференциальное хроматографическое поведение MiniTrap и его оксо-вариантов с использованием AEX, так что MiniTrap по существу находится в проточной фракции, тогда как оксо-варианты по существу сохраняются на колонке AEX и могут контролироваться посредством очистки колонки (см. пример 9 ниже).
В одном примере образцы из различных этапов получения анализировали в отношении цвета и наличия оксо-вариантов. Относительно примера 9, пул аффинной проточной фракции (проточная фракция из второго этапа аффинности с белком A) имел первое значение b* около 1,58 (см. таблицу 9-3). Данную вторую аффинную проточную фракцию подвергали AEX. Проточная фракция AEX имела второе значение b* около 0,50, что указывает на значительное снижение желто-коричневого цвета после применения AEX. Очистка колонки AEX обеспечивала образец очистки, и наблюдалось третье значение b* около 6,10, что указывает на то, что данный образец очистки имел более желто-коричневый цвет по сравнению либо с загрузкой, либо с проточной фракцией.
Что касается примера 9, также осуществляли анализ оксо-варианта. Анализированные образцы представляли собой пул аффинной проточной фракции (второй элюат аффинности с белком A), проточная фракция AEX и очистка AEX. Относительно таблицы 9-5 и таблицы 9-6, изменения оксо-вариантов могут наблюдаться между различными стадиями получения. Например, данное изменение может быть проиллюстрировано данными в разделе «Уровень окисления триптофана (%)», в частности, в колонке «W58(+16)». Может наблюдаться, что оксо-варианты (в частности, оксо-триптофан) проходят от около 0,055% в загрузочном образце до около 0,038% в проточном образце после хроматографии AEX, что указывает на то, что происходит снижение оксо-вариантов после AEX. Очистку AEX проанализировали, и было обнаружено, что процент оксо-триптофана составляет около 0,089%. Если значение данной полосы сравнивали с нагрузкой (а также проточной фракцией), оказалось, что значительная часть данного оксо-варианта оставалась на колонке AEX.
Настоящее изобретение может включать добавление одной или более стадий, без определенного порядка, например, хроматографии с гидрофобным взаимодействием, аффинной хроматографии, многомодальной хроматографии, вирусной инактивации (например, с использованием низкого pH), вирусной фильтрации, и/или ультра/диафильтрации.
Один вариант осуществления настоящего изобретения направлен на способ регенерации хроматографической колонки, содержащей смолу. В одном аспекте варианта осуществления смола имеет иммобилизованное гидролизующее средство. В другом аспекте варианта осуществления смола содержит иммобилизованный фермент протеазу. В другом аспекте варианта осуществления смола представляет собой смолу FabRICATOR(или мутант смолы. В одном аспекте варианта осуществления способ регенерации колонки, содержащей смолу, включает реакционную эффективность смолы.
В одном аспекте варианта осуществления способ регенерации колонки, содержащей смолу, включает инкубацию смолы в колонке с уксусной кислотой. В одном аспекте концентрация применяемой уксусной кислоты составляет от около 0,1 моль до около 2 моль. В одном аспекте концентрация уксусной кислоты составляет около 0,5 моль. В одном аспекте смолу инкубируют в течение по меньшей мере около 10 мин. В другом аспекте смолу инкубируют в течение по меньшей мере около 30 мин. В другом аспекте настоящего варианта осуществления смолу инкубируют в течение по меньшей мере около 50 мин. В другом аспекте настоящего варианта осуществления смолу инкубируют в течение по меньшей мере около 100 мин. В другом аспекте настоящего варианта осуществления смолу инкубируют в течение по меньшей мере около 200 мин. В другом аспекте настоящего варианта осуществления смолу инкубируют в течение по меньшей мере около 300 мин.
Необязательно, смолу в колонке дополнительно инкубируют с гидрохлоридом гуанидина (Gu-HCl). В одном аспекте Gu-HCl без уксусной кислоты применяют для регенерации смолы в колонке. Концентрация применяемого Gu-HCl составляет от около 1 н. до около 10 н. В другом аспекте концентрация Gu-HCl составляет около 6 н. В следующем аспекте смолу в колонке можно инкубировать в течение по меньшей мере около 10 мин с регенерирующими средствами (уксусная кислота, Gu-HCl). В другом аспекте смолу инкубируют в течение по меньшей мере около 30 мин. В другом аспекте смолу инкубируют в течение по меньшей мере около 50 мин. В другом аспекте указанную смолу инкубируют в течение по меньшей мере около 100 мин.
В одном варианте осуществления колонку, содержащую смолу, хранят в этаноле. В одном аспекте колонку хранят в этаноле, причем процентное содержание этанола составляет от около 5% об./об. до около 20% об./об. В конкретном аспекте колонку хранят с использованием 20% об./об. этанола.
В одном варианте осуществления способ может дополнительно включать составление MiniTrap VEGF с использованием фармацевтически приемлемого вспомогательного вещества. В одном аспекте фармацевтически приемлемое вспомогательное вещество может быть выбрано из следующего: вода, буферные средства, сахар, соль, поверхностно-активное вещество, аминокислота, полиол, хелатирующее средство, эмульгатор и консервант.Другие хорошо известные специалисту в данной области вспомогательные вещества находятся в рамках данного варианта осуществления.
Состав по настоящему изобретению подходит для введения субъекту-человеку. В одном аспекте настоящего варианта осуществления введение можно осуществлять посредством интравитреальной инъекции. В одном аспекте состав может иметь от около 40 до около 200 мг/мл белка, представляющего интерес.В конкретном аспекте белок, представляющий интерес, представляет собой либо афлиберцепт, либо афлиберцепт MiniTrap.
Состав можно применять в способе лечения или предупреждения ангиогенных заболеваний глаз, которые могут включать: возрастную макулярную дистрофию (например, влажную или сухую), макулярный отек, макулярный отек после окклюзии вены сетчатки, окклюзию вены сетчатки (RVO), окклюзию центральной вены сетчатки (CRVO), окклюзию вены ветки сетчатки (BRVO), диабетический макулярный отек (DME), хориоидальную неоваскуляризацию (CNV), неоваскуляризацию радужной оболочки, неоваскулярную глаукому, послеоперационный фиброз при глаукоме, пролиферативную витреоретинопатию (PVR), неоваскуляризацию диска зрительного нерва, неоваскуляризацию роговицы, неоваскуляризацию сетчатки, неоваскуляризацию стекловидного тела, паннус, крыловидную плеву, сосудистую ретинопатию, диабетическую ретинопатию у субъекта с диабетическим макулярным отеком; или диабетические ретинопатии (например, непролиферативную диабетическую ретинопатию (например, характеризующуюся уровнем по шкале тяжести диабетической ретинопатии (DRSS) около 47 или 53), или пролиферативную диабетическую ретинопатию; например, у субъекта, не страдающего DME).
В настоящем раскрытии описано применение IdeS (FabRICATOR) (SEQ ID NO.: 1) или других полипептидов, которые представляют собой варианты IdeS (SEQ ID NO.: 2-16) для получения MiniTrap VEGF. IdeS (SEQ ID NO.: 1) содержит остатки аспарагина в положении 87, 130, 182 и/или 274 (показано как «N*» жирным шрифтом и курсивом в SEQ ID NO.: 1 ниже). Аспарагин в данных положениях может быть мутированным до аминокислоты, отличной от аспарагина, с образованием вариантов IdeS (и мутированная(-ые) аминокислота(-ы) показаны курсивом и подчеркнуты):
SEQ ID NO.: 1
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFN*GKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFN*GEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFIN*GYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSN*GNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 2
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFDGKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFN*GEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFIN*GYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSN*GNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 3
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFN*GKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFRGEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFIN*GYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSN*GNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 4
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFN*GKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFN*GEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFILGYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSN*GNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 5
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFN*GKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFN*GEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFIN*GYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSDGNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 6
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFDGKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFRGEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFIN*GYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSN*GNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 7
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFDGKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFN*GEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFILGYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSN*GNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 8
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFDGKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFN*GEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFIN*GYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSDGNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 9
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFN*GKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFRGEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFILGYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSN*GNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 10
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFN*GKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFRGEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFIN*GYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSDGNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 11
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFN*GKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFN*GEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFILGYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSDGNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 12
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFDGKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFRGEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFILGYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSN*GNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 13
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFDGKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFRGEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFIN*GYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSDGNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 14
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFDGKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFN*GEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFILGYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSDGNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 15
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFN*GKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFRGEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFILGYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSDGNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
SEQ ID NO.: 16
MRKRCYSTSAAVLAAVTLFVLSVDRGVIADSFSANQEIRYSEVTPYHVTSVWTKGVTPPANFTQGEDVFHAPYVANQGWYDITKTFDGKDDLLCGAATAGNMLHWWFDQNKDQIKRYLEEHPEKQKINFRGEQMFDVKEAIDTKNHQLDSKLFEYFKEKAFPYLSTKHLGVFPDHVIDMFILGYRLSLTNHGPTPVKEGSKDPRGGIFDAVFTRGDQSKLLTSRHDFKEKNLKEISDLIKKELTEGKALGLSHTYANVRINHVINLWGADFDSDGNLKAIYVTDSDSNASIGMKKYFVGVNSAGKVAISAKEIKEDNIGAQVLGLFTLSTGQDSWNQTN
В одном варианте осуществления полипептид имеет выделенную аминокислотную последовательность, которая по меньшей мере на 70% идентична по всей длине выделенной аминокислотной последовательности, приведенной в группе, состоящей из SEQ ID NO.: 2, SEQ ID NO.: 3, SEQ ID NO.: 4, SEQ ID NO.: 5, SEQ ID NO.: 6, SEQ ID NO.: 7, SEQ ID NO.: 8, SEQ ID NO.: 9, SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12, SEQ ID NO.: 13, SEQ ID NO.: 14, SEQ ID NO.: 15 и SEQ ID NO.: 16. В одном аспекте выделенная аминокислотная последовательность по меньшей мере около на 80% идентична по всей длине выделенной аминокислотной последовательности. В другом аспекте выделенная аминокислотная последовательность по меньшей мере около на 90% идентична по всей длине выделенной аминокислотной последовательности. В другом аспекте выделенная аминокислотная последовательность по меньшей мере около на 100% идентична по всей длине выделенной аминокислотной последовательности. В одном аспекте полипептид может быть способен расщеплять целевой белок на фрагменты. В конкретном аспекте целевой белок представляет собой IgG. В другом аспекте целевой белок представляет собой слитый белок. В другом аспекте фрагменты могут содержать фрагмент Fab и/или фрагмент Fc.
Настоящее изобретение также включает выделенную молекулу нуклеиновой кислоты, кодирующую полипептид, имеющий выделенную аминокислотную последовательность по меньшей мере на 70% идентичную по всей длине выделенной аминокислотной последовательности, приведенной в группе, состоящей из SEQ ID NO.: 2, SEQ ID NO.: 3, SEQ ID NO.: 4, SEQ ID NO.: 5, SEQ ID NO.: 6, SEQ ID NO.: 7, SEQ ID NO.: 8, SEQ ID NO.: 9, SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12, SEQ ID NO.: 13, SEQ ID NO.: 14, SEQ ID NO.: 15 и SEQ ID NO.: 16. В одном аспекте выделенная аминокислотная последовательность по меньшей мере около на 80% идентична по всей длине выделенной аминокислотной последовательности. В другом аспекте выделенная аминокислотная последовательность по меньшей мере около на 90% идентична по всей длине выделенной аминокислотной последовательности. В другом аспекте выделенная аминокислотная последовательность по меньшей мере около на 100% идентична по всей длине выделенной аминокислотной последовательности. В одном аспекте полипептид может быть способен расщеплять целевой белок на фрагменты. В конкретном аспекте целевой белок представляет собой IgG. В другом конкретном аспекте целевой белок представляет собой слитый белок. В другом конкретном аспекте фрагменты могут содержать фрагмент Fab и/или фрагмент Fc.
Настоящее раскрытие также включает вектор, который содержит нуклеиновую кислоту, кодирующую полипептид, имеющий выделенную аминокислотную последовательность, по меньшей мере на 70% идентичную по всей длине выделенной аминокислотной последовательности, приведенной в группе, состоящей из SEQ ID NO.: 2, SEQ ID NO.: 3, SEQ ID NO.: 4, SEQ ID NO.: 5, SEQ ID NO.: 6, SEQ ID NO.: 7, SEQ ID NO.: 8, SEQ ID NO.: 9, SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12, SEQ ID NO.: 13, SEQ ID NO.: 14, SEQ ID NO.: 15 и SEQ ID NO.: 16. В одном аспекте молекула нуклеиновой кислоты функционально связана с последовательностью для контроля экспрессии, способной управлять ее экспрессией в клетке-хозяине. В одном аспекте вектор может представлять собой плазмиду. В одном аспекте выделенная аминокислотная последовательность по меньшей мере около на 80% идентична по всей длине выделенной аминокислотной последовательности. В другом аспекте выделенная аминокислотная последовательность по меньшей мере около на 90% идентична по всей длине выделенной аминокислотной последовательности. В другом аспекте выделенная аминокислотная последовательность по меньшей мере около на 100% идентична по всей длине выделенной аминокислотной последовательности. В одном аспекте полипептид может быть способен расщеплять целевой белок на фрагменты. В конкретном аспекте целевой белок представляет собой IgG. В другом аспекте целевой белок представляет собой слитый белок. В другом аспекте фрагменты могут содержать фрагмент Fab и/или фрагмент Fc.
В одном варианте осуществления выделенная аминокислота может содержать исходную аминокислотную последовательность, определенную в SEQ ID NO.: 1, с остатком аспарагина в положении 87, 130, 182 и/или 274, мутированным до аминокислоты, отличной от аспарагина. В одном аспекте мутация может обеспечить повышенную химическую стабильность при щелочных значениях pH по сравнению с исходной аминокислотной последовательностью. В другом аспекте мутация может обеспечивать повышение химической стабильности на 50% при щелочных значениях pH по сравнению с исходной аминокислотной последовательностью. В одном аспекте аминокислота может быть выбрана из аспарагиновой кислоты, лейцина и аргинина. В конкретном аспекте остаток аспарагина в положении 87 мутирован до остатка аспарагиновой кислоты. В другом аспекте остаток аспарагина в положении 130 мутирован до остатка аргинина. В другом аспекте остаток аспарагина в положении 182 мутирован до остатка лейцина. В другом аспекте остаток аспарагина в положении 274 мутирован до остатка аспарагиновой кислоты. В другом аспекте остатки аспарагина в положениях 87 и 130 мутированы. В другом аспекте остатки аспарагина в положениях 87 и 182 мутированы. В другом аспекте остатки аспарагина в положениях 87 и 274 мутированы. В другом аспекте остатки аспарагина в положениях 130 и 182 мутированы. В другом аспекте остатки аспарагина в положениях 130 и 274 мутированы. В другом аспекте остатки аспарагина в положениях 182 и 274 мутированы. В другом аспекте остатки аспарагина в положениях 87, 130 и 182 мутированы. В другом аспекте остатки аспарагина в положениях 87, 182 и 274 мутированы. В другом аспекте остатки аспарагина в положениях 130, 182 и 274 мутированы. В другом аспекте остатки аспарагина в положениях 87, 130, 182 и 274 мутированы.
В родственном варианте осуществления настоящее изобретение включает молекулу выделенной нуклеиновой кислоты, кодирующей полипептид с выделенной аминокислотной последовательностью, содержащей исходную аминокислотную последовательность, определенную в SEQ ID NO.: 1 с остатком аспарагина в положении 87, 130, 182 и/или 274, мутированным до аминокислоты, отличной от аспарагина - см. выше. Мутация может обеспечивать повышенную химическую стабильность при щелочных значениях pH по сравнению с исходной аминокислотной последовательностью.
В следующем родственном варианте осуществления настоящее изобретение включает вектор, который содержит молекулу нуклеиновой кислоты, кодирующую полипептид с выделенной аминокислотной последовательностью, содержащей исходную аминокислотную последовательность, определенную в SEQ ID NO.: 1 с остатком аспарагина в положении 87, 130, 182 и/или 274, мутированным до аминокислоты, отличной от аспарагина - см. выше. Мутация может обеспечивать повышенную химическую стабильность при щелочных значениях pH по сравнению с исходной аминокислотной последовательностью. В одном аспекте молекула нуклеиновой кислоты функционально связана с последовательностью для контроля экспрессии, способной управлять ее экспрессией в клетке-хозяине. В одном аспекте вектор может представлять собой плазмиду.
Получение на основе аффинности
В настоящем изобретении также представлены способы снижения белков клетки-хозяина, а также других нежелательных белков и нуклеиновых кислот в ходе получения белка против VEGF с использованием аффинной хроматографии.
В одном варианте осуществления способ получения рекомбинантного белка включает (a) обеспечение клетки-хозяина, генетически сконструированной для экспрессии рекомбинантного белка, представляющего интерес; (b) культивирование клетки-хозяина в подходящих условиях, в которых клетка экспрессирует рекомбинантный белок, представляющий интерес; и (c) сбор препарата рекомбинантного белка, представляющего интерес, продуцируемого клеткой. В одном аспекте рекомбинантный белок, представляющий интерес, представляет собой белок против VEGF. В конкретном аспекте белок против VEGF выбран из группы, состоящей из афлиберцепта, MiniTrap, рекомбинантного MiniTrap (пример которых раскрыт в патенте США №7279159), scFv и других белков против VEGF.
В одном аспекте настоящего варианта осуществления рекомбинантный белок, представляющий интерес, экспрессируется в подходящей клетке-хозяине. Неограничивающие примеры подходящих клеток-хозяев включают без ограничения CHO, CHO K1, EESYR®, NICE®, NS0, Sp2/0, эмбриональные клетки почек и BHK.
В одном аспекте настоящего варианта осуществления рекомбинантный белок, представляющий интерес, культивируют в ХОС.Подходящий ХОС включает среду Игла в модификации Дульбекко (DME), питательную смесь Хема, среду Excell, среду IS CHO-CD и ХОС1B. Другие ХОС, известные специалистам в данной области, также рассматриваются как входящие в объем настоящего изобретения.
Препарат для получения может содержать по меньшей мере одну примесь, включая один или более белков клетки-хозяина в дополнение к рекомбинантному белку, представляющему интерес.По меньшей мере одна примесь может быть образована из клеточного субстрата, клеточной культуры или дальнейших процессов.
В одном варианте осуществления настоящее изобретение направлено на способы получения белка против VEGF из биологического образца с использованием аффинной хроматографии. В конкретном аспекте способы, раскрытые в данном документе, можно применять для отделения, по меньшей мере частичного, белка против VEGF от одного или более белков клетки-хозяина и нуклеиновых кислот (например, ДНК), образованного в ходе способа получения культуры белка против VEGF.
В одном аспекте способ может включать подвергание биологического образца, содержащего белок против VEGF, вместе с сопутствующими примесями, аффинной хроматографии в подходящих условиях. В конкретном аспекте аффинная хроматография может включать материал, способный селективно или специфически связываться с белком против VEGF («захват»). Неограничивающие примеры такого хроматографического материала включают белок A, белок G, хроматографический материал, содержащий, например, белок, способный связываться с белком против VEGF, и хроматографический материал, содержащий Fc-связывающий белок. В конкретном аспекте белок, способный связываться или взаимодействовать с белком против VEGF, может представлять собой антитело, слитый белок или его фрагмент.Неограничивающие примеры такого материала, способного селективно или специфически связываться с белком против VEGF, описаны в примере 7.
В одном аспекте настоящего варианта осуществления способ может включать подвергание биологического образца, содержащего белок против VEGF и один или более белков клетки-хозяина/примесей, аффинной хроматографии в подходящих условиях, причем стационарная фаза аффинной хроматографии содержит белок, способный селективно или специфически связываться с белком против VEGF. В конкретном аспекте белок может представлять собой антитело, слитый белок, scFv или фрагмент антитела. В конкретном аспекте белок может представлять собой формы VEGF165, VEGF121 или VEGF других видов, таких как кролик. Например, как проиллюстрировано в таблице 7-1 и таблице 7-10, применение VEGF165 в качестве белка, способного селективно или специфически связываться или взаимодействовать с белком против VEGF, обеспечивает успешное получение MT5 (белка против VEGF), афлиберцепта и фрагмента scFv против VEGF. В другом конкретном аспекте белок может представлять собой один или более белков с аминокислотной последовательностью, показанной в SEQ ID NO.: 73-80. В таблице 7-1 также раскрыто успешное получение MT5 с использованием белков с аминокислотными последовательностями, показанными в SEQ ID NO.: 73-80, в качестве белка, способного селективно или специфически связываться с белком против VEGF (MT5).
В одном аспекте настоящего варианта осуществления способ может включать подвергание биологического образца, содержащего белок против VEGF и один или более белков/примесей клетки-хозяина, аффинной хроматографии в подходящих условиях, причем стационарная фаза аффинной хроматографии содержит белок, способный селективно или специфически связываться или взаимодействовать с белком против VEGF, причем белок против VEGF может быть выбран из афлиберцепта, MiniTrap VEGF или антитела против VEGF. В конкретном аспекте MiniTrap VEGF может быть получен, кроме того, из компонентов рецептора VEGF, он может быть образован посредством рекомбинантной экспрессии MiniTrap VEGF в клетке-хозяине. Осуществление способа может снижать количество одного или более белков клетки-хозяина в образце. Например, на фиг. 35A и фиг. 35B показано значительное снижение общего содержания белков клетки-хозяина в образце, содержащем MT5 (белок против VEGF) при использовании пяти различных колонок для аффинной хроматографии, содержащих (i) VEGF165 (SEQ ID NO.: 72); (ii) mAb1 (человеческий IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 73 представляет собой тяжелую цепь и SEQ ID NO.: 74 представляет собой легкую цепь); (iii) mAb2 (человеческий IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 75 представляет собой тяжелую цепь и SEQ ID NO.: 76 представляет собой легкую цепь); (iv) mAb3 (мышиный IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 77 представляет собой тяжелую цепь и SEQ ID NO.: 78 представляет собой легкую цепь) и (v) mAb4 (мышиный IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 79 представляет собой тяжелую цепь и SEQ ID NO.: 80 представляет собой легкую цепь), поскольку различные белки способны селективно или специфически связываться с MT5. Как видно на фиг. 35A и фиг. 35B, элюаты из каждого из способов получения на основе аффинности снижали количество беков клетки-хозяина от более 7000 ч./млн до около 25 ч./млн, и до около 55 ч./млн, соответственно.
Подходящие условия применения аффинной хроматографии могут включать без ограничения уравновешивание колонки для аффинной хроматографии с использованием буфера для уравновешивания. После уравновешивания с использованием, например, трис-гидрохлорида при pH от около 8,3 до около 8,6, в колонку для аффинной хроматографии загружают биологический образец. После загрузки колонки колонку можно промыть один или несколько раз, с использованием, например, буфера для уравновешивания, такого как фосфатно-солевой буфер Дульбекко (DPBS). Другие промывки, в том числе промывки с использованием различных буферов, можно применять перед элюированием колонки. Элюирование колонки может зависеть от типа буфера, pH и проводимости. Могут применяться другие условия элюирования, хорошо известные специалисту в данной области. После элюирования с использованием одного или более типов элюирующих буферов, например, глицина при pH от около 2,0 до около 3,0, элюированные фракции можно нейтрализовать посредством добавления нейтрализующего буфера, например, 1 моль Tris при pH 7,5.
В одном аспекте варианта осуществления pH как промывочного буфера, так и буфера для уравновешивания может составлять от около 7,0 до около 8,6. В одном аспекте варианта осуществления промывочный буфер может представлять собой DPBS. В одном аспекте элюирующий буфер может содержать 100 ммоль глицинового буфера с pH около 2,5. В другом аспекте элюирующий буфер может представлять собой буфер с pH от около 2,0 до около 3,0. В одном аспекте нейтрализующий буфер может содержать 1 моль Tris с pH около 7,5.
В одном аспекте настоящего варианта осуществления способ может дополнительно включать промывку колонки промывочным буфером. В одном аспекте настоящего варианта осуществления способ может дополнительно включать элюирование колонки элюирующим буфером с получением элюированных фракций. В конкретном аспекте количество белков клетки-хозяина в элюированных фракциях значительно снижено по сравнению с количеством белков клетки-хозяина в биологическом образце, например, на около 70%, около 80%, 90%, около 95%, около 98% или около 99%.
Настоящее изобретение может включать добавление одной или более стадий, без определенного порядка, например, хроматографии с гидрофобным взаимодействием, аффинной хроматографии, многомодальной хроматографии, вирусной инактивации (например, с использованием низкого pH), вирусной фильтрации, и/или ультра/диафильтрации.
В одном аспекте профиль гликозилирования композиции белка против VEGF является следующим: от около 40% до около 50% общего количества фукозилированных гликанов, от около 30% до около 55% общего количества сиалированных гликанов, от около 6% до около 15% маннозы-5, и от около 60% до около 79% галактозилированных гликанов.
В одном аспекте данного варианта осуществления белок против VEGF обладает гликозилированием Man5 с около 32,4% остатков аспарагина 123 и/или около 27,1% остатков аспарагина 196. В конкретном варианте осуществления белок против VEGF может представлять собой афлиберцепт, антитело против VEGF или MiniTrap VEGF.
В одном варианте осуществления способ может дополнительно включать составление лекарственного вещества с использованием фармацевтически приемлемого вспомогательного вещества. В одном аспекте фармацевтически приемлемое вспомогательное вещество может быть выбрано из следующего: вода, буферные средства, сахар, соль, поверхностно-активное вещество, аминокислота, полиол, хелатирующее средство, эмульгатор и консервант.Другие хорошо известные специалисту в данной области вспомогательные вещества находятся в рамках данного варианта осуществления.
В одном аспекте варианта осуществления состав может подходить для введения субъекту-человеку. В одном аспекте настоящего варианта осуществления введение можно осуществлять посредством интравитреальной инъекции. В одном аспекте состав может иметь от около 40 до около 200 мг/мл белка, представляющего интерес.В конкретном аспекте белок, представляющий интерес, может представлять собой афлиберцепт, антитело против VEGF или MiniTrap VEGF.
Состав можно применять в способе лечения или предупреждения ангиогенных заболеваний глаз, которые могут включать: возрастную макулярную дистрофию (например, влажную или сухую), макулярный отек, макулярный отек после окклюзии вены сетчатки, окклюзию вены сетчатки (RVO), окклюзию центральной вены сетчатки (CRVO), окклюзию вены ветки сетчатки (BRVO), диабетический макулярный отек (DME), хориоидальную неоваскуляризацию (CNV), неоваскуляризацию радужной оболочки, неоваскулярную глаукому, послеоперационный фиброз при глаукоме, пролиферативную витреоретинопатию (PVR), неоваскуляризацию диска зрительного нерва, неоваскуляризацию роговицы, неоваскуляризацию сетчатки, неоваскуляризацию стекловидного тела, паннус, крыловидную плеву, сосудистую ретинопатию, диабетическую ретинопатию у субъекта с диабетическим макулярным отеком; или диабетические ретинопатии (например, непролиферативную диабетическую ретинопатию (например, характеризующуюся уровнем по шкале тяжести диабетической ретинопатии (DRSS) около 47 или 53), или пролиферативную диабетическую ретинопатию; например, у субъекта, не страдающего DME).
Синтез оксо-форм
Один вариант осуществления настоящего изобретения направлен на один или более способов синтеза окисленных форм белка с использованием света. В одном аспекте настоящего варианта осуществления белок, представляющий интерес, представляет собой белок против VEGF. В конкретном аспекте белок против VEGF представляет собой афлиберцепт.В другом аспекте белок против VEGF представляет собой MiniTrap VEGF, в том числе рекомбинантный MiniTrap VEGF. В другом аспекте настоящего варианта осуществления белок против VEGF представляет собой одноцепочечный вариабельный фрагмент (scFv).
В одном аспекте настоящего варианта осуществления образец содержит белок, представляющий интерес, например, слитый белок афлиберцепт с минимальным содержанием оксо-вариантов или без них. Образец подвергают фото-стрессу для синтеза окисленных форм афлиберцепта. В конкретном аспекте образец подвергают фото-стрессу посредством применения холодного белого света. В другом конкретном аспекте образец подвергают фото-стрессу посредством применения ультрафиолетового света.
В определенном аспекте варианта осуществления образец, содержащий афлиберцепт или другой белок против VEGF, подвергают воздействию холодного белого света в течение от около 30 часов до около 300 часов, с получением от около 1,5 до около 50-кратного повышения модифицированного олигопептида. Данные пептиды ферментативно расщепляются и их анализируют, при этом они содержат одно или более из группы, состоящей из
DKTH*TC*PPC*PAPELLG (SEQ ID NO.: 17), EIGLLTC*EATVNGH*LYK (SEQ ID NO.: 18), QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19), TELNVGIDFNWEYPSSKH*QHK (SEQ ID NO.: 20), TNYLTH*R (SEQ ID NO.: 21), SDTGRPFVEMYSEIPEIIH*MTEGR (SEQ ID NO.: 22), VH*EKDK (SEQ ID NO.: 23), SDTGRPFVEM*YSEIPEIIHMTEGR (SEQ ID NO.: 64), SDTGRPFVEMYSEIPEIIHM*TEGR (SEQ ID NO.: 65), TQSGSEM*K (SEQ ID NO.: 66), SDQGLYTC*AASSGLM*TK (SEQ ID NO.: 67), IIW*DSR (SEQ ID NO.: 28), RIIW*DSR (SEQ ID NO.: 115), IIW*DSRK (SEQ ID NO.: 114), TELNVGIDFNW*EYPSSK (SEQ ID NO.: 29), GFIISNATY*K (SEQ ID NO.: 69), KF*PLDTLIPDGK (SEQ ID NO.: 70) F*LSTLTIDGVTR (SEQ ID NO.: 32), где H* представляет собой гистидин, окисленный до 2-оксо-гистидина, где C* представляет собой карбоксиметилированный цистеин, где M* представляет собой окисленный метионин, где W* представляет собой окисленный триптофан, где Y* представляет собой окисленный тирозин и где F* представляет собой окисленный фенилаланин. Расщепление можно осуществлять посредством протеаз о которых говорилось ранее, например, трипсина. Олигопептиды можно анализировать с использованием масс-спектрометрии.
В определенном аспекте варианта осуществления образец, содержащий афлиберцепт или другой белок против VEGF, подвергают воздействию ультрафиолетового света в течение от около 4 часов до около 40 часов, с получением от около 1,5 до около 25-кратного повышения модифицированных олигопептидных продуктов (полученных при осуществлении расщепления), причем образец содержит один или более модифицированных олигопептидов, выбранных из группы, состоящей из
DKTH*TC*PPC*PAPELLG (SEQ ID NO.: 17), EIGLLTC*EATVNGH*LYK (SEQ ID NO.: 18), QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19), TELNVGIDFNWEYPSSKH*QHK (SEQ ID NO.: 20), TNYLTH*R (SEQ ID NO.: 21), SDTGRPFVEMYSEIPEIIH*MTEGR (SEQ ID NO.: 22), VH*EKDK (SEQ ID NO.: 23), SDTGRPFVEM*YSEIPEIIHMTEGR (SEQ ID NO.: 64), SDTGRPFVEMYSEIPEIIHM*TEGR (SEQ ID NO.: 65), TQSGSEM*K (SEQ ID NO.: 66), SDQGLYTC*AASSGLM*TK (SEQ ID NO.: 67), IIW*DSR (SEQ ID NO.: 28), RIIW*DSR (SEQ ID NO.: 115), IIW*DSRK (SEQ ID NO.: 114), TELNVGIDFNW*EYPSSK (SEQ ID NO.: 29), GFIISNATY*K (SEQ ID NO.: 69), KF*PLDTLIPDGK (SEQ ID NO.: 70) F*LSTLTIDGVTR (SEQ ID NO.: 32), где H* представляет собой гистидин, окисленный до 2-оксо-гистидина, где C* представляет собой карбоксиметилированный цистеин, где M* представляет собой окисленный метионин, где W* представляет собой окисленный триптофан, где Y* представляет собой окисленный тирозин и где F* представляет собой окисленный фенилаланин. Расщепление можно осуществлять посредством протеаз о которых говорилось ранее, например, трипсина. Олигопептиды можно анализировать с использованием масс-спектрометрии.
Способы сведения желто-коричневого цвета к минимуму
В настоящем изобретении представлены способы снижения желто-коричневой окраски в ходе получения афлиберцепта, MiniTrap или т.п., полученных в ХОС.
В одном варианте осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, а затем сбор препарата, содержащего рекомбинантный белок, представляющий интерес.В одном аспекте рекомбинантный белок, представляющий интерес, представляет собой белок против VEGF. В конкретном аспекте белок против VEGF выбран из группы, состоящей из афлиберцепта, MiniTrap, рекомбинантного MiniTrap (примеры которых раскрыты в патенте США №7279159, который включен в настоящий документ посредством ссылки во всей своей полноте), scFv и других белков против VEGF. В одном аспекте способ может обеспечивать получение рекомбинантного белка, представляющего интерес, причем цвет препарата характеризуют с использованием европейского способа BY или способа CIELAB (b*). Кроме того, наличие оксо-вариантов можно анализировать с использованием, например, ЖХ-МС.
В одном аспекте настоящего варианта осуществления условия смягчения воздействия включают повышение или снижение кумулятивных концентраций одного или более компонентов среды, например, аминокислот, металлов или антиоксидантов, в том числе солей и прекурсоров, что соответствует снижению цвета и белковых вариантов афлиберцепта и MiniTrap VEGF. Неограничивающие примеры аминокислот включают аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин. В конкретном аспекте снижение концентрации цистеина может быть эффективным для снижения желто-коричневого цвета препарата. Концентрация цистеина может также влиять на оксо-варианты.
В одном варианте осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, например, афлиберцепт, и сбор препарата белка, представляющего интерес, продуцированного клеткой, причем подходящие условия получают частично посредством снижения кумулятивной концентрации цистеина в ХОС до не более чем около 10 ммоль. Примеры подходящей среды включают без ограничения ХОС1B, Excell или т.п.Применяемый в данном документе термин “кумулятивное количество” относится к общему количеству конкретного компонента, добавленного в биореактор в ходе культивирования клеток с образованием ХОС, включая количества, добавленные в начале культивирования (ХОС в день 0) и добавленные впоследствии количества компонента. Количества компонента, добавленные в культуру в системе посевных ферментеров или инокулят перед получением в биореакторе (т.е., перед ХОС в день 0), также включены при расчете кумулятивного количества компонента. Кумулятивное количество не зависит от потери компонента с течением времени в ходе культивирования (например, посредством метаболизма или химического разложения). Таким образом, две культуры с одинаковыми кумулятивными количествами компонента могут, тем не менее, иметь различные абсолютные уровни, например, если компонент добавляют в две культуры в различные моменты времени (например, если в одной культуре весь компонент добавляют с самого начала, а в другой культуре компонент добавляют с течением времени). Кумулятивное количество также не зависит от синтеза компонента in situ с течением времени в ходе культивирования (например, посредством метаболизма или химического преобразования). Таким образом, две культуры с одинаковыми кумулятивными количествами приведенного компонента могут, тем не менее, иметь различные абсолютные уровни, например, если компонент синтезируется in situ в одной из двух культур посредством способа биологического преобразования. Кумулятивное количество может выражаться в таких единицах, как, например, граммы или моли компонента.
Применяемый в данном документе термин «кумулятивная концентрация» относится к кумулятивному количеству компонента, разделенному на объем жидкости в биореакторе в начале производственной партии, включая потребление начального объема из любого инокулята, применяемого в культуре. Например, если биореактор содержит 2 литра среды клеточной культуры в начале производственной партии, и один грамм компонента X добавляют в дни 0, 1, 2 и 3, то кумулятивная концентрация после дня 3 составляет 2 г/л (т.е., 4 грамма, разделенные на 2 литра). Если в день 4 в биореактор добавляют еще один литр жидкости, не содержащей компонент X, кумулятивная концентрация будет по-прежнему составлять 2 г/л. Если в день 5 некоторое количество жидкости было утеряно из биореактора (например, вследствие испарения), кумулятивная концентрация будет по-прежнему составлять 2 г/л. Кумулятивная концентрация может выражаться в таких единицах, как, например, граммы на литр или моли на литр.
В одном аспекте данного варианта осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, сбор препарата белка, продуцированного клеткой, причем подходящие условия получают посредством снижения отношения кумулятивной концентрации цистеина от около 1:10 до 1:29 к кумулятивной общей концентрации аминокислоты от около 1:50 до около 1:30.
В одном варианте осуществления способ включает (i) культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, такой как афлиберцепт, и (ii) сбор препарата рекомбинантного белка, представляющего интерес, продуцированного клеткой, причем подходящие условия получают посредством снижения кумулятивной концентрации железа в ХОС до менее чем около 55,0 мкмоль. В одном аспекте данного варианта осуществления препарат, полученный посредством данного способа, имеет менее желто-коричневый цвет, чем препарат, полученный посредством способа, в котором кумулятивная концентрация цинка в ХОС составляет более чем около 55,0 мкмоль.
В одном варианте осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, такой как афлиберцепт.Способ дополнительно включает сбор препарата рекомбинантного белка, представляющего интерес, продуцированного клеткой, причем подходящие условия получают посредством снижения кумулятивной концентрации цинка в ХОС до не более чем около 0,8 мкмоль. В одном аспекте данного варианта осуществления препарат, полученный посредством данного способа, имеет менее желто-коричневый цвет, чем препарат, полученный посредством способа, в котором кумулятивная концентрация цинка в ХОС составляет более чем около 0,8 мкмоль.
В одном варианте осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, такой как афлиберцепт, и сбор препарата рекомбинантного белка, представляющего интерес, продуцированного клеткой, причем подходящие условия получают посредством снижения кумулятивной концентрации никеля в ХОС до не более приблизительно 0,40 мкмоль. В одном аспекте данного варианта осуществления препарат, полученный посредством данного способа, имеет менее желто-коричневый цвет, чем препарат, полученный посредством способа, в котором кумулятивная концентрация цинка в ХОС составляет более чем около 0,40 мкмоль.
В одном варианте осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, такой как афлиберцепт.Способ дополнительно включает сбор препарата рекомбинантного белка, представляющего интерес, продуцированного клеткой, причем подходящие условия получают посредством снижения кумулятивной концентрации цинка в ХОС до не более чем около 56 мкмоль. В одном аспекте данного варианта осуществления препарат, полученный посредством данного способа, имеет менее желто-коричневый цвет, чем препарат, полученный посредством способа, в котором кумулятивная концентрация цинка в ХОС составляет более чем около 56 мкмоль.
В одном варианте осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, такой как афлиберцепт.Способ дополнительно включает сбор препарата рекомбинантного белка, представляющего интерес, продуцированного клеткой, причем подходящие условия получают посредством наличия антиоксидантов в ХОС в кумулятивной концентрации от около 0,001 ммоль до около 10 ммоль для одного антиоксиданта и кумулятивной концентрации не более около 30 ммоль, если в указанный ХОС добавляют несколько антиоксидантов. В одном аспекте данного варианта осуществления препарат, полученный посредством данного способа, имеет менее желто-коричневый цвет, чем препарат, полученный посредством способа, причем антиоксиданты присутствуют в ХОС в кумулятивной концентрации менее 0,01 ммоль или более около 100 ммоль. Неограничивающие примеры антиоксиданта могут включать таурин, гипотаурин, глицин, тиоктовую кислоту, глутатион, холинхлорид, гидрокортизон, витамин C, витамин E, хелатообразующие средства, каталазу, S-карбоксиметил-L-цистеин и их комбинации. Неограничивающие примеры хелатообразующих средств включают ауринтрикарбоновую кислоту (ATA), дефероксамин (DFO), EDTA и цитрат.
В одном варианте осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, такой как афлиберцепт.Способ дополнительно включает сбор препарата рекомбинантного белка, представляющего интерес, продуцированного клеткой, причем подходящие условия включают ХОС с кумулятивной концентрацией железа в указанной ХОС, составляющей менее около 55 мкмоль, кумулятивной концентрацией меди в указанной ХОС, составляющей не более около 0,8 мкмоль, кумулятивной концентрацией никеля в указанной ХОС, составляющей не более около 0,40 мкмоль, кумулятивной концентрацией цинка в указанной ХОС, составляющей не более около 56 мкмоль, кумулятивной концентрацией цистеина в указанной ХОС, составляющей менее 10 ммоль; и/или антиоксидант в указанной ХОС в концентрации от около 0,001 ммоль до около 10 ммоль для одного антиоксиданта, и кумулятивной концентрацией не более около 30 ммоль, если в указанный ХОС добавляют несколько антиоксидантов.
В одном аспекте настоящего варианта осуществления препарат, полученный посредством подходящих условий, обеспечивает снижение белковых вариантов афлиберцепта и MiniTrap VEGF до необходимого количества белковых вариантов афлиберцепта и MiniTrap VEGF (что называется «целевым значение» белковых вариантов афлиберцепта и MiniTrap VEGF). В следующем аспекте данного варианта осуществления препарат, полученный посредством применения подходящих условий, обеспечивает снижение цвета препаратов до необходимого значения b* или значения BY (что называется «целевое значение b*» «целевое значение BY», соответственно), если препарат белка, в том числе варианты афлиберцепта и MiniTrap VEGF, нормализованы до концентрации 5 г/л или 10 г/л. В следующем аспекте настоящего варианта осуществления целевое значение b* (или целевое значение BY) и/или целевое значение вариантов может быть получено в препарате, в котором титр повышается или значительно не снижается.
Эти и другие аспекты изобретения будут лучше оценены и поняты при рассмотрении вместе со следующим описанием и прилагаемыми графическими материалами. Следующее описание, хотя и указывает на различные варианты осуществления и их многочисленные конкретные детали, предусмотрено в качестве иллюстрации, а не ограничения. Многие замены, модификации, добавления или перестановки могут быть выполнены в пределах объема настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Файл патента или заявки содержит по меньшей мере один цветной графический материал. Копии этого патента или публикации заявки на патент с цветным графическим материалом(ами) будут предоставлены Ведомством по запросу и после уплаты необходимой пошлины.
На фиг. 1 изображен MiniTrap VEGF, образованный с использованием иллюстративного варианта осуществления, содержащий VEGFR1 (SEQ ID NO.: 34), VEGFR2 (SEQ ID NO.: 36), фрагмент шарнирного домена (SEQ ID NO.: 60) отщепленный от афлиберцепта фрагмент Fc (SEQ ID NO.: 113).
На фиг. 2 изображен предложенный механизм окисления гистидина до 2-оксо-гистидина (14 Да).
На фиг. 3 изображен предложенный механизм окисления гистидина до 2-оксо-гистидина (16 Да).
На фиг. 4 изображен предложенный механизм окисления триптофана до N-формилкинуренина и кинуренина.
На фиг. 5 изображен иллюстративный вариант осуществления получения афлиберцепта.
На фиг. 6 изображен иллюстративный вариант осуществления получения MiniTrap VEGF.
На фиг. 7 изображен иллюстративный вариант осуществления получения афлиберцепта.
На фиг. 8 изображен иллюстративный вариант осуществления получения MiniTrap VEGF.
На фиг. 9 изображена блок-схема рассчитанных стандартов BY по сравнению со значением b*, рассчитанным согласно иллюстративному варианту осуществления.
На фиг. 10 изображены результаты эксперимента, осуществляемого для оценки процентного содержания 2-оксо-гистидинов и окисления триптофана (где подчеркивание означает окисление остатка) в олигопептидах из расщепленной протеазой загрузки AEX и проточной фракции, включая фрагменты восстановленного и алкилированного афлиберцепта (SEQ ID NO.: 55), включая SEQ ID NOS 114-115, 21, 115, 28, 28, 20, 18, 17, 116-117 и 19, соответственно, в порядке появления.
На фиг. 11 изображена относительная распространенность пептидов, идентифицированных из анализа пептидного картирования, осуществленного с использованием олигопептидов из расщепленной протеазой загрузки AEX и проточной фракции (где подчеркивание означает окисление остатка в пептидной последовательности), включая фрагменты афлиберцепта (SEQ ID NO.: 55), включая SEQ ID NOS 22, 18, 21, 19-20, 118-119, и 28-29, соответственно, в порядке появления.
На фиг. 12A изображен полный обзор графика хроматограммы поглощения в зависимости от времени (минуты) для MT4 и MT1 с длиной волны 350 нм.
На фиг. 12B изображен развернутый вид графика хроматограммы поглощения в зависимости от времени (16-30 минут) для MT4 и MT1 с длиной волны 350 нм, включая SEQ ID NOS 21, 28 и 28, соответственно, в порядке появления.
На фиг. 12B изображен развернутый вид графика хроматограммы поглощения в зависимости от времени (30-75 минут) для MT4 и MT1 с длиной волны 350 нм, включая SEQ ID NOS 17, 20, 18 и 19, соответственно, в порядке появления.
На фиг. 13 изображены результаты эксперимента, осуществляемого для оценки процентного содержания 2-оксо-гистидинов (и двойного окисления триптофана) в олигопептидах из расщепленного протеазой MT1, который был обработан посредством хроматографии AEX и олигопептидов из расщепленного протеазой MT1, который вычищали из хроматографии AEX, включая SEQ ID NOS 21, 28, 17, 20 и 18-19, соответственно, в порядке появления.
На фиг. 14 изображены результаты эксперимента, осуществляемого для сравнения кислотных форм, присутствующих в различных производственных партиях MT1, и кислотных фракций кислоты, полученных при осуществлении сильной катионообменной (CEX) хроматографии, включая SEQ ID NOS 21, 28, 28, 17, 20 и 18-19, соответственно, в порядке появления.
На фиг. 15 изображен иллюстративный способ обогащения кислотных форм и других вариантов, присутствующих в образцах сбора клеточной культуры с использованием сильной катионообменной хроматографии.
На фиг. 16 изображены фракции, образованные при осуществлении сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 17 изображены сильные катионообменные хроматограммы, полученные в соответствии с иллюстративным вариантом осуществления, для получения MT1 (перед любой производственной процедурой, ≤BY3), подвергаемого CEX, и для обогащенных вариантов десиалилированного MiniTrap (dsMT1) с использованием двойного градиента соли и pH.
На фиг. 18A изображена 3D хроматограмма для нефракционированного исходного контроля, осуществляемая посредством сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 18B изображена 3D хроматограмма для MT1, при этом фракция 1 демонстрирует некоторые из хвостовых особенностей эксперимента, осуществляемого посредством сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 18C изображена 3D хроматограмма для MT1, функция фракции 2, осуществляемая посредством сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 18D изображена 3D хроматограмма для MT1, функция фракции 3, осуществляемая посредством сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 18E изображена 3D хроматограмма для MT1, функция фракции 4, осуществляемая посредством сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 18F изображена 3D хроматограмма для MT1, функция фракции 5, осуществляемая посредством сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 18G изображена 3D хроматограмма для MT1, функция фракции 6, осуществляемая посредством сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 18H изображена 3D хроматограмма для MT1, функция фракции 7, осуществляемая посредством сильной катионообменной хроматографии в соответствии с иллюстративным вариантом осуществления.
На фиг. 19 изображены электроферограммы капиллярного изоэлектрического фокусирования с детекцией (icIEF) непосредственно в капилляре, выполненного в соответствии с иллюстративным вариантом осуществления для получения МТ1.
На фиг. 20 изображены результаты исследования корреляции воздействия холодного белого света на MT1 или УФА-света с появлением окисленных аминокислотных остатков, включая SEQ ID NOS 114, 114-115, 21, 115, 28, 28, 28, 17, 83, 20, 18, 29, 29, 19, и 22, соответственно, в порядке появления.
На фиг. 21 изображены 3D хроматограммы SEC-PDA (эксклюзионной хроматографии в сочетании с детектором на фотодиодной матрице) подвергнутого воздействию ХБС MT1 с поглощением при ~350 нм (см., например, круговое выделение ~350 нм) в соответствии с иллюстративным вариантом осуществления, где A обозначает хроматограмму при T=0, B обозначает хроматограмму при 0,5x ICH, C обозначает хроматограмму при 2,0x ICH и D обозначает MT1 во флаконах (нормализованный до 80 мг/мл), подвергнутого воздействию ХБС в течение различных временных интервалов
На фиг. 22 изображены 3D хроматограммы SEC-PDA подвергнутого воздействию УФА MT1 с поглощением при ~350 нм (см., например, круговое выделение ~350 нм) в соответствии с иллюстративным вариантом осуществления, где A обозначает хроматограмму при T=0, B обозначает хроматограмму при 0,5x ICH, C обозначает хроматограмму при 2,0x ICH и D обозначает MT1 во флаконах (нормализованный до 80 мг/мл) подвергнутого воздействию УФА в течение различных временных
На фиг. 23A изображены коэффициенты поглощения A320/280, рассчитанные на основании хроматограмм SEC-PDA для образцов, подвергнутых стрессу с использованием CWL (верхняя панель), а B представляет собой график коэффициентов поглощения A320/280 вариантов размера в образцах, подвергнутых воздействию CWL (нижняя панель), причем образцы подвергают воздействию в соответствии с иллюстративным вариантом осуществления.
На фиг. 24A изображены коэффициенты поглощения A320/280, рассчитанные на основании хроматограмм SEC-PDA для образцов, подвергнутых стрессу с использованием UVA (верхняя панель), а B представляет собой график коэффициентов поглощения A320/280 вариантов размера в образцах, подвергнутых воздействию UVA (нижняя панель), причем образцы подвергают воздействию в соответствии с иллюстративным вариантом осуществления.
На фиг. 25 A изображена масштабная оценка влияния инкубации различных компонентов с афлиберцептом на формирование цвета (CIE L*, a*, b*, прогнозируемое значение b); и B представляет собой график фактического значения относительно прогнозируемого значения b.
На фиг. 26 A изображено влияние ХОС, содержащих низкое содержание цистеина и низкое содержание металлов, на титр афлиберцепта, на фиг. 26 B изображено влияние ХОС, содержащих низкое содержание цистеина и низкое содержание металлов, на концентрацию жизнеспособных клеток, на фиг. 26 C изображено влияние ХОС, содержащих низкое содержание цистеина и низкое содержание металлов, на жизнеспособность, на фиг. 26 D изображено влияние ХОС, содержащих низкое содержание цистеина и низкое содержание металлов, на содержание аммиака, на фиг. 26 E изображено влияние ХОС, содержащих низкое содержание цистеина и низкое содержание металлов, на осмоляльность.
На фиг. 27 представляет собой диаграмму, демонстрирующую прогнозируемый профиль цвета урожая (видимого как значения b* дня 13) при увеличении/уменьшении содержания металлов и цистеина в соответствии с иллюстративным вариантом осуществления.
На фиг. 28 (A-B) изображено влияние инкубации различных компонентов с афлиберцептом в отработанном ХОС на формирование цвета (CIE L*, a*, b*, прогнозируемое значение b) (A); и по графику масштабированных прогнозируемых воздействий на значение b (B).
На фиг. 28C изображены масштабированные оценочные эффекты инкубации различных компонентов с афлиберцептом в ХОС на формирование цвета (CIE L*, a*, b*, прогнозируемое значение b) в культуре во встряхиваемой колбе.
На фиг. 28D изображено влияние инкубации мезилатной соли гипотаурина и дефероксамина (DFO) с афлиберцептом в отработанном ХОС на генерацию цвета (CIE L*, a*, b*, прогнозируемое значение "b").
На фиг. 28E изображено влияние инкубации различных компонентов по отдельности с афлиберцептом из культуры во встряхиваемой колбе на формирование цвета (CIE L*, a*, b*, предсказанное значение "b").
На фиг. 29 представляет собой диаграмму, показывающую влияние добавления уридина, марганца, галактозы и дексаметазона в ХОС на титр продуцируемого афлиберцепта.
На фиг. 30 представляет собой диаграмму, показывающую влияние добавления уридина, марганца, галактозы и дексаметазона в ХОС на жизнеспособность клеток, экспрессирующих афлиберцепт, в которых образуется афлиберцепт.
На фиг. 31 представляет собой диаграмму, показывающую влияние добавления уридина, марганца, галактозы и дексаметазона в ХОС на количество жизнеспособных клеток, экспрессирующих афлиберцепт, в которых образуется афлиберцепт.
На фиг. 32 представляет собой диаграмму, показывающую стандартную кривую поглощения белка клетки-хозяина в зависимости от белка (нг/мл), полученного с использованием стандартных растворов белка клетки-хозяина из Cygnus 3G (F550).
На фиг. 33 представляет собой изображение анализа SDS-PAGE, выполненного с использованием невосстанавливающего буфера для образцов SDS-PAGE.
На фиг. 34 представляет собой изображение анализа SDS-PAGE, выполненного с использованием восстанавливающего буфера для образцов SDS-PAGE.
На фиг. 35A представляет собой диаграмму общего количества белка клетки-хозяина, обнаруженного в загрузочном растворе, элюированные фракции из колонки для аффинной хроматографии 1-3, содержащие VEGF165, mAb1 и mAb2, соответственно.
На фиг. 35B представляет собой диаграмму общего количества белков клетки-хозяина, обнаруженных в загрузочном растворе, элюированные фракции из колонки для аффинной хроматографии 1, 2, 4 и 5, содержащие VEGF165, mAb1, mAb3 и mAb4, соответственно.
На фиг. 36A показаны профили SEC VEGF MiniTrap до и на фиг. 36B показаны профили SEC VEGF MiniTrap после проведения аффинной хроматографии.
На фиг. 37 изображено мультипликационное изображение кинетического исследования VEGF MiniTrap на VEGF165, где изученные конструкции VEGF MiniTrap получали до и после получения аффинной хроматографии в соответствии с некоторыми иллюстративными вариантами осуществления.
На фиг. 38 представлены сенсограммы SPR от кинетического исследования VEGF MiniTrap до VEGF165, где изученные конструкции VEGF MiniTrap получали до и после получения аффинной хроматографии в соответствии с некоторыми иллюстративными вариантами осуществления.
На фиг. 39 представляет собой диаграмму общего количества белка клетки-хозяина, обнаруженного в загрузочном растворе, элюированные фракции из колонки для аффинной хроматографии, повторно применяемые для колонок, содержащих VEGF165, mAb1 и mAb2.
На фиг. 40 изображена структура VEGF MiniTrap MT1 (SEQ ID NO: 46) в соответствии с иллюстративным вариантом осуществления.
На фиг. 41 изображена структура VEGF MiniTrap MT6 (SEQ ID NO: 51) в соответствии с иллюстративным вариантом осуществления.
На фиг. 42 изображены общие ионные хроматограммы (TIC) относительной абсорбции в зависимости от времени (минуты) для нативного анализа SEC-MS МТ1, МТ5 и МТ6 и увеличенный вид низкомолекулярной области из TIC.
На фиг. 43 изображены масс-спектры с деконволюцией основного пика для MT1 и MT5 для подтверждения идентичности димера MiniTrap с выяснением для некоторых PTM с указанием N-концевых аминокислот (SEQ ID NO.: 120).
На фиг. 44 изображены масс-спектры с деконволюцией основного пика для MT6, подтверждающие идентичность одноцепочечной MiniTrap с выяснением для некоторых PTM.
На фиг. 45A представлен график зависимости относительного поглощения от времени (минуты) для низкомолекулярных примесей в MT1.
На фиг. 45B изображены масс-спектры низкомолекулярных примесей в MT1.
На фиг. 46 изображено относительное поглощение в зависимости от времени (минуты) для MT1, что показывает отсутствие фермента FabRICATOR, применяемого для расщепления афлиберцепта на MT1.
На фиг. 47 показана относительная абсорбция в зависимости от времени (минуты) для низкомолекулярных примесей в МТ5.
На фиг. 48 изображено относительное поглощение в зависимости от времени (минуты) для низкомолекулярных примесей в МТ6.
На фиг. 49A представляет собой график зависимости поглощения от времени (минуты), полученный при выполнении HILIC-UV/MS для VEGF MiniTrap MT6, где график показывает элюирование основного пика через 21 минуту и O-гликанов примерно через 21,5 минуты.
На фиг. 49B изображен масс-спектр, полученный при выполнении HILIC-UV/MS для VEGF MiniTrap MT6, показывающий основной пик при 47985,8 Да.
На фиг. 49C изображены масс-спектры O-гликанов VEGF MiniTrap MT6, полученные при выполнении HILIC-UV/MS.
На фиг. 50 представляет собой изображение димера VEGF MiniTrap, где дисульфидный мостик в шарнирной области VEGF MiniTrap (SEQ ID NO.: 83, 123, 83 и 123) может быть параллельным или скрещенным.
На фиг. 51 изображена относительная частота распределения гликанов, наблюдаемая в Asn36 среди MT1, MT5 и MT6. Фигура раскрывает SEQ ID NO.: 121.
На фиг. 52 изображена относительная частота распределения гликанов, наблюдаемая в Asn68 среди MT1, MT5 и MT6. Фигура раскрывает SEQ ID NOS 101 и 30, соответственно, в порядке появления.
На фиг. 53 изображена относительная частота распределения гликанов, наблюдаемая в Asn123 среди MT1, MT5 и MT6. Фигура раскрывает SEQ ID NO.: 82.
На фиг. 54 изображена относительная частота распределения гликанов, наблюдаемая в Asn196 среди MT1, MT5 и MT6. Фигура раскрывает SEQ ID NOS 103 и 122, соответственно, в порядке появления.
На фиг. 55 показан анализ высвобожденного N-связанного гликана посредством хроматографии с гидрофильным взаимодействием (HILIC) в сочетании с обнаружением посредством флуоресценции и масс-спектрометрическим анализом (полномасштабным и сокращенным).
На фиг. 56 представлены хроматограммы HILIC-FLR для MT1, MT5 и MT6.
На фиг. 57 показан анализ высвобожденного N-связанного гликана посредством HILIC в сочетании с обнаружением посредством флуоресценции и масс-спектрометрическим анализом (полномасштабным, сокращенным и нормализованным).
На фиг. 58A представляет собой таблицу с подробной идентификацией и количественной оценкой гликанов из образцов VEGF MiniTrap MT1, MT5 и MT6.
На фиг. 58B представляет собой таблицу с подробной идентификацией и количественной оценкой гликанов из образцов VEGF MiniTrap MT1, MT5 и MT6.
На фиг. 58С представляет собой таблицу с подробной идентификацией и количественной оценкой гликанов из образцов VEGF MiniTrap MT1, MT5 и MT6.
На фиг. 59 изображена иллюстративная производственная процедура для получения MiniTrap в соответствии с иллюстративным примером осуществления.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Ангиогенез - рост новых кровеносных сосудов из ранее существовавшей сосудистой сети, представляет собой высокоорганизованный процесс, который имеет решающее значение для правильного эмбрионального и постнатального развития сосудов. Аномальный или патологический ангиогенез является признаком рака и некоторых заболеваний сетчатки, когда повышенная регуляция проангиогенных факторов, таких как фактор роста эндотелия сосудов (VEGF), приводит к увеличению пролиферации эндотелия, изменениям морфологии сосудов и повышению проницаемости сосудов. Повышенные уровни VEGF были обнаружены в стекловидном теле и сосудистой сети сетчатки у пациентов с различными глазными заболеваниями. Блокирование активности VEGF также стало терапией выбора для лечения DME, влажной AMD, CNV, окклюзии вены сетчатки и других глазных заболеваний, в основе которых лежит патологический ангиогенез.
В контексте данного документа афлиберцепт представляет собой один из таких белков против VEGF, содержащий полностью человеческую аминокислотную последовательность, содержащую второй домен Ig человеческого VEGFR1 и третий Ig-домен человеческого VEGFR2, экспрессируемые в виде линейного слияния с (Fc) человеческого IgG1. Афлиберцепт связывает все формы VEGF-A (VEGF), но, кроме того, связывает PlGF и VEGF-B. Несколько других гомодимерных MiniTrap VEGF были созданы в виде ферментативно расщепленных продуктов из афлиберцепта или рекомбинантно экспрессируемых непосредственно из линий клеток-хозяев. Один такой пример MiniTrap VEGF показан на фиг. 1. На данной фигуре показан концевой лизин (K), некоторые процессы культивирования обеспечивают удаление данного концевого лизина, а другие - нет. Фиг. 1 проиллюстрирован способ, при котором концевой лизин остается. В целом афлиберцепт охватывает как наличие, так и отсутствие концевого лизина.
Как показано в данном документе, в настоящем изобретении частично раскрыто получение белков против VEGF (пример 1) с использованием ХОС.Анализ растворов, содержащих афлиберцепт, полученных с использованием определенных ХОС, продемонстрировал определенное свойство цвета, например, интенсивный желто-коричневый цвет.Интенсивность цвета раствора зависит от применяемого ХОС.Не все исследованные ХОС обеспечивали образец с отчетливым желто-коричневым цветом после того, как растворы были нормализованы до концентрации 5 г/л.
Цвет, например, желто-коричневый, в растворе инъекционного терапевтического препарата может представлять собой нежелательную характеристику. Это может быть важным параметром, применяемым для определения того, удовлетворяет ли лекарственный продукт заданному уровню чистоты и качества для конкретного терапевтического средства. Такой цвет, как желто-коричневый, наблюдаемый в ходе получения биологического препарата, может быть вызван химическими модификациями данного биологического препарата, продуктами разложения вспомогательных веществ состава или продуктами разложения, образованными в результате реакции биологических и вспомогательных веществ состава. Тем не менее, такая информация может быть полезна для понимания причины изменения цвета. Это также может помочь в разработке условий как краткосрочного, так и длительного хранения для предотвращения модификаций, способствующих такому изменению цвета.
Авторы настоящего изобретения наблюдали, что применение AEX в ходе получения раствора белка против VEGF сводило к минимуму желто-коричневую окраску. Кроме того, авторы настоящего изобретения обнаружили, что желто-коричневая окраска может быть уменьшена посредством модификации культуры клеток, применяемой для получения рекомбинантного белка, такого как афлиберцепт, или модифицированного афлиберцепта, такого как MiniTrap.
Настоящее изобретение охватывает белки против VEGF и их получение с использованием ХОС.Кроме того, настоящее изобретение основано на идентификации и оптимизации технологии предшествующих и последующих процессов для получения белка.
Как показано в данном документе, в некоторых из примеров, приведенных ниже, описано получение белка против VEGF (пример 1), получение окисленных белков против VEGF (пример 4), способы уменьшения окисленных белков против VEGF посредством оптимизации культуральной среды (пример 5) и за счет оптимизации способов получения (пример 2).
Ряд недавних патентных заявок и выданных патентов направлены на описание различных форм афлиберцепта и способов его получения, но ни в одной из них не описаны или не предлагаются композиции против VEGF и способы их получения, описанные в данном документе. См., например, заявку на патент США №16/566847 от Coherus Biosciences Inc., патент США №10646546 от Sam Chun Dang Pharm. Co., Ltd., патент США №10576128 от Formycon AG, международную заявку №PCT/US2020/015659 от Amgen Inc. и патенты США №№8956830; 9217168; 9487810; 9663810; 9926583 и 10144944 от Momenta Pharmaceuticals, Inc.
I. Объяснение выбранных терминов
Если не указано иное, все технические и научные термины, применяемые в данном документе, имеют то же значение, которое обычно понимается специалистом в области, к которой принадлежит настоящее изобретение. Способы и материалы, аналогичные или эквивалентные описанным в данном документе, известные специалисту в данной области, можно применять в практике конкретных вариантов осуществления, описанных в данном документе. Все упомянутые публикации включены в настоящий документ посредством ссылки во всей своей полноте.
Формы единственного числа следует понимать как означающие «по меньшей мере один» и термины «около» и «приблизительно» следует понимать как допускающие стандартные вариации, как будет понятно специалистам в данной области техники, а в случаях, когда указаны диапазоны, в них включены конечные точки.
Применяемый в данном документе термин «ангиогенное заболевание глаза» означает любое заболевание глаза, вызванное или ассоциированное с ростом или пролиферацией кровеносных сосудов или проницаемостью кровеносных сосудов.
Применяемый в данном документе термин «среда с химически определенным составом» или «среды с химически определенным составом» (сокращение «ХОС» в обоих случаях) относится к синтетической питательной среде, в которой определены идентичность и концентрация всех ингредиентов. Среда с определенным химическим составом не содержит экстрактов бактерий, дрожжей, животных или растений, сыворотки или плазмы животных, несмотря на то, что могут быть добавлены отдельные компоненты растительного или животного происхождения (например, белки, полипептиды и т.д.). Среды с определенным химическим составом могут содержать неорганические соли, такие как фосфаты, сульфаты и т.п., необходимые для поддержания роста. Источник углерода определен и обычно представляет собой сахар, такой как глюкоза, лактоза, галактоза и т.п., или другие соединения, такие как глицерин, лактат, ацетат и т.п.В то время как в некоторых культуральных средах с определенным химическим составом также применяются фосфатные соли в качестве буфера, можно применять другие буферы, такие как бикарбонат натрия, HEPES, цитрат, триэтаноламин и т.п.Примеры коммерчески доступных сред с включают без ограничения различные среды Игла в модификации Дульбекко (DME) (Sigma-Aldrich Co; SAFC Biosciences, Inc.), питательную смесь Хема (Sigma-Aldrich Co; SAFC Biosciences, Inc.), различные среды EX-CELL (Sigma-Aldrich Co; SAFC Biosciences, Inc.), различные среды IS CHO-CD (FUJIFILM Irvine Scientific), их комбинации и т.п.Способы получения культуральных сред с определенным химическим составом известны в данной области, например, в патентах США №№6171825 и 6936441, WO 2007/077217 и заявках на патент США №№2008/0009040 и 2007/0212770, полное содержание которых включено в настоящий документ посредством ссылки.
Применяемый в данном документе термин “кумулятивное количество” относится к общему количеству конкретного компонента, добавленного в биореактор в ходе культивирования клеток с образованием ХОС, включая количества, добавленные в начале культивирования (ХОС в день 0) и добавленные впоследствии количества компонента. Количества компонента, добавленные в культуру в системе посевных ферментеров или инокулят перед получением в биореакторе (т.е., перед ХОС в день 0), также включены при расчете кумулятивного количества компонента. Кумулятивное количество не зависит от потери компонента с течением времени в ходе культивирования (например, посредством метаболизма или химического разложения). Таким образом, две культуры с одинаковыми кумулятивными количествами компонента могут, тем не менее, иметь различные абсолютные уровни, например, если компонент добавляют в две культуры в различные моменты времени (например, если в одной культуре весь компонент добавляют с самого начала, а в другой культуре компонент добавляют с течением времени). Кумулятивное количество также не зависит от синтеза компонента in situ с течением времени в ходе культивирования (например, посредством метаболизма или химического преобразования). Таким образом, две культуры с одинаковыми кумулятивными количествами приведенного компонента могут, тем не менее, иметь различные абсолютные уровни, например, если компонент синтезируется in situ в одной из двух культур посредством способа биологического преобразования. Кумулятивное количество может выражаться в таких единицах, как, например, граммы или моли компонента.
Применяемый в данном документе термин «кумулятивная концентрация» относится к кумулятивному количеству компонента, разделенному на объем жидкости в биореакторе в начале производственной партии, включая потребление начального объема из любого инокулята, применяемого в культуре. Например, если биореактор содержит 2 литра среды клеточной культуры в начале производственной партии, и один грамм компонента X добавляют в дни 0, 1, 2 и 3, то кумулятивная концентрация после дня 3 составляет 2 г/л (т.е., 4 грамма, разделенные на 2 литра). Если в день 4 в биореактор добавляют еще один литр жидкости, не содержащей компонент X, кумулятивная концентрация будет по-прежнему составлять 2 г/л. Если в день 5 некоторое количество жидкости было утеряно из биореактора (например, вследствие испарения), кумулятивная концентрация будет по-прежнему составлять 2 г/л. Кумулятивная концентрация может выражаться в таких единицах, как, например, граммы на литр или моли на литр.
Применяемый в данном документе термин “состав” относится к белку, представляющему интерес, который объединен в состав вместе с одной или более фармацевтически приемлемыми средами. В одном аспекте белок, представляющий интерес, представляет собой афлиберцепт и/или MiniTrap.В некоторых иллюстративных вариантах осуществления количество белка, представляющего интерес, в составе может варьировать от около 0,01 мг/мл до около 600 мг/мл. В некоторых конкретных вариантах осуществления количество белка, представляющего интерес, в составе может составлять около 0,01 мг/мл, около 0,02 мг/мл, около 0,03 мг/мл, около 0,04 мг/мл, около 0,05 мг/мл, около 0,06 мг/мл, около 0,07 мг/мл, около 0,08 мг/мл, около 0,09 мг/мл, около 0,1 мг/мл, около 0,2 мг/мл, около 0,3 мг/мл, около 0,4 мг/мл, около 0,5 мг/мл, около 0,6 мг/мл, около 0,7 мг/мл, около 0,8 мг/мл, около 0,9 мг/мл, около 1 мг/мл, около 2 мг/мл, около 3 мг/мл, около 4 мг/мл, около 5 мг/мл, около 6 мг/мл, около 7 мг/мл, около 8 мг/мл, около 9 мг/мл, около 10 мг/мл, около 15 мг/мл, около 20 мг/мл, около 25 мг/мл, около 30 мг/мл, около 35 мг/мл, около 40 мг/мл, около 45 мг/мл, около 50 мг/мл, около 55 мг/мл, около 60 мг/мл, около 65 мг/мл, около 70 мг/мл, около 75 мг/мл, около 80 мг/мл, около 85 мг/мл, около 90 мг/мл, около 100 мг/мл, около 110 мг/мл, около 120 мг/мл, около 130 мг/мл, около 140 мг/мл, около 150 мг/мл, около 160 мг/мл, около 170 мг/мл, около 180 мг/мл, около 190 мг/мл, около 200 мг/мл, около 225 мг/мл, около 250 мг/мл, около 275 мг/мл, около 300 мг/мл, около 325 мг/мл, около 350 мг/мл, около 375 мг/мл, около 400 мг/мл, около 425 мг/мл, около 450 мг/мл, около 475 мг/мл, около 500 мг/мл, около 525 мг/мл, около 550 мг/мл, около 575 мг/мл или около 600 мг/мл. В некоторых иллюстративных вариантах осуществления pH композиции может составлять более около 5,0. В одном иллюстративном варианте осуществления pH может составлять более около 5,0, более около 5,5, более около 6,0, более около 6,5, более около 7,0, более около 7,5, более около 8,0 или более около 8,5.
Применяемый в данном документе термин «база данных» относится к биоинформатическому инструменту, который обеспечивает возможность поиска неинтерпретированных спектров МС-МС по всем возможным последовательностям в базе данных. Неограничивающими примерами таких инструментов являются Mascot (www.matrixscience.com), Spectrum Mill (www.chem.agilent.com), PLGS (www.waters.com), PEAKS (www.bioinformaticssolutions.com), Proteinpilot (download.appliedbiosystems.com//proteinpilot), Phenyx (www.phenyx-ms.com), Sorcerer (www.sagenresearch.com), OMSSA (www.pubchem.ncbi.nlm.nih.gov/omssa/), X!Tandem (www.thegpm.org/TANDEM/), Protein Prospector (www.prospector.ucsf.edu/prospector/mshome.htm), Byonic (www.proteinmetrics.com/products/byonic) или Sequest (fields.scripps.edu/sequest).
Применяемый в данном документе термин “ультрафильтрация” или “UF” может включать процесс мембранной фильтрации, подобный обратному осмосу, с использованием гидростатического давления для проталкивания воды через полупроницаемую мембрану. Ультрафильтрация подробно описана в Leos J. Zeman & Andrew L. Zydney, Microfiltration and ultrafiltration: principles and applications (1996), полное содержание которого включено в настоящий документ.Для ультрафильтрации можно применять фильтры с размером пор менее 0,1 мкм. При использовании фильтров, имеющих такой маленький размер пор, объем образца может быть уменьшен за счет проникновения буфера образца через фильтр, в то время как белки остаются за фильтром.
В контексте данного документа «диафильтрация» или «DF» может включать способ применения ультрафильтров для удаления и замены солей, сахаров и неводных растворителей, для отделения свободных форм от связанных, для удаления низкомолекулярного материала и/или для обеспечения быстрого изменения ионных и/или pH сред. Наиболее эффективно растворенные микрочастицы удаляются при добавлении растворителя в раствор, подвергаемый ультрафильтрации, со скоростью, приблизительно равной скорости ультрафильтрации. Это обеспечивает вымывание микрочастицы из раствора в постоянном объеме. В определенных иллюстративных вариантах осуществления настоящего изобретения стадию диафильтрации можно применять для замены различных буферов, применяемых совместно с настоящим изобретением, например, перед хроматографией или другими стадиями производства, а также для удаления примесей из препарата белка. Применяемый в данном документе термин «технология дальнейших процессов» относится к одной или более техникам, применяемым после технологий предшествующих процессов для получения белка. Технология дальнейших процессов включает, например, получение белкового продукта, с использованием, например, аффинной хроматографии, в том числе аффинной хроматографии с белком A, а также аффинной хроматографии, в которой применяют твердую фазу с хорошо определенной молекулой, такой как VEGF, которая может взаимодействовать с ее родственной формой, такой как рецептор VEGF (VEGFR), ионообменной хроматографии, такой как анионо- или катионообменная хроматография, хроматографии с гидрофобным взаимодействием или вытеснительной хроматографии.
Выражение «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») включает клетку, в которую был введен рекомбинантный вектор экспрессии, кодирующий белок, представляющий интерес.Следует понимать, что такой термин предназначен для обозначения не только конкретной рассматриваемой клетки, но и потомства такой клетки. Поскольку определенные модификации могут происходить в последующих поколениях из-за мутаций или влияний окружающей среды, такое потомство может фактически не быть идентичным исходной клетке, но все же включено в объем термина «клетка-хозяин», который используется в данном документе. В одном варианте осуществления клетки-хозяева включают прокариотические и эукариотические клетки, выбранные из любого биологического царства. В одном аспекте эукариотические клетки включают клетки простейших, грибов, растений и животных. В следующем аспекте клеткихозяева включают эукариотические клетки, такие как клетки растений и/или животных. Клетки могут представлять собой клетки млекопитающего, клетки рыбы, клетки насекомого, клетки земноводного или клетку пернатого. В конкретном аспекте клетка-хозяин представляет собой клетку млекопитающего. Широкое разнообразие клеточных линий млекопитающих, подходящих для роста в культуре, доступно в Американской коллекции типовых культур (Манассас, Вирджиния) и других хранилищах, а также у коммерческих поставщиков. Клетки, которые можно применять в процессах по настоящему изобретению, включают без ограничения клетки MK2.7, клетки PER-C6, клетки яичника китайского хомяка (CHO), такие как CHO-K1 (ATCC CCL-61), DG44 (Chasin et al., 1986, Som. Cell Molec. Genet., 12:555-556; Kolkekar et al., 1997, Biochemistry, 36: 10901-10909; и WO 01/92337 A2), отрицательные по дигидрофолатредуктазе клетки СНО (CHO/-DHFR, Urlaub and Chasin, 1980, Proc. Natl. Acad. Sci. USA, 77:4216), и клетки dp12.CHO (патент США №5721121); клетки почки обезьяны (CV1, ATCC CCL-70); клетки CV1 почки обезьяны, трансформированные SV40 (клетки COS, COS-7, ATCC CRL-1651); клетки HEK 293 и клетки Sp2/0, клетки гибридомы 5L8, клетки Daudi, клетки EL4, клетки HeLa, клетки HL-60, клетки K562, клетки Jurkat, клетки THP-1, клетки Sp2/0, первичные эпителиальные клетки (например, кератиноциты, клетки эпителия шейки матки, клетки бронхиального эпителия, клетки эпителия трахеи, клетки эпителия почек и клетки эпителия сетчатки) и устойчивые клеточные линии и их штаммы (например, эмбриональные клетки почек человека (например, клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., 1977, J. Gen. Virol., 36:59); клетки почки новорожденного хомяка (BHK, ATCC CCL-10); клетки Сертоли мыши (TM4, Mather, 1980, Biol. Reprod., 23:243-251); клетки карциномы шейки матки человека (HELA, ATCC CCL-2); клетки почки собаки (MDCK, ATCC CCL-34); клетки легкого человека (W138, ATCC CCL-75); клетки гепатомы человека (HEP-G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL-51); клетки печени крысы линии Buffalo (BRL 3A, ATCC CRL-1442); клетки TRI (Mather, 1982, Annals NY Acad. Sci., 383:44-68); клетки MCR 5; клетки FS4; клетки сетчатки PER-C6, клетки MDBK (NBL-1), клетки 911, клетки CRFK, клетки MDCK, клетки BeWo, клетки Chang, клетки Detroit 562, клетки HeLa 229, клетки HeLa S3, клетки Hep-2, клетки KB, клетки LS 180, клетки LS 174T, клетки NCI-H-548, клетки RPMI 2650, клетки SW-13, клетки T24, WI-28 VA13, клетки 2RA, клетки WISH, клетки BS-C-I, клетки LLC-MK2, клетки Clone M-3, клетки 1-10, клетки RAG, клетки TCMK-1, клетки Y-1, клетки LLC-PK1, клетки PK(15), клетки GH1, клетки GH3, клетки L2, клетки LLC-RC 256, клетки MH1C1, клетки XC, клетки MDOK, клетки VSW и клетки TH-I, B1, или их производные), клетки фибробластов из любой ткани или органа (включая без ограничения сердце, печень, почки, толстую кишку, кишечник, пищевод, желудок, нервную ткань (головного, спинного мозга), легкое, сосудистую ткань (артерию, вену, капилляр), лимфоидную ткань (лимфатическую железу, аденоид, миндалину, костный мозг и кровь), селезенку и фибробластные и фибробластоподобные клеточные линии (например, клетки TRG-2, клетки IMR-33, клетки Don, клетки GHK-21, клетки цитруллинемии, клетки Dempsey, клетки Detroit 551, клетки Detroit 510, клетки Detroit 525, клетки Detroit 529, клетки Detroit 532, клетки Detroit 539, клетки Detroit 548, клетки Detroit 573, клетки HEL 299, клетки IMR-90, клетки MRC-5, клетки WI-38, клетки WI-26, клетки MiCl1, клетки CV-1, клетки COS-1, клетки COS-3, клетки COS-7, клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587; VERO, ATCC CCL-81); клетки DBS-FrhL-2, клетки BALB/3T3, клетки F9, клетки SV-T2, клетки M-MSV-BALB/3T3, клетки K-BALB, клетки BLO-11, клетки NOR-10, клетки C3H/IOTI/2, клетки HSDM1C3, клетки KLN205, клетки McCoy, L-клетки мыши, клетки штамма 2071 (L-клетки мыши), клетки штамма L-M (L-клетки мыши), клетки L-MTK (L-клетки мыши), клоны NCTC 2472 и 2555, клетки SCC-PSA1, клетки Swiss/3T3, клетки индийского мунтжака, клетки SIRC, клетки CII и клетки Jensen, или их производные) или любой другой тип клеток, известный специалисту в данной области.
Применяемый в данном документе термин «белки клетки-хозяина» (HCP) включает белок, образованный из клетки-хозяина, и он может не иметь отношения к необходимому белку, представляющему интерес.Белки клетки-хозяина могут представлять собой производственную примесь, которая может быть образована в ходе способа производства, и она может включать три основные категории: производные клеточного субстрата, производные клеточной культуры и производные дальнейшего процесса. Примеси, образованные из клеточного субстрата, включают без ограничения белки, полученные из организма-хозяина, и нуклеиновую кислоту (геномную, векторную или общую ДНК клетки-хозяина). Примеси, полученные из клеточной культуры, включают без ограничения индукторы, антибиотики, сыворотку и другие компоненты среды. Образованные в ходе последующих стадий примеси включают без ограничения ферменты, химические и биохимические реагенты для обработки (например, бромистый цианоген, гуанидин, окисляющие и восстанавливающие средства), неорганические соли (например, тяжелых металлов, мышьяка, иона неметалла), растворители, носители, лиганды (например, моноклональные антитела) и другие выщелачиваемые продукты.
В некоторых иллюстративных вариантах осуществления белок клетки-хозяина может иметь pI в диапазоне от около 4,5 до около 9,0. В иллюстративном варианте осуществления pI может составлять около 4,5, около 5,0, около 5,5, около 5,6, около 5,7, около 5,8, около 5,9, около 6,0, около 6,1, около 6,2, около 6,3, около 6,4, около 6,5, около 6,6, около 6,7, около 6,8, около 6,9, около 7,0, около 7,1, около 7,2, около 7,3, около 7,4, около 7,5, около 7,6, около 7,7, около 7,8, около 7,9, около 8,0, около 8,1, около 8,2, около 8,3, около 8,4, около 8,5, около 8,6, около 8,7, около 8,8, около 8,9 или около 9,0.
Применяемый в данном документе термин «гидролизующее средство» относится к любому одному или комбинации большого числа различных средств, которые могут осуществлять расщепление белка. Неограничивающие примеры гидролизующих средств, которые могут осуществлять ферментативное расщепление, включают протеазу из Aspergillus saitoi, эластазу, субтилизин, протеазу XIII, пепсин, трипсин, Tryp-N, химотрипсин, аспергиллопепсин I, протеазу LysN (Lys-N), эндопротеазу LysC (Lys-C), эндопротеазу Asp-N (Asp-N), эндопротеазу Arg-C (Arg-C), эндопротеазу Glu-C (Glu-C) или наружный белок мембран T (OmpT), иммуноглобулин-расщепляющий фермент Streptococcus pyogenes (IdeS), термолизин, папаин, проназу, протеазу V8 или их биологически активные фрагменты или гомологи, или их комбинации. Неограничивающие примеры гидролизующие средства, которые могут осуществлять неферментативное расщепление, включают применение высокой температуры, микроволнового излучения, ультразвука, высокого давления, инфракрасного излучения, растворителей (неограничивающими примерами являются этанол и ацетонитрил), расщепление иммобилизованным ферментом (IMER), ферментов с иммобилизованными магнитными частицами и встроенных иммобилизованных ферментов. Недавний обзор, в котором обсуждаются доступные способы для расщепление белка, см. в Switzar et al., «Protein Digestion: An Overview of the Available Techniques and Recent Developments» (Linda Switzar, Martin Giera & Wilfried M. A. Niessen, Protein Digestion: An Overview of the Available Techniques and Recent Developments, 12 Journal of Proteome Research 1067-1077 (2013), полное содержание которых включено в настоящий документ). Один или комбинация гидролизующих средств может расщеплять пептидные связи в белке или полипептиде специфическим для последовательности образом, создавая предсказуемую коллекцию более коротких пептидов. Отношение гидролизующего средства к белку и время, необходимое для расщепления, могут быть соответствующим образом выбраны для получения оптимального расщепления белка. Если отношение фермента к субстрату является неприемлемо высоким, соответствующая высокая скорость расщепления не дает достаточно времени для анализа пептидов посредством масс-спектрометра, и последовательность покрытия будет нарушена. С другой стороны, при низком соотношении E/S потребуется длительное расщепление и, следовательно, длительное время сбора данных. Соотношение фермента и субстрата может составлять от около 1:0,5 до около 1:200. Применяемый в данном документе термин «расщепление» относится к гидролизу одного или более пептидных связей белка. Существует несколько подходов к проведению расщепления белка в биологическом образце с использованием подходящего гидролизующего средства, например, ферментативное расщепление или неферментативное расщепление. Один из широко распространенных способов расщепления белков в образце предполагает применение протеазы. Существует множество протеаз, и каждая из них имеет свои особенности в плане специфичности, эффективности и оптимальных условий расщепления. Протеазы относятся как к эндопептидазам, так и к экзопептидазам, которые классифицируются на основе способности протеазы расщеплять неконцевые или концевые аминокислоты в пептиде. В качестве альтернативы, протеазы также относятся к шести различным классам - аспарагиновая, глутаминовая и металлопротеаза, цистеиновая, сериновая и треониновая протеазы, которые классифицируются на основе механизма катализа. Термины «протеаза» и «пептидаза» применяются взаимозаменяемо для обозначения ферментов которые гидролизуют пептидные связи.
Термин «совместно с» указывает на то, что компоненты, композиция против VEGF по настоящему изобретению вместе с другим средством, таким как антитело к ANG2, могут быть объединены в единую композицию для одновременной доставки или могут быть объединены отдельно в две или более композиций (например, набор, включающий каждый компонент). Компоненты, вводимые совместно, можно вводить субъекту в другое время, чем когда вводится другой компонент; например, каждое введение можно проводить не одновременно (например, раздельно или последовательно) с интервалами в течение указанного периода. Отдельные компоненты, вводимые совместно, также можно вводить по существу одновременно (например, точно в одно и то же время или через клинически незначимый период) во время одного и того же сеанса введения. Кроме того, отдельные компоненты, вводимые совместно, можно вводить субъекту одним и тем же или другим путем, например, композиция афлиберцепта вместе с другим средством, таким как антитело к ANG2, где композиция афлиберцепта содержит около 15% его вариантов или меньше.
Применяемый в данном документе термин «жидкостная хроматография» относится к процессу, в котором биологическая/химическая смесь, переносимая жидкостью, может быть разделена на компоненты в результате дифференциального распределения компонентов, когда они протекают через (или в) неподвижную жидкую или твердую фазу. Неограничивающие примеры жидкостной хроматографии включают обращеннофазовую жидкостную хроматографию, ионообменную хроматографию, эксклюзионную хроматографию, аффинную хроматографию, хроматографию со смешанным режимом или гидрофобную хроматографию.
В контексте данного документа «аффинная хроматография» может включать разделения, включающие любой способ, посредством которого два вещества разделяются на основании их аффинности к хроматографическому материалу. Она может включать подвергание веществ воздействию колонки, содержащей подходящую аффинную хроматографическую среду. Неограничивающие примеры такой хроматографической среды включают без ограничения смолу с белком A, смолу с белком G, аффинные подложки, содержащие антиген, против которого была выработана связывающая молекула (например, антитело), белок, способный связываться с белком, представляющим интерес, и аффинные подложки, содержащие Fc-связывающий белок. В одном аспекте аффинная колонка может быть уравновешена подходящим буфером перед загрузкой образца. Примером подходящего буфера может быть буфер Tris/NaCl с pH от 7,0 до 8,0. Квалифицированный специалист может разработать подходящий буфер без излишней нагрузки. После этого уравновешивания образец может быть загружен в колонку. После загрузки колонки ее можно промыть один или более раз, с использованием, например, уравновешивающего буфера. Другие промывки, в том числе промывки с использованием различных буферов, можно применять перед элюированием колонки. Затем аффинную колонку можно элюировать с использованием подходящего элюирующего буфера. Примером подходящего элюирующего буфера может быть буфер уксусная кислота/NaCl, pH примерно от 2,0 до 3,5. Снова, квалифицированный специалист может разработать соответствующий элюирующий буфер без излишней нагрузки. Элюат можно контролировать с использованием способов, хорошо известных специалистам в данной области, включая УФ. Например, можно применять поглощение при 280 нм, особенно если образец, представляющий интерес, содержит ароматические кольца (например, белки с ароматическими аминокислотами, такие как триптофан).
В контексте данного документа «ионообменная хроматография» может относиться к разделениям, включая любой способ, посредством которого два вещества разделяются на основании разности их соответствующих ионных зарядов, либо на молекуле, представляющей интерес, и/или хроматографическом материале в целом, либо локально в специфических областях молекулы, представляющей интерес, и/или хроматографического материала, и таким образом, можно применять либо катионообменный материал, либо анионообменный материал. Ионообменная хроматография обеспечивает разделение молекул на основе различий между локальными зарядами молекул, представляющих интерес, и локальными зарядами хроматографического материала. Упакованная ионообменная хроматографическая колонка или ионообменное мембранное устройство может работать в режиме связывания-элюирования, режиме проточной фракции или гибридном режиме. После промывки колонки или мембранного устройства буфером для уравновешивания или другим буфером, извлечение продукта может быть достигнуто за счет увеличения ионной силы (т.е. проводимости) буфера для элюирования, чтобы он мог конкурировать с растворенным веществом за заряженные участки ионообменной матрицы. Изменение pH и, следовательно, изменение заряда растворенного вещества может представлять собой другой способ достижения элюирования растворенного вещества. Изменение проводимости или pH может быть постепенным (градиентное элюирование) или ступенчатым (ступенчатое элюирование). Анионные или катионные заместители могут быть присоединены к матрицам в порядке получения анионных или катионных подложек для хроматографии. Неограничивающие примеры анионообменных заместителей включают диэтиламиноэтильную (DEAE), четвертичную аминоэтильную (QAE) и четвертичную аминогруппу (Q) группы. Катионные заместители включают карбоксиметил (CM), сульфоэтил (SE), сульфопропил (SP), фосфат (P) и сульфонат (S). Целлюлозные ионообменные среды или подложка могут включать DE23™, DE32™, DE52™, CM-23™, CM-32™, и CM-52™, доступные от Whatman Ltd. Maidstone, Kent, U.K. Также известны сшитые и полученные на основе SEPHADEX(ионообменные материалы. Например, DEAE-, QAE-, CM- и SP-SEPHADEX(и DEAE-, Q-, CM- и S-SEPHAROSE(и SEPHAROSE(Fast Flow, и Capto(S, все из которых доступны от GE Healthcare. Кроме того, сополимер этиленгликоля и метакрилата, производный как DEAE, так и CM, такой как TOYOPEARL(DEAE-650S или M и TOYOPEARL(CM-650S или M доступны от Toso Haas Co., Philadelphia, Pa., или Nuvia S и UNOSphere(S от BioRad, Hercules, Calif., Eshmuno(S от EMD Millipore, MA.
Применяемый в данном документе термин «смола для хроматографии с гидрофобным взаимодействием» могут включать твердую фазу, которая может быть ковалентно модифицирована фенилом, октилом, бутилом и т.п.В ней могут применяться свойства гидрофобности для отделения молекул друг от друга. В данном типе хроматографии гидрофобные группы, такие как фенил, октил, гексил или бутил, могут образовывать стационарную фазу колонки. Молекулы, такие как белки, пептиды и т.п., проходят через колонку HIC (хроматография с гидрофобным взаимодействием), которая имеет одну или более гидрофобных областей на своей поверхности или имеет гидрофобные карманы и могут взаимодействовать с гидрофобными группами, составляющими стационарную фазу HIC. Примеры смол HIC или подложки включают фенил-сефарозу FF, капто-фенил (GE Healthcare, Упсала, Швеция), фенил 650-M (Tosoh Bioscience, Токио, Япония) и фенил Sartobind (Sartorius Corporation, Нью-Йорк, США).
Применяемый в данном документе термин «хроматография со смешанным режимом» или «многомодальная хроматография» (сокращение для обеих «MMC») включает способ хроматографии, в котором растворенные вещества взаимодействуют со стационарной фазой посредством более чем одного режима или механизма взаимодействия. MMC можно применять в качестве альтернативного или комплементарного инструмента к традиционной обращеннонофазовой (RP), ионообменной (IEX) и нормальнофазовой хроматографии (NP). В отличие от хроматографии RP, NP и IEX, в которых гидрофобное взаимодействие, гидрофильное взаимодействие и ионное взаимодействие, соответственно, являются доминирующими режимом взаимодействия, в хроматографии со смешанным режимом можно применять комбинацию двух или более данных режимов взаимодействия. Среда для хроматографии со смешанным режимом может обеспечивать уникальную селективность, которая не может быть воспроизведена посредством хроматографии с одним режимом. Хроматография со смешанным режимом также может обеспечивать потенциальную экономию затрат, более длительный срок службы колонки и гибкость в эксплуатации по сравнению со способами на основе аффинности. В некоторых иллюстративных вариантах осуществления среда для хроматографии со смешанным режимом может состоять из лигандов смешанного типа, связанных с органической или неорганической подложкой, иногда обозначаемой как основная матрица, непосредственно или через спейсер. Подложка может быть в форме частиц, таких как по существу сферические частицы, монолит, фильтр, мембрана, поверхность, капилляры и т.д. В некоторых иллюстративных вариантах осуществления подложка может быть получена из природного полимера, такого как сшитый углеводный материал, такой как агароза, agPV, целлюлоза, декстран, хитозан, конжак, каррагинан, геллан, альгинат и т.д. Для получения высокой адсорбционной способности подложка может быть пористой, и лиганды затем присоединяются к внешним поверхностям, а также к поверхностям пор. Такие подложки из исходного полимера могут быть получены в соответствии со стандартными способами, такими как обратное гелеобразование суспензии (S Hjerten: Biochim Biophys Acta 79(2), 393-398 (1964), полное содержание которого включено в настоящий документ). В качестве альтернативы, подложка может быть получена из синтетического полимера, такого как сшитые синтетические полимеры, например, стирол или производные стирола, дивинилбензол, акриламиды, сложные эфиры акрилата, сложные эфиры метакрилата, сложные виниловые эфиры, виниламиды и т.п. Такие синтетические полимеры можно получать посредством стандартных способов, например, «Styrene based polymer supports developed by suspension polymerization» (R Arshady: Chimica e L′Industria 70(9), 70-75 (1988), полное содержание которой включено в настоящий документ). Пористые подложки из природного или синтетического полимера также доступны из коммерческих источников, таких как GE Healthcare, Упсала, Швеция.
Применяемый в данном документе термин «масс-спектрометр» включает устройство, способное идентифицировать конкретные виды молекул и точное измерение их масс.Подразумевается, что термин включает любой молекулярный детектор, посредством которого можно охарактеризовать полипептид или пептид. Масс-спектрометр может включать три основные части: источник ионов, масс-анализатор и детектор. Роль источника ионов заключается в образовании ионов газовой фазы. Атомы, молекулы или кластеры определяемого вещества могут переноситься в газовую фазу и ионизированы одновременно (как в ионизации электрораспылением) или посредством отдельных способов. Выбор источника ионов зависит от применения. В некоторых иллюстративных вариантах осуществления масс-спектрометр может представлять собой тандемный масс-спектрометр. Применяемый в данном документе термин «тандемная масс-спектрометрия» включает методику, в которой структурную информацию о молекулах образца получают посредством применения нескольких этапов массового отбора и разделения изотопов. Обязательным условием является преобразование молекул образца в газовую фазу и ионизацию таким образом, чтобы фрагменты формировались предсказуемым и управляемым способом после первой стадии массового отбора. Многостадийную МС/МС, или МСn, можно осуществлять посредством первого выбора и выделения иона прекурсора (МС2), его фрагментации, выделения первичного фрагментного иона (МС3), его фрагментация, выделение вторичного фрагмента (МС4), и так до тех пор, пока можно будет получить значимую информацию, или сигнал фрагментного иона поддается обнаружению. Тандемную МС успешно осуществляли с широким разнообразием комбинаций анализатора. Выбор анализатора для конкретного применения может определяться множеством различных факторов, таких как чувствительность, селективность и скорость, а также размер, стоимость и доступность. Две основные категории способов тандемной MS представляют собой тандемную в пространстве и тандемную во времени, но есть также гибриды, где тандемные во времени анализаторы соединены в пространстве или с тандемными в пространстве анализаторами. Тандемный в пространстве масс-спектрометр включает источник ионов, устройство активации ионов-прекурсоров и по меньшей мере два не захватывающих масс-анализатора. Конкретные функции разделения массы/заряда могут быть спроектированы таким образом, чтобы в одной секции прибора ионы выбирались, диссоциировали в промежуточной области, а ионы продукта затем передавались в другой анализатор для разделения массы/заряда и сбора данных. В тандемном во времени масс-спектрометре ионы, образующиеся в ионном источнике, могут быть захвачены, выделены, фрагментированы и разделены по массе/заряду в одном и том же физическом устройстве. Выявленные масс-спектрометром пептиды могут применяться в качестве суррогатных представителей интактного белка и их посттрансляционных модификаций. Их можно применять для характеристики белков посредством сопоставления экспериментальных и теоретических данных MS/MS, последние генерируются из возможных пептидов в базе данных последовательностей белков. Характеристика включает без ограничения секвенирование аминокислот фрагментов белка, определение секвенирования белка, определение секвенирования белка de novo, определение местоположения посттрансляционнных модификаций или определение посттрансляционных модификаций, или анализ сопоставимости, или их комбинации.
В контексте данного документа «Mini-Trap» или «MiniTrap» или «связывающая MiniTrap молекула» способен связываться с молекулой VEGF. Такие MiniTrap могут включать (i) химерные полипептиды, а также (ii) мультимерные (например, димерные) молекулы, содержащие два или более полипептидов, которые связываются нековалентно, например, посредством одного или более дисульфидных мостиков. MiniTrap могут быть получены посредством химической модификации, ферментативной активности или произведены рекомбинантно.
В контексте данного документа «VEGF MiniTrap» или «связывающая VEGF MiniTrap молекула» может представлять собой молекулу или комплекс молекул, которые связываются с VEGF и имеет один или несколько наборов Ig-подобных доменов рецептора VEGF (или их вариантов) (например, Ig-домен 2 VEGFR1 и/или Ig-домен 3 и/или 4 VEGFR2) и модифицированный или отсутствующий мультимеризующий компонент (MC), например, в котором MC представляет собой модифицированный иммуноглобулин Fc. Модификация может быть результатом протеолитического расщепления ловушки VEGF (например, афлиберцепта или конберцепта) или прямой экспрессии образующихся полипептидных цепей с укороченной последовательностью MC. (см. молекулярную структуру, изображенную на Фиг. 1.) Фиг. 1 представляет собой изображение молекулы VEGF MiniTrap, которая является продуктом протеолиза афлиберцепта с IdeS Streptococcus pyogenes. Изображена гомодимерная молекула, имеющая Ig-фрагмент шарнирного домена, соединенный двумя параллельными дисульфидными связями. Указаны домен VEGFR1, домен VEGFR2 и фрагмент шарнирного домена (MC). Точка в афлиберцепте, где происходит расщепление IdeS, обозначена знаком «//». Отщепленный от афлиберцепт фрагмент Fc также обозначен. Один такой химерный полипептид, который не димеризуется, также может представлять собой VEGF MiniTrap, если он обладает активностью связывания VEGF. Термин «VEGF MiniTrap» включает один полипептид, содержащий первый набор одного или более Ig-доменов рецептора VEGF (или его вариантов), без MC, но слитый с линкером (например, линкером пептида) с одним или несколькими дополнительными наборами из одного или более Ig-доменов рецептора VEGF (или его вариантов). Связывающие VEGF домены в VEGF MiniTrap по настоящему изобретению могут быть идентичными или отличаться от других (см. WO2005/00895, полное содержание которой включено в настоящий документ).
Например, в варианте осуществления настоящего изобретения немодифицированный Fc домен иммуноглобулина содержит аминокислотную последовательность или ее аминокислоты 1-226:
DKTHTCPX1CPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKX2TPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO.: 33; где X1 представляет собой L или P, а X2 представляет собой A или T)
Ингибирование VEGF включает, например, антагонизм VEGF, связывающегося с рецептором VEGF, например, посредством конкуренции с рецептором VEGF за связывание с VEGF (например, VEGF110, VEGF121 и/или VEGF165). Такое ингибирование может привести к ингибированию VEGF-опосредованной активации VEGFR, например, ингибирование экспрессии люциферазы в клеточной линии (например, HEK293), экспрессирующей химерный рецептор VEGF (например, его гомодимер), имеющий внеклеточные домены VEGFR, слитые с внутриклеточными доменами IL18R(и/или IL18R(на поверхности клетки, а также имеющий репортерный ген NFkB-люцифераза-IRES-eGFP, например, клеточная линия HEK293/D9/Flt-IL18Rα/Flt-IL18Rβ, как изложено в данном документе.
Компоненты Ig-домена рецептора VEGF из VEGF MiniTrap по настоящему изобретению могут включать
(i) один или более иммуноглобулин-подобных (Ig) доменов 2 VEGFR1 (Flt1) (R1D2),
(ii) один или более Ig-доменов 3 VEGFR2 (Flk1 или KDR) (Flk1D3) (R2D3),
(iii) один или более Ig-доменов 4 VEGFR2 (Flk1 или KDR) (Flk1D4) (R2D4) и/или
(iv) один или более Ig-доменов 3 VEGFR3 (Flt4) (Flt1D3 или R3D3).
Иммуноглобулин-подобные домены рецепторов VEGF могут называться в данном документе домены VEGFR “Ig”. Ig-домены VEGFR, упоминаемые в данном документе, например, R1D2 (которые могут называться в данном документе VEGFR1(d2)), R2D3 (которые могут называться в данном документе VEGFR2(d3)), R2D4 (которые могут называться в данном документе VEGFR2(d4)) и R3D3 (которые могут называться в данном документе VEGFR3(d3)) предназначены для охвата не только полного домена Ig дикого типа, но также его вариантов, которые по существу сохраняют функциональные характеристики домена дикого типа, например, сохраняют способность образовывать функционирующий домен связывания VEGF при включении в VEGF MiniTrap.Специалисту в данной области будет очевидно, что могут быть получены многочисленные варианты вышеуказанных Ig-доменов, которые сохранят по существу те же функциональные характеристики, что и домен дикого типа.
В настоящем изобретении представлен полипептид VEGF MiniTrap, содержащий следующую структуру домена:
((R1D2)-(R2D3))a-линкер-((R1D2)-(R2D3))b;
((R1D2)-(R2D3)-(R2D4))c-линкер-((R1D2)-(R2D3)-(R2D4))d;
((R1D2)-(R2D3))e-(MC)g;
((R1D2)-(R2D3)-(R2D4))f-(MC)g;
где
R1D2 представляет собой Ig-домен 2 (D2) рецептора VEGF 1 (VEGFR1);
R2D3 представляет собой Ig-домен 3 VEGFR2;
R2D4 представляет собой Ig-домен 4 VEGFR2;
MC представляет собой мультимеризующий компонент (например, шарнирный домен IgG или его фрагмент, например, из IgG1);
линкер представляет собой пептид, содержащий около 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 аминокислот, например, (GGGS)g (SEQ ID NO.: 104);
и,
независимо,
a=1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15;
b=1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15;
c=1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15;
d=1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15;
e=1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15;
f=1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15; и
g=1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15.
В одном варианте осуществления настоящего изобретения R1D2 содержит аминокислотную последовательность: SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIID (SEQ ID NO.: 34). В одном аспекте R1D2 не содержит N-концевой SDT.
В одном варианте осуществления настоящего изобретения R1D2 содержит аминокислотную последовательность: PFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQT (SEQ ID NO.: 35).
В одном варианте осуществления настоящего изобретения R2D3 содержит аминокислотную последовательность: VVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEK (SEQ ID NO.: 36).
В одном варианте осуществления настоящего изобретения R2D4 содержит аминокислотную последовательность: PFVAFGSGMESLVEATVGERVRIPAKYLGYPPPEIKWYKNGIPLESNHTIKAGHVLTIMEVSERDTGNYTVILTNPISKEKQSHVVSLVVYVPPGPG (SEQ ID NO.: 37).
В одном варианте осуществления настоящего изобретения R2D4 содержит аминокислотную последовательность: FVAFGSGMESLVEATVGERVRIPAKYLGYPPPEIKWYKNGIPLESNHTIKAGHVLTIMEVSERDTGNYTVILTNPIKSEKQSHVVSLVVYVP (SEQ ID NO.: 38).
В одном варианте осуществления настоящего изобретения мультимеризующий компонент (MC) для применения в VEGF MiniTrap представляет собой пептид, например, модифицированный Fc иммуноглобулин (например, из IgG1), который способен связываться с другим мультимеризующим компонентом. В одном аспекте MC представляет собой модифицированный Fc иммуноглобулин, который включает шарнирную область иммуноглобулина. Например, в одном варианте осуществления настоящего изобретения MC представляет собой пептид, содержащий один или более (например, 1, 2, 3, 4, 5 или 6) цистеинов, которые способны образовывать один или более цистеиновых мостиков с цистеинами в другом MC, например, DKTHTCPPC (SEQ ID NO.: 39), DKTHTCPPCPPC (SEQ ID NO.: 40), DKTHTCPPCPPCPPC (SEQ ID NO.: 41), DKTHTC(PPC)h, где h представляет собой 1, 2, 3, 4 или 5 (SEQ ID NO.: 105), DKTHTCPPCPAPELLG (SEQ ID NO.: 60), DKTHTCPLCPAPELLG (SEQ ID NO.: 43), DKTHTC (SEQ ID NO.: 44) или DKTHTCPLCPAP (SEQ ID NO.: 45).
В настоящем изобретении также представлен полипептид VEGF MiniTrap, имеющий следующую структуру домена:
(i) (R1D2)a-(R2D3)b-(MC)c; или
(ii) (R1D2)a-(R2D3)b-(R2D4)c-(MC)d;
который может быть гомодимеризован со вторым из указанных полипептидов, например, посредством связывания между MC каждого полипептида,
где
(i) указанные домены R1D2 согласуются;
(ii) указанные домены R2D3 согласуются; и/или
(iii) указанные домены R2D4 согласуются,
с образованием димерного VEGF-связывающего домена.
В одном варианте осуществления настоящего изобретения полипептид VEGF MiniTrap содержит следующую аминокислотную последовательность: SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPN36ITVTLKKFPLDTLIPDGKRIIWDSRKGFIISN68ATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLN123CTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKN196STFVRVHEKDKTHTCPPCPAPELLG (SEQ ID NO.: 46; MC подчеркнуто);
GRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHENLSVAFGSGMESLVEATVGERVRIPAKYLGYPPPEIKWYKNGIPLESNHTIKAGHVLTIMEVSERDTGNYTVILTNPISKEKQSHVVSLVVYVPPGPGDKTHTCPLCPAPELLG (SEQ ID NO.: 47; MC подчеркнуто);
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPN36ITVTLKKFPLDTLIPDGKRIIWDSRKGFIISN68ATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLN123CTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKN196STFVRVHEKDKTHTCPPC (SEQ ID NO.: 48; MC подчеркнуто);
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPN36ITVTLKKFPLDTLIPDGKRIIWDSRKGFIISN68ATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLN123CTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKN196STFVRVHEKDKTHTCPPCPPC (SEQ ID NO.: 49; MC подчеркнуто);
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPN36ITVTLKKFPLDTLIPDGKRIIWDSRKGFIISN68ATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLN123CTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKN196STFVRVHEKDKTHTCPPCPPCPPC (SEQ ID NO.: 50; MC подчеркнуто);
или SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEKDKTHTC-(PPC)x (MC подчеркнуто; где x составляет 1, 2, 3, 4 или 5) (SEQ ID NO.: 106).
Как уже обсуждалось, такие полипептиды могут быть мультимеризованы (например, димеризованы (например, гомодимеризованы)), причем связывание между полипептидами опосредовано мультимеризующими компонентами.
В одном варианте осуществления настоящего изобретения Ig-подобный домен 2 VEGFR1 мономерных VEGF MiniTrap по настоящему изобретению имеют N-связанное гликозилирование по N36 и/или N68; и/или внутрицепочечный дисульфидный мостик между C30 и C79; и/или Ig-подобный домен 3 VEGFR2 мономерных VEGF MiniTrap по настоящему изобретению имеют N-связанное гликозилирование по N123 и/или N196; и/или внутрицепочечный дисульфидный мостик между C124 и C185.
В одном варианте осуществления настоящего изобретения VEGF MiniTrap содержит следующую структуру:
(R1D2)1-(R2D3)1-(G4S)3-(R1D2)1-(R2D3)1 (“(G4S)3” раскрыта как SEQ ID NO.: 107);
(R1D2)1-(R2D3)1-(G4S)6-(R1D2)1-(R2D3)1 (“(G4S)6” раскрыта как SEQ ID NO.: 108);
(R1D2)1-(R2D3)1-(G4S)9-(R1D2)1-(R2D3)1 (“(G4S)9” раскрыта как SEQ ID NO.: 109); или
(R1D2)1-(R2D3)1-(G4S)12-(R1D2)1-(R2D3)1 (“(G4S)12” раскрыта как SEQ ID NO.: 110).
G4S представляет собой -Gly-Gly-Gly-Gly-Ser (SEQ ID NO.: 111)
В одном варианте осуществления настоящего изобретения VEGF MiniTrap содержит следующую аминокислотную последовательность:
(i)
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEKGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSSDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEK (SEQ ID NO.: 51; линкер подчеркнут);
(iii)
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEKGGGGSGGGGSGGGGSSDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEK (SEQ ID NO.: 52; линкер подчеркнут);
(iv)
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEKGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSSDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEK (SEQ ID NO.: 53; линкер подчеркнут)
(v)
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEKGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSSDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEK (SEQ ID NO.: 54; линкер подчеркнут);
или
(vi)

(где x составляет 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15). Как обсуждается в данном документе, данные полипептиды могут содержать вторичную структуру, в которой подобные домены Ig VEGFR связаны с образованием внутрицепочечного VEGF-связывающего домена (например, Фиг. 2). В одном варианте осуществления настоящего изобретения два или более таких полипептидов мультимеризуются (например, димеризуются (например, гомодимеризуются)), причем Ig-домены VEGFR каждой цепочки, связываются с подобными Ig-доменами другой цепи с образованием межцепочечного связывающего-VEGF домена.
В определенных вариантах осуществления настоящего изобретения VEGF MiniTrap по настоящему изобретению не содержит какой-либо значительной модификации аминокислотных остатков полипептида VEGF MiniTrap (например, направленная химическая модификация, такая как пегилирование или йодацетамидирование, например, на N- и/или C-конце).
В одном варианте осуществления настоящего изобретения полипептид содержит вторичную структуру, в которой Ig-домены VEGFR в одном химерном полипептиде (например, (R1D2)a-(R2D3)b-линкер-(R1D2)c-(R2D3)d; или (R1D2)a-(R2D3)b-(R2D4)c-линкер-(R1D2)d-(R2D3)e-(R2D4)f) или в отдельных химерных полипептидах (например, гомодимерах) координируют с образованием связывающего VEGF домена. Например, в котором
(i) указанные домены R1D2 согласуются;
(ii) указанные домены R2D3 согласуются; и/или
(iii) указанные домены R2D4 согласуются,
с образованием VEGF-связывающего домена. На Фиг. 2 представляет собой описание одноцепочечного VEGF MiniTrap, изображающее такое согласование домена. VEGFR1, VEGFR2 и линкерные домены указаны. Показанный линкер представляет собой (G4S)6(SEQ ID NO.: 108). Настоящее изобретение включает одноцепочечные VEGF MiniTrap с линкером (G4S)3 (SEQ ID NO.: 107); (G4S)9 (SEQ ID NO.: 109) или (G4S)12 (SEQ ID NO.: 110).
Кроме того, в настоящем изобретении также представлен комплекс, содержащий VEGF MiniTrap, как обсуждается в данном документе, связанный в комплекс с полипептидом VEGF или его фрагментом или слиянием. В одном варианте осуществления настоящего изобретения VEGF (например, VEGF165) гомодимеризован и/или VEGF MiniTrap гомодимеризован в комплекс 2:2 (2 VEGF:2 MiniTrap) и/или VEGF MiniTrap гомодимеризован в комплекс 1:1. Комплексы могут включать гомодимеризованные молекулы VEGF, связанные с гомодимеризованными полипептидами VEGF MiniTrap.В одном варианте осуществления настоящего изобретения комплекс представлен in vitro (например, иммобилизован на твердой подложке) или находится в организме субъекта. Настоящее изобретение также включает композицию комплексов димера VEGF (например, VEGF165), связанного в комплекс с VEGF MiniTrap.
Применяемый в данном документе термин «белок» или «белок, представляющий интерес» могут включать любой аминокислотный полимер с ковалентно связанными амидными связями. Примеры белков, представляющих интерес, включают без ограничения афлиберцепт и MiniTrap.Белки содержат одну или более аминокислотных полимерных цепочек, широко известных в данной области как «полипептиды». «Полипептид» относится к полимеру, состоящему из аминокислотных остатков, соответствующих встречающихся в природе структурных вариантов и их синтетических не встречающихся в природе аналогов, связанных посредством пептидных связей. «Синтетический пептид или полипептид» относится к не встречающемуся в природе пептиду или полипептиду. Синтетические пептиды или полипептиды могут быть синтезированы, например, с использованием автоматического синтезатора полипептидов. Специалисту в данной области известны различные способы твердофазного пептидного синтеза. Белок может содержать один или несколько полипептидов с образованием единственной функционирующей биомолекулы. В другом иллюстративном аспекте белок может включать фрагменты антитела, нанотела, химеры рекомбинантного антитела, цитокины, хемокины, пептидные гормоны и т.п. Белки, представляющие интерес, могут включать любой из биотерапевтических белков, рекомбинантных белков, применяемых в исследованиях или терапии, белков-ловушек и других Fc-слитых белков химерного рецептора, химерных белков, антител, моноклональных антител, поликлональных антител, человеческих антител и биспецифических антитела. В конкретном аспекте белок, представляющий интерес, представляет собой слитый белок против VEGF (например, афлиберцепт или MiniTrap). Белки могут быть получены с использованием систем продуцирования на основе рекомбинантных клеток, таких как система бакуловирусов насекомых, системы дрожжей (например, Pichia sp.) и системы млекопитающих (например, CHO-клетки и производные CHO-клеток, такие как CHO-K1-клетки). Недавний обзор биотерапевтических белков и их получения см. в Ghaderi et al., «Production platforms for biotherapeutic glycoproteins. Occurrence, impact, and challenges of non-human sialylation (Darius Ghaderi et al., Production platforms for biotherapeutic glycoproteins. Occurrence, impact, and challenges of non-human sialylation, 28 BIOTECHNOLOGY AND GENETIC ENGINEERING REVIEWS 147-176 (2012), полное содержание которых включено в настоящий документ). В некоторых иллюстративных вариантах осуществления белки содержат модификации, аддукты и другие ковалентно связанные фрагменты. Данные модификации, аддукты и фрагменты включают, например, авидин, стрептавидин, биотин, гликаны (например, N-ацетилгалактозамин, галактозу, нейраминовую кислоту, N-ацетилглюкозамин, фукозу, маннозу и другие моносахариды), PEG, полигистидин, FLAGtag, мальтоза-связывающий белок (MBP), хитин-связывающий белок (CBP), глутатион-S-трансферазу (GST) myc-эпитоп, флуоресцентные метки и другие красители и т.п. Белки могут быть классифицированы на основании композиций и растворимости и, таким образом, могут включать простые белки, такие как глобулярные белки и фибриллярные белки; конъюгированные белки, такие как нуклеопротеины, гликопротеины, мукопротеины, хромопротеины, фосфопротеины, металлопротеины и липопротеины; и производные белки, такие как первичные производные белки и вторичные производные белки.
В некоторых иллюстративных вариантах осуществления белок, представляющий интерес, может представлять собой рекомбинантный белок, антитело, биспецифическое антитело, мультиспецифическое антитело, фрагмент антитела, моноклональное антитело, слитый белок, scFv и их комбинации.
Применяемый в данном документе термин “рекомбинантный белок” относится к белку, полученному в результате транскрипции и трансляции гена, содержащегося в рекомбинантном векторе экспрессии, который был внедрен в подходящую клетку-хозяина. В определенных иллюстративных вариантах осуществления рекомбинантный белок может представлять собой слитый белок. В конкретном аспекте рекомбинантный белок представляет собой слитый белок против VEGF (например, афлиберцепт или MiniTrap). В определенных иллюстративных вариантах осуществления рекомбинантный белок может представлять собой антитело, например, химерное, гуманизированное или полностью человеческое антитело. В определенных иллюстративных вариантах осуществления рекомбинантный белок может представлять собой антитело изотипа, выбранного из группы, состоящей из IgG, IgM, IgA1, IgA2, IgD или IgE. В определенных иллюстративных вариантах осуществления молекула антитела представляет собой полноразмерное антитело (например, IgG1) или, в качестве альтернативы, антитело может представлять собой фрагмент (например, фрагмент Fc или фрагмент Fab).
Применяемый в данном документе термин "антитело", включает молекулы иммуноглобулина, содержащие четыре полипептидные цепи, две тяжелые цепи (H) и две легкие цепи (L), связанные между собой дисульфидными связями, а также их мультимеры (например, IgM). Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легка цепь содержит вариабельную область легкой цепи (сокращенно обозначаемую в данном документе как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен (CL1). VH- и VL-области могут быть дополнительно подразделены на области гипервариабельности, называемые областями, определяющими комплементарность (CDR), с вкраплениями более консервативных областей, называемых каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. В различных вариантах осуществления настоящего изобретения FR антитела против big-ET-1 (или его антигенсвязывающей части) могут быть идентичны последовательностям зародышевой линии человека или могут быть модифицированы естественным или искусственным путем. Аминокислотная консенсусная последовательность может быть определена на основе параллельного анализа двух или более CDR. Применяемый в данном документе термин «антитело» также включает антигенсвязывающие фрагменты молекул полного антитела. Термины «антигенсвязывающая часть» антитела, «антигенсвязывающий фрагмент» антитела и т.п., используемые в данном документе, включают любой встречающийся в природе, ферментативно получаемый, синтетический или генетически сконструированный полипептид или гликопротеин, который специфично связывает антиген с образованием комплекса. Антигенсвязывающие фрагменты антитела могут быть получены, например, из молекул полного антитела с использованием любых подходящих стандартных методик, таких как протеолитическое расщепление или методики рекомбинантной генной инженерии, включающие манипулирование и экспрессию ДНК, кодирующей вариабельные и необязательно константные домены антитела. Такая ДНК известна и/или легко доступна, например, из коммерческих источников, библиотек ДНК (включая, например, фаговые библиотеки антител), или может быть синтезирована. ДНК может быть секвенирована и обработана химически или с использованием методов молекулярной биологии, например, для размещения одного или нескольких вариабельных и/или константных доменов в подходящей конфигурации или для введения кодонов, создания цистеиновых остатков, модификации, добавления или удаления аминокислот и т.д.
Используемый в данном документе термин «фрагмент антитела» включает часть интактного антитела, такую как, например, антигенсвязывающая или вариабельная область антитела. Примеры фрагментов антител включают, но не ограничиваются ими, фрагмент Fab, фрагмент Fab', фрагмент F(ab')2, фрагмент scFv, фрагмент Fv, диатело dsFv, фрагмент dAb, фрагмент Fd', фрагмент Fd и область выделенной области, определяющей комплементарность (CDR), а также триатела, тетратела, линейные антитела, одноцепочечные молекулы антител и мультиспецифичные антитела, образованные из фрагментов антител. Фрагменты Fv представляют собой комбинацию вариабельных областей тяжелой и легкой цепей иммуноглобулина, а ScFv-белки представляют собой рекомбинантные одноцепочечные полипептидные молекулы, в которых вариабельные области легкой и тяжелой цепей иммуноглобулина соединены пептидным линкером. В некоторых иллюстративных вариантах осуществления фрагмент антитела содержит достаточную аминокислотную последовательность исходного антитела, к которому относится данный фрагмент, который связывается с тем же антигеном, что и исходное антитело; в некоторых иллюстративных вариантах осуществления фрагмент связывается с антигеном с сопоставимой аффинностью, подобной аффинности исходного антитела и/или конкурирует с исходным антителом за связывание с антигеном. Фрагмент антитела можно получить любым способом. Например, фрагмент антитела может быть получен ферментативным или химическим путем с помощью фрагментации интактного антитела и/или он может быть получен рекомбинантным путем из гена, кодирующего частичную последовательность антитела. Альтернативно или дополнительно фрагмент антитела может быть полностью или частично получен синтетическим путем. Фрагмент антитела может необязательно содержать одноцепочечный фрагмент антитела. Альтернативно или дополнительно фрагмент антитела может содержать несколько цепей, которые связаны вместе, например, дисульфидными связями. Фрагмент антитела может необязательно содержать многомолекулярный комплекс.Функциональный фрагмент антитела обычно содержит по меньшей мере около 50 аминокислот и более типично содержит по меньшей мере около 200 аминокислот.
Термин «биспецифическое антитело» включает антитело, способное селективно связывать два или более эпитопа. Биспецифические антитела обычно включают две разные тяжелые цепи, каждая из которых специфически связывается с разными эпитопами - либо с двумя разными молекулами (например, антигенами) или с той же молекулой (например, на том же антигене). Если биспецифическое антитело способно селективно связывать два разных эпитопа (первый эпитоп и второй эпитоп), аффинность первой тяжелой цепи к первому эпитопу, как правило, будет на один-два, три или четыре порядка ниже, чем сродство первой тяжелой цепи ко второму эпитопу, и vice versa. Эпитопы, распознаваемые биспецифическим антителом, могут находиться на одной или другой мишени (например, на том же или другом белке). Биспецифические антитела могут быть получены, например, посредством объединения тяжелых цепей, распознающих разные эпитопы одного и того же антигена. Например, последовательности нуклеиновых кислот, кодирующие вариабельные последовательности тяжелой цепи, которые распознают различные эпитопы на том же антигене, могут быть слиты с последовательностями нуклеиновых кислот, кодирующими различные константные области тяжелой цепи, и такие последовательности могут экспрессироваться в клетке, которая экспрессирует легкую цепь иммуноглобулина.
Типичное биспецифическое антитело имеет две тяжелые цепи, каждая из которых имеет три CDR тяжелой цепи, за которыми следуют домен CH1, шарнирная область, домен CH2, домен CH3 и легкая цепь иммуноглобулина, которая либо не придает антигенсвязывающей специфичности, но может связываться с каждой тяжелой цепью, либо которые могут связываться с каждой тяжелой цепью, и которые могут связывать один или несколько эпитопов, связанных антигенсвязывающими областями тяжелой цепи, или которые могут связываться с каждой тяжелой цепью и обеспечивать связывание одной или обеих тяжелых цепей с одним или обоими эпитопами. BsAb можно разделить на два основных класса: те, которые содержат Fc-область (IgG-подобную), и те, которые не имеют Fc-области, причем последняя обычно меньше, чем IgG и IgG-подобные биспецифические молекулы, содержащие Fc. IgG-подобные bsAbs могут иметь разные форматы, такие как, помимо прочего, триомаб, выступы в отверстиях IgG (kih IgG), crossMab, orth-Fab IgG, двойные вариабельные домены Ig (DVD-Ig), Fab два-в-одном или двойного действия (DAF), IgG-одноцепочечный Fv (IgG-scFv) или κλ-тельца. Не являющиеся IgG-подобными различные форматы включают тандемные scFv, формат диатела, одноцепочечное диатело, тандемные диатела (TandAb), молекулу с ретаргетингом с двойной аффинностью (DART), DART-Fc, нанотела или антитела, продуцируемые посредством способа dock-and-lock (DNL) (Gaowei Fan, Zujian Wang & Mingju Hao, Bispecific antibodies and their applications, 8 JOURNAL OF HEMATOLOGY & ONCOLOGY 130; Dafne Müller & Roland E. Kontermann, Bispecific Antibodies, HANDBOOK OF THERAPEUTIC ANTIBODIES 265-310 (2014), полное содержание которых включено в настоящий документ). Способы получения bsAb не ограничиваются квадромной технологией, основанной на соматическом слиянии двух разных клеточных линий гибридомы, химической конъюгации, которая включает химические перекрестные линкеры, и генетическими подходами, в которых применяется технология рекомбинантной ДНК. Примеры bsAb включают раскрытые в следующих патентных заявках, которые включены в настоящий документ посредством ссылки: США №12/823838, подана 25 июня 2010 г.; США №13/488628, подана 5 июня 2012 г.; США №14/031075, подана 19 сентября 2013 г.; США №14/808171, подана 24 июля 2015 г.; США №15/713574, подана 22 сентября 2017 г.; США №15/713569, подана 22 сентября 2017 г.; США №15/386453, подана 21 декабря 2016 г.; США №15/386443, подана 21 декабря 2016 г.; США №15/22343 подана 29 июля 2016 г.; США №15814095, подана 15 ноября 2017 г.Низкие уровни примесей гомодимера могут присутствовать на нескольких этапах производства биспецифических антител. Обнаружение таких примесей гомодимеров может быть проблематичным при выполнении с использованием анализа неповрежденной массы вследствие низкого содержания примесей гомодимеров и совместной элюции данных примесей с основными видами при проведении с использованием обычного жидкостного хроматографического способа.
В контексте данного документа «мультиспецифическое антитело» относится к антителу со связывающей специфичностью по меньшей мере для двух различных антигенов. Несмотря на то, что такие молекулы обычно связывают только два антигена (т.е. биспецифические антитела, bsAb), антитела с дополнительной специфичностью, такие как триспецифические антитела и триспецифические KIH, также могут быть рассмотрены с использованием системы и способа, описанных в данном документе.
Применяемый в данном документе термин «моноклональное антитело» не ограничивается антителами, полученными с помощью гибридомной технологии. Моноклональное антитело может быть получено из одного клона, включая любой эукариотический, прокариотический или фаговый клон, посредством любых способов, доступных или известных в данной области. Моноклональные антитела, пригодные для использования в настоящем изобретении, могут быть получены с использованием широкого спектра методов, известных в данной области техники, включая использование технологий гибридомной, рекомбинантной и фаговой индикации или их комбинации.
В некоторых иллюстративных вариантах осуществления белок, представляющий интерес, может иметь pI в диапазоне от около 4,5 до около 9,0. В одном конкретном иллюстративном варианте осуществления pI может составлять около 4,5, около 5,0, около 5,5, около 5,6, около 5,7, около 5,8, около 5,9, около 6,0, около 6,1, около 6,2, около 6,3, около 6,4, около 6,5, около 6,6, около 6,7, около 6,8, около 6,9, около 7,0, около 7,1, около 7,2, около 7,3, около 7,4, около 7,5, около 7,6, около 7,7, около 7,8, около 7,9, около 8,0, около 8,1, около 8,2, около 8,3, около 8,4, около 8,5, около 8,6, около 8,7, около 8,8, около 8,9 или около 9,0. В некоторых иллюстративных вариантах осуществления в композициях может быть более одного типа белка, представляющего интерес.
В некоторых иллюстративных вариантах осуществления белок, представляющий интерес, может продуцироваться клеткой млекопитающего. Клетки млекопитающего могут быть человеческого происхождения или не человеческого происхождения, могут включать первичные эпителиальные клетки (например, кератиноциты, клетки эпителия шейки матки, клетки бронхиального эпителия, клетки эпителия трахеи, клетки эпителия почек и клетки эпителия сетчатки), устойчивые клеточные линии и их штаммы (например, 293 эмбриональные клетки почек, клетки BHK, HeLa клетки эпителия шейки матки и клетки сетчатки PER-C6, клетки MDBK (NBL-1), клетки 911, клетки CRFK, клетки MDCK, клетки CHO, клетки BeWo, клетки Chang, клетки Detroit 562, клетки HeLa 229, клетки HeLa S3, клетки Hep-2, клетки KB, клетки LS 180, клетки LS 174T, клетки NCI-H-548, клетки RPMI 2650, клетки SW-13, клетки T24, WI-28 VA13, клетки 2RA, клетки WISH, клетки BS-C-I, клетки LLC-MK2, клетки Clone M-3, клетки 1-10, клетки RAG, клетки TCMK-1, клетки Y-1, клетки LLC-PK1, клетки PK(15), клетки GH1, клетки GH3, клетки L2, клетки LLC-RC 256, клетки MH1C1, клетки XC, клетки MDOK, клетки VSW и клетки TH-I, клетки B1, клетки BSC-1, клетки RAf, RK-клетки, клетки PK-15 или их производные), клетки фибробластов из любой ткани или органа (включая без ограничения сердце, печень, почки, толстую кишку, кишечник, пищевод, желудок, нервную ткань (головного, спинного мозга), легкое, сосудистую ткань (артерию, вену, капилляр), лимфоидную ткань (лимфатическую железу, аденоид, миндалину, костный мозг и кровь), селезенку и фибробластные и фибробластоподобные клеточные линии (например, клетки CHO, клетки TRG-2, клетки IMR-33, клетки Don, клетки GHK-21, клетки цитруллинемии, клетки Dempsey, клетки Detroit 551, клетки Detroit 510, клетки Detroit 525, клетки Detroit 529, клетки Detroit 532, клетки Detroit 539, клетки Detroit 548, клетки Detroit 573, клетки HEL 299, клетки IMR-90, клетки MRC-5, клетки WI-38, клетки WI-26, клетки Midi, клетки CHO, клетки CV-1, клетки COS-1, клетки COS-3, клетки COS-7, клетки Vero, клетки DBS-FrhL-2, клетки BALB/3T3, клетки F9, клетки SV-T2, клетки M-MSV-BALB/3T3, клетки K-BALB, клетки BLO-11, клетки NOR-10, клетки C3H/IOTI/2, клетки HSDM1C3, клетки KLN205, клетки McCoy, L-клетки мыши, клетки штамма 2071 (L-клетки мыши), клетки штамма L-M (L-клетки мыши), клетки L-MTK' (L-клетки мыши), клоны NCTC 2472 и 2555, клетки SCC-PSA1, клетки Swiss/3T3, клетки индийского мунтжака, клетки SIRC, клетки Cn и клетки Jensen, Sp2/0, клетки NS0, NS1 или их производные).
Применяемый в данном документе термин «алкилирующее белок средство» относится к средству, применяемому для алкилирования определенных свободных аминокислотных остатков в белке. Неограничивающими примерами алкилирующих белок средств являются йодацетамид (IOA), хлорацетамид (CAA), акриламид (AA), N-этилмалеимид (NEM), метилметантиосульфонат (MMTS) и 4-винилпиридин или их комбинации.
В контексте данного документа «денатурация белка» может относиться к процессу, в котором трехмерная форма молекулы изменяется от его исходного состояния. Денатурация белка может осуществляться с использованием денатурирующего белок средства. Неограничивающие примеры денатурирующего белок средства включают тепло, высокий или низкий pH, восстанавливающие средства, такие как DTT (см. ниже) или воздействие хаотропных средств. В качестве денатурирующих белок средств можно применять несколько хаотропных средств. Хаотропные растворенные вещества повышают энтропию системы посредством препятствования внутримолекулярным взаимодействиям, опосредованным нековалентными силами, такими как водородные связи, ван-дер-ваальсовы силы и гидрофобные эффекты. Неограничивающие примеры хаотропных средств включают бутанол, этанол, хлорид гуанидина, перхлорат лития, ацетат лития, хлорид магния, фенол, пропанол, додецилсульфат натрия, тиомочевину, N-лаурилсаркозинат, мочевину и их соли.
Применяемый в данном документе термин «восстанавливающее белок средство» относится к средству, применяемому для восстановления дисульфидных мостиков в белке. Неограничивающими примерами восстанавливающих белок средств, применяемых для восстановления белка, являются дитиотреитол (DTT), β-меркаптоэтанол, реактив Эллмана, хлористоводородный гидроксиламин, цианоборгидрид натрия, трис(2-карбоксиэтил)гидрохлорид фосфина (TCEP-HCl) или их комбинаций.
Применяемый в данном документе термин «вариант» полипептида (например, Ig-домен VEGFR) относится к полипептиду, содержащему аминокислотную последовательность, которая на по меньшей мере около 70-99,9% (например, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5, 99,9%) идентична или подобна указанной или исходной аминокислотной последовательности белка, представляющего интерес.Сравнение последовательностей может быть выполнено, например, с использованием алгоритма BLAST, в котором параметры алгоритма выбраны для обеспечения наибольшего совпадения между соответствующими последовательностями по всей длине соответствующих контрольных последовательностей (например, ожидаемый порог: 10; размер слова: 3; максимальное количество совпадений в диапазоне запроса: 0; матрица BLOSUM 62; стоимость гэпа: наличие 11, расширение 1, условная композиционная корректировка матрицы замен). Варианты полипептида (например, Ig-домен VEGFR) также могут относится к полипептиду, содержащему указанную аминокислотную последовательность, за исключением одной или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10) мутаций, таких как, например, мутации с изменением смысла (например, консервативные замещения), несмысловые мутации, делеции или вставки. Следующие ссылки относятся к алгоритмам BLAST, часто применяемым для последовательного анализа: BLAST ALGORITHMS: Altschul et al. (2005) FEBS J. 272(20): 5101-5109; Altschul, S. F., et al., (1990) J. Mol. Biol. 215:403-410; Gish, W., et al., (1993) Nature Genet. 3:266-272; Madden, T. L., et al., (1996) Meth. Enzymol. 266:131-141; Altschul, S. F., et al., (1997) Nucleic Acids Res. 25:3389-3402; Zhang, J., et al., (1997) Genome Res. 7:649-656; Wootton, J. C., et al., (1993) Comput. Chem. 17:149-163; Hancock, J. M. et al., (1994) Comput. Appl. Biosci. 10:67-70; ALIGNMENT SCORING SYSTEMS: Dayhoff, M. O., et al., “A model of evolutionary change in proteins.” в Atlas of Protein Sequence and Structure, (1978) vol. 5, suppl. 3. M. O. Dayhoff (ed.), pp.345-352, Natl. Biomed. Res. Found., Washington, D.C.; Schwartz, R. M., et al., “Matrices for detecting distant relationships.” в Atlas of Protein Sequence and Structure, (1978) vol. 5, suppl. 3.'' M. O. Dayhoff (ed.), pp.353-358, Natl. Biomed. Res. Found., Washington, D.C.; Altschul, S. F., (1991) J. Mol. Biol. 219:555-565; States, D. J., et al., (1991) Methods 3:66-70; Henikoff, S., et al., (1992) Proc. Natl. Acad. Sci. USA 89:10915-10919; Altschul, S. F., et al., (1993) J. Mol. Evol. 36:290-300; ALIGNMENT STATISTICS: Karlin, S., et al., (1990) Proc. Natl. Acad. Sci. USA 87:2264-2268; Karlin, S., et al., (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877; Dembo, A., et al., (1994) Ann. Prob. 22:2022-2039; и Altschul, S. F. “Evaluating the statistical significance of multiple distinct local alignments.” в Theoretical and Computational Methods in Genome Research (S. Suhai, ed.), (1997) pp.1-14, Plenum, N.Y.; содержание которых включено в настоящий документ.
Некоторые варианты могут представлять собой ковалентные модификации, которым подвергаются полипептиды, либо в ходе (котрансляционная модификация), либо после (посттрансляционная модификация “PTM”) их рибосомного синтеза. PTM обычно вводятся специфическими ферментами или ферментными путями. Многие из них возникают в месте специфической характерной белковой последовательности (например, сигнатурной последовательности) внутри белкового каркаса. Было зарегистрировано несколько сотен PTM и данные модификации неизменно влияют на некоторые аспекты структуры или функции белка (Walsh, G. «Proteins» (2014) второе издание, опубликовано в Wiley and Sons, Ltd., ISBN: 9780470669853, содержание которого включено в настоящий документ). В определенных иллюстративных вариантах осуществления белковая композиция может содержать более одного типа белкового варианта белка, представляющего интерес.
Белковые варианты в случае афлиберцепта (и белки с одинаковыми структурными характеристиками афлиберцепта, например, одна или более областей тяжелой или легкой цепи афлиберцепта) могут включать без ограничения варианты окисления, которые могут образовываться вследствие окисления одного или более аминокислотных остатков, возникающих, например, на остатках гистидина, цистеина, метионина, триптофана, фенилаланина и/или тирозина; варианты дезамидирования, которые могут образовываться вследствие дезамидирования на остатках аспарагина и/или дезоксиглюкозонирования в остатках аргинина.
Относительно афлиберцепта (и белков с одинаковыми структурными характеристиками афлиберцепта, например, одна или более областей тяжелых или легкой цепи афлиберцепта) варианты окисления могут включать окисление остатков гистидина в His86, His110, His145, His209, His95, His19 и/или His203 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); окисление остатков триптофана в Trp58 и/или Trp138 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); окисление остатков тирозина в Tyr64 (или эквивалентных положениях на белках с одинаковыми определенными структурными характеристиками афлиберцепта); окисление остатков фенилаланина в Phe44 и/или Phe166 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); и/или окисление остатков метионина в Met10, Met20, Met163 и/или Met192 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта).
Относительно афлиберцепта (и белков с одинаковыми структурными характеристиками афлиберцепта, например, одной или более областей тяжелой или легкой цепи афлиберцепта) варианты дезамидирования могут включать дезамидирование остатка аспарагина в Asn84 и/или Asn99 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта).
Относительно афлиберцепта (и белков с одинаковыми структурными характеристиками афлиберцепта, например, одной или более областей тяжелой или легкой цепи афлиберцепта) вариант дезоксиглюкозонирования может включать 3-дезоксиглюкозонирование остатка аргинина в Arg5 (или эквивалентном положении остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта).
Белковые варианты могут включать как кислотные формы, так и основные формы. Кислые формы обычно представляют собой варианты, которые элюируются раньше, чем основной пик от CEX, или позже, чем основной пик от AEX, в то время как основные разновидности представляют собой варианты, которые элюируются позже, чем основной пик от CEX, или раньше, чем основной пик от AEX.
Применяемые в данном документе термины “кислотные формы”, “AS”, “кислотная область” и “AR” относятся к вариантам белка, которые характеризуются общим кислотным зарядом. Например, в препаратах рекомбинантного белка такие кислотные формы могут быть обнаружены посредством различных способов, таких как ионообменная, например, WCX-10 ВЭЖХ (слабая катионообменная хроматография) или IEF (изоэлектрическое фокусирование). Кислотные формы антитела могут включать варианты, варианты структуры и/или варианты фрагментации. Иллюстративные варианты могут включать без ограничения варианты дезамидирования, варианты афукозилирования, варианты окисления, метилглиоксальные (MGO) варианты, варианты гликации и варианты лимонной кислоты. Иллюстративные варианты структуры включают без ограничения варианты гликозилирование и варианты ацетонирования. Иллюстративные варианты фрагментации включают любые модифицированные формы белка из целевой молекулы вследствие диссоциации пептидной цепи, ферментативные и/или химические модификации, включая без ограничения фрагменты Fc и Fab, фрагменты без Fab, фрагменты без вариабельного домена тяжелой цепи, варианты C-концевого усечения, варианты с иссечением N-концевого Asp в легкой цепи, и варианты с N-концевым усечением легкой цепи. Другие варианты кислотных форм включают варианты, содержащие непарные дисульфиды, белки клетки-хозяина и нуклеиновые кислоты клетки-хозяина, хроматографические материалы и компоненты среды. Обычно кислотные формы элюируются раньше основного пика во время CEX или позже основного пика во время анализа AEX (см. Фиг. 16 и 17).
В определенных вариантах осуществления белковая композиция может содержать более одного типа варианта кислотных форм. Например, но не в качестве ограничения, общее количество кислотных форм можно разделить на категории на основе хроматографического времени удерживания появляющихся пиков. Другой пример, в котором общие кислотные формы могут быть классифицированы, может быть основан на типе варианта - варианты, варианты структуры или вариант фрагментации.
Термин “кислотные формы” или “AS” не относится к технологическим примесям. Термин «производственная примесь» в контексте данного документа относится к примесям, которые присутствуют в композиции, содержащей белок, но не происходят от самого белка. Технологические примеси включают без ограничения белки клетки-хозяина (HCP), нуклеиновые кислоты клетки-хозяина, хроматографические материалы и компоненты среды.
В одном иллюстративном варианте осуществления количество кислотных форм в композиции против VEGF по сравнению с белком, представляющим интерес, может составлять не более около 20%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, или 0,0% и варьирует в пределах одного или более из предыдущих. Примеры композиция против VEGF обсуждаются ниже в разделе III. В одном аспекте композиция против VEGF может содержать белок против VEGF, выбранный из группы, состоящей из афлиберцепта, рекомбинантного MiniTrap (примеры которых раскрыты в патенте США №7279159), scFv и других белков против VEGF. В предпочтительном аспекте рекомбинантный белок, представляющий интерес, представляет собой афлиберцепт.
Среди способов химического разложения, отвечающих за кислотные или основные формы, две наиболее часто наблюдаемые ковалентные модификации, происходящие в белках и пептидах, представляют собой дезаминирование и окисление. Метионин, цистеин, гистидин, триптофан и тирозин являются некоторыми аминокислотами, которые наиболее чувствительны к окислению: Met и Cys вследствие их атомов серы и His, Trp и Tyr вследствие их ароматических колец.
Применяемые в данном документе термины “окислительные формы”, “OS” или “вариант окисления” относится к вариантам белка, образованным посредством окисления. Такие окислительные формы также могут быть обнаружены посредством различных способов, таких как ионообменная, например, WCX-10 ВЭЖХ (слабая катионообменная хроматография), или IEF (изоэлектрическое фокусирование). Варианты окисления могут образовываться вследствие окисления, возникающего на остатках гистидина, цистеина, метионина, триптофана, фенилаланина и/или тирозина. В частности, относительно афлиберцепта (и белков с одинаковыми структурными характеристиками афлиберцепта, например, одна или более областей тяжелых или легкой цепи афлиберцепта) варианты окисления могут включать окисление остатков гистидина в His86, His110, His145, His209, His95, His19 и/или His203 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); окисление остатков триптофана в Trp58 и/или Trp138 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); окисление остатков тирозина в Tyr64 (или эквивалентных положениях на белках с одинаковыми определенными структурными характеристиками афлиберцепта); окисление остатков фенилаланина в Phe44 и/или Phe166 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); и/или окисление остатков метионина в Met10, Met 20, Met163 и/или Met192 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта).
В одном иллюстративном варианте осуществления количество окислительных форм в композиции против VEGF по сравнению с белком, представляющим интерес, может составлять не более около 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, или 0,0% и варьирует в пределах одного или более из предыдущих. Примеры композиция против VEGF обсуждаются ниже в разделе III. В одном аспекте композиция против VEGF может содержать белок против VEGF, выбранный из группы, состоящей из афлиберцепта, рекомбинантного MiniTrap (примеры которых раскрыты в патенте США №7279159), scFv и других белков против VEGF. В предпочтительном аспекте рекомбинантный белок, представляющий интерес, представляет собой афлиберцепт или MiniTrap.
Остатки цистеина могут подвергаться самопроизвольному окислению с образованием либо внутри-, либо межмолекулярных дисульфидных связей или мономолекулярных побочных продуктов, таких как сульфеновая кислота.
Гистидиновые остатки также очень чувствительны к окислению за счет реакции с их имидазольными кольцами, которые впоследствии могут генерировать дополнительные гидроксилы (Li, S, C Schoneich, and RT. Borchardt. 1995. Chemical Instability of Protein Pharmaceuticals: Mechanisms of Oxidation and Strategies for Stabilization. Biotechnol. Bioeng. 48:490-500, полное содержание которой включено в настоящий документ). Предложенные механизмы окисления гистидина выделены на фиг 2 и Фиг. 3. Подробные исследования механизмов доступны в Anal. Chem. 2014, 86, 4940-4948 и J. Pharm. Biomed. Anal. 21 (2000) 1093-1097, полное содержание которой включено в настоящий документ.
Окисление метионина может приводить к образованию сульфоксида метионина (Li, S, C Schoneich, and RT. Borchardt. 1995. Chemical Instability of Protein Pharmaceuticals: Mechanisms of Oxidation and Strategies for Stabilization. Biotechnol. Bioeng. 48:490-500). Различные возможные механизмы окисления метионина обсуждались в литературе (Brot, N., Weissbach, H. 1982. The biochemistry of methionine sulfoxide residues in proteins. Trends Biochem. Sci. 7: 137-139, полное содержание которой включено в настоящий документ).
Окисление триптофана может обеспечивать комплексную смесь продуктов. Первичными продуктами могут быть N-формилкинуренин и кинуренин вместе с продуктами моно-окисления, ди-окисления и/или продуктов три-окисления (Фиг. 4). Пептиды, несущие модификации окисленного Trp обычно показывают повышение массы на 4, 16, 32 и 48 Да, что соответствует образованию кинуренина (KYN), гидрокситриптофана (Wox1) и N-формилкинуренина/дигидрокситриптофана (NFK/Wox2, называемого также «дважды окисленный Trp»), тригидрокситриптофана (Wox3, называемого также «трижды окисленный Trp») и их комбинаций, таких как гидроксикинуренин (KYNox1,+20 Да). Окисление до гидрокситриптофана (Wox1) обсуждалось в литературе (Mass spectrometric identification of oxidative modifications of tryptophan residues in proteins: chemical artifact or post-translational modification? J. Am. Soc. Mass Spectrom. 2010 Jul; 21(7): 1114-1117, полное содержание которой включено в настоящий документ). Было обнаружено, что окисление триптофана, но не окисление метионина и гистидина, вызывают изменение цвета белковых продуктов (Characterization of the Degradation Products of a Color-Changed Monoclonal Antibody: Tryptophan-Derived Chromophores. dx.doi.org/10.1021/ac404218t | Anal. Chem. 2014, 86, 6850-6857). Подобно триптофану, окисление тирозина прежде всего обеспечивает 3,4-дигидроксифенилаланин (DOPA) и дитирозин (Li, S, C Schoneich, and RT. Borchardt. 1995. Chemical Instability of Protein Pharmaceuticals: Mechanisms of Oxidation and Strategies for Stabilization. Biotechnol. Bioeng. 48:490-500).
Применяемые в данном документе термины “основные формы”, “основная область” и “BR” относятся к вариантам белка, например, антителу или его антигенсвязывающей области, которые характеризуются общим основным зарядом относительно варианта первичного заряда, присутствующего в белке. Например, в препаратах рекомбинантного белка такие основные формы могут быть обнаружены посредством различных способов, таких как ионообменная, например, WCX-10 ВЭЖХ (слабая катионообменная хроматография) или IEF (изоэлектрическое фокусирование). Иллюстративные варианты могут включать без ограничения варианты лизина, изомеризацию аспарагиновой кислоты, образование сукцинимида на аспарагине, окисление метионина, амидирование, неполное образование дисульфидной связи, мутация от серина до аргинина, гликозилирование, фрагментация и агрегация. Обычно основные виды элюируются позже основного пика во время CEX или раньше, чем основной пик во время анализа AEX. (Chromatographic analysis of the acidic and basic species of recombinant monoclonal antibodies. MAbs. 2012 Sep 1; 4(5): 578-585. doi: 10,4161/mabs.21328, полное содержание которой включено в настоящий документ.)
В определенных вариантах осуществления белковая композиция может содержать более одного типа варианта основной формы. Например, но не в качестве ограничения, общие основные формы можно разделить на категории на основе хроматографического времени удерживания появляющихся пиков. Другой пример, в котором общие основные формы могут быть разделены, может быть основан на типе варианта - варианты, варианты структуры или вариант фрагментации.
Как обсуждается для кислотных форм, термин «основные формы» не включают технологические примеси, и основные формы могут быть результатом получения продукта (называемые в данном документе как «основные формы, полученные из препарата»), или результатом хранения (называемые в данном документе как «образованные вследствие хранения основные формы»).
В одном иллюстративном варианте осуществления количество основных форм в композиции против VEGF по сравнению с белком, представляющим интерес, может составлять не более около 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, или 0,0% и варьирует в пределах одного или более из предыдущих. Примеры композиция против VEGF обсуждаются ниже в разделе III. В одном аспекте композиция против VEGF может содержать белок против VEGF, выбранный из группы, состоящей из афлиберцепта, рекомбинантного MiniTrap (примеры которых раскрыты в патенте США №7279159), scFv и других белков против VEGF. В предпочтительном аспекте рекомбинантный белок, представляющий интерес, представляет собой афлиберцепт.
В контексте данного документа «матрица образца» или «биологический образец» могут быть получены на любой стадии биопроцесса, например, жидкость для культивирования клеток (CCF), жидкость для культивирования собранных клеток (HCCF), на любой стадии последующего процесса обработки, лекарственное вещество (DS) или лекарственный продукт (DP), содержащий конечный сформулированный продукт.В некоторых других конкретных иллюстративных вариантах осуществления биологический образец может быть выбран из любой стадии последующего процесса осветления, хроматографического получения, вирусной инактивации или фильтрации. В некоторых конкретных иллюстративных вариантах осуществления лекарственный продукт может быть выбран из произведенного лекарственного продукта в ходе клинических испытаний, транспортировки, хранения или обращения.
Применяемый в данном документе термин «субъект» относится к млекопитающему (например, крысе, мыши, кошке, собаке, корове, овце, лошади, козе, кролику), предпочтительно человеку, нуждающемуся в предупреждении и/или лечении рака или ангиогенного заболевания глаз. Субъект может иметь рак или ангиогенное заболевание глаз, или быть предрасположенным к развитию рака или ангиогенного заболевания глаз.
С точки зрения состава белка, термин «стабильный» в контексте данного документа относится к белку, представляющему интерес, в составе, способном сохранять приемлемый уровень химической структуры или биологической функции после хранения в иллюстративных условиях, определенных в данном документе. Состав может быть стабильным, даже если содержащийся в нем белок, представляющий интерес, не сохраняет 100% своей химической структуры или биологической функции после хранения в течение определенного времени. При определенных обстоятельствах поддержание около 90%, около 95%, около 96%, около 97%, около 98% или около 99% структуры или функции белка после хранения в течение определенного времени может рассматриваться как «стабильное».
Термин «лечить» или «лечение» относится к терапевтическим мерам, которые обращают вспять, стабилизируют или устраняют нежелательное заболевание или расстройство (например, ангиогенное заболевание глаз или рак), например, вызывая регресс, стабилизацию или устранение одного или более симптомов или признаков такого заболевания или расстройства в любой клинически измеряемой степени, например, в отношении ангиогенного заболевания глаз, вызывая снижение или поддержание показателя тяжести диабетической ретинопатии (DRSS), посредством улучшения или поддержания зрения (например, при наилучшей коррекции остроты зрения, например, при измерении увеличения букв ETDRS), увеличение или поддержание поля зрения и/или уменьшение или поддержание центральной толщины сетчатки и, в отношении рака, остановка или обращение вспять роста, выживаемости и/или метастазирования раковых клеток у субъекта. Обычно терапевтическая мера представляет собой введение одной или более доз терапевтически эффективного количества VEGF MiniTrap субъекту с заболеванием или расстройством.
Применяемый в данном документе термин «технология предшествующего процесса» в контексте получения белка относится к действиям, включающим получение и сбор белков из клеток в ходе или после клеточного культивирования белка, представляющего интерес.Применяемый в данном документе термин «клеточная культура» относится к способу образования и поддержания популяции клеток-хозяев, способных продуцировать рекомбинантный белок, представляющий интерес, а также способам и методикам оптимизации получения и сбора белка, представляющего интерес.Например, сразу после введения вектора экспрессии в соответствующую клетку-хозяина, клетка-хозяин может поддерживаться в условиях, подходящих для экспрессии соответствующих кодирующих нуклеотид последовательностей, и сбора и получения необходимого рекомбинантного белка.
При использовании методик культивирования клеток по настоящему изобретению белок, представляющий интерес, может быть продуцирован внутриклеточно, в периплазматическом пространстве или непосредственно секретирован в среду. В вариантах осуществления, в которых белок, представляющий интерес, продуцирован внутриклеточно, твердые остатки - либо клетки-хозяева, либо лизированные клетки (например, в результате гомогенизации) могут быть удалены посредством различных способов, включая без ограничения центрифугирование или ультрафильтрацию. Если белок, представляющий интерес, секретируется в среду, супернатанты из таких систем экспрессии могут быть сначала сконцентрированы с использованием коммерчески доступного фильтра белков, например, с использованием ультрафильтрационной установки Amicon(или Millipore Pellicon™. В одном аспекте белок, представляющий интерес, может быть собран посредством центрифугирования с последующей глубинной фильтрации, а затем аффинной хроматографии для захвата.
В контексте данного документа «антагонист VEGF» представляет собой любой белок или пептид, который связывается или взаимодействует с VEGF. Как правило, данное связывание или взаимодействие ингибирует связывание VEGF с его рецепторами (VEGFR1 и VEGFR2), и/или ингибирует биологические сигнальные пути и активность VEGF. Антагонисты VEGF включают молекулы, которые препятствуют взаимодействию между VEGF и природным рецептором VEGF, например, молекулами, которые связываются с VEGF или рецептором VEGF и предупреждают или иным образом препятствуют взаимодействию между VEGF и рецептором VEGF. Конкретные иллюстративные антагонисты VEGF включают антитела к VEGF (например, ранибизумаб [LUCENTIS®]), антитела к рецептору VEGF (например, антитела к VEGFR1, антитела к VEGFR2 и т.п.) и химерные молекулы на основе рецептора VEGF или VEGF-ингибирующие слитые белки (также называемые в данном документе «VEGF-Trap» или «VEGF MiniTrap»), такие как афлиберцепт, зив-афлиберцепт и белок, имеющий аминокислоту с SEQ ID NO.: 60. Другими примерами VEGF-Trap являются ALT-L9, M710, FYB203 и CHS-2020. Дополнительные примеры VEGF-Trap могут быть найдены в патентах США №7070959; 7306799; 7374757; 7374758; 7531173; 7608261; 5952199; 6100071; 6383486; 6897294 и 7771721, которые конкретно включены в настоящий документ посредством ссылки во всей своей полноте.
Химерные молекулы на основе рецептора VEGF включают химерные полипептиды, которые содержат два или более иммуноглобулин(Ig)-подобных домена рецептора VEGF, такого как VEGFR1 (также обозначаемый как Flt1) и/или VEGFR2 (также обозначаемый как Flk1 или KDR), и могут также содержать мультимеризующий домен (например, домен Fc, который обеспечивает мультимеризацию [например, димеризацию] двух или более химерных полипептидов). Иллюстративной химерной молекулой на основе рецептора VEGF является молекула, называемая VEGFR1R2-FcΔC1 (a) (также известная как афлиберцепт; продается под торговым названием EYLEA®). В определенных иллюстративных вариантах осуществления афлиберцепт содержит изложенную аминокислотную последовательность:
SDTGRPFVEMYSEIPEIIHMTEGRELVIPCRVTSPNITVTLKKFPLDTLIPDGKRIIWDSRKGFIISNATYKEIGLLTCEATVNGHLYKTNYLTHRQTNTIIDVVLSPSHGIELSVGEKLVLNCTARTELNVGIDFNWEYPSSKHQHKKLVNRDLKTQSGSEMKKFLSTLTIDGVTRSDQGLYTCAASSGLMTKKNSTFVRVHEKDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK. (SEQ ID NO.: 55)
В контексте данного документа “вирусная фильтрация” может включать фильтрацию с использованием подходящих фильтров, включая без ограничения Planova 20N™, 50 N или BioEx от Asahi Kasei Pharma, фильтры Viresolve(от EMD Millipore, ViroSart CPV от Sartorius, или фильтр Ultipor DV20 или DV50(от Pall Corporation. Обычному специалисту в данной области будет очевиден выбор подходящего фильтра для получения необходимых характеристик фильтрации.
II. Определение цвета
В контексте данного документа цвет, наблюдаемый в ходе получения рекомбинантного белка, конкретнее, белка против VEGF, может быть измерен посредством различных способов. Неограничивающие примеры включают применение йодного индекса цвета, индекса цвета по Хазену, индекса цвета по Гарднеру, индекса цвета по Ловибонду, индекса цвета по Сейболту, индекса цвета минерального масла, индекса цвета Европейской Фармакопеи, индекса цвета Фармакопеи США, CIE L*, a*, b* (или CIELAB), индекса цвета по Клетту, индекса цвета по Гессу-Ивсу, индекса пожелтения, индекса цвета ADMI и ASBC и индекса цвета пивоварения EBC. Подробное описание данных шкал можно найти в отчете о применении №3.9 e от Lange, полное содержание которого включено в настоящий документ.
Визуальное сопоставление цветов на основе Европейской фармакопеи (Ph Eur) (европейского эталона цветов, см. European Pharmacopoeia. Chapter 2.2.2. Degree of coloration of liquids. 8th ed. EP, полное содержание которой включено в настоящий документ) могут включать подготовку раствора с эталонным цветом, как описано в Ph. Eur. (EP 2.2.2. Degree of Coloration of Liquids 2) - получают три исходных раствора для красного (хлорид кобальта (II)), желтого (хлорид железа (III)) и синего (сульфат меди (II)) и 1% соляной кислоты, пять цветных эталонных растворов для желтого (Y), зеленовато-желтого (GY), коричневато-желтого (BY), коричневого (B) и красного (R) оттенков. С использованием данных пяти эталонных растворов по очереди готовят в общей сложности тридцать семь растворов с эталонным цветом (Y1-Y7, GY1-GY7, BY1-BY7, B1-B9 и R1-R7). Каждый эталонный раствор четко определен в цветовом пространстве CIE-Lab, например, по яркости, оттенку и цветности. Из семи стандартов желто-коричневый (стандарты BY) BY1 является самым темным стандартом, а BY7 - наименее темным. Соответствие данного образца образцу стандарта цвета BY обычно выполняется при рассеянном дневном свете. Композиции европейских стандартов желто-коричневого цвета описаны ниже в таблице 1.
Коричнево-желтый стандартный раствор 10,8 г/л FeCl3.6H2O, 6,0 г/л CoCl2.6H2O и 2,5 г/л CuSO4.5H2O
Испытание цвета жидкостей проводят посредством сравнения исследуемого раствора со стандартным цветовым раствором. Композиция стандартного цветового раствора выбрана в зависимости от оттенка и интенсивности цвета исследуемого раствора. Как правило, сравнение осуществляют в плоскодонных пробирках из бесцветного прозрачного нейтрального стекла, которые максимально соответствуют внутреннему диаметру и во всех остальных отношениях (например, пробирки диаметром около 12, 15, 16 или 25 мм). Например, сравнение может быть между 2 или 10 мл исследуемого раствора и стандартного цветового раствора. Глубина жидкостей, например, может составлять 15, 25, 40 или 50 мм. Цвет, присвоенный исследуемому раствору, не должен быть более интенсивным, чем стандартный цвет.Сравнение цветов обычно проводят при рассеянном свете (например, дневном свете) на белом фоне. Цвета можно сравнивать по вертикальной или горизонтальной оси пробирок.
В отличие от измерения цвета EP, монография USP 1061 Color - Instrumental Measurement ссылается на применение измерения цвета CIE L*, a*, b* (или CIELAB) для точной и объективной количественной оценки цветов. В Фармакопее США определено всего двадцать цветных эталонных растворов (обозначенных последовательно буквами от A до T). Цвет измеряемого образца автоматически коррелирует с цветовыми эталонными растворами. Это означает, что отображается эталонный цветовой раствор, ближайший к образцу (т.е., эталонный раствор с наименьшим цветовым отличием ΔE* от цвета образца). Значения ΔL*, Δa* и Δb* дают количественные различия между значениями L*, a* и b* образца и отображаемыми растворами в соответствии с USP. Система координат CIE L* a* b*, L* представляет степень светлоты цвета по шкале от 0 до 100, где 0 представляет собой самый темный, и 100 - самый светлый, a* представляет красноту или зеленоватость цвета (положительные значения a* представляют красный цвет, тогда как отрицательные значения a* представляют зеленый цвет), и b* представляет желтизну или голубизну образца, положительные значения b* представляют желтый цвет, а отрицательные значения b* представляют синий цвет.Отличие цвета от стандарта или исходного образца при оценке может быть представлено изменением отдельных цветовых компонентов ΔL*, Δa* и Δb*. Сложное изменение или различие в цвете можно рассчитать как простое евклидово расстояние в пространстве в соответствии с формулой 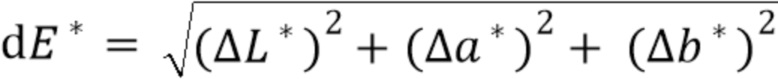 . Цветовые координаты CIE L*, a*, b* могут быть сгенерированы, например, с использованием Hunter Labs UltrascanPro (Hunter Associates Laboratory, Рестон, Вирджиния) или на BYK Gardner LCS IV (BYK-Gardner, Колумбия, Мэриленд). Для Hunter Labs UltraScan Pro можно выполнить испытание дидимиевого фильтра для калибровки длины волны. Прибор может быть стандартизирован в TTRAN с использованием вставки порта 0,780 дюйма и DIW перед использованием; таким образом устанавливая верхнее (L=100) и нижнее (L=0) значения фотометрической шкалы с использованием световой ловушки и черной карты. См. Pack et al., Modernization of Physical Appearance and Solution Color Tests Using Quantitative Tristimulus Colorimetry: Advantages, Harmonization, and Validation Strategies, J. Pharmaceutical Sci. 104: 3299-3313 (2015), полное содержание которой включено в настоящий документ.Цвет стандартов BY также может быть выражен в цветовом пространстве CIE L*, a*, b* (цветовое пространство «CIELAB» или «CIELab»). См. таблицу 2.
. Цветовые координаты CIE L*, a*, b* могут быть сгенерированы, например, с использованием Hunter Labs UltrascanPro (Hunter Associates Laboratory, Рестон, Вирджиния) или на BYK Gardner LCS IV (BYK-Gardner, Колумбия, Мэриленд). Для Hunter Labs UltraScan Pro можно выполнить испытание дидимиевого фильтра для калибровки длины волны. Прибор может быть стандартизирован в TTRAN с использованием вставки порта 0,780 дюйма и DIW перед использованием; таким образом устанавливая верхнее (L=100) и нижнее (L=0) значения фотометрической шкалы с использованием световой ловушки и черной карты. См. Pack et al., Modernization of Physical Appearance and Solution Color Tests Using Quantitative Tristimulus Colorimetry: Advantages, Harmonization, and Validation Strategies, J. Pharmaceutical Sci. 104: 3299-3313 (2015), полное содержание которой включено в настоящий документ.Цвет стандартов BY также может быть выражен в цветовом пространстве CIE L*, a*, b* (цветовое пространство «CIELAB» или «CIELab»). См. таблицу 2.
^ По сообщению Pack et al.
~ Измерено экспериментально в данном документе - значения L* и b* для каждого стандарта цвета BY.
Для обеспечения высокопроизводительного скрининга для анализа цвета, способ спектрофотометрического анализа (CIELAB) является более подходящим и количественным показателем, чем стандарты цвета BY. Суррогатный анализ был дополнительно оптимизирован, как описано в разделе «Примеры».
Для любого из образцов, оцениваемых по цвету, белок в образцах должен быть стандартизирован относительно белка в образце, например, 5 г/л, 10 г/л и т.п.для сравнения.
III. Композиции против VEGF
Существует по меньшей мере пять членов семейства белков VEGF, которые регулируют сигнальный путь VEGF: VEGF-A, VEGF-B, VEGF-C, VEGF-D и плацентарный фактор роста (PlGF). Композиции против VEGF могут содержать антагонист VEGF, который специфически взаимодействует с одним или более членами семейства белков VEGF и ингибирует одну или более его биологических активностей, например, его митогенную, ангиогенную и/или активность в отношении проницаемости сосудов.
В одном варианте осуществления способ получения белка против VEGF включает (a) обеспечение клетки-хозяина, генетически сконструированной для экспрессии белка против VEGF; (b) культивирование клетки-хозяина в ХОС в подходящих условиях, в которых клетка экспрессирует белок против VEGF; и (c) сбор препарата белка против VEGF, продуцированного клеткой. В одном аспекте белок против VEGF выбран из группы, состоящей из афлиберцепта, рекомбинантного MiniTrap (примеры которых раскрыты в патенте США №7279159), scFv и других белков против VEGF. В предпочтительном аспекте рекомбинантный белок, представляющий интерес, представляет собой афлиберцепт.
Авторы настоящего изобретения обнаружили, что производство белков против VEGF (например, афлиберцепта) в определенных ХОС обеспечивало биологический образец, имеющий отличающийся цвет.Разные цветовые свойства наблюдались на разных стадиях производства и даже в конечном составе, содержащем белок против VEGF. Как наблюдали в примере 9, для получения VEGF MiniTrap культивирование клеток в ХОС обеспечивало белок против VEGF (например, афлиберцепт) с интенсивным желто-коричневым цветом. Аффинность стадии захвата после сбора также обеспечивало элюат, имеющий определенный цвет - желто-коричневый цвет.Дальнейшие производственные стадии с использованием AEX также показали желто-коричневый цвет, но с меньшей интенсивностью.
В соответствии с более подробным описанием ниже, цвет можно оценивать с использованием (i) европейского эталона BY, в котором произведен качественный визуальный осмотр, или (ii) колориметрического анализа, CIELAB, который является более количественным, чем система BY. Тем не менее, в любом случае, оценка цвета между несколькими образцами была нормализована относительно концентрации белка с целью обеспечения содержательной оценки/сравнения. Например, относительно примера 9 ниже, в частности, таблицы 9-2, элюат белка A имеет значение «b*» около 2,52, что соответствует значению BY около BY5 (при измерении в концентрации белка 5 г/л в элюате белка A). Если цвет элюата белка A следует сравнивать с другим образцом, то сравнение следует выполнять с использованием той же концентрации белка. Таким образом, при сравнении элюата белка A с пулом AEX, который имеет значение ab* около 0,74 (при измерении с содержанием 5 г/л белка в элюате белка A), способ получения показывает существенное снижение желто-коричневого цвета образца от элюата белка A до пула AEX после хроматографии AEX.
Композиции по настоящему изобретению могут характеризоваться желто-коричневым цветом, как обсуждается в данном документе, например, не более темным/интенсивным, чем европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6 и/или имеющим значение b* 17-23, 10-17, 5-10, 3-5, или 1-3, причем композиция содержит около 5 г/л белка против VEGF или около 10 г/л белка против VEGF, и при этом композицию получают в виде образца из осветленного сбора или элюата белка A осветленного сбора.
В одном варианте осуществления композиции по настоящему изобретению, полученные с использованием ХОС обеспечивает получение биологического образца с отличающимся желто-коричневым цветом, причем образец может характеризоваться признанной стандартной цветовой характеристикой:
(i) не более желто-коричневый, чем европейский эталон цвета BY2;
(ii) не более желто-коричневый, чем европейский эталон цвета BY3;
(iii) не более желто-коричневый, чем европейский эталон цвета BY4;
(iv) не более желто-коричневый, чем европейский эталон цвета BY5;
(v) между значениями европейского эталона цвета BY2 и BY3;
(vi) между значениями европейского эталона цвета BY3 и BY4;
(vii) между значениями европейского эталона цвета BY4 и BY5, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF, и при этом композиция получена в виде образца из элюата белка A осветленного сбора.
В другом варианте осуществления композиции по настоящему изобретению, полученные с использованием A ХОС обеспечивает получение биологического образца с отличающимся желто-коричневым цветом, причем композиция характеризуется признанной стандартной цветовой характеристикой по шкале CIELAB:
(i) не более желто-коричневый, чем значение b* около 22-23;
(ii) не более желто-коричневый, чем значение b* около 16-17;
(iii) не более желто-коричневый, чем значение b* 9-10;
(iv) не более желто-коричневый, чем значение b* 4-5;
(v) не более желто-коричневый, чем значение b* 2-3;
(vi) значение b* от 17 до 23;
(vii) значение b* от 10 до 17;
(viii) значение b* от 5 до 10;
(ix) значение b* от 3 до 5; или
(x) значение b* от 1 до 3, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF, и при этом композиция получена в виде образца из элюата белка A осветленного сбора.
В одном варианте осуществления композиции по настоящему изобретению, полученные с использованием ХОС, могут содержать другие формы или варианты белка против VEGF. Данные варианты включают изоформы белка против VEGF, которые содержат один или более окисленных аминокислотных остатков, в общем называемых оксо-вариантами. Ферментативное расщепление таких композиций, содержащих белок против VEGF и его оксо-варианты, может включать одно или более из следующих:
EIGLLTC*EATVNGH*LYK (SEQ ID NO.: 18), которая содержит около 0,004-0,013% 2-оксо-гистидинов,
QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19), которая содержит около 0,006-0,028% 2-оксо-гистидинов,
TELNVGIDFNWEYPSSKH*QHK (SEQ ID NO.: 20), которая содержит около 0,049-0,085% 2-оксо-гистидинов,
DKTH*TC*PPC*PAPELLG (SEQ ID NO.: 17), которая содержит около 0,057-0,092% 2-оксо-гистидинов,
TNYLTH*R (SEQ ID NO.: 21), которая содержит около 0,008-0,022% 2-оксо-гистидинов, и/или
IIWDSR (SEQ ID NO.: 56), которая содержит около 0,185-0,298% диокисленного триптофана;
или
EIGLLTC*EATVNGH*LYK (SEQ ID NO.: 18), которая содержит около 0,008% 2-оксо-гистидинов,
QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19), которая содержит около 0,02% 2-оксо-гистидинов,
TELNVGIDFNWEYPSSKH*QHK (SEQ ID NO.: 20), которая содержит около 0,06% 2-оксо-гистидинов,
DKTH*TC*PPC*PAPELLG (SEQ ID NO.: 17), которая содержит около 0,07% 2-оксо-гистидинов,
TNYLTH*R (SEQ ID NO.: 21), которая содержит около 0,01% 2-оксо-гистидинов, и/или
IIWDSR (SEQ ID NO.: 56), которая содержит около 0,23% ди-оксо-триптофанов, где H* представляет собой гистидин, который может быть окислен до 2-оксо-гистидина, и где C* представляет собой цистеин, который может быть карбоксиметилирован. В конкретных вариантах осуществления белок против VEGF представляет собой афлиберцепт.В другом варианте осуществления белок против VEGF представляет собой VEGF MiniTrap.
В одном иллюстративном варианте осуществления настоящего изобретения композиции по настоящему изобретению могут содержать белок против VEGF, причем не более около 1%, не более около 0,1% или около 0,1-1%, 0,2-1%, 0,3-1%, 0,4-1%, 0,5-1%, 0,6-1%, 0,7-1%, 0,8-1% или 0,9-1% остатков гистидина белка против VEGF представляют собой 2-оксо-гистидин. В таких композициях может быть неоднородная популяция вариантов белка против VEGF, каждый из которых имеет переменное количество остатков 2-оксо-гистидина и неокисленных остатков гистидина. Таким образом, процентное содержание белка 2-оксо-гистидина против VEGF в композиции относится к сайт-специфическим 2-оксо-гистидинам среди молекул против VEGF, разделенному на общее количество сайт-специфических гистидинов в молекулах белка против VEGF (окисленный плюс не-окисленный), умноженное на 100. Одним из способов количественного определения уровня 2-оксо-гистидинов в композиции является расщепление полипептида протеазой (например, Lys-C и/или трипсином) и анализ количества 2-оксо-гистидинов в образовавшихся пептидах, например, посредством масс-спектрометрии (МС).
Перед расщеплением белка против VEGF сульфгидрильные группы цистеинов блокируются реакцией с йодацетамидом (IAM), в результате чего образуется остаток, представленный следующей химической структурой:
 .
.
Такая модификация защищает свободные тиолы от повторного образования дисульфидных мостиков и предотвращает расщепление дисульфидных связей. Настоящее изобретение включает композиции (например, водные композиции), содержащий белок против VEGF и его варианты, которые при модификации IAM и расщеплении протеазой (например, Lys-C и трипсином) и анализе посредством масс-спектрометрии содержат следующие пептиды:
EIGLLTC*EATVNGH*LYK (SEQ ID NO.: 18), которая содержит около 0,004-0,013% 2-оксо-гистидинов,
QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19), которая содержит около 0,006-0,028% 2-оксо-гистидинов,
TELNVGIDFNWEYPSSKH*QHK (SEQ ID NO.: 20), которая содержит около 0,049-0,085% 2-оксо-гистидинов,
DKTH*TC*PPC*PAPELLG (SEQ ID NO.: 17), которая содержит около 0,057-0,092% 2-оксо-гистидинов,
TNYLTH*R (SEQ ID NO.: 21), которая содержит около 0,008-0,022% 2-оксо-гистидинов, и/или
IIWDSR (SEQ ID NO.: 56), которая содержит около 0,185-0,298% диокисленного триптофана;
или
EIGLLTC*EATVNGH*LYK (SEQ ID NO.: 18), которая содержит около 0,008% 2-оксо-гистидинов,
QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19), которая содержит около 0,02% 2-оксо-гистидинов,
TELNVGIDFNWEYPSSKH*QHK (SEQ ID NO.: 20), которая содержит около 0,06% 2-оксо-гистидинов,
DKTH*TC*PPC*PAPELLG (SEQ ID NO.: 17), которая содержит около 0,07% 2-оксо-гистидинов,
TNYLTH*R (SEQ ID NO.: 21), которая содержит около 0,01% 2-оксо-гистидинов, и/или
IIWDSR (SEQ ID NO.: 56), которая содержит около 0,23% ди-оксо-триптофанов,
где H* представляет собой 2-оксо-гистидин, и где C* представляет собой карбоксиметилированный цистеин. В одном варианте осуществления настоящего изобретения пептиды дегликозилированы посредством PNG-азы F.
Настоящее изобретение включает композиции, содержащий белок против VEGF, причем около 0,1%-10% всех гистидинов белка против VEGF модифицированы до 2-оксо-гистидина. Кроме того, цвет композиции не более темный/интенсивный, чем, например, Европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6, или, в качестве альтернативы, имеющий значение b*, как охарактеризовано посредством CIE L*, a*, b*, от около 17-23, 10-17, 5-10, 3-5, или 1-3, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF. Композицию получают либо в виде образца из осветленного сбора, либо в виде элюата белка A из осветленного сбора. Такие композиции могут быть получены из осветленного сбора, если собранный материал подвергают процедуре хроматографии для захвата. В одном аспекте стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, аффинной колонки с белком A. Если аффинный образец анализируют с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более вариантов.
Настоящее изобретение включает композиции, содержащий белок против VEGF, причем около 0,1%-10% всех триптофанов белка против VEGF модифицированы до кинуренина. Кроме того, цвет композиции не более темный/интенсивный, чем Европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6 и/или с имеющий значение b*, как охарактеризовано посредством CIE L*, a*, b*, около 17-23, 10-17, 5-10, 3-5, или 1-3, причем композиция содержит около 5 г/л белка против VEGF или около 10 г/л белка против VEGF. Композицию получают в виде образца из осветленного сбора или элюата белка A из осветленного сбора. Такие композиции могут быть получены из осветленного сбора при подвергании процедуре хроматографии для захвата. Стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, аффинной колонки с белком A. Если аффинный образец анализируют с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов.
Настоящее изобретение включает композиции, содержащий белок против VEGF, причем около 0,1%-10% всех триптофанов белка против VEGF модифицированы до моно-гидроксилтриптофана. Кроме того, цвет композиции не более темный/интенсивный, чем Европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6 и/или с имеющий значение b*, как охарактеризовано посредством CIE L*, a*, b* от около 17-23, 10-17, 5-10, 3-5, или 1-3, причем композиция содержит около 5 г/л белка против VEGF или около 10 г/л белка против VEGF. Композицию получают в виде образца из осветленного сбора или элюата белка A из осветленного сбора. Такие композиции могут быть получены из осветленного сбора при подвергании процедуре хроматографии для захвата. Стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, аффинной колонки с белком A. Если образец, извлеченный на стадии аффинности, анализируют с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов.
Настоящее изобретение включает композиции, содержащий белок против VEGF, причем около 0,1%-10% всех триптофанов белка против VEGF модифицированы до ди-гидроксилтриптофана. Кроме того, цвет не более темный/интенсивный, чем Европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6 и/или с имеющий значение b*, как охарактеризовано посредством CIE L*, a*, b* от около 17-23, 10-17, 5-10, 3-5, или 1-3, причем композиция содержит около 5 г/л белка против VEGF или около 10 г/л белка против VEGF. Композицию получают в виде образца из осветленного сбора или элюата белка A из осветленного сбора. Такие композиции могут быть получены из осветленного сбора, полученного с использованием ХОС, содержащего белок против VEGF, а также его оксо-варианты, подвергнутые процедуре хроматографии для захвата. Стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, аффинной колонки с белком A. Если образец, извлеченный на стадии аффинности, анализируют с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов.
Настоящее изобретение включает композиции, содержащий белок против VEGF, причем около 0,1%-10% всех триптофанов белка против VEGF модифицированы до три-гидроксилтриптофана. Кроме того, цвет композиции не более темный/интенсивный, чем Европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6 и/или с имеющий значение b*, как охарактеризовано посредством CIE L*, a*, b* от около 17-23, 10-17, 5-10, 3-5, или 1-3, причем композиция содержит около 5 г/л белка против VEGF или около 10 г/л белка против VEGF. Композицию получают в виде образца из осветленного сбора или элюата белка A из осветленного сбора. Такие композиции могут быть получены с использованием хроматографии для захвата. Стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, аффинной колонки с белком A. Если образец, извлеченный на аффинности, анализируют с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов.
В одном варианте осуществления композиции по настоящему изобретению могут содержать белок против VEGF, причем белок против VEGF может характеризоваться модификациями одного или более остатков следующим образом: один или более аспарагинов дезамидированы; одна или более аспарагиновых кислот преобразованы в изо-аспартат и/или аспарагин; один или более метионинов окислены; один или более триптофанов преобразованы в N-формилкинуренин; один или более триптофанов представляют собой моно-гидроксилтриптофан; один или более триптофанов представляют собой ди-гидроксилтриптофан; один или более триптофанов представляют собой три-гидроксилтриптофан; один или более аргининов преобразованы в Arg 3-дезоксиглюкозон; C-концевой глицин отсутствует; и/или существует один или более негликозилированных гликосайтов.
Такие композиции могут быть получены из осветленного сбора, полученного с использованием ХОС, содержащего белок против VEGF, а также его варианты, подвергнутые, например, процедуре хроматографии для захвата. Стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, колонки с белком A. Если образец, извлеченный на стадии аффинности, анализируют, например, с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов.
В одном иллюстративном варианте осуществления композиции по настоящему изобретению могут содержать белок против VEGF, имеющий одинаковые структурные характеристики афлиберцепта, который может быть окислен на одном или более из следующего: His86, His110, His145, His209, His95, His19 и/или His203 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); Trp58 и/или Trp138 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); Tyr64 (или эквивалентных положениях на белках с одинаковыми определенными структурными характеристиками афлиберцепта); Phe44 и/или Phe166 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); и/или Met10, Met 20, Met163 и/или Met192 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта). Такие композиции могут быть получены из осветленного сбора с использованием ХОС, содержащего афлиберцепт, а также его оксо-варианты, подвергнутые процедуре хроматографии для захвата. Стадия захвата может представлять собой процедуру аффинной хроматографии с использованием, например, колонки с белком A. Если образец, извлеченный на стадии аффинности, анализируют, например, с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов.
В одном варианте осуществления композиции по настоящему изобретению могут содержать VEGF MiniTrap с аминокислотной последовательностью SEQ ID NO.: 46, который может быть окислен на His86, His110, His145, His209, His95, His19 и/или His203; Trp58 и/или Trp138; Tyr64; Phe44 и/или Phe166; и/или Met10, Met 20, Met163 и/или Met192. Такие композиции могут быть получены из осветленного сбора, полученного с использованием ХОС, содержащего VEGF MiniTrap, а также варианты, подвергнутые процедуре хроматографии для захвата. Стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, колонки с белком A - при анализе с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов.
В некоторых иллюстративных вариантах осуществления композиции по настоящему изобретению могут содержать белок против VEGF и его варианты (в том числе оксо-варианты), причем количество белковых вариантов в композиции может составлять не более около 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,0% и варьирует в пределах одного или более из предыдущих. Такие композиции могут быть получены из осветленного сбора, полученного с использованием ХОС, содержащего белок против VEGF, а также его варианты, подвергнутые процедуре хроматографии для захвата. Стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, колонки с белком A - при анализе с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов. В одном аспекте цвет такой композиции не темнее/интенсивнее, чем, например, европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6 и/или имеющий значение b*, характеризованное CIE L*, a*, b* от около 17-23, 10-17, 5-10, 3-5 или 1-3, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF.
В других иллюстративных вариантах осуществления композиции по настоящему изобретению может содержать белок против VEGF и его варианты, причем количество белковых вариантов в композиции может составлять от около 0% до около 20%, например, от около 0% до около 20%, от около 0,05% до около 20%, от около 0,1% до около 20%, от около 0,2% до около 20%, от около 0,3% до около 20%, от около 0,4% до около 20%, от около 0,5% до около 20%, от около 0,6% до около 20%, от около 0,7% до около 20%, от около 0,8% до около 20%, от около 0,9% до около 20%, от около 1% до около 20%, от около 1,5% до около 20%, от около 2% до около 20%, от около 3% до около 20%, от около 4% до около 20%, от около 5% до около 20%, от около 6% до около 20%, от около 7% до около 20%, от около 8% до около 20%, от около 9% до около 20%, от около 10% до около 20%, от около 0% до около 10%, от около 0,05% до около 10%, от около 0,1% до около 10%, от около 0,2% до около 10%, от около 0,3% до около 10%, от около 0,4% до около 10%, от около 0,5% до около 10%, от около 0,6% до около 10%, от около 0,7% до около 10%, от около 0,8% до около 10%, от около 0,9% до около 10%, от около 1% до около 10%, от около 1,5% до около 10%, от около 2% до около 10%, от около 3% до около 10%, от около 4% до около 10%, от около 5% до около 10%, от около 6% до около 10%, от около 7% до около 10%, от около 8% до около 10%, от около 9% до около 10%, от около 0% до около 7,5%, от около 0,05% до около 7,5%, от около 0,1% до около 7,5%, от около 0,2% до около 7,5%, от около 0,3% до около 7,5%, от около 0,4% до около 7,5%, от около 0,5% до около 7,5%, от около 0,6% до около 7,5%, от около 0,7% до около 7,5%, от около 0,8% до около 7,5%, от около 0,9% до около 7,5%, от около 1% до около 7,5%, от около 1,5% до около 7,5%, от около 2% до около 7,5%, от около 3% до около 7,5%, около 4% до около 7,5%, от около 5% до около 7,5%, от около 6% до около 7,5%, от около 7% до около 7,5%, от около 0% до около 5%, от около 0,05% до около 5%, от около 0,1% до около 5%, от около 0,2% до около 5%, от около 0,3% до около 5%, от около 0,4% до около 5%, от около 0,5% до около 5%, от около 0,6% до около 5%, от около 0,7% до около 5%, от около 0,8% до около 5%, от около 0,9% до около 5%, от около 1% до около 5%, от около 1,5% до около 5%, от около 2% до около 5%, от около 3% до около 5%, от около 4% до около 5% и варьирует в пределах одного или более из предыдущих. Такие композиции могут быть получены посредством хроматографии для захвата на собранном образце. Стадия захвата представляет собой процедуру аффинной хроматографии с использованием, например, колонки с белком A. Если образец анализируют с использованием жидкостной хроматографии- масс-спектрометрии (ЖХ-МС), могут быть обнаружены один или более данных вариантов. В одном аспекте цвет такой композиции не темнее/интенсивнее, чем, например, европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6 и/или имеющий значение b*, характеризованное CIE L*, a*, b* от около 17-23, 10-17, 5-10, 3-5 или 1-3, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF.
В одном варианте осуществления композиции по настоящему изобретению могут содержать белок против VEGF, в том числе его кислотные формы, причем количество кислотных форм в композиции может составлять около 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,0% и варьирует в пределах одного или более из предыдущих. Как обсуждалось выше, такие кислотные формы могут быть обнаружены посредством различных способов, такими как ионный обмен, например, WCX (WCX-10 ВЭЖХ, слабая катионообменная хроматография) или IEF (изоэлектрическое фокусирование). Обычно кислотные формы элюируются раньше основного пика во время CEX или позже основного пика во время анализа AEX (см. Фиг. 16 и Фиг. 17). Композиции, содержащие кислотные формы, могут быть получены из биологического материала, такого как сбор или полученный посредством аффинности материал с использованием ионообменной хроматографии.
В одном аспекте цвет такой композиции не темнее/интенсивнее, чем, например, европейский стандарт коричнево-желтого цвета BY2-BY3, BY3-BY4, BY4-BY5 или BY5-BY6 и/или имеющий значение b*, характеризованное CIE L*, a*, b* от около 17-23, 10-17, 5-10, 3-5 или 1-3, причем композиция содержит около 5 г/л или около 10 г/л. В качестве примера, ссылаясь на Фиг. 16 и Фиг. 17, фракции F1 и F2 означают кислотные фракции, которые содержат большинство кислотных форм. Пики 1 и 2 MT1 на Фиг. 17 содержат кислотные формы, а фракции F1 и F2 содержат большинство кислотных фракций. Фракции, содержащие такие кислотные формы (F1 и F2), также продемонстрировали желто-коричневый цвет по сравнению с другими фракциями (Фиг. 18B и Фиг. 18C).
В других иллюстративных вариантах осуществления композиции по настоящему изобретению может содержать белок против VEGF и его кислотные формы, причем количество кислотных форм в композиции может составлять от около 0% до около 20%, например, от около 0% до около 20%, от около 0,05% до около 20%, от около 0,1% до около 20%, от около 0,2% до около 20%, от около 0,3% до около 20%, от около 0,4% до около 20%, от около 0,5% до около 20%, от около 0,6% до около 20%, от около 0,7% до около 20%, от около 0,8% до около 20%, от около 0,9% до около 20%, от около 1% до около 20%, от около 1,5% до около 20%, от около 2% до около 20%, от около 3% до около 20%, от около 4% до около 20%, от около 5% до около 20%, от около 6% до около 20%, от около 7% до около 20%, от около 8% до около 20%, от около 9% до около 20%, от около 10% до около 20%, от около 0% до около 10%, от около 0,05% до около 10%, от около 0,1% до около 10%, от около 0,2% до около 10%, от около 0,3% до около 10%, от около 0,4% до около 10%, от около 0,5% до около 10%, от около 0,6% до около 10%, от около 0,7% до около 10%, от около 0,8% до около 10%, от около 0,9% до около 10%, от около 1% до около 10%, от около 1,5% до около 10%, от около 2% до около 10%, от около 3% до около 10%, от около 4% до около 10%, от около 5% до около 10%, от около 6% до около 10%, от около 7% до около 10%, от около 8% до около 10%, от около 9% до около 10%, от около 0% до около 7,5%, от около 0,05% до около 7,5%, от около 0,1% до около 7,5%, от около 0,2% до около 7,5%, от около 0,3% до около 7,5%, от около 0,4% до около 7,5%, от около 0,5% до около 7,5%, от около 0,6% до около 7,5%, от около 0,7% до около 7,5%, от около 0,8% до около 7,5%, от около 0,9% до около 7,5%, от около 1% до около 7,5%, от около 1,5% до около 7,5%, от около 2% до около 7,5%, от около 3% до около 7,5%, около 4% до около 7,5%, от около 5% до около 7,5%, от около 6% до около 7,5%, от около 7% до около 7,5%, от около 0% до около 5%, от около 0,05% до около 5%, от около 0,1% до около 5%, от около 0,2% до около 5%, от около 0,3% до около 5%, от около 0,4% до около 5%, от около 0,5% до около 5%, от около 0,6% до около 5%, от около 0,7% до около 5%, от около 0,8% до около 5%, от около 0,9% до около 5%, от около 1% до около 5%, от около 1,5% до около 5%, от около 2% до около 5%, от около 3% до около 5%, от около 4% до около 5% и варьирует в пределах одного или более из предыдущих. Как обсуждалось выше, такие кислотные формы могут быть обнаружены посредством различных способов, такими как ионный обмен, например, WCX (WCX-10 ВЭЖХ, слабая катионообменная хроматография) или IEF (изоэлектрическое фокусирование). Как правило кислотные формы элюируются раньше основного пика во время CEX или позже основного пика во время анализа AEX (см. Фиг. 16 и Фиг. 17).
При использовании катионообменной колонки все пики, элюируемые до основного пика, представляющего интерес, суммировались как кислотная область, а все пики, элюирующиеся после белка, представляющего интерес, суммировались как основная область. В иллюстративных вариантах осуществления кислотные формы могут быть элюированы в виде двух или более кислотных областей и могут быть пронумерованы как AR1, AR2, AR3 и т.д. на основе определенного времени удерживания пиков и используемой ионообменной колонки.
В одном варианте осуществления композиции могут содержать белок против VEGF, в том числе кислотные формы, причем AR1 составляет 20%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,0%, и варьирует в пределах одного или более из предыдущих. В одном аспекте композиции могут содержать белок против VEGF, в том числе его кислотные формы, причем AR1 составляет от около 0,0% до около 10%, от около 0,0% до около 5%, от около 0,0% до около 4%, от около 0,0% до около 3%, от около 0,0% до около 2%, от около 3% до около 5%, от около 5% до около 8%, от около 8% до около 10%, или от около 10% до около 15%, и варьирует в пределах одного или более из предыдущих. Как обсуждалось выше, такие кислотные области могут быть обнаружены посредством различных способов, такими как ионный обмен, например, WCX (WCX-10 ВЭЖХ, слабая катионообменная хроматография) или IEF (изоэлектрическое фокусирование). Обычно кислотные формы элюируются раньше основного пика во время CEX или позже основного пика во время анализа AEX (см. Фиг. 16 и Фиг. 17).
В другом варианте осуществления композиции могут содержать белок против VEGF, в том числе кислотные формы, причем AR2 составляет 20%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,0%, и варьирует в пределах одного или более из предыдущих. В одном аспекте композиции могут содержать белок против VEGF, в том числе кислотные формы, причем AR2 составляет от около 0,0% до около 10%, от около 0,0% до около 5%, от около 0,0% до около 4%, от около 0,0% до около 3%, от около 0,0% до около 2%, от около 3% до около 5%, от около 5% до около 8%, от около 8% до около 10%, или от около 10% до около 15%, и варьирует в пределах одного или более из предыдущих.
В одном варианте осуществления композиции могут содержать белок против VEGF, в том числе его основные формы, причем количество основных форм в композиции может составлять не более около 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,0% и варьирует в пределах одного или более из предыдущих. В одном аспекте композиции могут содержать белок против VEGF и его основные формы, причем количество основных форм в композиции по сравнению с белком против VEGF может составлять от 0% до около 20%, например, от около 0% до около 20%, от около 0,05% до около 20%, от около 0,1% до около 20%, от около 0,2% до около 20%, от около 0,3% до около 20%, от около 0,4% до около 20%, от около 0,5% до около 20%, от около 0,6% до около 20%, от около 0,7% до около 20%, от около 0,8% до около 20%, от около 0,9% до около 20%, от около 1% до около 20%, от около 1,5% до около 20%, от около 2% до около 20%, от около 3% до около 20%, от около 4% до около 20%, от около 5% до около 20%, от около 6% до около 20%, от около 7% до около 20%, от около 8% до около 20%, от около 9% до около 20%, от около 10% до около 20%, от около 0% до около 10%, от около 0,05% до около 10%, от около 0,1% до около 10%, от около 0,2% до около 10%, от около 0,3% до около 10%, от около 0,4% до около 10%, от около 0,5% до около 10%, от около 0,6% до около 10%, от около 0,7% до около 10%, от около 0,8% до около 10%, от около 0,9% до около 10%, от около 1% до около 10%, от около 1,5% до около 10%, от около 2% до около 10%, от около 3% до около 10%, от около 4% до около 10%, от около 5% до около 10%, от около 6% до около 10%, от около 7% до около 10%, от около 8% до около 10%, от около 9% до около 10%, от около 0% до около 7,5%, от около 0,05% до около 7,5%, от около 0,1% до около 7,5%, от около 0,2% до около 7,5%, от около 0,3% до около 7,5%, от около 0,4% до около 7,5%, от около 0,5% до около 7,5%, от около 0,6% до около 7,5%, от около 0,7% до около 7,5%, от около 0,8% до около 7,5%, от около 0,9% до около 7,5%, от около 1% до около 7,5%, от около 1,5% до около 7,5%, от около 2% до около 7,5%, от около 3% до около 7,5%, от около 4% до около 7,5%, от около 5% до около 7,5%, от около 6% до около 7,5%, от около 7% до около 7,5%, от около 0% до около 5%, от около 0,05% до около 5%, от около 0,1% до около 5%, от около 0,2% до около 5%, от около 0,3% до около 5%, от около 0,4% до около 5%, от около 0,5% до около 5%, от около 0,6% до около 5%, от около 0,7% до около 5%, от около 0,8% до около 5%, от около 0,9% до около 5%, от около 1% до около 5%, от около 1,5% до около 5%, от около 2% до около 5%, от около 3% до около 5%, от около 4% до около 5% и варьирует в пределах одного или более из предыдущих.
Основные формы могут быть элюированы в виде двух или более основных областей и могут быть пронумерованы как BR1, BR2, BR3 и т.д. на основании определенного времени удержания пиков и применяемого ионного обмена.
В одном варианте осуществления композиции могут содержать белок против VEGF, в том числе основные формы, причем BR1 составляет 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,0%, и варьирует в пределах одного или более из предыдущих. В одном аспекте композиции могут содержать белок против VEGF и его основные формы, причем BR1 составляет от около 0,0% до около 10%, от около 0,0% до около 5%, от около 0,0% до около 4%, от около 0,0% до около 3%, от около 0,0% до около 2%, от около 3% до около 5%, от около 5% до около 8%, от около 8% до около 10%, или от около 10% до около 15%, и варьирует в пределах одного или более из предыдущих.
В одном варианте осуществления композиция могут содержать белок против VEGF и его основные формы, причем BR2 составляет 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,0%, и варьирует в пределах одного или более из предыдущих. В одном аспекте композиции могут содержать белок против VEGF и его основные формы белка против VEGF, причем BR2 составляет от около 0,0% до около 10%, от около 0,0% до около 5%, от около 0,0% до около 4%, от около 0,0% до около 3%, от около 0,0% до около 2%, от около 3% до около 5%, от около 5% до около 8%, от около 8% до около 10%, или от около 10% до около 15%, и варьирует в пределах одного или более из предыдущих.
В одном варианте осуществления композиция могут содержать белок против VEGF и его основные формы, причем BR3 составляет 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4,5%, 4%, 3,5%, 3%, 2,5%, 2%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0,0%, и варьирует в пределах одного или более из предыдущих. В одном аспекте композиции могут содержать белок против VEGF и его основные формы белка против VEGF, причем BR3 составляет от около 0,0% до около 10%, от около 0,0% до около 5%, от около 0,0% до около 4%, от около 0,0% до около 3%, от около 0,0% до около 2%, от около 3% до около 5%, от около 5% до около 8%, от около 8% до около 10%, или от около 10% до около 15%, и варьирует в пределах одного или более из предыдущих.
Фотоиндуцированное окисление афлиберцепта
Помимо обнаружения различных цветовых характеристик или вариантов белковых композиций против VEGF, полученных с использованием ХОС, авторы настоящего изобретения также обнаружили, что такие композиции могут быть искусственно получены в лаборатории посредством воздействия света.
Модифицированные, в том числе окисленные, варианты композиции против VEGF могут быть получены посредством воздействия на против VEGF холодного белого света или ультрафиолетового света. В одном аспекте композиция против VEGF может включать от около 1,5 до около 50-кратного повышения содержания одного или более модифицированных олигопептидов по сравнению с образцом, причем олигопептиды выбраны из группы, состоящей из
DKTH*TC*PPC*PAPELLG (SEQ ID NO.: 17), EIGLLTC*EATVNGH*LYK (SEQ ID NO.: 18), QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19), TELNVGIDFNWEYPSSKH*QHK (SEQ ID NO.: 20), TNYLTH*R (SEQ ID NO.: 21), SDTGRPFVEMYSEIPEIIH*MTEGR (SEQ ID NO.: 22), VH*EKDK (SEQ ID NO.: 23), SDTGRPFVEM*YSEIPEIIHMTEGR (SEQ ID NO.: 64), SDTGRPFVEMYSEIPEIIHM*TEGR (SEQ ID NO.: 65), TQSGSEM*K (SEQ ID NO.: 66), SDQGLYTC*AASSGLM*TK (SEQ ID NO.: 67), IIW*DSR (SEQ ID NO.: 28), RIIW*DSR (SEQ ID NO.: 115), IIW*DSRK (SEQ ID NO.: 114), TELNVGIDFNW*EYPSSK (SEQ ID NO.: 29), GFIISNATY*K (SEQ ID NO.: 69), KF*PLDTLIPDGK (SEQ ID NO.: 70) F*LSTLTIDGVTR (SEQ ID NO.: 32), где H* представляет собой гистидин, окисленный до 2-оксо-гистидина, где C* представляет собой карбоксиметилированный цистеин, где M* представляет собой окисленный метионин, где W* представляет собой окисленный триптофан, где Y* представляет собой окисленный тирозин и где F* представляет собой окисленный фенилаланин. В следующем аспекте композиция против VEGF может включать от около 1,5 до около 10-кратного повышения содержания одного или более модифицированных олигопептидов посредством подвергания композиции против VEGF холодному белому свету в течение периода, например, около 30 часов. В другом аспекте композиция против VEGF может включать от около 1,5 до около 10-кратного повышения содержания одного или более модифицированных олигопептидов посредством подвергания образца холодному белому свету в течение около 75 часов. В другом аспекте композиция против VEGF может включать от около 1,5 до около 20-кратного повышения содержания одного или более олигопептидов перед подверганием образца холодному белому свету в течение около 100 часов. В другом аспекте композиция против VEGF может включать от около 1,5 до около 20-кратного повышения содержания одного или более олигопептидов перед подверганием образца холодному белому свету в течение около 150 часов. В следующем аспекте композиция против VEGF может включать от около 1,5 до около 50-кратного повышения содержания одного или более олигопептидов посредством подвергания образца холодному белому свету в течение около 300 часов - см. пример 4 ниже.
Композиция против VEGF может включать от около 1,5 до около 3-кратного повышения содержания одного или более олигопептидов, описанных выше, посредством подвергания образца композиции против VEGF ультрафиолетовому свету в течение около 4 часов. В другом аспекте композиция против VEGF может содержать от около 1,5 до около 10-кратного повышения содержания одного или более олигопептидов посредством подвергания образца ультрафиолетовому свету в течение около 10 часов. В другом аспекте композиция против VEGF может включать от около 1,5 до около 10-кратного повышения содержания одного или более описанных олигопептидов посредством подвергания образца ультрафиолетовому свету в течение около 16 часов. В другом аспекте композиция против VEGF может включать от около 1,5 до около 25-кратного повышения содержания одного или более описанных олигопептидов посредством подвергания образца ультрафиолетовому свету в течение около 20 часов. В другом аспекте композиция против VEGF может включать от около 1,5 до около 25-кратного повышения содержания одного или более описанных олигопептидов посредством подвергания образца ультрафиолетовому свету в течение около 40 часов. См. пример 4.
Гликоразнообразие - белок против VEGF, полученный с использованием ХОС
Композиции по настоящему изобретению содержат белок против VEGF, причем белок против VEGF, полученный в ХОС, обладает различным гликоразнообразием. Различные профили гликозилирования белка против VEGF входят в объем настоящего изобретения.
В некоторых иллюстративных вариантах осуществления настоящего изобретения композиция может содержать белок против VEGF, гликозилированный на одном или более аспарагинов следующим образом: гликозилирование G0-GlcNAc; гликозилирование G1-GlcNAc; гликозилирование G1S-GlcNAc; гликозилирование G0; гликозилирование G1; гликозилирование G1S; гликозилирование G2; гликозилирование G2S; гликозилирование G2S2; гликозилирование G0F; гликозилирование G2F2S; гликозилирование G2F2S2; гликозилирование G1F; гликозилирование G1FS; гликозилирование G2F; гликозилирование G2FS; гликозилирование G2FS2; гликозилирование G3FS; гликозилирование G3FS3; гликозилирование G0-2GlcNAc; гликозилирование Man4; гликозилирование Man4_A1G1; гликозилирование Man4_A1G1S1; гликозилирование Man5; гликозилирование Man5_A1G1; гликозилирование Man5_A1G1S1; гликозилирование Man6; гликозилирование Man6_G0+ фосфат; гликозилирование Man6+ фосфат; и/или гликозилирование Man7. В одном аспекте белок, представляющий интерес, может представлять собой афлиберцепт, антитело против VEGF или MiniTrap VEGF.
В одном варианте осуществления композиция может иметь следующий профиль гликозилирования: от около 40% до около 50% общих фукозилированных гликанов, от около 30% до около 50% общих сиалированных гликанов, от около 6% до около 15% маннозы-5, и от около 60% до около 79% галактозилированных гликанов. (Пример 6).
В одном варианте осуществления композиция может содержать белок против VEGF, причем белок, представляющий интерес, имеет гликозилирование Man5 на около 32,4% остатков аспарагина 123 и/или около 27,1% остатков аспарагина 196. В одном аспекте белок, представляющий интерес, может представлять собой афлиберцепт, антитело против VEGF или MiniTrap VEGF.
В другом варианте осуществления композиция может содержать около 40%, около 41%, около 42%, около 43%, около 44%, около 45%, около 46%, около 47%, около 48%, около 49% или около 50% общих фукозилированных гликанов.
В другом варианте осуществления композиция может содержать около 30%, около 31%, около 32%, около 33%, около 34%, около 35%, около 36%, около 37%, около 38%, около 39%, около 40%, около 41%, около 42%, около 43%, около 44%, около 45%, около 46%, около 47%, около 48%, около 49% или около 50% общих сиалированных гликанов.
В одном варианте осуществления композиция может содержать около 6%, около 7%, около 8%, около 9%, около 10%, около 11%, около 12%, около 13%, около 14%, или около 15% маннозы-5.
В другом варианте осуществления композиция может содержать около 60%, около 61%, около 62%, около 63%, около 64%, около 65%, около 66%, около 67%, около 68%, около 69%, около 70%, около 71%, около 72%, около 73%, около 74%, около 75%, около 76%, около 77%, около 78%, или около 79% общих галактозилированных гликанов.
В одном варианте осуществления белок против VEGF может иметь уровень фукозилированных гликанов, сниженный на около 1%, 1,2%, 1,5%, 2%, 2,2%, 2,5%, 3%, 3,2%, 3,5%, 4%, 4,2%, 4,5%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%. Белки против VEGF могут иметь сниженный уровень фукозилированных гликанов в диапазонах в пределах одного или более из предыдущих значений, например, 1-10%, 1-15%, 1-20%, 1-25%, 1-30%, 1-35%, 1-40%, 1-41%, 1-42%, 1-43%, 1-44%, 1-45%, 1-46%, 1-47%, 1-48%, 1-49%, 1-50%, 2-10%, 2-15%, 2-20%, 2-25%, 2-30%, 2-35%, 2-40%, 2-41%, 2-42%, 2-43%, 2-44%, 2-45%, 2-46%, 2-47%, 2-48%, 2-49%, 2-50%, 3-10%, 3-15%, 3-20%, 3-25%, 3-30%, 3-35%, 3-40%, 3-41%, 3-42%, 3-43%, 3-44%, 3-45%, 3-46%, 3-47%, 3-48%, 3-49%, 3-50%, 4-10%, 4-15%, 4-20%, 4-25%, 4-30%, 4-35%, 4-40%, 4-41%, 4-42%, 4-43%, 4-44%, 4-45%, 4-46%, 4-47%, 4-48%, 4-49%, 4-50% или 1-99% по сравнению с уровнем фукозилированных гликанов в белке против VEGF, полученном с использованием гидролизата сои.
В одном варианте осуществления белок против VEGF может иметь уровень сиалированных гликанов, сниженный на около 1%, 1,2%, 1,5%, 2%, 2,2%, 2,5%, 3%, 3,2%, 3,5%, 4%, 4,2%, 4,5%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%. Белки против VEGF могут иметь сниженный уровень сиалированных гликанов в диапазонах в пределах одного или более из предыдущих значений, например, 1-10%, 1-15%, 1-20%, 1-25%, 1-30%, 1-35%, 1-40%, 1-41%, 1-42%, 1-43%, 1-44%, 1-45%, 1-46%, 1-47%, 1-48%, 1-49%, 1-50%, 2-10%, 2-15%, 2-20%, 2-25%, 2-30%, 2-35%, 2-40%, 2-41%, 2-42%, 2-43%, 2-44%, 2-45%, 2-46%, 2-47%, 2-48%, 2-49%, 2-50%, 3-10%, 3-15%, 3-20%, 3-25%, 3-30%, 3-35%, 3-40%, 3-41%, 3-42%, 3-43%, 3-44%, 3-45%, 3-46%, 3-47%, 3-48%, 3-49%, 3-50%, 4-10%, 4-15%, 4-20%, 4-25%, 4-30%, 4-35%, 4-40%, 4-41%, 4-42%, 4-43%, 4-44%, 4-45%, 4-46%, 4-47%, 4-48%, 4-49%, 4-50% или 1-99% по сравнению с уровнем сиалированных гликанов в белке против VEGF, полученном с использованием гидролизата сои.
В одном варианте осуществления белок против VEGF может иметь уровень галактозилированных гликанов, сниженный на около 1%, 1,2%, 1,5%, 2%, 2,2%, 2,5%, 3%, 3,2%, 3,5%, 4%, 4,2%, 4,5%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%. В одном варианте осуществления белок против VEGF может иметь уровень галактозилированных гликанов, сниженный, например, на 1-10%, 1-15%, 1-20%, 1-25%, 1-30%, 1-35%, 1-40%, 1-41%, 1-42%, 1-43%, 1-44%, 1-45%, 1-46%, 1-47%, 1-48%, 1-49%, 1-50%, 2-10%, 2-15%, 2-20%, 2-25%, 2-30%, 2-35%, 2-40%, 2-41%, 2-42%, 2-43%, 2-44%, 2-45%, 2-46%, 2-47%, 2-48%, 2-49%, 2-50%, 3-10%, 3-15%, 3-20%, 3-25%, 3-30%, 3-35%, 3-40%, 3-41%, 3-42%, 3-43%, 3-44%, 3-45%, 3-46%, 3-47%, 3-48%, 3-49%, 3-50%, 4-10%, 4-15%, 4-20%, 4-25%, 4-30%, 4-35%, 4-40%, 4-41%, 4-42%, 4-43%, 4-44%, 4-45%, 4-46%, 4-47%, 4-48%, 4-49%, 4-50% или 1-99% по сравнению с уровнем галактозилированных гликанов в белке против VEGF, полученном с использованием гидролизата сои.
В одном варианте осуществления белок против VEGF может иметь уровень маннозилированных гликанов, повышенный на около 1%, 1,2%, 1,5%, 2%, 2,2%, 2,5%, 3%, 3,2%, 3,5%, 4%, 4,2%, 4,5%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%. Белки против VEGF могут иметь повышенный уровень маннозилированных гликанов в диапазонах в пределах одного или более из предыдущих значений, например, 1-10%, 1-15%, 1-20%, 1-25%, 1-30%, 1-35%, 1-40%, 1-41%, 1-42%, 1-43%, 1-44%, 1-45%, 1-46%, 1-47%, 1-48%, 1-49%, 1-50%, 2-10%, 2-15%, 2-20%, 2-25%, 2-30%, 2-35%, 2-40%, 2-41%, 2-42%, 2-43%, 2-44%, 2-45%, 2-46%, 2-47%, 2-48%, 2-49%, 2-50%, 3-10%, 3-15%, 3-20%, 3-25%, 3-30%, 3-35%, 3-40%, 3-41%, 3-42%, 3-43%, 3-44%, 3-45%, 3-46%, 3-47%, 3-48%, 3-49%, 3-50%, 4-10%, 4-15%, 4-20%, 4-25%, 4-30%, 4-35%, 4-40%, 4-41%, 4-42%, 4-43%, 4-44%, 4-45%, 4-46%, 4-47%, 4-48%, 4-49%, 4-50% или 1-99% по сравнению с уровнем маннозилированных гликанов в белке против VEGF, полученном с использованием гидролизата сои.
Композиции, описанные в данном разделе, могут быть произведены посредством нескольких предшествующих и последующих параметров, как описано ниже в разделах IV и V, соответственно.
IV. Получение композиций с использованием технологий предшествующего процесса
Для биопрепаратов необходимо внедрение надежного и гибкого восходящего процесса. Эффективный предшествующий процесс может обеспечивать необходимое получение и масштабирование белка, представляющего интерес.Авторы настоящего изобретения обнаружили, что композиции по настоящему изобретению, содержащие белок против VEGF, могут быть получены посредством модулирования условий во время продукции белка в восходящем направлении, таких как изменения в компонентах среды ХОС.Каждая стадия предшествующего процесса может повлиять на качество, чистоту и количество производимого белка.
В настоящем изобретении предоставлены доказательства существования определенных вариантов афлиберцепта и/или MiniTrap, полученных с использованием ХОС.Данные варианты включают изоформы, которые содержат один или более окисленных аминокислотных остатков. Примеры окисленных остатков включают без ограничения один или более остатков гистидина, триптофана, метионина, фенилаланина или тирозина. Композиции, полученные посредством применения модифицированного ХОС, могут обеспечивать препарат белка против VEGF с необходимым целевым значением белковых вариантов афлиберцепта и/или MiniTrap.Как упоминалось выше, также может наблюдаться желто-коричневый цвет, связанный с фракциями, полученными с использованием ХОС.(Как упоминалось выше, не все ХОС, испытанные авторами настоящего изобретения, демонстрировали отчетливое изменение цвета.)
Настоящее изобретение включает культивирование клетки-хозяина в модифицированной ХОС в подходящих условиях, в которых клетка экспрессирует рекомбинантный белок, представляющий интерес, с последующим сбором препарата рекомбинантного белка, представляющего интерес, продуцированного клеткой. Такой модифицированный ХОС можно применять для получения композиций, как описано выше в разделе III.
В одном варианте осуществления способ включает культивирование клетки-хозяина в ХОС в подходящих условиях, причем клетка-хозяин экспрессирует рекомбинантный белок, представляющий интерес, такой как афлиберцепт.Способ дополнительно включает сбор препарата рекомбинантного белка, представляющего интерес, продуцированного клеткой, причем подходящие условия включают ХОС с кумулятивной концентрацией железа в указанной ХОС, составляющей менее около 55 мкмоль, кумулятивной концентрацией меди в указанной ХОС, составляющей не более около 0,8 мкмоль, кумулятивной концентрацией никеля в указанной ХОС, составляющей не более около 0,40 мкмоль, кумулятивной концентрацией цинка в указанной ХОС, составляющей не более около 56 мкмоль, кумулятивной концентрацией цистеина в указанной ХОС, составляющей менее около 10 ммоль; и/или антиоксидант в указанной ХОС в концентрации от около 0,001 ммоль до около 10 ммоль для одного антиоксиданта, и кумулятивной концентрацией не более около 30 ммоль, если в указанный ХОС добавляют несколько антиоксидантов.
В одном аспекте настоящего варианта осуществления препарат, полученный посредством подходящих условий, обеспечивает снижение белковых вариантов афлиберцепта и MiniTrap VEGF до необходимого количества белковых вариантов афлиберцепта и MiniTrap VEGF (что называется «целевым значение» белковых вариантов афлиберцепта и MiniTrap VEGF). В следующем аспекте данного варианта осуществления препарат, полученный вследствие применения подходящих условий, обеспечивает снижение цвета препаратов до необходимого значения BY (называемого «целевое значение BY»), если препарат белка, в том числе варианты афлиберцепта и VEGF MiniTrap, нормализованы до концентрации 5 г/л, 10 г/л или даже выше.
В следующем аспекте настоящего варианта осуществления целевое значение BY и/или целевое значение вариантов может быть получено в препарате, в котором титр повышается или значительно не снижается (см. пример 5).
В некоторых вариантах осуществления композиции, полученные посредством применения модифицированного ХОС, могут обеспечивать получение препарата белка против VEGF с необходимым целевым значением BY, причем цвет препарата характеризуется следующим образом:
(i) не более желто-коричневый, чем европейский эталон цвета BY2;
(ii) не более желто-коричневый, чем европейский эталон цвета BY3;
(iii) не более желто-коричневый, чем европейский эталон цвета BY4;
(iv) не более желто-коричневый, чем европейский эталон цвета BY5;
(v) между значениями европейского эталона цвета BY2 и BY3;
(vi) между значениями европейского эталона цвета BY3 и BY4;
(vii) между значениями европейского эталона цвета BY4 и BY5, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF, и при этом образец композиции может быть получен в виде образца из элюата белка A осветленного сбора. Как видно ниже в примере 9, таблице 9-3, элюат белка A, содержащий 5 г/л афлиберцепта, имел желто-коричневый цвет, измеренное значение b* которого составляет 1,77. Такой образец, если он был получен после AEX, имел значение b* 0,50, демонстрируя полезность AEX для снижения желто-коричневой окраски образца (таблица 9-3).
Композиции, полученные с использованием модифицированного ХОС, могут обеспечивать препарат белка против VEGF, причем цвет препарата характеризуется признанной стандартной цветовой характеристикой по шкале CIELAB:
(i) не более желто-коричневый, чем значение b* около 22-23;
(ii) не более желто-коричневый, чем значение b* около 16-17;
(iii) не более желто-коричневый, чем значение b* 9-10;
(iv) не более желто-коричневый, чем значение b* 4-5;
(v) не более желто-коричневый, чем значение b* 2-3;
(vi) значение b* от 17 до 23;
(vii) значение b* от 10 до 17;
(viii) значение b* от 5 до 10;
(ix) значение b* от 3 до 5; или
(x) значение b* от 1 до 3, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF, и при этом композиция получена в виде образца из элюата белка A осветленного сбора. См. пример 9, таблицу 9-3.
Для компонентов, добавленных в культуру клеток с образованием модифицированного ХОС, применяемый в данном документе термин «кумулятивное количество» относится к общему количеству конкретного компонента, добавленного в биореактор в ходе культивирования клеток с образованием ХОС, включая количества, добавленные в начале культивирования (ХОС в день 0) и добавленные впоследствии количества компонента. Количества компонента, добавленные в культуру в системе посевных ферментеров или инокулят перед получением в биореакторе (т.е., перед ХОС в день 0), также включены при расчете кумулятивного количества компонента. Кумулятивное количество не зависит от потери компонента с течением времени в ходе культивирования (например, посредством метаболизма или химического разложения). Таким образом, две культуры с одинаковыми кумулятивными количествами компонента могут, тем не менее, иметь различные абсолютные уровни, например, если компонент добавляют в две культуры в различные моменты времени (например, если в одной культуре весь компонент добавляют с самого начала, а в другой культуре компонент добавляют с течением времени). Кумулятивное количество также не зависит от синтеза компонента in situ с течением времени в ходе культивирования (например, посредством метаболизма или химического преобразования). Таким образом, две культуры с одинаковыми кумулятивными количествами приведенного компонента могут, тем не менее, иметь различные абсолютные уровни, например, если компонент синтезируется in situ в одной из двух культур посредством способа биологического преобразования. Кумулятивное количество может выражаться в таких единицах, как, например, граммы или моли компонента. Термин «кумулятивная концентрация» относится к кумулятивному количеству компонента, разделенному на объем жидкости в биореакторе в начале производственной партии, включая потребление начального объема из любого инокулята, применяемого в культуре. Например, если биореактор содержит 2 литра среды клеточной культуры в начале производственной партии, и один грамм компонента X добавляют в дни 0, 1, 2 и 3, то кумулятивная концентрация после дня 3 составляет 2 г/л (т.е., 4 грамма, разделенные на 2 литра). Если в день 4 в биореактор добавляют еще один литр жидкости, не содержащей компонент X, кумулятивная концентрация будет по-прежнему составлять 2 г/л. Если в день 5 некоторое количество жидкости было утеряно из биореактора (например, вследствие испарения), кумулятивная концентрация будет по-прежнему составлять 2 г/л. Кумулятивная концентрация может выражаться в таких единицах, как, например, граммы на литр или моли на литр.
Аминокислоты:
В некоторых вариантах осуществления модифицированная ХОС может быть получена посредством снижения или повышения кумулятивных концентраций аминокислот в ХОС.Неограничивающие примеры таких аминокислот включают аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин (или их соли). Повышение или снижение кумулятивного количества данных аминокислот в модифицированной ХОС могут составлять около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100% по сравнению с исходным ХОС, и варьирует в пределах одного или более из предыдущих. В качестве альтернативы, повышение или снижение кумулятивного количества одной или более аминокислот в модифицированной ХОС может составлять от около 5% до около 20%, от около 10% до около 30%, от около 30% до около 40%, от около 30% до около 50%, от около 40% до около 60%, от около 60% до около 70%, от около 70% до около 80%, от около 80% до около 90% или от около 90% до около 100% по сравнению с немодифицированной ХОС, и варьирует в пределах одного или более из предыдущих (см. Фиг. 25-27 и пример 5).
В некоторых вариантах осуществления модифицированная ХОС может быть получена посредством снижения кумулятивной концентрации цистеина в ХОС.Снижение количества цистеина в ХОС с образованием модифицированного ХОС может составлять около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% по сравнению с немодифицированной ХОС, и варьирует в пределах одного или более из предыдущих. В качестве альтернативы, снижение кумулятивного количества цистеина в модифицированной ХОС могут составлять от около 5% до около 20%, от около 10% до около 30%, от около 30% до около 40%, от около 30% до около 50%, от около 40% до около 60%, от около 60% до около 70%, от около 70% до около 80%, от около 80% до около 90% или от около 90% до около 100% по сравнению с ХОС, и варьирует в пределах одного или более из предыдущих. В одном аспекте количество кумулятивного цистеина в модифицированной ХОС составляет менее около 1 ммоль, около 2 ммоль, около 3 ммоль, около 4 ммоль, около 5 ммоль, около 6 ммоль, около 7 ммоль, около 8 ммоль, около 9 ммоль или около 10 ммоль (см. Фиг. 25-27 и пример 5).
В некоторых вариантах осуществления модифицированная ХОС может быть получена посредством замещения по меньшей мере определенного процентного содержания кумулятивного цистеина в ХОС цистеином. Замещение может составлять около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% по сравнению с немодифицированной ХОС, и варьирует в пределах одного или более из предыдущих. В качестве альтернативы, замещение может составлять от около 5% до около 20%, от около 10% до около 30%, от около 30% до около 40%, от около 30% до около 50%, от около 40% до около 60%, от около 60% до около 70%, от около 70% до около 80%, от около 80% до около 90% или от около 90% до около 100% по сравнению с немодифицированной ХОС, и варьирует в пределах одного или более из предыдущих (см. Фиг. 25-27 и пример 5).
В некоторых вариантах осуществления модифицированная ХОС может быть получена посредством замещения по меньшей мере определенного процентного содержания кумулятивного цистеина в ХОС сульфатом цистеина. Замещение может составлять около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% по сравнению с немодифицированной ХОС, и варьирует в пределах одного или более из предыдущих. В качестве альтернативы, замещение может составлять от около 5% до около 20%, от около 10% до около 30%, от около 30% до около 40%, от около 30% до около 50%, от около 40% до около 60%, от около 60% до около 70%, от около 70% до около 80%, от около 80% до около 90% или от около 90% до около 100% по сравнению с немодифицированной ХОС, и варьирует в пределах одного или более из предыдущих.
Металлы:
В некоторых вариантах осуществления модифицированная ХОС может быть получена посредством снижения или повышения кумулятивной концентрации металлов в ХОС.Неограничивающие примеры металлов включают железо, медь, марганец, молибден, цинк, никель, кальций, калий и натрий. Повышение или снижение количества одного или более металлов в модифицированной ХОС может составлять около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% по сравнению с немодифицированной ХОС, и варьирует в пределах одного или более из предыдущих. В качестве альтернативы, повышение или снижение кумулятивного количества одного или более металлов в модифицированной ХОС может составлять от около 5% до около 20%, от около 10% до около 30%, от около 30% до около 40%, от около 30% до около 50%, от около 40% до около 60%, от около 60% до около 70%, от около 70% до около 80%, от около 80% до около 90% или от около 90% до около 100% по сравнению с немодифицированной ХОС, и варьирует в пределах одного или более из предыдущих (см. Фиг. 25-27 и пример 5).
Антиоксиданты:
В некоторых вариантах осуществления модифицированный ХОС содержит один или более антиоксидантов. Неограничивающие примеры антиоксидантов могут включать таурин, гипотаурин, глицин, тиоктовую кислоту, глутатион, холинхлорид, гидрокортизон, витамин C, витамин E и их комбинации (см. Фиг. 28A-E и пример 5).
В некоторых вариантах осуществления модифицированный ХОС содержит от около 0,01 ммоль до около 20 ммоль таурина, т.е. от 0,01 ммоль до около 1 ммоль, от около 0,01 ммоль до около 5 ммоль, от около 0,01 ммоль до около 10 ммоль, от около 0,1 ммоль до около 1 ммоль, от около 0,1 ммоль до около 5 ммоль, от около 0,1 ммоль до около 10 ммоль, от около 1 ммоль до около 5 ммоль, от около 1 ммоль до около 10 ммоль и варьирует в пределах одного или более из предыдущих.
В некоторых вариантах осуществления модифицированный ХОС содержит от около 0,01 ммоль до около 20 ммоль гипотаурина, т.е. от 0,01 ммоль до около 1 ммоль, от около 0,01 ммоль до около 5 ммоль, от около 0,01 ммоль до около 10 ммоль, от около 0,1 ммоль до около 1 ммоль, от около 0,1 ммоль до около 5 ммоль, от около 0,1 ммоль до около 10 ммоль, от около 1 ммоль до около 5 ммоль, от около 1 ммоль до около 10 ммоль и варьирует в пределах одного или более из предыдущих.
В некоторых вариантах осуществления модифицированный ХОС содержит от около 0,01 ммоль до около 20 ммоль глицина, т.е. от 0,01 ммоль до около 1 ммоль, от около 0,01 ммоль до около 5 ммоль, от около 0,01 ммоль до около 10 ммоль, от около 0,1 ммоль до около 1 ммоль, от около 0,1 ммоль до около 5 ммоль, от около 0,1 ммоль до около 10 ммоль, от около 1 ммоль до около 5 ммоль, от около 1 ммоль до около 10 ммоль и варьирует в пределах одного или более из предыдущих.
В некоторых вариантах осуществления модифицированный ХОС содержит от около 0,01 мкмоль до около 5 мкмоль тиоктовой кислоты, т.е., от около 0,01 мкмоль до около 0,1 мкмоль, от около 0,1 мкмоль до около 1 мкмоль, от около 1 мкмоль до около 2.5 мкмоль, от около 1 мкмоль до около 3 мкмоль, от около 1 мкмоль до около 5 мкмоль и варьирует в пределах одного или более из предыдущих.
В некоторых вариантах осуществления модифицированный ХОС содержит около 0,01 M до около 5 ммоль глутатиона, т.е., от около 0,01 ммоль до около 1 ммоль, от около 0,1 ммоль до около 1 ммоль, от около 0,1 ммоль до около 5 ммоль, от около 1 ммоль до около 5 ммоль и варьирует в пределах одного или более из предыдущих.
В некоторых вариантах осуществления модифицированный ХОС содержит от около 0,01 мкмоль до около 5 мкмоль гидрокортизина, т.е., от около 0,01 мкмоль до около 0,1 мкмоль, от около 0,1 мкмоль до около 1 мкмоль, от около 1 мкмоль до около 2.5 мкмоль, от около 1 мкмоль до около 3 мкмоль, от около 1 мкмоль до около 5 мкмоль и варьирует в пределах одного или более из предыдущих.
В некоторых вариантах осуществления модифицированный ХОС содержит от около 1 мкмоль до около 50 мкмоль витамина C, т.е., от около 1 мкмоль до около 5 мкмоль, от около 5 мкмоль до около 20 мкмоль, от около 10 мкмоль до около 30 мкмоль, от около 5 мкмоль до около 30 мкмоль, от около 20 мкмоль до около 50 мкмоль, от около 25 мкмоль до около 50 мкмоль и варьирует в пределах одного или более из предыдущих.
Изменения среды для модуляции гликозилирования:
Настоящее раскрытие также включает способы модуляции гликозилирования белка против VEGF посредством изменения кумулятивных концентраций определенных компонентов в ХОС.На основании кумулятивных количеств компонентов, добавленных в ХОС, общий % фукозилирования, общий % галактозилирования, общий % сиалилирования и манноза-5 могут варьировать.
В иллюстративных вариантах осуществления способ модуляции гликозилирования белка против VEGF может включать добавление в ХОС уридина. Белок против VEGF может иметь от около 40% до около 50% общих фукозилированных гликанов, от около 30% до около 55% общих сиалированных гликанов, от около 2% до около 15% маннозы-5 и от около 60% до около 79% галактозилированных гликанов. (См. пример 6 ниже).
В некоторых вариантах осуществления способ модуляции гликозилирования белка против VEGF может включать добавление в ХОС марганца. В одном аспекте ХОС не содержать марганца до подачи. Белок против VEGF может иметь от около 40% до около 50% общих фукозилированных гликанов, от около 30% до около 55% общих сиалированных гликанов, от около 2% до около 15% маннозы-5 и от около 60% до около 79% галактозилированных гликанов. (См. пример 6 ниже).
В некоторых вариантах осуществления способ модуляции гликозилирования белка против VEGF может включать добавление в ХОС галактозы. В одном аспекте ХОС не содержит галактозы до подачи. Белок против VEGF может иметь от около 40% до около 50% общих фукозилированных гликанов, от около 30% до около 55% общих сиалированных гликанов, от около 2% до около 15% маннозы-5 и от около 60% до около 79% галактозилированных гликанов. (См. пример 6 ниже).
В некоторых вариантах осуществления способ модуляции гликозилирования белка против VEGF может включать добавление в ХОС дексаметазона. В одном аспекте ХОС не содержит дексаметазона до подачи. Белок против VEGF может иметь от около 40% до около 50% общих фукозилированных гликанов, от около 30% до около 55% общих сиалированных гликанов, от около 2% до около 15% маннозы-5 и от около 60% до около 79% галактозилированных гликанов. (См. пример 6 ниже).
В некоторых вариантах осуществления способ модуляции гликозилирования белка против VEGF может включать подачу в ХОС одного или более из уридина, марганца, галактозы и дексаметазона. В одном аспекте ХОС не содержит одного или более из уридина, марганца, галактозы и дексаметазона до подачи. Белок против VEGF может иметь от около 40% до около 50% общих фукозилированных гликанов, от около 30% до около 55% общих сиалированных гликанов, от около 2% до около 15% маннозы-5 и от около 60% до около 79% галактозилированных гликанов. (См. пример 6 ниже).
V. Получение композиций с использованием технологий последующего процесса
Композиции, содержащие белок против VEGF по настоящему изобретению, могут быть получены посредством модуляции условий в ходе последующего получения белка. Авторы настоящего изобретения обнаружили, что оптимизация последующих процедур может обеспечивать сведение к минимуму определенных вариантов белка против VEGF, а также обесцвечивание. Оптимизация последующего процесса может обеспечивать композицию со сниженными оксо-вариантами, а также оптимизированными цветовыми характеристиками.
Технологии последующего процесса можно применять отдельно или в комбинации с технологиями предшествующего процесса, описанными выше в разделе IV.
Анионообменная хроматография:
В некоторых вариантах осуществления композиция по настоящему изобретению может включать процесс, включающий экспрессию белка против VEGF в клетке-хозяине в ХОС, причем белок против VEGF секретируется из клетки-хозяина в среду с получением осветленного сбора. Сбор подвергают следующим (a) загрузка биологического образца, полученного из сбора, в колонку для анионообменной хроматографии (AEX); (b) промывка колонки AEX подходящим промывочным буфером, (c) сбор проточной(-ых) фракции(-й), необязательно, (d) промывка колонки подходящим буфером для очистки и (e) сбор очищенных фракций.
Проточные фракции могут содержать оксо-варианты белка против VEGF, которые составляют около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% образца белка против VEGF по сравнению с оксо-вариантами в очищенной фракции колонке для анионообменной хроматографии. Например, относительно таблицы 9-5 и таблицы 9-6, проточные фракции содержат окисленные варианты белка против VEGF, где некоторые остатки гистидина и триптофана около 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% (и варьирует в пределах одного или более из предыдущих), по сравнению с окисленными вариантами в очищенных фракциях.
pH обоих из буфера для уравновешивания и промывки для колонки AEX может составлять от около 8,20 до около 8,60. В другом аспекте проводимость обоих из буферов для уравновешивания и промывки для колонки AEX может составлять от около 1,50 до около 3,0 мСм/см. В одном аспекте буферы для уравновешивания и промывки могут представлять собой 50 ммоль трис-гидрохлорида. В одном аспекте буфер для очистки содержит 2 моль хлорида натрия или 1 н. гидроксида натрия или обоих (см. таблицу 2-2). В примере 2 дополнительно проиллюстрирована оптимизация проводимости буфера для уравновешивания и промывки.
Белковые варианты могут включать модификации одного или более остатков следующим образом: один или более аспарагинов дезамидированы; одна или более аспарагиновых кислот преобразованы в изо-аспартат и/или Asn; один или более метионинов окислены; один или более триптофанов преобразованы в N-формилкинуренин; один или более триптофанов представляют собой моно-гидроксилтриптофан; один или более триптофанов представляют собой ди-гидроксилтриптофан; один или более триптофанов представляют собой три-гидроксилтриптофан; один или более аргининов преобразованы в Arg 3-дезоксиглюкозон; C-концевой глицин отсутствует; и/или существует один или более негликозилированных гликосайтов.
Белок, представляющий интерес, может представлять собой афлиберцепт, антитело против VEGF или VEGF MiniTrap.Белковые варианты могут быть образованы посредством одного или более из следующих: (i) окисление гистидинов из остатков гистидина, выбранных из His86, His110, His145, His209, His95, His19 и/или His203 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); (ii) окисление остатков триптофана, выбранных из остатков триптофана в Trp58 и/или Trp138 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); (iii) окисление остатка тирозина в Tyr64 (или эквивалентных положениях на белках с одинаковыми определенными структурными характеристиками афлиберцепта); (iv) окисление остатков фенилаланина, выбранных из Phe44 и/или Phe166 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта); и/или (v) окисление остатков метионина, выбранных из Met10, Met 20, Met163 и/или Met192 (или эквивалентных положениях остатка на белках с одинаковыми определенными структурными характеристиками афлиберцепта).
Проточные фракции могут содержать одно или более из следующих:
процентное содержание остатков гистидина, которые были окислены до 2-оксо-гистидина, причем их цветовая характеристика является следующей:
(i) не более желто-коричневый, чем европейский эталон цвета BY2;
(ii) не более желто-коричневый, чем европейский эталон цвета BY3;
(iii) не более желто-коричневый, чем европейский эталон цвета BY4;
(iv) не более желто-коричневый, чем европейский эталон цвета BY5;
(v) между значениями европейского эталона цвета BY2 и BY3;
(vi) между значениями европейского эталона цвета BY3 и BY4;
(vii) между значениями европейского эталона цвета BY4 и BY5, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF, и при этом композицию получают в виде образца из проточных фракций.
Процентное содержание остатков гистидина, которые были окислены до 2-оксо-гистидина. Кроме того, их цвет характеризуется наличием желто-коричневого цвета, что приблизительно соответствует BY2, BY3, BY4, BY5, BY6, BY7; или он не темнее/интенсивнее, чем BY2, не темнее, чем BY3, не темнее, чем BY4, не темнее, чем BY5, не темнее, чем BY6, не темнее, чем BY7; или находится между значениями BY2 и BY3, между значениями BY2 и BY4, между значениями BY3 и BY4 или между значениями BY3 и BY5.
Процентное содержание остатков гистидина, которые были окислены до 2-оксо-гистидина, причем их цвет характеризуется цветом в цветовом пространстве CIE L*, a*, b* следующим образом:
(i) не более желто-коричневый, чем значение b* около 22-23;
(ii) не более желто-коричневый, чем значение b* около 16-17;
(iii) не более желто-коричневый, чем значение b* 9-10;
(iv) не более желто-коричневый, чем значение b* 4-5;
(v) не более желто-коричневый, чем значение b* 2-3;
(vi) значение b* от 17 до 23;
(vii) значение b* от 10 до 17;
(viii) значение b* от 5 до 10;
(ix) значение b* от 3 до 5; или
(x) между значениями b* 1-3, причем композиция содержит около 5 г/л или около 10 г/л белка против VEGF, и при этом композицию получают в виде образца из проточных фракций.
Не более около 1%, не более около 0,1% или около 0,1-1%, 0,2-1%, 0,3-1%, 0,4-1%, 0,5-1%, 0,6-1%, 0,7-1%, 0,8-1% или 0,9-1% остатков гистидина в композиции окислены до 2-оксо-гистидина. Расчет процентного содержания описан в разделе II.
Аффинная хроматография:
В некоторых вариантах осуществления композиции по настоящему изобретению могут быть получены посредством процесса, включающего экспрессию белка против VEGF в клетке-хозяине причем белок против VEGF секретируется из клетки-хозяина в среду с получением осветленного сбора. Сбор подвергают следующим стадиям, включающим (а) загрузку биологического образца, полученного из очищенного урожая, в колонку для аффинной хроматографии, причем аффинная хроматография включает белок, способный селективно или специфически связываться с белком против VEGF; (b) промывку колонки для аффинной хроматографии подходящим элюирующим буфером, и (c) сбор элюированной(-ых) фракции(-й). Например, как проиллюстрировано в таблице 7-1 и таблице с 7-7 по 7-10, применение VEGF165 в качестве белка, способного селективно или специфически связываться с белком против VEGF, и сбор элюированных фракций, как в описанном выше способе, обеспечивало успешное получение MT5 (белка против VEGF), афлиберцепта и фрагмента scFv против VEGF. В таблице 7-1 также раскрыто успешное получение MT5 с использованием (i) mAb1 (человеческий IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 73 представляет собой тяжелую цепь и SEQ ID NO.: 74 представляет собой легкую цепь); (ii) mAb2 (человеческий IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 75 представляет собой тяжелую цепь и SEQ ID NO.: 76 представляет собой легкую цепь); (iii) mAb3 (мышиный IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 77 представляет собой тяжелую цепь и SEQ ID NO.: 78 представляет собой легкую цепь) и (iv) mAb4 (мышиный IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 79 представляет собой тяжелую цепь и SEQ ID NO.: 80 представляет собой легкую цепь), поскольку различные белки способны селективно или специфически связываться с MT5.
Относительно стадии (а) выше, биологический образец для загрузки в аффинную колонку может быть получен из образца, в котором осветленный сбор может быть подвергнут хроматографии до аффинности, включая без ограничения ионообменную хроматографию (анионную или катионную). Другие хроматографические процедуры, хорошо известные специалисту в данной области, также могут быть использованы перед применением стадии аффинности. Важным моментом является то, что биологический образец, содержащий белок против VEGF, можно подвергать аффинной хроматографии.
В некоторых вариантах осуществления композиции по настоящему изобретению могут быть получены с использованием процесса, включающего следующее: экспрессия белка VEGF MiniTrap в клетке-хозяине, причем VEGF MiniTrap секретирован из клетки-хозяина в среде, и при этом среда может быть дополнительно обработана с образованием осветленного сбора. Данный сбор может быть дополнительно обработан посредством известных хроматографических процедур с получением биологического образца, содержащего VEGF MiniTrap.Данный биологический образец может быть дополнительно обработан посредством применения следующих стадий, включающих (a) загрузку биологического образца в колонку для аффинной хроматографии, причем аффинная хроматография содержит белок, способный селективно или специфически связываться или взаимодействовать с белком VEGF MiniTrap; (b) промывку колонки для аффинной хроматографии подходящим элюирующим буфером и (c) сбор элюированной(ых) фракции(-й). Относительно таблицы 7-1, в данной таблице раскрыто успешное получение MT5 (VEGF MiniTrap) с использованием (i) VEGF165; (ii) mAb1 (человеческий IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 73 представляет собой тяжелую цепь и SEQ ID NO.: 74 представляет собой легкую цепь); (iii) mAb2 (человеческий IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 75 представляет собой тяжелую цепь и SEQ ID NO.: 76 представляет собой легкую цепь); (iv) mAb3 (мышиный IgG1 против мышиного mAb к VEGF-R1, где SEQ ID NO.: 77 представляет собой тяжелую цепь и SEQ ID NO.: 78 представляет собой легкую цепь) и (v) mAb4 (мышиный IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 79 представляет собой тяжелую цепь и SEQ ID NO.: 80 представляет собой легкую цепь), поскольку различные белки способны селективно или специфически связываться или взаимодействовать с MT5.
В одном варианте осуществления аффинную хроматографию также можно применять для выделения других белков MiniTrap.После расщепления афлиберцепта образец, содержащий расщепленный афлиберцепт, можно подвергнуть аффинной хроматографии с использованием связующего вещества, специфичного для расщепленного афлиберцепта. В одном аспекте связующее вещество может представлять собой антитело или его часть.
Отщепление афлиберцепта можно облегчить с использованием протеолитического расщепления афлиберцепта, например, протеазы IdeS (FabRICATOR) или его варианта для создания VEGF MiniTrap.Отщепление афлиберцепта посредством протеазы IdeS или ее варианта может обеспечивать смесь продуктов, включая фрагмент Fc и VEGF MiniTrap.VEGF MiniTrap может быть дополнительно обработан с использованием одной или более стратегий получения, описанных в данном документе.
В некоторых иллюстративных вариантах осуществления белок, способный селективно или специфически связываться («связующее вещество») или взаимодействовать с белком против VEGF, таким как афлиберцепт или MiniTrap, может происходить от человека или мыши.
Аффинный процесс получения может дополнительно включать уравновешивание аффинной колонки с использованием буфера для уравновешивания перед загрузкой биологического образца. Иллюстративные буферы для уравновешивания могут представлять собой 20 ммоль фосфата натрия, pH 6-8 (особенно 7,2), 10 ммоль фосфата натрия, 500 ммоль NaCl, pH 6-8 (особенно 7,2), 50 ммоль Tris pH 7-8, DPBS pH 7,4.
Биологический образец может быть загружен с использованием подходящего буфера, такого как DPBS.
Данный аффинный процесс получения может дополнительно включать промывание аффинной колонки одним или более промывочных буферов. Колонку можно промывать один или несколько раз. Кроме того, промывки также могут быть собраны в качестве промывочных фракций. pH промывочного буфера может составлять от около 7,0 до около 8,60. В одном аспекте промывочный буфер может представлять собой DPBS. В другом аспекте промывочный буфер может представлять собой 20 ммоль фосфата натрия, pH 6-8 (особенно 7,2), 10 ммоль фосфата натрия, 500 ммоль NaCl, pH 6-8 (особенно 7,2), 50 ммоль Tris pH 7-8 или DPBS pH 7,4.
Данный аффинный процесс может дополнительно включать промывку аффинной колонки одним или более подходящих элюирующих буферов и сбор элюированных фракций. Колонку можно промывать один или несколько раз. Неограничивающие примеры такого подходящего элюирующего буфера включают ацетат аммония (pH от около 2,0 до около 3,0), уксусную кислоту (pH от около 2,0 до около 3,2), глицин-HCl (pH от около 2,0 до около 3,0), цитрат натрия (pH от около 2,0 до около 3,0), лимонную кислоту (pH от около 2,0 до около 3,0), изотиоцианат калия (pH от около 2,0 до около 3,0) или их комбинации.
В некоторых аспектах элюированные фракции могут быть нейтрализованы с использованием нейтрализующего буфера. Примером такого нейтрализующего буфера являются Tris - Tris-HCl (pH от около 7,0 до около 9,0).
Мутанты IdeS:
Протеаза IdeS, применяемая для отщепления слитого белка Fc, такого как афлиберцепт, будет быстро терять ферментативную активность в условиях основного pH, что может ограничивать его применение при производстве VEGF MiniTrap.Таким образом, были разработаны варианты, более стабильные при основном pH, например, в присутствии сильного основания, такого как NaOH. Такие основные условия могут представлять собой 0,05 н. NaOH в течение 1 ч. или 0,1 н. NaOH в течение 0,5 ч.
В некоторых вариантах осуществления мутант IdeS может иметь аминокислотную последовательность, по меньшей мере на около 70% идентичную по всей ее длине аминокислотным последовательностям, изложенным в группе, состоящей из SEQ ID NO.: 2, SEQ ID NO.: 3, SEQ ID NO.: 4, SEQ ID NO.: 5, SEQ ID NO.: 6, SEQ ID NO.: 7, SEQ ID NO.: 8, SEQ ID NO.: 9, SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12, SEQ ID NO.: 13, SEQ ID NO.: 14, SEQ ID NO.: 15 и SEQ ID NO.: 16. В некоторых аспектах аминокислотная последовательность на около 75%, 80%, 85%, 90%, 95% или около 100% идентична по всей ее длине аминокислотным последовательностям, непосредственно указанным выше.
В некоторых вариантах осуществления мутант IdeS может иметь выделенную молекулу нуклеиновой кислоты, кодирующую полипептид с аминокислотной последовательностью, по меньшей мере на 70% идентичную по всей ее длине аминокислотным последовательностям, приведенным в группе, состоящей из SEQ ID NO.: 2, SEQ ID NO.: 3, SEQ ID NO.: 4, SEQ ID NO.: 5, SEQ ID NO.: 6, SEQ ID NO.: 7, SEQ ID NO.: 8, SEQ ID NO.: 9, SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12, SEQ ID NO.: 13, SEQ ID NO.: 14, SEQ ID NO.: 15 и SEQ ID NO.: 16. В некоторых аспектах аминокислотная последовательность на около 75%, 80%, 85%, 90%, 95% или около 100% идентична по всей ее длине аминокислотным последовательностям, непосредственно указанным выше.
В некоторых вариантах осуществления полипептид может иметь аминокислотную последовательность, по меньшей мере на 70% идентичную по всей ее длине аминокислотным последовательностям, приведенным в группе, состоящей из SEQ ID NO.: 2, SEQ ID NO.: 3, SEQ ID NO.: 4, SEQ ID NO.: 5, SEQ ID NO.: 6, SEQ ID NO.: 7, SEQ ID NO.: 8, SEQ ID NO.: 9, SEQ ID NO.: 10, SEQ ID NO.: 11, SEQ ID NO.: 12, SEQ ID NO.: 13, SEQ ID NO.: 14, SEQ ID NO.: 15 и SEQ ID NO.: 16 и может экспрессироваться клеткой-хозяином подходящим вектором, содержащим нуклеиновую кислоту, кодирующую идентифицированные пептиды. В одном аспекте молекула нуклеиновой кислоты функционально связана с последовательностью для контроля экспрессии, способной управлять ее экспрессией в клетке-хозяине. В одном аспекте вектор может представлять собой плазмиду. В некоторых аспектах аминокислотная последовательность на около 75%, 80%, 85%, 90%, 95% или около 100% идентична по всей ее длине аминокислотным последовательностям, непосредственно указанным выше. В некоторых аспектах выделенную молекулу нуклеиновой кислоты можно применять для кодирования полипептида.
В некоторых вариантах осуществления мутант IdeS может иметь аминокислотную последовательность, содержащую исходную аминокислотную последовательность, идентифицированную в SEQ ID NO.: 1 (IdeS) с остатком аспарагина в положении 87, 130, 182 и/или 274, мутированную до аминокислоты, отличной от аспарагина. В одном аспекте мутация может обеспечить повышенную химическую стабильность при щелочных значениях pH по сравнению с исходной аминокислотной последовательностью. В другом аспекте мутация может обеспечивать повышение химической стабильности на 50% при щелочных значениях pH по сравнению с исходной аминокислотной последовательностью. В одном аспекте аминокислота может быть выбрана из аспарагиновой кислоты, лейцина и аргинина. В конкретном аспекте остаток аспарагина в положении 87 мутирован до остатка аспарагиновой кислоты. В другом конкретном аспекте остаток аспарагина в положении 130 мутирован до остатка аргинина. В другом конкретном аспекте остаток аспарагина в положении 182 мутирован до остатка лейцина. В другом конкретном аспекте остаток аспарагина в положении 274 мутирован до остатка аспарагиновой кислоты. В другом конкретном аспекте остатки аспарагина в положении 87 и 130 мутированы. В другом конкретном аспекте остатки аспарагина в положении 87 и 182 мутированы. В другом конкретном аспекте остатки аспарагина в положении 87 и 274 мутированы. В другом конкретном аспекте остатки аспарагина в положении 130 и 182 мутированы. В другом конкретном аспекте остатки аспарагина в положении 130 и 274 мутированы. В другом конкретном аспекте остатки аспарагина в положении 182 и 274 мутированы. В другом конкретном аспекте остатки аспарагина в положении 87, 130 и 182 мутированы. В другом конкретном аспекте остатки аспарагина в положении 87, 182 и 274 мутированы. В другом конкретном аспекте остатки аспарагина в положении 130, 182 и 274 мутированы. В другом конкретном аспекте остатки аспарагина в положении 87, 130, 182 и 274 мутированы. В некоторых аспектах аминокислотная последовательность на около 75%, 80%, 85%, 90%, 95% или около 100% идентична по всей ее длине аминокислотным последовательностям, описанным выше. В некоторых аспектах выделенную молекулу нуклеиновой кислоты можно применять для кодирования полипептида.
Специалисты в данной области, знакомые со стандартными способами молекулярной биологии, могут без излишней нагрузки получить и применять мутанты IdeS по настоящему изобретению. Для рекомбинантной ДНК, синтеза олигонуклеотидов, культуры ткани и трансформации можно применять стандартные способы (например, электропорацию, липофекцию). см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, выше, включенный в настоящий документ посредством ссылки для любых целей. Ферментативные реакции и методики получения можно осуществлять в соответствии с описанием производителя или как описано в данном документе.
VI. Общее получение белка
Множество различных методик получения, включая без ограничения аффинную, ионообменную хроматографию, хроматографию со смешанным режимом, эксклюзионную хроматографию и хроматографию с гидрофобным взаимодействием, по отдельности или в комбинации, рассматриваются как входящие в объем настоящего изобретения. Данные хроматографические стадии позволяют разделить смеси белков биологического образца на основе их заряда, степени гидрофобности, размера или их комбинаций, в зависимости от конкретной формы разделения. Для каждого из способов, упомянутых выше, доступно несколько различных хроматографических смол, что позволяет точно адаптировать производственную схему к конкретному задействованному белку. Каждый способ разделения приводит к тому, что белок проходит с разной скоростью через колонку для достижения физического разделения, которое увеличивается по мере того, как они проходят дальше через колонку или селективно прилипают к разделяющей среде. Затем белки либо (i) дифференциально элюируют с использованием соответствующего элюирующего буфера и/или (ii) собирают из проточных фракций, полученных из применяемой колонки, необязательно вследствие промывки колонки соответствующим буфером для уравновешивания. В некоторых случаях белок, представляющий интерес, отделяют от примесей (HCP, белковых вариантов и т.д.), если примеси предпочтительно прилипают к колонке, и белок, представляющий интерес, в меньшей степени, т.е., белок, представляющий интерес, не адсорбируется на твердой фазе конкретной колонки и, таким образом, протекает через колонку. В некоторых случаях примеси отделяют от белка, представляющего интерес, когда они не адсорбируются в колонке и, таким образом, протекают через колонку.
Процесс производства может начинаться на стадии разделения после того, как рекомбинантный белок был получен с использованием предшествующих способов производства, описанных выше, и/или альтернативных способов производства, традиционных в данной области. После получения осветленного раствора или смеси, содержащей белок, представляющий интерес, например, слитый белок, происходит отделение белка, представляющего интерес, от технологических примеси (например, других белков, продуцированных клеткой (например, HCP), а также родственных соединений, таких как кислотные или основные варианты). Можно применять комбинацию одного или более различных способов получения, включая аффинную, ионообменную хроматографию (например, CEX, AEX), хроматографию со смешанным режимом (MM) и/или хроматографию с гидрофобным взаимодействием. Такие стадии получения позволяют разделять смеси компонентов в пределах биологического образца на основе их, например, заряда, степени гидрофобности и/или видимого размера. Для каждой из упомянутых в данном документе методик хроматографии коммерчески доступны многочисленные хроматографические смолы, позволяющие точно адаптировать производственную схему к конкретному задействованному белку. Каждый из способов разделения позволяет белкам либо проходить с разной скоростью через колонку, достигая физического разделения, которое увеличивается по мере того, как они проходят дальше через колонку, либо адсорбироваться селективно разделительной смолой (или средой). Затем белки можно собирать по-разному. В некоторых случаях белок, представляющий интерес, отделяется от компонентов биологического образца, когда другие компоненты специфически адсорбируются на смолу в колонке, а белок, представляющий интерес, не абсорбируется.
Первичное восстановление и инактивация вирусов
В некоторых вариантах осуществления начальные стадии способов получения, раскрытых в настоящем документе, включают разъяснение и первичное извлечение белка, представляющего интерес, из биологического образца. Первичное восстановление будет включать один или более стадий центрифугирования для отделения белка, представляющего интерес, от клетки-хозяина и сопутствующих клеточных остатков. Центрифугирование образца можно выполнять со скоростью, например, без ограничения от 7000 x г до приблизительно 12750 x г.В контексте крупномасштабного производства такое центрифугирование может происходить в оперативном режиме с установленной скоростью потока для достижения, например, уровня мутности 150 NTU в полученном супернатанте. Такой супернатант затем можно собирать для дальнейшей обработки или поточной фильтрации через один или несколько глубинных фильтров для дальнейшего осветления образца.
В некоторых вариантах осуществления первичное извлечение может включать применение одной или нескольких стадий глубинной фильтрации для осветления образца и, таким образом, облегчения обработки белка, представляющего интерес.В другом варианте осуществления первичное восстановление может включать применение одной или более стадий глубинной фильтрации после центрифугирования. Неограничивающие примеры глубинных фильтров, которые можно применять в контексте настоящего изобретения, включают глубинные фильтры Millistak+X0HC, F0HC, D0HC, A1HC, B1HC (EMD Millipore), 3M(модель 30/60ZA, 60/90 ZA, VR05, VR07, глубинные фильтры Delipid (3M Corp.). За глубинными фильтрами обычно следуют фильтр 0,2 мкм, такой как двухслойный Sartopore(Sartorius 0,45/0,2 мкм или картриджи фильтров Millipore Express SHR или SHC. Также можно применять другие фильтры, хорошо известные специалистам.
В определенных вариантах осуществления процесс первичного восстановления также может быть точкой для уменьшения или инактивации вирусов, которые могут присутствовать в биологическом образце. Любые один или более из множества способов уменьшения/инактивации вирусов можно применять в фазе первичного восстановления производства, включая тепловую инактивацию (пастеризацию), pH-инактивацию, обработку буфером/моющим средством, УФ- и облучение γ-лучами и добавление определенных химических инактивирующих средств, таких как β-пропиолактон или, например, фенантролин меди, как описано в патенте США №4534972, полное содержание которого включено в настоящий документ посредством ссылки. В некоторых иллюстративных вариантах осуществления настоящего изобретения образец подвергают воздействию вирусной инактивации посредством моющего средства в ходе фазы первичного восстановления. В другом варианте осуществления образец можно подвергать инактивации при низком pH в ходе фазы первичного восстановления.
В тех вариантах осуществления, в которых применяют уменьшение/инактивацию вируса, биологический образец может быть скорректирован, если необходимо, для дальнейших стадий получения. Например, после вирусной инактивации с низким pH, pH образца обычно доводят до более нейтрального pH, например, от примерно 4,5 до около 8,5, до продолжения процесса получения. Дополнительно смесь может быть разбавлена водой для инъекций (WFI) с получением необходимой проводимости.
Аффинная хроматография
В определенных иллюстративных вариантах осуществления может быть предпочтительно подвергать биологический образец аффинной хроматографии с получением белка, представляющего интерес.Хроматографический материал способен селективно или специфически связываться или взаимодействовать с белком, представляющим интерес.Неограничивающие примеры такого хроматографического материала включают белок A и белок G. Кроме того, включает хроматографический материал, включающий, например, белок или его часть, способен связываться с или взаимодействовать с белком, представляющим интерес.В одном аспекте белок, представляющий интерес, представляет собой белок против VEGF, такой как афлиберцепт, MiniTrap или белок, родственный им.
Аффинная хроматография может включать подвергание биологического образца воздействию колонки, содержащей подходящую смолу с белком A. Применяемый в данном документе термин «белок A» охватывает белок A, выделенный из его природного источника, белок A, полученный синтетическим путем (например, посредством пептидного синтеза или посредством рекомбинантных методик), и его варианты, которые сохраняют способность связывать белки, которые имеют область CH2/CH3. В определенных аспектах смола с белком A пригодна для получения на основе аффинности и выделения различных изотипов антител посредством специфического взаимодействия с частью Fc молекулы, если она содержит такую область.
Существует несколько коммерческих источников смолы с белком A. Одна подходящая смола представляет собой MabSelect(от GE Healthcare. Подходящие смолы включают без ограничения MabSelect SuRe™, MabSelect SuRe LX, MabSelect, MabSelect SuRe pcc, MabSelect Xtra, rProtein A Sepharose от GE Healthcare, ProSep HC, ProSep Ultra и ProSep Ultra Plus от EMD Millipore, MapCapture от Life Technologies. Неограничивающий пример подходящей колонки, упакованной с MabSelect™, представляет собой колонку с диаметром около 1,0 см x длину около 21,6 см (объем слоя 17 мл). Подходящая колонка может содержать смолу, такую как MabSelect(SuRe или аналогичную смолу. Белок A также может быть коммерчески приобретен от Repligen, Pharmacia и Fermatech.
Аффинность колонки может быть уравновешена подходящим буфером перед загрузкой образца. После загрузки колонки ее можно промыть один или более раз посредством подходящего промывочного буфера. Затем колонку можно элюировать с использованием подходящего элюирующего буфера, например, глицин-HCl, уксусной кислоты или лимонной кислоты. Элюат можно контролировать с использованием способов, хорошо известных специалистам в данной области, таких как УФ-детектор. Элюированные фракции, представляющие интерес, могут быть собраны, а затем подготовлены для последующей обработки.
В одном аспекте элюат можно подвергать вирусной инактивации, например, либо посредством моющего средства, либо низкого pH. Подходящая концентрация моющего средства или pH (и время) могут быть выбраны с получением необходимого результата относительно вирусной инактивации. После вирусной инактивации элюат обычно подвергают регулированию pH и/или проводимости для последующих стадий получения.
Элюат можно подвергать фильтрация через глубинный фильтр для удаления мутности и/или различных примесей из белка, представляющего интерес, перед дополнительными хроматографическими стадиями дополнительной очистки. Примеры подходящих глубинных фильтров включают без ограничения фильтры Millistak+XOHC, FOHC, DOHC, AIHC, X0SP и BIHC Pod (EMD Millipore), или фильтры Zeta Plus 30ZA/60ZA, 60ZA/90ZA, delipid, VR07 и VR05 (3M). Многоступенчатый фильтр Emphaze AEX Hybrid Purifier также можно применять для очистки элюата. Пул элюата, возможно, потребуется отрегулировать до определенного значения pH и проводимости для обеспечения необходимого удаления примесей и извлечения продукта на стадии глубинной фильтрации.
Анионообменная хроматография
В определенных вариантах осуществления белок, представляющий интерес, получают посредством подвергания биологического образца по меньшей мере одной стадии анионообменного разделения. В одном случае анионообменная стадия может происходить после процедуры аффинной хроматографии (например, аффинности с белком A). В других случаях анионообменная стадия может происходить перед стадией аффинной хроматографии. В других протоколах анионный обмен может происходить как до, так и после стадии аффинной хроматографии. В одном аспекте белок, представляющий интерес, представляет собой либо афлиберцепт, либо MiniTrap.
Применение материала анионного обмена по сравнению с материалом катионного обмена частично основано на локальных зарядах белка, представляющего интерес.Анионообменную хроматографию можно применять в комбинации с другими хроматографическими процедурами, такими как аффинная хроматография, эксклюзионная хроматография, хроматография с гидрофобным взаимодействием а также другие режимы хроматографии, известные специалисту в данной области.
При выполнении разделения исходную белковую композицию (биологический образец) можно приводить в контакт с анионообменнным материалом с использованием любой из множества методик, например, с использованием методики серийного производства или хроматографической методики.
В контексте серийного производства анионообменный материал получают в необходимом исходном буфере или уравновешивают им. При получении получают суспензию анионообменного материала. Биологический образец приводят в контакт с суспензией для обеспечения адсорбции белка анионообменным материалом. Раствор, содержащий кислотные формы, которые не связываются с материалом AEX, получают из суспензии посредством обеспечения осаждения суспензии и удаления супернатанта. Суспензию можно подвергнуть одной или более стадиям промывки и/или стадиям элюирования.
В контексте хроматографического разделения хроматографическую колонку применяют для вмещения хроматографической подложки материала (смолы или твердой фазы). Образец, содержащий белок, представляющий интерес, загружают в определенную хроматографическую колонку. Затем колонку можно настроить на одну или более стадий промывки с использованием подходящего промывочного буфера. Компоненты образца, не адсорбированные смолой, скорее всего будут протекать через колонку. Компоненты, адсорбированные смолой, можно дифференцированно элюировать с использованием подходящего элюирующего буфера.
Стадию промывки обычно осуществляют посредством хроматографии AEX с использованием условий, аналогичных условиям загрузки, или, в качестве альтернативы, посредством снижения pH и/или увеличения ионной силы/проводимости промывки ступенчатым или линейным градиентом. В одном аспекте водный раствор соли, применяемый как в загрузочном, так и в промывочном буфере, имеет pH, равный или близкий к изоэлектрической точке (pI) белка, представляющего интерес.Как правило, pH на около 0-2 единицы выше или ниже pI белка, представляющего интерес, тем не менее, он может быть на 0-0,5 единиц выше или ниже. Он также может быть равен pI белка, представляющего интерес.
Анионное средство может быть выбрано из группы, состоящей из ацетата, хлорида, формиата и их комбинации. Катионное средство может быть выбрано из группы, состоящей из триса, аргинина, натрия и их комбинации. В конкретном примере буферный раствор представляет собой буфер трис/формиат.Буфер может быть выбран из группы, состоящей из пиридина, пиперазина, L-гистидина, бис-триса, бис-трис-пропана, имидазола, N-этилморфолина, TEA (триэтаноламина), триса, морфолина, N-метилдиэтаноламина, AMPD (2-амино-2-метил- l,3-пропандиола), диэтаноламина, этаноламина, AMP (2-амино-2-метил-l-пропанола), пиперазина, 1,3-диаминопропана и пиперидина.
Упакованная анионообменная хроматографическая колонка, анионообменное мембранное устройство, анионообменное монолитное устройство или глубинный фильтрующий материал могут работать либо в режиме связывания с элюированием, либо в режиме проточной фракции, либо в гибридном режиме, в котором белки взаимодействуют с хроматографическим материалом и могут быть очищены от такого материала с использованием буфера, который аналогичен или по существу аналогичен загрузочному буферу.
В режиме связывания-элюирования колонку или мембранное устройство сначала кондиционируют буфером с соответствующей ионной силой и pH в условиях, когда определенные белки будут адсорбироваться на матрице на основе смолы. Например, в ходе загрузки белок, представляющий интерес, может адсорбироваться смолой вследствие электростатического притяжения. После промывки колонки или мембранного устройства буфером для уравновешивания или другим буфером с другим pH и/или проводимостью восстановление продукта достигается за счет увеличения ионной силы (т.е., проводимости) элюирующего буфера для конкурирования с растворенным веществом за заряженные участки анионообменной матрицы. Изменение pH и, таким образом, изменение заряда растворенного вещества представляет собой еще один способ добиться элюирования растворенного вещества. Изменение проводимости или pH может быть постепенным (градиентное элюирование) или ступенчатым (ступенчатое элюирование).
В режиме проточной фракции колонка или мембранное устройство работает с выбранным pH и проводимостью, так что белок, представляющий интерес, не связывается со смолой или мембраной, тогда как кислотные формы будут либо сохраняться на колонке, либо будут иметь отличный профиль элюирования по сравнению с белком, представляющим интерес.В контексте данной стратегии, кислотные формы будут взаимодействовать или связываться с хроматографическим материалом в подходящих условиях, тогда как белок, представляющий интерес, и определенные агрегаты и/или фрагменты белка, представляющего интерес, будет протекать через колонку.
Неограничивающие примеры анионообменных смол включают группы диэтиламиноэтила (DEAE), четвертичного аминоэтила (QAE) и четвертичного амина (Q). Дополнительные неограничивающие примеры включают Poros 50PI и Poros 50HQ, которые представляют собой жесткие полимерные гранулы с каркасом, состоящим из сшитого поли[стирол-дивинилбензола]; Capto Q Impres и Capto DEAE, которые представляют собой гранулы агарозы с высокой текучестью; Toyopearl QAE-550, Toyopearl DEAE-650 и Toyopearl GigaCap Q-650, которые представляют собой гранулы с полимерным основанием; Fractogel(EMD TMAE Hicap, который представляет собой синтетическую полимерную смолу с ионообменным материалом типа «щупальца»; Sartobind STIC(PA nano, который представляет собой устойчивую к соли хроматографическую мембрану с лигандом первичного амина; Sartobind Q nano, который представляет собой сильную анионообменную хроматографическую мембрану; CUNO BioCap, который представляет собой среду глубинного фильтра Zeta-Plus, изготовленную из неорганических фильтрующих добавок, очищенной целлюлозы и ионообменной смолы; и XOHC, который представляет собой среду глубинного фильтра, изготовленную из неорганической фильтрующей добавки, целлюлозы и смешанных сложных эфиров целлюлозы.
В определенных вариантах осуществления загрузку белка образца можно регулировать до общей загрузки белка в колонке от около 50 г/л до около 500 г/л, или от около 75 г/л до около 350 г/л, или от около 200 г/л до около 300 г/л. В других иллюстративных вариантах осуществления концентрацию белка смеси загрузки белка регулируют до концентрации белка материала, загруженного в колонку, от около 0,5 г/л до около 50 г/л, от около 1 г/л до около 20 г/л, или от около 3 г/л до около 10 г/л. В других вариантах осуществления концентрация белка смеси загрузки белка регулируют до концентрации белка в материале в колонке около 37 г/л.
Добавки, такие как полиэтиленгликоль (ПЭГ), моющие средства, аминокислоты, сахара, хаотропные средства, могут быть добавлены для повышения эффективности разделения для достижения лучшего разделения, извлечения и/или качества продукта.
В некоторых вариантах осуществления, включая те, которые относятся к афлиберцепту и/или VEGF MiniTrap, способы по настоящему изобретению можно применять для селективного удаления, значительного уменьшения или по существу удаления по меньшей мере 10% белковых вариантов с получением таким образом белковых композиций, которые имеют уменьшенное содержание белковых вариантов.
Белковые варианты могут включать модификации одного или более остатков следующим образом: один или более аспарагинов дезамидированы; одна или более аспарагиновых кислот преобразованы в аспартат-глицин и/или Asn-Gly; один или более метионинов окислены; один или более триптофанов преобразованы в N-формилкинуренин; один или более триптофанов представляют собой моно-гидроксилтриптофан; один или более триптофанов представляют собой ди-гидроксилтриптофан; один или более триптофанов представляют собой три-гидроксилтриптофан; один или более аргининов преобразованы в Arg 3-дезоксиглюкозон; C-концевой глицин отсутствует; и/или существует один или более негликозилированных гликосайтов. Было также отмечено, что применение AEX снижает окисленные и кислотные формы вариантов анти-VEGF в указанном аффинном элюате. По сравнению с аффинным элюатом, после применения AEX, проточная фракция может продемонстрировать снижение по меньшей мере на около 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, или 5% окисленных и/или кислотных форм вариантов против VEGF.
Белковые варианты афлиберцепта и/или VEGF MiniTrap могут включать одно или более из (i) окисленных гистидинов из остатков гистидина, выбранных из His86, His110, His145, His209, His95, His19 и/или His203; (ii) окисленных остатков триптофана, выбранных из остатков триптофана в Trp58 и/или Trp138; (iii) окисленного остатка тирозина в Tyr64; (iv) окисленных остатков фенилаланина, выбранных из Phe44 и/или Phe166; и/или (v) окисленных остатков метионина, выбранных из Met10, Met 20, Met163 и/или Met192.
Катионообменная хроматография
Композиции по настоящему изобретению могут быть получены посредством подвергания биологического образца, содержащего белок, представляющий интерес, по меньшей мере одной катионообменной (CEX) стадии. В определенных иллюстративных вариантах осуществления стадия CEX будет дополнять стадию AEX и ее осуществляют либо до, либо после стадии AEX. В одном аспекте белок, представляющий интерес, представляет собой либо афлиберцепт, либо MiniTrap, либо родственную им молекулу.
Применение материала катионного обмена по сравнению с материалом анионного обмена, такого как материалы анионного обмена, обсуждаемые выше, частично основано на локальных зарядах белка, представляющего интерес, в данном растворе и необходимых условиях разделения. В объем настоящего изобретения входит применение стадии катионного обмена перед применением стадии анионного обмена или стадии анионного обмена перед применением стадии катионного обмена. Кроме того, в объем настоящего изобретения входит применение только стадии катионного обмена в комбинации с другими хроматографическими процедурами.
При осуществлении катионного обмена образец, содержащий белок, представляющий интерес, можно приводить в контакт с катионообменным материалом посредством применения какой-либо из множества методик, например, с использованием методики серийного производства или хроматографической методики, как описано выше для AEX.
Водный раствор соли можно применять в качестве как загрузочного, так и промывочного буфера с pH ниже изоэлектрической точки (pI) белка, представляющего интерес.В одном аспекте pH на около 0-5 единиц ниже pI белка. В другом аспекте он на 1-2 единицы ниже pI белка. В другом аспекте он на 1-1,5 единицы ниже pI белка.
В определенных вариантах осуществления концентрацию анионного средства в водном растворе соли повышают или снижают для достижения pH от около 3,5 до около 10,5, или от около 4 до около 10, или от около 4,5 до около 9,5, или от около 5 до около 9, или от около 5,5 до около 8,5, или от около 6 до около 8, или от около 6,5 до около 7,5. В одном аспекте концентрацию анионного средства повышают или снижают в водном растворе соли с целью достижения pH 5, или 5,5, или 6, или 6,5, или 6,8, или 7,5. Буферные системы, подходящие для применения в способах CEX, включают без ограничения трис-формиат, трис-ацетат, сульфат аммония, хлорид натрия и сульфат натрия.
В определенных вариантах осуществления проводимость и pH водного раствора соли регулируют посредством повышения или снижения концентрации катионного средства. В одном аспекте концентрацию катионного средства поддерживают в диапазоне от около 20 ммоль до около 500 ммоль, около 50 ммоль до около 350 ммоль, около 100 ммоль до около 300 ммоль, или около 100 ммоль до около 200 ммоль. Неограничивающие примеры катионного средства могут быть выбраны из группы, состоящей из натрия, триса, триэтиламина, аммиака, аргинина и их комбинации.
Упакованная катионообменная хроматографическая колонка или устройство с катионообменной мембраной могут работать как в режиме связывания-элюирования, так и в проточном режиме, или гибридном режиме, причем продукт демонстрирует связывание или взаимодействие с хроматографическим материалом, но ее можно очистить от такого материала с использованием буфера, который является таким же или по существу аналогичным загрузочному буферу (подробности данных режимов изложены выше).
Катионные заместители включают карбоксиметил (CM), сульфоэтил (SE), сульфопропил (SP), фосфат (P) и сульфонат (S). Дополнительные катионные материалы включают без ограничения Capto SP ImpRes, который представляет собой гранулы агарозы с высокой текучестью; CM Hyper D степени F, который представляет собой керамические гранулы, покрытые и пропитанные функционализированным гидрогелем, 250-400 ионных групп мкэкв./мл; Eshmuno S, который представляет собой гидрофильную базовую матрицу на основе поливинилового эфира с 50-100 мкмэкв./мл ионной емкости; Nuvia C Prime, который представляет собой гидрофобную катионообменную среду, состоящую из макропористой высокосшитой гидрофильной полимерной матрицы 55-75 με/мл; Nuvia S, который имеет базовую матрицу UNOsphere с 90 -150 με/мл ионных групп; Poros HS, который представляет собой жесткие полимерные гранулы с каркасом, состоящим из сшитого поли[стирол-ливинилбензола]; Poros XS, который представляет собой жесткие полимерные гранулы с каркасом, состоящим из сшитого поли[стирол-дивинилбензола]; Toyo Pearl Giga Cap CM 650M, который представляет собой гранулы с полимерным основанием 0,225 мэкв./мл ионной емкости; Toyo Pearl Giga Cap S 650M, который представляет собой гранулы с полимерным основанием; Toyo Pearl MX TRP, который представляет собой гранулы с полимерным основанием. Отмечено, что хроматографию CEX можно применять со смолами MM, описанными в данном документе.
Загрузка белка образца, содержащего белок, представляющий интерес, регулируют до общей загрузки белка в колонке от около 5 г/л до около 150 г/л, или от около 10 г/л до около 100 г/л, от около 20 г/л до около 80 г/л, от около 30 г/л до около 50 г/л, или от около 40 г/л до около 50 г/л. В определенных вариантах осуществления концентрацию белка смеси загрузки белка регулируют до концентрации белка материала, подлежащего загрузке в колонку, от около 0,5 г/л до около 50 г/л, или от около 1 г/л до около 20 г/л.
Добавки, такие как полиэтиленгликоль, моющие средства, аминокислоты, сахара, хаотропные средства, могут быть добавлены для повышения эффективности разделения для достижения таким образом лучшего разделения, извлечения и/или качества продукта.
В определенных вариантах осуществления, включая те, что касаются афлиберцепта или антитела к VEGF или VEGF MiniTrap, способы по настоящему изобретению можно применять для селективного удаления, значительного снижения или по существу удаления всех оксо-вариантов в образце, где белок, представляющий интерес, будет по существу представлять собой проточную фракцию процедуры CEX, тогда как оксо-варианты будут по существу захвачены средой колонки.
Хроматография со смешанным режимом
Хроматография со смешанным режимом (“MM”) можно применять для получения композиций по настоящему изобретению. Хроматография MM, также называемая в данном документе “многомодальной хроматографией”, представляет собой хроматографическую стратегию, в которой применяется подложка, содержащая лиганд, который способен обеспечивать по меньшей мере два различных взаимодействия с аналитом или белком, представляющим интерес, из образца. Один из данных сайтов обеспечивает привлекательный тип взаимодействия зарядов между лигандом и белком, представляющим интерес, а другой сайт обеспечивает донорно-акцепторное взаимодействие электронов и/или гидрофобное и/или гидрофильное взаимодействие. Донорно-акцепторные взаимодействия электронов включают такие взаимодействия, как водородная связь, π-π, катион-π, перенос заряда, диполь-диполь, индуцированный диполь и т.д.
Смола в колонке, применяемая для разделения со смешанным режимом, может представлять собой Capto Adhere. Capto Adhere представляет собой сильный анионообменный материал с многомодальными техническими характеристиками. Его основная матрица представляет собой сильно сшитую агарозу с лигандом (N-бензил-N-метилэтанолмин), который проявляет различные функциональные возможности для взаимодействия, такие как ионное взаимодействие, водородная связь и гидрофобное взаимодействие. В определенных аспектах смола, применяемая для разделения со смешанным режимом, выбрана из PPA-HyperCel и HEA-HyperCel. Базовые матрицы PPA-HyperCel и HEA-HyperCel представляют собой сшитую целлюлозу с высокой пористостью. Их лигандами являются фенилпропиламин и гексиламин, соответственно. Фенилпропиламин и гексиламин обеспечивают различные варианты селективности и гидрофобности для разделения белка. Дополнительные подложки для хроматографии со смешанным режимом включают без ограничения Nuvia C Prime, Toyo Pearl MX Trp 650M и Eshmuno(HCX. В определенных аспектах смола для хроматографии со смешанным режимом состоит из лигандов, связанных с органической или неорганической подложкой, иногда обозначаемых как базовая матрица, напрямую или через разделитель. Подложка может быть в форме частиц, таких как по существу сферические частицы, монолит, фильтр, мембрана, поверхность, капилляры и т.п.В определенных аспектах подложка получена из исходного полимера, такого как сшитый углеводородный материал, например, агароза, агар, целлюлоза, декстран, хитозан, конжак, каррагинан, геллан, альгинат и т.п.Для получения высокой адсорбционной способности подложка может быть пористой, и лиганды затем присоединяются к внешним поверхностям, а также к поверхностям пор. Такие подложки из исходного полимера могут быть получены в соответствии со стандартными способами, такими как обратное гелеобразование суспензии (S Hjerten: Biochim Biophys Acta 79(2), 393-398 (1964), полное содержание которой включено в настоящий документ посредством ссылки). В качестве альтернативы, подложка может быть получена из синтетического полимера, такого как сшитые синтетические полимеры, например, стирол или производные стирола, дивинилбензол, акриламиды, сложные эфиры акрилата, сложные эфиры метакрилата, сложные виниловые эфиры, виниламиды и т.п.Такие синтетические полимеры могут быть получены посредством стандартных способов, см. “Styrene based polymer supports developed by suspension polymerization” (R Arshady: Chimica e L'Industria 70(9), 70-75 (1988), полное содержание которой включено в настоящий документ посредством ссылки). Подложки из пористого исходного или синтетического полимера также доступны из коммерческих источников, таких как GE Healthcare, Упсала, Швеция.
Загрузка белка смеси биологического образца, содержащая белок, представляющий интерес, можно регулировать до общей загрузки белка в колонке от около 25 г/л до около 750 г/л, или от около 75 г/л до около 500 г/л, или от около 100 г/л до около 300 г/л. В определенных иллюстративных вариантах осуществления концентрацию белка смеси загрузки белка регулируют до концентрации белка материала, загруженного в колонку, от около 1 г/л до около 50 г/л, или от около 9 г/л до около 25 г/л.
Добавки, такие как полиэтиленгликоль, моющие средства, аминокислоты, сахара, хаотропные средства, могут быть добавлены для повышения эффективности разделения для достижения таким образом лучшего разделения, извлечения и/или качества продукта.
В определенных вариантах осуществления, включая те, которые касаются афлиберцепта и/или MiniTrap, способы по настоящему изобретению можно применять для селективного удаления, значительного снижения или по существу удаления всех PTM, включая оксо-варианты.
Способы получения композиций по настоящему изобретению можно также применять в непрерывном режиме хроматография. В данном режиме применяют по меньшей мере две колонки (называемые “первой” колонкой и “второй” колонкой). В определенных вариантах осуществления данный непрерывный режим хроматографии можно осуществлять таким образом, что элюированные фракции и/или очищенные фракции, содержащие PTM, например, оксо-варианты, затем могут быть загружены последовательно или параллельно во вторую колонку (с разведением или без него).
В одном варианте осуществления выбранная среда для непрерывного режима может представлять собой одну из многих хроматографических смол с боковыми гидрофобными и анионообменными функциональными группами, монолитную среду, мембранно-адсорбирующую среду или среду для глубинной фильтрации.
Хроматография с гидрофобным взаимодействием
Композиции по настоящему изобретению также могут быть получены с использованием хроматографии с гидрофобным взаимодействием (HIC).
При осуществлении разделения биологический образец приводят в контакт с материалом для HIC, например, с использованием методики серийного производства или с использованием колоночной или мембранной хроматографии. Перед обработкой посредством HIC может быть необходимо скорректировать концентрацию солевого буфера для достижения необходимого связывания/взаимодействия белков со смолой или мембраной.
Поскольку ионообменная хроматография основана на локальном заряде белка, представляющего интерес, для селективного разделения, в хроматографии с гидрофобным взаимодействием применяются гидрофобные свойства белков для достижения селективного разделения. Гидрофобные группы на белке или внутри белка взаимодействуют с гидрофобными группами хроматографической смолы или мембраны. Как правило, в подходящих условиях чем более гидрофобный белок (или части белка), тем сильнее он взаимодействует с колонкой или мембраной. Таким образом, в подходящих условиях HIC можно применять для облегчения отделения технологических примесей (например, HCP), а также родственных веществ (например, агрегатов и фрагментов) от белка, представляющего интерес, в образце.
Подобно ионообменной хроматографии, колонка HIC или мембранное устройство HIC также может работать в режиме элюирования, проточном или гибридном режиме, в котором продукт связывается или взаимодействует с хроматографическим материалом, но может быть очищен от такого материала с использованием буфера, который является таким же или по существу аналогичным загрузочному буферу. (Подробности данных режимов описаны выше в связи с обработкой AEX.) Поскольку гидрофобные взаимодействия наиболее сильны при высокой ионной силе, данную форму разделения удобно проводить после стадии элюирования соли, такой как те, которые обычно используются в связи с ионообменной хроматографией. В качестве альтернативы, соли можно добавлять в образец перед применением стадии HIC. Адсорбции белка на колонке HIC благоприятствует высокая концентрация соли, но фактическое содержание может варьировать в широком диапазоне в зависимости от природы белка, представляющего интерес, типа соли и конкретного выбранного лиганда HIC. Различные ионы могут быть организованы в так называемый солофобный ряд в зависимости от того, способствуют ли они гидрофобным взаимодействиям (эффекты высаливания) или нарушают структуру воды (хаотропный эффект) и приводят к ослаблению гидрофобного взаимодействия. Катионы классифицируются с точки зрения увеличения эффекта высаливания в виде Ba2+; Ca2+; Mg2+; Li+; Cs+; Na+; K+; Rb+; NH4+, в то время как анионы могут быть отнесены к категории усиления хаотропного эффекта в виде PO43-; SO42-; CH3CO3-; CI-; Br-; NO3-; ClO4-; I-; SCN-.
В целом, сульфаты Na+, K+или NH4+эффективно обеспечивают взаимодействие лиганда с белком с использованием HIC. Могут быть составлены соли, влияющие на силу взаимодействия, определяемую следующим соотношением: (NH4)2SO4>Na2SO4>NaCl>NH4C1>NaBr>NaSCN. Как правило, полезны концентрации соли с содержанием сульфата аммония от 0,75 M до около 2 M или NaCl от 1 M до около 4 M.
Среды HIC обычно содержат базовую матрицу (например, сшитую агарозу или синтетический сополимерный материал), с которой связаны гидрофобные лиганды (например, алкильные или арильные группы). Подходящая среда для HIC включает агарозную смолу или мембрану, функционализированную фенильными группами (например, Phenyl Sepharose(от GE Healthcare или Phenyl Membrane от Sartorius). Многие смолы HIC доступны в продаже. Примеры включают без ограничения Capto Phenyl, Phenyl Sepharose(6 Fast Flow с низкой или высокой степенью замещения, Phenyl Sepharose (High Performance, Octyl Sepharose(High Performance (GE Healthcare); пропил Fractogel (EMD или фенил Fractogel(EMD (E. Merck, Германия); метил Macro-Prep(или колонки с трет-бутилом Macro-Prep((Bio-Rad, Калифорния); WP HI-Propyl (C3)((J. T. Baker, Нью-Джерси); и простой эфир, фенил или бутил Toyopearl((TosoHaas, PA); ToyoScreen PPG; фенил ToyoScreen; бутил ToyoScreen; гексил ToyoScreen; GE HiScreen и Butyl FF HiScreen Octyl FF.
Загрузка белка образца, содержащего белок, представляющий интерес, регулируют до общей загрузки белка в колонке от около 50 г/л до около 1000 г/л, от около 5 г/л до около 150 г/л, от около 10 г/л до около 100 г/л, от около 20 г/л до около 80 г/л, от около 30 г/л до около 50 г/л или от около 40 г/л до около 50 г/л. В определенных вариантах осуществления концентрацию белка смеси загрузки белка регулируют до концентрации белка материала, подлежащего загрузке в колонку, от около 0,5 г/л до около 50 г/л, или от около 1 г/л до около 20 г/л.
Поскольку pH, выбранный для любого конкретного производственного процесса, должен быть совместим со стабильностью и активностью белка, конкретные условия pH могут быть специфичными для каждого применения. Тем не менее, поскольку при pH 5,0-8,5 конкретные значения pH имеют очень небольшое значение для конечной селективности и разрешения разделения HIC, такие условия могут быть предпочтительными. Повышение pH ослабляет гидрофобные взаимодействия, и удерживание белков меняется более резко при значениях pH выше 8,5 или ниже 5,0. Кроме того, изменения ионной силы, присутствие органических растворителей, температуры и pH (особенно в изоэлектрической точке pI, когда нет чистого поверхностного заряда) могут влиять на структуру и растворимость белка и, следовательно, на взаимодействие с другими гидрофобными поверхностями, такими как таковые в среде HIC, и, следовательно, в некоторых вариантах осуществления настоящее изобретение включает стратегии получения, в которых одно или несколько из вышеперечисленных регулируют для достижения необходимого снижения технологических примесей и/или родственных веществ.
В определенных вариантах осуществления способы спектроскопии, такие как УФ, NIR, FTIR, флуоресцентная и рамановская, можно применять для мониторинга белка, представляющего интерес, и примесей в режиме в системе, у потока или в контуре, который затем можно применять для контроля уровня агрегатов в объединенном материале, собранном из выходящего потока адсорбента HIC. В определенных вариантах осуществления способы мониторинга в системе, у потока или в контуре можно применять либо в линии выходящего потока стадии хроматографии или в сосуде для сбора для обеспечения достижения необходимого качества/восстановления. В определенных вариантах осуществления УФ-сигнал можно применять в качестве суррогата для достижения соответствующего качества/восстановления продукта, причем УФ-сигнал может быть обработан соответствующим образом, включая без ограничения такие способы обработки, как интеграция, дифференциация и скользящее среднее, так что нормальная изменчивость процесса может быть устранена и может быть достигнуто целевое качество продукта. В определенных вариантах осуществления такие измерения могут быть объединены со способами поточного разбавления, так что концентрация ионов/проводимость загрузки/промывки можно контролировать с использованием обратной связи и, следовательно, облегчать контроль качества продукта.
Эксклюзионная хроматография
Эксклюзионная хроматография или гельфильтрация основана на разделении компонентов в зависимости от их молекулярного размера. Разделение зависит от количества времени, которое вещества проводят в пористой стационарной фазе по сравнению со временем, проведенным в жидкости. Вероятность того, что молекула будет находиться в поре, зависит от размера молекулы и поры. Кроме того, способность вещества проникать в поры определяется диффузионной подвижностью макромолекул, которая выше для небольших макромолекул. Очень большие макромолекулы могут вообще не проникать в поры стационарной фазы; а для очень маленьких макромолекул вероятность проникновения близка к единице. В то время как компоненты с большей молекулярной массой перемещаются быстрее через стационарную фазу, компоненты с малым молекулярным размером имеют большую длину пути через поры стационарной фазы и, таким образом, дольше задерживаются в стационарной фазе.
Хроматографический материал может содержать материал разделения по размеру, где материал разделения по размеру представляет собой смолу или мембрану. Матрица, применяемая для исключения размера, предпочтительно представляет собой инертную гелевую среду, которая может представлять собой композит из поперечно-сшитых полисахаридов, например, поперечно-сшитой агарозы и/или декстрана в форме сферических шариков. Степень сшивки определяет размер пор, которые присутствуют в набухших гранулах геля. Молекулы больше определенного размера не попадают в гранулы геля и, таким образом, наиболее быстро проходят через хроматографический слой. Более мелкие молекулы, такие как моющее средство, белок, ДНК и т.п., которые проникают в гранулы геля в разной степени в зависимости от их размера и формы, задерживаются при прохождении через слой. Таким образом, молекулы обычно элюируются в порядке уменьшения размера молекул.
Пористые хроматографические смолы, подходящие для гель-хроматографии вирусов, могут состоять из декстрозы, агарозы, полиакриламида или диоксида кремния, которые имеют разные физические характеристики. Также можно применять комбинации полимеров. Чаще всего применяют те, которые продаются под торговым названием «SEPHADEX» от Amersham Biosciences. Также подходят подложки другого размера из других конструкционных материалов, например Toyopearl 55F (полиметакрилат от Tosoh Bioscience, Montgomery Pa.) и Bio-Gel P-30 Fine (BioRad Laboratories, Геркулес, Калифорния).
Загрузка белка образца, содержащего белок, представляющий интерес, может регулировать до общей загрузки белка в колонке от около 50 г/л до около 1000 г/л, от около 5 г/л до около 150 г/мл, от около 10 г/л до около 100 г/л, от около 20 г/л до около 80 г/л, от около 30 г/л до около 50 г/л, или от около 40 г/л до около 50 г/л. В определенных вариантах осуществления концентрацию белка смеси загрузки белка регулируют до концентрации белка материала, подлежащего загрузке в колонку, от около 0,5 г/л до около 50 г/л, или от около 1 г/л до около 20 г/л.
Вирусная фильтрация
Вирусная фильтрация представляет собой специальную стадию производственного процесса, снижающую вирусную нагрузку. Данную стадию обычно выполняют после хроматографической полировки. Снижения количества вирусов можно добиться с использованием подходящих фильтров, включая без ограничения Planova 20N™, 50 N или BioEx от Asahi Kasei Pharma, фильтры Viresolve(от EMD Millipore, ViroSart CPV от Sartorius, или фильтр Ultipor DV20 или DV50(от Pall Corporation. Обычному специалисту в данной области будет очевиден выбор подходящего фильтра для получения необходимых характеристик фильтрации.
Ультрафильтрация/диафильтрация
В определенных вариантах осуществления настоящего изобретения применяются ультрафильтрация и диафильтрация для дополнительной концентрации и составления белка, представляющего интерес.Ультрафильтрация подробно описана в Microfiltration and Ultrafiltration: Principles and Applications, L. Zeman and A. Zydney (Marcel Dekker, Inc., New York, N.Y., 1996); и в Ultrafiltration Handbook, Munir Cheryan (Technomic Publishing, 1986; ISBN No. 87762- 456-9); полное содержание которых включены в настоящий документ посредством ссылки. Одним из процессов фильтрации является фильтрация тангенциального потока, как описано в каталоге Millipore под названием «Pharmaceutical Process Filtration Catalogue» стр.177-202 (Bedford, Mass., 1995/96), полное содержание которого включено в настоящий документ посредством ссылки. Под ультрафильтрацией обычно понимают фильтрацию с использованием фильтров с размером пор менее 0,1 мкм. При использовании фильтров, имеющих такой маленький размер пор, объем образца может быть уменьшен за счет проникновения буфера для образца через поры мембраны фильтра, в то время как белки остаются над поверхностью мембраны.
Специалист в данной области может выбрать подходящее устройство мембранного фильтра для операции УФ/ДФ. Примеры мембранных кассет, подходящих для настоящего изобретения, включают без ограничения кассеты Pellicon 2 или Pellicon 3 с мембранами 10 кДа, 30 кДа или 50 кДа от EMD Millipore, мембранные кассеты Kvick 10 кДа, 30 кДа или 50 кДа от GE Healthcare, и кассеты Centramate или Centrasette 10 кДа, 30 кДа или 50 кДа от Pall Corporation.
Иллюстративные стратегии получения
Первичное восстановление может происходить путем последовательного применения снижения pH, центрифугирования и фильтрации для удаления клеток и клеточный остатков (включая HCP) из сбора производственного биореактора. Настоящее изобретение направлено на подвергание биологического образца, содержащего белок, представляющий интерес, из первичного восстановления одной или более стадиям получения, включая (без определенного порядка) AEX, CEX, SEC, HIC и/или MM. Определенные аспекты настоящего изобретения включают дополнительные стадии обработки. Примеры дополнительных процедур обработки включают осаждение этанолом, изоэлектрическое фокусирование, обращеннофазовую ВЭЖХ, хроматографию на силикагеле, хроматографию на гепарине Sepharose™, последующую анионообменную хроматографию и/или последующую катионообменную хроматографию, хроматофокусирование, SDS-PAGE, осаждение сульфатом аммония, хроматография с гидроксиапатитом, гель-электрофорез, диализ и аффинную хроматографию (например, с использованием белка A или G, антитела, специфического субстрата, лиганда или антигена в качестве реагента захвата). В определенных аспектах температура колонки (а также другие параметры) могут независимо варьировать для улучшения эффективности разделения и/или выхода любой конкретной стадии получения.
В определенных вариантах осуществления несвязанная проточная фракция и промывочные фракции могут быть дополнительно фракционированы и комбинация фракций, обеспечивающих целевую чистоту продукта, могут быть объединены.
Стадии загрузки колонки и промывки могут контролироваться посредством измерения в контуре, у потока или вне контура уровней примесей/веществ, связанных с продуктом, либо в выходящем потоке колонки, либо в собранном пуле, либо в обоих, для достижения конкретной цели качество продукции и/или выхода. В некоторых вариантах осуществления концентрацию в загрузке можно динамически контролировать посредством разбавления в контуре, серийного или непрерывного разбавления буферами или другими растворами для достижения разделения, необходимого для повышения эффективности разделения и/или выхода.
Примеры таких производственных процессов изображены на Фиг. 5-8.
На Фиг. 5 представлен один иллюстративный вариант осуществления, применяемый для получения афлиберцепта. Ссылаясь на Фиг. 5, способ включает (a) экспрессию афлиберцепта в клетке-хозяине, культивированной в ХОС; (b) захват афлиберцепта с использованием первой подложки для хроматографии, которая может включать аффинную смолу для захвата; и (c) приведение в контакт по меньшей мере части афлиберцепта со второй подложкой для хроматографии, которое может включать анионообменную хроматографию. Стадия (c) может дополнительно включать промывку колонки AEX и сбор проточной фракции(-й) образца, содержащего афлиберцепт.Необязательно, стадия (c) может включать очистку второй хроматографической подложки и сбор очищенных фракций. Данные стадии могут быть выполнены по стандартной методике в сочетании с методологией, упомянутой выше. Следует понимать, что специалист в данной области может предпочесть применение CEX вместо или в дополнение к AEX. В произвольном порядке можно применять дополнительные хроматографические стадии, включая без ограничения HIC и SEC.
В дополнение к иллюстративному варианту осуществления на Фиг. 5, другой дополнительный иллюстративный вариант осуществления (d) приведение в контакт по меньшей мере части указанного афлиберцепта, полученного на стадии (c), с третьей хроматографической подложкой. В одном аспекте протокол может включать (e) приведение в контакт по меньшей мере части афлиберцепта со стадии (d) с четвертой хроматографической подложкой. В одном аспекте данного варианта осуществления протокол может необязательно включать подвергание образца, содержащего афлиберцепт со стадии (c), воздействию pH менее 5,5. В одном аспекте настоящий способ включает стадию осветления перед стадией (a).
На Фиг. 6 представлен один иллюстративный вариант осуществления, применяемый для получения VEGF MiniTrap.Данный способ включает (a) экспрессию афлиберцепта в клетке-хозяине, культивированной в ХОС; (b) захват афлиберцепта с использованием первой хроматографической подложки, которая может включать смолу для аффинной хроматографии; (c) отщепление афлиберцепта с удалением таким образом домена Fc и образованием образца, содержащего VEGF MiniTrap; (d) приведение в контакт образца со стадии (c) со второй хроматографической подложкой, которая может представлять собой аффинную хроматографию и (e) приведение в контакт проточной фракции со стадии (d) с третьей хроматографической подложкой, которая может включать анионообменную хроматографию. Стадия (d) включает сбор проточной фракции(-й), где вследствие отсутствия домена Fc MiniTrap должен находиться, в то время как афлиберцепт или любой другой белок, имеющий домен Fc, должен по существу взаимодействовать с аффинной колонкой на стадии (d). Необязательно, стадия (d) может включать очистку третьей хроматографической подложки сбор очищенных фракций. Данные стадии могут быть выполнены в соответствии со стандартной методикой в сочетании с методологией, изложенной выше. В произвольном порядке могут быть включены без ограничения дополнительные хроматографические стадии, HIC и SEC.
На Фиг. 7 представлен один иллюстративный вариант осуществления для получения афлиберцепта. Данный способ включает (a) экспрессию афлиберцепта в клетке-хозяине, культивированной в ХОС; (b) захват афлиберцепта с использованием первой хроматографической подложки, которая может включать катионообменную хроматографию; и (c) приведение в контакт проточной фракции со стадии (b) со второй хроматографической подложкой, которая может включать анионообменную хроматографию. Необязательно, стадия (c) может включать очистку второй хроматографической подложки и сбор очищенных фракций. Данные стадии могут быть выполнены в соответствии со стандартной методикой в сочетании с протоколами, упомянутыми выше. В произвольном порядке можно применять дополнительные хроматографические процедуры, включая без ограничения HIC и SEC.
На Фиг. 8 представлен один иллюстративный вариант осуществления для получения VEGF MiniTrap.Данный способ включает (a) экспрессию афлиберцепта в клетке-хозяине, культивированной в ХОС; (b) захват афлиберцепта с использованием первой хроматографической подложки, которая может включать ионообменную хроматографию; (c) подвергание проточной фракции из (b), содержащей афлиберцепт, аффинной хроматографии; элюирование, причем элюирование включает афлиберцепт; (d) подвергание афлиберцепта (c) активности отщепления, при этом домен Fc расщепляется, образуя VEGF MiniTrap.В одном аспекте ионный обмен со стадии (b) включает AEX. В качестве альтернативы, стадия (b) может включать CEX. В произвольном порядке могут быть включены дополнительные хроматографические стадии, такие как дополнительные стадии ионообменной хроматографии после стадии (d), добавление HIC и/или SEC.
VII. Фармацевтические составы, содержащие композиции
В настоящем изобретении также раскрыты составы, содержащие композиции против VEGF (как описано выше). Подходящие составы белков против VEGF включают без ограничения составы, описанные в патенте США №7608261, патенте США №7807164, патенте США №8092803, патенте США №8481046, патенте США №8802107, патенте США №9340594, патенте США №9914763, патенте США №9580489, патенте США №10400025, патенте США №8110546, патенте США №8404638, патенте США №8710004, патенте США №8921316, патенте США №9416167, патенте США №9511140, патенте США №9636400 и патенте США №10406226, все из которых включены в настоящий документ посредством ссылки во всей своей полноте.
Технологии предшествующего процесса (описанные в разделе IV выше) и технологии последующего процесса (описанные в разделе V выше) можно применять отдельно или в комбинации друг с другом для осуществления получения состава.
В настоящем изобретении раскрыты составы, содержащие композиции против VEGF, совместно с одним или более ингредиентами/вспомогательными веществами, а также способы из применения и способы получения таких композиций. В одном варианте осуществления настоящего изобретения фармацевтический состав по настоящему изобретению имеет pH приблизительно 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1 или 6,2.
Для получения фармацевтических составов композиций против VEGF композицию против VEGF смешивают с фармацевтически приемлемым носителем или вспомогательным веществом. См., например, Remington's Pharmaceutical Sciences and U.S. Pharmacopeia: National Formulary, Mack Publishing Company, Easton, Pa. (1984); Hardman, et al. (2001) Goodman and Gilman's The Pharmacological Basis of Therapeutics, McGraw-Hill, New York, N.Y.; Gennaro (2000) Remington: The Science and Practice of Pharmacy, Lippincott, Williams, and Wilkins, New York, N.Y.; Avis, et al. (eds.) (1993) Pharmaceutical Dosage Forms: Parenteral Medications, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Tablets, Marcel Dekker, NY; Lieberman, et al. (eds.) (1990) Pharmaceutical Dosage Forms: Disperse Systems, Marcel Dekker, N.Y.; Weiner and Kotkoskie (2000) Excipient Toxicity and Safety, Marcel Dekker, Inc., New York, N.Y.; полное содержание которых включены в настоящий документ посредством ссылки. В одном варианте осуществления настоящего изобретения фармацевтический состав является стерильным.
Фармацевтические составы по настоящему изобретению включают композицию против VEGF и фармацевтически приемлемый носитель, включая, например, воду, буферные средства, консерванты и/или моющие средства.
В настоящем изобретении представлен фармацевтический состав, содержащий любые композиции против VEGF, изложенные в данном документе, и фармацевтически приемлемый носитель, например, причем концентрация полипептида составляет около 40 мг/мл, около 60 мг/мл, около 80 мг/мл, около 90 мг/мл, около 100 мг/мл, около 110 мг/мл, около 120 мг/мл, около 130 мг/мл, около 140 мг/мл, около 150 мг/мл, около 200 мг/мл или около 250 мг/мл.
Объем настоящего изобретения включает обезвоженные, например лиофилизированные, композиции, содержащие белок против VEGF и фармацевтически приемлемый носитель по существу (от примерно 85% до примерно 99% или более) не содержащий воду.
В одном варианте осуществления дополнительное терапевтическое средство, которое вводят субъекту совместно с композицией против VEGF, раскрытой в данном документе, вводят субъекту в соответствии с Physicians' Desk Reference 2003 (Thomson Healthcare; 57-е издание (1 ноября 2002 г.), содержание которого включено в настоящий документ посредством ссылки).
В настоящем изобретении представлен сосуд (например, пластиковый или стеклянный флакон с крышкой или хроматографической колонкой, полую иглу или цилиндр шприца), содержащий любую из композиций против VEGF или фармацевтический состав, содержащий фармацевтически приемлемый носитель, описанный в данном документе. В настоящем изобретении также представлено инъекционное устройство, содержащее композицию против VEGF или состав, приведенный в данном документе, например, шприц, предварительно заполненный шприц или шприц-ручка. В одном аспекте сосуд окрашен (например, в коричневый цвет) для блокирования света, естественного или иного.
Настоящее изобретение включает комбинации, включающие композиций против VEGF, совместно с одним или более дополнительными терапевтическими средствами. Композиция против VEGF и дополнительное терапевтическое средство может находиться в одной композиции или в отдельных композициях. Например, терапевтическое средство представляет собой ингибитор Ang-2 (например, несвакумаб), активатор рецептора Tie-2, антитело к PDGF или его антигенсвязывающий фрагмент, рецептор против PDGF или антитело к рецептору PDGF бета или его антигенсвязывающий фрагмент и/или дополнительный антагонист VEGF, такой как афлиберцепт, конберцепт, бевацизумаб, ранибизумаб, аптамер к VEGF, такой как пегаптаниб (например, пегаптаниб натрия), одноцепочечное (например, VL-VH) антитело к VEGF, такое как бролуцизумаб, DARPin к VEGF, такой как DARPin абиципар пегол, биспецифическое антитело к VEGF, например, которое также связывается с ANG2, например, RG7716, или растворимая форма рецептора 3 фактора роста эндотелия сосудов человека (VEGFR-3), содержащая внеклеточные домены 1-3, экспрессируемые в виде Fc-слитого белка.
VIII. Способы лечения
В настоящем изобретении представлены способы лечения или предупреждения рака (например, рост и/или метастазирование которого опосредовано, по меньшей мере частично, VEGF, например, VEGF-опосредованный ангиогенез) или ангиогенного заболевания глаз у субъекта, включающего введение терапевтически эффективного количества композиций, описанных в данном документе (раздел III выше).
Технологии предшествующего процесса (раздел IV выше), технологии последующего процесса (разделы V и VI выше) можно применять отдельно или в комбинации друг с другом с получением композиций, описанных в разделе III, и/или составов, описанных в разделе VII, которые можно применять для лечения или предупреждения различных расстройств, включая офтальмологическое и онкологическое заболевание.
В настоящем изобретении также представлен способ введения композиций, приведенных в данном документе (раздел III и раздел VII), субъекту (например, человеку), включающий введение композиций с около 0,5 мг, 2 мг, 4 мг, 6 мг, 8 мг, 10 мг, 12 мг, 14 мг, 16 мг, 18 мг или 20 мг белка, представляющего интерес, (например, афлиберцепт или MiniTrap) в не более около 100 мкл, например, около 50 мкл, около 70 мкл или около 100 мкл, и необязательно дополнительное терапевтическое средство, в организм субъекта посредством, например, внутриглазной инъекции, например, посредством интравитреальной инъекции.
В настоящем изобретении представлен способ лечения рака, рот и/или метастазирования которого опосредовано, по меньшей мере частично, посредством VEGF, например, VEGF-опосредованный ангиогенез или ангиогенное заболевание глаз у субъекта, нуждающегося в этом, при этом способ включает введение терапевтически эффективного количества композиций, приведенных в данном документе (раздел III и раздел VII выше), например, 2 мг, 4 мг, 6 мг, 8 мг или 10 мг белка, представляющего интерес, в не более около 100 мкл, и необязательно дополнительного терапевтического средства, субъекту. В одном варианте осуществления настоящего изобретения введение осуществляют посредством интравитреальной инъекции. Неограничивающие примеры ангиогенных заболеваний глаз, которые можно лечить или предупреждать с использованием описанных в данном документе, включают
возрастную макулярную дистрофию (например, влажную или сухую),
макулярный отек,
макулярный отек после окклюзии вены сетчатки,
окклюзию вены сетчатки (RVO),
окклюзию центральной вены сетчатки (CRVO),
окклюзию ветки вены сетчатки (BRVO),
диабетический макулярный отек (DME),
хориоидальную неоваскуляризацию (CNV),
неоваскуляризацию радужной оболочки,
неоваскулярную глаукому,
послеоперационный фиброз при глаукоме,
пролиферативную витреоретинопатию (PVR),
неоваскуляризацию диска зрительного нерва,
неоваскуляризацию роговицы,
неоваскуляризацию сетчатки,
неоваскуляризацию стекловидного тела,
паннус,
крыловидную плеву,
сосудистую ретинопатию,
диабетическую ретинопатию у субъекта с диабетическим макулярным отеком; и
диабетические ретинопатии (например, непролиферативную диабетическую ретинопатию (например, характеризующуюся уровнем по шкале тяжести диабетической ретинопатии (DRSS) от около 47 или 53) или пролиферативную диабетическую ретинопатию; например, у субъекта, которые не страдает DME).
Способ введения таких композиций или составов (раздел III и раздел VII) может варьировать и может определяется опытным специалистом. Способы введения включают парентеральный, отличный от парентерального, пероральный, ректальный, трансмукозальный, кишечный, парентеральный, внутримышечный, подкожный, внутрикожный, интрамедуллярный, интратекальный, прямой внутрижелудочковый, внутривенный, внутрибрюшинный, интраназальный, внутриглазной, ингаляционный, инсуфляционный, наружный, кожный, внутриглазной, интравитреальный, чрескожный или внутриартериальный.
В одном варианте осуществления настоящего изобретения интравитреальная инъекция фармацевтического состава по настоящему изобретению (который включает композиции или составы по настоящему изобретению) включает стадию прокола глаза шприцем и иглой (например, инъекционной иглой 30 калибра), содержащими состав, и инъецирование состава (например, не более около 100 микролитров; около 40, 50, 55, 56, 57, 57.1, 58, 60 или 70 микролитров) в стекловидное тело глаза в достаточном объеме с целью доставки терапевтически эффективного количества, приведенного в данном документе, например, около 2, 4, 6, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 10 или 20 мг белка, представляющего интерес.Необязательно, способы включают стадии введения местного анестетика (например, проксиметакаина, лидокаина или тетракаина), антибиотика (например, фторхинолона), антисептика (например, повидон-йода) и/или средство для расширения зрачка в глаз, подлежащий инъекции. В одном аспекте перед инъекцией создается стерильное поле вокруг глаза, подлежащего инъекции. После интравитреальной инъекции субъекта контролируют на предмет повышения внутриглазного давления, воспаления и/или артериального давления.
Эффективное или терапевтически эффективное количество белка, представляющего интерес, для ангиогенного заболевания глаз, относится к количеству белка, представляющего интерес, достаточному для того, чтобы вызвать регресс, стабилизацию или устранение рака или ангиогенного заболевания глаз, например, посредством регресса, стабилизации или устранения одного или более симптомов или признаков рака или ангиогенного заболевания глаз до любой клинически измеримой степени, например, в отношении ангиогенного заболевания глаз, вызывая сокращение или поддержание шкалы тяжести диабетической ретинопатии (DRSS), посредством улучшения или поддержания зрения (например, в наиболее скорректированной остроте зрения, измеряемой увеличением букв ETDRS), увеличения или поддержания поля зрения и/или уменьшения или поддержания центральной толщины сетчатки и, в отношении рака, остановки или обращения вспять роста, выживания и/или метастазирования раковых клеток у субъекта.
В одном варианте осуществления настоящего изобретения эффективное или терапевтически эффективное количество белка, представляющего интерес, такого как афлиберцепт, для лечения или предупреждения ангиогенного заболевания глаз составляет около 0,5 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 7,25 мг, 7,7 мг, 7,9 мг, 8,0 мг, 8,1 мг, 8,2 мг, 8,3 мг, 8,4 мг, 8,5 мг, 8,6 мг, 8,7 мг, 8,8 мг, 8,9 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг или 20 мг, например, в не более около 100 мкл. Количество может варьировать в зависимости от возраста и размера вводимого субъекта, целевого заболевания, условий, способа введения и т.п.В определенных иллюстративных вариантах осуществления за исходной дозой может следовать введение второй или множества последующих доз белка, представляющего интерес, в количестве, которое может быть приблизительно таким же, или меньшим, или большим, чем начальная доза, причем последующие дозы разделены по меньшей мере 1-3 днями; по меньшей мере одной неделей, по меньшей мере 2 неделями; по меньшей мере 3 неделями; по меньшей мере 4 неделями; по меньшей мере 5 неделями; по меньшей мере 6 неделями; по меньшей мере 7 неделями; по меньшей мере 8 неделями; по меньшей мере 9 неделями; по меньшей мере 10 неделями; по меньшей мере 12 неделями; или по меньшей мере 14 неделями.
Следует отметить, что значения дозировки могут варьировать в зависимости от типа и тяжести состояния, которое необходимо смягчить. Следует также понимать, что для любого конкретного субъекта конкретные схемы применения могут корректироваться со временем в соответствии с индивидуальной потребностью и профессиональным суждением лица, осуществляющего или контролирующего введение композиций, и что диапазоны доз указанные в данном документе, являются только иллюстративными и не предназначены для ограничения объема или практики заявленной композиции.
IX. Способ анализа белковых вариантов
Уровни белковых вариантов в хроматографическом образце, полученном с использованием описанных в данном документе методик, могут быть проанализированы, как описано в примерах ниже. В некоторых вариантах осуществления применяют способ cIEF с использованием анализатора iCE3 (ProteinSimple) с капиллярным картриджем, покрытым фторуглеродом (100 мкм x 5 см). Раствор амфолита состоит из смеси 0,35% метилцеллюлозы (MC), 4% амфолитов-носителей Pharmalyte 3-10, 4% амфолитов-носителей Pharmalyte 5-8, 10 ммоль L-аргинина HCl, 24% формамида и маркеров pI 5,12 и 9,77 в очищенной воде. Анолит представляет собой 80 ммоль фосфорной кислоты, а католит представляет собой 100 ммоль гидроксида натрия, оба в 0,10% метилцеллюлозы. Образцы разбавляли очищенной водой до 10 мг/мл. Образцы смешивали с раствором амфолита, а затем фокусировали, создавая потенциал 1500 В в течение одной минуты, а затем потенциал 3000 В в течение 7 минут.Изображение сфокусированных вариантов получали посредством пропускания ультрафиолетового света 280 нм через капилляр и в линзу цифровой камеры устройства с зарядовой связью. Затем данное изображение анализировали для определения распределения различных вариантов заряда. Специалисты в данной области могут изменять точные параметры, достигая при этом необходимого результата.
В тексте описания цитируются различные публикации, включая патенты, патентные заявки, опубликованные патентные заявки, номера доступа, технические статьи и научные статьи. Каждая из данных цитируемых ссылок полностью включена посредством ссылки.
Настоящее изобретение станет более понятным из следующих примеров. Однако их не следует рассматривать как ограничивающие объем изобретения.
ПРИМЕРЫ
MiniTrap (MT) 1-6, обсуждаемые в примерах, являются следующими:
MT1: VEGF MiniTrap, полученный посредством отщепления афлиберцепта, полученного с использованием ХОС1.
MT2: VEGF MiniTrap, полученный посредством отщепления афлиберцепта, полученного с использованием ХОС2.
MT3: VEGF MiniTrap, полученный посредством отщепления афлиберцепта, полученного с использованием ХОС3.
MT4: VEGF MiniTrap, полученный посредством отщепления афлиберцепта, полученного с использованием гидролизата сои.
MT5: рекомбинантный VEGF MiniTrap (димер).
MT6: рекомбинантный VEGF MiniTrap (scFv).
Характеристика MT1, MT5 и MT6 описаны ниже в примере 8.
Оценка цвета образцов
Способ спектрофотометрического анализа для измерения значения b* (CIELAB) оказался подходящим для выполнения оценки цвета.
Поглощение образца белка объемом 1 мл определяли количественно по спектру видимого света (от 380 до 780 нм), и кривую поглощения преобразовывали в цветовое пространство CIELAB с использованием набора матричных операций. Инструмент может обрабатывать примерно 6 образцов в час.В высокопроизводительном формате анализа применяли считывающее устройство для планшетов CLARIOstar (BMG Labtech). Можно проанализировать до 96 образцов с использованием 96-луночного планшета, для которого требуется 0,3 мл образца.
Для преобразования стандартов BY в значения b* эталонные стандарты BY (от BY1 до BY7) были количественно определены с использованием формата высокопроизводительного анализа.
Растворы получали в соответствии со стандартами BY, описанными выше. Значение b* для каждого из стандартов показано на Фиг. 9. Данный способ обеспечил более быстрый анализ с меньшими требованиями к образцам и более короткое время анализа, как показано ниже в таблице 3. Для всех образцов, оцениваемых с использованием данного способа, концентрацию белка в образцах для испытания стандартизировали до 5 г/л или 10 г/л.
Пример 1. Получение белка с использованием среды с химически определенным составом
1.1 Источник и сбор клеток
В текущем исследовании применяли продуцирующую афлиберцепт клеточную линию. Продуцирующие афлиберцепт клеточные линии культивировали и собирали с использованием среды с химически определенным составом (ХОС).
1.2 Протеолитическое отщепление афлиберцепта
Колонку с иммобилизованным ферментом IdeS (FabRICATOR®, полученным от Genovis (Кембридж, Массачусетс)) применяли для образования MT1. Афлиберцепт, полученный из сбора клеточных культур (20 мг в 1,0 мл буфера для расщепления), добавляли в колонку и инкубировали в течение 30 мин при 18°C. Через 30 мин. колонку промывали буфером для отщепления (1,0 мл). Смесь для расщепления и промывочные растворы объединяли. Смесь загружали на аналитическую колонку с белком A и элюировали (Applied Biosystems™, POROS(20 мкмоль белка A, картридж 2,1 (30 ммоль, 0,1 мл (№по каталогу 2-1001-00)). Обработку проводили в соответствии с протоколом Applied Biosystems(для картриджа POROS(20 мкмоль белка A 2,1×30 ммоль, 0,1 мл (№по каталогу 2-1001-00). Высота колонки составляла 20 (1,0 см, время пребывания составляло 15 минут, и уравновешивание/отмывку проводили с использованием 40 ммоль буфера трис, 54 ммоль ацетата pH 7,0 (0,1.
Пример 2. Анионообменная хроматография (AEX) для сведения цвета к минимуму
(A) AEX применяли для уменьшения образования цвета
Хроматографию AEX применяли для удаления окраски, полученной в ходе получения афлиберцепта, экспрессированного с использованием ХОС1.
2.1 Дизайн
Для данного исследования выполняли пять разделений AEX, как подробно описано в таблице 2-1, с протоколом AEX, как описано в таблице 2-2. Колонку Q Sepharose Fast Flow объемом 15,7 мл (высота слоя 19,5 см, внутренний диаметр 1,0 см) и колонку POROS 50 HQ объемом 14,1 мл (высота слоя 18,0 см, внутренний диаметр 1,0 см) интегрировали в настольный контроллер жидкостной хроматографии AKTA Avant.
PH загрузки AEX доводили до целевого значения ±0,05 единиц pH с использованием 2 моль трис-основания или 2 моль уксусной кислоты. Электропроводность загрузки AEX доводили до целевого значения ±0,1 мСм/см с использованием 5 моль хлорида натрия или деионизированной воды. Все образцы пула анализировали на предмет высокой молекулярной массы (HMW), цвета и выхода.
(см/ч.)
Переменные pH и проводимость
Переменные pH и проводимость
Переменные pH и проводимость
2.2 Результаты
Применение разделения AEX для производства показало значительное уменьшение цвета. (Таблица 2-3). Например, как видно в таблице 2-3, цвет, наблюдаемый в проточной фракции (FT) и промывке в разделении AEX 1 (pH 8,30-8,50, 1,90-2,10 мСм/см), имел значение ab* 1,05 по сравнению с цветом загрузки для AEX («Загрузка AEX») со значением ab* 3,06. Увеличение значения b* отражает интенсивность желто-коричневой окраски образца.
Осуществляли пять разделений AEX для оценки влияния смолы (Q Sepharose FF или POROS 50 HQ) и заданной величины pH и проводимости (pH 8,40 и 2,00 мСм/см, pH 8,00 и 2,50 мСм/см или pH 7,80 и 4,00 мСм/см) на уменьшение цвета. Для POROS 50 HQ выходы (64,4, 81,9 и 91,4%) и уровни пула HMW (1,02, 1,29 и 1,83%) повышались при изменении заданной величины на более низкий pH и более высокую проводимость. Цвет (значения b*) также увеличился (1,05, 1,33 и 1,55), поскольку заданную величину изменяли на более низкий pH и более высокую проводимость. Более высокие уровни pH и более низкая проводимость обеспечивали наибольшее снижение цвета по сравнению с разделением AEX для POROS 50 HQ.
Для Q Sepharose Fast Flow выходы (49,5 и 77,7%) и уровни HMW в пуле (0,59 и 1,25%) также увеличивались, поскольку заданную величину изменяли на более низкий pH и более высокую проводимость. Цвет (значения b*) также увеличился (0,96 и 1,35), так как заданную величину изменяли на более низкий pH и более высокую проводимость.
Применение AEX снижает желто-коричневую цветность - см. таблицу 2-3. Кроме того, было определено, что Q Sepharose Fast Flow снижала цвет больше, чем POROS 50 HQ, для двух заданных величин, оцененных в обеих смолах. При заданной величине pH 8,00 и 2,50 мСм/см, пул POROS 50 HQ имел значение b* 1,33, тогда как пул Q Sepharose Fast Flow имел значение b* 0,96. Подобным образом, при заданной величине pH 7,80 и 4,00 мСм/см, пул POROS 50 HQ имел значение b* 1,55, тогда как пул Q Sepharose Fast Flow имел значение b* 1,35 (таблица 2-3).
(%)
AEX, анионообменная хроматография; HMW, высокомолекулярные соединения; N/A, не указано
Для измерения цвета фракции корректировали до концентрации белка 10 г/л.
2.3 Заключение
Установлено, что применение AEX снижает желто-коричневую окраску, см. таблицу 2-3. Ссылаясь на таблицу 2-3, загрузка AEX имеет значение b*, равное 3,06, но при подвергании хроматографии AEX (разделению AEX 1-5) значение b* уменьшается, указывая на уменьшение желто-коричневой окраски. Снова, по мере уменьшения значения b* уменьшается и окраска; увеличение значения b* отражает увеличение желто-коричневого цвета в данном образце.
Снижение цвета оценивали с использованием двух смол AEX (POROS 50 HQ и Q Sepharose Fast Flow) и трех заданных значений (pH 8,40 и 2,00 мСм/см, pH 8,00 и 2,50 мСм/см, и pH 7,80 и 4,00 мСм/см). Для обоих смол снижение цвета было выше для более высоких значений pH и более низких значений проводимости. Кроме того, Q Sepharose Fast Flow обеспечивала большее уменьшение цвета, чем POROS 50 HQ, в двух контрольных точках, оцененных на обоих смолах (pH 8,00 и 2,50 мСм/см и pH 7,80 и 4,00 мСм/см). Тем не менее, все пять способов разделения AEX обеспечивали значительное уменьшение цвета по сравнению с загрузочным раствором для AEX («Загрузка AEX»), демонстрируя важность получения AEX в процессе получения афлиберцепта, экспрессированного с использованием ХОС.Начальное значение b* нагрузки AEX (при весе 10 г/л) может варьировать от около 0,5 до около 30, более конкретно от около 1,0 до около 25,0, и еще более конкретно от около 2,0 до около 20,0. После применения AEX значение b* для проточной фракции (при концентрации 10 г/л) может варьировать от 0,5 до около 10,0, более конкретно от около 0,5 до около 7,0 и еще более конкретно от около 0,5 до около 5,0.
2.4 Картирование пептида
Получение образца. Триптическое картирование образцов восстановленного и алкилированного афлиберцепта, полученных из загрузки AEX, и проточную фракцию указанного выше эксперимента (таблица 2-3) осуществляли для выявления и количественной оценки посттрансляционной модификации (PTM). Аликвоту каждого образца (загрузки и проточной фракции) денатурировали с использованием 8,0 моль мочевины, 0,1 моль трис-HCl, pH 7,5, восстанавливали DTT, а затем алкилировали йодацетамидом. Денатурированный, восстановленный и алкилированный образец сначала расщепляли рекомбинантным Lys-C (rLys-C) при соотношении фермента к субстрату 1:100 (мас./мас.) при 37°C в течение 30 мин., разводили 0,1 моль трис-HCl, pH 7,5, так что конечная концентрация мочевины была 1,8 моль, затем расщепляли трипсином при соотношении фермента к веществу 1:20 (мас./мас.) при 37°C в течение 2 часов, а затем дегликозилировали с использованием PNG-азы F при соотношении ферментных субстратов 1:5 (мас./мас.) при 37°C в течение 1 часа. Расщепление останавливали, доводя pH ниже 2,0 с использованием муравьиной кислоты (FA).
Анализ посредством ЖХ-МС.Аликвоту 20 мкг образующихся rLys-C/триптических пептидов из каждого образца отделяли и анализировали посредством ультрапроизводительной жидкостной хроматографии с обращенной фазой (UPLC) с использованием колонки Waters ACQUITY UPLC CSH C18 (130 Å, 1,7 мкмоль, 2,1 × 150 мм) с последующим детектированием КПК в системе (на длинах волн 280 нм, 320 нм и 350 нм) и анализом посредством масс-спектрометрии. Подвижная фаза А содержала 0,1% FA в воде, а подвижная фаза В - 0,1% FA в ацетонитриле. После введения образца инициировали градиент с выдержкой в течение 5 минут при 0,1% B с последующим линейным увеличением до 35% B в течение 75 минут для оптимального разделения пептидов. Эксперименты МС и МС/МС проводили с использованием масс-спектрометра Thermo Scientific Q Exactive Hybrid Quadrupole-Orbitrap с более высокой энергией ударной диссоциации (HCD), применяемой для пептидной фрагментации для экспериментов МС/МС.Присвоение идентичности пептидам было основано на экспериментально определенной точной массе данного пептида в полном спектре МС, а также на фрагментах ионов b и y в соответствующем спектре МС/МС HCD. Получали извлеченные ионные хроматограммы пептидов из загрузки и проточной фракции (см. Фиг. 10). Как видно на извлеченной ионной хроматограмме на Фиг. 10, показаны пептидные фрагменты, идентифицированные в «загрузке AEX» и «FT/промывке AEX» из разделений AEX 1-5 (как определено в таблице 2-3). Относительное количество некоторых из данных пептидов, идентифицированных на Фиг. 10 из анализа картирования пептидов показаны на Фиг. 11.
Ссылаясь на Фиг. 11, данная цифра идентифицирует различные проанализированные пептидные фрагменты и их относительные уровни окисления. В частности, третья колонка идентифицирует аминокислотные остатки («пептидную последовательность») пептидных фрагментов, которые были выделены и проанализированы. Каждая пептидная последовательность имеет аминокислотный остаток, который подчеркнут.Подчеркнутый аминокислотный остаток указывает на аминокислоту в пептидной последовательности, которая окислена. Окисленные аминокислоты соответствуют либо окислению гистидина (H), либо окислению триптофана (W). На данной фигуре также изображены строки справа от каждой из пептидных последовательностей, показывающие количество окисленных форм. Данная штриховка в строках указывает на различия в относительном количестве окисленных остатков в конкретном образце с использованием различных разделений AEX, указанных в соответствующих заголовках колонок. Например, ссылаясь на второй пептид, EIGLLTCEATVNGHLYK (SEQ ID NO.: 18 на Фиг. 11, если читать по горизонтали, относительная общая популяция данного пептида в конкретном образце («загрузка AEX афлиберцепта»), который является окисленным, окислена приблизительно на 0,013%. По мере продвижения по той же строке наблюдается смещение штриховки, указывающее на изменение относительного содержания окисленных форм. Например, при использовании той же пептидной последовательности относительное количество окисленных форм для разделения AEX составляет от 0,006% до 0,010% при соблюдении различных протоколов разделения AEX. Таким образом, можно понять, что хроматография AEX снижает содержание окисленных форм.
(B) AEX применяли для уменьшения образования цвета при получении MiniTrap
Хроматографию AEX проводили для удаления окраски, полученной в ходе получения MT1, которая была получена при выполнении расщепления полноразмерного афлиберцепта, экспрессированного с использованием ХОС1.
2.5 Дизайн
Для данного исследования выполняли четыре разделения AEX, как описано в таблице 2-4. Загрузку AEX получали из фильтрации образца MT1 («фильтрованный пул MT1»). Колонку с 15,7 мл Capto Q (высота слоя 20,0 см, внутренний диаметр 1,0 см), колонку с 14,1 мл POROS 50 HQ (высота слоя 18,0 см, внутренний диаметр 1,0 см) и колонку с 16,5 мл Q Sepharose FF (высота слоя 21,0 см, внутренний диаметр 1,0 см) были интегрированы в настольный контроллер жидкостной хроматографии AKTA Avant для данного эксперимента.
PH загрузки AEX доводили до целевого значения±0,05 единиц pH с использованием 2 моль трис-основания или 2 моль уксусной кислоты. Электропроводность загрузки AEX доводили до целевого значения±0,1 мСм/см с использованием 5 моль хлорида натрия или деионизированной воды. Все образцы пула анализировали в отношении HMW, цвета и выхода.
(см/ч.)
pH 7,90-8,10, 6,50-7,50 мСм/см
pH 7,90-8,10, 6,50-7,50 мСм/см
pH 7,90-8,10, 6,50-7,50 мСм/см
AEX, анионообменная хроматография; CV, объем колонки
(см/ч.)
pH 8,30-8,50, 1,90-2,10 мСм/см
pH 8,30-8,50, 1,90-2,10 мСм/см
pH 8,30-8,50, 1,90-2,10 мСм/см
pH 8,30-8,50, 8,50-9,50 мСм/см
AEX, анионообменная хроматография; CV, объем колонки
2.6 Результаты
Все четыре разделения AEX обеспечивали уменьшение цвета, как это было видно при окрашивании проточной фракции и промывке для разделений AEX 1-4 (таблица 2-7). Несмотря на то, что первые три разделения AEX оценивали в режиме связывания и элюирования (таблица 2-6), было замечено, что большая часть продукта присутствовала в загрузочных и промывных блоках (62%-94%).
Первые три разделения применяли для оценки заданного значения pH 8,4 и 2,0 мСм/см для смол Capto Q, POROS 50 HQ и Q Sepharose FF. Все три разделения обеспечивали хороший выход (более 80%). Пул POROS 50 HQ AEX показал самый низкий желтый цвет в пуле AEX (значение b* 2,09), за ним следовали пул Q Sepharose FF AEX (значение b* 2,22) и пул Capto Q AEX (значение b* 2,55).
AEX, анионообменная хроматография; HMW, высокомолекулярные соединения.
Для измерения цвета фракции корректировали до концентрации белка 5 г/л.
2.7 Заключение
Как видно для афлиберцепта (см. раздел 2.3 выше), было обнаружено, что применение AEX снижает желто-коричневую окраску (таблица 2-7) при получении MiniTrap.Ссылаясь на таблицу 2-7, загрузка AEX имеет значение b*, равное 4,17, но при подвергании хроматографии AEX (разделению AEX 1-4) значение b* уменьшается, указывая на уменьшение желто-коричневой окраски. Снова, по мере уменьшения значения b* уменьшается и окраска. Начальное значение b* нагрузки AEX (при весе 5 г/л) может варьировать от около 0,5 до около 25, более конкретно от около 1,0 до около 20,0, и еще более конкретно от около 1,5 до около 15,0. После применения AEX значение b* для проточной фракции (при концентрации 5 г/л) может варьировать от 0,5 до около 10,0, более конкретно от около 0,5 до около 7,0 и еще более конкретно от около 0,5 до около 5,0.
Пример 3. Исследование окисленного пептида
3.1 Картирование пептида
Получение образца. Триптическое картирование образцов восстановленного и алкилированного MiniTrap (MT1) и MT4 (MiniTrap, аналогичное MT1 с использованием другого полноразмерного афлиберцепта, полученного с использованием клеточной культуры в гидролизате сои) выполняли для идентификации и количественной оценки посттрансляционной модификации. Аликвоту образца денатурировали с использованием 8,0 моль мочевины в 0,1 моль трис-HCl, pH 7,5, восстанавливали DTT, а затем алкилировали йодацетамидом. Денатурированный, восстановленное и алкилированное лекарственное вещество сначала расщепляли рекомбинантным Lys-C (rLys-C) при соотношении фермента к субстрату 1:100 (мас./мас.) при 37°C в течение 30 мин., разводили 0,1 моль трис-HCl, pH 7,5, так что конечная концентрация мочевины была 1,8 моль, затем расщепляли трипсином при соотношении фермента к веществу 1:20 (мас./мас.) при 37°C в течение 2 часов, а затем дегликозилировали с использованием PNG-азы F при соотношении ферментных субстратов 1:5 (мас./мас.) при 37°C в течение 1 часа. Расщепление останавливали, доводя pH ниже 2,0 с использованием муравьиной кислоты (FA).
Анализ посредством ЖХ-МС.Аликвоту 20 мкг образующихся rLys-C/триптических пептидов из каждого образца отделяли и анализировали посредством ультрапроизводительной жидкостной хроматографии с обращенной фазой (UPLC) с использованием колонки Waters ACQUITY UPLC CSH C18 (130 Å, 1,7 мкмоль, 2,1 × 150 мм) с последующим детектированием КПК в системе (на длинах волн 280 нм, 320 нм и 350 нм) и анализом посредством масс-спектрометрии. Подвижная фаза А содержала 0,1% FA в воде, а подвижная фаза В - 0,1% FA в ацетонитриле. После введения образца начинали градиент с выдержкой в течение 5 мин при 0,1% B с последующим линейным увеличением до 35% B в течение 75 минут для оптимального разделения пептидов. Эксперименты МС и МС/МС проводили на масс-спектрометре Thermo Scientific Q Exactive Hybrid Quadrupole-Orbitrap с более высокой энергией ударной диссоциации (HCD), применяемой для пептидной фрагментации для экспериментов МС/МС.Присвоение идентичности пептидам было основано на экспериментально определенной точной массе данного пептида в полном спектре МС, а также на фрагментах ионов b и y в соответствующем спектре МС/МС HCD. Получали экстрагированные ионные хроматограммы окисленных пептидов и соответствующего исходного пептида с интегрированными площадями пиков для расчета сайт-специфичного процентного содержания окисленного(-ых) аминокислотного(-ых) остатка(-ов) в образце MT1.
Фрагменты пептида, связанные для повышения поглощения при 350 нм
PTM на MT1 наблюдали при сравнении карт триптических пептидов для MT1 и MT4 (Фиг. 12A показывает поглощение пептидов, элюированных от 20,0 до 75 минут). Выделены пептиды с различными УФ-пиками. Расширенный вид хроматограммы показан на Фиг. 12B, на которой показано поглощение пептидов, элюированных от 16 до 30 минут.Пептиды с резким контрастом УФ-поглощения между MT1 и MT4 представляли собой TNYLTH*R (SEQ ID NO.: 21), IIW(+4)DSR (SEQ ID NO.: 28) и IIIW(+132)DSR (SEQ ID NO.: 124) (* или подчеркивание означает окисление остатка). Далее расширенный вид хроматограммы показан на Фиг. 12C, на которой показано поглощение пептидов, элюированных от 30 до 75 минут.Пептиды с резким контрастом УФ-поглощения между MT1 и MT4 представляли собой DKTH*TC*PPC*PAPELLG (SEQ ID NO.: 17), TELNVGIDFNWEYPSSKH*QHK (SEQ ID NO.: 20), EIGLLTCEATVNGH*LYK (SEQ ID NO.: 18) и QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19) (* означает окисление остатка). Картирование пептидов выявило идентичность пептидов, количество которых значительно различается в VEGF MiniTrap.Относительное количество пептидов, идентифицированных посредством анализа картирования пептидов, показано в таблице 3-1. Количество 2-оксо-гистидинов в MT1 (продуцируемых в ХОС) было выше, чем в MT4 (продуцируемом в гидролизате сои), что позволяет предположить, что среда, применяемая для экспрессии афлиберцепта, может оказывать значительное влияние на относительное содержание пептидов с окисленными гистидинами или окисленными триптофанами. Например, для пептида QTNTIIDVVLSPSH*GIELSVGEK (SEQ ID NO.: 19), процентное относительное содержание пептида в MT1 (продуцируемом в ХОС) составляло 0,015% по сравнению с процентным относительным содержанием пептида в MT4 (продуцируемом в гидролизате сои; что примерно в 15 раз меньше по сравнению с MT1).
MT1/MT4
Количественное определение цвета и 2-оксо-гистидина. Также показано процентное содержание 2-оксо-гистидинов в олигопептидах, образованных в результате расщепления протеазы, измеренное посредством масс-спектрометрии (таблица 3-2). (Значения были нормализованы относительно немодифицированных пептидов.) В таблице 3-2 (I) показан процент окисленных гистидинов/триптофанов, наблюдаемый для проточной фракции AEX: MT1 партия 1, проточной фракции AEX для MT1 партия 2 и проточной фракции AEX для MT1 партия 3. В таблице 3-2 (II) показан процент окисленных гистидинов/триптофанов, наблюдаемый для кислотной фракции 1, кислотной фракции 2 и основной фракции, полученных при выполнении разделения CEX для партии MT1 3. Из данной таблицы ясно, что кислотные варианты состоят из окисленных частиц. Из таблицы 3-2(I) ясно, что % 2-оксо-гистидинов и диокисление триптофана, содержащие пептиды/белок, снижен в проточной фракции AEX по сравнению с очисткой AEX. Очевидно, что очистка колонки AEX увеличивает процент таких модифицированных пептидов. Например, % модифицированного пептида «EIGLLTC[+57]EATVNGH[+14]LYK (SEQ ID NO.: 18)» в проточной фракции AEX (MT1 партия 1) составлял 0,013% и в «очистке AEX» составлял 0,080%. Это также подтверждает, что колонка AEX захватывает модифицированные пептиды, снижая таким образом процент модифицированных пептидов в проточной фракции AEX.
BY1, 110 мг/мл
Желтый
Желтый
Цвет отсутствует
В таблице 3-2 (II) [+57] представляют собой алкилирование цистеина йодоактамидом с добавлением фрагмента карбоксиметилмина на цистеине, что представляет собой увеличение массы нетто примерно на+57 по сравнению с немодифицированным цистеином:
В таблице 3-2 (II), [+14] представлено преобразование из His в 2-оксо-His. Один атом кислорода добавляется к углероду 2, но два атома водорода теряются (один от углерода 2, другой от азота 3), что представляет собой увеличение массы нетто примерно на+14 по сравнению с немодифицированным гистидином.
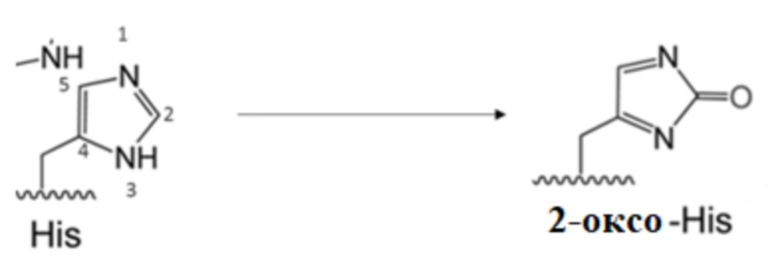
В таблице 3-2 (II), [+32] представляет диокисление триптофана, приводящее к образованию N-формилкинуренина, что представляет собой увеличение массы нетто примерно на+32 по сравнению с немодифицированным триптофаном (Фиг. 4).
Вторую серию экспериментов проводили для оценки процентного содержания 2-оксо-гистидинов (и диокисления триптофана) в олигопептидах из расщепленного протеазой отщепленного посредством FabRICATOR афлиберцептом (MT4), который обрабатывали посредством хроматографии AEX (Фиг. 13 и таблица 3-3 ниже). Процентное содержание 2-оксо-гистидинов и диокисления триптофана в очистке AEX для олигопептидов из расщепленного протеазой отщепленного посредством FabRICATOR афлиберцепта (MT4) было значительно больше, чем процентное содержание 2-оксо-гистидинов и диокисления триптофана в проточной фракции AEX (ссылаясь на «MT1» в таблице 3-3 ниже).
a значение, рассчитанное с использованием другого пептида для полноразмерного афлиберцепта, так как С-концевой пептид отличается от MiniTrap.
Процентное содержание 2-оксо-гистидинов и диокисления триптофана в полосе AEX был значительно больше, чем процент 2-оксо-гистидинов и диокисления триптофана в проточной фракции AEX в ходе получения MT1 (ссылаясь на “MT1” в таблице 3-3 выше). По сравнению с таблицей 3-2, в таблице 3-3 показаны подобные результаты, что очистка колонки AEX обеспечивала образец со значительно более высоким процентным содержанием 2-оксо-гистидинов и диокисления триптофана по сравнению с процентным содержанием 2-оксо-гистидинов и диокисления триптофана в проточной фракции AEX, что позволяет предположить, что формы 2-оксо-гистидинов и диокисления триптофана связаны с колонкой AEX в ходе разделения и удаляются при очистке колонки AEX. Это также очевидно на извлеченной ионной хроматограмме, как видно на Фиг. 14.
Сильная катионообменная хроматограмма (CEX)
Осуществляли серию экспериментов для выявления кислотных форм и других вариантов, присутствующих в образцах, содержащих белков против VEGF.
Сильную катионообменную хроматографию выполняли с использованием колонки MonoS (10/100) GL (GE Life Sciences, Мальборо, Массачусетс). Для разделения образцов применяли подвижные фазы: 20 ммоль 2-(N-морфолино)этансульфоновой кислоты (MES), pH 5,7 (подвижная фаза A) и 40 ммоль фосфата натрия, 100 ммоль хлорида натрия, pH 9,0 (подвижная фаза B). Нелинейный градиент pH применяли для элюирования заряженных вариантов MT1 с детектированием при 280 нм. Пики, которые элюируются при относительном времени пребывания раньше основного пика, обозначены в данном документе как кислотные формы.
Образец из MT1 партии 2 (≤BY3) до любого обогащения подвергали CEX с использованием способа, описанного на Фиг. 15. Образец подвергали десиалилированию для упрощения вариантов МТ1. За этим следовала препаративная обработка SEC (Superdex 200, prep grade XK26/100) с использованием 1X DPBS, pH 7,2±0,2, в качестве подвижной фазы. Фракции, полученные из препаративной колонки SEC, содержащей десиалилированный MiniTrap (dsMT1), объединяли и дополнительно подвергали сильной катионообменной хроматографии (SCX) для обогащения заряженными вариантами MT1 с использованием двойного градиента соли и pH. В результате получали всего 7 фракций (F1-F7; MC представляет собой контроль способа, Фиг. 16 и Фиг. 17).
При выполнении CEX кислотные формы элюируются раньше основных пиков, а основные формы элюируются после основных пиков. Как видно на Фиг. 17, пики 3-5 являются основными пиками. Пики 1 и 2 элюируются перед элюированием основных форм МТ1 (пики 3-5) и, таким образом, содержат кислотные формы. Пик 6 элюируется после элюирования основных видов MT1 (пики 3-5) и, таким образом, включает основные формы. В таблице 3-4 показано относительное содержание пиков в MC (как показано на Фиг. 16). Например, строка два в таблице 3-4 (отмеченная как MC) демонстрирует, что общее относительное количество кислотных форм в MC составляет около 19,8% (т.е., пик 1+пик 2). В таблице-3-4 также показано относительное содержание пиков для каждой отдельной фракции. Несмотря на то, что существуют перекрывающиеся виды в разных фракциях (как показано на Фиг. 16 и Фиг. 17), большая часть фракций F1 и F2 представляют собой кислотные формы (т.е., пик 1 и пик 2). Например, фракция F1 состоит из 63,7% пика 1 и 19,2% пика 2 (всего 82,9% кислотных форм). Фракция F2 состоит из 9,6% пика 1 и 75,9% 2 (всего 85,5% кислотных форм). Большинство фракций F3-F5 являются главными формами MT1 (пики 3-5). Наконец, большинство фракций F6-F7 являются основными формами (пик 6), но включают некоторые части главных видов (например, пики 4 и 5).
Также было замечено, что фракции F1 и F2 (которые составляют кислотные формы) имели интенсивную желто-коричневую окраску по сравнению с фракциями F3-F5 (которые включают главные формы или «MT1»). Все фракции проверяли относительно цвета в концентрации не менее 13 мг/мл. Как видно из данного примера, наличие кислотных форм в образце отслеживается с появлением желто-коричневой окраски, удаление (или сведение к минимуму) которой можно осуществлять посредством удаления (или сведения к минимуму) кислотных форм из MT1.
н/в: не выявлено
3D хроматограммы для MT1 партии 2 и фракций F1-F7 показаны на Фиг. 18A-H. МТ1 партия 2 не продемонстрировал каких-либо существенных спектральных особенностей (Фиг. 18A). Фракции 1 и 2 (содержащие кислотные формы) продемонстрировали спектральную характеристику от 320-360 нм (см. круг на Фиг. 18B). Данная особенность была более заметной во фракции 1 по сравнению с фракцией 2 (Фиг. 18B и 18C) и отсутствовала во фракции 3 и фракциях 4-7 (основные виды, MT1) (Фиг. 18D и 18H), которые не проявляли желто-коричневой окраски.
Таким образом, как отмечалось выше, CEX привела к идентификации кислотных форм/кислотных фракций (фракции 1 и 2), которые показывают интенсивную желто-коричневую окраску по сравнению с основными формами/фракциями (фракции 3-6). Данный результат также наблюдался в виде отчетливой спектральной характеристики, присутствующей на трехмерных хроматограммах фракций F1-F2 и отсутствующих во фракциях F3-F7.
Визуализированные электрофореграммы капиллярной изоэлектрической фокусировки (icIEF)
Распределение вариантов по фракциям F1-F7 и MC (от МТ1 - партия 2 после CEX) дополнительно оценивали с использованием icIEF (Фиг. 19).
Распределение вариантов во фракциях F1-F7 и MC (из MT1 - партия 2 после CEX) дополнительно оценивали посредством icIEF с использованием анализатора iCE3 (ProteinSimple) с капиллярным картриджем, покрытым фторуглеродом (100 мкм x 5 см). Раствор амфолита состоял из смеси 0,35% метилцеллюлозы (MC), 0,75% амфолитов-носителей Pharmalyte 3-10, 4,2% амфолитов-носителей Pharmalyte 8-10,5 и 0,2% маркера pI 7,40 и 0,15% маркера pI 9,77 в очищенной воде. Анолит представляет собой 80 ммоль фосфорной кислоты, а католит представляет собой 100 ммоль гидроксида натрия, оба в 0,10
% метилцеллюлозы. Образцы разбавляли очищенной водой и сиалидазу A добавляли к каждому разбавленному образцу при соотношении фермента к субстрату 1:200 (единиц сиалидазы A на миллиграмм MT1) с последующей инкубацией при температуре окружающей среды в течение приблизительно 16 часов. Образцы, обработанные сиалидазой А, смешивали с раствором амфолита, а затем фокусировали, создавая потенциал 1500 В в течение одной минуты, а затем потенциал 3000 В в течение 7 минут. Изображение сфокусированных вариантов MT1 получали посредством пропускания ультрафиолетового света 280 нм через капилляр и в линзу цифровой камеры устройства с зарядовой связью. Затем данное изображение анализировали для определения распределения различных вариантов заряда (Фиг. 19). Ссылаясь на Фиг. 19, фракции F1 и F2 (или кислотные фракции) показали отсутствие пика для MT1, что отчетливо наблюдается для MC и фракций F3-F7 (основные формы, MT1). Таким образом, считалось, что электрофореграммы icIEF способны обнаруживать и определять распределение различных вариантов заряда рассматриваемого белка, в данном случае MT1. Таким образом, было очевидно, что кислотная фракция при проведении анализа CEX показала (а) повышенное относительное содержание 2-оксо-гистидина или диоксо-триптофана (таблица 3-2 (II)); (b) повышенную желто-коричневую окраску (данные не показаны); и (c) наличие спектральной подписи на трехмерных хроматограммах для фракций 1 и 2 (Фиг. 18B и Фиг. 18C).
Пример 4. Исследование фотоиндукции
В данном примере фотоиндукцию VEGF MiniTrap (MT), например MT1, проводили путем воздействия на образец белка различных количеств холодного белого (CW) флуоресцентного света или ультрафиолетового A (UVA) света. Определяли цветное содержание и содержание окисленной аминокислоты в образцах, подвергшихся воздействию света. ЖХМС-анализ выполняли после воздействия, как описано выше. Подвергание МТ холодному белому свету или УФА-свету приводит к увеличению окисленных аминокислотных остатков, например, гистидина (таблица 4-1, таблица 4-2 и таблица 4-3).
ICH ссылается на Гармонизированное трехстороннее руководство ICH: Испытание стабильности: Испытание фотостабильности новых лекарственных веществ и продуктов Q1B, в котором указаны исследования фотостабильности, которые должны проводиться при холодном белом флуоресцентном свете не менее 1,2 миллиона люкс*час и энергии ближнего ультрафиолетового спектра не менее 200 Вт*ч./м2.
В таблице 4-2 показано усиление окраски образца МТ под воздействием холодного белого света и ультрафиолетового света. Например, значение b для образца (t=0) составляло 9,58. При воздействии на данный образец холодного белого света с интенсивностью 2,4 миллиона люкс*ч. значение b увеличивается до 22,14. Данное увеличение значения b указывает на то, что воздействие холодного белого света на МТ при 2,4 миллиона люкс*ч. увеличивает желто-коричневую окраску образца по сравнению с образцом (t=0). Подобным образом, при воздействии ультрафиолетового света на образец МТ (t=0) при 400 Вт*ч./м2 значение b увеличивается до 10,72 от 9,58. Данное увеличение значения b указывает на то, что воздействие ультрафиолетового света на образец МТ при 400 Вт*ч./м2 приводит к усилению желто-коричневой окраски образца по сравнению с образцом (t=0).
(люкс*ч.)
Образцы цветов указаны с использованием цветового пространства CIELAB (переменные L*, a* и b*) и относительно стандарта цвета EP BY; L*=от белого к черному (L* - светлота); a*=от пурпурного до цвета морской волны; b*=от желтого до синего, чем выше значение b, тем больше желтого.
Воздействие на афлиберцепт МТ холодного белого света или УФА света отслеживалось по появлению окисленных гистидинов (2-оксо-His). (Таблица 4-3). Ссылаясь на таблицу 4-3, пептид «SDTGRPFVEMYSEIPEIIHMTEGR (SEQ ID NO.: 22)» с оксо-гистидином составлял 0,007% в образце MT (t=0), тогда как его содержание увеличилось до 0,324% при воздействии ультрафиолетового света в течение 40 часов (таблица 4-3 (I)) и до 1,309% при воздействии холодного белого света в течение 300 часов (таблица 4-3 (II)).
Наблюдались две формы 2-оксо-гистидина, формы 13,98 Да (как показано на Фиг. 2) и формы 15,99 Да (как показано на Фиг. 3), при этом формы 13,98 Да являются преимущественными в подвергнутых свету образцах MiniTrap.Известно, что формы 15,99 Да являются продуктом процесса, катализируемого металлической медью (Schöneich, J. Pharm. Biomed Anal., 21:1093-1097 (2000)). Кроме того, формы 13,98 Да являются продуктом процесса, управляемого светом (Liu et al., Anal. Chem., 86, 10, 4940-4948 (2014)).
Подобно повышенному содержанию окисленных гистидинов в образцах, подвергнутых воздействию холодного белого света и УФА-света, воздействию холодного белого света или УФА-света на МТ также вызывало образование других PTM (таблица 4-4 и таблица 4-5).
Таким образом, воздействие на МТ холодного белого света или УФА-света отслеживали по появлению окисленных остатков (таких как гистидины/триптофаны (оксо-Trp)). Наблюдали четыре вида оксо-trp:+4 Да, +16 Да, +32 Да и +48 Да. Формы +4 Да объясняются образованием кинуренина (Фиг. 4), тогда как +16 Да, +32 Да и +48 Да представляют собой моно-окисление, ди-окисление и три-окисление остатков триптофана. Пептидное картирование триптических гидролизатов образцов МТ, наблюдаемое при длине волны 320 нм, как показано на Фиг. 20. Относительное присутствие окисленных остатков, содержащих пептиды, можно сравнить на Фиг. 20. Например, для пептида IIW(+4)DSRK (SEQ ID NO.: 114), значительную разницу в его присутствии можно увидеть для образца МТ при t=0, и образца МТ1, подвергнутого УФА в течение 40 часов, и образца МТ, подвергнутого воздействию холодного белого света в течение 300 часов.
Воздействие на МТ холодного белого света или УФА света также оценивали на наличие HMW/низкомолекулярных (LMW) частиц (таблица 4-6).
Для отслеживания окраски по отношению к формам HMW/LMW для каждого образца, проводили аналитическую эксклюзионную хроматографию с детектированием PDA полного спектра (SEC-PDA), как показано выше, на всех подвергнутых стрессу образцах (холодный белый свет и УФА). Анализ SEC-PDA МТ, подвергнутых воздействию холодного белого света, показывает значительное увеличение поглощения при ~ 350 нм для всех вариантов размера, кроме форм LMW (Фиг. 21), тогда как SEC-PDA на МТ, подвергнутых воздействию УФА, не обнаруживает увеличения поглощения при ~ 350 нм (Фиг. 22). В отличие от образцов, подвергнутых воздействию холодного белого света, образцы, подвергнутые воздействию УФА, не обеспечивали сколько-нибудь значимо поддающегося количественной оценке желто-коричневого цвета.
Аналогичный результат был получен после изучения коэффициентов поглощения при 320 нм и 280 нм для образцов, подвергшихся воздействию УФА и холодного белого света. Отношения A320/A280, проанализированные либо по необработанной интенсивности, либо по общей площади пика, отслеживались с увеличением интенсивности желтого цвета в образцах, подвергнутых холодному белому свету (Фиг. 23), тогда как отношения A320/A280 не отслеживались с увеличением интенсивности желтого цвета в образцах, подвергнутых УФА-излучению (Фиг. 24). Это подтверждает предыдущее наблюдение, что образцы MT1, подвергнутые воздействию УФА, не обеспечивают такой же желто-коричневый цвет, который наблюдается после воздействия холодного белого света.
Пример 5. Предшествующие способы снижения окраски
5.1 Исследование инкубации среды с химически определенным составом
Было выявлено влияние различных компонентов, внесенных в свежую среду с химически определенным составом (ХОС), содержащую афлиберцепт, в отношении окраски.
Одну или более 50 мл пробирок для встряхивания с вентиляционными крышками с 10 мл рабочего объема (свежая ХОС1) инкубировали в течение 7 дней, отбирая образцы в день 0 и день 7. Образцы афлиберцепта (рекомбинантный белок афлиберцепт в водном буферном растворе, pH 6,2, содержащий 5 ммоль фосфата натрия, 5 ммоль цитрата натрия и 100 ммоль хлорида натрия) вносили в пробирки для встряхивания в концентрации 6 г/л.
Компоненты, добавленные для достижения кумулятивной концентрации:
Цистеин: 16,6 ммоль
Железо: 0,23 ммоль
Медь: 0,0071 ммоль
Цинк: 0,54 ммоль
Масштабный эффект каждой составляющей, добавленной к значению b* (цветовое пространство CIE L*, a*, b*), представлен на Фиг. 25A и график зависимости фактического значения b* от прогнозируемого значения b* показан на Фиг. 25B. Добавление цистеина привело к наибольшему увеличению желто-коричневого цвета. Железо и цинк также образуют цвет.Фолиевая кислота и витамин группы B (в том числе тиамин, ниацинамид, D-пантотеновая кислота, D-биотин и пиридоксин) повышали желто-коричневый цвет.Рибофлавин и витамин B12 значительно не влияли на цвет.
5.2 Влияние снижения цистеина и металлов на значение b*
Биореакторы (например, 2L) инокулировали из посевной культуры клеточной линии, продуцирующей афлиберцепт.Инокулированные культуры выращивали при температуре 35,5°C, pH 7,1±0,25 и заданном значении барботажа 22 куб. см. При необходимости в биореакторы добавляли глюкозу, пеногаситель и основное питание. Влияние снижения концентрации цистеина и металлов на цвет при экспрессии афлиберцепта оценивали в ХОС1.
Среда в день 0=ХОС1, включая 1,48 ммоль цистеина
Питательные среды:
День 2 = питательная среда с химически определенным составом (CDF)+1,3-2,1 ммоль цистеина
День 4 = CDF+1,6-1,7 ммоль цистеина
День 6 = CDF+1,6-1,7 ммоль цистеина
День 8 = CDF+1,6-1,7 ммоль цистеина
Условия биореактора были следующими:
цистеин добавляли при кумулятивной концентрации около 6-7 миллимолей на литр культуры, 8-9 миллимолей на литр культуры или 10-11 миллимолей на литр культуры.
Металлы в ХОС1 (уровни 0,5x, 1x или 1,5x ХОС1) на уровнях 1x перечислены ниже (где значения предшествуют добавлению инокулята):
Fe=68-83 микромолей на литр культуры
Zn=6-7 микромолей на литр культуры
Cu=0,1-0,2 микромолей на литр культуры
Ni=0,5-1 микромолей на литр культуры
Снижение кумулятивных уровней цистеина до 6-7 миллимоль/л снижает желто-коричневый цвет без значительного влияния на титр. Уменьшение содержания металла до 0,5 раз в среде уменьшило цвет со значительным увеличением титра. Влияние на титр, VCC (концентрация жизнеспособных клеток), жизнеспособность, аммиак или осмоляльность было минимальным, (см. Фиг. 26A-E). Прогнозируемый масштабный эффект содержания металлов и цистеина на значение b* и титр изложен на Фиг. 27.
5.3 Оценка влияния антиоксидантов на значение b*
Оценивали влияние антиоксидантов, таурина, гипотаурина, тиоктовой кислоты, глутатиона, глицина и витамина C на цвет, вносимый в отработанную ХОС, содержащую афлиберцепт.Одну или более 50 мл пробирок для встряхивания с вентиляционными крышками с 10 мл рабочего объема (ХОС1) инкубировали в течение 7 дней, отбирая образцы в день 0 и день 7.
Условия для добавления компонентов в обедненный ХОС1 были следующими:
образец афлиберцепта (рекомбинантный белок афлиберцепт в водном буферном растворе, pH 6,2, содержащий 5 ммоль фосфата натрия, 5 ммоль цитрата натрия и 100 ммоль хлорида натрия), добавленный в пробирки для встряхивания в концентрации 6 г/л
антиоксиданты, добавленные в обедненный ХОС1 в следующих концентрациях:
таурин = 10 ммоль культуры
гипотаурин = 10 ммоль культуры
глицин = 10 ммоль культуры
тиоктовая кислота = 0,0024 ммоль культуры
глутатион, восстановленный = 2 ммоль культуры
гидрокортизон = 0,0014 ммоль культуры
витамин C (аскорбиновая кислота) = 0,028 ммоль культуры
Несколько антиоксидантов уменьшали цветообразование в отработанной среде: комбинация гипотаурина, таурина и глицина; тиоктовая кислота; и витамин C. Глутатион повышал значение b*.
* антиоксиданты, которые значительно снизили значение b*: гипотаурин/таурин/глицин, тиоктовая кислота, витамин C.
Краткое изложение прогнозируемого влияния различных антиоксидантов на значение b* (цветовое пространство CIE L*, a*, b*) приведено на Фиг. 28 (A-C).
Было оценено влияние дальнейшего добавления антиоксидантов на цвет обедненной ХОС, содержащей афлиберцепт.Одну или более 50 мл пробирок для встряхивания с вентиляционными крышками с 10 мл рабочего объема (ХОС1) инкубировали в течение 7 дней, отбирая образцы в день 0 и день 7.
Условия для добавления компонентов в обедненный ХОС1 были следующими:
образец афлиберцепта (рекомбинантный белок афлиберцепт в водном буферном растворе, pH 6,2, содержащий 5 ммоль фосфата натрия, 5 ммоль цитрата натрия и 100 ммоль хлорида натрия), добавленный в пробирки для встряхивания в концентрации 6 г/л
Проводили два эксперимента DOE:
(i) антиоксиданты, добавленные в обедненный ХОС1 в следующих концентрациях:
таурин = 10 ммоль культуры
гипотаурин = 10 ммоль культуры
глицин = 10 ммоль культуры
тиоктовая кислота = 0,0024 ммоль культуры
витамин C (аскорбиновая кислота) = 0,028 ммоль культуры
(ii) антиоксиданты, добавленные для достижения следующих кумулятивных концентраций:
ATA=2,5 мкмоль - 5 мкмоль
дефероксамин мезилат (DFO)=5 мкмоль - 10 мкмоль
каталаза = 101,5 мг/л
S-карбоксиметил-L-цистеин = 10 ммоль
гипотаурин снижает образование цвета обедненной среды (Фиг. 28D). DFO также значительно снижал образование цвета обедненной среды (Фиг. 28D). Остальные антиоксиданты не оказали статистического влияния на образование цвета.
Исследование с антиоксидантом во флаконе для встряхивания:
таурин, гипотаурин, глицин, тиоктовая кислота и витамин C оценивали отдельно и в комбинации в отношении их способности снижать образование цвета в клеточной культуре (таблица 5-3).
Флаконы для встряхивания объемом 250 мл инокулировали из посевной культуры клеточной линии, продуцирующей афлиберцепт.Инокулированные клетки выращивали при 35,5°C в инкубаторах с контролем 5% CO2. При необходимости во встряхиваемые колбы добавляли глюкозу и основное питание. Применяли описанный выше процесс, в котором металлы присутствовали в концентрации 0,5x в ХОС1 и цистеин добавляли в кумулятивной концентрации 6-7 ммоль.
0x
0.5x
1x
На Фиг. 28E показан прогнозируемый эффект антиоксидантов в таблице 5-3 на значение b* (цветовое пространство CIE L*, a*, b*) и конечный титр. Таурин, гипотаурин и глицин значительно снижали значение b* без отрицательного влияния на титр.
Пример 6. Исследования гликозилирования и жизнеспособности для получения афлиберцепта с использованием ХОС
Биореакторы (например, 2L) инокулировали из посевной культуры клеточной линии, продуцирующей афлиберцепт.Инокулированные культуры выращивали при температуре 35,5°C, pH 7,1±0,25 и заданном значении барботажа 22 куб. см. При необходимости в биореакторы добавляли глюкозу, пеногаситель и основное питание. Получение белка афлиберцепта осуществляли с использованием ХОС1 (фирменной). Получение линии клеток-хозяев, экспрессирующих слитый белок афлиберцепта, осуществляли с использованием ХОС1 (фирменной), ХОС2 (доступной в продаже) и ХОС3 (доступной в продаже). Ряд экспериментов осуществляли с использованием ХОС 1, 2, и 3 без дополнительных компонентов среды. Еще один ряд экспериментов осуществляли с использованием ХОС 1-3, к которым добавляли марганец (марганца хлорид тетрагидрат, Sigma, 3,2 мг/л), галактозу (Sigma, 8 г/л) и уридин (Sigma, 6 г/л) в питательные среды для изменения профиля галактозилирования. Наконец, осуществляли ряд экспериментов с использованием ХОС 1-3, к которым добавляли марганец (марганца хлорид тетрагидрат, Sigma, 3,2 мг/л), галактозу (Sigma, 8 г/л) и уридин (Sigma, 6 г/л) в питательные среды для изменения профиля галактозилирования и добавляли дексаметазон (Sigma, 12 мг/л) в питательные среды для изменения профиля сиалирования композиции. Осветленный сбор с использованием каждого ХОС получали посредством центрифугирования с последующей фильтрацией 0,45 мкм.
Образцы обрабатывали белком A перед анализом с N-гликаном.
Измерения титра
В данных примерах, если не указано иное, титры афлиберцепта измеряли ежедневно с использованием ВЭЖХ серии 1200 Agilent (Санта-Клара, Калифорния) или эквивалентного, работающего при низком pH, ступенчатом градиенте элюирования с детектированием при 280 нм. Концентрации были присвоены относительно эталонной калибровочной кривой.
Значения плотности жизнеспособных клеток (VCD) и жизнеспособности клеток
В данных примерах, если не указано иное, значения плотности жизнеспособных клеток (VCD) и жизнеспособности клеток измеряли посредством исключения трипанового синего с использованием автоматических счетчиков клеток Nova BioProfile Flex (Nova Biomedical, Уолтем, Массачусетс). Глюкоза, лактат, pH вне контура, растворенный кислород (DO), измерения pCO2 и осмоляльность измеряли с использованием Nova BioProfile Flex (Nova Biomedical, Уолтем, Массачусетс).
Профилирование N-гликан-олигосахаридов
[1] Приблизительно 15 мкг обработанных образцов белка A из сборов ХОС 1-3 получали для анализа N-гликанов в соответствии с протоколом Waters GlycoWorks с использованием наборов GlycoWorks Rapid Deglycosylation и GlycoWorks RapiFluor-MS Label (номера деталей Waters 186008939 и 186008091, соответственно). N-гликаны удаляли из белка афлиберцепта посредством обработки образцов с использованием PNG-азы-F при 50,5°C в течение 5 минут с последующим охлаждением при 25°C в течение 5 минут. Высвобожденные гликаны помечали флуоресцентным красителем RapiFluor-MS посредством реакции при комнатной температуре в течение 5 минут.Белок осаждали посредством добавления ацетонитрила к реакционной смеси и осаждали на дно лунки посредством центрифугирования при 2204 х г в течение 10 минут.Супернатант, содержащий меченые гликаны, собирали и анализировали посредством СВЭЖХ с использованием жидкостной хроматографии с гидрофильным взаимодействием (колонка Waters BEH Amide) с постколоночной флуоресцентной детекцией. После связывания с колонкой меченые гликаны разделяли и элюировали с использованием градиента бинарной подвижной фазы, состоящей из ацетонитрила и 50 ммоль водного формиата аммония (pH 4,4). Меченые гликаны детектировали с использованием флуоресцентного детектора с длиной волны возбуждения 265 нм и длиной волны испускания 425 нм. Используя относительные проценты площадей пиков N-гликанов на полученных хроматограммах, распределение N-гликанов представлено как общий процент N-гликанов (1), содержащих остатки ядра фукозы (общее фукозилирование, таблица 6-1), (2) содержащий по меньшей мере один остаток салициловой кислоты (общее сиалирование, таблица 6-2), (3) идентифицированных как манноза-5 (манноза-5, таблица 6-3), (4) содержащих по меньшей мере один остаток галактозы (общее галактозилирование, таблица 6-4), и (5) с известной идентичностью (общие идентифицированные пики, таблица 6-5).
Результаты
Подсчет жизнеспособных клеток (VCC), жизнеспособность и титры сбора показаны на Фиг. 29-31 для ХОС 1-3 с дополнительными компонентами и без них.
Среди девяти культур культура ХОС1, содержащая уридин, марганец и галактозу, показала самый высокий титр через 12 дней (5,5 г/л). ХОС1 без дополнительных компонентов также показал высокий титр через 12 дней (около 4,25 г/л) по сравнению с другими семью культурами (Фиг. 29).
Результаты жизнеспособности клеток были одинаковыми в различных условиях до дня 6 процесса. После дня 7 процесса культуры ХОС2 и ХОС3 с дополнительными компонентами среды или без них показали жизнеспособность более 90% (Фиг. 30).
Культура ХОС1 с уридином, марганцем и галактозой продемонстрировала самый высокий VCC приблизительно в день 6 (Фиг. 31).
Влияние культур и добавок оказало значительное влияние на общее распределение N-гликанов (таблицы с 6-1 по 6-5). Уровни гликана сравнивали с использованием афлиберцепта, обработанного белком A (оценивали два образца), полученного с использованием гидролизата сои. Общие идентифицированные пики перечислены в таблице 6-5.
U представляет собой уридин, M представляет собой марганец, G представляет собой галактоза, Dex представляет собой дексаметазон
U представляет собой уридин, M представляет собой марганец, G представляет собой галактоза, Dex представляет собой дексаметазон
U представляет собой уридин, M представляет собой марганец, G представляет собой галактоза, Dex представляет собой дексаметазон
U представляет собой уридин, M представляет собой марганец, G представляет собой галактоза, Dex представляет собой дексаметазон
U представляет собой уридин, M представляет собой марганец, G представляет собой галактоза, Dex представляет собой дексаметазон
Общее фукозилирование, общее сиалирование, общее галактозилирование и манноза-5, наблюдаемые в день 12 культур различных ХОС, составили от 42,61% до 46,26%, от 30,84% до 39,14%, от 59,02 до 66% и от 8,86% до 13,38%, соответственно. Данные значения для гликозилирования отличаются от значений гликозилирования, полученных с использованием гидролизата сои.
Наконец, проводили измерения цвета для осветленных сборов, полученных из клеток, экспрессирующих афлиберцепт в ХОС1, ХОС2 и ХОС3, дополненных уридином, марганцем и галактозой. Рабочие параметры для стадий исследования биореактора будут известны среднему специалисту в данной области.
Пример 7. Аффинное получение белков против VEGF
7.1 Экспрессия VEGF MiniTrap
Кодирующие области рекомбинантного VEGF MiniTrap (например, MT5, SEQ ID NO.: 46) были функционально связаны с сигнальной последовательностью, клонированной в вектор экспрессии млекопитающего и трансфицировали в клетки яичника китайского хомячка (CHO-K1); стабильно трансфицированные пулы выделяли после отбора с использованием гигромицина 400 мкг/мл в течение 12 дней. Стабильные пулы клеток СНО, выращенные в среде без белков с определенным химическим составом, применяли для получения белков для испытания. Рекомбинантные полипептиды секретировались из клеток в питательную среду.
Последовательности составляющих доменов VEGF MiniTrap
Человеческий Flt1 (номер доступа NP_001153392.1)
Человеческий Flk1 (номер доступа NP_002244.1)
Человеческий Fc (IGHG1, номер доступа P01857-1)
Рекомбинантный VEGF MiniTrap с (MT5) получали из данного процесса и дополнительно обрабатывали.
7.2 Получение колонок для аффинной хроматографии
Оценивали пять отличных белков, способных связываться с VEGF MiniTrap (MT5). Применяемые белки включают VEGF165 (SEQ ID NO.: 72), mAb1 (человеческий IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 73 представляет собой тяжелую цепь и SEQ ID NO.: 74 представляет собой легкую цепь); mAb2 (человеческий IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 75 представляет собой тяжелую цепь и SEQ ID NO.: 76 представляет собой легкую цепь); mAb3 (мышиный IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 77 представляет собой тяжелую цепь и SEQ ID NO.: 78 представляет собой легкую цепь) и mAb4 (мышиный IgG1 против мышиного mAb к VEGFR1, где SEQ ID NO.: 79 представляет собой тяжелую цепь и SEQ ID NO.: 80 представляет собой легкую цепь).
Колонку активировали посредством промывки колонок 6 объемами колонки (CV) 1 ммоль ледяной соляной кислоты при скорости потока, не превышающей 1 мл/мин. Десять мг каждого белка загружали в три аффинные колонки HiTrap NHS-Activated HP (1 мл, GE Healthcare, №по каталогу 17-0716-01), и колонки закрывали для обеспечения связывания в течение 30 минут при комнатной температуре. Колонки промывали 18 объемами колонки 0,5 моль ацетата натрия, 0,5 моль NaCl, pH 4,0 и открытые участки блокировали 18 объемами колонки 0,5 моль трис-HCl, 0,5 моль NaCl pH 8,3 (промывку проводили в следующем порядке: 6 объемов колонки 0,5 моль трис-HCl, 0,5 моль NaCl, pH 8,3; 6 объемов колонки 0,5 моль ацетата натрия (ацетат натрия: JT Baker, №по кат.3470-01), 0,5 моль NaCl, pH 4,0; 6 объемов колонки 0,5 моль буфера трис, pH 8,3; колонку инкубировали в течение 30 минут при комнатной температуре; 6 объемов колонки 0,5 моль буфера ацетата натрия, 0,5 моль NaCl, pH 4,0; 6 объемов колонки 0,5 моль трис-HCl, 0,5 NaCl, pH 8,3 и 6 объемов колонки 0,5 моль буфера ацетата натрия, 0,5 моль NaCl, pH 4,0). Колонки хранили в DPBS, pH 7,5. Пять оцениваемых колонок были обозначены как колонка 1 (содержащая VEGF165), колонка 2 (содержащая mAb1), колонка 3 (содержащая mAb2), колонка 4 (содержащая mAb3) и колонка 5 (содержащая mAb4).
7.3 Получение MiniTrap с использованием аффинной хроматографии
Получение образца. Выполняли два различных процесса получения для MiniTrap.В одном случае материал, содержащий образец MiniTrap, получали с использованием каждой аффинной колонки, где исходный материал (MiniTrap) разводили 1X буфером DPBS до 20 мг/мл и наносили на колонку и включали при комнатной температуре в течение 30 минут.Используя аффинную колонку, MiniTrap выделяли из ~ 7000 ч./млн HCP.
В качестве альтернативы, применяли собранный супернатант культуры, который содержал 0,4 мг/мл белка в супернатанте, и загружали на различные аффинные колонки (1-5) отдельно. Дальнейшее разбавление не проводили. Затем аффинные колонки промывали с использованием 9 CV 1x буфера DPBS с последующим разведением белков с использованием элюирующего буфера IgG, pH 2,8 (Thermo, №по кат. 21009).
Затем материал MiniTrap, полученный как описано выше, фильтровали через фильтр 0,45 мкмоль или центрифугировали перед загрузкой на колонки, полученные как описано выше в разделе 7.2. Двадцать пять мл загрузочного раствора, содержащего приблизительно 0,4 мг/мл, загружали в каждую из колонок и инкубировали в течение 20 минут. Каждую колонку промывали 9 CV DPBS (Invitrogen, №по кат. 14190-144) перед элюированием для уравновешивания. Количество МТ5 во фракциях промывки показано в таблице 7-1. После промывок следовало элюирование с использованием 6 CV при pH 2,8 (коммерческий элюирующий буфер, (Thermo, № по кат. 21009)) и 100 ммоль глицинового буфера с pH 2,5 и фракции быстро нейтрализовали посредством добавления 1 моль буфера трис, pH 7,5 (Invitrogen, №по кат.15567-027). Количество MiniTrap в элюированных фракциях также указано в таблице 7-1.
MiniTrap (MT5) был успешно получен из всех пяти аффинных колонок. Выход из колонки с VEGF165 был большим по сравнению с колонками mAb1 и mAb2. MAb3 и mAb4, содержащие гуманизированные mAb против VEGFR1, также показали успешное получение MT5 с выходом, аналогичным mAb1 и mAb2. В таблице 7-1 ожидаемый выход рассчитывали на основе 100% эффективности конъюгации и молярного отношения 1:1 захваченного на основе аффинности белка к MT5.
VEGF165
mAb1
mAb2
mAb3
mAb4
7.4 Исследование стабильности колонки
Несколько циклов выполняли с использованием колонок 1 и 2 после способа, описанного в разделе 7.3 (таблица 7-2 для колонки 1 и таблица 7-3 для колонки 2).
Колонки хранили при 4° в течение около 5 недель. Подобное количество MT5 было элюировано из каждой продукции, демонстрируя хорошую стабильность колонки.
7.5 Исследование стабильности полученного VEGF MiniTrap
Осуществляли анализ SDS-PAGE элюированных фракций из трех колонок (колонки 1, колонки 2 и колонки 3). Образцы получали в невосстанавливающем и восстанавливающем иллюстративном буфере SDS-PAGE и запускали на 4-12% градиенте NuPage геля бис-трис с использованием 1X MES (№по кат.NP0322, Invitrogen, Карлсбад, Калифорния).
В лунки загружали (1) стандарт молекулярной массы, (2) загрузочный раствор, (3) промывку колонки из колонки 1, (4) элюированную фракцию из колонки 2, (5) элюированную фракцию из колонки 1, (6) элюированную фракцию из колонки 3, (7) MT5, хранящийся при pH 2,8 в течение 1 мин., (8) MT5, хранящийся при pH 2,8 в течение 30 мин., и (9) стандарт молекулярной массы (Фиг. 33 и Фиг. 34). Анализ показал, что фракции, полученные из элюированных фракций из всех трех аффинных колонок (колонки 1-3), показали одинаковый размер профилей, и применение аффинных колонок не дестабилизировало MiniTrap.
7.6 Расчет уровня белка клетки-хозяина
Стандартная кривая концентрации белков клетки-хозяина получали с использованием набора CHO HCP ELISA, 3G (F550) (Cygus Technologies) (Фиг. 32 и таблица 7-4). Количество HCP в загрузочных растворах и элюированных фракциях рассчитывали с использованием стандартной кривой, как показано на Фиг. 32, и формулы кривой, представленной в таблице 7-4.
Общее количество HCP рассчитывали с использованием стандартной кривой, а диаграмма с общим количеством белков клетки-хозяина представлена на Фиг. 35A. На Фиг. 35B также показано общее количество белков клетки-хозяина в загрузке по сравнению с промывками и элюированными фракциями из колонок 1, 2, 4 и 5. Несколько прогонов осуществляли с использованием колонок и (#) на Фиг. 35B представляет прогон, из которого была элюирована фракция.
Применение аффинного захвата с использованием белков, способных связываться с MiniTrap, показало эффективное снижение HCP от около 7000 ч./млн до около 25-50 ч./млн. Как наблюдалось для выхода, колонка с VEGF165 продемонстрировала более высокую чистоту MiniTrap из HCP, чем показано для колонок mAb1 и mAb2.
7.7 Профили SEC VEGF MiniTrap до и после аффинного получения
Профили SEC элюированных фракций из трех колонок (колонки 1-3) сравнивали с профилем SEC MiniTrap в загрузочном растворе. Как видно на Фиг. 36 и в таблице 7-5, профили SEC MT5 до или после аффинного получения были в значительной степени подобны.
7.8 Кинетические характеристики VEGF MiniTrap до и после связывания образцов из колонок с mAb1, mAb2 и VEGF165
Исследования кинетических характеристик осуществляли с использованием инструмента Biacore T200.
Равновесные константы диссоциации (значения KD) для VEGF165, связывающегося с MiniTrap в элюатах из колонок 1 и 2, и загрузочного раствора определяли с использованием биосенсора поверхностного плазмонного резонанса в реальном времени с использованием инструмента Biacore T200. Все исследования связывания проводили в 10 ммоль HEPES, 150 ммоль NaCl, 3 ммоль EDTA и 0,05% об./об. поверхностно-активного вещества Твин-20, pH 7,4 (HBS-ET), запуская буфер при 25°C. Поверхность сенсора Biacore сначала получали посредством связывания аминного соединения с mAb1 для захвата MT5. Упрощенное изображение исследования связывания показано на Фиг. 37.
Вкратце, элюаты из колонок и загрузочного раствора разводили в буфере HBS-EP (Biacore) и вводили через иммобилизованные белковые матрицы на уровне захвата ~ 70 RU. Затем VEGF165 инъецировали со скоростью потока 50 мкл/мин. Эквивалентный объем аналита одновременно вводили на необработанную контрольную поверхность, чтобы он служил в качестве пустых сенсограмм для вычитания фона объемного показателя преломления. Поверхность сенсорного чипа регенерировали между циклами посредством двух 5-минутных инъекций 10 ммоль глицина со скоростью 25 мкл/мин. Затем полученные экспериментальные сенсограммы связывания оценивали с использованием программного обеспечения BIA Assessment 4.0.1 для определения параметров кинетической скорости. Наборы данных для каждого образца соответствовали модели Ленгмюра 1:1. Для данных исследований данные связывания и диссоциации анализировали в соответствии с протоколом анализа Global Fit, при этом выбирая локальное соответствие для максимальной связывающей способности аналита (RU) или атрибута Rmax. В данном случае программа рассчитывала единственную константу диссоциации (kd), константу ассоциации (ka) и константу аффинности (Kd). Равновесная константа диссоциации составляла KD=kd/ka. Кинетическую скорость прямой реакции, кинетическую скорость обратной реакции и общее сродство определяли с использованием различных концентраций VEGF165 в диапазоне 0,03-2 нмоль (таблица 7-6). Периоды полувыведения диссоциации (t½) были рассчитаны на основе кинетических констант скорости как t1/2=ln(2)/60*Kd. Кинетические параметры связывания для MT5 к VEGF165, полученные вследствие предварительной и последующей аффинной хроматографии при 25°C, показаны в таблице 7-6.
Аффинность (KD), скорость прямой реакции (ka, M-1 с-1) и скорость обратной реакции (kd) для MT5, полученного посредством аффинной хроматографии, по сравнению с загрузочным раствором для оценки эффекта(-ов) стадии аффинной хроматографии, не продемонстрировало изменения кинетических характеристик MT5 от других образцов. Сенсограммы SPR конструктов VEGF MiniTrap представлены на Фиг. 38.
(106 M-1 с-1)
(10-5 с-1)
(10-12 M)
(мин.)
(RU2)
7.9 Несколько производственных циклов
Хроматографическое получение сбора, полученного на стадии 7.1, проводили с использованием колонки 1 (hVEGF165) и колонки 2 (mAb1), как показано в 7.3. Колонки применяли для нескольких хроматографических циклов. Выход колонок существенно не изменился вследствие дополнительных прогонов, что свидетельствует о том, что колонки сохранили связывающую способность (таблица 7-7).
Расчеты HCP в загрузочном растворе, промывочных фракциях и элюированных фракциях для колонок 1 и 2 выполняли с использованием способа, описанного в 7.4 (Фиг. 39). Рассчитанное общее количество HCP показало, что повторное применение колонок не снижает способность колонок связываться с MiniTrap.
7.10 Оптимизация аффинных хроматографических колонок
Хроматографическое получение собранного материала в соответствии с получением 7.1 осуществляли с использованием колонки 1 (VEGF165) и колонки 2 (mAb1). Для исследований по оптимизации 14 мг или 45 мг вместо 10 мг VEGF165 или mAb к VEGFR1 загружали в две аффинные колонки HiTrap NHS-Activated HP (1 мл, GE Healthcare), и колонки закрывали для обеспечения выдерживания соединения в течение 30 минут при комнатной температуре. Подготовку колонки и получение сбора, включая MiniTrap, выполняли, как описано выше в пунктах 7.2 и 7.3. Количество МТ5 в промывке и элюированных фракциях указано в таблице 7-8. Сравнение аффинной колонки с количеством конъюгации 14 мг или 45 мг (VEGF165 или mAb к VEGFR1 (mAb1)) вместо 10 мг показывает повышенный выход MiniTrap из обеих колонок. Таким образом, выход колонки с использованием описанного способа может быть улучшен посредством оптимизации соотношения белка к колонке или посредством увеличения эффективности конъюгации путем изменения pH, времени инкубации, температуры инкубации и т.д.
7.11 Применение CEX с аффинной хроматографией
Образец культуры клеток от экспрессии MT5 получали с использованием колонки 1, как описано выше в разделе 7.3. Полученный элюат подвергали катионообменной хроматографии (CEX) колонка (HiTrap Capto S, 1 мл). Условия эксплуатации колонки показаны в таблице 7-9.
Общее количество HCP в исходном/стартовом образце культуры клеток, элюате колонки для аффинной хроматографии 1 и элюате CEX составляло около 230000 нг/мл, от около 9000 нг/мл до около 850 нг/мл, соответственно. Количества HCP определяли количественно с использованием набора Cygnus CHO HCP ELISA, 3G, как указано выше.
7.12 Применение аффинной хроматографии для получения другого белка против VEGF
Колонку 1 оценивали для изучения ее способности продуцировать другие белки против VEGF. Для данного исследования применяли афлиберцепт и фрагмент scFv с потенциалом связывания VEGF. Производственные процессы выполняли в соответствии с описанием в разделе 7.3. В таблице 7-10 показано, что колонка 1 успешно связывала и элюировала другие белки против VEGF.
Пример 8. Характеристика конструктов VEGF MiniTrap на основании масс-спектрометрии
Материалы. VEGF MiniTrap (MT1) получали из афлиберцепта, как описано в примере 1. VEGF MiniTrap 5 (MT5) получали, как описано в примере 7. VEGF MiniTrap (MT6) получали посредством следующего способа: кодирующие области рекомбинантного VEGF MiniTrap (MT5) были функционально связаны с сигнальной последовательностью и клонированы в вектор экспрессии млекопитающих, трансфицированы в клетки яичника китайского хомячка (CHO-K1) и стабильно трансфицированные пулы выделяли после отбора с использованием гигромицина 400 мкг/мл в течение 12 дней. Стабильные пулы клеток CHO, выращенные в ХОС, применяли для получения белков для анализа.
8.1 Дегликозилирование гликопротеинов.
Образцы из осветленного сбора MT1, MT5 и MT6 разбавляли или восстанавливали до концентрации 0,52 мг/мл в 28,8 мкл 1% (мас./об.) раствора поверхностно-активного вещества RG (RapiGest SF, Waters, Милфорд, Массачусетс) и 50 ммоль HEPES (pH 7,9). Данные растворы нагревали приблизительно до 95°C в течение 2 минут, давали остыть до 50°C и смешивали с 1,2 мкл раствора PNG-азы F (GlycoWorks Rapid PNGase F, Waters, Милфорд, Массачусетс). Дегликозилирование завершали инкубацией образцов при 50°C в течение 5 мин.
8.2 Анализ посредством HILIC-флуоресцентной-ESI-MS (МС/МС).
МТ1 анализировали посредством разделения HILIC в сочетании с флуоресцентным и масс-спектрометрическим детектированием. MT5 и MT6 анализировали с использованием только HILIC. Хроматографию проводили с использованием Waters 2D Acquity UPLC, оборудованного фотодиодной матрицей и детекторами флуоресценции (FLR) и сопряженными с масс-спектрометром Waters Synapt G2-S (условия МС). Режим разделения посредством хроматографии с гидрофильным взаимодействием (HILIC) применяли с колонкой Waters UPLC Glycan BEH Amide, 150 × 2,1 ммоль, 1,7 мкм. Температуру колонки устанавливали на 60°C, а температуру автоматического пробоотборника устанавливали на 5°C. Объем впрыска составлял 50 мкл. Диапазон сканирования матрицы фотодиодов составлял 190-700 нм. FLR устанавливали на возбуждение 265 нм, испускание 425 нм для меченных RapiFluor гликанов и возбуждение 274 нм и испускание 303 нм для тирозина, присутствующего в гликопептидах. Начальная скорость потока составляла 0,4 мл/мин. с подвижной фазой A, содержащей 100 ммоль формиата аммония (pH 4,4), и подвижной фазой B, являющейся ацетонитрилом.
8.3 Условия МС
Эксперименты жидкостной хроматографии/масс-спектрометрии (ЛХ/МС) проводили с использованием масс-спектрометра Waters Synapt G2-S. Диапазон сканирования представлял собой отношение массы к заряду 100-2400 для анализов в режиме положительных и отрицательных ионов. Время сканирования составляло 1 с, и глю-фибринопептид B постоянно вводили (2 мкл/мин.) в качестве калибрующего вещества («фиксирующей массы»). Напряжение на капилляре устанавливали равным 2,5 кВ, при температуре источника 120°C и температуре десольватации 500°C. Расход газа азотного распылителя устанавливали на 700 л/ч.
8.4 Исходная SEC-MS
Система ACQUITY UPLC I класса (Waters, Милфорд, Массачусест) была связана с масс-спектрометром Q Exactive HF hybrid quadrupole-Orbitrap (Thermo Scientific, Бремен, Германия) для всех онлайн-анализов SEC-MS. Колонку ACQUITY UPLC Protein BEH SEC (200Å, 1,7 мкм, 4,6 × 300 мм) устанавливали при 30°C и применяли для разделения белков. Подвижная фаза представляла собой 100 ммоль ацетата аммония при pH 6,8. Каждое разделение занимало 30 минут со скоростью потока 0,3 мл/мин., и объем впрыска устанавливали на 40 мкг.Следующие параметры MS применяли для онлайн-сбора данных SEC-нано-ESI-MS. Каждое получение данных длилось 25 минут, начиная сразу после введения образца. Дегликозилированные образцы ионизировали в положительном режиме с напряжением распыления 3 кВ, температурой капилляра 200°C и уровнем RF 70 S-линзы. Внутренний CID устанавливали на 75 эВ. Полное сканирование MS было получено при разрешающей способности 15 К с диапазоном масс масса/заряд 2000-8000. Для полного сканирования MS применяли максимальное время впрыска 100 мс, целевое значение автоматической регулировки усиления 3e6 и 10 микросканов.
8.5 Пептидное картирование
Получение образца для пептидного картирования. Уменьшения достигали посредством добавления 500 ммоль/л дитиотреитола (DTT) до конечной концентрации 5 ммоль/л с последующей инкубацией при 4°C в течение 60 мин. Алкилирование проводили посредством добавления 500 ммоль/л йодацетамида (IAM) к конечной концентрации 10 ммоль/л и инкубирования при 4°C в течение 60 мин. в темноте. Денатурирующий буфер заменяли на буфер для расщепления (1 моль/л мочевины в 0,1 моль/л буфера трис, pH 7,8) с использованием обессоливающих эксклюзионных колонок Zeba(Spin 7 K MWCO (P/N 89882) (Thermo Scientific, Уолтем, Массачусетс) согласно инструкции производителя. Рекомбинантный свиной трипсин (приобретенный у Sigma, №по кат.03708985001) добавляли в массовом соотношении 1:18 (фермент:образец) (на основе белка VEGF MiniTrap, измеренного с использованием спектрофотометрии UV-Vis после замены буфера), концентрацию белков VEGF MiniTrap доводили до 0,5 мкг/мкл и расщеплению позволяли протекать в течение 4 ч. инкубации при комнатной температуре. По окончании расщепления добавляли 0,1% муравьиной кислоты в воду степени ЖХ-МС в соотношении по объему 1:1. Гидролизаты хранили при -80°C до анализа.
Анализ посредством ЖХ-МС/MS триптических гидролизатов. Один или более 2,5 мкг (10 мкл) расщепленных пептидов загружали через автоматический пробоотборник на колонку C18, заключенную в термостатируемую печь колонки, установленную на 40°C. В очереди на инъекцию образцы выдерживали при 7°C. Хромографический способ начинали с 98% подвижной фазы A (0,1% объемной доли муравьиной кислоты в воде) и 2% подвижной фазы B (0,1% объемной доли муравьиной кислоты в ацетонитриле) при постоянной скорости потока 0,200 мл/мин. После промывки в течение 10 минут пептиды элюировались в течение градиента 110 минут, при котором содержание подвижной фазы B увеличивалось со скоростью 0,39% в минуту до достижения конечной композиции, содержащей 45% подвижной фазы B. Перед следующим вводом образца колонку промывали в течение 15 мин. 97% подвижной фазы B, затем уравновешивали 98% подвижной фазы A в течение 25 мин. Элюат был направлен в отработку в течение первых 1,5 минут и последних 5 минут прогона. Пептиды, элюирующие из хроматографической колонки, анализировали по УФ-поглощению при 214 нм с последующей масс-спектрометрией на LTQ Orbitrap Elite или Discovery XL. Репликационные данные пептидного картирования собирали для образцов PS 8670 и RM 8671 для включения трех тандемных анализов МС (МС/МС) и одного анализа только МС.Анализы МС/МС выполняли для идентификации пептидов в зависимом от данных режиме, в котором один цикл экспериментов состоял из одного полного МС-сканирования от 300 масса/заряд до 2000 масса/заряд, за которым следовали пять последовательных МС/МС-явлений, выполненных для ионов с первого по пятый по интенсивности, обнаруженных при минимальном пороговом счете 500 при сканировании МС, инициирующем данный цикл. Цель последовательной масс-спектрометрии (MSn) AGC была установлена на 1E4 с микросканированием=3. Ионную ловушку применяли в режиме центроида при нормальной скорости сканирования для анализа фрагментов МС/МС.Полные сканы МС собирали в режиме профиля с использованием анализатора FTMS высокого разрешения (R=30 000) с целью полного сканирования AGC 1E6 и микросканирований=1. Ионы отбирали для МС/МС с использованием ширины изоляции 2 Да, затем фрагментировали посредством диссоциации, индуцированной столкновением (CID) с газообразным гелием, с использованием нормированной энергии CID, равной 35, Q активации 0,25 и времени активации 10 мсек. Состояние заряда по умолчанию было установлено на z=2. Массы, зависящие от данных, помещали в список исключений на 45 секунд, если ион-предшественник инициировал явление дважды в течение 30 с; ширина исключения была установлена на уровне±1 Да. Отказ состояния заряда включен для неназначенных состояний заряда. В массовый список отказа были включены распространенные примеси на 122,08 масса/заряд, 185,94 масса/заряд, 355,00 масса/заряд, 371,00 масса/заряд, 391,00 масса/заряд, 413,30 масса/заряд, 803,10 масса/заряд, 1222,10 масса/заряд, 1322,10 масса/заряд, 1422,10 масса/заряд, 1522,10 масса/заряд, 1622,10 масса/заряд, 1722,10 масса/заряд, 1822,10 масса/заряд и 1922,10 масса/заряд. Анализы только для МС выполняли для создания карты невосстановленных пептидов TIC и уменьшенных карт.
8.6 Результаты
Структура конструктов VEGF MiniTrap.Структура VEGF MiniTrap MT1, MT5 и MT6 показана на Фиг. 40, Фиг. 41, Фиг. 43 и Фиг. 44.
Первоначальный масс-анализ с использованием SEC-MS подтвердил идентичность всех трех молекул на уровне интактного белка после дегликозилирования (Фиг. 42). Хромограмма общего количества ионов (TIC) нативного анализа SEC-MS демонстрирует обнаружение интактных молекул VEGF MiniTrap примерно через 12-13 минут.Расширение низкомолекулярной (LMW) области TIC показало наличие LMW примесей во всех трех образцах белков.
Масс-спектры VEGF MiniTrap с деконволюцией дополнительно подтвердили их идентичность и предоставили данные для выяснения основных присутствующих PTM в образце, содержащих MT1 и MT5 (Фиг. 43), которые представляют собой димеры и MT6 (Фиг. 44), который представляет собой одноцепочечный белок.
Анализ образца MT1. Формы LMW, идентифицированные посредством TIC анализа SEC-MS образцов, содержащих MT1, экстрагировали для определения трех различных примесей LMW - LMW1, LMW2 и LMW3 (Фиг. 45A и Фиг. 45B). Формы LMW1 включали усеченные формы афлиберцепта. Формы LMW2 включали примесь Fc, присутствующую в образце от расщепления афлиберцепта, которое выполняли для получения MiniTrap.Форма LMW3 включает мономер, возможно, отщепленный от молекулы MT1 (димера).
Образец MT1 не показал наличие фермента FabRICATOR, который применяли для расщепления афлиберцепта с образованием белка MiniTrap.Фермент, если он присутствует, обнаруживается примерно через 11,5 и 12,5 минут.Такой пик не был обнаружен во время анализа SEC-MS образца MT1 (Фиг. 46).
Анализ образца MT5. Формы LMW, идентифицированные посредством TIC анализа SEC-MS образцов, содержащих MT5, экстрагировали на наличие двух различных примесей LMW - LMW1 и LMW2 (Фиг. 47).
Анализ образца MT6. Формы LMW, идентифицированные посредством TIC анализа SEC-MS образцов, содержащих MT1, экстрагировали на наличие трех различных примесей LMW - LMW1, LMW2 и LMW3 (Фиг. 48). Формы LMW2 включают фрагмент MT6, в результате расщепления образуется фрагмент VEGF MiniTrap с линкером G4S (SEQ ID NO.: 111). Формы LMW5 представляют собой фрагмент MT6, в котором расщепление произошло непосредственно до или после линкера G4S (SEQ ID NO.: 111).
Гликаны в образце МТ6 были идентифицированы по их массе и порядку элюирования в способе хроматографии HILIC с использованием значения единицы глюкозы, впервые введенного Waters и Национальным институтом исследований и обучения биотехнологии (Дублин, Ирландия) (Фиг. 49A и Фиг. 49B).
Количественное определение свободного тиола. Остатки цистеина конструктов VEGF MiniTrap могут участвовать в образовании внутри- и межмолекулярных дисульфидных связей или они могут существовать в виде свободных тиолов. Было показано, что наличие сульфидных связей в пептидах и белках налагает конформационную жесткость на белок. Тиолы могут быть обнаружены посредством различных реагентов и способов разделения. Анализ трех конструкций VEGF MiniTrap относительно очень низкий уровня свободных тиолов показан в таблице 8-1.
Количественное определение трисульфида. Подобно свободным тиолам в Cys-остатках конструктов VEGF MiniTrap, трисульфидные связи могут влиять на структуру белка. Анализ трех конструктов VEGF MiniTrap в условиях с очень низким уровнем свободных тиолов показан в таблице 8-2.
Внутрицепочечный дисульфид в шарнирной области. Неспаренные дисульфидные связи в шарнирной области могут влиять на структуру, функцию и стабильность конструктов VEGF MiniTrap.Анализ трех конструктов VEGF MiniTrap на очень низкое или полное отсутствие внутрицепочечных дисульфидных связей в шарнирной области конструктов VEGF MiniTrap [THTC*PPC*PAPELLG, C* показывает, где может образовываться внутрицепочечная сульфидная связь] (SEQ ID NO.: 83) показан в таблице 8-3.
Количественное определение изомеров поперечных и параллельных дисульфидных связей. Для MT1 и MT5, которые представляют собой димеры, соединенные параллельными дисульфидными связями в шарнирных областях, существует возможность изомеров, в которых дисульфидные связи в шарнирных областях могут пересекаться (Фиг. 50).
Количественное определение типов дисульфидной связи, параллельной и перекрестной, показала, что рекомбинантно экспрессируемый белок MT5 имел немного более высокий уровень перекрестного дисульфидного мостика в шарнирной области Fc по сравнению с MT1, который представляет собой молекулу, расщепленную FabRICATOR (таблица 8-4).
Посттрансляционные модификации (PTM).
(Asn319)
(Asn334)
(Met427)
Оценка PTM во всех трех конструкциях VEGF MiniTrap показала сопоставимые уровни PTM (таблица 8-5). Дезамидирование, наблюдаемое при Asn84 с образованием сукцинимида, составляло от 3,1 до 3,2%, а с образованием аспарагиновой кислоты/изоаспарагиновой кислоты составляло 18,9-21,9%. Окисление нескольких остатков метионина (например, Met10, Met 20m Met163 и Met192) наблюдали в диапазоне около 0,7-6,8% для всех трех конструктов VEGF MiniTrap.МТ6, который, в отличие от МТ1 и МТ5, содержит линкер, показал дополнительное окисление остатков метионина на линкере (например, Met245 и Met255). Около 0,1% и 2,0% C-концевого глицина (Gly211) в MT1 и MT5 показали потерю глицина. Этого не наблюдалось для MT6, в котором отсутствует C-концевой глицин.
Модификации конечного продукта усовершенствованной гликации, связанные с гликацией лизина и аргинина. Гликация конструкций VEGF MiniTrap может изменять их структуру и функцию, что приводит к нарушению активности против VEGF.
Оценка модификаций во всех трех конструкциях VEGF MiniTrap показала сопоставимые уровни (таблица 8-6).
Модифицированные сайты. Измененные сайты на конструктах VEGF MiniTrap, как выяснилось посредством анализа интактной массы в соответствии с разделом 8.4, были подтверждены и количественно определены с использованием сокращенного пептидного картирования, как показано в разделе 8.5 (таблица 8-7). Сайт T90N91 для пептидной последовательности TNYLTHR (SEQ ID NO.: 21) ** означает, что аспарагин был преобразован в аспарагиновую кислоту после усечения, тогда как для сайта N99T100 для пептидной последовательности QTNTIIDVVLSPSHGIELSVGEK (SEQ ID NO.: 19) * означает высокий уровень неспецифического отщепления трипсином. Данные два участка усечения были обнаружены при образовании примесей низкомолекулярных форм при оценке MT1 и MT5. Усечение на M245Y246 было обнаружено только на MT6, который имел уникальный линкер и отвечал за примесь LMW2 во время получения MT6.
[2] Количественное определение занятости гликозитов. N-гликозилирование является обычным PTM. Характеристика сайт-специфического N-гликозилирования, включая макрогетерогенность N-гликана (занятость сайта гликозилирования) и микрогетерогенность (сайт-специфическая структура гликана), важна для понимания биосинтеза и функции гликопротеинов. Степень гликозилирования может меняться в зависимости от того, как белок экспрессирован. Уровни гликозилирования на N36 были одинаковыми для всех трех VEGF MiniTrap (таблица 8-8 и Фиг. 51). Подобным образом, уровни гликозилирования на N68 также были одинаковыми для всех трех VEGF MiniTrap (таблица 8-8 и Фиг. 52). Уровни гликозилирования на N123 также были одинаковыми для всех трех VEGF MiniTrap (таблица 8-8 и Фиг. 53), но было обнаружено, что манноза-5 повышен в препарате МТ1. Для конструкций VEGF MiniTrap гликозилирование Asn196 было ниже для MT5 и MT6 по сравнению с MT1 (таблица 8-8 и Фиг. 54). Кроме того, уровень маннозы-5 был также повышен для препарата МТ1, чем у препаратов МТ5 и МТ6.
[3] Анализ N-гликанов. Гликозилирование на N36 показано в таблице 8-9. G2F, G2FS, G2FS2 являлись основными N-гликанами, обнаруженными во всех трех VEGF MiniTrap.Для гликозилирования на N68, показанного в таблице 8-10, G2F и G2FS являлись основными N-гликанами, обнаруженными во всех трех VEGF MiniTrap.Для гликозилирования на N123, показанного в таблице 8-11, G2F и G2S являлись основными N-гликанами, обнаруженными во всех трех VEGF MiniTrap, и манноза-5 была обнаружена при высоких уровнях MT1 по сравнению с MT5 и MT6. Для гликозилирования на N196, показанного в таблице 8-12, G2, G2S, G2S2 являлись основными N-гликанами, обнаруженными во всех трех VEGF MiniTrap, и манноза-5 была обнаружена при высоких уровнях MT1 по сравнению с MT5 и MT6.
O-гликаны на линкере для MT6. Линкер GS для MT6 оценивали для исследования O-гликанов на MT6. О-ксилозилирование было обнаружено на остатках серина, находящемся на GS линкере МТ6 (GGGGSGGGGSGGGGSGGGGSGGGGSGGGGSSDTGRPFVEMYSEIPEIIHMTEGR, подчеркнутые остатки серина были гликозилированы) (SEQ ID NO.: 98). Композиция O-гликана показана в таблице 8-13.
Анализ HILIC-FLR-MS. Анализ HILIC-FLR-MS осуществляли для всех белков VEGF MiniTrap, как описано в разделе 8.2. Анализ показал, что N-связанные гликаны для MT5 и MT6 были похожи, но отличались от гликанов, полученных для MT1 (на Фиг. 55 показаны полные и сокращенные хроматограммы, на Фиг. 56 показаны полные и перекрывающиеся хроматограммы и на Фиг. 57 показаны полные, сокращенные и нормализованные хроматограммы).
Наконец, процент гликозилирования и подробная идентификация гликанов и количественная оценка для всех трех белков VEGF MiniTrap перечислены в таблица 8-14 и на Фиг. 58A-C, соответственно. Как наблюдается во всех анализах гликанов, профиль гликозилирования и уровни маннозы для МТ5 и МТ6 аналогичны, но отличаются от МТ1.
Пример 9. Получение и количественная оценка цвета с использованием восходящей среды и оптимизация процесса подачи.
(A) Неоптимизированный ХОС (контрольный биореактор)
Применяли изготовление MiniTrap, описанное в примере 5.
Рабочие параметры для стадий исследования известны среднему специалисту в данной области.
Среда в день 0=ХОС1 и включала следующие питательные вещества, антиоксиданты и металлы:
Цистеин добавляли в кумулятивной концентрации 8-9 ммоль
Металлы в исходной среде перечислены ниже в концентрации 1x (если элементы указаны до добавления инокулята):
Fe=68-83 микромолей на литр культуры
Zn=6-7 микромолей на литр культуры
Cu=0,1-0,2 микромолей на литр культуры
Ni=0,5-1 микромолей на литр культуры
При сборе MT1 следовала процедура получения, показанная на Фиг. 59. Рабочие параметры хроматографии известны обычному специалисту в данной области. Рабочие параметры для аффинного захвата (стадия 3 на Фиг. 59), аффинная проточная фракция (стадия 5 на Фиг. 59), AEX (стадия 8 на Фиг. 59) и HIC (стадия 9 на Фиг. 59) изложены в таблице 9-1. Протеолитическое расщепление афлиберцепта после стадии аффинного захвата и фильтрации проводили с использованием процедуры, описанной в примере 1.2.
pH 8,30-8,50, 1,90-2,10 мСм/см
pH 8,30-8,50, 1,90-2,10 мСм/см
pH 8,30-8,50, 1,90-2,10 мСм/см
В таблице 9-2 показана количественная оценка цвета пулов, полученных при выполнении различных хроматографических стадий. Количественную оценку цвета проводили с использованием образцов из пула, имеющих белок выброс 5 г/л.
Пул аффинного захвата относится к элюату, собранному при осуществлении стадии аффинного захвата (стадия 3 на Фиг. 59). Ферментативный пул относится к проточной фракции, собранной при осуществлении стадии ферментативного отщепления (стадия 4 на Фиг. 59). Пул аффинной проточной фракции относится к проточной фракции, собранной при осуществлении стадии аффинной проточной фракции (стадия 5 на Фиг. 59) и элюат аффинной проточной фракции относится к элюату, собранному при осуществлении стадии аффинной проточной фракции (стадия 5 на Фиг. 59). Пул AEX и очистка AEX относятся к проточной фракции и очищенной фракции, полученным на стадии анионообменной хроматографии (стадия 8 на Фиг. 59). Пул HIC относится к проточной фракции, собранной при осуществлении стадии хроматографии с гидрофобным взаимодействием (стадия 9 на Фиг. 59).
Как видно в таблице 9-2, каждая стадия демонстрирует снижение окраски (как видно по уменьшению значений b* пула). Например, при выполнении аффинной хроматографии проточной фракции проточная фракция имеет значение b* 2,16 (уменьшено со значения b* 2,52 для проточной фракции, полученной в результате стадии аффинного захвата). Проточная фракция и промывка после разделения AEX еще больше уменьшили окраску, о чем свидетельствует уменьшение значения b* с 2,16 до 0,74. Как и ожидалось, очистка колонки AEX привела к образцу с желто-коричневым цветом, который был значительно более интенсивным, чем окраска от проточной фракции и промывки после разделения AEX, как видно из значений b* (8,10 против 0,74). Наконец, стадия HIC обеспечивала дальнейшее уменьшение цвета (значение b* может быть нормализовано для 5 г/л белок безопасного из значения b*, полученного для пула HIC при концентрации белка 28,5 г/л).
(B) Оптимизированный ХОС (низкий уровень цистеина, низкий уровень металлов и повышенный уровень антиоксидантов, биореактор)
Влияние снижения содержания цистеина, снижения содержания металлов и увеличения содержания антиоксидантов на окраску оценивали с использованием следующих протоколов:
Среднее в день 0=ХОС1
Цистеин добавляли в кумулятивной концентрации 5-6 ммоль
Антиоксиданты добавляли в ХОС1 для достижения следующих кумулятивных концентраций (где данные присутствуют до добавления инокулята):
таурин = 10 ммоль культуры
глицин = 10 ммоль культуры
тиоктовая кислота = 0,0024 ммоль культуры
витамин C (аскорбиновая кислота)=0,028 ммоль культуры
Металлы в начальной среде перечислены ниже для уровня 1x.
Fe=68-83 микромолей на литр культуры
Zn=6-7 микромолей на литр культуры
Cu=0,1-0,2 микромолей на литр культуры
Ni=0,5-1 микромолей на литр культуры
Уменьшение содержания всех металлов включено с использованием концентраций 0,25x, указанного выше для среды.
После сбора образца MT1 следовала процедура получения, показанная на Фиг. 59. Рабочие параметры хроматографии известны обычному специалисту в данной области. Рабочие параметры для аффинного захвата, аффинной проточной фракции и HIC изложены в таблице 9-1. Протеолитическое расщепление афлиберцепта после стадии аффинного захвата и фильтрации проводили с использованием процедуры, описанной в примере 1.2.
В таблице 9-3 показана количественная оценка цвета пулов, полученных при выполнении различных хроматографических стадий. Количественную оценку цвета проводили с использованием образцов из пула, имеющих белок выброс 5 г/л. Как видно в таблице 9-3, стадии обеспечивали подобное получение, что и для стадий в таблице 9-2.
Сравнивая таблицу 9-2 и таблицу 9-3, очевидно, что «условие биореактора с низким содержанием цистеина, низким содержанием металлов и повышенным содержанием антиоксидантов» имеет более низкий цвет в пуле аффинного захвата (значение b* 1,77) по сравнению с «условием контрольного биореактора» (значение b* 2,52).
Для образца MT с концентрацией 160 г/л, где MT образован с использованием стадий, перечисленных в таблице 9-2 и таблице 9-3, прогнозируется значение ab* 13,45 для «условия низкого содержания цистеина, низкого содержания металлов и повышенного содержания антиоксидантов в биореакторе» и значение ab* 17,45 для «условия контрольного биореактора». Уменьшение цвета на 23% достигается за счет оптимизации исходных носителей и питательных сред. Для образца MT с концентрацией 110 г/л, где MT образован с использованием стадий, перечисленных в таблице 9-2 и таблице 9-3, прогнозируется значение ab* 9,25 для «условия низкого содержания цистеина, низкого содержания металлов и повышенного содержания антиоксидантов в биореакторе» и значение ab* 12 для «условия контрольного биореактора».
Для понимания того, как каждая операция производственной установки способствует снижению цвета, было вычислено значение b* для каждого промежуточного звена производственного процесса в виде процента от цвета пула аффинного захвата (таблица 9-4).
Операция модуля AEX обеспечивает максимальное уменьшение цвета (изменение b* от 1,08 до 1,42), тогда как операция модуля HIC обеспечивает некоторое дополнительное уменьшение цвета (изменение b* от 0,08 до 0,19). Операции установки оценивали общее удаление 76,3% - 78,2% цвета, присутствующего в пуле аффинного захвата.
Цвет различных промежуточных продуктов производственного процесса для «условия контрольного биореактора» и «низкое содержание цистеина, низкое содержание металлов и повышенное содержание антиоксидантов в биореакторе» также изучали процентное содержание 2-оксо-гистидинов и процент оксо-триптофанов в олигопептидах, которые были образованы посредством расщепления протеазой, как измерено посредством масс-спектрометрии, как показано в таблице 9-5 и таблице 9-6, соответственно. Пептидное картирование выполняли, как описано в примере 3.
Ссылаясь на таблицу 9-5, при сравнении уровней окисления гистидина в пулах на различных стадиях получения очевидно, что относительное содержание процента образованных уровней окисления гистидина для МТ уменьшается в пуле по мере продвижения процесса получения. Например, для H209 в «условии контрольного биореактора» процентный уровень окисления гистидина составлял 0,062 для пула ферментативного расщепления, который был снижен до 0,029 для проточной фракции AEX и далее снижен до 0,020 для пула HIC. Подобным образом, для H209 в условиях «низкого содержания цистеина, низкого содержания металлов и повышенного содержания антиоксидантов в биореакторе» процент окисления гистидина составлял 0,039 для пула ферментативного расщепления, и он был снижен до 0,023 для проточной фракции AEX и далее снижен до 0,016 для пула HIC. Таким образом, производственная стратегия привела к снижению процентного уровня окисления гистидина в MT. По мере уменьшения окраски уменьшается и наличие некоторых окисленных остатков в образце. Подобно окислению гистидина, уровни окисления триптофана также отслеживались для пулов на разных стадиях производства для обоих «условий контрольного биореактора» и «низкого содержания цистеина, низкого содержания металлов и повышенного содержания антиоксидантов в биореакторе» (таблица 9-6).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> REGENERON PHARMACEUTICALS, INC.
<120> БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
<130> 070816-02409
<140>
<150>
<150>
<160> 103
<170> PatentIn версия 3.5
<210> 1
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 1
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asn Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Asn Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Asn Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asn Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 2
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 2
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asp Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Asn Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Asn Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asn Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 3
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 3
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asn Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Arg Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Asn Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asn Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 4
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 4
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asn Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Asn Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Leu Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asn Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 5
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 5
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asn Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Asn Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Asn Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asp Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 6
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 6
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asp Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Arg Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Asn Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asn Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 7
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 7
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asp Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Asn Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Leu Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asn Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 8
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 8
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asp Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Asn Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Asn Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asp Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 9
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 9
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asn Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Arg Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Leu Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asn Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 10
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 10
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asn Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Arg Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Asn Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asp Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 11
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 11
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asn Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Asn Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Leu Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asp Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 12
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 12
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asp Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Arg Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Leu Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asn Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 13
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 13
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asp Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Arg Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Asn Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asp Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 14
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 14
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asp Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Asn Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Leu Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asp Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 15
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 15
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asn Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Arg Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Leu Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asp Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 16
<211> 339
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 16
Met Arg Lys Arg Cys Tyr Ser Thr Ser Ala Ala Val Leu Ala Ala Val
1 5 10 15
Thr Leu Phe Val Leu Ser Val Asp Arg Gly Val Ile Ala Asp Ser Phe
20 25 30
Ser Ala Asn Gln Glu Ile Arg Tyr Ser Glu Val Thr Pro Tyr His Val
35 40 45
Thr Ser Val Trp Thr Lys Gly Val Thr Pro Pro Ala Asn Phe Thr Gln
50 55 60
Gly Glu Asp Val Phe His Ala Pro Tyr Val Ala Asn Gln Gly Trp Tyr
65 70 75 80
Asp Ile Thr Lys Thr Phe Asp Gly Lys Asp Asp Leu Leu Cys Gly Ala
85 90 95
Ala Thr Ala Gly Asn Met Leu His Trp Trp Phe Asp Gln Asn Lys Asp
100 105 110
Gln Ile Lys Arg Tyr Leu Glu Glu His Pro Glu Lys Gln Lys Ile Asn
115 120 125
Phe Arg Gly Glu Gln Met Phe Asp Val Lys Glu Ala Ile Asp Thr Lys
130 135 140
Asn His Gln Leu Asp Ser Lys Leu Phe Glu Tyr Phe Lys Glu Lys Ala
145 150 155 160
Phe Pro Tyr Leu Ser Thr Lys His Leu Gly Val Phe Pro Asp His Val
165 170 175
Ile Asp Met Phe Ile Leu Gly Tyr Arg Leu Ser Leu Thr Asn His Gly
180 185 190
Pro Thr Pro Val Lys Glu Gly Ser Lys Asp Pro Arg Gly Gly Ile Phe
195 200 205
Asp Ala Val Phe Thr Arg Gly Asp Gln Ser Lys Leu Leu Thr Ser Arg
210 215 220
His Asp Phe Lys Glu Lys Asn Leu Lys Glu Ile Ser Asp Leu Ile Lys
225 230 235 240
Lys Glu Leu Thr Glu Gly Lys Ala Leu Gly Leu Ser His Thr Tyr Ala
245 250 255
Asn Val Arg Ile Asn His Val Ile Asn Leu Trp Gly Ala Asp Phe Asp
260 265 270
Ser Asp Gly Asn Leu Lys Ala Ile Tyr Val Thr Asp Ser Asp Ser Asn
275 280 285
Ala Ser Ile Gly Met Lys Lys Tyr Phe Val Gly Val Asn Ser Ala Gly
290 295 300
Lys Val Ala Ile Ser Ala Lys Glu Ile Lys Glu Asp Asn Ile Gly Ala
305 310 315 320
Gln Val Leu Gly Leu Phe Thr Leu Ser Thr Gly Gln Asp Ser Trp Asn
325 330 335
Gln Thr Asn
<210> 17
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (4)..(4)
<223> Может быть окислен
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (6)..(6)
<223> Может быть карбоксиметилирован
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (9)..(9)
<223> Может быть карбоксиметилирован
<400> 17
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
<210> 18
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (7)..(7)
<223> Может быть карбоксиметилирован
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (14)..(14)
<223> Может быть окислен
<400> 18
Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly His Leu Tyr
1 5 10 15
Lys
<210> 19
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (14)..(14)
<223> Может быть окислен
<400> 19
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
1 5 10 15
Glu Leu Ser Val Gly Glu Lys
20
<210> 20
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (18)..(18)
<223> Может быть окислен
<400> 20
Thr Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser
1 5 10 15
Lys His Gln His Lys
20
<210> 21
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (6)..(6)
<223> Может быть окислен
<400> 21
Thr Asn Tyr Leu Thr His Arg
1 5
<210> 22
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (19)..(19)
<223> Может быть окислен
<400> 22
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 23
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (2)..(2)
<223> Может быть окислен
<400> 23
Val His Glu Lys Asp Lys
1 5
<210> 24
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (10)..(10)
<223> Может быть окислен
<400> 24
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 25
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (20)..(20)
<223> Может быть окислен
<400> 25
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 26
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (7)..(7)
<223> Может быть окислен
<400> 26
Thr Gln Ser Gly Ser Glu Met Lys
1 5
<210> 27
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (8)..(8)
<223> Может быть карбоксиметилирован
<400> 27
Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met Thr
1 5 10 15
Lys
<210> 28
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (3)..(3)
<223> Может быть окислен
<400> 28
Ile Ile Trp Asp Ser Arg
1 5
<210> 29
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (11)..(11)
<223> Может быть окислен
<400> 29
Thr Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser
1 5 10 15
Lys
<210> 30
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (9)..(9)
<223> Может быть окислен
<400> 30
Gly Phe Ile Ile Ser Asn Ala Thr Tyr Lys
1 5 10
<210> 31
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (2)..(2)
<223> Может быть окислен
<400> 31
Lys Phe Pro Leu Asp Thr Leu Ile Pro Asp Gly Lys
1 5 10
<210> 32
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(1)
<223> Может быть окислен
<400> 32
Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr Arg
1 5 10
<210> 33
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Leu or Pro
<220>
<221> MOD_RES
<222> (173)..(173)
<223> Ala или Thr
<400> 33
Asp Lys Thr His Thr Cys Pro Xaa Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Xaa Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 34
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 34
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp
100
<210> 35
<211> 93
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 35
Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile His Met Thr
1 5 10 15
Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val Thr Ser Pro Asn Ile
20 25 30
Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr Leu Ile Pro Asp Gly
35 40 45
Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe Ile Ile Ser Asn Ala
50 55 60
Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly
65 70 75 80
His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg Gln Thr
85 90
<210> 36
<211> 102
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 36
Val Val Leu Ser Pro Ser His Gly Ile Glu Leu Ser Val Gly Glu Lys
1 5 10 15
Leu Val Leu Asn Cys Thr Ala Arg Thr Glu Leu Asn Val Gly Ile Asp
20 25 30
Phe Asn Trp Glu Tyr Pro Ser Ser Lys His Gln His Lys Lys Leu Val
35 40 45
Asn Arg Asp Leu Lys Thr Gln Ser Gly Ser Glu Met Lys Lys Phe Leu
50 55 60
Ser Thr Leu Thr Ile Asp Gly Val Thr Arg Ser Asp Gln Gly Leu Tyr
65 70 75 80
Thr Cys Ala Ala Ser Ser Gly Leu Met Thr Lys Lys Asn Ser Thr Phe
85 90 95
Val Arg Val His Glu Lys
100
<210> 37
<211> 97
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 37
Pro Phe Val Ala Phe Gly Ser Gly Met Glu Ser Leu Val Glu Ala Thr
1 5 10 15
Val Gly Glu Arg Val Arg Ile Pro Ala Lys Tyr Leu Gly Tyr Pro Pro
20 25 30
Pro Glu Ile Lys Trp Tyr Lys Asn Gly Ile Pro Leu Glu Ser Asn His
35 40 45
Thr Ile Lys Ala Gly His Val Leu Thr Ile Met Glu Val Ser Glu Arg
50 55 60
Asp Thr Gly Asn Tyr Thr Val Ile Leu Thr Asn Pro Ile Ser Lys Glu
65 70 75 80
Lys Gln Ser His Val Val Ser Leu Val Val Tyr Val Pro Pro Gly Pro
85 90 95
Gly
<210> 38
<211> 92
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 38
Phe Val Ala Phe Gly Ser Gly Met Glu Ser Leu Val Glu Ala Thr Val
1 5 10 15
Gly Glu Arg Val Arg Ile Pro Ala Lys Tyr Leu Gly Tyr Pro Pro Pro
20 25 30
Glu Ile Lys Trp Tyr Lys Asn Gly Ile Pro Leu Glu Ser Asn His Thr
35 40 45
Ile Lys Ala Gly His Val Leu Thr Ile Met Glu Val Ser Glu Arg Asp
50 55 60
Thr Gly Asn Tyr Thr Val Ile Leu Thr Asn Pro Ile Lys Ser Glu Lys
65 70 75 80
Gln Ser His Val Val Ser Leu Val Val Tyr Val Pro
85 90
<210> 39
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 39
Asp Lys Thr His Thr Cys Pro Pro Cys
1 5
<210> 40
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 40
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Pro Cys
1 5 10
<210> 41
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 41
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Pro Cys Pro Pro Cys
1 5 10 15
<210> 42
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 42
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
<210> 43
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 43
Asp Lys Thr His Thr Cys Pro Leu Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
<210> 44
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 44
Asp Lys Thr His Thr Cys
1 5
<210> 45
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 45
Asp Lys Thr His Thr Cys Pro Leu Cys Pro Ala Pro
1 5 10
<210> 46
<211> 221
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 46
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Asp Lys Thr
195 200 205
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
210 215 220
<210> 47
<211> 315
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 47
Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile His
1 5 10 15
Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val Thr Ser Pro
20 25 30
Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr Leu Ile Pro
35 40 45
Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe Ile Ile Ser
50 55 60
Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val
65 70 75 80
Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg Gln Thr Asn
85 90 95
Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile Glu Leu Ser
100 105 110
Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr Glu Leu Asn
115 120 125
Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys His Gln His
130 135 140
Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly Ser Glu Met
145 150 155 160
Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr Arg Ser Asp
165 170 175
Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met Thr Lys Lys
180 185 190
Asn Ser Thr Phe Val Arg Val His Glu Asn Leu Ser Val Ala Phe Gly
195 200 205
Ser Gly Met Glu Ser Leu Val Glu Ala Thr Val Gly Glu Arg Val Arg
210 215 220
Ile Pro Ala Lys Tyr Leu Gly Tyr Pro Pro Pro Glu Ile Lys Trp Tyr
225 230 235 240
Lys Asn Gly Ile Pro Leu Glu Ser Asn His Thr Ile Lys Ala Gly His
245 250 255
Val Leu Thr Ile Met Glu Val Ser Glu Arg Asp Thr Gly Asn Tyr Thr
260 265 270
Val Ile Leu Thr Asn Pro Ile Ser Lys Glu Lys Gln Ser His Val Val
275 280 285
Ser Leu Val Val Tyr Val Pro Pro Gly Pro Gly Asp Lys Thr His Thr
290 295 300
Cys Pro Leu Cys Pro Ala Pro Glu Leu Leu Gly
305 310 315
<210> 48
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 48
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Asp Lys Thr
195 200 205
His Thr Cys Pro Pro Cys
210
<210> 49
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 49
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Asp Lys Thr
195 200 205
His Thr Cys Pro Pro Cys Pro Pro Cys
210 215
<210> 50
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 50
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Asp Lys Thr
195 200 205
His Thr Cys Pro Pro Cys Pro Pro Cys Pro Pro Cys
210 215 220
<210> 51
<211> 440
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 51
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Gly Gly Gly
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Asp Thr Gly Arg
225 230 235 240
Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile His Met Thr
245 250 255
Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val Thr Ser Pro Asn Ile
260 265 270
Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr Leu Ile Pro Asp Gly
275 280 285
Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe Ile Ile Ser Asn Ala
290 295 300
Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly
305 310 315 320
His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg Gln Thr Asn Thr Ile
325 330 335
Ile Asp Val Val Leu Ser Pro Ser His Gly Ile Glu Leu Ser Val Gly
340 345 350
Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr Glu Leu Asn Val Gly
355 360 365
Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys His Gln His Lys Lys
370 375 380
Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly Ser Glu Met Lys Lys
385 390 395 400
Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr Arg Ser Asp Gln Gly
405 410 415
Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met Thr Lys Lys Asn Ser
420 425 430
Thr Phe Val Arg Val His Glu Lys
435 440
<210> 52
<211> 425
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 52
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Gly Gly Gly
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Asp Thr Gly
210 215 220
Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile His Met
225 230 235 240
Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val Thr Ser Pro Asn
245 250 255
Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr Leu Ile Pro Asp
260 265 270
Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe Ile Ile Ser Asn
275 280 285
Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn
290 295 300
Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg Gln Thr Asn Thr
305 310 315 320
Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile Glu Leu Ser Val
325 330 335
Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr Glu Leu Asn Val
340 345 350
Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys His Gln His Lys
355 360 365
Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly Ser Glu Met Lys
370 375 380
Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr Arg Ser Asp Gln
385 390 395 400
Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met Thr Lys Lys Asn
405 410 415
Ser Thr Phe Val Arg Val His Glu Lys
420 425
<210> 53
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 53
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Gly Gly Gly
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
225 230 235 240
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Asp Thr Gly Arg Pro
245 250 255
Phe Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile His Met Thr Glu
260 265 270
Gly Arg Glu Leu Val Ile Pro Cys Arg Val Thr Ser Pro Asn Ile Thr
275 280 285
Val Thr Leu Lys Lys Phe Pro Leu Asp Thr Leu Ile Pro Asp Gly Lys
290 295 300
Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe Ile Ile Ser Asn Ala Thr
305 310 315 320
Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly His
325 330 335
Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg Gln Thr Asn Thr Ile Ile
340 345 350
Asp Val Val Leu Ser Pro Ser His Gly Ile Glu Leu Ser Val Gly Glu
355 360 365
Lys Leu Val Leu Asn Cys Thr Ala Arg Thr Glu Leu Asn Val Gly Ile
370 375 380
Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys His Gln His Lys Lys Leu
385 390 395 400
Val Asn Arg Asp Leu Lys Thr Gln Ser Gly Ser Glu Met Lys Lys Phe
405 410 415
Leu Ser Thr Leu Thr Ile Asp Gly Val Thr Arg Ser Asp Gln Gly Leu
420 425 430
Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met Thr Lys Lys Asn Ser Thr
435 440 445
Phe Val Arg Val His Glu Lys
450 455
<210> 54
<211> 470
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 54
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Gly Gly Gly
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
225 230 235 240
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Asp Thr Gly Arg Pro Phe
260 265 270
Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile His Met Thr Glu Gly
275 280 285
Arg Glu Leu Val Ile Pro Cys Arg Val Thr Ser Pro Asn Ile Thr Val
290 295 300
Thr Leu Lys Lys Phe Pro Leu Asp Thr Leu Ile Pro Asp Gly Lys Arg
305 310 315 320
Ile Ile Trp Asp Ser Arg Lys Gly Phe Ile Ile Ser Asn Ala Thr Tyr
325 330 335
Lys Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly His Leu
340 345 350
Tyr Lys Thr Asn Tyr Leu Thr His Arg Gln Thr Asn Thr Ile Ile Asp
355 360 365
Val Val Leu Ser Pro Ser His Gly Ile Glu Leu Ser Val Gly Glu Lys
370 375 380
Leu Val Leu Asn Cys Thr Ala Arg Thr Glu Leu Asn Val Gly Ile Asp
385 390 395 400
Phe Asn Trp Glu Tyr Pro Ser Ser Lys His Gln His Lys Lys Leu Val
405 410 415
Asn Arg Asp Leu Lys Thr Gln Ser Gly Ser Glu Met Lys Lys Phe Leu
420 425 430
Ser Thr Leu Thr Ile Asp Gly Val Thr Arg Ser Asp Gln Gly Leu Tyr
435 440 445
Thr Cys Ala Ala Ser Ser Gly Leu Met Thr Lys Lys Asn Ser Thr Phe
450 455 460
Val Arg Val His Glu Lys
465 470
<210> 55
<211> 432
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 55
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Asp Lys Thr
195 200 205
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
210 215 220
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
225 230 235 240
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
245 250 255
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
260 265 270
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
275 280 285
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
290 295 300
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
305 310 315 320
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
325 330 335
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
340 345 350
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
355 360 365
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
370 375 380
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
385 390 395 400
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
405 410 415
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
420 425 430
<210> 56
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 56
Ile Ile Trp Asp Ser Arg
1 5
<210> 57
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 57
Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly His Leu Tyr
1 5 10 15
Lys
<210> 58
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 58
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
1 5 10 15
Glu Leu Ser Val Gly Glu Lys
20
<210> 59
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 59
Thr Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser
1 5 10 15
Lys His Gln His Lys
20
<210> 60
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 60
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
<210> 61
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 61
Thr Asn Tyr Leu Thr His Arg
1 5
<210> 62
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (7)..(7)
<223> Может быть карбоксиметилирован
<400> 62
Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly His Leu Tyr
1 5 10 15
Lys
<210> 63
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 63
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
1 5 10 15
Glu Leu Ser Val Gly Glu Lys
20
<210> 64
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (10)..(10)
<223> Может быть окислен
<400> 64
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 65
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (20)..(20)
<223> Может быть окислен
<400> 65
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 66
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (7)..(7)
<223> Может быть окислен
<400> 66
Thr Gln Ser Gly Ser Glu Met Lys
1 5
<210> 67
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (8)..(8)
<223> Может быть карбоксиметилирован
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (15)..(15)
<223> Может быть окислен
<400> 67
Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met Thr
1 5 10 15
Lys
<210> 68
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 68
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 69
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (9)..(9)
<223> Может быть окислен
<400> 69
Gly Phe Ile Ile Ser Asn Ala Thr Tyr Lys
1 5 10
<210> 70
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (2)..(2)
<223> Может быть окислен
<400> 70
Lys Phe Pro Leu Asp Thr Leu Ile Pro Asp Gly Lys
1 5 10
<210> 71
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(1)
<223> Может быть окислен
<400> 71
Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr Arg
1 5 10
<210> 72
<211> 165
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 72
Ala Pro Met Ala Glu Gly Gly Gly Gln Asn His His Glu Val Val Lys
1 5 10 15
Phe Met Asp Val Tyr Gln Arg Ser Tyr Cys His Pro Ile Glu Thr Leu
20 25 30
Val Asp Ile Phe Gln Glu Tyr Pro Asp Glu Ile Glu Tyr Ile Phe Lys
35 40 45
Pro Ser Cys Val Pro Leu Met Arg Cys Gly Gly Cys Cys Asn Asp Glu
50 55 60
Gly Leu Glu Cys Val Pro Thr Glu Glu Ser Asn Ile Thr Met Gln Ile
65 70 75 80
Met Arg Ile Lys Pro His Gln Gly Gln His Ile Gly Glu Met Ser Phe
85 90 95
Leu Gln His Asn Lys Cys Glu Cys Arg Pro Lys Lys Asp Arg Ala Arg
100 105 110
Gln Glu Asn Pro Cys Gly Pro Cys Ser Glu Arg Arg Lys His Leu Phe
115 120 125
Val Gln Asp Pro Gln Thr Cys Lys Cys Ser Cys Lys Asn Thr Asp Ser
130 135 140
Arg Cys Lys Ala Arg Gln Leu Glu Leu Asn Glu Arg Thr Cys Arg Cys
145 150 155 160
Asp Lys Pro Arg Arg
165
<210> 73
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 73
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Phe Tyr Cys
85 90 95
Ala Arg Leu Gly Asn Tyr Gly Gly Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 74
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 74
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Lys Val Thr Ile Thr Cys Thr Thr Ser Gln Asp Ser Asn Asn Tyr
20 25 30
Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
His Tyr Ala Ser Thr Leu Gln Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Leu Gln Tyr Asp Tyr Leu Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 75
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 75
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ser Gly Gly Gly Tyr Thr Tyr Tyr Ser Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Asn Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Phe Tyr Cys
85 90 95
Ala Arg Leu Gly Asn Tyr Gly Gly Tyr Tyr Gly Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 76
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 76
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Lys Val Thr Ile Thr Cys Lys Thr Ser Gln Asp Ser Asn Lys Tyr
20 25 30
Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asn Leu Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 77
<211> 445
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 77
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Phe Tyr Cys
85 90 95
Ala Arg Leu Gly Asn Tyr Gly Gly Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser
115 120 125
Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val
130 135 140
Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro
180 185 190
Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro
195 200 205
Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly
210 215 220
Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys
245 250 255
Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln
260 265 270
Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln
275 280 285
Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu
290 295 300
Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg
305 310 315 320
Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro
340 345 350
Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr
355 360 365
Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln
370 375 380
Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly
385 390 395 400
Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu
405 410 415
Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn
420 425 430
His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 78
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 78
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Lys Val Thr Ile Thr Cys Thr Thr Ser Gln Asp Ser Asn Asn Tyr
20 25 30
Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
His Tyr Ala Ser Thr Leu Gln Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Leu Gln Tyr Asp Tyr Leu Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala Pro
100 105 110
Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly Gly
115 120 125
Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile Asn
130 135 140
Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu Asn
145 150 155 160
Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser
165 170 175
Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr
180 185 190
Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 79
<211> 445
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 79
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ser Gly Gly Gly Tyr Thr Tyr Tyr Ser Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Asn Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Phe Tyr Cys
85 90 95
Ala Arg Leu Gly Asn Tyr Gly Gly Tyr Tyr Gly Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser
115 120 125
Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val
130 135 140
Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro
180 185 190
Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro
195 200 205
Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly
210 215 220
Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys
245 250 255
Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln
260 265 270
Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln
275 280 285
Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu
290 295 300
Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg
305 310 315 320
Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro
340 345 350
Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr
355 360 365
Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln
370 375 380
Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly
385 390 395 400
Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu
405 410 415
Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn
420 425 430
His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 80
<211> 200
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 80
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Lys Val Thr Ile Thr Cys Lys Thr Ser Gln Asp Ser Asn Lys Tyr
20 25 30
Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asn Leu Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala Pro
100 105 110
Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly Gly
115 120 125
Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile Asn
130 135 140
Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu Asn
145 150 155 160
Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser
165 170 175
Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr
180 185 190
Cys Glu Ala Thr His Lys Thr Ser
195 200
<210> 81
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 81
Glu Leu Val Ile Pro Cys Arg
1 5
<210> 82
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 82
Leu Val Leu Asn Cys Thr Ala Arg
1 5
<210> 83
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (2)..(2)
<223> Может быть окислен
<400> 83
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10
<210> 84
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 84
Glu Leu Val Ile Pro Cys Arg Glu Ile Gly Leu Leu Thr Cys Glu Ala
1 5 10 15
Thr Val Asn Gly His Leu Tyr Lys
20
<210> 85
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (26)..(26)
<223> Может присутствовать или отсутствовать
<400> 85
Leu Val Leu Asn Cys Thr Ala Arg Ser Asp Gln Gly Leu Tyr Thr Cys
1 5 10 15
Ala Ala Ser Ser Gly Leu Met Thr Lys Lys
20 25
<210> 86
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (28)..(28)
<223> Может присутствовать или отсутствовать
<400> 86
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Thr His
1 5 10 15
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
20 25
<210> 87
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 87
Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly His Leu Tyr
1 5 10 15
Lys
<210> 88
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 88
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
1 5 10 15
Glu Leu Ser Val Gly Glu Lys
20
<210> 89
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (10)..(10)
<223> Может быть окислен
<400> 89
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 90
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (20)..(20)
<223> Может быть окислен
<400> 90
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 91
<211> 54
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (40)..(40)
<223> Может быть окислен
<400> 91
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Asp
20 25 30
Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile
35 40 45
His Met Thr Glu Gly Arg
50
<210> 92
<211> 54
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (50)..(50)
<223> Может быть окислен
<400> 92
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Asp
20 25 30
Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile
35 40 45
His Met Thr Glu Gly Arg
50
<210> 93
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (7)..(7)
<223> Может быть окислен
<400> 93
Thr Gln Ser Gly Ser Glu Met Lys
1 5
<210> 94
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (15)..(15)
<223> Может быть окислен
<400> 94
Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met Thr
1 5 10 15
Lys
<210> 95
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 95
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10
<210> 96
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 96
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
1 5 10 15
Glu Leu Ser Val Gly Glu Lys
20
<210> 97
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 97
Thr Asn Tyr Leu Thr His Arg
1 5
<210> 98
<211> 54
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 98
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Asp
20 25 30
Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile
35 40 45
His Met Thr Glu Gly Arg
50
<210> 99
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 99
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg
20
<210> 100
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(1)
<223> Может присутствовать или отсутствовать
<400> 100
Arg Val Thr Ser Pro Asn Ile Thr Val Thr Leu Lys
1 5 10
<210> 101
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(1)
<223> Может присутствовать или отсутствовать
<400> 101
Lys Gly Phe Ile Ile Ser Asn Ala Thr Tyr Lys
1 5 10
<210> 102
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(1)
<223> Может присутствовать или отсутствовать
<400> 102
Lys Leu Val Leu Asn Cys Thr Ala Arg
1 5
<210> 103
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(1)
<223> Может присутствовать или отсутствовать
<400> 103
Lys Asn Ser Thr Phe Val Arg
1 5
<210> 104
<211> 60
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (1)..(60)
<223> Эта последовательность может охватывать 1-15 повторяющихся единиц «Gly Gly Gly Ser».
<400> 104
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
20 25 30
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
35 40 45
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
50 55 60
<210> 105
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (7)..(21)
<223> Эта область может охватывать 1-5 повторяющихся единиц «Pro Pro Cys».
<400> 105
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Pro Cys Pro Pro Cys Pro
1 5 10 15
Pro Cys Pro Pro Cys
20
<210> 106
<211> 226
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (212)..(226)
<223> Эта область может охватывать 1-5 повторяющихся единиц «Pro Pro Cys».
<400> 106
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Asp Lys Thr
195 200 205
His Thr Cys Pro Pro Cys Pro Pro Cys Pro Pro Cys Pro Pro Cys Pro
210 215 220
Pro Cys
225
<210> 107
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 107
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 108
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 108
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 109
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 109
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
35 40 45
<210> 110
<211> 60
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
35 40 45
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
50 55 60
<210> 111
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 111
Gly Gly Gly Gly Ser
1 5
<210> 112
<211> 485
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (206)..(280)
<223> Эта область может охватывать 1-15 повторяющихся единиц
«Gly Gly Gly Gly Ser».
<400> 112
Ser Asp Thr Gly Arg Pro Phe Val Glu Met Tyr Ser Glu Ile Pro Glu
1 5 10 15
Ile Ile His Met Thr Glu Gly Arg Glu Leu Val Ile Pro Cys Arg Val
20 25 30
Thr Ser Pro Asn Ile Thr Val Thr Leu Lys Lys Phe Pro Leu Asp Thr
35 40 45
Leu Ile Pro Asp Gly Lys Arg Ile Ile Trp Asp Ser Arg Lys Gly Phe
50 55 60
Ile Ile Ser Asn Ala Thr Tyr Lys Glu Ile Gly Leu Leu Thr Cys Glu
65 70 75 80
Ala Thr Val Asn Gly His Leu Tyr Lys Thr Asn Tyr Leu Thr His Arg
85 90 95
Gln Thr Asn Thr Ile Ile Asp Val Val Leu Ser Pro Ser His Gly Ile
100 105 110
Glu Leu Ser Val Gly Glu Lys Leu Val Leu Asn Cys Thr Ala Arg Thr
115 120 125
Glu Leu Asn Val Gly Ile Asp Phe Asn Trp Glu Tyr Pro Ser Ser Lys
130 135 140
His Gln His Lys Lys Leu Val Asn Arg Asp Leu Lys Thr Gln Ser Gly
145 150 155 160
Ser Glu Met Lys Lys Phe Leu Ser Thr Leu Thr Ile Asp Gly Val Thr
165 170 175
Arg Ser Asp Gln Gly Leu Tyr Thr Cys Ala Ala Ser Ser Gly Leu Met
180 185 190
Thr Lys Lys Asn Ser Thr Phe Val Arg Val His Glu Lys Gly Gly Gly
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
225 230 235 240
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
260 265 270
Gly Gly Ser Gly Gly Gly Gly Ser Ser Asp Thr Gly Arg Pro Phe Val
275 280 285
Glu Met Tyr Ser Glu Ile Pro Glu Ile Ile His Met Thr Glu Gly Arg
290 295 300
Glu Leu Val Ile Pro Cys Arg Val Thr Ser Pro Asn Ile Thr Val Thr
305 310 315 320
Leu Lys Lys Phe Pro Leu Asp Thr Leu Ile Pro Asp Gly Lys Arg Ile
325 330 335
Ile Trp Asp Ser Arg Lys Gly Phe Ile Ile Ser Asn Ala Thr Tyr Lys
340 345 350
Glu Ile Gly Leu Leu Thr Cys Glu Ala Thr Val Asn Gly His Leu Tyr
355 360 365
Lys Thr Asn Tyr Leu Thr His Arg Gln Thr Asn Thr Ile Ile Asp Val
370 375 380
Val Leu Ser Pro Ser His Gly Ile Glu Leu Ser Val Gly Glu Lys Leu
385 390 395 400
Val Leu Asn Cys Thr Ala Arg Thr Glu Leu Asn Val Gly Ile Asp Phe
405 410 415
Asn Trp Glu Tyr Pro Ser Ser Lys His Gln His Lys Lys Leu Val Asn
420 425 430
Arg Asp Leu Lys Thr Gln Ser Gly Ser Glu Met Lys Lys Phe Leu Ser
435 440 445
Thr Leu Thr Ile Asp Gly Val Thr Arg Ser Asp Gln Gly Leu Tyr Thr
450 455 460
Cys Ala Ala Ser Ser Gly Leu Met Thr Lys Lys Asn Ser Thr Phe Val
465 470 475 480
Arg Val His Glu Lys
485
<210> 113
<211> 211
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MOD_RES
<222> (157)..(157)
<223> Любая аминокислота
<400> 113
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
1 5 10 15
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
20 25 30
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
35 40 45
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
50 55 60
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
65 70 75 80
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
85 90 95
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
100 105 110
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
115 120 125
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
130 135 140
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Xaa Thr Pro Pro
145 150 155 160
Val Leu Asp Ser Asp Gly Ser Pro Pro Leu Tyr Ser Lys Leu Thr Val
165 170 175
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Pro Ser Cys Ser Val Met
180 185 190
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
195 200 205
Pro Gly Lys
210
<210> 114
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (3)..(3)
<223> Может быть окислен
<400> 114
Ile Ile Trp Asp Ser Arg Lys
1 5
<210> 115
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (4)..(4)
<223> Может быть окислен
<400> 115
Arg Ile Ile Trp Asp Ser Arg
1 5
<210> 116
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 116
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10
<210> 117
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (9)..(9)
<223> Может быть окислен
<400> 117
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
1 5 10 15
<210> 118
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (2)..(2)
<223> Может быть окислен
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (4)..(4)
<223> Может быть карбоксиметилирован
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (7)..(7)
<223> Может быть карбоксиметилирован
<400> 118
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
1 5 10 15
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
20 25
<210> 119
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (9)..(9)
<223> Может быть окислен
<400> 119
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
1 5 10 15
<210> 120
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 120
Ser Asp Thr Gly Arg Pro Phe Val Glu Met
1 5 10
<210> 121
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 121
Val Thr Ser Pro Asn Ile Thr Val Thr Leu Lys
1 5 10
<210> 122
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 122
Asn Ser Thr Phe Val Arg
1 5
<210> 123
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (14)..(14)
<223> Может присутствовать или отсутствовать
<400> 123
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10
<210> 124
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> ПРОЧ_ПРИЗНАКИ
<222> (4)..(4)
<223> Может быть окислен
<400> 124
Ile Ile Ile Trp Asp Ser Arg
1 5
<---

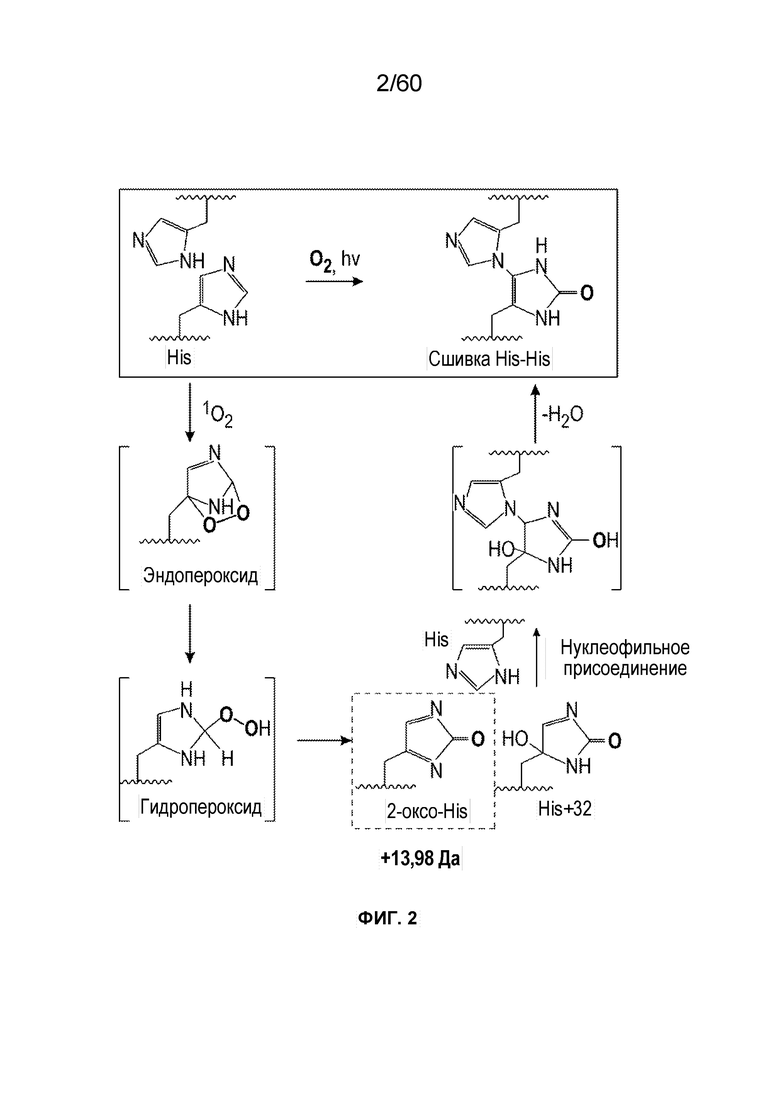
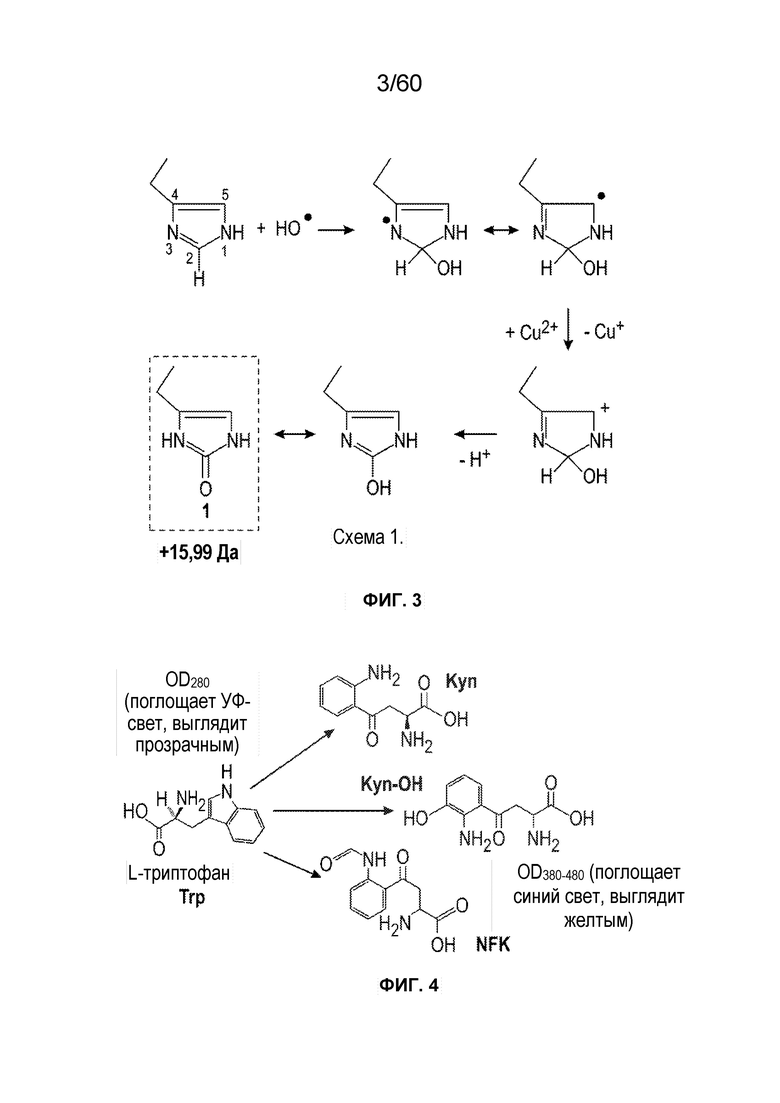
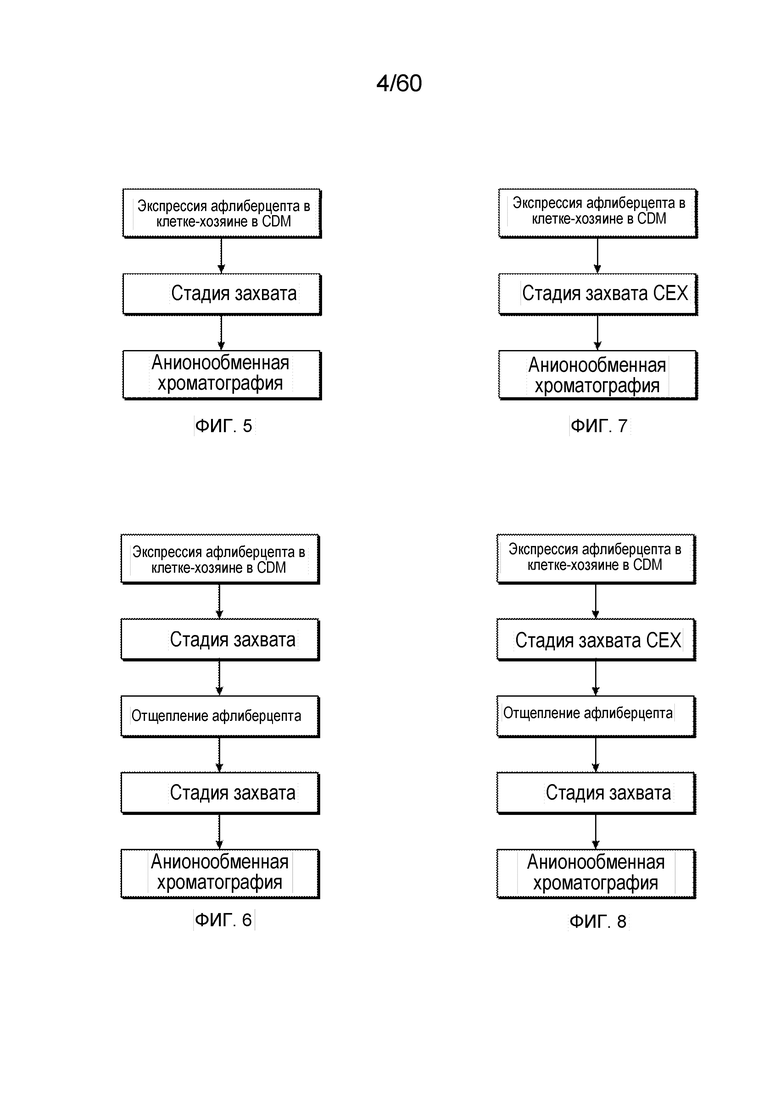
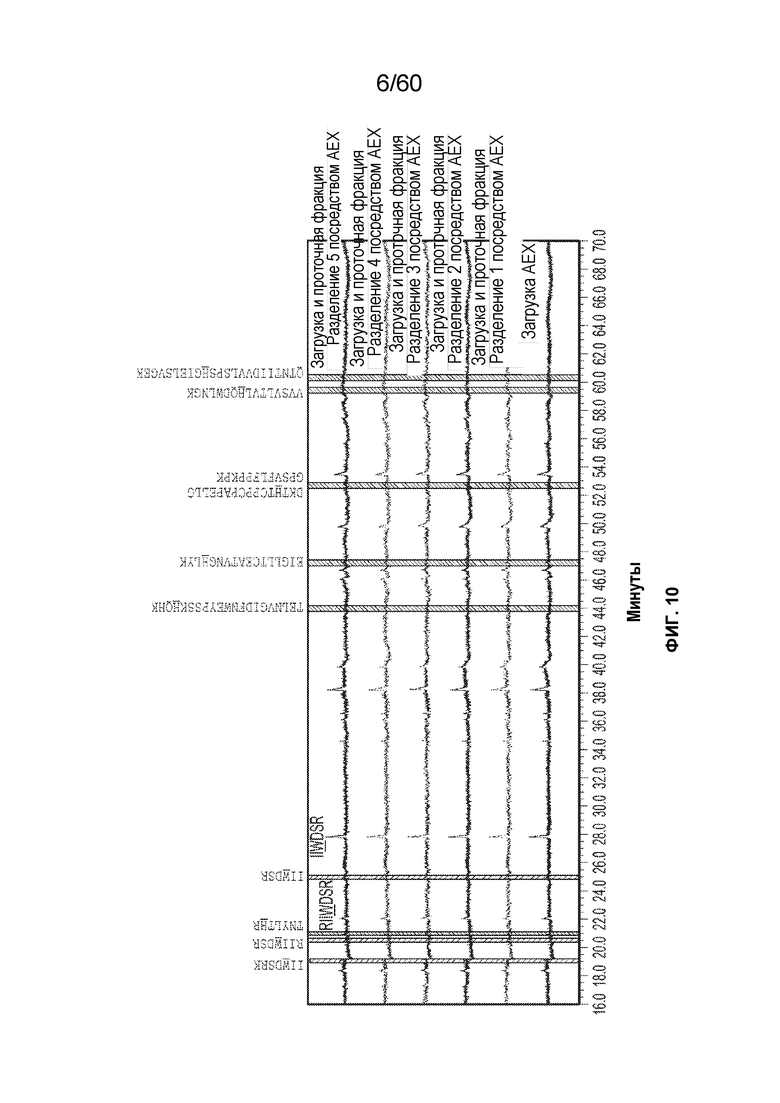
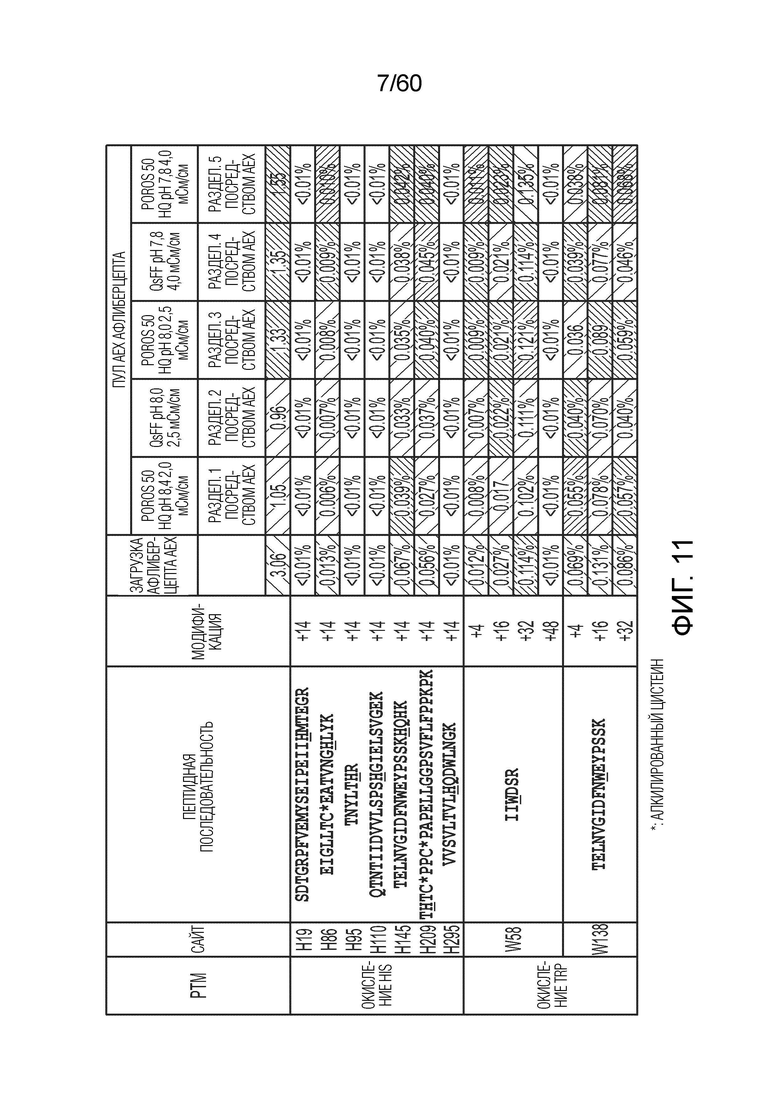
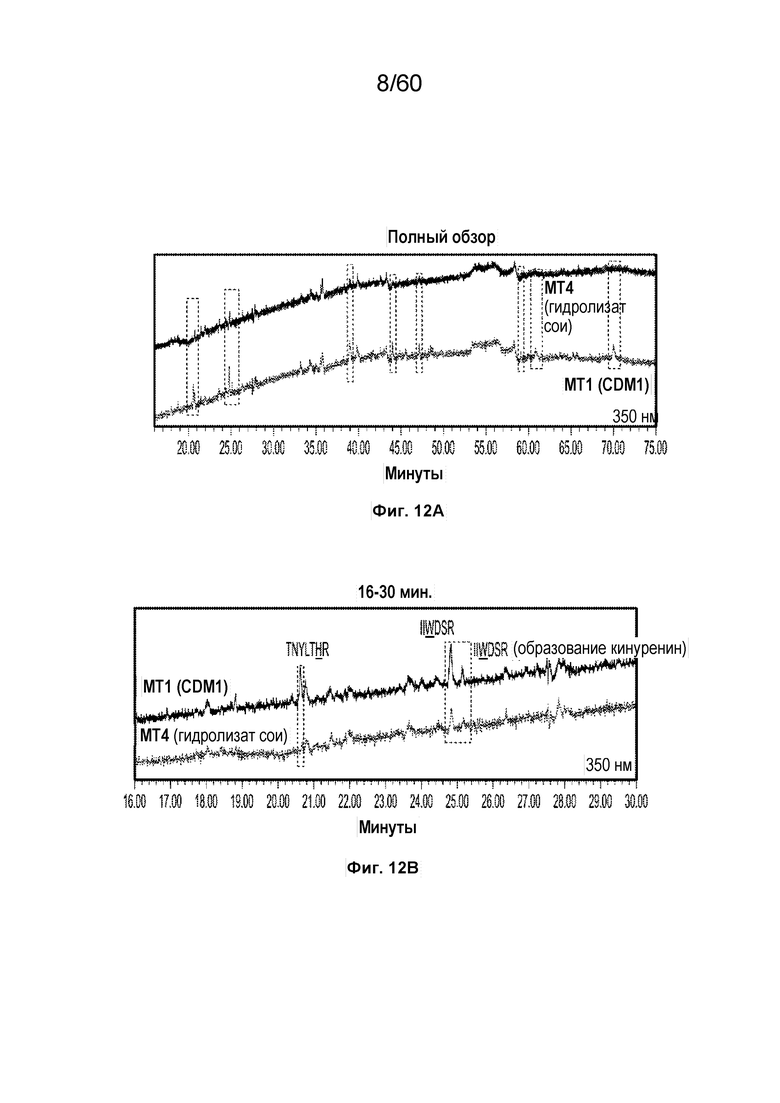


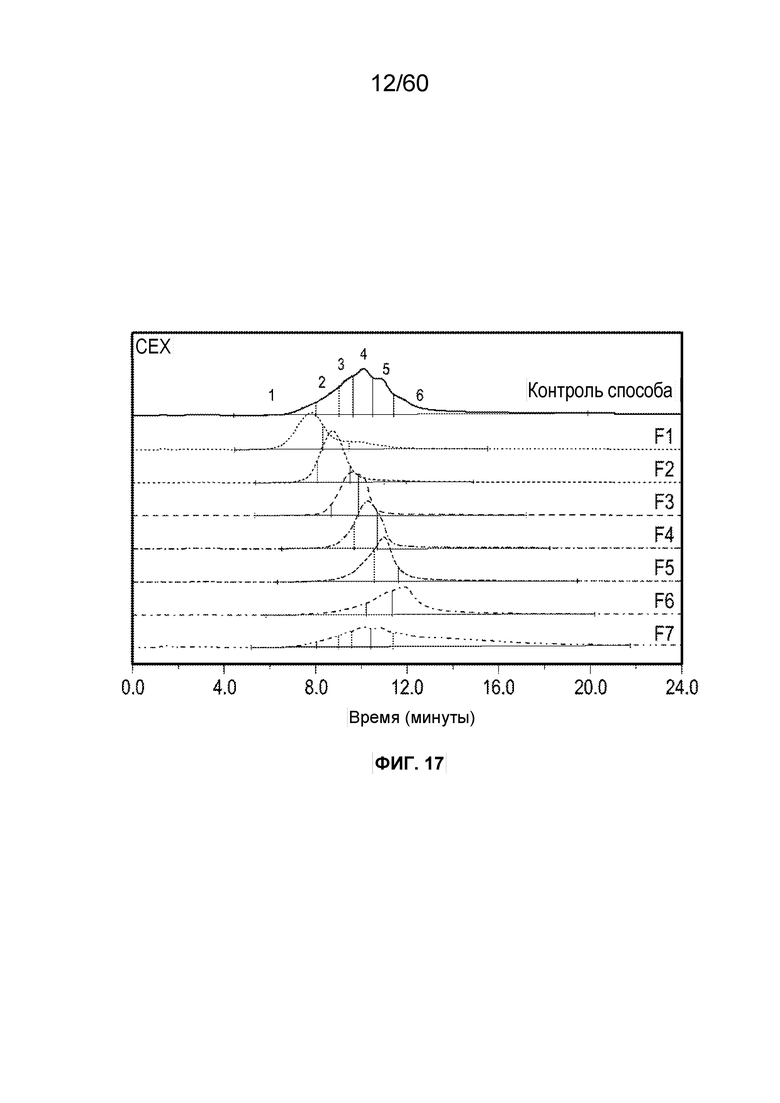

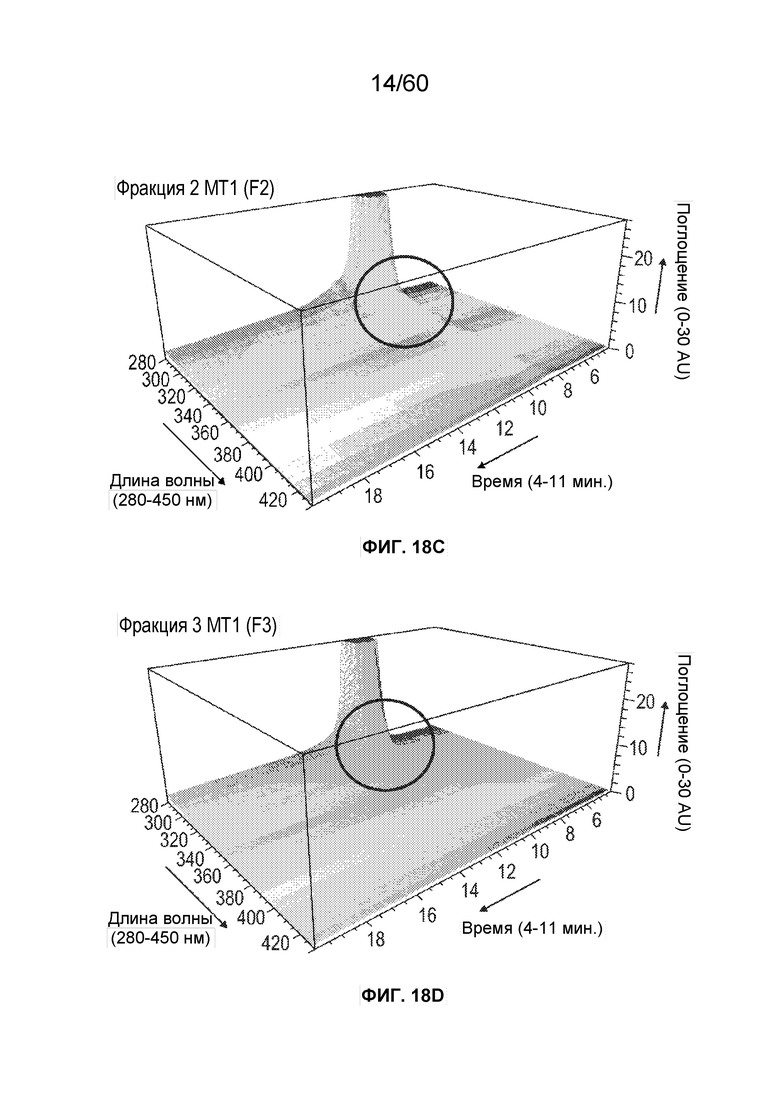
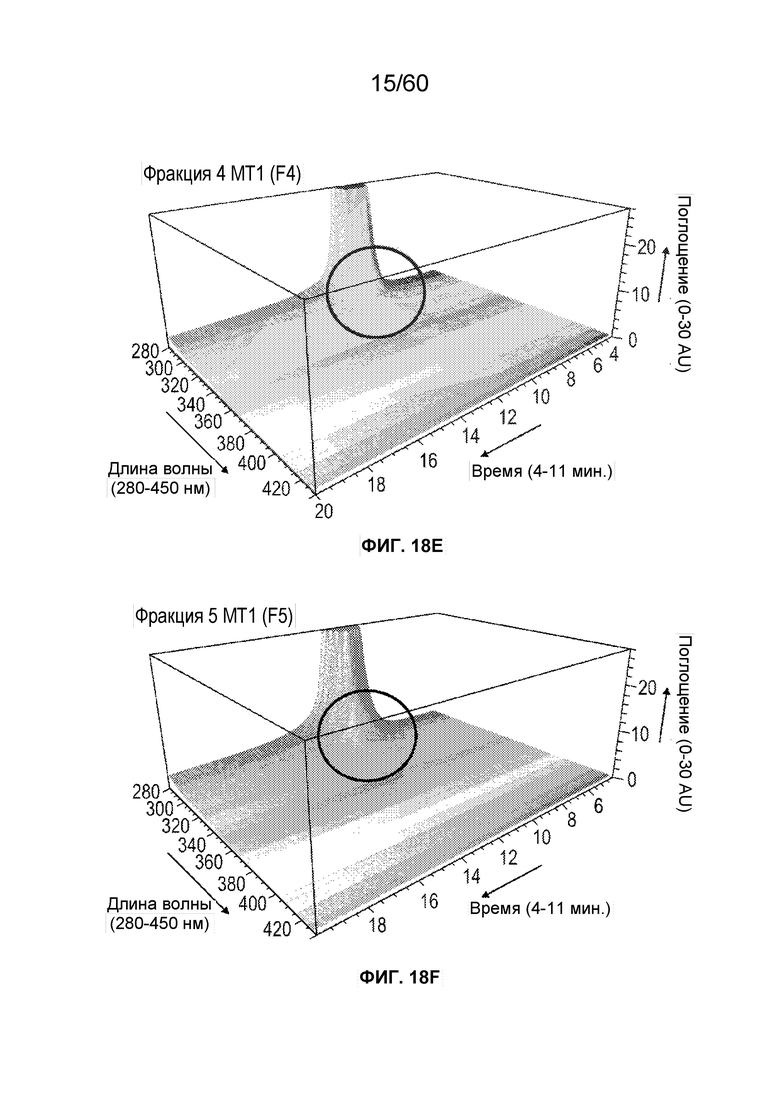

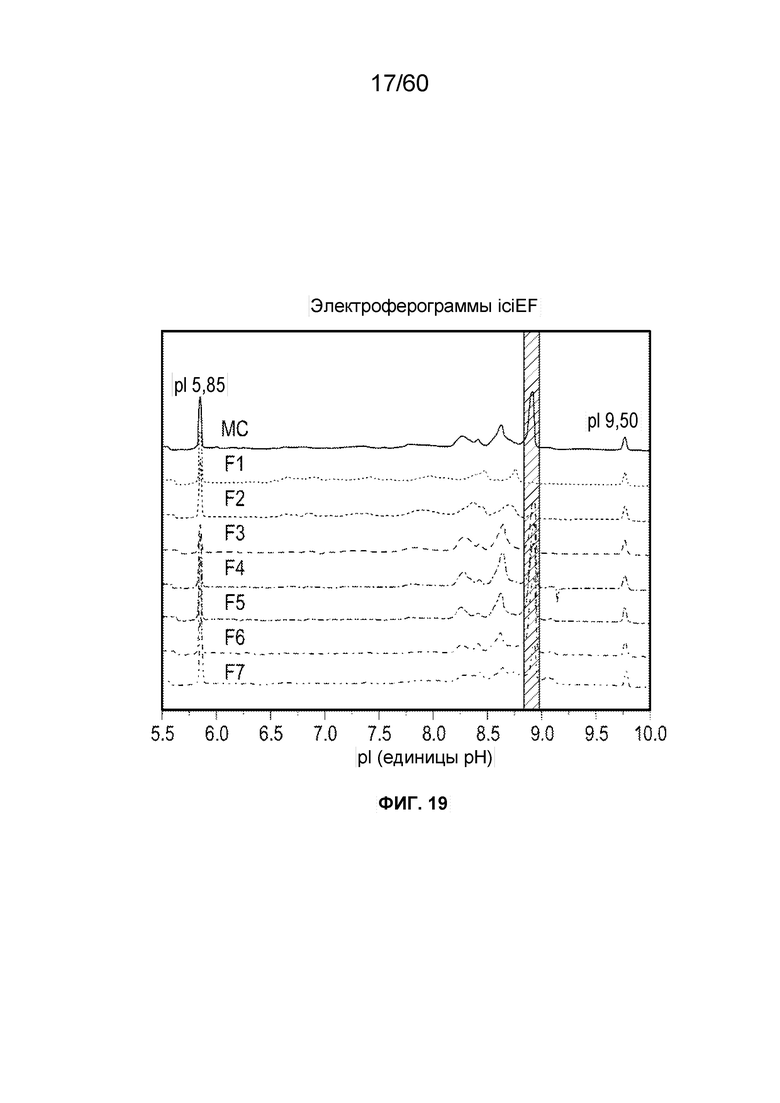

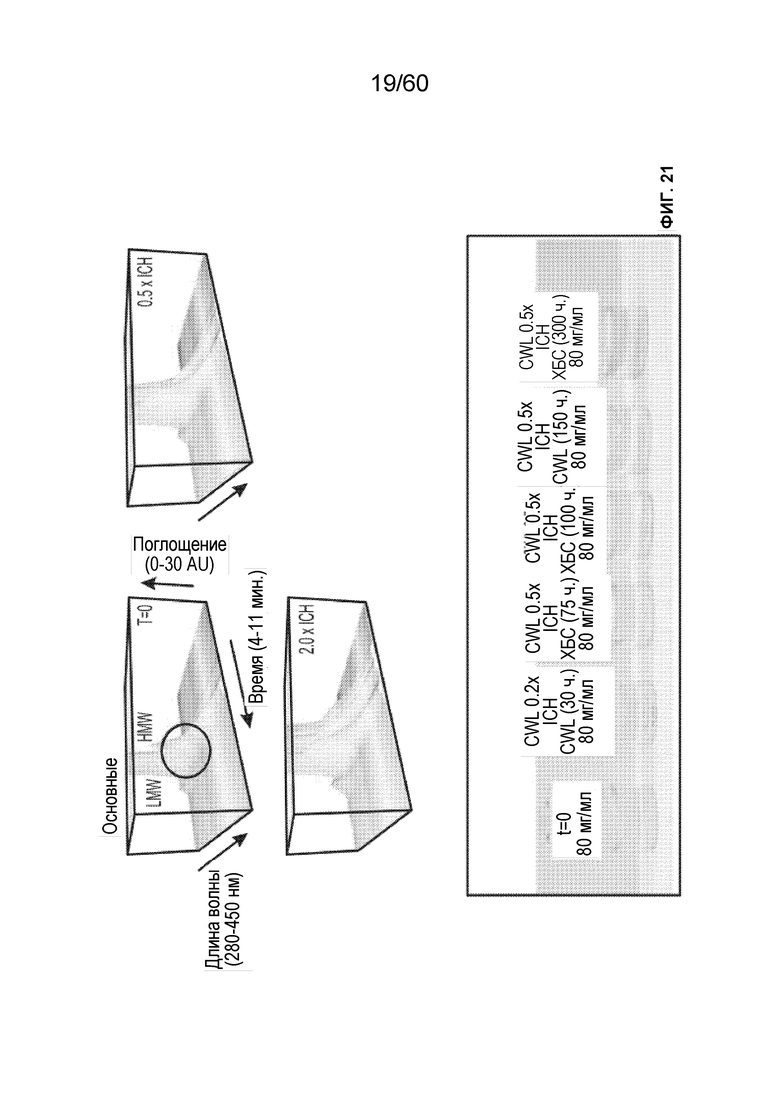
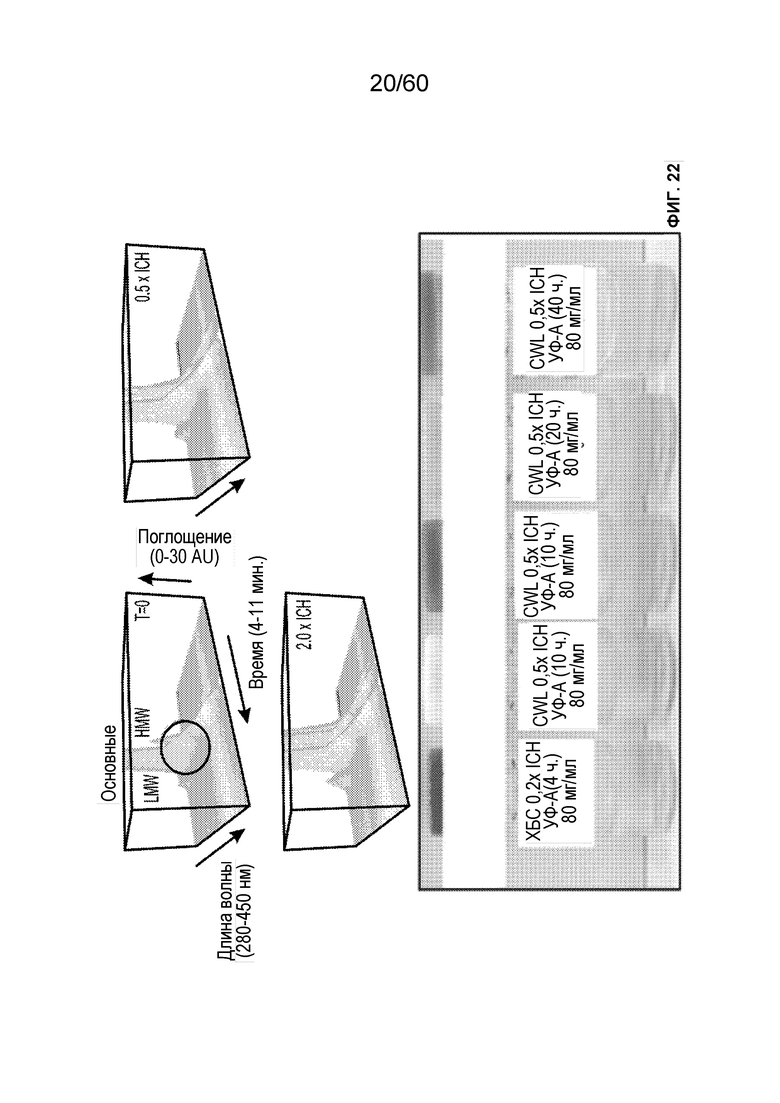
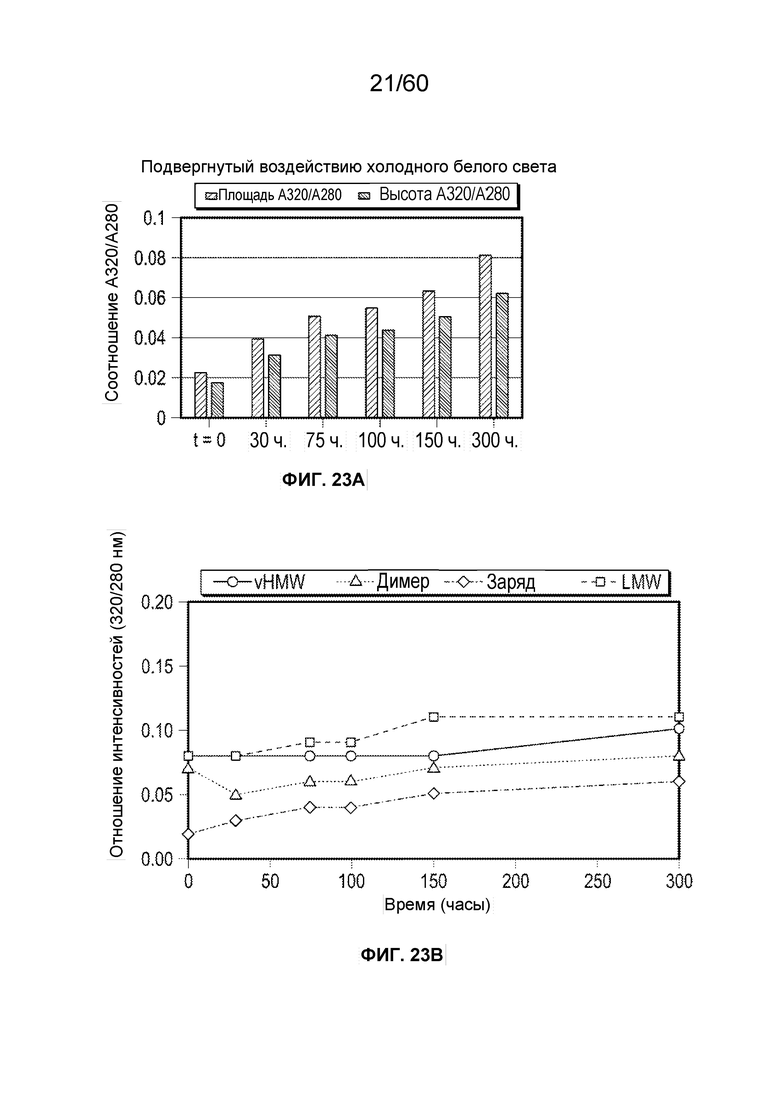
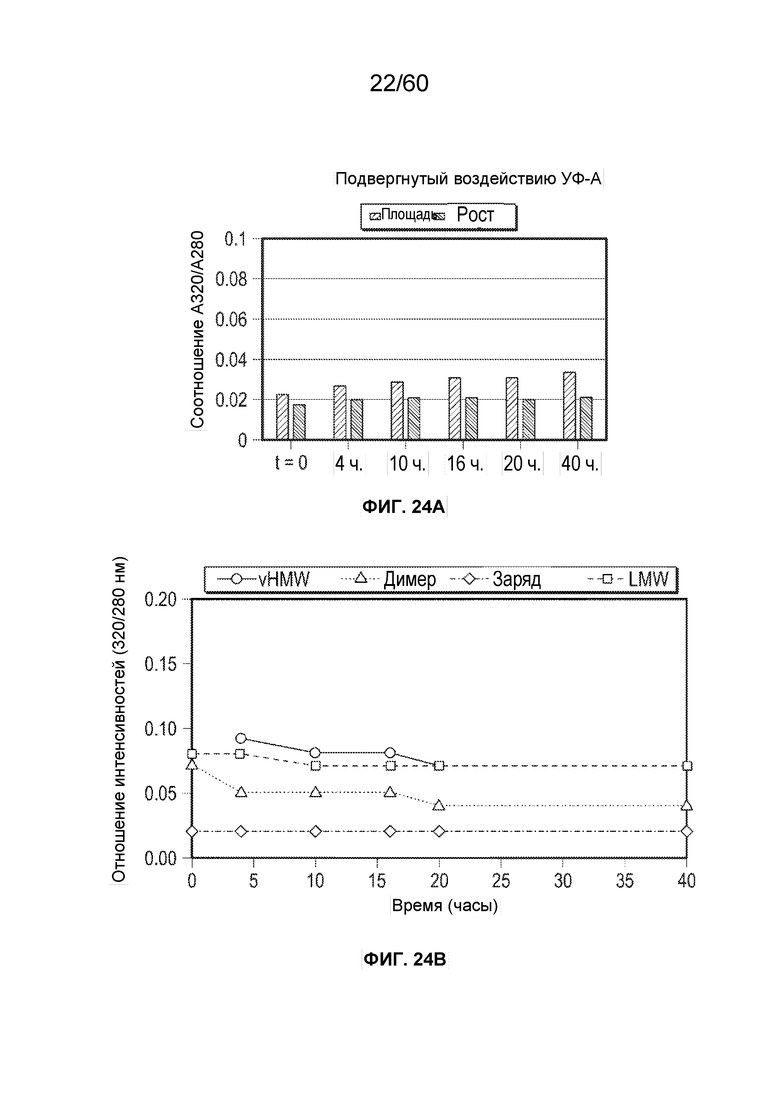
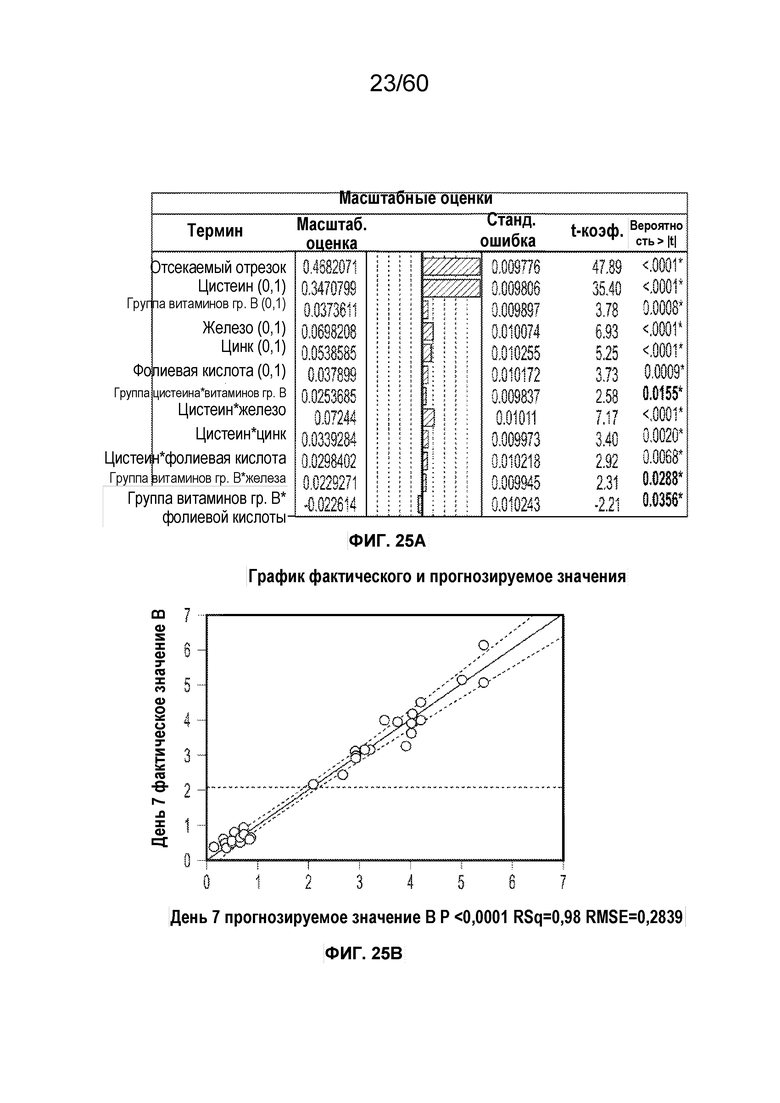
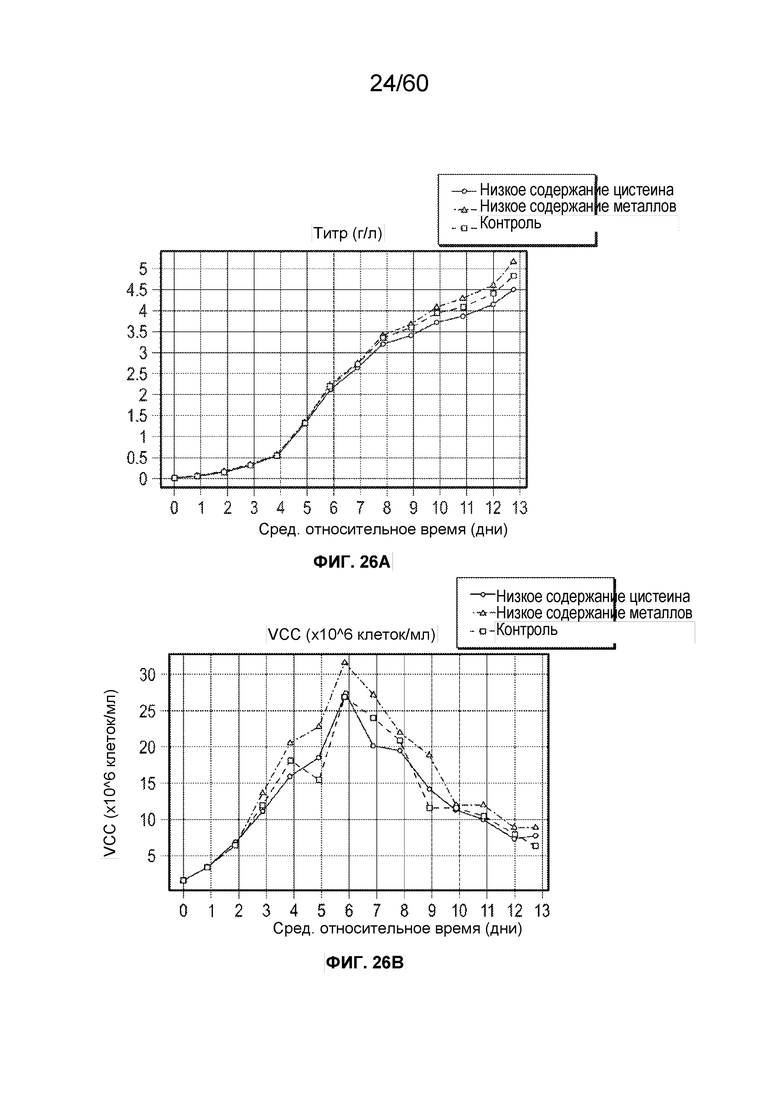
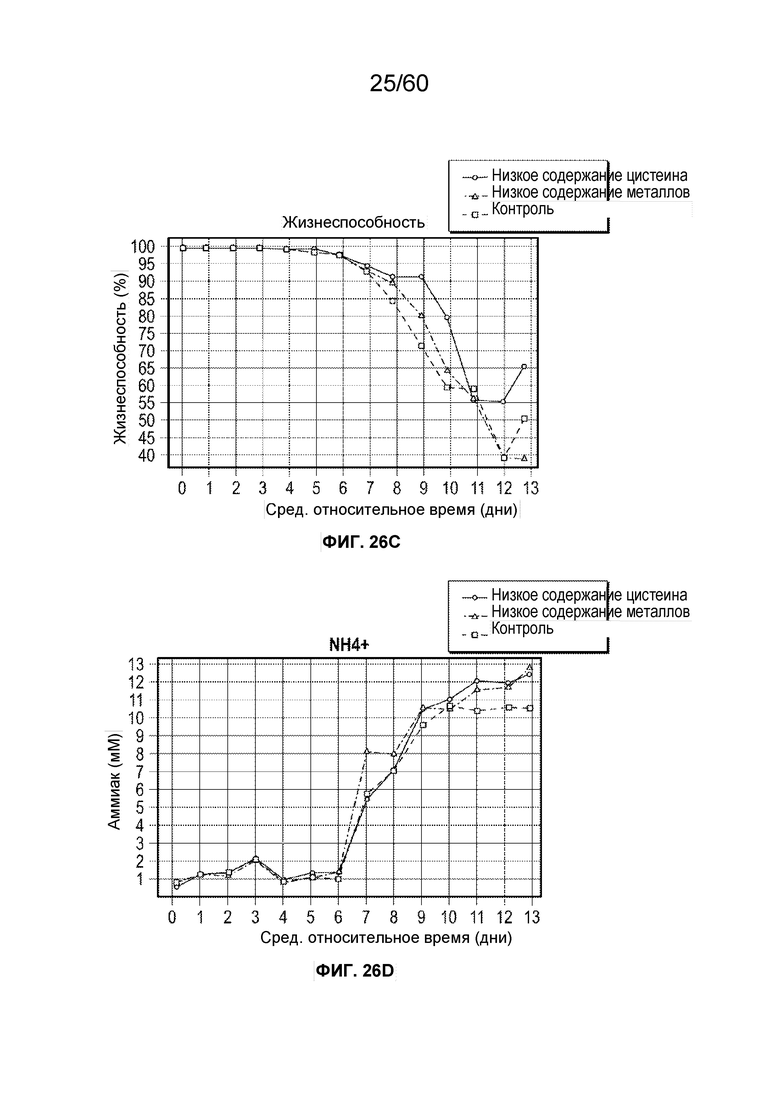
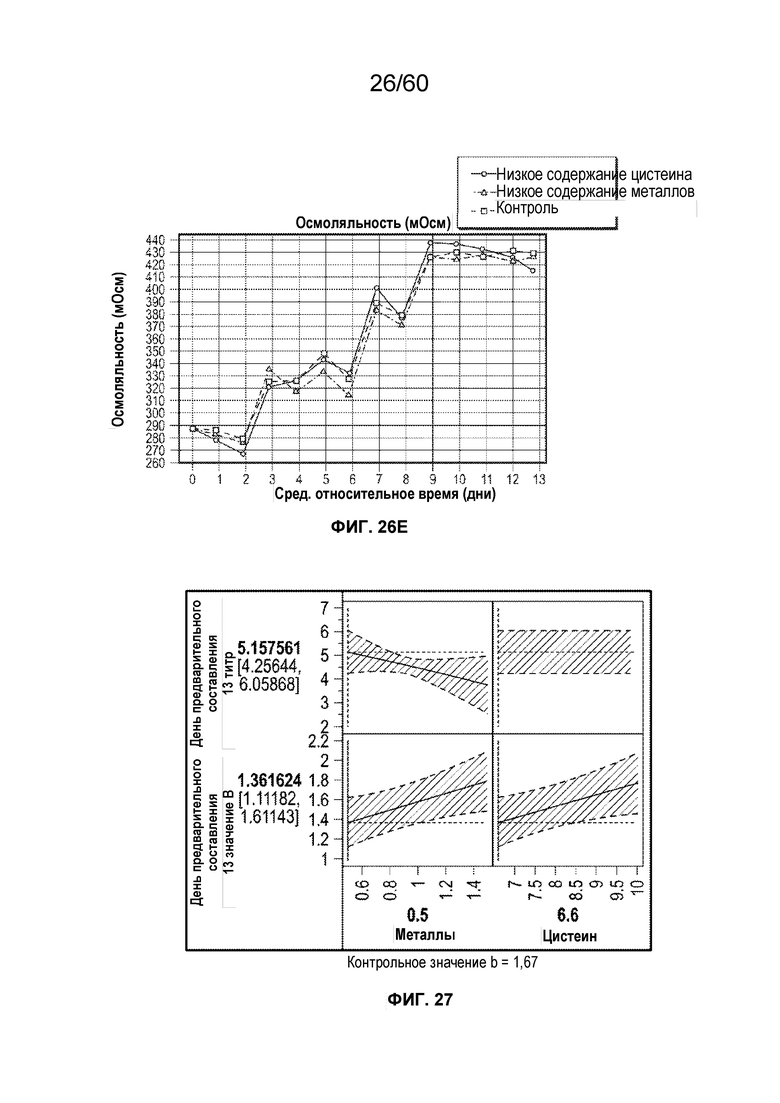
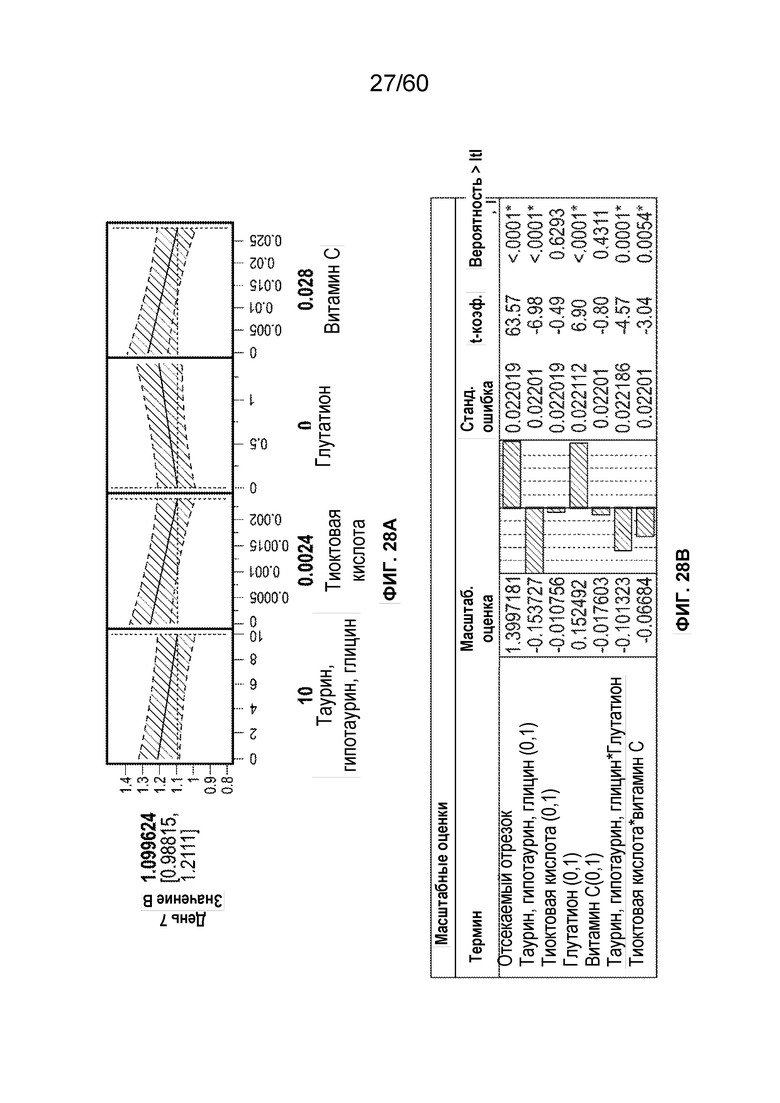
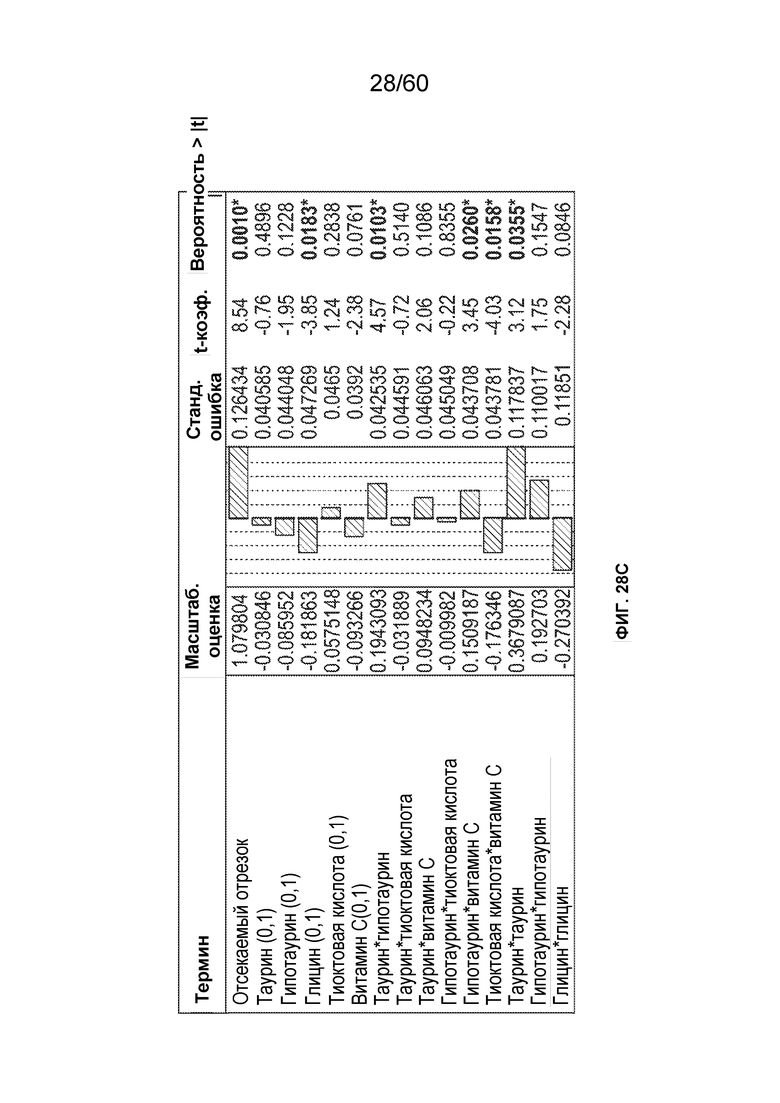
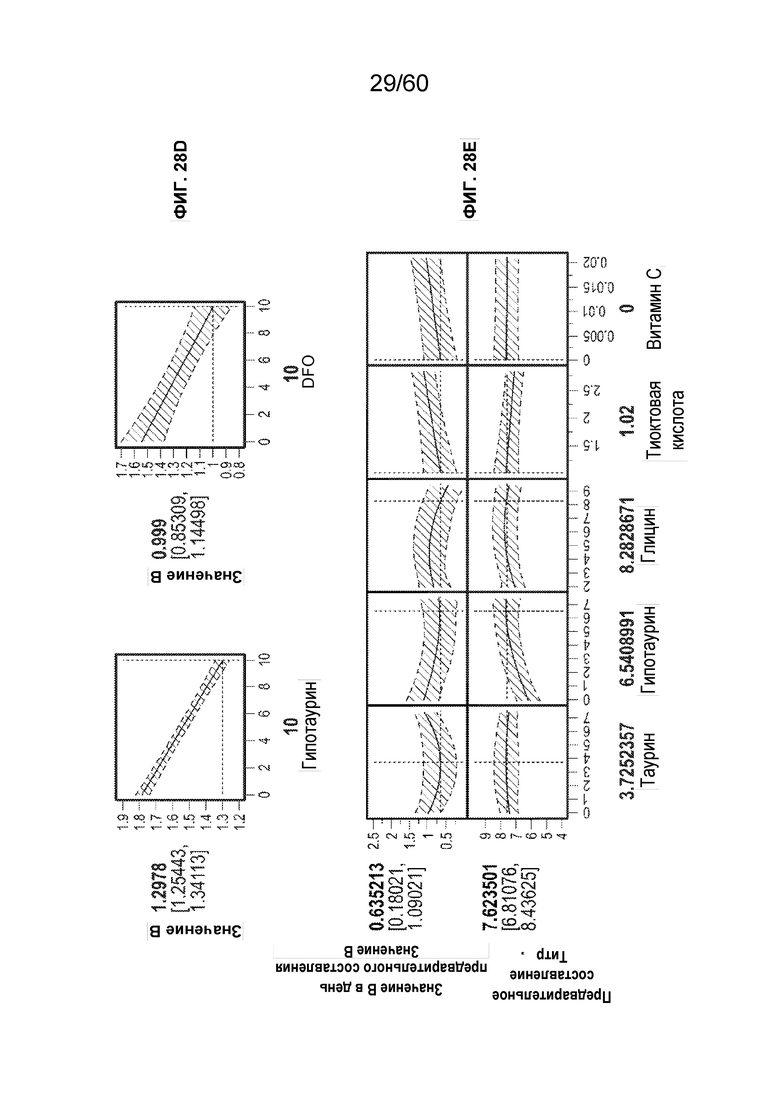
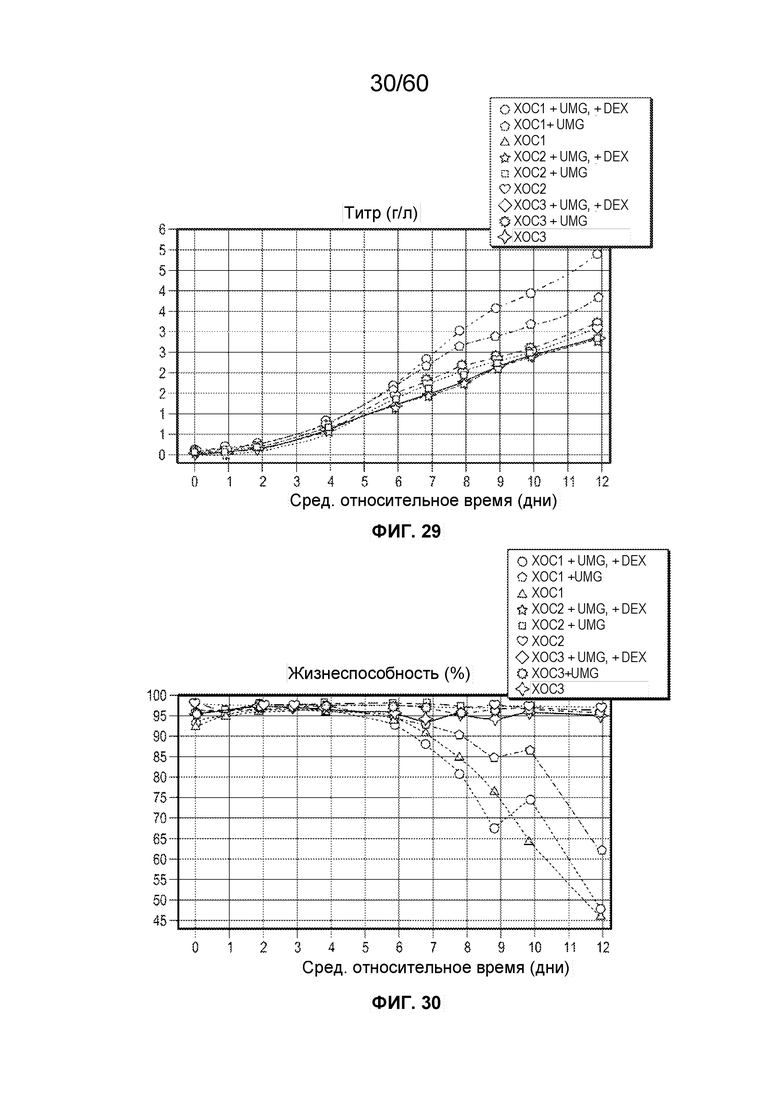
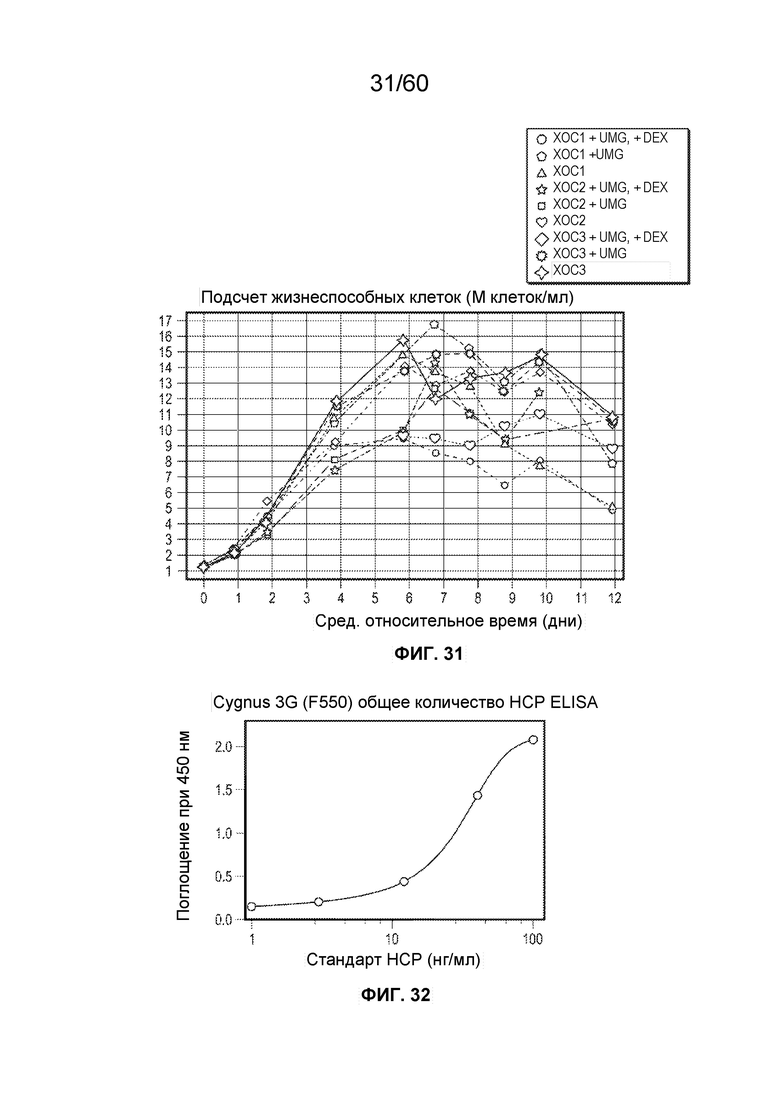
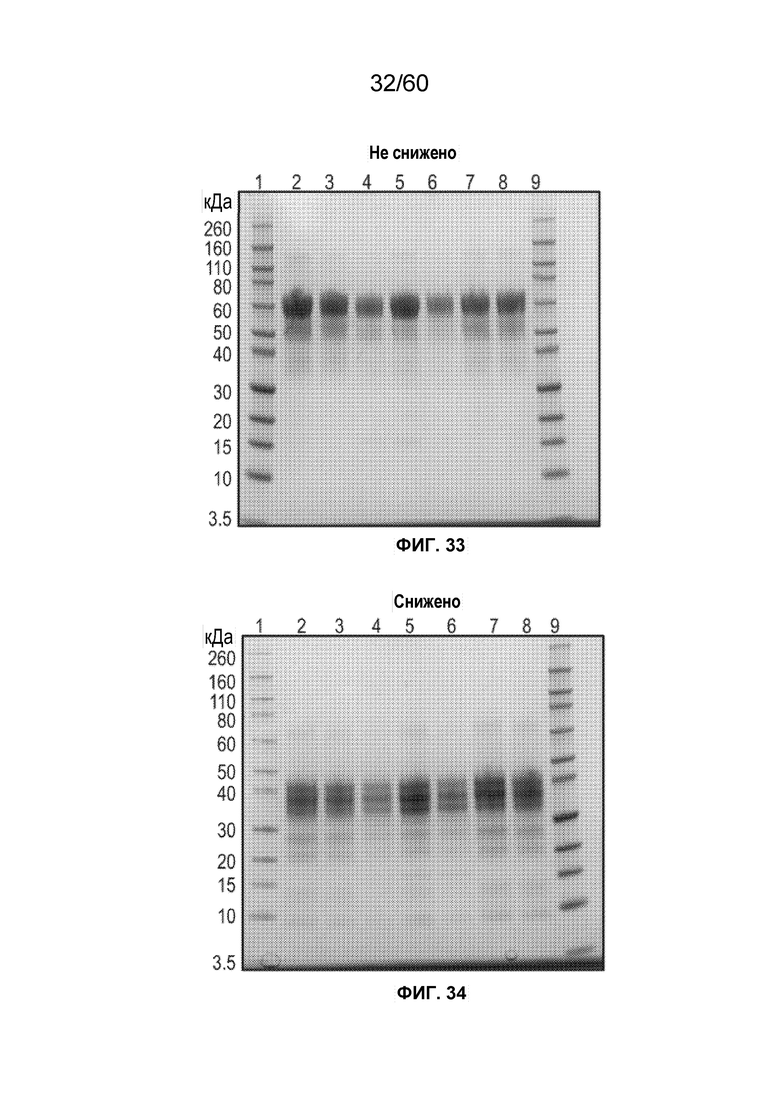
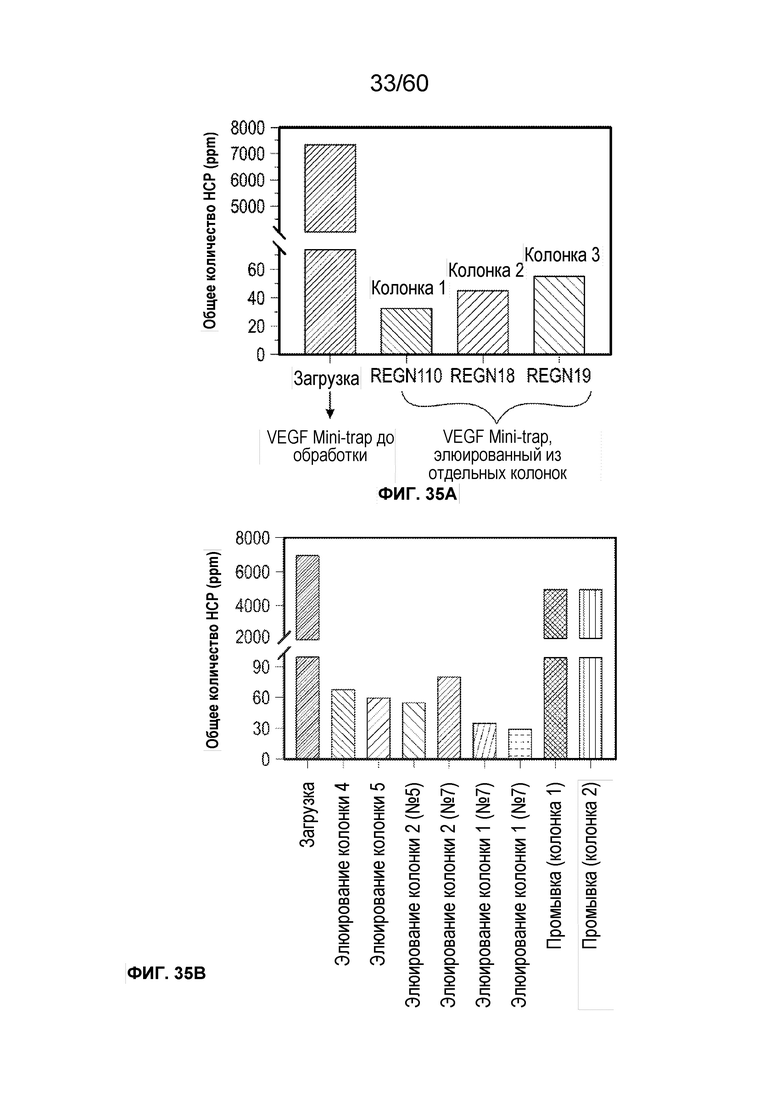

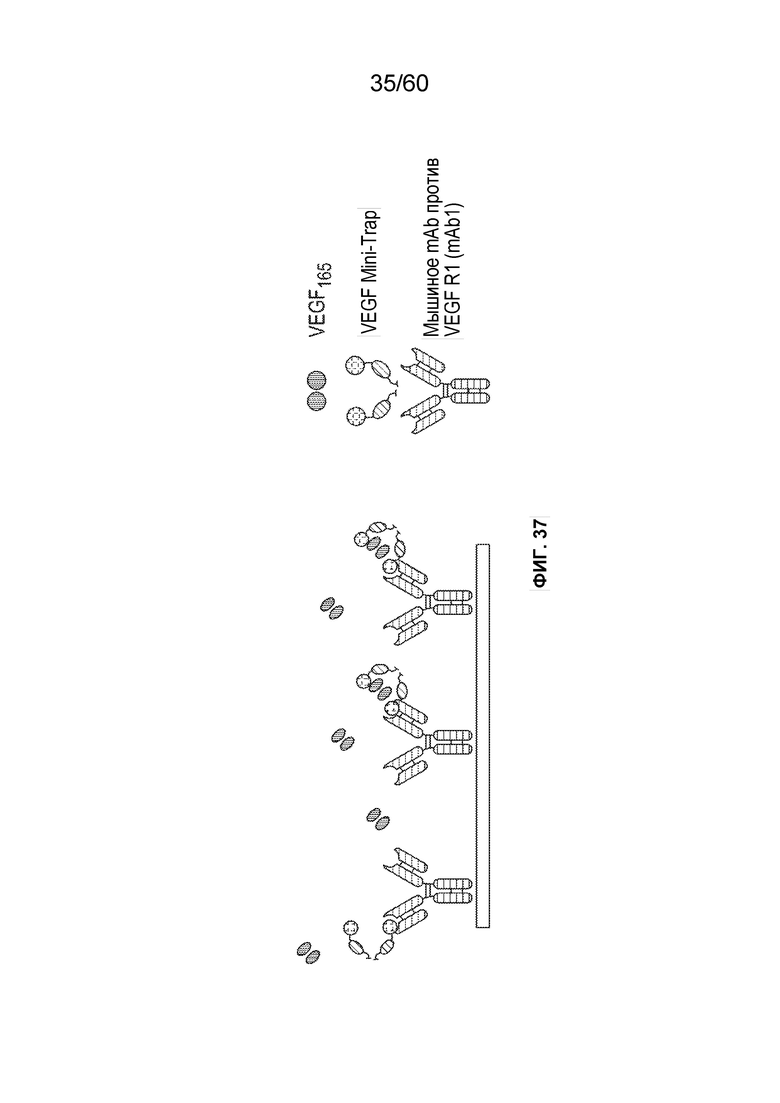
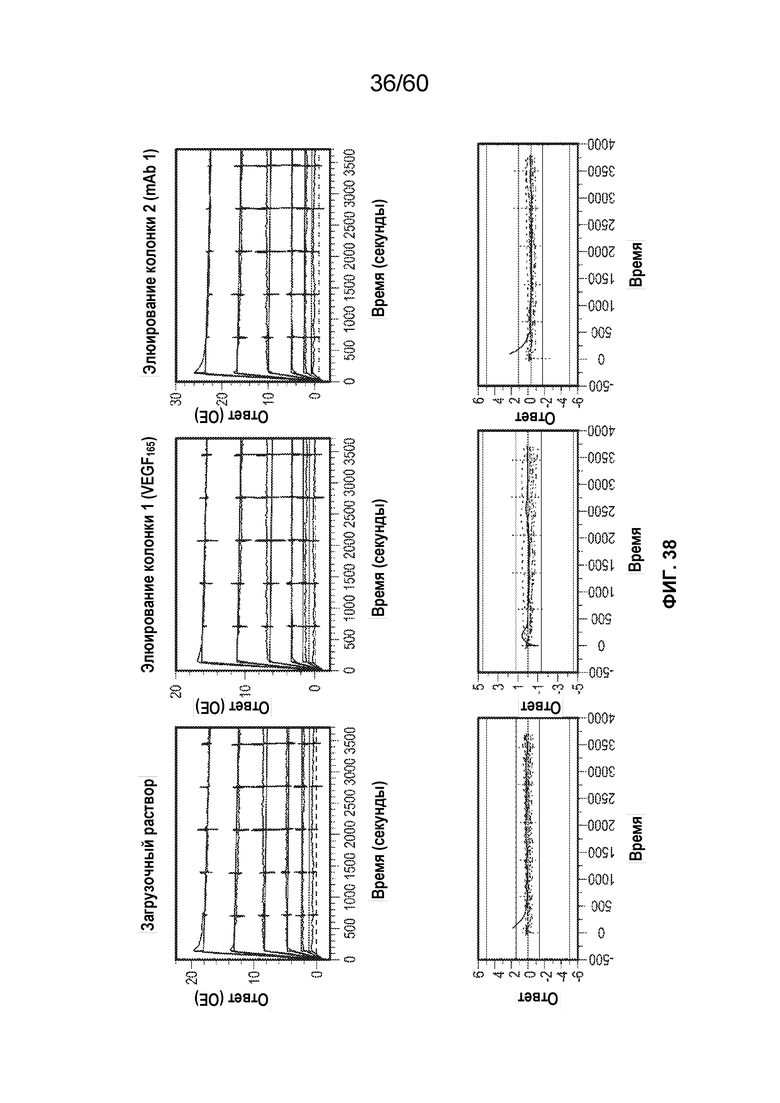
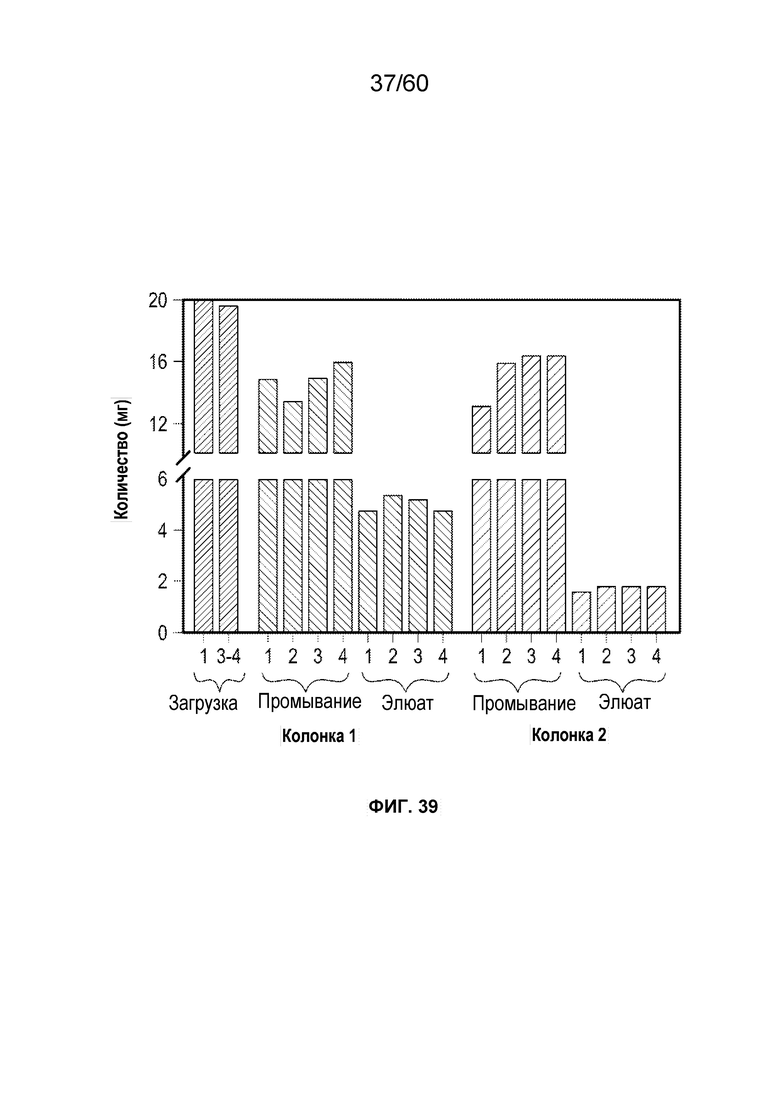
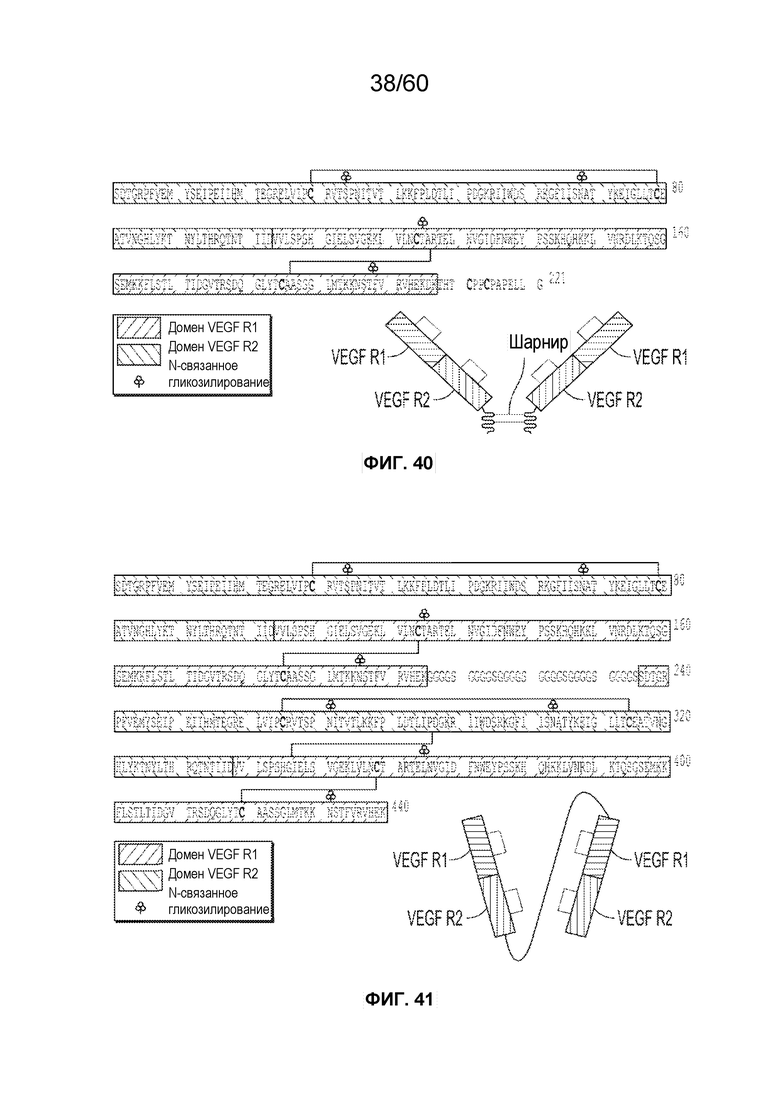
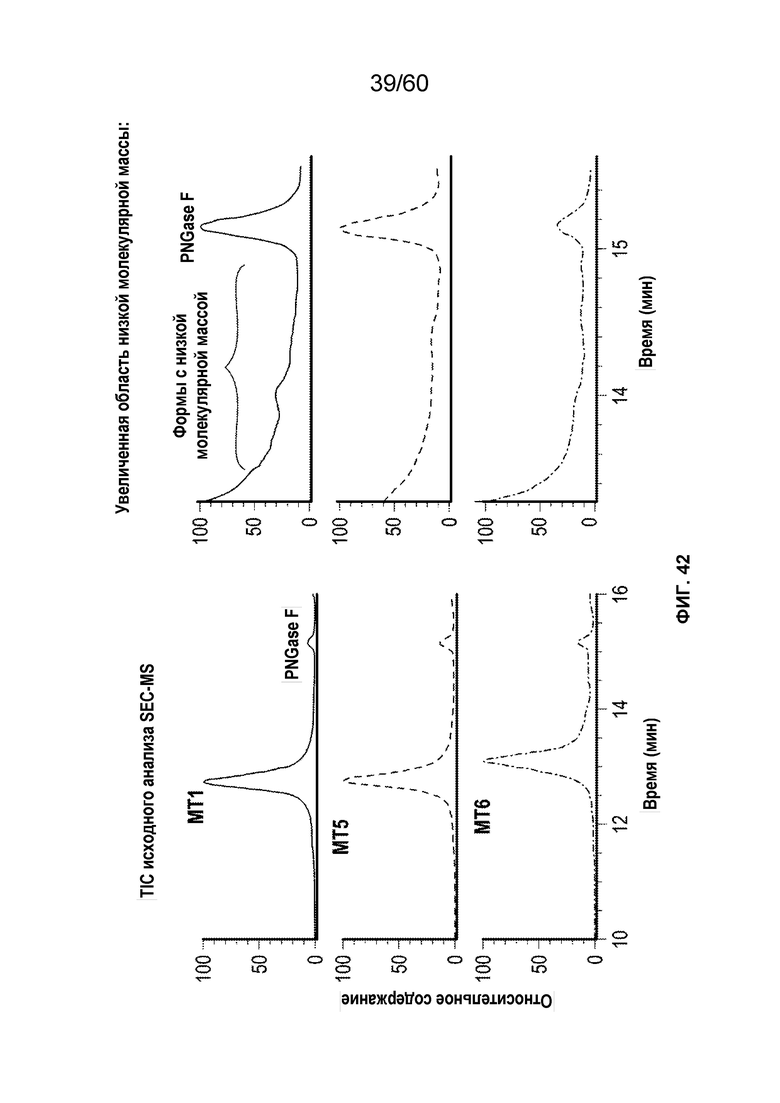
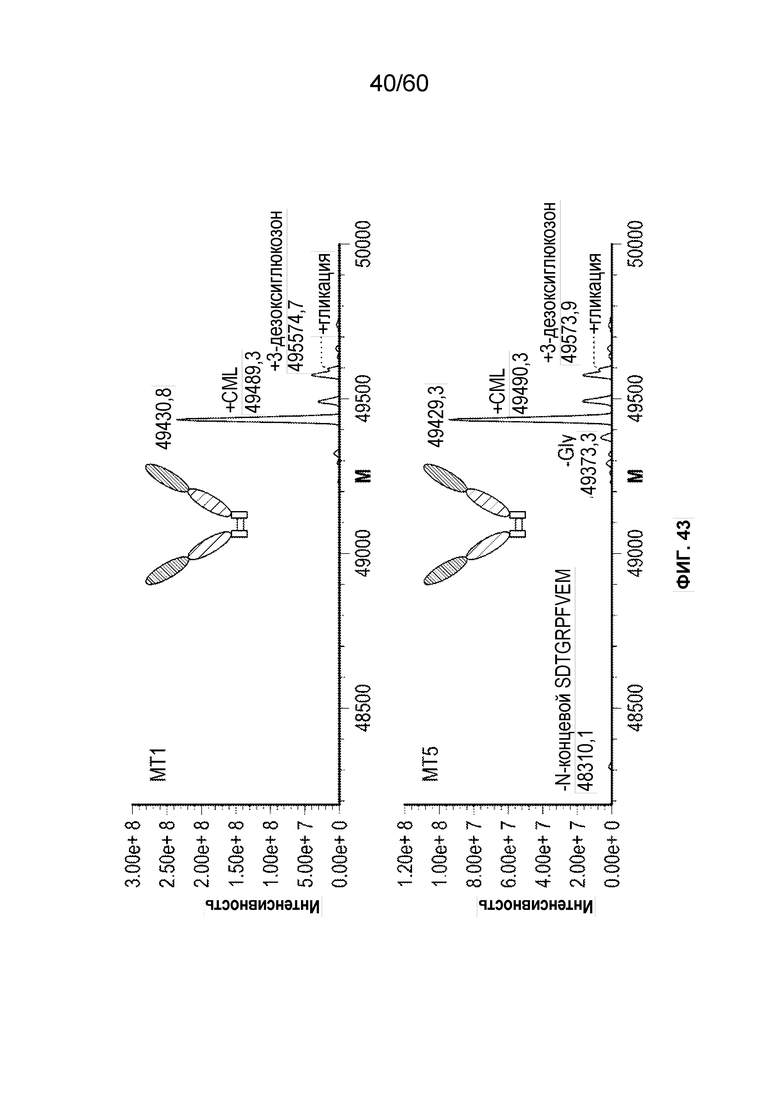
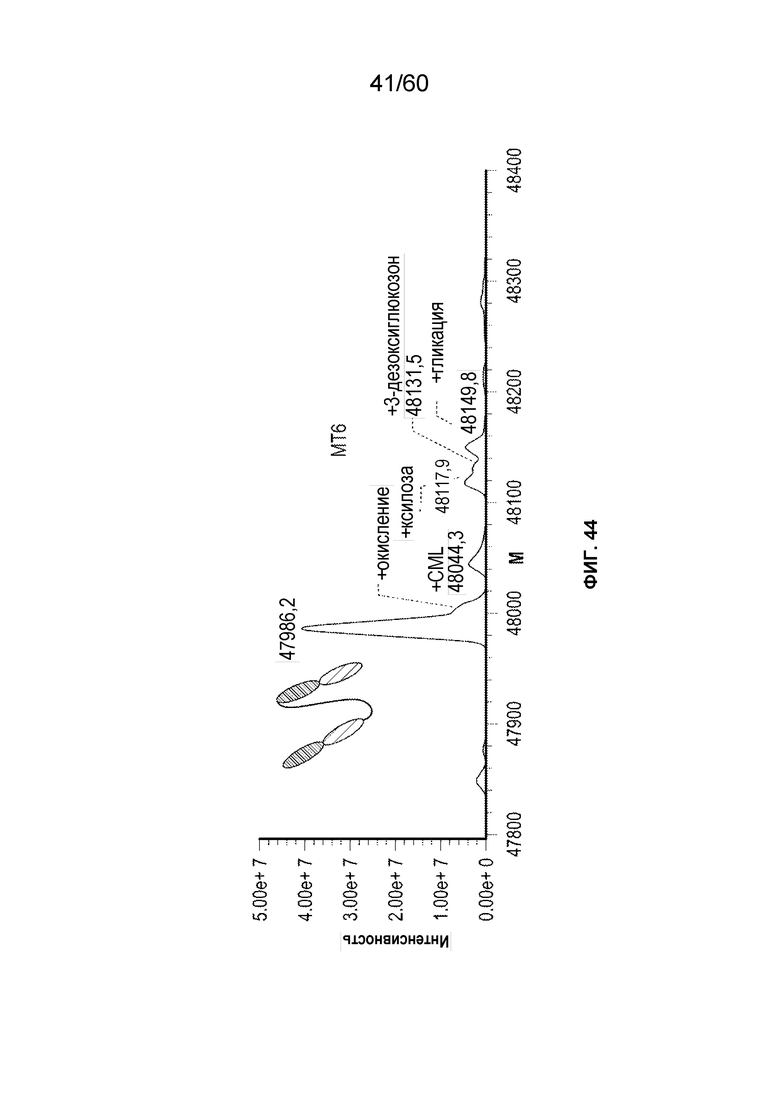
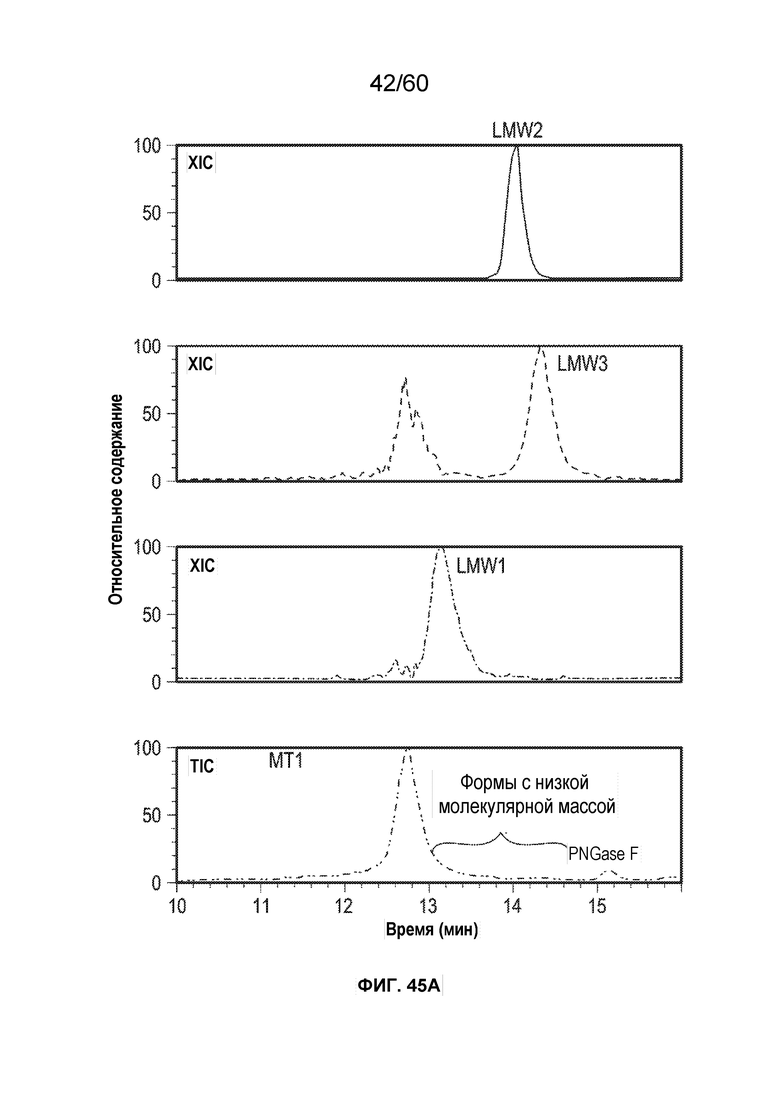
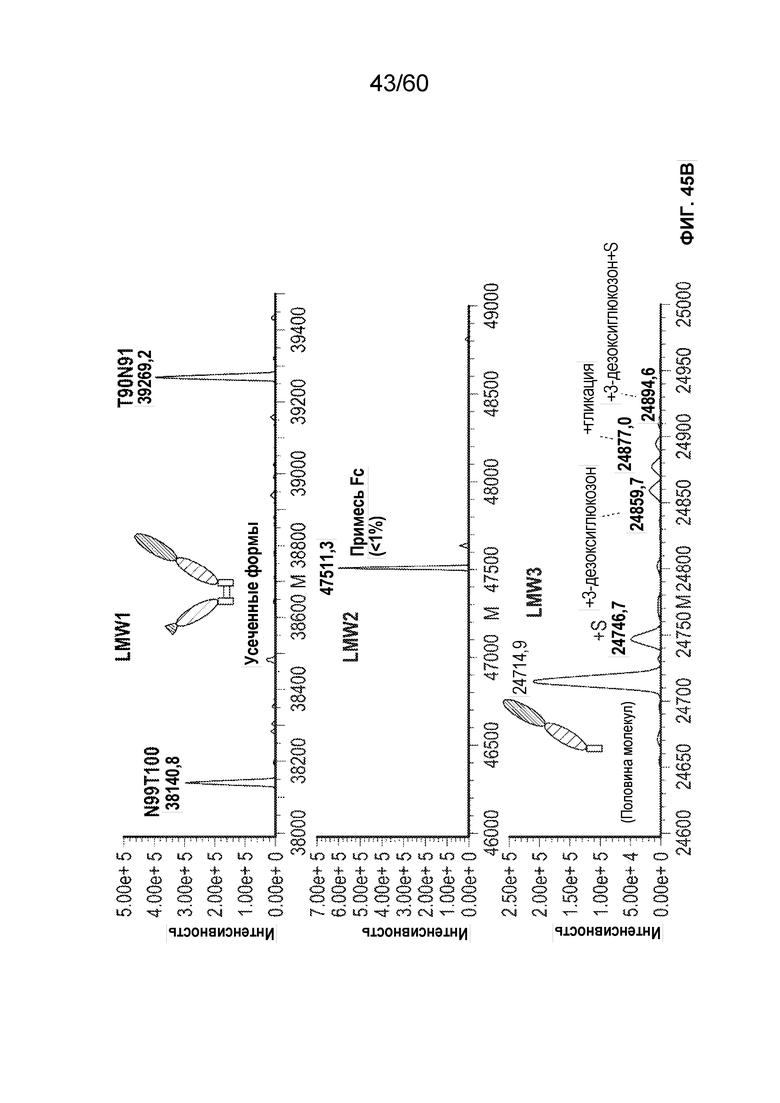
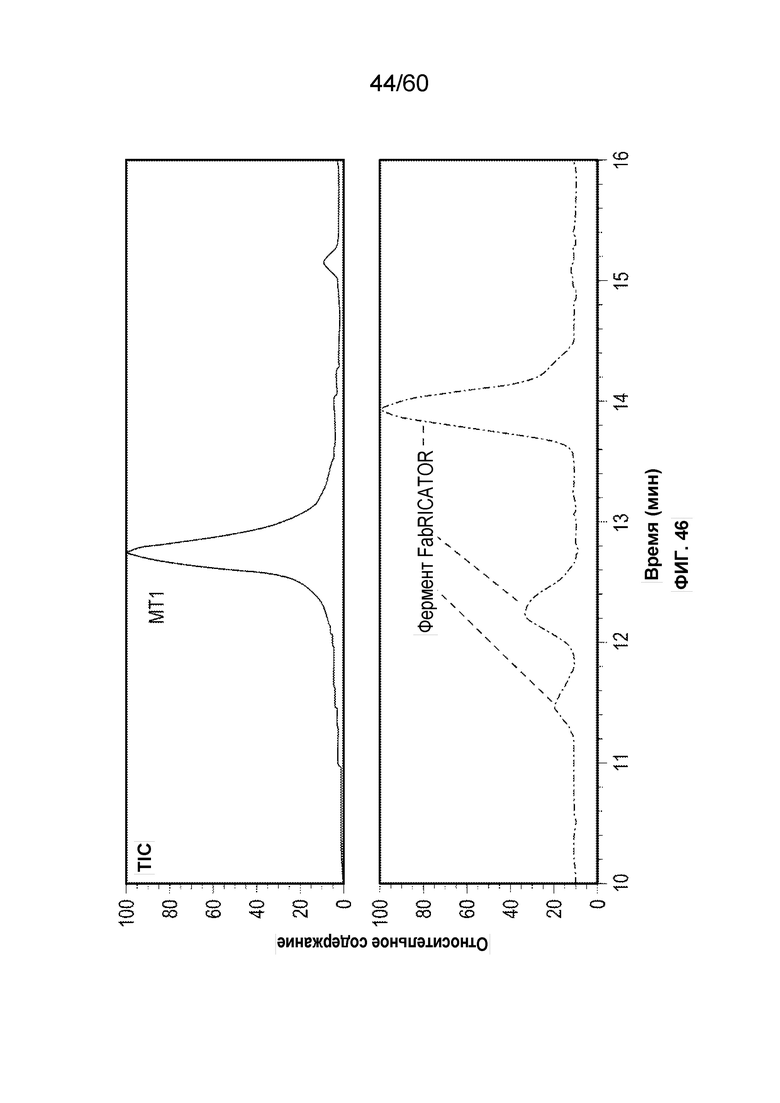

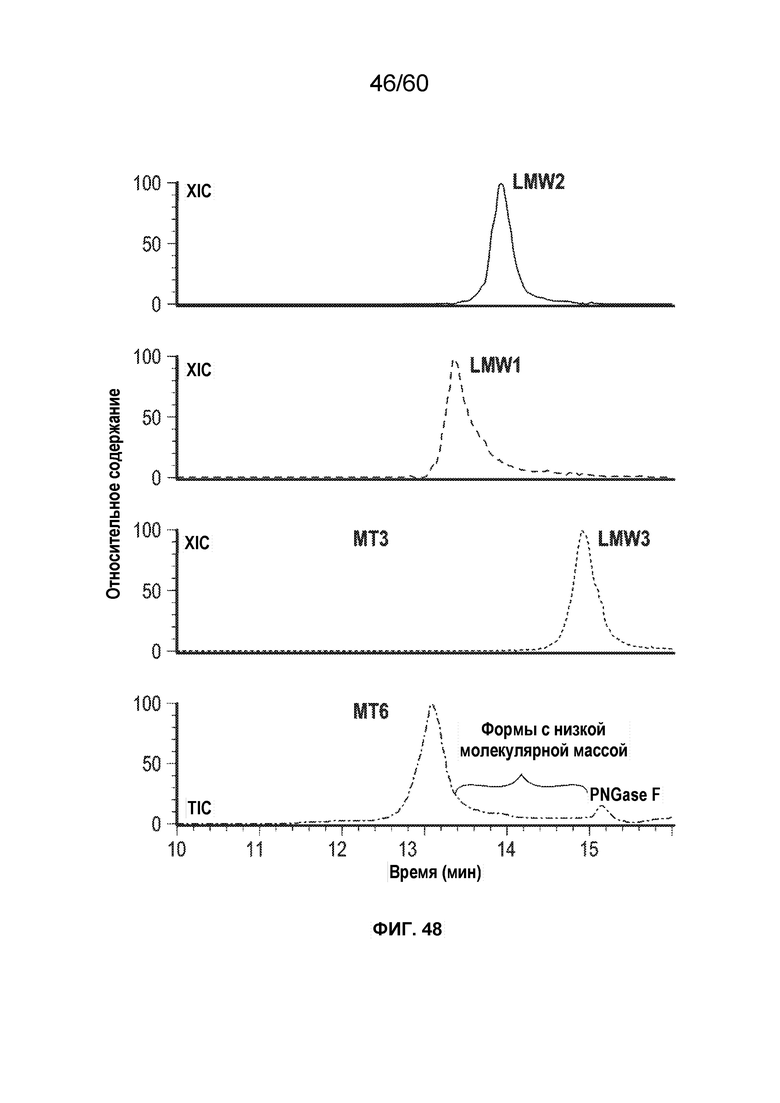
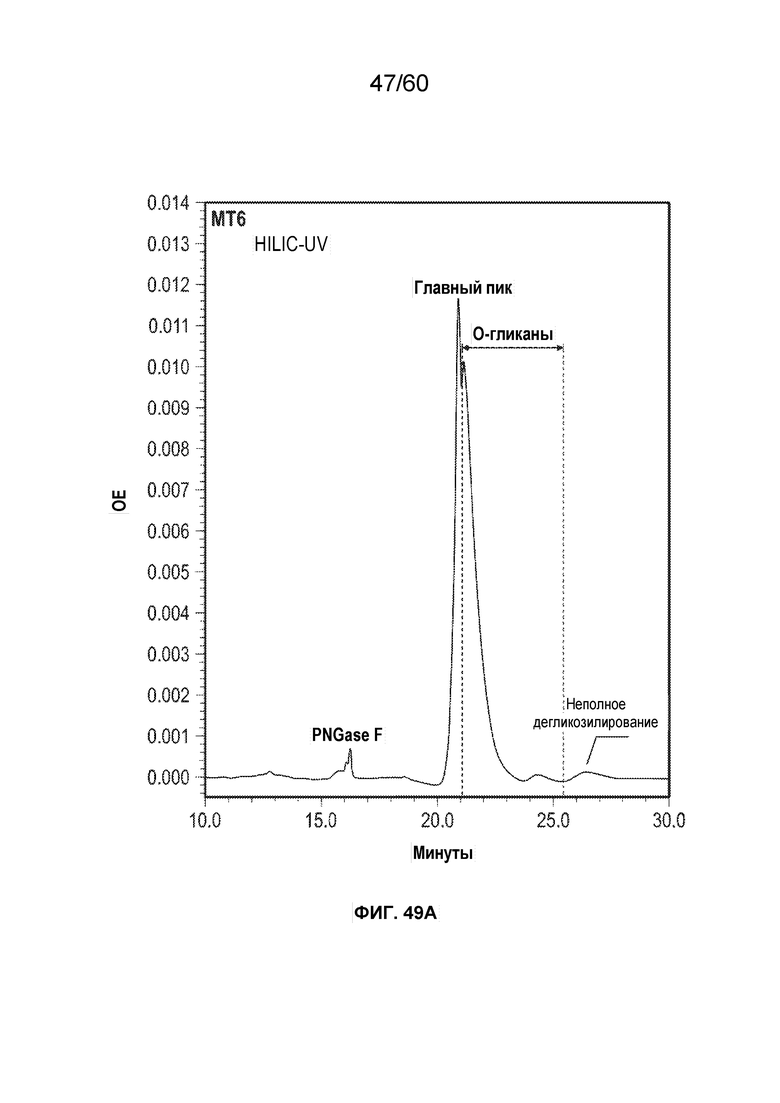
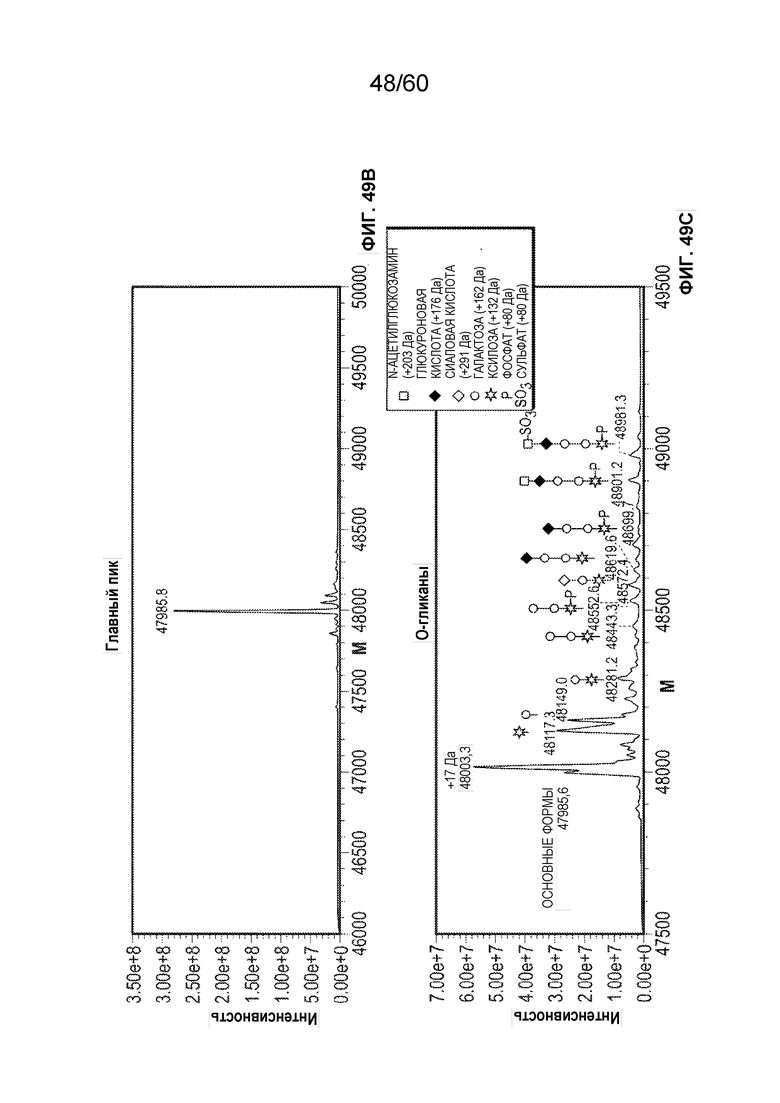

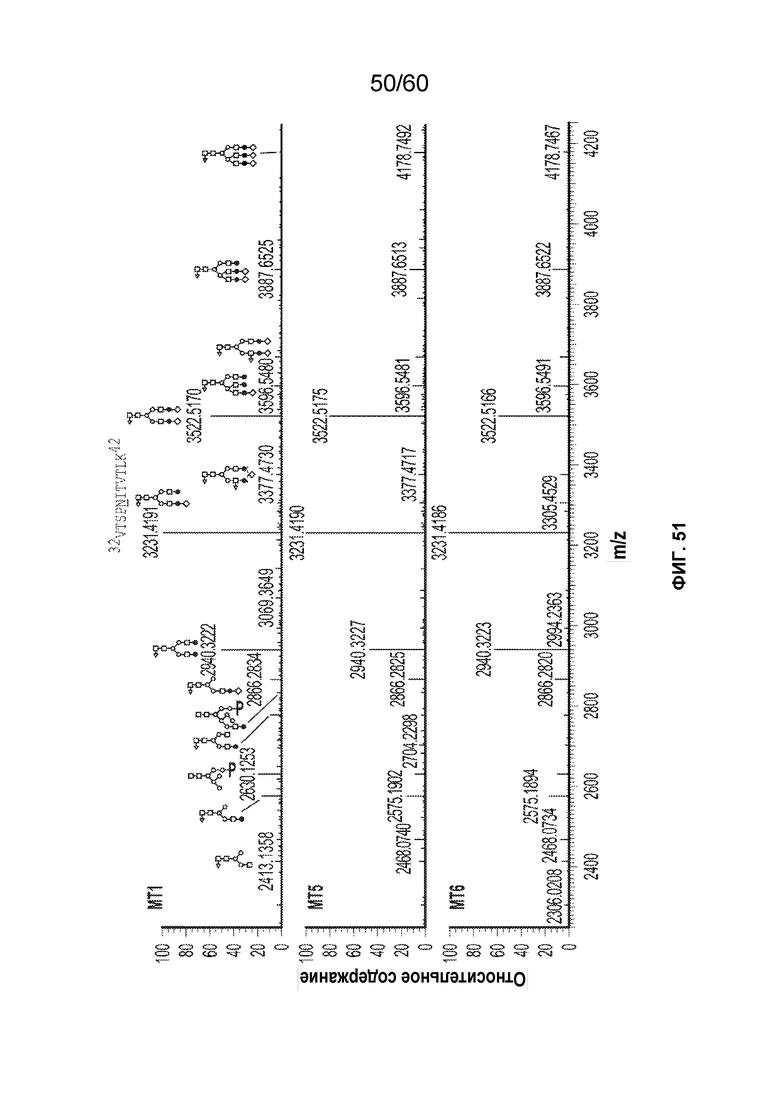
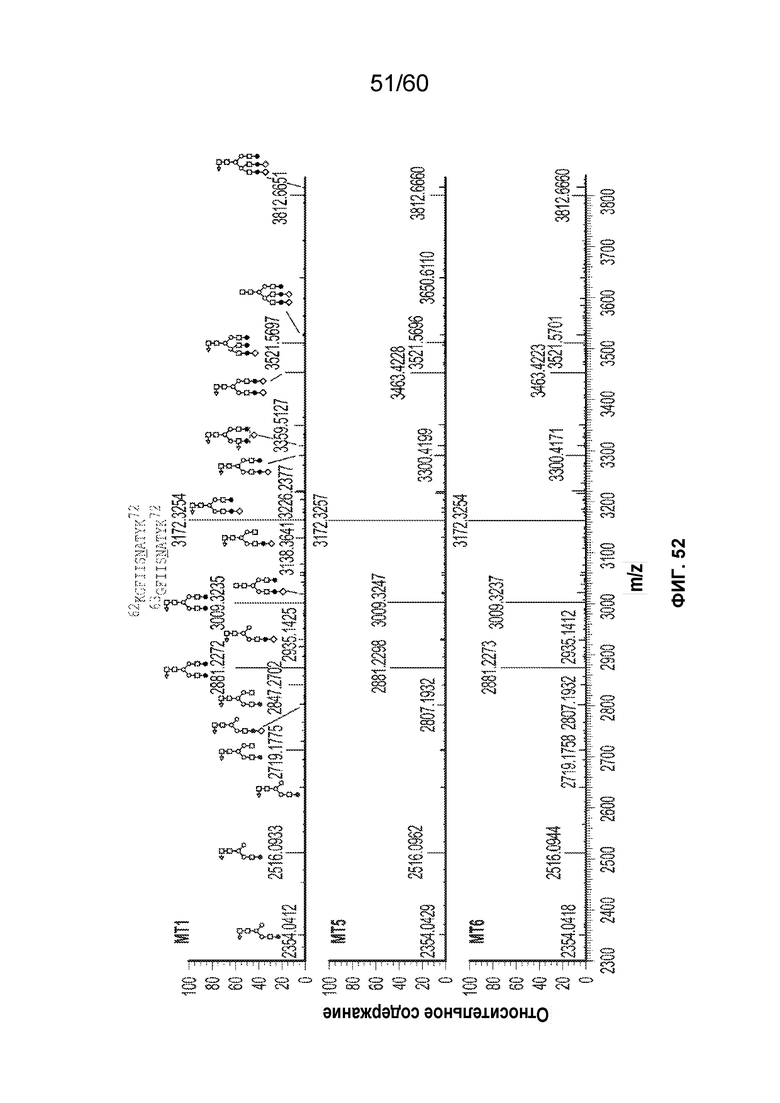
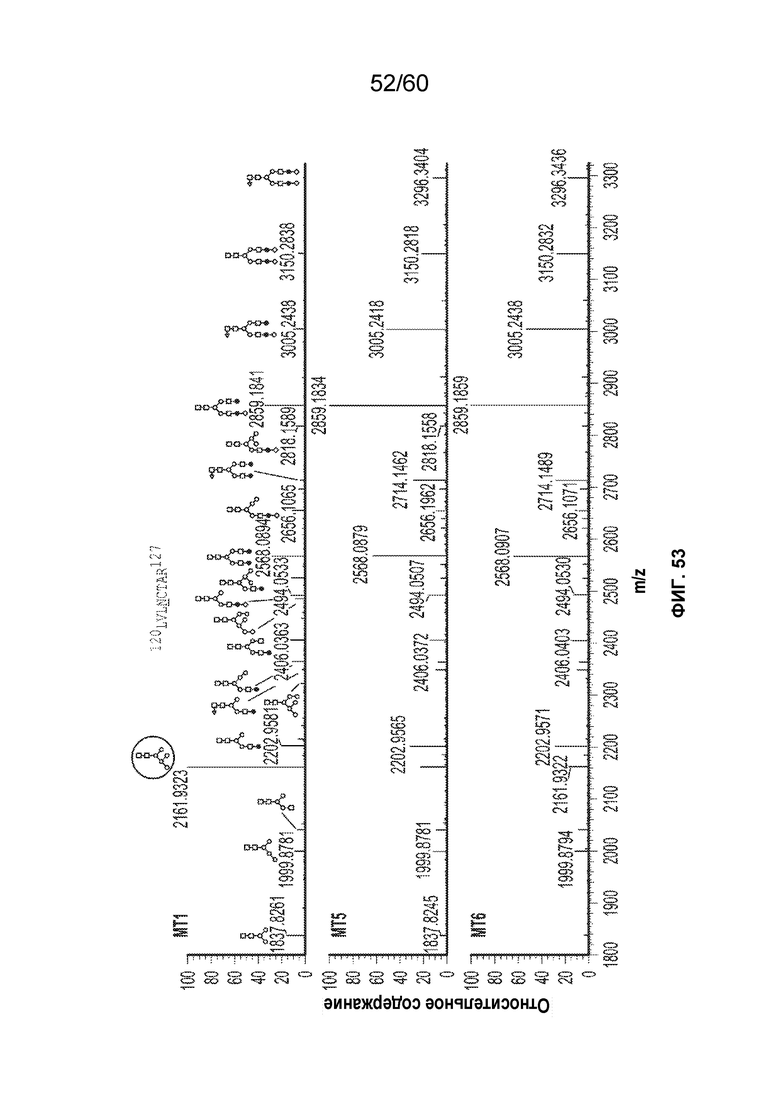
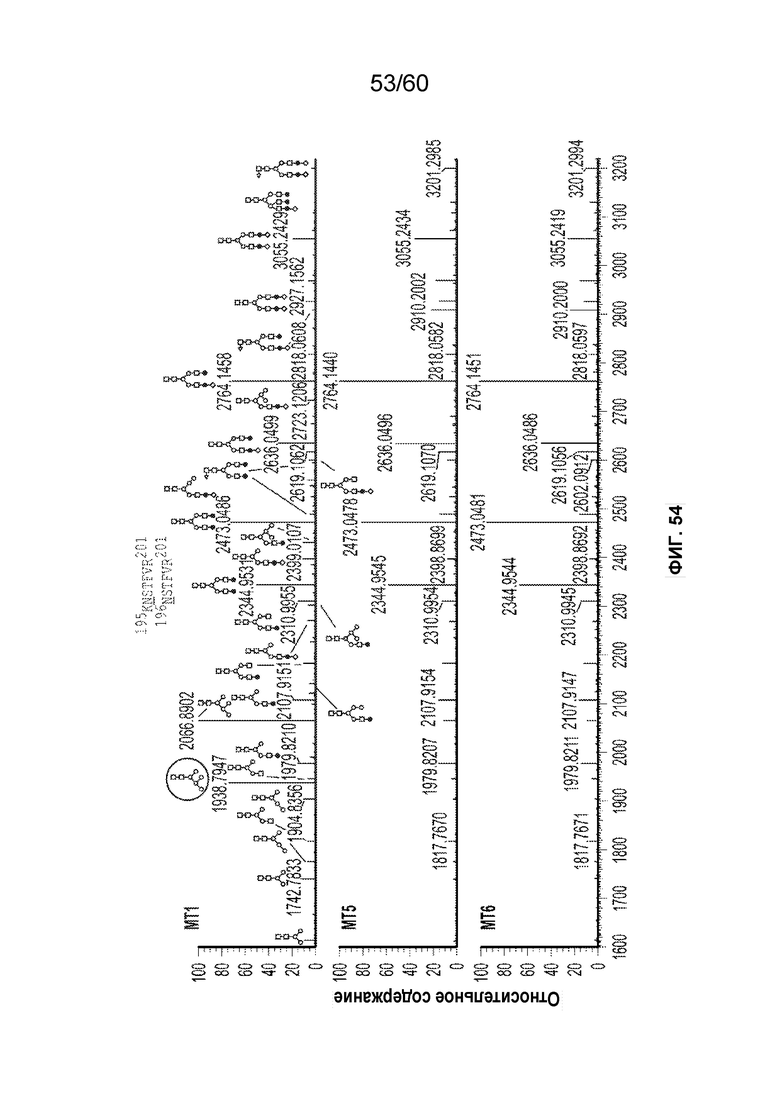
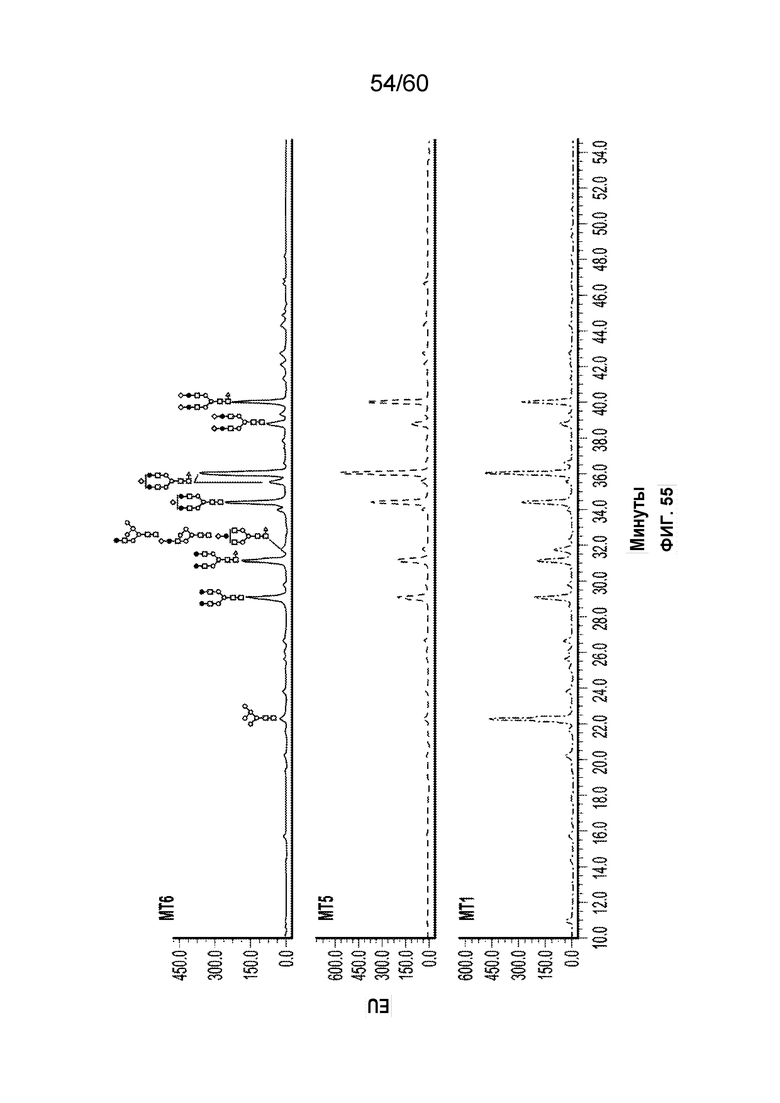

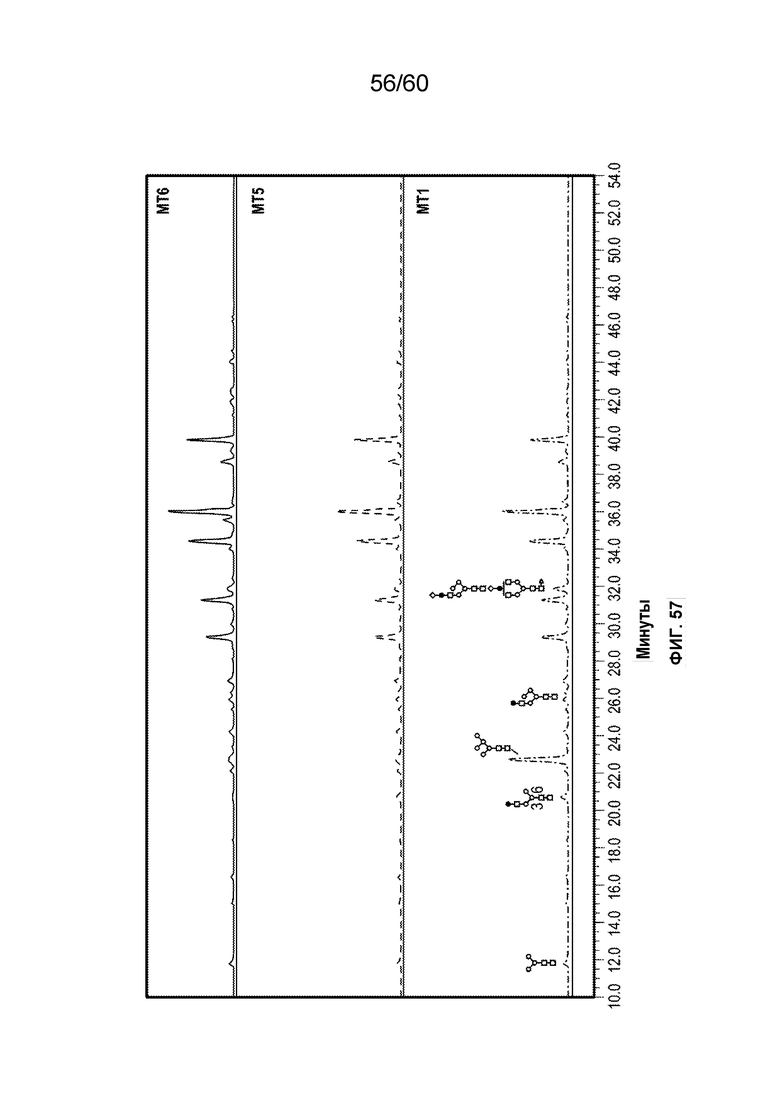
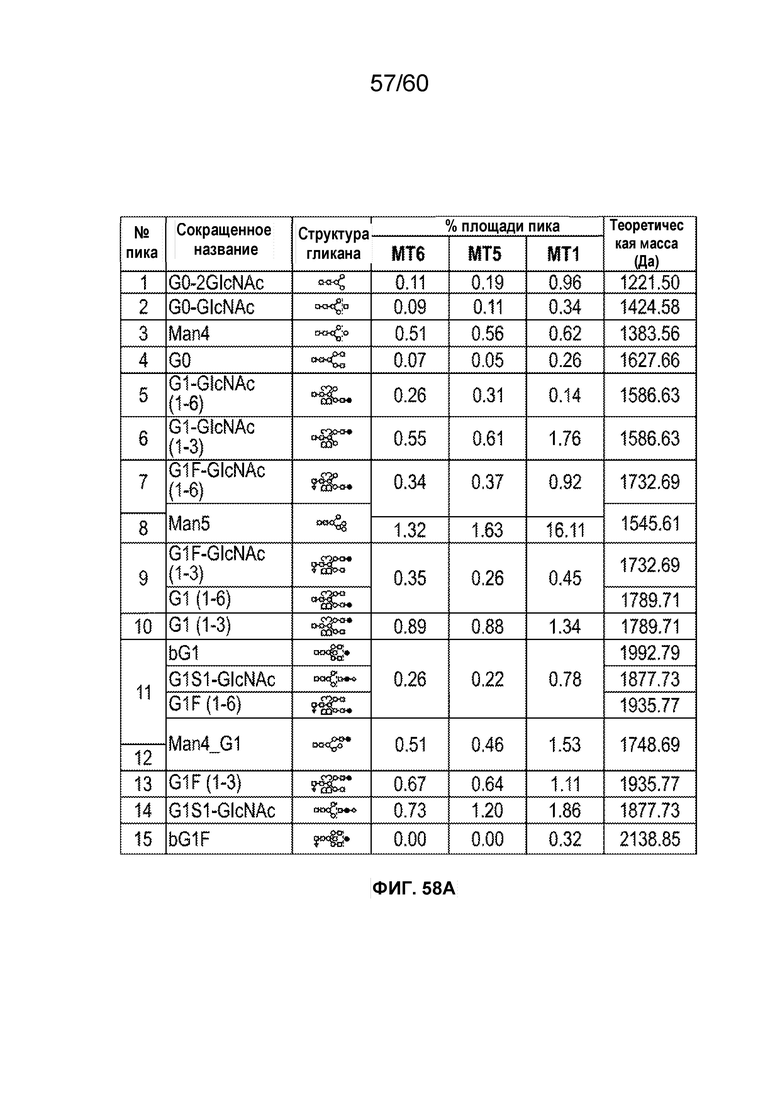
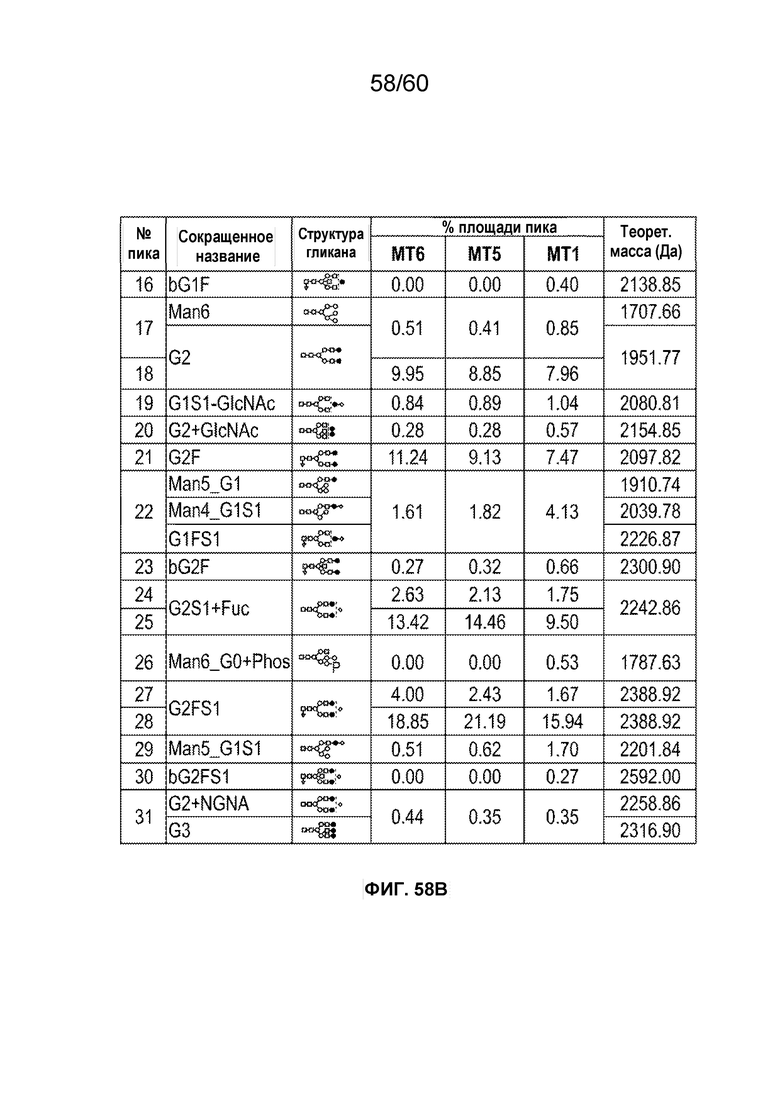
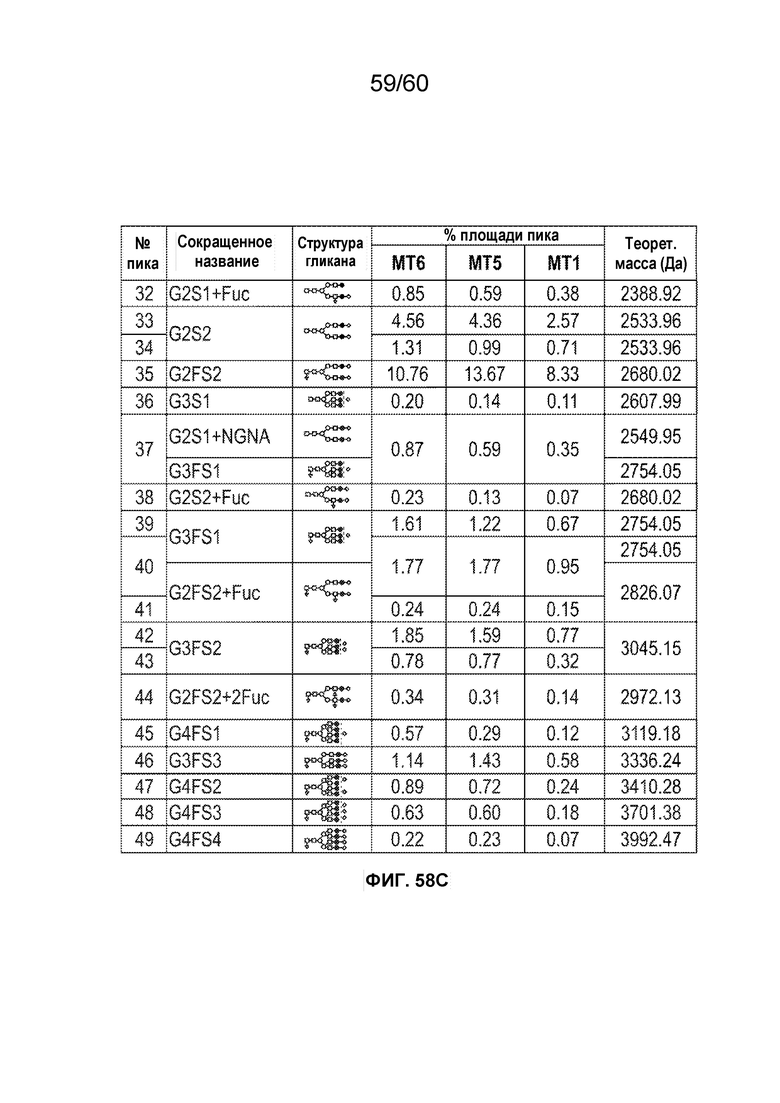
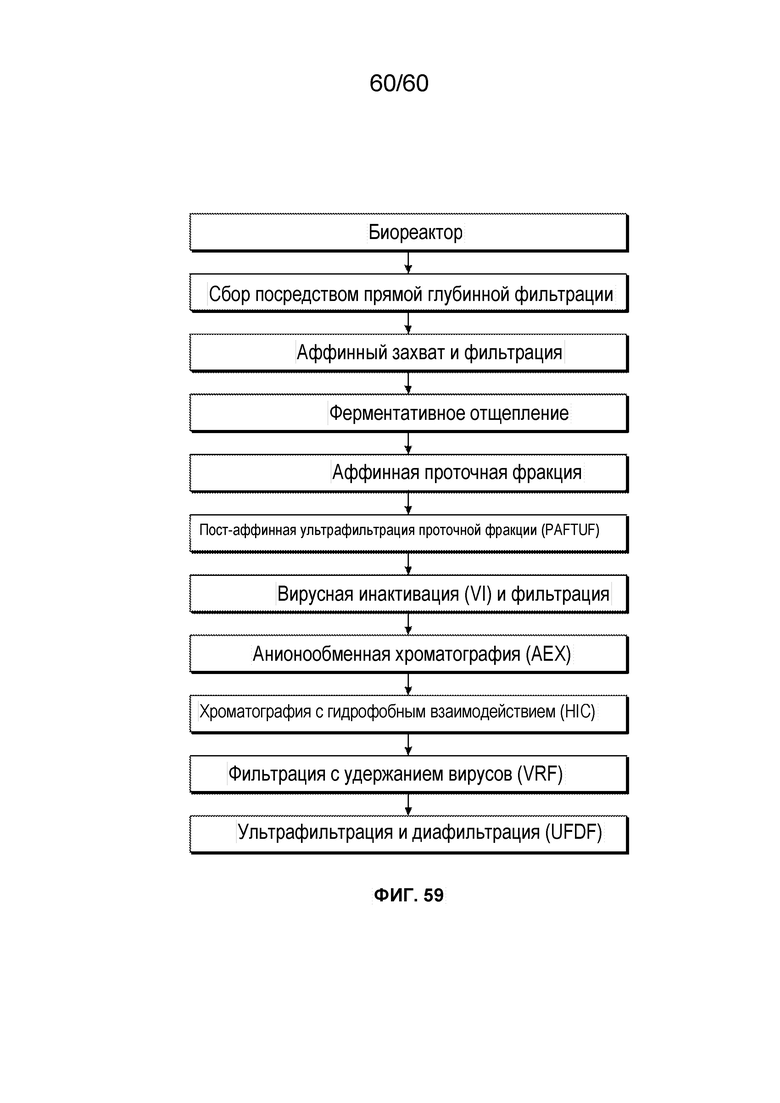
Изобретение относится к эффективным способам получения MiniTrap афлиберцепта из осветленного сбора клетки, культивированной в химически определенной среде (ХОС) и экспрессирующей афлиберцепт, которые обеспечивают снижение желто-коричневой окраски в ходе получения MiniTrap афлиберцепта. 4 н. и 24 з.п. ф-лы, 59 ил., 9 табл., 9 пр.
1. Способ получения MiniTrap афлиберцепта из осветленного сбора клетки, культивированной в химически определенной среде (ХОС) и экспрессирующей афлиберцепт, включающий:
(a) связывание афлиберцепта из указанного осветленного сбора с первой хроматографией для захвата;
(b) элюирование указанного афлиберцепта со стадии (a) и подвергание указанного афлиберцепта ферментативному расщеплению для удаления его домена Fc с образованием таким образом MiniTrap;
(c) подвергание продукта стадии (b) второй хроматографии для захвата, причем указанную стадию второй хроматографии для захвата подвергают одной или более промывкам, и при этом первая проточная фракция содержит MiniTrap и имеет первый цвет, при этом указанный первый цвет имеет значение b* в диапазоне от 1,5 до 15,0, если концентрация белка нормализована до 5,0 г/л;
(d) подвергание указанной первой проточной фракции со стадии (c) анионообменной хроматографии (AEX); и
(e) промывку указанной колонки AEX со стадии (d), причем указанный MiniTrap собирают во вторую проточную фракцию и он имеет второй цвет, причем указанный второй цвет имеет значение b* в диапазоне от 0,5 до 15,0, если концентрация белка нормализована до 5,0 г/л, и при этом указанный первый цвет представляет собой более интенсивный желто-коричневый цвет, чем указанный второй цвет.
2. Способ по п. 1, в котором указанные первая и вторая хроматографии для захвата содержат смолу с белком A.
3. Способ по п. 1, в котором указанная клетка выбрана из группы, состоящей из CHO, NSO, Sp2/0, эмбриональной клетки почки и BHK.
4. Способ по п. 1, в котором указанный осветленный сбор содержит один или более вариантов афлиберцепта, причем указанные варианты имеют по меньшей мере один окисленный аминокислотный остаток.
5. Способ по п. 4, в котором указанный окисленный аминокислотный остаток выбран из группы, состоящей из метионина, триптофана, гистидина, фенилаланина, тирозина и их комбинации.
6. Способ по п. 5, в котором указанный окисленный аминокислотный остаток представляет собой гистидин.
7. Способ по п. 5, в котором указанный окисленный аминокислотный остаток представляет собой триптофан.
8. Способ по п. 4, в котором указанный вариант афлиберцепта содержит пептид с аминокислотной последовательностью, выбранной из группы, состоящей из: SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71 и их комбинации.
9. Способ по п. 1, в котором указанная колонка AEX содержит анионообменный заместитель, включая группы диэтиламиноэтила (DEAE), четвертичного аминоэтила (QAE) и четвертичного амина (Q).
10. Способ по п. 1, который дополнительно включает после осветления сбора подвергание афлиберцепта одной или более дополнительным хроматографическим стадиям, выбранным из группы, состоящей из катионообменной хроматографии, хроматографии с гидрофобным взаимодействием, эксклюзионной хроматографии и их комбинации.
11. Способ получения MiniTrap афлиберцепта из осветленного сбора клетки, культивированной в химически определенной среде (ХОС), включающий:
(a) связывание афлиберцепта из указанного осветленного сбора с первой хроматографией для захвата;
(b) элюирование указанного афлиберцепта со стадии (a) и подвергание указанного афлиберцепта ферментативному расщеплению для удаления его домена Fc с образованием таким образом MiniTrap;
(c) подвергание продукта стадии (b) второй хроматографии для захвата, причем указанную стадию второй хроматографии для захвата подвергают одной или более промывкам, и при этом первая проточная фракция содержит MiniTrap, при этом указанный MiniTrap имеет одну или более кислотных форм;
(d) подвергание указанной первой проточной фракции со стадии (c) анионообменной хроматографии (AEX); и
(e) промывку указанной колонки AEX со стадии (d) и сбор во вторую проточную фракцию, причем процент кислотных форм MiniTrap в указанном аффинном элюате со стадии (b) превышает процент кислотных форм MiniTrap в указанной второй проточной фракции AEX, если концентрация белка в указанном элюате и проточной фракции AEX нормализована, причем указанные кислотные формы MiniTrap соответствуют пикам, которые элюируют раньше, чем главный пик в хроматограмме сильной катионообменной хроматографии (CEX) афлиберцепта, и при этом хроматограмма образована с использованием первой подвижной фазы 20 мМ 2-(N-морфолино)этансульфоновой кислоты (MES), pH 5,7, и второй подвижной фазы 40 мМ фосфат натрия, 100 мМ хлорида натрия, pH 9,0 (подвижная фаза B), и при этом хроматограмма образована с использованием обнаружения при 280 нм.
12. Способ по п. 11, в котором указанные первая и вторая хроматографии для захвата содержат смолу с белком A.
13. Способ по п. 11, в котором указанные проточные фракции AEX содержат менее 20% общего содержания кислотных форм MiniTrap.
14. Способ по п. 11, в котором указанные кислотные формы MiniTrap содержат по меньшей мере один окисленный аминокислотный остаток, выбранный из группы, состоящей из метионина, триптофана, гистидина, фенилаланина, тирозина их комбинации.
15. Способ по п. 11, в котором pH как указанного буфера для уравновешивания, так и промывочного буфера для указанной колонки AEX составляет от 8,30 до 8,60.
16. Способ по п. 11, в котором проводимость как указанного буфера для уравновешивания, так и промывочного буфера для указанной колонки AEX может составлять от 1,50 до 3,0 мСм/см.
17. Способ по п. 11, в котором в ферментативном расщеплении для удаления домена Fc от афлиберцепта для образования MiniTrap применяют протеолитическое расщепление с использованием протеазы или ее ферментативно активного варианта.
18. Способ по п. 17, в котором указанная протеаза представляет собой иммуноглобулинрасщепляющий фермент Streptococcus pyogenes (IdeS).
19. Способ по п. 18, который дополнительно включает после связывания афлиберцепта из указанного осветленного сбора подвергание афлиберцепта одной или более дополнительным хроматографическим стадиям, выбранным из группы, состоящей из катионообменной хроматографии (CEX), хроматографии с гидрофобным взаимодействием, эксклюзионной хроматографии и их комбинации.
20. Способ получение MiniTrap из осветленного сбора клетки, культивированной в химически определенной среде (ХОС), включающий:
(a) связывание афлиберцепта из указанного осветленного сбора в смоле с белком A;
(b) элюирование указанного афлиберцепта со стадии (a) и подвергание указанного афлиберцепта ферментативному расщеплению для удаления его домена Fc с образованием таким образом MiniTrap;
(c) подвергание продукта стадии (b) второй хроматографии для захвата, причем указанную стадию второй хроматографии для захвата подвергают одной или более промывкам, и при этом первая проточная фракция содержит MiniTrap, при этом указанный MiniTrap имеет одну или более окисленных форм MiniTrap;
(d) подвергание указанной первой проточной фракции со стадии (c) анионообменной хроматографии (AEX); и
(e) промывку указанной колонки AEX со стадии (d) с получением второй проточной фракции, причем процент окисленных форм MiniTrap в указанном аффинном элюате со стадии (b) превышает процент окисленных форм в указанной второй проточной фракции AEX, если концентрации белка в указанном элюате и проточной фракции нормализованы, и при этом указанные окисленные формы MiniTrap измеряют посредством подвергания указанного аффинного элюата и указанных проточных фракций расщеплению с последующим их анализом с использованием обращенно-фазовой ультрапроизводительной хроматографии (UPLC), детекции при длинах волн 280 нм, 320 нм и 350 нм и масс-спектрометрического анализа с использованием первой подвижной фазы 0,1% муравьиной кислоты в воде и второй подвижной фазы 0,1% муравьиной кислоты в ацетонитриле.
21. Способ по п. 20, в котором указанный окисленный аминокислотный остаток выбран из группы, состоящей из метионина, триптофана, гистидина, фенилаланина, тирозина и их комбинации.
22. Способ по п. 20, в котором указанный окисленный аминокислотный остаток содержит аминокислотную последовательность, указанную в группе, состоящей из: SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71 и их комбинации.
23. Способ получения MiniTrap из осветленного сбора клетки, культивированной в химически определенной среде (ХОС), включающий:
(a) связывание афлиберцепта из указанного осветленного сбора с первой хроматографией для захвата, причем указанная первая хроматография для захвата представляет собой смолу с белком A;
(b) элюирование указанного афлиберцепта со стадии (a) и подвергание указанного афлиберцепта ферментативному расщеплению для удаления его домена Fc с образованием таким образом MiniTrap;
(c) подвергание продукта стадии (b) второй хроматографии для захвата, причем указанную стадию второй хроматографии для захвата подвергают одной или более промывкам, и при этом первая проточная фракция содержит MiniTrap, при этом указанная проточная фракция имеет значение b* более 0,5, если концентрация белка нормализована до 5,0 г/л;
(d) подвергание указанной первой проточной фракции со стадии (c) анионообменной хроматографии (AEX); и
(e) промывку указанной колонки AEX со стадии (d), причем указанный MiniTrap собирают во вторую проточную фракцию и он имеет значение b*, и при этом указанное значение b* меньше значения b* на стадии (c), если концентрация белка нормализована до 5,0 г/л.
24. Способ по п. 23, в котором pH как указанного буфера для уравновешивания, так и промывочного буфера для колонки AEX может составлять от 7,0 до 8,6.
25. Способ по п. 23, в котором в ферментативном расщеплении для удаления домена Fc от афлиберцепта для образования MiniTrap применяют иммуноглобулинрасщепляющий фермент Streptococcus pyogenes (IdeS).
26. Способ по п. 25, в котором указанный IdeS представляет собой полипептид, имеющий аминокислотную последовательность, указанную в группе, состоящей из SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16 и их комбинации.
27. Способ по п. 23, в котором указанный осветленный сбор содержит один или более вариантов афлиберцепта, причем указанные варианты имеют по меньшей мере один окисленный аминокислотный остаток, выбранный из группы, состоящей из метионина, триптофана, гистидина, фенилаланина, тирозина и их комбинации.
28. Способ по п. 23, который дополнительно включает после связывания афлиберцепта из указанного осветленного сбора, подвергание афлиберцепта одной или более дополнительным хроматографическим стадиям, выбранным из группы, состоящей из катионообменной хроматографии, хроматографии с гидрофобным взаимодействием, эксклюзионной хроматографии и их комбинации.
| WO 2017168296 A1, 05.10.2017 | |||
| ИЗОЛИРОВАННАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩАЯ СЛИТЫЙ ПОЛИПЕПТИД, СПОСОБНЫЙ СВЯЗЫВАТЬ ФАКТОР РОСТА ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК СОСУДОВ (VEGF), СЛИТЫЙ ПОЛИПЕПТИД, РЕПЛИЦИРУЕМЫЙ ЭКСПРЕССИОННЫЙ ВЕКТОР, СПОСОБ ПОЛУЧЕНИЯ СЛИТОГО ПОЛИПЕПТИДА, ЛОВУШКА VEGF, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И НАБОР ДЛЯ ЛЕЧЕНИЯ VEGF-ОПОСРЕДОВАННОГО ЗАБОЛЕВАНИЯ ИЛИ СОСТОЯНИЯ | 2004 |
|
RU2376373C2 |
| WO 2014020160 A1, 06.02.2014 | |||
| US 20180072986 A1, 15.03.2018 | |||
| US 20180230210 A1, 16.08.2018 | |||
| US 20190298801 A1, 03.10.2019 | |||
| WO 2016128558 A1, 18.08.2016 | |||
| YAN AN et al | |||
| "A new tool for monoclonal antibody analysis : Application of IdeS proteolysis in IgG domain-specific characterization", | |||
Авторы
Даты
2022-12-15—Публикация
2020-08-18—Подача