Изобретение относится к области медицины и молекулярной биологии и может быть использовано в клинической практике для количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В).
ВГЧ-6В (Human betaherpesvirus 6В) - ДНК-содержащий вирус семейства Herpesviridae подсемейства Betaherpesvirinae рода Roseolavirus - является ближайшим генетическим родственником вируса герпеса человека 6А (ВГЧ-6A, Human betaherpesvirus 6А), а также цитомегаловируса человека (Human betaherpesvirus 5) и вируса герпеса человека 7 (Human betaherpesvirus 7). На текущий момент для ВГЧ-6А и ВГЧ-6В сохраняется общее название - вирус герпеса человека 6 (ВГЧ-6, ВГЧ-6А/В).
ВГЧ-6 впервые выделен в 1986 г. из В-лимфоцитов периферической крови ВИЧ-инфицированных больных неходжкинскими лимфомами. В 1992 г. предложено разделить ВГЧ-6 на два варианта (далее типа) А и В, которые в 2012 г. были классифицированы как отдельные виды: ВГЧ-6А и ВГЧ-6В. Установлено, что ВГЧ-6А и ВГЧ-6В способны эффективно интегрировать в теломеры хромосом клетки-хозяина как in vivo, так и in vitro, благодаря особенностям организации генома.
Вирус проявляет тропизм к широкому спектру клеток хозяина: Т-клетки, моноциты-макрофаги, гемопоэтические клетки костного мозга, эпителиальные клетки почек и слюнных желез, эндотелиальные клетки, клетки центральной нервной системы (микроглиальные клетки, олигодендроциты и астроциты). Для ВГЧ-6В, как и для других герпес-вирусов, характерна способность к персистенции и латенции в организме инфицированного человека. ВГЧ-6В-инфекция - антропоноз. Источником и резервуаром инфекции является человек, больной ВГЧ-6В-инфекцией, а также вирусоноситель.
Показана высокая патогенетическая значимость ВГЧ-6А/В: он может вызывать острые поражения кожи у детей раннего возраста (внезапная экзантема новорожденных), лихорадку новорожденных с судорожным синдромом, мононуклеозоподобный синдром; участвовать в развитии миалгического энцефаломиелита; у иммунокомпрометированных лиц - быть причиной лихорадки, пневмонии, гепатита, поражения центральной нервной системы. Доказано, что ВГЧ-6А/В может выступать и в качестве кофактора ВИЧ. Наряду с возникновением первичной инфекции, возможна реактивация вируса. Верификация диагноза ВГЧ-бВ-инфекции осуществляется только при лабораторном подтверждении.
ВГЧ-6В значительно чаще, чем ВГЧ-6А, вызывает острые инфекции у детей (внезапная экзантема, лихорадка без сыпи), а также ассоциирован с фебрильными судорогами и височной эпилепсией. К тому же ВГЧ-6В, в отличие от ВГЧ-6А, резистентен к противовирусному действию альфа- и бета-интерферонов.
ВГЧ-6А и ВГЧ-6В различаются по последовательности нуклеотидов, особенностям культивирования, эпидемиологическим данным. Нуклеотидные последовательности ВГЧ-6А и ВГЧ-6В совпадают в 75-95% в зависимости от сравниваемого гена. Вирусы используют разные клеточные рецепторы для проникновения: ВГЧ-6А CD46, ВГЧ-6В CD134. Эти различия могут объяснять различную тропность вирусов к тканям и отличающийся спектр патологии.
С каждым годом сведения о различиях между ВГЧ-6А и ВГЧ-6В обновляются, чаще для дифференциации ВГЧ-6А и ВГЧ-6В используются молекулярно-биологические методы: ПЦР и секвенирование.
Известен способ дифференциации ВГЧ-6А и ВГЧ-6В [Патент JP 2003135100, дата подачи 26.07.2002] на основе разницы длин амплифицируемых фрагментов для различных подтипов с последующей электрофоретической детекцией. Для анализа выбран ген U89/90, отличающийся наличием инсерций размером 108 и 228 п.н. для ВГЧ-6В относительно ВГЧ-6А. Недостатком способа является использование для анализа электрофоретической детекции и вариабельность размеров инсерций.
Для обнаружения ВГЧ-6В используют различные методы для дискриминации аллельных вариантов: на основе лигирования [Landegren U., et al. A Ligase-Mediated Gene Detection Technique// Science. - 1988. - Vol.241. - P. 1077-1080], масс-спектроскопии [Griffin T. J., et al. Direct genetic analysis by matrix-assisted laser desorptiony/ionization mass spectrometry // Proc. Natl. Acad. Sci. - 1999. - Vol.25. - P. 6301-6306]; ДНК-микрочипа [Wang D.G, et al. Large-Scale Identification, Mapping, and Genotyping of Single-Nucleotide Polymorphisms in the Human Genome // Science. - 1998 - Vol.280. - P. 1077-1082]; анализа длин рестрикционных фрагментов [Saiki R.K., et al. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia // Science. - 1985. - Vol.230. - No. 4732. - P. 1350-1354]; зондов типа TaqMan [Livak K.J., et al. 12 Oligonucleotides with Fluorescent Dyes at Ends Provide a Quenched Probe System Useful for Detecting PCR Product and Nucleic Acid Hybridization // PCR Wethods Appl. 1995. Vol.4. P. 357-362]; анализа кривой плавления [Ririe К. M., et al. Product Differentiation by Analysis of DNA Melting Curves during the Polymerase Chain Reaction//Anal. Biochem. 1997. Vol.245 P. 154-160].
Из уровня техники известен зонд для обнаружения герпес вируса человека типа 6А и/или 6В (патент JP 2018085961, дата подачи 29.11.2016), который применяют в наборе для проведения ПЦР в режиме реального времени, при этом тип флуоресцентного красителя, содержащегося в зонде для обнаружения HHV6 типа В, отличается от типа флуоресцентного красителя, которым обладает зонд для обнаружения HHV типа 6В.
При практической реализации упомянутого решения наблюдалось достаточно большое количество ложноположительных результатов, что является его недостатком.
Также из уровня техники известен способ идентификации вариантов А и В вируса герпеса человека 6-го типа (патент RU 2627607, дата приоритета 28.09.2016), который позволяет определять специфические для ВГЧ-6А и ВГЧ-6В однонуклеотидные полиморфизмы в гене U67 ВГЧ-6 методом ПЦР в формате реального времени с использованием праймеров HHV6F 5'-CGGATACAGTAAGACGGGATAT-3' и HHV6R 5'-ACGTAAGCTTGCACAATGC-3' и двух флуоресцентно меченных зондов HHV6AZ F1-GCAATAGATTTGGAAACGCGGCAT-Q1 и HHV6BZ F2-GCAATAGATTCGGAAATGCGGCAT-Q2, где о наличии ВГЧ-6А или ВГЧ-6В судят в случае регистрации экспоненциального накопления сигнала флуоресценции в соответствующих зондам каналах. Данный способ основан на определении однонуклеотидных полиморфизмов в гене U67 и не содержит данных о его чувствительности.
Упомянутые выше решения относятся к методам только качественного определения ВГЧ-6А, тогда как вирусная нагрузка и активность инфекционного процесса характеризуется посредством количественного определения ДНК возбудителя. Именно количественное определение ДНК вируса герпеса человека позволяет назначать адекватную противовирусную терапию, а, при необходимости, снизить лекарственную нагрузку на организм, своевременно определять оптимальную тактику ведения пациента.
Из уровня техники известен набор для определения абсолютной количественной типизации для цифровой ПЦР и способ обнаружения HHV-6A/6B (патент CN 104975113, дата подачи 31.07.2015), где набор включает раствор для экстракции ДНК, цифровой буфер реакции ПЦР А, цифровой буфер реакции ПЦР В, контроль положительного качества на вирусный ген HHV-6A, контроль качества положительного вируса на HHV-6В, контроль отрицательного качества на вирусном гене HHV-6A / 6В и внутренний контроль качества, стандартное решение. Способ обнаружения включает следующие этапы: 1) обработка обнаруженного образца; 2) лечение продукта контроля качества; 3) приготовление реакционного смесительного раствора для ПЦР; 4) генерирование капель микрореакции и усиление реакции цифровой ПЦР; и 5) считывание флуоресцентного сигнала, анализ типа HHV и подсчет числа копий. В соответствии с изобретением применяются цифровая технология ПЦР и двухцветный флуоресцентный зонд, два подтипа HHV-6 обнаруживаются одновременно.
Недостатком указанного решения является применение только контроля качества, который не позволяет в полной мере определять причину получения ложноположительных или ложноотрицательных результатов ПЦР-исследования.
Также известен набор для обнаружения расщепления флуоресцентной количественной ПЦР в реальном времени для герпесвируса-6 человека (HHV-6) (патент CN 103820574, дата подачи 21.01.2014). Набор состоит из реакционной жидкости для количественной ПЦР, стандартного вещества HHV-6A, стандартного вещества HHV-6B, положительного эталонного вещества HHV-6A, положительного эталонного вещества HHV-6B, отрицательного эталона вещество. При этом раствор для ПЦР содержит буферный раствор для ПЦР, MgCl2, dNTP, термостойкую ДНК-полимеразу, праймер для амплификации в восходящем направлении, праймер для амплификации в нисходящем направлении, флуоресцентный зонд HHV-6A и HHV-6В флуоресцентный зонд.
Указанный набор не содержит систему внутренних контролей качества прохождения ПЦР, что не позволяет оценить адекватность получаемых результатов.
Несмотря на то, что спрос на быстрые, производительные, недорогие тесты для определения ДНК различных инфекционных агентов привел к развитию различных лабораторных методик, существует потребность в расширении точного диагностического решения, позволяющего в короткие сроки и с наименьшими затратами идентифицировать различные виды вируса герпеса человека, в частности ВГЧ-6В, и измерять вирусную нагрузку посредством количественного определения ДНК.
Задачей заявляемого решения является создание способа, позволяющего определить наличие, вид и количество ДНК ВГЧ-6В в образцах биологического материала путем определения линейной зависимости между логарифмом исходной концентрации ДНК-мишени в исследуемом образце и циклом начала экспоненциального увеличения флуоресцентного сигнала, а также создание набора олигонуклеотидных праймеров и зонда для осуществления заявляемого способа.
Технический результат заявляемого изобретения направлен на определение ДНК ВГЧ-6В с высокой степенью специфичности в образцах биологического материала посредством такого набора олигонуклеотидов - праймеров и флоуресцентного зонда, который позволяет эффективно проводить видовую идентификацию вируса с использованием широко распространенных методик и доступных материалов, а также определять его количество.
Технический результат достигается за счет применения в способе набора химически-синтезированных олигонуклеотидов для определения ДНК ВГЧ-6В в образце биологического материала, имеющих следующий нуклеотидный состав:
прямой праймер HHV-6A/B-for - SEQ ID NO: 1;
обратный праймер HHV-6A/B-rev SEQ ID NO: 2;
флуоресцентно-меченый зонд HHV-6B-probe SEQ ID NO: 3.
Праймеры представляют собой последовательности олигонуклеотидов для амплификации участка гена U31, флоуресцентный зонд является олигонуклеотидом, содержащим флуорофор и гаситель флуоресценции, позволяющим детектировать амплифицированный фрагмент.
Способ включает систему внутренних контролей, необходимых для обнаружения потенциальных ошибок ПЦР-исследования, которые могли бы привести к получению ложноположительных или ложноотрицательных результатов для каждого исследуемого образца. Система внутреннего контроля состоит из эндогенного и экзогенного внутренних контрольных образцов (ВКО).
Эндогенный внутренний контроль (эндогенный ВКО) представляет собой фрагмент β-глобинового гена человека и позволяет оценивать проведение преаналитического этапа ПЦР-исследования. Эндогенный ВКО подобран таким образом, что он всегда содержится в биологическом материале человека.
Экзогенный внутренний контрольный образец (экзогенный ВКО) представляет собой искусственно сконструированную уникальную последовательность и позволяет учитывать потери ДНК в процессе экстракции, а так же оценивать влияние интерферирующих веществ на результаты ПЦР-исследования. Экзогенный ВКО добавляется в каждый исследуемый образец биологического материала на этапе экстракции.
Количественное определение ДНК ВГЧ-6В основывается на существовании линейной зависимости между логарифмом исходной концентрации ДНК-мишени в исследуемом образце и циклом начала экспоненциального увеличения флуоресцентного сигнала (пороговый цикл, Cycle threshold, Ct). По результатам амплификации ДНК-калибраторов строится калибровочная линия, по которой происходит определение концентрации ДНК-мишени в исследуемых образцах.
Набор олигонуклеотидных праймеров и зонда для осуществления заявляемого способа разработан на основе известной последовательности гена U31 Human betaherpesvirus 6В (референс-геном эталонного экзогенного штамма Human betaherpesvirus 6В HST, АВ021506.1), представленной в базе данных National Center for Biotechnology Information (NCBI) [https://www.ncbi.nlm.nih.gov/nuccore/ AB021506.1].
К выбранному фрагменту подобраны праймеры и зонд для определения фрагмента размером 200 п.н.: прямой праймер HHV-6A/B-for SEQ ID NO: 1; обратный праймер HHV-6A/B-rev SEQ ID NO: 2 и флуоресцентный зонд HHV-6B-probe SEQ ID NO: 3.
Заявляемое изобретение является результатом исследования, проведенного в ФБУН ЦНИИ Эпидемиологии Роспотребнадзора (Москва, Россия) в рамках выполнения работы по совершенствованию диагностики герпес-вирусных заболеваний человека.
Для подбора последовательностей-мишеней - мест посадки олигонуклеотидов, использовали последовательности фрагмента гена U31 штаммов/изолятов ВГЧ-6В Human betaherpesvirus 6В, представленных в базе данных National Center for Biotechnology Information (NCBI) [http://www.ncbi.nlm.nih.gov]. Для поиска консервативных последовательностей применяли современные алгоритмы in silico анализа нуклеотидных последовательностей и программы, находящиеся в открытом доступе, включая Mega, олиго калькуляторы (Oligo Calculators) «Thermo Fisher Scientific)) (США). Составляли перечень уникальных последовательностей, характерных для ВГЧ-6В. Затем подбирали олигонуклеотидные последовательности прямого и обратного праймеров, а также флуоресцентно-меченого зонда. Упомянутые последовательности набора олигонуклеотидных праймеров и зонда приведены в Таблице 1.
Анализ упомянутых последовательностей с использованием ресурса Primer BLAST показал, что при использовании прямого праймера HHV-6A/B-for (SEQ ID NO: 1), обратного праймера HHV-6A/B-rev (SEQ ID NO: 2) и флуоресцентного зонда HHV-6B-probe - SEQ ID NO: 3, выявляется участок ВГЧ-6В со 100% специфичностью.

Где Fx - флуорофор, Q - гаситель флуоресценции, соответствующий красителю канала флуорофора.
В качестве образцов биологического материала для исследования предпочтительно использовать: цельную кровь, мазки со слизистой оболочки ротоглотки, волосяные фолликулы, ногтевые пластины, мочу.
ПЦР-исследование проводили в соответствии с МУ 1.3.2569-09 «Организация работ лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности». Для экстракции ДНК может быть использован комплект реагентов «РИБО-преп» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) или любой аналогичный набор/комплект реагентов для выделения ДНК, с добавлением экзогенного ВКО, например, BKO-FL (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) в соответствии с инструкцией производителя.
ПЦР-РВ проводят с применением заявляемого набора олигонуклеотидов -праймеров и зонда, представленных в Таблице 1, при следующих условиях:
Общий объем реакционной смеси, содержащей ДНК, экстрагированной из образцов биологического материала - 25 мкл.
Компоненты смешиваются следующим образом:
(a) 10 мкл смеси, содержащей:
- олигонуклеотидные праймеры SEQ ID NO: 1, 2 - по 0,6 пмоль/мкл;
- флуоресцентный зонд SEQ ID NO: 3-0,15 пмоль/мкл;
- dNTPs - 0,44 мМ.
(b) ПЦР-буфер, содержащий MgCl2 и рекомбинантный фермент Taq ДНК-полимеразу, например, 5 мкл ПЦР-буфер-Н (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) или любого аналогичного коммерческого реагента в соответствии с инструкцией производителя.
(c) олигонуклеотидные праймеры и зонд для определения эндогенного ВКО, например, Glob 1, 2, 3 (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) или любой аналогичный коммерческий набор реагентов в соответствии с инструкцией производителя;
(d) олигонуклеотидные праймеры и зонд для определения экзогенного ВКО, например, VKO 1, 2, 3 ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) или любой аналогичный коммерческий набор реагентов в соответствии с инструкцией производителя;
е) ДНК, экстрагированная из образцов биологического материала - 10 мкл.
Для проведения количественного теста амплификацию ДНК из исследуемых образцов проводят одновременно с образцами с известной концентрацией ДНК ДНК-калибраторами: К1 и К2, которые представляют собой образцы с известной концентрацией ДНК в разных степенях разведения 105 и 102 копий/реакцию, соответственно для искомой мишени и внутренних контролей, достаточной для построения калибровочной прямой и расчета получаемых значений концентрации ДНК выявляемого вируса и системы внутренних контролей.
Общий объем реакционных смесей, содержащих ДНК-калибраторы, составляет 25 мкл каждая. Компоненты для реакционных смесей смешиваются как описано в пунктах (а) - (d), при этом для смеси, содержащей ДНК-калибратор К1, добавляют образцы с известной концентрацией ДНК-мишени, ДНК экзогенного и эндогенного ВКО в концентрации 105 копий/реакцию в объеме 10 мкл, а в смесь, содержащую ДНК-калибратор К2, добавляют 10 мкл образцов с известной концентрацией ДНК-мишени, ДНК экзогенного и эндогенного ВКО в концентрации 102 копий/реакцию.
Постановку и анализ результатов амплификации проводят на приборе с системой детекции флуоресцентного сигнала в режиме «реального времени», например, Rotor-Gene Q («Qiagen», Германия) в соответствии с инструкцией производителя или аналогичном.
Амплификацию проводят по следующей программе: 1 цикл 95°С в течение 15 минут, затем 45 циклов при температуре 95°С - 10 секунд / 60°С - 20 сек. Детекция флуоресценции по используемым каналам проводится на этапе 60°С.
Анализ полученных результатов проводят с помощью программного обеспечения прибора, используемого для проведения ПЦР-РВ.
Анализируют кривые накопления флуоресцентного сигнала по 3 каналам (таблица 2):

Для анализа результатов задают пороговую линию, соответствующую величине 0,03. Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флуоресценции S-образной (сигмообразной) формы с установленной на соответствующем уровне пороговой линией. Это определяет наличие или отсутствие для анализируемой пробы ДНК значения порогового цикла. Образцы, для которых по каналу для флуорофора Fx кривые флуоресценции пересекают пороговую линию, и при этом кинетика накопления флуоресцентного сигнала является экспоненциальной, являются положительными, то есть содержат ДНК ВГЧ-6В.
На основании полученных значений порогового цикла и исходя из заданных значений концентраций для ДНК-калибраторов К1 и К2 происходит автоматическое (посредством программного обеспечения прибора) построение калибровочной прямой и расчет значений концентраций ДНК выявляемого вируса ВГЧ-6В, экзогенного ВКО и эндогенного ВКО в копиях/реакцию. Полученные значения используются для расчета количества копий ДНК выявляемого вируса в 1 мл исследуемых и контрольных образцов, расчет производят по формуле 1.
Формула 1:

где:
А коэффициент, учитывающий объем экстракции, рассчитывается по формуле 2.
Формула 2:

В коэффициент, учитывающий потери ДНК в процессе экстракции, число копий экзогенного ВКО в 1 мл исследуемого материала.
Полученное значение концентрации ДНК ВГЧ-6В может быть нормировано на 100000 клеток человека. Расчет нормированных значений концентрации ДНК ВГЧ-6В производят согласно формуле 3.
Формула 3:

клеток человека)
Нормированные значения концентраций отражают количество клеток возбудителя относительно клеток человека.
Для выражения относительной концентрации ДНК выявляемого вируса в lg копий на стандартное количество клеток используется коэффициент пересчета по формуле 4.
Формула 4:
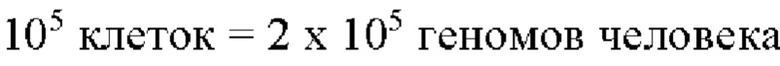
Реализация заявляемого изобретения поясняется следующими примерами:
Пример 1. Получение набора олигонуклеотидных праймеров и зонда для количественного определения ДНК ВГЧ-6В
Для подбора последовательностей-мишеней - мест посадки олигонуклеотидов, использовали последовательности фрагмента гена U31 штаммов/изолятов ВГЧ-6В Human betaherpesvirus 6В, представленных в базе данных National Center for Biotechnology Information (NCBI) [http://www.ncbi.nlm.nih.gov]. Для поиска консервативных последовательностей применили современные алгоритмы in silico анализа нуклеотидных последовательностей и программы, находящиеся в открытом доступе, включая Mega, олиго калькуляторы (Oligo Calculators) «Thermo Fisher Scientific)) (США). Составили перечень уникальных последовательностей, характерных для ВГЧ-6В, к которым подобрали уникальные олигонуклеотидные последовательности прямого HHV-6A/B-for и обратного HHV-6A/B-rev праймеров, а также флуоресцентный зонд HHV-6B-probe.
Анализ упомянутых последовательностей с использованием ресурса Primer BLAST показал, что при использовании данного набора олигонуклеотидных праймеров и флуоресцентного зонда выявляется участок ДНК ВГЧ-6В со 100% специфичностью.
Набор олигонуклеотидных праймеров и зонда для количественного определения ДНК ВГЧ-6В прямой праймер HHV-6A/B-for, обратный праймер HHV-6A/B-rev, флуоресцентный зонд HHV-6B-probe, представлен уникальными последовательностями SEQ ID NO NO: 1-3 соответственно.
Пример 2. Условия проведения ПЦР-РВ для количественного определения ДНК ВГЧ-6В
Количественное определение ДНК ВГЧ-6В проводили методом ПЦР-РВ при следующих условиях:
Общий объем реакционной смеси, содержащей ДНК, экстрагированной из образцов биологического материала, - 25 мкл.
Компоненты ПЦР смешивали следующим образом:
(a) 10 мкл смеси, содержащей:
- олигонуклеотидные праймеры SEQ ID NO: 1, 2 - по 0,6 пмоль/мкл;
- флуоресцентный зонд SEQ ID NO: 3 - 0,15 пмоль/мкл;
- dNTPs - 0,44 мМ.
(b) 5 мкл ПЦР-буфер-Н (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия), содержащего MgCl2, рекомбинантный фермент Taq ДНК-полимеразу.
(c) олигонуклеотидные праймеры и зонд для определения эндогенного ВКО:
- олигонуклеотидные праймеры Glob 1, 2 (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) - по 0,3 пмоль/мкл;
- флуоресцентный зонд Glob 3 (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) - 0,15 пмоль/мкл.
(d) олигонуклеотидные праймеры и зонд для определения экзогенного ВКО:
- олигонуклеотидные праймеры VKO 1, 2 (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) - по 0,3 пмоль/мкл;
- флуоресцентный зонд VKO 3 (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) - 0,15 пмоль/мкл;
е) ДНК, экстрагированная из образцов биологического материала - 10 мкл.
Компоненты для реакционной смеси, содержащей ДНК-калибратор К1, смешивали как указано в пунктах (a) (d), а также добавили ДНК-калибратор К1 в концентрации 105 копий/реакцию в объеме 10 мкл.
Компоненты для реакционной смеси, содержащей ДНК-калибратор К2, смешивали как указано в пунктах (а) - (d), а также добавили 10 мкл ДНК-калибратора К2 в концентрации 102 копий/реакцию.
Подготовленный описанным способом материал, содержащий набор олигонуклеотидных праймеров и зонда с уникальными последовательностями SEQ ID NO: 13 использовали для количественного определения ДНК ВГЧ-6В в образцах биологического материала.
Постановку и анализ результатов амплификации проводили на приборе с системой детекции флуоресцентного сигнала в режиме «реального времени» Rotor-Gene Q («Qiagen», Германия) в соответствии с инструкцией производителя.
Пример 3. Количественное определение ДНК ВГЧ-6В в образцах биологического материала
На этапе апробации заявляемого способа использовалась панель контрольных биологических образцов пациентов с ВГЧ-6А/В-инфекцией или с установленным наследуемым хромосомно-интегрируемым ВГЧ-6А/В-статусом, условно-здоровых доноров крови, представляющая собой 16 зашифрованных проб: 8 положительных и 8 отрицательных. Положительные пробы образцы биологического материала, содержащие ДНК ВГЧ-6В в концентрации от 104 до 106 копий/мл. Отрицательные - образцы биологического материала, не содержащие ДНК ВГЧ-6В.
Для положительных образцов наличие ДНК ВГЧ-6В подтверждено с помощью метода прямого секвенирования нуклеотидных последовательностей (по Сэнгеру), которое выполнялось на анализаторе ABI 3500xL («Applied Biosystems», США) в соответствии с инструкцией производителя. Выравнивание и анализ полученных последовательностей осуществляли с помощью программы AlignX («Thermo Fisher Scientific)), США). Количественное определение ДНК ВГЧ-6А/В (без видовой дифференциации) проводили с использованием набора реагентов «АмплиСенс® HHV6-скрин-титр-FL» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия).
ПЦР-исследование проводили в соответствии с МУ 1.3.2569-09 «Организация работ лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности». Для экстракции ДНК использовали набор реагентов «РИБО-преп» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) в соответствии с инструкцией производителя. В качестве экзогенного ВКО использовали BKO-FL (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) в соответствии с инструкцией производителя.
ПЦР-РВ проводили в условиях, описанных в Примере 2, с использованием набора олигонуклеотидных праймеров и зонда с уникальными последовательностями SEQ ID NO: 1-3.
Амплификацию проводили по следующей программе: 1 цикл 95°С в течение 15 минут, 45 циклов при температуре 95°С - 10 секунд / 60°С - 20 сек. Детекцию флуоресценции проводили на этапе 60°С по каналам для флуорофоров: для ДНК искомой мишени ВГЧ-6В ROX, для ДНК экзогенного ВКО Су5, для ДНК эндогенного ВКО FAM. Для анализа результатов задали пороговую линию, соответствующую величине 0,03. Для 8 образцов по каналу для флуорофора ROX кривая флуоресценции пересекла пороговую линию и, при этом кинетика накопления флуоресцентного сигнала была экспоненциальной, что свидетельствовало о том, что данные образцы содержали ДНК ВГЧ-6В. По каналам для флуорофоров Су5, FAM кривая флуоресценции пересекла пороговую линию и, при этом кинетика накопления флуоресцентного сигнала была экспоненциальной, для всех 16 образцов, что свидетельствовало о том, что данные образцы содержат ДНК экзогенного ВКО и эндогенного ВКО.
На основании полученных значений порогового цикла и исходя из заданных значений концентраций для ДНК-калибраторов: K1 - 105 копий/реакцию и К2 - 102 копий/реакцию; автоматически (посредством программного обеспечения прибора) построена калибровочная прямая и проведен расчет значений концентраций ДНК выявляемого вируса ВГЧ-6В, экзогенного ВКО и эндогенного ВКО в копиях/реакцию. Полученные значения использовались для расчета количества копий ДНК выявляемого вируса в 1 мл исследуемых образцов. Расчет произведен по формулам 14. Результаты расчета представлены в таблице 3.

Полученные результаты коррелировали в пределах допустимых погрешностей используемого метода ПЦР-РВ с первоначально заданными параметрами.
Таким образом, заявляемое изобретение позволяет со 100% специфичностью проводить видовую идентификацию вируса герпеса человека 6В (ВГЧ-6В) с одновременной количественной оценкой получаемого результата.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ количественного определения ДНК вируса герпеса человека 6А (ВГЧ-6А) и ДНК вируса герпеса человека 6В (ВГЧ-6В) и набор олигонуклеотидных праймеров и зонда для его реализации | 2022 |
|
RU2800731C1 |
| Способ количественного определения ДНК вируса герпеса человека 6А (ВГЧ-6А) и набор олигонуклеотидных праймеров и зонда для его реализации | 2022 |
|
RU2802931C1 |
| Набор олигонуклеотидных праймеров и зондов для видовой дифференциации вируса герпеса человека 6А и вируса герпеса человека 6В и способ его применения | 2022 |
|
RU2806427C1 |
| Набор олигонуклеотидных праймеров и зонда для выявления вируса герпеса человека 6В | 2022 |
|
RU2802953C1 |
| Набор олигонуклеотидных праймеров и зонда для выявления вируса герпеса человека 6А | 2022 |
|
RU2806428C1 |
| Способ выявления и лабораторного подтверждения наследуемого хромосомно-интегрируемого вируса герпеса человека 6A/B | 2020 |
|
RU2739997C1 |
| Способ идентификации вариантов А и В вируса герпеса человека 6-го типа | 2016 |
|
RU2627607C1 |
| Способ количественной оценки резервуара ВИЧ и ДНК-калибратор для его осуществления | 2021 |
|
RU2787587C2 |
| Способ экстракции нуклеиновых кислот из ногтевых пластин | 2020 |
|
RU2751244C1 |
| Способ генотипирования гена TLR2 по полиморфизму rs3804100 и набор олигонуклеотидных праймеров и зондов для его реализации | 2023 |
|
RU2805860C1 |
Изобретение относится к области медицины, биотехнологии и молекулярной биологии. Представленная группа изобретений состоит из способа количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) и набора. Способ включает экстракцию ДНК из образца биологического материала, проведение реакции ПЦР в режиме реального времени с использованием набора олигонуклеотидных праймеров и зонда SEQ ID NO: 1–3 и ДНК-калибраторов с известной концентрацией, амплификацию, анализ и интерпретацию результатов путем построения калибровочной прямой и определения концентрации ДНК-мишени в исследуемом образце. Набор имеет следующий нуклеотидный состав: набор олигонуклеотидных праймеров и зонда для реализации способа количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В), имеющий следующий нуклеотидный состав: прямой праймер HHV-6A/B-for – SEQ ID NO: 1; обратный праймер HHV-6A/B-rev – SEQ ID NO: 2; флуоресцентный зонд HHV-6В-probe – SEQ ID NO: 3. Представленная группа изобретений позволяет со 100% специфичностью проводить видовую идентификацию вирусов герпеса человека 6В (ВГЧ-6В) с одновременной количественной оценкой получаемого результата. 2 н. и 8 з.п. ф-лы, 3 табл., 3 пр.
1. Способ количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В), включающий экстракцию ДНК из образца биологического материала, проведение реакции ПЦР в режиме реального времени с использованием набора олигонуклеотидных праймеров и зонда SEQ ID NO: 1–3 и ДНК-калибраторов с известной концентрацией, амплификацию, анализ и интерпретацию результатов путем построения калибровочной прямой и определения концентрации ДНК-мишени в исследуемом образце.
2. Способ количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) по п. 1, где экстракцию ДНК из образца биологического материала производят с применением эндогенного внутреннего контрольного образца и экзогенного внутреннего контрольного образца.
3. Способ количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) по п. 2, где эндогенный внутренний контроль представляет собой фрагмент β-глобинового гена человека.
4. Способ количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) по п. 2, где экзогенный внутренний контрольный образец представляет собой искусственно сконструированную уникальную последовательность.
5. Способ количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) по п. 1, где один из ДНК-калибраторов имеет разведение 105 копий/реакцию.
6. Способ количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) по п. 1, где один из ДНК-калибраторов имеет разведение 102 копий/реакцию.
7. Способ количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) по п. 1, где построение калибровочной прямой происходит на основании полученных значений порогового цикла и исходя из заданных значений концентраций для ДНК-калибраторов.
8. Способ количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) по п. 1, где концентрацию ДНК-мишени в исследуемом образце рассчитывают на основании полученных значений концентраций ДНК выявляемого ВГЧ-6В, экзогенного внутреннего контрольного образца и эндогенного внутреннего контрольного образца.
9. Набор олигонуклеотидных праймеров и зонда для реализации способа количественного определения ДНК вируса герпеса человека 6В (ВГЧ-6В) по п. 1, имеющий следующий нуклеотидный состав:
прямой праймер HHV-6A/B-for – SEQ ID NO: 1;
обратный праймер HHV-6A/B-rev – SEQ ID NO: 2;
флуоресцентный зонд HHV-6В-probe – SEQ ID NO: 3.
10. Набор олигонуклеотидных праймеров и зонда для выявления вируса герпеса человека 6В по п. 9, где для создания прямого и обратного праймеров, флуоресцентного зонда используют фрагмент гена U31 Human betaherpesvirus 6В.
| Способ выявления и лабораторного подтверждения наследуемого хромосомно-интегрируемого вируса герпеса человека 6A/B | 2020 |
|
RU2739997C1 |
| WO 2011049886 A1, 28.04.2011 | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ВРОЖДЕННЫХ ИНФЕКЦИЙ | 2013 |
|
RU2532382C1 |
Авторы
Даты
2023-08-01—Публикация
2022-12-28—Подача