Область техники
Настоящее изобретение относится к области биотехнологии, иммунологии, медицины. Оно касается экспрессионного вектора на основе аденовируса человека с защитным действием широкого спектра (кросс-протективного) в отношении вирусов гриппа А субтипа Н1, а также фармацевтической композиции на его основе. Изобретение может быть использовано в фармацевтической промышленности для производства противогриппозных вакцин.
Предшествующий уровень развития
Грипп - высококонтагиозное инфекционное заболевание, широко распространенное по всему миру. В структуре заболеваемости гриппом значительную долю составляют штаммы вируса гриппа А субтипа Н1. Важнейшей мерой защиты от гриппозной инфекции и ограничения ее распространения является вакцинопрофилактика с помощью трехвалентных или четырехвалентных вакцин, в состав которых обязательно входит антигенный компонент, полученный из ожидаемого к циркуляции в предстоящем сезоне штамма вируса гриппа А субтипа Н1.
Эффективность существующих сезонных вакцин находится в прямой зависимости от степени соответствия антигенной структуры гемагглютининов (HA) вируса гриппа, входящих в состав вакцины, и штаммов гриппа, циркулирующих среди населения в текущий эпидемический сезон. При этом иммунодоминантные эпитопы гемагглютинина вируса гриппа расположены на его глобулярной части и антитела к ним способны нейтрализовать вирус, что является основой защитного иммунного ответа после вакцинации. Высокая антигенная вариабельность (т.н. «антигенный дрейф») иммунодоминантных эпитопов гемагглютинина вызывает необходимость в ежегодном обновлении состава вакцин в отношении штаммов вируса гриппа А. Однако даже обновленные вакцины не всегда оказываются эффективными в очередном эпидемиологическом сезоне по причине несоответствия ожидаемого и пришедшего штамма вируса гриппа. Антигенные эпитопы широкой специфичности, которые вызывают образование перекрестных антител внутри субтипа Н1, не являются иммунодоминантными и поэтому при иммунизации нативным гемагглютинином в составе инактивированных вакцин к ним вырабатывается незначительное количество антител, которое не позволяет получить защитный иммунный ответ широкого спектра действия. Проблема широко рассматривается в научной литературе (Lee J., Boutz D.R., et all. Molecular-level analysis of the serum antibody repertoire in young adults before and after seasonal influenza vaccination. // Nat Med. 2016 Dec;22(12):1456-1464; Laursen N.S., Friesen R.H.E., Zhu X., et all. Universal protection against influenza infection by a multidomain antibody to influenza hemagglutinin. Science. 2018 Nov 2;362(6414):598-602).
Кроме вариабельности гемагглютинина вируса гриппа, на защитную эффективность противогриппозных вакцин может оказать феномен «антигенного импринтинга». Предполагают, что основные механизмы этого феномена реализуются за счет ранее выработанных антител в ответ на предыдущие вакцинации или переболевания гриппом (Zarnitsyna V.I., et all. Multi-epitope models explain how pre-existing antibodies affect the generation of broadly protective responses to influenza. PLoS Pathog. 2016 Jun 23;12(6):e1005692). Феномен антигенного импринтинга может снизить эффективность вакцинации и вызвать нежелательные явления, поэтому его потенциальное возникновение следует учитывать на этапе разработки антигенных компонентов. В ряде публикаций отмечено, что феномен не наблюдается при последовательном заражении животных антигеннодалекими штаммами вируса гриппа (Gulati U., Kumari K., Wu W. et al. Amount and avidity of serum antibodies against native glycoproteins and denatured virus after repeated influenza whole-virus vaccination // Vaccine. - 2005. - Vol. 23. - P. 1414-1425; Kim J.H., Skountzou I., Compans R. et al. // Original antigenic sin responses to influenza viruses // J. Immunol. - 2009. - Vol. 183. - P. 3294-3301).
Следовательно, основной нерешенной научно-технической проблемой при разработке вакцин является получение высокоиммуногенных антигенных компонентов, индуцирующих иммунитет широкого спектра действия против вирусов гриппа А, в частности внутри субтипа Н1. Для обеспечения эффективной профилактики сезонного гриппа вакцины должны обеспечивать перекрестную защиту не только от циркулирующих в настоящее время штаммов вируса гриппа А, но и от тех, которые могут возникнуть в будущем в результате мутаций вируса, а также не должны вызывать антигенный импринтинг. Антигенные компоненты с широким спектром действия против вируса гриппа А субтипа Н1 не будут требовать ежегодной замены в составе противогриппозных вакцин.
Показано, что некоторые антигены вируса гриппа имеют эпитопы, консервативные для филогенетически далеких штаммов вируса гриппа. Данные антигены и должны служить основой вакцины широкого спектра действия. Известно, что консервативные B-клеточные эпитопы располагаются в основном в стволовом домене гемагглютинина, специфичные антитела к которым были недавно обнаружены. При этом данные антитела реагируют сразу с несколькими подтипами вируса гриппа (гемагглютининами). Антитело CR6261 - с подтипами филогенетической группы 1 (Ekiert D.C. et al. Antibody recognition of a highly conserved influenza virus epitope // Science. - 2009. - Vol. 324. - Issue 5924. - P. 246-251), антитело CR8020 - с подтипами филогенетической группы 2 (Ekiert D.C., Wilson I.A. Broadly neutralizing antibodies against influenza virus and prospects for universal therapies // Current Opinion in Virology. - 2012. - Volume 2. - Issue 2. - April 2012. - P. 134-141), антитело FI6 - с подтипами обоих групп (Corti D. et al. A Neutralizing Antibody Selected from Plasma Cells That Binds to Group 1 and Group 2 Influenza A Hemagglutinins // Science. - 2011. - 12 Aug 2011. - Vol. 333. - Issue 6044. - P. 850-856). Показано, что антитела против стволового домена гемагглютинина способны препятствовать конформационным изменениям структуры НА, необходимым для проникновения вируса внутрь клетки.
Следовательно, перспективным является представление HA иммунной системе в таком варианте, в котором иммунодоминантными выступают консервативные сайты стволовой части и максимально снижена иммуногенность иммунодоминантных антигенных сайтов в глобулярной части НА. При иммунизации таким антигеном НА ожидаемо получение кросс-реактивного иммунного ответа за счет индукции антител к стволовой части.
Таким образом, наиболее многообещающими антигенами для создания вакцин широкого спектра действия являются консервативные эпитопы гемагглютинина. В этой связи разрабатываются различные подходы к модификации гемагглютинина для придания ему новых иммуногенных свойств.
Одним из подходов к решению задачи является получение только стволовой части гемагглютинина, так называемые «безголовые» гемагглютинины (Impagliazzo A., et al. A stable trimeric influenza hemagglutinin stem as a broadly protective immunogen.Science // 2015 - Sep 18;349(6254):1301-6.; Yassine H.M., et al. Hemagglutinin-stem nanoparticles generate heterosubtypic influenza protection // Nat Med. 2015 Sep;21(9):1065-70).
Известен патент, в котором применяется данный подход (WO/2019/070955). Раскрыты универсальные вирусы гриппа на основе укороченного белка гемагглютинина (HA) вируса гриппа, не имеющего головного домена (hrHA). Также раскрыта композиция, содержащая наночастицу, покрытую раскрытым полипептидом hrHA. Также раскрыта композиция, содержащая вирусоподобную частицу (VLP), экспрессирующую на своей поверхности раскрытый полипептид hrHA.
Подход по созданию «обезглавленных» гемагглютининов (WO/2019/070955) имеет существенные недостатки, так как на практике чрезвычайно сложно их создать без потери конформационной укладки белка, что вызывает ухудшение иммуногенных свойств подобных антигенов.
Другим подходом является создание химерных гемагглютининов с экзотическими глобулярными частями (Krammer F., Palese P., Steel J.. Advances in universal influenza virus vaccine design and antibody mediated therapies based on conserved regions of the hemagglutinin // Curr Top Microbiol Immunol. 2015;386:301-21.; Hai R., et al. Influenza viruses expressing chimeric hemagglutinins: globular head and stalk domains derived from different subtypes // J Virol. 2012 May;86(10):5774-81).
Данный подход реализован в технических решениях патентов US11266734B2, US20190106461A1, EP1997831.
Известно, что в патенте US11266734B2 представлены химерные полипептиды гемагглютинина (HA) и их применение для индуцирования иммунного ответа (например, гуморального ответа) против вируса гриппа. Также в настоящем документе предусмотрены способы получения антител к химерным полипептидам HA у субъекта.
В свою очередь, в патенте EP1997831 описаны химерные вакцинные антигены против вируса птичьего гриппа (AI). Такие вакцинные антигены основаны на вирусных субъединицах, связанных с белковыми костимулирующими молекулами, которые усиливают как клеточное, так и гуморальное звено иммунного ответа. Химерные антигены могут быть получены в системах экспрессии, которые гарантируют правильную трехмерную укладку химерных молекул, составляющих основу настоящего изобретения.
Подход по созданию химерных гемагглютининов (US11266734B2, EP1997831) также имеет существенные недостатки, заключающиеся в том, что во-первых, в глобулярной части находятся антигенные сайты С, D и Е, которые являются достаточно консервативными в пределах одного субтипа и, следовательно, при изменении глобулярной части теряется множество эпитопов, антитела к которым являются безусловно протективными, а во вторых, иммунодоминантными по-прежнему остаются антигенные сайты на верхушке HA. В результате, напряженный иммунный ответ широкого спектра действия на такие гемагглютинины сложно получить.
Существует еще один подход по модификации гемагглютинина - гипергликозилирование.
Гликозилирование антигенов - это признанная стратегия уклонения вирусов от иммунного ответа хозяина. Гликозилирование гемагглютинина вируса гриппа происходит в основном в антигенных сайтах, причем сайтов гликозилирования со временем становиться больше (Medina R.A. et al. Glycosylations in the globular head of the hemagglutinin protein modulate the virulence and antigenic properties of the H1N1 influenza viruses. // Sci Transl Med. 2013 May 29;5(187):187ra70).
В ряде публикаций было показано, что гипергликозилирование гемагглютинина в глобулярном домене приводит к значительному увеличению гетеросубтипических антител (Lin S.C., et al. Broader neutralizing antibodies against H5N1 viruses using prime-boost immunization of hyperglycosylated hemagglutinin DNA and virus-like particles // PLoS One -2012-7: e39075.; Lin S.C., et al. Glycan masking of hemagglutinin for adenovirus vector and recombinant protein immunizations elicits broadly neutralizing antibodies against H5N1 avian influenza viruses // PLoS One. 2014 Mar 26;9(3):e92822; Eggink D., Goff P.H., Palese P. Guiding the immune response against influenza virus hemagglutinin toward the conserved stalk domain by hyperglycosylation of the globular head domain // J Virol. 2014 Jan;88(1):699-704; Bajic G., Maron M.J., Adachi Y., et al. Influenza antigen engineering focuses immune responses to a subdominant but broadly protective viral epitope // Cell Host Microbe. 2019 Jun 12;25(6):827-835.e6).
Так, например, Eggink D. с соавт. в 2014 году ввели 7 мутаций в Ca1, Cb, Sa и Sb антигенные сайты HA штамма A/Puerto Rico/8/1934 H1N1 и, таким образом, гипергликозилировали НА (Eggink D., Goff P.H., Palese P. Guiding the immune response against influenza virus hemagglutinin toward the conserved stalk domain by hyperglycosylation of the globular head domain // J Virol. 2014 Jan;88(1):699-704). В конечном итоге они показали, что в отличие от дикого типа HA увеличивалась, во-первых, выработка антител к стволовой части HA, а во-вторых, такая иммунизация защищала мышей от вируса гриппа подтипа H9.
C другой стороны, имеются сведения о вероятности экранирования иммуногенных эпитопов в стволовой части гемагглютинина сайтами гликозилирования (Andrews S.F., et al. Is it possible to develop a "universal" influenza virus vaccine? Immunogenetic considerations underlying B-cell biology in the development of a pan-subtype influenza a vaccine targeting the hemagglutinin stem // Cold Spring Harb Perspect Biol. 2018 Jul 2;10(7). pii: a029413).
Подход по модификации гемагглютинина вируса гриппа на основе гипергликозилирования, по-видимому, является самым перспективным, поскольку позволяет точно экранировать необходимые антигенные сайты.
В общем понимании, создание антигенов вируса гриппа широкого спектра действия на основе гипергликозилирования заключается в том, чтобы заставить организм индуцировать выработку антител к необходимым эпитопам гемагглютинина вируса гриппа.
В качестве вектора, экспрессирующего созданный модифицированный ген вируса гриппа наиболее перспективным представляется рекомбинантный аденовирус. В настоящее время рекомбинантные аденовирусы, которые обладают рядом преимуществ по сравнению с другими генетическими векторами, активно применяются в качестве вектора для экспрессии различных целевых антигенов возбудителей инфекционных заболеваний. Такие векторы безопасны - ДНК рекомбинантных аденовирусов не встраивается в геном клеток-мишеней и введенные аденовирусные частицы выводятся из организма в течение 4- 5 недель. При этом они способны проникать в широкий спектр как делящихся, так и неделящихся клеток, осуществляют высокоэффективную экспрессию генов, индуцируют гуморальный и цитотоксический иммунный ответ на экспрессируемый чужеродный антиген, не требуют адъювантов.
Вирусный вектор на основе генома аденовируса человека 5 серотипа признан одним из наиболее иммуногенных аденовирусных векторов в отношении трансгена, предполагается, что это происходит из-за более эффективной трансдукции клеток с CAR- рецептором (Abbink P. et.al. Comparative seroprevalence and immunogenicity of six rare serotype recombinant adenovirus vaccine vectors from subgroups B and D. // J.Virol. - 2007.- May;81(9):4654-63). Таким образом, с точки зрения ожидаемой эффективности выбор аденовируса человека 5 серотипа для создания вакцины обоснован. (Coughlan L. Factors which contribute to the immunogenicity of non-replicating adenoviral vectored vaccines // Front. Immunol. -2020.-11:909).
На сегодняшний день в мире активно ведутся разработки противогриппозных вакцин на основе антигенов широкого спектра действия, однако до сих пор зарегистрированные к применению препараты отсутствуют.
Таким образом, для совершенствования эффективности профилактической иммунизации против сезонного гриппа крайне необходимо создание новых антигенов с защитным действием широкого спектра действия (кросс-протективного) в отношении вирусов гриппа А субтипа Н1, которые могут быть использованы в фармацевтической промышленности для производства противогриппозных вакцин.
Раскрытие сущности изобретения
Технической задачей изобретения является создание вирусного вектора, экспрессирующего ген целевого антигена, индуцирующего иммунитет к различным штаммам вируса гриппа А человека субтипа Н1 без эффекта антигенного импринтинга, который может применяться в качестве фармацевтической композиции для профилактики гриппа А субтипа Н1, а также входить в состав противогриппозной вакцины.
Технический результат заключается в получении экспрессионного вектора на основе аденовируса человека 5 серотипа с делецией Е1 и Е3 областей, несущего модифицированный ген гемагглютинина вируса гриппа А антигенно далекого субтипа Н1, способного обеспечить индукцию кросс-протективного иммунитета против инфекции, вызванной вирусами гриппа А субтипа Н1 патогенными для человека, без эффекта антигенного импринтинга при введении субъекту в составе фармацевтической композиции или противогриппозной вакцины.
Указанный технический результат достигается тем, что создан экспрессионный вектор на основе генома аденовируса человека 5 серотипа, индуцирующий кросс-протективный иммунитет к вирусам гриппа А субтипа Н1, содержащий:
- геном аденовируса человека 5-го серотипа, за исключением Е1 области, где удалены один или более эндогенных нуклеотидов с потерей её функциональной активности, и E3 области, где удалены один или более эндогенных нуклеотидов с потерей её функциональной активности;
- экспрессионную кассету в месте удаления E1 области генома аденовируса, включающую: промотор, модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, с последовательностью SEQ ID NO: 1, где ген получен из вируса гриппа штамма A/swine/Illinois/A01672343/2017(H1N1), последовательность сигнала полиаденилирования.
В частном варианте исполнения экспрессионного вектора геном аденовируса человека 5-го серотипа представлен SEQ ID NO: 2.
Кроме того, в частном варианте исполнения экспрессионного вектора, экспрессионная кассета в месте удаления Е1 области генома аденовируса включает регулируемый промотор, при этом в экспрессионный вектор в месте удаления Е3 области генома аденовируса дополнительно помещается экспрессионная кассета, включающая: конститутивный промотор, ген активатора транскрипции для регулируемого промотора, последовательность сигнала полиаденилирования. При этом, возможен вариант, когда экспрессия модифицированного гена гемагглютинина вируса гриппа А субтипа Н1 в эукариотической клетке негативно регулируется в присутствии антибиотика тетрациклинового ряда.
Также создана фармацевтическая композиция для защиты от вирусов гриппа А субтипа Н1, содержащая в эффективном количестве разработанный экспрессионный вектор и фармацевтически приемлемый буферный раствор.
Кроме того, разработано применение фармацевтической композиции для защиты субъекта от вирусов гриппа А субтипа Н1. В том числе, в составе противогриппозной векторной вакцины.
Описание фигур
На фиг.1 схематически представлено расположение единичных аминокислотных замен  в модифицированном гемагглютинине swH1glyc (использована нумерация относительно HA субтипа H3 без учета сигнального пептида). На схеме обозначены субъединицы гемагглютинина НА1 и НА2, а также локализация глобулярного и стволового участков молекулы гемагглютинина.
в модифицированном гемагглютинине swH1glyc (использована нумерация относительно HA субтипа H3 без учета сигнального пептида). На схеме обозначены субъединицы гемагглютинина НА1 и НА2, а также локализация глобулярного и стволового участков молекулы гемагглютинина.
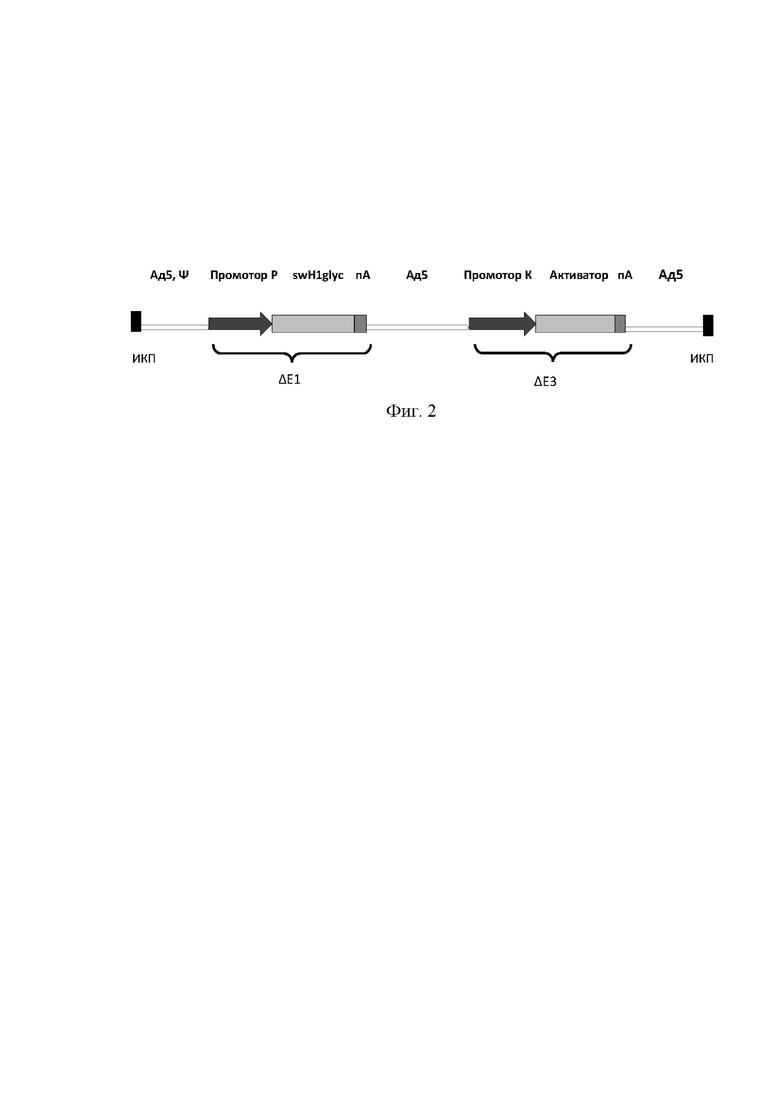
На фиг. 2 представлена схема экспрессионных кассет созданного экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc, где
Ад5 - часть генома аденовируса, Ψ - сигнал упаковки аденовируса;
промотор Р - регулируемый промотор для гена, кодирующего модифицированный ген гемагглютинина swH1glyc;
целевой ген - модифицированный ген гемагглютинина swH1glyc;
пА - сигнал полиаденилирования;
промотор К - конститутивный промотор для гена, продукт которого активирует транскрипцию регулируемого промотора;
активатор - ген, продукт которого активирует транскрипцию регулируемого промотора;
ИКП - инвертированные концевые повторы аденовируса;
ΔE1 - участок удаления E1 области, куда встроена кассета экспрессирующая целевой ген;
ΔE3 - участок удаления E3 области, куда встроена кассета экспрессирующая ген, продукт которого активирует транскрипцию регулируемого промотора.
На фиг. 3 представлена электрофореграмма результатов ПЦР-анализа экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc. Полученные в ходе анализа ПЦР - фрагменты (целевые полосы) требуемого размера подтверждают создание экспрессионного вектора на основе генома аденовируса человека 5 серотипа по изобретению, так как показывают наличие аденовирусного генома и наличие целевого трансгена.
Обозначения:
М - маркер молекулярного веса Thermo Scientific Gene Ruler 1 kb DNA Ladder;
Треки 1, 2, 3 - результат ПЦР на аденовирусный геном, где:
1 - контроль отрицательный;
2 - контроль положительный (плазмида, несущая гексон аденовируса человека 5 серотипа);
3 - гексон аденовируса человека 5 серотипа (размер фрагмента 440 п.о.)
Треки 4, 5, 6 - результат ПЦР на трансген (модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, с последовательностью SEQ ID NO: 1), где:
4 - контроль отрицательный;
5 - контроль положительный (плазмида, несущая ген SwH1glyc);
6 - ген SwH1glyc (размер фрагмента 730 п.о.).
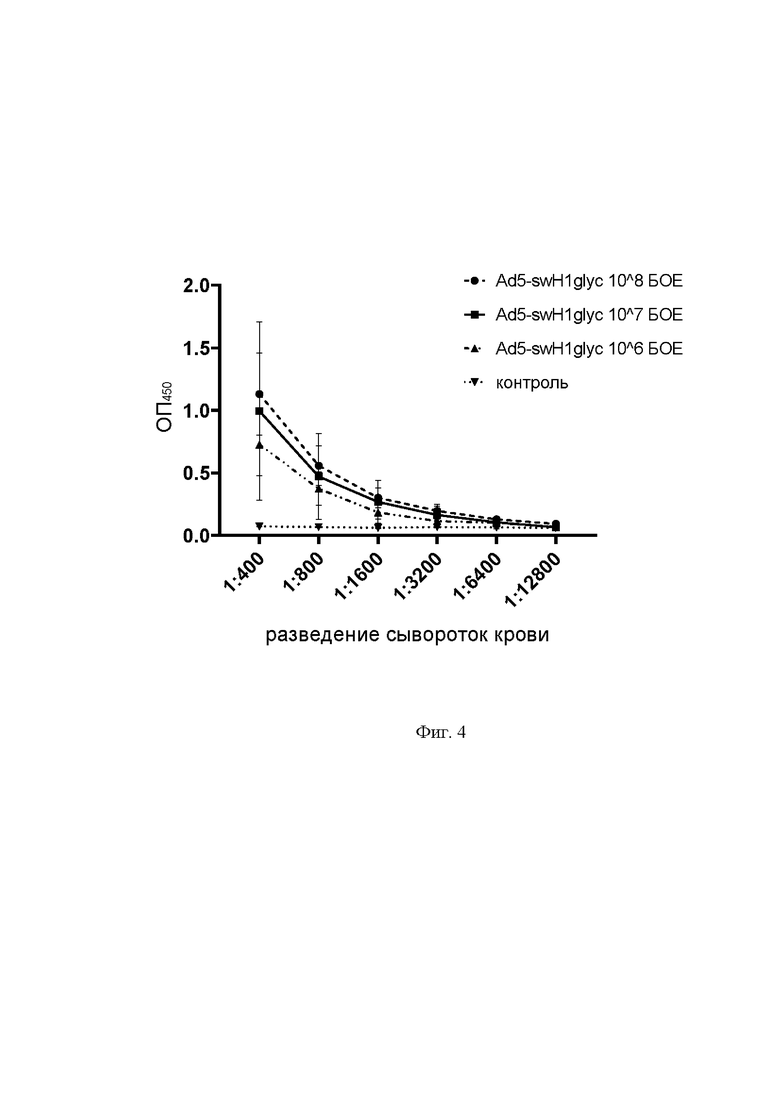
Фигура 4
На фиг. 4 представлены результаты оценки иммуногенной активности экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc, проведенной методом ИФА с рекомбинантным гемагглютинином гетерологичного вируса гриппа A/California/04/2009 (H1N1) в сыворотках крови иммунизированных мышей. Ось абсцисс - разведения сывороток крови, ось ординат - оптическая плотность, измеренная с помощью спектрофотометра (при длине волны 450 нм). Кривые титрования обозначают следующие группы животных:

На кривых титрования маркеры обозначают средние значения измерений оптической плотности по группам, а линиями с засечками отмечено стандартное отклонение.
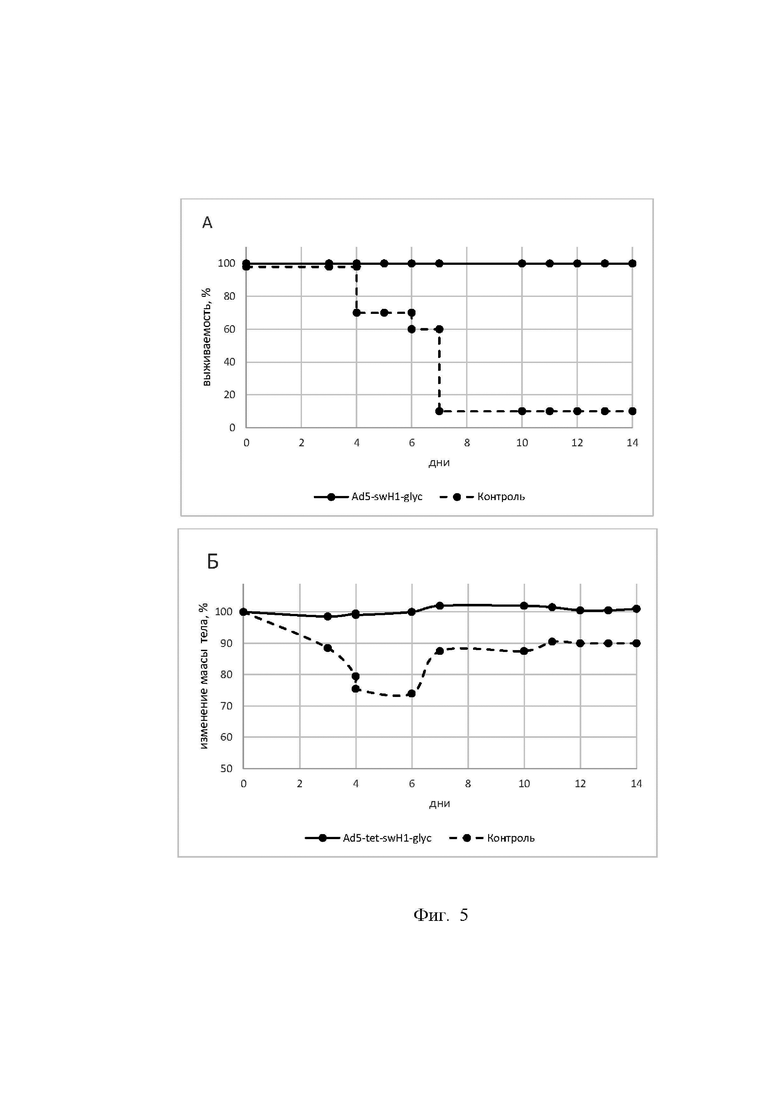
Фигура 5
На фигуре 5 представлены результаты изучения кросс - протективного иммунного ответа мышей, иммунизированных экспрессионным вектором Ad5-swH1glyc в составе фармацевтической композиции при однократном интраназальном способе введения, в дозе 107 БОЕ/животное, с последующим заражением гетерологичным вирусом гриппа A/Victoria/2570/19 ma (H1N1).
На графиках кривые выживаемости и изменения массы тела обозначены следующим образом:
 опытная группа мышей, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции;
опытная группа мышей, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции;
 контрольная группа мышей, получившая буферный раствор.
контрольная группа мышей, получившая буферный раствор.
5А. Выживаемость мышей, зараженных 15 LD50 вируса гриппа A/Victoria/2570/19 ma (H1N1).
Ось ординат - % выживших животных.
Ось абсцисс - дни с момента заражения.
Маркеры на линиях графика обозначают количество животных в группе.
Различия между выживаемостью в группах иммунизированных мышей и контрольной группой являются статистически достоверными (p=0,0001).
5Б. Изменение массы тела мышей, зараженных 15 LD50 вируса гриппа штамма A/Victoria/2570/19 ma (H1N1).
Ось ординат - изменения массы тела животных в %.
Ось абсцисс - дни с момента заражения.
Маркеры на линиях обозначают % изменения средней массы тела животных по группе.
Фигура 6
На фигуре 6 представлены результаты изучения кросс-протективного иммунного ответа мышей, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции при однократном интраназальном способе введения, в дозе 107 БОЕ/животное, с последующим заражением гетерологичным вирусом гриппа A/California/05/09 ma (H1N1).
На графиках кривые выживаемости и изменения массы обозначены следующим образом:
 - опытная группа мышей, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции;
- опытная группа мышей, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции;
 - контрольная группа мышей, получившая буферный раствор.
- контрольная группа мышей, получившая буферный раствор.
6А. Выживаемость мышей, зараженных 15 LD50 вируса гриппа A/California/05/09 ma (H1N1).
Ось ординат - % выживших животных.
Ось абсцисс - дни с момента заражения.
Маркеры на линиях графика обозначают количество животных в группе.
Различия между выживаемостью в группах иммунизированных мышей и контрольной группой являются статистически достоверными (p=0,0001).
6Б. Изменение массы тела мышей, зараженных 15 LD50 вируса гриппа штамма A/Victoria/2570/19 ma (H1N1).
Ось ординат - изменение массы тела животных в %.
Ось абсцисс - дни с момента заражения.
Маркеры на линиях обозначают % изменения средней массы тела животных по группе.
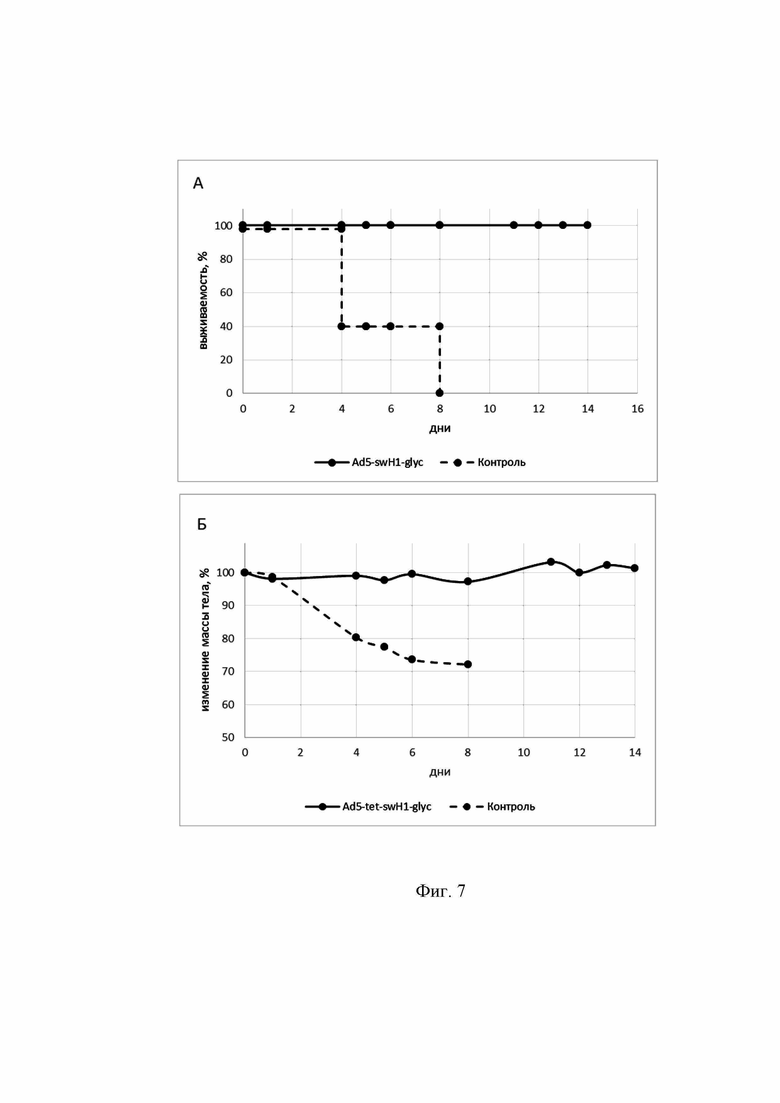
Фигура 7
На фиг. 7 представлены результаты изучения кросс-протективного иммунного ответа мышей, иммунизированных экспрессионным вектором Ad5-swH1glyc в составе фармацевтической композиции при однократном интраназальном способе введения, в дозе 107 БОЕ/животное, с последующим заражением гетерологичным вирусом гриппа A/Duck/Moscow/4970/20 ma (H1N1).
На графиках кривые выживаемости и изменения массы тела обозначены следующим образом:
 - опытная группа мышей, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции;
- опытная группа мышей, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции;
 - контрольная группа мышей, получившая буферный раствор.
- контрольная группа мышей, получившая буферный раствор.
7А. Выживаемость мышей, зараженных 15 LD50 вируса гриппа A/Duck/Moscow/4970/20 ma (H1N1).
Ось ординат - % выживших животных.
Ось абсцисс - дни с момента заражения.
Маркеры на линиях графика обозначают количество животных в группе.
Различия между выживаемостью в группах иммунизированных мышей и контрольной группой являются статистически достоверными (p=0,0001).
7Б. Изменение массы тела мышей, зараженных 15 LD50 вируса гриппа штамма A/Victoria/2570/19 ma (H1N1).
Ось ординат - изменение массы тела животных в %.
Ось абсцисс - дни с момента заражения.
Маркеры на линиях обозначают % изменения средней массы тела животных по группе.
Реализация изобретения
Новизна данного изобретения заключается в том, что для создания противогриппозной вакцины для человека был использован антиген вируса гриппа A/swine/Illinois/A01672343/2017(H1N1), не циркулирующий в популяции человека и антигенно далекий от вирусов гриппа А субтипа Н1, патогенных для человека. Таким образом, у человека нет предсуществующих антител к данному антигену, что позволяет избежать эффекта антигенного импринтинга. Авторами была выполнена существенная модификация антигена, которая позволила сфокусировать иммунный ответ на ряд эпитопов стволовой части гемагглютинина. Данные эпитопы являются консервативными и имеют высокую степень гомологии с эпитопами вируса гриппа А субтипа Н1, что позволяет обеспечить кросс-протективный эффект.
Специалисту среднего уровня понятно, что иммунный ответ на экспрессионный вектор и фармацевтическую композицию на его основе в первую очередь определяется последовательностью целевого антигена. При этом в состав экспрессионной кассеты может входить любой промотор, обеспечивающий высокую экспрессию гена целевого антигена (например, CMV промотор). Вместе с тем использование регулируемого промотора, которое описано в примерах, дает преимущество при наращивании экспрессионного вектора и позволяет получать его с большим выходом.
В качестве экспрессионного вектора авторы используют вектор на основе аденовируса человека 5 серотипа. Экспрессионный вектор был получен из последовательности SEQ ID NO:2 путем делеции Е1 и Е3 областей. При этом на место Е1 области помещают экспрессионную кассету с промотором, целевым геном (модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, с последовательностью SEQ ID NO: 1), последовательностью сигнала полиаденилирования. Возможен вариант изобретения, когда дополнительно вместо Е3 области помещают экспрессионную кассету с конститутивным промотором, геном активатора транскрипции для регулируемого промотора, последовательностью сигнала полиаденилирования. Получение препаративного количества разработанного экспрессионного вектора проводят в суспензионной линии клеток HEK293.
Полученный экспрессионный вектор, а также фармацевтическая композиция на его основе при введении в организм млекопитающих способны индуцировать антиген-специфический иммунный ответ и могут быть использованы как самостоятельное средство для профилактики гриппа А субтипа Н1, а также в составе противогриппозных вакцин.
Осуществление изобретения подтверждается следующими примерами, которые при этом не ограничивают его объем.
Пример 1
Создание последовательности модифицированного гена гемагглютинина вирусов гриппа А субтипа Н1
В примере описана работа по выбору исходного гена гемагглютинина вируса гриппа А для проведения генно-инженерной модификации, которая позволит после введения субъекту модифицированного гена индуцировать кросс-протективный иммунитет к вирусам гриппа А субтипа Н1 без эффекта антигенного импринтинга.
Для преодоления проблемы «антигенного импринтинга» в качестве основы для создания модифицированных гемагглютининов вирусов гриппа А были выбраны антигенно далекие штаммы вируса гриппа А патогенные для свиней, что по мнению авторов не вызовет бустирование неактуальных в настоящее время предсуществующих антител к иммунодоминантным эпитопам вирусов гриппа А человека. Дополнительно были закрыты иммунодоминантные эпитопы в глобулярной части гемагглютинина и иммунный ответ перенаправлен на консервативные эпитопы стволовой части гемагглютинина.
С целью выбора исходной аминокислотной последовательности гемагглютинина вируса гриппа А патогенного для свиней была получена обобщенная (консенсусная) последовательность изолятов 2017 года. Далее для конструирования за основу взята последовательность гемагглютинина максимально гомологичная консенсусной последовательности.
В результате, в качестве исходного гемагглютинина для создания модифицированных генов был выбран гемагглютинин штамма Influenza A virus A/swine/Illinois/A01672343/2017(H1N1), номер аминокислотной последовательности в общедоступной базе NCBI Protein - AQU12415. Для осуществления модификации была взята соответствующая нуклеотидная последовательность гемагглютинина A/swine/Illinois/A01672343/2017(H1N1), которая находится в общедоступной базе NCBI GenBank под номером KY593239.1 (ниже по тексту данный ген гемагглютинина обозначен - swH1).
Далее для фокусирования иммунного ответа проводилось экранирование наиболее вариабельных и доступных иммунодоминантных эпитопов на поверхности белка гемагглютинина с помощью введения 2 дополнительных сайтов гликозилирования в глобулярной части гемагглютинина вируса гриппа А субтипа H1 A/swine/Illinois/A01672343/2017(H1N1) путем замены в последовательности гемагглютинина 2 аминокислот. И, наоборот, часть природных сайтов гликозилирования в стволовой части, маскирующих консервативные эпитопы были убраны путем замены в последовательности гемагглютинина 2 аминокислот для того, чтобы сделать эпитопы более открытыми иммунной системе с целью повышения их иммуногенности.
Таким образом, в результате проведенных работ in silico с исходной нуклеотидной последовательностью swH1, были внесены следующие мутации в гемагглютинине (использована нумерация относительно HA субтипа H3 без учета сигнального пептида):
1) проведена аминокислотная замена N33Q, которая привела к удалению сайта гликозилирования в HA (33-35);
2) проведена аминокислотная замена S291N, которая привела к удалению сайта гликозилирования в HA (289-291);
3) проведена аминокислотная замена в положении T144N, которая привела к добавлению сайта гликозилирования в HA (144-146);
4) проведена аминокислотная замена в положении G158N, которая привела к добавлению сайта гликозилирования в HA (158-160).
В итоге были удалены сайты гликозилирования в стволовой части и добавлены сайты гликозилирования в глобулярной части. Для увеличения экспонирования антигена лидерный пептид гемагглютинина вируса гриппа был заменен на лидерный пептид щелочной фосфатазы - SEAP. Также была проведена оптимизация кодонов для экспрессии в клетках млекопитающих. Полученный вариант модифицированного гена гемагглютинина обозначен - swH1glyc.
Целевой ген со всеми модификациями был синтезирован de novo (ЗАО «Евроген», Москва).
Последовательность модифицированного гена гемагглютинина вируса гриппа А субтипа Н1 представлена в Перечне последовательностей, как SEQ ID NO: 1 (ген swH1glyc).
Наличие всех модификаций в гене гемагглютинина swH1glyc было подтверждено секвенированием.
Таким образом, был создан модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, с последовательностью SEQ ID NO: 1, где ген получен из вируса гриппа штамма A/swine/Illinois/A01672343/2017(H1N1).
Пример 2
Получение экспрессионного вектора на основе генома аденовируса человека 5-го серотипа, с удаленными Е1 и Е3 областями, содержащего модифицированный ген гемагглютинина вируса гриппа А субтипа Н1
В данном примере рассмотрен процесс получения экспрессионного вектора на основе генома аденовируса человека 5 серотипа, содержащего модифицированный ген гемагглютинина вируса гриппа А субтипа Н1 из примера 1, методом гомологичной рекомбинации.
Процесс получения экспрессионного вектора на основе генома аденовируса человека 5-го серотипа, с удаленными Е1 и Е3 областями, содержащего модифицированный ген гемагглютинина вируса гриппа А субтипа Н1 состоял из нескольких основных этапов, суть которых известна специалисту данной области, основывался на общеизвестных методиках (например, Sambrook J. et al., Molecular cloning : a laboratory manual, 3rd ed., Russell, 2001, том 1, 2, 3 - Молекулярное клонирование - лабораторное руководство) и поэтому в данном примере подробно не рассматривается, указывая лишь на самые основные этапы:
1) Переклонирование синтезированного целевого гена swH1glyc с SEQ ID NO: 1 из плазмиды для клонирования продуктов ПЦР в плазмиду pShuttle-TswH1glyc, несущую экспрессионную кассету с регулируемым промотором;
2) Конструирование плазмиды pAdeno-E3/TA на основе генома аденовируса человека 5 серотипа, представленного SEQ ID NO: 2, с удалением E3 области и вставкой экспрессионной кассеты с геном, продукт которого активирует транскрипцию регулируемого промотора;
3) Гомологичная рекомбинация между плазмидой pShuttle-TswH1glyc и плазмидой pAdeno-E3/TA происходит в клетках линии HEK293 (Human embryonic kidney 293) после трансфекции плазмидными ДНК с получением экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc. В результате рекомбинации в участок удаления E1 области была встроена экспрессионная кассета с регулируемым промотором, целевым геном (модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, с последовательностью SEQ ID NO: 1), последовательностью сигнала полиаденилирования.
4) Получение препаративного количества экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc проводили в суспензионной линии клеток HEK293.
Схема сконструированного экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc представлена на фигуре 2.
Представленные на фигуре 3 результаты проведенного ПЦР анализа подтверждают создание экспрессионного вектора на основе генома аденовируса человека 5 серотипа, несущего модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, с последовательностью SEQ ID NO: 1. На электрофореграммах видно, что молекулярные массы фрагментов амплифицированной ДНК в препарате, содержащем экспрессионный вектор на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc, соответствуют молекулярным массам фрагментов амплифицированной ДНК в положительных контролях. При этом наличие целевой полосы с размером фрагмента 440 п.о. в ПЦР с праймерами AdH01/AdH02 на ген гексона аденовируса 5 серотипа свидетельствует о наличии ДНК генома аденовируса человека 5 серотипа, а наличие целевой полосы с размером фрагмента 730 п.о. (праймеры SWH1glyc-forw/SW-H1TM-rev) свидетельствует о наличии последовательности гена гемагглютинина swH1glyc.
Корректность указанной конструкции экспрессионного вектора на основе генома аденовируса человека 5 серотипа была подтверждена результатами секвенирования генома рекомбинантного аденовируса.
Таким образом, в результате работ был получен экспрессионный вектор на основе генома аденовируса человека 5 серотипа, с удаленными Е1 и Е3 областями, содержащий в удаленной Е1 области экспрессионную кассету, включающую модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, находящийся под контролем регулируемого промотора, ген активатора которого находится экспрессионной кассете в удаленной Е3 области под контролем конститутивного промотора.
Пример 3
Определение экспрессии модифицированного гена гемагглютинина вируса гриппа A субтипа H1 на культуре клеток
В примере показан эксперимент по изучению экспрессии модифицированного гена гемагглютинина вируса гриппа А субтипа Н1 с SEQ ID NO: 1 созданным в примере 2 экспрессионным вектором на основе генома аденовируса человека 5 серотипа, который проводили на культуре клеток человека A549 и оценивали с помощью метода иммуноблоттинга.
Клеточная линия A549 была трансдуцирована экспрессионным вектором на основе генома аденовируса человека 5 серотипа в дозе 5-10 БОЕ на клетку. В качестве отрицательного контроля использовали аденовирус, не несущий экспрессионной кассеты (Ad-null), После 48 часов инкубации собирали клеточный осадок для дальнейшего анализа методом электрофореза в полиакриламидном геле с последующим иммуноблоттингом с использованием мышиных моноклональных антител к гемагглютинину/HA свиного гриппа H1N1 (Cat: 11055-MM09, Sino Biological Inc.). В качестве вторичных антител использовали антимышиное антитело козы, конъюгированное с пероксидазой хрена (Goat anti-mouse IgG H&L (HRP) (ab205719, Abcam).
Было показано, что созданный по изобретению экспрессионный вектор на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc обеспечивает продукцию в культуре клеток человека модифицированного гемагглютинина вируса гриппа А субтипа Н1.
Пример 4
Получение на основе экспрессионного вектора на основе генома аденовируса человека 5 серотипа фармацевтической композиции для защиты от вирусов гриппа А субтипа Н1
В данном примере показан процесс наращивания сконструированного в примере 2 экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc с целью получения на его основе фармацевтической композиции для защиты субъекта от вирусов гриппа А субтипа Н1.
Для наращивания рекомбинантных аденовирусов использовали культуру клеток НЕК 293 (эмбриональной почки человека), адаптированную для роста в суспензии.
Количественное измерение рекомбинантных аденовирусов проводили в единицах активности (БОЕ, бляшкобразующие единицы), измеренных на культуре клеток НЕК 293.
Клеточную суспензию линии НЕК293, инфицировали экспрессионным вектором на основе генома аденовируса человека 5 серотипа, полученным в примере 2, со множественностью инфекции 10 БОЕ на клетку, и использовали для дальнейшего наращивания большего количества экспрессионного вектора на основе генома аденовируса человека 5 серотипа.
С этой целью, в волновой биореактор с 4500,0 мл суспензии пермиссивной клеточной культуры 293HEK вносили вируссодержащую жидкость объемом 500,0 мл, содержащую экспрессионный вектор на основе генома аденовируса человека 5 серотипа из примера 2. Для наращивания экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc с регулируемым промотором, проводили культивирование в течение 48 часов в присутствие антибиотика тетрациклинового ряда (например, доксициклина) с концентрацией 1-10 мкг на мл среды. Затем экспрессионный вектор на основе генома аденовируса человека 5 серотипа очищали из лизата клеток с помощью общеизвестных методов ультрафильтрации и высокоэффективной жидкостной хроматографии в несколько этапов.
Для стерилизации полученного препарата использовали фильтр с размером пор 0,22 мкМ и разбавляли стерильным фармацевтически приемлемым буферным раствором, сохраняющим стабильность рекомбинантных аденовирусов, например: трис (гидроксиметил) аминометан - 0,606 мг; натрия хлорид - 2,19 мг; сахароза - 25,0 мг; полисорбат-80 - 0,00025 мл; магния хлорида гексагидрат - 0,1 мг; этанол 95% - 0,0025 мл; ЭДТА динатриевая соль - 0,019 мг; вода для инъекций - остальное, рН 7,0-8.0, с получением на основе экспрессионного вектора на основе генома аденовируса человека 5 серотипа фармацевтической композиции, содержащей:
- экспрессионный вектор на основе генома аденовируса человека 5 серотипа - 1х1011 -5х1011 частиц/мл с активностью не менее 2х108 БОЕ;
- фармацевтически приемлемый буферный раствор.
Таким образом, в результате проведенных работ была получена фармацевтическая композиция на основе экспрессионного вектора на основе генома аденовируса человека 5 серотипа по изобретению, содержащая в эффективном количестве экспрессионный вектор на основе генома аденовируса человека 5 серотипа и фармацевтически приемлемый буферный раствор.
Пример 5
Иммуногенная активность экспрессионного вектора на основе генома аденовируса человека 5 серотипа, несущего модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, при введении лабораторным животным
Иммуногенная активность оценивалась по способности вырабатывать специфические антитела в ответ на интраназальное введение экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc мышам. Оценка проводилась в сыворотке крови мышей методом иммуноферментного анализа (ИФА).
Мыши линии Balb/c, самки, массой 14-16 грамм, были иммунизированы однократно интраназально фармацевтической композицией из примера 4, с различным содержанием экспрессионного вектора на основе генома аденовируса человека 5 серотипа в дозе, что при необходимости достигалось разбавлением исходной концентрации буферным раствором. В качестве контрольной группы были использованы животные, получившие буферный раствор. Количество мышей в опытной и контрольной группах составляло по 6 особей. Таким образом, были сформированы следующие экспериментальные группы:
Группа 1) Ad5-swH1glyc, доза 108 БОЕ;
Группа 2) Ad5-swH1glyc, доза 107 БОЕ
Группа 3) Ad5-swH1glyc, доза 106 БОЕ
Группа 4) Буферный раствор (контроль).
Получение сывороток крови мышей. Кровь получали от мышей через 28 дней после иммунизации в пробирки «эппендорф», инкубировали в термостате 40 минут при 37°С для формирования сгустка фибрина. После этого пробирки центрифугировали при 3000 об/мин., 4°С, 20 минут. Сыворотки отбирали в чистые пробирки, прогревали 30 минут при 57°С (для инактивации системы комплемента) и замораживали на -20°С.
Методика проведения ИФА для определения титра антител в сыворотках крови мышей.
Антигеном для реакции служил: рекомбинантный гемагглютинин вируса гриппа A/California/04/2009 (H1N1) (Abcam, ab217662);
Для постановки ИФА лунки 96-луночного планшета сенсибилизировали путем внесения антигенов в 10мМ калиево-карбонатном буфере (рН=9.6). Сенсибилизацию проводили 18 часов при 4°С. Затем планшет отмывали 3х кратно дистиллятом и 3х кратно раствором TPBS (фосфатно-солевой буфер с 0,05% Tween 20). Далее проводили инкубацию планшета в буфере забивки (TPBS с 5%ным овоальбумином) при 37°С на шейкере. Затем 3х кратно отмывали TPBS и инкубировали с разведениями сывороток от 1/400 до 1/25600 в буфере забивки 1 час при 37°С на шейкере. Далее снова 3х кратно отмывали TPBS и инкубировали с антивидовым мышиным коньюгатом (поликлональные антитела лошади к IgG мыши, коньюгированные с пероксидазой, (Amersham, Великобритания), в буфере забивки 1 час при 37°С на шейкере (рабочее разведение 1:5000). Затем снова 3х кратно отмывали TPBS. Для проявления реакции использовали TMB-индикаторную смесь. Для остановки реакции использовали 4М H2SO4. Оптическую плотность окрашенного продукта пероксидазной реакции определяли на приборе iEMS Reader MF (Termolabsystems) при длине волны 450 нм. Фоном служили лунки, куда не добавлялись сыворотки, но добавлялись антиген и конъюгат.
На фигуре 4 представлены полученные результаты эксперимента по оценке с помощью ИФА уровня антител, взаимодействующих с рекомбинантным гемагглютинином вируса гриппа A субтипа H1, в сыворотках крови мышей, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в сравнении с группой контроль, мышам которой вводили буферный раствор.
Как видно на фигуре 4, у мышей из опытной группы, иммунизированных экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc, детектируются антитела к гемагглютинину вируса гриппа A субтипа H1. Для группы 1 (доза 108 БОЕ) предельным разведением сыворотки крови, в котором значение оптической плотности при А450 достоверно отличались от контрольной группы было 1:12800 (p<0,0001), а для группы 2 (доза 107 БОЕ) и группы 3 (доза 106 БОЕ) - 1:6400 (p<0,05). Дозой экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc для применения и использования в дальнейших исследованиях была принята 107 БОЕ на мышь. При этом в контрольной группе антитела определялись на фоновом уровне.
Таким образом, сконструированный экспрессионный вектор на основе генома аденовируса человека 5 серотипа, содержащий модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, обладает иммуногенной активностью при введении субъекту в составе фармацевтической композиции, то есть способен вызвать образование антител к вирусу гриппа А субтипа Н1, что соответствует поставленной цели изобретения.
Пример 6
Применение фармацевтической композиции для профилактики гриппа А субтипа Н1 с оценкой кросс-протективных свойств на лабораторных животных
На данном этапе проведены работы по оценке кросс-протективных свойств экспрессионного вектора на основе генома аденовируса человека 5 серотипа в составе фармацевтической композиции против различных гетерологичных штаммов вирусов гриппа А субтипа Н1. Оценка проводилась по выживаемости и динамике массы тела иммунизированных фармацевтической композицией мышей после их заражения вирусами гриппа.
Исходя из разработанной конструкции экспрессионного вектора на основе генома аденовируса человека 5 серотипа, иммунизация должна стимулировать выработку антител, в том числе на высококонсервативные участки гемагглютининов вирусов гриппа А субтипа Н1, поэтому предполагалось, что экспрессионный вектор на основе генома аденовируса человека 5 серотипа в составе фармацевтической композиции будет обладать широким спектром действия (кросс-протективным), то есть способностью защищать от различных штаммов вирусов гриппа А субтипа H1N1. Для демонстрации кросс-протективного действия иммунизированных мышей заражали следующими гетерологичными штаммами вируса гриппа А субтипа H1, адаптированными к мышам:
1) вирус гриппа человека A/Victoria/2570/19 ma (H1N1);
2) вирус гриппа человека A/California/05/09 ma (H1N1);
3) вирус гриппа птиц A/Duck/Moscow/4970/20 ma (H1N1).
Для проведения эксперимента использовались мыши линии Balb/c, самки, массой 14-16 грамм. Мыши опытных групп были однократно интраназально иммунизированы экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции в дозе 107 БОЕ. Контрольным мышам вводили буферный раствор. В каждой группе было 10 мышей.
Через 28 дней после иммунизации мышей интраназально под эфирным наркозом заражали вышеуказанными вирусами гриппа в дозе 15 ЛД50 на животное. Для приготовления необходимых разведений вирусов гриппа использовали среду Хенкса с гидролизатом лактальбумина и антибиотиком гентамицином (ПанЭко, Россия).
Таким образом, в эксперименте были сформированы следующие опытные и контрольные группы:
1 группа) Ad5-swH1glyc + заражение A/Victoria/2570/19 ma;
2 группа) Буферный раствор+ заражение A/Victoria/2570/19 ma;
3 группа) Ad5-swH1glyc + заражение A/California/05/09 ma;
4 группа) Буферный раствор+ заражение A/California/05/09 ma;
5 группа) Ad5-swH1glyc + заражение A/Duck/Moscow/4970/20 ma;
6 группа) Буферный раствор+ заражение A/Duck/Moscow/4970/20 ma.
Наблюдение за мышами проводилось в течение 14 дней после заражения вирусами гриппа, в этот период оценивались выживаемость животных, а также проявление симптомов заболевания (изменение массы тела).
Для статистической обработки результатов эксперимента была использована компьютерная программа. Статистическую обработку выживаемости животных проводили с помощью критерия Гехана-Бреслоу-Вилкоксона, различия между группами считались достоверными при р<0,05.
Результаты эксперимента представлены в таблице 1 и на фигурах 5, 6, 7.
* - достоверное отличие от контроля (p=0,0001)
Из таблицы 1 следует, что экспрессионный вектор на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции на 100% защищал мышей от заражения вирусами гриппа А субтипа H1 во всех трех опытных группах. При этом выживаемость контрольных групп составила 10% (для вируса гриппа A/Victoria/2570/19 ma (H1N1), 0% (для вирусов гриппа A/California/05/09 ma (H1N1) и A/Duck/Moscow/4970/20 ma (H1N1). Разница в выживаемости опытной и контрольной группы по каждому из использованных для заражения вирусов гриппа является достоверной (p= 0,0001, критерий Гехана-Бреслоу-Вилкоксона). Падения массы тела у мышей всех опытных групп, иммунизированных Ad5-swH1glyc, не происходило, при этом в контрольных группах мышей до момента гибели наблюдалось значительное падение массы тела, которое доходило до 30%. У иммунизированных мышей в опытных группах отсутствовали клинические симптомы заболевания, в отличие от контрольных мышей.
Следовательно, в ходе эксперимента было показано защитное действие иммунного ответа, индуцированного у мышей экспрессионным вектором на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции против гетерологичных вирусов гриппа А субтипа H1: A/Victoria/2570/19 ma (H1N1), A/California/05/09 ma (H1N1), A/Duck/Moscow/4970/20 ma (H1N1), что подтверждает наличие кросс-протективных свойств в отношении вирусов гриппа А субтипа Н1.
Таким образом, экспрессионный вектор на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе фармацевтической композиции индуцирует кросс-протективный иммунитет и может применяться для профилактики гриппа А субтипа Н1 у субъекта, что соответствует поставленной цели изобретения.
Пример 7
Применение экспрессионного вектора на основе генома аденовируса человека 5 серотипа в составе противогриппозной вакцины с оценкой протективных свойств и безопасности
В примере показана возможность применения экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе противогриппозной векторной вакцины. Оценивали протективные свойства экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе четырехвалентной противогриппозной векторной вакцины и ее безопасность при применении лабораторным животным (мышам).
В состав вакцины входила смесь 4 видов экспрессионных векторов на основе аденовируса человека 5 серотипа, различающихся вставкой гена гемагглютинина вируса гриппа, которые представляли собой: ген гемагглютинина вируса гриппа А субтипа H1 (модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, с последовательностью SEQ ID NO: 1- swH1glyc), ген гемагглютинина вируса гриппа А субтипа H3, ген гемагглютинина вируса гриппа В линии Виктория, а также ген гемагглютинина вируса гриппа В линии Ямагата.
Доза экспрессионного вектора на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc в составе противогриппозной векторной вакцины, лекарственная форма которой была представлена объемом 0,5 мл, составляла 1х108 БОЕ.
Для оценки протективных свойств Ad5-swH1glyc и безопасности противогриппозной вакцины, содержащей 4 типа экспрессионных векторов, были использованы мыши линии Balb/c, самки, 14-16 грамм. Животных иммунизировали однократно интраназально вакциной в объеме 50 мкл (содержание экспрессионного вектора Ad5-swH1glyc 107 БОЕ). В качестве контрольной группы были использованы животные, получившие буферный раствор. Количество мышей в опытной и контрольной группе составляло по 10 особей. Через 28 дней после иммунизации мышей интраназально под эфирным наркозом заражали вирусом гриппа A /California/07/09 (H1N1) в дозе 15 ЛД50 на животное. Оценку выживаемости и падения массы тела животных проводили в течение 14 дней после заражения. Результаты проведенного эксперимента представлены в таблице 2.
падение массы тела 20%
Из таблицы 2 следует, что выживаемость мышей опытной группы после заражения вируса гриппа А субтипа H1 составила 100%, при этом у мышей контрольной группы составила 0%. Разница между опытной и контрольной группой была достоверной (p= 0,0001, критерий Гехана-Бреслоу-Вилкоксона). Падение массы тела мышей в контрольной группе после заражения вирусом гриппа А субтипа H1 до момента гибели достигало 20%, при этом мыши опытной группы почти не теряли массу тела, у них отсутствовали клинические симптомы заболевания гриппом.
Таким образом, в ответ на введение четырехвалентной противогриппозной векторной вакцины, содержащей экспрессионный вектор на основе генома аденовируса человека 5 серотипа Ad5-swH1glyc, у лабораторных мышей вырабатывался защитный иммунный ответ в отношении вируса гриппа А субтипа Н1.
Применение вакцины для лабораторных животных было безопасно, токсических эффектов на введенную мышам дозу не наблюдалось.
В результате эксперимента было показано, что экспрессионный вектор на основе генома аденовируса человека 5 серотипа по изобретению, введенный в состав противогриппозной векторной вакцины, может применяться для защиты субъекта от заражения вирусами гриппа А субтипа Н1.
Таким образом, поставленная техническая задача, а именно, создание вирусного вектора несущего антиген, индуцирующего иммунитет к различным штаммам вируса гриппа А человека субтипа Н1 без эффекта антигенного импринтинга, который может применятся в качестве фармацевтической композиции для профилактики гриппа А субтипа Н1, а также входить в состав противогриппозной вакцины, достигнута, что подтверждается приведенными примерами.
Промышленная применимость
Все приведенные примеры подтверждают способность разработанного экспрессионного вектора на основе аденовируса человека 5 серотипа индуцировать иммунный ответ против целевого антигена и его промышленную применимость для создания вакцин против гриппа.
| название | год | авторы | номер документа |
|---|---|---|---|
| Экспрессионный вектор на основе аденовируса человека 5 серотипа индуцирующий кросс-протективный иммунитет к вирусам гриппа А субтипа H3 и фармацевтическая композиция на его основе. | 2023 |
|
RU2814189C1 |
| Вакцина против гриппа типа А, гриппа типа B и COVID-19 | 2021 |
|
RU2751485C1 |
| Штамм рекомбинантной псевдоаденовирусной частицы на основе генома аденовируса человека 5 серотипа Ad5-tetOFF-E3-HA125, несущей ген консенсусной последовательности гемагглютинина вируса гриппа А субтипов H1, H2, H5 для создания противогриппозных иммуногенных препаратов, способ получения гена | 2018 |
|
RU2713722C1 |
| РЕКОМБИНАНТНАЯ ТРЕХВАЛЕНТНАЯ ВАКЦИНА ОТ ГРИППА ЧЕЛОВЕКА | 2012 |
|
RU2485973C1 |
| Универсальная противогриппозная вакцина | 2015 |
|
RU2618918C2 |
| РЕКОМБИНАНТНАЯ ПСЕВДОАДЕНОВИРУСНАЯ ЧАСТИЦА НА ОСНОВЕ ГЕНОМА АДЕНОВИРУСА ЧЕЛОВЕКА 5 СЕРОТИПА ДЛЯ ИНДУКЦИИ СПЕЦИФИЧЕСКОГО ИММУНИТЕТА К ВИРУСУ ГРИППА А СУБТИПА Н1N1 И СПОСОБ ЕЕ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ КОМПОНЕНТА ДЛЯ СОЗДАНИЯ ВАКЦИНЫ | 2012 |
|
RU2507257C1 |
| РЕКОМБИНАНТНАЯ ПСЕВДОАДЕНОВИРУСНАЯ ЧАСТИЦА НА ОСНОВЕ ГЕНОМА АДЕНОВИРУСА ЧЕЛОВЕКА 5 СЕРОТИПА, ПРОДУЦИРУЮЩАЯ ГЕМАГГЛЮТИНИН ВИРУСА ГРИППА ШТАММА A/Brisbane/59/2007(H1N1) И СПОСОБ ЕЕ ИСПОЛЬЗОВАНИЯ | 2012 |
|
RU2523599C1 |
| ПРОТИВОГРИППОЗНАЯ ВАКЦИНА ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ ПРОТИВ ПТИЧЬЕГО ГРИППА А НА ОСНОВЕ ЭКТОДОМЕНА БЕЛКА М2 | 2014 |
|
RU2571944C1 |
| РЕКОМБИНАНТНАЯ ПСЕВДОАДЕНОВИРУСНАЯ ЧАСТИЦА НА ОСНОВЕ ГЕНОМА АДЕНОВИРУСА ЧЕЛОВЕКА 5 СЕРОТИПА, ДЛЯ ИНДУКЦИИ СПЕЦИФИЧЕСКОГО ИММУНИТЕТА К ВИРУСУ ГРИППА А СУБТИПА Н3N2 И СПОСОБ ЕЕ ИСПОЛЬЗОВАНИЯ | 2012 |
|
RU2507258C1 |
| ПРОТИВОВИРУСНОЕ ОДНОДОМЕННОЕ МИНИ-АНТИТЕЛО, НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, ЭКСПРЕССИРУЮЩИЙ РЕКОМБИНАНТНЫЙ ВИРУСНЫЙ ВЕКТОР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ТЕРАПИИ ГРИППА ТИПА А | 2013 |
|
RU2536956C1 |



Изобретение относится к области биотехнологии, иммунологии, медицины. Описан экспрессионный вектор на основе аденовируса человека 5 серотипа с делецией Е1 и Е3 областей, несущего модифицированный ген гемагглютинина вируса гриппа А антигенно далекого субтипа Н1, способного обеспечить индукцию кросс-протективного иммунитета против инфекции, вызванной вирусами гриппа А субтипа Н1 патогенными для человека, без эффекта антигенного импринтинга при введении субъекту в составе фармацевтической композиции или противогриппозной вакцины. Также представлена фармацевтическая композиция на его основе. Изобретение может быть использовано в фармацевтической промышленности для производства противогриппозных вакцин, так как представленное изобретение позволяет создать вирусный вектор, экспрессирующий ген целевого антигена, индуцирующего иммунитет к различным штаммам вируса гриппа А человека субтипа Н1 без эффекта антигенного импринтинга, который может применяться в качестве фармацевтической композиции для профилактики гриппа А субтипа Н1, а также входить в состав противогриппозной вакцины. 3 н. и 4 з.п. ф-лы, 7 ил., 2 табл., 7 пр.
1. Экспрессионный вектор на основе аденовируса человека 5 серотипа, индуцирующий кросс-протективный иммунитет к вирусам гриппа А субтипа Н1, содержащий:
- геном аденовируса человека 5-го серотипа, за исключением Е1 области, где удалены один или более эндогенных нуклеотидов с потерей её функциональной активности, и E3 области, где удалены один или более эндогенных нуклеотидов с потерей её функциональной активности;
- экспрессионную кассету в месте удаления E1 области генома аденовируса, включающую: промотор, модифицированный ген гемагглютинина вируса гриппа А субтипа Н1, с последовательностью SEQ ID NO: 1, последовательность сигнала полиаденилирования.
2. Экспрессионный вектор по п.1, отличающийся тем, что геном аденовируса человека 5-го серотипа представлен SEQ ID NO: 2.
3. Экспрессионный вектор по п.1, отличающийся тем, что экспрессионная кассета в месте удаления Е1 области генома аденовируса включает регулируемый промотор, при этом в экспрессионный вектор в месте удаления Е3 области генома аденовируса дополнительно помещается экспрессионная кассета, включающая: конститутивный промотор, ген активатора транскрипции для регулируемого промотора, последовательность сигнала полиаденилирования.
4. Экспрессионный вектор по п.3, отличающийся тем, что экспрессия модифицированного гена гемагглютинина вируса гриппа А субтипа Н1 в эукариотической клетке негативно регулируется в присутствии антибиотика тетрациклинового ряда.
5. Фармацевтическая композиция для защиты от вирусов гриппа А субтипа Н1, содержащая в эффективном количестве экспрессионный вектор по любому из пп.1-4 и фармацевтически приемлемый буферный раствор.
6. Применение фармацевтической композиции по п.5 для защиты субъекта от вирусов гриппа А субтипа Н1.
7. Применение фармацевтической композиции по п.5 в составе противогриппозной векторной вакцины.
| Штамм рекомбинантной псевдоаденовирусной частицы на основе генома аденовируса человека 5 серотипа Ad5-tetOFF-E3-HA125, несущей ген консенсусной последовательности гемагглютинина вируса гриппа А субтипов H1, H2, H5 для создания противогриппозных иммуногенных препаратов, способ получения гена | 2018 |
|
RU2713722C1 |
| РЕКОМБИНАНТНАЯ ПСЕВДОАДЕНОВИРУСНАЯ ЧАСТИЦА НА ОСНОВЕ ГЕНОМА АДЕНОВИРУСА ЧЕЛОВЕКА 5 СЕРОТИПА, ПРОДУЦИРУЮЩАЯ ГЕМАГГЛЮТИНИН ВИРУСА ГРИППА ШТАММА A/Brisbane/59/2007(H1N1) И СПОСОБ ЕЕ ИСПОЛЬЗОВАНИЯ | 2012 |
|
RU2523599C1 |
| US 11253608 B2, 22.02.2022. | |||
Авторы
Даты
2023-09-01—Публикация
2023-06-16—Подача