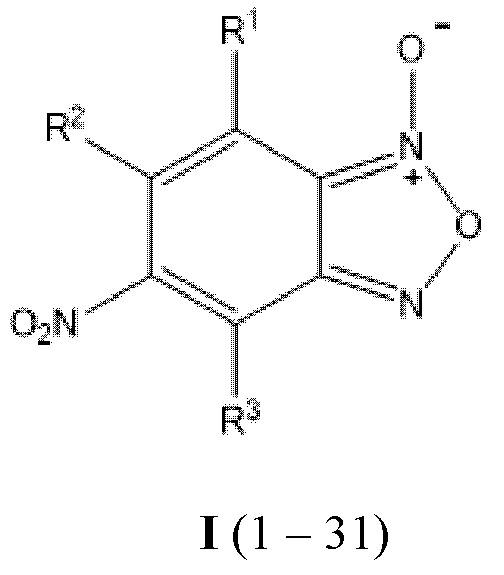
Изобретение относится к области органической химии, в частности, к новым азот- и кислородсодержащим гетероциклическим соединениям, а именно - к стабильным анилинзамещенным производным 5-нитро-4,6-дихлор- и 4,6-динитро-5,7-дихлор-бензофуроксанов общей формулы I (1-31), которые обладают высокой антибалантидиозной активностью при низких концентрациях (0,001 мас.%) и которые могут найти применение в области ветеринарии и медицины.
 ,
,
где:











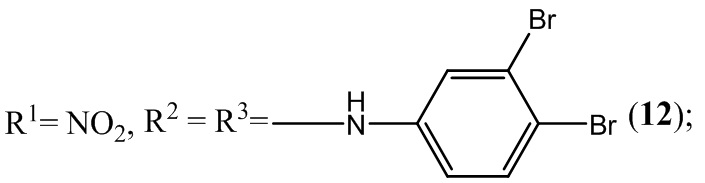



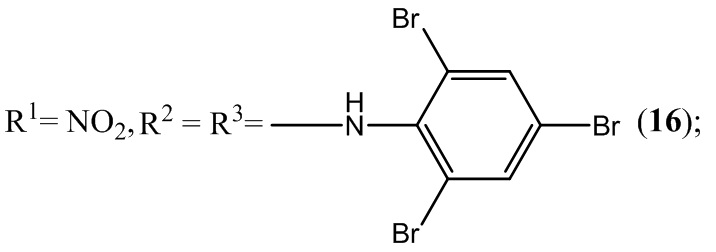


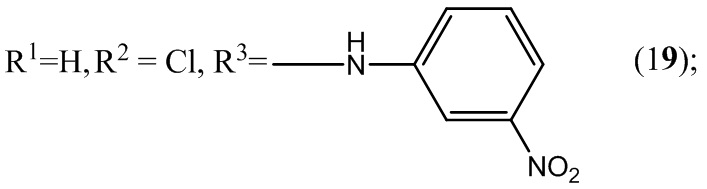
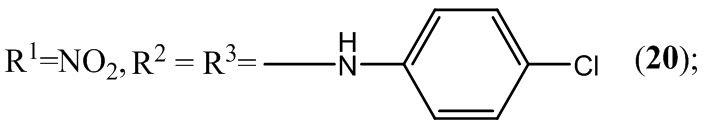










Разработка новых отечественных лекарственных препаратов в настоящее время в связи с санкциями Евросоюза поставлена российским государством в ранг основных приоритетных направлений социально-экономического развития и национальной безопасности нашей страны. Поэтому в плане адаптации к новым рыночным условиям фундаментальной задачей органической, фармацевтической и медицинской химии является разработка новых отечественных эффективных лекарственных средств, обладающих высокой физиологической активностью и минимальной токсичностью. Для успешного осуществления поставленной правительством задачи необходимо решать вопросы, находящиеся на стыке многих областей науки - химии, физики, биологии, ветеринарии и медицины. Однако отсутствие на дату подачи заявки единой удовлетворительной теории, связывающей химическое строение с биологической активностью, существенно замедляет появление новых отечественных лекарственных препаратов не только в России, но и во всем мире.
Заявителем впервые получены соединения нового класса, ранее не известные из уровня техники и не имеющие аналогов в мире. После проведения заявителем биологических испытаний на живых культурах балантидий у свиней были получены высокие обнадеживающие результаты. Кроме того, заявленные соединения по данным ТГ-ДСК (термогравиметрии и сканирующей калориметрии) являются термически стабильными при нагревании до 200°С без разложения и потери массы и выдерживают стерилизацию и автоклавирование.
Структурных аналогов заявленных соединений, обладающих антибалантидиозной активностью, заявителем из исследованного уровня техники не выявлено.
На основе синтеза заявленных соединений можно создавать лекарственные формы для профилактики и лечения балантидиоза свиней, что может найти применение в ветеринарии.
Балантидиоз - широко распространенное заболевание свиней на сельскохозяйственных фермах, возбудителем которого является инфузория Balantidium coli, обитающая главным образом в толстом отделе кишечника свиней [https://ru.wikipedia.org/wiki/Балантидиоз]. Кроме свиней, балантидиозом болеют и другие животные, а также человек. Болезнь протекает с явлениями катарального колита или катарально-геморрагического энтероколита, сопровождается диареей, исхуданием, в кале обнаруживается кровь. Животные лежат, отказываются от корма. Потери в массе, как правило, продолжаются и после лечения. Болезнь продолжается от трех недель до двух месяцев, часто до полного истощения. Диагноз ставят по клиническим признакам и результатам исследования проб фекалий, где обнаруживается большое количество подвижных балантидий и цисты.
Тактика лечения балантидиоза включает уничтожение возбудителя, снятия интоксикации и поддержание общего состояния организма животного. Анализ уровня техники, проведенный заявителем, показал, что для лечения балантидиоза известен целый ряд препаратов.
Так, известно изобретение по патенту RU № 2032415 «Способ профилактики и лечения балантидиоза свиней», сущностью является способ профилактики и лечения балантидиоза свиней, включающий дачу с питьем поросятам перед отъемом от свиноматки биологически активных веществ, отличающийся тем, что дачу биологически активного вещества осуществляют за три дня перед отъемом от свиноматки 2 раза в день, причем биологически активное вещество в дозе 0,3-0,5 г/кг массы животного растворяют в 20-30 мл дистиллированной воды и задают совместно с трихополом в дозе 0,2-0,5 г на голову. Способ по п.1, отличающийся тем, что в качестве биологически активного вещества используют препарат растительного происхождения, включающий растительный экстракт, например сена люцерны, содержащий растворимые соли металлов, мг/кг растительной массы: Мо 8,0; Ва 10,0; Рв 20,0; V 1,0; Cz 0,5; Zn 200,0; Fe 300,0; Sn 40,0.
Кроме этого из описания известного изобретения выявлено, что для лечения балантидиоза обычно применяют:
орасол в дозе: животным 2-3 мес. 0,1-0,2; 3-4 мес 0,2-0,3; 4-8 мес 0,3-0,4; 8-12 мес, 0,4-0,5; старше 12-ти мес 0,5-0,7;
тилан назначают в дозе 0,00125 г/кг 2 раза в день три дня подряд, после трехдневного перерыва курс лечения повторяют. Препарат смешивают в воде в течение 20 мин, а затем смешивают с кормом;
метронидазол поросятам дают в дозе 0,25 г 2 раза в день три дня подряд; через 3-7 дней повторяют 2-3 раза;
ветдипасфен для лечения поросят до 30 дней применяют в дозе 0,125 г от 31 дня до 60-го 0,25 г, от 61 до 120 дней 0,375 г и старше 120 дней 0,725 г ежедневно по 1 разу в день три дня подряд;
фуразолидон назначают в дозе 0,01 г/кг 3 раза в день в течение 3-5 дней;
йодинол рекомендуют 4-6 месячным поросятам по 20-25 мл на один прием 2 раза в день в течение 7-10 дней с небольшой порцией корма;
Недостатком известных средств для лечения балантидиоза является:
- выработка высокой устойчивости, так как многолетнее лечение этими препаратами в течение многих лет вызывает привыкание к нему паразитов;
– имеют высокую стоимость.
Заявленные соединения из исследованного уровня техники не выявлены.
Техническим результатом заявленного технического решения является расширение арсенала средств указанного назначения путем создания соединений нового поколения – анилинзамещенных производных 5-нитро-4,6-дихлорбензофуроксана и 4,6-динитро-5,7-дихлорбензофуроксана(1-31) общей формулы I, обладающих антибалантидиозной активностью в низких концентрациях (0,001мас.%) и термической стабильностью – до 180-200°С по данным метода ТГ-ДСК.
При этом заявленные соединения обладают невысокой стоимостью.
Сущностью заявленного технического решения являются анилинзамещенные производные нитробензофуроксанов 1-2, 6-17, 20, 22-23, 25, 27, 29-31 общей формулы I:

I (1-2,6-17,20,22-23,25,27,29-31), где:






















Применение анилинзамещенных производных нитробензофуроксанов общей формулы I(1-31) в качестве антибалантидиозных средств:

I (1 – 31), где:































Заявленное техническое решение иллюстрируется Фиг.1 – Фиг.5.
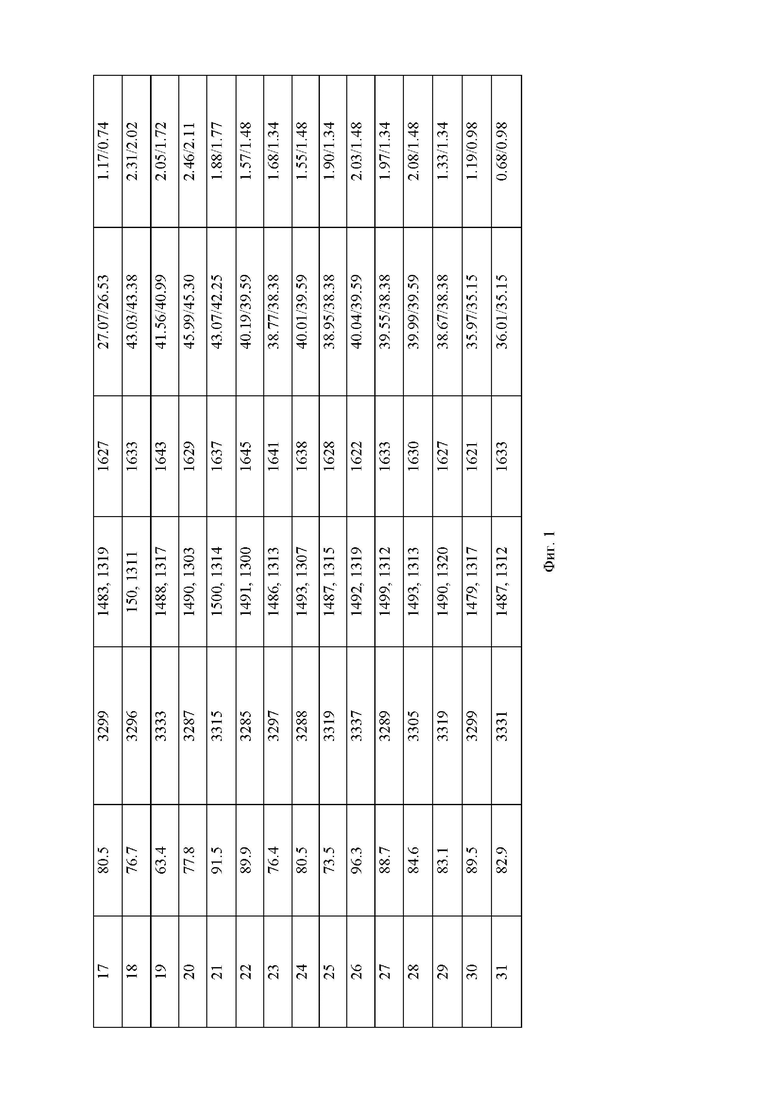
На Фиг.1 представлена Таблица 1, содержащая характеристики заявленных соединений(1-31), полученные опытным путем.
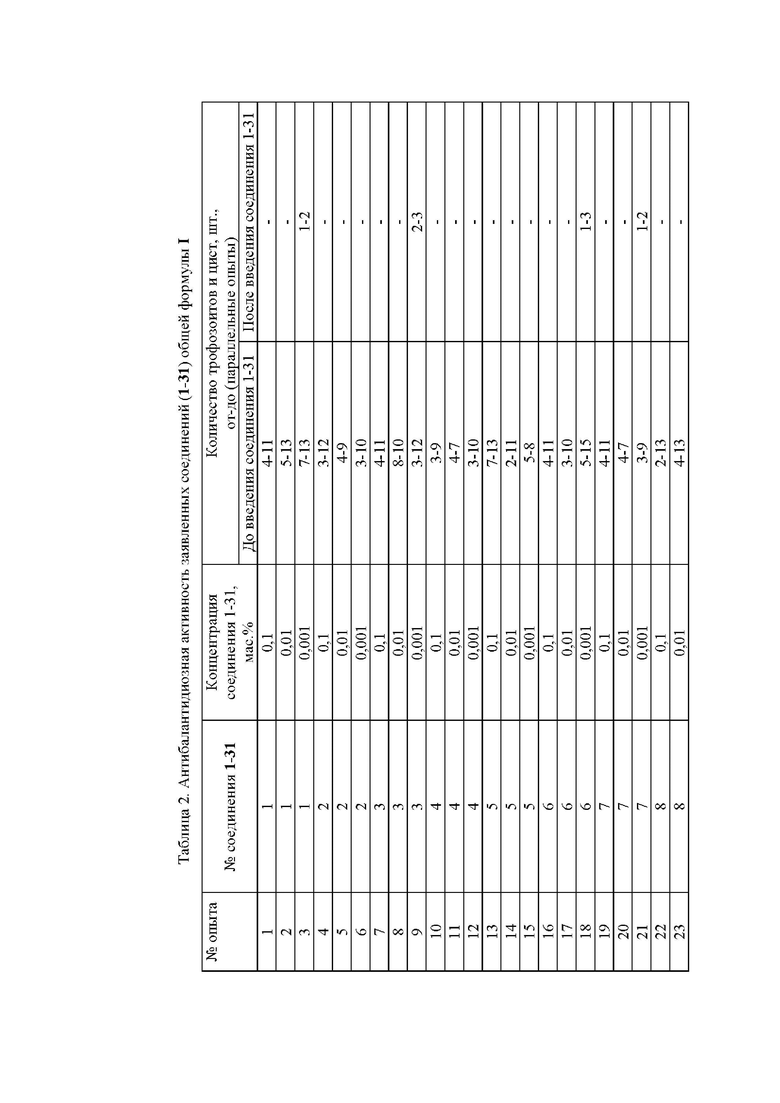
На Фиг.2 представлена Таблица 2, в которой приведена антибалантидиозная активность заявленных соединений(1-31) общей формулы I.
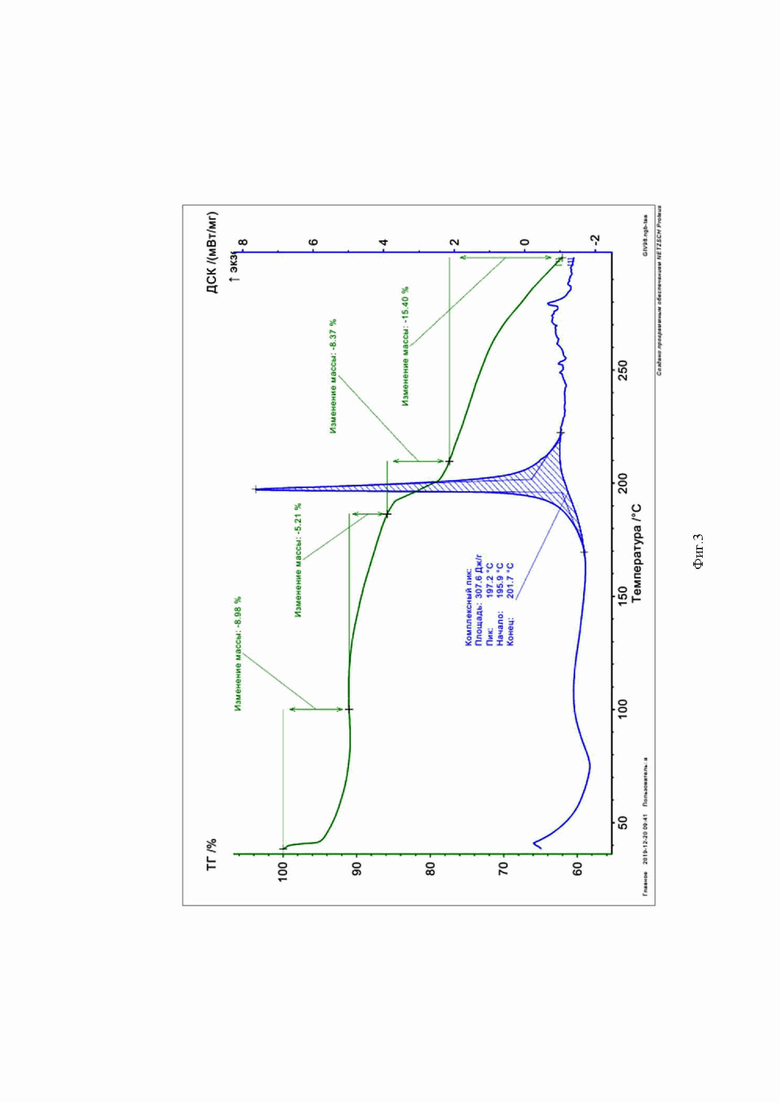
На Фиг. 3 представлена кривая ТГ-ДСК для 5,7-бис((4-бромфенил)амино)4,6-динитробензофуроксана (4).
На Фиг. 4 представлена кривая ТГ-ДСК для 6-хлор-4-(2,3-дихлорфениламино)-5-нитробензофуроксана (23).
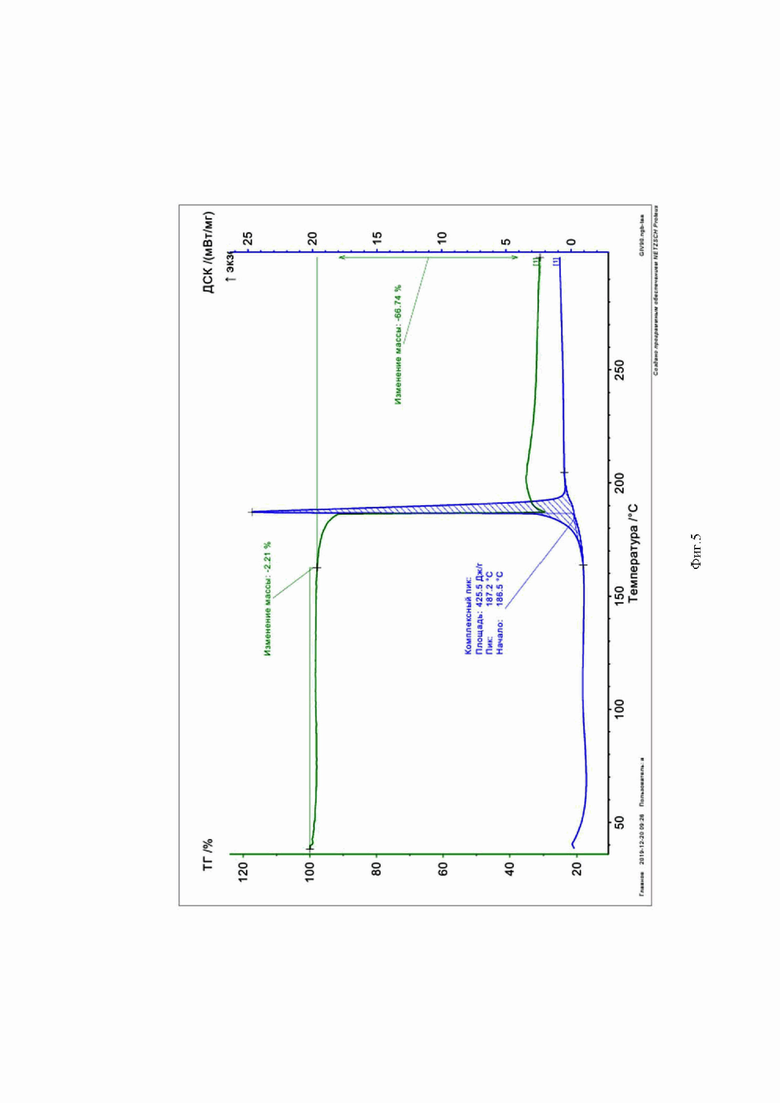
На Фиг. 5 представлена кривая ТГ-ДСК для 6-хлор-4-(3,5-дихлорфениламино)-5-нитробензофуроксана (29).
ТГ – термогравиметрия, ДСК – дифференциальная сканирующая калориметрия. Заявитель поясняет, что надписи на Фиг.3 – Фиг. 5 выполнены автоматически прибором – синхронным микротермоанализатором при снятии кривых и редактуре не подлежат.
Далее заявителем приведено описание заявленного технического решения.
Заявленный технический результат достигается получением заявленных соединений 1 – 31 общей формулы I.
Характеристика исходных реагентов:
– исходные амины на основе анилина являются товарными продуктами: 4-йоданилин,4-фторанилин, 4-броманилин, 2,3-диброманилин, 2,4-диброманилин, 2,5-диброманилин, 3,4-диброманилин, 3,5-диброманилин, 2,4,6-триброманилин, 3-нитроанилин, 4-хлоранилин, 2,3-дихлоранилин, 2,5-дихлоранилин, 3,4-дихлоранилин, 3,5-дихлоранилин, 2,4,6-трихлоранилин;
– 4,6-динитро-5,7-дихлорбензофуроксан(ДНДХБФ) получают по известному способу, описанному, например, в [Юсупова Л. М., Спатлова Л. / Оптимизация синтеза 5,7-дихлоро-4,6–динитробензофуроксана // Вестник Казанского технологического университета, 2011, с.49-56];
– 5-нитро-4,6-дихлорбензофуроксан (НДХБФ) получают по известному способу, описанному, например, в [Мухаметшина А.М., Юсупова Л.М., Хузиахметова А.Н. / Оптимизация синтеза 5-нитро-4,6-дихлорбензофуроксана с контролем качества исходного сырья, промежуточных и конечного продуктов реакции // Казанский национальный исследо-вательский технологический университет, 11 июня 2016] [https://izron.ru/articles/problemy-meditsiny-v-sovremennykh-usloviyakh-sbornik-nauchnykh-trudov-po-itogam-mezhdunarodnoy-nauch/sektsiya-52-farmatsevticheskaya-khimiya-farmakognoziya-spetsialnost-14-04-02/optimizat-siya-sinteza-5-nitro-4-6-dikhlorbenzofuroksana-s-kontrolem-kachestva-iskhodnogo-syrya-prome/].
Далее заявителем приведено получение соединений 1 – 31 формулы I в целом.
Заявленные соединения 1 – 31 общей формулы I получают по реакции исходных аминов на основе анилина с 4,6-динитро-5,7-дихлорбензофуроксаном или 5-нитро-4,6-дихлорбензофуроксаном.
Для этого к раствору 4 ммоля 5-нитро-4,6-дихлорбензофуроксана или 4,6-динитро-5,7-дихлорбензофураксанав 50 мл очищенного этанола прикапывают раствор 16 ммолей соответствующего исходного аминана основе анилина в 50 мл очищенного этанола.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
Выход и характеристики синтезированных соединений приведены в Таблице 1 на Фиг.1.
Далее заявителем приведены примеры осуществления заявленного технического решения.
Пример 1. Получение 5,7-бис(4-йодфениламино)-4,6-динитробензофуроксана ( 1 ) из 4-йоданилина и 4,6-динитро-5,7-дихлорбензофураксана.
К раствору1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают раствор 3,5 г (16 ммоль) 4-йоданилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (1) приведены в Таблице 1 на Фиг.1.
Пример 2. Получение 5,7-бис(4-фторфенил)амино)-4,6-динитробензофуроксана ( 2 ) из 4-фторанилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают раствор 1,78 г (16 ммоль) 4-фторанилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (2) приведены в Таблице 1 на Фиг. 1.
Пример 3. Получение 6-хлор-4-(4-фторофениламино)-5-нитробензофуроксана ( 3 ) из 4-фторанилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 5-нитро-4,6-дихлорбензофуроксана 1,0 г (4 ммоль) в 50 мл этилового спирта прикапывают 0,89 г (8 ммоль) 4-фторанилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
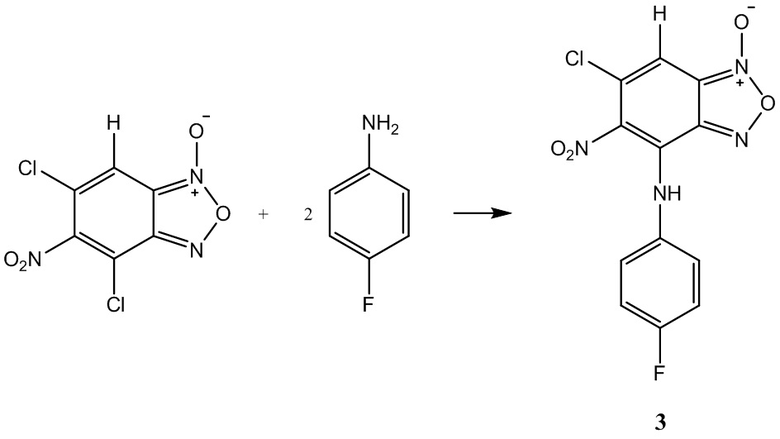
Выход и характеристики полученного соединения (3) приведены в Таблице 1 на Фиг.1.
Пример 4. Получение 5,7-бис(4-бромфениламино)-4,6-динитробензофуроксана ( 4 ) из 4-броманилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают раствор 2.75 г (16 ммоль) 4-броманилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (4) приведены в Таблице 1 на Фиг.1.
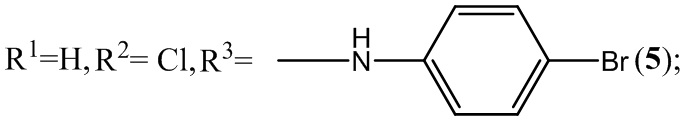
Пример 5. Получение 4-(4-бромфениламино)-6-хлор-5-нитробензофуроксана ( 5 ) из 4-броманилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору5-нитро-4,6-дихлорбензофуроксана1,0 г (4 ммоль) в 50 мл этилового спирта прикапывают 1,38 г (8 ммоль) 4-броманилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта 5отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
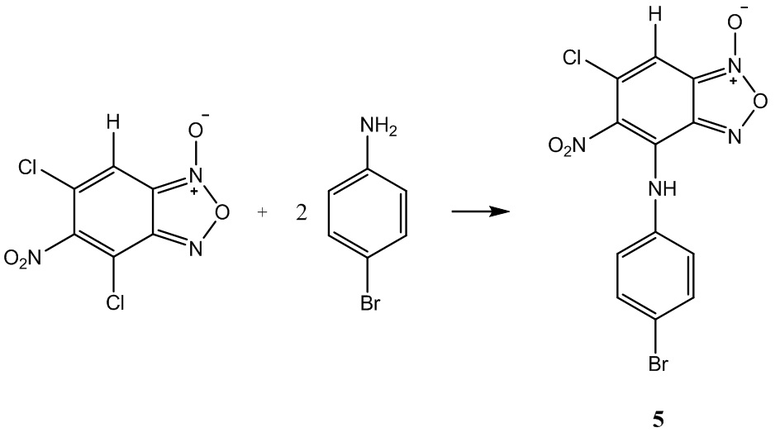
Выход и характеристики полученного соединения (5) приведены в Таблице 1 на Фиг.1.
Пример 6. Получение 5,7-бис(2,3-дибромфениламино)-4,6-динитробензофуроксана(6) из 2,3-диброманилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 4.02 г (16 ммоль) 2,3-диброманилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
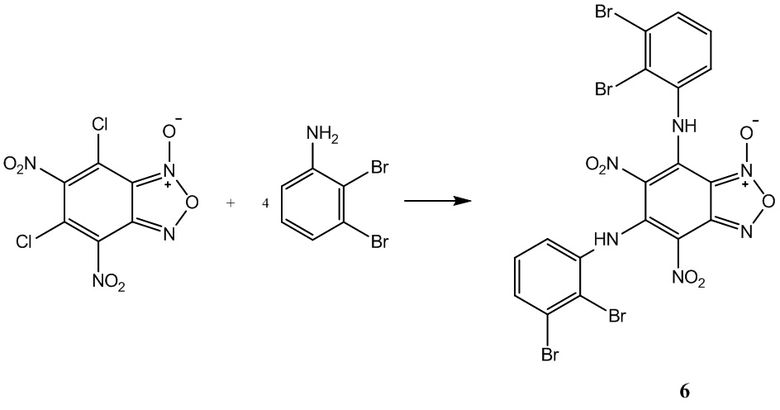
Выход и характеристики полученного соединения (6) приведены в Таблице 1 на Фиг.1.
Пример 7. Получение 6-хлор-4-(2,3-дибромфениламино)-5-нитробензофуроксана ( 6 ) из 2,3-диброманилин и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 5-нитро-4,6-дихлорбензофуроксана 1,0 г (4 ммоль) в 50 мл этилового спирта прикапывают 2,01 г (8 ммоль) 2,3-диброманилинав 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
Выход и характеристики полученного соединения (7) приведены в Таблице 1 на Фиг.1.
Пример 8. Получение 5,7-бис(2,4-дибромфениламино)-4,6-динитробензо-фуроксана ( 7 ) из 2,4-диброманилин и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 4,01 г (16 ммоль) 2,4-диброманилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (8) приведены в Таблице 1 на Фиг.1.
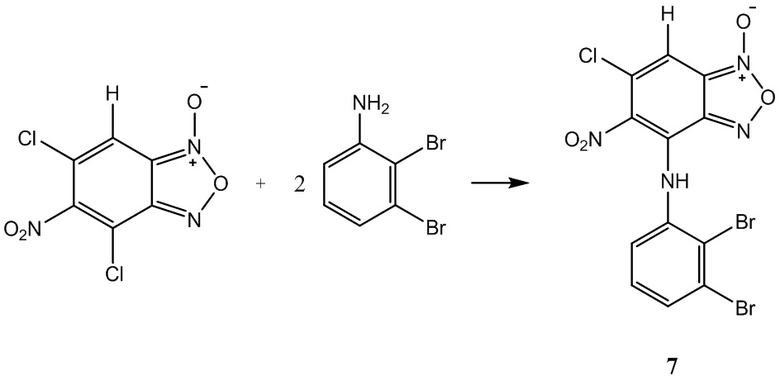
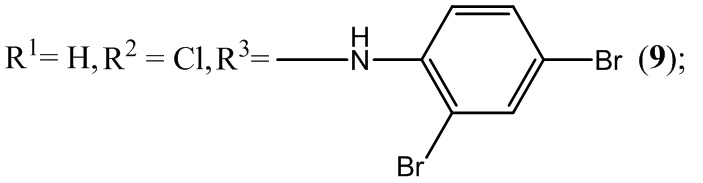
Пример 9. Получение 6-хлор-4-(2,4-дибромфениламино)-5-нитробензофуроксана ( 7 ) из 2,4-диброманилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,01 г (8 ммоль) 2,4-диброманилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
Выход и характеристики полученного соединения (9) приведены в Таблице 1 на Фиг. 1.
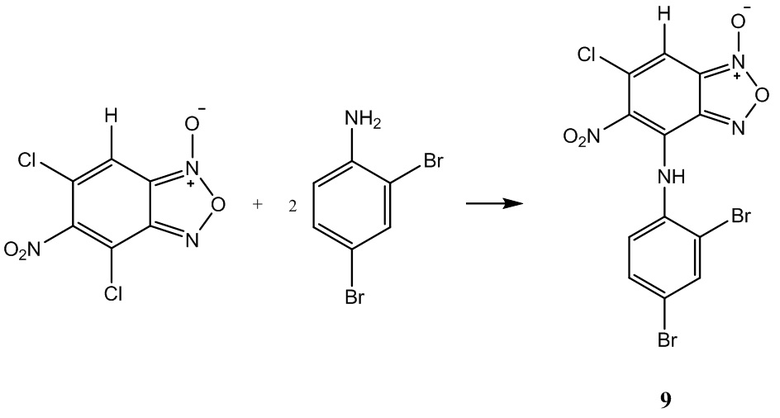
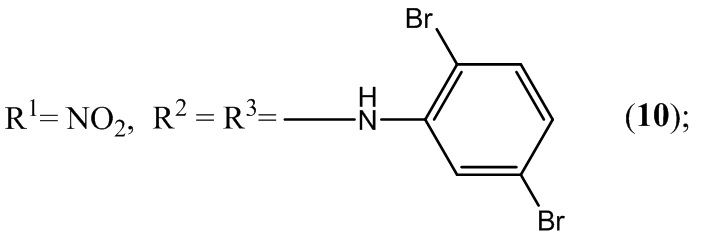
Пример 10. Получение 5,7-бис(2,5-дибромфениламин)-4,6-динитробензо-фуроксана ( 7 ) из 2,5-диброманилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 4,01 г (16 ммоль) 2,5-диброманилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
Выход и характеристики полученного соединения (10) приведены в Таблице 1 на Фиг. 1.
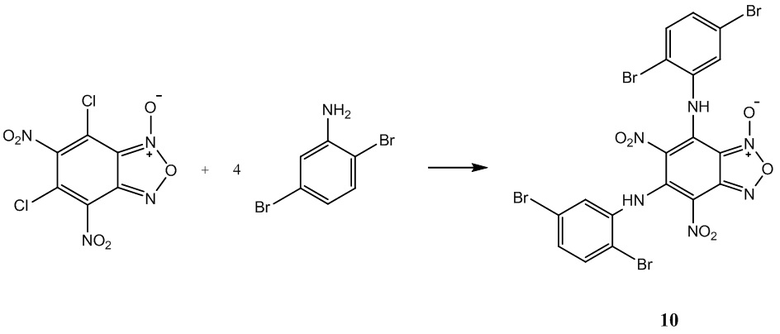
Пример 11. Получение 6-хлор-4-(2,5-дибромфениламино)-5-нитробензо-фуроксана (11) из 2,5-диброманилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,01 г (16 ммоль) 2,5-диброманилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (11) приведены в Таблице 1 на Фиг. 1.
Пример 12. Получение 5,7-бис(3,4-дибромфениламино)-4,6-динитробензо-фуроксана ( 7 ) из 3,4-диброманилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 4,01 г (16 ммоль) 3,4-диброманилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (12) приведены в Таблице 1 на Фиг. 1.
Пример 13. Получение 6-хлор-4-(3,4-дибромфениламино)-5-нитробензо-фуроксана (13) из 3,4-диброманилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,01 г (8 ммоль) 3,4-диброманилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (13) приведены в Таблице 1 на Фиг. 1.
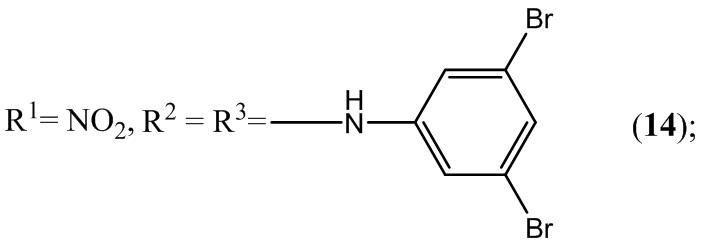
Пример 14. Получение 5,7-бис(3,5-дибромфениламино)-4,6-динитробензо-фуроксана (14) из 3,5-диброманилин и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 4,01 г (16 ммоль) 3,5-диброманилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
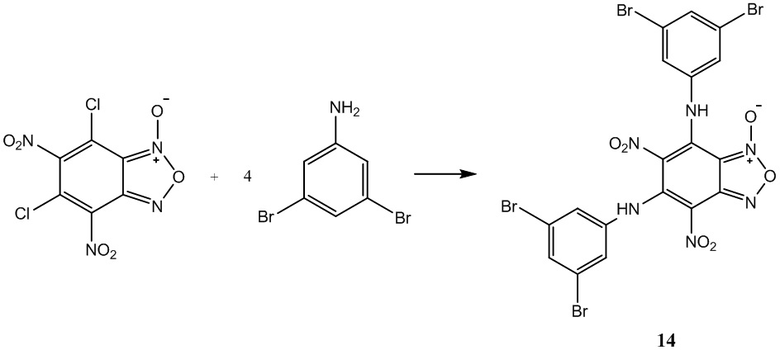
Выход и характеристики полученного соединения (14) приведены в Таблице 1 на Фиг. 1.
Пример 15. Получение 6-хлор-4-(3,5-дибромфениламино)-5-нитробензо-фуроксана (15) из 3,5-диброманилин и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,01 г (8 ммоль) 3,5-диброманилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
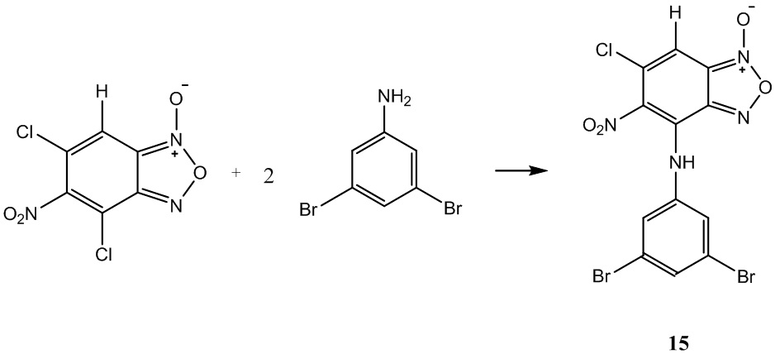
Выход и характеристики полученного соединения (15) приведены в Таблице 1 на Фиг. 1.
Пример 16. Получение 5,7-бис(2,4,6-трибромфениламино)-4,6-динитробензо-фуроксана (16) из 2,4,6-триброманилин и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 5.28 г (16 ммоль) 2,4,6-триброманилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
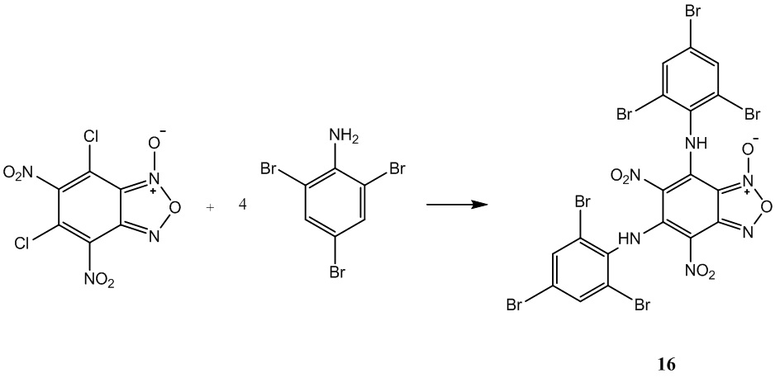
Выход и характеристики полученного соединения (16) приведены в Таблице 1 на Фиг. 1.
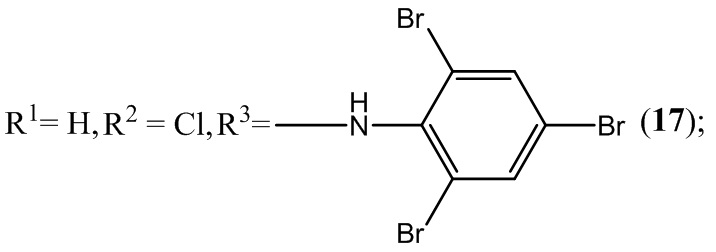
Пример 17. Получение 6-хлор-5-нитро-4-(2,4,6-трибромфениламино)-бензофуроксана (1 7 ) из 2,4,6-триброманилин и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,54 г (8 ммоль) 2,4,6-триброманилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (17) приведены в Таблице 1 на Фиг. 1.
Пример 18. Получение 4,6-динитро-5,7-бис(3-нитрофениламино)бензофуроксана (18) из 3-нитроанилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,21 г (16 ммоль) 3-нитроанилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
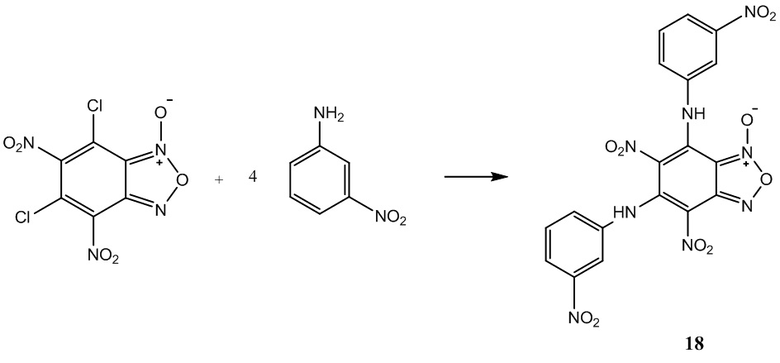
Выход и характеристики полученного соединения (18) приведены в Таблице 1 на Фиг. 1.
Пример 19. Получение 6-хлор-5-нитро-4-(3-нитрофениламино)бензофуроксана (19) из 3-нитроанилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 1,10 г (8 ммоль) 3-нитроанилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (19) приведены в Таблице 1 на Фиг. 1.
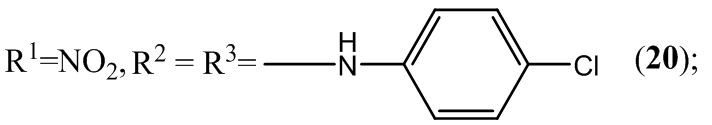
Пример 20. Получение 5,7-бис(4-хлорфениламино)-4,6-динитробензофуроксана (20) из 4-хлоранилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,04 г (16 ммоль) 4-хлоранилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (20) приведены в Таблице 1 на Фиг. 1.
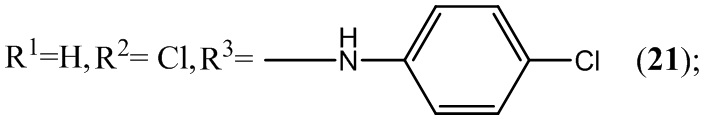
Пример 21. Получение 6-хлор-4-(4-хлорфениламино)-5-нитробензофуроксана (21) из 4-хлоранилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 1,02 г (8 ммоль) 4-хлоранилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
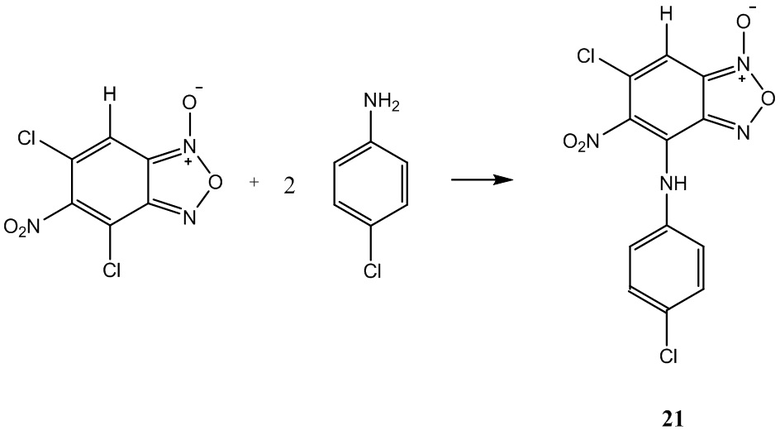
Выход и характеристики полученного соединения (21) приведены в Таблице 1 на Фиг. 1.
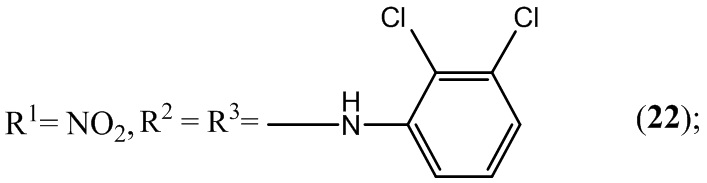
Пример 22. Получение 5,7-бис(2,3-дихлорфениламино)-4,6-динитробензо-фуроксана (22) из 2,3-дихлоранилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,59 г (16 ммоль) 2,3-дихлоранилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (22) приведены в Таблице 1 на Фиг. 1.
Пример 23. Получение 6-хлор-4-(2,3-дихлорфениламино)-5-нитробензофуроксана (23) из 2,3-дихлоранилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 1,3 г (8 ммоль) 2,3-дихлоранилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (23) приведены в Таблице 1 на Фиг. 1.
Пример 24. Получение 5,7-бис(2,5-дихлорфениламино)-4,6-динитробензо-фуроксана (24) из 2,5-дихлоранилин и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксанав 50 мл этилового спирта прикапывают 2,59 г (16 ммоль) 2,5-дихлоранилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (24) приведены в Таблице 1 на Фиг. 1.
Пример 25. Получение 6-хлор-4-(2,5-дихлорфениламино)-5-нитробензофуроксана (25) из 2,5-дихлоранилин и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 1.3 г (8 ммоль) 2,5-дихлоранилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
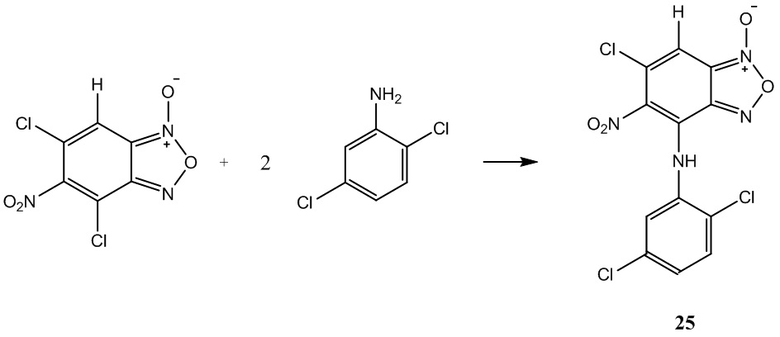
Выход и характеристики полученного соединения (25) приведены в Таблице 1 на Фиг. 1.
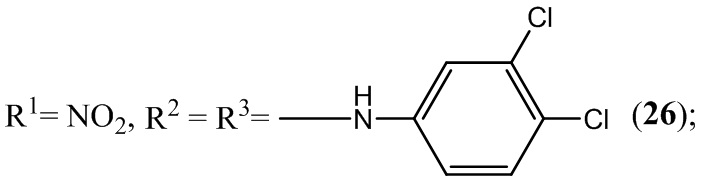
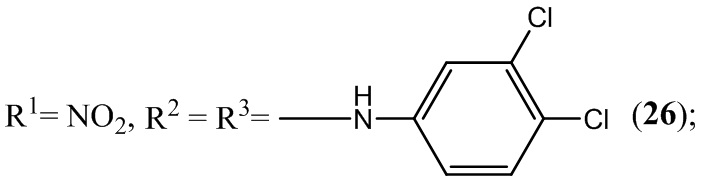
Пример 26. Получение 5,7-бис(3,4-дихлорфениламино)-4,6-динитробензо-фуроксана (26) из 3,4-дихлоранилин и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,59 г (16 ммоль) 3,4-дихлоранилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.
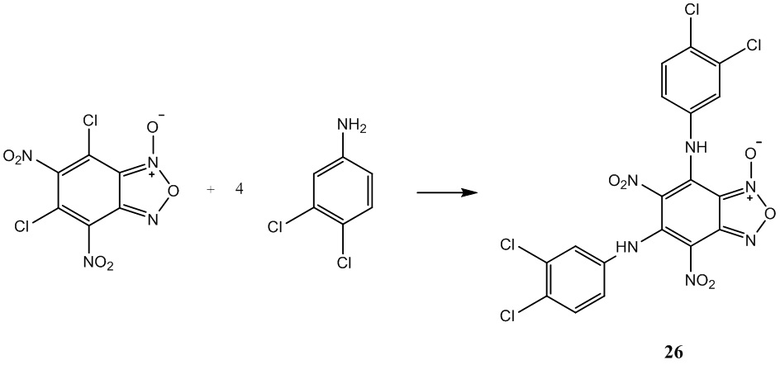
Выход и характеристики полученного соединения (26) приведены в Таблице 1 на Фиг. 1.
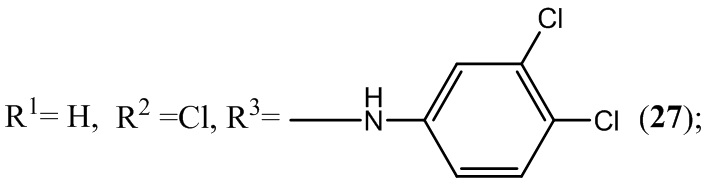
Пример 27. Получение 6-хлор-4-(3,4-дихлорфениламино)-5-нитробензофуроксана (27) из 3,4-дихлоранилин и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 1,3 г (8 ммоль) 3,4-дихлоранилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (27) приведены в Таблице 1 на Фиг. 1.
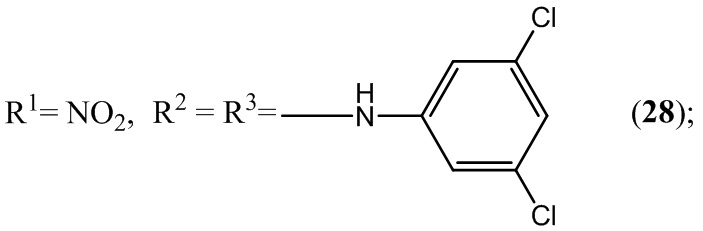
Пример 28. Получение 5,7-бис(3,5-дихлорфениламино)-4,6-динитробензо-фуроксана (28) из 3,5-дихлоранилина и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 2,59 г (16 ммоль) 3,5-дихлоранилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (28) приведены в Таблице 1 на Фиг. 1.
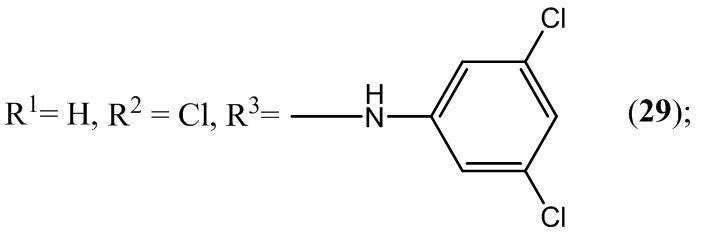
Пример 29. Получение 6-хлор-4-(3,5-дихлорфениламино)-5-нитробензофуроксана (29) из 3,5-дихлоранилина и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 1,3 г (8 ммоль) 3,5-дихлоранилина в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (29) приведены в Таблице 1 на Фиг. 1.
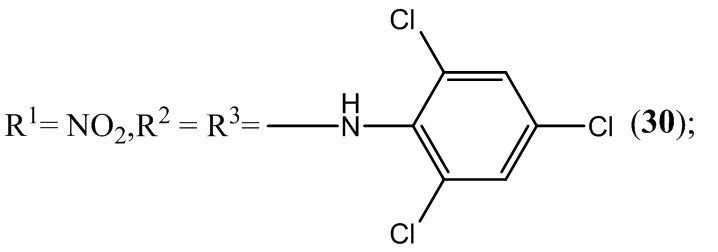
Пример 30. Получение 4,6-динитро-5,7-бис(2,4,6-трихлорфениламино)-бензофуроксана (30) из 2,4,6-трихлоранилин и 4,6-динитро-5,7-дихлорбензофуроксана.
К раствору 1,2 г (4 ммоль) 4,6-динитро-5,7-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 3,14 г (16 ммоль) 2,4,6-трихлоранилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (30) приведены в Таблице 1 на Фиг. 1.
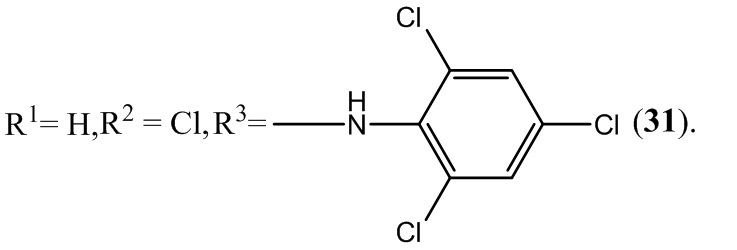
Пример 31. Получение 6-хлор-5-нитро-4-(2,4,6-трихлорфениламино)-бензофуроксана (31) из 2,4,6-трихлоранилин и 5-нитро-4,6-дихлорбензофуроксана.
К раствору 1,0 г (4 ммоль) 5-нитро-4,6-дихлорбензофуроксана в 50 мл этилового спирта прикапывают 1,57 г (8 ммоль) 2,4,6-трихлоранилин в 50 мл этилового спирта.
Полученный раствор перемешивают при комнатной температуре в течение 12 часов, затем выдерживают 24 часа. Выпавший осадок целевого продукта отфильтровывают, промывают этиловым спиртом и диэтиловым эфиром, сушат в вакууме.

Выход и характеристики полученного соединения (31) приведены в Таблице 1 на Фиг. 1.
Пример 32. Исследование термической стабильности заявленных соединений общей формулы I .
Заявителем изучена термическая стабильность заявленных соединений общей формулы I методом термогравиметрии и сканирующей калориметрии (ТГ-ДСК), Термическую устойчивость изучали с использованием синхронного микротермоанализатора STA 449C Jupiter (Netzsch, Германия), сопряженного с квадрупольным масс-спектрометром QMS403C Aeolos (Netzsch, Германия); скорость нагрева образца составила 10 град/мин в среде аргона.
В результате исследований выявлено, что температуры плавления заявленных соединений (1-31) общей формулы I имеют значения до 180-200°С, что свидетельствует об их высокой термической стабильности.
В качестве примера заявителем приведены кривые ТГ-ДСК для соединений 4 (Фиг.3), 23 (Фиг.4), 29(Фиг.5)формулы I.
Из кривых ТГ-ДСК анализа на кривых видно, что приведенные соединения 4, 23 и 29 формулы I действительно обладают высокой термической стабильностью с соответствующими температурами плавления 197,2°С, 184,3°С и 187,2°С соответственно, что делает возможным их стерилизацию при 100°С.
Пример 33. Исследование антибалантидиозной активности заявленных соединений (1-31) общей формулы I .
Исследования антибалантидиозной активности заявленных соединений (1-31) общей формулы I проводили на свинках различных возрастных групп, спонтанно зараженных балантидиозом. В качестве контроля проведен опыт без введения свинкам заявленных соединений.
До начала опыта с целью выявления балантидий в организме свинок их копрологически исследовали под микроскопом известными методами: методом нативного мазка [https://dpo-ilm.ru/materials/76/158?ysclid=l55s94uz0192694919] и методом Дарлинга[https://www.zoovet.ru/stati/slovar-veterinarnykh-terminov/metod_darlinga/?ysclid=l55s849pbh915661123].
При этом с целью лучшей дифференцировки цист и вегетативных форм балантидий (трофозоитов) нативные мазки подкрашивали раствором Люголя.
В результате исследования у всех свинок выявлен балантадиоз, результаты приведены в Таблице 2 на Фиг.2.
Для проведения исследования из фекалий спонтанно зараженных свинок культивировали вегетативные формы балантидий (трофозоитов) и исследовали на них и цистах антибалантидиозную активность заявленных соединений (1-31) общей формулы I.
Для этого в стерильной колбе Эрленмейра (1 г фекалий на 200 мл отстоявшейся, в течение 7 суток водопроводной воды) при температуре 23°C в темноте в течение 20 дней выращивали вегетативные формы балантидий. Полученную взвесь с живыми балантидиями и цистами при перемешивании распределяли по 9 мл по 93 стерилизованным пробиркам с крышкамии исследовали её на количество трофозоитов и цист в нативных мазках под микроскопом по известной методике [Першин Г.Н. Методы экспериментальной химиотерапии. – М.: Медицина, 1971. – 245 с.].
Результаты приведены в Таблице 2 на Фиг.2, столбец «до введения соединения 1-31». При этом в каждом из 93 опытов (по 3 опыта на каждое соединение) провели по 3 параллельных замера – последовательно троекратно замеряли под микроскопом количество паразитов в поле зрения микроскопа: минимальное и максимальное количество отражено в Таблице 2 – интервал «от и до».
Затем для установления антибалантидиозной активности заявленных соединений приготовили их растворы концентраций 0.1 мас.%, 0.01 мас.%, 0.001 мас.%, при этом приготовили сначала исходные 1 мас.% растворы. Затем в каждую пробирку (по 9 мл в каждой пробирке) с установленным, как описано выше, исходным количеством трофозоитов и цист медленно прикапывали такое расчетное количество приготовленного 1 мас.% раствора каждого испытуемого соединения 1-31, чтобы обеспечить создание точных концентраций в каждой пробирке, а именно:
для создания 0.1 мас.% концентрации прикапывали 1 мл 1 мас.% раствора,
для создания 0.01 мас.% концентрации прикапывали 0.1 мл 1 мас.% раствора,
для создания 0.001 мас.% концентрации прикапывали 0.01 мл 1 мас.% раствора.
Затем, ровно через 30 минут (по секундомеру) замеряли количество цист и трофозоитов балантидий в поле зрения микроскопа в каждой пробирке.
Результаты приведены в Таблице 2 на Фиг.2, столбец «после введения соединений 1-31». При этом в каждом из 93 опытов также провели по 3 параллельных замера.
Из результатов, приведенных в Таблице 2, видно, что заявленные соединения (1-31) общей формулы I проявили высокую антибалантидиозную активность на фоне их 30-минутной экспозиции на трофозоитах и цистах при низких концентрациях – до 0,001 мас.%.
Таким образом, из изложенного выше можно сделать вывод, что заявителем достигнут заявленный технический результат, а именно: расширен арсенал средств указанного назначения путем создания соединений нового поколения – анилинзамещенных производных 5-нитро-4,6-дихлорбензофуроксана и 4,6-динитро-5,7-дихлорбензо-фуроксана (1-31) общей формулы I, обладающих антибалантидиозной активностью в низких концентрациях (0,001мас.%) и термической стабильностью – до 180-200°C по данным метода ТГ-ДСК.
При этом заявленные соединения обладают невысокой стоимостью, так как синтезированы из недорогих исходных реагентов известными стандартными способами.
| название | год | авторы | номер документа |
|---|---|---|---|
| Пиперазинзамещенные производные 5-нитро-4,6-дихлорбензофураксана и 4,6-динитро-5,7-дихлорбензофураксана, обладающие антибалантидиозной активностью | 2022 |
|
RU2793329C1 |
| Способ получения 4,6-динитро-5,7-дихлорбензофуроксана | 2020 |
|
RU2752080C1 |
| Способ получения композиции 5-нитро-4,6-дихлорбензофуроксана и 4,6-динитро-5,7-дихлорбензофуроксана | 2021 |
|
RU2771002C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА НАТРИЯ 4,6-ДИНИТРО-5,7-ДИАМИНО-БЕНЗОФУРОКСАНА | 2012 |
|
RU2529486C2 |
| НОВЫЕ БЕНЗОФУРОКСАНЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ И БАКТЕРИЦИДНОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2428419C2 |
| Акарицидная фармацевтическая композиция, средства для лечения паразитарных заболеваний, вызванных чесоточными клещами, содержащие указанную композицию (варианты) | 2021 |
|
RU2768705C1 |
| 5,7-ДИЗАМЕЩЕННЫЙ-4,6-ДИНИТРОБЕНЗОФУРОКСАН ОБЩЕЙ ФОРМУЛЫ CNO(R), ОБЛАДАЮЩИЙ АКАРИЦИДНОЙ И БАКТЕРИЦИДНОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2255935C2 |
| ФУНГИЦИДНЫЙ СОСТАВ | 1992 |
|
RU2076803C1 |
| Способ получения карбонилзамещенных 1-сульфонилбензимидазолов | 1976 |
|
SU691089A3 |
| 4- ИЛИ 6-НИТРО-5,7-ДИХЛОРБЕНЗОФУРОКСАН, ОБЛАДАЮЩИЙ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2032678C1 |





Изобретение относится к области органической химии, в частности к анилинзамещенным производным нитробензофуроксана (1-31) общей формулы I, где R1, R2 R3 приведены в формуле изобретения. Анилинзамещенные производные нитробензофуроксана по изобретению обладают антибалантидиозной активностью. Технический результат - анилинзамещенные производные нитробензофуроксана, обладающие антибалантидиозной активностью при низких концентрациях (0,001 мас.%). 2 н.п. ф-лы, 3 ил., 2 табл., 31 пр.

1. Анилинзамещенные производные нитробензофуроксанов 1-2, 6-17, 20, 22-23, 25, 27, 29-31 общей формулы I:
 ,
,
где:

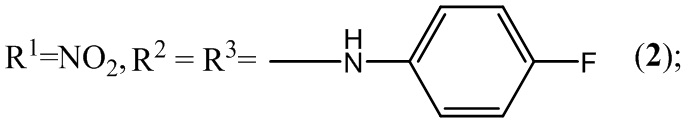


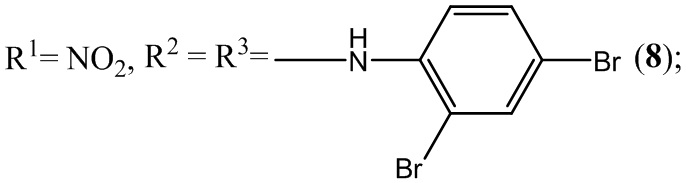







2. Применение анилинзамещенных производных нитробензофуроксанов общей формулы I (1-31) в качестве антибалантидиозных средств:
 ,
,
где:



























| Чугунова Елена Александровна: НОВЫЕ СИНТЕТИЧЕСКИЕ ВОЗМОЖНОСТИ БЕНЗОФУРОКСАНОВОЙ ПЛАТФОРМЫ ДЛЯ КОНСТРУИРОВАНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СИСТЕМ | |||
| На правах рукописи | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| "Институт органической химии им.А.Е.Арбузова - обособленное структурное подразделение федерального государственного бюджетного учреждения науки "Федеральный | |||
Авторы
Даты
2023-09-05—Публикация
2022-12-02—Подача