Изобретение относится к новым химическим соединениям, а именно к 4-нитро- или 6-нитро-5,7-дихлорбензофуроксанам общей формулы I
где Ia R1 NO2; R2 H (шифр Ю-У),
Iб R1 H, R2 NO2 (шифр Ю-VI)
Соединения Iа, б обладают выраженным фунгицидным действием, умеренно токсичны для теплокровных животных. Соединения Ia и Iб в литературе не описаны.
Известны структурные аналоги: бензофуроксан II и его монозамещенные производные
R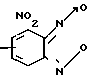 где R H, 4-NO2, 5-Cl, 5-Br, 4-CH3, 5-CH3, 5-OCH3; 4-нитробензофуразан III
где R H, 4-NO2, 5-Cl, 5-Br, 4-CH3, 5-CH3, 5-OCH3; 4-нитробензофуразан III диоксим 1,2-бензохинона IV и его производные
диоксим 1,2-бензохинона IV и его производные
R где R H, 4-Cl, 4-Br, 3-Br, 3-CH3, 4-OCH3.
где R H, 4-Cl, 4-Br, 3-Br, 3-CH3, 4-OCH3.
Соединения формул II-IV проявляют фунгицидное действие в концентрации 0,25% (разведение 1:400) (1,2), т.е. гораздо менее активны, чем соединения Ia и Iб. Этот эффект нельзя было предсказать заранее, так как увеличение числа заместителей в бензофуроксанах чаще всего приводит к снижению активности (3).
Для пропитки древесины железнодорожных шпал в настоящее время используется каменноугольное масло. Одним из недостатков каменноугольного масла является невысокая фунгицидная активность. Во-вторых, оно небезопасно, так как может содержать канцерогенные компоненты. Хотя по токсичности каменноугольное масло относится к умеренно опасным веществам, ЛД50 составляет 830 мг/кг (III класс опасности), часто при работе с ним на участках кожи, подверженных действию света, развивается воспалительная краснота с последующей пигментацией; при длительной работе с каменноугольным маслом возможны экземы, фолликулы, зуд, и гиперкератоз, пигментация кожи, рак (5, 6).
Целью изобретения является повышение фунгицидной активности в ряду нитробензофуроксанов.
Поставленная цель достигается синтезом полизамещенных бензофуроксанов, а именно ранее описанных 4-нитро и 6-нитро-5,7-дихлорбензофуроксанов общей формулы I, обладающих фунгицидным действием.
Соединение Iа получают путем нитрования 4,6-дихлорбензофуроксана, получение которого описано Боултоном (7).
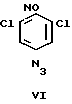
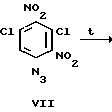
Соединение Iб получают взаимодействием доступного 2,6-дихлор-4-нитронитрозобензола (V) с азидом натрия в среде водного ацетона с последующим нитрованием продукта (VI) концентрированной азотной кислотой и циклизацией соединения VII в уксусной кислоте до целевого вещества Iб по схеме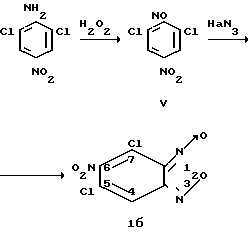
П р и м е р 1. 4-Нитро-5,7-дихлорбензофуроксан (Iа).
Готовят смесь из азотной кислоты (8 мл, d=1,51) и серной кислоты (90 мл, d= 1,84). Смесь охлаждают ледяной баней до 5оС и дозируют 4,1 (0,02 м) 4,6-дихлорбензофуроксана в течение 5 мин. Смесь затем нагревают до 50оС, выдерживают 1 ч, охлаждают до 20оС. Через 30 мин выдержки выливают в дробленный лед (300 г). Нитросоединение Iа отделяют фильтрованием. Выход 2,17 г (45% ). Т.пл. 123-125оС. Продукт можно было перекристаллизовать из гексана. Получают светло-желтые пластинки.
П р и м е р 2. 6-Нитро-5,7-дихлорбензофуроксан (Iб).
2,6-Дихлор-4-нитро-нитрозобензол.
К 3 г (0,01 м) 2,6-дихлор-4-нитроанилина в 30 мл трифторуксусной кислоты прибавляют 7,5 мл пергидроил (30% Н2О2) и 0,5 мл серной кислоты (d=1,84 г/см3) и выдерживают при 40оС в течение 4 ч. Охлаждают до комнатной температуры, разбавляют 30 мл воды, выпавший осадок отфильтровывают, промывают водой, сушат, масса 1,9 г (55%), т.пл. 114оС (спирт).
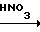
2,6-Дихлор-4-азидонитрозобензол (VI).
К суспензии 15,0 г (0,068 м) 2,6-дихлор-4-нитронитрозобензола в 250 мл ацетона прибавляют раствор 4,6 г (0,071 м) азида натрия в 30 мл воды. Реакционную смесь выдерживают при комнатной температуре в течение 75 мин. Осадок отфильтровывают, промывают водой, сушат. Выход 12,8 г (87%), т.пл. 147-148оС (гексан).
Найдено, С 33,17; Н 0,91; 0,93; N 25,79; Се 25,8
С6Р2Cl2N4О
Вычислено, С 33,18; H 0,92; N 25,81
ИК-спектр, см-1: 2120 (N 3), 1280 (NO).
3,5-Дихлор-2,4-динитрофенилазид (VII).
К cуcпензии 21,7 г (0,1 м) 2,6-дихлор-4-азидонитрозобензола в 200 мл хлороформа прибавляют по каплям 200 мл HNО3 (d=1,5 г/см3) при температуре не выше 20оС. Затем реакционную смесь кипятят (52-55оС) с обратным холодильником в течение 30 мин, охлаждают, разбавляют 200 мл воды при температуре не выше 50оС. Органический слой отделяют от водно-кислотного и дважды промывают водой (по 200 мл). Хлороформ отгоняют. Выход 27,2 г (98%), т.пл. 108-110оС. Перекристаллизовывают из гексана т.пл. 114-115оС.
6-Нитро-5,7-дихлорбензофуроксан (1б)
27,8 г (0,1 м) 3,5-дихлор-2,4-динитрофенилазида кипятят с обратным холодильником в 150 мл уксусной кислоты в течение 1 ч, охлаждают, разбавляют 300 мл воды. Выпавший осадок отфильтровывают, промывают водой, сушат. Выход 24,3 г (97%), т.пл. 115-117оС. Перекристаллизованный из гептана т.пл. 116-117оС.
Найдено, С 28,79, 28,80; Н 0,41, 0,42; N 16,78, 16,80.
С6НСl2N3О4
Вычислено, С 28,8; H 0,4; N 16,6
ИК-спектр, см-1: 1615 (С-N), 1365 (NO2). Спектр ПМР, диоксан-d6, δ, м.д. 7,97 с (4-Н).
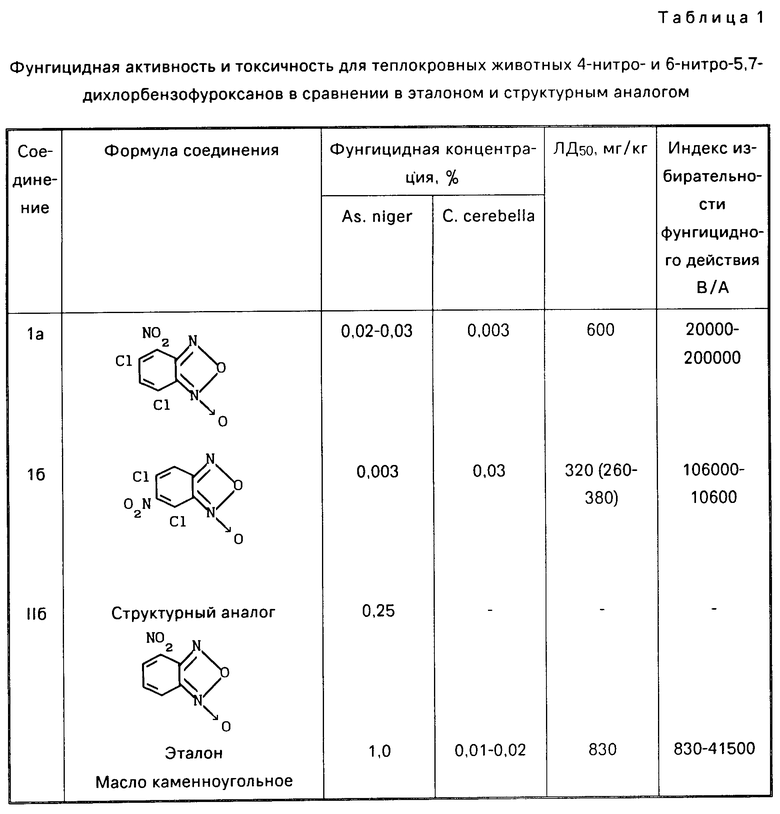
П р и м е р 3. Фунгицидная активность 4-нитро и 6-нитро-5,7-дихлорбензофуроксанов (Ia, Iб).
Фунгицидную активность соединений Iа и Iб изучают в лабораторных условиях на мицелии патогенных грибов по общепринятой методике (8). В качестве тест-объектов используют наиболее устойчивые виды грибов: возбудитель плесневения
БКМF-1119 и дереворазрушающий гриб.
Исследования проводят с серией растворов различной концентрации Ia и Iб. Повторность опытов 2-3-кратная. Экспозиция 3-5 сут, после чего проводят учет роста колоний грибов и по формуле Эббота подсчитывают процент подавления их роста. Результаты исследований представлены в табл. 1.
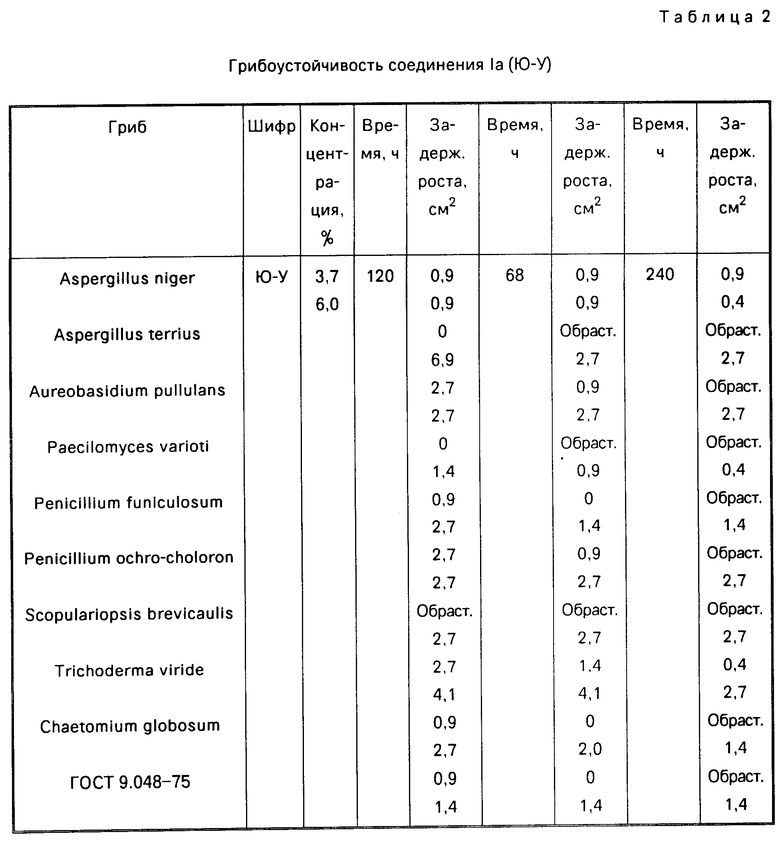
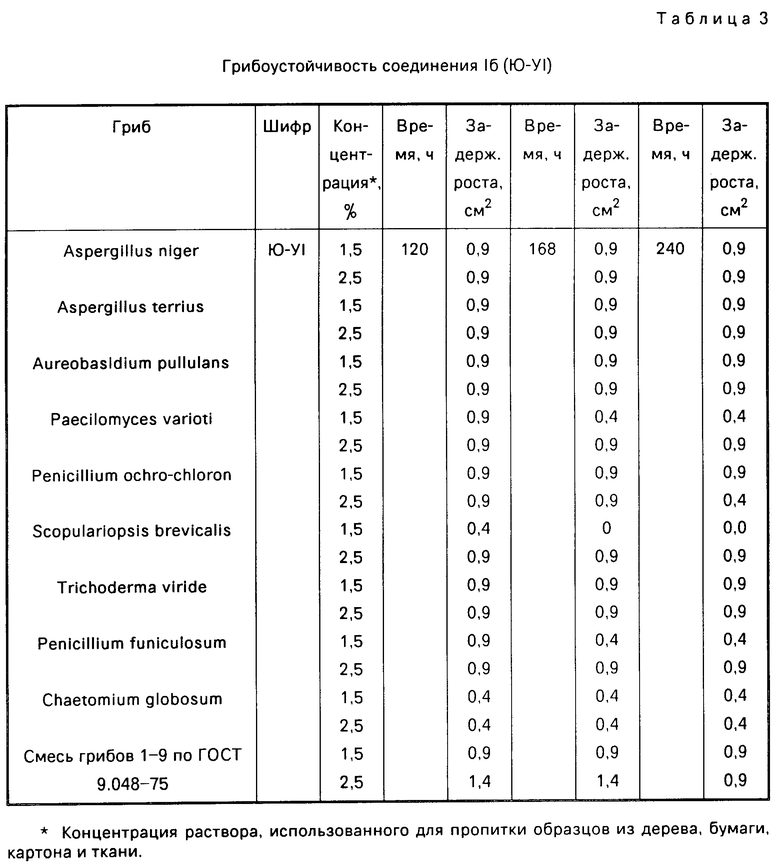
П р и м е р 4. Испытание на грибоустойчивость технических изделий из дерева, бумаги и картона по (9). Оценка активности проводится через 48 ч в течении нескольких суток. Величина диаметра зоны задержки роста гриба свидетельствует о активности соединения. Сравнение проводится со смесью грибов согласно ГОСТу. Результаты изучения на грибоустойчивость приведены в табл. 2 и 3.
П р и м е р 5. Острая оральная токсичность 4-нитро и 6-нитро-5,7-дихлорбензофуроксанов (Ia, Iб)
Токсичность соединений (Ia и Iб) определена на белых беспородных мышах массой 18-20 г при пероральном введении ацетоно-масляных растворов с вычислением ЛД50 и ее доверительных границ по методу Литчфилда и Уилкоксона (10). Результаты исследований приведены в табл. 1.
Как видно из представленных в табл. 1 данных, соединения Iа и Iб обладают выраженным фунгицидным действием. По данному показателю они превосходят структурный аналог на 1-2 порядка.
Данных по отношению к C.cerebella для структурного аналога в доступной литературе нет. Соединение Iа превосходит эталон в отношении дереворазрушающего гриба на порядок. Предлагаемые соединения Iа и Iб по индексу избирательности фунгицидного действия в отношении возбудителя плесневения превосходят эталон в 24-115 раз, в отношении C.cerebella соединение Ia в 4,8 раза, что показывает большую безопасность при применении предлагаемых соединений в сравнении с эталоном.
Для подтверждения высокой фунгицидной активности предлагаемые соединения были изучены на их грибоустойчивость согласно ГОСТу 9.048-85. Как видно из представленных в табл. 2 и 3 данных наиболее активным соединением является 1б (Ю-VI), которое задерживает рост плесневых грибов в малых концентрациях.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФУНГИЦИДНЫЙ СОСТАВ | 1992 |
|
RU2076803C1 |
| НОВЫЕ БЕНЗОФУРОКСАНЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ И БАКТЕРИЦИДНОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2428419C2 |
| СОСТАВ ДЛЯ ЛЕЧЕНИЯ СКВАМОЗНО-ГИПЕРКЕРАТОТИЧЕСКОЙ ФОРМЫ РУБРОМИКОЗА СТОП И КИСТЕЙ | 1998 |
|
RU2169564C2 |
| СОЛИ БЕНЗОФУРОКСАНОВ С ЛОМЕФЛОКСАЦИНОМ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2602804C1 |
| 2,8-ДИМЕТИЛ-3,7-ДИАЛКОКСИ-5-R -ФУРО [C,B] ТРОПИЛИЕВЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2103267C1 |
| 7-АЛКОКСИ-8,9-ДИГИДРОКСАНТИЛИЕВЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2100353C1 |
| 1,5,9,11- ТЕТРААЗАТРИЦИКЛО [7,3,3,1] ГЕКСАДЕКАНЫ | 1981 |
|
SU1014252A1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРАЗИНОВ, СОДЕРЖАЩИХ О-ГИДРОКСИФЕНИЛЬНУЮ ГРУППУ | 1991 |
|
RU2026295C1 |
| 4-ЗАМЕЩЕННЫЕ 11-НИТРО-1,4,7,9-ТЕТРААЗАТРИЦИКЛО 7,3,1,1 ТЕТРАДЕКАН-2,6-ДИОНЫ | 1982 |
|
SU1088330A1 |
| ВЫСШИЕ N-АЦИЛ-N, N -ТРИФЕНИЛ- β -АМИНОИЗОБУТИРИЛАМИДИНИЙ ХЛОРИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2024500C1 |
Область применения: в качестве антисептических средств защиты технических изделий, содержащих детали из дерева, бумаги, картона и ткани. Сущность изобретения: продукт - 4-нитро-5, 7-дихлорбензофуроксан, БФ, C6HCl2N3O4, выход 45%, т. пл. 123 - 125°С, 6-нитро-5, 7-дихлорбензофуроксан, выход 97%, т. пл. 115 - 117°С. 3 табл.
4- или 6-нитро-5,7-дихлорбензофуроксан формулы
где R1 NO2; R2 H или R1 H; R2 - NO2, обладающий фунгицидной активностью.
| Farm Scienes, 5,241, 1950 | |||
| Chemical Industria, 33,135-137, 1951 | |||
| J | |||
| Med | |||
| Shem, 11(2), 305-11, 1968 | |||
| J | |||
| Chem | |||
| Soc, B, 13, 1967, (9), 909-11. |
Авторы
Даты
1995-04-10—Публикация
1991-06-28—Подача