Изобретение относится к медицине, а именно - к медицине труда и пульмонологии и может быть использовано для прогнозирования развития профессиональной хронической обструктивной болезни легких (ПХОБЛ) в течение последующих 3-х лет у лиц, работающих в течение 5 и более лет в условиях воздействия аэрозолей, содержащих ненамернные наночастицы с кремнием.
Промышленные аэрозоли - один из основных профессиональных факторов риска здоровью. По данным Росстата, 4,5% всех работающих подвергаются воздействию аэрозолей преимущественно фиброгенного действия, 7,7% - химического фактора [1], при этом в условиях производства токсичные вещества попадают в организм человека преимущественно ингаляционным путем. Длительное воздействие токсичных химических веществ и ирритантов в виде пылей, газов, паров приводят к развитию профессиональных заболеваний органов дыхания. В современной профпатологии это наиболее тяжелая группа болезней, включающая в том числе жизнеугрожающие состояния [2, 3].
ПХОБЛ характеризуется неуклонно прогрессирующей стойкой бронхообструкцией и эмфиземой, что приводит к инвалидизации и снижению продолжительности жизни больных [3]. Заболевание может быть причиной прекращения работы по медицинским показаниям (по результатам экспертизы профпригодности) еще до появления критериев инвалидности - в случаях частых обострений в течение предыдущего года. По данным Роспотребнадзора, доля ПХОБЛ в структуре заболеваний, связанных с воздействием химического фактора, составляет 23,5% [2]. По результатам эпидемиологических исследований, в общей популяции 15,8% случаев смерти от ХОБЛ обусловлено влиянием профессиональных факторов [4].
Таким образом, управление риском профессиональной ХОБЛ является актуальной проблемой медицины труда. Эффективность первичной и вторичной профилактики тесно связана с возможностью прогноза развития заболевания. Прогнозирование необходимо для выделения группы риска -лиц, нуждающихся в более частом и точном обследовании, а также для разработки рекомендаций по рациональному трудоустройству [5].
Патогенные свойства промышленных аэрозолей зависят не только от химического состава, но и от размера частиц в аэрозолях. Этиологическим фактором ПХОБЛ являются токсичные/ирритантные газы и мелкие (менее 2,5 мкм) частицы, способные длительно оставаться во взвешенном состоянии и с инспираторным потоком воздуха достигать бронхиол и альвеол [7-9]. В последнее время активно изучается роль частиц наноразмерного диапазона (ультрамелких или наночастиц), т.е. частиц, хотя бы один из размеров которых менее 100 нм. В зависимости от источника наночастицы подразделяют на инженерные - целенаправленно производимые для дальнейшего использования в определенных технологиях, ненамеренные -являющиеся закономерным побочным продуктом каких-либо производственных процессов и природные - образующиеся независимо от действия человека. Ненамеренные наночастицы формируются в процессе горения, испарения, дробления. Данным условиям соответствуют многие промышленные аэрозоли, в первую очередь в литейных цехах, при добыче полезных ископаемых, строительстве тоннелей, выполнении сварочных работ.
Таким образом, число рабочих, подвергающихся воздействию наночастиц, достаточно велико. В составе аэрозолей наночастицы находятся в свободном состоянии или в виде фрактальноподобных агломератов [10].
Фундаментальными исследованиями установлено, что наночастицы обладают высокой проникающей способностью и реактогенностью [11-14]. В бронхолегочной системе они запускают процессы воспаления [15], оксидативного стресса [16, 17], фиброза [18], что определяет возможность их участия в патогенезе ПХОБЛ с формированием отдельного фенотипа.
Исходя из этих данных, могут быть установлены маркеры риска ПХОБЛ в условиях воздействия наночастиц на основе знаний клеточно-молекулярных особенностей.
В настоящее время в пульмонологии и медицине труда известны следующие способы прогнозирования ХОБЛ.
1. Способ прогнозирования ХОБЛ у длительно курящих лиц, описанный в патенте РФ №2359618, опубликованном 27.06.2009, бюл. №18. Способ заключается в определении в мокроте пациента активности α1-антитрипсина и α2-макроглобулина. При значениях α1=341,17±41,77 мИЕ/мл и α2=76,81±6,84 мИЕ/мл и выше прогнозируют риск развития ХОБЛ.
Недостатком способа является низкая чувствительность - не все курильщики болеют ХОБЛ. По данным проспективного наблюдения когорты Framingham Offspring в течение 23 лет ХОБЛ развивается у 33,0% курящих мужчин и 24,2% женщин [19]. Если у курящего появляются респираторные симптомы (кашель с мокротой или одышка), вероятность развития ХОБЛ возрастает.
Применимость метода для ПХОБЛ, являющейся отдельным фенотипом, отличающимся от ХОБЛ табакокурения, в частности, паттерном воспаления, не известна. Дополнительной проблемой является необходимость получения у обследуемого образца мокроты, что для здорового человека в большинстве случаев технически затруднительно.
2. Guo YI et al предложена многофакторная модель прогноза ХОБЛ на основе логистического регрессионного анализа. Уравнение модели выглядит следующим образом: вероятность развития ХОБЛ=1/[1+ехр (-2.4933-1.2197×пол+1.1842×респираторная инфекция в детстве+2.4350×низкий вес при рождении+1.8524×курение - 1.1978×rs2070600+2.0270×rs10947233+0.6468×rs1800629+0.5272×rs2241712+0.4024×rs1205)]. В данной модели переменная «пол» принимает значение 1 для мужчин и 0 для женщин, другие переменные принимают значение 1 при наличии признака и 0 - при его отсутствии, rs2070600 - наличие аллеля G однонуклеотидного полиморфизма (ОНП) rs2070600 гена рецептора конечных продуктов гликозилирования (AGER); rs 10947233 - наличие аллеля G ОНП rs 10947233 гена пальмитоил-протеин-тиоэстеразы (РРТ2); rs 1800629 - наличие аллеля G ОНП rs 1800629 гена фактора некроза опухолей-α (TNF-α); rs2241712 - наличие аллеля А ОНП rs2241712 гена трансформирующего фактора роста- β1 (TGF-β1); rs1205 - наличие аллеля С ОНП rs1205 гена С-реактивного белка. При значении решения уравнения, превышающем 0,5, делают вывод о высокой вероятности развития ХОБЛ у пациента. Чувствительность метода составила 0,83, специфичность - 0,85. Недостатком данного способа является его разработка на основании кросс-секционного, а не проспективного исследования, что несет дополнительные риски смещения результатов [20].
3. Модель прогноза развития ХОБЛ в течение 10 лет, предложенная Kotz D et al, включает возраст, статус курения, уровень социально-экономической депривации по индексу Карстейрса (Carstairs Index of Deprivation) и наличие бронхиальной астмы. Расчет индекса риска для мужчин осуществляется по формуле: 3,5×(возраст старше 65 лет)+1,9×(курение)+0,9×(5-й квинтиль уровня депривации по Карстейрсу)+1,2×(наличие астмы). Значение решения уравнения, превышающее 7,51, соответствует максимальному риску развития ХОБЛ в течение последующих 10 лет, 0 - минимальному. Индекс риска для женщин рассчитывается по формуле: 3,2×(возраст старше 65 лет)+2,3×(курение)+0,9×(5-й квинтиль уровня депривации по Карстейрсу)+1,0×(наличие астмы). Значение решения уравнения, превышающее 7,48, соответствует максимальному риску ХОБЛ в течение последующих 10 лет, 0 - минимальному. Чувствительность и специфичность метода для мужчин составила 0,85 и 0,71, соответственно, для женщин - 0,85 и 0,68 [21].
4. В исследовании Kalhan R et al определено, что персистирующие респираторные симптомы (любые из следующих: кашель или мокрота, эпизоды бронхита, хрипы, одышка и болезненность грудной клетки) являются предикторами ХОБЛ. Данные факторы обуславливают дополнительные 2.71 мл/год снижения ОФВ1 (количество воздуха, выведенного из легких за первую секунду выдоха) и 2.18 мл/год снижения ФЖЕЛ (форсированная жизненная емкость легких), увеличивают шансы ХОБЛ на 63%. Персистирующий кашель увеличивает шансы эмфиземы через 30 лет на 56% [22].
Все вышеперечисленные методы не учитывают воздействие профессиональных факторов риска, т.е. разработаны для групп лиц без учета того, присутствует или отсутствует влияние указанных факторов на измеряемые параметры здоровья у этих лиц, что может снижать операционные характеристики данных методов (чувствительность, специфичность, точность и т.д.) при применении их для лиц, работающих в условиях профессиональных факторов риска.
Показана связь клинических и патогенетических особенностей ПХОБЛ с профессиональным этиологическим фактором [6]. По данным эпидемиологического исследования BOLD работа в условиях запыленности более 10 лет увеличивает вероятность ХОБЛ на 64% [23]. В другом проспективном исследовании риск развития ХОБЛ в течение 24 лет у мужчин увеличивали: воздействие кристаллического кремния - на 46%, гипсовой пыли - на 56%, выбросов дизельных двигателей - на 18%, паров асфальта/битума - на 71%, сварочного аэрозоля - на 57%. Фактором риска для женщин была органическая пыль, увеличивающая вероятность ХОБЛ на 53% [24].
5. В статье Fishwik et al. указывается, что у работающих в условиях воздействия промышленных аэрозолей снижение объема форсированного выдоха за первую секунду (ОФВ1) на 10% в течение года является фактором риска развития ПХОБЛ в ближайшее время [25]. Применение метода требует длительного наблюдения пациента (минимум в течение года). Кроме того, снижение ОФВ1 с течением времени - процесс нелинейный, что снижает надежность данного метода [26].
6. Известен способ дифференциальной диагностики профессионального бронхита, профессиональной ХОБЛ и профессиональной бронхиальной астмы, представленный в патенте РФ на изобретение №2715212, дата публикации 25.02.2020, бюл. №6. Способ заключается в определении у пациента мгновенной объемной скорости после выдоха 75% форсированной жизненной емкости легких; отношения форсированной жизненной емкости легких к объему форсированного выдоха за 1 минуту и мгновенной объемной скорости после выдоха 25% форсированной жизненной емкости легких, оценке симптомов по вопроснику CAT с определением интенсивности кашля (1-й пункт), выраженности одышки (4-й пункт), mMRC с определением общего балла, результатов 6-шагового теста (расстояние и % от должных величин). Полученные данные используют для расчета коэффициентов, на основании которых относят пациента к одной из трех нозологических форм.
Способ позволяет определить наличие ХОБЛ в настоящее время, но не прогнозировать ее развитие на ближайший период. Применим только у работников алюминиевой промышленности.
7. Известен способ прогнозирования обострений хронической обструктивной болезни легких (ХОБЛ) в течение последующего года у лиц, работающих в условиях воздействия промышленных аэрозолей (патент РФ №2774206). У пациента с установленным диагнозом профессионально обусловленной ХОБЛ (ПО ХОБЛ) определяют показатели максимальных разовых концентраций (МРК) пыли, содержащей диоксид кремния (МРК SiO2), алюминия и его сплавов (МРК А1), озона (МРК О3) в воздухе рабочей зоны больного. Затем определяют величину диффузионной способности легких по монооксиду углерода (DLco), концентрацию в сыворотке крови N-терминального пептида проколлагена III (K PIIINP) и наличие у больного бронхоэктазов (Бр) методом компьютерной томографии. Далее решают уравнение логистической регрессии и определяют низкий или высокий риск обострений ПО ХОБЛ. Способ обеспечивает возможность прогнозирования обострения ПО ХОБЛ у лиц, работающих в условиях воздействия промышленных аэрозолей, за счет оценки совокупности наиболее важных показателей.
Данный способ разработан на основании обследования лиц, подвергающихся на своем рабочем месте воздействию ряда вредных факторов, в том числе воздействию аэрозолей, содержащих диоксид кремния и уже имеющих диагноз профессионально обусловленной ХОБЛ. Он позволяет прогнозировать обострения ПО ХОБЛ и не предназначен для прогноза ее развития, т.е. имеет иное назначение по отношению к заявляемому.
Раскрытие сущности изобретения
Предлагаемый способ прогнозирования развития профессиональной хронической обструктивной болезни легких (ПХОБЛ) характеризуется тем, что у пациента, не имеющего респираторных заболеваний, проработавшего в течение пяти и более лет в условиях воздействия промышленных аэрозолей, содержащих ненамеренные наночастицы с кремнием, определяют в периферической крови долю субпопуляции моноцитов CD14DimCD16+ («неклассических» моноцитов - НМ) относительно всех моноцитов; определяют в сыворотке крови концентрации фактора роста фибробластов-2 (FGF-2), растворимой сосудистой молекулы адгезии-1 (sVCAM-1), матриксной металлопротеиназы-9 (ММР-9) и N-концевого пропептида проколлагена 3 типа (PIIINP), далее решают уравнение логистической регрессии:
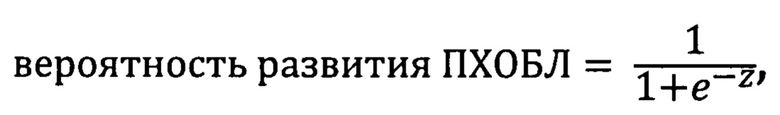
в котором z=-83,47+0,90×НМ+2,26×FGF 2+0,40×sVCAM-1+0,20×ММР-9+0,26×PIIINP, где НМ - доля моноцитов CD 14DimCD 16+ в процентах; FGF-2, sVCAM-1 и ММР-9 - концентрации соответственно FGF-2, sVCAM-1 и ММР-9 в пг/мл; PIIINP - концентрация PIIINP в нг/мл и при значении решения уравнения, равном 0,364 и более, прогнозируют высокий риск развития ПХОБЛ у данного пациента в течение последующих ближайших 3-х лет, а при значении решения уравнения менее 0,364 прогнозируют низкий риск развития ПХОБЛ у пациента в течение ближайших 3-х лет.
Техническими результатами заявленного способа являются:
1) реализация назначения: возможность прогнозировать развитие ПХОБЛ в течение 3 лет у лиц, проработавших 5 и более лет и продолжающих работать в условиях воздействия аэрозолей, содержащих ненамеренные наночастицы с кремнием;
2) способ основан на установленном авторами в результате исследования комплексе объективных показателей - клеточных и биохимических параметрах, наиболее сильно связанных с риском развития ПХОБЛ в условиях воздействия наночастиц с кремнием, а именно: доле субпопуляции моноцитов CD14DimCD16+ в периферической крови, сывороточных концентрациях фактора роста фибробластов-2, растворимой сосудистой молекулы адгезии-1, матриксной металлопротеиназы-9, N-концевого пропептида проколлагена 3 типа;
3) высокая чувствительность и специфичность способа, составляющие 93,5% и 89,2% соответственно;
4) способ существенно не увеличивает время пребывания больного в клинике для периодического медицинского осмотра.
Фигуры иллюстративного материала
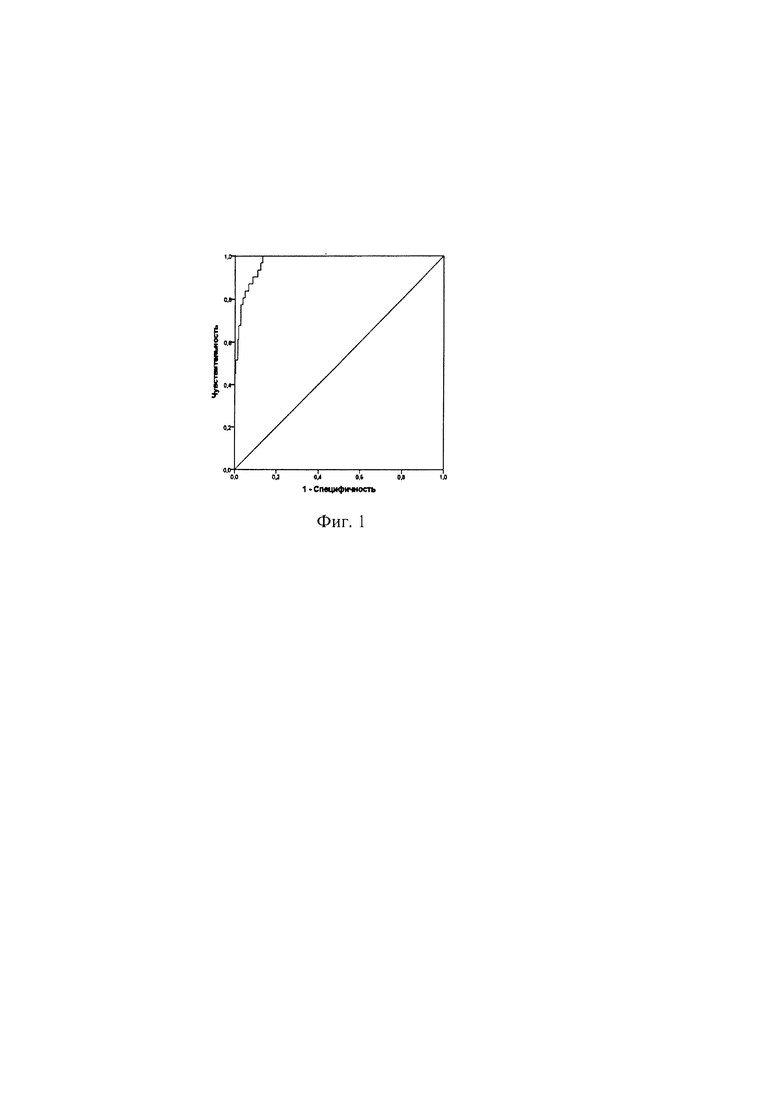
Фиг. 1. - Кривая «чувствительность - специфичность».
Способ осуществляют следующим образом
Известным в данной области техники способом проводят венепункцию кубитальной вены и забор двух образцов венозной крови по 10 мл.
В первом образце методом проточной цитометрии определяют процент «неклассических» CD14DimCD16+ моноцитов по отношению ко всем моноцитам.
Известными в данной области техники способами из второго образца крови получают сыворотку, в которой методом твердофазного иммуноферментного анализа определяют в пг/мл концентрации фактора роста фибробластов-2, растворимой сосудистой молекулы адгезии-1, матриксной металлопротеиназы-9, в нг/мл - N-концевого пропептида проколлагена 3 типа. Далее решают вышеприведенное уравнение логистической регрессии и прогнозируют высокий или низкий риск развития ПХОБЛ у пациента в течение последующих 3-х лет, как было указано выше.
Перечень фигур иллюстративного материала
Фигура 1. ROC-кривая соотношения чувствительность-специфичность предлагаемого способа.
Обоснование изобретения
Дизайн исследования. Материалы и методы.
Проспективное когортное наблюдательное одноцентровое клинико-гигиеническое исследование проведено в 3 этапа.
На первом этапе проведена детекция наночастиц в воздухе рабочей зоны на рабочих местах предприятия машиностроения (код ОКВЭД 30.30.32), определение их химического состава, измерение концентрации ненамеренных наночастиц (являющихся закономерным побочным продуктом некоторых производственных процессов) в поглотительном растворе.
На втором этапе выполнено одномоментное сравнительное исследование. Проводили набор пациентов в 3 страты согласно критериям включения и невключения (таблица 1А), В первую группу вошли больные ПХОБЛ рабочие (n=24); во вторую группу - условно здоровые рабочие, n=25), работавшие на исследованных участках и подвергавшиеся воздействию преимущественно наночастиц с кремнием; в третью группу (контрольную) - условно здоровые лица без профрисков здоровью (n=50).

На втором этапе в начале наблюдения было выполнено однократное исследование субпопуляций моноцитов в периферической крови и серии сывороточных белков (цитокинов и маркеров патофизиологических процессов, составляющих основу патогенеза ПХОБЛ) у больных ПХОБЛ (первая группа), условно здоровых рабочих (2 группа) и условно здоровых лиц контрольной (3-ей) группы для определения перспективных маркеров риска, т.е. у 99 человек.
На третьем этапе исследования осуществляли проспективное наблюдение условно здоровых рабочих, подвергающихся воздействию аэрозолей с ненамеренными наночастицами с кремнием. Время наблюдения составило 36 месяцев. Конечная точка исследования - ПХОБЛ.
Для третьего этапа исследования была сформирована группа из 250 рабочих, подверженных воздействию аэрозолей с ненамеренными наночастицами с кремнием в связи с выполнением служебных обязанностей, не имеющих респираторной патологии. В указанную группу из 250 человек были включены участники второго этапа исследования из группы условно здоровых контактных рабочих (n=25) и лица, занятые на аналогичных рабочих местах по производственным процессам и применяемым материалам (n=225), у которых тоже было проведено исследование субпопуляций моноцитов в периферической крови и серии сывороточных белков. Сформированная на третьем этапе группа из 250 человек именуется далее также «2-я группа с дополнением».
Критерии включения и невключения в третий этап исследования представлены в таблице 1Б.
Отбор проб воздуха на рабочих местах обследуемых проводили электрическим аспиратором ПУ-4Э. Объем пробы составлял 200-600 л. Систему устанавливали в месте пробоотбора, термостатировали и на протяжении 10-40 минут пропускали воздух через склянку Дрекселя, наполненную поглотительным раствором (использовали деионизованную воду объемом 50 мл для предотвращения растворения твердых частиц аэрозоля).
Выполняли физико-химические исследования полученного раствора. Разделение частиц по размерам было проведено методом фугования поглотительного раствора в планетарной центрифуге (10 мин, 1500 об/мин) с последующим исследованием верхней части раствора, содержащей ультрамелкие частицы. Общий химический (элементный) состав твердых аэрозолей воздуха рабочей зоны определяли методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой (АЭС ИСП). Поглотительный раствор объемом 3-50 мл выпаривали во фторопластовой чашке в боксе из оргстекла с принудительной тягой в потоке обеспыленного воздуха при нагревании под инфракрасной лампой. Объем концентрата после упаривания составлял 50-100 мкл. Для предотвращения потерь в виде летучих соединений и растворения твердых частиц в процессе концентрирования добавляли 14 М HNO3 (марки ос.ч. 27-5 дополнительно очищенной перегонкой без кипения).
Использовали спектрометр высокого разрешения iCAP-6500 фирмы «Thermo Scientific)). Размеры частиц подтверждали методом сканирующей электронной микроскопии (СЭМ) в сочетании с энергодисперсионным анализатором (сканирующий электронный микроскоп Zeiss EVO MA 15 фирмы «Karl Zeiss)), увеличение в 2000-8000 раз).
Для оценки концентраций кремнийсодержащей пыли без учета размерных фракций в воздухе рабочей зоны участников исследования были проанализированы санитарно-гигиенические характеристики условий труда предприятия, составленные экспертами отдела надзора по гигиене труда, коммунальной гигиене Управления Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Новосибирской области при проведении экспертиз связи заболевания с профессией.
Диагноз ПХОБЛ устанавливали на основании спирографического критерия - постбронходилататорной величины отношения объема форсированного выдоха за первую секунду (ОФВ 1) к форсированной жизненной емкости легких (ФЖЕЛ) меньшее или равное 0.7 [27]. Экспертиза связи заболевания с профессией была проведена в центре профпатологии г. Новосибирска (ГБУЗ НСО ГКБ 2).
Все больные ПХОБЛ получали базисную терапию согласно требованиям Федеральных клинических рекомендаций [27].
Всем пациентам на втором и третьем этапах исследования (т.е. пациентам первой группы (24 чел.), пациентам второй группы с дополнением (250 чел.) и пациентам третьей группы (50 чел.) были выполнены: оценка жалоб, анамнеза респираторных заболеваний, включая ПХОБЛ, коморбидных заболеваний, истории перенесенных заболеваний и операций, статуса курения. Учитывали данные результатов периодических медицинских осмотров, выписок из амбулаторных карт и опроса пациента. Был проведен физикальный осмотр.
Спирографию с пробой с бронхолитиком выполняли, следуя методике, изложенной в рекомендациях Российского респираторного общества (спирограф МАС2-С, Белинтелмед, Республика Беларусь) [28]. Исследование проводили всем участникам на втором этапе (т.е. 24-ти рабочим с ХОБЛ, 25 условно здоровым контактным рабочим без ХОБЛ и 50 условно здоровым лицам контрольной группы), на скрининговом визите третьего этапа исследования и далее 1 раз в 3 месяца в течение времени наблюдения 250 рабочим второй группы с дополнением.
Цитокиновый и маркерный профиль сыворотки крови исследовали методом твердофазного иммуноферментного анализа (ИФА). Использован 8-канальный иммуноферментный планшетный фотометр «Expert Plus».
Для второго этапа исследования (всех трех групп - 99 человек) были выбраны молекулярные факторы, участвующие в патогенезе ХОБЛ согласно известным научным данным, а именно: интерлейкин-1β (IL1-β), гранулоцтарно-макрофагальный колониестимулирующий фактор (GM-CSF), интерлейкин-5 (IL-5), С-реактивный белок (CRP), моноцитарный хемоаттрактантный белок (МСР-1), фактор роста фибробластов-2 (FGF-2), трансформирующий фактор роста-β1 (TGF-β1), гиалуроновая кислота, N-концевой пропептид проколлагена 3 типа (PIIINP), матриксная металлопротеиназа-1 (ММР-1), матриксная металлопротеиназа-9 (ММР-9), нейтрофильная эластаза, растворимая сосудистая молекула адгезии-1 (sVCAM 1) [29].
Моноциты являются предшественниками альвеолярных макрофагов, в свою очередь являющихся ключевой клеткой патогенеза ХОБЛ [30]. При этом сами моноциты являются активными участниками воспаления, фиброза и других патологических процессов [30]. Известны несколько субпопуляций моноцитов, обладающих различными функциями [31]. Таким образом, в связи с поиском прогностических маркеров ПХОБЛ в условиях воздействия наночастиц с кремнием представляло интерес исследование субпопуляций моноцитов крови. При этом предполагали возможность влияния цитокинового профиля, характерного для данного фенотипа ПХОБЛ, или прямое воздействие наночастиц с кремнием, проникающих из легких в системный кровоток, на дифференцировку моноцитов.
Определение субпопуляций моноцитов периферической крови проводили методом проточной цитометрии на аппарате NovoCyte, Agilent, США. Клетки крови окрашивали антителами CD 14, CD 16, HLA-DR на фоне линеаспецифического коктейля антител (CD3, CD 19 и CD56) для выявления популяции моноцитов.
На третьем этапе определяли клеточно-молекулярные факторы, отличавшие на втором этапе исследования больных ПХОБЛ от условно здоровых рабочих 2-й группы, условно здоровых лиц контрольной (3-й) группы и связанные с концентрацией ненамеренных наночастиц с кремнием субпопуляции моноцитов периферической крови, сывороточные концентрации 1L1-β, СРБ, МСР-1, FGF-2, TGF-β1, PIIINP, ММР-9, sVCAM-1.
При проведении исследования руководствовались этическими принципами проведения научных медицинских исследований с участием человека, изложенными в Хельсинкской Декларации Всемирной медицинской ассоциации и этическими нормами и правилами, предусмотренными Бюллетенем Высшей аттестационной комиссии Министерства образования России №3 от 2002 г. «О порядке проведения биомедицинских исследований у человека». Проведение исследования одобрено комитетом по этике ФГБОУ ВО НГМУ Минздрава России.
Статистический анализ.
Статистическая обработка данных была проведена с использованием программного обеспечения SPSS 24 версии. Уровень значимости для отклонения нулевой гипотезы (р) был принят равным 0,01 для сравнения трех групп с учетом поправки Бонферрони, 0,05 для регрессионного анализа. Методы описательной статистики представлены медианой и межквартильным интервалом для непрерывных переменных, определением долей для ординальных и номинальных. Сравнение групп по непрерывным переменным выполнено при помощи критерия Манна-Уитни, по ординальным и номинальным - с использованием критерия χ2. Связи интенсивности воздействия наночастиц с кремнием с молекулярными факторами исследовали методом линейной регрессии.
Значимые факторы прогноза развития ПХОБЛ (второй этап исследования) определяли методом логистической регрессии. Первоначально был выполнен однофакторный анализ. Параметры, показавшие значимость по результатам однофакторного анализа, после проверки на мультиколлинеарность были использованы для построения многофакторной прогностической модели. Факторы в модель включали последовательно, начиная с характеризующегося наибольшим коэффициентом регрессии.
Все модели в качестве ковариат включали возраст и стаж работы для исключения воздействия вмешивающихся факторов.
Качество модели оценивали при помощи тестов Найджелкерка, Кокса и Стелла, Хосмера-Лемешова. Анализ практической ценности прогноза был выполнен методом построения кривых операционных характеристик (ROC-анализ). Величина площади под кривой чувствительность-специфичность 50% и более означала приемлемую различающую способность модели.
Результаты.
1 этап.
На рабочих местах шихтовщиков, формовщиков, обрубщиков, пескоструйщиков, шлифовщиков наибольшей была массовая концентрация наночастиц с кремнием, равнявшаяся 0,035 (0,29; 0,41) мкг/мл.
2 этап.
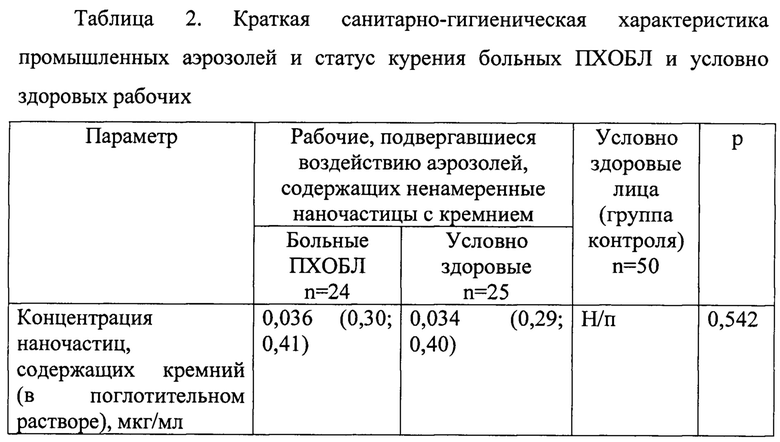
В группу ПХОБЛ (1-ю группа) были включены двое шихтовщиков, 6 формовщиков, 5 обрубщиков, 11 шлифовщиков. В группе здоровых рабочих (2-я группа) 2-е работали по профессии шихтовщик, 10 - по профессии шлифовщик, 7 - формовщик, 6 - обрубщик. Сравнительная характеристика промышленных аэрозолей и статуса курения исследуемых групп представлена в таблице 2.
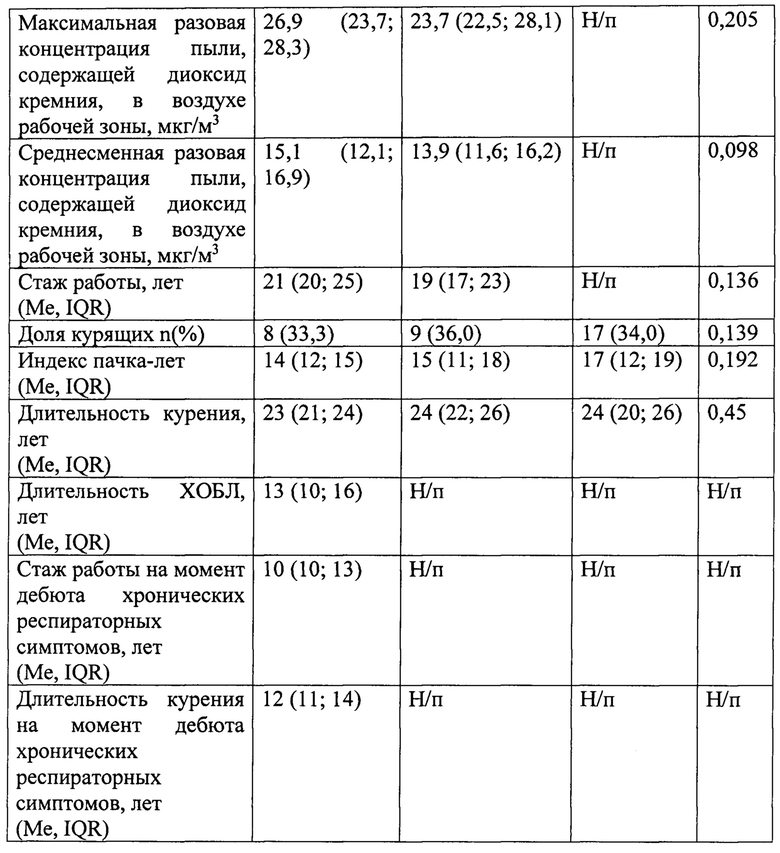
Исходные характеристики лиц на момент их включения во второй этап исследования представлены в таблице 3.
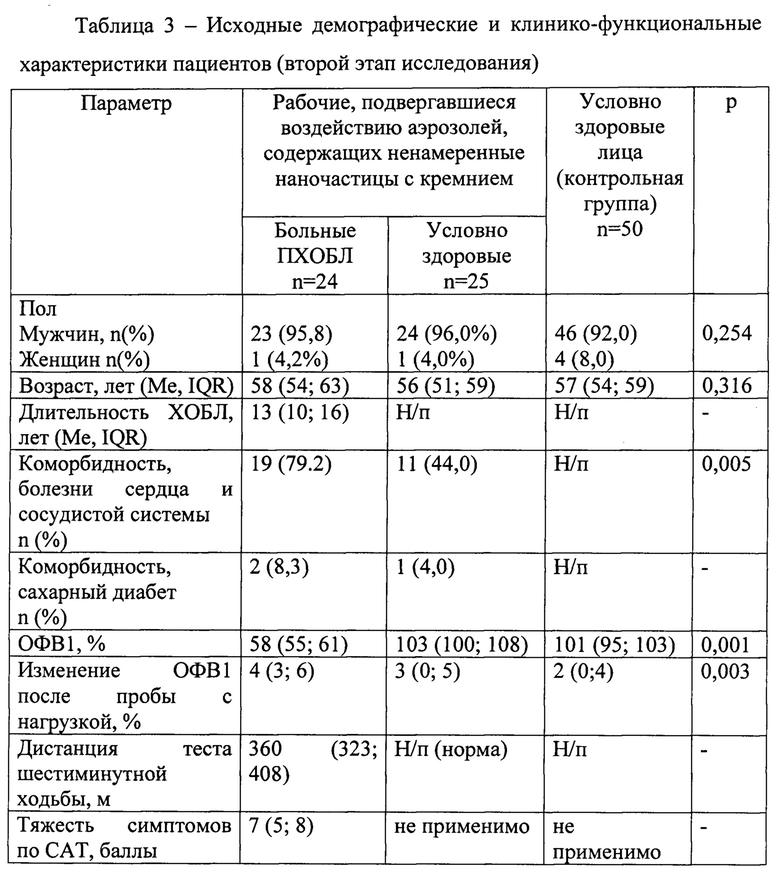
Таким образом, группы были сопоставимы по полу, возрасту, интенсивности и продолжительности курения, доле курящих. Группы больных ПХОБЛ (1-я гр.) и условно здоровых рабочих второго этапа (2-я гр.) не различались по стажу работы, интенсивности воздействия промышленного аэрозоля.
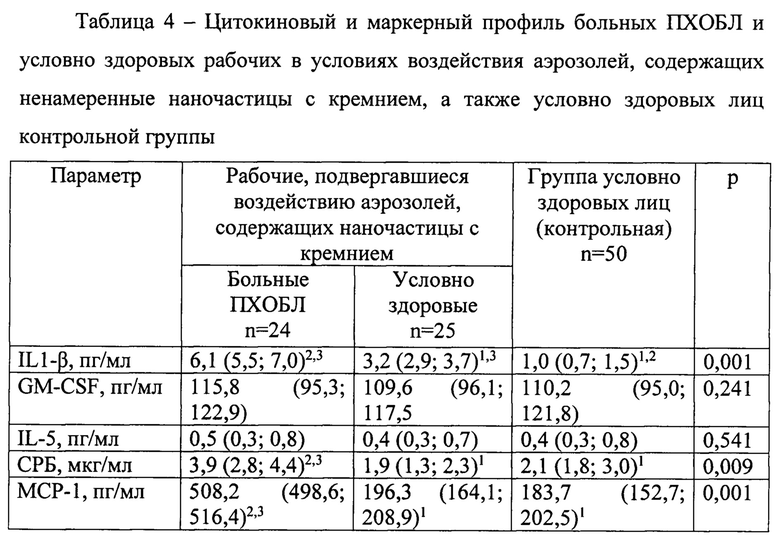
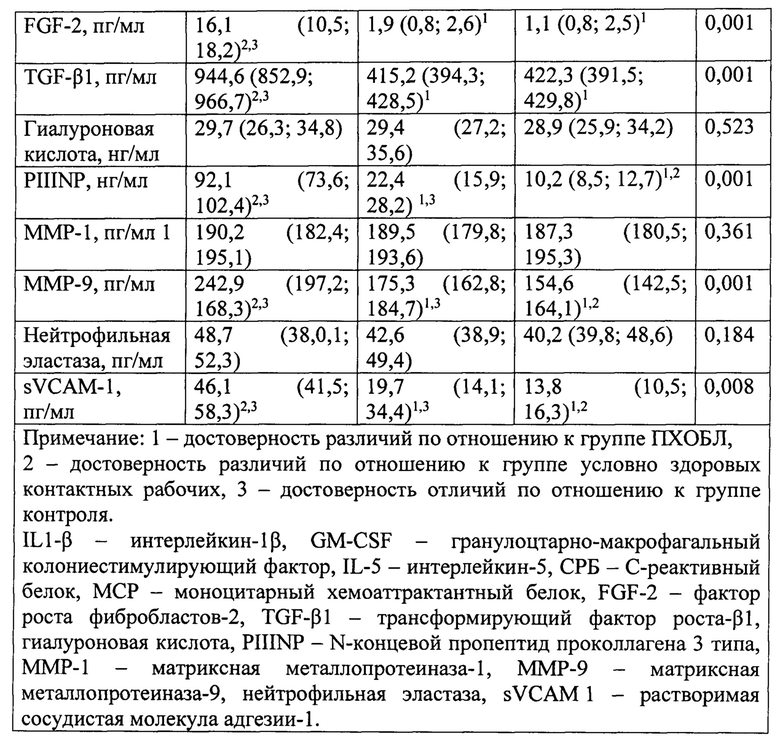
В результате сравнения указанных в предыдущем абзаце двух групп были выявлены особенности молекулярного паттерна воспаления, отличающие больных ПХОБЛ в условиях воздействия аэрозолей, содержащих наночастицы с кремнием, от условно здоровых рабочих (2-й гр.) и группы контроля (3-й гр.) (таблица 4).
Такими отличающими особенностями (факторами), были провоспалительный цитокин (преимущественно моноцитарный) IL1-P, острофазовый показатель СРБ (без превышения установленных референсных значений во всех группах), моноцитарный хемоаттрактант МСР-1, профиброзные цитокины FGF-2 и TGF-β1, маркер активного фиброобразования PIIINP, маркер деструкции соединительнотканного матрикса легких ММР-9 и маркер вовлечения эндотелия в воспаление sVCAM-1. При этом концентрации IL1-β, PIIINP, ММР-9 и sVCAM-1 были выше и у контактных здоровых рабочих второй группы в сравнении с группой контроля, что не исключает повышение концентраций в ответ на воздействие промышленных аэрозолей.
Были выявлены значимые различия субпопуляций моноцитов (таблица 5) между группами, обследованными на втором этапе. У больных ПХОБЛ в сравнении с контролем были достоверно были выше доли неклассических и промежуточных моноцитов, меньше - классических. У условно здоровых рабочих, контактировавших с аэрозолями (2-я гр.), содержащими наночастицы с кремнием, был увеличен по отношению к контролю процент неклассических моноцитов, снижен - промежуточных и не отличался от группы контроля процент классических моноцитов.
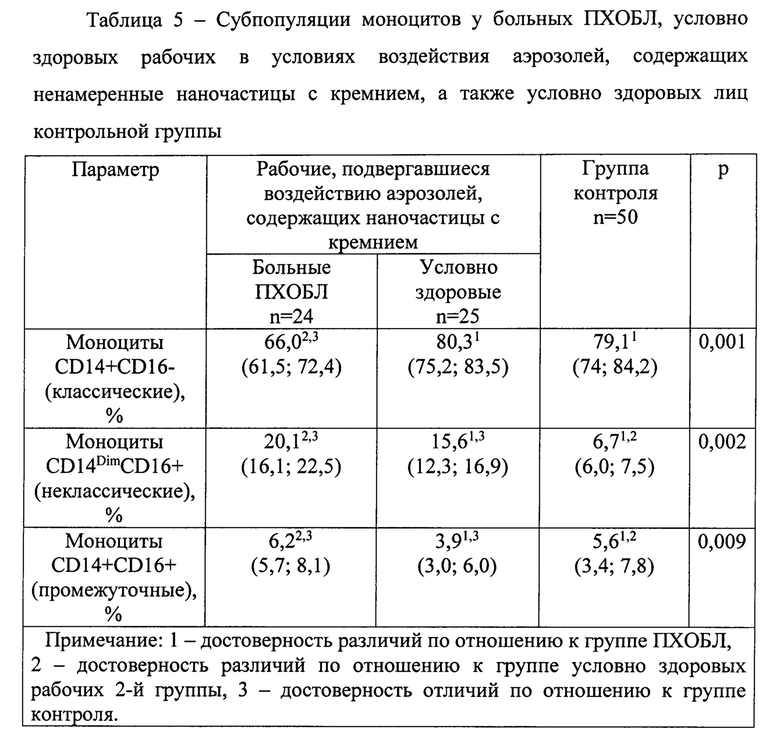
Для уточнения этиологической роли ненамеренных наночастиц с кремнием провели многофакторный линейный регрессионный анализ, включавший ковариаты: пол, возраст, стаж работы, индекс пачка-лет, наличие сердечно-сосудистых заболеваний, суммарная концентрация диоксида кремния в воздухе рабочей зоны (максимальная разовая и среднесменная), концентрация ненамеренных наночастиц с кремнием. Прогнозируемые факторы в моделях - исследуемые молекулярные факторы и субпопуляции моноцитов. Только концентрация ненамеренных наночастиц с кремнием была значимым предиктором сывороточных уровней PIIINP (В=0,8), FGF-2 (B=1,9), sVCAM-1 (В=0,7), неклассических CD14DimCD16+ моноцитов (В=0,9). Значимыми предикторами сывороточной концентрации матриксной металл опротеиназы-9 были: концентрация наночастиц с кремнием (В=0,5) и концентрации в воздухе рабочей зоны кремнийсодержащей пыли - максимальная разовая (В=1,2) и среднесменная (В=0,9).
3 этап.
Из 250 рабочих (2-я гр. с дополнением), исходно включенных для проспективного наблюдения, завершили участие в исследовании по протоколу 243 человека: 236 (97,2%) мужчин и 7 (2,8%) женщин. Возраст участников на момент включения в исследование составил 51 (46; 55) лет. Коморбидные заболевания сердечно-сосудистой системы имели 98 (40,3%), сахарный диабет - 3 (1,2%) человек. Доля курящих составила 25,5% (62 человека), значение индекса пачка-лет равнялось 18 (15; 20). Стаж работы составил 15 (13; 18) лет, минимальный - 5 лет, максимальный - 28 лет, продолжительность курения - 17 (15; 19) лет.
Спирография показала, что исходные (на момент включения в исследование) значения постбронходилататорного ОФВ1 были 103,5% (98,6%; 105,9%), постбронходилататорного ОФВ 1/ФЖЕЛ - 102,8% (97,3%; 104,7%).
Результаты исследования молекулярных факторов были следующими: IL1-P - 3,3 (2,8; 3,9) пг/мл; СРБ - 2,0 (1,4; 2,2) мкг/мл; МСР-1 - 195,1 (159,8; 201,3) пг/мл; FGF-2 - 1,7 (1,6; 2,5) пг/мл; TGF-β1 - 409,6 (391,2; 419,4) пг/мл; PIIINP - 20,2 (15,9; 29,8) нг/мл; ММР-9 - 171,8 (163,5; 182,4) пг/мл; sVCAM-1 - 19,5(14,6; 26,8) пг/мл.
Медиана процента классических моноцитов равнялась 81,1% (74,9%; 83,6%), неклассических - 15,1% (12,5%; 16,4%), промежуточных - 3,4% (3,2%; 5,8%).
Результаты ретроспективной оценки клеточно-молекулярных факторов при стратификации по факту наступления события конечной точки (ПХОБЛ) представлены в таблице 6.
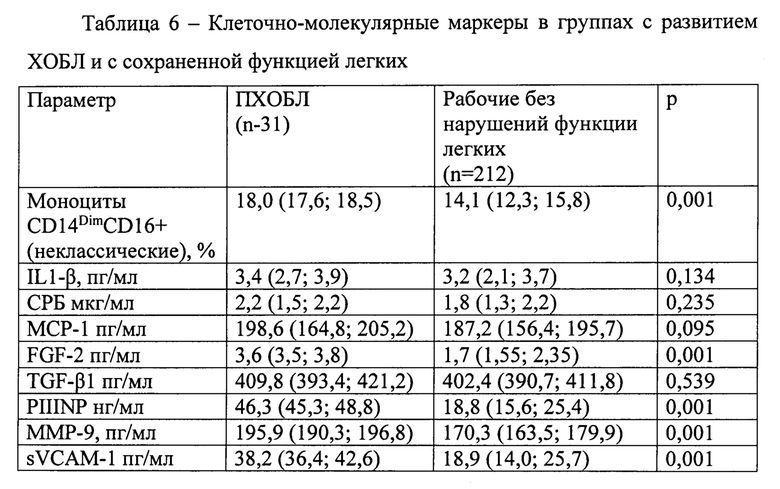
За время наблюдения (36 мес.) ПХОБЛ диагностировали у 31 (12,8%) из 243 участников. По результатам логистического регрессионного анализа наиболее значимыми факторами прогноза развития ПХОБЛ были: процент неклассических CD14DimCD16+ моноцитов, сывороточные концентрации PIIINP, FGF 2, sVCAM-1, ММР-9 (табл. 7).
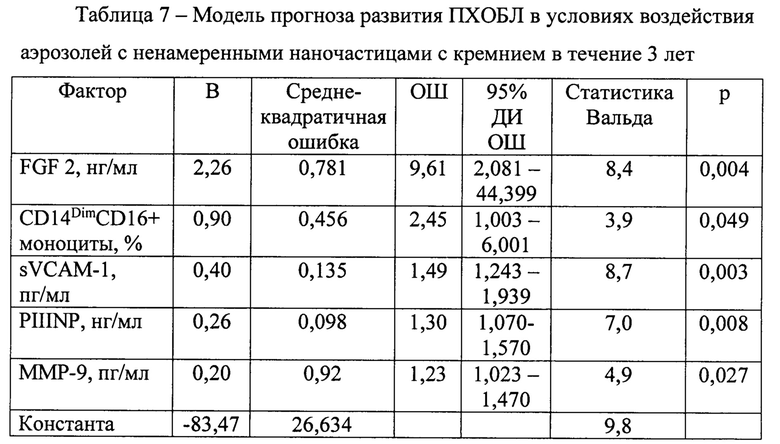
В результате уравнение логистической регрессии для вычисления вероятности развития ПХОБЛ в течение ближайших трех лет у лиц, проработавших 5 и более лет в условиях воздействия промышленных аэрозолей, содержащих ненамеренные наночастицы с кремнием, имеет вид:
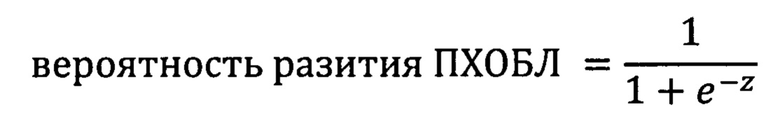
в котором z=-83,47+0,90׫неклассические» моноциты+2,26×FGF 2+0,40× -1+0,20×ММР-9+0,26×PIIINP,
где «неклассические моноциты» - доля субпопуляции моноцитов CD14DimCD16+ по отношению ко всем моноцитам периферической крови в процентах; FGF-2, sVCAM-1, ММР-9 - концентрации в сыворотке крови соответственно фактора роста фибробластов-2, растворимой сосудистой молекулы адгезии-1 и матриксной металлопротеиназы-9 в пг/мл; PIIINP -концентрация в сыворотке крови N-концевого пропептида проколлагена 3 типа в нг/мл.
При значении решения уравнения, равном 0,364 и более, прогнозируют высокий риск развития ПХОБЛ у пациента в течение ближайших трех, а при значении решения уравнения менее 0,364 - низкий риск развития ПХОБЛ.
Диагностическая чувствительность способа составляет 93,5%, специфичность - 89,2%. Площадь под кривой чувствительность-специфичность равняется 0,95, 95% ДИ 0,93 - 0,99, р<0,001 (фиг. 1).
Значение R квадрата Кокса и Снелла составило 0,50, R квадрата Найджелкерка (коэффициент детерминации) 0,83, - 2 Log правдоподобия 58,98. Проверка по методу Хосмера-Лемешева показала достаточную согласованность модели, χ2=2,5, р=0,95. Таким образом, качество модели является приемлемым.
Клинические примеры применения предлагаемого способа
1. Пациент В., 45 лет, работает шлифовщиком (литейное производство машиностроительного предприятия), стаж 11 лет. Медицинские осмотры проходит регулярно, респираторные симптомы не выявляли. Согласно данным, предоставленным работодателем, неблагоприятными производственными факторами были следующие: пыль с содержанием диоксида кремния более 10%, максимальная разовая концентрация пыли в воздухе рабочей зоны 18 мкг/м3, среднесменная - 11 мкг/м3 (превышение ПДК). Рабочее место обследовано в рамках исследования, в воздухе рабочей зоны выявлены наночастицы с кремнием. Кроме того, воздействует локальная вибрация с превышением ПДК на 2 Дб. Пациент не курит. Хронических заболеваний не выявляли.
Данные спирографии на момент начала наблюдения были следующими: постбронходилататорный ОФВ1 - 3,68 л, или 98,1% должного значения (должное значение - значение у здоровых людей того же пола, возраста, роста без респираторных симптомов); постбронходилататорный ФЖЕЛ - 4,36; 97,5% должного; ОФВ 1/ФЖЕЛ - 84,4%.
Доля CD14dimCD16+ MOHOUHTOB по отношению ко всем моноцитам периферической крови составляет 17,8%, концентрация в сыворотке крови FGF-2 равнялась 3,5 пг/мл; sVCAM-1 - 36,4 пг/мл, PIIINP - 48,2 нг/мл, ММР-9 - 187,5 пг/мл.
Значение решения вышеприведенного уравнения логистической регрессии составило 0,994.
Сделан вывод о высоком риске развития ПХОБЛ у данного рабочего.
При спирографии через 18 месяцев постбронходилаторное значение ОФВ 1 составило 2,92 л, или 82,9% должного; постбронходилаторное значение ФЖЕЛ - 4,29; 95,9% должного; ОФВ 1 /ФЖЕЛ 68%. Острых респираторных событий за время наблюдения не было. Жалоб рабочий не предъявляет. Диагноз: ХОБЛ легкой степени, группа А; заболевание профессиональное (тяжесть и группа установлены по стандартным классификациям [28].
2. Пациент С, 55 лет, работает формовщиком ручной формовки (литейное производство предприятия по производству деталей для железнодорожных путей), стаж работы - 21 год. Медицинские осмотры проходит регулярно, респираторные симптомы не выявляли. С возраста 49 лет страдает артериальной гипертензией 2 степени. Согласно данным, предоставленным работодателем, неблагоприятным производственным фактором является пыль с содержанием диоксида кремния более 10%. Максимальная разовая концентрация пыли в воздухе рабочей зоны составляет 19 мкг/м3, среднесменная - 9 мкг/м3 (превышение ПДК). Кроме того, воздействует локальная вибрация с превышением ПДК на 4 Дб. Пациент курит, индекс пачка-лет равен 25.
Данные спирографии на момент начала наблюдения следующие: постбронходилататорный ОФВ1 составил 3,70 л, или 99,5% должного значения; постбронходилататорная ФЖЕЛ - 4,61; 100,1%) должного значения; ОФВ 1/ФЖЕЛ 80,3%.
Доля CD14dimCD16+ моноцитов - 18%; концентрация в сыворотке крови FGF-2 - 3,6 пг/мл; sVCAM-1 - 21,3 пг/мл; ММР-9 - 196,2 пг/мл; PIIINP - 46,1 нг/мл.
Значение решения уравнения 0,648.
Сделан вывод о высоком риске развития ПХОБЛ у данного рабочего.
Через 18 мес.от начала наблюдения появилась одышка, снижающая переносимость физической нагрузки (mMRC 1 по анкете оценки тяжести одышки). Одышка была выявлена при активном расспросе пациента, самостоятельно жалоб не предъявлял. Данные спирографии через 24 месяца: постбронходилататорный ОФВ1 - 3,15 л, что составляет 84,7% должного; постбронходилататорная ФЖЕЛ - 4,56 л, т.е. 99,8% должного; ОФВ1/ФЖЕЛ - 69,1%.
Острых респираторных событий за время наблюдения не было. Диагноз: ХОБЛ легкой степени, группа А; заболевание профессиональное.
3. Пациент И., 46 лет; шихтовщик (литейное производство машиностроительного предприятия), стаж 8 лет. Медицинские осмотры проходит регулярно, респираторные симптомы не выявляли. Хронических заболеваний нет. Курит, индекс пачка-лет составляет 15. Согласно данным, предоставленным работодателем, неблагоприятным производственным фактором является пыль с содержанием диоксида кремния более 10%. Максимальная разовая концентрация пыли в воздухе рабочей зоны составляет 22 мкг/м3, среднесменная - 13 мкг/м3 (превышение ПДК).
Рабочее место обследовано в рамках исследования, в воздухе рабочей зоны выявлены наночастицы с кремнием. Из других неблагоприятных производственных факторов присутствует физическое перенапряжение.
Спирография на момент начала наблюдения: постбронходилататорный ОФВ1 3,79 л, или 91,1% должных значений; постбронходилататорная ФЖЕЛ - 4,78; 95,0% должного; ОФВ 1/ФЖЕЛ 83,1.
Доля CD14dimCD16+ моноцитов составила 16,3%; концентрация в сыворотке FGF-2 - 2,4 пг/мл; sVCAM-1 - 26,1 пг/мл; ММР-9 - 180,5 пг/мл; PIIINP-29,1 нг/мл.
Значение решения уравнения 0,0001.
Сделан вывод о низком риске ПХОБЛ.
Данные спирографии через 36 мес: постбронходилататорный ОФВ1 -3,72 л; 89,4% должного; постбронходилататорная ФЖЕЛ - 4,69; 93,2% должного; ОФВ1/ФЖЕЛ - 79,3%, что более 70%. У данного больного по завершению 3 лет наблюдения вентиляционная функция легких не нарушена.
4. Пациент И., 57 лет, шихтовщик (литейное производство машиностроительного предприятия), стаж 23 года. Медицинские осмотры проходит регулярно, респираторные симптомы не выявляли. Хронических заболеваний не выявлено. Хронических заболеваний нет. Курит, индекс пачка-лет составляет 21.
Согласно данным, предоставленным работодателем, неблагоприятным производственным фактором является пыль с содержанием диоксида кремния более 10%. Максимальная разовая концентрация пыли в воздухе рабочей зоны составляет 21 мкг/м3, среднесменная - 12 мкг/м3 (превышение ПДК). Из других неблагоприятных производственных факторов присутствует физическое перенапряжение.
Спирография на момент начала наблюдения: постбронходилататорный ОФВ1 - 2,55 л; 85,0% должных значений; постбронходилататорная ФЖЕЛ -3,12 л; 83,9% должного; ОФВ 1/ФЖЕЛ - 81,7%.
Доля CD14dimCD16+моноцитов составляет 16,4%, концентрация в сыворотке FGF-2 - 2,4 пг/мл, sVCAM-1 - 32,5 пг/мл, ММР-9 - 190,6 пг/мл; PIIINP - 30,4 нг/мл.
Значение решения вышеприведенного уравнения равно 0,009.
Сделан вывод о низком риске ПХОБЛ.
Спирография через 36 месяцев: постбронходилататорный ОФВ1 - 2,47 л; 82,3% должных значений; постбронходилататорная ФЖЕЛ - 2,99 л; 80,4% должного; ОФВ1/ФЖЕЛ - 82,6% - показатели в пределах референсных значений. За время наблюдения хронических респираторных симптомов не было.
Список литературы
1. Удельный вес численности работников, занятых на работах с вредными и (или) опасными условиями труда, в организациях. Режим доступа https://rosstat.gov.ru/working_conditions, дата обращения 15.08.2022.
2.0 состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 году: Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2022. 340 с.
3. Быстрицкая Е.В., Биличенко Т.Н. Заболеваемость, инвалидность и смертность от болезней органов дыхания в Российской Федерации (2015-2019). Пульмонология. 2021;31(5):551-561. http://doi.org/10.18093/0869-0189-2021-31-5-551-561.
4. Zou J, Sun T, Song X, Liu YM, Lei F, Chen MM, Chen Z, Zhang P, Ji YX, Zhang XJ, She ZG, Cai J, Luo Y, Wang P, Li H. Distributions and trends of the global burden of COPD attributable to risk factors by SDI, age, and sex from 1990 to 2019: a systematic analysis of GBD 2019 data. Respir Res. 2022 Apr 11; 23(1):90. doi: 10.1186/s 12931-022-02011-y.
5. Бухтияров И.В. Современное состояние и основные направления сохранения и укрепления здоровья работающего населения России. Медицина труда и промышленная экология. 2019. 59; №9:527-532. https://doi.org/10.31089/1026-9428-2019-59-9-527-532.
6. Шпагина Л.А., Котова О.С., Сараскина Л.Е., Ермакова М.А. Особенности клеточно-молекулярных механизмов профессиональной хронической обструктивной болезни легких. Сибирское медицинское обозрение. 2018;№2 (110):37-45. DOL10.20333/2500136-2018-2-37-45.
7. Lopez-Lilao A, Escrig A, Orts MJ, Mallol G, Monfort E. Quartz dustiness: A key factor in controlling exposure to crystalline silica in the workplace. J Occup Environ Hyg. 2016 Nov;13(l l):817-28.
8. Ribalta C, Viana M, Lopez-Lilao A, Estupina S, Minguillon MC, Mendoza J, Diaz J, Dahmann D, Monfort E. On the Relationship between Exposure to Particles and Dustiness during Handling of Powders in Industrial Settings. Ann Work Expo Health. 2019 Jan 7;63(1): 107-123.
9. De Matteis S, Jarvis D, Darnton A, et al. The occupations at increased risk of COPD: analysis of lifetime job-histories in the population-based UK Biobank Cohort. Eur Respir J. 2019;54(1):1900186.
10. Gonzalez-Pech N1, Stebounova LV, Ustunol IB, Park JH, Renee Anthony T, Peters TM, Grassian VH. Size, composition, morphology, and health implications of airborne incidental metal-containing nanoparticles. J Occup Environ Hyg. 2019 Jun;16(6):387-399. doi: 10.1080/15459624.2018.1559925.
11. Фатхутдинова Л.М., Халиуллин Т.О., Залялов P.P., Ткачев А.Г., Бирч М.Э., Шведова А.А. Гигиеническая оценка аэрозоля многослойных углеродных нанотрубок в производственных условиях. Российские нанотехнологии. 2016; 11(1-2):85-90. doi: 10.1134/S1995078016010055.
12. Sarwar F, Malik RN, Chow CW, Alam K. Occupational exposure and consequent health impairments due to potential incidental nanoparticles in leather tanneries: An evidential appraisal of south Asian developing countries. Environ Int. 2018;117:164-174. doi: 10.1016/j.envint.2018.04.051.
13. Zhang S, Gao H, Bao G. Physical Principles of Nanoparticle Cellular Endocytosis. ACS Nano. 2015;9(9):8655-71. doi: 10.1021/acsnano.5b03184.
14. Shvedova AA, Yanamala N, Kisin ER, Khailullin TO, Birch ME, Fatkhutdinova LM. Integrated Analysis of Dysregulated ncRNA and mRNA Expression Profiles in Humans Exposed to Carbon Nanotubes. PLoS One. 2016;ll(3):e0150628. doi: 10.1371/journal.pone.0150628.
15. Jeong MJ, Jeon S, Yu HS, Cho WS, Lee S, Kang D, Kim Y, Kim YJ, Kim SY. Exposure to Nickel Oxide Nanoparticles Induces Acute and Chronic Inflammatory Responses in Rat Lungs and Perturbs the Lung Microbiome. Int J Environ Res Public Health. 2022 Jan 4;19(1):522. doi: 10.3390/ijerphl9010522.
16. Afroz T, Hiraku Y, Ma N, Ahmed S, Oikawa S, Kawanishi S, Murata M. Nitrative DNA damage in cultured macrophages exposed to indium oxide. J Occup Health. 2018 Mar 27;60(2):148-155. doi: 10.1539/joh.l7-0146-OA.
17. Mo Y, Jiang M, Zhang Y, Wan R, Li J, Zhong CJ, Li H, Tang S, Zhang Q. Comparative mouse lung injury by nickel nanoparticles with differential surface modification. J Nanobiotechnology. 2019 Jan 7;17(1):2. doi: 10.1186/sl2951-018-0436-0.
18. Zhang Y, Mo Y, Yuan J, Zhang Y, Mo L, Zhang Q. MMP-3 activation is involved in copper oxide nanoparticle-induced epithelial-mesenchymal transition in human lung epithelial cells. Nanotoxicology. 2021 Dec;15(10):1380-1402. doi: 10.1080/17435390.2022.2030822.
19. Kohansal R, Martinez-Camblor P, Agusti A, Buist AS, Mannino DM, Soriano JB. The natural history of chronic airflow obstruction revisited: an analysis of the Framingham offspring cohort. Am J Respir Crit Care Med. 2009 Jul 1;180(1):3-10. doi: 10.1164/rccm.200901-0047ОС.
20. Guo YI, Qian Y, Gong YI, Pan C, Shi G, Wan H. A predictive model for the development of chronic obstructive pulmonary disease. Biomed Rep.2015 Nov;3(6):853-863. doi: 10.3892/br.2015.503.
21. Kotz D, Simpson CR, Viechtbauer W, van Schayck ОС, Sheikh A. Development and validation of a model to predict the 10-year risk of general practitioner-recorded COPD. NPJ Prim Care Respir Med. 2014 May 20;24:14011. doi: 10.1038/npjpcrm.2014.11.
22. Kalhan R, Dransfield MT, Colangelo LA, Cuttica MJ, Jacobs DR Jr, Thyagarajan B, Estepar RSJ, Harmouche R, Onieva JO, Ash SY, Okajima Y, Iribarren C, Sidney S, Lewis CE, Mannino DM, Liu K, Smith LJ, Washko GR. Respiratory Symptoms in Young Adults and Future Lung Disease. The CARDIA Lung Study. Am J Respir Crit Care Med. 2018 Jun 15; 197(12): 1616-1624. doi: 10.1164/rccm.201710-21080C.
23. Burney P, Patel J, Minelli C, Gnatiuc L, Amaral AFS, Kocabas A, Cherkaski HH, Gulsvik A, Nielsen R, Bateman E, Jithoo A, Mortimer K, Sooronbaev TM, Lawin H, Nejjari C, Elbiaze M, El Rhazi K, Zheng JP, Ran P, Welte T, Obaseki D, Erhabor G, Elsony A, Osman NB, Ahmed R, Nizankowska-Mogilnicka E, Mejza F, Mannino DM, Barbara C, Wouters EFM, Idolor LF, Loh LC, Rashid A, Juvekar S, Gislason T, Al Ghobain M, Studnicka M, Harrabi I, Denguezli M, Koul PA, Jenkins C, Marks G, Jogi R, Hafizi H, Janson C, Tan WC, Aquart-Stewart A, Mbatchou B, Nafees AA, Gunasekera K, Seemungal T, Anand MP, Enright P, Vollmer WM, Blangiardo M, Elfadaly FG, Buist AS; BOLD Collaborative Research Group.Prevalence and Population-Attributable Risk for Chronic Airflow Obstruction in a Large Multinational Study. Am J Respir Crit Care Med. 2021 Jun 1;203(11): 1353-1365. doi: 10.1164/rccm.202005-1990OC.
24. Grahn K, Gustavsson P, Andersson T, Linden A, Hemmingsson T, Selander J, Wiebert P. Occupational exposure to particles and increased risk of developing chronic obstructive pulmonary disease (COPD): A population-based cohort study in Stockholm, Sweden. Environ Res. 2021 Sep;200:l 11739. doi: 10.1016/j.envres.2021.11173 9.
25. Fishwick D, Sen D, Barber C, Bradshaw L, Robinson E, Sumner J. Occupational chronic obstructive pulmonary disease: a standard of care. Occupational medicine (Oxford, England). 2015;65(4):270-82. DOI: 10.1093/occmed/kqvO 9.
26. Suissa S, Dell'Aniello S, Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax. 2012;67(ll):957-63. http://doi.org/10.1136/thoraxjnl-2011-201518.
27. Чучалин А.Г., Авдеев C.H., Айсанов 3.P., Белевский А.С., Лещенко И.В., Овчаренко СИ., Шмелев Е.И. Хроническая обструктивная болезнь легких: федеральные клинические рекомендации по диагностике и лечению. Пульмонология. 2022;32(3):356-392. https://doi.org/l0.18093/0869-0189-2022-32-3-356-392.
28. Айсанов З.Р., Каменева М.Ю., Черняк А.В., Перельман Ю.М., Приходько А.Г., Чушкин М.И., Калманова Е.М., Авдеев С.Н., Белевский А.С., Чикина С.Ю., Кравченко Н.Ю. Спирометрия. Клинические рекомендации РРО. Режим доступа https://spulmo.ru/upload/spirometriya_18_02_2022_extEd.pdf?t=1 Дата обращения 15.08.2022.
29. Christenson SA, Smith ВМ, Bafadhel М, Putcha N. Chronic obstructive pulmonary disease. Lancet. 2022 Jun 11; 399 (10342):2227-2242. doi: 10.1016/SO140-6736(22)00470-6.
30. Silva-Cardoso SC, Tao W, Angiolilli C, Lopes AP, Bekker CPJ, Devaprasad A, Giovannone B, van Laar J, Cossu M, Marut W, Hack E, de Boer RJ, Boes M, Radstake TRDJ, Pandit A. CXCL4 Links Inflammation and Fibrosis by Reprogramming Monocyte-Derived Dendritic Cells in vitro. Front Immunol. 2020 Sep 17; 11:2149. doi: 10.3389/fimmu.2020.02149.
31. Kapellos TS, Bonaguro L, Gemiind I, Reusch N, Saglam A, Hinkley ER, Schultze JL. Human Monocyte Subsets and Phenotypes in Major Chronic Inflammatory Diseases. Front Immunol. 2019 Aug 30;10:2035. doi: 10.3389/fimmu.2019.02035.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования обострений хронической обструктивной болезни легких у лиц, работающих в условиях воздействия промышленных аэрозолей | 2021 |
|
RU2774206C1 |
| Способ прогнозирования развития коморбидной формы артериальной гипертензии и хронической обструктивной болезни легких | 2016 |
|
RU2620566C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЧАСТОТЫ ОБОСТРЕНИЯ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ | 2011 |
|
RU2484770C2 |
| Способ отбора лиц, работающих в условиях воздействия кремнийсодержащих аэрозолей, для последующего мониторинга состояния бронхолегочной системы | 2023 |
|
RU2813952C1 |
| Способ диагностики профессиональной хронической обструктивной болезни легких, сформировавшейся в условиях действия токсических промаэрозолей | 2016 |
|
RU2613164C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИНФЕКЦИОННОГО ОСЛОЖНЕНИЯ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ | 2015 |
|
RU2595853C1 |
| СПОСОБ ОЦЕНКИ РИСКА РАЗВИТИЯ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ | 2013 |
|
RU2545740C1 |
| CПОСОБ ПРОГНОЗА ПРОГРЕССИРОВАНИЯ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ | 2008 |
|
RU2370773C1 |
| Способ отбора стажированных работников химического производства в группу высокого риска развития производственно обусловленной кардиореспираторной патологии | 2020 |
|
RU2742342C1 |
| СПОСОБ ОЦЕНКИ И ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ДИСФУНКЦИИ МАЛЫХ ДЫХАТЕЛЬНЫХ ПУТЕЙ У ПАЦИЕНТОВ С БРОНХИАЛЬНОЙ АСТМОЙ, АССОЦИИРОВАННОЙ С ОЖИРЕНИЕМ | 2021 |
|
RU2778070C1 |
Изобретение относится к медицине, а именно к медицине труда и пульмонологии, и может быть использовано для прогнозирования развития профессиональной хронической обструктивной болезни легких (ПХОБЛ). Прогноз осуществляют на ближайшие 3 года в отношении пациентов, не имеющих респираторных заболеваний, проработавших в течение 5 лет и более в условиях воздействия промышленных аэрозолей, содержащих ненамеренные наночастицы с кремнием. В периферической крови пациента определяют долю субпопуляции неклассических моноцитов CD14DimCD16+ относительно всех моноцитов. В сыворотке крови определяют концентрации фактора роста фибробластов-2 (FGF-2), растворимой сосудистой молекулы адгезии-1 (sVCAM-1), матриксной металлопротеиназы-9 (ММР-9) и N-концевого пропептида проколлагена 3 типа (PIIINP). Решают уравнение логистической регрессии. При значении решения уравнения 0,364 и более прогнозируют высокий риск развития ПХОБЛ у пациента в ближайшие 3 года. При значении решения уравнения менее 0,364 прогнозируют низкий риск развития ПХОБЛ. Способ обеспечивает возможность прогнозирования развития ПХОБЛ в течение 3 лет за счет определения в крови пациентов комплекса клеточных и биохимических показателей, связанных с риском развития ПХОБЛ в условиях воздействия наночастиц с кремнием. 1 ил., 8 табл., 4 пр.
Способ прогнозирования развития профессиональной хронической обструктивной болезни легких (ПХОБЛ), характеризующийся тем, что прогноз осуществляют на ближайшие 3 года в отношении пациентов, не имеющих респираторных заболеваний, проработавших в течение 5 лет и более в условиях воздействия промышленных аэрозолей, содержащих ненамеренные наночастицы с кремнием, для чего определяют в периферической крови пациента долю субпопуляции моноцитов CD14DimCD16+ «неклассических моноцитов» - НМ относительно всех моноцитов; определяют в сыворотке крови концентрации: фактора роста фибробластов-2 (FGF-2), растворимой сосудистой молекулы адгезии-1 (sVCAM-1), матриксной металлопротеиназы-9 (ММР-9), N-концевого пропептида проколлагена 3 типа (PIIINP), решают уравнение логистической регрессии:
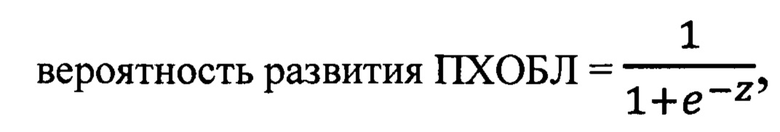
в которой
z = -83,47 + 0,90 × HM + 2,26 × FGF-2 + 0,40 × sVCAM-1 + 0,20 × MMP-9 + 0,26 × PIIINP,
где НМ - доля моноцитов CD14DimCD16+ в процентах, FGF-2, sVCAM-1 и ММР-9 - концентрации соответственно FGF-2, sVCAM-1 и ММР-9 в пг/мл; PIIINP - концентрация PIIINP в нг/мл, и при значении решения уравнения, равном 0,364 и более, прогнозируют высокий риск развития ПХОБЛ у пациента в ближайшие три года, а при значении решения уравнения менее 0,364 - низкий риск развития ПХОБЛ.
| Способ дифференциальной диагностики профессионального хронического необструктивного бронхита, профессиональной хронической обструктивной болезни легких, профессиональной бронхиальной астмы у работников производства алюминия в постконтактном периоде | 2019 |
|
RU2715212C1 |
| Способ прогнозирования обострений хронической обструктивной болезни легких у лиц, работающих в условиях воздействия промышленных аэрозолей | 2021 |
|
RU2774206C1 |
| ЗЕНКОВА М.А | |||
| и др | |||
| Хроническая обструктивная болезнь лёгких в условиях воздействия промышленных аэрозолей, содержащих наночастицы: особенности воспаления и фенотип | |||
| Мед | |||
| труда и пром | |||
| экол | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| FISHWICK D | |||
| et al | |||
| Occupational chronic obstructive pulmonary disease: a standard | |||
Авторы
Даты
2023-09-11—Публикация
2023-02-13—Подача