Изобретение относится к производным бензимидазола, к их применению в медицине, к содержащим их композициям, к способам их получения и к промежуточным соединениям, используемым в таких способах. Более конкретно, изобретение относится к ингибиторам интерлейкин-2-индуцируемой Т-клеточной киназы (ITK) и их применению для лечения заболеваний, опосредованных ITK, в частности кожных заболеваний, таких как дерматит (например, атопический дерматит).
Атопический дерматит (AD) представляет собой распространенное хроническое воспалительное заболевание кожи, встречающееся как у детей, так и у взрослых. Пациенты с AD страдают от сухих и зудящих кожных поражений, которые могут сильно повлиять на качество их жизни. Генетические факторы и факторы окружающей среды могут способствовать нарушению кожного барьера и гиперактивации иммунной системы, которые являются ключевыми факторами патогенеза AD.
Патогенная роль Т-клеток и цитокинов, происходящих из клеток Th2, IL-4 и IL-13, при AD была показана в клинической разработке дупилумаба, антитела к рецептору IL-4, которое блокирует активность как IL-4, так и IL-13. Важная активность этих цитокинов также согласуется с ранней клинической эффективностью, наблюдаемой с ингибиторами янус-киназы (JAK), которые блокируют передачу сигналов IL-4 и IL-13, а также дополнительных воспалительных цитокинов, продуцируемых в коже. Терапевтическая стратегия, которая может эффективно контролировать продукцию IL-4 и IL-13, является альтернативным подходом к модулированию этого пути. Кроме того, клетки Th1, клетки Th22 и клетки Th17 и цитокины, которые они продуцируют, IFNγ, IL-22 и IL-17, соответственно, также вносят вклад в патогенез AD.
Эффективное противовоспалительное средство при AD могло бы модулировать преобладающий воспалительный ответ, управляемый Т-клетками. Интерлейкин-2-индуцируемая Т-клеточная киназа (ITK) является членом семейства тирозинкиназ Tec. Экспрессия ITK в значительной степени ограничена иммунными клетками, такими как T, натуральные киллеры (NK), T-натуральные киллеры (NKT) и тучные клетки. В Т-клетках ITK усиливает сигналы, зависящие от Т-клеточного рецептора (TCR), чтобы способствовать активации Т-клеток, продуцированию цитокинов и пролиферации Т-клеток. Делеция ITK или ингибирование активности ITK в Т-клетках приводит к подавлению TCR-индуцированного продуцирования IL-4 и IL-13, что играет центральную роль в патофизиологии AD. Ожидается, что ингибитор ITK будет иметь дополнительную эффективность по сравнению с антагонистом рецептора IL-4, поскольку ITK также способствует TCR-зависимого продуцирования многочисленных провоспалительных цитокинов, таких как IL-2, IL-17, IL-22, IL-31, IFNγ и TNF-α. Кроме того, ITK-дефицитные CD8+ Т-клетки демонстрируют нарушенное размножение цитотоксических Т-лимфоцитов, сниженную дегрануляцию и дефектную цитолитическую способность. Мыши с дефицитом ITK и/или мыши, леченные ингибитором ITK, демонстрируют снижение заболеваемости на моделях диабета I типа, лимфопролиферативного заболевания, аллергии/астмы и гиперреактивности дыхательных путей. Кроме того, у мышей с дефицитом ITK или у мышей, леченных ингибитором ITK, наблюдается уменьшение воспаления кожи на моделях дерматита. Повышенные уровни ITK были описаны в периферических Т-клетках у пациентов с AD от умеренной до тяжелой степени, и экспрессия ITK повышена в кожных поражениях у пациентов с AD.
Кроме того, тропомиозиновые рецепторные киназы (TRK) экспрессируются клетками кожи, такими как кератиноциты, нейроны, тучные клетки и базофилы. И TRKA, и ее лиганд, фактор роста нервов (NGF), присутствуют в коже, и их экспрессия усиливается при поражениях кожи при AD. Было показано, что уровни NGF в кожных поражениях у пациентов с AD коррелируют с тяжестью зуда. Было показано, что цитокины IL-4 и IL-13, которые вносят вклад в патогенез AD, усиливают экспрессию TRKA кератиноцитами. В дополнение к регулированию развития и поддержания нейронов, NGF может сенсибилизировать ноцицепторов и вызывать кожный зуд. Зуд является основным фактором, способствующим снижению качества жизни пациентов с AD. Терапия, которая может подавить зуд, не только облегчила бы состояние пациентов, но также могла бы разорвать цикл зуд-чесание, который способствует разрушению барьера, и, таким образом, уменьшить течение и хроническое течение болезни.
NGF также экспрессируется и оказывает влияние на ненейронные клетки. NGF индуцирует пролиферацию кератиноцитов, способствует активации базофилов, стимулирует дегрануляцию тучных клеток и способствует нейрогенному зуду и воспалению. Кроме того, сообщалось об экспрессии TRKA на TCR-стимулированных Т-клетках периферической крови и Т-клетках, собранных из синовиальной жидкости пациентов с артритом, и NGF индуцирует пролиферацию Т-клеток. Таким образом, ингибирование TRKA в коже может подавлять кожное воспаление в дополнение к уменьшению зуда.
Эти данные свидетельствуют о том, что ингибитор ITK будет подавлять патогенные Т-клеточные ответы и снижать продуцирование цитокинов и, следовательно, иметь терапевтическую ценность при лечении различных воспалительных и аутоиммунных заболеваний, включая дерматологические состояния, такие как атопический дерматит, контактный дерматит, псориаз, очаговая алопеция и витилиго. Более того, ингибитор активности как ITK, так и TRKA, должен иметь особое преимущество при лечении дерматологических состояний, таких как только что упомянутые (например, атопический дерматит).
Ссылки
Benecke H, et al. Expert Opin. Invest. Drugs. 2013;22:1167-1179;
Bissonette R, Papp KA, et al. Brit. J. Derm. 2016;175:902-911;
Botchkarev VA, Yaar M, Peters EMJ et al. J. Invest. Dermatology. 2006;126:1719-1727;
Brunner PM, et al. J Allergy Clin Immunol. 2017;139(4S):S65-S76;
Kapnick SM, Stinchcombe JC, et al. Immunol. 2017;198:2699-2711;
Lin TA, McIntyre KW, et al. Biochemistry 2004;43:11056-11062;
Matsumura S, Terao M, et al. J. Derm. Science 2015;78:215-223;
Otsuka A, Nomura T, et al. Immunological Reviews. 2017;278:246-262;
Raychaudhuri SP, Raychaudhuri SK, et al. Arthritis & Rheumatism 2011;63:3243-3252;
Sabat R, Wolk K, et al. Seminars in Immunopathology 2019;41:359-377;
Sahu N, and August A. Curr. Top. Med. Chem. 2009;9:690-703;
Von Bonin A, Rausch A, et al. Exp. Derm. 2010;20:41-47;
Yamaguchi J, Aihara M, et al. J. Dermatol. Science. 2008;53:48-54
Согласно первому аспекту изобретения предложено соединение формулы (I)
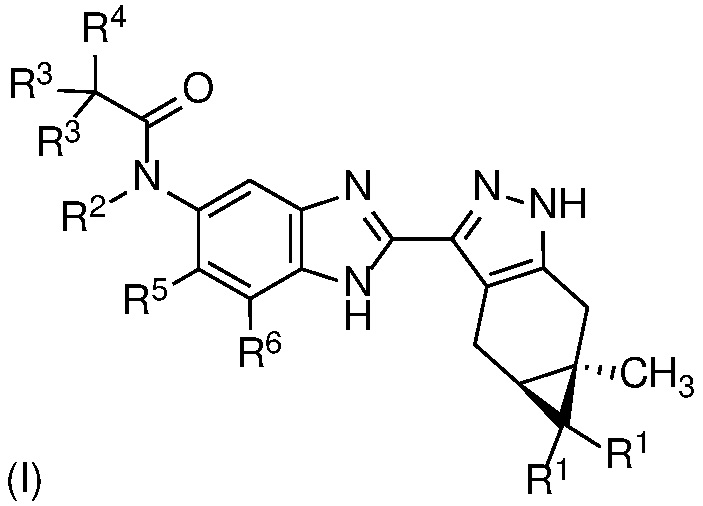
или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где
каждый R1 независимо представляет собой H или F;
R2 представляет собой H, (C1-C4)алкил, гидрокси(C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил или (C1-C4)алкил, замещенный одним, двумя или тремя F;
каждый R3 независимо представляет собой H, F, (C3-C5)циклоалкил, (C1-C4)алкил или (C1-C4)алкил, замещенный одним, двумя или тремя F; или оба R3 вместе с атомом углерода, к которому они присоединены, образуют (C3-C5)циклоалкил;
R4 представляет собой 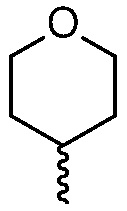 или
или 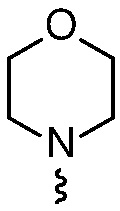 , где каждый гетероцикл необязательно замещен одним или двумя заместителями, независимо выбранными из оксо, (C1-C4)алкила, гидрокси(C1-C4)алкила и (C1-C4)алкила, замещенного одним, двумя или тремя F; и
, где каждый гетероцикл необязательно замещен одним или двумя заместителями, независимо выбранными из оксо, (C1-C4)алкила, гидрокси(C1-C4)алкила и (C1-C4)алкила, замещенного одним, двумя или тремя F; и
R5 и R6 независимо представляют собой Н; галоген; ОН; CN; (С1-С6)алкил; гидрокси(С1-С6)алкил; (С1-С4)алкокси(С1-С6)алкил; (С1-С6)алкил, замещенный одним, двумя или тремя F; (С1-С6)алкокси; или (С1-С6)алкокси, замещенный (С1-С4)алкокси.
Ниже описаны варианты осуществления этого первого аспекта изобретения, где для удобства E1 идентичен ему.
E1 Соединение формулы (I) или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, как определено выше.
E2 Соединение по варианту осуществления E1 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где каждый R1 представляет собой H или F.
E3 Соединение по варианту осуществления E2 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где каждый R1 представляет собой Н.
E4 Соединение по любому из вариантов осуществления E1-E3 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R2 представляет собой H или (C1-C4)алкил.
E5 Соединение по варианту осуществления E4 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R2 представляет собой Н.
E6 Соединение по варианту осуществления E4 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R2 представляет собой метил или этил.
E7 Соединение по варианту осуществления E6 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R2 представляет собой метил.
E8 Соединение по варианту осуществления E6 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R2 представляет собой этил.
E9 Соединение по любому из вариантов осуществления E1-E8 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где каждый R3 независимо представляет собой H, F или (C1-C4)алкил.
E10 Соединение по варианту осуществления E9 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где каждый R3 независимо представляет собой H, F или метил.
E11 Соединение по варианту осуществления E10 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где каждый R3 представляет собой F.
E12 Соединение по варианту осуществления E10 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где каждый R3 представляет собой Н.
E13 Соединение по варианту осуществления E10 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где один R3 представляет собой Н, и другой R3 представляет собой метил.
E14 Соединение по варианту осуществления E13 формулы (Ia)
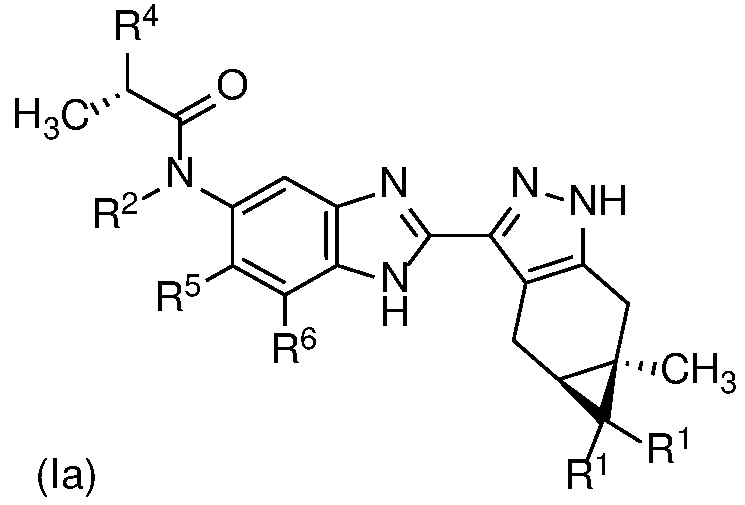
или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E15 Соединение по любому из вариантов осуществления E1-E14 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R4 представляет собой
 или
или  ,
,
необязательно замещенный одним или двумя заместителями, независимо выбранными из оксо, (C1-C4)алкила и гидрокси(C1-C4)алкила.
E16 Соединение по варианту осуществления E15 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R4 представляет собой
 или
или  ,
,
необязательно замещенный одним или двумя заместителями, независимо выбранными из оксо, метила и гидроксиметила.
E17 Соединение по варианту осуществления E16 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R4 представляет собой
 или
или  .
.
E18 Соединение по варианту осуществления E17 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R4 представляет собой
 .
.
E19 Соединение по варианту осуществления E16 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R4 представляет собой
 ,
,
необязательно замещенный одним или двумя заместителями, независимо выбранными из оксо, метила и гидроксиметила.
E20 Соединение по варианту осуществления E19 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R4 представляет собой
 ,
,
необязательно замещенный оксо.
E21 Соединение по варианту осуществления E19 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R4 представляет собой
 ,
,
необязательно замещенный одним или двумя метилами.
E22 Соединение по варианту осуществления E19 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R4 представляет собой
 .
.
E23 Соединение по любому из вариантов осуществления E1-E22 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R5 и R6 независимо представляют собой H; галоген; OH; CN; (С1-С3)алкил; гидрокси(С1-С3)алкил; (С1-С3)алкокси(С1-С3)алкил; (С1-С3)алкил, замещенный одним, двумя или тремя F; (С1-С3)алкокси; или (С1-С3)алкокси, замещенный (С1-С3)алкокси.
E24 Соединение по варианту осуществления E23 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R5 представляет собой H, галоген, CN, (С1-С6)алкил, (С1-С6)алкокси или (С1-С6)алкокси, замещенный (С1-С4)алкокси.
E25 Соединение по варианту осуществления E24 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R5 представляет собой H, галоген, CN, (С1-С3)алкил, (С1-С3)алкокси или (С1-С3)алкокси, замещенный (С1-С3)алкокси.
E26 Соединение по варианту осуществления E25 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R5 представляет собой H, F, Br, CN, метил, этил, метокси или CH3O-CH2-CH2O-.
E27 Соединение по любому из вариантов осуществления E1-E26 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R6 представляет собой Н; галоген; OH; CN; (С1-С6)алкил; гидрокси(С1-С6)алкил; (С1-С4)алкокси(С1-С6)алкил; (С1-С6)алкил, замещенный одним, двумя или тремя F; или (С1-С6)алкокси.
E28 Соединение по варианту осуществления E27 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R6 представляет собой Н; галоген; OH; CN; (С1-С3)алкил; гидрокси(С1-С3)алкил; (С1-С3)алкокси(С1-С3)алкил; (С1-С3)алкил, замещенный одним, двумя или тремя F; или (С1-С3)алкокси.
E29 Соединение по варианту осуществления E28 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, где R6 представляет собой H, F, Cl, Br, OH, CN, метил, этил, гидроксиметил, метоксиметил, CHF2, CF3 или метокси.
E30 Соединение по варианту осуществления E1 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, выбранный из:
Пример 1: (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 2: N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 3: (R)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 4: (R)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид;
Пример 5: N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид;
Пример 6: (S)-N-этил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 7: (R)-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид;
Пример 8: N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид;
Пример 9: (S)-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид;
Пример 10: N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)ацетамид;
Пример 11: 2,2-дифтор-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)ацетамид;
Пример 12: (R)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)пропанамид;
Пример 13: (S)-N-(2-((4aS,5aR)-5,5-дифтор-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 14: (S)-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 15: (S)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 16: (S)-N-этил-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 17: (S)-N-(6-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 18: (S)-N-(6-этил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 19: (S)-N-(6-метокси-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 20: (S)-N-(6-бром-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 21: (S)-N-(6-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 22: (S)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(3-оксоморфолино)пропанамид;
Пример 23: (R)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(3-оксоморфолино)пропанамид;
Пример 24: (S)-N-(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 25: (S)-N-(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-этил-2-морфолинопропанамид;
Пример 26: 2-((S)-2-(гидроксиметил) морфолино)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)ацетамид;
Пример 27: 2-(2-(Гидроксиметил) морфолино)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)ацетамид;
Пример 28: 2-((R)-2-(Гидроксиметил)морфолино)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)ацетамид;
Пример 29: 2-(2,2-Диметилморфолино)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)ацетамид;
Пример 30: Метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-((R)-2-метилморфолино)ацетамид;
Пример 31: Метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-((S)-2-метилморфолино)ацетамид;
Пример 32: 2-((2R,6R)-2,6-диметилморфолино)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)ацетамид;
Пример 33: 2-((2S,6S)-2,6-диметилморфолино)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)ацетамид;
Пример 34: N-Метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолиноацетамид;
Пример 35: N-Метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)ацетамид;
Пример 36: N-Метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(3-оксоморфолино)ацетамид;
Пример 37: (S)-N-(7-бром-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 38: (S)-N-(7-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 39: (S)-N-(7-гидрокси-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 40: (S)-N-(7-метокси-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 41: (S)-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-7-(трифторметил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 42: (S)-N-(7-(метоксиметил)-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 43: (S)-N-(7-хлор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 44: (S)-N-(7-этил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 45: (S)-N-(7-(гидроксиметил)-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 46: (S)-N-(7-фтор-6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 47: (S)-N-(6-фтор-7-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 48: (S)-N-(7-(дифторметил)-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 49: (S)-N-(6-(2-метоксиэтокси)-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 50: (S)-N-метил-N-(7-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид; и
Пример 51: (S)-N-(2-((4aS,5aR)-5,5-дифтор-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-7-метил-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид.
E31 Соединение по варианту осуществления E1 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, выбранный из:
Пример 52: (S)-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 53: (S)-N-(2-((4aS,5aR)-5,5-дифтор-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-5-метил-1H-бензо[d]имидазол-6-ил)-N-метил-2-морфолинопропанамид;
Пример 54: N-(6-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)ацетамид;
Пример 55: (R)-N-(7-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)пропенамид; и
Пример 56: (S)-N-(метил-13C-d3)-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид.
E32 Соединение по варианту осуществления E1 или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли, выбранный из:
Пример 1: (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 7: (R)-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид;
Пример 12: (R)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)пропанамид;
Пример 15: (S)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 16: (S)-N-этил-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид;
Пример 24: (S)-N-(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид;
Пример 25: (S)-N-(6.7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-этил-2-морфолинопропанамид;
Пример 46: (S)-N-(7-фтор-6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид; и
Пример 50: (S)-N-метил-N-(7-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид.
E33 Соединение по варианту осуществления E32, которое представляет собой (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E34 Соединение по варианту осуществления E32, которое представляет собой (R)-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E35 Соединение по варианту осуществления E32, которое представляет собой (R)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)пропанамид или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E36 Соединение по варианту осуществления E32, которое представляет собой (S)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E37 Соединение по варианту осуществления E32, которое представляет собой (S)-N-этил-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E38 Соединение по варианту осуществления E32, которое представляет собой (S)-N-(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E39 Соединение по варианту осуществления E32, которое представляет собой (S)-N-(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-этил-2-морфолинопропанамид или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E40 Соединение по варианту осуществления E32, которое представляет собой (S)-N-(7-фтор-6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E41 Соединение по варианту осуществления E32, которое представляет собой (S)-N-метил-N-(7-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли.
E42 Соединение по варианту осуществления E33, которое представляет собой (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид или его фармацевтически приемлемый сольват.
E43 Соединение по варианту осуществления E42, которое представляет собой (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид или его гидрат.
E44 Соединение по варианту осуществления E43, которое представляет собой (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид, дигидрат.
E45 Соединение по варианту осуществления E33, которое представляет собой
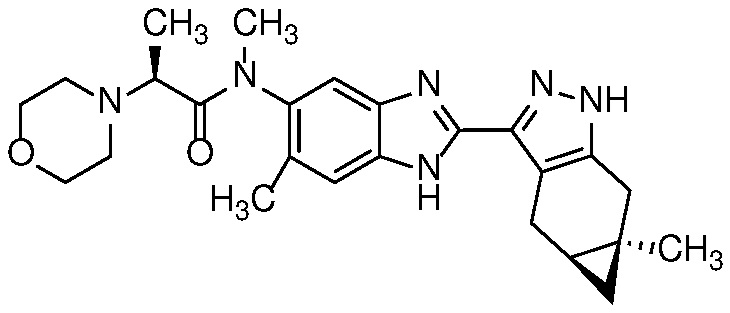 .
.
E46 Кристаллическая форма соединения по варианту осуществления E44.
E47 Кристаллическая форма по варианту осуществления E46 с одним, двумя, тремя, четырьмя или пятью пиками PXRD, выбранными из 6,6°±0,2° 2θ, 7,4°±0,2° 2θ, 11,0°±0,2° 2θ, 11,6°±0,2° 2θ, 15,7°±0,2° 2θ и 17,7°±0,2° 2θ.
E48 Кристаллическая форма по варианту осуществления E47 с пиками PXRD при 6,6°±0,2° 2θ, 11,0°±0,2° 2θ, 15,7°±0,2° 2θ и 17,7°±0,2° 2θ.
E49 Кристаллическая форма по варианту осуществления E47 с пиками PXRD при 6,6°±0,2° 2θ, 7,4°±0,2° 2θ, 11,0°±0,2° 2θ и 11,6°±0,2° 2θ.
E50 Кристаллическая форма по варианту осуществления E47 с пиками PXRD при 7,4°±0,2° 2θ, 11,6°±0,2° 2θ, 15,7°±0,2° 2θ и 17,7°±0,2° 2θ.
E51 Кристаллическая форма по варианту осуществления E47 с пиками PXRD при 6,6°±0,2° 2θ, 7,4°±0,2° 2θ, 11,0°±0,2° 2θ, 11,6°±0,2° 2θ, 15,7°±0,2° 2θ и 17,7°± 0,2° 2θ.
E52 Кристаллическая форма по варианту осуществления E46 с пиками PXRD при 6,6°±0,2° 2θ, 7,4°±0,2° 2θ, 11,0°±0,2° 2θ, 11,6°±0,2° 2θ, 13,3°±0,2° 2θ, 15,7°±0,2° 2θ, 16,2°±0,2° 2θ, 17,7°±0,2° 2θ, 18,8°±0,2° 2θ и 22,9°±0,2° 2θ.
Краткое описание чертежей
На Фигуре 1 представлена рентгенограмма PXRD для соединения из примера 1.1 (кристаллическая форма 1).
На Фигуре 2 представлена рентгенограмма PXRD для соединения из примера 1.2а (кристаллическая форма 2).
На Фигуре 3 представлена рентгенограмма PXRD для соединения из примера 1.3 (кристаллическая форма 3).
На Фигуре 4 представлена диаграмма ORTEP для соединения из примера 1.4 (кристаллическая форма 2), построенная с параметрами замещения с вероятностью 50% и молекулами воды, опущенными для ясности.
На Фигуре 5 представлена диаграмма ORTEP для соединения из примера 1.4 (кристаллическая форма 2), построенная с параметрами смещения при вероятности 50% и показанными молекулами воды.
На Фигуре 6 представлен TGA соединения из примера 1.1 (кристаллическая форма 1).
На Фигуре 7 представлен TGA соединения из примера 1.3 (кристаллическая форма 3).
В соединениях формулы (I):
- Алкил означает углеводородную группу с прямой или разветвленной цепью формулы -CnH(2n+1). Примеры алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
- Алкилокси означает алкильный заместитель, присоединенный через атом кислорода. Примеры алкилокси включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси.
- Циклоалкил означает циклическую углеводородную группу формулы -CnH(2n-1), содержащую, по меньшей мере, три атома углерода. Примеры циклоалкила включают циклопропил, циклобутил и циклопентил.
- Примеры галогена включают фтор (F), хлор (Cl), бром (Br) и йод (I).
- Оксо относится к кислороду с двойной связью (=O).
В дальнейшем все ссылки на соединения по изобретению включают соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или многокомпонентные комплексы, или фармацевтически приемлемые сольваты или многокомпонентные комплексы фармацевтически приемлемых солей соединений формулы (I), как более подробно обсуждается ниже.
Предпочтительными соединениями изобретения являются соединения формулы (I) или их фармацевтически приемлемые соли или фармацевтически приемлемые сольваты указанных соединений или указанных солей.
Другими предпочтительными соединениями изобретения являются соединения формулы (I) или их фармацевтически приемлемые сольваты.
Другими предпочтительными соединениями изобретения являются соединения формулы (I) или их фармацевтически приемлемые гидраты.
Подходящие кислотно-аддитивные соли образуются из кислот, образующих нетоксичные соли. Примеры включают ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, цикламат, эдисилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, 1,5-нафталиндисульфонат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/водород фосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинофоат.
Могут также образовываться полусоли кислот, например, гемисульфат и гемитартрат.
Специалисту понятно, что вышеупомянутые соли включают соли, в которых противоион является оптически активным, например, d-лактат, или рацемическим, например, dl-тартрат.
Обзор подходящих солей см. в «Handbook of Pharmaceutical Salts: Properties, Selection, and Use» by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002).
Фармацевтически приемлемые соли соединений формулы (I) могут быть получены одним или более из трех способов:
(i) путем взаимодействия соединения формулы (I) с желаемой кислотой;
(ii) удалением кислотолабильной защитной группы из подходящего предшественника соединения формулы (I) с использованием желаемой кислоты; или
(iii) превращением одной соли соединения формулы (I) в другую путем взаимодействия с соответствующей кислотой или с помощью подходящей ионообменной колонки.
Все три реакции обычно проводят в растворе. Получаемая соль может выпадать в осадок и собираться фильтрованием или может быть восстановлена выпариванием растворителя. Степень ионизации в полученной соли может варьироваться от полностью ионизированной до почти не ионизированной.
Соединения формулы (I) или их фармацевтически приемлемые соли могут существовать как в не сольватированной, так и в сольватированной формах. Термин «сольват» используется в настоящем документе для описания молекулярного комплекса, включающего соединение формулы (I) или его фармацевтически приемлемую соль и одну или более молекул фармацевтически приемлемого растворителя, например, этанола. Термин «гидрат» используется, когда указанный растворитель представляет собой воду. Фармацевтически приемлемые сольваты в соответствии с изобретением включают сольваты, в которых растворитель кристаллизации может быть изотопно замещен, например, D2O, d6-ацетон и d6-ДМСО.
В настоящее время принятой системой классификации органических гидратов является та, которая определяет гидраты с выделенным сайтом, каналом или координированные с ионами металла - см. Polymorphism in Pharmaceutical Solids by K.R. Morris (Ed. HG Brittain, Marcel Dekker, 1995), включенной в настоящее описание посредством ссылки. Гидраты с выделенным сайтом представляют собой такие, в которых молекулы воды изолированы от прямого контакта друг с другом за счет промежуточных органических молекул. В канальных гидратах, молекулы воды лежат в каналах решетки, где они находятся рядом с другими молекулами воды. В координированных с ионами металлов гидратах молекулы воды связаны с ионами металлов.
Когда растворитель или вода прочно связаны, комплекс будет иметь четко определенную стехиометрию, не зависящую от влажности. Когда, однако, растворитель или вода слабо связаны, как в канальных сольватах и гигроскопичных соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях, не стехиометрия будет нормой.
В объем изобретения также включены многокомпонентные комплексы (отличные солей и сольватов) соединений формулы (I) или их фармацевтически приемлемых солей, в которых лекарственное средство и, по меньшей мере, один другой компонент присутствуют в стехиометрических или не стехиометрических количествах. Комплексы этого типа включают клатраты (комплексы включения лекарство-хозяин) и сокристаллы. Последние обычно определяются как кристаллические комплексы нейтральных молекулярных составляющих, которые связаны друг с другом посредством нековалентных взаимодействий, но также могут представлять собой комплекс нейтральной молекулы с солью. Сокристаллы могут быть получены кристаллизацией из расплава, перекристаллизацией из растворителей или физическим измельчением компонентов вместе - см. Chem Commun, 17, 1889-1896, O. Almarsson and M. J. Zaworotko (2004), включенные в настоящий документ посредством ссылки. Общий обзор многокомпонентных комплексов см. в J Pharm Sci, 64 (8), 1269-1288, Haleblian (August 1975), включенной в настоящий документ посредством ссылки.
Соединения по изобретению могут существовать в континууме твердых состояний в диапазоне от полностью аморфного до полностью кристаллического. Термин «аморфный» относится к состоянию, в котором в материале отсутствует дальний порядок на молекулярном уровне и, в зависимости от температуры, он может проявлять физические свойства твердого тела или жидкости. Обычно такие материалы не дают отчетливых рентгеновских дифрактограмм и, хотя и проявляют свойства твердого вещества, более формально описываются как жидкости. При нагревании происходит переход от твердых к жидким свойствам, который характеризуется изменением состояния, как правило, второго порядка («стеклование»). Термин «кристаллический» относится к твердой фазе, в которой материал имеет правильную упорядоченную внутреннюю структуру на молекулярном уровне и дает отчетливую рентгеновскую дифрактограмму с определенными пиками. Такие материалы при достаточном нагревании также будут проявлять свойства жидкости, но переход от твердого состояния к жидкому характеризуется фазовым переходом, обычно первого порядка («точка плавления»).
Термин «2 тета» или «2θ» относится к положению пика PXRD в градусах по оси x. Типовая ошибка, связанная с положением пика PXRD, составляет до +/- 0,2° 2θ (USP-941).
Соединения по изобретению могут также существовать в мезоморфном состоянии (мезофаза или жидкие кристаллы) при воздействии подходящих условий. Мезоморфное состояние является промежуточным между истинным кристаллическим состоянием и истинным жидким состоянием (расплавом или раствором). Мезоморфизм, возникающий в результате изменения температуры, описывается как «термотропный», и возникающий в результате добавления второго компонента, такого как вода или другой растворитель, описывается как «лиотропный». Соединения, способные образовывать лиотропные мезофазы, описываются как «амфифильные» и состоят из молекул, обладающих ионной (например, -COO-Na+, -COO-K+ или -SO3-Na+) или неионной (например, -N-N+(CH3)3) полярной головной группой. Для получения дополнительной информации см. Crystals and the Polarizing Microscope by N. H. Hartshorne and A. Stuart, 4th edition (Edward Arnold, 1970), включенное в настоящий документ посредством ссылки.
Соединения по изобретению можно вводить в виде пролекарств. Таким образом, некоторые производные соединений формулы (I), которые сами по себе могут иметь небольшую фармакологическую активность или не иметь ее, могут при введении внутрь или нанесении на тело превращаться в соединения формулы (I), обладающие желаемой активностью, например, путем гидролитического расщепления. Такие производные называются «пролекарствами». Дополнительную информацию об использовании пролекарств можно найти в «Pro-drugs as Novel Delivery Systems», Vol. 14, ACS Symposium Series (T Higuchi and W Stella) и «Bioreversible Carriers in Drug Design», Pergamon Press, 1987 (ed. E B Roche, American Pharmaceutical Association).
Пролекарства могут быть получены, например, путем замены соответствующих функциональных групп, присутствующих в соединении формулы (I), некоторыми фрагментами, известными специалистам в данной области техники как «пролекарства», как описано, например, в «Design of Prodrugs» by H Bundgaard (Elsevier, 1985)
Примеры пролекарств включают пролекарства на основе фосфатов, такие как пролекарства на основе дигидрогена или диалкила (например, ди-трет-бутил) фосфата. Дополнительные примеры замещающих групп в соответствии с приведенными выше примерами и примеры других типов пролекарств можно найти в вышеупомянутых ссылках.
Также в объем изобретения включены метаболиты соединений формулы (I), то есть соединения, образующиеся in vivo при введении лекарственного средства. Примеры метаболитов в соответствии с изобретением включают варианты, в которых соединение формулы (I) содержит морфолинильную группу по варианту осуществления E19, гидроксиэтиламины формулы (Ib) и амины формулы (Ic), как показано ниже.
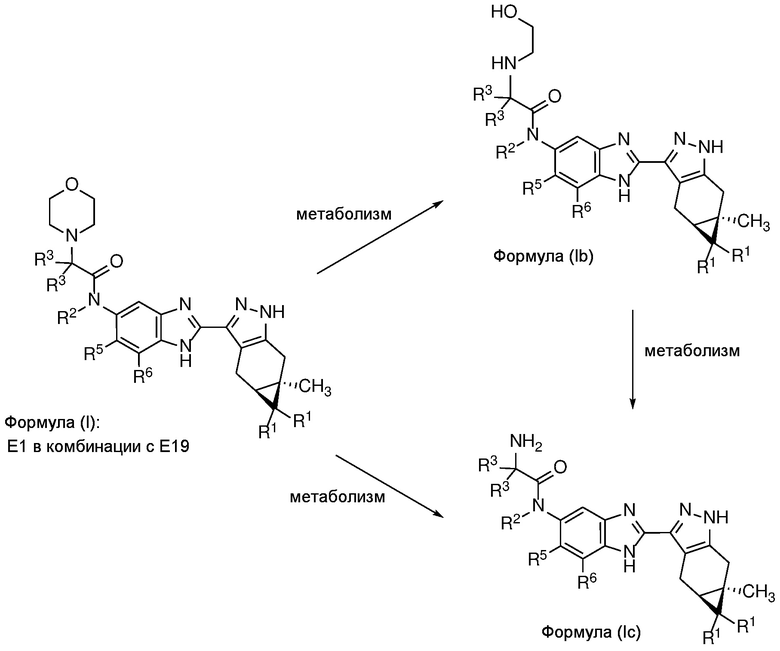
Приведенные ниже соединения М1 и М2, метаболиты соединения Примера 1, иллюстрируют этот аспект изобретения и представляют особый интерес.
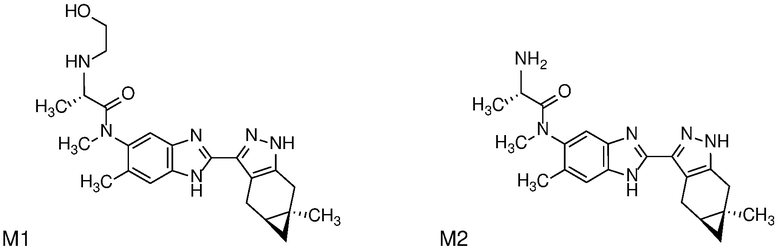
Другие примеры метаболитов по изобретению включают:
(i) производные гидроксиметила (-CH3 → -CH2OH);
(ii) когда соединение формулы (I) содержит алкоксигруппу, его производное гидрокси (-(C1-C6)алкокси → -ОН); и
(iii) когда соединение формулы (I) содержит фенильную группу, его фенольное производное (-Ph → -PhOH).
Формула (I) содержит асимметричную циклопропиндазолильную группу и стереоспецифически определена (как стереоизомер «4aS,5aR»).
Специалисту в данной области техники будет понятно, что один или более заместителей в формуле (I) могут вводить один или более дополнительных асимметричных центров. Иллюстрацией такого дополнительного асимметричного центра является асимметричный атом углерода соединения формулы (Ia) или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или указанной соли в соответствии с Вариантом осуществления E14, отмеченным звездочкой (*) в представлении формулы (Ia) ниже:
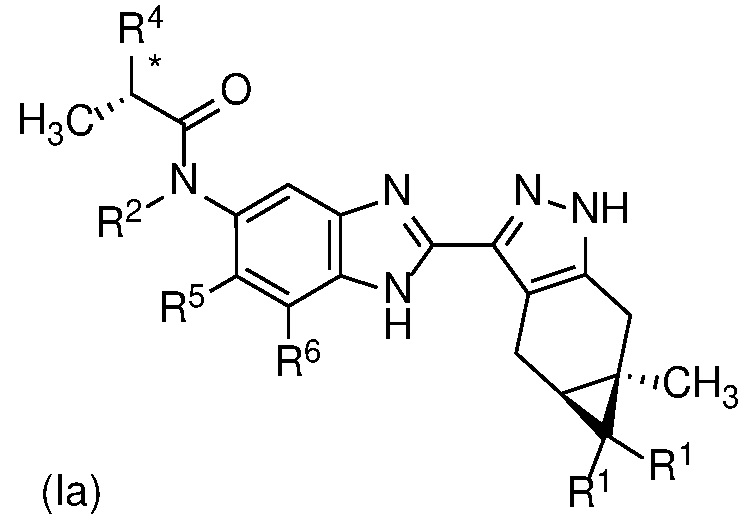 .
.
Соединения по изобретению, содержащие указанный один или более дополнительных центров асимметрии, могут существовать в виде двух или более стереоизомеров; в объем изобретения включены все такие стереоизомеры (включая эпимеры) соединений изобретения и смеси двух или более из них.
Обычные методики получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной жидкостной хроматографии высокого давления (ВЭЖХ).
Альтернативно, рацемат (или рацемический предшественник) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например, спиртом, или, в случае, когда соединение формулы (I) содержит кислотную или основную группу, основанием или кислотой, такую как 1-фенилэтиламин или винная кислота. Полученную диастереомерную смесь можно разделить хроматографией и/или фракционной кристаллизацией, и один или оба диастереоизомера превратить в соответствующий(ие) чистый(ые) энантиомер(ы) способами, хорошо известными специалисту в данной области техники.
Хиральные соединения по изобретению (и их хиральные предшественники) могут быть получены в энантиомерно-обогащенной форме с использованием хроматографии, обычно ВЭЖХ, на асимметрической смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащего от 0 до 50% об. изопропанола, обычно, от 2% до 20%, и от 0 до 5% об. алкиламина, обычно, 0,1% диэтиламина. Концентрация элюата дает обогащенную смесь.
Можно использовать хиральную хроматографию с использованием суб- и сверхкритических жидкостей. Способы хиральной хроматографии, применимые в некоторых вариантах осуществления настоящего изобретения, известны; см., например, Smith, Roger M., Loughborough University, Loughborough, UK; Chromatographic Science Series (1998), 75 (Supercritical Fluid Chromatography with Packed Columns), pp. 223-249 и цитируемые там ссылки.
Смеси стереоизомеров могут быть разделены обычными методами, известными специалистам в данной области; см., например, «Stereochemistry of Organic Compounds» by E. L. Eliel and S. H. Wilen (Wiley, New York, 1994.
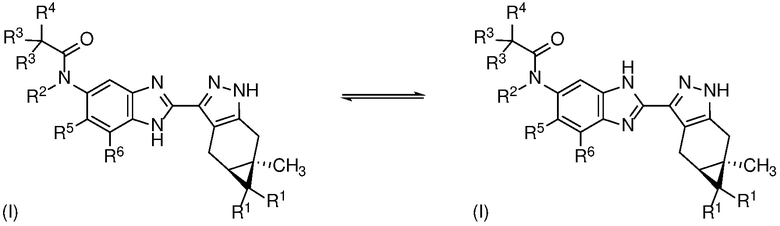
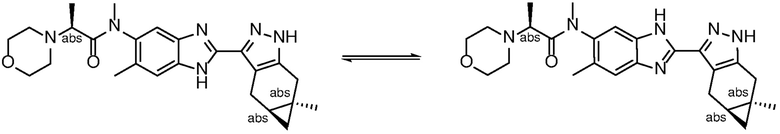
Там, где структурные изомеры являются взаимопревращаемыми через низкий энергетический барьер, может возникать таутомерная изомерия («таутомерия») и конформационная изомерия.
Таутомерия может принимать форму протонной таутомерии в соединениях формулы (I), как показано ниже в формуле (I) в целом и в примере 1, в частности, в отношении бензимидазольной группы:
 ;
;
 .
.
Специалисту в данной области техники будет понятно, что протонная таутомерия также может иметь место на пиразольном кольце в соединениях формулы (I).
Хотя для краткости соединения формулы (I) представлены в настоящем документе в единственной таутомерной форме, все возможные таутомерные формы и их смеси включены в объем изобретения.
Конформационная изомерия представляет собой форму стереоизомерии, при которой изомеры соединения могут превращаться друг в друга исключительно за счет вращения вокруг одинарных связей. Такие изомеры обычно называют конформационными изомерами или конформерами и, в частности, ротамерами. «Ротамерная смесь» или «смесь ротамеров» описывает соединение, существующее в виде смеси более чем одного из возможных конформационных изомеров. Хотя для краткости соединения формулы (I) изображены в одной конформационной форме, все возможные конформеры и их смеси включены в объем изобретения.
Объем изобретения включает все кристаллические формы соединений изобретения, включая их рацематы и рацемические смеси (конгломераты). Стереоизомерные конгломераты также могут быть разделены обычными методами, описанными в настоящем документе чуть выше.
Объем изобретения включает все фармацевтически приемлемые изотопно-меченые соединения по изобретению, в которых один или более атомов заменены атомами, имеющими тот же атомный номер, но атомную массу или массовое число, отличающееся от атомной массы или массового числа, преобладающих в природе.
Примеры изотопов, подходящих для включения в соединения изобретения, включают изотопы: водорода, такие как 2H и 3H; углерод, такой как 11С, 13С и 14С; фтор, такой как 18F; хлор, такой как 36Cl; йод, такой как 123I и 125I; азот, такой как 13N и 15N; кислород, такой как 15О, 17О и 18О.
Некоторые изотопно-меченые соединения по изобретению, например, соединения, включающие радиоактивный изотоп, полезны в исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы трития, т.е. 3Н и углерод-14, т.е. 14С, особенно пригодны для этой цели ввиду простоты их включения и удобных средств обнаружения. Замещение более тяжелыми изотопами, такими как дейтерий (D), т.е. 2H, может давать определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличение периода полувыведения in vivo или снижение требований к дозировке, и, следовательно, в некоторых обстоятельствах может быть предпочтительным. Замена изотопами, излучающими позитроны, такими как 11C, 15O и 13N, может быть полезна в исследованиях позитронно-эмиссионной томографии (РЕТ) для изучения занятости субстрата рецепторами.
Меченые изотопами соединения формулы (I), как правило, могут быть получены обычными методами, известными специалистам в данной области техники, или способами, аналогичными тем, которые описаны в сопроводительных примерах и примерах получения, с использованием соответствующего реагента, меченного изотопом, вместо ранее использовавшегося немеченого реагента.
Также в объем изобретения входят промежуточные соединения, как определено ниже, все их соли, сольваты и комплексы, а также все сольваты и комплексы их солей, как определено выше для соединений формулы (I). Изобретение включает все полиморфы вышеупомянутых видов и их кристаллические габитусы.
При получении соединения формулы (I) в соответствии с изобретением, специалист в данной области техники может обычным образом выбрать форму промежуточного соединения, которая обеспечивает наилучшее сочетание свойств для этой цели. К таким характеристикам относятся температура плавления, растворимость, технологичность и выход промежуточной формы, а также возникающая в результате легкость очистки продукта при выделении.
Соединения по изобретению могут быть получены любым способом, известным в данной области техники для получения соединений аналогичной структуры. В частности, соединения по настоящему изобретению могут быть получены способами, описанными со ссылкой на следующие схемы, или конкретными способами, описанными в примерах, или способами, аналогичными тем и другим.
Специалисту в данной области техники будет понятно, что экспериментальные условия, изложенные на следующих схемах, иллюстрируют подходящие условия для осуществления показанных превращений и что может быть необходимо или желательно варьировать точные условия, используемые для получения соединений формулы (I). Кроме того, будет понятно, что может быть необходимо или желательно проводить превращения в порядке, отличном от порядка, описанного на схемах, или модифицировать одно или более превращений для получения желаемого соединения по изобретению.
Соединения по настоящему изобретению содержат два или более стереогенных центра со стереохимическим обозначением (R) или (S). Специалисту в данной области техники будет понятно, что все синтетические превращения можно проводить либо с энантиообогащенными, либо с рацемическими соединениями, и что разделение на желаемый стереоизомер может происходить в любой момент синтеза с использованием хорошо известных способов, описанных в настоящем документе и/или известных в данной области техники.
Кроме того, специалисту в данной области техники понятно, что на любой стадии синтеза соединений по изобретению может быть необходимо или желательно защитить одну или более чувствительных групп, чтобы предотвратить нежелательные побочные реакции. В частности, может быть необходимо или желательно защитить гидроксильные, карбоксильные и/или аминогруппы. Защитные группы, используемые при получении соединений изобретения, могут быть использованы обычным образом; см., например, те, которые описаны в «Greene’s Protective Groups in Organic Synthesis» by Theodora W Greene and Peter G M Wuts, fifth edition, (John Wiley and Sons, 2014), включенной в настоящий документ посредством ссылки, и, в частности, в главах 2, 5 и 7, соответственно, где также описаны способы удаления таких групп.
В следующих общих процессах и, если не указано иное:
- R1 - R6 являются такими, как определено ранее для соединения формулы (I);
- R представляет собой алкил, такой как этил, или в случае формул 3 и 4, два R могут быть взяты вместе с атомами кислорода, к которым они присоединены, с образованием циклического ацеталя;
- PG представляет собой подходящую защитную группу для аминогруппы, такую как силиловый эфир (например, SEM), алкоксикарбонильная (например, BOC), ацетильная (Ac), бензильная (например, PMB) или дигидропирановая (DHP) защитная группа; и
X представляет собой F или Cl.
Замещенный пиразол формулы 11 может быть получен, как показано на схеме 1.
Схема 1
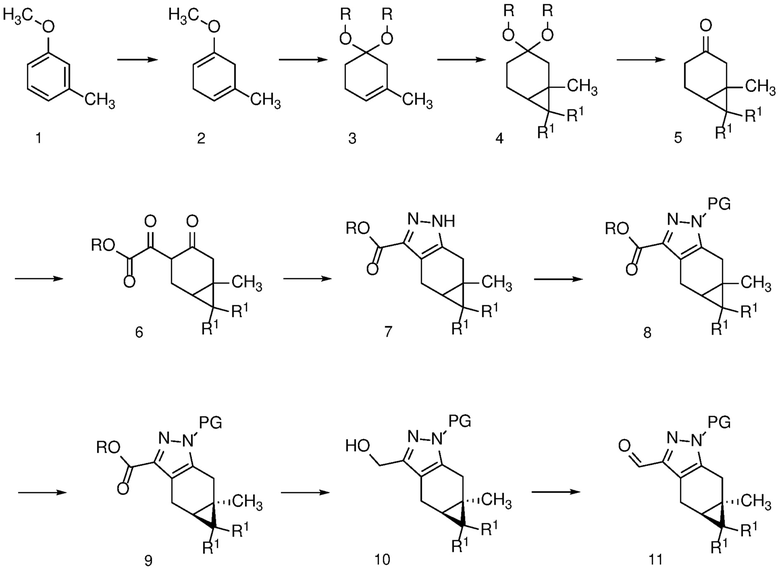
Соединение 1 (3-метокситолуол) может быть восстановлено до соответствующего 1,4-диенового соединения 2 путем восстановления Берча (Mander, L. N. Comprehensive Organic Synthesis; Trost, B. M. and Fleming, I., Ed.; Pergamon: Oxford, 1991, Vol. 8, pp. 489-521), с использованием щелочного металла, такого как Li или Na, в жидком аммиаке при температуре ниже -30°C.
Получение олефинового ацеталя формулы 3 из 1,4-диенового соединения 2 можно проводить в каталитических кислых условиях, например, с использованием pTSA или CSA в присутствии первичных алкиловых спиртов, таких как MeOH или EtOH, или диола, такого как этиленгликоль, с растворителем или без него, таким как ДХМ или другой апротонный растворитель, при температуре от 0 до 100°С, например, от 0 до 25°С.
Превращение олефина формулы 3 в циклопропан формулы 4 может происходить посредством присоединения дигалогенкарбена или циклопропанирования Симмонса-Смита (Charette, A. B.; Beauchemin, A. Simmons-Smith Cyclopropanation Reaction.Org. React. 2001, 58, p 1-415).
Снятие защиты с ацеталя формулы 4 с получением кетона формулы 5 можно проводить в кислых условиях, например, с использованием HCl, H2SO4 или органической кислоты, такой как pTSA, в смеси воды и растворителя, такого как ТГФ.
Получение дикетона формулы 6 может быть достигнуто путем взаимодействия кетона формулы 5 с: i) диалкилоксалатом и 1-3 эквивалентами сильного основания, такого как LDA, LiHMDS или KOtBu, в полярном апротонном растворителе, таком как ТГФ, при температуре от -78°С до 25°С; или ii) с алкоксидом в соответствующем спиртовом растворителе (например, EtONa в этаноле) при температуре от 0°C до температуры кипения с обратным холодильником.
Конденсация дикетона формулы 6 с гидразином или гидратом гидразина в протонном растворителе, таком как MeOH или EtOH, при температуре от 25°C до температуры кипения с обратным холодильником может дать пиразол формулы 7. Соль гидразина, такая как соль HCl, также может использоваться вместе с соответствующим молярным эквивалентом неорганического (например, K2CO3) или органического (например, Et3N или iPr2NEt) основания.
Защиту пиразола формулы 7 можно осуществить с помощью SEM-Cl, DHP или другой подходящей защитной группы для доставки пиразола формулы 8, разделение которого для доставки соответствующего энантиомера формулы 9 можно осуществить с помощью сверхкритической жидкостной хроматографии с использованием хиральной твердой фазы.
Восстановление сложного эфира формулы 9 до спирта формулы 10 можно проводить с использованием LAH в апротонном растворителе, таком как ТГФ, при температуре от 0°C до температуры кипения с обратным холодильником.
Окисление спирта формулы 10 до альдегида формулы 11 можно осуществить: i) с использованием агента, такого как PCC, PDC или MnO2, в апротонном растворителе; или ii) катализом, например, с использованием TEMPO/отбеливателя и TPAP/NMO (Caron, S., Dugger, R. W., Gut Ruggeri, S., Ragan, J. A., Brown Ripin, D. H., Chem. Rev. 2006, 106, 2943-2989) или условий окисления по Сверну.
Соединение формулы (I) может быть получено, как показано на схеме 2, где R представляет собой H или PG.
Схема 2
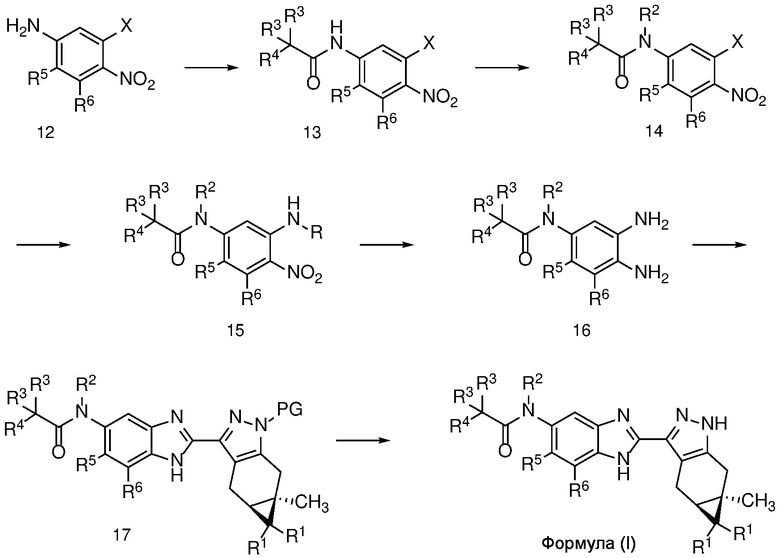
4-нитроанилин формулы 12 можно ацилировать с получением амида формулы 13 карбоновой кислотой с использованием стандартных реагентов амидного сочетания, таких как EDCI, HATU, HBTU или T3P; или реакцией с альтернативным ацилирующим агентом, таким как хлорангидрид или ацилимидазол, в растворителе, таком как ДХМ или ДМФ, в присутствии органического основания, такого как Et3N, при температуре от 0°C до температуры кипения с обратным холодильником.
Алкилирование амида формулы 13 с получением амида формулы 14 можно осуществить с помощью алкилирующего агента, такого как алкилгалогенид или тозилат, в присутствии основания, такого как KOtBu или LiHMDS, в полярном апротонном растворителе, таком как ДМФ или ТГФ.
Нитроанилин формулы 15 может быть получен заменой X в соединении формулы 14 азотсодержащим нуклеофилом, таким как аммиак, бензил или замещенный бензиламин, при температуре от 25 до 100°C либо в чистом виде, либо в растворителе, таком как ДМФ. или ТГФ.
Восстановление нитроанилина формулы 15 (с сопутствующим снятием защиты, если необходимо) можно проводить в условиях гидрирования с Pd-катализатором, таким как 10% Pd/C, при 1-3 атм H2, в спиртовом растворителе, таком как MeOH или EtOH, при температуре от 20 до 60°C с получением орто-диаминов формулы 16. Альтернативно, когда R=H, восстановление нитрогруппы может быть осуществлено с использованием металла, такого как Zn или Fe, в AcOH, при температуре 20-100°С.
Диамин формулы 16 можно конденсировать с альдегидом формулы 11 в полярном растворителе, таком как ДМФ с 2-5 экв. ДМСО, с окислителем, таким как Na2S2O5, при температуре от 90 до 150°C, с получением бензимидазола формулы 17. Альтернативно, конденсация соединений формул 16 и 11 может происходить в присутствии водного NaHSO3 и EtOH или другого спиртового растворителя при температуре 60°C до температуры кипения с обратным холодильником.
Удаление защитной группы в соединении формулы 17 с получением соответствующего соединения формулы (I) может быть осуществлено в условиях, хорошо известных специалисту в данной области. Например, когда PG=SEM, защитная группа может быть удалена с помощью ТФК в ДХМ, необязательно с добавлением Et3SiH.
Способами, непосредственно соответствующими описанным на Схеме 2, соединение формулы (I) также можно получить из 3-нитроанилина формулы 18 в соответствии со Схемой 3.
Схема 3
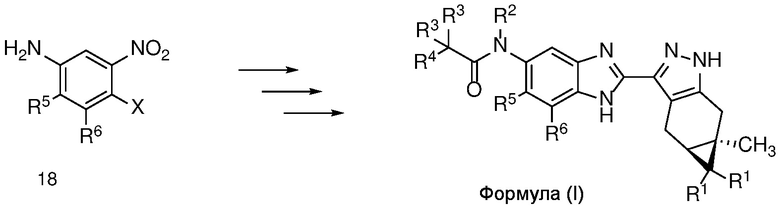
Соединение формулы (I) также можно синтезировать в соответствии со схемой 4, где R представляет собой H или PG.
Схема 4
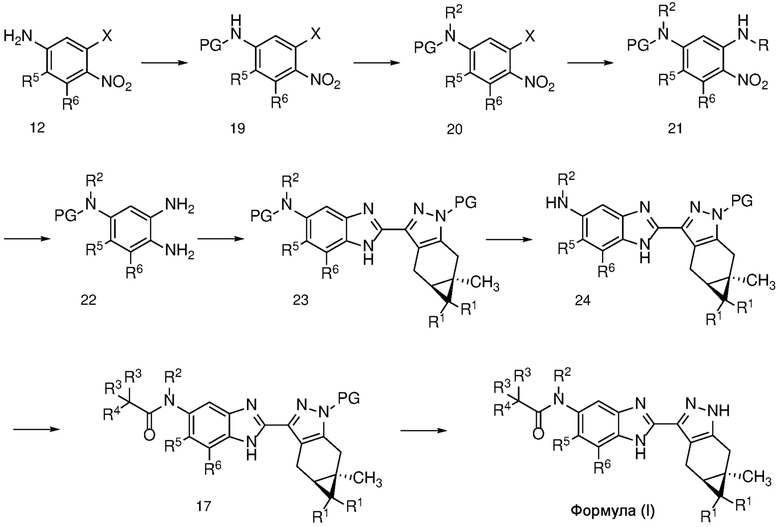
4-нитроанилин формулы 12 может быть N-защищен соответствующей защитной группой, такой как BOC или Ac, с получением соединения формулы 19, которое, в свою очередь, может быть N-алкилировано алкилгалогенидом, как описано на схеме 2 выше, для получения соединения формулы 14, для доставки соединения формулы 20.
Соединение формулы 20 может быть замещено в условиях ароматического нуклеофильного замещения с получением соединения формулы 21; который, в свою очередь, может быть восстановлен, например, в условиях, описанных выше на схеме 2 для получения соединения формулы 16, с получением диамина формулы 22; и, наконец, диамин конденсируют с альдегидом формулы 11 с получением ортогонально защищенного соединения формулы 23.
Селективное снятие защиты с анилиновой защитной группы соединения формулы 23 с получением анилина формулы 24 может быть достигнуто реакцией с ZnBr2 или TMSOTf (PG=BOC) в неполярном растворителе, таком как ДХМ; или основным гидролизом с водн. NaOH или KOH в MeOH или EtOH при кипячении с обратным холодильником (PG=Ac).
Анилин формулы 24 можно ацилировать в условиях, описанных выше на схеме 2, для получения бензимидазола формулы 17, а затем снять защиту с бензимидазола с получением соединения формулы (I) в условиях, хорошо известных специалисту в данной области техники, таких как как описано на Схеме 2 для получения формулы (I).
Соединения формулы (I) также могут быть синтезированы в соответствии со схемой 5.
Схема 5
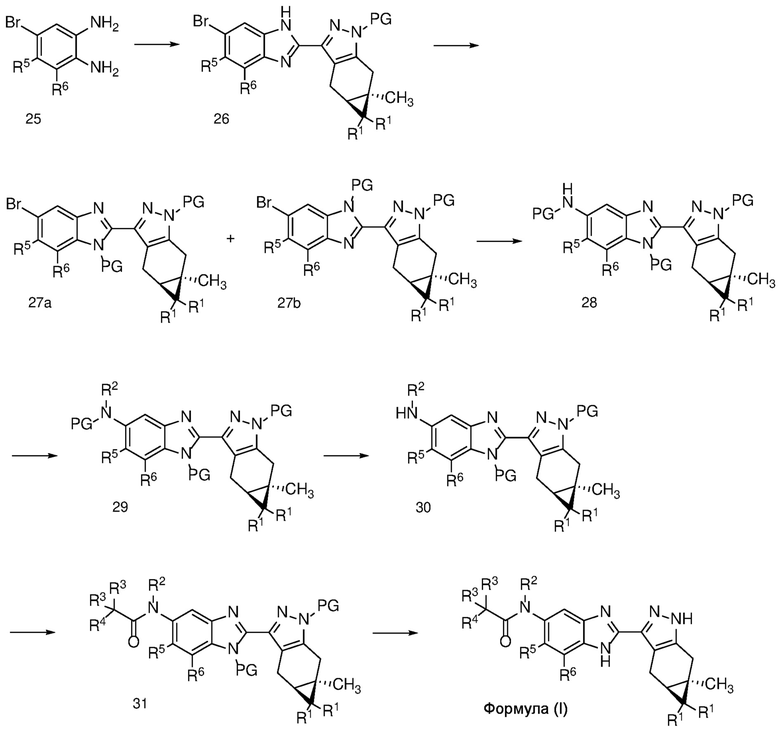
1-бром-3,4-диаминобензол формулы 25 можно конденсировать с альдегидом формулы 11 в условиях, описанных на схеме 2 для получения соединения формулы 17, с получением бензимидазола формулы 26, который в свою очередь, может быть защищен реакцией с SEM-Cl в апротонном растворителе, таком как ТГФ или ДМФА, с основанием, таким как NaH, KOtBu или LiHMDS, при температуре от -78°C до 60°C с получением смеси региоизомеры формул 27a и 27b. Соединение формулы 27b может быть выделено из него обычными способами.
Хотя описание последующих превращений сделано со ссылкой на формулу 27b, специалисту в данной области техники будет понятно, что:
i. смесь региоизомеров формул 27а и 27b может быть использована в окончательном получении соединения формулы (I) (что приводит к получению соответствующих пар региоизомеров формул 29, 30 и 31); и
ii. региоизомеры соединений формулы 29, 30 или 31 также могут быть выделены обычными методами и использованы в окончательном получении соединения формулы (I).
Катализируемое переходным металлом перекрестное сочетание соединения формулы 27b с защищенным производным амина, таким как трет-бутилкарбамат, также известное как сочетание Бухвальда/Хартвига, дает защищенный анилин формулы 28. Реакция перекрестного сочетания может катализироваться металл Pd или Cu и соответствующие лиганды и проводят в растворителе, таком как толуол, трет-амиловый спирт или 1,4-диоксан; с рядом оснований, включая Cs2CO3, LiHMDS, NaOtBu и KOtBu; и при температуре от 20 до 120°С.
Защищенный анилин формулы 28 может быть алкилирован, как описано на схеме 2, для получения соединения формулы 14 с получением соединения формулы 29. Последующие стадии снятия защиты с получением соединения формулы 30, ацилирование с получением соединения формулы 31 и конечное снятие защиты для получения соединения формулы (I) могут быть осуществлены в обычных условиях, таких как условия, описанные на схеме 4 для получения, соответственно, соединений формул 24, 17 и (I).
Соединение формулы (I) также может быть синтезировано в соответствии со схемой 6.
Схема 6
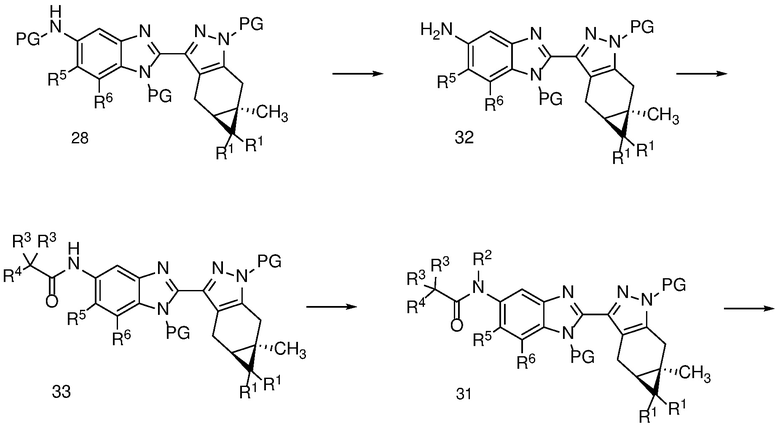

С соединения формулы 28 можно снять защиту в условиях, описанных на схеме 5 для получения соединения формулы 30, с получением анилина формулы 32, который можно ацилировать, в условиях, описанных на схеме 2 для получения бензимидазола формулы 17 с получением амида формулы 33.
Амид формулы 33 может быть N-алкилирован с получением соединения формулы 31, и затем снят с защиты с получением соединения формулы (I) в обычных условиях, таких как описанные на Схеме 2 соответственно для получения соединений формулы 14 и (I).
Соединение формулы (I), где R4 представляет собой морфолиниловый заместитель, также можно синтезировать в соответствии со схемой 7.
Схема 7
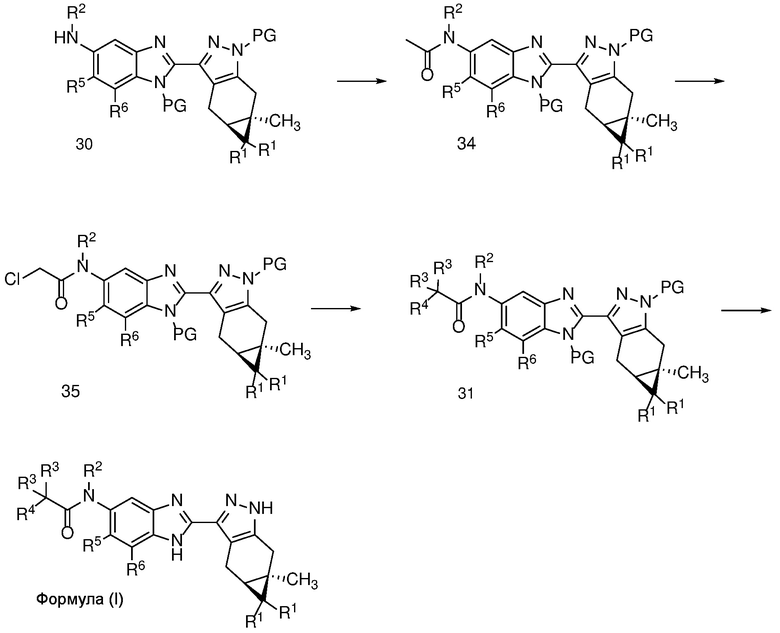
Анилин формулы 30 может быть ацилирован с использованием ацетилхлорида или уксусного ангидрида, в чистом виде или в апротонном растворителе, таком как ДХМ, с органическим основанием, таким как Et3N, при температуре от -20 до 60°C с получением N-ацетильного соединения формулы 34.
Соединение формулы 34 можно обработать сильным основанием, таким как LDA, в апротонном растворителе, таком как ТГФ, с последующим хлорированием реагентом, таким как бензолсульфонилхлорид, с получением α-хлорамида формулы 35.
Амид формулы 35 можно обработать соответствующим морфолином в апротонном растворителе, таком как ДМФ или MeCN, в присутствии основания, такого как K2CO3 или Na2CO3, и с добавлением NaI, чтобы получить соединение формулы 31, с которого затем можно снять защиту с получением соединения формулы (I) в обычных условиях, таких как условия, описанные на Схеме 2 для получения соединения формулы (I).
Соединения формулы (I) могут быть превращены в альтернативное соединение формулы (I) путем взаимных превращений функциональных групп, хорошо известных специалистам в данной области техники. Например, когда R5 или R6 представляет собой галоген, такой как Br или Cl, возможно дополнительное превращение с использованием синтетических методов, таких как реакции сочетания, опосредованные переходными металлами, включая кросс-сочетания Сузуки и Бухвальда/Хартвига, цианирование и борилирование, среди прочих реакций, до манипулировать заменой в этих положениях.
Соединения формул 1, 12, 18 и 25 могут быть получены из коммерческих источников, приготовлены по аналогии с описанными в литературе способами или получены способами, описанными в разделе «Эксперименты» ниже, или их вариантами, хорошо известными специалисту в данной области техники.
Все новые способы получения соединений формулы (I) или их фармацевтически приемлемых солей и соответствующих новых промежуточных соединений, используемых в них, составляют дополнительные аспекты настоящего изобретения.
Соединения по изобретению, предназначенные для фармацевтического применения, могут вводиться в аморфной или кристаллической форме или могут существовать в континууме твердых состояний в диапазоне от полностью аморфного до полностью кристаллического. Их можно получить, например, в виде твердой прессованной массы, порошков или пленок такими способами, как осаждение, кристаллизация, сушка вымораживанием, сушка распылением или сушка выпариванием. Для этой цели можно использовать микроволновую или радиочастотную сушку.
Соединения по изобретению можно вводить любым подходящим путем в форме фармацевтической композиции, адаптированной к такому пути, и в дозе, эффективной для предполагаемого лечения. Как правило, их вводят в виде состава в сочетании с одним или более фармацевтически приемлемыми эксципиентами. Термин «эксципиент» используется в настоящем документе для описания любого ингредиента, отличного от соединения(й) по изобретению. Выбор наполнителя будет в значительной степени зависеть от таких факторов, как способ введения, влияние наполнителя на растворимость и стабильность и природа дозированной формы.
Способы введения соединений по изобретению включают пероральное, парентеральное, местное, ректальное, вагинальное, глазное и пероральное введение.
Пероральное введение может включать проглатывание, так что соединение по изобретению попадает в желудочно-кишечный тракт, или трансбуккальное или подъязычное введение, так что соединение попадает в кровоток непосредственно изо рта.
Парентеральное введение может включать инъекцию соединения по изобретению в кровоток, мышцу или внутренний орган, где инъекция может быть внутривенной, внутриартериальной, внутрибрюшинной, подоболочечной, внутрижелудочковой, внутриуретральной, интрастернальной, внутричерепной, внутримышечной или подкожной. Для парентерального введения могут использоваться игольные (включая микроиглы) инъекторы, безыгольные инъекторы и методы инфузии.
Местное введение является предпочтительным и включает:
- введение в кожу, ноготь, волосы, коготь, копыто, слизистую оболочку;
- деомальное или трансдермальное введение;
- интраназальное введение или введение путем ингаляции;
- ректальное или вагинальное введение; и
- введение непосредственно в глаз или ухо.
Термин «трансдермальное введение» относится к диффузии соединения по изобретению через кожный барьер, ноготь, волосы, когти или копыта в результате местного введения или другого применения композиции. Трансдермальная доставка включает доставку через любую часть кожи, ногтя, волоса, когтя или копыта и абсорбцию или проникновение через оставшуюся часть.
Местное введение соединения по изобретению может привести к ограниченному распределению соединения через кожу и окружающие ткани или, когда соединение удаляется из области лечения кровотоком, может привести к системному воздействию соединения по изобретению. Предпочтительно, местное введение соединения по изобретению приводит к ограничению распределения соединения кожей и окружающими тканями. Когда происходит системное воздействие соединения по изобретению, предпочтительно, соединение быстро метаболизируется, так что системное воздействие соединения по изобретению сводится к минимуму. Сведение к минимуму системного воздействия может уменьшить нежелательные биологические эффекты (т.е. побочные эффекты).
В другом аспекте, изобретение предлагает фармацевтическую композицию, содержащую соединение по изобретению и фармацевтически приемлемый эксципиент.
Фармацевтические композиции, подходящие для доставки соединений по изобретению, и способы их получения будут очевидны специалистам в данной области техники. Такие композиции и способы приготовления можно найти, например, в «Remington’s Pharmaceutical Sciences», 19th Edition (Mack Publishing Company, 1995).
Фармацевтические композиции обычно готовят путем смешивания соединения по изобретению и одного или более эксципиентов. Эксципиенты включают такие материалы, как углеводы, воски, водорастворимые и/или набухающие полимеры, гидрофильные или гидрофобные материалы, желатин, масла, растворители, воду, буферы, стабилизаторы, поверхностно-активные вещества, смачивающие агенты, смазывающие агенты, эмульгаторы, суспендирующие агенты, консерванты, антиоксиданты, опакеры, глиданты, технологические добавки, красители, подсластители, отдушки, ароматизаторы и подобные. Растворители могут включать воду, этанол, пропиленгликоль, полиэтиленгликоли (например, ПЭГ400, ПЭГ300) и их смеси. Эксципиент(ы) выбирают для облегчения изготовления или использования фармацевтической композиции.
Фармацевтические композиции могут быть приготовлены обычным растворением и смешиванием. Например, соединение по изобретению может быть растворено в растворителе в присутствии одного или более эксципиентов, описанных выше. Скорость растворения плохо растворимых в воде соединений может быть повышена за счет использования высушенных распылением дисперсий, таких как описанные Takeuchi, H., et al. в «Enhancement of the dissolution rate of a poorly water-soluble drug (tolbutamide) by a spray-drying solvent deposition method and disintegrants» J. Pharm. Pharmacol., 39, 769-773 (1987); и US2002/009494; включено в настоящий документ посредством ссылки.
Твердые дозированные формы для перорального введения соединений по изобретению включают, например, таблетки, твердые или мягкие капсулы, пастилки, гранулы или порошки, каждая из которых содержит, по меньшей мере, одно соединение по изобретению. В таких твердых дозированных формах соединение по изобретению обычно комбинируют с одним или более фармацевтически приемлемыми эксципиентами. Твердые дозированные формы для перорального введения, такие как таблетки и капсулы, могут быть приготовлены с энтеросолюбильным покрытием.
Жидкие дозированные формы для перорального введения соединений по изобретению включают, например, фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно используемые в данной области техники (например, воду). Такие композиции также могут содержать эксципиенты, такие как смачивающие, эмульгирующие, суспендирующие, ароматизирующие (например, подсластители) и/или отдушки.
Парентеральные составы соединений по изобретению обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферы (предпочтительно буферирующие до рН от 3 до 9). Составы для парентерального введения также могут представлять собой стерильные не водные растворы или высушенные (например, лиофилизированные) формы для введения при восстановлении подходящим носителем, таким как стерильная апирогенная вода.
Фармацевтические композиции для местного или чрескожного введения соединения по изобретению включают мази, пасты, кремы, лосьоны, гели, суппозитории, порошки, растворы, спреи, капли, ингалянты и пластыри. Соединение по изобретению смешивают в стерильных условиях с фармацевтически приемлемым носителем для местного применения и любыми консервантами или буферами, которые могут потребоваться. Соединения, которые являются летучими, могут потребовать смешивания с составляющими агентами или с упаковочными материалами для обеспечения надлежащей доставки дозы. Соединения по изобретению, которые имеют плохую проницаемость через кожу, могут потребовать одного или более усилителей проницаемости, тогда как для соединений, быстро всасывающихся через кожу, может потребоваться состав с агентами, замедляющими абсорбцию, или барьерами.
Термин «фармацевтически приемлемый носитель для местного применения» относится к среде-носителю, подходящей для местного применения, которая обеспечивает надлежащую доставку эффективного количества соединения по изобретению, такой как неактивная жидкость или кремовый носитель, способный суспендировать или растворять соединение. Специалисту в данной области техники будет понятно, что этот термин также охватывает материалы-носители, одобренные для использования в косметике для местного применения.
Термин «усилитель проникновения» относится к увеличению проницаемости кожи, ногтей, волос, когтей или копыт для соединения по настоящему изобретению, чтобы увеличить скорость и степень проникновения соединения. Повышенное проникновение можно наблюдать, например, путем измерения скорости диффузии лекарственного средства через кожу, ноготь, волосы, когти или копыта животного или человека с использованием аппарата с диффузионными ячейками. Диффузионная клетка описана Merritt et al. Diffusion Apparatus for Skin Penetration, J of Controlled Release, 1 (1984) pp. 161-162.
Мази, пасты, кремы, лосьоны, гели, суппозитории, порошки, растворы, спреи, капли, ингалянты и пластыри для местного применения могут содержать, в дополнение к соединению по изобретению, один или более фармацевтически приемлемых эксципиентов, таких как животные или растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк, оксид цинка, консерванты, антиоксиданты, ароматизаторы, эмульгаторы, красители, инертные наполнители, антираздражители, усилители клейкости, отдушки, замутнители, антиоксиданты, желирующие агенты, стабилизаторы, поверхностно-активные вещества, смягчающие средства, красители, консерванты, буферные агенты, усилители проницаемости. Такие эксципиенты не должны мешать эффективности биологической активности активного агента и не должны оказывать вредного воздействия на эпителиальные клетки или их функцию.
Трансдермальное введение может быть осуществлено с помощью трансдермального пластыря. Трансдермальный пластырь может быть типа «резервуар и пористая мембрана» или использовать «матричную систему».
Растворимость соединений по изобретению, используемых при приготовлении фармацевтических композиций, может быть увеличена за счет использования соответствующих технологий составления, таких как включение агентов, повышающих растворимость.
Фармацевтические композиции могут быть составлены для немедленного и/или модифицированного высвобождения. Удобно, чтобы соединения по изобретению были составлены для немедленного высвобождения.
Составы с модифицированным высвобождением включают отсроченное, пролонгированное, импульсное, контролируемое, таргетное и запрограммированное высвобождение. Таким образом, соединения по изобретению могут быть составлены в виде твердой, полутвердой или тиксотропной жидкости для введения в виде имплантированного депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких составов включают микросферы поли(dl-молочно-когликолевой) кислоты (PGLA).
Соединения по изобретению можно комбинировать с растворимыми макромолекулярными соединениями, такими как циклодекстрин и его подходящие производные, или полимерами, содержащими полиэтиленгликоль, для улучшения их растворимости, скорости растворения, маскирования вкуса, биодоступности и/или стабильности для применения в любом из вышеперечисленных способов введения.
Для введения пациентам-людям общая суточная доза соединений по изобретению обычно составляет от 1 мг до 10 г, например, от 60 мг до 6 г, например, от 100 мг до 1,5 г, в зависимости от способа введения и эффективности. Например, для введения может потребоваться общая суточная доза от 200 мг до 1 г, например, от 250 мг до 750 мг. Общая суточная доза может быть введена однократно или разделенными дозами и может, по усмотрению врача, выходить за пределы типового диапазона, указанного в настоящем документе. Эти дозировки основаны на среднем человеческом субъекте, имеющем вес примерно от 60 до 70 кг. Врач без труда сможет определить дозы для субъектов, чей вес выходит за пределы этого диапазона, таких как младенцы и пожилые люди.
Как отмечалось выше, соединения по изобретению полезны, поскольку они проявляют фармакологическую активность у животных, т.е. ингибируют ITK. Более конкретно, соединения по изобретению применимы для лечения заболеваний, для которых показан ингибитор ITK.
Предпочтительно животное представляет собой млекопитающее, более предпочтительно человека.
Предпочтительно соединение по изобретению также ингибирует TRKA.
В еще одном аспекте изобретения предложено соединение по изобретению для применения в качестве лекарственного средства.
В другом аспекте изобретения предложено соединение по изобретению для применения при лечении нарушения, для которого показан ингибитор ITK.
В еще одном аспекте изобретения предложено применение соединения по изобретению для приготовления лекарственного средства для лечения нарушения, для которого показан ингибитор ITK.
В еще одном аспекте изобретения предложен способ лечения заболевания у животного (предпочтительно, млекопитающего, более предпочтительно, человека), для которого показан ингибитор ITK, включающий введение указанному животному терапевтически эффективного количества соединения по изобретению.
Заболевания или состояния, при которых показан ингибитор ITK, включают воспалительные, аутоиммунные, дерматологические, глазные, респираторные, суставные, сердечно-сосудистые и нейровоспалительные заболевания. Специалисту в данной области техники будет понятно, что данное заболевание, нарушение или состояние может подпадать более чем под одну из вышеперечисленных категорий.
В частности, нарушения или состояния, при которых показан ингибитор ITK, включают:
- воспалительные нарушения, такие как аллергический конъюнктивит, глютеновая болезнь, проктит, эозинофильный гастроэнтерит, мастоцитоз, воспалительное заболевание кишечника (например, болезнь Крона, язвенный колит, микроскопический колит (например, коллагеновый колит или лимфоцитарный колит), диверсионный колит, болезнь Бехчета и неопределенный колит), нефрит, ретинит, ретинопатия, миозит, васкулит, синдром Шегрена, гранулематоз Вегенера, артериит, склерозирующий холангит и эозинофильный эзофагит;
- аутоиммунные нарушения, такие как волчаночный нефрит, аутоиммунный гепатит, тяжелая миастения, синдром Гийена-Барре и болезнь Грейвса;
- заболевания или состояния глаз, включая аутоиммунные заболевания глаз, кератоконъюнктивит, весенний конъюнктивит, неинфекционный увеит (например, увеит, связанный с болезнью Бехчета, и факоантигенный увеит), кератит (например, герпетический кератит и конический кератит), дистрофию эпителия роговицы, кератолейкому, премфигус глаза, язву Мурена, склерит, ретинит, ретинопатию, офтальмопатию Грейвса, синдром Фогта-Коянаги-Харада, сухой кератоконъюнктивит (сухой глаз), фликтену, иридоциклит, саркоидоз, эндокринную офтальмопатию, симпатический офтальмит, аллергический конъюнктивит и глазную неоваскуляризацию;
- дерматологические состояния, такие как экзема (например, хроническая и дисгидротическая экзема), хронический зуд, дерматит (например, атопический, раздражающий контактный, аллергический контактный, профессиональный, периоральный, застойный, нумулярный, себорейный, ксеротический, века, пеленочный и дерматит рук), витилиго, очаговая алопеция, зуд (например, хронический идиопатический зуд), псориаз (например, бляшечный, каплевидный, обратный, пустулезный, ногтевой, изгибно-ладонно-подошвенный, лицевой или эритродермический псориаз), склеродермия, пузырчатка, дерматомиозит, нейродермит, гиперемия кожи, крапивница, кожная красная волчанка (например, острая кожная волчанка (острая кожная волчанка), подострая кожная волчанка (подострая волчанка) и хроническая кожная волчанка (дискоидная волчанка)), келоид, солнечный ожог, гипертрофический рубец, идиопатическая тромбоцитопеническая тромботическая пурпура (также известная как иммунная тромбоцитопения пурпура (ITP)), ихтиоз (например, вульгарный ихтиоз), гиперплазия эпидермиса, акне, красный плоский лишай, склерозирующий лишай, розацеа, буллезный эпидермолиз, интертриго, фолликулярный кератоз, крапивница (например, хроническая спонтанная крапивница, хроническая идиопатическая крапивница, хроническая физическая крапивница), контагиозный моллюск, синдром Нетертона, синдром Фогта-Коянаги-Харада, синдром Свита, белый лишай, вульвовагинит, невус/невусы Саттона, поствоспалительная гипопигментация, старческая лейкодерма, химическая/лекарственная лейкодерма, ладонно-подошвенный пустулез, пемфигоид и гнойный гидраденит;
- респираторные состояния, такие как ринит (например, аллергический и круглогодичный ринит), ринорея, заложенность носа, воспаление носа, астма (например, хроническая астма, застарелая астма, поздняя астма, бронхиальная астма, аллергическая астма, внутренняя астма, экзогенная астма и пылевая астма) хроническая обструктивная болезнь легких (COPD), хроническая и острая бронхоконстрикция, хронический бронхит, эмфизема легких, хроническая эозинофильная пневмония, острое повреждение легких (ACI), респираторный дистресс-синдром взрослых (ARDS), заболевание легочных сосудов (PVD), легочная артериальная гипертензия (PAH), бронхоэктазы, синусит, легочный саркоидоз и силикоз;
- заболевания суставов, такие как артрит (например, остеоартрит, а также псориатический, ревматоидный, ювенильный и подагрический артрит), спондилоартропатия (например, реактивный артрит (также известный как синдром Рейтера) и аксиальный спондилоартрит (включая анкилозирующий спондилоартрит)), воспаление хряща, деградация кости и болезнь Стилла;
- сердечно-сосудистые и метаболические нарушения, такие как диабет (тип 1 и тип 2), диабетическая невропатия, кахексия и целиация-спру; и
- нейровоспалительные нарушения, такие как волчанка (например, ЦНС, системная и дискоидная волчанка), диабетическая невропатия и рассеянный склероз.
Аллергический контактный дерматит (ACD) представляет собой контактный дерматит, характеризующийся аллергической реакцией на контакт с веществом. Примером ACD является вызванный урушиолом контактный дерматит (также называемый токсикодендроновым дерматитом или луговым дерматитом), который вызывается маслом урушиола, содержащимся в различных растениях, включая ядовитый плющ, ядовитый дуб, ядовитый сумах и китайское лаковое дерево. Другие аллергены, которые могут вызывать ACD, включают хром, золото и никель.
Раздражающий контактный дерматит (ICD) представляет собой форму контактного дерматита, которую можно разделить на формы, вызванные химическими раздражителями, и формы, вызванные физическими раздражителями. Обычные химические раздражители включают кислоты, щелочи, латекс, масла, отдушки и консерванты в косметике, растворители и поверхностно-активные вещества.
Профессиональный дерматит представляет собой ACD или ICD, возникающий в результате воздействия аллергена или раздражителя на рабочем месте.
Кроме того, ингибитор ITK может применяться при лечении определенных вирусных и бактериальных инфекций, отторжения трансплантата, септического шока, острой или хронической реакции «трансплантат против хозяина», ревматической полимиалгии, саркоидоза, болезни Аддисона и синдрома Рейно.
В одном варианте осуществления, нарушение или состояние, при котором показан ингибитор ITK, представляет собой дерматологическое заболевание. В другом варианте осуществления, дерматологическим состоянием, при котором показан ингибитор ITK, является дерматит. В другом варианте осуществления, дерматит, для лечения которого показан ингибитор ITK, представляет собой атопический дерматит.
Соединение по изобретению можно с пользой комбинировать с одним или более другими фармакологически активными соединениями. Такие комбинации дают возможность значительных преимуществ, включая соблюдение пациентом схемы лечения, простоту дозирования и синергетическую активность.
В еще одном аспекте изобретения предложено соединение по изобретению в комбинации с другим фармакологически активным соединением или с двумя или более другими фармакологически активными соединениями.
В таких комбинациях, соединение по изобретению и другое фармакологически активное(ые) соединение(я) можно вводить одновременно, например, в виде разовой дозированной формы (например, композиции для местного применения, такой как крем или мазь), последовательно или раздельно.
Один или более дополнительных терапевтических агентов могут быть выбраны из любых следующих агентов или типов агента:
- агент для лечения аутоиммунных и/или воспалительных нарушений, такой как сульфасалазин, месалазин, азатиоприн, антитело (например, инфликсимаб, адалимумаб, белимумаб, танезумаб, ранибизумаб, бевацизумаб, меполизумаб, цертолизумаб, натализумаб и ведолизумаб), 6-меркаптопурин, гидроксихлорохин, мофетил, микофенолат натрия, лефлуномид, ритуксан, солумедрол, депомедрол, нестероидный противовоспалительный препарат (NSAID) (например, аспирин, ибупрофен, целекоксиб, вальдекоксиб, WBI-1001 и MRX-6) и кортикостероид (например, бетаметазон, дексаметазон и преднизон);
- агент для лечения дерматологических состояний, такой как иммунодепрессант (например, циклоспорин, такролимус и пимекролимус), антитело (например, инфликсимаб, адалимумаб, дупилумаб, омализумаб и эфализумаб), ингибитор TNF (например, этанерцепт), ингибитор PDE4 (например, кризаборол) и местный кортикостероид (например, флуоцинонид, мапракорат, гидрокортизон, дезонид, алклометазон, триамцинолон и дезоксиметазон);
- агент для лечения респираторных состояний, такое как оксиметазолин, рифампин, антигистамин (например, фексофенадин, лоратидин, дезлоратидин, левоцетиризин, метапирилен, цетиризин), антагонист лейкотриеновых рецепторов (например, монтелукаст и зафирлукаст), антагонист белка, активирующего 5-липоксигеназу (FLAP), антагонист мускариновых рецепторов (например, тиотропий и ипратропий), кромогликат натрия, недокромил натрия, кортикостероид (например, будесонид, флутиказон, мометазон, дексаметазон, преднизолон, циклесонид и беклометазон), агонист бета-2 (например, салметерол, альбутерол, сальбутамол, фенотерол и формотерол) и антитело (например, омализумаб);
- агент для лечения нарушений суставов, такой как метотрексат, азатиоприн и NSAID (например, аспирин, ибупрофен, целекоксиб, вальдекоксиб, WBI-1001 и MRX-6);
- агент для лечения сердечно-сосудистых и метаболических нарушений, такой как урсодезоксихолевая кислота, хлорохин, хинакрин, метилнорэфрин, фенилэфрин, метоксамин, оксиметазолин, теофиллин, ингибитор PDE5 (например, силденафил, варденафил и тадалафил), ингибитор PDE4 (например, крисаборол, ибудиласт, циломиласт, рофлумиласт и ампремиласт) и антагонист кининовых B1 или B2 рецепторов; и
- агент для лечения нейровоспалительного нарушения, такой как циклофосфамид.
Один или более дополнительных терапевтических агентов также могут быть выбраны из любых следующих агентов:
- ингибиторы JAK, такие как аброцитиниб, барицитиниб, брепоцитиниб, цердулатиниб, децернотиниб, дельгоцитиниб, федратиниб, филготиниб, гандотиниб, илгинатиниб, итацитиниб, лестауртиниб, момелотиниб, оклацитиниб, пакритиниб, пефицитиниб, ритлецитиниб, руксолитиниб, тофацитиниб, упадацитиниб, ATI-502, BMS-986165, JTE052, PF-06826647, SNA-152 и SHR-0302;
- агонист арильных углеводородных рецепторов, такой как тапинароф;
- ингибитор IRAK4, такой как PF-06650833;
- аналог витамина D, такой как кальципотриен;
- производное ретиноевой кислоты, такое как алитретиноин;
- селективный агонист Х-рецептора печени (LXR), такой как VTP-38543;
- антагонист Н4-рецептора, такой как ZPL-389;
- антагонист рецептора NKI, такой как апрепитант и традипитант;
- антагонист рецептора CRTH2, такой как февипипрант и ОС-459;
- ингибитор химазы, такой как SUN 13834;
- ингибитор GATA-3, такой как SB-011 и GR-MD-02;
- обратный агонист ROR, такой как VTP-43742, ARN6039, TAK-828 и JTE-451;
- иммуномодулятор, такой как PF-06763809; и
- ингибитор SYK и BTK, включая, но не ограничиваясь ими, R-348, фостаматиниб, мастиниб, мивавотиниб, спербрутиниб, фенебрутиниб, цердулатиниб, ибрутиниб, энтосплетиниб и тирабрутиниб.
В объем изобретения входит то, что две или более фармацевтических композиций, по меньшей мере, одна из которых содержит соединение по изобретению, могут быть удобно объединены в виде набора, подходящего для совместного введения композиций. Таким образом, набор по изобретению включает две или более отдельных фармацевтических композиций, по меньшей мере, одна из которых содержит соединение по изобретению, и средства для раздельного хранения указанных композиций, такие как контейнер, разделенная бутылка или разделенный пакет из фольги. Примером такого набора является известная блистерная упаковка, используемая для упаковки таблеток, капсул и т.п. Набор по изобретению особенно подходит для введения различных лекарственных форм (например, для местного, перорального, парентерального и т.д.), для введения отдельных композиций с различными интервалами дозирования или для титрования отдельных композиций относительно друг друга. Для облегчения соблюдения режима набор обычно содержит инструкции по применению и может быть снабжен так называемым запоминающим устройством.
В другом аспекте изобретение относится к фармацевтическому продукту (например, в форме набора), включающему соединение по изобретению вместе с одним или более дополнительными терапевтически активными агентами в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении нарушения, для которого показан ингибитор ITK.
Следует понимать, что все ссылки на лечение в настоящем документе включают лечебное, паллиативное и профилактическое лечение.
В неограничивающих примерах и препаратах, изложенных ниже, которые иллюстрируют изобретение, и в вышеупомянутых схемах могут быть ссылки на следующие сокращения, определения и аналитические процедуры:
°2θ означает градусы 2-тета;
AcOH означает уксусную кислоту;
Ac2O означает уксусный ангидрид;
APC означает аллофикоцианин;
водн. означает водный;
атм. означает атмосферу;
АТФ означает тригидрат динатриевой соли аденозин-5'-трифосфата;
BINAP означает (2,2'-бис(дифенилфосфино)-1,1'-бинафтил);
Boc означает трет-бутоксикарбонил;
BOC2O означает BOC ангидрид, ди-трет-бутилдикарбонат;
ш означает широкий;
BTFFH означает гексафторфосфат фторбис(тетраметилен)формамидиния;
BTK означает тирозинкиназу Брутона;
°C означает градусы Цельсия;
CD3OD означает дейтерометанол;
CDCl3 означает дейтерохлороформ;
конц. означает концентрированный;
CSA означает камфорсульфоновую кислоту;
δ означает химический сдвиг;
д означает дублет;
дд означает дублет дублетов;
ддд означает дублет дублетов дублетов;
дт означает дублет триплетов;
DAST означает трифторид диэтиламиносеры;
ДХМ означает дихлорметан;
ДХЭ означает 1,2-дихлорэтан;
Периодинан Десса-Мартина означает 3-оксо-1,3-дигидро-1λ5,2-бензиодоксол-1,1,1-триилтриацетат;
DHP означает дигидропиран;
ДМАП означает 4-диметиламинопиридин;
ДМФ означает N,N-диметилформамид;
ДМСО означает диметилсульфоксид;
EDCI означает гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида;
эи означает энантиомерный избыток;
ЭДТК означает этилендиаминтетрауксусную кислоту;
ИЭР-МС означает масс-спектрометрию с ионизацией электрораспылением;
EtOAc означает этилацетат;
EtOH означает этанол;
EtONa означает этоксид натрия;
Et3N означает триэтиламин;
Et3SiH означает триэтилсилан;
г означает грамм;
ч означает час(ы);
ГАТУ означает гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксид;
ГБТУ означает гексафторфосфат N,N,N',N'-тетраметил-O-(1H-бензотриазол-1-ил)урония;
HEPES означает (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту);
ВЭЖХ означает жидкостную хроматографию высокого давления;
iPr2NEt означает N,N-диизопропилэтиламин, также известный как основание Хюнига;
KOAc означает ацетат калия;
KOtBu означает трет-бутоксид калия;
л означает литр;
АЛГ означает алюмогидрид лития;
ЖХМС означает жидкостную хроматографию - масс-спектрометрию;
ДАЛ означает диизопропиламид лития;
LiHMDS означает гексаметилдисилазид лития, также известный как бис(триметилсилил)амид лития;
м означает мультиплет;
М означает молярный;
MeCN означает ацетонитрил;
MeNH2 означает метиламин;
МеОН означает метанол;
МГц означает это мегаГерц;
мин означает минуты;
мл означает миллилитр;
мм означает миллиметр;
ммоль означает миллимоль;
моль означает моль;
МС m/z означает пик масс-спектра;
МТБЭ означает метил-трет-бутиловый эфир;
n-BuLi означает н-бутиллитий;
NaHMDS означает бис(триметилсилил)амид натрия;
NaOtBu означает трет-бутоксид натрия;
NMP означает N-метил-2-пирролидон;
ЯМР означает ядерный магнитный резонанс;
ORTEP означает Oak Ridge Thermal Ellipsoid Plot;
PCC означает хлорхромат пиридиния;
PDC означает дихромат пиридиния;
Pd2(dba)3 означает трис(дибензилиденацетон)дипалладий(0);
Pd/C означает палладий на угле;
Pd(dppf)Cl2 означает 1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II);
Pd(OAc)2 означает ацетат палладия(II);
Pd(OH)2/C означает гидроксид палладия(II) на угле;
Pd(Ph3P)4 означает тетракис(трифенилфосфин)палладий(0);
ПЭ означает петролейный эфир;
PhCH3 означает толуол;
PMB означает пара-метоксибензил;
pTSA означает моногидрат п-толуолсульфоновой кислоты;
PXRD означает порошковую дифракцию рентгеновских лучей;
ка означает квартет;
Qphos означает 1,2,3,4,5-пентафенил-1'-(ди-трет-бутилфосфино)ферроцен;
КТ означает комнатную температуру;
с означает синглет;
насыш. означает насыщенный;
SEM-Cl означает 2-(триметилсилил)этоксиметилхлорид;
СЖХ означает сверхкритическую жидкостную хроматографию;
SPhos означает 2-дициклогексилфосфино-2',6'-диметоксибифенил;
SXRD означает монокристаллическую рентгеновскую дифракцию;
т означает триплет;
трет-BuDavePhos означает 2-ди-трет-бутилфосфино-2'-(N,N-диметиламино)бифенил;
t-BuOH означает трет-бутанол;
TCEP означает трис(2-карбоксиэтил)фосфин;
ТФК означает трифторуксусную кислоту;
АТФК означает ангидрид трифторуксусной кислоты;
ТГА означает термогравиметрический анализ;
ТГФ означает тетрагидрофуран;
TMSCF3 означает трифторметилтриметилсилан;
TMSOTf означает триметилсилилтрифторметансульфонат;
T3P означает ангидрид пропилфосфоновой кислоты;
Tris означает трис(гидроксиметил)аминометан;
мкм означает микрометр;
об./об. означает объем на объем;
масс./об. означает массу на объем;
XantPhos означает 4,5-бис(дифенилфосфино)-9,9-диметилксантен; и
ZnEt2 означает диэтилцинк.
Если не указано иное, все реакции проводят в атмосфере азота. Когда гидрид натрия используется в следующих процедурах, вес корректируется, чтобы отразить его использование в виде 60% суспензии в минеральном масле. Обычно считается, что КТ (комнатная температура) означает приблизительно 22°C (±5°C). Термин «концентрированный» относится к процессу удаления летучих соединений, таких как растворители, с использованием роторного испарителя при пониженном давлении.
Спектры 1H и 19F ЯМР во всех случаях соответствуют предполагаемым структурам. Характеристики δ для 1H ЯМР приведены относительно остаточных сигналов растворителя (для CDCl3, δH=7,27 ч./млн., для ДМСО-d6, δH=2,50 ч./млн., для CD3OD, δH=3,30 ч./млн., для ДМФ-d7, δH=8,03 ч./млн.) с использованием общепринятых сокращений для обозначения основных пиков. Специалисту в данной области техники будет понятно, что таутомеры могут быть зарегистрированы в данных ЯМР, и некоторые обмениваемые протоны могут быть не видны. Аналогичным образом специалисту в данной области техники будет понятно, что смесь ротамеров может быть зарегистрирована в данных ЯМР.
Масс-спектры регистрируют с помощью ИЭР-МС. В соответствующих случаях и если не указано иное, представленные данные m/z относятся к изотопам 19F, 35Cl, 79Br и/или 81Br и 127I.
В случае использования препаративной ТСХ или хроматографии на силикагеле, специалисту в данной области техники будет понятно, что для очистки желаемого соединения можно использовать любой подходящий растворитель или комбинацию растворителей.
Номенклатуру соединений в следующих далее примерах получения и примерах создают с использованием ChemDraw Professional 18.0, Perkin Elmer, в соответствии с IUPAC (Международным союзом теоретической и прикладной химии).
Примеры получения
Пример получения 1: 1-метокси-5-метилциклогекса-1,4-диен
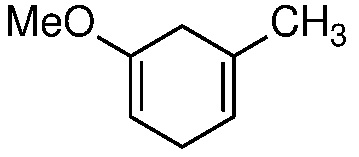
Реакцию проводят в 25 параллельных партиях. В раствор 1-метокси-3-метилбензола (500 г, 4,09 моль) в t-BuOH (1,5 л) и ТГФ (1 л) барботируют безводный аммиак (1,4 кг, 82,2 ммоль), при этом реакцию поддерживают между -60 и -50°С. Затем к реакционной смеси порциями добавляют литиевый песок (62,5 г, 9,0 моль), поддерживая температуру от -60 до -50°C, и реакционную смесь перемешивают в течение 2 часов. Реакционную смесь медленно нагревают до ~20°С и дают аммиаку испариться. К реакционной смеси добавляют NH4Cl (500 г) и воду (500 мл). Партии объединяют и отделяют органический слой. Водный слой промывают EtOAc (5 л ×2). Затем объединенные органические слои промывают солевым раствором (5 л), органический слой сушат (Na2SO4) и концентрируют, получая указанное в заголовке соединение (10,1 кг, 80%). 1H ЯМР (400 МГц, CDCl3) δ 5,42-5,41 (м, 1H), 4,65-4,63 (м, 1H), 3,56 (с, 3H), 2,79-2,77 (м, 2H), 2,65-2,56 (м, 2Н), 1,74-1,68 (м, 3Н).
Пример получения 2: 7-метил-1,4-диоксаспиро[4.5]дец-7-ен
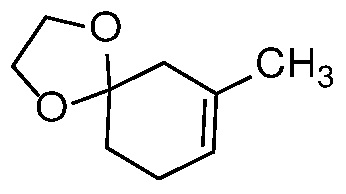
Реакцию проводят в 6 параллельных партиях. К раствору из Примера получения 1 (500 г, 4,03 моль) в ДХМ (4,0 л) добавляют моногидрат п-толуолсульфоновой кислоты (46,8 г, 201 ммоль) и этиленгликоль (399 г, 6,04 моль) при температуре от -10 до 0°С. Смесь перемешивают приблизительно при 0°С в течение 0,5 часа. Реакционные партии объединяют и промывают насыщ. водным NaHCO3 (5 л), водой (5 л, 2х), сушат (Na2SO4), фильтруют и концентрируют, получая указанное в заголовке соединение (14,2 кг). 1H ЯМР (400 МГц, CDCl3) δ 5,40-5,34 (м, 1H), 3,98-3,88 (м, 4H), 2,21-2,12 (м, 4H), 1,67 (д, 5H).
Пример получения 3: 1-метилспиро[бицикло[4.1.0]гептан-3,2'-[1,3]диоксолан]
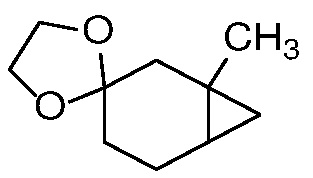
Реакцию проводят 10 параллельными партиями. Раствор ZnEt2 (1,00 М, 5,14 л) в ДХМ (2,0 л) охлаждают до 0°С, туда по каплям добавляют ТФК (380 мл, 5,14 моль) при 0°С. Смесь перемешивают при 0°C в течение 30 мин, после чего по каплям добавляют CH2I2 (414 мл, 5,14 моль) при 0°C. Смесь перемешивают при 0°С в течение 30 мин. Добавляют по каплям Пример получения 2 (396 г, 2,57 моль), поддерживая температуру на уровне 0°С, и полученную смесь перемешивают при 0°С в течение 30 мин. Реакционную смесь выливают в воду (1 л) и партии объединяют. Объединенную смесь экстрагируют ДХМ (3х8 л). Объединенные органические фазы сушат (Na2SO4), фильтруют и концентрируют, получая указанное в заголовке соединение (3,0 кг); 1H ЯМР (400 МГц, CDCl3) δ 3,93-3,73 (м, 4H), 2,13-2,01 (м, 1H), 1,84-1,79 (м, 1H), 1,75-1,67 (м, 2H), 1,47-1,36 (м, 1H), 1,27 (м, 1H)), 1,03 (с, 3Н), 0,73-0,61 (м, 1Н), 0,35-0,25 (м, 2Н).
Пример получения 4: 1-метилбицикло[4.1.0]гептан-3-он
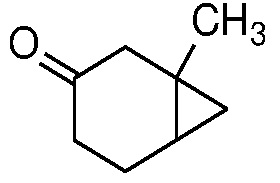
Реакцию проводят в 14 параллельных партиях. Раствор из Примера получения 3 (300 г, 1,78 моль) в ТГФ (1,5 л) и воде (300 мл) обрабатывают pTSA-H2O (34,0 г, 178 ммоль). Смесь перемешивают при 60°С в течение 3 ч и затем охлаждают до КТ. 14 партий объединяют и обрабатывают насыщ. водным NaHCO3 до тех пор, пока pH не станет равным 6-7. Смесь экстрагируют МТБЭ (3× 8 л), сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/PE=0-100%), получая указанное в заголовке соединение (1,2 кг, 39%). 1H ЯМР (400 МГц, CDCl3) δ 2,60-2,40 (м, 1H), 2,32-2,18 (м, 1H), 2,11-1,93 (м, 1H), 1,34-1,17 (м, 1H), 1,17-1,05 (м, 4Н), 0,95-0,86 (м, 1Н), 0,85-0,74 (м, 2Н), 0,43-0,33 (м, 1Н).
Пример получения 5: этил-2-(6-метил-4-оксобицикло[4.1.0]гептан-3-ил)-2-оксоацетат
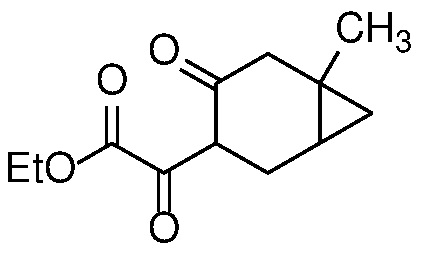
Реакцию проводят четырьмя параллельными партиями. Раствор из Примера получения 4 (200 г, 1,61 моль) в EtOH (1,0 л) обрабатывают EtONa (126 г, 1,77 моль) при 0°С. Добавляют диэтилоксалат (259 г, 1,77 моль, 242 мл) при 0°C, смесь медленно нагревают до 20°C и перемешивают в течение 1 часа. Четыре партии объединяют, и смесь выливают в 1N HCl (5 л) и экстрагируют ДХМ (3× 3 л). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/PE=0-10%), получая указанное в заголовке соединение (1,4 кг, 97%). ЖХ/МС m/z (M+H)+=225,0
Пример получения 6: этил-5а-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбоксилат
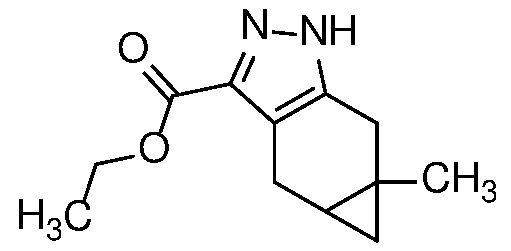
Реакцию проводят четырьмя параллельными партиями. К раствору из Примера получения 5 (350 г, 1,56 моль) в EtOH (1,5 л) добавляют гидрат гидразина (79,7 г, 1,56 моль) при 0°С. Полученную смесь перемешивают при 20°С в течение 2 часов. Четыре реакционные партии объединяют, добавляют Н2О (10 л) и экстрагируют ДХМ (3× 8 л). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/PE=5-33%), получая указанное в заголовке соединение (800 г, 58%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,70-12,78 (м, 1H), 4,25-4,20 (м, 2H), 3,14-3,07 (м, 1H), 2,89-2,82 (м, 2H), 2,68-2,62 (м, 1H), 1,27 (ушс, 3H), 1,20 (ушс, 3H), 1,04-1,00 (м, 1H), 0,31-0,29 (м, 1H), 0,08-0,02 (м, 1H); ЖХ/МС m/z (М+Н)+=221,0.
Пример получения 6а: этил-(4aR,5aS)-5а-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбоксилат; и
Пример получения 6b: этил-(4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-карбоксилат
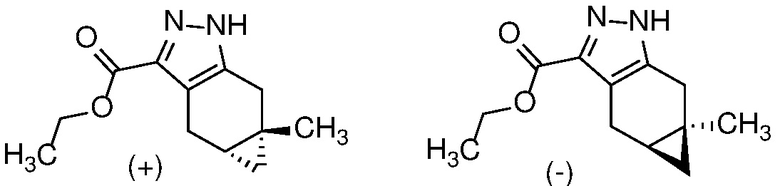
Пример получения 6 разделяют с помощью хиральной СЖХ (колонка Chiral Tech OZ-H 250 мм × 4,6 мм × 5 мкм с подвижной фазой CO2(g)/MeOH=80:20 с 0,2% NH4+(7N NH3 в MeOH) и скорость потока 3,0 мл/мин).
6а: время удержания=3,89 мин, 100% эи, [α]20D=+67,1 (с=4,2, МеОН); ЖХ/МС m/z (М+Н)+=221,1.
6b: время удержания=4,76 мин, 98,9% эи; [α]20D=-80,2 (с=4,7, МеОН); 1H ЯМР (400 МГц, ДМСО-d6) δ 13,44-12,80 (м, 1H), 4,20-4,12 (м, 2H), 3,25-3,10 (м, 1H), 3,09-2,99 (м, 1H), 2,96 -2,86 (м, 1H), 2,82-2,71 (м, 1H), 2,63-2,52 (м, 1H), 1,25-1,18 (м, 3H), 1,14 (с, 3H), 1,02-0,92 (м, 1H), 0,34-0,20 (ушс, 1H), 0,05-0,05 (ушс, 1H).
Пример получения 7а: этил-(4aS,5aR)-5а-метил-2-((2-(триметилсилил)этокси)метил)-2,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбоксилат; и
Пример получения 7b: этил-(4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-карбоксилат
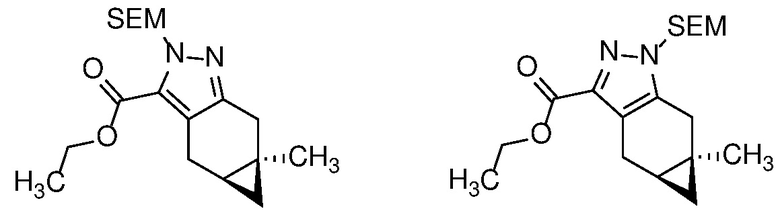
Суспензию NaH (19,3 г, 483 ммоль) в ТГФ (500 мл) обрабатывают раствором из Примера получения 6b (103 г, 467,6 ммоль) в ТГФ (1,25 л) при 0°С. Через 30 минут добавляют SEM-Cl (81,9 г, 491 ммоль) при 0°С и смесь перемешивают при 0°С в течение 3 часов. Смесь обрабатывают насыщ. водным NH4Cl (500 мл) при 0°С. Смесь экстрагируют EtOAc (3× 500 мл), промывают раствором соли (500 мл), сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/гептаны=7-18%), получая указанные в заголовке соединения.
7а: (5,5 г, 3,3%); 1H ЯМР (400 МГц, ДМСО-d6) δ 5,43 (ушс, 2H), 4,54-4,28 (м, 2H), 3,55-3,50 (м, 2H), 3,27-3,23 (м, 1H), 3,12-3,08 (м, 1H), 2,99-2,97 (м, 1H), 2,71-2,67 (м, 1H), 1,60-1,41 (м, 3H), 1,21 (с, 3H), 1,08-1,05 (м, 1H), 0,89-0,85 (м, 2Н), 0,41-0,39 (м, 1Н), 0,21-0,19 (м, 1Н), -0,03 (с, 9Н).
7b: (138 г, 84%); 1H ЯМР (400 МГц, ДМСО-d6) δ 5,64 (с, 2H), 4,32-4,25 (м, 2H), 3,49-3,44 (м, 2H), 3,20-3,16 (м, 1H), 2,95-2,88 (м, 2H), 2,67-2,62 (м, 1H), 1,32-1,28 (м, 3H), 1,21 (с, 3H), 1,05-0,95 (м, 1H), 0,76-0,72 (м, 2H), 0,33-0,29 (м, 1Н), 0,04-0,01 (м, 1Н), -0,1 (с, 9Н); ЖХ/МС m/z (М+Н)+=351,3.
Пример получения 8: ((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)метанол
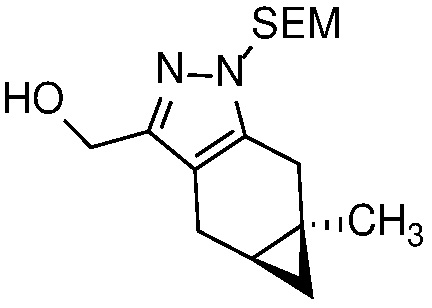
Суспензию LiAlH4 (14,94 г, 393,7 ммоль) в ТГФ (500 мл) при 0°С обрабатывают по каплям раствором из Примера получения 7b (138 г, 393,7 ммоль) в ТГФ (1 л). Смесь перемешивают при 15°С в течение 2 часов. Смесь охлаждают до 0°С и последовательно обрабатывают добавлением по каплям H2O (15 мл), 15% водн. NaOH (15 мл) и H2O (30 мл) с последующим добавлением MgSO4 и EtOAc (500 мл). Полученную смесь фильтруют и фильтрат концентрируют с получением указанного в заголовке соединения (110 г, 91%). 1H ЯМР (400 МГц, CDCl3) δ 5,35-5,23 (м, 2H), 4,64-4,55 (м, 2H), 3,53-3,49 (м, 2H), 3,06-3,02 (м, 1H), 2,86-2,81 (м, 2H), 2,67-2,63 (м, 1H), 2,07-1,90 (м, 1H), 1,24 (с, 3H), 1,05-1,03 (м, 1H), 0,91-0,87 (м, 2H), 0,39-0,35 (м, 1Н), 0,25-0,22 (м, 1Н), -0,03 (д, 9Н).
Пример получения 9: (4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-карбальдегид
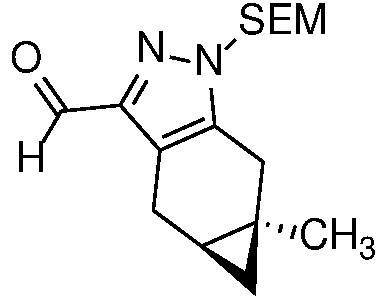
Раствор из Примера получения 8 (110,13 г, 0,36 моль) в ДХМ (1,5 л) обрабатывают активированным MnO2 (310 г, 3,57 моль) и полученную смесь перемешивают при 25°С в течение 16 часов. Смесь фильтруют. Фильтрат концентрируют и неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/PE=3-10%), получая указанное в заголовке соединение (96 г, 88%). Метод СЖХ: Chiral Pak AD-3 150 мм × 4,6 мм × 3 мкм, 5-40% (0,05% диэтиламина в EtOH/CO2(g)) в течение 1,5 мин, 2,5 мл/мин, время удержания=1,466 мин 97,4%, 94,8% э.и. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,86 (с, 1H), 5,52-5,38 (м, 2H), 3,53-3,49 (м, 2H), 3,16-3,11 (м, 2H), 2,93-2,82 (м, 1H), 2,69-2,65 (м, 1H), 1,22 (с, 3H), 1,08-1,02 (м, 1H), 0,84-0,80 (м, 2H), 0,40-0,39 (м, 1H), 0,10-0,08 (м, 1Н), -0,07 (с, 9Н); ЖХ/МС m/z (М+Н)+=307,3.
Пример получения 10. 7,7-дифтор-1-метилспиро[бицикло[4.1.0]гептан-3,2'-[1,3]диоксолан]
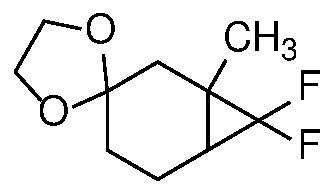
Реакцию проводят в 2-6 партиях параллельно. Раствор из Примера получения 2 (150 г, 972 ммоль) в ТГФ (1,20 л) обрабатывают 276 г (1,95 моль) TMSCF3 и 75,8 г (50,6 ммоль) NaI. Смесь перемешивают при 70°С в течение 16 ч. 26 реакционных смесей охлаждают до комнатной температуры и объединяют. Смесь разбавляют водой (10 л) и экстрагируют МТБЭ (4× 3 л). Органическую фазу промывают солевым раствором (8 л), сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (4,30 кг, выход 83%).
Пример получения 11: 7,7-дифтор-1-метилбицикло[4.1.0]гептан-3-он
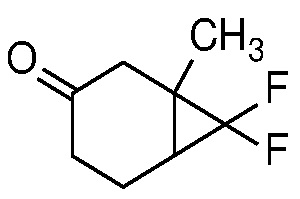
Реакцию проводят 5 партий параллельно. Смесь из примера получения 10 (860 г, 4,21 моль) в ТГФ (10 л) обрабатывают 3М HCl (2,6 л) при 25°С. Смесь перемешивают при 25°С в течение 16 часов. 5 реакций объединяют и экстрагируют МТБЭ (4х2,5 л), промывают насыщ. водным NaHCO3 (5 л) и раствором соли (5 л). Органическую фазу сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 11 (3,50 кг); 1H ЯМР (400 МГц, CDCl3) δ: 2,56 (ушд, 1H), 2,38-2,13 (м, 4H), 2,01-1,89 (м, 1H), 1,49-1,38 (м, 1H), 1,27 (ушс, 3H)
Пример получения 12: этил-2-(7,7-дифтор-6-метил-4-оксобицикло[4.1.0]гептан-3-ил)-2-оксоацетат
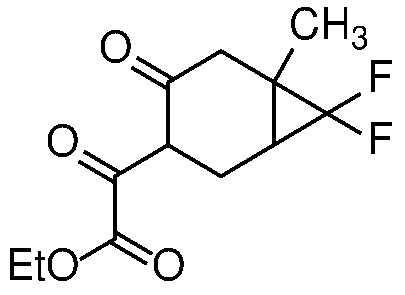
Реакцию проводят 8 партий параллельно. Раствор из Примера получения 11 (250 г, 1,56 моль) в EtOH (1,25 л) обрабатывают EtONa (112 г, 1,65 моль) порциями при 0°С. Полученную смесь обрабатывают диэтилоксалатом (24,2 г, 1,65 моль) при 0°С. Реакционную смесь перемешивают при 25°С в течение 1 часа. 8 партий объединяют. Смесь выливают в 3 М раствор HCl (8,00 л) и экстрагируют ДХМ (3× 2 л). Органические экстракты промывают раствором соли (5 л), сушат (Na2SO4), фильтруют и концентрируют для получения указанного в заголовке соединения 12 (3,20 кг, выход 98%).
Пример получения 13: этил-5,5-дифтор-5а-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбоксилат
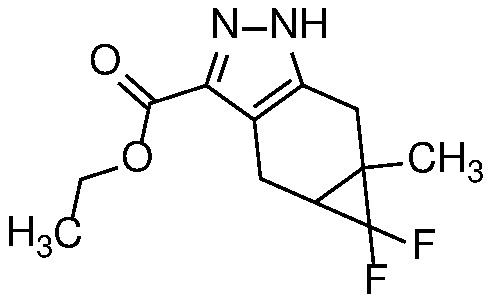
Реакцию проводят 8 партий параллельно. Суспензию из Примера получения 12 (400 г, 1,54 моль) в EtOH (2 л) обрабатывают гидразингидратом (76,9 г, 1,54 моль) при 0°С. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Восемь реакций объединяют для обработки. Реакционную смесь концентрируют, и остаток помещают в H2O (5,00 л) и экстрагируют EtOAc (5× 2 л). Объединенные органические экстракты сушат над (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают перекристаллизацией из 6:1 EtOAc/EtOH (3 л) при 20°С с получением указанного в заголовке соединения 13 (1,0 кг). 1H ЯМР (400 МГц, CDCl3) δ: 12,03-10,65 (ушм, 1H), 4,38 (кв, 2H), 3,30-3,04 (м, 3H), 2,79 (дд, 1H), 1,57 (ушдд, 1Н), 1,34-1,43 (м, 6Н); ЖХ-МС (ЭР+) e/z [M+H]=257,1
Пример получения 14: хиральное СЖХ разделение энантиомеров
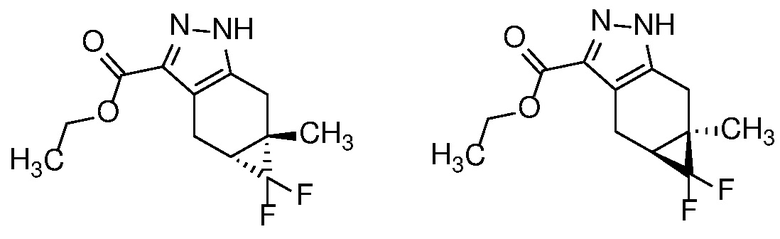
Пример получения 13 разделяют хиральной СЖХ с использованием колонки Chiral Tech AD-H 250 мм × 21,2 мм × 5 мкм с подвижной фазой CO2(g)/MeOH=80:20 с 0,2% 7N NH3 в MeOH и скоростью потока 200 мл/мин.
Аналитический метод СЖХ: Chiral Tech AD-H 250 мм × 4,6 мм × 5 мкм A=CO2(g); B=0,2% NH3 (в виде 7N NH3 в MeOH) в MeOH; градиент=0-1 мин 5% B, 1-9,5 мин 5-60% B линейное изменение; 9,5-10 мин 60-5% B линейное изменение.
Пример получения 14а, этил-(4aR,5aS)-5,5-дифтор-5а-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбоксилат, 100% эи по аналитическому способу СЖХ, время удержания=4,605 мин.
Пример получения 14b, этил-(4aS,5aR)-5,5-дифтор-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-карбоксилат, 99,85% эи по аналитическому способу СЖХ, время удержания=5,565 мин.
Пример получения 15: этил-(4aS,5aR)-5,5-дифтор-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбоксилат
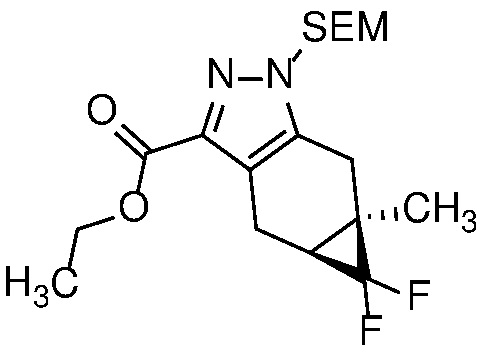
Смесь 4,25 г (106 ммоль) NaH в 20 мл ТГФ, охлажденную до 0°С, обрабатывают по каплям в течение 45 мин раствором из Примера получения 14b (18,16 г, 70,87 ммоль) в 100 мл ТГФ. Смесь перемешивают при 0°С в течение 1 ч и затем обрабатывают по каплям SEM-Cl (17,7 г, 106 ммоль) в ТГФ (80 мл). Полученную смесь перемешивают при комнатной температуре в течение 48 часов. Реакционную смесь медленно выливают на лед и экстрагируют 3 раза EtOAc. Органические экстракты объединяют, промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/гептаны=0-20%), получая 25,8 г (94%) указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3) δ 5,50-5,40 (м, 2H), 4,40 (кв 2H), 3,55-3,47 (м, 2H), 3,26-3,05 (м, 3H), 2,76 (ушдд, 1Н), 1,62-1,54 (м, 1Н), 1,44-1,35 (м, 6Н), 0,94-0,81 (м, 2Н), -0,03 (с, 9Н); ЖХ-МС m/z (M+H)+=387,4
Пример получения 16: ((4aS,5aR)-5,5-дифтор-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)метанол
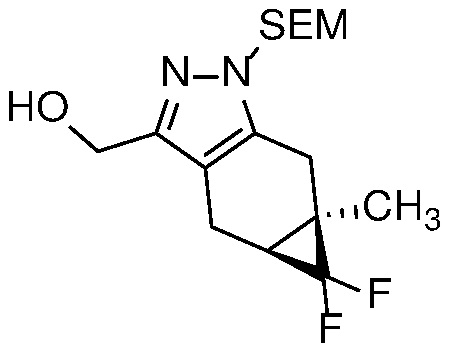
К раствору из Примера получения 15 (25,84 г, 66,86 ммоль) в ТГФ (100 мл) при температуре приблизительно -5°С добавляют по каплям раствор LiAlH4 (100 мл, 1 М в ТГФ) с такой скоростью, чтобы контролировать температуру. от 0 до 10°С. Смесь перемешивают при 0°С в течение дополнительного 1 часа и постепенно нагревают до комнатной температуры и перемешивают в течение дополнительных 4 часов. Смесь охлаждают до -10°С и обрабатывают по каплям 6N раствором NaOH (45 мл) в течение 30 мин. Добавляют дополнительное количество EtOAc, чтобы облегчить перемешивание густой смеси, и взвесь нагревают до комнатной температуры. Добавляют безводный MgSO4 и продолжают перемешивание еще в течение 30 мин. Смесь фильтруют, и твердые вещества промывают EtOAc. Фильтрат концентрируют и сушат, получая указанное в заголовке соединение (21,89 г, 95%). 1H ЯМР (400 МГц, CDCl3) δ 5,38-5,21 (м, 2H), 4,60 (с, 2H), 3,55-3,41 (м, 2H), 3,08 (ушд, 1H), 2,98-2,83 (м, 2H), 2,79-2,65 (м, 1H), 2,24 (ушс, 1H), 1,60-1,49 (м, 1H), 1,40 (ушс, 3H), 0,94-0,80 (м, 2H), -0,03 (с, 9Н); ЖХ-МС m/z (М+Н)+=345,5.
Пример получения 17: (4aS,5aR)-5,5-дифтор-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбальдегид
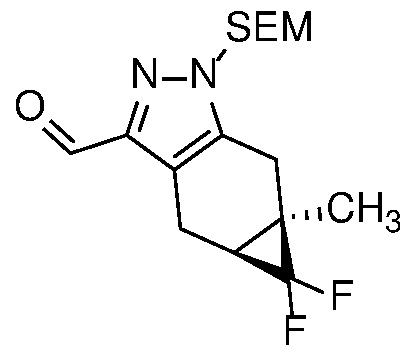
Раствор из Примера получения 16 (21,89 г, 63,55 ммоль) в ДХМ (25 мл) охлаждают до 0°С. По каплям добавляют раствор периодинана Десс-Мартина (33,7 г, 79,4 ммоль) в ДХМ (250 мл) при 0°С в течение примерно 20 мин. Смесь обрабатывают 2,2% водой/ДХМ (50 мл), добавляя по каплям в течение 45 минут при 0°С. Смесь нагревают до комнатной температуры и перемешивают в течение 4 часов. Смесь обрабатывают 1N раствором NaOH (380 мл) и перемешивают в течение 30 мин. Двухфазную смесь разделяют. Органическую фазу промывают раствором соли, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/гептаны=0-50%), получая указанное в заголовке соединение (17,8 г, 82%). 1H ЯМР (400 МГц, CDCl3) δ 9,98 (с, 1H), 5,52-5,35 (м, 2H), 3,61-3,43 (м, 2H), 3,27-3,05 (м, 4H), 2,82-2,66 (м, 1Н), 1,42 (м, 3Н), 0,98-0,80 (м, 2Н), 0,08-0,13 (м, 9Н); ЖХ-МС m/z (М+Н)+=343,3.
Пример получения 18: бензил-(S)-2-морфолинопропаноат
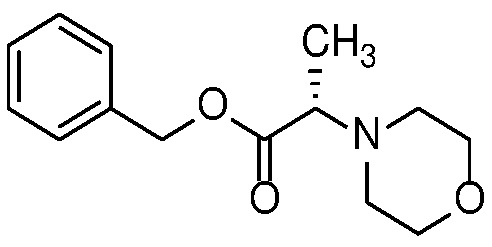
Раствор бензил-L-аланинат-4-метилбензолсульфоната (500 г, 1,42 моль) в ДМСО (3 л) обрабатывают Et3N (624 г, 6,165 моль) и смесь охлаждают до 0°С. К реакционной смеси медленно добавляют раствор 1-бром-2-(2-бромэтокси)этана (429 г, 1,849 моль) в ДМСО (1 л). Полученную смесь перемешивают при 25°С в течение 36 часов. К смеси добавляют воду (3 л) и EtOAc (2 л). Водную фазу экстрагируют EtOAc (2× 1 л). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/PE=11%), получая указанное в заголовке соединение (290 г, 82%). 1H ЯМР (400 МГц, ДМСО-d6) δ 7,42-7,31 (м, 5H), 5,19 (с, 2H), 3,79-3,66 (м, 4H), 3,35-3,30 (м, 1H), 2,69-2,56 (м, 4Н), 1,32-1,29 (м, 3Н).
Пример получения 19: (S)-2-морфолинопропановая кислота
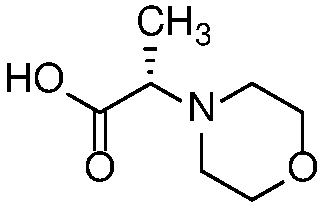
Раствор из Примера получения 18 (290 г, 1,56 моль) в MeOH (2,9 л) обрабатывают 10% Pd(OH)2/C (29 г) при 25°С. Смесь дегазируют и продувают N2 (3 раза), и затем перемешивают в атмосфере H2 в течение 36 часов. Твердое вещество удаляют фильтрованием и фильтрат концентрируют. Полученный остаток промывают МТБЭ (200 мл x2) с получением указанного в заголовке соединения (146 г, 79%). Аналитический метод СЖХ: Chiral Tech IC 250 мм × 4,6 мм × 5 мкм, от 5 до 60% с 0,2% NH4+(7N в MeOH) в MeOH/CO2(g), 3,0 мл/мин, время удержания=5,88 мин, 100% эи; 1H ЯМР (400 МГц, ДМСО-d6) δ 3,56 (с, 4H), 3,18-3,16 (м, 1H), 2,54-2,53 (м, 4H), 1,17-1,15 (м, 3H); ЖХ/МС m/z (М+Н)+=160,1.
Пример получения 20: 2-(тетрагидро-2 H -пиран-4-ил)ацетилхлорид
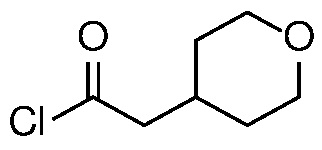
Раствор 2-(тетрагидро-2Н-пиран-4-ил)уксусной кислоты (17,3 г, 120 ммоль) в ДХМ (400 мл) и ДМФА (1 мл) при 0° обрабатывают оксалилхлоридом (30,5 г, 240 ммоль). Затем смесь нагревают до 20°С и перемешивают в течение 16 часов. Смесь концентрируют, получая указанное в заголовке соединение (19,5 г, колич.).
Пример получения 21: (R)-4-бензил-3-(2-(тетрагидро-2 H -пиран-4-ил)ацетил)оксазолидин-2-он
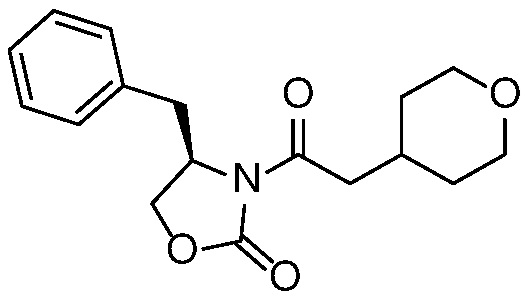
Раствор 20 (14,2 г, 79,9 ммоль) в ТГФ (500 мл) при -78°С обрабатывают n-BuLi (47,9 мл, 120 ммоль). Затем смесь перемешивают при -78°С в течение 2 часов. Добавляют раствор 2-(тетрагидро-2H-пиран-4-ил)ацетилхлорида (19,5 г, 120 ммоль) в ТГФ (100 мл) при -78°С и перемешивают в течение дополнительных 2 часов. Затем смесь нагревают до 20°С и затем перемешивают в течение 16 часов. Реакцию обрабатывают насыщ. водным NH4Cl (400 мл) и полученную двухфазную смесь разделяют. Органическую фазу сушат (Na2SO4) и концентрируют. Остаток суспендируют в ДХМ/ПЭ (50 мл/300 мл) и перемешивают при -50°С в течение 30 мин. Твердые вещества собирают и сушат с получением указанного в заголовке соединения (21,5 г, выход 89%). ЖХ/МС m/z (М+Н)= 303,8.
Пример получения 21a: (R)-4-бензил-3-((R)-2-(тетрагидро-2 H -пиран-4-ил)пропаноил)оксазолидин-2-он
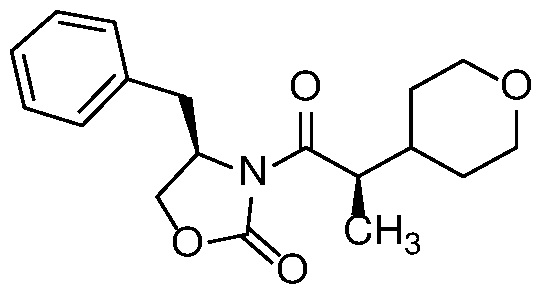
Раствор из Примера получения 21 (21,5 г, 70,8 ммоль) в ТГФ (200 мл) при -78°С обрабатывают NaHMDS (1М в ТГФ, 106 мл). Смесь перемешивают в течение 1 ч и обрабатывают йодидом метила (50,3 г, 354 ммоль) при -78°С. Реакционную смесь перемешивают при -78°С в течение 2 часов, и затем постепенно нагревают до 20°С в течение 16 часов. Реакционную смесь обрабатывают насыщ. водным NH4Cl (300 мл) и двухфазную смесь разделяют. Органический слой промывают раствором соли, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/PE: 0-100%), получая указанное в заголовке соединение (15,5 г, 69%). 1H ЯМР (400 МГц, CDCl3) δ 7,32-7,11 (м, 5H), 4,62 (дд, 1H), 4,20-4,07 (м, 2H), 4,02 (дд, 1H), 3,94 (дд, 1H), 3,65-3,54 (м, 1H), 3,33 (тт, 2H), 3,22 (дд, 1H), 2,72 (дд, 1H), 1,97-1,87 (м, 1H), 1,64-1,56 (м, 1H), 1,58-1,51 (м, 1Н), 1,41-1,26 (м, 2Н), 1,15 (д, 3Н); ЖХ/МС m/z (М+Н)+=318,3.
Пример получения 22: (R)-2-(тетрагидро-2 H -пиран-4-ил)пропановая кислота
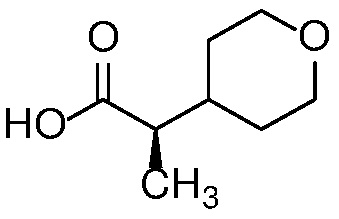
Раствор из Примера получения 21a (15,5 г, 48,8 ммоль) в ТГФ/H2O (410 мл/255 мл) при 0°С обрабатывают LiOH·H2O (10,2 г, 244 ммоль) и 30% водн. H2O2 (27,7 г, 244 ммоль). Смесь перемешивают при 0°С в течение 1,5 часов, и затем при 20°С в течение 1,5 часов. Смесь обрабатывают насыщ. водным Na2SO3 (300 мл), и органический растворитель удаляют в вакууме. Смесь промывают ДХМ (2× 200 мл) и затем обрабатывают конц. HCL до достижения pH=1. Смесь экстрагируют ДХМ (3× 200 мл), экстракты объединяют и сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 22 (6,12 г, выход 79%). (Ссылка: Evans, D.A., et al. J. Am. Chem. Soc. 1984, 106, 1154-1156)
1H ЯМР (400 МГц, CDCl3) δ 4,07-3,93 (м, 2H), 3,39 (дт, 2H), 2,30 (п, 1H), 1,87-1,77 (м, 1H), 1,68-1,56 (м, 2H)), 1,51-1,28 (м, 2Н), 1,17 (д, 3Н). [α]20D=-17,98 (с=0,3 г/100 мл, EtOH); Хиральная СЖХ (MeOH/CO2, Chiral Tech IG, от 5 до 60% в течение 10 мин, 250 мм × 4,6 мм × 5 мкм), время удержания=3,42 мин, 97% эи.
Пример получения 23: (S)-2-(тетрагидро-2 H -пиран-4-ил)пропановая кислота
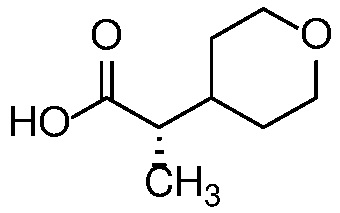
Кислоту получают аналогично примеру получения 22 (R)-2-(тетрагидро-2H-пиран-4-ил)пропановой кислоты с использованием (S)-4-бензилоксазолидин-2-она на стадии 2. 1H ЯМР (400 МГц, CDCl3) δ 4,07-3,93 (м, 2H), 3,39 (тт, 2H), 2,30 (п, 1H), 1,81 (тдт, 1H), 1,61 (дддкв, 2H), 1,51-1,28 (м, 2Н), 1,17 (д, 3Н). [α]20D=+19,99 (c=0,3 г/100 мл, EtOH)
Пример получения 24: бензил-2-бромпропаноат
К раствору 2-бромпропионовой кислоты (5,0 г, 32,7 ммоль) в ДХМ (100 мл) при 0°С добавляют Et3N (3,64 г, 36,0 ммоль), и затем по каплям добавляют бензилхлорформиат (5,58 г, 32,7 ммоль). Через 10 мин добавляют ДМАП (399 мг, 3,27 ммоль) и смесь перемешивают в течение 4 ч при 30°С. Смесь выливают в 1М HCl (15 мл) и раствор соли (80 мл). Смесь экстрагируют ДХМ (2× 80 мл). Органические экстракты объединяют, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ, 0-5%), получая указанное в заголовке соединение (4,81 г, 86%). 1H ЯМР (400 МГц, CDCl3) δ 7,38-7,27 (м, 5H), 5,22-5,10 (м, 2H), 4,43-4,37 (м, 1H), 1,80 (д, 3H); ЖХ/МС m/z (M+Na)+=267,0.
Пример получения 25: бензил-2-(3-оксоморфолино)пропаноат
Раствор морфолин-3-она (750 мг, 7,42 ммоль) в ТГФ (49 мл) при 5°С обрабатывают NaH (475 мг, 11,9 ммоль). После перемешивания в течение 30 мин по каплям добавляют Пример получения 24 (16 г, 8,90 ммоль). После перемешивания при 25°С в течение 3 ч смесь разбавляют насыщ. водным NH4Cl (30 мл) и водой (20 мл). Смесь экстрагируют EtOAc (2× 60 мл), объединенные экстракты сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/PE=0-70%), получая указанное в заголовке соединение 25 (256 мг, 13%). 1H ЯМР (400 МГц, CDCl3) δ 7,41-7,30 (м, 5H), 5,33 (кв, 1H), 5,22-5,09 (м, 2H), 4,22 (с, 2H), 3,96-3,77 (м, 2H), 3,52-3,20 (м, 2Н), 1,45 (д, 3Н).
Пример получения 26: 2-(3-оксоморфолино)пропановая кислота
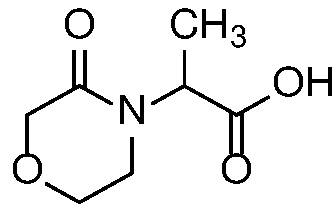
К смеси из Примера получения 25 (256 мг, 0,98 ммоль) в МеОН (10 мл) добавляют 10% Pd/C (50% в воде, 207 мг, 0,19 ммоль). Смесь перемешивают в атмосфере H2 (1 атм) при 25°С в течение 16 часов. Реакционную смесь фильтруют, и твердые вещества промывают МеОН (3× 20 мл). Фильтрат концентрируют, получая указанное в заголовке соединение 26 (167 мг, 99%). 1H ЯМР (400 МГц, CDCl3) δ 6,15 (ушс, 1H), 5,16 (д, 1H), 4,24 (д, 2H), 4,06-3,82 (м, 2H), 3,55-3,28 (м, 2H), 1,45 (дд, 3H).
Пример получения 27: (S) -N- (5-хлор-2-метил-4-нитрофенил)-2-морфолинопропанамид
К раствору 5-хлор-2-метил-4-нитроанилина (4,0 г, 21,4 ммоль) и Примера получения 19 (4,09 г, 25,7 ммоль) в пиридине (70 мл) добавляют EDCI (8,84 г, 46,1 ммоль) при 20°С. Смесь перемешивают при 20°С в течение 16 часов. Смесь обрабатывают насыщ. водным NH4Cl (100 мл) и экстрагируют EtOAc (3×100 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт растирают с МТБЭ (100 мл) с получением указанного в заголовке соединения (4,8 г, 68%). 1H ЯМР (400 МГц, CDCl3) δ 9,83 (с, 1H), 8,68 (с, 1H), 7,87 (с, 1H), 3,87-378 (м, 4H), 3,35-3,29 (м, 1H), 2,72-2,62 (м, 2Н), 2,37 (с, 3Н), 1,39-1,38 (м, 3Н).
Пример получения 28: (S)-N-(5-хлор-2-метил-4-нитрофенил) -N -метил-2-морфолинопропанамид
К раствору из Примера получения 27 (5,50 г, 16,8 ммоль) в ТГФ (75 мл) добавляют KOtBu (2,07 г, 18,5 ммоль) при 0°С. Смесь перемешивают при 0°С в течение 1 ч и по каплям добавляют раствор метилиодида (2,62 г, 18,5 ммоль) в ТГФ (15 мл) при 0°С. Смесь перемешивают при 25°С в течение 16 часов. Реакцию обрабатывают насыщ. водным NH4Cl (100 мл) и экстрагируют EtOAc (2× 100 мл). Объединенные органические слои промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (5,1 г, 89%). 1H ЯМР (400 МГц, CDCl3) δ 7,92-7,81 (м, 1H), 7,72 (с, 0,5H), 7,32 (с, 0,5H), 3,79-3,47 (м, 4H), 3,21-3,19 (м, 3Н), 3,39-2,83 (м, 1Н), 2,62-2,51 (м, 2Н), 2,43-2,29 (м, 3Н), 2,22-2,16 (м, 2Н), 1,18-1,11 (м, 3Н).
Пример получения 29: (S) -N- (5-((4-метоксибензил)амино)-2-метил-4-нитрофенил) -N -метил-2-морфолинопропанамид
К смеси из Примера получения 28 (320 г, 936,3 ммоль) в 4-метоксибензиламине (513,7 г, 3,74 моль) добавляют ацетат аммония (72,2 г, 936,3 ммоль). Смесь нагревают при 100°С в течение 16 часов. Смесь разбавляют EtOAc (1,5 л) и промывают насыщ. водным NH4Cl (3× 1,5 л) и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, МеОН/ДХМ=0-10%) с получением указанного в заголовке соединения (261 г, 64%) в виде твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 8,38-8,02 (м, 1H), 7,26-7,22 (м, 2H), 6,94-6,98 (м, 2H), 6,79-6,48 (м, 1H), 4,57-4,47 (м, 2H), 3,87-3,81 (м, 3H), 3,61-3,51 (м, 5H), 3,14-3,11 (м, 3H), 3,03-2,83 (м, 1H), 2,56-2,40 (м, 2H), 2,30-2,04 (м, 4Н), 1,14-1,01 (м, 3Н).
Пример получения 30: (S) -N- (4,5-диамино-2-метилфенил) -N -метил-2-морфолинопропанамид
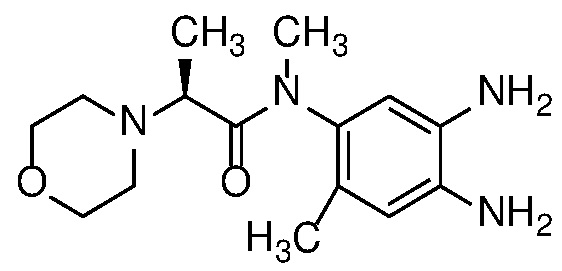
К раствору из Примера получения 29 (256 г, 578,5 ммоль) в ДХМ (1,25 л) добавляют ТФК (1,28 л, 17,3 моль) и смесь перемешивают при 25°С в течение 2 часов. Смесь концентрируют и затем разбавляют в ДХМ (1 л). Полученную смесь доводят до ~pH 9 с помощью насыщ. Na2CO3 и затем экстрагируют ДХМ (2× 1 л). Объединенный органический слой промывают солевым раствором (1 л), сушат над Na2SO4, фильтруют и фильтрат концентрируют. Остаток растворяют в ДХМ (500 мл), к которому по каплям добавляют 4М раствор HCl/диоксана (1 л) и перемешивают в течение 0,5 часа. Смесь концентрируют и добавляют ДХМ (800 мл). Полученную смесь перемешивают в течение 16 часов. Смесь фильтруют, и полученный осадок на фильтре сушат в вакууме с получением HCl соли (S)-N-(4-амино-2-метил-5-нитрофенил)-N-метил-2-морфолинопропанамида (200 г) в виде твердого вещества. В сосуд для гидрирования тремя отдельными порциями загружают (S)-N-(4-амино-2-метил-5-нитрофенил)-N-метил-2-морфолинопропанамид (66,6 г, 206,6 ммоль), указанный выше, и MeOH (900 мл). В реакционный сосуд добавляют 10% Pd/C (13 г, 41,32 ммоль) и смесь продувают N2, и затем H2. Реакционную смесь гидрируют под давлением H2 при 50 ф./кв. д. при 40°C в течение 48 часов. Реакционную смесь фильтруют (2 раза), и фильтрат промывают МеОН (3 раза по 500 мл). Фильтрат концентрируют с получением остатка. Остаток растворяют в МеОН (1 л), к которому добавляют Na2CO3 (41,9 г, 395 ммоль), и смесь перемешивают при 25°С в течение 1 часа. Смесь фильтруют и промывают МеОН (5× 200 мл). Фильтрат концентрируют. Остаток очищают хроматографией (двуокись кремния, градиент ДХМ:MeOH 0-10%), получая указанное в заголовке соединение (159,4 г, выход 89%). Метод СЖХ: Chiralpak IB N-5 250 мм x 4,6 мм x 5 мкм, 5% (0,2% изопропиламина в изопропаноле/CO2(g)) в течение 1 мин, затем до 60% в течение 8 мин, 2,5 мл/мин, время удержания=8,636 мин, 98,42%, 96,85% эи. 1H ЯМР (400 МГц, CDCl3) δ 6,60 (с, 0,5H), 6,59 (с, 0,5H), 6,56 (с, 0,5H), 6,42 (с, 0,5H), 6,56-6,42 (м, 1H), 3,71-3,60 (м, 4H), 3,40 (ушс, 4H), 3,17-3,07 (м, 4H), 2,66-2,57 (м, 2H), 2,40-2,31 (м, 2H), 2,16 (с, 1,5Н), 2,06 (с, 1,5Н), 1,19-1,12 (м, 3Н); ЖХ/МС m/z (M+H)+=293,2.
Пример получения 31: N- (4,5-диамино-2-метилфенил) -N -метил-2-морфолинопропанамид
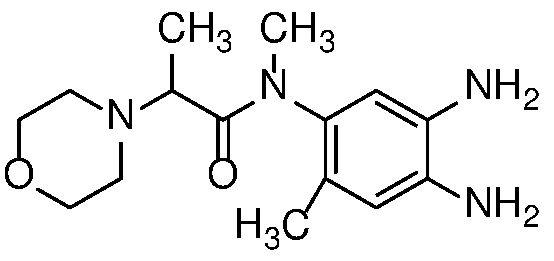
Указанное в заголовке соединение 31 получают аналогично примеру получения. 30, исходя из (±)-2-морфолинопропановой кислоты; ЖХ/МС m/z (М+Н)+=293,3.
Пример получения 32: (S) -N- (3,4-диаминофенил)-N-метил-2-морфолинопропанамид
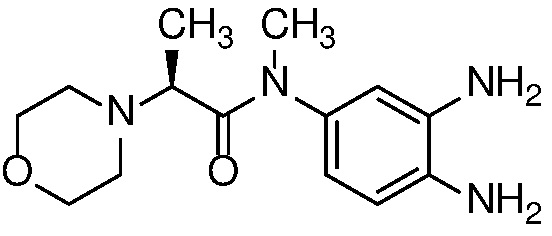
Указанное в заголовке соединение получают аналогично примеру получения 30, исходя из 3-хлор-4-нитроанилина и примера получения 19.
1H ЯМР (400 МГц, CDCl3) δ=6,68 (д, 1H), 6,60-6,47 (м, 2H), 3,75-3,61 (м, 4H), 3,54-3,37 (м, 2H), 3,26 (кв, 1Н), 3,21 (с, 3Н), 2,64-2,55 (м, 2Н), 2,47-2,35 (м, 2Н), 1,15 (д, 3Н)
Пример получения 33: N- (5-хлор-2-этилфенил)ацетамид
5-хлор-2-этиланилин (405 мг, 2,6 ммоль) добавляют к Ac2O (10 мл, 110 ммоль) при перемешивании при 25°С. Реакционную смесь перемешивают в течение 3 ч и фильтруют для сбора осадка. Твердые вещества промывают водой (3× 15 мл) и сушат, получая указанное в заголовке соединение (496 мг, 96%). 1H ЯМР (400 МГц, CDCl3) δ 7,91 (с, 1H), 7,12 (т, 2H), 6,96 (с, 1H), 2,56 (кв, 2H), 2,21 (с, 3H), 1,22 (т, 3Н); ЖХ/МС m/z (М+Н)= 197,9.
Пример получения 34: N- (5-хлор-2-этил-4-нитрофенил)ацетамид
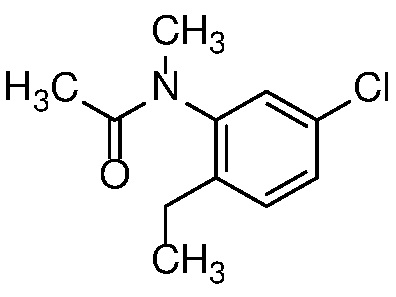
Раствор из Примера получения 33 (496 мг 2,51 ммоль) в конц. H2SO4 (2 мл) охлаждают до 0°С и обрабатывают KNO3 (254 мг, 2,51 ммоль) порциями, поддерживая внутреннюю температуру ниже 5°С. Полученную смесь перемешивают в течение 4 ч при температуре 0-5°С. Смесь выливают в воду (30 мл) и перемешивают в течение 10 мин. Смесь фильтруют, и собранные твердые вещества промывают водой (3× 20 мл) и сушат в вакууме, получая указанное в заголовке соединение (600 мг, 99%). 1H ЯМР (400 МГц, CDCl3) δ 8,47 (с, 1H), 7,85 (д, 1H), 7,18 (с, 1H), 2,70-2,59 (м, 2H), 2,29 (с, 3H), 1,34 (т, 3H); ЖХ/МС m/z (М+Н)= 242,9.
Пример получения 35: 5-хлор-2-этил-4-нитроанилин
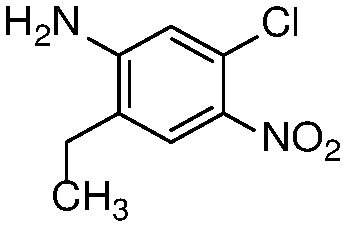
Раствор из Примера получения 34 (450 мг, 1,85 ммоль) в EtOH (10 мл) и воде (5 мл) обрабатывают NaOH (371 мг, 9,27 ммоль) при 25°С. Полученную смесь нагревают при 80°С в течение 16 часов. К смеси добавляют дополнительное количество NaOH (74,2 мг, 1,85 ммоль) и нагревание продолжают при 80°С в течение дополнительных 16 часов. Смесь концентрируют, разбавляют водой (20 мл) и экстрагируют EtOAc (2× 20 мл). Объединенные органические слои концентрируют и очищают хроматографией (двуокись кремния, EtOAc/ПЭ=от 0 до 15%), получая указанное в заголовке соединение (278 мг, 74%). 1H ЯМР (400 МГц, CDCl3) δ 7,88 (с, 1H), 6,70 (с, 1H), 4,29 (с, 2H), 2,54-2,43 (м, 2H), 1,29 (т, 3H); ЖХ/МС m/z (М+Н)= 200,9.
Пример получения 36. (S) -N- (3-фтор-4-нитрофенил)-2-морфолинопропанамид
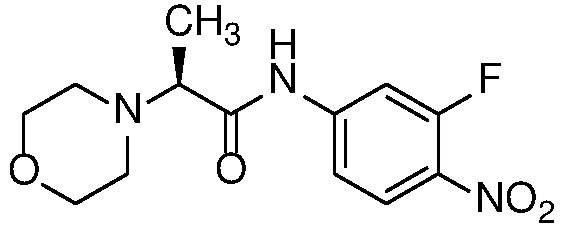
Раствор 3-фтор-4-нитроанилина (1,0 г, 6,41 ммоль) в пиридине (20 мл) при 20°С обрабатывают примером получения 19 (1,22 г, 7,69 ммоль) и EDCI (1,46 г, 12,8 ммоль). Смесь перемешивают в течение 15 ч, концентрируют и разбавляют EtOAc/H2O (150 мл/50 мл). Органический слой отделяют, и водный слой экстрагируют EtOAc (50 мл). Органические экстракты объединяют, промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), получая указанное в заголовке соединение (1,36 г, 72%). ЖХ/МС m/z (М+Н)+=298,0.
Пример получения 37. (S) -N- (3-фтор-4-нитрофенил)-N-метил-2-морфолинопропанамид
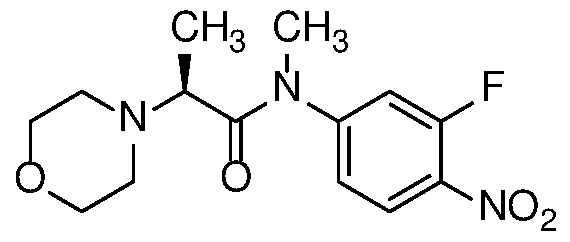
Раствор из Примера получения 36 (1,36 г, 4,58 ммоль) в ТГФ (60 мл) при 0°С обрабатывают NaH (274 мг, 6,86 ммоль). Через 30 минут добавляют метилйодид (0,43 мл, 6,86 ммоль) и смесь перемешивают в течение 16 часов. Смесь обрабатывают насыщ. водным NH4Cl (1 мл) и затем распределяют между EtOAc и H2O (150 мл/50 мл). Органический слой отделяют, и водный слой экстрагируют EtOAc (100 мл). Органические экстракты собирают, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), получая указанное в заголовке соединение (410 мг, 29%). ЖХ/МС m/z (М+Н)+=312,1.
Пример получения 38. (S) -N- (3-амино-4-нитрофенил)-N-метил-2-морфолинопропанамид
Раствор из Примера получения 37 (370 мг, 1,19 ммоль) в EtOH (30 мл) при 20°С обрабатывают конц. NH4OH (10 мл). Смесь перемешивают в течение 15 ч при 70°С и разбавляют смесью EtOAc/H2O (150/50 мл). Органический слой отделяют, и водный слой экстрагируют EtOAc (50 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (366 мг, 99%). ЖХ/МС m/z (M+H) +=309,1.
Пример получения 39: (S) -N- (5-амино-2-бром-4-нитрофенил)-N-метил-2-морфолинопропанамид
Раствор из Примера получения 38 (270 мг, 0,88 ммоль) в AcOH (10 мл) при 20°С обрабатывают Br2 (140 мг, 0,88 ммоль). Смесь перемешивают в течение 1 ч, и осадок собирают фильтрованием. Твердые вещества очищают с помощью преп. ВЭЖХ (Phenomenex Gemini-NX 150 мм × 30 мм × 5 мкм, H2O/CH3CN (0,05% NH4OH), 18-58% в течение 10 мин) с получением указанного в заголовке соединения (65 мг, 19%). 1H ЯМР (400 МГц, ДМСО-d6) δ 8,25 (д, 1H), 7,69 (с, 1H), 7,57 (с, 1H), 7,23 (с, 0,6H), 7,07 (с, 0,4H), 3,54-3,46 (м, 3Н), 3,37-3,33 (м, 2Н), 3,04 (с, 3Н), 2,41 (дт, 2Н), 2,21-2,10 (м, 2Н), 1,07 (д, 1,3Н), 1,01 (д, 1,7Н); ЖХ/МС m/z (M+H)+=388,8/390,8 (79Br, 81Br).
Пример получения 40: (S) -N- (4,5-диамино-2-бромфенил)-N-метил-2-морфолинопропанамид
Раствор 39 (40 мг, 0,10 ммоль) в EtOH (3 мл) при 20°С обрабатывают насыщ. водным NH4Cl (0,5 мл) и порошок железа (17,3 мг, 0,31 ммоль). Смесь нагревают до 70°С в течение 1 ч и фильтруют. Фильтрат концентрируют, и остаток очищают препаративной ВЭЖХ (Boston Prime C18, 150 × 30 мм × 5 мкм; H2O/MeCN (0,05% NH4OH) 16-39% в течение 10 мин) с получением указанного в заголовке соединения. (5 мг, 10%). 1H ЯМР (400 МГц, ДМСО-d6) δ 6,75 (с, 0,3H), 6,72 (с, 0,7H), 6,58 (с, 0,7H), 6,47 (с, 0,3H), 4,91 (д, 2H), 4,82 (д, 2Н), 3,55-3,46 (м, 4Н), 3,09 (д, 2Н), 2,96 (д, 3Н), 1,06 (д, 1,3Н), 1,01 (д, 1,7Н). ЖХ/МС m/z (M+H)=357,0/359,1 (79Br, 81Br).
Пример получения 41: трет -бутил(5-фтор-2-метил-4-нитрофенил)карбамат
Раствор 5-фтор-2-метил-4-нитроанилина (133 г, 781 ммоль, 1 экв.), ДМАП (9,55 г, 78,1 ммоль, 0,1 экв.) и iPr2NEt (202 г, 1,56 моль, 272 мл, 2 экв.) в ДХМ (2 л) обрабатывают BOC2O (187 г, 859 ммоль) при 20°С. Смесь перемешивают при 20°С в течение 16 ч и концентрируют. Остаток растворяют в EtOAc (3 л) и последовательно промывают насыщ. водным NH4Cl (1 л), насыщ. водным NaHCO3 (1 л) и раствором соли (1 л). Органический слой сушат (Na2SO4), фильтруют и концентрируют. Остаток растирают с МеОН (3 л) и твердые вещества собирают фильтрованием, получая указанное в заголовке соединение (90 г, 374 ммоль).
Фильтрат концентрируют, и остаток растворяют в MeOH (500 мл) и обрабатывают K2CO3 (15,5 г). Смесь перемешивают при 20°С в течение 3 часов. Смесь фильтруют, и твердые вещества промывают МеОН. Фильтрат концентрируют и остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-10%), получая дополнительное указанное в заголовке соединение (45 г, 166 ммоль).
Обе партии объединяют с получением всего указанного в заголовке соединения (135 г, 72%). 1H ЯМР (400 МГц, CDCl3) δ 8,15 (д, 1H), 7,94-7,88 (м, 1H), 6,62 (с, 1H), 2,28 (с, 3H), 1,55 (с, 9H).
Пример получения 42: трет -бутил(5-фтор-2-метил-4-нитрофенил)карбамат
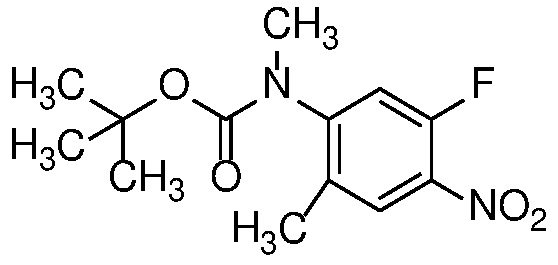
Раствор из Примера получения 41 (131 г, 486 ммоль) в ТГФ (1,9 л) обрабатывают KOtBu (81,9 г, 730 ммоль) при 0°С и смесь перемешивают при 0°С в течение 1 часа. Добавляют по каплям метилйодид (61 мл, 980 ммоль) при 0°С. Полученную смесь перемешивают при 20°С в течение 16 часов. Реакционную смесь обрабатывают насыщ. водным NH4Cl (500 мл) и экстрагируют EtOAc (1 л). Органический слой промывают раствором соли (500 мл), сушат (Na2SO4) и концентрируют с получением указанного в заголовке соединения (150 г, выход 95%). 1H ЯМР (400 МГц, CDCl3) δ 7,95 (д, 1H), 7,07 (д, 1H), 3,17 (с, 3H), 2,26 (с, 3H), 1,40 (д, 9H).
Пример получения 43: трет -бутил(5-амино-2-метил-4-нитрофенил)(метил)карбамат
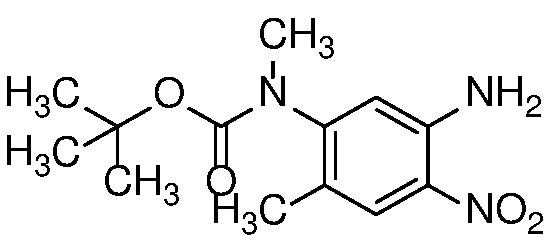
Раствор из Примера получения 42 (450 г, 1,38 моль, 1 экв.) в 7 М NH3 в МеОН (7 М, 5,5 л) нагревают при 58°С в течение 72 часов. Смесь концентрируют. Остаток растворяют в EtOAc (2 л) и промывают раствором соли (2 л). Органический слой сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), получая указанное в заголовке соединение (295 г, выход 76%). 1H ЯМР (400 МГц, CDCl3) δ 8,00 (с, 1H), 6,62 (с, 1H), 5,95 (с, 2H), 3,15 (с, 3H), 2,15 (д, 3H), 1,41 (с, 9Н); ЖХ/МС m/z (М+Н-трет-бутил)=225,8.
Пример получения 44: трет -бутил(4,5-диамино-2-метилфенил)(метил)карбамат
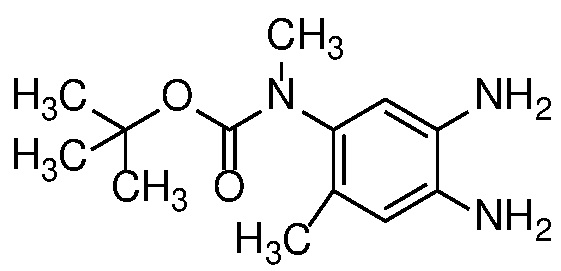
Раствор из Примера получения 43 (98 г, 349 ммоль) в MeOH (1 л) обрабатывают 10% Pd/C (10 г). Реакционную смесь перемешивают при 40°С в атмосфере H2 (3 атм) в течение 24 часов. Реакционную смесь фильтруют, и твердые вещества промывают МеОН (3× 500 мл). Фильтрат концентрируют, получая указанное в заголовке соединение (68,3 г, 78%). 1H ЯМР (400 МГц, ДМСО-d6) δ 6,32 (с, 1H), 6,27 (с, 1H), 4,37 (с, 2H), 4,29 (с, 2H), 2,96 (д, 3H), 1,89 (д, 3Н), 1,44 (с, 3Н), 1,28 (с, 6Н; ЖХ/МС m/z (М+Н-трет-бутил)=195,9.
Подготовка 45: трет-бутилметил-(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)карбамат
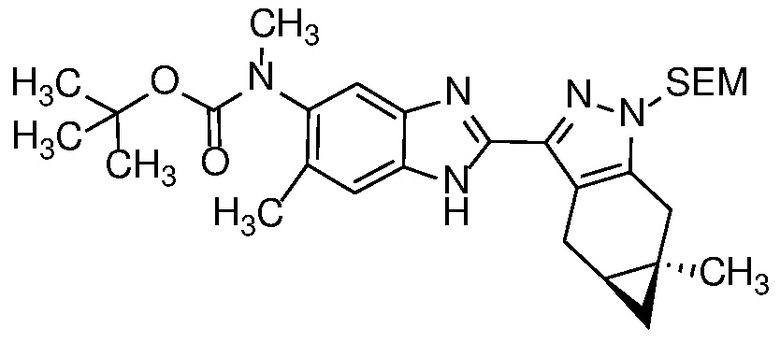
Раствор из Примера получения 44 (5,53 г, 23,5 ммоль) и Na2S2O5 (2,24 г, 11,8 ммоль) в ДМФ (124 мл) обрабатывают соединением 9 (7,21 г, 23,5 ммоль) и ДМСО (4,6 г, 58,8 ммоль) при комнатной температуре. Смесь нагревают при 110°С в течение 16 часов. Смесь концентрируют. Остаток разбавляют EtOAc (500 мл) и промывают 3% водн. LiCl (100 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-25%), получая указанное в заголовке соединение (10,8 г, 86%). 1H ЯМР (400 МГц, CD3OD) δ 7,46 (т, 1H), 7,38 (с, 1H), 5,53-5,42 (м, 2H), 3,63 (т, 2H), 3,40 (д, 1H), 3,26-3,11 (м, 5Н), 2,77 (д, 1Н), 2,33 (с, 3Н), 1,56 (с, 3Н), 1,36-1,30 (м, 9Н), 1,18 (дд, 1Н), 0,96-0,84 (м, 2H), 0,45 (дд, 1H), 0,28 (т, 1H), -0,02 (с, 9H); ЖХ/МС m/z (М+Н)+=538,3.
Подготовка 46: N,6-диметил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-амин
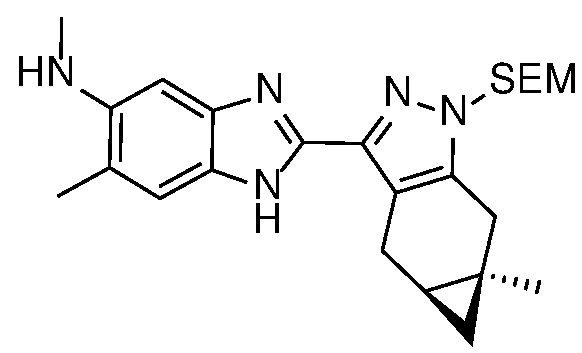
Раствор из Примера получения 45 (10,86 г, 20,2 ммоль) в ДХМ (135 мл) обрабатывают ZnBr2 (22,7 г, 101 ммоль) при 0°С. Смесь постепенно нагревают до комнатной температуры и перемешивают в течение 16 часов. Смесь выливают в насыщ. водный NaHCO3 (200 мл) и экстрагируют ДХМ (2× 200 мл). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), с получением указанного в заголовке соединения (7,54 г, 85,3%). Хиральная СЖХ (Chiral Pak AS-3, 150 мм × 4,6 мм × 3 мкм; CO2/EtOH с 0,05% iPr2NEt, от 5 до 40% в течение 5,5 мин) время удержания=2,93 мин (97,2% э.и.); 1H ЯМР (400 МГц, CD3OD) δ 7,32 (с, 1H), 6,76 (с, 1H), 5,51-5,42 (м, 2H), 3,38 (т, 2H), 3,40 (д, 1H), 3,31-3,28 (м, 2Н), 3,22 (с, 3Н), 3,17 (м, 1Н), 2,27 (с, 3Н), 1,32 (с, 3Н), 1,18 (м, 1Н), 0,88 (м, 2Н), 0,45 (дд, 1H), 0,28 (т, 1H), -0,02 (с, 9H); ЖХ/МС m/z (М+Н)+=438,3.
Пример получения 47: N- (3-фтор-4-нитрофенил)ацетамид
3-Фтор-4-нитроанилин (20 г, 128,1 ммоль) обрабатывают Ac2O (250 мл). Смесь перемешивают в течение 16 часов при комнатной температуре и затем разбавляют водой (100 мл). Осадок собирают фильтрованием. Твердые вещества растворяют в EtOAc (100 мл), сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения 47 (23,0 г, выход 91%). 1H ЯМР (400 МГц, CD3OD) δ 8,09 (т, 1H), 7,86 (дд, 1H), 7,38 (дт, 1H), 2,17 (с, 3H).
Пример получения 48. N- (3-фтор-4-нитрофенил) -N- метилацетамид
Раствор из Примера получения 47 (23,0 г, 116,1 ммоль) в ДМФА (300 мл) при 0°С обрабатывают NaH (6,96 г, 174 ммоль) и перемешивают в течение 20 мин. Добавляют метилйодид (33,0 г, 232 ммоль) и смесь перемешивают в течение 2 часов. Смесь обрабатывают водой (100 мл) и полученную смесь экстрагируют смесью 10% MeOH/EtOAc (2х200 мл). Экстракты собирают, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=20-50%), с получением указанного в заголовке соединения (16,0 г, выход 65%). 1H ЯМР (400 МГц, CDCl3) δ 8,13 (т, 1H), 7,25-7,15 (м, 2H), 3,35 (с, 3H), 2,10 (с, 3H)
Пример получения 49: N- (3-амино-4-нитрофенил) -N- метилацетамид
Раствор из Примера получения 48 (16,0 г, 75,4 ммоль) в EtOH (200 мл) при комнатной температуре обрабатывают конц. NH4OH (13,2 г, 377 ммоль). Смесь нагревают при 50°С в течение 3 дней и смесь концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=40-80%), с получением указанного в заголовке соединения (7,5 г, выход 48%). 1H ЯМР (400 МГц, CDCl3) δ 8,17 (д, 1H), 6,66 (д, 1H), 6,54 (дд, 1H), 6,18 (с, 2H), 3,27 (с, 3H), 2,02 (с, 3Н); ЖХ/МС m/z (М+Н)+=210,3.
Пример получения 50: N- (3,4-диаминофенил) -N- метилацетамид
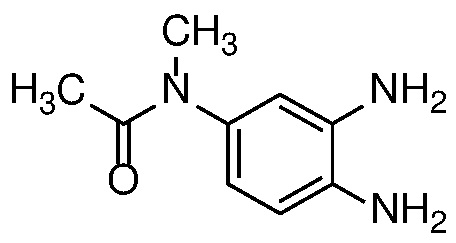
Раствор из Примера получения 49 (6,5 г, 31,1 ммоль) в MeOH (40 мл) обрабатывают 10% Pd/C (1,5 г). Смесь перемешивают при 20°С в атмосфере H2 (2 атм) в течение 3 часов. Смесь фильтруют и твердые вещества промывают МеОН (2× 50 мл). Фильтрат концентрируют, с получением указанного в заголовке соединения (5,38 г, выход 96%). 1H ЯМР (400 МГц, CDCl3) δ 6,71-6,64 (м, 1H), 6,50 (д, 2H), 3,46 (д, 4H), 3,19 (с, 3H), 1,87 (с, 3H); ЖХ/МС m/z (М+Н)+=180,3.
Пример получения 51: N- (3,5-дифтор-4-нитрофенил) -N- метилацетамид
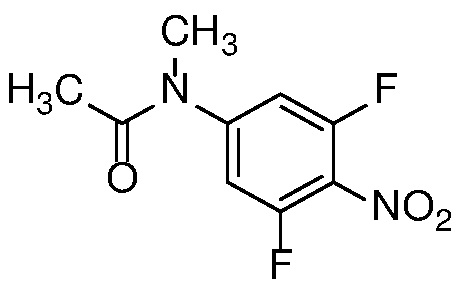
Раствор 5-бром-1,3-дифтор-2-нитробензола (25,0 г, 105,0 ммоль) в PhCH3 (250 мл) при 25°С в атмосфере азота обрабатывают N-метилацетамидом (11,5 г, 158 ммоль), Cs2CO3 (68,5 г, 210 ммоль), Pd2(dba)3 (9,62 г, 10,5 ммоль), XantPhos (6,08 г, 10,5 ммоль) и трифлатом алюминия(III) (9,96 г, 21 ммоль). Смесь нагревают при 100°С в течение 15 часов. Твердые вещества удаляют фильтрованием и фильтрат концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (8,75 г, 36%). 1H ЯМР (400 МГц, CDCl3) δ 7,10-6,99 (м, 2H), 3,34 (с, 3H), 2,15 (с, 3H); ЖХ/МС m/z (М+Н)+=230,9.
Пример получения 52: N- (3-амино-5-фтор-4-нитрофенил) -N- метилацетамид
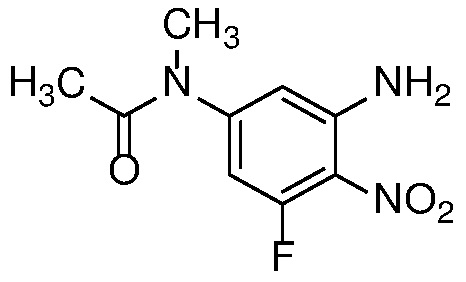
Раствор из Примера получения 51 (8,75 г, 38,0 ммоль) в EtOH (95 мл) обрабатывают конц. NH4OH (24 мл). Смесь перемешивают при комнатной температуре в течение 16 ч и обрабатывают водой (120 мл). Смесь экстрагируют EtOAc (2× 80 мл). Объединенные органические экстракты промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (5,70 г, 66%). 1H ЯМР (400 МГц, ДМСО-d6) δ 7,17 (с, 2H), 6,69 (т, 1H), 6,62 (дд, 1H), 3,15 (с, 3H), 1,99 (с, 3H). ЖХ/МС m/z (М+Н)+=227,9.
Пример получения 53: N- (3,4-диамино-5-фторфенил) -N- метилацетамид
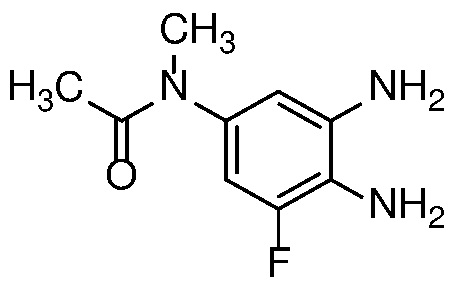
Приготовление раствора 52 (5,70 г, 25,1 ммоль) в EtOH (150 мл) обрабатывают 10% Pd/C (700 мг). Смесь перемешивают в атмосфере H2 (1 атм) при 25°С в течение 24 часов. Смесь фильтруют, и твердые вещества промывают EtOH. Фильтрат концентрируют, с получением указанного в заголовке соединения (4,6 г, 93%). 1H ЯМР (400 МГц, ДМСО-d6) δ 6,32 (дд, 1H), 6,24 (дд, 1H), 5,01 (с, 2H), 4,52 (с, 2H), 3,02 (с, 3H), 1,74 (с, 3H); ЖХ/МС m/z (М+Н)+=198,1.
Пример получения 54: N-метил-N- (2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил) -1H -бензо[d]имидазол-5-ил)ацетамид
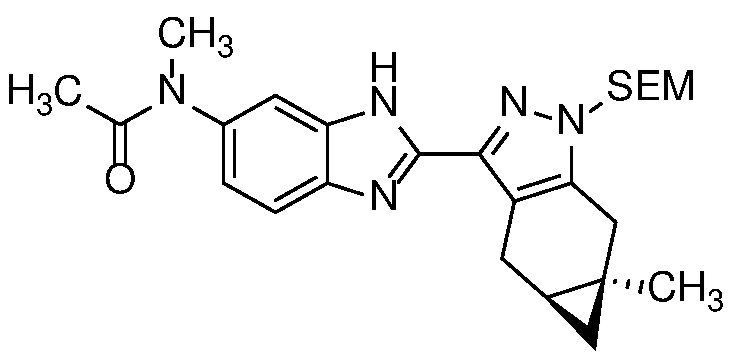
Раствор из Примера получения 50 (5,26 г, 29,4 ммоль) в ДМФ (147 мл) обрабатывают Na2S2O5 (2,79 г, 14,7 ммоль), 9 (9,0 г, 29,4 ммоль) и ДМСО (5,74 г, 73,4 ммоль). Смесь нагревают при 110°С в течение 6 ч и выливают в 3% водный раствор LiCl (250 мл). Смесь экстрагируют EtOAc (3× 100 мл), сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (13 г, выход 95%). 1H ЯМР (400 МГц, ДМСО-d6) ротомерная смесь δ 12,83 (с, 1H), 7,96 (с, 1H), 7,67 (д, 0,5 х H), 7,59 (с, 0,5 х H), 7,48 (д, 0,5 x H), 7,33 (с, 0,5 x H), 7,16-7,06 (м, 1H), 5,55-5,28 (м, 2H), 3,23-3,12 (м, 3H), 3,07-2,96 (м, 1H), 2,89 (с, 3H), 2,76-2,64 (м, 4H), 1,26 (с, 3H), 1,22-1,01 (м, 1H), 0,84 (дд, 2H), 0,41 (дд, 1H), 0,18-0,15 (м, 1Н), -0,06 (с, 9Н); ЖХ/МС m/z (М+Н)+=466,2.
Пример получения 55: N -метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f] индазол-3-ил) -1H -бензо[d]имидазол-5-амин
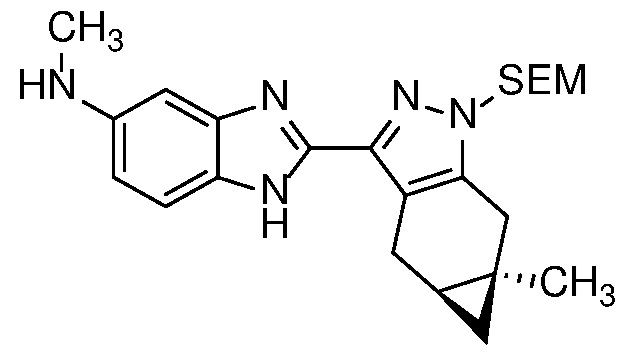
Раствор из Примера получения 54 (2,70 г, 5,8 ммоль) в EtOH (22 мл) при комнатной температуре обрабатывают 5N раствором NaOH (11,6 мл). Реакционную смесь нагревают при 90°С в течение 16 часов. К смеси добавляют воду (150 мл) и смесь экстрагируют EtOAc (2× 150 мл). Объединенные органические экстракты промывают солевым раствором (50 мл), сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=50-100%), с получением указанного в заголовке соединения 55 (93 мг, выход 38%). 1H ЯМР (400 МГц, CD3OD) δ 7,39 (д, 1H), 6,78-6,73 (м, 1H), 6,68 (дд, 1H), 5,47-5,39 (м, 2H), 3,66-3,50 (м, 2H), 2H), 3,37-3,31 (м, 1H), 3,22-3,04 (м, 2H), 2,82 (с, 3H), 2,75 (д, 1H), 1,30 (с, 3H), 1,16 (дт, 1H), 0,88 (тд, 2Н), 0,43 (дд, 1Н), 0,25 (т, 1Н), -0,03 (с, 9Н); ЖХ/МС m/z (М+Н)+=424,2.
Пример получения 56: N -(7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа [f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)- N- метилацетамид
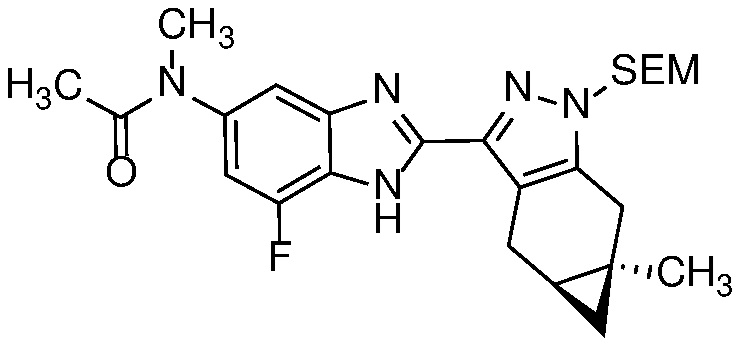
Раствор из Примера получения 9 (6,53 г, 21,3 ммоль) в ДМФ (106 мл) при 25°С обрабатывают примером получения 53 (4,20 г, 21,3 ммоль), Na2S2O5 (2,02 г, 10,6 ммоль) и ДМСО (4,16 г, 53,2 ммоль). Смесь нагревают при 110°С в течение 16 ч и разбавляют 3% водным раствором. LiCl (50 мл). Смесь экстрагируют EtOAc (2× 50 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-75%), с получением указанного в заголовке соединения (7,55 г, 67%). 1H ЯМР (400 МГц, CDCl3) δ 9,99 (д, 1H), 7,45 (д, 0,5H), 7,12-7,03 (м, 0,5H), 6,87-6,71 (м, 1H), 5,40 (квд, 2H)), 3,62-3,45 (м, 3Н), 3,30 (с, 3Н), 3,23-3,05 (м, 2Н), 2,75 (д, 1Н), 1,90 (с, 3Н), 1,29 (с, 3Н), 1,16 (с, 1Н), 0,91 (ддд, 2Н), 0,43 (дт, 1Н), 0,27 (д, 1Н), -0,02 (д, 9Н); ЖХ/МС m/z (М+Н)+=484,4.
Пример получения 57: 7-фтор- N- метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-амин
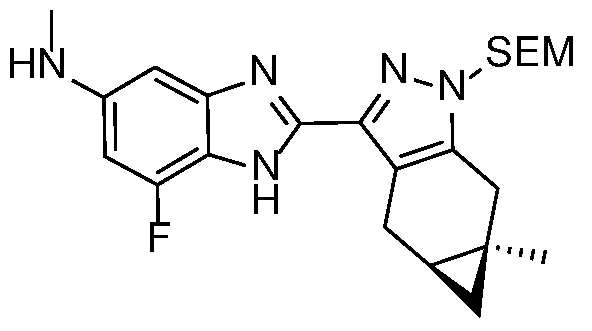
Раствор из Примера получения 56 (6,50 г, 13,44 ммоль) в EtOH (51,7 мл) обрабатывают 5N NaOH (26,9 мл, 134 ммоль). Реакционную смесь нагревают при 90°С в течение 46 часов. Добавляют воду (200 мл) и смесь экстрагируют EtOAc (2× 200 мл). Органические экстракты объединяют, промывают солевым раствором (50 мл), сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), с получением указанного в заголовке соединения (5,2 г, 75,9%). 1H ЯМР (400 МГц, CD3OD) δ 6,47 (с, 1H), 6,38 (дд, 1H), 5,48-5,38 (м, 2H), 3,60 (т, 2H), 3,37-3,30 (м, 1H), 3,21-3,08 (м, 2H), 2,83-2,72 (м, 1H), 2,80 (с, 3H), 1,29 (с, 3H), 1,15 (дт, 1H), 0,88 (тд, 2H), 0,42 (дд, 1H), 0,25 (т, 1H), -0,03 (с, 9H); ЖХ/МС m/z (М+Н)+=442,2.
Пример получения 58: N -(5-фтор-2-метил-4-нитрофенил)ацетамид
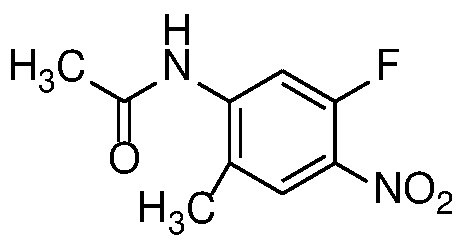
5-фтор-2-метил-4-нитроанилин (9,5 г, 56 ммоль) порциями добавляют к Ас2О (100 мл) при 15°С. Реакционную смесь перемешивают при 15°С в течение 36 часов. Твердые вещества собирают фильтрованием и промывают водой (3× 50 мл). Твердые вещества сушат, с получением указанного в заголовке соединения 58 (6,3 г, 53%).
Фильтрат экстрагируют EtOAc (100 мл). Органический слой промывают водой (2 х 100 мл), насыщ. водный Na2HCO3 (3× 100 мл), сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), получая дополнительное указанное в заголовке соединение 58 (4 г, 34%). 1H ЯМР (400 МГц, CDCl3) δ 8,34 (д, 1H), 7,94 (д, 1H), 7,17 (с, 1H), 2,32 (с, 3H), 2,28 (с, 3H).
Пример получения 59: N -(5-фтор-2-метил-4-нитрофенил)- N- метилацетамид
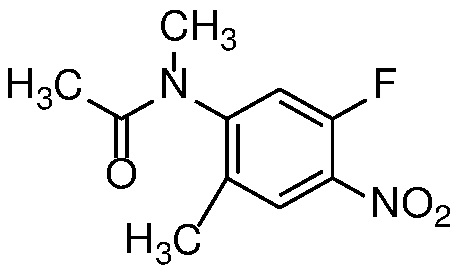
Раствор из Примера получения 58 (9,3 г, 43,8 ммоль) в ТГФ (220 мл) при 0°С обрабатывают KOtBu (48,2 мл, 1 М ТГФ). Смесь перемешивают 1 ч при 0°С и затем обрабатывают раствором метилиодида (6,84 г, 48,2 ммоль) в ТГФ (20 мл). Смесь нагревают до 15°С и перемешивают в течение 16 часов. Смесь обрабатывают насыщ. водный NH4Cl (50 мл). Смесь экстрагируют EtOAc (2× 50 мл). Объединенные органические экстракты промывают солевым раствором, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=20-50%), с получением указанного в заголовке соединения 59 (9,4 г, 95%). 1H ЯМР (400 МГц, CDCl3) δ 8,04 (д, 1H), 7,13 (д, 1H), 3,18 (с, 3H), 2,30 (с, 3H), 1,82 (с, 3H); ЖХ/МС m/z (М+Н)+=226,9.
Пример получения 60: N -(5-амино-2-метил-4-нитрофенил)- N- метилацетамид
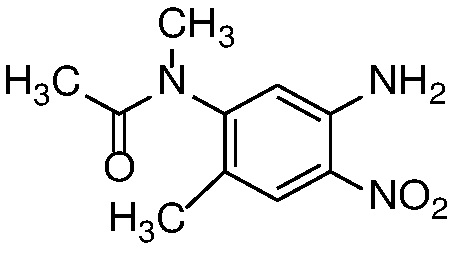
Раствор из Примера получения 59 (10,3 г, 45,5 ммоль) в EtOH (200 мл) при 15°С обрабатывают конц. NH4OH (200 мл). Смесь нагревают при 50°С и перемешивают в течение 40 часов. EtOH удаляют при пониженном давлении и суспензию фильтруют для сбора твердых веществ. Твердые вещества промывают водой и сушат с получением указанного в заголовке соединения (9 г, 89%). 1H ЯМР (400 МГц, CDCl3) δ 8,07 (с, 1H), 6,65 (с, 1H), 6,05 (с, 2H), 3,15 (с, 3H), 2,15 (с, 3H), 1,82 (с, 3Н); ЖХ/МС m/z (М+Н)+=224,1.
Пример получения 61: N -(4,5-диамино-2-метилфенил)- N- метилацетамид
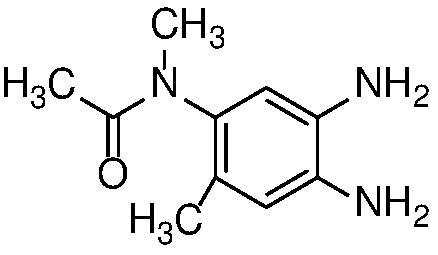
Раствор из Примера получения 60 (8 г, 35,8 ммоль) в EtOH (10 мл) обрабатывают 10% Pd/C (1,3 г). Смесь дегазируют с помощью N2 и трижды заполняют Н2. Реакционную смесь перемешивают при 15°С в атмосфере H2 (1 атм) в течение 16 часов. Смесь фильтруют и фильтрат концентрируют с получением указанного в заголовке соединения (7,7 г, 99%). 1H ЯМР (400 МГц, CDCl3) δ 6,57 (с, 1H), 6,46 (с, 1H), 3,40 (с, 4H), 3,12 (с, 3H), 2,05 (с, 3H), 1,78 (с, 3Н); ЖХ/МС m/z (М+Н)+=194,3.
Пример получения 62: N- метил- N -(6-метил-2-((4a S ,5a R )-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[ f ]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)ацетамид
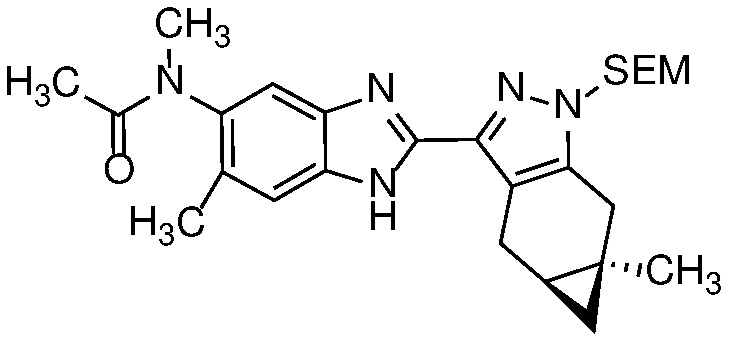
Пример получения 61 (4 г, 20,7 ммоль) и Na2S2O5 (1,97 г, 10,3 ммоль) смешивают с раствором из Примера получения 9 (6,84 г, 22,3 ммоль) в ДМФ (100 мл) и ДМСО (3,7 мл). Смесь нагревают при 110°С в течение 16 часов. Смесь охлаждают до КТ и добавляют 3% водн. LiCl (150 мл). Полученное твердое вещество собирают фильтрованием, промывают водой и сушат с получением указанного в заголовке соединения (7,9 г, 80%). 1H ЯМР (400 МГц, CDCl3) δ 9,88 (с, 1H), 7,58 (с, 1H), 7,31 (с, 1H), 5,50-5,26 (м, 2H), 3,55 (т, 3H), 3,23 (с, 3H), 3,20-3,05 (м, 2H), 2,74 (д, 1H), 2,32 (с, 3H), 1,79 (с, 3H), 1,29 (с, 3H), 1,16 (дт, 1H), 0,90 (дд, 2Н), 0,42 (дд, 1Н), 0,26 (т, 1Н), -0,03 (с, 9Н); ЖХ/МС m/z (М+Н)+=480,4.
Пример получения 63: N -(4-фтор-2-метил-5-нитрофенил)ацетамид
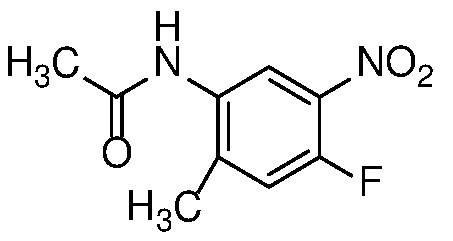
4-Фтор-2-метил-5-нитроанилин (16,7 г, 98,2 ммоль) добавляют к Ас2О (200 мл) при перемешивании при 15°С, и смесь перемешивают при 15°С в течение 16 часов. Смесь обрабатывают водой (300 мл) и экстрагируют EtOAc (300 мл). Органический слой промывают насыщ. водным Na2CO3 (2 х 150 мл) и раствором соли (100 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют. Остаток растирают с EtOAc/ПЭ (об./об.=1:5, 100 мл). Полученное твердое вещество собирают фильтрованием и сушат, с получением указанного в заголовке соединения (15 г, 72%). 1H ЯМР (400 МГц, CDCl3) δ 8,52 (д, 1H), 7,13 (ушд, 2H), 2,35 (с, 3H), 2,25 (с, 3H)
Пример получения 64: N -(4-амино-2-метил-5-нитрофенил)ацетамид
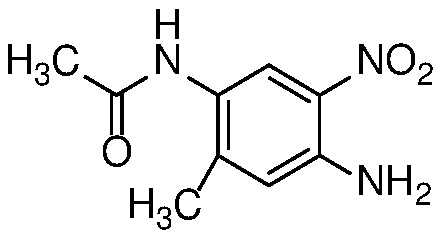
Раствор из Примера получения 63 (15 г, 70,7 ммоль) в EtOH (300 мл) обрабатывают конц. NH4OH (198 г) при 30°С и смесь перемешивают при 50°С в течение 16 часов. Добавляют еще конц. NH4OH (140 г) и смесь перемешивают при 50°С в течение 16 часов. Добавляют еще конц. NH4OH (46 г) и смесь перемешивают при 60°С в течение 16 часов. Смесь концентрируют, и твердые вещества собирают фильтрованием. Твердые вещества промывают водой (3× 10 мл) и сушат, с получением указанного в заголовке соединения (14,0 г, 95%). 1H ЯМР (400 МГц, CD3OD) δ 7,97 (с, 1H), 6,81 (с, 1H), 2,19 (с, 3H), 2,13 (с, 3H)
Пример получения 63: N -(4,5-диамино-2-метилфенил)ацетамид
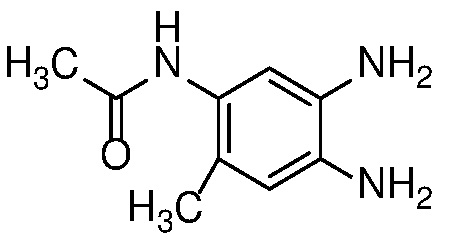
Суспензию примера получения 64 (2,50 г, 11,95 ммоль) в EtOH (50 мл) добавляют к суспензии 10% Pd/C (500 мг) в EtOH (10 мл). Смесь дегазируют и трижды снова заполняют Н2, и реакционную смесь перемешивают при 15°С в атмосфере Н2 (1 атм) в течение 16 часов. Смесь фильтруют, и фильтрат концентрируют с получением указанного в заголовке соединения 65 (2,2 г, 103%). ЖХ/МС m/z (М+Н)+=180,1.
Пример получения 66: N -(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)ацетамид
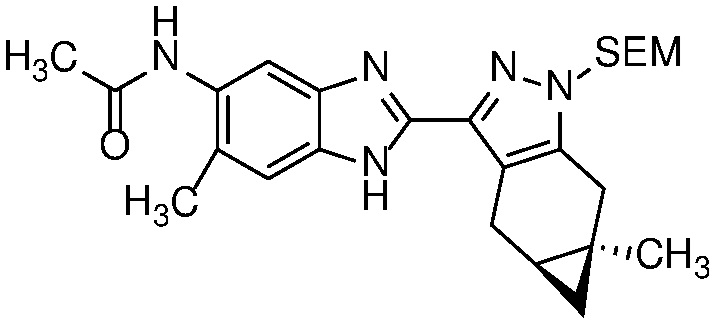
Раствор из Примера получения 65 (2,20 г, 12,28 ммоль) в ДМФ (40 мл) обрабатывают Na2S2O5 (1,17 г, 6,14 ммоль), ДМСО (2,18 мл, 30,7 ммоль) и 9 (3,76 г, 12,3 ммоль) в ДМФ (20 мл). Смесь перемешивают при 100°С в течение 16 часов. Смесь концентрируют, и неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%, затем MeOH/ДХМ 0-10%), с получением указанного в заголовке соединения 66 (5,3 г, 92%). ЖХ/МС m/z (М+Н)+=466,2.
Пример получения 67: N- этил-6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 H -бензо[d]имидазол-5-амин
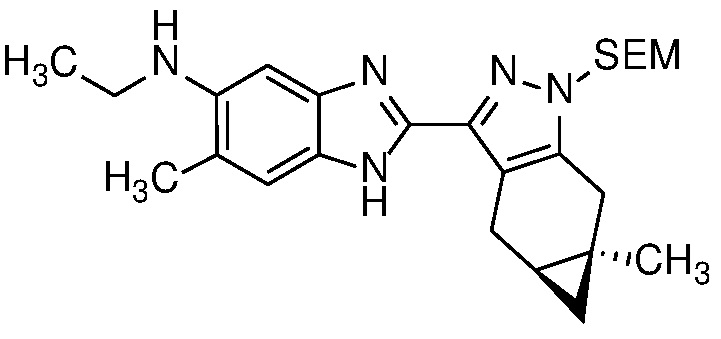
Суспензию LiAlH4 (326 мг, 8,59 ммоль) в ТГФ (33 мл) при 0°С обрабатывают раствором из Примера получения 66 (2 г, 4,3 ммоль) в ТГФ (10 мл) и перемешивают при 20°С в течение 72 часов. Смесь обрабатывают Na2SO4-H2O, и затем MgSO4 (4 г). Смесь перемешивают в течение 30 мин. Смесь разбавляют EtOAc (20 мл) и фильтруют. Фильтрат концентрируют и остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), с получением указанного в заголовке соединения (1,03 г, 53%). 1H ЯМР (400 МГц, CDCl3) δ 9,55 (с, 1H), 7,51 (с, 1H), 7,10 (д, 1H), 6,57 (с, 1H), 5,43-5,27 (м, 2H), 3,60-3,50 (м, 3H), 3,28-3,13 (м, 3H), 3,09 (д, 1H), 2,72 (д, 1H), 2,25 (с, 3H), 1,35 (т, 3H), 1,28 (с, 3H), 1,14 (дт, 1Н), 0,96-0,84 (м, 2Н), 0,39 (дд, 1Н), 0,28 (т, 1Н), -0,03 (с, 9Н); ЖХ/МС m/z (М+Н)+=452,3.
Пример получения 68: (4aS,5aR)-5,5-дифтор-5а-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбоновая кислота

Раствор из Примера получения 15 (1,0 г, 3,90 ммоль) в MeOH (12 мл) и воде (2,0 мл) при 20°С обрабатывают NaOH (468 мг, 11,7 ммоль). Через 32 часа смесь концентрируют и остаток разбавляют H2O (10 мл) и pH доводят до 4-5 с помощью 1M HCl. Полученную суспензию фильтруют для сбора твердых веществ. Твердые вещества сушат, с получением указанного в заголовке соединения (900 мг, 100%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,03 (ушс, 2H), 3,16 (д, 1H), 3,03-2,97 (м, 3H), 2,76 (дд, 1H), 1,75 (д, 1H), 1,33 (д, 3Н); ЖХ/МС m/z (М+Н)+=228,8.
Пример получения 69: (4aS,5aR)-3-(5-бром-7-фтор-1 H- бензо[d]имидазол-2-ил)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
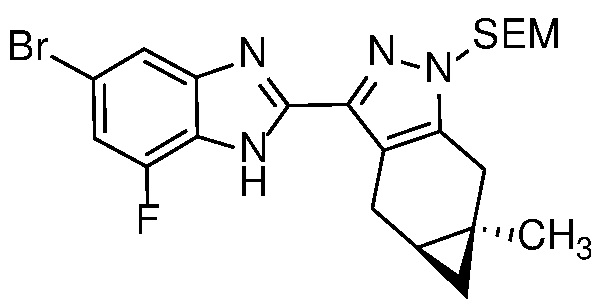
Раствор из Примера получения 9 (510 мг, 1,66 ммоль) в ДМФ (20,8 мл) обрабатывают 5-бром-3-фторбензол-1,2-диамином (358 мг, 1,75 ммоль) и Na2S2O5 (380 мг, 2,00 ммоль) при комнатной температуре. Флакон герметично закрывают и нагревают в микроволновом реакторе при 150°С в течение 2 часов. Смесь выливают в 3% водн. LiCl (40 мл) и смесь экстрагируют EtOAc (2× 40 мл). Органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-25%), с получением указанного в заголовке соединения (815 г, 98%). 1H ЯМР (400 МГц, CD3OD) δ 7,50 (с, 1H), 7,23-7,07 (м, 1H), 5,52-5,41 (м, 2H), 3,61 (т, 2H), 3,42-3,32 (м, 2H), 1H), 3,25-3,07 (м, 2H), 2,81-2,72 (м, 1H), 1,30 (с, 3H), 1,26-1,13 (м, 2H), 0,88 (тд, 2H), 0,44 (дд, 1H), 0,25 (т, 1Н), -0,04 (с, 9Н); ЖХ/МС m/z (M+Na)+=514,7 (79Br).
Пример получения 70: (4aS,5aR)-3-(5-бром-7-фтор-1 H- бензо[d]имидазол-2-ил)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол
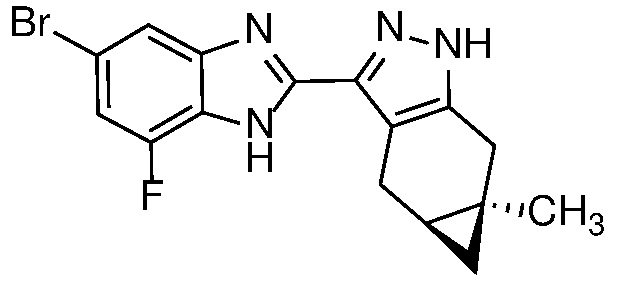
Раствор из Примера получения 69 (100 мг, 0,20 ммоль) в ТФК (2 мл) при 10°С обрабатывают Et3SiH (118 мг, 1,02 ммоль). Смесь перемешивают при 10°С в течение 3 часов. Смесь концентрируют, и остаток обрабатывают насыщ. водным Na2CO3. Смесь экстрагируют EtOAc (3× 15 мл). Органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией [препаративная ВЭЖХ, H2O:MeCN (в/0,05% NH4OH)] с получением указанного в заголовке соединения (27,1 мг, 37%). 1H ЯМР (400 МГц, CD3OD) δ 7,53 (с, 1H), 7,16 (д, 1H), 3,36-3,31 (м, 1H), 3,13 (дд, 1H), 3,06 (д, 1H), 2,77 (д, 1Н), 1,29 (с, 3Н), 1,20-1,09 (м, 1Н), 0,41 (дд, 1Н), 0,24 (т, 1Н); ЖХ/МС m/z (M+H) +=363,0 (79Br).
Пример получения 71a: (4aS,5aR)-3-(6-бром-4-фтор-1-((2-(триметилсилил)этокси)метил)-1 H -бензо[d]имидазол-2-ил)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
Пример получения 71b: (4aS,5aR)-3-(5-бром-7-фтор-1-((2-(триметилсилил)этокси)метил)-1 H -бензо[d]имидазол-2-ил)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
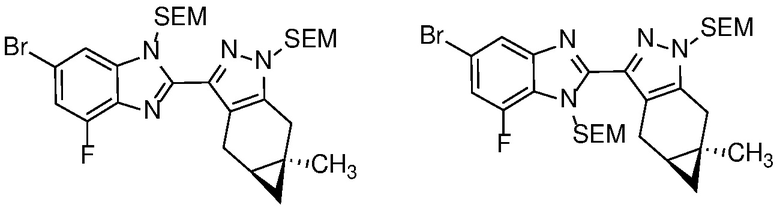
Раствор из Примера получения 70 (1,53 г, 3,11 ммоль) в ТГФ (39 мл) при 0°С обрабатывают NaH (149 мг, 3,73 ммоль). После перемешивания в течение 30 минут добавляют SEM-Cl (570 мг, 3,42 ммоль) и смесь перемешивают в течение 2 часов при 10°С. Смесь обрабатывают насыщ. водным NH4Cl (30 мл). Смесь экстрагируют EtOAc (3× 40 мл) и органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-15%), получая указанные в заголовке соединения в виде смеси (1,60 г, 83%). 1H ЯМР (400 МГц, CD3OD) δ 7,69 (дд, 1H), 7,26 (ддд, 1H), 6,24-5,97 (м, 2H), 5,53-5,46 (м, 2H), 4,10 (к, 1H), 3,63 (дд, 2H), 3,53-3,36 (м, 2H), 3,28-3,17 (м, 2H), 3,16-3,03 (м, 1H), 2,78 (д, 1H), 1,31 (с, 3H), 1,24 (т, 1H), 1,15 (дт, 1H), 0,92 (тд, 2H), 0,76 (дт, 2H), 0,48-0,39 (м, 1H), 0,24 (тд, 1H), -0,01 (с, 9H), -0,18 (с, 9H); ЖХ/МС m/z (M+H)+=622,8 (79Br).
Пример получения 72a: трет -бутил(4-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-ил)карбамат
Пример получения 72b: трет -бутил(7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)карбамат
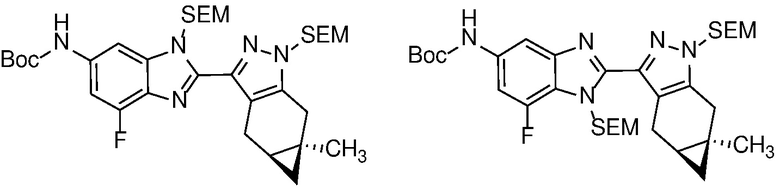
Часть смеси из Примеров получения 71а и 71b (712 мг, 1,15 ммоль), трет-бутилкарбамат (161 мг, 1,37 ммоль), Cs2CO3 (746 мг, 2,29 ммоль) в трет-амиловом спирте (11,5 мл) обрабатывают Pd2(dba)3 (105 мг, 0,12 ммоль) и трет-BuDavePhos (78 мг, 0,23 ммоль). Реакционную смесь нагревают при 100°С в течение 23 часов. Смесь концентрируют, и неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), получая указанные в заголовке соединения в виде смеси (706 мг, 93%). 1H ЯМР (400 МГц, CD3OD) δ 7,72 (с, 1H), 7,40-7,21 (м, 1H), 7,07 (д, 1H), 6,08-5,89 (м, 2H), 5,48 (д, 2H), δ 3,69-3,57 (м, 2H), 3,46 (дд, 1H), 3,25-3,02 (м, 3H), 2,78 (д, 1H), 2,50 (д, 1H), 1,55 (с, 9H), 1,43 (д, 1Н), 1,33-1,23 (м, 5Н), 1,20-1,09 (м, 2Н), 0,99-0,83 (м, 5Н), 0,82-0,69 (м, 1Н), 0,42 (дд, 1Н), 0,25 (т, 1Н), -0,00 (с, 9Н), -0,13 (с, 9Н); ЖХ/МС m/z (M+H)+=658,0
Пример получения 73a: трет -бутил(4-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-ил)(метил)карбамат
Пример получения 73b: трет -бутил(7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)(метил)карбамат
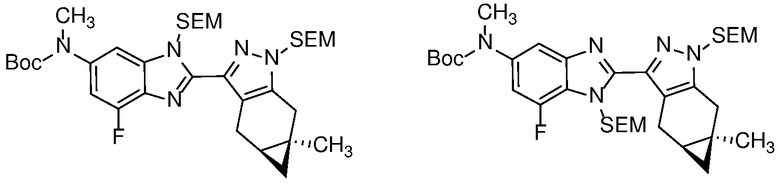
Часть смеси из примеров получения 72a и 72b (235 мг, 0,36 ммоль) в ТГФ (5 мл) при 0°С обрабатывают NaH (21,4 мг, 0,54 ммоль). Смесь перемешивают при 15°С в течение 30 мин и обрабатывают йодидом метила (61 мг, 0,43 ммоль). Смесь перемешивают в течение 16 ч и обрабатывают насыщ. водным NH4Cl (15 мл). Смесь экстрагируют EtOAc (2× 20 мл). Органические экстракты собирают, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-30%), получая указанные в заголовке соединения в виде смеси (120 мг, 50%). 1H ЯМР (400 МГц, CD3OD) δ 7,39 (д, 1H), 7,01 (дд, 1H), 6,16-5,95 (м, 2H), 5,50 (д, 2H), 3,68-3,56 (м, 2H), 3,46 (т, 2H), 3,27-3,05 (м, 4H), 2,79 (д, 1H), 1,46 (с, 9H), 1,31 (с, 3H), 1,18-1,13 (м, 1H), 0,97-0,85 (м, 2H), 0,82-0,71 (м, 2H), 0,43 (дд, 1H), 0,26 (т, 1H), -0,00 (с, 9H), -0,14 (с, 9H); ЖХ/МС m/z (M+Na)+=694,0.
Пример получения 74a: 4-фтор- N- метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-амин
Пример получения 74b: 7-фтор- N- метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-амин
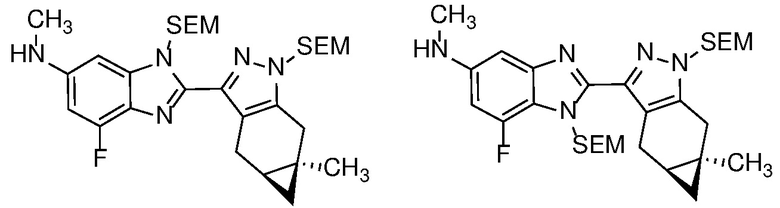
Смесь примеров получения 73a и 73b (120 мг, 0,178 ммоль) в ДХМ (2,0 мл) при 0°С обрабатывают ZnBr2 (201 мг, 0,89 ммоль). Смесь перемешивают в течение 12 ч, затем обрабатывают насыщ. водным NaHCO3 (10 мл) и смесь экстрагируют ДХМ (2× 20 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют с получением указанных в заголовке соединений в виде смеси (111 мг, 109%). 1H ЯМР (400 МГц, CD3OD) δ 6,51 (д, 1H), 6,43 (дд, 1H), 5,97 (д, 1H), 5,86 (д, 1H), 5,47 (с, 2H), 3,62 (т, 2H), 3,41 (т, 2H), 3,25-3,03 (м, 3H)), 2,84 (с, 3H), 2,82-2,75 (м, 1H), 1,30 (с, 3H), 1,17-1,10 (м, 1H), 0,92 (дд, 2H), 0,77 (т, 2H), 0,41 (дд, 1H), 0,25 (т, 1H), -0,00 (с, 9H), -0,13 (с, 9H); ЖХ/МС m/z (M+Na)+=594,0.
Пример получения 75a: трет -бутилэтил(4-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-ил)карбамат
Пример получения 75b: трет -бутилэтил(7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)карбамат
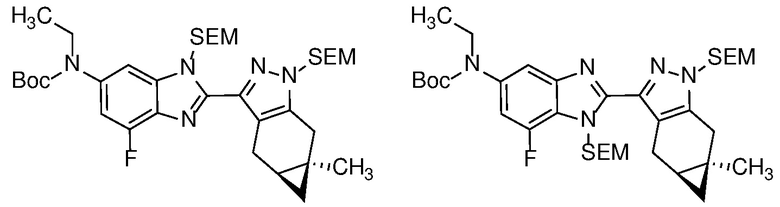
Смесь примеров получения 72a и 72b (10,5 г, 16,0 ммоль) в ТГФ (160 мл) при 0°С обрабатывают NaH (1,27 г, 31,9 ммоль). Смесь перемешивают в течение 30 минут и обрабатывают этилиодидом (3,30 г, 21 ммоль), и смесь перемешивают в течение 16 часов. Смесь обрабатывают насыщ. водным NH4Cl (150 мл). Смесь экстрагируют EtOAc (2 х 200 мл) и органические слои объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-10%), получая указанные в заголовке соединения в виде смеси (8,26 г, 75%). ЖХ/МС m/z (М+Н)+=453,3.
Пример получения 76a: N-этил-4-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-амин
Пример получения 76b: N-этил-7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-амин
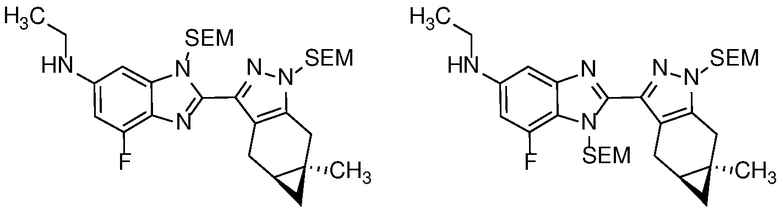
Смесь примеров получения 75a и 75b (10,39 г, 15,14 ммоль) в ДХМ (151 мл) при 0°С обрабатывают ZnBr2 (17,1 г, 75,7 ммоль). Реакционную смесь нагревают до 30°С и перемешивают в течение 16 часов. Смесь выливают в насыщенный раствор NaHCO3 (150 мл) и фильтруют. Фильтрат экстрагируют ДХМ (2 х 100 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-10%), что дает указанные в заголовке соединения в виде смеси (6,14 г, 69,2%). ЖХ/МС m/z (М+Н)= 586,2.
Пример получения 77: (4aS,5aR)-3-(5-бром-6-фтор-1 H- бензо[d]имидазол-2-ил)-5a-метил-1-((2-(триметилсилил)этокси) метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
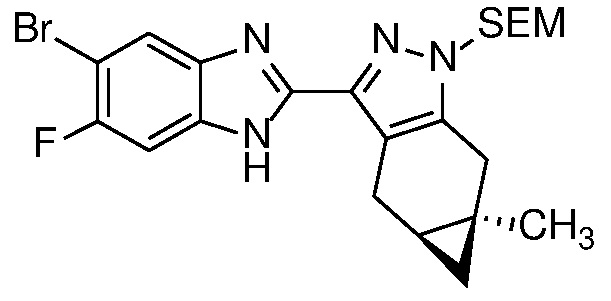
Раствор из Примера получения 9 (467 мг, 1,52 ммоль) в ДМФ (19 мл) обрабатывают 4-бром-5-фторбензол-1,2-диамином (328 мг, 1,60 ммоль) и Na2S2O5 (380 мг, 2,00 ммоль) при КТ. Флакон герметично закрывают и нагревают в микроволновом реакторе при 150°С в течение 2 часов. Смесь выливают в 3% водн. LiCl (80 мл) и экстрагируют EtOAc (2× 60 мл). Органические слои объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-25%), с получением указанного в заголовке соединения (644 мг, 86%). 1H ЯМР (400 МГц, CDCl3) δ 9,96 (с, 1H), 7,98 (с, 1H), 7,57 (с, 1H), 5,46-5,28 (м, 2H), 3,58-3,49 (м, 2H), 3,20-3,07 (м, 3H), 2,74 (д, 1H), 1,29 (с, 3H), 1,21-1,10 (м, 1H), 0,95-0,83 (м, 2H), 0,43 (дд, 1H), 0,27 (т, 1Н), -0,02 (с, 9Н).
Пример получения 78a: трет -бутил(6-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H -бензо[d]имидазол-5-ил)карбамат
Пример получения 78b: трет -бутил(5-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H -бензо[d]имидазол-6-ил)карбамат
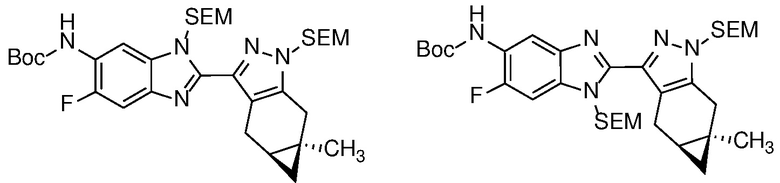
Смесь примеров получения 77 (800 мг, 1,29 ммоль), трет-бутилкарбамата (181 мг, 1,54 ммоль) и Cs2CO3 (838 мг, 2,57 ммоль) в трет-амиловом спирте (12,9 мл) обрабатывают Pd2(dba)3 (59 мг, 0,64 ммоль) и (88 мг, 0,26 ммоль). Смесь нагревают до 100°С в течение 16 часов. Добавляют дополнительное количество Pd2(dba)3 (59 мг, 0,64 ммоль) и (88 мг, 0,26 ммоль) и продолжают нагревание при 100°С в течение 16 часов. Смесь концентрируют и остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), получая указанные в заголовке соединения в виде смеси (480 мг, 57%). 1H ЯМР (400 МГц, CDCl3) δ 8,34 (д, 1H), 7,49 (т, 1H), 6,82 (с, 1H), 6,15-5,97 (м, 2H), 5,47-5,34 (м, 2H), 3,62-3,37 (м, 5Н), 3,10 (т, 2Н), 2,73 (д, 1Н), 1,55 (с, 9Н), 1,28 (с, 3Н), 1,12 (с, 1Н), 0,99-0,77 (м, 4H), 0,39 (дд, 1H), 0,26 (кв, 1H), -0,02 (с, 9H), -0,13 (д, 9H); ЖХ/МС m/z (M+H)+=658,3
Пример получения 79a: трет -бутил(6-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1 H-бензо[d]имидазол-5-ил)(метил)карбамат
Пример получения 79b трет -бутил(5-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1 H-бензо[d]имидазол-6-ил)(метил)карбамат
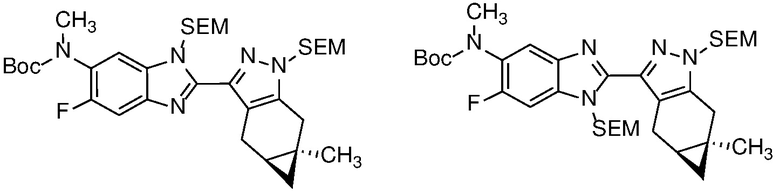
Часть смеси из примеров получения 78a и 78b (230 мг, 0,35 ммоль) в ТГФ (4,6 мл) при 0°С обрабатывают NaH (21,0 мг, 0,52 ммоль). Смесь перемешивают при 15°С в течение 20 мин и затем обрабатывают метилиодидом (124 мг, 0,87 ммоль). После перемешивания в течение 16 часов, смесь разбавляют насыщ. водным NH4Cl (2 мл) и экстрагируют EtOAc (2× 10 мл). Органические экстракты собирают, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-30%), получая указанные в заголовке соединения в виде смеси (286 мг, 100%). 1H ЯМР (400 МГц, CDCl3) δ 7,63 (с, 0,5H), 7,51 (д, 0,5H), 7,40 (с, 1H), 6,10 (д, 2H), 5,50-5,37 (м, 2H), 3,64-3,53 (м, 2H), 3,56-3,43 (м, 3H), 3,28 (д, 3H), 3,20-3,07 (м, 2H), 2,76 (д, 1H), 1,38 (с, 7H), 1,30 (д, 5Н), 1,15 (дт, 1Н), 0,98-0,81 (м, 4Н), 0,42 (дд, 1Н), 0,29 (т, 1Н), 0,01 (с, 9Н), -0,09 (д, 9Н); ЖХ/МС m/z (M+H) +=672,5.
Пример получения 80a: 5-фтор-N-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1 H-бензо[d]имидазол-6-амин
Пример получения 80b: 6-фтор-N-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1 H-бензо[d]имидазол-5-амин
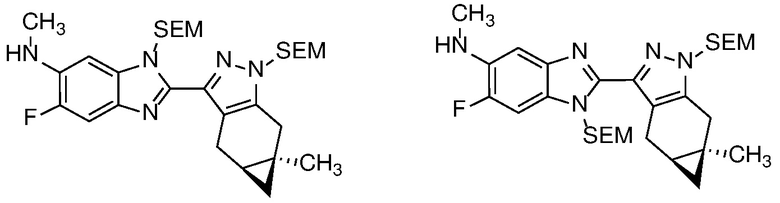
Смесь из примеров получения 79а и 79b (286 мг, 0,425 ммоль) в ДХМ (4,26 мл) при 0°С обрабатывают ZnBr2 (479 мг, 2,13 ммоль). После перемешивания при 15°С в течение 12 ч смесь выливают в насыщ. водный NaHCO3 (20 мл), и полученную смесь экстрагируют ДХМ (2× 20 мл). Органические экстракты собирают, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-40%), получая указанные в заголовке соединения в виде смеси (160 мг, 66%). 1H ЯМР (400 МГц, CDCl3) δ 7,41 (д, 0,57H), 7,21 (д, 0,43H), 7,07 (д, 0,43H), 6,73 (д, 0,57H), 6,06 (д, 1H), 6,07-5,95 (м, 1H), 5,46-5,34 (м, 2H), 4,05 (с, 1H), 3,61-3,37 (м, 5H), 3,09 (т, 2H), 2,94 (д, 3H), 2,73 (д, 1Н), 1,30-1,22 (м, 3Н), 1,11 (д, 1Н), 0,91 (т, 2Н), 0,85-0,80 (м, 2Н), 0,38 (дд, 1Н), 0,26 (т, 1Н), -0,02 (д, 9Н), -0,12 (с, 9Н); 19F ЯМР (376 МГц, CD3OD) δ -131,20; ЖХ/МС m/z (M+H) +=572.
Пример получения 81: 4-фтор-2-метокси-5-нитроанилин
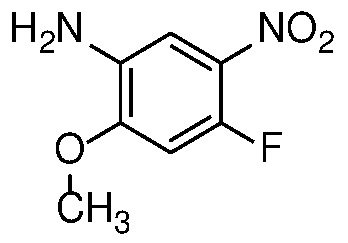
Раствор 4-фтор-2-метоксианилина (1590 мг, 11,27 ммоль) в конц. H2SO4 (9,55 мл) обрабатывают твердым KNO3 (1140 мг, 11,3 ммоль) порциями, поддерживая внутреннюю температуру ниже 5°С. Полученную смесь перемешивают в течение 2 ч при 0°С и выливают в воду со льдом (100 мл), медленно нейтрализуют твердым Na2CO3 и экстрагируют EtOAc (2× 60 мл). Органические слои сушат (Na2SO4), фильтруют и концентрируют, с получением указанного в заголовке соединения (2 г, 95%). 1H ЯМР (400 МГц, CDCl3) δ 7,42 (д, 1H), 6,66 (д, 1H), 3,96 (с, 3H), 1,60 (с, 2H); ЖХ/МС m/z (М+Н)+ =186,8.
Пример получения 82: (S)- N -(4-фтор-2-метокси-5-нитрофенил)-2-морфолинопропанамид
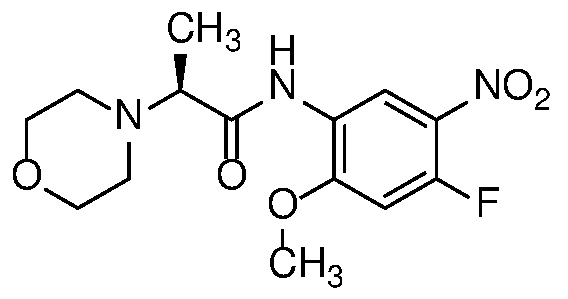
Раствор из Примера получения 81 (590 мг, 3,17 ммоль) и примера получения 19 (605 мг, 3,80 ммоль) в пиридине (45,3 мл) обрабатывают EDCI (1,22 г, 6,34 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов и затем выливают в воду (30 мл). Полученную смесь экстрагируют EtOAc (2× 40 мл). Органические слои объединяют, последовательно промывают насыщ. водным NH4Cl и раствором соли, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), с получением указанного в заголовке соединения (586 мг, 77%). 1H ЯМР (400 МГц, CDCl3) δ 9,94 (с, 1H), 9,19 (д, 1H), 6,75 (д, 1H), 4,02 (с, 3H), 3,86-3,72 (м, 4H), 3,26 (кв, 1Н), 2,70-2,53 (м, 4Н), 1,34 (д, 3Н). 19F ЯМР (376 МГц, CDCl3) δ -118,16. ЖХ/МС m/z (М+Н)= 328,1; Способ СЖХ: Chiral Tech AD-3 150 мм × 4,6 мм × 3 мкм, CO2/ИПС (0,05% iPr2NEt), изократный 40%, 2,5 мл/мин, температура колонки 40°С, ВУ=4,027 мин (99,31%)
Пример получения 83: (S)- N -(4-фтор-2-метокси-5-нитрофенил)- N- метил-2-морфолинопропанамид
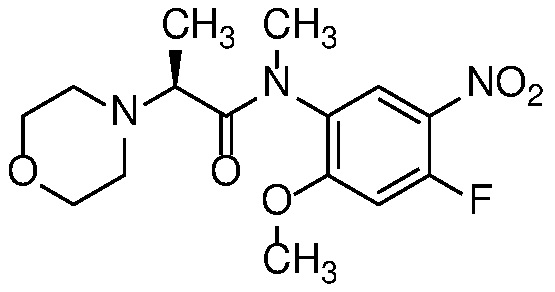
Смесь из примера получения 82 (586 мг, 1,79 ммоль) в ТГФ (25 мл) при 0°С обрабатывают NaH (107 мг, 2,69 ммоль). Смесь перемешивают при 20°С в течение 30 мин и обрабатывают метилиодидом (305 мг, 2,15 ммоль). После перемешивания в течение 16 часов, смесь разбавляют насыщ. водным NH4Cl (2 мл) и экстрагируют EtOAc (2х20 мл). Органические экстракты собирают, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (423 мг, 69%). 1H ЯМР (400 МГц, CDCl3) δ 8,30 (д, 0,5H), 7,98 (д, 0,5H), 6,86 (дд, 1H), 4,03-3,93 (м, 3H), 3,65 (т, 2H), 3,60-3,46 (м, 2H), 3,21-3,12 (м, 4H), 3,02-2,92 (м, 0,5H), 2,55 (дт, 1H), 2,48-2,37 (м, 0,5H), 2,24 (дп, 2H), 1,18 (д, 1Н), 1,11 (д, 2Н); ЖХ/МС m/z (М+Н)= 429,1.
Пример получения 84: (S)- N -(4,5-диамино-2-метоксифенил)-N-метил-2-морфолинопропанамид
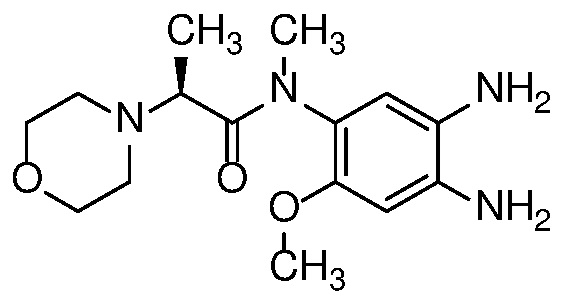
Смесь из примера получения 83 (400 мг, 0,934 ммоль) в MeOH (10 мл) обрабатывают 10% Pd/C (100 мг) и MeOH (5 мл). Смесь дегазируют и повторно заполняют аргоном и Н2 три раза, и затем перемешивают в атмосфере Н2 (3 атм.) при 25°С в течение 24 часов. Добавляют дополнительно 10% Pd/C (100 мг) и смесь перемешивают в атмосфере H2 (3 атм) при 25°С в течение дополнительных 24 часов. Реакционную смесь фильтруют, и фильтрат концентрируют. Неочищенный продукт очищают хроматографией (диоксид кремния, МеОН/ДХМ=0-10%), с получением указанного в заголовке соединения (239 мг, 83%). 1H ЯМР (400 МГц, CDCl3) δ 7,41-7,29 (м, 3H), 6,60 (с, 1H), 6,35 (д, 1H), 4,46 (д, 1H), 3,74 (д, 3H), 3,72-3,60 (м, 4Н), 3,18-3,12 (м, 4Н), 2,63-2,52 (м, 1Н), 2,51-2,39 (м, 3Н), 1,19 (д, 1Н), 1,14 (д, 2Н); ЖХ/МС m/z (М+Н)= 309,2.
Пример получения 85: (S)- N -(6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
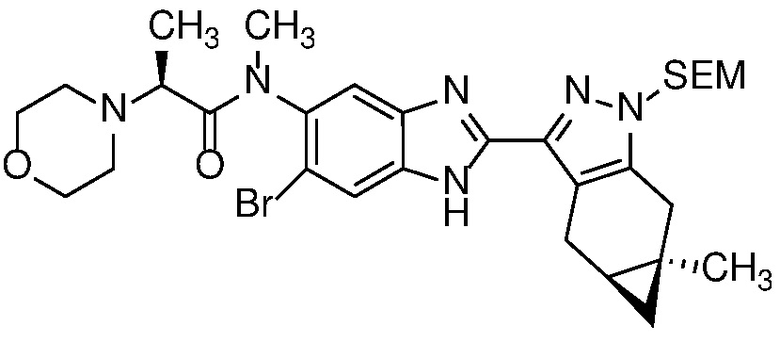
Смесь из примера получения 40 (900 мг, 2,52 ммоль) в ДМФ (30 мл) при 20°С обрабатывают соединением 9 (722 мг, 2,52 ммоль) и Na2S2O5 (479 мг, 2,52 ммоль). Смесь нагревают при 110°С в течение 15 ч и концентрируют. Неочищенный продукт очищают хроматографией (диоксид кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (703 мг, 43,4%). ЖХ/МС m/z (M+H) +=643,2/645,2 (79Br, 81Br).
Пример получения 86a: (S)- N -(6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
Пример получения 86a: (S)- N -(6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
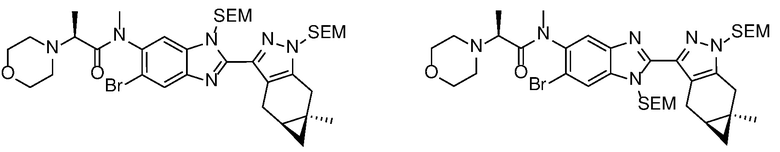
Раствор из Примера получения 85 (600 мг, 0,93 ммоль) в ТГФ (30 мл) при 0°С обрабатывают NaH (48,5 мг, 1,21 ммоль). После перемешивания в течение 30 минут добавляют SEM-Cl (233 мг, 1,40 ммоль) и смесь перемешивают при 20°С в течение 2 часов. Смесь обрабатывают насыщ. водным NH4Cl (1 мл) и разбавляют 3:1 EtOAc/H2O (200 мл). Органический слой собирают, а водный слой экстрагируют EtOAc (150 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), получая указанные в заголовке соединения в виде смеси (705 мг, 98%). ЖХ/МС m/z (M+H) +=773,0/775,0 (79Br, 81Br).
Пример получения 87a: (S)- N -(6-циано-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
Пример получения 87b: (S)- N -(6-циано-1-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
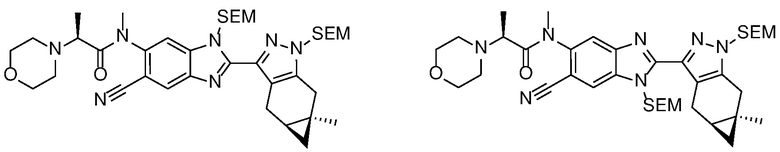
Часть смеси примеров получения 86a и 86b (200 мг, 0,258 ммоль) в NMP (10 мл) при 20°С обрабатывают Pd(PPh3)4 (30,0 мг, 0,026 ммоль) и Zn(CN)2 (152 мг, 1,29 ммоль). Полученную смесь нагревают в микроволновом реакторе при 160°С в течение 1,5 часов. Смесь выливают в EtOAc/H2O (50/10 мл) и собирают органический слой. Водный слой экстрагируют EtOAc (50 мл). Органические экстракты объединяют, промывают солевым раствором, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), получая указанные в заголовке соединения в виде смеси (165 мг, 89%). ЖХ/МС m/z (М+Н)+=720,3.
Пример получения 88. 4-бром-2,3-дифтор-6-нитроанилин.
Раствор 2,3-дифтор-6-нитроанилина (10,0 г, 57,4 ммоль) в ДМФ (230 мл) при 15°С обрабатывают N-бромсукцинимидом (12,3 г, 68,9 ммоль). Смесь нагревают при 90°С в течение 6 ч, затем охлаждают до комнатной температуры и выливают в воду со льдом. Смесь экстрагируют EtOAc (2х100 мл) и органические экстракты объединяют, промывают солевым раствором и сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), с получением указанного в заголовке соединения (13,5 г, 93%). 1H ЯМР (400 МГц, CDCl3) δ 8,22 (дд, 1H), 6,24 (с, 2H).
Пример получения 89: 5-бром-3,4-дифторбензол-1,2-диамина
Раствор из Примера получения 88 (13,5 г, 53,4 ммоль) в EtOH (296 мл) при 20°С обрабатывают SnCl2 (48,2 г, 213 ммоль). Смесь нагревают при 70°С в течение 16 ч и затем охлаждают до КТ. Смесь разбавляют H2O (200 мл) и промывают насыщ. водным NaHCO3 (200 мл). Смесь фильтруют, и собранные твердые вещества промывают EtOAc (100 мл). Фильтрат концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-60%), с получением указанного в заголовке соединения (8,50 г, 71,4%). 1H ЯМР (400 МГц, CDCl3) δ 6,63 (дд, 1H), 3,49 (с, 2H), 3,35 (с, 2H); ЖХ/МС m/z (M+H)+=223,1/225,0 (79Br, 81Br).
Пример получения 90: (4aS,5aR)-3-(5-бром-6,7-дифтор-1 H- бензо[d]имидазол-2-ил)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
Раствор из Примера получения 89 (5,0 г, 22,42 ммоль) в ДМФ (112 мл) при комнатной температуре обрабатывают примером получения 9 (6,87 г, 22,4 ммоль), Na2S2O5 (2,13 г, 11,2 ммоль) и ДМСО (4,38 г, 56,0 ммоль). Реакционную смесь нагревают при 110°С в течение 16 часов. Смесь выливают в 3% водн. LiCl (100 мл) и экстрагируют EtOAc (2× 80 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), с получением указанного в заголовке соединения (10,17 г, 89%). ЖХ/МС m/z (М+Н)= 509,3/511,3 (79Br, 81Br).
Пример получения 91a: (4aS,5aR)-3-(6-бром-4,5-дифтор-1-((2-(триметилсилил)этокси)метил)- 1Н- бензо[d]имидазол-2-ил)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
Пример получения 91b: (4aS,5aR)-3-(5-бром-6,7-дифтор-1-((2-(триметилсилил)этокси)метил)- 1Н- бензо[d]имидазол-2-ил)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
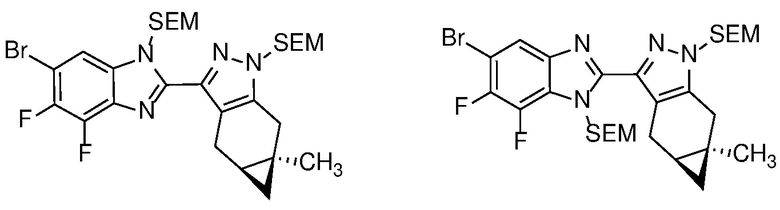
В раствор из Примера получения 90 (10,95 г, 2,49 ммоль) в ТГФ (269 мл) при 0°С добавляют NaH (1,29 г, 32,2 ммоль). После перемешивания в течение 30 минут добавляют SEM-Cl (3,94 г, 23,6 ммоль) и смесь перемешивают в течение 3 часов при комнатной температуре. Смесь выливают в насыщ. водный NH4Cl (150 мл) и экстрагируют EtOAc (2× 100 мл). Органические экстракты собирают, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), получая указанные в заголовке соединения в виде смеси (12,49 г, 90,8%). 1H ЯМР (400 МГц, метанол-d4) δ 7,74 (ддд, 1H), 6,26-5,99 (м, 2H), 5,49 (д, 2H), 3,63 (т, 2H), 3,45 (дт, 2H), 3,23 (дд, 2H), 3,08 (тд, 1H), 2,78 (дд, 1H), 1,31 (с, 3H), 1,15 (дт, 1H), 0,91 (тд, 2H), 0,77 (ддд, 2H), 0,43 (дд, 1Н), 0,24 (к, 1Н), -0,01 (д, 9Н), -0,14 (с, 4Н), -0,17 (с, 5Н).
Пример получения 92а: трет -бутил(4,5-дифтор-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-ил)карбамат
Пример получения 92b: трет -бутил(6,7-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)карбамат
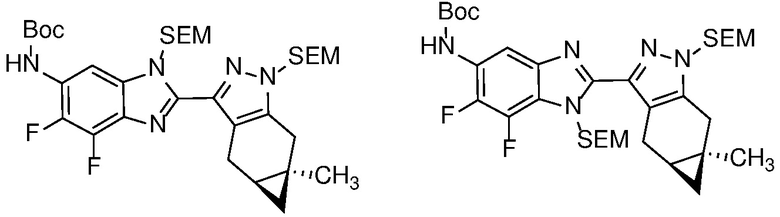
Часть смеси примеров получения 91a и 91b (9,45 г, 14,7 ммоль) в трет-амиловом спирте (148 мл) при КТ обрабатывают трет-бутилкарбаматом (2,60 г, 22,2 ммоль), Cs2CO3 (9,63 г, 29,5 ммоль), Pd2(dba)3 (1,35 г, 1,48 ммоль) и (1,01 г, 2,95 ммоль). Смесь нагревают при 100°С в течение 16 часов. Смесь концентрируют, и остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-16%), получая указанные в заголовке соединения в виде смеси (4,24 г, 43%). ЖХ/МС m/z (М+Н)= 676,3.
Пример получения 93a: 4,5-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопроп[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-амин
Пример получения 93b: 6,7-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопроп[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-амин
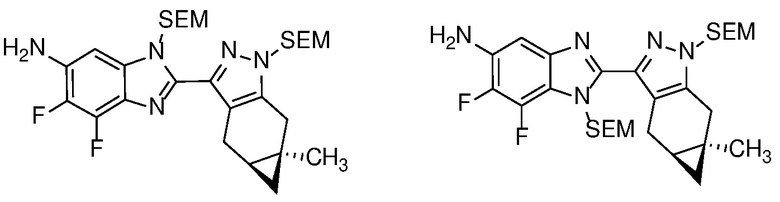
Смесь 92a и 92b (5,27 г, 7,79 ммоль) в ДХМ (78,0 мл) при 0°С обрабатывают ZnBr2 (8,78 г, 39,0 ммоль). Смесь перемешивают при 15°С в течение 12 ч и выливают в насыщ. водный NaHCO3 (70 мл). Смесь экстрагируют ДХМ (2× 80 мл) и органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-25%, затем MeOH/EtOAc=0-15%) с получением указанных в заголовке соединений в виде смеси (2,8 г, 62,4%). ЖХ/МС m/z (М+Н)+=576,3.
Пример получения 94a: (S)- N -(4,5-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-ил)-2-морфолинопропанамид
Пример получения 94b: (S)- N -(6,7-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
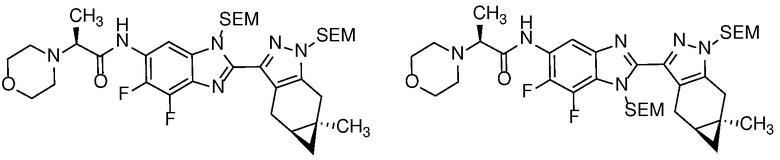
Смесь примеров получения 93a и 93b (2,80 г, 4,86 ммоль) в пиридине (69,5 мл) при 0°С обрабатывают примером получения 19 (1,12 г, 7,05 ммоль) и EDCI (1,86 г, 9,72 ммоль). Смесь перемешивают при комнатной температуре в течение 19 ч, разбавляют H2O (100 мл) и экстрагируют EtOAc (2× 100 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-25%), получая указанные в заголовке соединения в виде смеси (3,07 г, 88,1%). ЖХ/МС m/z (М+Н)= 717,6.
Пример получения 95a: (S)- N -(4,5-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид
Пример получения 95b: (S)- N -(6,7-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
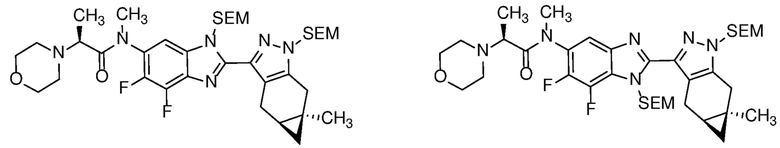
Раствор смеси примеров получения 94a и 94b (3,07 г, 4,28 ммоль) в ТГФ (61 мл) при 0°С обрабатывают NaH (257 мг, 6,42 ммоль). После перемешивания в течение 30 минут при 15°С добавляют метилйодид (729 мг, 5,14 ммоль) и смесь перемешивают при комнатной температуре в течение 3 часов. Смесь разбавляют насыщ. водным NH4Cl (80 мл) и экстрагируют EtOAc (2 х 80 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), получая указанные в заголовке соединения в виде смеси (3,26 г, 100%). ЖХ/МС m/z (М+Н)= 731,4.
Пример получения 96a: (S)- N -(4,5-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-ил)- N- этил-2-морфолинопропанамид
Пример получения 96b: (S)- N -(6,7-дифтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)- N- этил-2-морфолинопропанамид
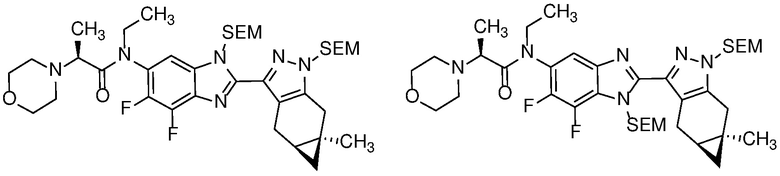
Раствор части смеси примеров получения 94a и 94b (55 мг, 0,08 ммоль) в ТГФ (1,10 мл) при 0°С обрабатывают NaH (4,60 мг, 0,12 ммоль). После перемешивания в течение 30 минут при комнатной температуре добавляют этилиодид (14 мг, 0,09 ммоль) и смесь перемешивают в течение 22 часов. Смесь разбавляют насыщ. водным NH4Cl (10 мл) и экстрагируют EtOAc (2× 15 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения в виде смеси. ЖХ/МС m/z (М+Н)= 745,1.
Пример получения 97: N- метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-5-ил)ацетамид
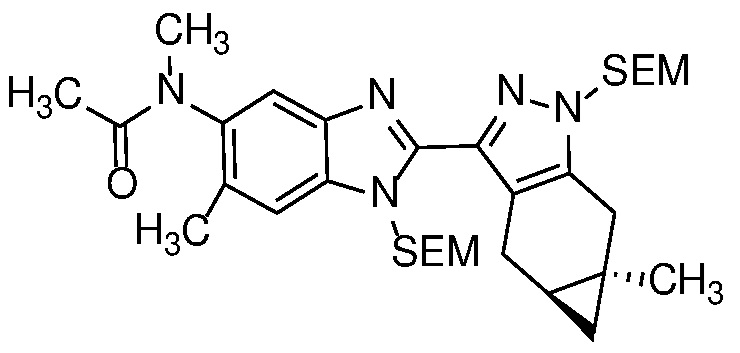
Раствор из Примера получения 62 (4,74 г, 9,88 ммоль) в ТГФ (124 мл) при 0°С обрабатывают NaH (474 мг, 11,9 ммоль). Смесь перемешивают при 0°С в течение 30 мин и добавляют SEM-Cl (1,81 г, 10,9 ммоль). Смесь перемешивают при 0°С в течение 1 часа, нагревают до 10°С и перемешивают в течение 1,5 часов. Смесь обрабатывают насыщ. водным NH4Cl (50 мл) и экстрагируют EtOAc (3× 50 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-40%), с получением указанного в заголовке соединения (2,42 г, 40%). ЖХ/МС m/z (М+Н)+=610,3.
Пример получения 98: 2-хлор- N- метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-5-ил)ацетамид
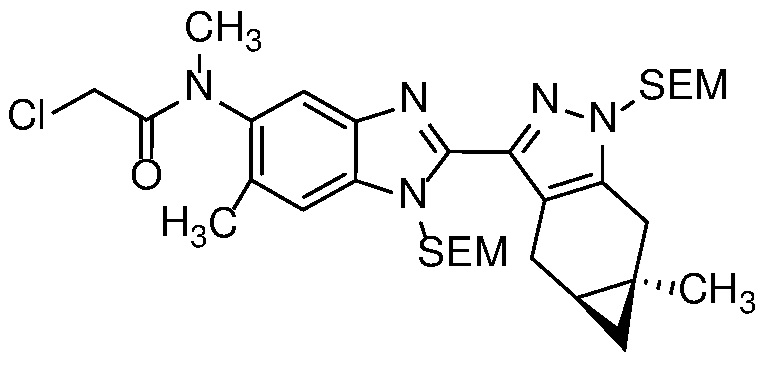
Раствор из Примера получения 97 (848 мг, 1,39 ммоль) в ТГФ (22 мл) при -10°С обрабатывают раствором ДАЛ (0,76 мл, 2N в ТГФ/гептане). Смесь перемешивают при -10°С в течение 30 мин и добавляют бензолсульфонилхлорид (577 мг, 3,27 ммоль). Смесь перемешивают в течение 2 ч при -10°С и затем обрабатывают насыщ. водным NH4Cl (20 мл) и экстрагируют EtOAc (3× 30 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-30%), с получением указанного в заголовке соединения (404 мг, 45%). 1H ЯМР (400 МГц, CDCl3) δ 7,71 (с, 1H), 7,39 (с, 1H), 6,20-5,93 (м, 2H), 5,53-5,33 (м, 2H), 3,92-3,66 (м, 2H)), 3,57 (т, 2Н), 3,54-3,47 (м, 2Н), 3,47-3,38 (м, 1Н), 3,30 (с, 3Н), 3,19-3,03 (м, 2Н), 2,74 (д, 1Н), 2,34 (д, 3H), 1,28 (д, 3H), 1,13 (дт, 1H), 0,91 (ддд, 2H), 0,86-0,72 (м, 2H), 0,46-0,33 (м, 1H), 0,26 (кв, 1Н), -0,02 (с, 9Н), -0,12 (с, 9Н); ЖХ/МС m/z (М+Н)+=644,3.
Пример получения 99: (S)- N -(4-амино-3-нитрофенил)-N-метил-2-морфолинопропанамид
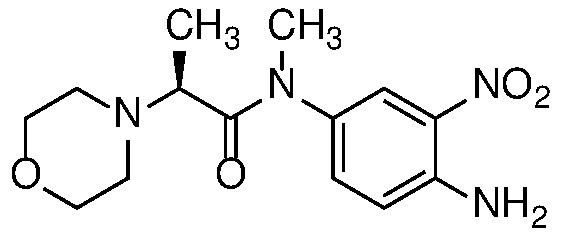
Указанное в заголовке соединение получают аналогично примеру получения 38, начиная с 4-хлор-3-нитроанилина, и примеру получения 19. ЖХ/МС m/z (М+Н)+=309,0.
Пример получения 100: (S)- N -(4-амино-3-бром-5-нитрофенил)- N- метил-2-морфолинопропанамид
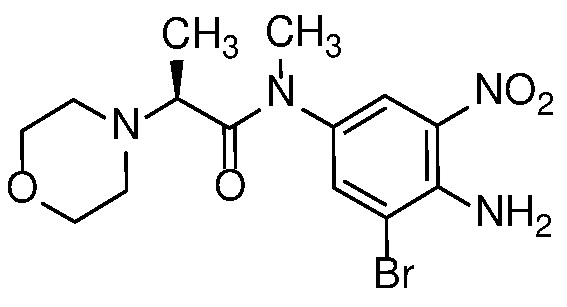
Раствор из Примера получения 99 (1,20 г, 3,89 ммоль) в ДМФ (20 мл) при 20°С обрабатывают бромом (1,24 г, 7,78 ммоль). Смесь перемешивают при 20°С в течение 15 часов. Смесь охлаждают до 0°С и обрабатывают Et3N (10 мл). Смесь концентрируют при пониженном давлении и остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (610 мг, 41%). ЖХ/МС m/z (M+H)+=388,8 (81Br).
Пример получения 101 (S)- N -(3,4-диамино-5-бромфенил)- N- метил-2-морфолинопропанамид
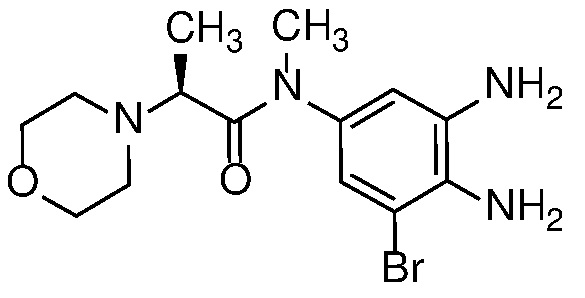
Раствор из Примера получения 100 (900 мг, 2,32 ммоль) в EtOH (80 мл) обрабатывают конц. HCl (1 мл) и порошком железа (389 мг, 6,97 ммоль). Смесь перемешивают при 70°С в течение 2 часов. Смесь охлаждают до 0°С и доводят до рН 7 добавлением конц. NH4OH (2 мл). Смесь фильтруют и фильтрат концентрируют. Остаток растворяют в ДХМ (60 мл), перемешивают в течение 1 ч и фильтруют. Фильтрат концентрируют, с получением указанного в заголовке соединения (802 мг, 87%). ЖХ/МС m/z (M+H)+=356,9 (79Br).
Пример получения 102: (S)- N -(7-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1 H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
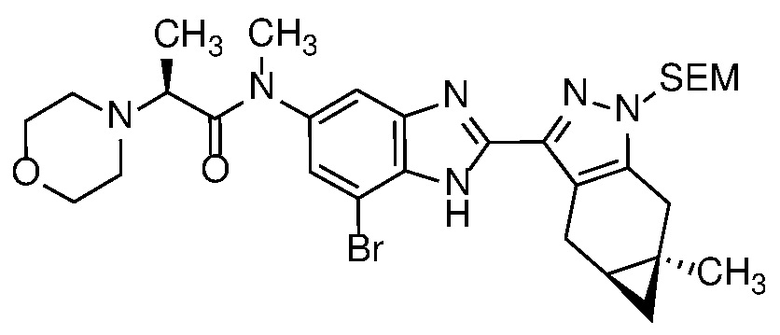
Смесь из примера получения 9 (601 мг, 1,96 ммоль) в ДМФ (25 мл) добавляют к 101 (700 мг, 1,96 ммоль) и Na2S2O5 (373 мг, 1,96 ммоль) и смесь нагревают при 110°С в течение 15 часов. Смесь концентрируют и остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (730 мг, 56%). 1H ЯМР (400 МГц, CDCl3) δ 9,94 (с, 1H), 7,59 (с, 1H), 7,35 (с, 1H), 5,53-5,24 (м, 2H), 3,66 (т, 4H), 3,61-3,48 (м, 3H), 3,31 (с, 3H), 3,25-3,06 (м, 3H), 2,75 (д, 1H), 2,56 (дт, 2H), 2,38-2,23 (м, 2H), 1,30 (с, 3Н), 1,14 (т, 4Н), 0,92 (ддд, 2Н), 0,43 (дд, 1Н), 0,26 (т, 1Н), -0,01 (с, 9Н); ЖХ/МС m/z (M+H)+=645,0 (81Br).
Пример получения 103: (S)- N -(4-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид
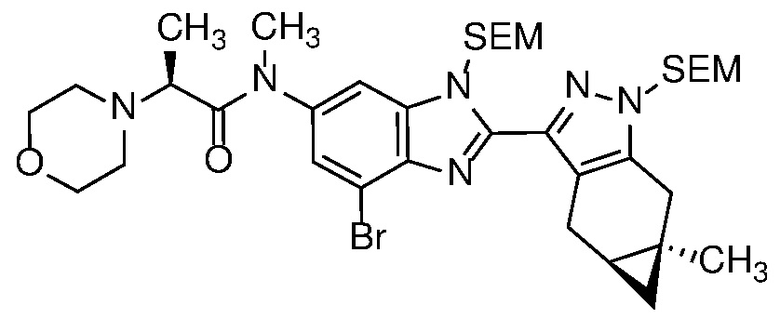
Раствор из Примера получения 102 (700 мг, 1,09 ммоль) в ТГФ (50 мл) при 0°С обрабатывают NaH (57 мг, 1,41 ммоль) и SEM-Cl (272 мг, 1,63 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 2 часов. Смесь охлаждают до 0°С и обрабатывают насыщ. водным NH4Cl (1 мл). Смесь разбавляют водой (50 мл) и экстрагируют EtOAc (2× 150 мл). Объединенные органические слои промывают солевым раствором, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (770 мг, 92%). ЖХ/МС m/z (M+H)+=775,2 (81Br).
Пример получения 104: (2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-6-((S)- N- метил-2-морфолинопропанамидо)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-4-ил)бороновая кислота
Раствор из Примера получения 103 (328 мг, 0,424 ммоль) в 1,4-диоксане (20 мл) обрабатывают KOAc (125 мг, 1,27 ммоль), бис(пинаколато)дибором (323 мг, 1,27 ммоль) и Pd(dppf)Cl2 (31 мг, 0,0424 ммоль). Смесь нагревают до 100°С и перемешивают в течение 15 часов. Смесь охлаждают до комнатной температуры и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%, затем MeOH/EtOAc=0-100%) с получением указанного в заголовке соединения (245 мг, 86%). ЖХ/МС m/z (M+H)+=739,2 (79Br).
Пример получения 105: (S)- N -(4-гидрокси-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид
Раствор из Примера получения 104 (350 мг, 0,224 ммоль) в ТГФ (30 мл) при 0°С обрабатывают раствором NaBO3-4H2O (104 мг, 0,673 ммоль) в воде (10 мл). Смесь перемешивают при 20°С в течение 5 часов. Смесь распределяют между водой (10 мл) и EtOAc (50 мл). Органический слой отделяют, и водный слой экстрагируют EtOAc (20 мл). Объединенные органические слои промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют, с получением указанного в заголовке соединения (300 мг, 94%). ЖХ/МС m/z (M+H)+=711,3
Пример получения 106: (S)- N -(4-метокси-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 H- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид
Раствор из Примера получения 105 (150 мг, 0,211 ммоль) в ДМФ (3 мл) при 0°С обрабатывают K2CO3 (88 мг, 0,63 ммоль) и метилиодидом (45 мг, 0,32 ммоль). Смесь перемешивают при 20°С в течение 2 часов. Смесь разбавляют водой (10 мл) и экстрагируют EtOAc (2 х 50 мл). Объединенные органические слои промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (153 мг, 100%). ЖХ/МС m/z (M+H)+=725,3
Пример получения 107: (4aS,5aR)-3-(5-бром-7-(трифторметил)-1 H -бензо[d]имидазол-2-ил)-5a-метил-1-((2-(триметилсилил) ) этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
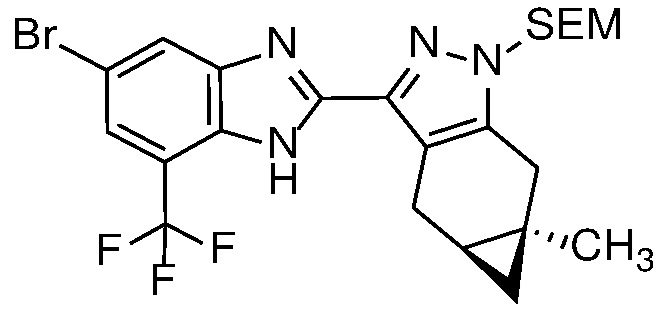
Раствор из Примера получения 9 (288 мг, 0,94 ммоль) в ДМФ (10 мл) обрабатывают 5-бром-3-(трифторметил)бензол-1,2-диамином (240 мг, 0,94 ммоль) и Na2S2O5 (179 мг, 0,94 ммоль). Смесь нагревают при 110° в течение 15 ч и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (430 мг, 84%). ЖХ/МС m/z (M+H)+=543,1 (81Br).
Пример получения 108: (4aS,5aR)-3-(6-бром-4-(трифторметил)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-2-ил)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
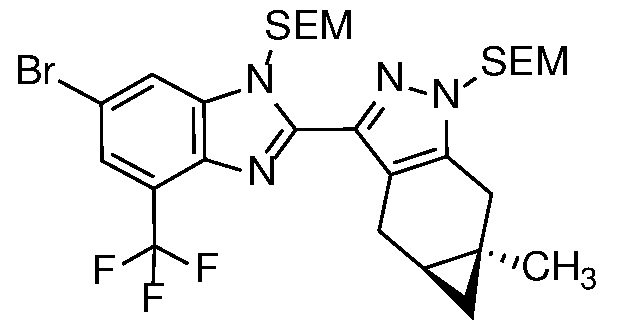
Раствор из Примера получения 107 (350 мг, 0,65 ммоль) в ТГФ (20 мл) при 0°С обрабатывают NaH (34 мг, 0,84 ммоль) и SEM-Cl (162 мг, 0,97 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 2 часов. Смесь охлаждают до 0°С и обрабатывают насыщ. водным NH4Cl (1 мл). Смесь разбавляют водой (50 мл) и экстрагируют EtOAc (2× 150 мл). Объединенные органические слои промывают солевым раствором, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (430 мг, 99%). ЖХ/МС m/z (M+H)+=673,0 (81Br).
Пример получения 109: трет- бутил-(2-((4аS,5аR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-4-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)карбамат
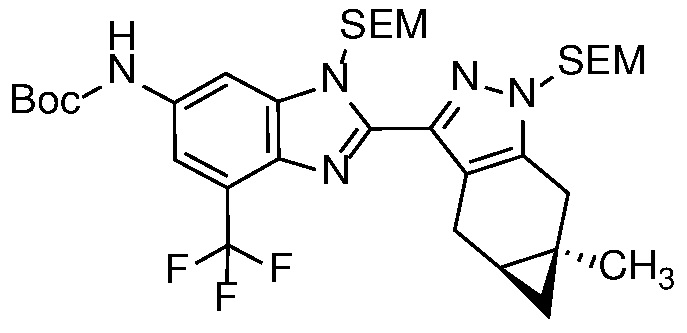
Раствор из Примера получения 108 (380 мг, 0,57 ммоль) в 1,4-диоксане (10 мл) в трет-амиловом спирте (10 мл) обрабатывают BOC2O (199 мг, 1,7 ммоль), Cs2CO3 (369 мг, 1,13 ммоль) (77 мг, 0,23 ммоль) и Pd2(dba)3 (52 мг, 0,057 ммоль). Смесь нагревают при 100°С в течение 15 часов. Смесь охлаждают до комнатной температуры и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ+0-100%), с получением указанного в заголовке соединения (223 мг, 56%). ЖХ/МС m/z (M+H)+=708,4.
Пример получения 110: 2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-4-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-амин
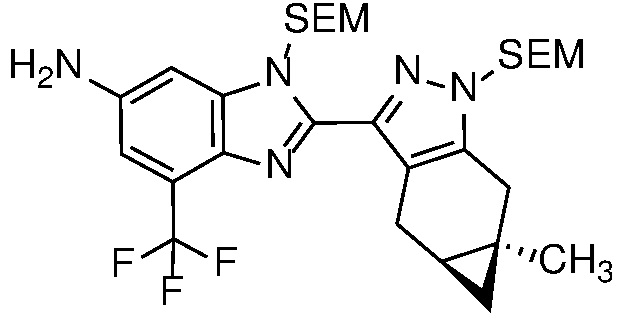
Раствор из Примера получения 109 (220 мг, 0,31 ммоль) в ДХМ (20 мл) обрабатывают ZnBr2 (350 мг, 1,55 ммоль). Смесь перемешивают при комнатной температуре в течение 15 часов. Смесь фильтруют, фильтрат разбавляют водой (50 мл) и экстрагируют ДХМ (2 х 50 мл). Объединенные органические слои промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (170 мг, 90%). ЖХ/МС m/z (М+Н)+=608,2.
Пример получения 111: (S)- N -(2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-4-(трифторметил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)-2-морфолинопропанамид
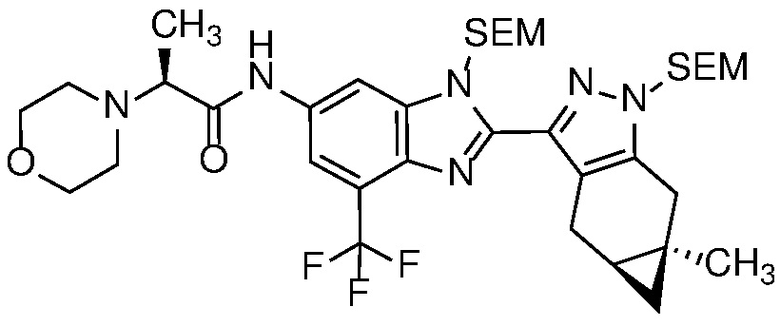
Раствор из Примера получения 110 (170 мг, 0,28 ммоль) и 19 (89 мг, 0,56 ммоль) в пиридине (5 мл) обрабатывают EDCI (107 мг, 0,56 ммоль). Смесь перемешивают при комнатной температуре в течение 15 часов. Смесь разбавляют водой (50 мл) и экстрагируют EtOAc (2× 50 мл). Объединенные органические слои промывают солевым раствором, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (125 м, (60%). ЖХ/МС m/z (M+H)+=749,4.
Пример получения 112: (S)- N- метил -N -(2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-4-(трифторметил)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-6-ил)-2-морфолинопропанамид
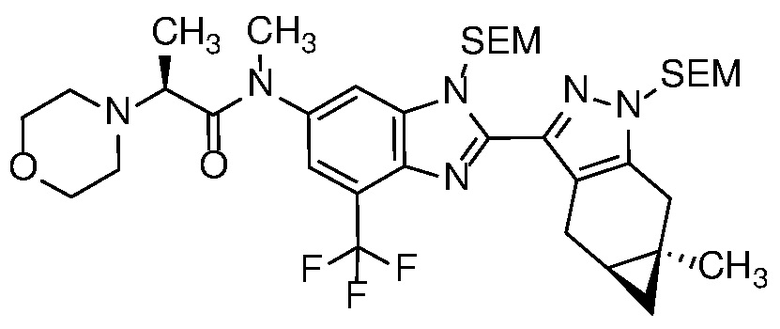
Раствор из Примера получения 111 (125 мг, 0,17 ммоль) в ТГФ (5 мл) при 0°С обрабатывают NaH (10 мг, 0,25 ммоль), а затем метилиодидом (36 мг, 0,25 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 2 часов. Смесь охлаждают до 0°С и обрабатывают насыщ. водным NH4Cl (0,3 мл). Смесь разбавляют водой (50 мл) и экстрагируют EtOAc (2× 50 мл). Объединенные органические слои промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (127 мг, 99%).
Пример получения 113: Метил-5-бром-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1 H- бензо[d]имидазол-7-карбоксилат
Смесь метил-2,3-диамино-5-бромбензоата (720 мг, 2,94 ммоль), 9 (990 мг, 3,32 ммоль) и NaHSO3 (336 мг, 3,23 ммоль) в EtOH (14,7 мл) и воде (2,5 мл) нагревают при 90°С на воздухе в течение 18 часов. Смесь охлаждают до КТ и разбавляют водой. Смесь экстрагируют ДХМ (х3) и объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Остаток перемешивают в смеси гептан:EtOAc (1:1, 10 мл) в течение 18 ч, и полученные твердые вещества собирают фильтрованием с получением указанного в заголовке соединения (842 мг, 54%) в виде бежевого твердого вещества. 1H ЯМР (600 МГц, CDCl3) δ 10,85 (с, 1H), 8,18 (с, 1H), 8,01 (д, 1H), 5,50-5,33 (м, 2H), 4,02 (с, 3H), 3,61-3,51 (м, 3H), 3,18 (дд, 1H), 3,13 (д, 1H), 2,74 (д, 1H), 1,29 (с, 3H), 1,17 (дт, 1H), 0,92 (тд, 2H), 0,43 (дд, 1H), 0,27 (т, 1H), -0,02 (с, 9H); ЖХ/МС m/z (М+Н)+=531,5.
Пример получения 114: Метил-6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-4-карбоксилат
Суспензию NaH (4147 мг, 10,4 ммоль) в ТГФ (6 мл) при 0°С обрабатывают раствором из Примера получения 113 (2,77 г, 5,22 ммоль) в ТГФ (24 мл). Смесь перемешивают при 0°С в течение 30 минут, и затем добавляют SEM-Cl (1310 мг, 7,83 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 18 часов. Смесь охлаждают до 0°С и обрабатывают насыщ. водным NH4Cl (5 мл). Органический растворитель выпаривают, и полученную смесь экстрагируют ДХМ (х4). Объединенные органические слои промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-60%), с получением указанного в заголовке соединения (2,88 г, 83%). 1H ЯМР (400 МГц, CDCl3) δ 8,10 (д, 1H), 7,92 (д, 1H), 6,18 (д, 2H), 5,49-5,33 (м, 2H), 4,06 (с, 3H), 3,63 (д, 1Н), 3,52 (дт, 4Н), 3,21-3,08 (м, 2Н), 2,74 (д, 1Н), 1,29 (с, 3Н), 1,15 (дт, 1Н), 0,94-0,80 (м, 4Н), 0,41 (дд, 1Н), 0,29 (т, 1Н), -0,02 (с, 9Н), -0,12 (с, 9Н).
Пример получения 115: Метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-6-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-4-карбоксилат
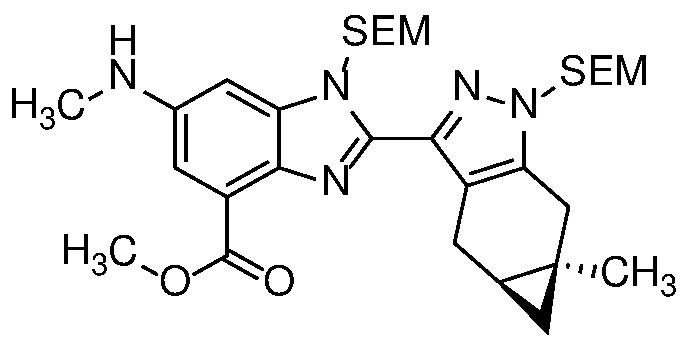
Раствор из Примера получения 114 (420 мг, 0,635 ммоль) в ДМФ (4,2 мл) добавляют во флакон, содержащий MeNH2-HCl (64 мг, 0,95 ммоль), CuI (10 мг, 0,051 ммоль), N-(2,6-диметилфенил)-6-гидроксипиколинамид (25 мг, 0,10 ммоль) и K3PO4 (404 мг, 1,9 ммоль). Смесь нагревают при 110°С в течение 20 часов. Смесь охлаждают до комнатной температуры и разбавляют EtOAc. Смесь экстрагируют водой (х2). Органический слой промывают раствором соли, сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-70%), с получением указанного в заголовке соединения (231 мг, 60%). 1H ЯМР (400 МГц, CDCl3) δ 7,37 (д, 1H), 6,92 (д, 1H), 6,13 (д, 2H), 5,46-5,35 (м, 2H), 4,06 (с, 3H), 3,64-3,43 (м, 5H), 3,22-3,07 (м, 2H), 2,94 (с, 3H), 2,73 (д, 1H), 1,65 (с, 1H), 1,28 (с, 3H), 1,13 (дт, 1H), 0,94-0,87 (м, 2Н), 0,86-0,76 (м, 2Н), 0,39 (дд, 1Н), 0,30 (т, 1Н), -0,02 (с, 9Н), -0,13 (с, 9Н); ЖХ/МС m/z (М+Н)+=612,5.
Пример получения 116: 2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-6-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-4-ил)метанол
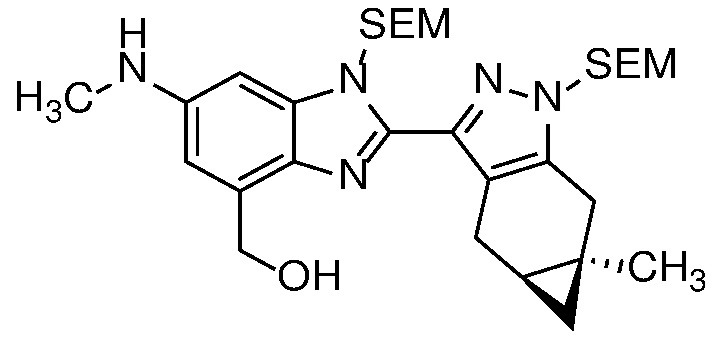
Раствор LiAlH4 (15 мг, 0,39 ммоль) в тетрагидрофуране (0,39 мл) при 0°С обрабатывают по каплям раствором из Примера получения 115 (158 мг, 0,26 ммоль) в ТГФ (1,3 мл). Смесь нагревают до комнатной температуры и перемешивают в течение 1 часа. Смесь охлаждают до 0°С и обрабатывают насыщ. водным виннокислым калием-натрием (тартратом калия-натрия). Смесь экстрагируют EtOAc (x2) и объединенные органические слои промывают раствором соли, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/гептаны=20-100%), с получением указанного в заголовке соединения (103 мг, 68%). 1H ЯМР (400 МГц, CDCl3) δ 6,59 (д, 1H), 6,46 (д, 1H), 6,17-5,94 (м, 2H), 5,47-5,34 (м, 2H), 5,06 (с, 2H), 4,75 (с, 1H), 3,65-3,45 (м, 4H), 3,39 (д, 1H), 3,10 (дд, 2H), 2,89 (с, 3H), 2,76-2,65 (м, 1H), 1,27 (с, 3H), 1,10 (дт, 1H), 0,91 (ддд, 2H), 0,88-0,79 (м, 2H), 0,39 (дд, 1H), 0,25 (т, 1H), -0,02 (с, 9H), -0,11 (с, 9H).
Пример получения 117: (S)- N -(4-(метоксиметил)-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид
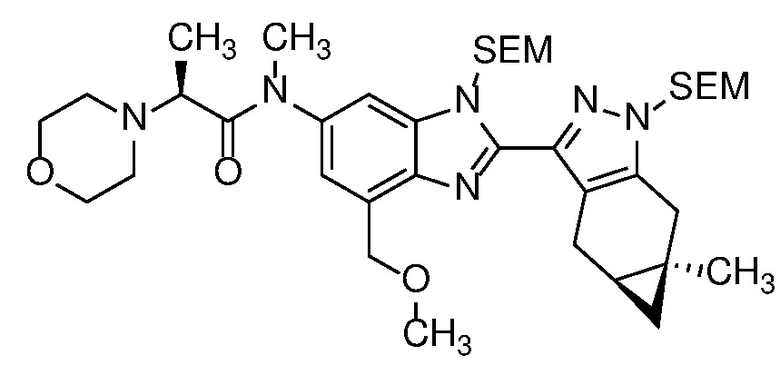
Раствор из примера получения 116 (102 мг, 0,18 ммоль) и 19 (42 мг, 0,262 ммоль) в пиридине (1 мл) обрабатывают EDCI (84 мг, 0,44 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют и остаток распределяют между EtOAc и насыщ. водным NaHCO3. Органический слой отделяют, и водный слой экстрагируют EtOAc (х2). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, [10:1 NH4OH/MeOH]/ДХМ=0-16%), получая смесь N- и O-ацильных продуктов. Смесь растворяют в ТГФ (1 мл) и охлаждают до 0°С. Добавляют NaH (18 мг, 0,45 ммоль) и смесь перемешивают в течение 30 мин, и затем обрабатывают метилиодидом (42 мг, 0,30 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 16 часов. Смесь охлаждают до 0°С и обрабатывают насыщ. водным NH4Cl. Смесь разбавляют водой и экстрагируют EtOAc (х3). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/гептаны=20-100%), с получением указанного в заголовке соединения (61 мг, 47%). 1H ЯМР (400 МГц, CDCl3) δ 7,33 (с, 1H), 7,21 (с, 1H), 6,08 (д, 2H), 5,49-5,36 (м, 2H), 4,98 (д, 2H), 3,65 (т, 4Н), 3,59-3,55 (м, 2Н), 3,54 (с, 3Н), 3,53-3,43 (м, 3Н), 3,33 (с, 3Н), 3,25 (к, 1Н), 3,17-3,02 (м, 2H), 2,73 (д, 1H), 2,64-2,51 (м, 2H), 2,39 (дд, 2H), 1,29 (с, 3H), 1,15 (д, 3H), 1,14-1,08 (м, 1H), 0,90 (ддд, 2Н), 0,85-0,76 (м, 2Н), 0,41 (дд, 1Н), 0,27 (т, 1Н), -0,02 (с, 9Н), -0,12 (с, 9Н).
Пример получения 118: (4aS,5aR)-3-(5-бром-7-хлор- 1H- бензо[d]имидазол-2-ил)-5a-метил-1-((2-(триметилсилил)этокси))метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
Смесь 1,2-диамино-5-бром-3-хлорбензола (200 мг, 0,90 ммоль), NaHSO3 (103 мг, 0,99 ммоль) и Примера получения 9 (304 мг, 0,99 ммоль) в EtOH (3,7 мл) и воду (0,8 мл) кипятят с обратным холодильником в течение 16 часов. Смесь охлаждают до КТ и разбавляют водой. После удаления EtOH при пониженном давлении, смесь экстрагируют EtOAc (х3). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ гептаны=0-30%), с получением указанного в заголовке соединения (410 мг, 89%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,13 (с, 1H), 7,55 (д, 1H), 7,43 (д, 1H), 5,49 (д, 1H), 5,42 (д, 1H), 3,57-3,51 (м, 2H), 3,48 (д, 1H), 3,19 (д, 1H), 3,01 (дд, 1H), 2,73 (д, 1H), 1,27 (с, 3H), 1,16 (ддд, 1H), 0,84 (тд, 2Н), 0,41 (дд, 1Н), 0,17 (дд, 1Н), -0,06 (с, 9Н); ЖХ/МС m/z (M+H)+=507,4 (79Br).
Пример получения 119a: (4aS,5aR)- 3 -(5-бром-7-хлор-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-2-ил)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
Пример получения 119b: (4aS,5aR)-3-(6-бром-4-хлор-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-2-ил)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
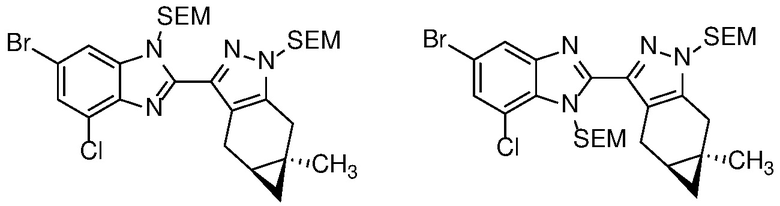
Раствор из Примера получения 118 (390 мг, 0,77 ммоль) в ТГФ (3,8 мл) обрабатывают NaH (59 мг, 1,54 ммоль). Смесь перемешивают при 0°С в течение 30 мин и добавляют SEM-Cl (205 мг, 1,23 ммоль). Смесь перемешивают при 0°С в течение 1,5 часов. Смесь охлаждают до 0°С и обрабатывают насыщ. водным NH4Cl. ТГФ выпаривают. Оставшуюся смесь экстрагируют EtOAc (х4). Объединенные органические слои сушат (MgSO 4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ гептаны=0-30%), с получением указанного в заголовке соединения в виде смеси (425 мг, 87%). ЖХ/МС m/z (M+H)+=637,6 (79Br).
Пример получения 120: 7-хлор- N- метил-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-5-амин
Пример получения 121: 4-хлор- N- метил-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-амин
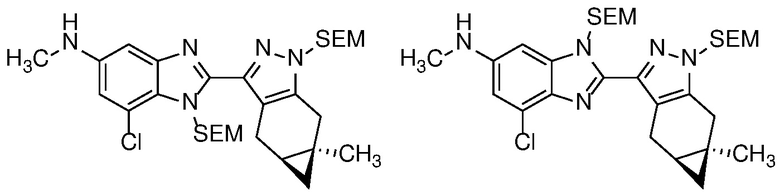
Раствор смеси примеров получения 119а и 119b (542 мг, 0,85 ммоль) в ДМФ (5,7 мл) добавляют к MeNH2-HCl (86 мг, 1,27 ммоль), CuI (13 мг, 0,068 ммоль), N-(2,6-диметилфенил)-6-гидроксипиколинамиду (33 мг, 0,14 ммоль) и K3PO4 (541 мг, 2,6 ммоль). Смесь нагревают при 110°С в течение 18 часов. Смесь разбавляют EtOAc и промывают водой (х3) и солевым раствором. Органический слой сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ гептаны=0-30%), с получением указанного в заголовке соединения (Ссылка: Bernhardson, D.J., Widlicka, D.W., Singer, R.A., Org. Process Res. Dev. 2019, 23, 1538-1551)
Пример получения: 120: (121 мг, 24%). 1H ЯМР (400 МГц, CDCl3) δ 6,66 (д, 1H), 6,58 (д, 1H), 6,03 (д, 2H), 5,44-5,34 (м, 2H), 3,59-3,44 (м, 5H), 3,11 (д, 2H), 3,07 (д, 1H), 2,89 (с, 3H), 2,71 (д, 1H), 1,28 (с, 3H), 1,11 (ддд, 1H), 0,95-0,87 (м, 2H), 0,86-0,77 (м, 2Н), 0,38 (дд, 1Н), 0,27 (дд, 1Н), -0,02 (с, 9Н), -0,12 (с, 9Н). ЖХ/МС m/z (M+H)+=588,6
Пример получения 121: (162 мг, 33%). 1H ЯМР (400 МГц, CDCl3) δ 6,91 (д, 1H), 6,65 (д, 1H), 6,28 (д, 1H), 6,25 (д, 1H), 5,44 (д, 1H), 5,39 (д, 1H), 3,68 (ушс, 1H), 3,57 (дд, 2H), 3,41-3,27 (м, 3H), 3,13 (д, 1H), 3,06 (дд, 1H), 2,88 (с, 3H), 2,73 (д, 1H), 1,28 (с, 3H), 1,10 (ддд, 1H), 0,95-0,89 (м, 2H), 0,75 (тд, 2H), 0,39 (дд, 1H), 0,27 (дд, 1H), -0,01 (с, 9Н), -0,16 (с, 9Н). ЖХ/МС m/z (M+H)+=588,6
Пример получения 122: (S)- N -(7-хлор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
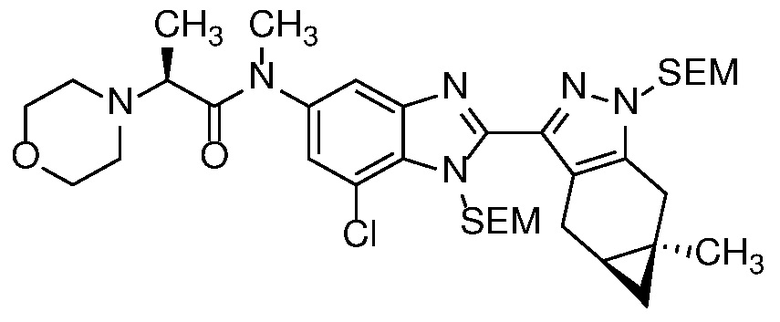
Смесь из примера получения 19 (24,4 мг, 0,15 ммоль), 120 (82 мг, 0,14 ммоль), пиридина (0,56 мл, 0,70 ммоль) и T3P (50% масс. в EtOAc, 0,17 мл, 0,28 ммоль) в EtOAc (0,9 мл) перемешивают при комнатной температуре в течение 18 часов. Смесь обрабатывают ДМФ (0,6 мл), и смесь перемешивают при комнатной температуре в течение дополнительных 24 часов. Смесь разбавляют EtOAc и водой. После разделения слоев органический слой промывают водой (х2) и солевым раствором. Оставшуюся органическую фракцию сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/гептаны, градиент 10-80%), с получением указанного в заголовке соединения (42,8 мг, 42%). 1H ЯМР (400 МГц, CDCl3) δ 7,55 (д, 1H), 7,21 (с, 1H), 6,38 (д, 2H), 5,45 (д, 1H), 5,41 (д, 1H), 3,65 (дд, 4H), 3,60-3,54 (м, 2H), 3,40 (д, 2H), 3,31 (с, 3H), 3,23 (к, 1H), 3,14 (д, 1H), 3,06 (дд, 1H), 2,74 (д, 1H), 2,57 (ддд, 2H), 2,32 (ддд, 2H), 1,77 (уш, 1H), 1,28 (с, 3H), 1,18-1,06 (м, 4H), 0,91 (ддд, 2H), 0,78 (тд, 2Н), 0,41 (дд, 1Н), 0,26 (дд, 1Н), -0,02 (с, 9Н), -0,16 (с, 9Н); ЖХ/МС m/z (М+Н)+=729,7.
Пример получения 123: N -(7-хлор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-5-ил)- N- метилацетамид
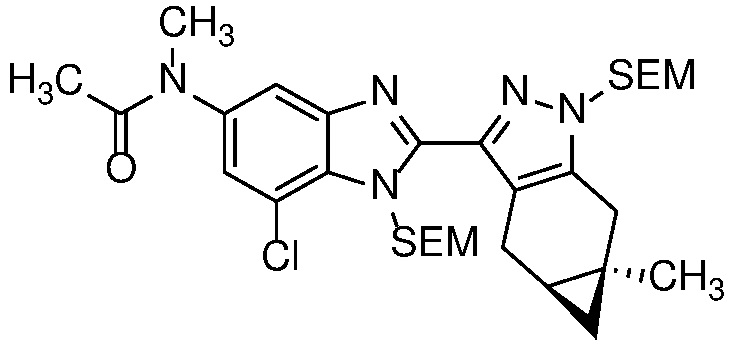
Раствор из Примера получения 120 (785 мг, 1,33 ммоль) в ДХМ охлаждают до 0°С. Раствор обрабатывают Et3N (0,56 мл, 4,00 ммоль) и ацетилхлоридом (0,14 мл, 2,00 ммоль). Смесь перемешивают при 0°С в течение 20 мин и обрабатывают насыщ. водным NaHCO3. Водный слой экстрагируют ДХМ (х3), объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/гептаны=0-50%), с получением указанного в заголовке соединения 123 (807 мг, 64%). ЖХ/МС m/z (М+Н)+ =630,5.
Пример получения 124: N- метил- N -(2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-7-винил-1 H- бензо[d]имидазол-5-ил)ацетамид.
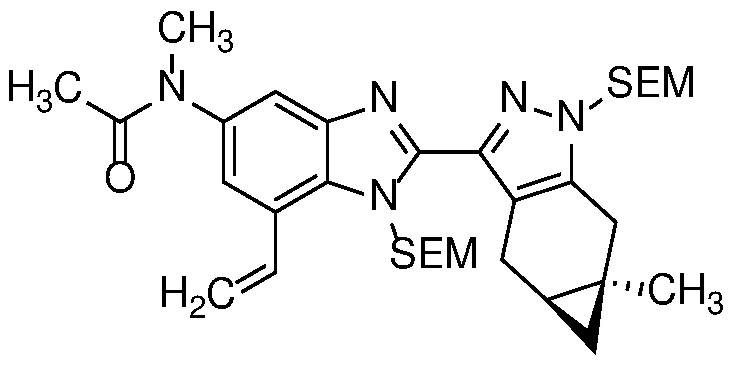
Смесь из примера получения 123 (675 мг, 1,07 ммоль), 2,4,6-тривинилциклотрибороксанпиридинового комплекса (297 мг, 1,24 ммоль), Pd(OAc)2 (9,3 мг, 0,04 ммоль) и SPhos (34 мг, 0,08 ммоль) в 1,4-диоксане (5,4 мл) добавляют 3 MK3PO4 (0,82 мл, 2,47 ммоль). Смесь нагревают при 100°С в течение 20 часов. Смесь фильтруют и твердые вещества промывают EtOAc. Фильтрат разбавляют водой и экстрагируют EtOAc (х3). Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/гептаны=0-50%), с получением указанного в заголовке соединения (391 мг, 59%). ЖХ/МС m/z (М+Н)+=622,5.
Пример получения 124a: N -(7-этил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-5-ил)- N- метилацетамид
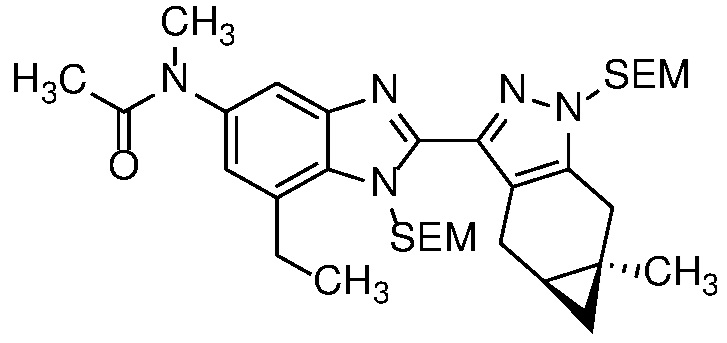
Раствор из Примера получения 124 (87 мг, 0,14 ммоль) в МеОН (2 мл) обрабатывают 10% Pd/C (20 мг). Смесь дегазируют с помощью N2 и трижды заполняют Н2. Смесь перемешивают при комнатной температуре в атмосфере H2 (3 атм) в течение 18 часов. Смесь фильтруют и фильтрат концентрируют, с получением указанного в заголовке соединения (87 мг, количественно). 1H ЯМР (600 МГц, CDCl3) δ 7,45 (д, 1H), 6,91 (д, 1H), 6,14 (к, 2H), 5,54-5,37 (м, 2H), 3,56 (т, 2H), 3,38-3,32 (м, 2H), 3,30 (с, 3H), 3,18-3,10 (м, 3H), 3,07 (дд, 1H), 2,74 (д, 1H), 1,97 (с, 1H), 1,88 (с, 3H), 1,34 (т, 3Н), 1,27 (с, 3Н), 1,11 (дт, 1Н), 0,91 (тд, 2Н), 0,79-0,64 (м, 2Н), 0,39 (дд, 1Н), 0,24 (т, 1Н), -0,02 (с, 9Н), -0,18 (с, 9Н).
Пример получения 125: 7-этил- N- метил-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-5-амин
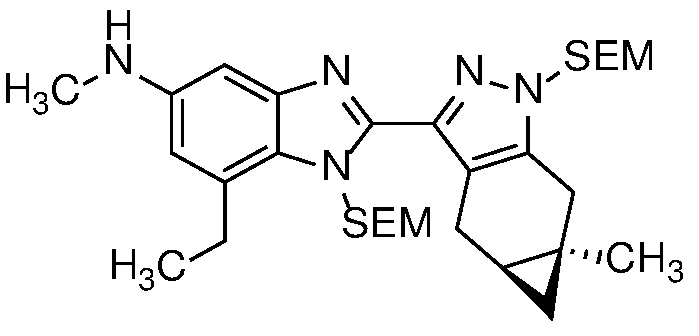
Раствор из Примера получения 124 (86 мг, 0,14 ммоль) в 1:1 EtOH:вода обрабатывают КОН (155 мг, 2,76 ммоль). Смесь нагревают до 90°С и перемешивают в течение 72 часов. Смесь охлаждают до комнатной температуры и разбавляют водой, экстрагируют ДХМ (х3). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/гептаны=градиент 0-80%) с получением соединения, указанного в заголовке (37 мг, 46%). 1H ЯМР (400 МГц, CDCl3) δ 6,88 (д, 1H), 6,51 (д, 1H), 6,13-5,90 (м, 2H), 5,50-5,29 (м, 2H), 3,57 (т, 2H), 3,33 (д, 1H), 3,25 (дд, 2H), 3,16-3,01 (м, 4H), 2,89 (с, 3H), 2,77-2,69 (м, 1H), 1,32 (т, 3H), 1,27 (с, 3H), 1,14-1,04 (м, 1H), 0,96-0,83 (м, 3H), 0,72 (тд, 2H), 0,38 (дд, 1H), 0,26 (т, 1H), -0,01 (с, 9H), -0,16 (с, 9H); ЖХ/МС m/z (М+Н)+=582,5.
Пример получения 126: (S)- N -(7-этил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
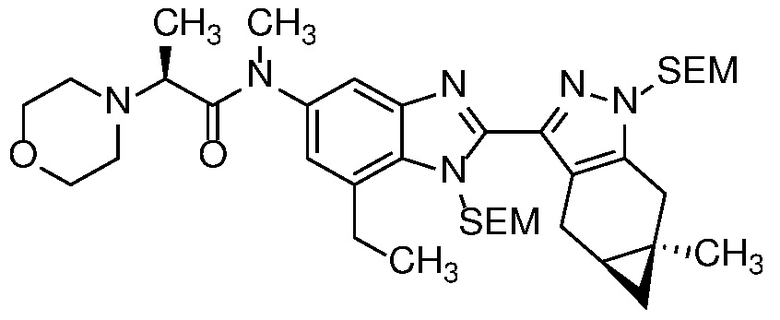
Раствор из Примера получения 125 (37 мг, 0,064 ммоль) и примера получения 19 (15 мг, 0,095 ммоль) в пиридине (1 мл) обрабатывают EDCI (31 мг, 0,159 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют и остаток разбавляют водой. Органический слой экстрагируют EtOAc (х3). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют, с получением указанного в заголовке соединения (45 мг, 98%). 1H ЯМР (600 МГц, CDCl3) δ 7,47 (с, 1H), 6,92 (с, 1H), 6,14 (с, 2H), 5,55-5,34 (м, 2H), 3,65 (дт, 4H), 3,57 (тд, 2Н), 3,40-3,33 (м, 2Н), 3,33 (с, 3Н), 3,26 (кв, 1Н), 3,15 (кв, 3Н), 3,06 (дд, 1Н), 2,75 (д, 1Н), 2,59-2,52 (м, 2Н), 2,40 (дт, 2Н), 1,34 (т, 3Н), 1,29 (с, 3Н), 1,25 (д, 1Н), 1,17 (д, 3Н), 1,15-1,06 (м, 1Н)), 0,92 (ддд, 2Н), 0,75 (тд, 2Н), 0,40 (дд, 1Н), 0,26 (т, 1Н), -0,01 (с, 9Н), -0,16 (с, 9Н); ЖХ/МС m/z (М+Н)+=723,7.
Пример получения 127: трет -бутил(4-хлор-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-6-ил)(метил)карбамат
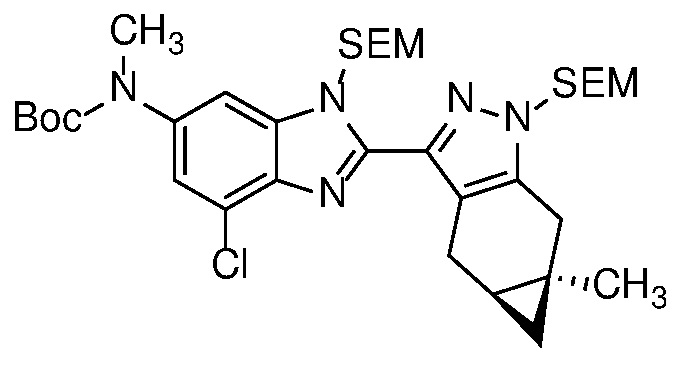
Раствор из Примера получения 121 (740 мг, 1,26 ммоль) в ТГФ (6,3 мл) обрабатывают Et3N (0,35 мл, 2,52 ммоль), Boc2O (412 мг, 1,89 ммоль) и ДМАП (154 мг, 1,26 ммоль) при КТ. Смесь перемешивают при комнатной температуре в течение 18 ч и добавляют дополнительное количество Et3N (0,35 мл, 2,52 ммоль), Boc2O (412 мг, 1,89 ммоль) и ДМАП (154 мг, 1,26 ммоль). Реакционную смесь нагревают до 60°С и перемешивают еще 36 часов. Смесь концентрируют и остаток очищают хроматографией (двуокись кремния, EtOAc/гептаны=0-50%), с получением указанного в заголовке соединения (637,3 мг, 74%). 1H ЯМР (400 МГц, CDCl3) δ 7,33 (д, 1H), 7,20 (д, 1H), 6,08 (д, 2H), 5,43 (д, 1H), 5,39 (д, 1H), 3,59-3,46 (д, 1H), м, 5Н), 3,30 (с, 3Н), 3,20-3,07 (м, 2Н), 2,73 (д, 1Н), 1,44 (с, 9Н), 1,28 (с, 3Н), 1,17-1,08 (м, 1Н), 0,95-0,88 (м, 2Н), 0,86-0,78 (м, 2Н), 0,40 (дд, 1Н), 0,27 (дд, 1Н), -0,02 (с, 9Н), -0,12 (с, 9Н).
Пример получения 128: трет- бутилметил(2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-4-винил-1 H- бензо[d]имидазол-6-ил)карбамат
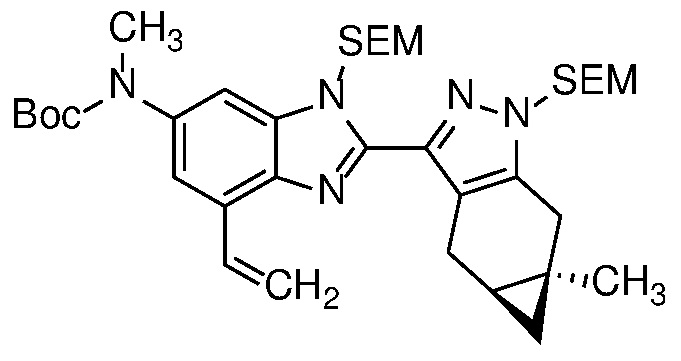
Смесь из примера получения 127 (450 мг, 0,71), комплекса винилборного ангидрида и пиридина (258 мг, 1,07 ммоль), Pd(OAc)2 (8,0 мг, 0,036 ммоль) и SPhos (29,3 мг, 0,71 ммоль) в 1,4-диоксане (3,6 мл) обрабатывают 3М K3PO4 (0,71 мл, 2,14 ммоль). Смесь нагревают при 100°С в течение 20 часов. Смесь фильтруют, и твердые вещества промывают EtOAc. Фильтрат разбавляют водой и экстрагируют EtOAc (х3). Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (диоксид кремния, EtOAc/гептаны=0-50%), с получением указанного в заголовке соединения (367 мг, 76%). 1H ЯМР (400 МГц, CDCl3) δ 7,30 (д, 1H), 7,18 (дд, 1H), 7,15 (с, 1H), 6,62 (дд, 1H), 6,15 (д, 1H), 6,11 (д, 1H), 5,56 (дд, 1H), 5,43 (д, 1H), 5,39 (д, 1H), 3,61-3,49 (м, 5H), 3,31 (с, 3H), 3,18-3,09 (м, 2H), 2,73 (д, 1H), 1,43 (с, 9H), 1,29 (с, 3H), 1,13 (ддд, 1H), 0,91 (ддд, 2H), 0,87-0,79 (м, 2H), 0,41 (дд, 1H), 0,28 (дд, 1Н), -0,02 (с, 9Н), -0,12 (с, 9Н).
Пример получения 129: трет -бутил(4-формил-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)(метил)карбамат
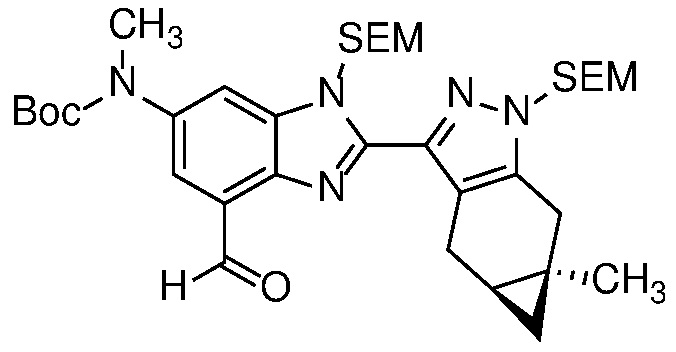
Раствор из Примера получения 128 (366 мг, 0,54 ммоль) в пиридине (2,7 мл) и ТГФ (2,7 мл) при 0°С обрабатывают OsO4 (4% масс. в воде, 5,1 мл, 0,81 ммоль). Смесь перемешивают при 0°С в течение 2 часов, и затем при комнатной температуре еще 18 часов. Смесь обрабатывают 10% водн. NaHSO3 (15 мл) и перемешивают при комнатной температуре в течение 3 часов. Смесь концентрируют и экстрагируют ДХМ (х4). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Этот остаток растворяют в смеси ТГФ/вода 2:1 (6 мл), охлаждают до 0°С и обрабатывают NaIO4 (138 мг, 0,65 ммоль). Смесь перемешивают при 0°С в течение 2,5 часов. Смесь фильтруют через целит и MgSO4 и фильтрат концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/гептаны=градиент 10-50%), с получением указанного в заголовке соединения (163 мг, 44%). 1H ЯМР (400 МГц, CDCl3) δ 10,92 (с, 1H), 7,77-7,56 (м, 2H), 6,19 (д, 1H), 6,15 (д, 1H), 5,45 (д, 1H), 5,40 (д, 1H), 5,40 (д, 1H). д, 1Н), 3,64-3,48 (м, 5Н), 3,34 (с, 3Н), 3,13 (дд, 2Н), 2,74 (д, 1Н), 1,44 (с, 9Н), 1,29 (с, 3Н), 1,21 -1,08 (м, 1H), 0,91 (ддд, 2H), 0,87-0,80 (м, 2H), 0,42 (дд, 1H), 0,28 (дд, 1H), -0,02 (с, 9H), -0,12 (с, 9Н).
Пример получения 130: трет- бутил(4-(гидроксиметил)-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)(метил)карбамат
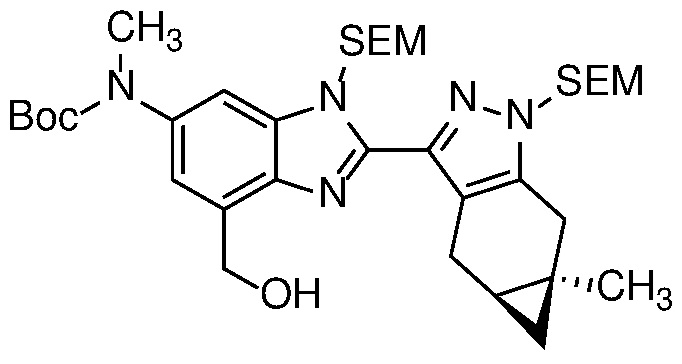
Раствор из Примера получения 129 (30 мг, 0,044 ммоль) в МеОН (1 мл) при 0°С обрабатывают NaBH4 (8 мг, 0,22 ммоль). Смесь нагревают до КТ и перемешивают 2 часа. Смесь охлаждают до 0°С и разбавляют раствором соли и водой. Смесь экстрагируют ДХМ (х3) и объединенные органические слои сушат (MgSO4), фильтруют и концентрируют, с получением указанного в заголовке соединения (19 мг, 63%). 1H ЯМР (400 МГц, CDCl3) δ 7,36-7,30 (м, 1H), 7,00 (с, 1H), 6,20-6,03 (м, 2H), 5,46-5,35 (м, 2H), 5,12 (д, 2H)), 4,63 (с, 1H), 3,65-3,49 (м, 4H), 3,42 (д, 1H), 3,30 (с, 3H), 3,12 (д, 2H), 2,73 (д, 1H), 1,44 (с, 9H), 1,28 (с, 3H), 1,12 (дт, 1H), 0,91 (ддд, 2H), 0,88-0,78 (м, 2H), 0,41 (дд, 1H), 0,25 (т, 1H), -0,02 (с, 9Н), -0,11 (с, 9Н); ЖХ/МС m/z (М+Н)+=684,3.
Пример получения 131: (2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-6-(метиламино)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-4-ил)метанол
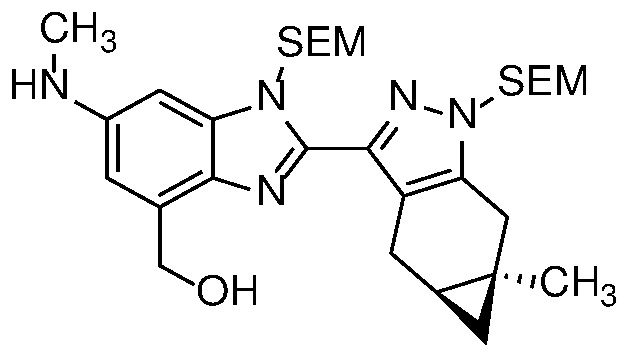
Раствор из Примера получения 130 (19 мг, 0,028 ммоль) в ДХМ (1 мл) при 0°С обрабатывают 2,6-лутидином (9 мг, 0,083 ммоль) и TMSOTf (19 мг, 0,083 ммоль). Смесь перемешивают при 0°С в течение 2 ч и обрабатывают насыщ. водным NaHCO3. Смесь экстрагируют ДХМ (х3). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют, с получением указанного в заголовке соединения (20 мг, количественно). 1H ЯМР (600 МГц, CDCl3) δ 6,77 (д, 1H), 6,58 (д, 1H), 6,08-5,87 (м, 2H), 5,46-5,32 (м, 2H), 5,18 (с, 2H), 3,64-3,51 (м, 3H), 3,47 (ддд, 2H), 3,38 (д, 1H), 3,09 (т, 2H), 2,91 (с, 3H), 2,71 (д, 1H), 1,64 (с, 1H), 1,28 (с, 3Н), 1,11 (дкв, 1Н), 0,98-0,88 (м, 2Н), 0,87-0,76 (м, 2Н), 0,38 (дд, 1Н), 0,33-0,24 (м, 1Н),-0,02 (д, 9Н), -0,13 (с, 9Н); ЖХ/МС m/z (М+Н)+=584,5.
Пример получения 132 (S)- N -(4-(гидроксиметил)-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид
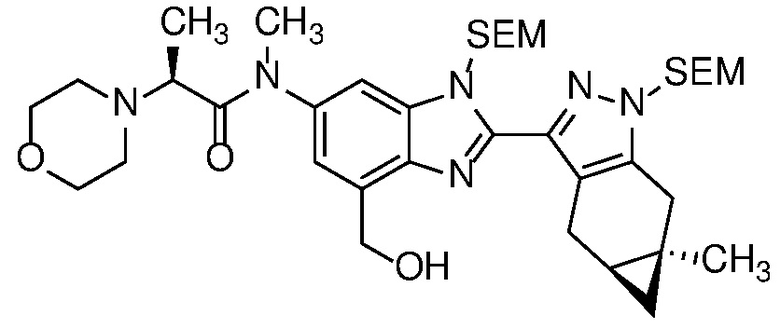
Раствор из Примера получения 131 (19 мг, 0,033 ммоль) и Примера получения 19 (10 мг, 0,065 ммоль) в пиридине (1 мл) обрабатывают EDCI (25 мг, 0,13 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют, остаток разбавляют водой и экстрагируют EtOAc (х3). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют, с получением указанного в заголовке соединения (21 мг, 90%). 1H ЯМР (600 МГц, CDCl3) δ 7,41-7,29 (м, 1H), 6,99 (с, 1H), 6,14 (с, 2H), 5,50-5,33 (м, 2H), 5,25-5,03 (м, 2H)), 4,55 (с, 1H), 3,64 (дд, 3H), 3,60-3,50 (м, 4H), 3,43 (д, 1H), 3,32 (с, 3H), 3,23 (д, 1H), 3,13 (дд, 2H), 2,74 (д, 1H), 2,63-2,47 (м, 3H), 2,37 (дт, 2H), 1,29 (с, 3H), 1,15 (д, 3H), 1,14-1,08 (м, 1H), 0,92 (тд, 2Н), 0,83 (дкв, 2Н), 0,43 (дд, 1Н), 0,25 (т, 1Н), -0,02 (д, 9Н), -0,11 (д, 9Н); ЖХ/МС m/z (М+Н)+=725,7.
Пример получения 133: 3,4-дифтор-2-метиланилин.
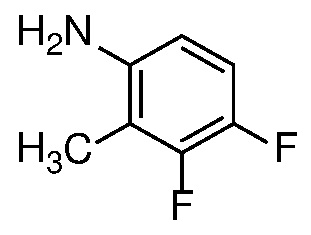
Раствор 1,2-дифтор-3-метил-4-нитробензола (5 г, 28,9 ммоль) в AcOH (150 мл) обрабатывают порошком железа (9,68 г, 173 ммоль) и смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь фильтруют, и фильтрат концентрируют. Остаток растворяют в EtOAc (300 мл) и промывают насыщ. водным NaHCO3 (500 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (3,8 г, 92%). ЖХ/МС m/z (М+Н)+=143,8.
Пример получения 134: (S)- N -(3,4-дифтор-2-метилфенил)-2-морфолинопропанамид
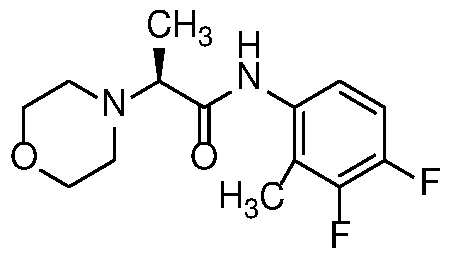
Раствор из Примера получения 133 (3,8 г, 26,6 ммоль) и примера получения 19 (8,45 г, 53,1 ммоль) в пиридине (200 мл) обрабатывают EDCI (10,2 г, 53,1 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов. Смесь концентрируют, остаток разбавляют водой и экстрагируют EtOAc (х3). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-30%), с получением указанного в заголовке соединения (6,9 г, 91%). ЖХ/МС m/z (М+Н)+=284,9.
Пример получения 135 (S)- N -(3,4-дифтор-2-метилфенил)- N- метил-2-морфолинопропанамид
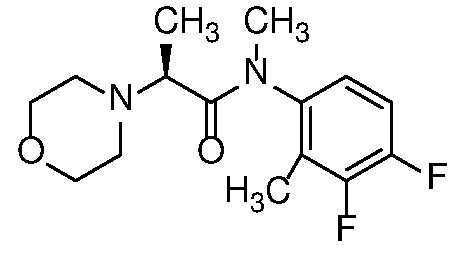
Раствор из Примера получения 134 (6,9 г, 24,3 ммоль) в ТГФ (150 мл) при 0°С обрабатывают NaH (1,94 г, 48,5 ммоль). Смесь перемешивают в течение 30 мин и добавляют йодистый метил (5,17 г, 36,4 ммоль). Смесь нагревают до 20°С и перемешивают в течение 16 часов. Смесь обрабатывают водой и экстрагируют EtOAc (2× 100 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-60%), с получением указанного в заголовке соединения (6,6 г, 91%). ЖХ/МС m/z (М+Н)+=298,9.
Пример получения 136: (S)- N -(3,4-дифтор-2-метил-5-нитрофенил)- N- метил-2-морфолинопропанамид
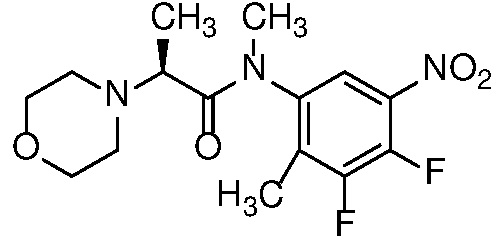
Раствор из Примера получения 135 (5 г, 16,8 ммоль) в конц. H2SO4 (40 мл) при 5-10°С обрабатывают по каплям конц. HNO3 (2,11 г, 33,5 ммоль). Смесь перемешивают при 5-10°С в течение 2 ч и выливают на лед. pH доводят до 7 с помощью насыщ. водного Na2CO3 и смесь экстрагируют EtOAc (2 х 100 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-40%), с получением указанного в заголовке соединения 136 (3,5 г, 61%). ЖХ/МС m/z (М+Н)+=344,1.
Пример получения 137: (S)- N -(4-амино-3-фтор-2-метил-5-нитрофенил)- N- метил-2-морфолинопропанамид
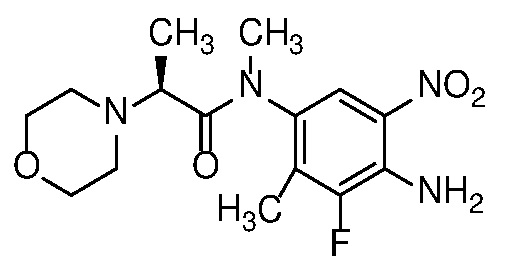
Раствор из Примера получения 136 (3,5 г, 10,2 ммоль) в ТГФ (40 мл) при 20°С обрабатывают конц. NH4OH (40 мл). Смесь перемешивают в течение 16 часов. Смесь экстрагируют EtOAc (2× 200 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения 137 (2,2 г, 63%). ЖХ/МС m/z (М+Н)+=341,0.
Пример получения 138: (S)- N -(4,5-диамино-3-фтор-2-метилфенил)- N- метил-2-морфолинопропанамид)
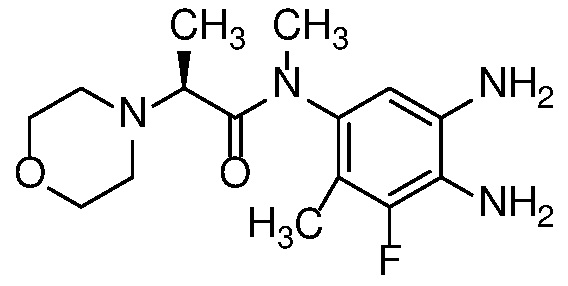
Раствор из Примера получения 137 (2,2 г, 6,5 ммоль) в AcOH (60 мл) обрабатывают порошком железа (2,17 г, 38,8 ммоль) и смесь перемешивают при комнатной температуре в течение 16 часов. Смесь фильтруют и фильтрат концентрируют. Остаток растворяют в EtOAc (100 мл) и промывают насыщ. водным NaHCO3 (30 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%, затем градиент 0-10% MeOH/ДХМ) с получением указанного в заголовке соединения (1,3 г, 65%). ЖХ/МС m/z (М+Н)+=311,1.
Пример получения 139: 3-фтор-2-метил-6-нитроанилин
Раствор 1,3-дифтор-2-метил-4-нитробензола (5 г, 28,9 ммоль) в ТГФ (100 мл) при 20°С обрабатывают конц. NH4OH (100 мл). Смесь перемешивают при комнатной температуре в течение 16 часов. Смесь экстрагируют EtOAc (2 х 200 мл). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-15%), с получением указанного в заголовке соединения (3 г, 61%). 1H ЯМР (400 МГц, CDCl3) δ 8,07 (дд, 1H), 6,46 (дд, 1H), 6,32 (с, 2H), 2,13 (д, 3H).
Пример получения 140: 4-бром-3-фтор-2-метил-6-нитроанилин
Раствор из Примера получения 139 (3 г, 07,6 ммоль) в MeCN (20 мл) при 20°С обрабатывают N-бромсукцинимидом (3,77 г, 21,2 ммоль). Смесь перемешивают при 90°С в течение 2 часов. Смесь охлаждают до комнатной температуры и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-15%), с получением указанного в заголовке соединения (4,3 г, 98%). 1H ЯМР (400 МГц, CDCl3) δ 8,31 (д, 1H), 6,31 (с, 2H), 2,18 (дд, 3H).
Пример получения 141: 5-бром-4-фтор-3-метилбензол-1,2-диамин
Раствор из Примера получения 140 (4,3 г, 17,3 ммоль) в AcOH (100 мл) обрабатывают порошком железа (5,79 г, 104 ммоль) и смесь перемешивают при КТ в течение 1 часа. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток растворяют в EtOAc (300 мл) и промывают насыщ. водным NaHCO3 (50 мл). Органический слой сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-35%), с получением указанного в заголовке соединения 141 (3,44 г, 91%). 1H ЯМР (400 МГц, CDCl3) δ 6,74 (д, 1H), 3,36 (с, 4H), 2,12 (д, 3H).
Пример получения 142: трет- бутил-(4-(дифторметил)-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)(метил)карбамат
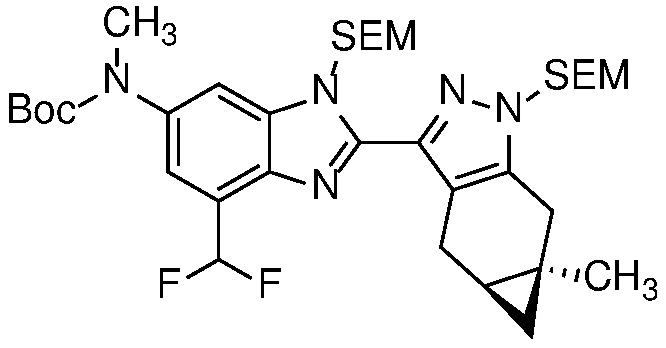
Раствор из Примера получения 129 (160 мг, 0,24 ммоль) в безводном ДХЭ (1,5 мл) обрабатывают DAST (0,047 мл, 0,35 ммоль) при 0°С. Смесь нагревают до комнатной температуры и перемешивают в течение 18 часов. Смесь обрабатывают насыщ. водным NaHCO3. Добавляют дополнительную воду и смесь экстрагируют ДХМ (х3). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-40%), с получением указанного в заголовке соединения (86,0 мг, 52%). 1H ЯМР (400 МГц, CDCl3) δ 7,51 (с, 1H), 7,43 (дд, 1H), 7,42 (с, 1H), 6,14 (д, 1H), 6,10 (д, 1H), 5,44 (д, 1H), 5,39 (д, 1H), 3,61-3,50 (м, 4H), 3,48 (д, 1H), 3,34 (с, 3H), 3,17-3,05 (м, 2H), 2,73 (д, 1H), 1,44 (с, 9H), 1,29 (с, 3H), 1,13 (ддд, 1H), 0,91 (ддд, 2H), 0,87-0,79 (м, 2H), 0,41 (дд, 1H), 0,27 (дд, 1H), -0,02 (с, 9Н), -0,11 (с, 9Н).
Пример получения 143: 4-(дифторметил)- N- метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 Н- бензо[d]имидазол-6-амин
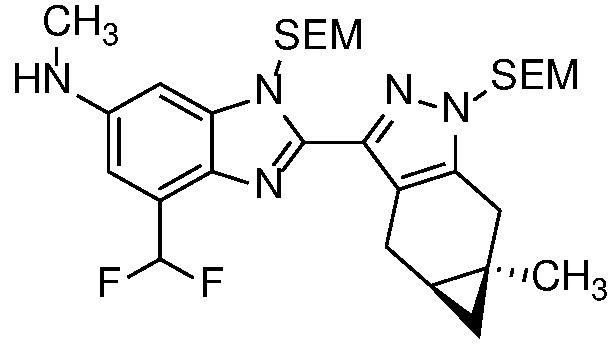
Раствор из Примера получения 142 (85 мг, 0,12 ммоль) в ДХМ (1 мл) при 0°С обрабатывают 2,6-лутидином (0,042 мл, 0,36 ммоль), и затем TMSOTf (0,066 мл, 0,36 ммоль). Смесь перемешивают при 0°С в течение 2 часов. Смесь обрабатывают насыщ. водным NaHCO3. Органическую фазу отделяют и водный слой экстрагируют дополнительным количеством ДХМ (х4). Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), с получением указанного в заголовке соединения (61,9 мг, 85%). ЖХ/МС m/z (М+Н)+=604,5.
Пример получения 144: (S)- N -(4-(дифторметил)-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1Н- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид
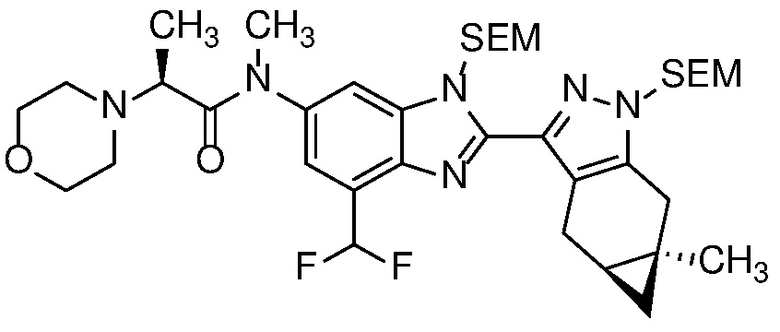
Раствор из примера получения 143 (61 мг, 0,10 ммоль) и 19 (24 мг, 0,15 ммоль) в пиридине (1 мл) обрабатывают EDCI (48 мг, 0,25 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют, остаток растворяют в воде и экстрагируют EtOAc (х3). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют, с получением указанного в заголовке соединения (72 мг, 96%). ЖХ/МС m/z (М+Н)+=745,7.
Пример получения 145: 4-фтор-2-(2-метоксиэтокси)-1-нитробензол
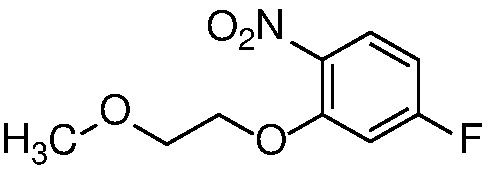
Раствор 2-метоксиэтанола (2,39 г, 31,4 ммоль) в ТГФ (40 мл) при 0°С обрабатывают 1М KOtBu в ТГФ (31,4 мл, 31,4 ммоль). Через 30 минут добавляют раствор 2,4-дифтор-1-нитробензола (5,0 г, 31,4 ммоль) в ТГФ (40 мл). Смесь перемешивают при 30°С в течение 1 ч и разбавляют смесью H2O:EtOAc, 1:1 (100 мл). Слои разделяют, и водный слой экстрагируют EtOAc (50 мл). Органические экстракты сушат, фильтруют и концентрируют с получением указанного в заголовке соединения (6,76 г, 100%). 1H ЯМР (400 МГц, CDCl3) δ 7,93 (дд, 1H), 6,82 (дд, 1H), 6,72 (ддд, 1H), 4,29-4,15 (м, 2H), 3,87-3,73 (м, 2H), 3,45 (с, 3Н).
Пример получения 146: 4-фтор-2-(2-метоксиэтокси)анилин
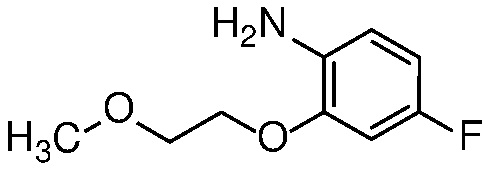
Раствор из Примера получения 145 (6,76 г, 31,4 ммоль) в MeOH (200 мл) обрабатывают 10% Pd/C (600 мг) и перемешивают в атмосфере H2 (1 атм) в течение 16 часов. Смесь фильтруют и фильтрат концентрируют с получением указанного в заголовке соединения (4,53 г, 78%). 1H ЯМР (400 МГц, CDCl3) δ 6,66-6,48 (м, 3H), 4,16-4,06 (м, 2H), 3,81-3,66 (м, 2H), 3,44 (с, 3H).
Пример получения 147: 4-фтор-2-(2-метоксиэтокси)-5-нитроанилин
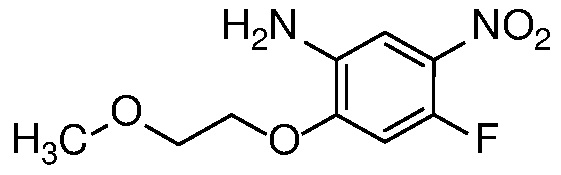
Раствор из Примера получения 146 (615 мг, 3,32 ммоль) в конц. H2SO4 при 5°С обрабатывают KNO3 (336 мг, 3,32 ммоль). Смесь перемешивают в течение 2 ч и выливают в воду со льдом (50 мл). Водную смесь экстрагируют EtOAc (2× 40 мл). Органические экстракты объединяют, сушат, фильтруют и концентрируют с получением указанного в заголовке соединения (790 мг, 103%). 1H ЯМР (400 МГц, CDCl3) δ 7,40 (д, 1H), 6,66 (д, 1H), 4,26-4,17 (м, 2H), 3,82-3,74 (м, 2H), 3,44 (с, 3H); ЖХ/МС m/z (М+Н)+=230,9.
Пример получения 148: (S)- N -(4-фтор-2-(2-метоксиэтокси)-5-нитрофенил)-2-морфолинопропанамид
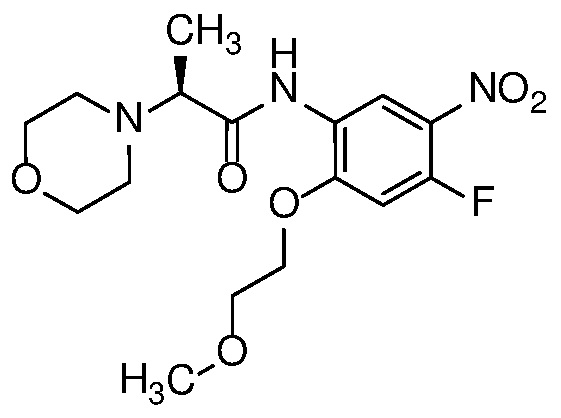
Раствор из Примера получения 147 (590 мг, 2,56 ммоль) и Примера получения 19 (490 мг, 3,08 ммоль) в пиридине (37 мл) при 20°С обрабатывают EDCI (983 мг, 5,13 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов и затем выливают в воду (40 мл). Смесь экстрагируют EtOAc (2× 40 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), с получением указанного в заголовке соединения 148 (398 мг, 42%). 1H ЯМР (400 МГц, CDCl3) δ 10,01 (с, 1H), 9,29 (д, 1H), 6,76 (д, 1H), 4,33-4,21 (м, 2H), 3,91-3,78 (м, 6H), 3,46 (с, 3Н), 3,27 (кв, 1Н), 2,72-2,50 (м, 4Н), 1,34 (д, 3Н); ЖХ/МС m/z (М+Н)+=372,0.
Пример получения 149: (S)- N -(4-фтор-2-(2-метоксиэтокси)-5-нитрофенил)- N- метил-2-морфолинопропанамид
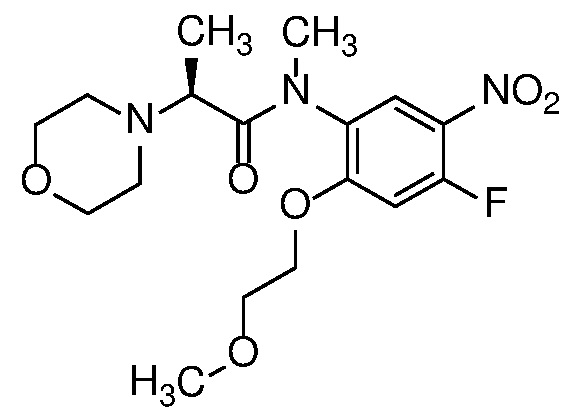
Раствор из Примера получения 148 (202 мг, 0,54 ммоль) в ТГФ (3 мл) при 0°С обрабатывают KOtBu (67 мг, 0,59 ммоль). После перемешивания в течение 1 часа добавляют раствор йодистого метила (84,7 мг, 0,59 ммоль) в ТГФ (3 мл) и смесь перемешивают при комнатной температуре в течение 16 часов. Смесь обрабатывают насыщ. водным NH4Cl (15 мл) и смесь экстрагируют EtOAc (20 мл). Органический экстракт объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (262 мг, 92%). 1H ЯМР (400 МГц, CDCl3) δ 8,28 (д, 0,5H), 6,87 (дд, 1H), 4,31-4,17 (м, 2H), 3,78-3,67 (м, 2H), 3,63 (т, 2H), 3,57-3,43 (м, 1Н), 3,38 (д, 3Н), 3,17 (д, 3Н), 2,61-2,14 (м, 4Н), 1,18 (д, 1,5Н), 1,10 (д, 1,5Н); 19F ЯМР (376 МГц, CDCl3) δ -111,09.; ЖХ/МС m/z (М+Н)+=386,1.
Пример получения 150: (S)- N -(4-амино-2-(2-метоксиэтокси)-5-нитрофенил)- N- метил-2-морфолинопропанамид
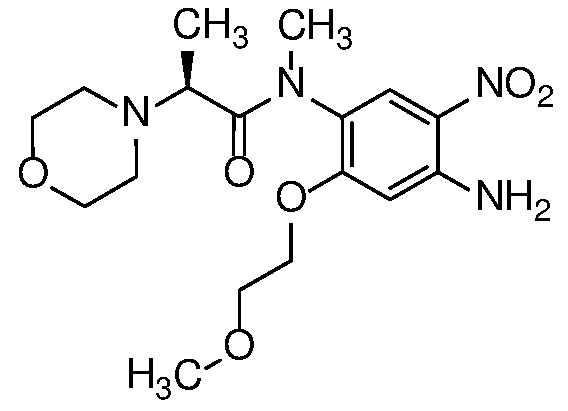
Раствор из Примера получения 149 (262 мг, 0,68 ммоль) в EtOH (5 мл) при 15°С обрабатывают конц. NH4OH (4,6 г, 130 ммоль). Смесь нагревают при 50°С и перемешивают в течение 16 часов. Смесь концентрируют, разбавляют H2O (10 мл) и экстрагируют EtOAc (2 х 10 мл). Водный слой дополнительно экстрагируют смесью MeOH:ДХМ (10 мл:10 мл). Органические экстракты объединяют, сушат, фильтруют и концентрируют с получением указанного в заголовке соединения 150 (86 мг, 33%). ЖХ/МС m/z (М+Н)= 383,1.
Пример получения 151: (S)- N -(4,5-диамино-2-(2-метоксиэтокси)фенил)- N- метил-2-морфолинопропанамид
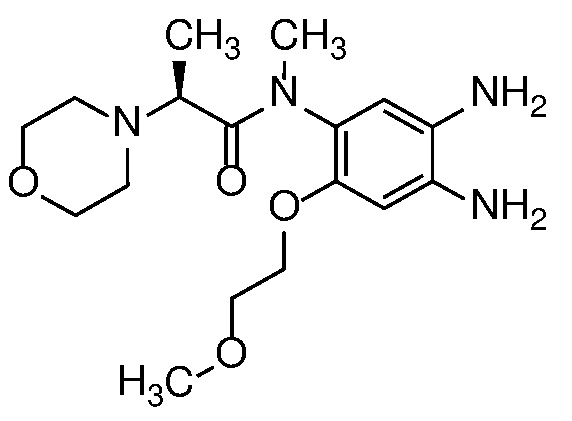
Раствор из Примера получения 150 (86 мг, 0,22 ммоль) в МеОН (2 мл) обрабатывают 10% Pd/C (23,6 мг). Смесь дегазируют аргоном (3 раза), а затем Н2 (3 раза). Затем смесь перемешивают в атмосфере H2 (1 атм) в течение 20 ч при комнатной температуре. Смесь фильтруют и твердые вещества промывают МеОН (3 раза). Фильтрат собирают и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOH/ПЭ, 0-10%), с получением указанного в заголовке соединения 151 (71 мг, 73%). ЖХ/МС m/z (М+Н)+=353,1.
Пример получения 152: (S)- N -(6-(2-метоксиэтокси)-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
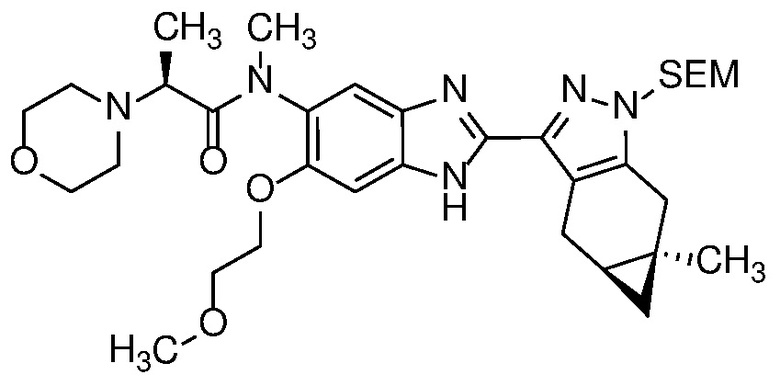
Раствор из Примера получения 151 (71 мг, 0,20 ммоль) и Na2S2O5 (19,1 мг, 0,10 ммоль) в ДМФ (1,0 мл) обрабатывают 9 (62 мг, 0,20 ммоль) и ДМСО (39 мг, 0,50 ммоль). ммоль). Смесь нагревают при 110°С в течение 16 ч, а затем выливают в 3% водный раствор LiCl (5 мл). Смесь экстрагируют EtOAc (10 мл). Органический экстракт собирают, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (160 мг, 120%). ЖХ/МС m/z (М+Н)+=639,3.
Пример получения 153: (4aS,5aR)-3-(5-бром-7-метил-1 H- бензо[d]имидазол-2-ил)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
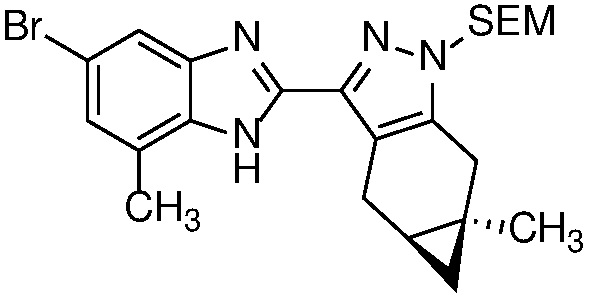
Раствор 5-бром-3-метилбензол-1,2-диамина (980 мг, 4,87 ммоль) и Na2S2O5 (463 мг, 2,44 ммоль) в ДМФ (24 мл) обрабатывают 9 (1,49 г, 4,87 ммоль) и ДМСО (952 мг, 12,2 ммоль). Смесь нагревают при 110°С в течение 16 часов. Смесь охлаждают до КТ и выливают в 3% водн. LiCl (100 мл). Твердое вещество собирают фильтрованием и фильтрат экстрагируют EtOAc (2× 100 мл). Органические слои объединяют с собранным твердым веществом и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), с получением указанного в заголовке соединения (2,17 г, 91%). 1H ЯМР (400 МГц, CD3OD) δ 7,57 (с, 1H), 7,17 (дд, 1H), 5,58-5,40 (м, 2H), 3,61 (дд, 2H), 3,38 (д, 1H), 3,26-3,02 (м, 2H), 2,82-2,68 (м, 1H), 2,58 (с, 3H), 1,30 (с, 3H), 1,17 (дт, 1H), 0,96-0,78 (м, 2H), 0,43 (дд, 1H), 0,26 (т, 1H), -0,04 (с, 9H); ЖХ/МС m/z (М+Н)+=488,8.
Пример получения 154: (4aS,5aR)-3-(6-бром-4-метил-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-2-ил)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол
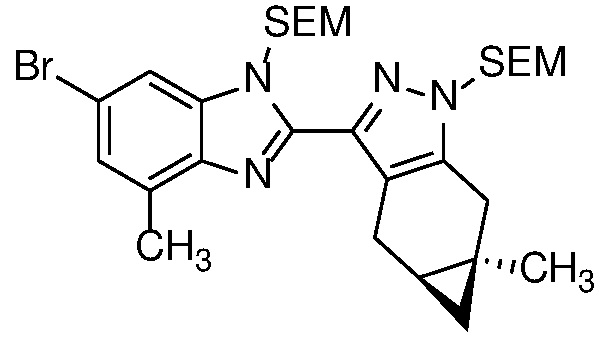
Раствор из Примера получения 153 (1,87 г, 3,84 ммоль) в ТГФ (38 мл) при 0°С обрабатывают NaH (184 мг, 4,6 ммоль) и смесь перемешивают в течение 30 мин. Добавляют SEM-Cl (703 мг, 4,22 ммоль), смесь нагревают до комнатной температуры и перемешивают в течение 2,5 часов. Реакционную смесь охлаждают до 5°С и обрабатывают насыщ. водным NH4Cl (20 мл). Смесь экстрагируют EtOAc и органический слой концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-10%), с получением указанного в заголовке соединения 154 (2,4 г, 92%). ЖХ/МС m/z (М+Н)+=618,9.
Пример получения 155: трет -бутил(4-метил-2-((4aS,5aR)-5а-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)карбамат
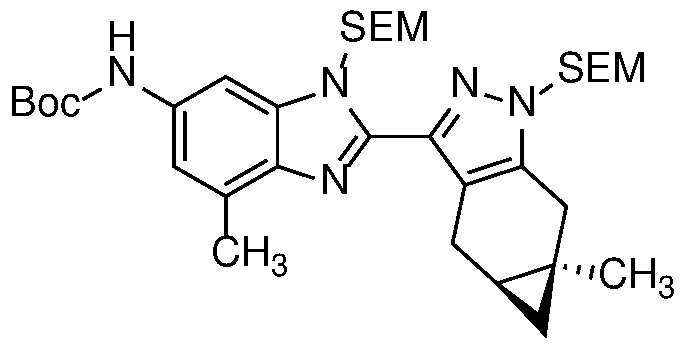
Раствор из Примера получения 154 (800 мг, 1,29 ммоль) в трет-амиловом спирте (13 мл) обрабатывают трет-бутилкарбаматом (182 мг, 1,55 ммоль), Cs2CO3 (844 мг, 2,59 ммоль), QPhos (184 мг, 0,26 ммоль) и Pd2(dba)3 (59 мг, 0,065 ммоль). Смесь нагревают при 100°С в течение 16 часов. Смесь охлаждают до комнатной температуры и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), получая 500 мг указанного в заголовке соединения (59%). ЖХ/МС m/z (М+Н)+=654,0.
Пример получения 156: трет -бутилметил(4-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)карбамат
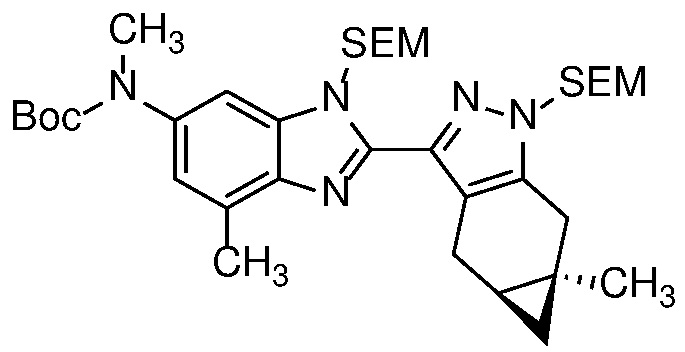
Раствор из Примера получения 155 (500 мг, 0,77 ммоль) в ТГФ (11 мл) при 0°С обрабатывают NaH (122 мг, 3,1 ммоль). Смесь перемешивают в течение 30 мин и добавляют йодистый метил (130 мг, 0,92 ммоль). Смесь нагревают до 15°С и перемешивают в течение 16 часов. Смесь обрабатывают насыщ. водным NH4Cl и экстрагируют EtOAc (2× 10 мл). Объединенные органические слои концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-20%), с получением указанного в заголовке соединения (308 мг, 74%). ЖХ/МС m/z (М+Н)+=668,0.
Пример получения 157: N, 4-диметил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-амин
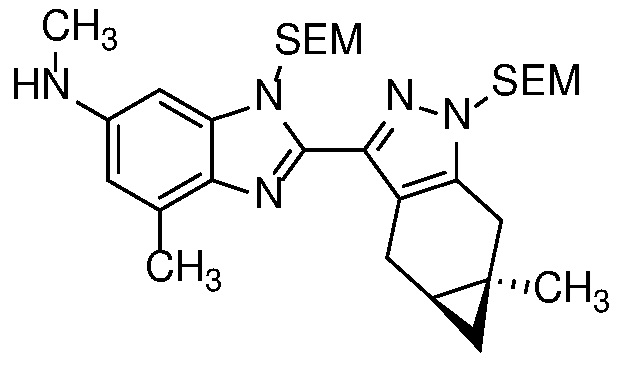
Раствор из Примера получения 156 (380 мг, 0,57 ммоль) в ДХМ (11 мл) при 0°С обрабатывают ZnBr2 (641 мг, 2,84 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Смесь выливают в насыщ. водным NaHCO3 (20 мл) и экстрагируют ДХМ (2× 20 мл). Объединенные органические слои концентрируют с получением указанного в заголовке соединения (170 мг, 90%). ЖХ/МС m/z (М+Н)+=567,9.
Пример получения 158: (S)- N -метил- N -(4-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1 H- бензо[d]имидазол-6-ил)-2-морфолинопропанамид
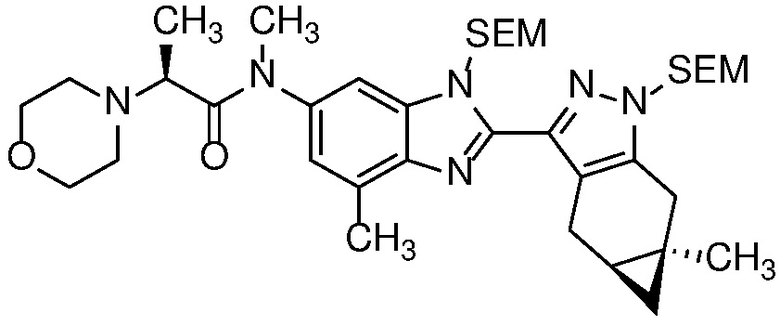
Раствор из Примера получения 157 (300 мг, 0,53 ммоль) и Примера получения 19 (124 мг, 0,63 ммоль) в пиридине (7,6 мл) обрабатывают EDCI (203 мг, 1,1 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов. Смесь распределяют между водой (50 мл) и EtOAc (50 мл). Органический слой отделяют и органический слой концентрируют, с получением указанного в заголовке соединения (380 мг, количественно). ЖХ/МС m/z (М+Н)+=709,0.
Пример получения 159: 2-бром-4-фтор-5-нитробензонитрил
К раствору 2-бром-4-фторбензонитрила (1,0 г, 5,0 ммоль) в конц. H2SO4 (5,0 мл) добавляют порциями KNO3 (556 мг, 5,50 ммоль) при 0°, а затем перемешивают при 25° в течение 2 часов. Реакционную смесь выливают в воду со льдом и смесь экстрагируют этилацетатом (3× 10 мл). Объединенные органические слои промывают раствором соли (10 мл), сушат (Na2SO4) и концентрируют с получением указанного в заголовке соединения (1,2 г, 98%). 1H ЯМР (400 МГц, CDCl3) δ 8,45 (д, J=7,3 Гц, 1H), 7,75 (д, J=9,5 Гц, 1H).
Пример получения 160: 4-амино-2-бром-5-нитробензонитрил
К раствору из Примера получения 159 (1,10 г, 4,490 ммоль) в ТГФ (40 мл) добавляют конц. NH4OH (0,63 мл, 4,49 ммоль) при 0°С. Реакционную смесь перемешивают при 25°С в течение 1 часа. Смесь фильтруют и фильтрат концентрируют с получением указанного в заголовке соединения (1,02 г, 94%). 1H ЯМР (400 МГц, ДМСО-d6) δ 8,51 (с, 1H), 8,17 (с, 2H), 7,40 (с, 1H).
Пример получения 161: 4,5-диамино-2-бромбензонитрил
К раствору из Примера получения 160 (1,11 г, 4,58 ммоль) в EtOH (20 мл) и H2O (20 мл) добавляют NH4Cl (1,23 г, 22,9 ммоль) при 25°С с последующим добавлением порошка железа (1,28 г, 22,9 ммоль). Смесь перемешивают при 25°С в течение 16 часов. Реакционную смесь фильтруют через диатомовую землю, осадок на фильтре промывают EtOH (2× 20 мл) и фильтрат концентрируют. Остаток растворяют в EtOAc и промывают раствором соли, водную фазу экстрагируют EtOAc (2× 20 мл), объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (860 мг, 88%). 1H ЯМР (400 МГц, CDCl3) δ 6,86 (с, 1H), 6,82 (с, 1H), 3,86 (с, 2H), 3,34 (с, 2H).
Пример получения 162: 6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-карбонитрил
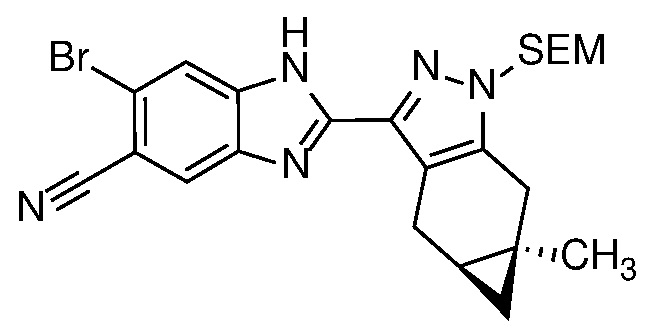
К раствору из Примера получения 161 (760 мг, 3,58 ммоль) в ДМФ (15 мл) добавляют Na2S2O5 (341 мг, 1,79 ммоль), ДМСО (700 мг, 8,96 ммоль) и раствор из Примера получения 17 (1,21 г, 3,94 ммоль) в ДМФ (3,0 мл). Реакционную смесь перемешивают при 110°С в течение 16 ч, затем концентрируют. Неочищенный продукт очищают хроматографией на силикагеле (двуокись кремния, EtOAc/ПЭ=0-30%), с получением указанного в заголовке соединения (1,38 г, 68%). ЖХ/МС m/z (M+H)+=499,1
Пример получения 163: 6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-5-карбонитрил и 5-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-карбонитрил
К суспензии NaH (133 мг, 3,32 ммоль) в ТГФ (5,0 мл) добавляют раствор из Примера получения 162 (1,380 г, 2,76 ммоль) в ТГФ (10 мл) при 0°С. После перемешивания при 0°C в течение 15 мин по каплям добавляют SEM-Cl (0,69 г, 4,15 ммоль) и реакционную смесь перемешивают при 20°С в течение 2 часов. Реакционную смесь выливают на лед, и смесь экстрагируют EtOAc (3× 10 мл). Объединенные органические слои промывают раствором соли (10 мл), сушат (Na2SO4) и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-30%), получая указанные в заголовке соединения в виде смеси (1,14 г, 66%). 1H ЯМР (400 МГц, CDCl3) δ 8,08 (д, 1H), 7,93 (д, 1H), 6,23-6,11 (м, 2H), 5,50-5,38 (м, 2H), 3,68-3,50 (м, 4H), 3,49 (м, 1H), 3,21-3,07 (м, 2H), 2,77 (д, J=16,3 Гц, 1H), 1,32 (с, 3H), 1,17 (дт, J=10,0, 5,5 Гц, 1H), 1,00-0,89 (м, 2H), 0,92-0,81 (м, 2H), 0,45 (дд, J=8,8, 4,7 Гц, 1H), 0,28 (т, J=5,1 Гц, 1H), 0,01 (с, 9H)), -0,08 (д, J=2,7 Гц, 9H); ЖХ/МС m/z (М+Н)+=629,1.
Пример получения 164: 2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-6-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-5-карбонитрил и 2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-5-(метиламино)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-карбонитрил
Раствор из Примера получения 163 (1,01 г, 1,61 ммоль) в ДМФ (8 мл) дегазируют азотом. Раствор обрабатывают N-(2,6-диметилфенил)-6-гидроксипиколинамидом (156 мг, 0,64 ммоль), K3PO4 (1,02 г, 4,82 ммоль), CuI (153 мг, 0,80 ммоль) и 2М СН3NH2 в ТГФ (99,8 мг, 3,21 ммоль) при 20°С. Реакционный флакон закрывают и нагревают при 110°С в течение 16 часов. Реакционную смесь концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-10%), с получением указанного в заголовке соединения в виде смеси (670 мг, 68,7%). 1H ЯМР (400 МГц, CDCl3) δ 7,87 (с, 0,5H), 7,65 (с, 0,5H), 7,01 (с, 0,5H), 6,67 (с, 0,5H), 6,15-6,01 (м, 2H), 5,49-5,36 (м, 2H), 4,64 (с, 0H), 3,63-3,49 (м, 5H), 3,53-3,40 (м, 1H), 3,11 (т, J=18,0 Гц, 2H), 2,99 (д, J=5,6 Гц, 3H), 2,75 (д, J=16,9 Гц, 1H), 1,30 (с, 3H), 1,14 (дт, J=9,8, 5,3 Гц, 1H), 0,98-0,89 (м, 2H), 0,89-0,80 (м, 2H), 0,46-0,38 (м, 1H), 0,27 (т, J=5,0 Гц, 1H), -0,00 (д, J=0,8 Гц, 9H), -0,09 (д, J=4,3 Гц, 9H); ЖХ/МС m/z (М+Н)+=579,3.
Пример получения 165: Стадия 1. метил-6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-4-карбоксилат
К раствору метил-2,3-диамино-5-бромбензоата (1,57 г, 6,41 ммоль) в ДМФ (30 мл) при 20°С добавляют Пример получения 9 (1,96 г, 6,41 ммоль) и Na2S2O5 (1,2 г, 6,40 ммоль). Смесь нагревают при 110°С в течение 16 ч, затем охлаждают до комнатной температуры и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-75%), с получением указанного в заголовке соединения (1,23 г, 36%). ЖХ/МС m/z (M+H)+=533,1 (81Br).
Пример получения 166: метил-6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбоксилат
К раствору из Примера получения 165 (1,20 г, 2,26 ммоль) в ТГФ (50 мл) при 0°C добавляют NaH (117 мг, 2,93 ммоль) и SEM-Cl (565 мг, 3,39 ммоль). Смесь перемешивают в течение 20 ч при комнатной температуре. Реакцию обрабатывают насыщ. водным NH4Cl (1,0 мл) и воду (50 мл). Смесь экстрагируют EtOAc (2× 150 мл). Объединенные органические экстракты промывают раствором соли, сушат (Na2SO4) и концентрируют с получением указанного в заголовке соединения (1,49 г, 99%). ЖХ/МС m/z (M+H)+=663,1 (81Br).
Пример получения 167: 6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбоновая кислота
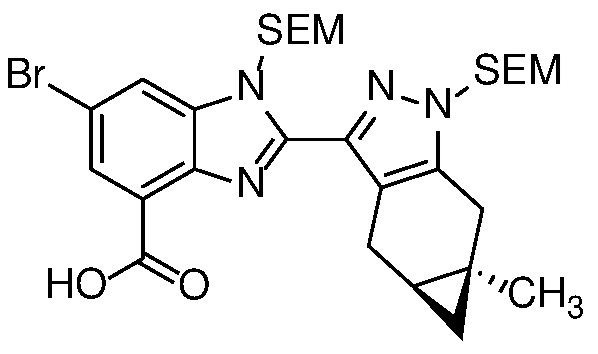
К раствору из Примера получения 166 (900 мг, 1,36 ммоль) в MeOH (50 мл) при комнатной температуре добавляют 10% NaOH (5 мл). Смесь перемешивают при комнатной температуре в течение 15 ч, охлаждают до 0°C и подкисляют 1N HCl до pH ~1. Затем смесь разбавляют водой (50 мл) и экстрагируют EtOAc (3× 50 мл). Органические экстракты объединяют, сушат (Na2SO4) и концентрируют с получением указанного в заголовке соединения (880 мг, 100%). ЖХ/МС m/z (M+H)+=649,1 (81Br).
Пример получения 168: 6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбоксамид
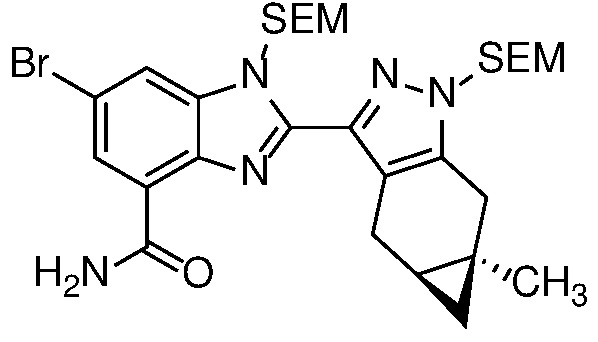
К раствору из Примера получения 167 (850 мг, 1,31 ммоль) в ДМФ (10 мл) при комнатной температуре добавляют ГАТУ (649 мг, 1,71 ммоль), Et3N (1 мл) и NH4Cl (211 мг, 3,94 ммоль). Смесь перемешивают при комнатной температуре в течение 15 часов. Смесь разбавляют водой (50 мл) и экстрагируют EtOAc (3× 50 мл). Органические экстракты объединяют, сушат (Na2SO4) и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), с получением указанного в заголовке соединения (400 мг, 47%). ЖХ/МС m/z (M+H)+=648,1 (81Br).
Пример получения 169: 6-бром-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбонитрил
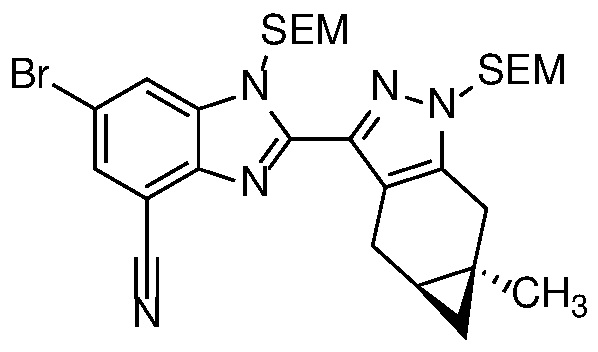
К раствору из Примера получения 168 (400 мг, 0,62 ммоль) в ТГФ (20 мл) при 0°C добавляют Et3N (375 мг, 3,71 ммоль) и АТФК (390 мг, 1,86 ммоль). Смесь перемешивают при комнатной температуре в течение 15 часов. Смесь разбавляют смесью 1:1 вода/ДХМ (100 мл) и разделяют слои. Водный слой экстрагируют ДХМ (50 мл). Объединенные органические экстракты промывают раствором соли (50 мл), сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (389 мг, 100%). ЖХ/МС m/z (M+H)+=630,1 (81Br).
Пример получения 170: трет-бутил-(4-циано-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-ил)карбамат
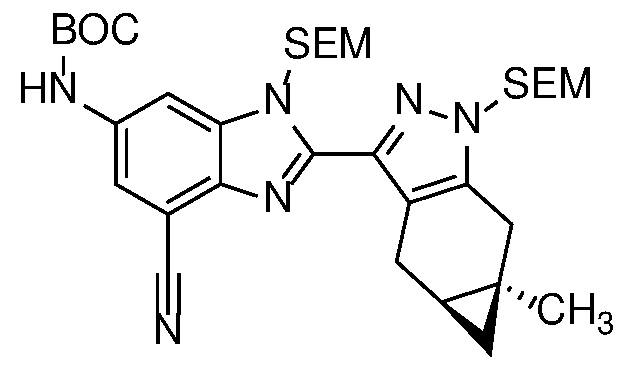
К раствору из Примера получения 169 (389 мг, 0,62 ммоль) в трет-амиловом спирте (10 мл) и диоксане (10 мл) в атмосфере N2 добавляют трет-бутилкарбамат (217 мг, 1,86 ммоль), Cs2CO3 (403 мг, 1,24 ммоль), трет-BuDavePhos (84,5 мг, 0,25 ммоль) и Pd2(dba)3 (57 мг, 0,06 ммоль). Смесь перемешивают при 100°С в течение 15 часов. Реакцию охлаждают до КТ и концентрируют. Неочищенный продукт очищают хроматографией (диоксид кремния, EtOAc/ПЭ=0-75%), с получением указанного в заголовке соединения (320 мг, 78%). ЖХ/МС m/z (M+H)+=665,3
Пример получения 171: 6-амино-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-4-карбонитрил
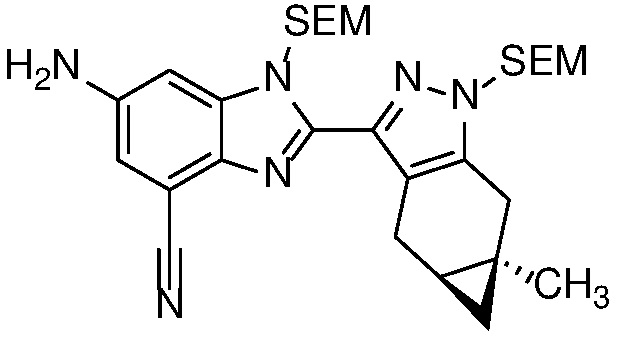
Раствор из Примера получения 170 (540 мг, 0,81 ммоль) в ДХМ (50 мл) обрабатывают ZnBr2 (914 мг, 4,06 ммоль). Смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь фильтруют, фильтрат помещают в ДХМ (150 мл) и промывают насыщ. водным NaHCO3 (50 мл). Слои разделяют и водный слой экстрагируют ДХМ (50 мл). Объединенные органические экстракты промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют с получением указанного в заголовке соединения (155 мг, 34%). ЖХ/МС m/z (M+H)+=565,3
Пример получения 172: (R)-N-(4-циано-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-ил)-2-(тетрагидро-2H-пиран-4-ил)пропенамид
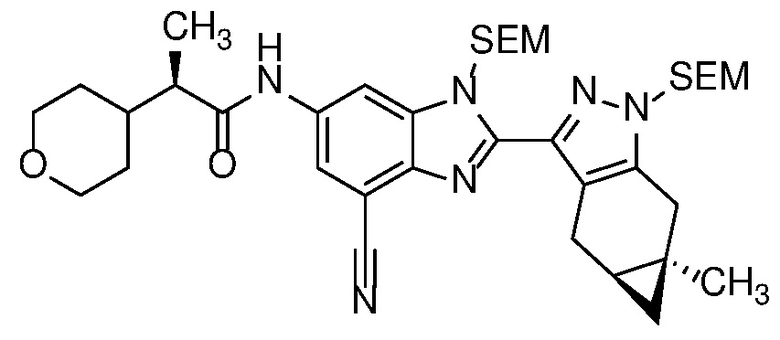
К раствору из Примера получения 171 (70 мг, 0,12 ммоль) в ТГФ (10 мл) при комнатной температуре добавляют Пример получения 22 (39 мг, 0,25 ммоль), 2-хлор-1-метилпиридиния иодид (63 мг, 0,25 ммоль) и iPr2NEt (80 мг, 0,62 ммоль). Смесь перемешивают при 60°С в течение 15 часов. Реакционную смесь охлаждают до КТ и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (80 мг, 92%). ЖХ/МС m/z (M+H)+=705,3
Пример получения 173: (R)-N-(4-циано-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)пропенамид
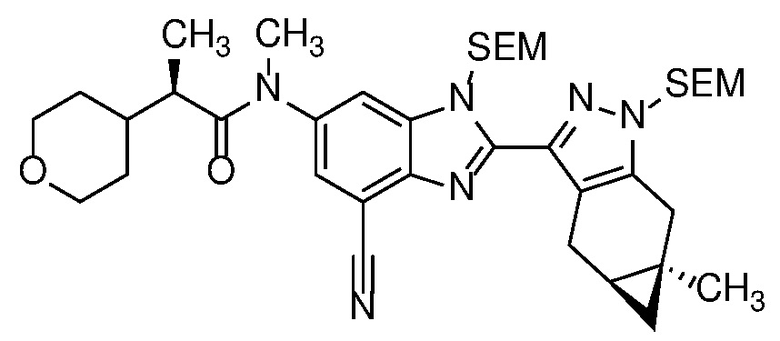
Раствор из Примера получения 172 (80 мг, 0,11 ммоль) в ТГФ (5 мл) при 0°С обрабатывают NaH (6,81 мг, 0,17 ммоль), и затем MeI (24,2 мг, 0,17 ммоль). Смесь перемешивают при комнатной температуре в течение 2 часов. Смесь обрабатывают насыщ. водным NH4Cl (0,3 мл) и водой (50 мл) и экстрагируют EtOAc (2× 50 мл). Объединенные органические экстракты промывают раствором соли, сушат (Na2SO4) и концентрируют с получением указанного в заголовке соединения (82 мг, 100%). ЖХ/МС m/z (М+Н)+=719,4.
Примеры
Пример 1: (S)- N- метил -N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
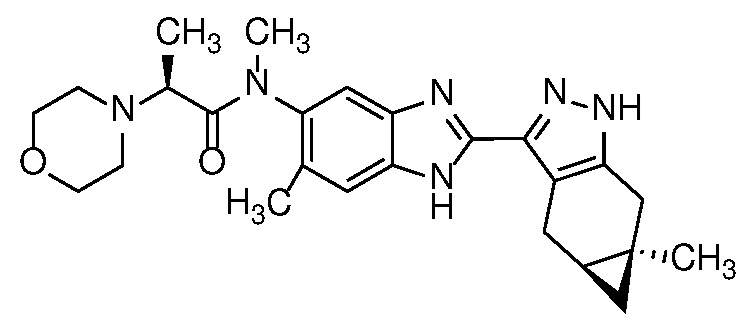
Стадия 1: (S)- N- метил -N -(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
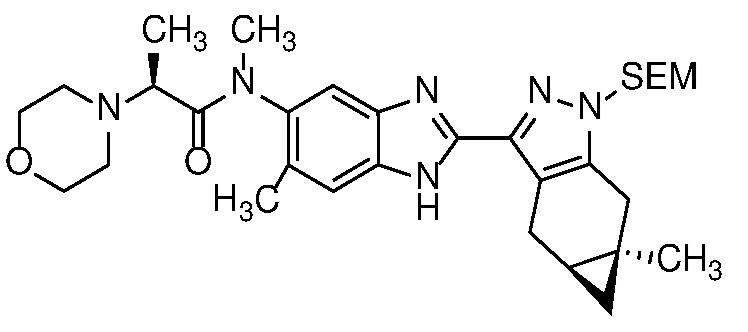
Смесь из примера получения 9 (20,2 г, 66,2 ммоль) и Na2S2O5 (6,2 г, 32,6 ммоль) обрабатывают раствором из Примера получения 30 (20 г, 65,3 ммоль) в ДМФ (114 мл). Смесь обрабатывают ДМСО (11,6 мл, 163 ммоль) и нагревают при 80°С в течение 16 часов. Смесь охлаждают до комнатной температуры и выливают в воду со льдом. pH смеси доводят до pH 7-8 с помощью насыщ. водным NaHCO3 и смесь перемешивают еще 2 часа. Твердые вещества собирают фильтрованием. Твердые вещества растворяют в ДХМ, промывают раствором соли, водой и сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, MeOH/EtOAc=0-10%), с получением указанного в заголовке соединения стадии 1 (32,0 г, 85%). 1H ЯМР (400 МГц, CD3OD) δ 7,69-7,32 (м, 2H), 5,53-5,40 (м, 2H), 3,77-3,55 (м, 4H), 3,52-3,36 (м, 1H), 3,27- 3,20 (м, 3Н), 3,19-3,03 (м, 3Н), 2,81-2,72 (м, 1Н), 2,63-2,49 (м, 2Н), 2,44-2,31 (м, 3Н), 2,30-2,20 (м, 2Н)), 1,22-1,14 (м, 3Н), 1,13-1,08 (м, 1Н), 0,94-0,84 (м, 7Н), 0,49-0,41 (м, 1Н), 0,30-0,22 (м, 1Н), 0,02-- 0,10 (м, 9Н); ЖХ/МС m/z (М+Н)+=579,4.
Стадия 2: (S)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
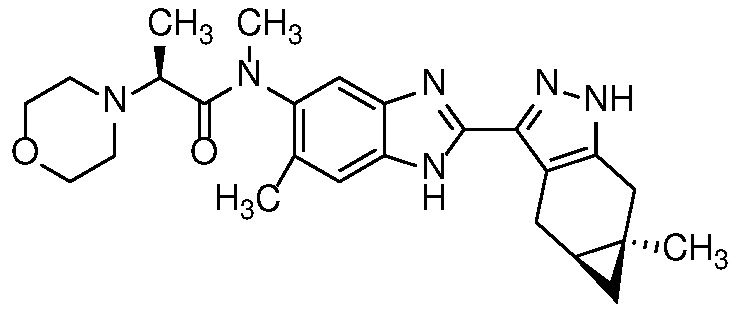
Раствор силилового эфира со стадии 1 (30,4 г, 52,6 ммоль) в ДХМ (50 мл) охлаждают до 0°С. Предварительно смешанный раствор ТФК (76,4 мл, 1 моль) в ДХМ (150 мл) добавляют по каплям в течение 30 минут. Смесь нагревают до комнатной температуры и затем перемешивают в течение 16 часов. Смесь обрабатывают толуолом (100 мл) и концентрируют. Полученный остаток подвергают азеотропной перегонке с толуолом (2× 250 мл). Остаток растворяют в EtOH (210 мл), охлаждают до 0°C и обрабатывают конц. NH4OH (138 мл) по каплям в течение 30 мин. Смесь нагревают до комнатной температуры и перемешивают в течение 2 часов. Растворитель концентрируют и подвергают азеотропной перегонке с гептанами (2× 200 мл). Остаток растворяют в ДХМ и последовательно промывают водным раствором 1N HaOH, раствором соли, водой, затем сушат (MgSO4), фильтруют и концентрируют. Полученное твердое вещество подвергают азеотропной перегонке с диэтиловым эфиром (х2). Полученное твердое вещество перекристаллизовывают из смеси 25% вода/MeCN (300 мл), фильтруют и сушат с получением указанного в заголовке соединения в виде кристаллического белого твердого вещества (17,45 г, 74%). 1H ЯМР (400 МГц, CD3OD) δ 7,68-7,32 (м, 2H), 3,79-3,56 (м, 4H), 3,51-3,33 (м, 1H), 3,27-3,20 (м, 3H), 3,16-3,01 (м, 3H), 2,81-2,72 (м, 1H), 2,61-2,49 (м, 2H), 2,45-2,31 (м, 3H), 2,32-2,22 (м, 2H), 1,34-1,25 (м, 3H)), 1,23-1,01 (м, 4Н), 0,45-0,35 (м, 1Н), 0,30-0,21 (м, 1Н); 1H ЯМР (500 МГц, 140°C, ДМФ-d7) δ 12,52 (с, 1H), 12,09 (с, 1H), 7,58 (с, 1,5H), 7,46 (с, 0,5H), 3,68-3,60 (м, 4Н), 3,61-3,52 (м, 1Н), 3,38-3,25 (ушс, 3Н), 3,17 (д, 2Н), 2,88 (т, 2Н), 2,74-2,65 (м, 2Н), 2,64-2,61 (ушс, 3H), 2,43-2,31 (м, 2H), 1,41 (с, 3H), 1,29-1,11 (м, 4H), 0,56-0,50 (м, 1H), 0,37-0,32 (м, 1Н); Способ СЖХ: Chiral Tech AD-H 250 мм × 4,6 мм × 5 мкм, от 10 до 60% с 0,2% изопропиламина в MeOH/CO2(g), 3,0 мл/мин, температура колонки 15°С, время удержания=6,59 мин (40,9%) и 9,54 мин (59,1%), 100% эи. ЖХ/МС m/z (М+Н)+=449,1.
Пример 1.1: (S)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид, дигидрат (кристаллическая форма 1)
Раствор силилового эфира из примера 1, стадия 1 (8,90 г, 15,4 ммоль) в ДХМ (59 мл) и ТФК (29 мл) перемешивают в течение 16 часов. Смесь концентрируют и остаток подвергают азеотропной перегонке с толуолом (2× 100 мл). Остаток растворяют в смеси 3:2 (об./об.) EtOH/конц. NH4OH (125 мл). Смесь перемешивают при комнатной температуре в течение 2 часов. Растворитель концентрируют и подвергают азеотропной перегонке с гептанами (2× 50 мл). Остаток растворяют в ДХМ и последовательно промывают водой и раствором соли. Водную фазу экстрагируют ДХМ (3 раза), сушат (MgSO4), фильтруют и концентрируют. Остаток очищают СЖХ (Princeton PPU 250 мм x 50 мм, 5 мкм; изократное элюирование 75% CO2/25% (0,2% 7N MeOH/MeOH; 80 мл/мин) с получением твердых веществ (5,3 г). Твердые вещества (5,3 г) растворяют в ДХМ (200 мл) и промывают (2× 50 мл) деионизированной водой. Водные слои объединяют и экстрагируют ДХМ (2× 50 мл). Объединенные слои ДХМ сушат (MgSO4), фильтруют через Celite®, концентрируют и сушат в вакууме с получением твердых веществ (4,5 г). Твердые вещества (4,5 г) суспендируют в MeCN (90,4 мл) при комнатной температуре, обрабатывают водой (22,3 мл) и смесь перемешивают при 58°C в течение 1 часа до растворения всех твердых веществ. Смеси дают остыть до комнатной температуры в течение 18 часов и затем перемешивают при комнатной температуре в течение 24 часов. Твердые вещества собирают фильтрованием и сушат в вакууме при 60°С в течение 60 ч с получением указанного в заголовке соединения (3,55 г, 51%). ЯМР для указанного в заголовке соединения соответствует таковому для примера 1.
Порошковая рентгеновская дифракция (PXRD)
Анализ PXRD проводят с использованием дифрактометра Bruker AXS D8 Endeavour, оснащенного источником излучения Cu. Щель расходимости устанавливают на постоянное освещение 11 мм. Дифрагированное излучение регистрируют датчиком PSD-Lynx Eye с отверстием PSD датчика, установленного на 2,949 градуса. Напряжение и сила тока рентгеновской трубки устанавливают на 40 кВ и 40 мА, соответственно. Данные собирают в гониометре Тэта-Тэта при длине волны Cu от 3,0 до 40,0 градусов 2-Тэта с использованием размера шага 0,016 градуса и времени шага 0,3 секунды. Противорассеивающий экран устанавливают на фиксированное расстояние 1,5 мм. Образцы вращают со скоростью 15 об/мин во время сбора. Образцы готовят, помещая их в силиконовый держатель для образцов с низким фоном и вращая их во время сбора. Данные собирают с помощью программного обеспечения Bruker DIFFRAC Plus, и анализ выполняют с помощью программного обеспечения EVA diffract plus. Файл данных PXRD не обрабатывают перед поиском пиков. Используя алгоритм поиска пиков в программном обеспечении EVA, пики, выбранные с пороговым значением 1, используют для предварительного присвоения пиков. Для обеспечения достоверности, корректировки вносят вручную; результаты автоматических назначений проверяют визуально, и положения пиков регулируют до максимума пика. Обычно выбирают пики с относительной интенсивностью ≥3%. Пики, которые не были разрешены или не согласовывались с шумом, не выбирают. Типовая ошибка, связанная с положением пика по данным PXRD, указанным в USP, составляет до ± 0,2° 2-тета (USP-941). Диаграмма PXRD для указанного в заголовке соединения представлена на фигуре 1, и соответствующий список пиков приведен в таблице 1 ниже.
Термогравиметрический анализ (ТГА)
ТГА проводят с использованием термогравиметрического анализатора Discovery TGA (TA Instruments). Образцы массой приблизительно 10 мг взвешивают в алюминиевых чашках и нагревают от температуры окружающей среды до 250°С со скоростью нагревания 10°С/мин при продувке азотом (10 мл/мин как для камеры для образцов, так и для весов). ТГА указанного в заголовке соединения представлен на фигуре 6. Наблюдаемая потеря массы 7,4% согласуется с теоретической потерей массы 7,4% для дигидрата формы 1.
Пример 1.2a: (S)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид, дигидрат (кристаллическая форма 2)
Раствор силилового эфира из примера 1, стадия 1 (30,4 г, 52,6 ммоль) в ДХМ (50 мл) охлаждают до 0°С. Предварительно смешанный раствор ТФК (76,4 мл, 1 моль) в ДХМ (150 мл) добавляют по каплям в течение 30 минут. Смесь нагревают до комнатной температуры и затем перемешивают в течение 16 часов. Смесь обрабатывают толуолом (100 мл) и концентрируют. Полученный остаток подвергают азеотропной перегонке с толуолом (2× 250 мл). Остаток растворяют в EtOH (210 мл), охлаждают до 0°C и обрабатывают конц. NH4OH (138 мл) по каплям в течение 30 мин. Смесь нагревают до комнатной температуры и перемешивают в течение 2 часов. Растворитель концентрируют и подвергают азеотропной перегонке с гептанами (2× 200 мл). Остаток растворяют в ДХМ и последовательно промывают водным раствором 1N NaOH, раствором соли, водой, затем сушат (MgSO4), фильтруют и концентрируют. Полученное твердое вещество подвергают азеотропной перегонке с диэтиловым эфиром (х2) с получением твердых веществ (24 г). Суспензию этих твердых веществ (24 г) в MeCN (240 мл) и воде (60 мл) нагревают при температуре от 60°С до 70°С в течение 30 мин. Нерастворившиеся твердые вещества удаляют фильтрованием, и фильтрат медленно охлаждают до комнатной температуры. Добавляют затравочные кристаллы (пример 1.1, форма 1) и смесь перемешивают при комнатной температуре в течение примерно 24 часов. Твердые вещества собирают фильтрованием и сушат в вакууме при 50°С с получением указанного в заголовке соединения (17,45 г, 74%).
1H ЯМР (400 МГц, CD3OD) δ 7,68-7,32 (м, 2H), 3,79-3,56 (м, 4H), 3,51-3,33 (м, 1H), 3,27-3,20 (м, 3H), 3,16-3,01 (м, 3H), 2,81-2,72 (м, 1H), 2,61-2,49 (м, 2H), 2,45-2,31 (м, 3H), 2,32-2,22 (м, 2H), 1,34-1,25 (м, 3H)), 1,23-1,01 (м, 4Н), 0,45-0,35 (м, 1Н), 0,30-0,21 (м, 1Н); 1H ЯМР (500 МГц, 140°C, ДМФ-d7) δ 12,52 (с, 1H), 12,09 (с, 1H), 7,58 (с, 1,5H), 7,46 (с, 0,5H), 3,68-3,60 (м, 4Н), 3,61-3,52 (м, 1Н), 3,38-3,25 (ушс, 3Н), 3,17 (д, 2Н), 2,88 (т, 2Н), 2,74-2,65 (м, 2Н), 2,64-2,61 (ушс, 3H), 2,43-2,31 (м, 2H), 1,41 (с, 3H), 1,29-1,11 (м, 4H), 0,56-0,50 (м, 1H), 0,37-0,32 (м, 1Н); Способ СЖХ: Chiral Tech AD-H 250 мм × 4,6 мм × 5 мкм, от 10 до 60% с 0,2% изопропиламина в MeOH/CO2(g), 3,0 мл/мин, температура колонки 15°С, время удержания=6,59 мин (40,9%) и 9,54 мин (59,1%), 100% эи. ЖХ/МС m/z (М+Н)+=449,1.
PXRD
PXRD выполняют в соответствии с процедурой, изложенной в примере 1.1 (форма 1), но с установленной щелью расхождения 10 мм, отверстием PSD датчика, установленным на 2,99 градуса, и размером шага 0,02 градуса. Диаграмма PXRD для указанного в заголовке соединения представлена на фигуре 2 и совмещена с расчетной порошковой диаграммой, полученной из раствора монокристалла из примера 1.4, приведенного ниже. Соответствующий список пиков приведен в Таблице 1 ниже.
Пример 1.2b: (S)-N-метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид, дигидрат (кристаллическая форма 2)
Раствор силилового эфира Примера 1, Стадия 1 (70,0 г, 120,9 ммоль) в ДХМ (150 мл) при температуре около 0°С по каплям обрабатывают смесью 1:1 (об./об.) ДХМ/ТФК (342 мл). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение примерно 16 часов. Смесь концентрируют и остаток подвергают азеотропной перегонке с толуолом (2х). Остаток растворяют в этаноле (300 мл) и обрабатывают по каплям конц. NH4OH (300 мл). Смесь перемешивают при комнатной температуре в течение примерно 24 часов. Растворитель концентрируют. Остаток растворяют в ДХМ и последовательно промывают раствором соли и водой. Экстракт ДХМ сушат (MgSO4), фильтруют и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=50-100%, затем MeOH/EtOAc 0-3%) с получением твердого вещества (партия 1, 31 г). Раствор собранных твердых веществ (2,0 г) в этаноле (12 мл) нагревают примерно до 75°С и добавляют воду (18 мл) с такой скоростью, чтобы поддерживать внутреннюю температуру выше 70°С. Смесь охлаждают примерно до 60°С и обрабатывают дополнительным количеством твердых веществ (100 мг). Смесь перемешивают при температуре примерно 60°С в течение примерно 2 часов, и затем перемешивают при температуре примерно 30°С в течение примерно 18 часов. Смесь охлаждают примерно до 5° и перемешивают в течение примерно 1 часа. Твердые вещества собирают фильтрованием, промывают смесью 1:2 (об./об.) этанол/вода и сушат с получением твердого вещества (партия 2, 1,1 г). Оставшиеся твердые вещества партии 1 (29 г) суспендируют в МТБЭ (150 мл) и перемешивают при температуре около 30°C в течение около 48 часов. Твердые вещества собирают фильтрованием, промывают МТБЭ и сушат с получением твердых веществ (партия 3, 23 г). Объединенные твердые вещества партии 2 и партии 3 (24,1 г) суспендируют в этаноле (150 мл) и нагревают примерно до 75°, и затем добавляют воду (220 мл) с такой скоростью, чтобы поддерживать внутреннюю температуру выше 70°. Раствор перемешивают при температуре около 65°С в течение приблизительно 1 часа, при температуре около 55°С в течение приблизительно 1 часа, при температуре 45°С в течение приблизительно 3 часов и затем при температуре около 35°С в течение приблизительно 48 часов. Твердые вещества собирают фильтрованием, промывают смесью этанол/вода 1:2 (об./об.) и сушат в вакууме с получением указанного в заголовке соединения (20,5 г, 38%). ЯМР и PXRD для указанного в заголовке соединения соответствуют таковым для примера 1.2a.
Пример 1.3: (S)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид, полугидрат (кристаллическая форма 3)
Дигидрат (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1Н-бензо[d]имидазол-5-ил)-2-морфолинопропанамида (кристаллическая форма 2) (400 мг) суспендируют в MeCN (4 мл) и перемешивают при комнатной температуре в течение примерно 18 часов. Твердые вещества собирают фильтрованием и промывают MeCN (около 3 мл). Собранные твердые вещества сушат в вакууме при 50°С в течение 1,5 ч, чтобы получить указанное в заголовке соединение (300 мг, 89%).
TGA и PXRD
TGA и PXRD, соответственно, проводят в соответствии с процедурами, изложенными в примерах 1.1 (форма 1) и 1.2а (форма 2). Диаграмма PXRD для указанного в заголовке соединения представлена на фигуре 3, и соответствующий список пиков приведен в таблице 1 ниже. ТГА для указанного в заголовке соединения представлен на фигуре 7. Наблюдаемая потеря массы 1,8% согласуется с теоретической потерей массы 2% для полугидрата Формы 3.
Список пиков PXRD для кристаллических форм 1, 2 и 3, соответственно, примеров 1.1, 1.2а и 1.3
[1] Диаграмма PXRD для формы 2 совмещена с рассчитанной порошковой диаграммой, полученной из раствора монокристалла примера 1.4 ниже.
Пример 1.4: (S)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид, дигидрат (кристаллическая форма 2)
Дигидрат (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1Н-бензо[d]имидазол-5-ил)-2-морфолинопропанамида (кристаллическая форма 2) (30 мг) растворяют в EtOAc (10 мл) в сцинтилляционной пробирке на 20 мл. Флакон закрывают крышкой, но не затягивают. Флакон оставляют в покое при комнатной температуре примерно на 26 дней. За истекшее время большая часть растворителя испарилась, оставив приблизительно 1 мл EtOAc и указанное в заголовке соединение.
Рентгеновская дифракция монокристалла (SXRD)
SXRD выполняют на дифрактометре Bruker D8 Venture при комнатной температуре. Сбор данных состоит из омега- и фи-сканов. Структура была разрешена методом внутренней фазировки с использованием пакета программ SHELX в орторомбической пространственной группе P212121. В дальнейшем структуру уточняют полноматричным методом наименьших квадратов. Все атомы, отличные от водорода, находят и уточняют с использованием параметров анизотропного смещения. Окончательный R-индекс составил 3,92%. Окончательная разница Фурье не выявляет отсутствующей или неуместной электронной плотности. Таблица 2 содержит структурные данные анализа SXRD.
Данные кристаллической структуры для кристаллической формы Примера 1.4 (Форма 2)
Диаграмма ORTEP для одной из молекул в асимметричном блоке раствора представлена на фигуре 4, с параметрами смещения для 50% вероятности и молекулами воды, для ясности на рисунке опущенными. На фигуре 5 представлена диаграмма ORTEP с параметрами вытеснения с вероятностью 50% и показанными молекулами воды.
Список пиков PXRD из рассчитанной порошковой картины для формы 2 приведен в таблице 3.
Рассчитанный список пиков PXRD на основе данных SXRD для (Форма 2)
Сравнение экспериментальных данных PXRD в таблице 1 кристаллической формы 2 (пример 1.2a) с данными в таблице 3 для рассчитанной картины PXRD кристаллической формы 2 (пример 1.4), полученной из определения структуры монокристалла, показывает хорошую корреляцию пиков.
Пример 2: N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
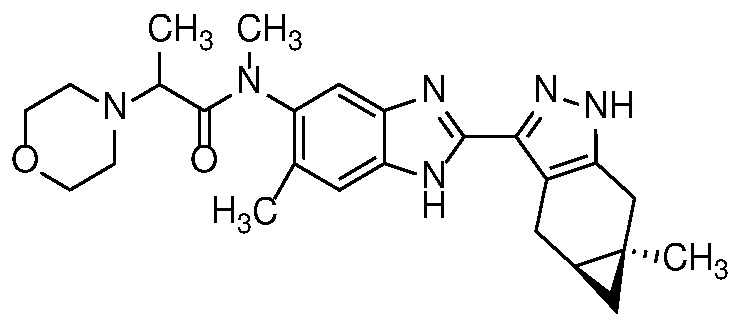
Пример 2 получают в соответствии с процедурой, описанной для примера 1, из примера получения 31 (292 мг) и примера получения 9 (306 мг) с получением 110 мг указанного в заголовке соединения. Способ СЖХ: Chiral Tech AD-H 250 мм × 4,6 мм × 5 мкм, CO2/MeOH (0,2% изопропиламина) от 5 до 60%, 3,0 мл/мин, температура колонки 15°С, время удержания=6,33 мин (13,42%), 6,74 мин (24,37%), 8,35 мин (35,92%) и 9,76 мин (24,37%); ЖХ/МС m/z (М+Н)+=449,5.
Пример 3: (R)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид
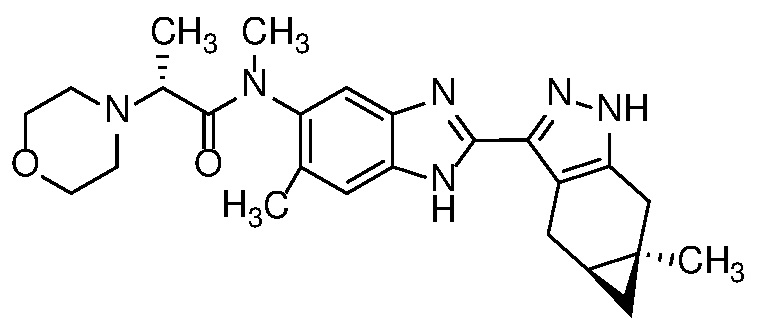
Стадия 1: (R)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)-2- морфолинопропанамид
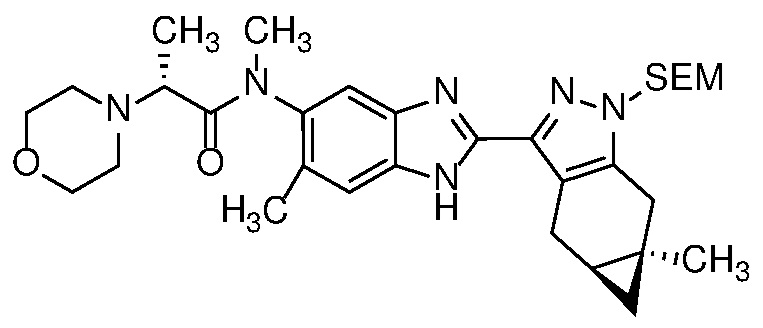
Смесь из примера получения 46 (219 мг, 0,5 ммоль), (R)-2-морфолинопропановой кислоты (398 мг, 2,50 ммоль), EDCI (959 мг, 5,00 ммоль) в пиридине (10,0 мл) нагревают при 80°С в течение 16 ч. Смесь охлаждают до комнатной температуры и разбавляют смесью EtOAc/вода. Органический слой отделяют и последовательно промывают насыщ. водным раствором NH4Cl, раствором соли, сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, 0-10% MeOH/EtOAc) с получением указанного в заголовке соединения 160 (150 мг, 50%). 1H ЯМР (400 МГц, CD3OD) δ 7,68 (с, 1H), 7,53 (с, 1H), 5,62-5,38 (м, 2H), 3,71-3,57 (м, 6H), 3,43 (д, 1H), 3,28 (д, 3H), 3,24-3,04 (м, 3H), 2,81 (д, 1H), 2,67-2,49 (м, 2H), 2,47 (с, 2H), 2,36 (с, 1H), 2,31 (дд, 2H), 1,34 (д, 4H), 1,22 (д, 2H), 1,13 (дд, 1H), 0,98-0,88 (м, 2H), 0,48 (дд, 1H), 0,30 (т, 1H), 0,02--0,02 (м, 9Н); ЖХ/МС m/z (М+Н)+=579,6.
Стадия 2: (R)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид
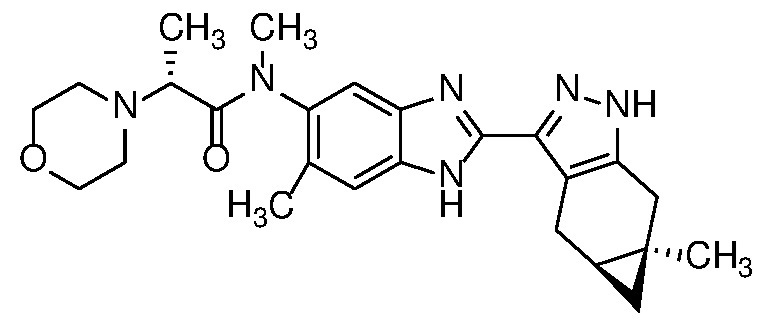
Раствор силилового эфира со стадии 1 (150 мг, 0,259 ммоль) в ТФК (2 мл) обрабатывают Et3SiH (151 мг, 1,3 ммоль). Смесь перемешивают при комнатной температуре в течение 1 часа. Смесь концентрируют и остаток растирают с толуолом (2× 10 мл). Остаток растворяют в EtOH (8 мл) и обрабатывают конц. NH4OH (2 мл). Смесь перемешивают при комнатной температуре в течение 2 часов и концентрируют. Остаток растворяют в ДХМ и последовательно промывают водой и раствором соли, сушат (MgSO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, MeOH-EtOAc=0-10%), с получением указанного в заголовке соединения (100 мг, 86%). Способ СЖХ: Chiral Tech AD-H 250 мм × 4,6 мм × 5 мкм, CO2/MeOH (0,2% изопропиламина) от 5 до 60%, 3,0 мл/мин, температура колонки 15°, ВУ=6,29 мин (30,15%) и 8,38 мин (69,20%), 99,37% эи; 1H ЯМР (400 МГц, CD3OD) δ 7,65 (с, 1H), 7,51 (с, 1H), 3,70-3,56 (м, 4H), 3,42-3,34 (м, 1H), 3,26 (д, 3H), 3,19-3,02 (м, 3Н), 2,79 (д, 1Н), 2,64-2,49 (м, 2Н), 2,45 (с, 2Н), 2,35 (с, 1Н), 2,34-2,22 (м, 2Н), 1,31 (с, 3Н), 1,25-1,15 (м, 2Н), 1,12 (д, 2Н), 0,44 (дд, 1Н), 0,27 (т, 1Н); ЖХ/МС m/z (М+Н)+=449,5.
Пример 4: (R)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро- 2H- пиран - 4-ил)пропанамид
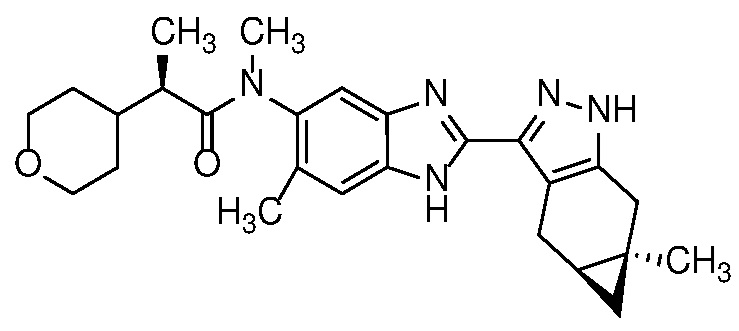
Стадия 1: (R)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2 H- пиран - 4-ил)пропанамид
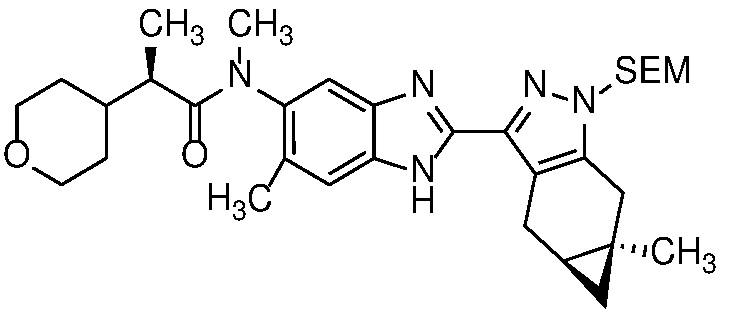
К раствору из Примера получения 46 (120 мг, 0,274 ммоль) в ТГФ (5 мл) добавляют iPr2NEt (100 мкл, 0,55 ммоль), пример получения 22 (86,8 мг, 0,55 ммоль) и йодид 2-хлор-1-метилпиридиния (140 мг, 0,548 ммоль). Смесь нагревают при 60°С в течение 16 часов. Добавляют воду (10 мл), и смесь экстрагируют EtOAc (2× 20 мл). Объединенные органические экстракты концентрируют и остаток очищают хроматографией на силикагеле (двуокись кремния, EtOAc/ПЭ=0-85%), с получением указанного в заголовке соединения (165 мг, количественный показатель). 1H ЯМР (400 МГц, CD3OD) δ 7,52 (с, 2H), 5,55-5,43 (м, 2H), 3,91 (т, 2H), 3,64 (т, 2H), 3,48-3,34 (м, 3H), 3,25 (дд, 3H), 3,21-3,11 (м, 3H), 2,79 (д, 1H), 2,42-2,35 (м, 3H), 2,20-2,10 (м, 1H), 2,01-1,91 (м, 1H), 1,82-1,72 (м, 1Н), 1,60 (т, 2Н), 1,33 (с, 3Н), 1,17 (дд, 1Н), 1,12 (д, 1Н), 1,06-0,99 (м, 2Н), 0,95-0,85 (м, 2Н), 0,46 (дд, 1Н), 0,28 (т, 1Н), -0,02 (д, 9Н); ЖХ/МС m/z (М+Н)+=578,3.
Стадия 2: (R)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2 H- пиран-4-ил)пропанамид
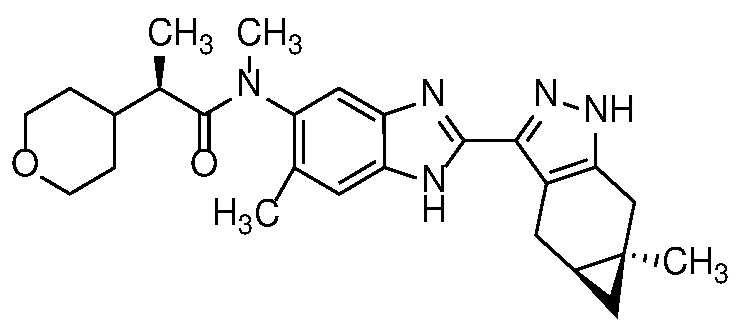
Смесь силилового эфира со стадии 1 (3,7 г, 6,4 ммоль) в ТФК (45,7 мл) и Et3SiH (3,72 г, 32,0 ммоль) перемешивают при комнатной температуре в течение 3 ч и смесь концентрируют. Остаток обрабатывают насыщ. водным NaHCO3 до рН=8 и экстрагируют EtOAc (2× 30 мл). Экстракты объединяют, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают препаративной ВЭЖХ (YMC triart C18 250 × 50 мм × 7 мкМ, вода (0,05% NH4OH)/MeCN от 26 до 66% в течение 10 мин, 60 мл/мин) с получением указанного в заголовке соединения (1,86 г, 64,9%). Способ СЖХ: Chiral Tech OD-3 100 мм × 4,6 мм × 3 мкм, CO2/EtOH (0,05%) от 5 до 40%, 1,5 мл/мин, температура колонки 35°, время удержания=3,47 мин (41,5%) и 3,55 мин (58,5%), 100% эи; 1H ЯМР (400 МГц, CD3OD) δ 7,52 (с, 2H), 3,99-3,66 (м, 2H), 3,46-3,34 (м, 3H), 3,26 (д, 3H), 3,20-3,11 (м, 3H), 2H), 3,08 (д, 1H), 2,79 (д, 1H), 2,38 (д, 3H), 2,16 (т, 0,5H), 1,99 (дд, 0,5H), 1,78 (дд, 1H), 1,60 (т, 2H), 1,31 (с, 3H), 1,18 (дт, 1H), 1,12 (д, 1H), 1,07-0,95 (м, 3H), 0,43 (дд, 1H), 0,27 (т, 1H); ЖХ/МС m/z (М+Н)+=448,3.
Пример 5: N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-(тетрагидро-2H- пиран -4-ил)пропанамид
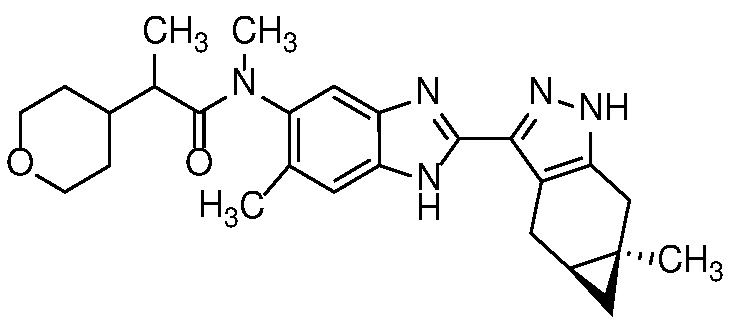
Пример 5 получают аналогично примеру 4 из примера полученияа 46 (100 мг) и 72 мг (±)-2-(тетрагидро-2H-пиран-4-ил)пропановой кислоты и очищают препаративной ВЭЖХ (Phenomenex Gemini-NX C18 150 мм × 30 мм × 5 мкМ, вода (0,04% NH4OH)/MeCN от 26 до 66% в течение 9 мин, 25 мл/мин) с получением указанного в заголовке соединения (63 мг, 51%). Способ СЖХ: Chiral Tech OD-3 100 мм × 4,6 мм × 3 мкм, CO2/EtOH (0,05%) от 5 до 40%, 2,8 мл/мин, температура колонки 35°, время удержания=3,39 мин (15,8%), 3,46 мин (26,0%), 3,54 мин (35,6%) и 3,76 мин (22,43%); 1H ЯМР (400 МГц, CD3OD) δ 7,57 (д, 1H), 7,47 (д, 1H), 4,00-3,80 (м, 2H), 3,47-3,35 (м, 4H), 3,29-3,22 (м, 4H), 3H), 3,15 (дд, 1H), 3,08 (д, 1H), 2,79 (д, 1H), 2,38 (д, 3H), 2,16 (дд, 0,5H), 1,99 (т, 0,5H), 1,90-1,69 (м, 1H), 1,60 (т, 2H), 1,31 (м, 4H), 1,17 (дк, 1H), 1,11 (дд, 1H), 1,03 (д, 2H), 0,43 (дд, 1H), 0,27 (кв, 1Н); ЖХ/МС m/z (М+Н)= 448,3.
Пример 6: (S)- N- этил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
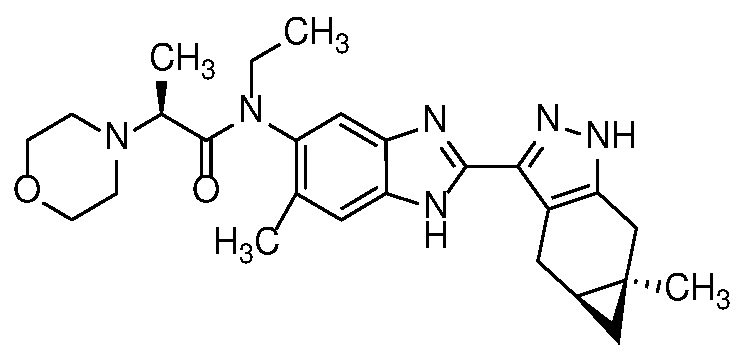
Стадия 1: (S)-N-этил-N-(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 H -бензо[d]имидазол-5-ил)-2-морфолинопропанамид
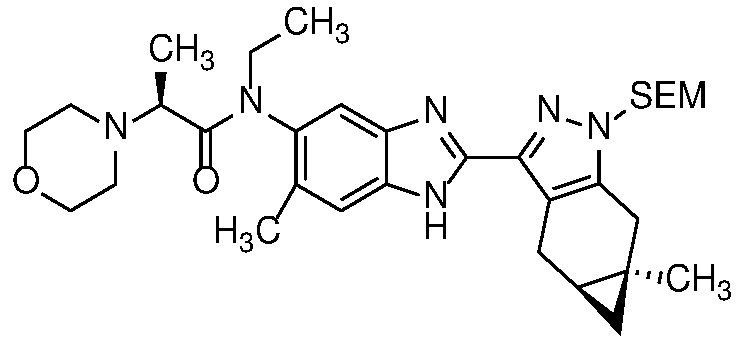
Раствор из Примера получения 67 (200 мг, 0,44 ммоль) в пиридине (4,43 мл) обрабатывают примером получения 19 (162 мг, 1,02 ммоль) и EDCI (170 мг, 0,89 ммоль). Смесь перемешивают в течение 96 часов, затем нагревают при 80°С еще 24 часа. Смесь разбавляют водой и смесь экстрагируют EtOAc (2× 20 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ 0-100%, затем MeOH/ДХМ=0-10%), с получением указанного в заголовке соединения (78 мг, 30%). ЖХ/МС m/z (М+Н)+=593,5.
Стадия 2: (S)- N- этил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
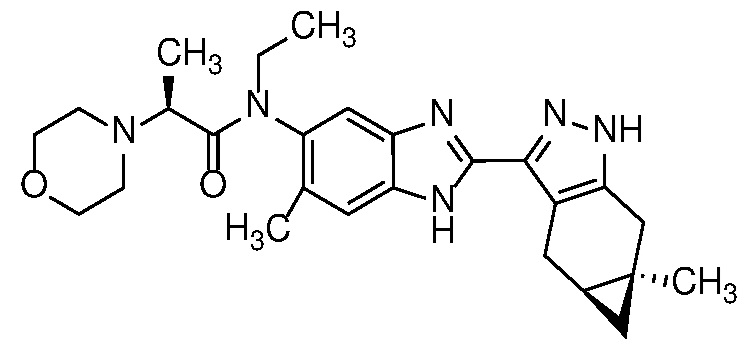
Раствор силилового эфира со стадии 1 (78 мг, 0,132 ммоль) в ТФК (1,5 мл) при 0-5°С обрабатывают Et3SiH (80 мг, 0,69 ммоль). После перемешивания при 15°С в течение 2 ч растворитель удаляют и реакционную смесь подщелачивают насыщенным водным Na2CO3. Смесь экстрагируют предварительно смешанным ДХМ/MeOH (10:1, 8 мл ×3) и экстракты объединяют. Концентрацию и остаток очищают препаративной ВЭЖХ [YMC-Actus Triart Prep C18 150 мм × 30 мм × 5 мкМ, вода (0,05% NH4OH)/MeCN от 43 до 63% в течение 10 мин, 35 мл/мин] с получением указанного в заголовке соединения (35 мг, 57%). Способ СЖХ: Chiral Tech AD-3 50 мм x 4,6 мм x 3 мкм, CO2/EtOH (0,05%), изократный 40%, 4 мл/мин, температура колонки 35°, время удержания=0,45 мин (51,01%) и 1,39 (48,99%), 100% э.и.; 1H ЯМР (400 МГц, ДМСО-d6) δ 12,88 (с, 1H), 12,60 (д, 1H), 7,69-7,46 (м, 0,75H), 7,41-7,33 (м, 1,25H), 4,11 (ткв, 1Н), 3,51-3,42 (м, 2Н), 3,11-2,94 (м, 5Н), 2,74 (д, 1Н), 2,46 (с, 2Н), 2,35 (с, 3Н), 2,22 (д, 2Н), 2,12-2,04 (м, 1Н), 2,02 (с, 1Н), 1,25 (с, 3Н), 1,13-0,91 (м, 7Н), 0,37 (дд, 1Н), 0,16 (д, 1Н); ЖХ/МС m/z (М+Н)+=463,2.
Пример 7: (R)-N-метил- N -(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-(тетрагидро-2H- пиран -4-ил)пропанамид
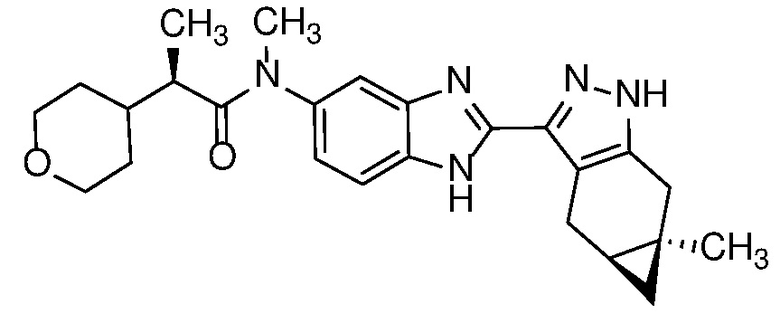
Стадия 1: (R)-N-метил- N -(2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a, 5,5a, 6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2 H- пиран - 4-ил)пропанамид
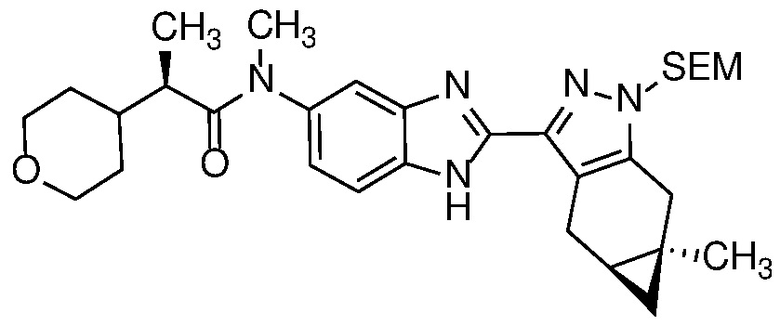
К раствору из Примера получения 55 (6,9 г, 16,3 ммоль) и Примера получения 22 (2,83 г, 17,9 ммоль) в пиридине (163 мл) при комнатной температуре добавляют EDCI (6,24 г, 32,6 ммоль). Смесь перемешивают при 25°С в течение 16 ч и разбавляют водой (150 мл) и раствором соли (150 мл). Полученную водную смесь экстрагируют EtOAc (2× 300 мл), экстракты сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-90%), с получением указанного в заголовке соединения (6,9 г, выход 75%). 1H ЯМР (400 МГц, CD3OD) δ 7,77 (с, 0,5 H), 7,65-7,51 (м, 1H), 7,40 (с, 0,5H), 7,14 (ушс, 1H), 5,56-5,37 (м, 2H), 3,94-3,77 (м, 2H), 3,63 (т, 2H), 3,45-3,06 (м, 8H), 2,78 (д, 1H), 2,31-2,10 (м, 1H), 1,83-1,68 (м, 1H), 1,60 (д, 2H), 1,32 (с, 3H), 1,28-1,11 (м, 2H), 1,05 (д, 3H), 0,98-0,87 (м, 3H), 0,45 (дд, 1H), 0,27 (т, 1Н), -0,03 (с, 9Н); ЖХ/МС m/z (М+Н)+=564,2.
Стадия 2: (R)-N-метил- N -(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-(тетрагидро-2 H -пиран-4-ил)пропанамид
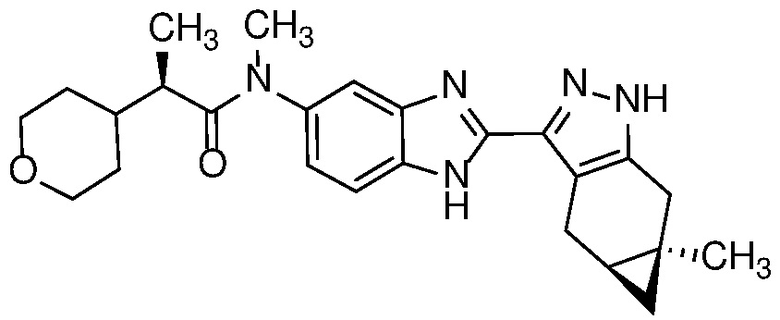
Раствор силилового эфира со стадии 1 (6,9 г, 12,2 ммоль) в ТФК (122 мл) при 25°С обрабатывают Et3SiH (7,12 г, 61,2 ммоль). После перемешивания в течение 3 часов смесь концентрируют и подщелачивают насыщ. водн. NaHCO3. Полученную смесь экстрагируют EtOAc (2× 100 мл). Органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ, 10-100%). Полученный материал дополнительно очищают хиральным СЖХ (CO2/MeOH+1% NH4OH, Daicel OJ, 250 мм × 50 мм × 10 мкм) с получением конечного продукта (3,43 г, 64,6%). 1H ЯМР (400 МГц, CD3OD) δ 7,79-7,41 (м, 2H), 7,17-7,05 (м, 1H), 3,87 (тд, 2H), 3,41-3,28 (м, 6H), 3,20-3,00 (м, 2H), 2,78 (д, 1H), 2,22 (дкв, 1H), 1,75 (кв, 1H), 1,60 (д, 2H), 1,29 (с, 3H), 1,24-1,12 (м, 2H), 1,05 (д, 3Н), 1,00-0,88 (м, 1Н), 0,42 (дд, 1Н), 0,26 (т, 1Н); ЖХ/МС m/z (М+Н)+=434,3; аналитический СЖХ (ChiralCel OJ-H 150 мм x 4,6 мм x 5 мкм, CO2/EtOH (0,05% ДЭА), от 5 до 40%), время удержания=4,91 мин (100%).
Пример 8: N -метил- N -( 2-(( 4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 H- бензо[d]имидазол-5-ил)-2-(тетрагидро-2H- пиран -4-ил)пропанамид
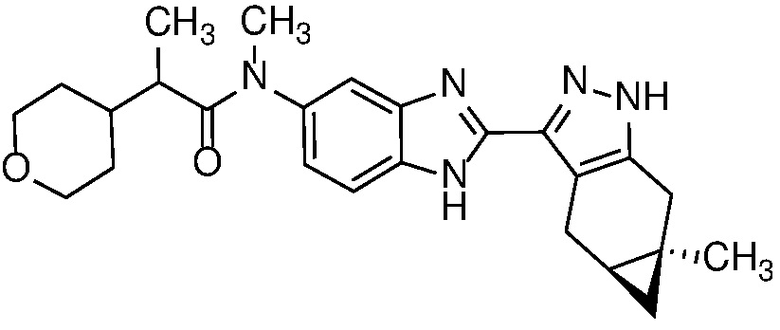
Пример 8 получают аналогично примеру 7 из примера получения 55 (350 мг) и (±)-2-(тетрагидро-2H-пиран-4-ил)пропановой кислоты (131 мг) и очищают препаративной ВЭЖХ (YMC-Actus Triart C18, 100 × 30 мм × 5 мкм, H2O/MeCN+0,05% NH4OH, 38%-58% в течение 10 мин) с получением указанного в заголовке соединения (150 мг, 39,4%). 1H ЯМР (400 МГц, CD3OD) δ 7,79-7,38 (м, 2H), 7,13 (дд, 1H), 3,87 (т, 2H), 3,41-3,33 (м, 3H), 3,31 (с, 3H), 3,19-3,10 (м, 1Н), 3,07 (д, 1Н), 2,78 (д, 1Н), 2,21 (дкв, 1Н), 1,84-1,68 (м, 1Н), 1,60 (д, 2Н), 1,29 (с, 3H), 1,27-1,10 (м, 2H), 1,05 (д, 3H), 0,95 (кд, 1H), 0,42 (дд, 1H), 0,26 (т, 1H); ЖХ/МС m/z (М+Н)+=434,3;
Пример 9: (S)-N-метил- N -(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид
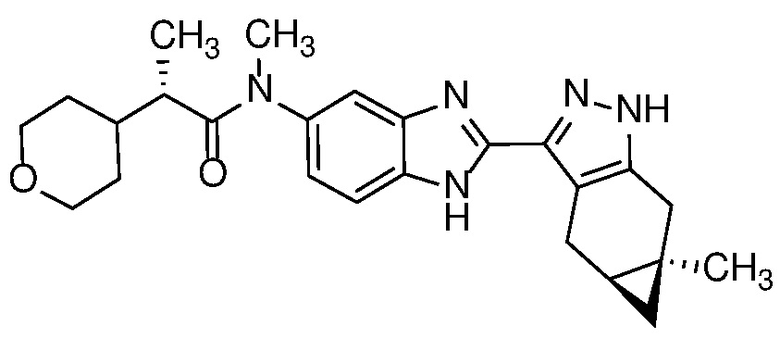
Пример 9 получают аналогично примеру 7 из примера получения 55 (296 мг) и (S)-2-(тетрагидро-2H-пиран-4-ил)пропановой кислоты (111 мг) и очищают препаративной ВЭЖХ (YMC-Actus triart C18, 100 × 30 мм × 5 мкм, H2O/MeCN (0,05% NH4OH), от 38 до 58% в течение 10 мин) с получением указанного в заголовке соединения (102 мг). 1H ЯМР (400 МГц, CD3OD) δ 7,81-7,34 (м, 2H), 7,11 (дд, 1H), 3,86 (ддд, 2H), 3,41-3,31 (м, 3H), 3,31 (с, 3H), 3,13 (дд, 1H), 3,05 (д, 1H), 2,76 (д, 1H), 2,20 (дкв, 1H), 1,73 (тд, 1H), 1,58 (дд, 2H), 1,28 (с, 3H), 1,25-1,10 (м, 2Н), 1,03 (д, 3Н), 0,93 (квд, 1Н), 0,40 (дд, 1Н), 0,24 (т, 1Н); Хиральная СЖХ (ChiralCel OJ-H 150×4,6 мм x 5 мкм, CO2/EtOH (0,05% ДЭА), от 5 до 40%), время удержания=3,60 мин.
Пример 10: N -метил- N -( 2-(( 4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 H- бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)ацетамид
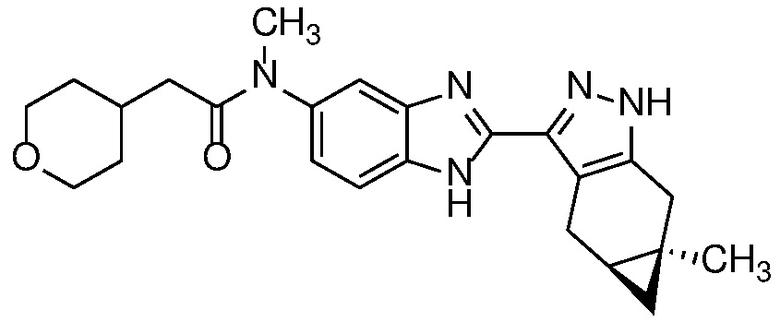
Пример 10 получают аналогично примеру 7 из примера получения 55 (200 мг) и 2-(тетрагидро-2H-пиран-4-ил)уксусной кислоты (82 мг) и очищают хиральной СЖХ (Daicel Chiralcel OJ-H (250 мМ × 30 мм × 5 мкм, CO2/EtOH w/0,1% NH4OH, 25% изократная смесь) с получением указанного в заголовке соединения (71 мг). 1H ЯМР (400 МГц, CD3OD) δ 7,75-7,39 (м, 2H), 7,13 (д, 1H), 3,83 (дд, 2H), 3,41-3,32 (м, 4H), 3,14 (дд, 1H), 3,07 (д, 1Н), 2,78 (д, 1Н), 2,15-1,92 (м, 3Н), 1,57 (д, 2Н), 1,30 (с, 3Н), 1,23-0,99 (м, 3Н), 0,42 (дд, 1H), 0,26 (т, 1H); ЖХ/МС m/z (М+Н)+=420,3.
Пример 11: 2,2-дифтор- N -метил- N -(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2 H -пиран-4-ил)ацетамид
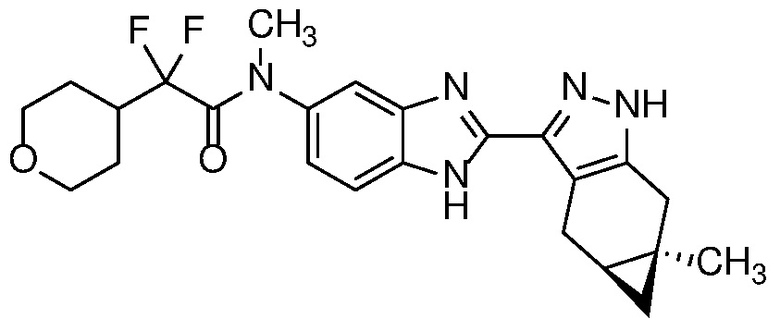
Пример 11 получают аналогично примеру 7 из примера получения 55 (200 мг) и 2,2-дифтор-2-(тетрагидро-2H-пиран-4-ил)уксусной кислоты (170 мг) и очищают хиральной СЖХ (Daicel Chiralcel OJ-H, 250 мм × 30 мм × 5 мкм, CO2/EtOH (0,1% NH4OH, 25% изократная смесь) с получением указанного в заголовке соединения (60 мг). 1H ЯМР (400 МГц, ДМСО-d6) δ 12,89 (с, 1H), 12,73 (д, 1H), 7,62 (д, 0,5H), 7,55 (д, 0,5H), 7,42 (д, 0,5H), 7,31 (с, 0,5H), 7,13-7,04 (м, 1H), 3,87-3,74 (м, 2H), 3,47-3,31 (м, 2H), 3,25 (с, 3H), 3,18 (т, 2H), 3,04-2,92 (м, 2Н), 2,72 (д, 1Н), 2,35-2,14 (м, 1Н), 1,49 (д, 2Н), 1,31-1,19 (м, 5Н), 1,15-1,00 (м, 1Н), 0,36 (дд, 1H), 0,14 (т, 1H); ЖХ/МС m/z (М+Н)+=582,3.
Пример 12: (R)- N -(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)- N- метил-2-(тетрагидро-2H-пиран-4-ил)пропанамид
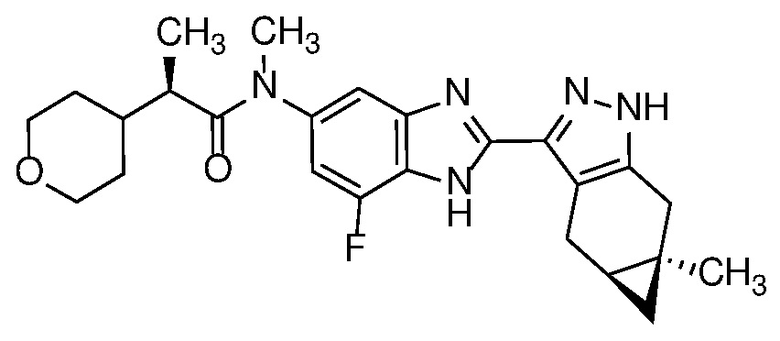
Стадия 1: (R)- N -(7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)- N -метил-2-(тетрагидро- 2H -пиран-4-ил)пропанамид
К раствору из Примера получения 57 (3,0 г, 6,79 ммоль) в пиридине (67,9 мл) при 25°С добавляют пример получения 22 (1,50 г, 9,51 ммоль) и EDCI (2,87 г, 14,9 ммоль). Смесь перемешивают при 25°С в течение 16 ч и концентрируют. Остаток разбавляют водой и экстрагируют EtOAc (5× 100 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), с получением указанного в заголовке соединения (2,3 г, 58,2%). 1H ЯМР (400 МГц, CD3OD) δ 7,26 (ушс, 1H), 6,97 (д, J=10,9 Гц, 1H), 5,59-5,37 (м, 2H), 3,89 (тд, J=12,4, 11,9, 4,1 Гц, 2H), 3,63 (т, J=7,9 Гц, 2H), 3,49-3,30 (м, 6H), 3,25-3,09 (м, 2H), 2,78 (д, J=16,3 Гц, 1H), 2,24 (дк, J=9,2, 6,7 Гц, 1H), 1,84-1,67 (м, 1H), 1,61 (д, J=13,2 Гц, 2H), 1,36-1,13 (м, 6H), 1,07 (д, J=6,8 Гц), 3H), 0,94-0,85 (м, 2H), 0,45 (дд, J=8,9, 4,6 Гц, 1H), 0,27 (т, J=5,1 Гц, 1H), -0,02 (с, 9H); ЖХ/МС m/z (М+Н)+=582,3.
Стадия 2: (R)- N -(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н -бензо[d]имидазол-5-ил)- N- метил-2-(тетрагидро-2H-пиран-4-ил)пропанамид
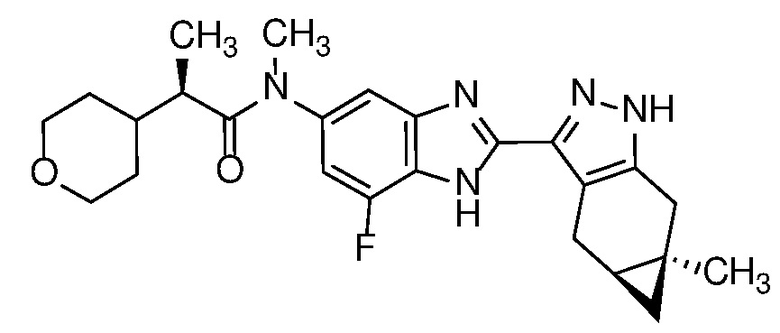
Раствор силилового эфира со стадии 1 (2,30 г, 3,95 ммоль) в ТФК (39,5 мл) при 5°С обрабатывают Et3SiH (2,30 г, 19,8 ммоль). После перемешивания в течение 3 ч при КТ смесь концентрируют и остаток разбавляют насыщ. водным раствором Na2CO3. Смесь экстрагируют EtOAc (2× 30 мл) и органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=20-100%). Соединение растворяют в MeCN (10 мл), EtOH (10 мл) и H2O (150 мл) и лиофилизируют с получением указанного в заголовке соединения (1,78 г, 99%). 1H ЯМР (400 МГц, CD3OD) δ 7,25 (с, 1H), 6,95 (д, 1H), 3,95-3,78 (м, 2H), 3,43-3,25 (м, 6H), 3,20-3,11 (м, 6H), 1H), 3,07 (д, 1H), 2,78 (д, 1H), 2,30-2,12 (м, 1H), 1,75 (кв, 1H), 1,60 (т, 2H), 1,30 (с, 3H), 1,25-1,11 (м, 2Н), 1,06 (д, 3Н), 0,98 (дт, 1Н), 0,42 (дд, 1Н), 0,25 (т, 1Н); ЖХ/МС m/z (М+Н)= 452,3.
Пример 13: (S)- N -(2-((4aS,5aR)-5,5-дифтор-5а-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
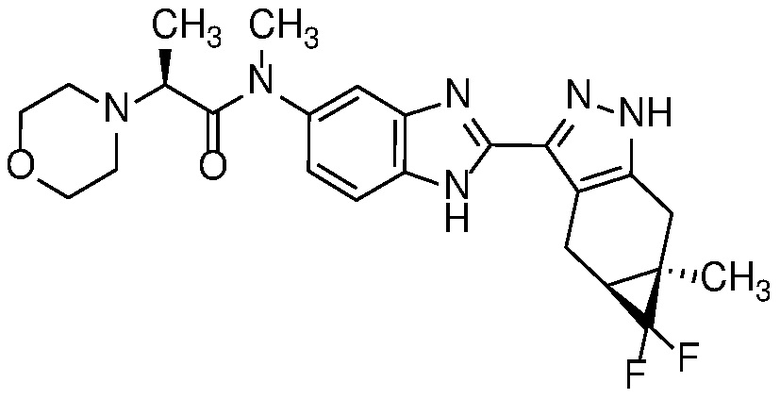
Стадия 1: (4aS,5aR)- N -(2-амино-5-((S)- N- метил-2-морфолинопропанамидо)фенил)-5,5-дифтор-5а-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-карбоксамид
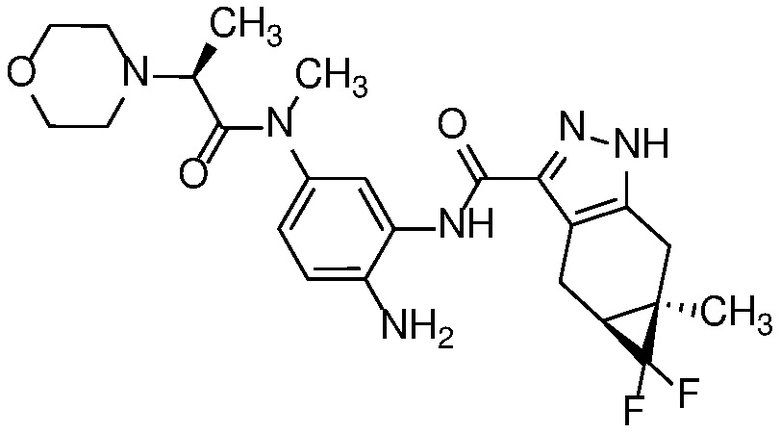
К раствору из Примера получения 68 (700 мг, 3,07 ммоль) в ДМФ (40 мл) при КТ добавляют ГБТУ (1,75 г, 4,60 ммоль), ДМАП (37,5 мг, 0,31 ммоль), iPr2NEt (1,19 мг, 9,2 ммоль) и 32 (854 мг, 3,07 ммоль). Смесь перемешивают при 80°С в течение 16 ч и разбавляют насыщ. водным NaHCO3 (100 мл). Водный слой экстрагируют EtOAc (4× 100 мл) и органические слои объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%, затем EtOAc/EtOH 3:1) с получением указанного в заголовке соединения (850 мг, 57%). ЖХ/МС m/z (М+Н)+=488,9.
Стадия 2: (S)- N -(2-((4aS,5aR)-5,5-дифтор-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
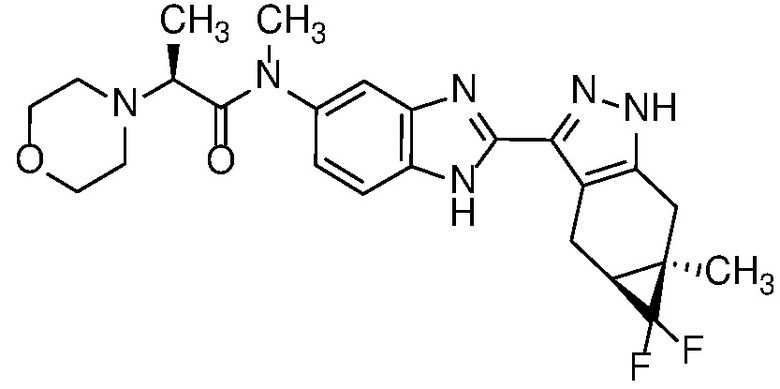
Смесь амида со стадии 1 (850 мг, 1,74 ммоль) и АсОН (50 мл) перемешивают при 90°С в течение 16 ч и концентрируют. Остаток разбавляют EtOAc (50 мл) и промывают насыщенным раствором Na2CO3. Водный слой экстрагируют EtOAc (4× 100 мл). Органические экстракты объединяют и концентрируют. Остаток очищают препаративной ВЭЖХ (Xtimiate C-18 150 × 25 мм × 5 мкм, H2O/CH3CN (0,225% FA), 20-40% в течение 8 мин) с получением указанного в заголовке соединения (289 мг, 35%). 1H ЯМР (400 МГц, CD3OD) δ 7,75-7,49 (м, 2H), 7,18 (д, 1H), 3,70-3,56 (м, 4H), 3,33 (с, 3H), 3,23 (кв, 1H), 3,14 (д, 1H), 2,86 (дд, 1H), 2,56 (дт, 2H), 2,40 (дд, 2H), 1,83-1,67 (м, 1H), 1,43 (д, 3H), 1,18 (д, 3H)); ЖХ/МС m/z (М+Н)+=435,3.
Пример 14: (S)-N-метил- N -(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
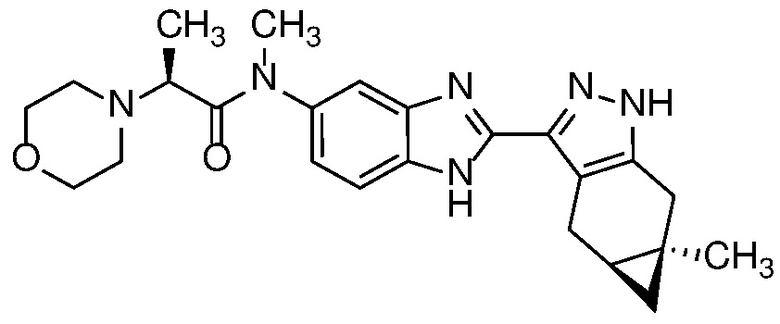
Стадия 1: (S)-N-метил- N -(2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
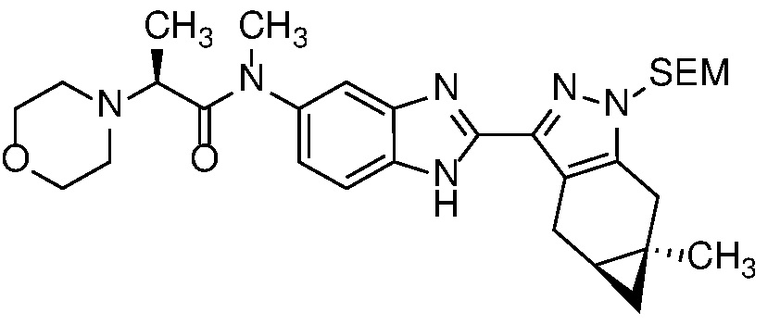
Смесь из примера получения 32 (1,53 г, 5,5 ммоль), Примера получения 9 (1,69 г, 5,5 ммоль) в EtOH (27,5 мл) и воды (2,75 мл) обрабатывают Na2S2O3 (1,14 г, 11,0 ммоль). Смесь нагревают при 90°С в течение 2 часов. Смесь концентрируют и остаток разбавляют EtOAc и H2O. Слои разделяют и водный слой экстрагируют EtOAc (2х). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/гептан=10-100%, затем EtOAc/MeOH=0-15%) с получением указанного в заголовке соединения (2,41 г, 78%). ЖХ/МС m/z (М+Н)+=565,5.
Стадия 2: (S)-N-метил- N -(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
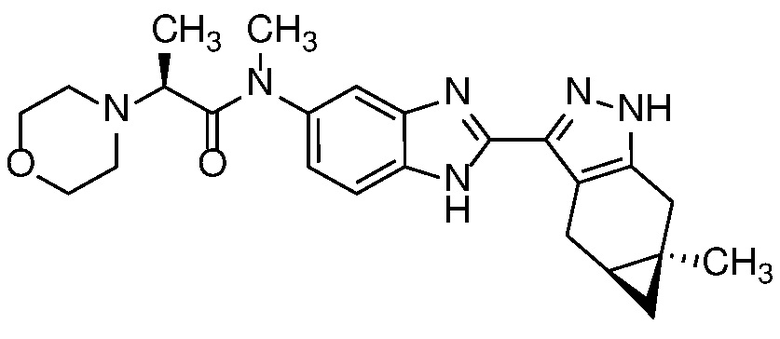
Раствор силилового эфира со стадии 1 (2,41 г, 4,26 ммоль) в ДХМ (12,8 мл) при 0°С обрабатывают ТФК (8,61 мл) и перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют и остаток растворяют в ТГФ/МеОН и доводят рН до ~10 с помощью твердого K2CO3. Смесь разбавляют 10% MeOH в ДХМ и промывают раствором соли. Водный слой экстрагируют 10% MeOH в ДХМ. Органические экстракты объединяют, сушат, фильтруют и концентрируют. Неочищенный продукт очищают хиральной СЖХ (Chiralcel OJ, 30 мм × 250 мм × 5 мкм, CO2/MeOH (0,2% NH3), изократный 25% в течение 10 мин) с получением указанного в заголовке соединения (0,89 г, 48%). 1H ЯМР (400 МГц, ДМСО-d6) δ 12,93-12,87 (м, 1H), 12,73 (д, J=5,9 Гц, 1H), 7,63 (д, J=8,4 Гц, 0,5H), 7,55 (с, 0,5H), 7,44 (д, J=8,3 Гц, 0,5H), 7,35 (с, 0,5H), 7,07 (т, J=9,9 Гц, 1H), 3,50-3,41 (м, 5H), 3,23-3,13 (м, 4H), 2,98 (дд, J=16,2, 8,6 Гц, 2H), 2,72 (д, J=16,1 Гц, 1H), 2,46-2,35 (м, 2H), 2,31-2,11 (м, 2H), 1,23 (с, 3Н), 1,15-0,88 (м, 4Н), 0,36 (дд, J=8,8, 4,3 Гц, 1Н), 0,14 (с, 1Н); ЖХ/МС m/z (М+Н)+=435,3; Хиральная СЖХ (Lux Cellulose-2, 150×4,6 мм x 3 мкм, CO2/EtOH (0,1% этаноламина, от 1 до 40% EtOH), время удержания=2,96 мин.
Пример 15: (S)- N -(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1 Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
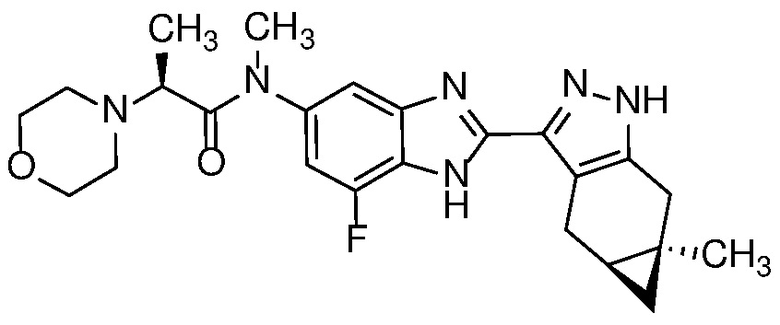
Стадия 1: (S)- N -(4-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1Н- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид и (S)- N -(7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
Смесь примеров получения 74a и 74b (мг, 0,19 ммоль) в пиридине (2,77 мл) при 15°С обрабатывают соединением 19 (45,6 мг, 0,23 ммоль) и EDCI (74,4 мг, 0,39 ммоль). Смесь перемешивают в течение 16 часов. Смесь разбавляют водой и экстрагируют EtOAc (2 х 20 мл). Органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют с получением указанных в заголовке соединений в виде смеси (131 мг, 95%). ЖХ/МС m/z (M+Na)+=735,1
Стадия 2: (S)- N -(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
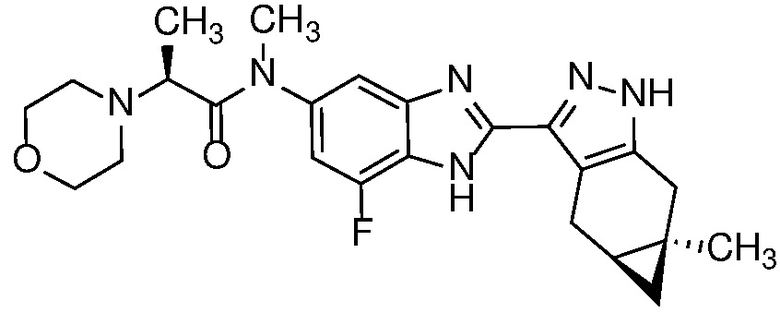
Смесь силиловых эфиров со стадии 1 (131 мг, 0,18 ммоль) в ТФК (1,84 мл) при 10°С обрабатывают Et3SIH (107 мг, 0,92 ммоль). После перемешивания в течение 3 часов смесь концентрируют и остаток подщелачивают насыщ. водным Na2CO3. Смесь экстрагируют EtOAc (3× 15 мл) и экстракты объединяют. Растворитель удаляют и остаток очищают препаративной ВЭЖХ (H2O:MeCN, 0,05% ТФК) с получением указанного в заголовке соединения (37 мг, 45%). 1H ЯМР (400 МГц, CD 3 OD) δ 7,34 (с, 1H), 7,04 (д, 1H), 4,61 (с, 1H), 3,62 (ддд, 4H), 3,30 (с, 3H), 3,37 (д, 1H), 3,23 (к, 1H), 3,19-3,10 (м, 1H), 3,07 (д, 1H), 2,78 (д, 1H), 2,54 (дт, 2H), 2,36 (дт, 2H), 1,30 (с, 3Н), 1,17 (д, 3Н), 0,42 (дд, 1Н), 0,25 (т, 1Н); ЖХ/МС m/z (M+H)+=453,3
Пример 16: (S)- N- этил- N -(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
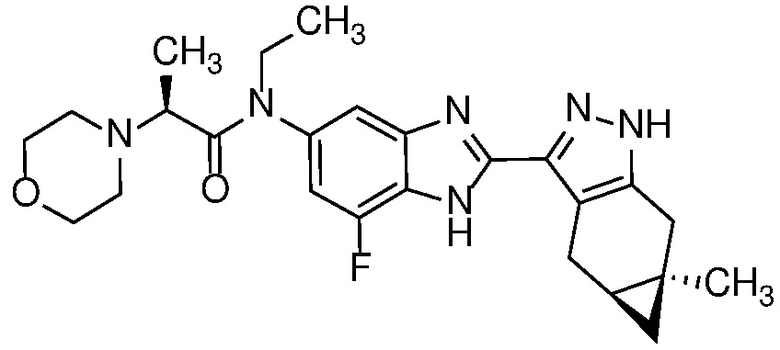
Стадия 1: (S)- N- этил- N -(4-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-ил)-2-морфолинопропанамид и (S)- N- этил- N -(7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
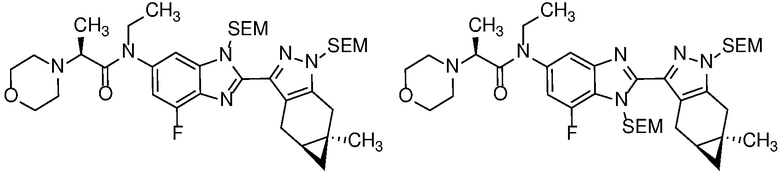
Смесь из примеров получения 76a и 76b (6,14 г, 10,48 ммоль) и 19 (1,46 г, 9,17 ммоль) в пиридине (70 мл) при 30°С обрабатывают EDCI (4,02 г, 21,0 ммоль). После перемешивания в течение 16 ч растворитель удаляют и добавляют воду (80 мл). Смесь экстрагируют EtOAc (2× 80 мл) и органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-50%), получая указанные в заголовке соединения в виде смеси (5,13 г, 67%). ЖХ/МС m/z (М+Н)= 727,4.
Стадия 2: (S)- N- этил- N -(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
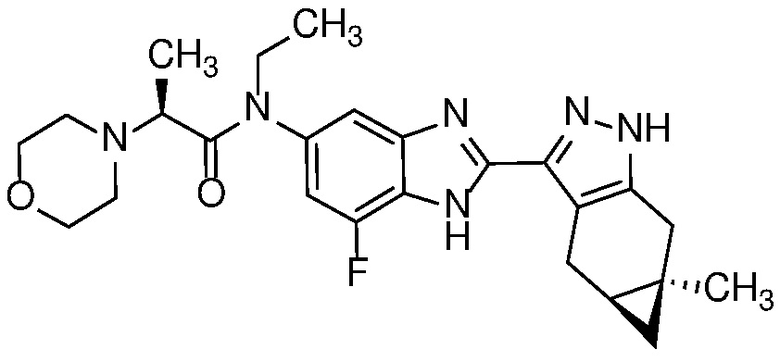
Смесь силиловых эфиров со стадии 1 (5,13 г, 7,06 ммоль) в ТФК (35 мл) при 0°С обрабатывают Et3SiH (4,1 г, 35,3 ммоль). Смесь перемешивают при 30°С в течение 3 часов. Смесь концентрируют и остаток разбавляют насыщ. водным NaHCO3. Смесь экстрагируют EtOAc (2× 100 мл) и органические экстракты объединяют, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт хроматографируют (двуокись кремния, EtOAc/ПЭ=0-50% (2,66 г, 81%). Смесь дополнительно очищают с помощью хиральной СЖХ (Daicel Chiralpak AD, 250 мм x 50 мм x 10 мкм; CO2/EtOH (0,1% NH4OH), 50% изократный) с получением указанного в заголовке соединения (1,72 г, 52%). 1H ЯМР (400 МГц, CD3OD) δ 7,31 (ушс, 1H), 7,05-6,93 (м, 1H), 3,78 (с, 2H), 3,61 (ддд, 4H), 3,38 (д, 1H), 3,14 (д, 2H), 3,06 (д, 1H), 2,76 (д, 1H), 2,53 (д, 2H), 2,35 (дт, 2H), 1,28 (с, 3H), 1,20-1,11 (м, 7H), 0,40 (дд, 1H), 0,24 (т, 1H), ЖХ/МС m/z (M+H)+=467,1.
Пример 17: (S)- N -(6-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
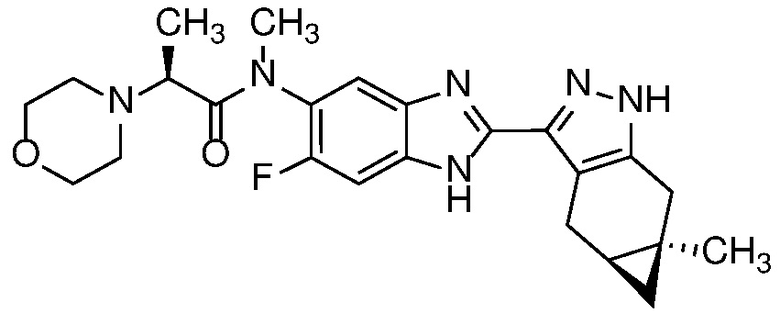
Стадия 1: (S)- N -(6-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид и (S)- N -(5-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-ил)-N-метил-2-морфолинопропанамид
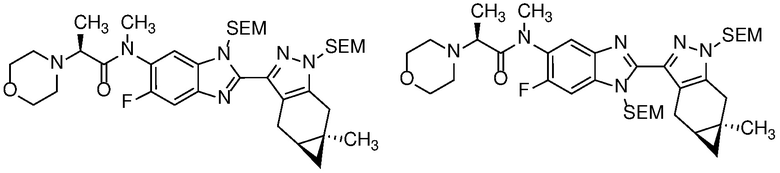
Смесь примеров получения 80a и 80b (170 мг, 0,29 ммоль) в пиридине (4,95 мл) при 15°С обрабатывают соединением 19 (71 мг, 0,45 ммоль) и EDCI (114 мг, 0,6 ммоль). Смесь перемешивают в течение 2 дней, затем разбавляют водой и экстрагируют EtOAc (2× 20 мл). Органические экстракты собирают, сушат (Na2SO4), фильтруют и концентрируют с получением указанных в заголовке соединений в виде смеси (180 мг, 85%). ЖХ/МС m/z (M+H)+=713,5
Стадия 2: (S)- N -(6-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-N-метил - 2-морфолинопропанамид
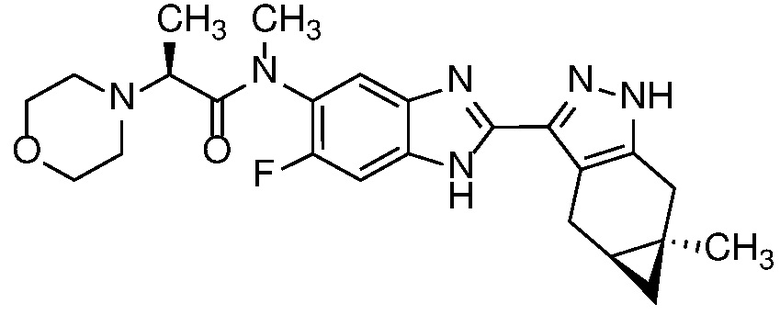
Смесь силиловых эфиров со стадии 1 (180 мг, 0,25 ммоль) в ТФК (2,52 мл) при 10°С обрабатывают Et3SiH (147 мг, 1,26 ммоль). Смесь перемешивают в течение 3 ч и концентрируют. Смесь подщелачивали насыщ. водным Na2CO3 и экстрагируют EtOAc (3× 8 мл). Объединенные экстракты концентрируют и остаток очищают препаративной ВЭЖХ (YMC-Triart Prep C18 150 мм × 40 мм × 7 мкМ, вода (0,05% NH4OH)/MeCN от 42 до 62% в течение 10 мин, 25 мл/мин) с получением указанного в заголовке соединения (38 мг, 34%). 1H ЯМР (400 МГц, CD3OD) δ 7,72-7,39 (м, 2Н), 3,69-3,50 (м, 4Н), 3,39 (д, 1Н), 3,30 (д, 3Н), 3,27-3,04 (м, 3Н), 3H), 2,79 (д, 1H), 2,54 (дт, 1H), 2,41 (дд, 2H), 2,27 (ддд, 1H), 1,31 (с, 3H), 1,23-1,12 (м, 4H), 0,44 (дд, 1H), 0,27 (т, 1H); ЖХ/МС m/z (М+Н)+=453,2.
Пример 18: (S)- N -(6-этил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
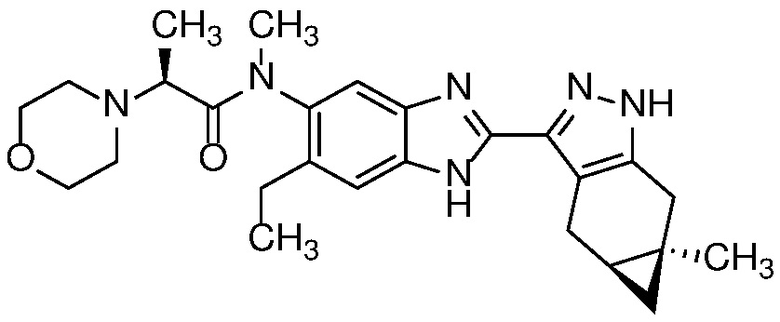
Пример 18 получают аналогично примеру 1 из 5-хлор-2-этил-4-нитроанилина с получением указанного в заголовке соединения (50 мг, 57%). 1H ЯМР (400 МГц, CD3OD) δ 7,54 (с, 2H), 3,69-3,58 (м, 4H), 3,38 (д, 1H), 3,27 (д, 3H), 3,20-3,01 (м, 3H), 2,87-2,72 (м, 1Н), 2,67 (кв, 2Н), 2,56 (д, 2Н), 2,35-2,27 (м, 2Н), 1,37 (дт, 3Н), 1,31 (с, 3Н), 1,19 (т, 2H), 1,11 (дд, J=6,6, 1,7 Гц, 2H), 0,44 (дд, 1H), 0,28 (д, J=5,6 Гц, 1H).; ЖХ/МС m/z (М+Н)+=463,4.
Пример 19: (S)- N -(6-метокси-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
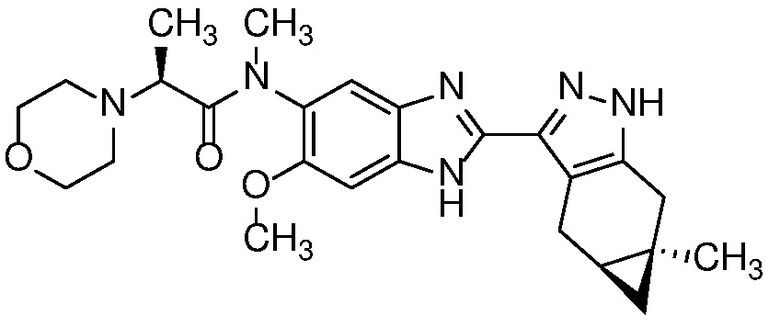
Стадия 1: (S)- N -(6-метокси-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамид
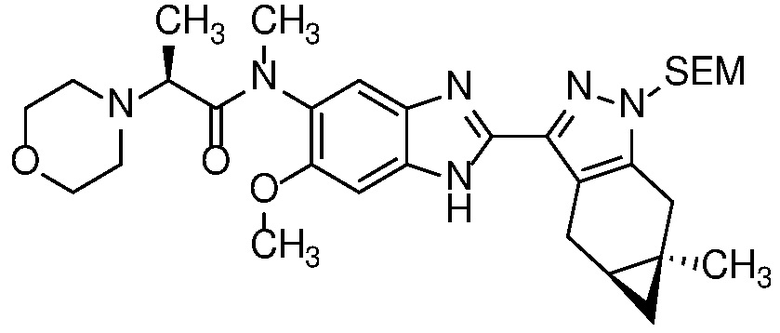
Смесь из примера получения 84 (189 мг, 0,61 ммоль), Na2S2O5 (126 мг, 0,66 ммоль) в ДМФ (7,3 мл) обрабатывают Примером получения 9 (157 мг, 0,51 ммоль). Смесь нагревают в микроволновом реакторе при 150°С в течение 2 ч и выливают в 3% водн. LiCl (20 мл) и EtOAc (30 мл). Слои разделяют, и водный слой экстрагируют EtOAc (30 мл). Органические слои собирают, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный продукт подвергают хроматографии (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения. (201 мг, 44%). ЖХ/МС m/z (М+Н)+=595,3.
Стадия 2: (S)- N -(6-метокси-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
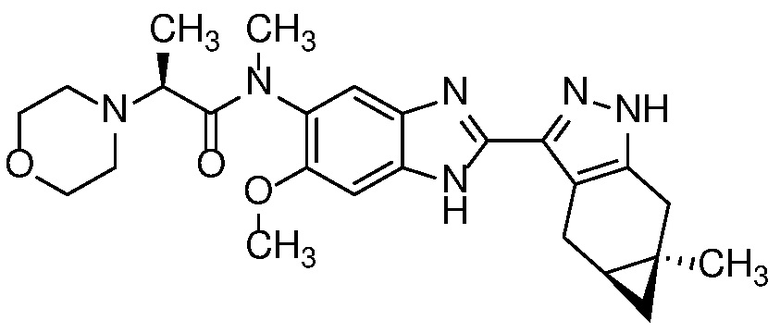
Раствор силилового эфира со стадии 1 (201 мг, 0,338 ммоль) в ТФК (3,38 мл) при 0-5°С обрабатывают Et3SiH (196 мг, 1,69 ммоль). Смесь перемешивают при комнатной температуре в течение 2 часов и концентрируют. Остаток подщелачивали насыщ. водным NaHCO3. Смесь экстрагируют EtOAc (2× 20 мл), экстракты и концентрируют. Остаток очищают препаративной ВЭЖХ (YMC Triart C18 150 мм × 30 мм × 7 мкМ, вода (0,05% NH4OH)/MeCN от 25 до 75% в течение 10 мин, 25 мл/мин) с получением указанного в заголовке соединения (87 мг, 55%). 1H ЯМР (400 МГц, CD3OD) δ 7,56 (с, 1H), 7,28 (с, 1H), 3,94 (д, 3H), 3,63 (ткв, 4H), 3,41-3,34 (м, 1H), 3,23 (д, 3Н), 3,20-3,08 (м, 2Н), 3,08-2,97 (м, 1Н), 2,79 (д, 1Н), 2,54 (д, 1Н), 2,44 (дт, 3Н), 1,31 (с, 3Н)), 1,26-1,10 (м, 4Н), 0,43 (дд, 1Н), 0,27 (т, 1Н); ЖХ/МС m/z (М+Н)+=465,2.
Пример 20: (S)- N -(6-бром-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
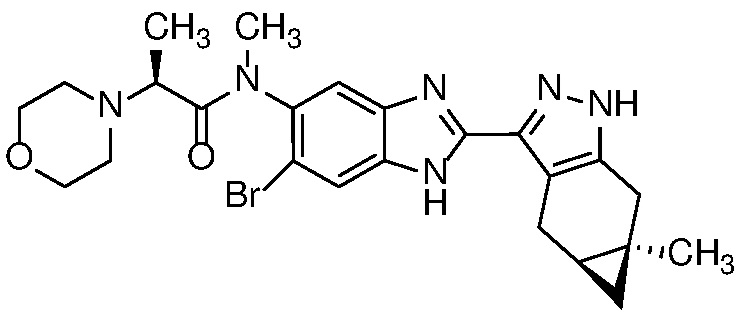
Раствор из Примера получения 85 (100 мг, 0,155 ммоль) в ТФК (5,0 мл) при 0°С обрабатывают Et3SiH (90,3 мг, 0,77 ммоль). Смесь перемешивают в течение 2 ч и концентрируют. Остаток растворяют в МеОН (10 мл) и обрабатывают конц. NH4OH (1 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и концентрируют. Остаток очищают препаративной ВЭЖХ (Boston Prime C18, 150 × 30 мм × 5 мкм, H2O/MeCN (0,05% NH4OH) 10-70% в течение 10 мин) с получением указанного в заголовке соединения (61 мг, 76%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,09-12,65 (м, 2H), 7,99-7,63 (м, 2H), 3,58-3,38 (м, 5H), 3,18-3,09 (м, 3H), 3,08-2,86 (м, 2Н), 2,81-2,60 (м, 1Н), 2,46-2,28 (м, 2Н), 2,24-1,91 (м, 2Н), 1,24 (с, 3Н), 1,17-0,90 (м, 4Н), 0,37 (дд, 1H), 0,15 (т, 1H); ЖХ/МС m/z (M+H)+=513,3/515,5 (79Br, 81Br).
Пример 21. (S)- N -(6-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
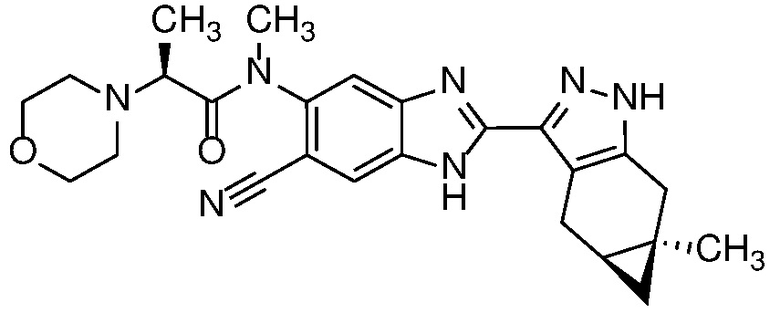
Смесь примеров получения 87a и 87b (150 мг, 0,21 ммоль) в ТФК (5 мл) обрабатывают Et3SiH (121 мг, 1,04 ммоль) при 0°С. Смесь перемешивают в течение 2 ч и концентрируют. Остаток растворяют в МеОН (10 мл) и добавляют конц. NH4OH (1 мл). Смесь перемешивают 1 час и смесь концентрируют. Остаток очищают препаративной ВЭЖХ (Boston Prime C18, 150 × 30 мм × 5 мкм; H2O/MeCN (0,2% FA), 23-45% в течение 10 мин) с получением указанного в заголовке соединения (34 мг, 35%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,22-13,05 (м, 2H), 8,35-7,36 (м, 2H), 3,58-3,25 (м, 5H), 3,22 (д, 3H), 3,01 (дд, 2Н), 2,80-2,56 (м, 2Н), 2,44-2,27 (м, 2Н), 2,12-1,90 (м, 2Н), 1,25 (с, 3Н), 1,18-0,95 (м, 34Н), 0,38 (дд, 1H), 0,16 (т, 1H); ЖХ/МС m/z (М+Н)+=460,2.
Пример 22: (S)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(3-оксоморфолино)пропанамид; и
Пример 23: (R)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(3-оксоморфолино)пропанамид
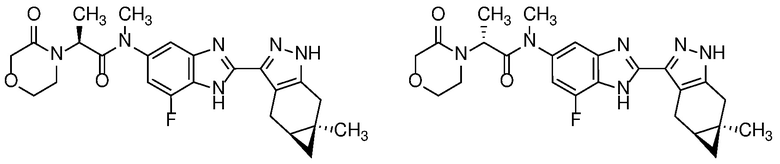
Стадия 1: N -(4-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-ил)- N -метил-2-(3-оксоморфолино)пропанамид и N -(7-фтор-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-5-ил)- N- метил-2-(3-оксоморфолино)пропанамид
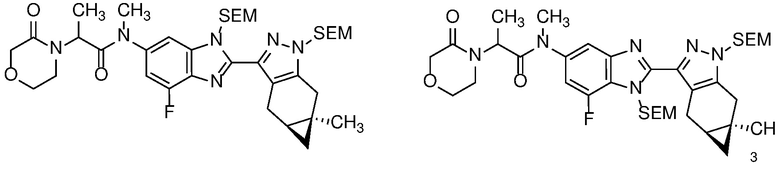
Смесь примеров получения 74a и 74b (150 мг, 0,26 ммоль) и примера получения 26 (54,5 мг, 0,32 ммоль) в пиридине (3,75 мл) при 25°С обрабатывают EDCI (101 мг, 0,53 ммоль). Смесь перемешивают в течение 48 ч и разбавляют водой (20 мл). Смесь экстрагируют EtOAc (3× 20 мл). Органические экстракты объединяют, сушат и концентрируют с получением указанных в заголовке соединений в виде смеси (60 мг, 31%). ЖХ/МС m/z (М+Н)+=727,3.
Стадия 2: (S)- N -(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-(3-оксоморфолино)пропанамид и (R)- N -(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-(3-оксоморфолино)пропанамид
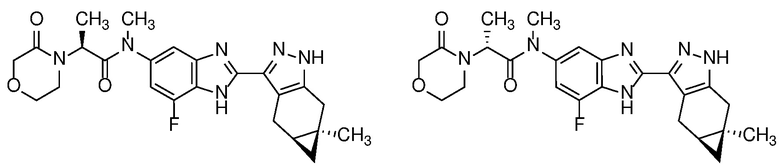
Смесь простых эфиров силиленола со стадии 1 (85,0 мг, 0,12 ммоль) в ТФК (1,2 мл) при 5°С обрабатывают Et3SiH (68,0 мг, 0,58 ммоль). Смесь перемешивают в течение 2 ч и концентрируют. Смесь обрабатывают насыщ. водным NaHCO3 и экстрагируют EtOAc (3× 8 мл). Органические экстракты объединяют, сушат, фильтруют и концентрируют, а остаток очищают препаративной ВЭЖХ (Phenomenex Gemini NX-C18, 75 мм × 30 мм × 3 мкм MeCN/H2O (0,225% FA), 29-49% в течение 10 мин). Смесь разделяют с помощью хиральной СЖХ (Daicel ChiralPak AD, 250 мм × 30 мм × 10 мкм, CO2/EtOH (0,1% NH4OH), 55% изократный) с получением указанных в заголовке соединений с абсолютной стереохимией при C-2 метиловой определяется произвольно.
Пример 22: 1H ЯМР (400 МГц, CD3OD) δ 7,44-7,40 (м, 1H), 7,08 (д, 1H), 5,14-5,07 (м, 1H), 4,03-3,85 (м, 3H), 3,81-3,71 (м, 1H), 3,56-3,44 (м, 1H), 3,38-3,25 (м, 4H), 3,14 (дд, 1H), 3,06 (д, 1H), 2,77 (д, 1H), 1,29 (с, 3Н), 1,25 (д, 3Н), 1,16 (дт, 1Н), 0,41 (дд, 1Н), 0,25 (т, 1Н); ЖХ/МС m/z (М+Н)+=467,1.
Пример 23: 1H ЯМР (400 МГц, CD3OD) δ 7,42 (с, 1H), 7,08 (д, 1H), 5,13-5,08 (м, 1H), 4,00-3,86 (м, 3H), 3,82-3,70 (м, 1H), 3,56-3,45 (м, 1H), 3,39-3,24 (м, 4H), 3,14 (дд, 1H), 3,06 (д, 1H), 2,77 (д, 1H), 1,29 (с, 3H), 1,25 (д, 3Н), 1,16 (дт, 1Н), 0,41 (дд, 1Н), 0,25 (т, 1Н); ЖХ/МС m/z (М+Н)+=467,1.
Пример 24: (S)- N -(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
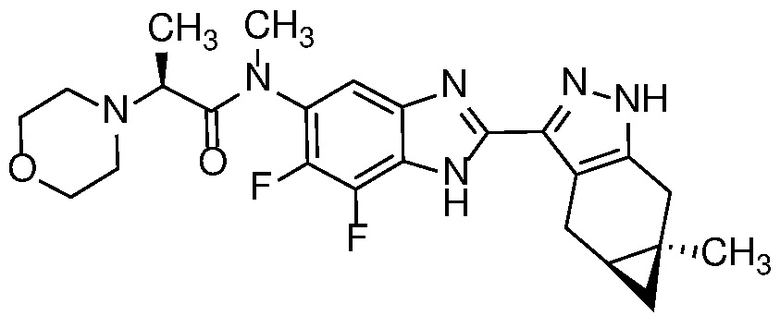
Смесь примеров получения 95a и 95b (3,26 г, 4,47 ммоль) в ТФК (45 мл) при 0°С обрабатывают Et3SiH (2,60 г, 22,3 ммоль). Смесь перемешивают в течение 5 ч и концентрируют. Смесь обрабатывают насыщ. водным NaHCO3 и экстрагируют ДХМ (3× 30 мл). Органические экстракты объединяют, сушат, фильтруют и концентрируют. Остаток хроматографируют (двуокись кремния, MeOH/EtOAc=0-7%) и выделенный продукт растворяют в MeOH (30 мл)/H2O (50 мл). Растворитель удаляют лиофилизацией с получением указанного в заголовке соединения (1,56 г, 69%). 1H ЯМР (400 МГц, CD3OD) δ 7,56-7,30 (м, 1H), 3,67-3,46 (м, 4H), 3,44-3,22 (м, 5H), 3,22-3,09 (м, 1H), 3,06 (м д, 1Н), 2,77 (д, 1Н), 2,58-2,29 (м, 3Н), 2,19 (ддд, 1Н), 1,29 (с, 3Н), 1,15 (дд, 4Н), 0,42 (дд, 1Н), 0,24 (т, 1Н); 19 F ЯМР (377 МГц, CD3OD) δ -153,83.
Пример 25: (S)- N -(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- этил-2-морфолинопропанамид
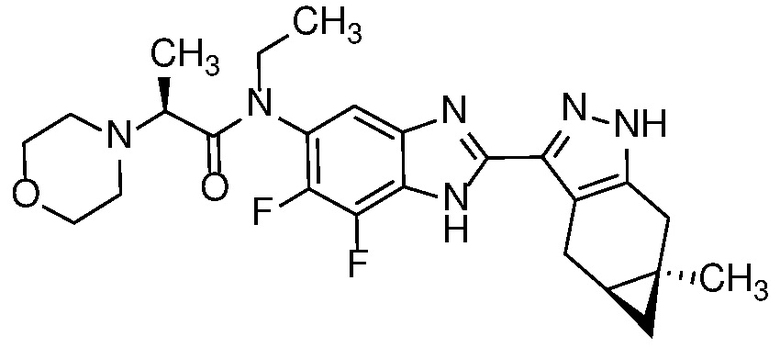
Смесь примеров получения 96а и 96б (120 мг, 0,16 ммоль) в ТФК (1,6 мл) при 5°С обрабатывают Et3SiH (93,6 мг, 0,81 ммоль). Смесь перемешивают 2 ч и концентрируют. Остаток разбавляют насыщ. водным NaHCO3 (5 мл) и экстрагируют EtOAc (3× 8 мл). Органические экстракты собирают, сушат, фильтруют и концентрируют. Остаток очищают препаративной ВЭЖХ (YMC Triart, 30 × 150 мм × 7 мкм, CH3CN/H2O (0,05% NH4OH), 46-66% в течение 10 мин) с получением указанного в заголовке соединения (7,2 мг, 9%). 1H ЯМР (400 МГц, метанол-d4) δ 7,41-7,26 (м, 1H), 3,90-3,66 (м, 1H), 3,65-3,46 (м, 4H), 3,44-3,32 (м, 1H), 3,23-3,10 (м, 1H), 3,07 (д, 1H), 2,78 (д, 1H), 2,56-2,41 (м, 2H), 2,38-2,19 (м, 1H), 1,30 (с, 3H), 1,19-1,14 (м, 6Н), 0,42 (дд, 1Н), 0,25 (т, 1Н); ЖХ/МС m/z (М+Н)+=485,1.
Пример 26: 2-((S)-2-(гидроксиметил)морфолино)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)- 1H- бензо[d]имидазол-5-ил)ацетамид
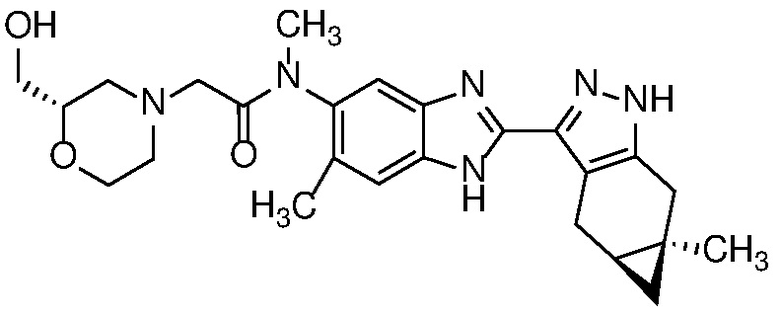
Стадия 1: 2-((S)-2-(гидроксиметил)морфолино)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[ d ]имидазол-5-ил)ацетамид
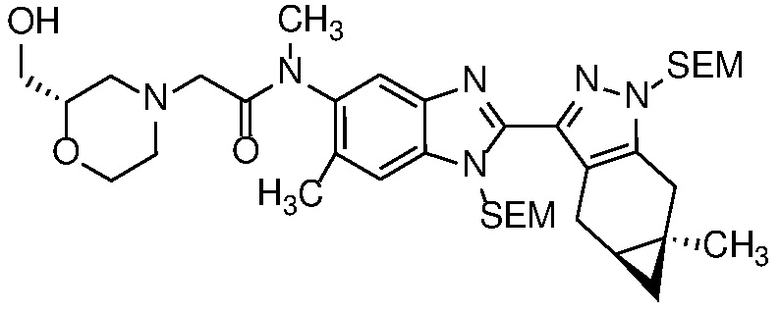
Раствор из Примера получения 98 (130 мг, 0,20 ммоль) и (S)-морфолин-2-илметанол (26 мг, 0,22 ммоль) в MeCN (5 мл) обрабатывают NaI (40 мг, 0,27 ммоль) и K2CO3 (40 мг, 0,29 ммоль). Смесь нагревают при 80°С в течение 16 часов. Смесь охлаждают до комнатной температуры и концентрируют. Остаток очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%, затем MeOH/EtOAc=0-20%) с получением указанного в заголовке соединения (108 мг, 74%). 1H ЯМР (400 МГц, хлороформ-d) δ 7,71 (с, 1H), 7,36 (д, 1H), 6,22-6,07 (м, 1H), 6,09-5,93 (м, 1H), 5,42 (к, 2H), 3,94-3,73 (м, 4Н), 3,71-3,37 (м, 8Н), 3,26 (с, 3Н), 3,19-3,01 (м, 2Н), 2,96-2,68 (м, 4Н), 2,34 (с, 4Н), 1,38-1,27 (м, 3Н), 1,17-1,01 (м, 2Н), 0,91 (т, 2Н), 0,87-0,73 (м, 2Н), 0,40 (с, 1Н), 0,26 (д, 1Н), -0,02 (с, 9Н), -0,11 (т, 9Н); ЖХ/МС m/z (М+Н)+=725,4.
Стадия 2: 2-((S)-2-(гидроксиметил)морфолино)- N -метил- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)- 1H- бензо[d]имидазол-5-ил)ацетамид
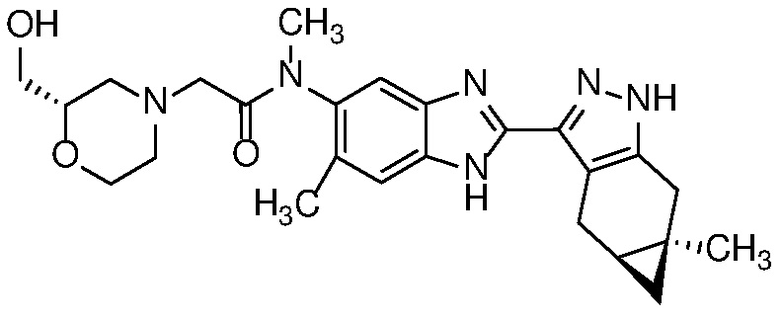
Раствор силилового эфира со стадии 1 (108 мг, 0,149 ммоль) в ДХМ (5 мл) при 15°С обрабатывают ТФК (1,5 мл). Смесь перемешивают при 15°С в течение 2 ч и концентрируют. Остаток растворяют в МеОН (5 мл) и обрабатывают конц. NH4OH (2 мл). Смесь перемешивают при комнатной температуре в течение 2 часов. Смесь концентрируют, и остаток очищают препаративной ВЭЖХ (Welch Xtimate 75 мм x 40 мм x 3 мкм, от 16 до 56% MeCN в 0,05% NH4OH/вода, 25 мл/мин, 10 мин) с получением указанного в заголовке соединения. (16 мг, 23%). 1H ЯМР (400 МГц, CD3OD) δ 7,68-7,39 (м, 2H), 3,77 (д, 1H), 3,72-3,52 (м, 2H), 3,52-3,40 (м, 2H), 3,40-3,33 (м, 2H), 3,24 (с, 3H), 3,19-2,93 (м, 3H), 2,86-2,59 (м, 4H), 2,35 (с, 3H), 2,19-2,04 (м, 1H), 1,85 (дт, 1Н), 1,29 (с, 3Н), 1,24-1,05 (м, 1Н), 0,42 (дт, 1Н), 0,24 (т, 1Н); ЖХ/МС m/z (М+Н)+=465,3.
Указанные в заголовке соединения в таблице ниже, получают по методике, описанной в примере 18, или аналогичной ей методике (с использованием DIPEA+K2CO3/NaI) из соответствующего амина и 2-хлор-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-5-ил)ацетамид (Пример получения 98).
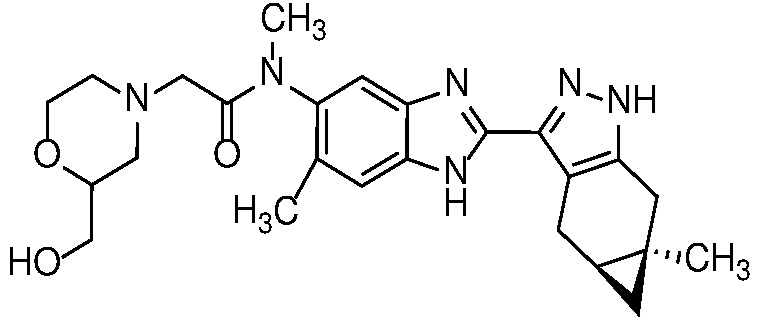
2-(2-(Гидроксиметил)морфолино)-
N
-метил-
N
-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-
1Н-
бензо[d]имидазол-5-ил)ацетамид
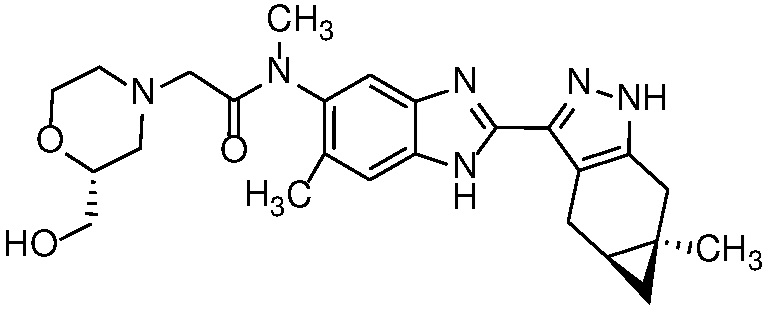
2-((
R)
-2-(Гидроксиметил)морфолино)-
N
-метил-
N
-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-
1H-
бензо[d]имидазол-5-ил)ацетамид
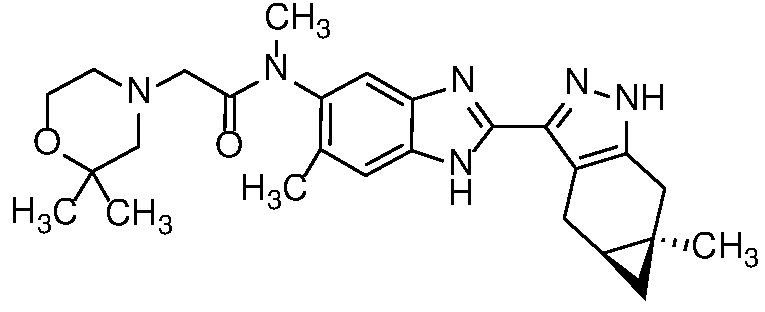
2-(2,2-Диметилморфолино)-
N
-метил-
N
-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопроп[f]индазол-3-ил)-
1H-
бензо[d]имидазол-5-ил)ацетамид
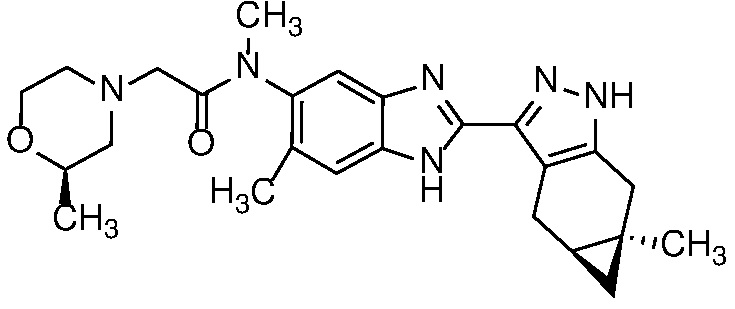
N-
Метил-
N
-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1
Н-
бензо[d]имидазол-5-ил)-2-((
R)
-2-метилморфолино)ацетамид
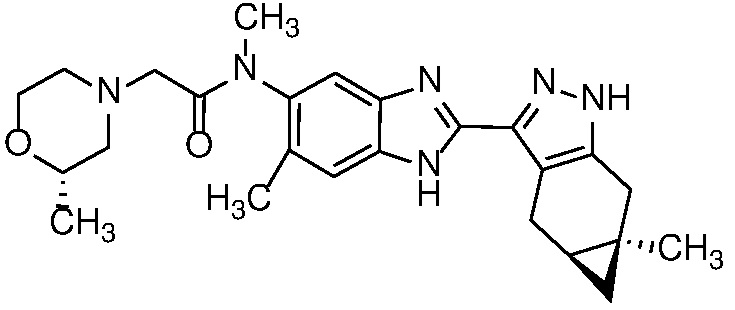
N-
Метил-
N
-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1
Н-
бензо[d]имидазол-5-ил)-2-((S)-2-метилморфолино)ацетамид
2-((2R,6R)-2,6-Диметилморфолино)-
N
-метил-
N
-(6-метил-2-((4aS,5aR)-5а-метил-1,4,4а,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-
1Н-
бензо[d]имидазол-5-ил)ацетамид
2-((
2S,
6S)-2,6-Диметилморфолино)-
N
-метил-
N
-(6-метил-2-((4aS,5aR)-
5a
-метил-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-
1H-
бензо[d]имидазол-5-ил)ацетамид
Условия препаративной ВЭЖХ: Способ 1: Welch Xtimate C18 100 мм x 40 мм x 3 мкм, от 22 до 52% MeCN в 0,05% NH4OH/вода, 25 мл/мин, 10 мин; Способ 2: Welch Xtimate C18 100 мм x 40 мм x 3 мкм, от 32 до 52% MeCN в 0,05 NH4OH/вода, 25 мл/мин, 10 мин; Способ 3: YMC-Actus Triart C18 100 мм x 30 мм x 5 мкм, от 42 до 62% MeCN в 0,05% NH4OH/вода, 35 мл/мин, 10 мин; Способ 4: YMC-Actus Triart C18 100 мм x 30 мм x 5 мкм, от 38 до 48% MeCN в 0,05% NH4OH/вода, 35 мл/мин, 10 мин; Способ 5: YMC-Actus Triart C18 100 мм x 30 мм x 5 мкм, от 40 до 60% MeCN в 0,05% NH4OH/вода, 35 мл/мин, 10 мин; Способ 6: Welch Xtimate C18 150 мм x 40 мм x 10 мкм, от 21 до 61% MeCN в 0,225% муравьиной кислоты в воде, 60 мл/мин, 10 мин.
Указанные в заголовке соединения в таблице ниже получают по методике, описанной для примера 3, из соответствующей кислоты и примера получения 46.
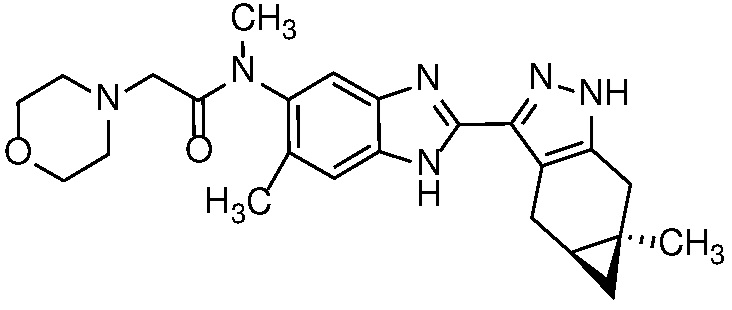
N-
Метил-
N
-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1
Н-
бензо[d]имидазол-5-ил)-2-морфолиноацетамид
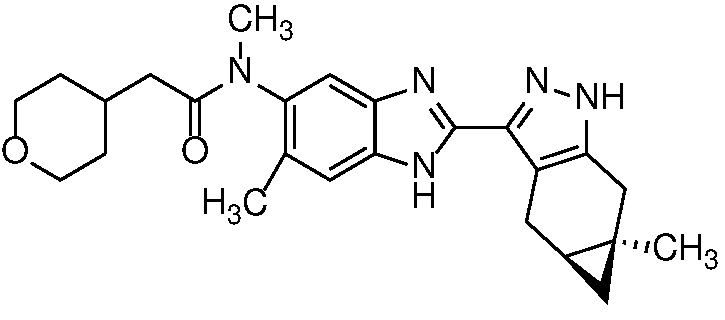
N-
Метил-
N
-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1
Н-
бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)ацетамид
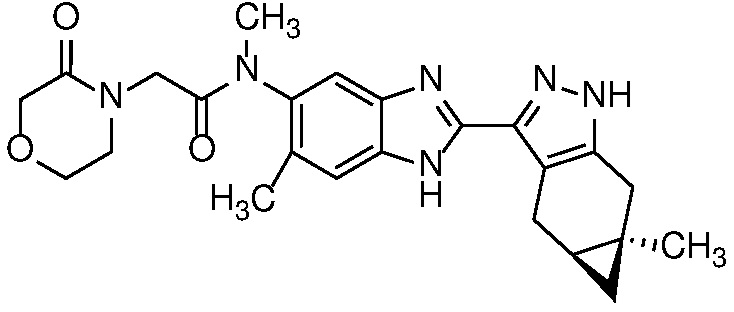
N-
Метил-
N
-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(3-оксоморфолино)ацетамид
Условия препаративной ВЭЖХ:
Способ 7: Phenomenex Gemini-NX 150 мм × 30 мм × 5 мкм, от 19 до 59% 0,05% NH4OH в MeCN/воде, 30 мл/мин, 10 мин.
Способ 8: YMC-Actus Triart C18 100 мм × 30 мм × 5 мкм, от 40 до 60% MeCN в 0,05% NH4OH/вода, 35 мл/мин, 10 мин.
Способ 9: Agela Durashell C18 150 мм x 25 мм x 5 мкм, i5-55% 0,225% муравьиной кислоты в MeCN/воде, 35 мл/мин, 8-минутный градиент.
Пример 37: (S)- N -(7-бром-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
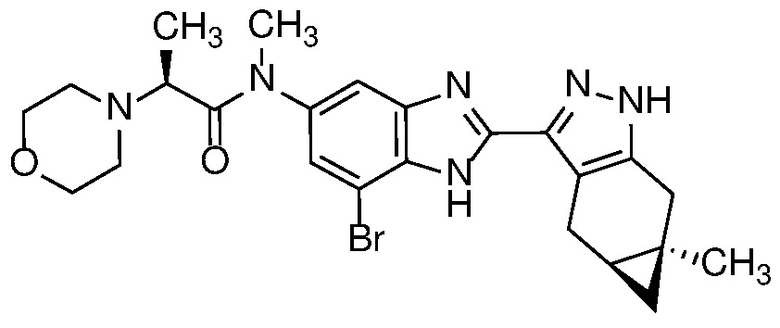
Раствор Et3SiH (117 мг, 1,01 ммоль) в ТФК (5 мл) при 0°С обрабатывают примером получения 102 (130 мг, 0,202 ммоль). Смесь перемешивают при 0°С в течение 2 ч и концентрируют. Остаток помещают в МеОН, охлаждают до 0°С и обрабатывают конц. NH4OH (1 мл). Смесь концентрируют, и остаток очищают препаративной ВЭЖХ (Boston Prime C18 150 мм × 30 мм × 5 мкм, от 35 до 55% MeCN в 0,05% NH4OH/вода, 25 мл/мин, 10 мин) с получением указанного в заголовке соединения (38 мг, 36%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,05 (с, 1H), 12,96 (с, 1H), 7,42 (с, 1H), 7,40 (с, 1H), 3,48 (д, 5H), 3,31-3,23 (м, 1H), 3,19 (с, 3H), 3,16 (д, 1H), 3,00 (тд, 2H), 2,74 (д, 1H), 2,47-2,36 (м, 1H), 2,23-2,01 (м, 2Н), 1,25 (с, 3Н), 1,13 (дт, 1Н), 0,99 (д, 3Н), 0,38 (дд, 1Н), 0,17 (т, 1Н); ЖХ/МС m/z (M+H)+=514,9 (81Br).
Пример 38: (S)- N -(7-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
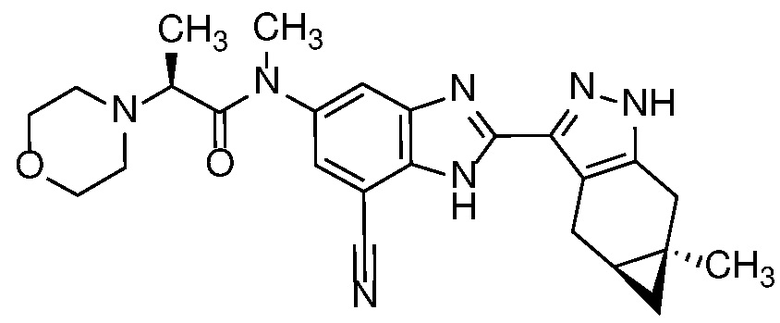
Стадия 1: (S)- N -(4-циано-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5а,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)- 1H- бензо[d]имидазол-6-ил)- N- метил-2-морфолинопропанамид
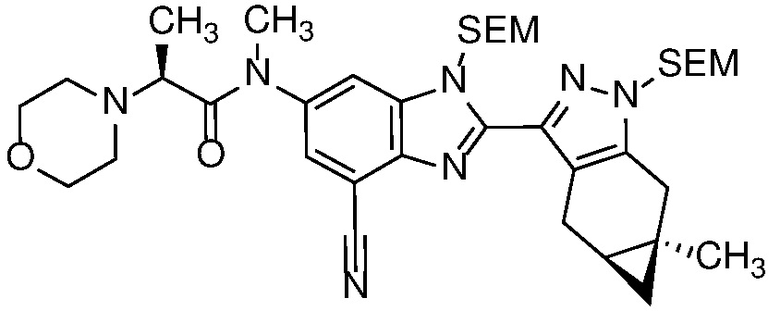
Раствор из Примера получения 103 (160 мг, 0,207 ммоль) в NMP (10 мл) обрабатывают Pd(Ph3P)4 (24 м, 0,021 ммоль) и Zn(CN)2 (121 мг, 1,03 ммоль). Смесь нагревают в микроволновом реакторе при 160°С в течение 1 часа. Смесь охлаждают до комнатной температуры и распределяют между водой (10 мл) и EtOAc (50 мл). Органический слой отделяют, и водный слой экстрагируют дополнительным количеством EtOAc (50 мл). Объединенные органические слои промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют. Неочищенный материал очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), с получением указанного в заголовке соединения (120 мг, 81%). ЖХ/МС m/z (М+Н)+=720,4.
Стадия 2: (S)- N -(7-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
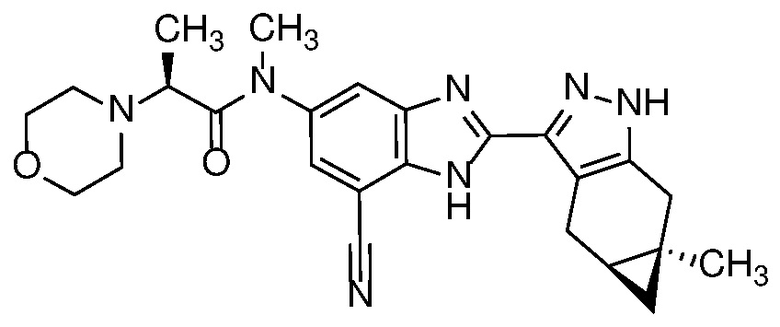
Раствор Et3SiH (81 мг, 0,694 ммоль) в ТФК (5 мл) при 0°С обрабатывают силиловым эфиром со стадии 1 (100 мг, 0,139 ммоль). Смесь перемешивают при 0°С в течение 2 ч и концентрируют. Остаток растворяют в МеОН и охлаждают до 0°С. Добавляют NH4OH (1 мл). Смесь концентрируют и остаток очищают препаративной ВЭЖХ (Boston Prime C18 150 мм × 30 мм × 5 мкм, от 22 до 47% MeCN в 0,2% муравьиной кислоте в воде, 25 мл/мин, 10 мин) с получением указанного в заголовке соединения (27 мг, 42%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,35 (с, 1H), 13,09 (с, 1H), 7,73 (с, 2H), 3,53-3,40 (м, 5H), 3,20 (с, 3H), 3,14 (д, 1Н), 3,02 (д, 2Н), 2,75 (д, 1Н), 2,37 (дд, 2Н), 2,07 (с, 1Н), 1,26 (с, 3Н), 1,14 (с, 1Н), 0,98 (д, 3Н), 0,38 (дд, 1Н), 0,17 (т, 1Н); ЖХ/МС m/z (М+Н)+=460,2.
Пример 39: (S)- N -(7-гидрокси-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
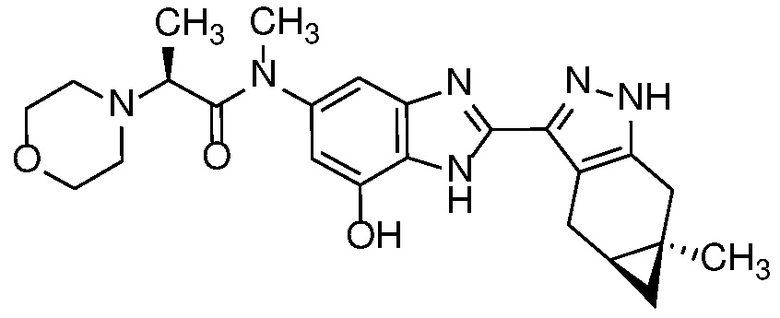
Раствор Et3SiH (196 мг, 1,69 ммоль) в ТФК (5 мл) при 0°С обрабатывают примером получения 105 (120 мг, 0,169 ммоль). Смесь перемешивают при 20°С в течение 2 ч и концентрируют. Остаток помещают в МеОН, охлаждают до 0°С и обрабатывают конц. NH4OH (1 мл). Смесь концентрируют и остаток очищают препаративной ВЭЖХ (Boston Prime C18 150 мм × 30 мм × 5 мкм, от 25 до 45% MeCN в 0,05% NH4OH в воде, 25 мл/мин, 10 мин) с получением указанного в заголовке соединения (28 мг, 37%). Аналитическая хиральная колонка СЖХ: Chiralpak AS-3 100 мм × 4,6 мм × 3 мкм; Подвижная фаза: A/B: CO2/EtOH (0,05% Et2NH); Градиент: от 5% до 40% В за 4 мин и удержание 40% в течение 2,5 мин, затем 5% В в течение 1,5 мин; Скорость потока: 2,8 мл/мин. Температура колонки: 35°С; время удержания=2,760 мин; ЖХ/МС m/z (М+Н)+=451,2.
Пример 40: (S)- N -(7-метокси-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н -бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
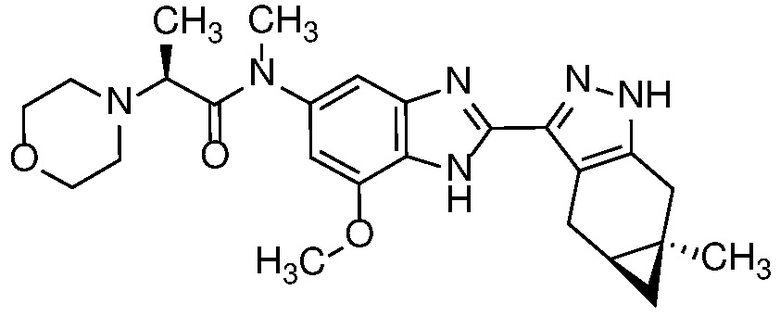
Раствор Et3SiH (120 мг, 1,03 ммоль) в ТФК (5 мл) при 0°С обрабатывают Примером получения 106 (150 мг, 0,207 ммоль). Смесь перемешивают при 0°С в течение 2 ч и концентрируют. Остаток растворяют в МеОН и охлаждают до 0°С. Смесь обрабатывают конц. NH4OH (1 мл), концентрируют и остаток очищают препаративной ВЭЖХ (Boston Prime C18 150 мм × 30 мм × 5 мкм, от 32 до 55% MeCN в 0,05% NH4OH/вода, 25 мл/мин, 10 мин) с получением указанного в заголовке соединения (11,4 мг, 12%). 1H ЯМР (400 МГц, ДМСО-d6) δ 12,84 (с, 1H), 12,70 (с, 1H), 6,96 (с, 1H), 6,60 (с, 1H), 3,96 (с, 3H), 3,49 (с д, 5Н), 3,39 (д, 0Н), 3,29 (тд, 1Н), 3,27-3,19 (м, 1Н), 3,19 (с, 3Н), 3,10-2,89 (м, 2Н), 2,73 (д, 1Н), 2,47-2,38 (м, 1H), 2,24 (д, 2H), 1,25 (с, 3H), 1,16-1,04 (м, 1H), 1,03 (д, 3H), 0,37 (дд, 1H), 0,16 (с, 1Н); ЖХ/МС m/z (М+Н)+=465,1.
Пример 41: (S)-N-метил- N -(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-7-(трифторметил)- 1Н- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
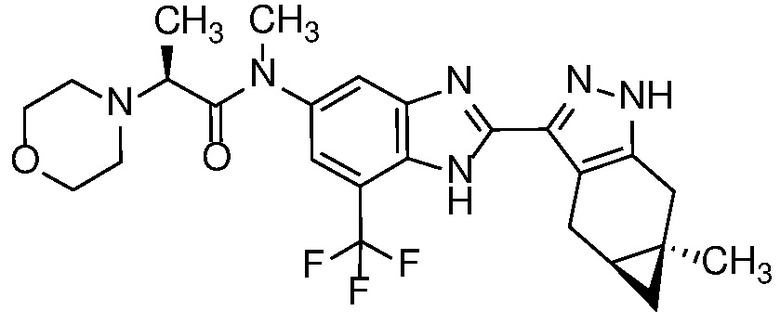
Раствор Et3SiH (183 мг, 1,57 ммоль) в ТФК (5 мл) при 0°С обрабатывают Примером получения 112 (120 мг, 0,157 ммоль). Смесь перемешивают при комнатной температуре в течение 2 часов и концентрируют. Остаток растворяют в МеОН и охлаждают до 0°С. Смесь обрабатывают конц. NH4OH (1 мл), концентрируют и остаток очищают препаративной ВЭЖХ (Boston Prime C18 150 мм × 30 мм × 5 мкм, от 43 до 65% MeCN в 0,05% NH4OH/вода, 25 мл/мин, 10 мин) с получением указанного в заголовке соединения (50 мг, 63%). 1H ЯМР (400 МГц, ДМСО-d6) δ 13,23 (с, 1H), 13,02 (с, 1H), 7,68 (с, 1H), 7,50 (с, 1H), 3,55-3,37 (м, 4H), 3,30 (с, 2H), 3,22 (с, 3H), 3,13 (кв, 1H), 3,08-2,90 (м, 2H), 2,75 (д, 1H), 2,45-2,30 (м, 1H), 2,14-1,93 (м, 2Н), 1,25 (с, 3Н), 1,12 (дд, 1Н), 0,97 (д, 3Н), 0,37 (дд, 1Н), 0,17 (т, 1Н); ЖХ/МС m/z (М+Н)+=503,1.
Пример 42: (S)- N -(7-(метоксиметил)-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
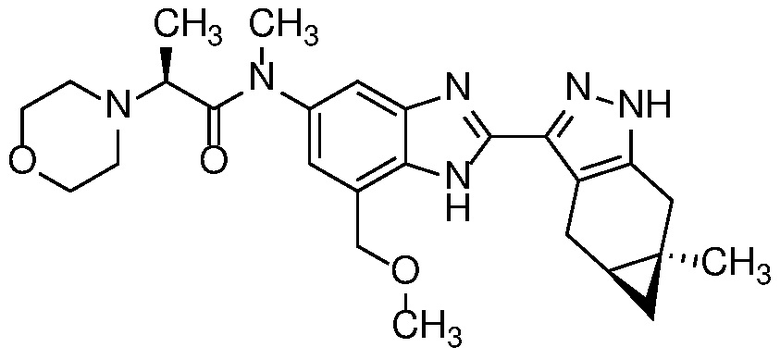
Раствор из Примера получения 117 (61 мг, 0,083 ммоль) в ДХЭ (0,7 мл) при комнатной температуре обрабатывают ТФК (0,6 мл). Смесь перемешивают в течение 16 ч и концентрируют. Остаток растворяют в EtOH (0,7 мл) и охлаждают до 0°С. Смесь обрабатывают конц. NH4OH (0,2 мл) и смесь перемешивают при комнатной температуре в течение 4 часов. Смесь разбавляют водой и экстрагируют смесью 85:15% изопропанол/ДХМ (х3). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают препаративной ВЭЖХ (XBridge C18 19 мм × 100 мм × 5 мкм, 5-95% MeCN (0,03% NH4OH)/вода, 8,5 мин, выдержка при 95% в течение 1,5 мин, 25 мл/мин) с получением указанного в заголовке соединения (23 мг, 59%). Время удержания=1,74 мин; ЖХ/МС m/z (М+Н)+=479,5.
Пример 43: (S)- N -(7-хлор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
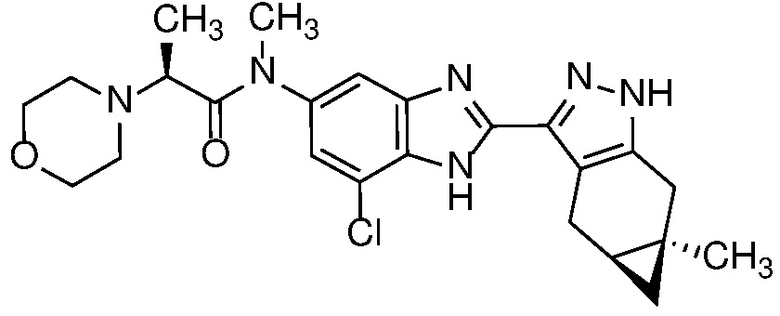
Раствор из Примера получения 122 (42 мг, 0,085 ммоль) в ТФК (0,6 мл) и ДХЭ (0,5 мл) перемешивают при комнатной температуре в течение 2 ч и обрабатывают Et3SiH (0,046 мл, 0,29 ммоль). Смесь перемешивают при комнатной температуре еще 2 часа. Смесь концентрируют и остаток разбавляют насыщ. водным NaHCO3. Смесь экстрагируют EtOAc (х3). Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают препаративной ВЭЖХ (XBridge C18 19 мм x 100 мм x 5 мкм, 5-95% MeCN (0,03% NH4OH)/вода, 8,5 мин, выдержка при 95% в течение 1,5 мин, 25 мл/мин) с получением указанного в заголовке соединения (17,3 мг, 63%). Время удержания=2,04 мин; ЖХ/МС m/z (М+Н)+=469,6.
Пример 44: (S)- N -(7-этил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
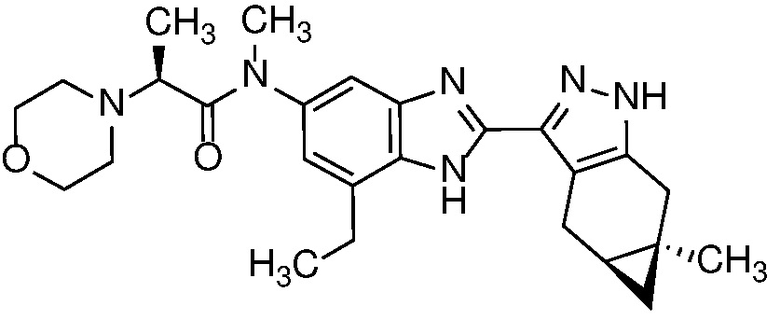
Раствор из Примера получения 126 (45 мг, 0,062 ммоль) в ДХЭ (0,5 мл) при комнатной температуре обрабатывают ТФК (0,2 мл) и Et3SiH (24 мг, 0,21 ммоль). Смесь перемешивают в течение 16 ч и концентрируют. Остаток растворяют в ДХМ и насыщ. водном NaHCO3. Слои разделяют, и водный слой экстрагируют EtOAc (х2). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Остаток очищают препаративной ВЭЖХ (XBridge C18 19 мм x 100 мм x 5 мкм, 5-95% MeCN (0,03% NH4OH)/вода, 8,5 мин, выдержка при 95% в течение 1,5 мин, 25 мл/мин) с получением указанного в заголовке соединения (6,1 мг, 21%). ЖХ/МС m/z (М+Н)+=463,6; Время удержания 1,78 мин.
Пример 45: (S)- N -(7-(гидроксиметил)-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
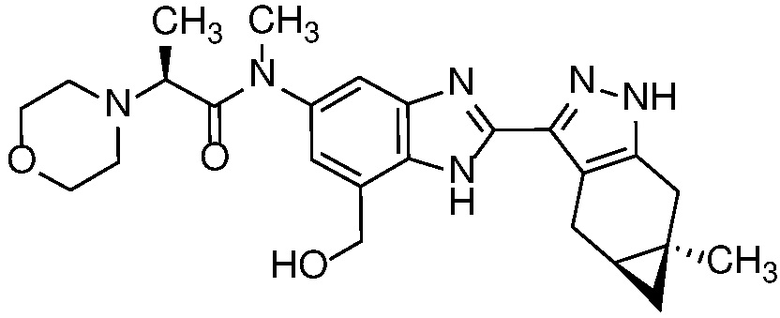
Раствор из Примера получения 132 (20 мг, 0,028 ммоль) в ДХЭ (0,3 мл) при 0°С обрабатывают ТФК (157 мг, 1,38 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 20 часов. Смесь концентрируют и растворяют в EtOH, охлаждают до 0°С, обрабатывают конц. NH4OH (0,2 мл) и смесь перемешивают в течение 3 часов. Смесь разбавляют водой и экстрагируют ДХМ (х4) и 15% изопропанолом/ДХМ (х3). Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают препаративной ВЭЖХ (XBridge C18 19 мм × 100 мм × 5 мкм, 5-95% MeCN (0,03% NH4OH)/вода, 8,5 мин, выдержка при 95% в течение 1,5 мин, 25 мл/мин) с получением указанного в заголовке соединения (4,9 мг, 38%). Время удержания=1,59; ЖХ/МС m/z (М+Н)+=465,6.
Пример 46: (S)- N -(7-фтор-6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
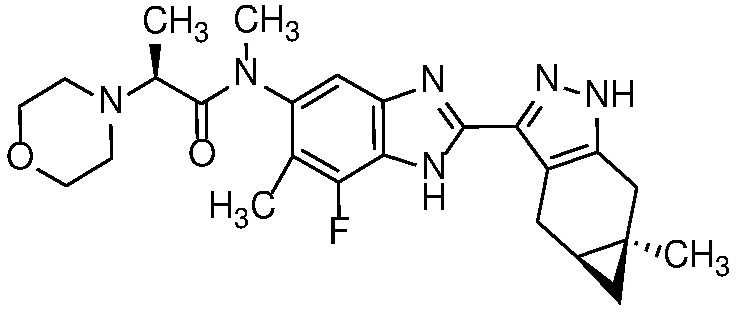
Указанное в заголовке соединение получают аналогично примеру 1 из 138 (2,1 г, 3,52 ммоль) и очищают препаративной ВЭЖХ (Chiralpak AD-3 50 мм × 6 мм × 3 мкм, 40% изократная смесь (0,05% диэтиламин в EtOH/CO2(g) 4 мл/мин, температура колонки=35°С) с получением указанного в заголовке соединения (1,3 г, 79%). Время удержания=0,38 мин и 1,46 мин; ЖХ/МС m/z (М+Н)+=467,1.
Пример 47: (S)- N -(6-фтор-7-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
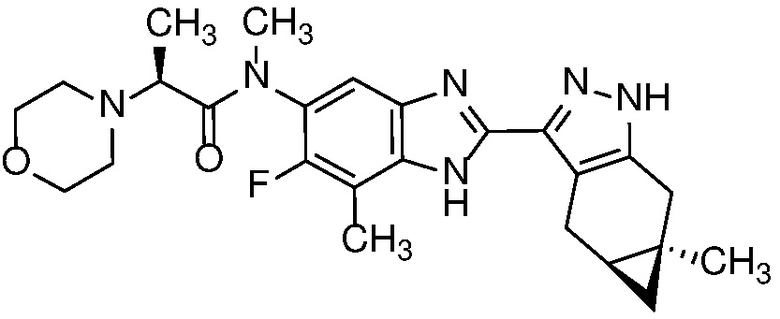
Указанное в заголовке соединение получают аналогично примеру 41 из 5-бром-4-фтор-3-метилбензол-1,2-диамина. Очищают в условиях препаративной ВЭЖХ: Welch Xtimate 75 мм × 40 мм × 3 мкм, от 42 до 62% MeCN в 0,05% NH4OH в воде, 25 мл/мин, 10 мин) с получением указанного в заголовке соединения (234 мг, 74%). Аналитическая СЖХ (Chiralpak AS-3 100 мм × 4,6 мм × 3 мкм, A: CO2(g); B: 0,05% диэтиламина в EtOH; градиент 5-40% B в течение 4 мин, выдержка 40% B в течение 2,5 мин, 5% B в течение 1,5 мин, 2,8 мл/мин, температура колонки=35°С), время удержания=2,70 мин; ЖХ/МС m/z (М+Н)+=467,2.
Пример 48: (S)- N -(7-(дифторметил)-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
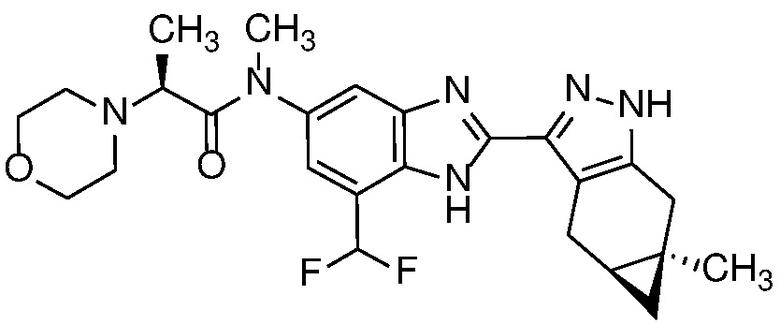
Раствор из Примера получения 144 (72 мг, 0,097 ммоль) в ДХЭ (0,6 мл) обрабатывают ТФК (0,37 мл). Смесь перемешивают при комнатной температуре в течение 20 часов. Смесь концентрируют, и полученный остаток растворяют в EtOH (1 мл), охлаждают до 0°С и обрабатывают конц. NH4OH (0,7 мл). Смесь перемешивают при комнатной температуре в течение 3 часов. Смесь разбавляют водой и экстрагируют ДХМ (х4), а затем смесью 15% изопропанол/ДХМ (х3). Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают препаративной ВЭЖХ (XBridge C18 19 мм × 100 мм × 5 мкм, 5-95% MeCN (0,03% NH4OH)/вода, 8,5 мин, выдержка при 95% в течение 1,5 мин, 25 мл/мин) с получением указанного в заголовке соединения (27 мг, 57%). Время удержания=2,16 мин; ЖХ/МС m/z (М+Н)+=485,6.
Пример 49: (S)- N -(6-(2-метоксиэтокси)-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид

Раствор из Примера получения 152 (160 мг, 0,25 ммоль) в ТФК (2,5 мл) при 5°С обрабатывают Et3SiH (146 мг, 1,25 ммоль). Смесь перемешивают 2 часа и смесь концентрируют. Остаток разбавляют насыщ. водным NaHCO3 и экстрагируют EtOAc (3× 8 мл). Органические экстракты объединяют, сушат, фильтруют и концентрируют. Остаток очищают препаративной ВЭЖХ (Phenomenex Gemini, NX-C18, 75 × 30 мм × 3 мкм, вода/CH3CN (0,05% NH4OH), 10-50% в течение 11 мин) с получением указанного в заголовке соединения (2,5 мг, 2%). 1H ЯМР (400 МГц, CD3OD) δ 7,67-7,16 (м, 2H), 4,26-4,18 (м, 2H), 3,81-3,72 (м, 2H), 3,65-357 (м, 4H), 3,40 (с, 3Н), 3,24 (д, 3Н), 3,19-3,01 (м, 2Н), 2,77 (д, 1Н), 2,57-2,36 (м, 4Н), 1,30 (с, 3Н), 1,27-1,08 (м, 3Н), 0,42 (дд, 1Н), 0,25 (т, 1Н); ЖХ/МС m/z (М+Н)+=509,3.
Пример 50: (S)- N -метил- N -(7-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1H- бензо[d]имидазол-5-ил)-2-морфолинопропанамид
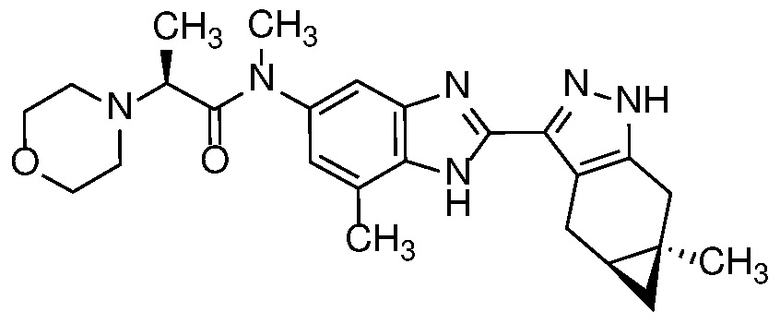
Раствор из Примера получения 158 (380 мг, 0,54 ммоль) в ТФК (5,4 мл) при комнатной температуре обрабатывают Et3SiH (321 мг, 2,7 ммоль). Смесь перемешивают при комнатной температуре в течение 3 ч и концентрируют. Остаток подщелачивали насыщ. водным NaHCO3 и экстрагируют EtOAc (3× 15 мл). Объединенные органические слои концентрируют. Остаток очищают препаративной ВЭЖХ (YMC Triart 150 мм × 30 мм × 5 мкм, от 27 до 67% MeCN в 0,05% NH4OH/вода, 25 мл/мин, 10 мин) с получением указанного в заголовке соединения (108 мг, 45%). 1H ЯМР (400 МГц, CD3OD) δ 7,36 (с, 1H), 6,99 (с, 1H), 3,62 (ддд, 4H), 3,36 (д, 1H), 3,31 (с, 3H), 3,26-3,10 (м, 2Н), 3,07 (д, 1Н), 2,78 (д, 1Н), 2,63 (с, 3Н), 2,54 (дт, 2Н), 2,38 (дт, 2Н), 1,30 (с, 3Н), 1,20-1,14 (м, 3Н), 1,16-1,13 (м, 1Н), 0,41 (дд, 1Н), 0,26 (т, 1Н); ЖХ/МС m/z (М+Н)+=448,9.
Пример 51: (S)- N -(2-((4aS,5aR)-5,5-дифтор-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-7-метил- 1H- бензо[d]имидазол-5-ил)- N- метил-2-морфолинопропанамид
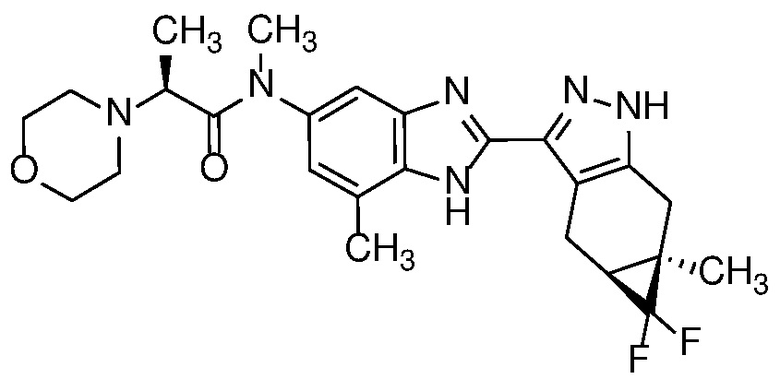
Указанное в заголовке соединение получают аналогично примеру 41 из 5-бром-3-метилбензол-1,2-диамина и примера получения 17. Условия препаративной ВЭЖХ: Phenomenex Gemini-NX 150 мм × 30 мм × 5 мкм, от 24 до 64% MeCN в 0,05% NH4OH/вода, 25 мл/мин, 9 мин) с получением указанного в заголовке соединения (56 мг, 39%). 1H ЯМР (400 МГц, CD3OD) δ 7,48-7,25 (м, 1H), 7,07-6,95 (м, 1H), 3,72-3,57 (м, 4H), 3,26-3,19 (м, 1H), 3,14 (ушд, 1H), 2,87 (дд, 1H), 2,69-2,52 (м, 5H), 2,46-2,35 (м, 2H), 1,80-1,71 (м, 1H), 1,44 (с, 3H), 1,18 (д, 3H); ЖХ/МС m/z (М+Н)+=485,2.
Пример 52: (S)- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид
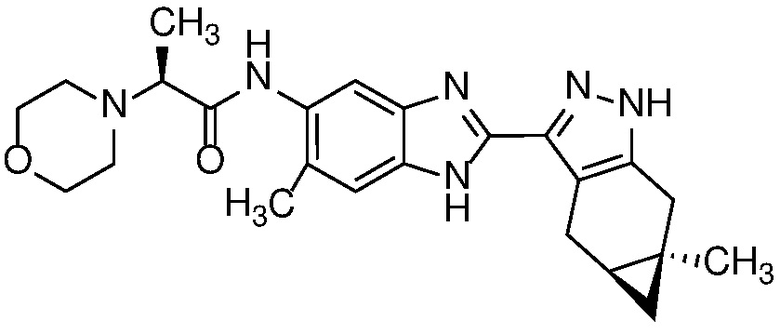
Стадия 1: 6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-амин
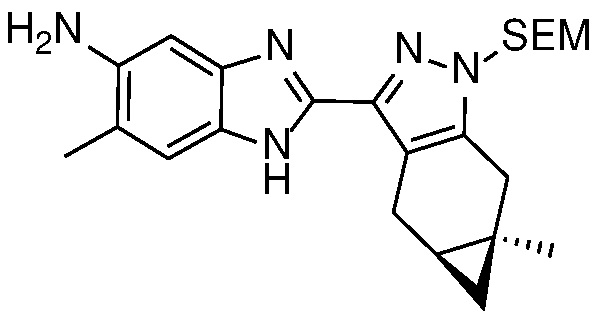
Раствор из Примера получения 66 (1,50 г, 3,22 ммоль) в этаноле (20 мл) обрабатывают водн. NaOH (10 М, 6,44 мл, 64,4 ммоль) при 15°С. Смесь перемешивают при 90°С в течение 18 часов. Смесь концентрируют и остаток экстрагируют EtOAc (3× 100 мл). Объединенные органические слои концентрируют и неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=30-50%), с получением указанного в заголовке соединения (984 г, 72%). ЖХ/МС m/z (М+Н)+=423,9.
Стадия 2: (S)-N-(6-метил-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид
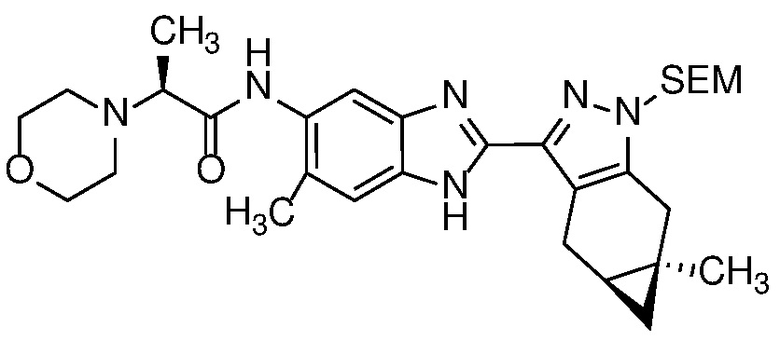
Указанное в заголовке соединение получают аналогично примеру 6, стадия 1, из примера получения 16 (115 мг, 0,59 ммоль) и силилового эфира со стадии 1 (208 мг, 0,491 ммоль), с получением указанного в заголовке соединения (216 мг, 78%). 1H ЯМР (400 МГц, CDCl3) δ 9,62-9,51 (м, 1H), 8,41-7,62 (м, 1H), 5,42-5,35 (м, 2H), 3,85-3,78 (м, 3H), 3,59-3,55 (м, 2H), 3,27-3,17 (м, 2H), 2,75-2,60 (м, 9H), 2,44-2,40 (м, 2H), 1,40-1,15 (м, 8H), 0,92-0,85 (м, 8H), 2Н), 0,42-0,38 (м, 1Н), 0,01--0,08 (м, 9Н); ЖХ/МС m/z (М+Н)+=565,1.
Стадия 3: (S)- N -(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид
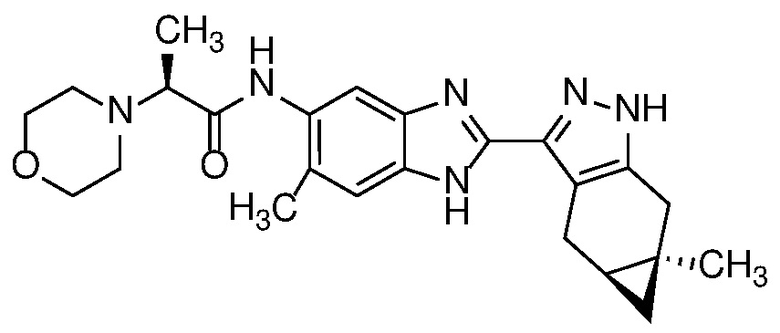
Указанное в заголовке соединение получают аналогично примеру 6, стадия 2, с использованием силилового эфира, полученного на стадии 2 (0,216 г, 0,382 ммоль), и очищают препаративной ВЭЖХ (Phenomenex Gemini NX-C18 30 мм × 74 мм × 3 мкм, 17-57% MeCN (0,05% NH4OH)/вода, 11 мин, 25 мл/мин) с получением указанного в заголовке соединения (81 мг, 49%). 1H ЯМР (400 МГц, CD3OD) δ 7,91 (с, 1H), 7,45 (ушс, 1H), 3,85-3,78 (м, 4H), 3,30-3,25 (м, 1H), 3,17-3,13 (м, 1H), 3,09-2,76 (м, 2H), 2,72-2,64 (м, 4H), 2,43 (с, 3H), 1,41-1,39 (м, 3H), 1,30 (м, 3H), 1,19-1,15 (м, 1Н), 0,44-0,39 (м, 1Н), 0,26-0,24 (м, 1Н); ЖХ/МС m/z (М+Н)+=435,1.
Пример 53: (S)-N-(2-((4aS,5aR)-5,5-дифтор-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-5-метил-1H-бензо[d]имидазол-6-ил)-N-метил-2-морфолинопропанамид
Стадия 1: (S)-N-(2-((4aS,5aR)-5,5-дифтор-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-5-метил-1H-бензо[d]имидазол-6-ил)-N-метил-2-морфолинопропанамид
Смесь из примера получения 17 (260 мг, 0,75 ммоль) и Na2S2O5 (65 мг, 0,34 ммоль) обрабатывают раствором из Примера получения 32 (200 мг, 0,68 ммоль) в ДМФ (5 мл). Смесь обрабатывают ДМСО (1 мл) и нагревают при 110°С в течение 18 часов. Смесь охлаждают до комнатной температуры, выливают в воду со льдом и экстрагируют с помощью EtOAc. Слои разделяют и органическую фазу промывают раствором соли, сушат (MgSO4), фильтруют и концентрируют с получением указанного в заголовке соединения стадии 1 (550 мг). ЖХ/МС m/z (М+Н)+=615,3,
Стадия 2: (S)-N-(2-((4aS,5aR)-5,5-дифтор-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-5-метил-1H-бензо[d]имидазол-6-ил)-N-метил-2-морфолинопропанамид
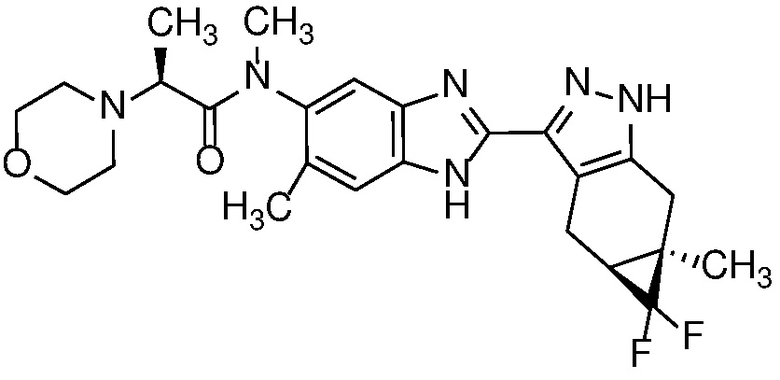
К силиловому эфиру со стадии 1 (0,55 г, 0,72 ммоль), охлажденному до 0°С добавляют ТФК (10 мл), и затем Et3SiH (0,83 мг, 7,16 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 1,5 часов. Смесь концентрируют, нейтрализуют с помощью водн. насыщ. NaHCO3 (20 мл), затем экстрагируют EtOAc. Органические слои объединяют, промывают раствором соли, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают ВЭЖХ с обращенной фазой (Phenomenex Gemini C18, 250 × 50 мм × 7 мкМ, вода (0,05% NH4OH)/MeCN от 30 до 50% в течение 10 мин, 35 мл/мин) с получением указанного в заголовке соединения (0,19 г, 55%). Метод СЖХ: Chiral Tech OD-3, 50 мм × 4,6 мм × 3 мкм, от 5 до 40% с 0,05% диэтиламина в EtOH/CO2(g), 4,0 мл/мин, температура колонки 35°С, время удержания=1,58 мин (43,1%) и 1,65 мин (56,8%), 100% эи. ЖХ/МС m/z (М+Н)+=485,3.
Пример 54: N -(6-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)ацетамид
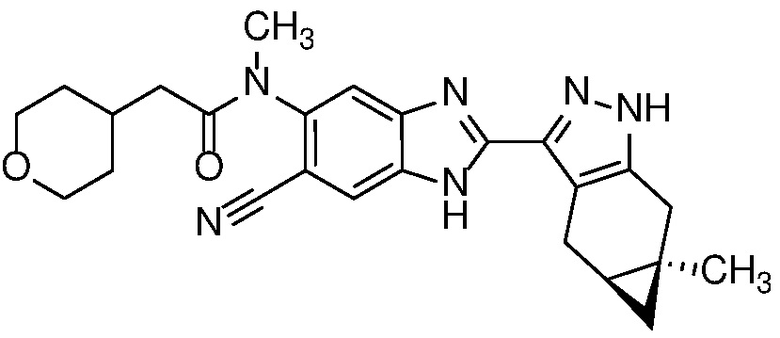
Стадия 1: N -(5-циано-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа [f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-6-ил)- N- метил-2-(тетрагидро-2H-пиран-4-ил)ацетамид и N-(6-циано-2-((4aS,5aR)-5a-метил-1-((2-(триметилсилил)этокси)метил)-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1-((2-(триметилсилил)этокси)метил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2 Н -пиран-4-ил)ацетамид
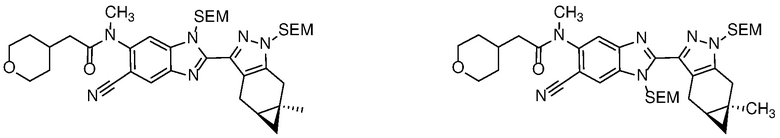
К раствору из Примера получения 164 (100,0 мг, 0,1727 ммоль) в ДМФ (5,0 мл) добавляют 2-(тетрагидро-2Н-пиран-4-ил)уксусную кислоту (25 мг, 0,17 ммоль), гексафторфосфат N,N,N',N'-тетраметилхлорформамидиния (72,7 мг, 0,259 ммоль) и N-метилимидазол; (28,4 мг, 0,345 ммоль) при комнатной температуре, затем реакционную смесь перемешивают при 60°С в течение 16 часов. Реакционную смесь обрабатывают 3% водн. LiCl (10 мл) и экстрагируют EtOAc (3× 5 мл). Объединенные органические слои промывают раствором соли (10 мл) и концентрируют. Неочищенный продукт очищают хроматографией (двуокись кремния, EtOAc/ПЭ=0-100%), получая указанные в заголовке соединения в виде смеси (104 мг, 85%). ЖХ/МС m/z (M+H)+=705,3
Стадия 2: N -(6-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)- 1Н- бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)ацетамид
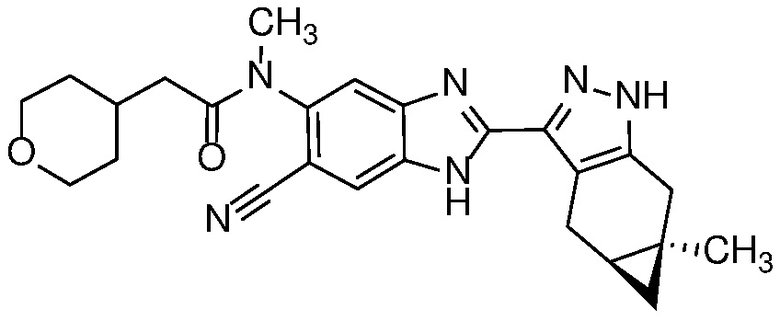
Раствор силиловых эфиров со стадии 1 (40 мг, 0,07 ммоль) в ТФК (2,0 мл) охлаждают до 0°С и добавляют Et3SiH (41 мг, 0,35 ммоль). Реакционную смесь перемешивают при 0°С в течение 2 часов. Смесь концентрируют, нейтрализуют конц. NH4OH (20 мл) и экстрагируют EtOAc (х2). Объединенные органические экстракты промывают раствором соли, затем сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают ВЭЖХ с обращенной фазой (Phenomenex Gemini NX, 75 × 30 мм × 3 мкМ, вода (0,05% NH4OH)/MeCN от 13 до 53% в течение 9 мин, 30 мл/мин) с получением указанного в заголовке соединения (14,86 мг, 48%). Метод СЖХ: Chiral Tech OD-3, 50 мм × 4,6 мм × 3 мкм, от 5 до 40% с 0,05% диэтиламина в EtOH/CO2(g), 2,8 мл/мин, температура колонки 35°С, время удержания=5,03 мин (100%), 100% эи. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,09 (с, 1H), 13,04 (с, 1H), 8,27 (с, 0,5H), 8,13 (с, 0,5H), 7,95 (с, 0,5H), 7,55 (0,5H), 3,83 (д, 5H), 3,31 (м, 1H), 3,03 (д, 2H), 2,83 (д, 2H), 2,76 (д, 1H), 2,17 (с, 1H), 1,67 (д, 2Н), 1,34 (квд, 2Н), 1,26 (с, 4Н), 1,23 (с, 1Н), 1,13 (с, 1Н), 0,42-0,35 (м, 1Н), 0,18 (с, 1Н); ЖХ/МС m/z (M+H)+=445,2
Пример 55: (R)- N -(7-циано-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2H-пиран-4-ил)пропанамид
К примеру получения 173 (82 мг, 0,18 ммоль), охлажденному до 0°С, добавляют смесь ТФК (5 мл) и Et3SiH (206 мг, 1,77 ммоль). Смесь перемешивают при комнатной температуре в течение 15 ч и удаляют растворитель. Остаток растворяют в MeOH (10 мл) и обрабатывают NH4OH (1 мл). Растворитель удаляют, и неочищенный материал очищают препаративной ВЭЖХ (Boston Prime C-18 150 х 30 мм х 5 мкм, H2O/CH3CN с 0,05% NH4OH, 40-65% за 10 мин, 25 мл/мин) с получением указанного в заголовке соединения (35 мг, 68%). 1H ЯМР (400 МГц, ДМСО-d6) δ 7,66 (ушс, 1H), 7,58 (с, 1H), 3,76 (т, 2H), 3,48 (д, 1H), 3,35-3,26 (м, 2H), 3,20 (с, 4Н), 3,02 (д, 2Н), 2,76 (д, 1Н), 2,11-1,95 (м, 1Н), 1,66-1,58 (м, 1Н), 1,48 (д, 2Н), 1,26 (с, 3Н), 1,19-0,97 (м, 1Н), 0,93 (д, 3Н), 0,88-0,80 (м, 1Н), 0,39 (дд, 1Н), 0,17 (т, 1Н). Хиральный СЖХ (Chiralpak AD-3, 50×4,6 мм, 3 мкм, CO2/iPrOH с 0,05% Et2NH, от 5 до 40% 2 мин, выдержка 1,2 мин, 4 мл/мин, T=35°С) ВУ=1,785 мин (100% эи). ЖХ/МС m/z (М+Н)+=459,1.
Пример 56: (S)-N-(метил-13C-d3)-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамид
Пример 56 получают в соответствии с процедурой, описанной для примера 1, с йодметан-13CD3 вместо йодметана с получением 550 мг указанного в заголовке соединения. Способ аналитической ВЭЖХ: Eclipse XDB-C18 150 мм × 4,6 мм × 3,5 мкм; H2O/MeCN: 10-90% в течение 10 мин, 1,0 мл/мин, время удержания=7,605 мин (99,6%), ЖХ/МС m/z (M+H)+=453,2.
Биологические анализы
Исследования in vitro
Активность IL-2-индуцируемой Т-клеточной киназы (ITK), IC50 (нМ)
Активность ITK определяют путем измерения эффекта тестируемого соединения в анализе фермента ITK.
1,0 М раствор HEPES Buffer pH 7,5 готовят следующим образом: 238,3 г HEPES свободной кислоты (Sigma) и 800 мл воды объединяют и смесь перемешивают до полного растворения. pH доводят до 7,5 титрованием 5N NaOH, и объем доводят до 1000 мл. Раствор фильтруют и стерилизуют.
Буфер для анализа ITK готовят следующим образом: 50 мл воды для ВЭЖХ обрабатывают 2 мл 1,0 М буфера HEPES, 500 мкл 2% желатина (Sigma), 1,0 мл водного раствора MgCl2 (1,0 М) и 1,0 мл водного раствора глутатиона (0,5 М), и раствор перемешивают. Раствор доводят до 99 мл в мерном цилиндре добавлением воды и стерилизуют через фильтр 0,2 мкм. Добавляют 0,1 мл раствора детергента Brij-35™ Surfact-Amps™ (10% масс./об. водный раствор, ThermoFisher) и 1,0 мл АТФ (Teknova, 100 мМ) и раствор перемешивают.
Раствор фермента 1,33X ITK готовят следующим образом: 49,99 мл буфера для анализа ITK обрабатывают 4,1 мкл фермента ITK (ITK FL (с меткой N-Flag и C-His, ~72 кДа) Lake Pharma, 0,25 мг/мл в буфере, содержащем 25 мМ Трис, рН 7,8, 150 мМ NaCl, 10% глицерина и 2 мМ TCEP), и смесь осторожно встряхивали. Полученный раствор хранят на льду. За 30 минут до использования раствор фермента удаляют со льда и уравновешивают до комнатной температуры путем инкубации на водяной бане при КТ.
Раствор субстрата 4X ITK готовят следующим образом: 50 мл буфера для анализа ITK обрабатывают 100 мкл пептида BTK (China Peptide Company, 2 мМ исходный раствор в ДМСО). Пробирку закрывают, перемешивают, осторожно переворачивая пробирку, и затем хранят на льду. За 30 минут до использования, раствор субстрата удаляют со льда и уравновешивают до комнатной температуры путем инкубации на водяной бане при КТ.
Во время анализа 7,5 мкл раствора фермента 1,33X ITK добавляют в лунки планшета, содержащие 0,1 мкл различных концентраций тестируемого соединения в ДМСО. Планшет инкубируют 30 мин при КТ. Каждую лунку планшета обрабатывают 2,5 мкл 4X раствора субстрата ITK и планшет герметично закрывают (TopSeal™, Perkin Elmer). Планшет вращают при 1000 об/мин в течение 30 с, и затем инкубируют в течение 60 мин при комнатной температуре. Пломбу удаляют, и каждую лунку обрабатывают 10 мкл буфера Stop/Detect Buffer (20 мМ HEPES pH 7,5, 0,01% желатина, 1 нМ LANCE PT66 (Perkin Elmer), 16,5 мкг/мл Surelight APC (Perkin Elmer), 10 мМ). ЭДТК, 250 мМ NaCl). Планшет снова накрывают и вращают при 1000 об/мин в течение 30 секунд. Планшет инкубируют в течение ночи при КТ и в закрытом носителе для уменьшения дегидратации. Крышку удаляют, и флуоресценцию считывают с помощью планшетного ридера с длиной волны возбуждения 665 нм и длиной волны испускания 615 нм. Концентрации и полученные значения действия для тестируемого соединения наносят на график, и концентрацию соединения, необходимую для 50% эффекта (IC50), определяют с помощью четырехпараметрического логистического уравнения доза-ответ.
IC50 (мкМ) для соединений по изобретению представлены в следующей таблице.
Активность по ингибированию IL-2, IC50 (мкМ)
Ингибирующую активность IL-2 в супернатантах, активированных CD4+ Т-клеток человека, определяют путем измерения влияния тестируемого соединения на активность с использованием технологии cisbio HTRF™.
Т-клетки CD4+ человека активируют CD3/CD28 в течение 3 дней и размножают в течение дополнительных 4-6 дней (всего от 7 до 9 дней). В день 0, замороженные CD4+ Т-клетки размораживают, обрабатывают CD3/CD28 Dynabeads и инкубируют при 37°C/5%CO2. На 3 день микрносители удаляют и клетки разводят до 5 × 105 клеток/см2, помещают в колбу G-Rex10 и инкубируют при 37°C/5%CO2. С 7 по 9 день клетки удаляют из колб G-Rex, подсчитывают и снова разводят до 1 × 106 клеток/мл в стандартной колбе для тканевых культур.
Размноженные CD4+ Т-клетки центрифугируют при 300 х g в течение 10 минут и ресуспендируют до концентрации 0,5 миллиона клеток на мл (30000 клеток/лунку). 60 мкл CD4+ Т-клеток добавляют на лунку в 384-луночный планшет, содержащий 0,1 мкл различных концентраций тестируемого соединения в ДМСО. Планшеты инкубируют в течение 15 мин при 37°C/5%CO2. 20 мкл разведенного ImmunoCult™ (STEMCELL Technologies, 1:12,5 в среде для анализа Т-клеток) добавляют во все лунки планшета (конечная концентрация для анализа 1:50). Планшеты инкубируют еще от 20 до 24 часов при 37°C/5%CO2. Планшеты центрифугируют при 300×g в течение 10 минут. 16 мкл супернатанта удаляют и объединяют с 4 мкл IL-2 HTRF Abs. (набор cisbio). Планшеты инкубируют в течение 3 часов при комнатной температуре и считывают с помощью планшетного ридера EnVision при длинах волн 665 нм и 615 нм. Концентрации и полученные значения эффекта для тестируемого соединения наносят на график, и концентрацию соединения, необходимую для 50% действия (IC50), определяют с помощью четырехпараметрического логистического уравнения доза-ответ.
IC 50 (мкМ) для соединений по изобретению представлены в следующей таблице.
Активность рецепторной киназы тропомиозина А (TRKA), % ингибирования
Анализы для определения активности TRKA известны в данной области техники; например, см. те, которые описаны в:
- Skerratt SE, et al. J. Med. Chem. (2016), 59(22):10084-10099
PMID: 27766865. DOI: 10.1021/acs.jmedchem.6b00850
- Bagal SK, et al. J. Med. Chem. (2018), 61(15):6779-6800
PMID: 29944371. DOI: 10.1021/acs.jmedchem.8b00633
Активность TRKA, также известного как нейротрофический тирозинкиназный рецептор типа 1 (NTKR1), определяли путем измерения влияния тестируемого соединения на активность в отношении фермента NTRK1 с использованием формата сопряженных ферментов на основе флуоресценции ThermoFisher Z'-LYTE Assay (www.thermofisher.com/selectscreen). Тестируемые соединения подвергают скринингу при фиксированной концентрации 1 мкМ и определяют % ингибирования по сравнению с контролями при фиксированной концентрации АТФ 1 мМ. Полученное значение эффекта для тестируемого соединения сравнивают с контрольными образцами для определения % ингибирования (%).
Значения% ингибирования (%) для соединений по изобретению представлены в следующей таблице.
Данные исследования in vitro
Ключ:
1 Значения ITK IC50 представлены как среднее геометрическое от количества n,
2 Значения IL-2 IC50 представлены как среднее геометрическое от количества n,
3 Значения % ингибирования TRKA представлены как среднее арифметическое от количества n,
НТ означает не тестировали,
Все ссылки, упомянутые выше, полностью включены посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| C-3 и C-17 модифицированные тритерпеноиды в качестве ингибиторов ВИЧ-1 | 2017 |
|
RU2716502C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ ROR-ГАММА | 2017 |
|
RU2760366C2 |
| МОДУЛЯТОРЫ КИНАЗЫ, АССОЦИИРОВАННОЙ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА-1 | 2007 |
|
RU2459821C2 |
| ПРОПЕНОАТНЫЕ ПРОИЗВОДНЫЕ БЕТУЛИНА | 2012 |
|
RU2613554C2 |
| 5-ЗАМЕЩЕННЫЕ ИНДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2008 |
|
RU2487873C2 |
| БИЦИКЛИЧЕСКИЕ АРИЛЬНЫЕ МОНОБАКТАМОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2017 |
|
RU2733402C2 |
| ИНГИБИТОРЫ РЕПЛИКАЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2019 |
|
RU2812128C2 |
| СОЕДИНЕНИЯ | 2016 |
|
RU2725616C2 |
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
| АМИНОТРИАЗОЛОПИРИДИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2009 |
|
RU2552642C2 |
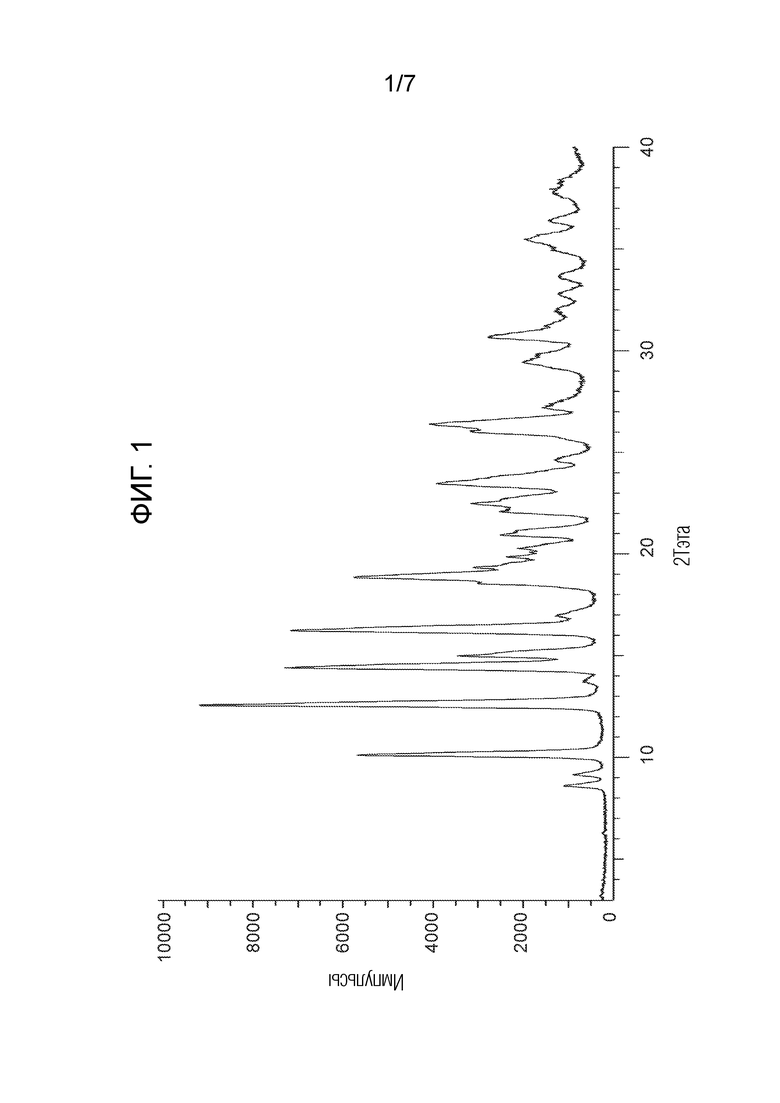
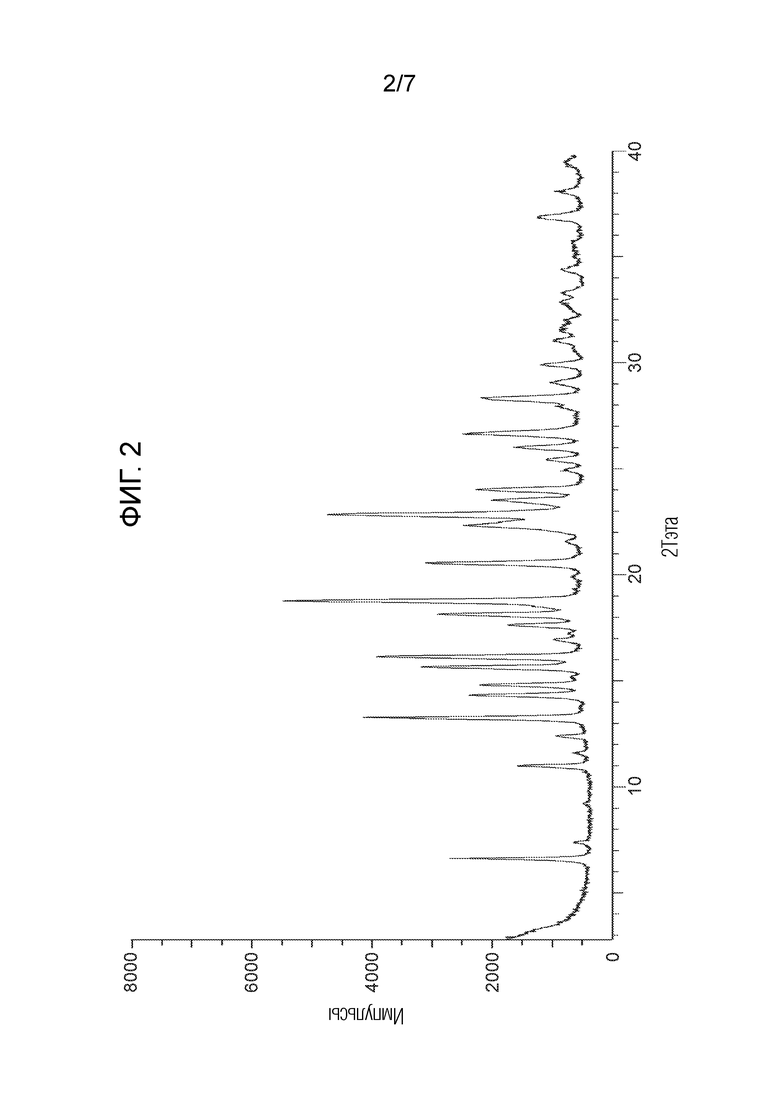
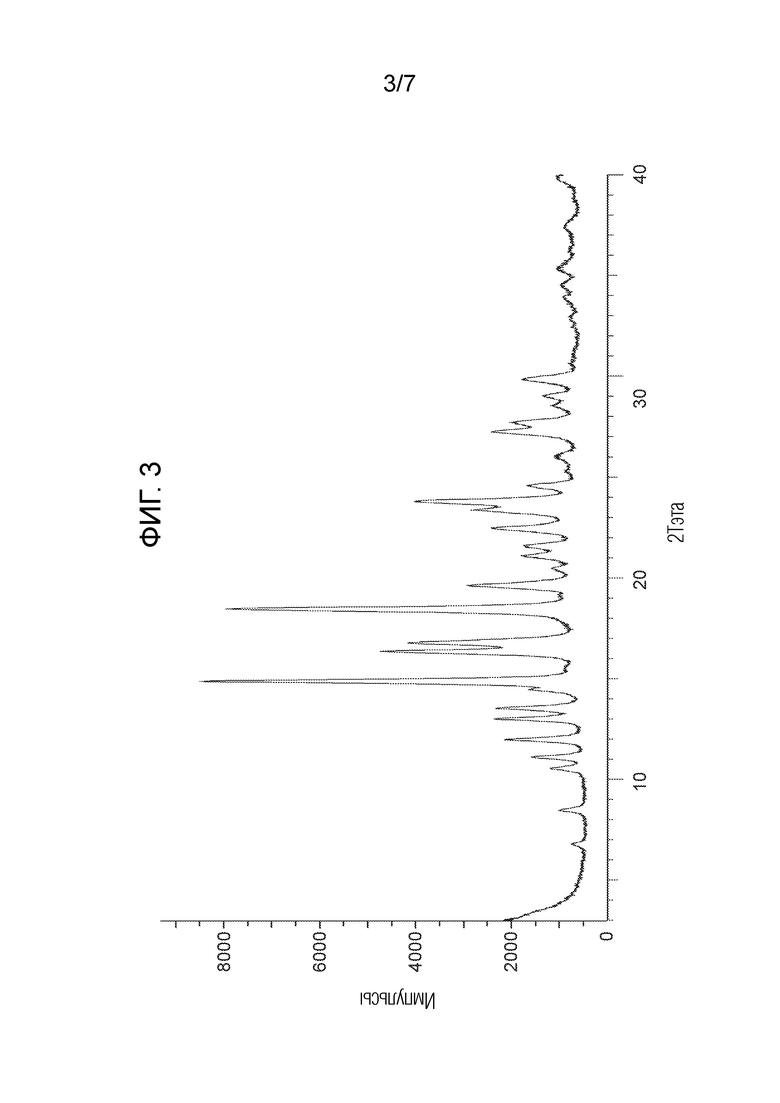
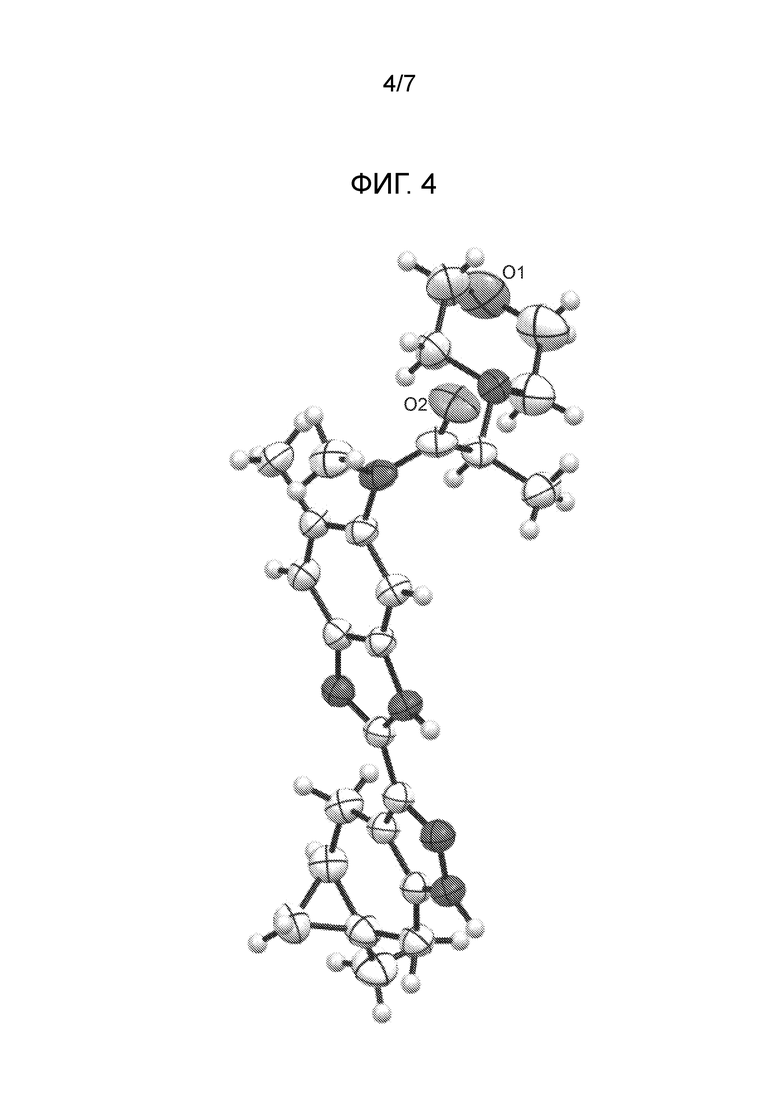
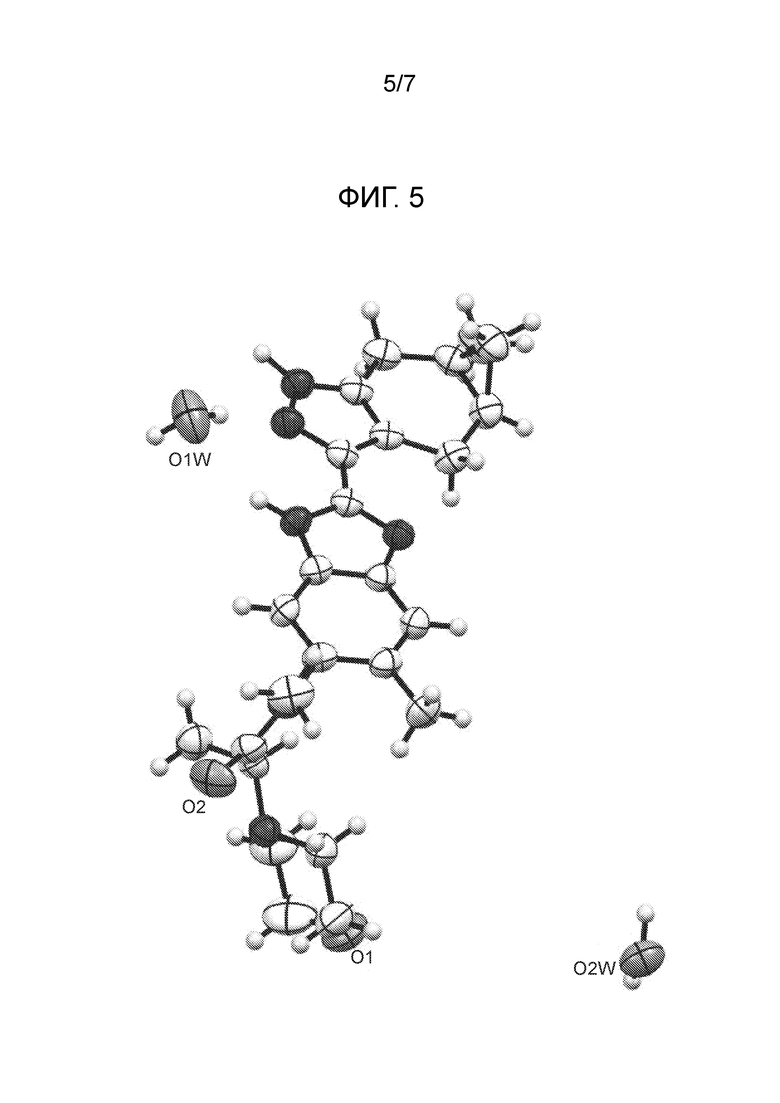
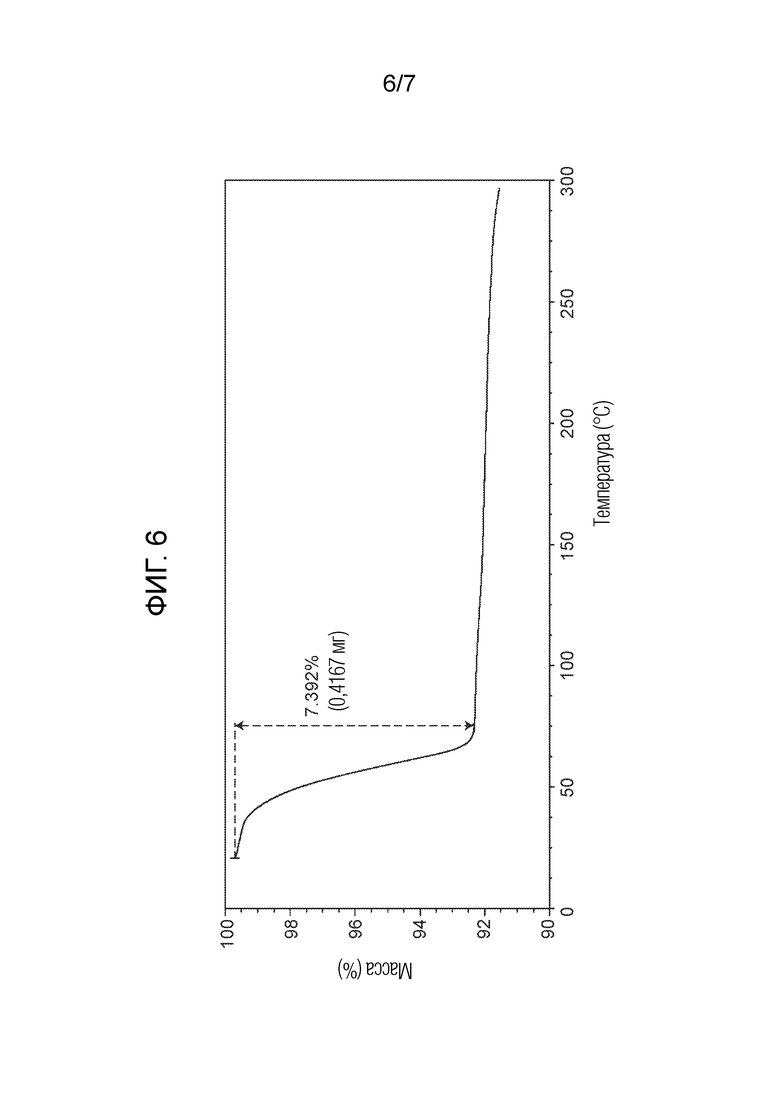
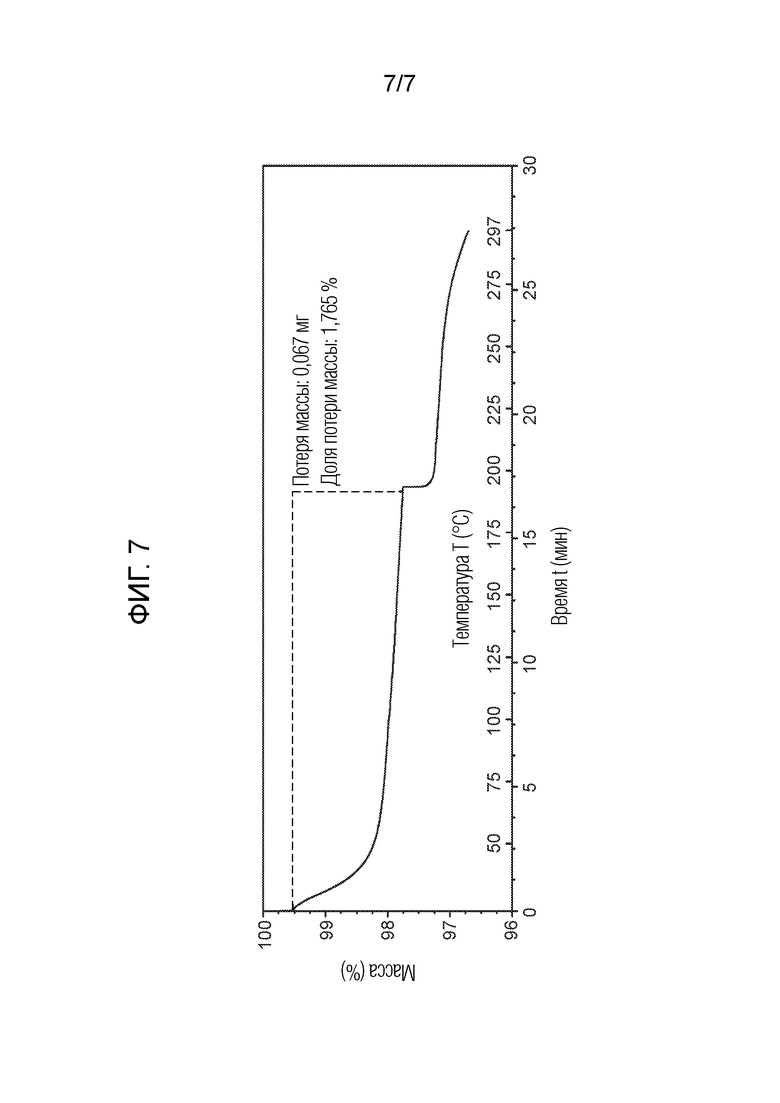
Группа изобретений относится к фармацевтической химии и включает соединение формулы (I), его фармацевтически приемлемые соли, энантиомеры, дигидрат (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1Н-бензо[d]имидазол-5-ил)-2-морфолинопропанамида, фармацевтическую композицию и применение на их основе. В формуле (I) каждый R1 независимо представляет собой H или F; R2 представляет собой H или (C1-C4)алкил; каждый R3 независимо представляет собой H, F или (C1-C4)алкил; R5 и R6 независимо представляют собой Н; галоген; ОН; CN; (С1-С6)алкил; гидрокси(С1-С6)алкил; (С1-С4)алкокси(С1-С6)алкил; (С1-С6)алкил, замещенный одним, двумя или тремя F; (С1-С6)алкокси; или (С1-С6)алкокси, замещенный (С1-С4)алкокси; R4 выбран из 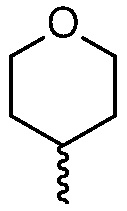 или
или 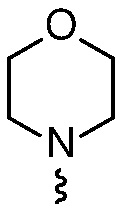 , каждый из которых необязательно замещен одним или двумя заместителями, независимо выбранными из оксо, (C1-C4)алкила и гидрокси(C1-C4) алкила. Технический результат - производные бензимидазола, проявляющие свойства ингибиторов ITK. 4 н. и 22 з.п. ф-лы, 7 ил., 4 табл., 56 пр.
, каждый из которых необязательно замещен одним или двумя заместителями, независимо выбранными из оксо, (C1-C4)алкила и гидрокси(C1-C4) алкила. Технический результат - производные бензимидазола, проявляющие свойства ингибиторов ITK. 4 н. и 22 з.п. ф-лы, 7 ил., 4 табл., 56 пр.
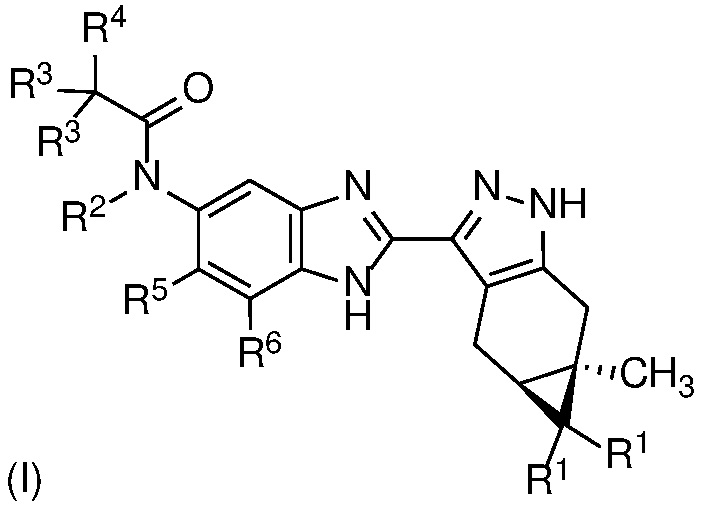
1. Соединение формулы (I)
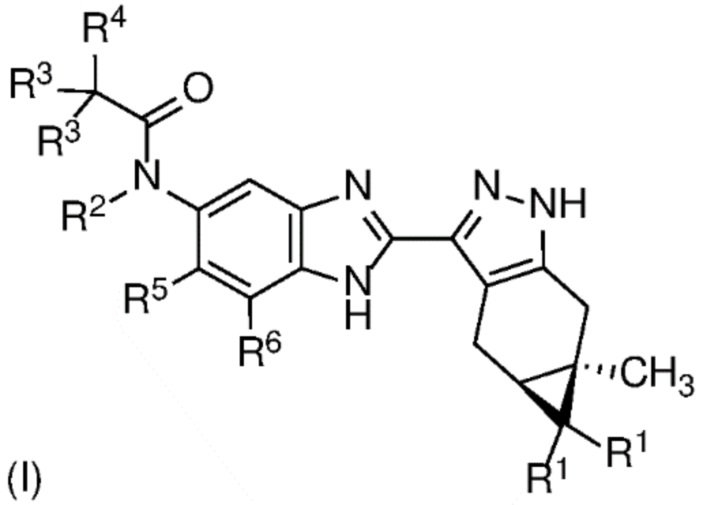
или его фармацевтически приемлемая соль или энантиомер, где:
каждый R1 независимо представляет собой H или F;
R2 представляет собой H или (C1-C4)алкил;
каждый R3 независимо представляет собой H, F или (C1-C4)алкил;
R4 выбран из 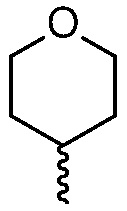 или
или 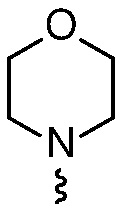 , каждый из которых необязательно замещен одним или двумя заместителями, независимо выбранными из оксо, (C1-C4)алкила и гидрокси(C1-C4) алкила; и
, каждый из которых необязательно замещен одним или двумя заместителями, независимо выбранными из оксо, (C1-C4)алкила и гидрокси(C1-C4) алкила; и
R5 и R6 независимо представляют собой Н; галоген; ОН; CN; (С1-С6)алкил; гидрокси(С1-С6)алкил; (С1-С4)алкокси(С1-С6)алкил; (С1-С6)алкил, замещенный одним, двумя или тремя F; (С1-С6)алкокси; или (С1-С6)алкокси, замещенный (С1-С4)алкокси.
2. Соединение по п.1, или его фармацевтически приемлемая соль, отличающееся тем, что каждый R1 представляет собой Н.
3. Соединение по п.1 или 2, или его фармацевтически приемлемая соль, отличающееся тем, что R2 представляет собой Н.
4. Соединение по п.3, или его фармацевтически приемлемая соль, отличающееся тем, что R2 представляет собой метил.
5. Соединение по любому из пп.1-4, или его фармацевтически приемлемая соль, отличающееся тем, что каждый R3 независимо представляет собой H или (C1-C4) алкил.
6. Соединение по любому из пп.1-4, или его фармацевтически приемлемая соль, отличающееся тем, что каждый R3 независимо представляет собой H, F или метил.
7. Соединение по п.6, или его фармацевтически приемлемая соль, отличающееся тем, что один R3 представляет собой Н, и другой R3 представляет собой метил.
8. Соединение по п.7 формулы (Ia)
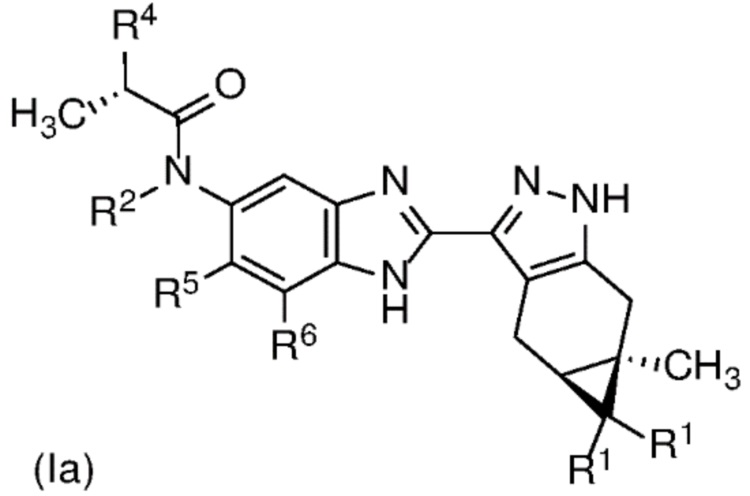
или его фармацевтически приемлемая соль.
9. Соединение по любому из пп.1-8, или его фармацевтически приемлемая соль, отличающееся тем, что R4 представляет собой
 или
или  ,
,
каждый из которых необязательно замещен одним или двумя заместителями, независимо выбранными из оксо, (C1-C4)алкила и гидрокси(C1-C4)алкила.
10. Соединение по п.9, или его фармацевтически приемлемая соль, отличающееся тем, что R4 представляет собой
 или
или  .
.
11. Соединение по п.10, или его фармацевтически приемлемая соль, отличающееся тем, что R4 представляет собой
 .
.
12. Соединение по любому из пп.1-11, или его фармацевтически приемлемая соль, отличающееся тем, что R5 и R6 независимо представляют собой Н; галоген; ОН; CN; (С1-С3)алкил; гидрокси(С1-С3)алкил; (С1-С3)алкокси(С1-С3)алкил; (С1-С3)алкил, замещенный одним, двумя или тремя F; (С1-С3)алкокси; или (С1-С3)алкокси, замещенный (С1-С3)алкокси.
13. Соединение по п.12, или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой H, галоген, CN, (С1-С3)алкил, (С1-С3)алкокси или (С1-С3)алкокси, замещенный (С1-С3)алкокси.
14. Соединение по п.12 или 13, или его фармацевтически приемлемая соль, отличающееся тем, что R6 представляет собой Н; галоген; ОН; CN; (С1-С3)алкил; гидрокси(С1-С3)алкил; (С1-С3)алкокси(С1-С3)алкил; (С1-С3)алкил, замещенный одним, двумя или тремя F; или (С1-С3)алкокси.
15. Соединение по п.1, или его фармацевтически приемлемая соль, выбранные из:
(S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамида;
(R)-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамида;
(R)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-(тетрагидро-2Н-пиран-4-ил)пропанамида;
(S)-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамида;
(S)-N-этил-N-(7-фтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамида;
(S)-N-(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1Н-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамида;
(S)-N-(6,7-дифтор-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-этил-2-морфолинопропанамида;
(S)-N-(7-фтор-6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-N-метил-2-морфолинопропанамида; и
(S)-N-метил-N-(7-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-морфолинопропанамида.
16. Соединение по п.15, которое представляет собой (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1Н-бензо[d]имидазол-5-ил)-2-морфолинопропанамид или его фармацевтически приемлемую соль.
17. Соединение по п.15, которое представляет собой (R)-N-метил-N-(2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1H-бензо[d]имидазол-5-ил)-2-(тетрагидро-2H-пиран-4-ил)пропанамид, или его фармацевтически приемлемую соль.
18. Соединение по п.16, которое представляет собой (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1Н-бензо[d]имидазол-5-ил)-2-морфолинопропанамид.
19. Соединение, которое представляет собой дигидрат (S)-N-метил-N-(6-метил-2-((4aS,5aR)-5a-метил-1,4,4a,5,5a,6-гексагидроциклопропа[f]индазол-3-ил)-1Н-бензо[d]имидазол-5-ил)-2-морфолинопропанамида.
20. Соединение по п.16, которое представляет собой
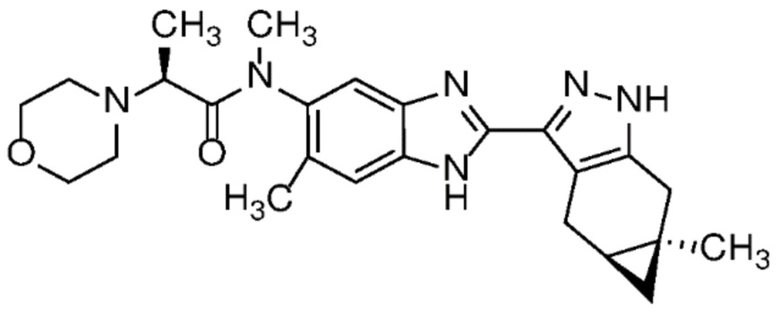 .
.
21. Фармацевтическая композиция, обладающая активностью ингибитора ITK, содержащая терапевтически эффективное количество соединения по любому из пп.1-20 или его фармацевтически приемлемой соли и фармацевтически приемлемый эксципиент.
22. Фармацевтическая композиция по п.21, адаптированная для местного применения.
23. Применение соединения по любому из пп.1-20 или его фармацевтически приемлемой соли для получения лекарственного средства, обладающего ингибирующей активностью в отношении ITK, для лечения состояния.
24. Применение по п.23, где состояние представляет собой дерматологическое нарушение.
25. Применение по п.24, где дерматологическим нарушением является дерматит.
26. Применение по п.24, где дерматит представляет собой атопический дерматит.
| ПРОИЗВОДНОЕ ИНДОЛА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2010 |
|
RU2556216C2 |
| WO 2003035065 A1, 01.05.2003 | |||
| Ho Yin Lo, Itk inhibitors: a patent review | |||
| Expert opinion on therapeutic patents, 2010, vol | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Jason Burch et al., Tetrahydroindazoles as interleukin-2 inducible T-cell kinase inhibitors | |||
| Part II | |||
| Second-generation analogues with enhanced potency, selectivity, and | |||
Авторы
Даты
2023-09-12—Публикация
2020-12-16—Подача