Изобретение относится к сельскохозяйственной, агропромышленной области, а именно к экстрактам бурых водорослей (БВ) Ascophyllum nodosum (A. nodosum), Fucus vesiculosus (F. vesiculosus), Laminaria digitata (L. digitata) и Saccharina latissima (S. latissima), обладающим биостимулирующим действием.
Получаемые экстракты бурых водорослей могут быть использованы как перспективные, безопасные для окружающей среды препараты биологического происхождения, обладающие фитоактивными свойствами.
В настоящем изобретении в качестве модельного тест-растения используются семена овса, по степени прорастания которых можно судить о биостимулирующих свойствах экстрактов бурых водорослей. При этом полученные результаты можно проецировать и на другие растения, поскольку используемый метод, а именно «фитотест», в соответствии с МР 2.1.7.2297-07, является унифицированным методом и предполагает использование единого модельного тест-растения и единого способа воздействия.
В настоящее время известны три основные группы биостимуляторов растений: кислотные (гуминовые и фульвокислоты, аминокислоты); экстракты морских водорослей (ЭМВ) и экстракты растений; микробиологические. Биостимуляторы на основе морских водорослей занимают около 15% объема мирового рынка биостимулирующих препаратов. Остальные 85% составляют биостимуляторы на основе экстрактов растений, аминокислот, гуминовых кислот и фульвокислот [Biostimulant Market: Trends, Forecast and Competitive Analysis // Research and Markets Report. April 2021. URL: https://www.researchandmarkets.com/reports/5003421/biostimulant-market-trends-forecastand#pos-0 (accessed: 17.11.2022)].
В России имеются большие запасы различных видов морских водорослей, добыча которых традиционно осуществляется на Дальнем Востоке (Японское море), на южных и малых Курильских островах, на Сахалине, в Приморье, на материковом побережье Охотского моря и в Белом море. Исследования ламинариевых и фукусовых водорослей Белого и Японского морей подтвердили общее сходство их химического состава с характерным для этих таксономических групп: полисахариды, витамины, жирные полиеновые кислоты, ауксины и гиббереллины, практически одни и те же первичные и вторичные метаболиты, богатый состав микро- и макроэлементов [Боголицын К.Г., Каплицин П.А., Ульяновский Н.В., Пронина О.А. Комплексное исследование химического состава бурых водорослей Белого моря // Химия растительного сырья. 2012. № 4. С. 153-160.; Клочкова Т.А., Климова А.В., Клочкова Н.Г. Перспективы использования камчатских ламинариевых водорослей в региональном растениеводстве // Вестник КамчатГТУ. 2019. № 48. С. 90-103]. Это дает основание считать, что указанные водоросли являются хорошим ресурсом для производства экстрактов со свойствами биостимуляторов растений. Разработка технологий комплексного использования морских водорослей ведется, однако заказчиками являются главным образом производители пищевых, фармацевтических и косметологических продуктов, в том числе содержащих биологически активные вещества. Для применения в сельском хозяйстве в России из бурых водорослей Белого моря производят удобрения, но не экстракты с биостимулирующими свойствами [Т.Г. Шибаева, Е.Г. Шерудило, А.Ф. Титов. Экстракты морских водорослей как биостимуляторы растений. Труды Карельского научного центра РАН. № 3. 2021. С. 36-67]. Таким образом, подтверждается значимость предлагаемого изобретения, разработанного на основе исследований по получению экстрактов арктических бурых водорослей и изучению их фитоактивных свойств.
Среди наиболее широко применяемых в мире ЭМВ находятся коммерческие препараты Acadian, Algifert, Goemar, Kelpak, Maxicrop, Seasol, Strimplex. В целом пять ведущих компаний, производящих биостимуляторы из водорослей, занимают 65% всего рынка.
К основным методам производства коммерческих препаратов биостимуляторов из водорослей относятся: водная экстракция из фукуса, ламинарии, например, SM 3 (Chase Organics, Великобритания); щелочная экстракция: Maxicrop® (Maxicrop, Великобритания) из A. nodosum; Wuxal® Ascofol (Aglukon spazialdunger, D) из A. nodosum; криогомогенизация: Goëmar® BM 86 (Goëmar, F) из A. nodosum; экстракция высоким давлением: Kelpak® (Kelpak Products, Южная Африка) из E. Maxima [Basak, A. (2008) in Biostimulators in Modern Agriculture. General Aspects (ed. H. Gawro'nska), Warsaw, pp. 7-17].
На промышленном уровне наиболее широко используемый процесс экстракции подразумевает нагревание биомассы водорослей с гидроксидом калия или натрия в реакционных сосудах под давлением [Craigie J.S. Seaweed extract stimuli in plant science and agriculture. J. Appl. Phycol. 2011. Vol. 23. P. 371-393]. Однако в ходе этого процесса могут быть утрачены соединения с биостимулирующим потенциалом [Sharma H.S.S., Fleming C., Selby C., Rao J.R., Martin T. Plant biostimulants: A review on the processing of macroalgae and use of extracts for crop management to reduce abiotic and biotic stresses. J. Appl. Phycol. 2014. Vol. 26. P. 465-490]. Кроме того, при экстракции щелочью полисахаридные цепи расщепляются на более мелкие олигомеры и могут образовываться новые соединения, изначально отсутствующие [Shukla P. S., Mantin E.G., Adil M., Bajpai S., Critchley A.T., Prithiviraj B. Ascophyllum nodosum-based biostimulants: sustainable applications in agriculture for the stimulation of plant growth, stress tolerance, and disease management. Front. Plant Sci. 2019. Vol. 10. P. 655]. Вместе с тем наиболее эффективные из разработанных методик обычно основаны на мягкой экстракции (при низком давлении, низкой температуре) и часто являются предметом профессиональной тайны производителей [Boukhari M.E.M.E., Barakate M., Bouhia Y., Lyamlouli K. Trends in seaweed extract based biostimulants: manufacturing process and beneficial effect on soil-plant systems. Plants. 2020. Vol. 9(3): 359].
Известен способ применения водорослевых удобрений, основанный на использовании удобрений в виде суспензии и эмульсии, состоящей из частиц размером 6-10 мкм в растворе, содержащем питательные вещества удобрений. Процесс заключается в промывании водорослей водой и замораживании при температуре ниже -25°C. Крио-микроизмельчение замороженных морских водорослей приводит к получению кремообразного продукта. Этот продукт производится из морских водорослей Ascophyllum nodosum и может быть использован как внекорневое удобрение и как удобрение в виде почвенной суспензии [Pellegrini, M., Pellegrini, L., Chabot, R., Percehais, S., and Yvin, J.C. (1987) Effects of a liquid extract derived from Ascophyllum nodosum on the ultrastructure of Vitis vinifera leaf tissue. Bot. Mar., 30, 437-446]. Аналогичный продукт может быть получен путем дезинтеграции свежих морских водорослей Ecklonia maxima методом клеточного разрыва в мельничном оборудовании при высоком давлении, а затем вводя его в камеру низкого давления, где образуется жидкий концентрат [Kelpak www.kelpak.com (accessed: 17.11.2022)].
Вместе с методами выделения экстрактов из морских водорослей, в литературе также описаны многочисленные варианты их применения в сельском хозяйстве.
Одним из направлений использования ЭМВ является получение препаратов биоконтроля, высокий спрос на которые обусловлен обнаружением в составе фруктов и овощей остаточных количеств синтетических фунгицидов. Vacciplant® (Goëmar) - это экстракт бурых водорослей L. digitata, содержащий ламинаран - олигосахарид ((1,3)-β-D-глюкан), активирующий естественную устойчивость растений к болезням. Продукт зарегистрирован как фитофармацевтический (рег. 1007/2009) [Bernardon-Mery, A., Joubert, J.-M., (2013) Laminarin used against apple scab. Phytoma, 662, 28-31].
Компосты на основе аскофиллума используются в виде суспензии, применение которой является эффективным методом улучшения деградированной структуры почвы [McHugh, D.J. (2003) A Guide to the Seaweed Industry, Food and Agricultural Organization of the United Nations, Rome, www.fao.org/docrep/006/y4765e/y4765e00.HTM, (accessed 22 November 2013)].
Триведи и др. [Trivedi, K.; Vijay Anand, K.G.; Vaghela, P.; Ghosh, A. Di_erential growth, yield and biochemical responses of maize to the exogenous application of Kappaphycus alvarezii seaweed extract, at grain-filling stage under normal and drought conditions. Algal Res. 2018, 35, 236-244] исследовали эффект применения экстракта морских водорослей Kappaphycus alvarezii на кукурузе на стадии налива зерна и сообщили об увеличении в основном на 15% урожая семян (г/растение) за счет улучшения таких параметров урожая, как урожайность семян (г/растение) в оптимальных водных условиях за счет улучшения таких параметров урожая, как количество семян в початке и длина початка.
Многие ЭМВ обладают фунгицидными, инсектицидными и антибактериальными свойствами. Показано, что ламинаран и сульфатированные фуканы из бурых водорослей вызывают множественные защитные реакции у люцерны (Medicago sativa L.) и табака (Nicotiana tabacum L.) [Kobayashi A., Tai A., Kanzaki H., Kawazu K. Elicitor-active oligosaccharides from algal laminaran stimulate the production of antifungal compounds in alfalfa // Z. Naturforsch. 1993. Vol. 48. P. 575-579; Klarzynski O., Descamps V., Plesse B., Yvin J.C., Kloareg B., Fritig B. Sulfated fucan oligosaccharides elicit defense responses in tobacco and local and systemic resistance against tobacco mosaic virus // Mol. Plant Microbe Interact. 2003. Vol. 16. P. 115-122]. Аналогично каррагинанам сульфатированные линейные галактаны являются эффективными элиситорами у растений табака [Mercier L., Lafitte C., Borderies G., Briand X., Esquerre-Tugaye M. T., Fournier J. The algal polysaccharide carrageenans can actas an elicitor of plant defence // New Phytol. 2001. Vol. 149. P. 43-51]. Ламинараны, фукоиданы и растворимые альгиновые кислоты бурых водорослей морей Дальнего Востока повышают устойчивость сои к бактериозу и грибковым болезням, на что указывает снижение пораженности растений почвенными патогенами и повышение урожая сои [Заостровных В. И., Трофимова Т. Ф., Шевченко Н. М., Чайкина Е. Л., Звягинцева Т. Н., Анисимов М. М. Влияние углеводсодержащих биополимеров из морских водорослей на устойчивость сои к заболеваниям // Защита и карантин растений. 2009. № 12. С. 24]. Опрыскивание листьев винограда экстрактом A. nodosum уменьшало зараженность фитофторой Phytophthora capsici у Capsicum и плазмопарой Plasmopara viticola [Lizzi Y., Coulomb C., Polian C., Coulomb P. J., Coulomb P. O. Seaweed and mildew: what does the future hold? Laboratory tests have produced encouraging results // Phytoma. 1998. Vol. 508. P. 29-30]. Показана эффективность применения бетаинов в низких концентрациях при поражении растений грибковой инфекцией [Blunden G. Betaines in the plant kingdom and their use in ameliorating stress conditions in plants // Acta Hortic. 2003. Vol. 597. P. 23-29]. При выращивании капусты внесение в почву жидких ЭМВ стимулировало рост и активность микроорганизмов, которые являются антагонистами Pythium ultimum, опасного грибкового патогена, возбудителя черной ножки у проростков капусты [Dixon G. R., Walsh U. F. Supressing Pythium ultimum induced damping-off in cabbage seedlings by biostimulation with proprietary liquid seaweed extracts // Acta Hortic. 2004. Vol. 635. P. 103-106].
В отношении насекомых - вредителей растений ЭМВ также находят эффективное применение. Тля и другие питающиеся соком насекомые обычно избегают растений, обработанных ЭМВ. Распыление гидролизованных ЭМВ на яблони уменьшало популяции красных паутинных клещей, а применение экстрактов в течение 2-3 лет снижало их до уровня, наблюдаемого при применении акарицидов [Stephenson W. M. The effect of hydrolyzed seaweed on certain plant pests and diseases // Proc. Int. Seaweed Symp. 1966. Vol. 5. P. 405-415]. Также замечено, что использование экстракта Maxicrop на растениях клубники значительно сокращает популяцию обыкновенного паутинного клеща (Tetranychus urticae) [Hankins S. D., Hockey H. P. The effect of a liquid seaweed extract from Ascophyllum nodosum (Fucales, Phaeophyta) on the two spotted red spider mite Tetranychus urticae. Hydrobiologia. 1990. Vol. 204(205). P. 555-559]. Хлороформный и бензольный экстракты бурой водоросли Padina pavonica продемонстрировали нимфицидную активность и способность значительно сокращать или увеличивать период развития личинок красного хлопкового жука (Dysdercus cingulatus). Такой эффект связывают с содержанием в ЭМВ гормонов, препятствующих развитию вредителей на стадии зародыша [Sahayaraj K., Kalidas S. Evaluation of nymphicidal and ovicidal effect of a seaweed, Padina pavonica (Linn.) (Phaeophyceae) on cotton pest, Dysdercus cingulatus (Fab.) // Indian J. Geo-Marine Sci. 2011. Vol. 40. P. 125-129]. Имеются данные и о противовирусном действии ЭМВ. Так, у препарата SPS4, изготовленного из красной водоросли Hypnea musciformis, выявлена биологическая активность против вируса табачной мозаики [Grannam A., Abbas A., Alek H., Al-Waari Z., Al-Ktaifani M. Enhancement of local plant immunity against tobacco mosaic virus infection after treatment with sulphaned-carrageenan from red alga (Hypnea musciformis) // Physiol. Mol. Plant Pathol. 2013. Vol. 84. P. 19-27].
В отличие от всех перечисленных разработок с применением ЭМВ, обладающих различными свойствами (повышение урожайности, улучшение структуры почвы, активация естественной устойчивости растений к болезням, фунгицидные, инсектицидные и антибактериальные свойства) предлагаемое изобретение направлено на получение экстракта бурых водорослей, обладающего фитоактивными свойствами на этапе проращивания семян и увеличивающий длину корней семян с применением овса в качестве модельного тест-растения.
В качестве прототипа выбран способ, описанный в работе [Kadam S. U., Tiwari B. K., O'Connell S., O'Donnell C. P. Effect of ultrasound pretreatment on the extraction kinetics of bioactives from brown seaweed (Ascophyllum nodosum). Sep. Sci. Technol. 2015. Vol. 50. P. 670-675]. Авторами исследуется применение ультразвука (УЗ) для улучшения экстракции биоактивных соединений, а именно общих фенолов, фукозы и уроновой кислоты, из бурых водорослей Ascophyllum nodosum. Для оптимизации процесса экстракции были исследованы ключевые параметры процесса, такие как интенсивность ультразвука, время экстракции и тип растворителя. Максимальные выходы биоактивных веществ (общих фенолов, фукозы и уроновой кислоты) в пересчете на сухую массу составили 82,70 мг/г, 135,76 мг/г и 197,19 мг/г, соответственно. Максимальный выход был получен при использовании 0,03 М HCl в качестве растворителя при мощности ультразвука 75,78 Вт/см2. Кинетика экстракции в течение 22 часов была смоделирована с использованием модели Пелега. Исследование кинетики экстракции показывает, что предварительная ультразвуковая обработка может значительно увеличить экстракцию биоактивных веществ из бурых водорослей.
Описанный в прототипе способ включает исследование одного вида водорослей (A. nodosum), а выделяемый экстракт содержит только лишь три компонента, тогда как бурые водоросли обладают более широким спектром биоактивных веществ. Кроме того, обработка ультразвуком требует дополнительных затрат электроэнергии и специализированного оборудования. Также в прототипе в качестве экстрагента используется соляная кислота, применение которой в производственных условиях осложняется способностью данного реагента дымиться на воздухе, коррозионными свойствами, а также присутствием в списке прекурсоров и химических веществ, часто используемых при незаконном изготовлении наркотических средств и психотропных веществ, находящихся под международным контролем.
Поставленными задачами в настоящем изобретении являются определение наиболее эффективного и безопасного экстрагента, а также условий экстракции, позволяющих достигнуть максимального выхода отдельных компонентов биомассы бурых водорослей, способствующих стимуляции роста растений; определение наиболее эффективных условий интенсификации экстракционного извлечения компонентов биомассы бурых водорослей; определение фитоэффекта экстрактов бурых водорослей на семена овса, по длине корней и проростков в контрольных и опытных пробах.
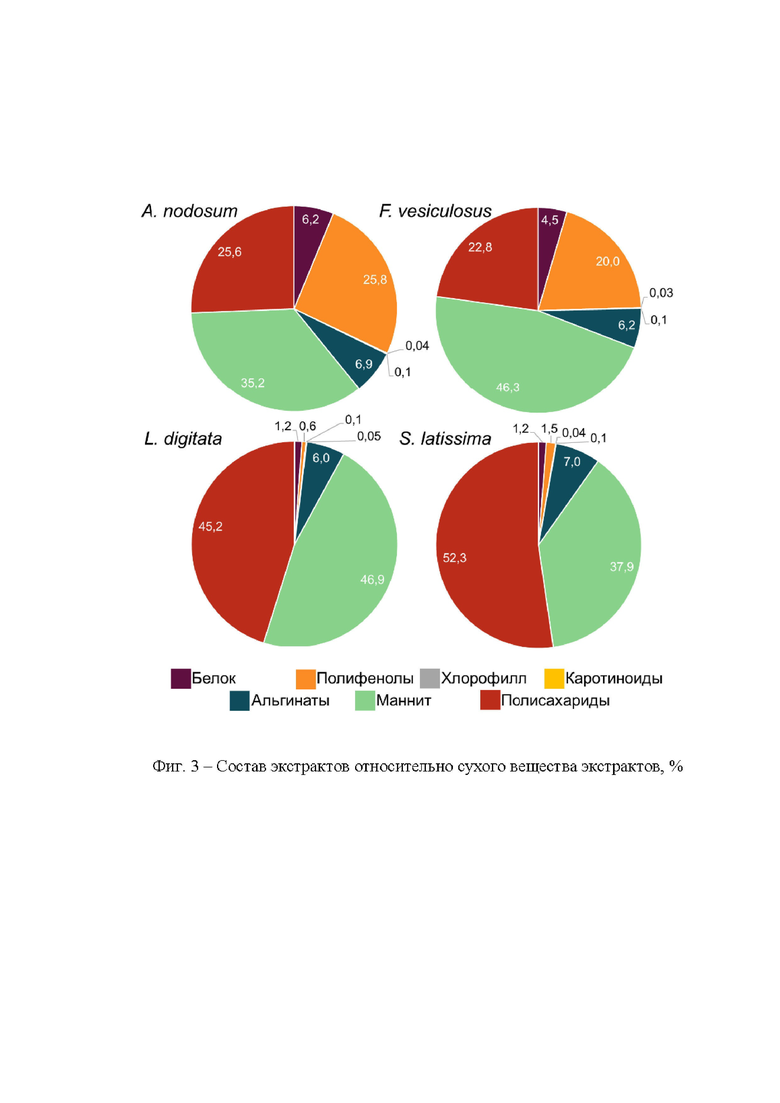
В отличие от прототипа в предлагаемом изобретении используется метод, основанный на экстракции 40%-ным изопропанолом при 60°С в течение 1 часа с предварительным набуханием биомассы бурых водорослей в течение 1 часа при комнатной температуре. В предлагаемом изобретении в качестве экстрагента используется изопропиловый спирт, который с точки зрения требований безопасности является более перспективным экстрагентом. Сопоставление результатов экспериментов по набуханию и ультразвуковой обработке исходного сырья, свидетельствует о том, что процедура набухания является более предпочтительным способом предварительной активации образцов бурых водорослей как с позиций выхода целевых компонентов, так и с практической стороны - данный подход не требует дополнительных затрат электроэнергии и специализированного оборудования для ультразвуковой обработки. В качестве исходного сырья использовались бурые водоросли четырех промысловых видов (A. nodosum, F. vesiculosus, L. digitata и S. latissima), в отличие от прототипа, где исследовался лишь один вид водорослей (A. nodosum). Кроме того, полученный экстракт содержит другие биоактивные компоненты, и более широкий их перечень, а именно: хлорофилл а, каротиноиды, маннит, полифенолы, альгинаты, белок, легкогидролизуемые полисахариды.
Технический результат изобретения - получение экстракта бурых водорослей, содержащего широкий спектр компонентов, обладающих эффектом биостимуляции по отношению к высшим сельскохозяйственным культурам, на примере семян овса, используемых в качестве модельных тест-растений.
В качестве объектов испытаний использовали образцы макрофитов четырех промысловых видов, отобранных в августе 2021 г. в акватории Ребалды (Белое море, Соловецкие острова): Ascophyllum nodosum, Fucus vesiculosus, Laminaria digitata и Saccharina latissima. Водоросли были промыты пресной водой для удаления поверхностных солей, высушены на воздухе, после чего образцы измельчали и просеивали. Для дальнейших исследований использовали фракцию с размером частиц 0,25-0,50 мм.
Фитоактивные свойства рассматривались в отношении неповрежденных (недеформированных) семян овса, моделирующих тест-растения и обладающих всхожестью не менее 95%.
Определение оптимальных параметров получения ЭМВ с максимальным содержанием биоактивных компонентов
В ходе многочисленных предварительных опытов была исследована эффективность различных экстрагентов (изопропанол, диметилсульфоксид, этанол, ацетон), в том числе включая различные методы предварительной обработки (предварительное набухание, обработка ультразвуком и их сочетание). Установлено, что наибольшая эффективность экстракции достигается обработкой исходного водорослевого сырья изопропиловым спиртом с предварительным набуханием биомассы бурых водорослей.
Для экстракции бурых водорослей и получения комплексных экстрактов использовались водные растворы изопропилового спирта. При этом исследовалось влияние состава экстракционной системы (доли изопропилового спирта) на выход различных соединений биомассы БВ. Порядок проведения эксперимента изложен в примере 1.
Результаты эксперимента демонстрируют значительную зависимость выхода отдельных компонентов биомассы БВ в зависимости от состава экстракционной системы. Для полифенолов, маннита, полисахаридов, альгинатов и белка характерна тенденция снижения выхода с увеличением доли изопропилового спирта. Тогда как для хлорофилла характерна обратная зависимость, что обусловлено свойствами молекулы и ее нерастворимостью в воде. Для альгинатов отмечается наименьший процент извлечения (1-4 %отн), что, вероятно, обусловлено существованием альгинатов в клеточной стенке в нерастворимой форме солей.
Установлено, что наиболее представительные и обогащенные различными фракциями компонентного состава экстракты удается получить при использовании экстракционной системы, содержащей 40% изопропилового спирта (таблица 1). Снижение полярности экстрагента приводит к значительному снижению выхода целевых компонентов: от 2 до 23 раз.
В ходе проведенных исследований был проведен сопоставительный анализ трех методов интенсификации экстракционного извлечения: обработка ультразвуком, набухание, а также комбинация этих двух процедур.
На первом этапе оценивали влияние воздействия ультразвуковой обработки на эффективность извлечения компонентов биомассы бурых водорослей. Порядок проведения эксперимента изложен в примере 2.
Наибольшая эффективность экстракции установлена при мощности ультразвука 10% при времени предобработки 30 минут. Схожие показатели, однако чуть менее высокие получены при обработке в течение 5 минут УЗ с мощностью 99%. В результате экспериментов, проведенных при мощности ультразвука 99% и времени воздействия 30 мин установлено, что показатели выхода падают в среднем в 1,5 раза, что, вероятно, может быть связано с процессами деструкции определяемых соединений. В таблице 2 представлены результаты анализа компонентного состава экстрактов, полученных в оптимальных условиях обработки УЗ (мощность 10%, время обработки 30 минут).
В ходе проведенных экспериментов было исследовано влияние процесса предварительного набухания водорослевого сырья на эффективность экстракции биоактивных компонентов изопропиловым спиртом. Порядок проведения эксперимента изложен в примере 3. Состав экстрактов после набухания приведен в таблице 3.
Учитывая, что как при воздействии ультразвуком, так и при набухании наблюдается увеличение выхода целевых компонентов, был проведен эксперимент на выявление синергического эффекта от последовательного воздействия как ультразвука, так и набухания на массу водоросли. Вначале проводили предобработку методом набухания по примеру 3, а затем методом воздействия ультразвука по примеру 2. Результаты эксперимента представлены в таблице 4.
В эксперименте по применению двух способов интенсификации экстракционного извлечения синергии между процессами выявлено не было, что указывает на отсутствие необходимости проведения сложной процедуры набухания с последующей обработкой ультразвуком. Основываясь на сопоставлении результатов в таблицах 3 и 4, можно сделать вывод, что процедура набухания является более предпочтительным способом предварительной активации образцов бурых водорослей как с позиций выхода целевых компонентов, так и с практической стороны - данный подход не требует дополнительных затрат электроэнергии и специализированного оборудования для ультразвуковой обработки.
Таким образом, наиболее целесообразно применение предварительного набухания биомассы бурых водорослей в водной среде при комнатной температуре с последующей экстракцией 40%-ным раствором изопропилового спирта. Однако, длительность процесса 4 ч - существенный лимитирующий фактор, который также должен быть оптимизирован.
В таблице 5 представлены данные по составу экстрактов, выделенных под воздействием 40%-ным раствором изопропанола на биомассу БВ с проведением предварительной обработки методом набухания в течение 1 часа. Порядок проведения эксперимента изложен в примере 4.
Высокая сходимость результатов, полученных при набухании в течение 4 часов и 1 часа, свидетельствует о возможности сокращения времени предварительного набухания до 1 часа без потери эффективности экстракционного извлечения.
Таким образом, в результате экспериментальной работы разработан способ, основанный на набухании биомассы бурых водорослей в течение 1 часа при комнатной температуре с последующей экстракций 40%-ным раствором изопропанола при 60°С в течение 1 часа, позволяющий получать представительные экстракты бурых водорослей, с массовой долей сухого вещества до 27% и химическим составом, представленным всеми основными группами соединений, характерными для данного вида сырья.
Оценка воздействия экстрактов бурых водорослей на степень проращивания семян овса.
Для проведения дальнейших исследований экстракты высушивали в вакуумном сушильном шкафу при температуре 40°С. Сухие экстракты использовали для приготовления водных растворов, которые тестировали на наличие фитостимулирующей активности.
Для оценки фитоэффекта экстрактов бурых водорослей использовали модифицированный метод проращивания семян овса на основании методических рекомендаций (MP 2.1.7.2297-07) обоснования класса опасности отходов производства и потребления по фитотоксичности. «Фитотест» основан на способности семян высших сельскохозяйственных культур адекватно реагировать на экзогенное биологическое воздействие путем изменения интенсивности прорастания корней, что позволяет длину последних принять за показатель тест-функции. Критерием данного воздействия считается стимулирование роста корней семян.
Исследования проводятся в условиях прямого контакта тест-растения с экстрактом водорослей и его разведений. Проращивание семян осуществляется в чашках Петри с фильтровальной бумагой, в которые вносится водный экстракт исследуемого образца.
В качестве модельного тест-растения использовали семена овса. В эксперимент отбирались неповрежденные (недеформированные) семена, всхожесть которых составляет не менее 95%. Объектом измерения у семян является корень максимальной длины. Определение фитоэффекта проводили путем сопоставления тест-функции контрольных и опытных семян.
При определении фитоэффекта экстрактов бурых водорослей на семена овса, определяли всхожесть семян с последующим определением длины корней и проростков семян овса. Порядок проведения эксперимента изложен в примере 5.
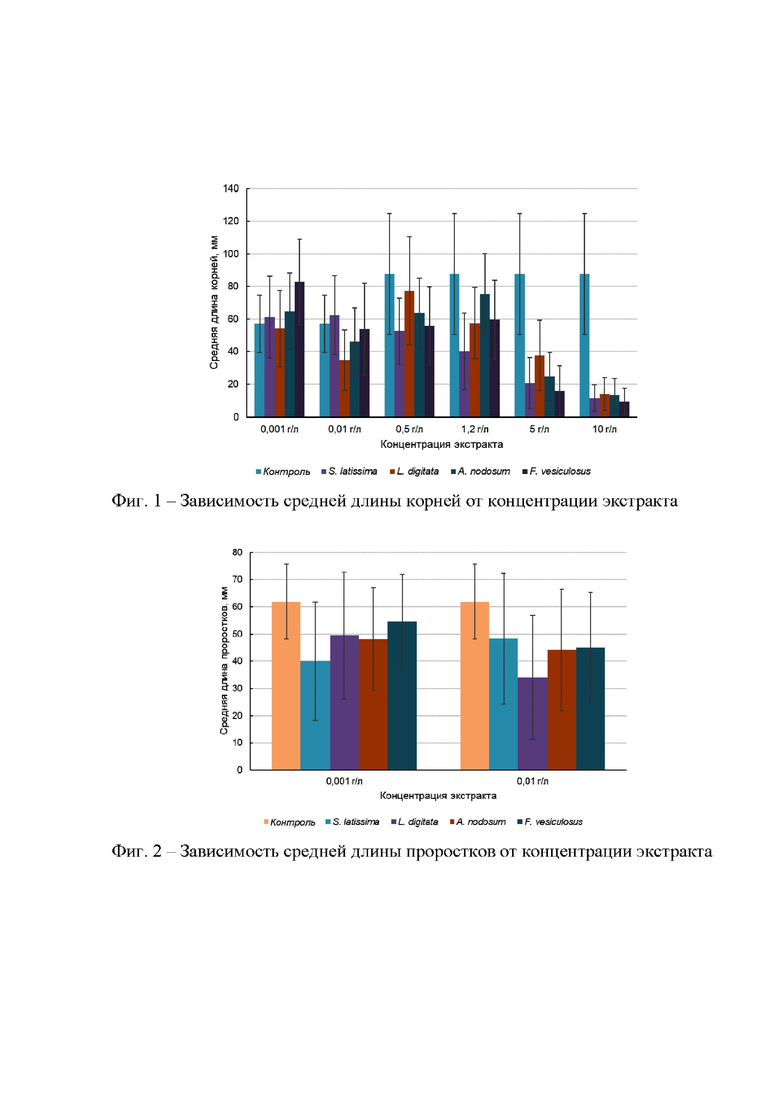
Комплексные экстракты бурых водорослей оказывают положительное действие на длину корней овса и отрицательное - на длину проростков (фиг. 1, 2). С ростом концентрации экстракта наблюдается снижение средней длины корней. Стимулирующее воздействие экстрактов наблюдается при малых концентрациях (0,001 и 0,01 г/л), при этом корни имели более плотную текстуру, были более крепкими. При более высоких концентрациях экстракта (0,5-10 г/л) фитоактивность снижалась, как в отношении длины корней, так и длины проростков семян овса.
Результаты исследования фитоэффекта по изменению длины корней семян овса при воздействии экстрактов бурых водорослей с концентрациями от 0,001 до 10 г/л представлены в таблице 6.
При этом при воздействии на семена овса экстракта бурых водорослей S. latissima концентрацией 0,001 и 0,01 г/л увеличение длины корней различается незначительно (7,2 и 9,5% соответственно), следовательно, за оптимальное значение можно принять значение, полученное при меньшей концентрации экстракта, что является более целесообразным с экономической точки зрения.
Таким образом, установлен значимый положительный (стимулирующий) фитоэффект на длину корней семян овса по отношению к контрольной пробе: 7,2; 13,5 и 45,2% при воздействии экстрактов с концентрацией 0,001 г/л, выделенных из бурых водорослей Saccharina latissima, Ascophyllum nodosum, Fucus vesiculosus, соответственно.
Вышеописанный способ получения экстрактов из арктических бурых водорослей, и определение биостимулирующих свойств данных экстрактов поясняется следующими примерами:
Пример 1
Экстракцию проводили при температуре 60°С, гидромодуле 1:20 в течение 1 часа при постоянном перемешивании. Для этого навеску водорослей Saccharina latissima с размером частиц 0,25-0,50 мм массой 2,5 г помещали в колбы, добавляли 50 мл раствора изопропилового спирта. Устанавливали колбы в термостат LT-117P (LOIP, Россия) при 60°С на 1 час. Для экстракции использовали растворы изопропилового спирта с концентрациями: 10, 20, 40, 60, 80, 100%. По окончании процесса смесь центрифугировали при 10595 g в течение 5 минут (Universal 320, Hettich, Германия). Раствор отделяли декантированием и использовали для определения химического состава (фиг. 3). Аналогичным образом получали экстракты из бурых водорослей Laminaria digitata, Ascophyllum nodosum, Fucus vesiculosus.
Для определения фитоэффекта полученные экстракты сушили в вакуумном сушильном шкафу (Binder VD 23, Binder, Германия) при температуре 40°С и давлении в системе ≤500 Па. Сухие экстракты измельчали в фарфоровой ступке до состояния порошка.
Пример 2
Навеску водорослей с размером частиц 0,25-0,50 мм массой 2,5 г помещали в колбы, добавляли 50 мл раствора изопропилового спирта. Обработку экстракционной системы проводили в ультразвуковой ванне (Сапфир ТТЦ+РМД, Сапфир, Россия) (2,8 л, мощность 100 Вт, частота 35 кГц) при температуре 60°С, мощности ультразвука 10 и 99%, времени воздействия 5, 15 и 30 минут. По прошествии обработки систему помещали в термостат и проводили процедуру экстракции, как описано выше. Результаты экспериментальной работы приведены в таблице 2.
Пример 3
Навеску водорослей с размером частиц 0,25-0,50 мм массой 2,5 г помещали в колбы, добавляли 30 мл дистиллированной воды. Набухание проводили в течение 4 часов при комнатной температуре. По завершению процесса к суспензии добавляли требуемое количество изопропилового спирта (20 мл) для получения 40%-ной концентрации при общем гидромодуле 1:20 и помещали суспензию в термостатирующее устройство для проведения экстракции, как описано в примере 1.
Пример 4
Эксперимент по набуханию биомассы водорослей проводили по методу, аналогичному описанному в примере 3, с сокращением продолжительности набухания до 1 часа.
Пример 5
Для оценки фитоэффекта экстрактов бурых водорослей на семена овса, чашки Петри с вложенными в них дисками фильтровальной бумаги стерилизовали при температуре 160°С в сухожаровом шкафу и охлаждали до комнатной температуры. Затем в каждую чашку помещали по 25 сухих здоровых семян. При определении всхожести субстратом для проращивания служила дистиллированная вода, которую вносили на фильтр в объеме 5 мл. Закрытые чашки термостатировали при температуре 23°С в течение 3 суток, после чего подсчитывали процентную долю проросших семян. Всхожесть семян составила 96%. В опытные чашки Петри с 25 сухими здоровыми семянами вносили по 5 мл каждой пробы экстрактов бурых водорослей S. latissima, L. digitata, A. nodosum, F. vesiculosus различной концентрации (10 г/л; 5 г/л; 1,2 г/л; 0,5 г/л, 0,01 г/л и 0,001 г/л) и выдерживали в термостате при температуре 23°С в течение 7 суток. Для сравнения в контрольные чашки Петри вместо экстрактов вносили дистиллированную воду в объеме 5 мл и также оставляли на экспозицию. По истечении срока экспозиции измеряли длину корней проростков в контрольных и опытных пробах. Объектом измерения у каждого семени являлся корень максимальной длины.
полисахариды
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭКСТРАКТОВ ИЗ АРКТИЧЕСКИХ БУРЫХ ВОДОРОСЛЕЙ, ОБЛАДАЮЩИХ БАКТЕРИОСТАТИЧЕСКИМИ И ФУНГИСТАТИЧЕСКИМИ СВОЙСТВАМИ | 2024 |
|
RU2834311C1 |
| СПОСОБ УВЕЛИЧЕНИЯ СЫРЬЕВОЙ ПРОДУКТИВНОСТИ RHODIOLA ROSEA L. | 2023 |
|
RU2818083C1 |
| Способ выделения целлюлозы из биомассы арктических бурых водорослей | 2022 |
|
RU2782259C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ФУКУСОВЫХ ВОДОРОСЛЕЙ (ВАРИАНТЫ) | 2006 |
|
RU2337571C2 |
| СТАБИЛИЗАТОР ПИЩЕВЫХ ЭМУЛЬСИЙ ТИПА МАСЛО-В-ВОДЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2022 |
|
RU2816758C1 |
| СПОСОБ ВОЗДЕЛЫВАНИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР | 2023 |
|
RU2807997C1 |
| Сухой экстракт из фукусовых водорослей, обладающий антиоксидантным действием, и способ его получения | 2016 |
|
RU2650808C1 |
| Паштет из путассу с фукусом и овощами (консервы) | 2015 |
|
RU2614801C1 |
| Сорбент на основе клетчатки бурых водорослей | 2016 |
|
RU2637436C1 |
| Способ извлечения водорастворимых компонентов из морских бурых водорослей, обогащенных фукоиданом и йодом | 2016 |
|
RU2662368C2 |
Изобретение относится к технологии переработки бурых водорослей. Предложенный способ получения экстрактов арктических бурых водорослей Saccharina latissima, Laminaria digitata, Ascophyllum Nodosum или Fucus Vesiculosus включает предварительное набухание биомассы бурых водорослей при гидромодуле 1:12 в течение 1 часа при комнатной температуре, экстракцию водорослей 40%-ным по массе раствором изопропанола при 60°С в течение 1 часа при гидромодуле 1:20, центрифугирование при 10595g в течение 5 минут, декантирование полученных экстрактов, высушивание при температуре 40°С и давлении ≤500 Па и измельчение до порошкообразного состояния. Также предложено применение полученного экстракта арктических бурых водорослей в качестве биостимулятора прорастания семян растений путем обработки семян водным раствором указанного экстракта с концентрацией в водном растворе 0,001 г/л и выдерживания в течение 7 суток при 23°С. Изобретение направлено на получение экстрактов арктических бурых водорослей, обладающих фитоактивными свойствами. 2 н.п. ф-лы, 3 ил., 4 табл., 5 пр.
1. Способ получения экстрактов арктических бурых водорослей Saccharina latissima, Laminaria digitata, Ascophyllum Nodosum или Fucus Vesiculosus, включающий предварительное набухание биомассы бурых водорослей при гидромодуле 1:12 в течение 1 часа при комнатной температуре, экстракцию водорослей 40%-ным по массе раствором изопропанола при 60°С в течение 1 часа при гидромодуле 1:20, центрифугирование при 10595g в течение 5 минут, декантирование полученных экстрактов, высушивание при температуре 40°С и давлении ≤500 Па и измельчение до порошкообразного состояния.
2. Применение экстракта арктических бурых водорослей, полученного способом по п. 1, в качестве биостимулятора прорастания семян растений путем обработки семян водным раствором указанного экстракта с концентрацией в водном растворе 0,001 г/л и выдерживания в течение 7 суток при 23°С.
| KADAM S.U., TIWARI B.K., O CONNELL S., O DONNELL C.P | |||
| "Effect of ultrasound pretreatment on the extraction kinetics of bioactives from brown seaweed (Ascophyllum nodosum)" | |||
| Sep | |||
| Sci | |||
| Technol | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Vol | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| P | |||
| Пневматический прибор для заправки нити в челнок | 1924 |
|
SU670A1 |
| Способ получения биологически активного полифенольного комплекса из арктических бурых водорослей | 2020 |
|
RU2741634C1 |
| Сухой экстракт из фукусовых водорослей, обладающий антиоксидантным действием, и способ его получения | 2016 |
|
RU2650808C1 |
| СТАБИЛИЗАТОР НАПРЯЖЕНИЯ ПЕРЕМЕННОГО ТОКА | 1972 |
|
SU419861A1 |
| CN 108619177 A, 09.10.2018 | |||
| JP 3298633 B2, | |||
Авторы
Даты
2023-09-18—Публикация
2022-12-20—Подача