Областью применения заявляемого изобретения являются медицина, стоматология, ветеринария и производство лекарственных средств и медицинских инструментов, в частности - реконструктивная хирургия, ортопедия и травматология, а также экспериментальная биология.
Известно множество способов стерилизации медицинских инструментов, изделий, имплантатов и лекарственных средств, которые в зависимости от физического принципа в целом подразделяют на термические, химические, радиационные и плазменно-химические и применяют в зависимости от свойств материалов, составляющих конструкцию объекта стерилизации, а также экономических и других соображений. Но применение многих медицинских изделий и в особенности погружных имплантатов из полимерных и биополимерных материалов или активных металлов (магниевые сплавы), которые считаются перспективными в реконструктивной челюстно-лицевой хирургии, сдерживается их возможной деградацией при повышенной температуре, химическом воздействии или радиационном повреждениях, сопровождающих процессы при таких способах стерилизации. [Singh, R., Dahotre, N.B. Corrosion degradation and prevention by surface modification of biometallic materials // (2007) Journal of Materials Science: Materials in Medicine, 18 (5), pp.725-751., Clough, R.L. High-energy radiation and polymers: A review of commercial processes and emerging applications // (2001) Nuclear Instruments and Methods in Physics Research, Section B: Beam Interactions with Materials and Atoms, 185 (1-4), pp. 8-33.].
В частности, полилактид, полигидроксибутират, полигликолид, полиметилметакрилат, сверхвысокомолекулярный полиэтилен, коллаген, хитозан, фиброин и десятки других полимерных и биополимерных материалов, а также их композитов и гибридов с металлическими и керамическими материалам уже применяются для изготовления различных медицинских изделий (биодеградирующих скафолдов и биоинертных графтов эндопротезов, имплантатов, направителей для инъекционных игл, буров, штифтов и винтов -и др.), требующих предварительной стерилизации [1-3]. Широко известен и применяется способ стерилизации материалов и изделий медицинского назначения, основанный на термической обработке в автоклаве, предполагающий обработку водяным паром повышенного давления при температуре 105-140°С, но который не может быть применен для большинства полимеров, и ограниченно применен для магниевых сплавов и прецизионного хирургического инструмента из высокохромистых сталей [4-5]. Известны способы стерилизации изделий медицинского назначения из этих материалов, основанные на химическом и радиационном воздействии [6-7]. γ- и β- виды излучения высокоэффективны и обеспечивают стерилизацию медицинских изделий, в т.ч. герметично упакованных в крафт-пакетах, но индуцируют окисление полимеров медицинского назначения кислородом воздуха, вызывая их деструкцию, что снижает их эксплуатационные характеристики и сроки службы [8-10]. Для снижения отрицательного влияния эффектов деградации в состав полимерных и биополимерных материалов вводят различные вещества и ингредиенты, которые также могут снижать функциональные свойства и характеристики биосовместимости [11-12].
Известны способы стерилизации материалов медицинского назначения в сверхкритических средах, т.е. в веществах, давление и температура которых находятся выше критического, например, в диоксиде углерода, окиси этилена и фреонах, и их смесях [13-14].
Недостатками данного способа являются возможность образования токсичных, пожаро- или взрывоопасных или химически агрессивных веществ [15-16]. В частности, известен способ стерилизации полимеров медицинского назначения в среде сверхкритического диоксида углерода, в том числе с использованием модификаторов [US Patent 7,108,832. В2 (2004).]. Недостатком способа является высокая вероятность образования угольной кислоты в изделии после стерилизации, если в обрабатываемом изделии присутствовала вода.
В качестве прототипа заявляемого способа рассматривается способ стерилизации RU 2603477 (опубл. 27.11.2016) сверхвысокомолекулярного полиэтилена, предназначенного для применения в медицине, путем обработки материала фреонами R22 или R410a в течение 30-60 минут в интервале температур 50-70°С и давлений 100-290 атм, в статическом режиме или в режиме чередования циклов быстрого нагнетания давления до заданной величины (290 атм), выдерживания при данном давлении в течение 5 минут с последующим быстрым сбросом давления от 290 до 100 атм. Данный способ обеспечивает стерильность образцов из СВМПЭ без деструкции, опосредующее биологическую безопасность его применения в качестве основы медицинских изделий в медицине, ветеринарии и экспериментальной биологии. Недостатком данного способа является применение дорогостоящих фреонов и экологически неблагоприятного фреона R22 при повышенном давлении (не менее 100 атм, что повышает опасность нежелательных утечек).
Технический результат предлагаемого изобретения заключается в обеспечении стерилизации материалов различных классов, так как помимо сверхвысокомолекулярного полиэтилена применим к металлическим, керамическим, полимерным, композитным и гибридным материалам и плотным тканям человека.
Технический результат предлагаемого способа достигается следующим образом.
Способ стерилизации металлических, керамических, полимерных, композитных и гибридных материалов, а также инструментов и изделий из этих материалов, а также фрагментов минерализованных и мягких тканей человека и животных, в т.ч. герметично упакованных в крафт-пакетах, предназначенных для применения в медицине, отличается тем, что в качестве стерилизующей среды используют нетоксичные легкодоступные газы (диоксид углерода, воздух, азот, аргон и их смеси) в динамическом режиме, т.е. стерилизацию проводят в интервале температур 37-90°С, при давлении в пределах 30-300 атм путем однократного или многократного быстрого набора, выдержки в течение 15 - 120 минут и максимально быстрой декомпрессии, т.е. сброса давления до атмосферного давления путем свободного истечения.
Способ стерилизации металлических, керамических, полимерных, композитных и гибридных материалов, а также инструментов и изделий из этих материалов, а также фрагментов минерализованных и мягких тканей человека и животных, в т.ч. герметично упакованных в крафт-пакетах, предназначенных для применения в медицине, отличается тем, что в качестве стерилизующей среды используют нетоксичные легкодоступные газы (диоксид углерода, воздух, азот, аргон и их смеси) в динамическом режиме, т.е. стерилизацию проводят в интервале температур 37-90°С, при давлении в пределах 30-300 атм путем однократного или многократного быстрого набора, выдержки в течение 15 - 120 минут с одновременным ультразвуковым воздействием на стерилизуемые объекты и максимально быстрой декомпрессии, т.е. сброса давления до атмосферного давления путем свободного истечения.
При этом важно, что после декомпрессии стерилизующие газы полностью удаляются из стерилизуемых материалов и изделий. Заявляемый способ позволяет получать стерилизуемые материалы и изделия герметично упакованными в крафт-пакетах готовыми к транспортировке и немедленному использованию без необходимости мер предосторожности и операций при упаковке и поддержанию стерильности в помещении. Образование угольной кислоты, которая исключается способе, приведенном в качестве прототипа, исключается благодаря сушке используемых газов, также сокращению времени стерилизации путем применения гигроскопичного материала крафт-пакетов, ультразвукого излучения.
Способ осуществляется следующим образом. Изделия из металлических, керамических, полимерных, композитных и гибридных материалов, а также инструментов и изделий из этих материалов, а также фрагментов минерализованных и мягких тканей человека и животных, в т.ч. герметично упакованных в крафт-пакетах, предназначенных для применения в медицине, обрабатываются нетоксичными легкодоступными газами (диоксид углерода, воздух, азот, аргон и их смеси) в интервале температур 20 - 90°С, при давлении в пределах 30-300 атм в течение 15 - 120 минут в трех различных режимах.
1. Динамический режим. В условиях динамического режима изделия выдерживали в камере высокого давления стерилизующей установки после однократного или многократного быстрого набора давления, выдержки в течение 15 - 120 минут и максимально быстрой декомпрессии, т.е. сброса давления до атмосферного давления путем свободного истечения.
2. Динамический режим с одновременным воздействием ультразвука. Данный режим подразумевает выдержку в камере высокого давления стерилизующей установки после однократного или многократного быстрого набора давления, выдержки в течение 15 - 120 минут в сочетании с одновременным ультразвуковым воздействием на стерилизуемые объекты и максимально быстрой декомпрессии, т.е. сброса давления до атмосферного давления путем свободного истечения.
По сравнению с прототипом применение заявляемого способа имеет ряд преимуществ:
- исключение использования дорогостоящих и экологически вредных фреонов;
- расширение классов стерилизуемых материалов, так как помимо сверхвысокомолекулярного полиэтилена применим к металлическим, керамическим, полимерным, композитным и гибридным материалам и плотным тканям человека (кость, сухожилия, удаленные зубы и их фрагменты);
- сокращение времени стерилизации - до 15 минут в сравнении с минимальным временем для прототипа 30 минут;
- снижение минимальной температуры стерилизации - до 37 с в сравнении с минимальной для прототипа 50 с;
- снижение минимального давления стерилизации - до 50 атм в сравнении с минимальным для прототипа 100 атм.
Варианты использования режимов для достижения заявленного эффекта представлены в таблице.
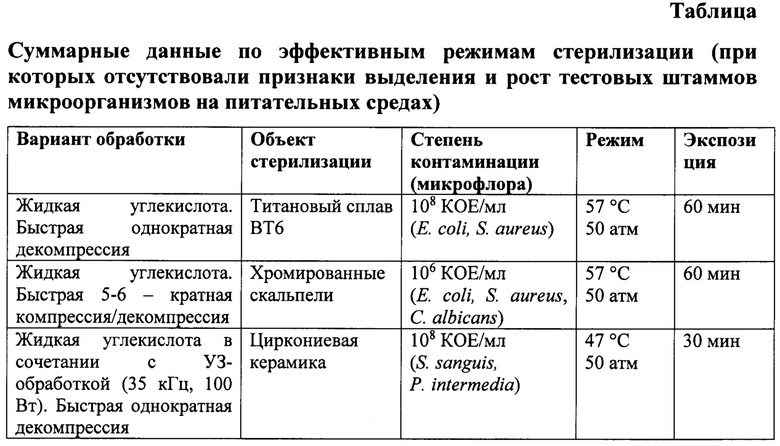
Выбор используемого интервала давления обосновывается тем, что при давлении меньше 30 атм. не обеспечивается стерильность изделий или время стерилизации превышает 8 часов, а превышение давления 300 атм приводит к усложнению конструкции стерилизующего оборудования.
Пример 1.
В качестве стерилизующей среды использовали жидкую углекислоту пищевой чистоты по ГОСТ 8050-85. Объектом стерилизации являлись образцы титанового сплава ВТ6 в форме дисков диаметром 8 мм и высотой 1,5-1,6 мм, предварительно контаминированные бактериями Escherichia coli (грамотрицательные) и Staphylococcus aureus (грамположительные) в количестве 108 КОЕ/мл и герметично упакованных в крафт-пакетах. Стерилизацию образцов осуществляли в динамическом режиме при температуре 57°С. Сосуд высокого давления наполняли жидкой углекислотой из стандартного баллона прямым наливом, повышая давление в сосуде от 1 атм до 50 атм в течение 5 секунд. Выдержка составила 60 минут, после чего осуществляли сброс давления до 1 атм (декомпрессию) максимально быстро, т.е. путем свободного истечения в атмосферу через магистраль диаметром ¼ дюйма после ручного открытия шарового крана.
После окончания процесса стерилизации в отношении исследуемых образцов проводилась методика микробиологического исследования, с целью индикации и количественного учета микробной обсемененности. Бактериологический анализ подразумевал использование метода смыва со стерилизованных образцов. Смыв проводится с поверхности всего образца предварительно увлажненным тампоном стерильной 0,1% пептонной водой. Для обнаружения стафилококков делают высев смывной жидкости объемом 0,2 мл с помощью микродозатора на среды: желточно-солевой агар, стафилококковый агар №110, хромогенный агар. Высевы помещают в термостат при температуре 37° и инкубируют в течение 24±2 часов. Для обнаружения колиморфных бактерий делают высев смывной жидкости объемом 0,2 мл с помощью микродозатора. Засеянные пробирки инкубируют при 37°С на среде Эндо или на хромогенной среде в течение 24±2 часов. После инкубации производят учет результатов смывов с использованием техники ручного и автоматизированного (счетчик колоний) подсчета выросших колоний.
Анализ полученных результатов смывов с экспериментальных образцов титанового сплава ВТ6 на питательные среды показал отсутствие признаков роста тестовых штаммов микрофлоры (Escherichia coli и Staphylococcus aureus в количестве 108 КОЕ/мл) при заявленном режиме деконтаминации (50 атм в течение 5 секунд; экспозиция 60 минут, после чего осуществляли сброс давления до 1 атм (декомпрессию) максимально быстро). Контроль смывов на питательных средах не выявил признаков контаминации микрофлорой. Полученные результаты анализа посевов образцов титанового сплава ВТ6, подвергнутых стерилизации заявляемым способом, демонстрирующие отсутствие признаков колониеобразования как грамположительных, так и грамотрицательных бактерий в специализированной питательной среде, свидетельствуют об отсутствии в испытуемых образцах бактериальной микрофлоры после стерилизующей обработки.
При отклонении от указанного режима деконтаминации, например, при 37° и экспозиции 30 минут наблюдали положительный высев от 1-2 до 30 КОЕ/мл тестовых штаммов Staphylococcus aureus, но не Escherichia coli, то есть происходила полная эрадикация грамотрицательных бактерий и частичная - грамположительных, что свидетельствует об их большей устойчивости к воздействию деконтаминирующего фактора.
Пример 2.
В качестве стерилизующей среды использовали жидкую углекислоту пищевой чистоты по ГОСТ 8050-85. Объектом стерилизации являлись образцы скальпелей из высокохромистой медицинской стали длиной 250 мм и массой 78 граммов, предварительно осемененных бактериями Е. colli и S. aureus, грибами Candida albicans в количестве 106 КОЕ/мл и герметично упакованных в крафт-пакетах. Стерилизацию образцов осуществляли в динамическом режиме при температуре 57°С. Сосуд высокого давления наполняли жидкой углекислотой из стандартного баллона прямым наливом, повышая давление в сосуде от 1 атм до 50 атм в течение 5 секунд. Выдержка составила 60 минут, в ходе которой 6 раз осуществляли сброс давления (декомпрессию) до 1 атм максимально быстро, т.е. путем свободного истечения в атмосферу через магистраль диаметром ¼ дюйма после ручного открытия шарового крана, и повторяющееся наполнение сосуда высокого давления жидкой углекислотой.
После окончания процесса стерилизации в отношении исследуемых образцов проводилась методика микробиологического исследования, с целью индикации и количественного учета микробной обсемененности. Бактериологический анализ подразумевал использование метода смыва со стерилизованных образцов. Смыв проводится с поверхности всего образца предварительно увлажненным тампоном стерильной 0,1% пептонной водой. Для обнаружения стафилококков делают высев смывной жидкости объемом 0,2 мл на среды: желточно-солевой агар, стафилококковый агар №110, хромогенный агар. Высевы помещают в термостат при температуре 37° и инкубируют в течение 24±2 часов. Для обнаружения колиморфных бактерий делают высев смывной жидкости объемом 0,2 мл. Засеянные пробирки инкубируют при 37°С на среде Эндо или на хромогенной среде в течение 24±2 часов. Для обнаружения дрожжевых грибов кандида использовали 1% агаровую среду Сабуро или соответствующую хромогенную среду при культивировании Candida albicans. После инкубации производят учет результатов смывов с использованием техники ручного и автоматизированного (счетчик колоний) подсчета выросших колоний.
Анализ полученных результатов смывов с экспериментальных образцов скальпелей из высокохромистой медицинской стали длиной 250 мм и массой 78 граммов на питательные среды показал отсутствие признаков роста тестовых штаммов микрофлоры (Escherichia coli, Staphylococcus aureus и Candida albicans) при заявленном режиме деконтаминации (50 атм в течение 5 секунд; экспозиция 60 минут, после чего осуществляли сброс давления до 1 атм (декомпрессию) максимально быстро, повторяя 6 раз). Контроль смывов на питательных средах не выявил признаков контаминации микрофлорой. Полученные результаты анализа посевов образцов скальпелей из высокохромистой медицинской стали, подвергнутых стерилизации заявляемым способом, демонстрирующие отсутствие признаков колониеобразования как бактерий, так и грибов, в специализированной питательной среде, свидетельствуют об отсутствии в испытуемых образцах микрофлоры после стерилизующей обработки.
При отклонении от указанного режима деконтаминации, например, при 37° и экспозиции 30 минут и/или однократной декомпрессии наблюдали положительный высев от 2-20 КОЕ/мл тестовых штаммов Candida albicans, но не Staphylococcus aureus и Escherichia coli, то есть происходила полная эрадикация грамположительных и грамотрицательных бактерий и частичная -дрожжевых грибов, что свидетельствует об их большей устойчивости к воздействию деконтаминирующего фактора.
Пример 3.
В качестве стерилизующей среды использовали жидкую углекислоту пищевой чистоты по ГОСТ 8050-85. Объектом стерилизации являлись образцы циркониевой керамики в форме цилиндров диаметром 12 мм и высотой 1,5 мм, предварительно контаминированных анаэробными бактериями - возбудителями пародонтита Prevotella intermedia в количестве 108 КОЕ/мл и герметично упакованных в крафт-пакетах. Стерилизацию образцов осуществляли в динамическом режиме с одновременным воздействием ультразвука при температуре 47°С. Сосуд высокого давления наполняли жидкой углекислотой из стандартного баллона прямым наливом, повышая давление в сосуде от 1 атм до 50 атм в течение 5 секунд. Выдержка составила 30 минут с одновременным воздействием ультразвука от генератора ультразвука с частотой 35 кГц и мощностью 100 Вт после чего осуществляли сброс давления до 1 атм (декомпрессию) максимально быстро, т.е. путем свободного истечения в атмосферу через магистраль диаметром ¼ дюйма после ручного открытия шарового крана.
После окончания процесса стерилизации в отношении исследуемых образцов проводилась методика микробиологического исследования, с целью индикации и количественного учета микробной обсемененности. Бактериологический анализ подразумевал использование метода смыва со стерилизованных образцов. Смыв проводится с поверхности всего образца предварительно увлажненным тампоном стерильной 0,1% пептонной водой. Для обнаружения Prevotella intermedia делают высев смывной жидкости объемом 0,2 мл на среды: 5% кровяной агар (бараньей крови с добавкой гемина 10 мкг/мл). Высевы помещают в термостат при температуре 37° и инкубируют в течение 24±2 часов.
Анализ полученных результатов смывов с экспериментальных образцов образцы циркониевой керамики в форме цилиндров диаметром 12 мм и высотой 1,5 мм на питательные среды показал отсутствие признаков роста тестовых штаммов микрофлоры (Prevotella intermedia) при заявленном режиме деконтаминации (50 атм в течение 5 секунд; экспозиция 30 минут, воздействие ультразвуком с частотой 35 кГц и мощностью 100 Вт после чего осуществляли сброс давления до 1 атм (декомпрессию) максимально быстро). Полученные результаты анализа посевов образцов циркониевой керамики в форме цилиндров диаметром 12 мм и высотой 1,5 мм, подвергнутых стерилизации заявляемым способом, демонстрирующие отсутствие признаков колониеобразования бактерий, в специализированной питательной среде, свидетельствуют об отсутствии в испытуемых образцах бактериальной микрофлоры после стерилизующей обработки.
Полученные результаты свидетельствуют о более высокой эффективности деконтаминации анаэробных бактерий при сочетании основного деконтаминирующего фактора с ультразвуковой обработкой заявленной мощности, что позволяет сократить экспозицию в 2 раза с 60 до 30 минут и уменьшить термическое воздействие до 47°С.
Пример 4.
В качестве стерилизующей среды использовали смесь жидкой углекислоты пищевой чистоты по ГОСТ 8050-85 с азотом особой чистоты сорта 1 по ГОСТ 9293-74 в соотношении 3:1. Объектом стерилизации являлись зубы мудрости нативные, удаленные хирургическим путем с рассечением десны у пациентов с диагносцированным пародонтитом, вызванным Prevotella intermedia, и обнаруженным стрептококком полости рта Streptococcus sanguis, герметично упакованные в крафт-пакетах после промывания в физиологическом растворе. Стерилизацию образцов осуществляли в динамическом режиме при температуре 37°С. Сосуд высокого давления наполняли смесью, повышая давление в сосуде от 1 атм до 100 атм в течение 120 секунд. Выдержка составила 60 минут после чего осуществляли сброс давления до 1 атм (декомпрессию) максимально быстро, т.е. путем свободного истечения в атмосферу через магистраль диаметром ¼ дюйма после ручного открытия шарового крана.
После окончания процесса стерилизации в отношении исследуемых образцов проводилась методика микробиологического исследования, с целью индикации и количественного учета микробной обсемененности. Бактериологический анализ подразумевал использование метода смыва со стерилизованных образцов. Смыв проводится с поверхности всего образца предварительно увлажненным тампоном стерильной 0,1% пептонной водой. Для обнаружения микробной контаминации делают высев смывной жидкости объемом 0,2-0,3 мл на 5% кровяной агар (бараньей крови с добавкой гемина 10 мкг/мл). Высевы помещают в термостат при температуре 37° и инкубируют в течение 48±2 часов.
Анализ полученных результатов смывов с образцов зубов мудрости на питательные среды показал отсутствие признаков роста тестовых штаммов микрофлоры (Prevotella intermedia и Streptococcus sanguis) при заявленном режиме деконтаминации (100 атм в течение 120 секунд; экспозиция 60 минут, сброс давления до 1 атм (декомпрессия) максимально быстро). Полученные результаты анализа посевов образцов зубов мудрости, подвергнутых стерилизации заявляемым способом, демонстрирующие отсутствие признаков колониеобразования бактерий, в специализированной питательной среде, свидетельствуют об отсутствии в испытуемых образцах бактериальной микрофлоры после стерилизующей обработки.
Полученные результаты свидетельствуют о более высокой эффективности деконтаминации, что позволяет сократить экспозицию до 60 минут и уменьшить термическое воздействие до 37°С, т.е. исключая деградацию коллагенового связующего эмали и дентина зуба.
Приведенные выше примеры свидетельствуют о том, что заявляемый способ обеспечивает удовлетворительное качество стерилизации материалов, и может быть применим к различным металлическим, керамическим, полимерным, композитным и гибридным материалам и плотным тканям человека.
Список литературы
1. Лось Д.М., Шаповалов В.М., Зотов С.В. Применение полимерных материалов для изделий медицинского назначения. Проблемы Здоровья и Экологии. 2020; 64(2): 5-13
https://cyberleninka.ru/article/n/primenenie-polimernyh-materialov-dlya-izdeliy-meditsinskogo-naznacheniya/viewer
2. Демина В.А., Седуш Н.Г., Гончаров Е.Н., Крашенинников С.В., Крупнин А.Е., Гончаров Н.Г., Чвалун СН. Биоразлагаемые наноструктурированные композиты для хирургии и регенеративной медицины. Российские нанотехнологии, 2021, том 16, №1, с. 4-22.
3. Немойкина А.Л., Бабкина О.В., Алексеенко К.В., Вайтулевич Е.А. Изучение влияния режимов стерилизации окисью этилена на свойства гликолидлактидных нитей. Вестник Томского государственного университета. 2014. №382. С. 230-233.
https://cyberleninka.ru/article/n/izuchenie-vliyaniya-rezhimov-sterilizatsii-okisyu-etilena-na-svoystva-glikolidlaktidnyh-nitey
4. Maqsood Ahmed, Geoffrey Punshon, Arnold Darbyshire, Alexander M. Seifalian. Effects of sterilization treatments on bulk and surface properties of nanocomposite biomaterials. JOURNAL OF BIOMEDICAL MATERIALS RESEARCH, 2013, p. 1182-1190.
https://onlinelibrary.wiley.com/doi/full/10.1002/jbm.b.32928
5. Kyriacos A. Athanasiou, Gabriele G. Niederauer, С Mauli Agrawal. Sterilization, toxicity, biocompatibility and clinical applications of polylactic acid/ polyglycolic acid copolymers. Biomaterials 1996, Vol. 17 No. 2, p. 93-102.
https://www.sciencedirect.com/science/article/abs/pii/0142961296857541\
6. Phillip E Jr. Murthy NS, Bolikal D, Narayanan P, Kohn J, Lavelle L, Bodnar S, Pricer K. 2013. Ethylene oxide's role as a reactive agent during sterilization: Effects of polymer composition and device architecture. J Biomed Mater Res Part В 2013:101B:532-540.
https://onlinelibrary.wiley.com/doi/abs/10.1002/jbm.b.32853
7. Costaa L., et al. Gallinarob Oxidation in orthopaedic UHMWPE sterilized by gamma-radiation and ethylene oxide // 1998. - Vol. 19. - P. 659-668.
8. Ю.Н. Хакимуллин, С.И. Вольфсон, Р.Ю. Галимзянова, И.В. Кузнецова, А.В. Ручкин, И.Ш. Абдуллин. Нетканные материалы на основе полимеров, используемые для производства медицинской одежды и белья, стерилизуемой радиационным излучением: виды материалов, технологии производства. Вестник Казанского технологического университета, 2011, с. 97-103.
https://cyberleninka.ru/article/n/netkannye-materialy-na-osnove-polimerov-ispolzuemye-dlya-proizvodstva-meditsinskoy-odezhdy-i-belya-sterilizuemoy-radiatsionnym
9. Ю.Н. Хакимуллин, К.В. Легаева, Е.С.Кузнецова, Л.С. Травкина, М.С. Лисаневич, Р.Ю. Галимзянова. Влияние радиационной стерилизации на свойства нетканого материала, полученного по технологии спанлейс. Вестник Казанского технологического университета, 2014, с. 150-153
https://cyberleninka.ru/article/n/vliyanie-radiatsionnoy-sterilizatsii-na-svoystva-netkanogo-materiala-poluchennogo-po-tehnologii-spanleys
10. Fumio Yoshii, Takashi Sasaki, Keizo Makuuchi, Naoyuki Tamura. Durability of radiation-sterilized polymers. I. Estimation of oxidative degradation in polymers by chemiluminescence. Journal of Applied Polymer, August 1985, p. 3339-3346.
https://onlinelibrary.wiley.com/doi/epdf/10.1002/app.1985.070300816
11. Qu S. at. al. // J. Applied Surface Science. 2012. - Vol. 262. - P. 168-175, Fernandez-Ronco M.P., at. al. // J. Supercrit. Fluids. 2014. - Vol. 95. - P. 204-213.
12. Ebru Oral, Keith K. Wannomae, Nathaniel Hawkins, William H. Harris, Orhun K.Muratoglu. a-Tocopherol-doped irradiated UHMWPE for high fatigue resistance and low wear. Biomaterials Volume 25, Issue 24, November 2004, Pages 5515-5522. https://www.sciencedirect.com/science/article/abs/pii/S0142961203012201
13. Angela K. Dillow, Fariba Dehghani, Jeffrey S. Hrkach, Neil R. Foster, and Robert Langer. Bacterial inactivation by using near- and supercritical carbon dioxide. PNAS August 31, 1999 96 (18) 10344-10348
https://www.pnas.org/content/96/18/10344.full
14. Jian Zhang, Thomas A. Davis, Michael A. Matthews, Michael J. Drews, Martine La Berge, Yuehuei H. An. Sterilization using high-pressure carbon dioxide. J. of Supercritical Fluids 38 (2006) 354-372.
https://www.sciencedirect.com/science/article/abs/pii/S0896844606000027
15. Gisela Cristina da Cunha Mendes, Teresa Ribeiro da Silva Brandao, Cristina Luisa Miranda Silva. Ethylene oxide potential toxicity. Expert Review of Medical Devices Volume 5, 2008, p. 323-328.
https://www.tandfonline.com/doi/full/10.1586/17434440.5.3.323?needAccess=true
16. Шильникова H.B., Андрияшина Т.В., Чепегин И.В. Оценка последствий при выбросах окиси этилена в производственных авариях. Инновационные научные исследования в современном мире: теория, методология, практика. Уфа, 18 февраля 2020 года, с. 49-55.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ газодинамической стерилизации материалов медицинского назначения в сверхкритических средах углекислого газа с одновременным воздействием микроволнового электромагнитного излучения | 2022 |
|
RU2813810C1 |
| УСТРОЙСТВО ДЛЯ ГАЗОДИНАМИЧЕСКОЙ СТЕРИЛИЗАЦИИ МЕДИЦИНСКИХ ТКАНЕЙ И ОБОРУДОВАНИЯ В СВЕРХКРИТИЧЕСКИХ СРЕДАХ ДИОКСИДА УГЛЕРОДА | 2023 |
|
RU2826520C1 |
| СПОСОБ СТЕРИЛИЗАЦИИ СВЕРХВЫСОКОМОЛЕКУЛЯРНОГО ПОЛИЭТИЛЕНА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ (ВАРИАНТЫ) | 2015 |
|
RU2603477C1 |
| СПОСОБ И УСТАНОВКА ДЛЯ СТЕРИЛИЗАЦИИ ТРАНСПЛАНТАТОВ СУХОЖИЛИЙ | 2022 |
|
RU2802139C1 |
| СПОСОБ ДЛЯ ОЧИСТКИ, ДЕЗИНФЕКЦИИ И СТЕРИЛИЗАЦИИ МЕДИЦИНСКИХ ИНСТРУМЕНТОВ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2527326C2 |
| СПОСОБ СТЕРИЛИЗАЦИИ И НАБОР СРЕДСТВ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2004 |
|
RU2277935C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОПРЕПАРАТА ДЛЯ ОЧИСТКИ МОРСКОЙ ВОДЫ ОТ НЕФТИ (ВАРИАНТЫ) | 2008 |
|
RU2404138C2 |
| СПОСОБ ВЫДЕЛЕНИЯ БАКТЕРИЙ РОДА LACTOBACILLUS ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 1999 |
|
RU2154822C1 |
| ДЕЗИНФИЦИРУЮЩЕЕ СРЕДСТВО "ДЕЗОМАКС-ИННОВА" | 2014 |
|
RU2571492C1 |
| СПОСОБ СТЕРИЛИЗАЦИИ | 2000 |
|
RU2195961C2 |
Группа изобретений относится к области стерилизации. Способ стерилизации медицинских инструментов и изделий включает герметичную упаковку инструментов и изделий в крафт-пакеты, применяемые в медицине, отличающийся тем, что в качестве стерилизующей среды используют жидкую углекислоту CO2 или ее смесь с аргоном при повышенном давлении, а стерилизацию проводят в динамическом режиме в течение 15-120 минут в интервале температур 37-90°С при давлении 30-300 атм путем повторения циклов набора и декомпрессии со сбросом давления до атмосферного давления свободным истечением. Также раскрывается вариант данного способа стерилизации в сочетании с одновременным ультразвуковым воздействием 35 кГц, 100 Вт. Группа изобретений обеспечивает эффективную стерилизацию материалов различных классов. 2 н. и 2 з.п. ф-лы, 4 пр., 1 табл.
1. Способ стерилизации медицинских инструментов и изделий, включающий герметичную упаковку инструментов и изделий в крафт-пакеты, применяемые в медицине, отличающийся тем, что в качестве стерилизующей среды используют жидкую углекислоту CO2 или ее смесь с аргоном при повышенном давлении, а стерилизацию проводят в динамическом режиме в течение 15-120 минут в интервале температур 37-90°С при давлении 30-300 атм путем повторения циклов набора и декомпрессии со сбросом давления до атмосферного давления свободным истечением.
2. Способ по п. 1, отличающийся тем, что проводят стерилизацию медицинских инструментов и изделий, выполненных из металлов.
3. Способ стерилизации медицинских инструментов и изделий, включающий герметичную упаковку инструментов и изделий в крафт-пакеты, применяемые в медицине, отличающийся тем, что в качестве стерилизующей среды используют жидкую углекислоту CO2 или ее смесь с аргоном при повышенном давлении, а стерилизацию проводят в динамическом режиме в течение 15-120 минут в интервале температур 37-90°С при давлении 30-300 атм путем повторения циклов набора и декомпрессии со сбросом давления до атмосферного давления свободным истечением в сочетании с одновременным ультразвуковым воздействием 35 кГц, 100 Вт.
4. Способ по п. 3, отличающийся тем, что проводят стерилизацию медицинских инструментов и изделий, выполненных из циркониевой керамики.
| СПОСОБ СТЕРИЛИЗАЦИИ СВЕРХВЫСОКОМОЛЕКУЛЯРНОГО ПОЛИЭТИЛЕНА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ (ВАРИАНТЫ) | 2015 |
|
RU2603477C1 |
| СПОСОБ СТЕРИЛИЗАЦИИ | 1999 |
|
RU2170046C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОБРАБОТКИ ОДНОРАЗОВЫХ ЕМКОСТЕЙ ИЗ ПОЛИМЕРНОГО МАТЕРИАЛА | 2009 |
|
RU2466082C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ СТЕРИЛИЗАЦИИ | 2013 |
|
RU2670972C9 |
| СПОСОБ ВАЩЕНКО СТЕРИЛИЗАЦИИ ОБЪЕКТОВ | 1989 |
|
RU2045150C1 |
| СПОСОБ ОЧИСТКИ И СТЕРИЛИЗАЦИИ МЕДИЦИНСКИХ ИНСТРУМЕНТОВ | 1996 |
|
RU2126691C1 |
Авторы
Даты
2023-09-25—Публикация
2022-01-31—Подача