ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] Настоящая заявка испрашивает приоритет и преимущество на основании предварительной заявки на выдачу патента США с серийным № 61/992658, поданной 13 мая 2014 года, предварительной заявки на выдачу патента США с серийным № 62/105992, поданной 21 января 2015 года, и предварительной заявки на выдачу патента США с серийным № 62/114336, поданной 10 февраля 2015 года. Полное содержание каждой из данных заявок тем самым включено в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Рак все еще остается основной проблемой всемирной охраны здоровья. Несмотря на прогресс в лечении рака, в данной области все еще остается нереализованная медицинская потребность в более эффективных и менее токсичных терапевтических средствах, особенно для таких пациентов с заболеванием на поздней стадии или с формами рака, которые устойчивы к существующей терапии.
[0003] Роль иммунной системы, в частности опосредованной T-клетками цитотоксичности, в контроле опухолей хорошо известна. Доказано что Т-клетки контролируют рост и выживаемость опухоли у пациентов с раком как на ранних, так и на поздних стадиях заболевания. Однако опухолеспецифичные T-клеточные ответы у пациентов с раком трудно устанавливать и подтверждать.
[0004] Два T-клеточных пути, привлекающих в настоящее время существенное внимание, передают сигнал через цитотоксичный T-лимфоцитарный антиген-4 (CTLA-4, CD152) и лиганд программируемой смерти 1 (PD-L1, также известный как B7-H1 или CD274).
[0005] CTLA4 экспрессируется на активированных Т-клетках и служит совместным ингибитором для удерживания Т-клеточных ответов под контролем после CD28-опосредованной активации Т-клеток. Полагают, что CTLA4 регулирует амплитуду ранней активации наивных Т-клеток и Т-клеток памяти после вовлечения TCR и является частью центрального ингибиторного пути, который нарушает как противоопухолевый иммунитет, так и аутоиммунитет. CTLA4 экспрессируется исключительно на Т-клетках, и экспрессия его лигандов CD80 (B7.1) и CD86 (B7.2) в значительной степени ограничивается антиген-презентирующими клетками, Т-клетками и другими опосредующими иммунитет клетками. Сообщалось о том, что антагонистические антитела к CTLA4, которые блокируют CTLA4 путь передачи сигнала, усиливают активацию Т-клеток. Одно такое антитело ипилимумаб было одобрено FDA в 2011 году для лечения метастатической меланомы. Другое антитело к CTLA4, тремелимумаб, тестировали на III фазе испытаний для лечения меланомы на поздней стадии, но оно не существенно повышает общую выживаемость пациентов по сравнению со стандартом лечения (темозоломидом или дакарбазином) в то же время.
[0006] PD-L1 также является частью комплексной системы рецепторов и лигандов, которые вовлечены в контроль активации T-клеток. В здоровой ткани PD-L1 экспрессируется на T-клетках, B-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках, тучных клетках костного мозга, а так же на разных негемопоэтических клетках. Его нормальной функцией является регуляция баланса между активацией и толерантностью T-клеток посредством взаимодействия с его двумя рецепторами: запрограммированной смерти 1 (также известным как PD-1 или CD279) и CD80 (также известным как B7-1 или B7.1). PD-L1 также экспрессируется в опухолях и действует во множестве сайтов для помощи опухолям во избежании обнаружения и устранения иммунной системой хозяина. PD-L1 экспрессируется в широком диапазоне форм рака, с высокой частотой. В некоторых формах рака экспрессия PD-L1 связана со снижением выживаемости и неблагоприятными прогнозами. Антитела, которые блокируют взаимодействие между B7-H1 и его рецептором, способны к ослаблению PD-L1-зависимых иммуносупрессивных эффектов и к усилению цитотоксической активности противоопухолевых T-клеток in vitro. MEDI4736 является человеческим моноклональным антителом, направленным против человеческого PD-L1, которое способно блокировать связывание PD-L1 с обоими рецепторами PD-1 и CD80.
[0007] Несмотря на значительный прогресс, достигнутый за последнее десятилетие в развитии стратегий борьбы с раком и другими заболеваниями, пациенты с заболеванием на поздней стадии, резистентным заболеванием и заболеванием с метастазами имеют ограниченные клинические возможности. Химиотерапия, облучение и химиотерапия с высокими дозами становятся дозолимитирующими. В данной области сохраняется существенная нереализованная потребность в новых менее токсичных способах и терапевтических средствах, которые обладают лучшей терапевтической эффективностью, более длительной клинической пользой и улучшенными профилями безопасности, в частности, для таких пациентов с заболеванием на поздней стадии или с формами рака, которые устойчивы к существующей терапии.
КРАТКОЕ ОПИСАНИЕ
[0008] Настоящее изобретение предусматривает способ лечения немелкоклеточного рака легкого (NSCLC) у пациента-человека, включающий введение пациенту 1 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0009] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 3 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0010] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0011] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 15 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0012] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0013] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 15 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0014] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 20 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0015] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 15 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0016] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 20 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0017] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 20 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0018] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0019] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 3 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0020] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 3 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0021] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 1 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0022] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 1 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[0023] Настоящее изобретение также предусматривает способ лечения, включающий введение MEDI4736 или его антиген-связывающего фрагмента (например, при 1 мг/кг, 3 мг/кг, 10 мг/кг, 15 мг/кг или 20 мг/кг) и тремелимумаба или его антиген-связывающего фрагмента (например, при 1 мг/кг, 3 мг/кг, 10 мг/кг) пациенту, идентифицированному как имеющий PD-L1- или PD-L1+ NSCLC.
[0024] Согласно конкретным вариантам осуществления любого из предыдущих способов MEDI4736 вводят каждые 4 недели. Согласно одному конкретному варианту осуществления MEDI4736 вводят каждые 4 недели в течение 49 недель. Согласно конкретным вариантам осуществления любого из предыдущих способов MEDI4736 вводят каждые 2 недели. Согласно другому варианту осуществления всего вводят 13 доз MEDI4736.
[0025] Согласно конкретным вариантам осуществления предыдущих аспектов тремелимумаб вводят каждые 4 недели в течение первых 21 недель. Согласно другим вариантам осуществления предыдущих аспектов тремелимумаб вводят каждые 12 недель от 25 до 49 недели. Согласно еще другим вариантам осуществления предыдущих аспектов всего вводят 9 доз тремелимумаба.
[0026] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента, при этом MEDI4736 вводят каждые 2 недели.
[0027] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента, при этом MEDI4736 вводят каждые 2 недели.
[0028] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента, при этом MEDI4736 вводят каждые 2 недели.
[0029] Согласно конкретным вариантам осуществления предыдущих аспектов тремелимумаб вводят каждые 4 недели в течение первых 25 недель. Согласно другим вариантам осуществления предыдущих аспектов тремелимумаб вводят каждые 12 недель от 25 до 49 недели. Согласно еще другим вариантам осуществления предыдущих аспектов всего вводят 9 доз тремелимумаба.
[0030] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента, при этом введения приводят в результате к ответу опухоли.
[0031] В способе по настоящему изобретению введения приводят в результате к усиленному ответу опухоли по сравнению с введением либо MEDI4736 или его антиген-связывающего фрагмента, либо тремелимумаба или его антиген-связывающего фрагмента отдельно.
[0032] Согласно некоторым вариантам осуществления ответ опухоли может быть выявлен на 2, 4, 6, 8 или 10 неделе. Согласно другим вариантам осуществления ответ опухоли может быть выявлен на 33 неделе. Согласно другим вариантам осуществления ответ опухоли может быть выявлен на 50 неделе.
[0033] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента, при этом введения повышают выживаемость без прогрессирования. Согласно некоторым вариантам осуществления введения приводят в результате к повышению выживаемости без прогрессирования по сравнению с введением либо MEDI4736 или его антиген-связывающего фрагмента, либо тремелимумаба или его антиген-связывающего фрагмента отдельно.
[0034] Настоящее изобретение также предусматривает способ лечения NSCLC у пациента-человека, включающий введение пациенту MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента, при этом введения повышают общую выживаемость. Согласно некоторым вариантам осуществления введения приводят в результате к повышению общей выживаемости по сравнению с введением либо MEDI4736 или его антиген-связывающего фрагмента, либо тремелимумаба или его антиген-связывающего фрагмента отдельно.
[0035] Согласно некоторым вариантам осуществления способов по настоящему изобретению введения приводят в результате к ответу опухоли. Согласно некоторым вариантам осуществления введения приводят в результате к повышенному ответу опухоли по сравнению с введением либо MEDI4736 или его антиген-связывающего фрагмента, либо тремелимумаба или его антиген-связывающего фрагмента отдельно. Согласно некоторым вариантам осуществления ответ опухоли может быть выявлен на 8 неделе. Согласно некоторым вариантам осуществления ответ опухоли может быть выявлен на 33 неделе.
[0036] Согласно некоторым вариантам осуществления способов по настоящему изобретению введения повышают выживаемость без прогрессирования. Согласно некоторым вариантам осуществления введения приводят в результате к повышению выживаемости без прогрессирования по сравнению с введением либо MEDI4736 или его антиген-связывающего фрагмента, либо тремелимумаба или его антиген-связывающего фрагмента отдельно.
[0037] Согласно некоторым вариантам осуществления способов по настоящему изобретению введения повышают общую выживаемость. Согласно некоторым вариантам осуществления введения приводят в результате к повышению общей выживаемости по сравнению с введением либо MEDI4736 или его антиген-связывающего фрагмента, либо тремелимумаба или его антиген-связывающего фрагмента отдельно.
[0038] Согласно конкретным вариантам осуществления любого из предыдущих способов MEDI4736 вводят каждые 4 недели. Согласно одному конкретному варианту осуществления MEDI4736 вводят каждые 4 недели в течение 49 недель. Согласно другому варианту осуществления вводят всего 13 доз MEDI4736.
[0039] Согласно конкретным вариантам осуществления предыдущих аспектов тремелимумаб вводят каждые 4 недели в течение первых 21 недель. Согласно другим вариантам осуществления предыдущих аспектов тремелимумаб вводят каждые 12 недель от 25 до 49 недели или после первых 6 доз. Согласно еще другим вариантам осуществления предыдущих аспектов всего вводят 9 доз тремелимумаба.
[0040] Согласно некоторым вариантам осуществления способа по настоящему изобретению введение тремелимумаба или его антиген-связывающего фрагмента осуществляют приблизительно каждые 4 недели на протяжении семи введений, а затем каждые 12 недель.
[0041] Согласно некоторым вариантам осуществления способа по настоящему изобретению введение снижает растворимый PD-L1. Согласно некоторым вариантам осуществления растворимый PD-L1 снижается по меньшей мере на приблизительно 65%, 80%, 90%, 95% или 99%.
[0042] Согласно некоторым вариантам осуществления способов по настоящему изобретению опухоль резистентна по меньшей мере к одному химиотерапевтическому средству. Такие химиотерапевтические средства могут включать в себя без ограничения вемурафениб, эрлотиниб, афатиниб, цетуксимаб, карбоплатин, бевацизумаб, эрлотиниб, гефитиниб или пеметрексед.
[0043] Согласно некоторым вариантам осуществления способов по настоящему изобретению пациент имеет показатель общего состояния 0-1 согласно Восточной объединенной онкологической группе (ECOG).
[0044] Согласно некоторым вариантам осуществления способов по настоящему изобретению пациент не получал иммунотерапию до введения MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента.
[0045] Согласно некоторым вариантам осуществления способов по настоящему изобретению пациент получал иммунотерапию до введения MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента.
[0046] Согласно некоторым вариантам осуществления способов по настоящему изобретению введение MEDI4736 или его антиген-связывающего фрагмента осуществляют путем внутривенной инфузии.
[0047] Согласно некоторым вариантам осуществления способов по настоящему изобретению введение тремелимумаба или его антиген-связывающего фрагмента осуществляют путем внутривенной инфузии.
[0048] Согласно конкретным вариантам осуществления способов по настоящему изобретению введения снижают размер опухоли по меньшей мере на приблизительно 10%, 25%, 50%, 75% или 100% относительно исходного уровня.
[0049] Согласно конкретным вариантам осуществления способов по настоящему изобретению пациент-человек имеет местно-распространенный, неоперабельный или метастатический NSCLC. Согласно конкретным вариантам осуществления способов по настоящему изобретению NSCLC является сквамозным или несквамозным. Согласно другим вариантам осуществления способов по настоящему изобретению NSCLC предусматривает KRAS-мутацию или EGFR-мутацию.
[0050] Согласно некоторым вариантам осуществления способов по настоящему изобретению MEDI4736 или его антиген-связывающим фрагментом является MEDI4736, и при этом тремелимумабом или его антиген-связывающим фрагментом является тремелимумаб.
[0051] В другом аспекте настоящее изобретение предусматривает способ лечения рака с помощью MEDI4736 или антиген-связывающего фрагмента MEDI4736 в комбинации с тремелимумабом или антиген-связывающим фрагментом тремелимумаба. Согласно некоторым вариантам осуществления настоящего изобретения рак выбран из рака предстательной железы, рака молочной железы, трижды негативного рака молочной железы, рака толстой кишки, рака легкого, NSCLC, рака головы и шеи, меланомы, рака желудка, рака поджелудочной железы, рака яичника, гипернефромы и рака печени.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ/ФИГУР
[0052] На фигуре 1 показана схема лечения. MTD=максимальная переносимая доза.
[0053] На фигуре 2 показаны схемы с эскалацией дозы и увеличением дозы.
[0054] На фигуре 3 показана схема исследования с эскалацией дозы. DLT=ограничивающая дозу токсичность.
[0055] На фигуре 4 представлены график и таблица, показывающие фармакокинетический (PK) профиль MEDI4736. Q4W=каждые 4 недели. LLOQ= нижний предел количественного определения. AUC=площадь под кривой.
[0056] На фигуре 5 представлены график и таблица, показывающие фармакокинетический профиль тремелимумаба.
[0057] На фигуре 6 представлен график, показывающий абсолютную концентрацию профилей растворимого PD-L1 (sPD-L1).
[0058] На фигуре 7 представлен график, показывающий подавление растворимого PD-L1 в процентах.
[0059] На фигуре 8 представлен график, показывающий фармакокинетические (PK) параметры MEDI4736 у отдельных пациентов.
[0060] На фигуре 9 представлен график, показывающий фармакокинетические (PK) параметры тремелимумаба у отдельных пациентов.
[0061] На фигурах 10A и 10B представлены таблицы, показывающие модификацию дозы MEDI4736 и тремелимумаба из-за токсичности 1 степени или 2 степени (10A) и токсичности 3 степени или 4 степени (10B).
[0062] На фигуре 11 представлена таблица, показывающая критерии исследования.
[0063] На фигуре 12 показано включение в исследование.
[0064] На фигуре 13 показаны относительные неблагоприятные явления (AE) для пациентов, получающих дозу.
[0065] На фигуре 14 показано изменение размера опухоли по сравнению с исходным уровнем у первых четырех когорт.
[0066] На фигуре 15 показаны исследуемые дозы и графики для MEDI4736 и тремелимумаба.
[0067] На фигуре 16 показано подавление sPD-L1 при отдельных профилях, при которых давали MEDI4736 и тремелимумаб в комбинации.
[0068] На фигуре 17 показано подавление sPD-L1 при отдельных профилях, при которых давали MEDI4736 и тремелимумаб в комбинации, объединенных в когорту.
[0069] На фигуре 18 показано увеличение CD4 Ki67+ и CD8 Ki67 пролиферирующих клеток от исходного уровня у субъектов, получающих MEDI4736 и тремелимумаб, по сравнению с увеличениями у получающих только MEDI4736. Увеличения CD4 Ki67+ и CD8 Ki67 пролиферирующих клеток по сравнению с исходным уровнем коррелировали с увеличивающейся дозой тремелимумаба.
[0070] На фигуре 19 показано увеличение CD4 ICOS+ и CD4 HLADR+ клеток от исходного уровня у субъектов, получающих MEDI4736 и тремелимумаб, по сравнению с увеличениями у получающих только MEDI4736. Увеличения CD4 ICOS+ и CD4 HLADR+ клеток по сравнению с исходным уровнем коррелировали с увеличивающейся дозой тремелимумаба.
[0071] На фигуре 20 показано увеличение CD4+ эффекторных Т-клеток от исходного уровня у субъектов, получающих MEDI4736 и тремелимумаб, по сравнению с увеличением у получающих только MEDI4736. Увеличения CD4+ эффекторных Т-клеток по сравнению с исходным уровнем коррелировали с увеличивающейся дозой тремелимумаба.
[0072] На фигуре 21 показано увеличение регуляторных Т-клеток от исходного уровня у субъектов, получающих MEDI4736 и тремелимумаб, по сравнению с увеличением у получающих только MEDI4736. Увеличения регуляторных Т-клеток по сравнению с исходным уровнем коррелировали с увеличивающейся дозой тремелимумаба.
[0073] На фигуре 22 представлена таблица, показывающая клиническую активность терапии MEDI4736 в комбинации с тремелимумабом по сравнению с MEDI4736 в виде монотерапии.
[0074] На фигуре 23 представлены спайдер-диаграммы, показывающие изменение размера опухоли по сравнению с исходным уровнем в когортах с фиксированной дозой тремелимумаба: 1 мг/кг (верхняя левая секция); 10 мг/кг (верхняя правая секция) и 3 мг/кг (нижняя секция).
[0075] На фигуре 24 представлен график, показывающий время наступления относительных неблагоприятных явлений (AE) степени≥3 в комбинации когорт с фиксированной дозой тремелимумаба: 1 мг/кг; 10 мг/кг и 3 мг/кг, по сравнению с MEDI4736 в виде монотерапии.
[0076] На фигуре 25 представлены спайдер-диаграммы, показывающие изменение размера опухоли по сравнению с исходным уровнем в когортах с фиксированной дозой MEDI4736: 10 мг/кг Q4W (верхняя левая секция); 15 мг/кг Q4W (верхняя правая секция); 20 мг/кг Q4W (нижняя левая секция) и 10 мг/кг Q2W (нижняя правая секция).
[0077] На фигуре 26 представлен график, показывающий время наступления относительных неблагоприятных явлений (AE) степени≥3 в комбинации когорт с фиксированной дозой MEDI4736: 1 мг/кг; 10 мг/кг и 3 мг/кг, по сравнению с MEDI4736 в виде монотерапии.
[0078] На фигуре 27 представлены спайдер-диаграммы, показывающие изменение размера опухоли от исходного уровня в выбранных когортах пациентов с NSCLC, получающих MEDI4736 и тремелимумаб (левая секция) по сравнению с получающими только MEDI4736 (10 мг/кг Q4W) (правая секция).
[0079] На фигуре 28 представлены графики, показывающие время наступления относительных неблагоприятных явлений (AE) степени≥3 в выбранной комбинации когорт (левая и правая секции) по сравнению с MEDI4736 в виде монотерапии (левая секция).
[0080] На фигуре 29 представлены спайдер-диаграммы, показывающие изменение размера опухоли по сравнению с исходным уровнем во всех исследуемых когортах пациентов с NSCLC, получающих MEDI4736 и тремелимумаб.
[0081] На фигуре 30 представлены спайдер-диаграммы, показывающие изменение размера опухоли от исходного уровня в выбранных когортах пациентов с отрицательным по PD-L1 NSCLC, получающих MEDI4736 и тремелимумаб (левая секция), по сравнению с получающими только MEDI4736 (10 мг/кг; CP1108) (правая секция).
[0082] На фигуре 31 представлены спайдер-диаграммы, показывающие изменение размера опухоли от исходного уровня в выбранных когортах пациентов с положительным по PD-L1 NSCLC, получающих MEDI4736 и тремелимумаб (левая секция), по сравнению с получающими только MEDI4736 (10 мг/кг; CP1108) (правая секция).
[0083] На фигуре 32 представлены спайдер-диаграммы с фиксированной дозой тремелимумаба: 1 мг/кг (левая секция), 3 мг/кг (центральная секция) и 10 мг/кг (правая секция), показывающие изменение размера опухоли по сравнению с исходным уровнем в выбранных когортах пациентов с отрицательным по PD-L1 NSCLC, получающих MEDI4736 и тремелимумаб.
[0084] На фигуре 33 представлены спайдер-диаграммы с фиксированной дозой MEDI4736: 10 мг/кг Q4W (верхняя левая секция), 15 мг/кг (верхняя правая секция) и 20 мг/кг (нижняя левая секция), показывающие изменение размера опухоли по сравнению с исходным уровнем в выбранных когортах пациентов с отрицательным по PD-L1 NSCLC, получающих MEDI4736 и тремелимумаб.
[0085] На фигурах 34A-34D представлены спайдер-диаграммы, показывающие изменение размера опухоли по сравнению с исходным уровнем у пациентов с NSCLC, получающих MEDI4736 и тремелимумаб, согласно фигуре 29, сгруппированных согласно статусу PD-L1 NSCLC: все пациенты с NSCLC (34A); пациенты, идентифицированные как имеющий PD-L1- NSCLC (34B); пациенты, идентифицированные как имеющие PD-L1+ NSCLC (34C); и пациенты с недоступным статусом PD-L1 NSCLC (34D).
[0086] На фигуре 35 представлена каскадная диаграмма, показывающая самое лучшее изменение размера опухоли по сравнению с исходным уровнем у пациентов с NSCLC, получающих MEDI4736 и тремелимумаб.
[0087] На фигуре 36 представлена каскадная диаграмма, показывающая самое лучшее изменение размера опухоли по сравнению с исходным уровнем у пациентов с NSCLC, получающих MEDI4736 и тремелимумаб, согласно фигуре 35, идентифицированных по статусу PD-L1 NSCLC.
[0088] На фигуре 37 представлена диаграмма в виде «дорожки», показывающая продолжительность последующего наблюдения пациентов с NSCLC, получающих MEDI4736 и тремелимумаб.
ПОДРОБНОЕ ОПИСАНИЕ
[0089] Следует отметить, что форма единственного числа объекта относится к одному или нескольким таким объектам; например, подразумевается, что «антитело» представляет собой одно или несколько антител. В связи с этим, форму единственного числа, выражения «один или несколько» и «по меньшей мере один» можно использовать в настоящем документе взаимозаменяемо.
[0090] В настоящем документе представлены способы лечения немелкоклеточного рака легкого (NSCLC) с использованием MEDI4736 и тремелимумаба. Существует три главных подтипа NSCLC: плоскоклеточный рак, аденокарцинома и гигантоклеточный (недифференцированный) рак. Другие подтипы включают в себя аденосквамозный рак и саркоматоидную карциному. NSCLC может включать в себя мутацию в KRAS или в рецепторе эпидермального фактора роста. Такие мутации известны в уровне техники и описываются, например, у Riely et al., Proc Am Thorac Soc. 2009 Apr 15;6(2):201-5, которая включена в настоящий документ посредством ссылки.
[0091] Кроме того, в настоящем документе представлены способы лечения рака или форм неопластического роста с использованием MEDI4736 и тремелимумаба. Используемый в настоящем документе «рак» относится к заболеванию, вызванному неконтролируемым делением патологических клеток. Примеры рака включают в себя рак предстательной железы, рак молочной железы, трижды негативный рак молочной железы, рак толстой кишки, рак легкого, NSCLC, рак головы и шеи, меланому, рак желудка, рак поджелудочной железы, рак яичника, гипернефрому и рак печени.
[0092] Представленные способы предусматривают введение эффективного количества MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента.
[0093] Под «MEDI4736» подразумевают антитело или его антиген-связывающий фрагмент, которые селективно связывают полипептид PD-L1 и содержат по меньшей мере часть вариабельной области легкой цепи, содержащей аминокислотную последовательность с SEQ ID NO:1, и/или по меньшей мере часть вариабельной области тяжелой цепи, содержащей аминокислотную последовательность с SEQ ID NO:2.
[0094] Информацию, касающуюся MEDI4736 (или его антиген-связывающих фрагментов) для применения в способах, представленных в настоящем документе, можно найти в патенте США № 8779108, раскрытие которого включено в настоящий документ посредством ссылки в полном объеме. Кристаллизующийся фрагмент (Fc), домен из MEDI4736, содержит тройную мутацию в константном домене тяжелой цепи IgG1, что снижает степень связывания с компонентом системы комплемента C1q и Fcγ рецепторами, ответственными за посредничество антителозависимой клеточноопосредованной цитотоксичности (ADCC). MEDI4736 является селективным для PD-L1 и блокирует связывание PD-L1 с рецепторами PD-1 и CD80. MEDI4736 может облегчить PD-L1-опосредованную супрессию активации T-клеток человека in vitro, и он ингибирует рост опухоли в модели ксенотрансплантата, посредством Т-клеточно-зависимого механизма.
[0095] MEDI4736 для применения в способах, предусмотренных в настоящем документе, содержит тяжелую цепь и легкую цепь или вариабельную область тяжелой цепи и вариабельную область легкой цепи. В конкретном аспекте MEDI4736 или его антиген-связывающий фрагмент для применения в способах, предусмотренных в настоящем документе, содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность с SEQ ID NO:1, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность с SEQ ID NO:2. В конкретном аспекте MEDI4736 или его антиген-связывающий фрагмент для применения в способах, предусмотренных в настоящем документе, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где вариабельная область тяжелой цепи содержит определенные по Kabat последовательности CDR1, CDR2 и CDR3 с SEQ ID NO:3-5, и где вариабельная область легкой цепи содержит определенные по Kabat последовательности CDR1, CDR2 и CDR3 с SEQ ID NO:6-8. Специалисты в данной области с легкостью смогут идентифицировать определенные по Chothia, определенные по Abm или другие определения CDR, известные специалистам в данной области. В конкретном аспекте MEDI4736 или его антиген-связывающий фрагмент для применения в способах, предусмотренных в настоящем документе, содержит последовательности CDR вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела 2.14H9OPT, раскрытого в патенте США № 8779108, который включен в настоящий документ посредством ссылки в полном объеме.
[0096] Под «тремелимумабом» подразумевают антитело или его антиген-связывающий фрагмент, которые селективно связывают полипептид CTLA4 и содержат по меньшей мере часть вариабельной области легкой цепи, содержащей аминокислотную последовательность с SEQ ID NO:9, и/или по меньшей мере часть вариабельной области тяжелой цепи, содержащей аминокислотную последовательность с SEQ ID NO:10. Типичные антитела к CTLA4 описываются, например, в патентах США №№ 6682736, 7109003, 7123281, 7411057, 7824679, 8143379, 7807797 и 8491895 (в тех документах тремелимумаб представляет собой 11.2.1), которые включены в настоящий документ посредством ссылки. Тремелимумаб является типичным антителом к CTLA4. Последовательности тремелимумаба представлены в нижеприведенном перечне последовательностей.
[0097] Информацию, касающуюся тремелимумаба (или его антиген-связывающих фрагментов) для применения в способах, представленных в настоящем документе, можно найти в патенте США № 6682736 (где он обозначен как 11.2.1), раскрытие которого включено в настоящий документ посредством ссылки в полном объеме. Тремелимумаб (также известный как CP-675,206, CP-675, CP-675206 и тицилимумаб) представляет собой человеческое моноклональное антитело IgG2, которое является высоко селективным в отношении CTLA4 и блокирует связывание CTLA4 с CD80 (B7.1) и CD86 (B7.2). Было показано, что оно приводит к иммунной активации in vitro, и у некоторых пациентов, которых лечили тремелимумабом, наблюдали регрессию опухоли.
[0098] Тремелимумаб и его антиген-связывающие фрагменты для применения в способах, предусмотренных в настоящем документе, содержат тяжелую цепь и легкую цепь или вариабельную область тяжелой цепи и вариабельную область легкой цепи. В конкретном аспекте тремелимумаб или его антиген-связывающий фрагмент для применения в способах, предусмотренных в настоящем документе, содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность с SEQ ID NO:9, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность с SEQ ID NO:10. В конкретном аспекте тремелимумаб или его антиген-связывающий фрагмент для применения в способах, предусмотренных в настоящем документе, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где вариабельная область тяжелой цепи содержит определенные по Kabat последовательности CDR1, CDR2 и CDR3 с SEQ ID NO:11-13, и где вариабельная область легкой цепи содержит определенные по Kabat последовательности CDR1, CDR2 и CDR3 с SEQ ID NO:14-16. Специалисты в данной области с легкостью смогут идентифицировать определенные по Chothia, определенные по Abm или другие определения CDR, известные специалистам в данной области. В конкретном аспекте тремелимумаб или его антиген-связывающий фрагмент для применения в способах, предусмотренных в настоящем документе, содержит последовательности CDR вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела 11.2.1, раскрытого в патенте США № 6682736, который включен в настоящий документ посредством ссылки в полном объеме.
[0099] Термин «антиген-связывающий фрагмент» относится к части интактного антитела и/или относится к вариабельным областям интактного антитела, определяющим антигены. Известно, что антиген-связывающая функция антитела может быть представлена фрагментами полноразмерного антитела. Примеры фрагментов антитела включают без ограничения Fab-, Fab'-, F(ab')2- и Fv-фрагменты, линейные антитела, одноцепочечные антитела, диатела и полиспецифические антитела, образованные из фрагментов антитела.
[00100] В определенных аспектах пациенту, поступающему с NSCLC, вводят MEDI4736 или его антиген-связывающий фрагмент и тремелимумаб или его антиген-связывающий фрагмент. MEDI4736 или его антиген-связывающий фрагмент и тремелимумаб или его антиген-связывающий фрагмент можно вводить только один раз или не часто, при этом это все еще будет приносить пользу пациенту. В дополнительных аспектах пациенту вводят дополнительные последующие дозы. Последующие дозы можно вводить с различными интервалами времени в зависимости от возраста, веса пациента, клинических анализов, опухолевой массы и/или других факторов, в том числе оценки лечащего врача.
[00101] Интервалы между дозами MEDI4736 или его антиген-связывающего фрагмента могут быть каждые четыре недели. Интервалы между дозами тремелимумаба или его антиген-связывающего фрагмента могут быть каждые четыре недели. Интервалы между дозами тремелимумаба или его антиген-связывающего фрагмента могут быть каждые двенадцать недель. Интервалы между дозами тремелимумаба или его антиген-связывающего фрагмента могут быть каждые четыре недели в течение шести циклов, а затем каждые двенадцать недель.
[00102] В определенных аспектах MEDI4736 или его антиген-связывающий фрагмент вводят приблизительно также часто, как и тремелимумаб или его антиген-связывающий фрагмент. В определенных аспектах MEDI4736 или его антиген-связывающий фрагмент вводят приблизительно в три раза чаще, чем тремелимумаб или его антиген-связывающий фрагмент.
[00103] Согласно некоторым вариантам осуществления пациенту вводят по меньшей мере две дозы MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления пациенту могут вводить по меньшей мере три дозы, по меньшей мере четыре дозы, по меньшей мере пять доз, по меньшей мере шесть доз, по меньшей мере семь доз, по меньшей мере восемь доз, по меньшей мере девять доз, по меньшей мере десять доз или по меньшей мере пятнадцать доз или более. Согласно некоторым вариантам осуществления MEDI4736 или его антиген-связывающий фрагмент вводят за четырехнедельный период лечения, за восьминедельный период лечения, за шестнадцатинедельный период лечения, за двадцатинедельный период лечения, за двадцатичетырехнедельный период лечения или за период лечения один год или более. Согласно некоторым вариантам осуществления тремелимумаб или его антиген-связывающий фрагмент вводят за четырехнедельный период лечения, за восьминедельный период лечения, за двенадцатинедельный период лечения, за шестнадцатинедельный период лечения, за двадцатинедельный период лечения, за двадцатичетырехнедельный период лечения, за тридцатишестинедельный период лечения, за сорокавосьминедельный период лечения или за период лечения один год или более.
[00104] Согласно некоторым вариантам осуществления MEDI4736 или его антиген-связывающий фрагмент и тремелимумаб или его антиген-связывающий фрагмент вводят в тот же день. Согласно некоторым вариантам осуществления MEDI4736 или его антиген-связывающий фрагмент вводят одновременно с тремелимумабом или его антиген-связывающим фрагментом. Согласно другим вариантам осуществления MEDI4736 или его антиген-связывающий фрагмент вводят через приблизительно 1 час после введения тремелимумаба или его антиген-связывающего фрагмента.
[00105] Количество MEDI4736 или его антиген-связывающего фрагмента и количество тремелимумаба или его антиген-связывающего фрагмента, подлежащих введению пациенту, будет зависеть от различных параметров, таких как возраст, вес пациента, клинические анализы, опухолевая масса и/или другие факторы, в том числе оценки лечащего врача.
[00106] В определенных аспектах пациенту вводят одну или несколько доз MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 1 мг/кг. В определенных аспектах пациенту вводят одну или несколько доз MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 3 мг/кг. В определенных аспектах пациенту вводят одну или несколько доз MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 10 мг/кг. В определенных аспектах пациенту вводят одну или несколько доз MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 15 мг/кг. В определенных аспектах пациенту вводят одну или несколько доз MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 20 мг/кг.
[00107] В определенных аспектах пациенту вводят по меньшей мере две дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 1 мг/кг. В определенных аспектах пациенту вводят по меньшей мере две дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 3 мг/кг. В определенных аспектах пациенту вводят по меньшей мере две дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 10 мг/кг. В определенных аспектах пациенту вводят по меньшей мере две дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 15 мг/кг. В определенных аспектах пациенту вводят по меньшей мере две дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 20 мг/кг. В некоторых вариантах осуществления по меньшей мере две дозы вводят по отдельности с разницей в приблизительно четыре недели.
[00108] В определенных аспектах пациенту вводят по меньшей мере три дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 1 мг/кг. В определенных аспектах пациенту вводят по меньшей мере три дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 3 мг/кг. В определенных аспектах пациенту вводят по меньшей мере три дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 10 мг/кг. В определенных аспектах пациенту вводят по меньшей мере три дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 15 мг/кг. В определенных аспектах пациенту вводят по меньшей мере три дозы MEDI4736 или его антиген-связывающего фрагмента, где доза составляет приблизительно 20 мг/кг. В некоторых вариантах осуществления по меньшей мере три дозы вводят по отдельности с разницей в приблизительно четыре недели.
[00109] В определенных аспектах пациенту вводят одну или несколько доз тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 1 мг/кг. В определенных аспектах пациенту вводят одну или несколько доз тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 3 мг/кг. В определенных аспектах пациенту вводят одну или несколько доз тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 10 мг/кг.
[00110] В определенных аспектах пациенту вводят по меньшей мере две дозы тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 1 мг/кг. В определенных аспектах пациенту вводят по меньшей мере две дозы тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 3 мг/кг. В определенных аспектах пациенту вводят по меньшей мере две дозы тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 10 мг/кг. В некоторых вариантах осуществления по меньшей мере две дозы вводят по отдельности с разницей в приблизительно четыре недели. В некоторых вариантах осуществления по меньшей мере две дозы вводят по отдельности с разницей в приблизительно двенадцать недель.
[00111] В определенных аспектах пациенту вводят по меньшей мере три дозы тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 1 мг/кг. В определенных аспектах пациенту вводят по меньшей мере три дозы тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 3 мг/кг. В определенных аспектах пациенту вводят по меньшей мере три дозы тремелимумаба или его антиген-связывающего фрагмента, где доза составляет приблизительно 10 мг/кг. В некоторых вариантах осуществления по меньшей мере три дозы вводят по отдельности с разницей в приблизительно четыре недели. В некоторых вариантах осуществления по меньшей мере три дозы вводят по отдельности с разницей в приблизительно двенадцать недель.
[00112] В определенных аспектах введение MEDI4736 или его антиген-связывающего фрагмента и/или тремелимумаба или антиген-связывающего фрагмента согласно способам, предусмотренным в настоящем документе, осуществляют путем парентерального введения. Например, MEDI4736 или его антиген-связывающий фрагмент и/или тремелимумаб или антиген-связывающий фрагмент можно вводить путем внутривенной инфузии или путем подкожной инъекции. В некоторых вариантах осуществления введение является внутривенной инфузией.
[00113] В определенных аспектах пациенту вводят 1 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 1 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 1 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[00114] В определенных аспектах пациенту вводят 3 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 3 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 3 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[00115] В определенных аспектах пациенту вводят 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 10 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[00116] В определенных аспектах пациенту вводят 15 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 15 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 15 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[00117] В определенных аспектах пациенту вводят 20 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 1 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 20 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 3 мг/кг тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах пациенту вводят 20 мг/кг MEDI4736 или его антиген-связывающего фрагмента и 10 мг/кг тремелимумаба или его антиген-связывающего фрагмента.
[00118] Способы, предусмотренные в настоящем документе, могут снижать, замедлять или стабилизировать рост опухоли. В некоторых аспектах снижение или замедление может быть статистически значимым. Снижение роста опухоли можно измерить при помощи сравнения роста опухоли у пациента на исходным уровне, с ожидаемым ростом опухоли, с ожидаемым ростом опухоли, основанным на большой популяции пациентов, или с ростом опухоли в контрольной популяции. В определенных аспектах ответ опухоли измеряют с использованием критериев оценки ответа солидных опухолей (RECIST).
[00119] В определенных аспектах ответ опухоли выявляют на 8 неделе. В определенных аспектах ответ опухоли выявляют на 33 неделе. В определенных аспектах ответ опухоли выявляют на 50 неделе.
[00120] В определенных аспектах ответ опухоли выявляют после введения двух доз MEDI4736 или его антиген-связывающего фрагмента и двух доз тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах ответ опухоли выявляют после введения восьми доз MEDI4736 или его антиген-связывающего фрагмента и семи доз тремелимумаба или его антиген-связывающего фрагмента. В определенных аспектах ответ опухоли выявляют после введения тринадцати доз MEDI4736 или его антиген-связывающего фрагмента и девяти доз тремелимумаба или его антиген-связывающего фрагмента.
[00121] В определенных аспектах пациент достигает контроля над заболеванием (DC). Контролем над заболеванием может быть полная ремиссия (CR), частичная ремиссия (PR) или стабилизация заболевания (SD).
[00122] «Полная ремиссия» (CR), «частичная ремиссия» (PR) и «стабилизация заболевания» (SD) могут быть определены, как описано в нижеприведенной таблице 1.
[00123] В определенных аспектах введение MEDI4736 или его антиген-связывающего фрагмента может увеличивать выживаемость без прогрессирования заболевания (PFS).
[00124] В определенных аспектах введение MEDI4736 или его антиген-связывающего фрагмента может увеличивать общую выживаемость (OS).
[00125] В некоторых вариантах осуществления пациент предварительно получал лечение по меньшей мере одним химиотерапевтическим средством. В некоторых вариантах осуществления пациент предварительно получал лечение по меньшей мере двумя химиотерапевтическими средствами. Химиотерапевтическое средство может включать в себя без ограничения вемурафениб, эрлотиниб, афатиниб, цетуксимаб, карбоплатин, бевацизумаб, эрлотиниб, гефитиниб и/или пеметрексед.
[00126] Согласно некоторым вариантам осуществления NSCLC является резистентным или устойчивым по меньшей мере к одному химиотерапевтическому средству. В некоторых вариантах осуществления опухоль является резистентной или устойчивой по меньшей мере к двум химиотерапевтическим средствам. Опухоль может быть резистентной или устойчивой к одному или нескольким, например, без ограничения из вемурафениба, эрлотиниба, афатиниба, цетуксимаба, карбоплатина, бевацизумаба, эрлотиниба, гефитиниба и/или пеметрекседа. Согласно некоторым вариантам осуществления NSCLC является отрицательным по PD-L1. Согласно некоторым вариантам осуществления NSCLC является положительным по PD-L1.
[00127] В некоторых вариантах осуществления пациент имеет показатель общего состояния 0 или 1 согласно Восточной объединенной онкологической группе (ECOG) (Oken MM, et al. Am. J. Clin. Oncol. 5: 649-55 (1982)) до введения MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента.
[00128] Согласно способам, предусмотренным в настоящем документе, введение MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента может давать в результате необходимые фармакокинетические параметры, как видно из некоторых ранних данных. Общая экспозиция препарата может быть оценена с применением «площади под кривой» (AUC). «AUC (tau)» относится к AUC от времени 0 до времени τ, интервал введения дозы, тогда как «AUC (inf)» относится к AUC до бесконечного времени. Введение может обеспечивать AUC (tau) от приблизительно 600 до приблизительно 3000 мкг/мл*сутки MEDI4736 или его антиген-связывающего фрагмента и от приблизительно 250 до приблизительно 350 мкг/мл*сутки тремелимумаба или его антиген-связывающего фрагмента. Введение может обеспечивать максимальную наблюдаемую концентрацию (Cmax) от приблизительно 60 до приблизительно 300 мкг/мл MEDI4736 или его антиген-связывающего фрагмента и от приблизительно 25 до приблизительно 35 мкг/мл тремелимумаба или его антиген-связывающего фрагмента. Введение может обеспечивать C остаточную (минимальную концентрацию лекарственного средства в плазме) от приблизительно 5 до приблизительно 40 мкг/мл MEDI4736 или его антиген-связывающего фрагмента и от приблизительно 4 до приблизительно 6 мкг/мл тремелимумаба или его антиген-связывающего фрагмента.
[00129] Как предусмотрено в настоящем документе, MEDI4736 или его антиген-связывающий фрагмент также может снижать уровни свободного (растворимого) PD-L1. Свободный (растворимый) PD-L1 относится к PD-L1, который не связан (например, с MEDI4736). Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 65%. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 80%. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 90%. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 95%. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 99%. Согласно некоторым вариантам осуществления уровни PD-L1 не выявляемы после введения MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента.
[00130] Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 65% после однократного введения MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 80% после однократного введения MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 90% после однократного введения MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 95% после однократного введения MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 99% после однократного введения MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 не выявляемы после однократного введения MEDI4736 или его антиген-связывающего фрагмента.
[00131] Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 65% после введения двух доз MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 80% после введения двух доз MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 90% после введения двух доз MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 95% после введения двух доз MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 снижаются по меньшей мере на 99% после введения двух доз MEDI4736 или его антиген-связывающего фрагмента. Согласно некоторым вариантам осуществления уровни PD-L1 не выявляемы после введения двух доз MEDI4736 или его антиген-связывающего фрагмента.
[00132] Лечение пациента с солидной опухолью с использованием и MEDI4736 или его антиген-связывающего фрагмента, и тремелимумаба или его антиген-связывающего фрагмента (т. e. совместная терапия), предусмотренное в настоящем документе, может приводить в результате к синергическому эффекту. Используемый в настоящем документе термин «синергический» относится к комбинации терапевтических средств (например, к комбинации MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента), которая является более эффективной, чем аддитивные эффекты отдельных терапевтических средств.
[00133] Синергический эффект комбинации терапевтических средств (например, комбинации MEDI4736 или его антиген-связывающего фрагмента и тремелимумаба или его антиген-связывающего фрагмента) делает возможным применение более низких доз одного или нескольких лечебных средств и/или менее частое введение указанных лечебных средств пациенту с солидной опухолью. Возможность использования более низких доз лечебных средств и/или введения указанных терапевтических средств менее часто снижает токсичность, ассоциированную с введением указанных терапевтических средств субъекту без снижения эффективности указанных терапевтических средств при лечении солидной опухоли. Кроме того, синергический эффект может обеспечивать в результате улучшенную эффективность лечебных средств при контроле, лечении или облегчении солидной опухоли. При помощи синергического эффекта комбинации лечебных средств можно избежать неблагоприятных или нежелательных побочных эффектов, ассоциированных с применением любого одного терапевтического средства, или снизить их.
[00134] При совместной терапии MEDI4736 или его антиген-связывающий фрагмент может быть необязательно включен в ту же фармацевтическую композицию, что и тремелимумаб или его антиген-связывающий фрагмент или может быть включен в отдельную фармацевтическую композицию. В последнем случае фармацевтическая композиция, содержащая MEDI4736 или его антиген-связывающий фрагмент, является приемлемой для введения до, одновременно с или после введения фармацевтической композиции, содержащей тремелимумаб или его антиген-связывающий фрагмент. В определенных случаях MEDI4736 или его антиген-связывающий фрагмент вводят параллельно с тремелимумабом или его антиген-связывающим фрагментов в отдельной композиции.
[00135] Субъекты, страдающих раком легкого (например, немелкоклеточным раком легкого), могут быть протестированы на экспрессию полинуклеотида или полипептида PD-L1 в ходе подбора способа лечения. Пациентов, идентифицированных как имеющие опухоли, которые являются отрицательными по PD-L1 (например, как определено по баллу Ct или IHC-M), или имеющие пониженные или невыявляемые уровни PD-L1 относительно эталонного уровня, определяют как отвечающих на лечение комбинацией антитела к PD-L1 и тремелимумаба. Таким пациентам вводят MEDI4736 или его антиген-связывающий фрагмент в комбинации с тремелимумабом или его антиген-связывающим фрагментом.
ПРИМЕРЫ
ПРИМЕР 1. Пациенты и способы
(a) СУБЪЕКТЫ
[00136] Субъекты в данном исследовании должны быть возрастом 18 лет или старше и иметь гистологически или цитологически подтвержденный немелкоклеточный рак легкого (NSCLC; сквамозный и несквамозный), по меньшей мере с одним поражением, измеряемым согласно методическим указаниям v1.1 критериев оценки ответа солидных опухолей (RECIST), которые включены в настоящий документ посредством ссылки в полном объеме.
[00137] Для обеих фаз эскалации дозы и увеличения дозы специфические в отношении когорты требования ранее получаемой иммунотерапии являются следующими: a) не получавшая иммунотерапию когорта: не должны ранее подвергаться иммунотерапии, такой как без ограничения другими антителами к CTLA-4, к PD-1 или к PD-L1, за исключением вакцин; и b) ранее получавшая иммунотерапию когорта: должны ранее подвергаться иммунотерапии, такой как без ограничения другими антителами к CTLA-4, к PD-1 или к PD-L1, за исключением вакцин, более чем за 28 дней до первой дозы MEDI4736 и тремелимумаба.
[00138] Субъекты также должны не отвечать на стандартное лечение, у них должен наблюдаться рецидив после стандартного лечения, они должны отказываться от стандартного лечения или не подходить для стандартного лечения. Субъекты будут иметь показатель общего состояния 0-1 согласно Восточной объединенной онкологической группе (ECOG).
[00139] Субъекты с метастазами в центральной нервной системе (CNS) должны быть бессимптомными на 1 день исследования. Кроме того, к 1 дню должно пройти по меньшей мере 28 недель без прогрессирования метастаз в CNS, что подтверждается магниторезонансной визуализацией (MRI)/компьютерной томографией (CT), после последнего дня лечения облучением и по меньшей мере 14 дней после последней дозы кортикостероидов.
[00140] Субъекты также должны иметь адекватную функцию органов (печени и почек) и костного мозга. Адекватная функция органов и костного мозга определяется следующим образом: гемоглобин≥9 г/дл; абсолютное количество нейтрофилов≥1500/мм3; количество тромбоцитов≥100000/мм3; общий билирубин < 1,5 x верхний предел нормы (ULN), кроме случаев, ассоциированных с синдромом Жильбера или метастазами в печени (для таких субъектов общий билирубин на исходном уровне должен составлять≤3,0 мг/дл); аланинаминотрансфераза (ALT) и аспартатаминотрансфераза (AST) должны составлять≤2,5 × ULN, кроме случаев, ассоциированных с метастазами в печени (для таких субъектов ALT и AST должны составлять≤5 × ULN); и креатинин сыворотки крови≤2,0 мг/дл.
[00141] Субъекты не могут участвовать, если они получают какую-либо сопутствующую химиотерапию, иммунотерапию, биологическую или гормональную терапию для лечения рака. Субъекты не могут участвовать, если они принимают какую-либо экспериментальную противораковую терапию в течение 28 дней до первой дозы MEDI4736 и тремелимумаба. Субъекты не могут участвовать, если у них наблюдается какое-либо существовавшее ранее связанное с иммунной системой неблагоприятное явление (irAE) степени≥3 при получении иммунотерапии, в том числе лечения антителом к CTLA-4, или любое нерешенное irAE степени > 1. Субъекты также не могут участвовать, если они подвергались серьезной хирургической процедуре (определенной исследователем) в течение 28 дней до первой дозы MEDI4736 и тремелимумаба, или если они все еще восстанавливаются после предыдущего хирургического вмешательства. Субъекты также не могут участвовать, если у них проявляются нерешенные токсичности в результате предварительной противораковой терапии, определяемые как нерешенные с 0 или 1 степенью согласно общим терминологическим критериям неблагоприятных явлений Национального института рака (NCI CTCAE) v4.03, за исключением алопеции и лабораторных значений, перечисленных в критериях включения. Могут быть включены субъекты с необратимой токсичностью, которая, по всей вероятности, не усугубится MEDI4736 и тремелимумабом. Субъекты также не допускаются, если они на данный момент используют или использовали иммуносупрессивный лекарственный препарат в течение 14 дней до первой дозы MEDI4736 и тремелимумаба, за исключением интраназальных и ингаляционных кортикостероидов или системных кортикостероидов при физиологических дозах, не превышающих 10 мг/сутки преднизона или эквивалента.
[00142] Субъекты не могут участвовать, если они имеют активное или существовавшее ранее аутоиммунное заболевание, в том числе воспалительное заболевание кишечника, дивертикулит, раздражающее кишечное заболевание, целиакию, синдром Вегенера и синдром Хашимото, в течение последних 3 лет, за исключением витилиго, алопеции, болезни Грейвса или псориаза, не требующих системного лечения (в течение последних 3 лет). Субъекты также не могут участвовать, если в анамнезе указан первичный иммунодефицит или туберкулез, если они имеют известный активный или хронический вирусный гепатит A, B или C; если они инфицированы вирусом иммунодефицита человека (HIV), имеют другие активные тяжелые болезни или неконтролируемые интеркуррентные болезни; получали живую, аттенуированную вакцину в течение 28 дней до первой дозы MEDI4736 и тремелимумаба; имеют другое инвазивное злокачественное новообразование в течение 5 лет или известную аллергию или гиперчувствительность к исследуемым составам лекарственных средств.
[00143] Субъекты также не могут участвовать, если они имеют NSCLC на поздней стадии с опухолями, содержащими перестройки генов рецепторной тирозинкиназы анапластической лимфомы (ALK) или чувствительные к рецептору эпидермального фактора роста (EGFR) мутации, и не получали соответствующей терапии ингибитором тирозинкиназы (TKI). Эти субъекты могут быть включены после задокументированного прогрессирования или непереносимости соответствующих TKI.
(b) СХЕМА ИССЛЕДОВАНИЯ
[00144] Исследование является открытым фазы 1b исследованием комбинации MEDI4736 и тремелимумаба (фигура 1). Ключевые критерии исследования для когорт показаны на фигуре 11. В исследование будут включены примерно 36 субъектов в фазу эскалации дозы и в фазу увеличения дозы, а также минимум по 20 субъектов в каждую из не получавшей иммунотерапию и ранее получавшей иммунотерапию когорт. Максимальная переносимая доза (MTD) или наивысшая определяемая по протоколу доза для каждого средства без превышения MTD, определенной для не получавшей иммунотерапию когорты во время фазы эскалации дозы, будет служить исходной дозой для субъектов, включенных в ранее получавшую иммунотерапию когорту, как часть фазы эскалации дозы. Изучение доз для ранее получавшей иммунотерапию когорты будут проводить параллельно с фазой увеличения дозы для не получавшей иммунотерапию когорты.
ФАЗА ЭСКАЛАЦИИ ДОЗЫ
Не получавшая иммунотерапию когорта
[00145] В фазе эскалации дозы исследования MEDI4736 и тремелимумаб изначально будут вводить последующим когортам из 3-6 субъектов, которые не получали иммунотерапию, при этом каждый субъект получает тремелимумаб Q4W на протяжении 6 доз и каждые 12 недель (Q12W) на протяжении 3 доз (т. e. дозу 7 тремелимумаба давали на 4 неделе после дозы 6, а дозу 8 давали на 12 неделе после дозы 7) и MEDI4736 Q4W 13 доз путем IV инфузии на протяжении суммарно одного года (фигура 2). Каждая когорта будет включать самое меньшее 3 субъекта согласно стандартной схеме 3+3 и модифицированной схеме на основе зон. Субъекты в первой когорте (когорте 1) будут получать дозу 3 мг/кг MED4736 и 1 мг/кг тремелимумаба. Если в когорте первой дозы наблюдают ограничивающие дозу токсичности (DLT) ≥2, то исходная доза будет уменьшена согласно фигуре 1. Если не более 1 из 6 субъектов испытывает DLT в когорте данной дозы, то эскалацию дозы будут продолжать.
[00146] Последующие когорты будут получать тремелимумаб, вводимый Q4W на протяжении 6 доз, а затем Q12W на протяжении 3 доз, и MEDI4736, вводимый Q4W на протяжении 13 доз, пока не будет определена MTD или наивысшая определяемая по протоколу доза для каждого средства без превышения MTD.
[00147] Фаза увеличения для не получавшей иммунотерапию когорты (см. фигуру 1) будет начинаться, как только будет определена MTD или наивысшая определяемая по протоколу доза для каждого средства без превышения MTD у не получавших иммунотерапию субъектов в ходе фазы эскалации дозы. Дополнительная(ые) доза(ы) из промежуточной(ых) когорты(когорт) на основе зон, которая(ые) не превышает(ют) MTD, может(могут) быть оценена(ы) в фазе увеличения на основании оценивания PK и фармакодинамики, параметров безопасности и эффективности у не получавшей иммунотерапию когорты из фазы увеличения дозы.
Ранее получавшая иммунотерапию когорта
[00148] MTD или наивысшая определяемая по протоколу доза для каждого средства без превышения MTD, определенной для не получавшей иммунотерапию когорты (см. фигуру 1) во время фазы эскалации дозы, будет служить исходной дозой для субъектов, включенных в ранее получавшую иммунотерапию когорту, как часть фазы эскалации дозы. Изучение дозы для ранее получавшей иммунотерапию когорты с использованием схемы 3+3 будут проводить параллельно с фазой увеличения дозы для не получавшей иммунотерапию когорты. Фаза увеличения дозы для ранее получавшей иммунотерапию когорты может начаться, как только будет определена MTD или наивысшая определяемая по протоколу доза для каждого средства без превышения MTD у ранее получавших иммунотерапию субъектов в ходе фазы эскалации дозы. Дополнительная(ые) доза(ы) из промежуточной(ых) когорты(когорт) на основе зон, которая(ые) не превышает(ют) MTD, может(могут) быть оценена(ы) в фазе увеличения дозы на основании оценивания PK и фармакодинамики, параметров безопасности и эффективности у ранее получавшей иммунотерапию когорты из фазы увеличения дозы.
ФАЗА УВЕЛИЧЕНИЯ ДОЗЫ
[00149] Будут использовать две когорты увеличения дозы: не получавшую иммунотерапию и ранее получавшую иммунотерапию (см. фигуру 1). В фазе увеличения дозы для обеих когорт будут использовать MTD или наивысшую определяемую по протоколу дозу для каждого средства без превышения MTD, определенной в ходе фазы эскалации дозы. Кроме того, доза(ы) из промежуточной(ых) когорты(когорт) на основе зон, которая(ые) не превышает(ют) MTD, может(могут) быть включена(ы) как дополнительная(ые) доза(ы) для ранее получавшей иммунотерапию и не получавшей иммунотерапию когорт в фазе увеличения дозы на основании полученных от субъектов данных, в том числе данных безопасности, PK, фармакодинамики, биомаркера и ответа, а также данных, полученных в настоящих испытаниях.
[00150] Изначально примерно 20 субъектов с NSCLC будут включены в каждую из не получавшей иммунотерапию когорты и ранее получавшей иммунотерапию когорты. Дополнительные субъекты, всего до 60 субъектов, которые могут быть включены в не получавшую иммунотерапию когорту в фазе увеличения дозы в зависимости от получаемых от субъектов данных, в том числе данных безопасности, PK, фармакодинамики, биомаркера и ответа, а также данных, полученных в настоящих испытаниях.
РЕЖИМ ЛЕЧЕНИЯ
[00151] Субъектов будут лечить либо в фазе эскалации дозы, либо в фазе увеличения дозы исследования. В фазах эскалации дозы и увеличения дозы исследования тремелимумаб будут вводить каждые четыре недели (Q4W) на протяжении 6 доз, а затем каждые двенадцать недель (Q12W) на протяжении 3 доз, при этом дозу 7 вводят через 4 недели после дозы 6 и дозу 8 вводят через 12 недель после дозы 7. MEDI4736 будут вводить Q4W на протяжении 13 доз. Оба средства будут вводить путем IV инфузии на протяжении суммарно одного года (фигура 2).
[00152] Тремелимумаб будут вводить внутривенно в 250 мл 0,9% натрия хлорида. MEDI4736 будут вводить внутривенно в 250 мл 0,9% натрия хлорида. Тремелимумаб будут вводить первым. Инфузию MEDI4736 будут начинать через примерно 1 час после окончания инфузии тремелимумаба. В когорте 1 продолжительность первой IV инфузии тремелимумаба будет составлять примерно 1 час, а продолжительность первой IV инфузии MEDI4736 будет составлять примерно 4 часа; продолжительность последующих инфузий для субъектов в этой когорте и всех инфузий для остальных когорт будет составлять примерно 1 час.
[00153] Субъекты, у которых будет достигнут и сохранен контроль над заболеванием (DC) (т. e. полная ремиссия (CR), частичная ремиссия (PR) или стабилизация заболевания (SD)) до конца 12-месячного периода лечения MEDI4736 и тремелимумабом, будут зачислены для последующего наблюдения. При признаках прогрессирующего заболевания (PD) в ходе последующего наблюдения субъектам могут повторно вводить MEDI4736 и тремелимумаб в течение дополнительного периода до 12 месяцев с теми же методическими указаниями, которым следовали в течение начального 12-месячного периода, если субъект не получал другие виды лечения своего заболевания и по-прежнему отвечает критериям включения и исключения для протокола исследования. Будет разрешен только один этап повторного лечения с помощью MEDI4736 и тремелимумаба.
[00154] В исследовании используют фазу эскалации дозы 3+3 и следуют структуре, изображенной на фигуре 3. Самое меньшее три субъекта будут включены в когорту каждой дозы. Если у 0 из 3 пациентов в когорте дозы наблюдается ограничивающая дозу токсичность (DLT), то будут начинать следующую когорту эскалации дозы. Если у 1 из 3 пациентов наблюдают DLT, то в ту же когорту будут включены дополнительные 3 пациента. Если не более 1 из 6 субъектов испытывает DLT, то будут начинать следующую когорту эскалации дозы. Если 2 или более пациентов в когорте дозы испытывают DLT в период оценивания, то не будут включать дополнительных субъектов в эту когорту дозы.
[00155] Максимальную переносимую дозу (MTD) определяют как наивысшую дозу тремелимумаба или MEDI4736 в когорта, где не более 1 из 6 пациентов испытывает DLT. Ее определяют как для не получавшей иммунотерапию, так и для ранее получавшей лечение когорт в ходе фазы эскалации дозы. Пациентов в фазе увеличения (не получавшая иммунотерапию и ранее получавшая иммунотерапию когорты) будут лечить при уровне MTD, определяемом в фазе эскалации дозы.
[00156] Введение MEDI4736 и тремелимумаба может быть модифицировано или прекращено в результате токсичностей, как описано на фигурах 10A и 10B. Модификации дозы не потребуются для неблагоприятных явлений (AE), которые явно не объясняются MEDI4736 или тремелимумабом (такие как травма), или для отклонения лабораторных показателей от нормы, которые не считаются клинически значимыми.
(c) ОЦЕНКИ ФАРМАКОКИНЕТИЧЕСКИХ ПАРАМЕТРОВ, ПРОТИВООПУХОЛЕВОГО ДЕЙСТВИЯ, БИОМАРКЕРА, РАСТВОРИМОГО ФАКТОРА И БЕЗОПАСНОСТИ
[00157] Измерения концентраций MEDI4736 и тремелимумаба в сыворотке будут выполнять с использованием одобренного иммуноанализа.
[00158] Образцы крови для фармакокинетической оценки будут собирать в следующие дни на протяжении фазы эскалации дозы: день 1 (до приема дозы и конец инфузии), день 8 (+ 1 день), день 15 (+ 1 день), день 29 (до приема дозы и конец инфузии;+3 дня), день 57 (до приема дозы и конец инфузии;+3 дня), день 85 (до приема дозы и конец инфузии;+3 дня), день 113 (до приема дозы и конец инфузии;+3 дня), день 141 (до приема дозы и конец инфузии;+3 дня), день 169 (до приема дозы и конец инфузии;+3 дня), день 197 (до приема дозы и конец инфузии;+3 дня; только MEDI4736), день 225 (до приема дозы и конец инфузии;+3 дня; только MEDI4736), день 253 (до приема дозы и конец инфузии;+3 дня), день 281 (до приема дозы и конец инфузии;+3 дня; только MEDI4736), день 309 (до приема дозы и конец инфузии;+3 дня), день 337 (до приема дозы и конец инфузии;+3 дня), в конце лечения, через 60 дней после окончания лечения и через 90 дней после окончания лечения.
[00159] Образцы крови для фармакокинетической оценки будут собирать в следующие дни на протяжении фазы увеличения дозы: день 1 (до приема дозы и конец инфузии), день 29 (+ 3 дня), день 57 (+ 3 дня), день 85 (+ 3 дня), день 113 (+ 3 дня), день 141 (+ 3 дня), день 169 (+ 3 дня); день 197 (+ 3 дня; только MEDI4736), день 225 (+ 3 дня; только MEDI4736), день 253 (+ 3 дня), день 281 (+ 3 дня; только MEDI4736), день 309 (+ 3 дня; только MEDI4736), день 337 (+ 3 дня), в конце лечения, через 60 дней после окончания лечения и через 90 дней после окончания лечения.
[00160] Присутствие антител к лекарственному средству (ADA) будут оценивать на 1 день и 29 (+ 3 дня), 85 (+ 3 дня), 141 (+ 3 дня), 169 (+ 3 дня), 253 (+ 3 дня) и 337 дни (+ 3 дня), в конце лечения, через 60 дней после окончания лечения и через 90 дней после окончания лечения. Одобренные электрохемилюминесцентные анализы с использованием платформы Meso Scale Discovery будут использовать для определения антител к MEDI4736 в сыворотке человека и для определения антител к тремелимумабу в сыворотке человека.
[00161] Образцы крови будут собирать для анализа циркулирующих растворимых факторов, в том числе растворимого PD-L1 (sPD-L1). В ходе фазы эскалации дозы уровни sPD-L1 будут оценивать на 1 день, 8 день (+ 1 день), 15 день (+ 1 день), 29 день (+ 3 дня), 57 день (+ 3 дня), 85 день (+ 3 дня), 113 день (+ 3 дня), 141 день (+ 3 дня), 169 день (+ 3 дня); 197 день (+ 3 дня), 225 день (+ 3 дня), 253 день (+ 3 дня), 281 день (+ 3 дня), 309 день (+ 3 дня), 337 день (+ 3 дня), в конце лечения, через 60 дней после окончания лечения и через 90 дней после окончания лечения. В ходе фазы увеличения дозы уровни sPD-L1 будут оценивать на 1 день, 29 день (+ 3 дня), 57 день (+ 3 дня), 85 день (+ 3 дня), 113 день (+ 3 дня), 141 день (+ 3 дня), 169 день (+ 3 дня); 197 день (+ 3 дня), 225 день (+ 3 дня), 253 день (+ 3 дня), 281 день (+ 3 дня), 309 день (+ 3 дня), 337 день (+ 3 дня), в конце лечения, через 60 дней после окончания лечения и через 90 дней после окончания лечения.
[00162] Оценки опухоли буду выполнять в ходе скрининга (от -28 дня до -1 дня), на 8 неделе (день 50+3 дня) и на 33 неделе (день 225+3 дня) в фазе эскалации дозы. Оценки опухоли будут основаны на методических указаниях RECIST v1.1 с модификациями и включают в себя следующие исследования: физическое обследование (с фотографиями и измерениями повреждений кожи, по необходимости), CT или MRI-сканирование грудной клетки, брюшной полости и таза; и CT или MRI-сканирование головного мозга. Компьютерную томографию или MRI-сканирование головного мозга проводят только при скрининге.
[00163] Оценки противоопухолевой активности основываются на измерении опухолевых очагов, оценивании целевых очагов, оценивании нецелевых очагов и появлении новых очагов.
Оценивание целевых очагов
[00164] Для оценивания целевых очагов полную ремиссию определяют как исчезновение всех целевых очагов. В любых патологических лимфатических узлах (либо целевых, либо нецелевых) должны наблюдать снижение по короткой оси до < 10 мм (сумма не может равняться «0», если узлы являются целевыми).
[00165] Для оценивания целевых очагов частичную ремиссию определяют как снижение по меньшей мере на 30% суммы диаметров целевых очагов, при этом эталоном считается исходная сумма диаметров.
[00166] Для оценивания целевых очагов прогрессирующее заболевание определяют как увеличение по меньшей мере на 20% суммы диаметров целевых очагов, при этом эталоном считается наименьшая сумма в исследовании (она включает в себя исходную сумму, если является наименьшей в исследовании). Кроме относительного увеличения на 20% по сумме также должно быть видно увеличение по меньшей мере на 5 мм. Появление одного или нескольких новых очагов также считают прогрессированием.
[00167] Для оценивания целевых очагов стабилизация заболевания (SD) не является достаточным сокращением, чтобы быть PR, ни достаточным усилением, чтобы быть PD, при этом эталоном считается наименьшая сумма диаметров в исследовании.
Оценивание нецелевых очагов
[00168] Для оценивания нецелевых очагов полную ремиссию (CR) определяют как исчезновение всех нецелевых очагов. Все лимфатические узлы должны составлять < 10 мм по короткой оси.
[00169] Для оценивания нецелевых очагов неполную ремиссию/непрогрессирующее заболевание определяют как сохранение одного или нескольких нецелевых очагов и/или поддерживание уровня опухолевого маркера выше нормальных пределов.
[00170] Для оценивания нецелевых очагов прогрессирующее заболевание определяют как общий уровень значительного ухудшения нецелевого заболевания таким образом, что даже при наличии SD или PR при целевом заболевании общая опухолевая масса увеличивается настолько, чтобы прекратить терапию. При отсутствии измеряемого заболевания изменение в неизмеряемом заболевании сравнивают по величине с повышением, которое требовалось бы для определения PD как измеряемого заболевания.
Новый очаг
[00171] Появление новых очагов считают PD согласно методическим указаниям RECIST v1.1. С учетом уникальных кинетических параметров ответа, которые наблюдали при иммунотерапии, новые очаги могут не отражать фактическое прогрессирование заболевания. При отсутствии быстрого клинического ухудшения субъекты могут продолжать получать лечение с помощью MEDI4736 и тремелимумаба.
Общий ответ
[00172] Подтверждение CR, PR, а также PD требует повторной последующей оценки не менее чем через 4 недели от даты первой регистрации. Оценивание общего ответа на основании оценивания целевого очага, нецелевого очага и нового очага определяют как в нижеприведенной таблице 1.
Таблица 1. Оценивание общего ответа
aОпределяются как нецелевые очаги на исходном уровне.
bНеподдающееся оценке определяют либо как отсутствие измерений, либо как выполнение только подгруппы измерений очага при оценке.
[00173] Неблагоприятные явления отслеживают после введения MEDI4736. Другие оценки включают в себя физическое обследование, мониторинг показателей жизненно важных функций и лабораторные измерения.
ПРИМЕР 2. Результаты
(a) ВКЛЮЧЕНИЕ И ПОСЛЕДУЮЩЕЕ НАБЛЮДЕНИЕ
[00174] Лечили двенадцать субъектов, по 3 субъекта в каждой из когорты 1a (1 мг/кг тремелимумаба и 3 мг/кг MEDI4736), когорты 2a (1 мг/кг тремелимумаба и 10 мг/кг MEDI4736), когорты 3a (1 мг/кг тремелимумаба и 15 мг/кг MEDI4736) и когорты 3b (3 мг/кг тремелимумаба и 10 мг/кг MEDI4736). Два субъекта в когорте 1a (один субъект отозвал согласие после 2 доз обоих средств) завершили примерно 115 дней последующего наблюдения; субъекты когорты 2a завершили примерно 56 дней последующего наблюдения; и субъекты когорт 3a и 3b завершили 28 дней последующего наблюдения (фигура 12).
(b) ФАРМАКОКИНЕТИКА
[00175] Фармакокинетические данные, полученные в результате введения MEDI4736 при 3 мг/кг и 10 мг/кг (в комбинации с 1 мг/кг тремелимумаба) подытожены на фигуре 4. Отдельные PK параметры, полученные в результате введения MEDI4736 показаны на фигуре 8. Среди этих начальных данных введения первой дозы средняя Cmax для субъектов, получающих 3 мг/кг MEDI4736, составляла 67,36 мкг/мл. Средняя AUCτ для субъектов, получающих 3 мг/кг MEDI4736, составляла 625,3 мкг/мл*день. Средняя Cостаточная для субъектов, получающих 3 мг/кг MEDI4736, составляла 8,85 мкг/мл. Средняя Cmax для субъектов, получающих 10 мг/кг MEDI4736, составляла 266,7 мкг/мл. Средняя AUCτ для субъектов, получающих 10 мг/кг MEDI4736, составляла 2860 мкг/мл*день. Средняя Cостаточная для субъектов, получающих 10 мг/кг MEDI4736, составляла 35,65 мкг/мл. MEDI4736 демонстрировал более чем пропорциональное дозе увеличение AUC, указывающее на нелинейную PK. См. фигуру 4.
[00176] Фармакокинетические данные, полученные в результате введения тремелимумаба при 1 мг/кг (в комбинации либо с 3 мг/кг MEDI4736, либо с 10 мг/кг MEDI4736) подытожены на фигуре 5. Отдельные PK параметры, полученные в результате введения тремелимумаба показаны на фигуре 9.
[00177] Средняя Cmax для субъектов, получающих 1 мг/кг тремелимумаба в комбинации с 3 мг/кг MEDI4736, составляла 27,07 мкг/мл. Средняя Cmax для субъектов, получающих 1 мг/кг тремелимумаба в комбинации с 10 мг/кг MEDI4736, составляла 30,40 мкг/мл.
[00178] Средняя AUCτ для субъектов, получающих 1 мг/кг тремелимумаба в комбинации с 3 мг/кг MEDI4736, составляла 262,2 мкг/мл*день. Средняя AUCτ для субъектов, получающих 1 мг/кг тремелимумаба в комбинации с 10 мг/кг MEDI4736, составляла 338,8 мкг/мл*день.
[00179] Средняя Cостаточная для субъектов, получающих 1 мг/кг тремелимумаба в комбинации с 3 мг/кг MEDI4736, составляла 4,21 мкг/мл. Средняя Cостаточная для субъектов, получающих 1 мг/кг тремелимумаба в комбинации с 10 мг/кг MEDI4736, составляла 5,33 мкг/мл.
(c) ОЦЕНКА РАСТВОРИМОГО PD-L1
[00180] Данные по sPD-L1, полученные в результате введения MEDI4736 при 3 и 10 мг/кг и тремелимумаба при 1 мг/кг, показаны на фигурах 6 (абсолютная концентрация), 7 и 8 (подавление, % от исходного уровня). После введения MEDI4736 наблюдали полное подавление sPD-L1 у 5 из 6 субъектов. У одного субъекта наблюдали подавление sPD-L1 примерно 65% после второй дозы MEDI4736.
(d) БЕЗОПАСНОСТЬ
[00181] Десять из двенадцати субъектов сообщали о возникшем во время лечения неблагоприятном явлении (TEAE). Наиболее часто сообщали о таких TEAE, как утомление (41,7%; 5 субъектов), повышенный уровень амилазы (25,0%; 3 субъекта), зуд и инфекция верхних дыхательных путей (16,7%; по 2 субъекта). Ни один субъект не испытывал ограничивающую дозу токсичность. У девяти из десяти субъектов, испытывающих TEAE, явления характеризовались 1 или 2 степенью тяжести. Один субъект (когорта 2a) имел повышенный уровень аспартатаминотрансферазы (AST) и повышенный уровень аланинаминотрансферазы (ALT) 3 степени и летальную (5 степени) миастению гравис. Двое из двенадцати субъектов испытывали возникшие во время лечения тяжелые неблагоприятные явления (SAE). Двое субъектов прекратили лечение из-за TEAE. На фигуре 13 показаны соответствующие неблагоприятные явления.
[00182] Начальные результаты, демонстрирующие изменение размера опухоли от исходного уровня, показаны на фигуре 14. Снижения размера опухоли наблюдали у пациентов в группах 1 мг/кг (T)+10 мг/кг (M), 1 мг/кг (T)+15 мг/кг (M) и 3 мг/кг (T)+10 мг/кг (M).
[00183] Это исследование показало, что MEDI4736 и тремелимумаб обладают благоприятными фармакокинетическими свойствами, и комбинация средств подавляет sPD-L1. Кроме того, MEDI4736 хорошо переносится большинством субъектов, получающих данное лечение.
ПРИМЕР 3. Фаза 1b открытого исследования MEDI4736 в комбинации
с тремелимумабом у пациентов с NSCLC на поздней стадии
[00184] Ингибиторные пути PD-L1 и CTLA-4 играют важную роль в контроле активации Т-клеток. MEDI4736 (M) представляет собой человеческое моноклональное антитело IgG1, которое блокирует PD-L1, связываясь с PD-1 и CD-80. Тремелимумаб (T) представляет собой человеческое моноклональное антитело IgG2, целенаправленно воздействующее на CTLA-4. И MEDI4736, и тремелимумаб демонстрировали обнадеживающие профили безопасности и многообещающую клиническую активность как отдельные средства; поскольку они блокируют различные взаимодействия, способствующие иммуносупрессии, терапия комбинацией MEDI4736+тремелимумаб может обеспечить большую противоопухолевую активность у пациентов (pts) с немелкоклеточным раком легкого на поздней стадии по сравнению с любым средством отдельно.
[00185] Данная фаза 1 исследования оценивает безопасность/переносимость, противоопухолевую активность, фармакокинетику (PK) и иммуногенность терапии комбинацией MEDI4736+тремелимумаб у пациентов с NSCLC на поздней стадии. Исследование состоит из фаз эскалации дозы и увеличения дозы.
[00186] Результаты. На 4 декабря 2014 года лечили 61 пациента (таблица 2).
Таблица 2
MEDI4736 (M)+тремелимумаб (T)
Q4W=каждые 4 недели; Q2W=каждые 2 недели
[00187] В целом, наиболее часто связанными с лекарственным средством AE всех степеней (≥10% pts) были диарея, утомляемость, зуд, повышенные уровни аланинтрансаминазы (ALT) и амилазы; которые контролировали согласно методическим указаниям по стандартному лечению, предусматривающему стероиды. Наиболее частыми связанными с лекарственным средством AE степени≥3 (≥5%) у всех пациентов были колит, диарея, повышенные уровни аспартатаминотрансферазы (AST) и ALT. Связанными с лекарственным средством AE, приводящими к прекращению, были колит (6,6%), диарея (3,3%), пневмония (3,3%), повышенные уровни AST (3,3%) и ALT (1,6%), кашель (1,6%) и одышка (1,6%); произошла 1 связанная с лечением смерть (полимиозит) в когорте 10 мг/кг M q4w+1 мг/кг T. Из 31 субъекта по меньшей мере при одном сканировании в 8 недель наилучший общий ответ регистрировали у 8 пациентов (26%); стабилизацию заболевания регистрировали у 11 pts (36%).
[00188] Эти многообещающие результаты указывают на то, что комбинация MEDI4736+тремелимумаб характеризуется контролируемым профилем безопасности и ранней клинической активностью.
[00189] Результаты. На 27 января 2015 года лечили 74 пациента в 10 когортах (таблица 3).
Таблица 3
Демографические и исходные характеристики

Таблица 3 (продолжение)
Таблица 3 (продолжение)

[00190] Исследовали разные дозы и графики для MEDI4736 и тремелимумаба, вводимых в комбинации (фигура 15). Дозы и графики для MEDI4736 предусматривали 3 мг/кг, 10 мг/кг, 15 мг/кг и 20 мг/кг каждые 4 недели (q4w) и 10 мг/кг каждые 2 недели (q2w). Дозы и графики для тремелимумаба предусматривали 1 мг/кг, 3 мг/кг и 10 мг/кг каждые 4 недели (q4w x 6 доз) и каждые 12 недель (q12w x 3 дозы).
[00191] Наблюдали полное подавление sPD-L1 при дозах≥15 мг/кг Q4W MEDI4736 (фигура 16). У одного субъекта в каждой группе 10 мг/кг Q4W и 15 мг/кг Q4W наблюдали частичное подавление sPD-L1 во время некоторых визитов с последующим полным подавлением после повторного введения дозы. У одного субъекта после 15 мг/кг Q4W не наблюдали подавление на 29 день. Для сравнения, полное подавление наблюдали с одиночным средством MEDI4736 (исследование 1108) при дозах > 3 мг/кг Q2W. При исследовании отдельных профилей sPD-L1 наблюдали полное подавление sPD-L1 у > 95% субъектов после дозы 10 мг/кг Q2W (фигура 17).
[00192] Также наблюдали повышенную пролиферацию Т-клеток при введении MEDI4736 и тремелимумаба в комбинации (фигура 18). Клетки сортировали с помощью анализа FACS по маркерам CD4 и CD8 в комбинации с Ki67, маркером пролиферации клеток. Наблюдали неизменное возрастание пика CD4+Ki67+ клеток с увеличением дозы тремелимумаба, которое было больше возрастания пика CD4+Ki67+, наблюдаемого только с MEDI4736. Пролиферативный ответ CD8+ был больше с комбинациями MEDI4736 и тремелимумаба, чем только с MEDI4736.
[00193] Увеличения CD4 ICOS+ и CD4 HLADR+ клеток наблюдали у субъектов, получающих MEDI4736 и тремелимумаб, по сравнению только с MEDI4736 (фигура 19). Наименьшие изменения в уровнях CD4+ICOS+ клеток и CD4+HLADR+ клеток наблюдали только с MEDI4736, и все тестируемые дозы комбинации характеризовались паттерном, отличимым от MEDI4736. Максимальные увеличения CD4+ICOS+ клеток и CD4+HLADR+ клеток наблюдали с дозой 10 мг/кг тремелимумаба. Увеличение CD4+ эффекторных Т-клеток и регуляторных Т-клеток (фенотип CD25hi CD127lo также может включать в себя некоторые активированные Т-клетки) также наблюдали у субъектов, получающих MEDI4736 и тремелимумаб, по сравнению только с MEDI4736 (фигуры 20 и 21).
[00194] Клиническую активность при NSCLC наблюдали при лечении с помощью MEDI4736 и тремелимумаба (все дозы), показывающем повышения частоты общего ответа, по сравнению с лечением с помощью MEDI4736 в виде монотерапии (10 мг/кг Q2W) (фигура 22). Ответ был оцениваемым у получавших лечение пациентов с измеряемым заболеванием при исходном уровне+≥1, последующее сканирование (в том числе прекращения из-за прогрессирования заболевания или смерти до первого последующего сканирования). Для MEDI4736 NSCLC (CP1108) включали пациентов только с≥12-недельным последующим наблюдением. Частота общего ответа (ORR) предусматривала подтвержденную и неподтвержденную полную ремиссию (CR) или частичную ремиссию (PR). Для MEDI4736 NSCLC в виде монотерапии (CP1108, 10 мг/кг Q2W) наблюдали лучший общий ответ (BOR) как стабильное заболевание (SD) с наименьшей продолжительностью 12 недель. Для комбинации MEDI4736 и тремелимумаба наблюдали BOR как SD с наименьшей продолжительностью 7 недель.
[00195] Снижение или стабилизацию размера опухоли наблюдали у большей части пациентов с NSCLC, которым вводили MEDI4736 и тремелимумаб при дозах тремелимумаба 1 мг/кг, 3 мг/кг и 10 мг/кг (фигура 23). Возникновение неблагоприятных явлений 3 степени показало, что повышение дозы тремелимумаба также уменьшало время возникновения неблагоприятного явления (фигура 24). Снижение или стабилизацию размера опухоли наблюдали у большей части пациентов с NSCLC, которым вводили MEDI4736 и тремелимумаб при дозах MEDI4736 10 мг/кг, 315 мг/кг и 20 мг/кг при Q4W или 10 мг/кг при Q2W (фигура 25). Возникновение неблагоприятных явлений 3 степени показало, что повышение дозы тремелимумаба влияет на время возникновения неблагоприятного явления, в отличии от повышения дозировки MEDI4736 (фигура 26). Таким образом, при выборе доз MEDI4736 и тремелимумаба следует принимать во внимание эффективность и безопасность.
[00196] Данные воздействия тремелимумаба в виде отдельного средства в терапии рака подтверждают, что максимальной эффективности необходимы воздействия более высокой дозы (> 30 мг/мл). Такие уровни достигают в среднем при дозах > 3 мг/кг. Предполагается, что воздействие, достигаемое после тремелимумаба при 1 мг/кг, будет давать меньшую токсичность, чем при 3 мг/кг, на основании анализа взаимосвязей воздействия отдельного средства и безопасности. Без привязывания к определенной теории, тремелимумаб при 1 мг/кг частично ингибирует CTLA4, хотя опосредованное иммунной системой побочное действие все еще наблюдаются при 1 мг/кг (пусть даже и при более низкой частоте возникновения). Тремелимумаб при 1 мг/кг может быть оптимальным в комбинации с MEDI4736, если наблюдают синергическую эффективность, и улучшается профиль безопасности относительно более высоких доз тремелимумаба.
[00197] В одном исследовании наблюдали полное подавление достаточного растворения PD-L1 и sPD-L1 в сыворотке при дозах > 3 мг/кг Q2W MEDI4736. Дозу 10 мг/кг Q2W выбрали для применения в виде отдельного средства на основании достижения >99% насыщения достаточного растворения у большей части субъектов с уровнями лекарственного средства, обеспечивающими максимальное ингибирование роста опухоли (TGI) на мышиных моделях (100 мг/мл идентифицировали как наименьшая целевая остаточная концентрация). После 10 мг/кг Q4W в комбинации с тремелимумабом у некоторых субъектов наблюдали подавление sPD-L1. Плотность дозы была боле высокой с MEDI4736 Q2W, а Cmax была более высокой при Q4W. График с Q4W может обеспечивать большее удобство. У других субъектов наблюдали неполное подавление, возможно из-за повышенной регуляции PD-L1 в комбинации с субоптимальными остаточными уровнями, достигаемыми при этом уровне дозы. MEDI4736 при 10 мг/кг Q4W, оцениваемое в комбинации с тремелимумабом, обеспечивало остаточные концентрации ниже целевых в 100 мг/мл. Однако целевых уровней достигали с MEDI4736 при 15 и 20 мг/кг Q4W, и более высокие дозы MEDI4736 поддерживали подавление sPD-L1 у всех субъектов, оцениваемых на данный момент. MEDI4736 при 10 мг/кг или выше может быть оптимальным в комбинации с тремелимумабом, если наблюдают синергическую эффективность, и улучшается профиль безопасности.
[00198] В целом, тенденцией комбинации MEDI4736 и тремелимумаба было снижение или стабилизация заболевания по сравнению с MEDI4736 в виде монотерапии, и MEDI4736, и тремелимумаб при наивысших тестируемых дозах ассоциировались с увеличением числа случаев неблагоприятных явлений. (Фигуры 27-29). Эти результаты указывают на то, что комбинация MEDI4736 и тремелимумаб хорошо переносится и обладает потенциалом эффективной терапии для NSCLC.
ПРИМЕР 4. Лечение отрицательных по PD-L1 опухолей при NSCLC с помощью MED14736 и тремелимумаба
[00199] Лечили двенадцать субъектов, по 3 субъекта в каждой из когорты 1a (1 мг/кг тремелимумаба и 3 мг/кг MEDI4736), когорты 2a (1 мг/кг тремелимумаба и 10 мг/кг MEDI4736), когорты 3a (1 мг/кг тремелимумаба и 15 мг/кг MEDI4736) и когорты 3b (3 мг/кг тремелимумаба и 10 мг/кг MEDI4736). Два субъекта в когорте 1a (один субъект отозвал согласие после 2 доз обоих средств) завершили около 115 дней последующего наблюдения; субъекты когорты 2a завершили около 56 дней последующего наблюдения; и субъекты когорт 3a и 3b завершили 28 дней последующего наблюдения.
[00200] Данные исходных уровней экспрессии PD-L1 опухолью для 7 субъектов в исследовании представлены в таблице 4 (ниже). Дополнительная информация представлена в таблице 5. 
Таблица 5
[00201] Испытуемую ткань пациентов с NSCLC характеризовали в отношении экспрессии PD-L1 при помощи иммуногистохимии в фиксированных в формалине и парафине образцах ткани. Образец определяли как «положительный по PD-L1», если образец содержал 25% или больше клеток опухоли с PD-L1 окрашиванием мембраны. Это выражают как (M)-балл иммуногистохимии мембраны. Все образцы оценивали как «отрицательные» в отношении экспрессии PD-L1. Доступны оценки опухоли 6 из 7 пациентов. Этих пациентов лечили комбинацией тремелимумаба и MEDI4736.
[00202] Двоих пациентов идентифицировали как неподтвержденных пациентов с частичной ремиссией (PR), двое характеризовались стабилизацией заболевания (SD), и двое имели прогрессирующее заболевание (PD). У всех 6 пациентов собирали образцы опухоли за > 6 месяцев до анализа в отношении экспрессии PD-L1, и 3 из 6 образцов биоптата собирали за более чем 2 года до анализа. Эти данные указывают на то, что комбинация MEDI4736 и тремелимумаба является активной при отрицательном по PD-L1 NSCLC на основании хранимых образцов ткани.
[00203] При введении MEDI4736 и тремелимумаба большинство пациентов с отрицательным по PD-L1 NSCLC отвечали на комбинационную терапию, и у них наблюдали снижения или стабилизацию размера опухоли по сравнению с MEDI4736 в виде монотерапии (CP1108, 10 мг/кг Q2W) (фигура 30). Пациенты с положительным по PD-L1 NSCLC также отвечали на комбинацию MEDI4736 и тремелимумаба в отличии от MEDI4736 в виде монотерапии, и у них наблюдали снижения или стабилизацию размера опухоли (фигура 31). При группировке результатов пациентов с отрицательным по PD-L1 NSCLC по дозе тремелимумаба 1 мг/кг тремелимумаба или 3 мг/кг тремелимумаба, вводимого в комбинации с MEDI4736 при 10 мг/кг Q4W или 15 мг/кг Q4W, были эффективными в контроле или ослаблении заболевания (фигура 32). При группировке результатов по дозе MEDI4736 результаты также показывали, что тремелимумаб при 1 мг/кг - 3 мг/кг, вводимый в комбинации с MEDI4736 при 10 мг/кг Q4W - 15 мг/кг Q4W, был эффективным в контроле или ослаблении заболевания (фигура 33). Анализ всех пациентов с NSCLC, получающих MEDI4736 и тремелимумаб, показал, что пациенты с PD-L1- и PD-L1+ NSCLC отвечали на лечение (фигуры 34A-34D и 35-37; таблицы 6-9).
Таблица 6
Лучший общий ответ - все оцениваемые субъекты
Отвечающая оцениваемая популяция
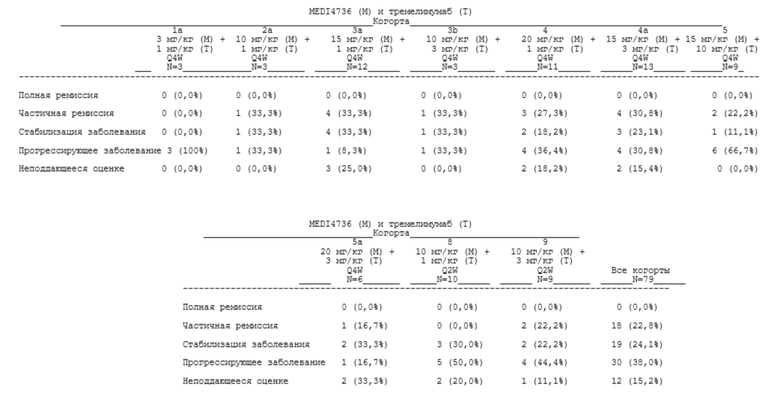
Таблица 7
Лучший общий ответ - положительные по PD-L1 субъекты
Отвечающая оцениваемая популяция
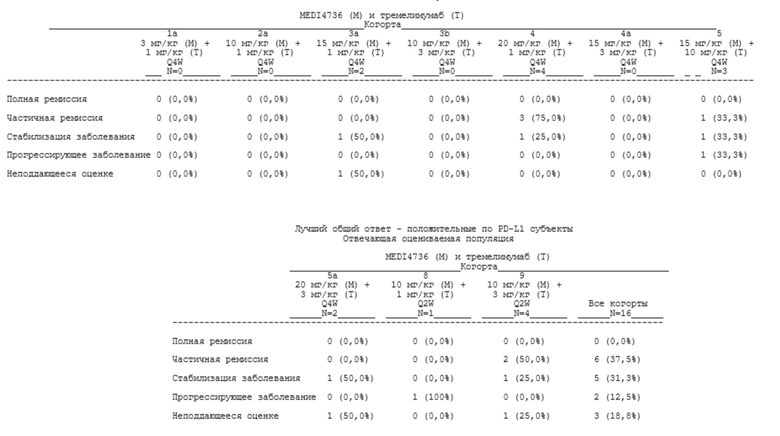
Таблица 8
Лучший общий ответ - отрицательные по PD-L1 субъекты
Отвечающая оцениваемая популяция
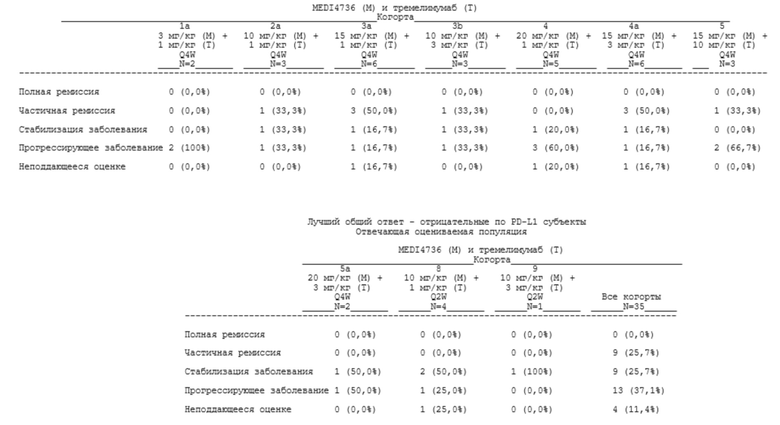
Таблица 9
Лучший общий ответ - NA по PD-L1 субъекты
Отвечающая оцениваемая популяция
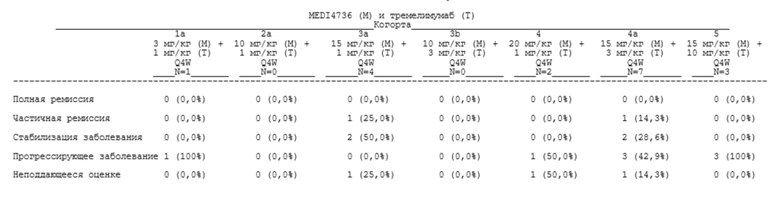
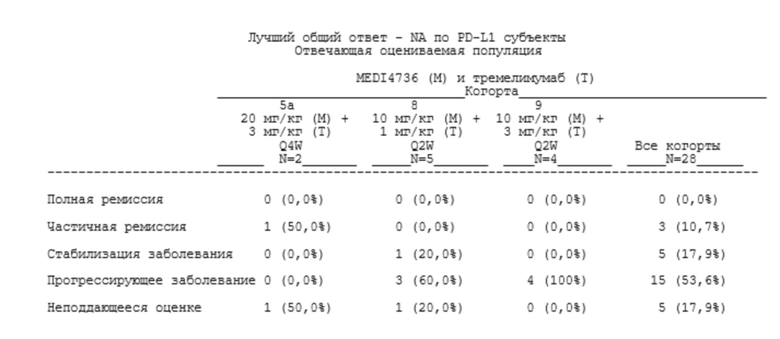
[00204] Для специалистов в данной области будут очевидны многочисленные эквиваленты конкретных аспектов раскрытия, описанного в настоящем документе, или они смогут определить их с использованием не более чем обычного проведения экспериментов. Подразумевают, что такие эквиваленты охвачены приведенной далее формулой изобретения.
[00205] В настоящем документе цитируются различные публикации, раскрытие которых включено посредством ссылки в полном объеме.
[00206] Хотя вышеприведенное изобретение описано с некоторыми подробностями в качестве иллюстрации и примера для облегчения понимания, будет очевидно, что некоторые изменения и модификации могут быть осуществлены в пределах объема прилагаемой формулы изобретения.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 MEDI4736 VL
EIVLTQSPGTLSLSPGERATLSCRASQRVSSSYLAWYQQKPGQAPRLLIYDASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGSLPWTFGQGTKVEIK
SEQ ID NO:2 MEDI4736 VH
EVQLVESGGGLVQPGGSLRLSCAASGFTFSRYWMSWVRQAPGKGLEWVANIKQDGSEKYYVDSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCAREGGWFGELAFDYWGQGTLVTVSS
SEQ ID NO:3 - MEDI4736 VH CDR1
RYWMS
SEQ ID NO:4 - MEDI4736 VH CDR2
NIKQDGSEKYYVDSVKG
SEQ ID NO:5 - MEDI4736 VH CDR3
EGGWFGELAFDY
SEQ ID NO:6 - MEDI4736 VL CDR1
RASQRVSSSYLA
SEQ ID NO:7 - MEDI4736 VL CDR2
DASSRAT
SEQ ID NO:8 - MEDI4736 VL CDR3
QQYGSLPWT
SEQ ID NO:9 VL тремелимумаба
PSSLSASVGDRVTITCRASQSINSYLDWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYSTPFTFGPGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKV
SEQ ID NO:10 VH тремелимумаба
GVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAVIWYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDPRGATLYYYYYGMDVWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVH
SEQ ID NO:11 - CDR1 VH тремелимумаба
GFTFSSYGMH
SEQ ID NO:12 - CDR2 VH тремелимумаба
VIWYDGSNKYYADSV
SEQ ID NO:13 - CDR3 VH тремелимумаба
TAVYYCARDPRGATLYYYYYGMDV
SEQ ID NO:14 - CDR1 VL тремелимумаба
RASQSINSYLD
SEQ ID NO:15 - CDR2 VL тремелимумаба
AASSLQS
SEQ ID NO:16 - CDR3 VL тремелимумаба
QQYYSTPFT
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MEDIMMUNE LIMITED
<120> АНТИТЕЛА К B7-H1 И К CTLA-4 ДЛЯ ЛЕЧЕНИЯ НЕМЕЛКОКЛЕТОЧНОГО
РАКА ЛЕГКОГО
<130> TRB7-100WO1
<140>
<141>
<150> 62/114336
<151> 2015-02-10
<150> 62/105992
<151> 2015-01-21
<150> 61/992658
<151> 2014-05-13
<160> 16
<170> PatentIn версии 3.5
<210> 1
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 1
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Arg Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Asp Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Leu Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 2
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Gly Trp Phe Gly Glu Leu Ala Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 3
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 3
Arg Tyr Trp Met Ser
1 5
<210> 4
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 4
Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val Lys
1 5 10 15
Gly
<210> 5
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
полипептид"
<400> 5
Glu Gly Gly Trp Phe Gly Glu Leu Ala Phe Asp Tyr
1 5 10
<210> 6
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
полипептид"
<400> 6
Arg Ala Ser Gln Arg Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 7
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 7
Asp Ala Ser Ser Arg Ala Thr
1 5
<210> 8
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 8
Gln Gln Tyr Gly Ser Leu Pro Trp Thr
1 5
<210> 9
<211> 139
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
полипептид"
<400> 9
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
1 5 10 15
Arg Ala Ser Gln Ser Ile Asn Ser Tyr Leu Asp Trp Tyr Gln Gln Lys
20 25 30
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln
35 40 45
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
50 55 60
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
65 70 75 80
Cys Gln Gln Tyr Tyr Ser Thr Pro Phe Thr Phe Gly Pro Gly Thr Lys
85 90 95
Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
100 105 110
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
115 120 125
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
130 135
<210> 10
<211> 167
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
полипептид"
<400> 10
Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser
1 5 10 15
Gly Phe Thr Phe Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro
20 25 30
Gly Lys Gly Leu Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Asn
35 40 45
Lys Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
50 55 60
Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
65 70 75 80
Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asp Pro Arg Gly Ala Thr Leu
85 90 95
Tyr Tyr Tyr Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His
165
<210> 11
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 11
Gly Phe Thr Phe Ser Ser Tyr Gly Met His
1 5 10
<210> 12
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220 источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 12
Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
1 5 10 15
<210> 13
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 13
Thr Ala Val Tyr Tyr Cys Ala Arg Asp Pro Arg Gly Ala Thr Leu Tyr
1 5 10 15
Tyr Tyr Tyr Tyr Gly Met Asp Val
20
<210> 14
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 14
Arg Ala Ser Gln Ser Ile Asn Ser Tyr Leu Asp
1 5 10
<210> 15
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 15
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 16
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический
пептид"
<400> 16
Gln Gln Tyr Tyr Ser Thr Pro Phe Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К В7-Н1 И К CTLA-4 ДЛЯ ЛЕЧЕНИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО | 2015 |
|
RU2702332C2 |
| АНТИТЕЛА К B7-H1 ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2014 |
|
RU2817281C2 |
| КОМБИНАЦИЯ | 2015 |
|
RU2744841C2 |
| РЕЖИМ ДОЗИРОВАНИЯ АВЕЛУМАБА ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2017 |
|
RU2777363C2 |
| СПОСОБЫ, ТЕРАПИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2021 |
|
RU2831425C1 |
| КОМБИНИРОВАННЫЕ СПОСОБЫ ЛЕЧЕНИЯ АНТАГОНИСТАМИ PD-L1 | 2016 |
|
RU2766890C2 |
| КОМБИНАЦИЯ АНТИ-PD-L1 АНТИТЕЛА И ИНГИБИТОРА ДНК-ПК ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2765997C2 |
| ПРИМЕНЕНИЕ ИММУНОКОНЪЮГАТОВ К CEACAM5 ДЛЯ ЛЕЧЕНИЯ РАКА ЛЕГКОГО | 2020 |
|
RU2828374C2 |
| КОМБИНАЦИЯ АНТАГОНИСТА PD-1, ИНГИБИТОРА ТИРОЗИНКИНАЗЫ VEGFR/FGFR/RET И ИНГИБИТОРА CBP/БЕТА-КАТЕНИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2020 |
|
RU2838452C1 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745707C2 |
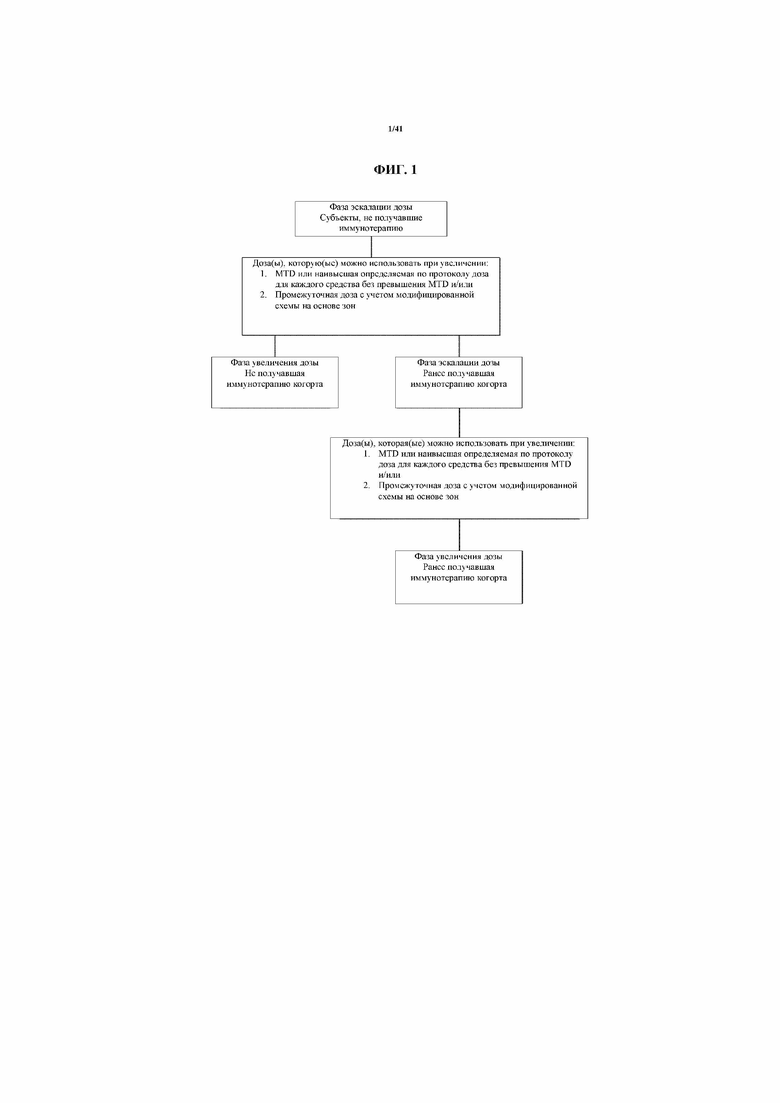
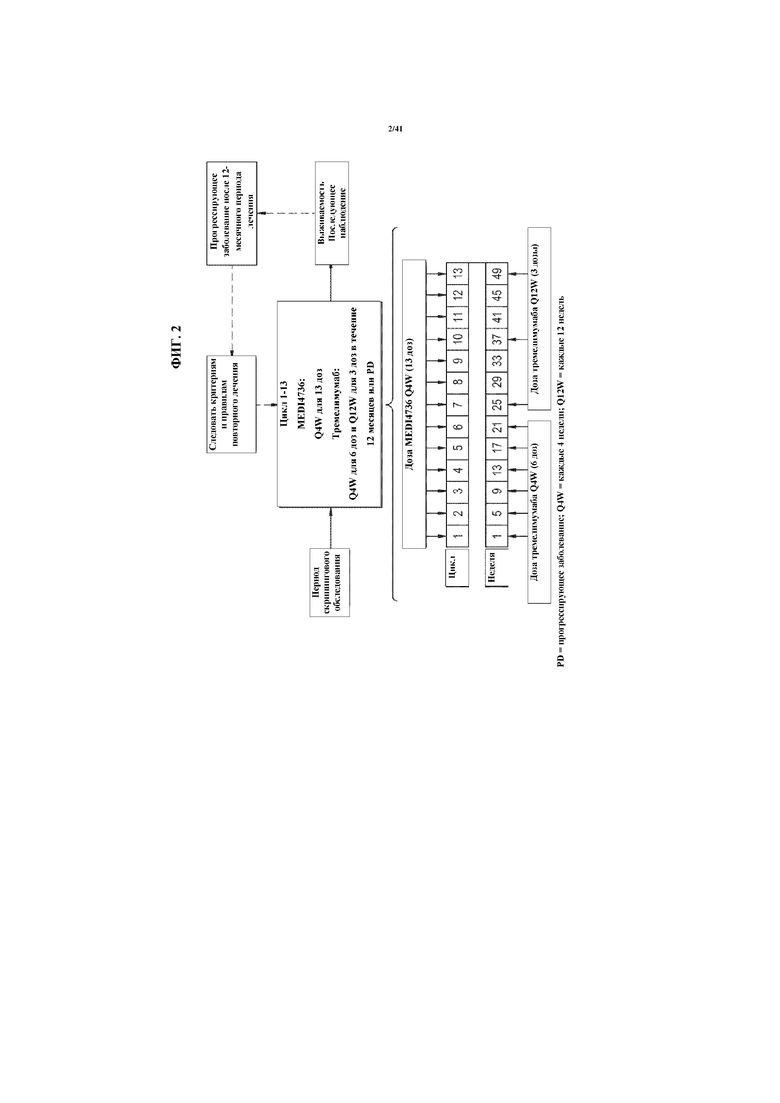
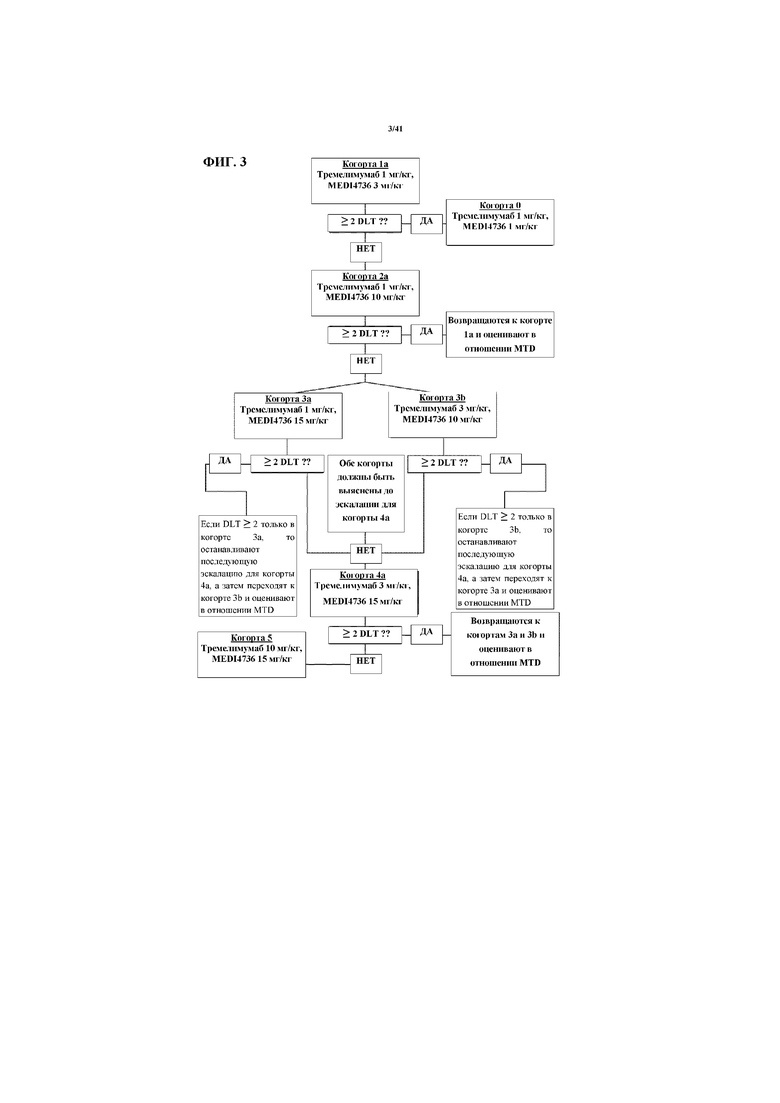
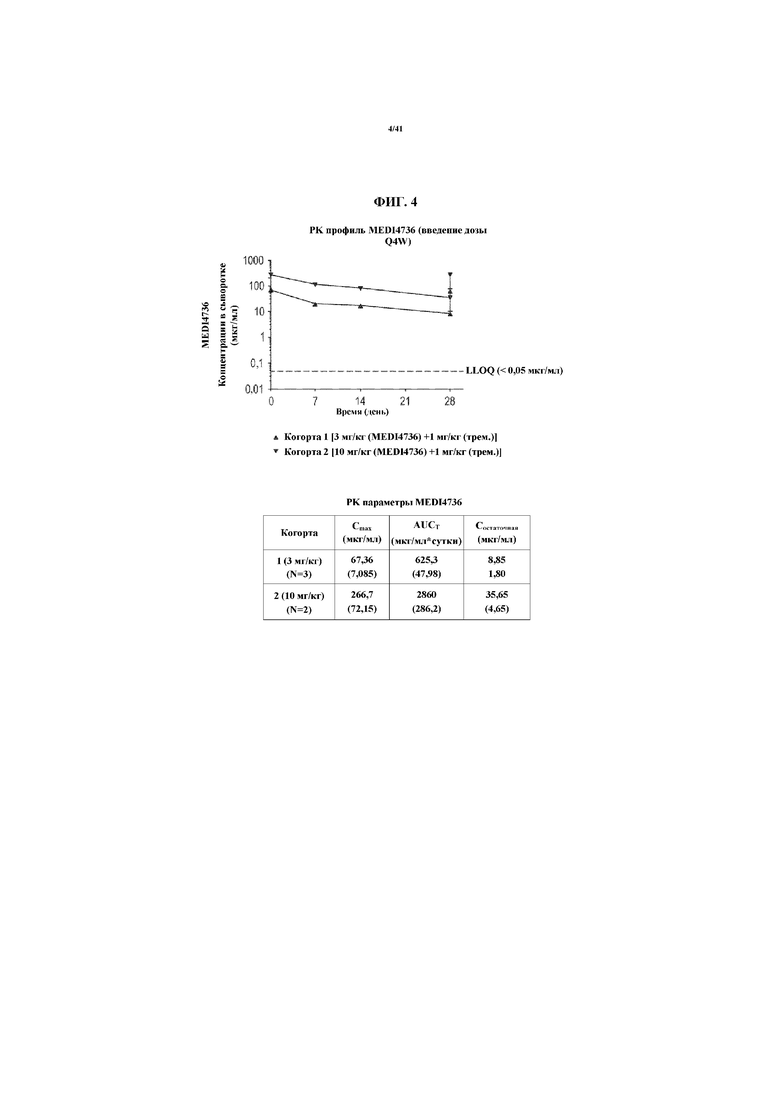


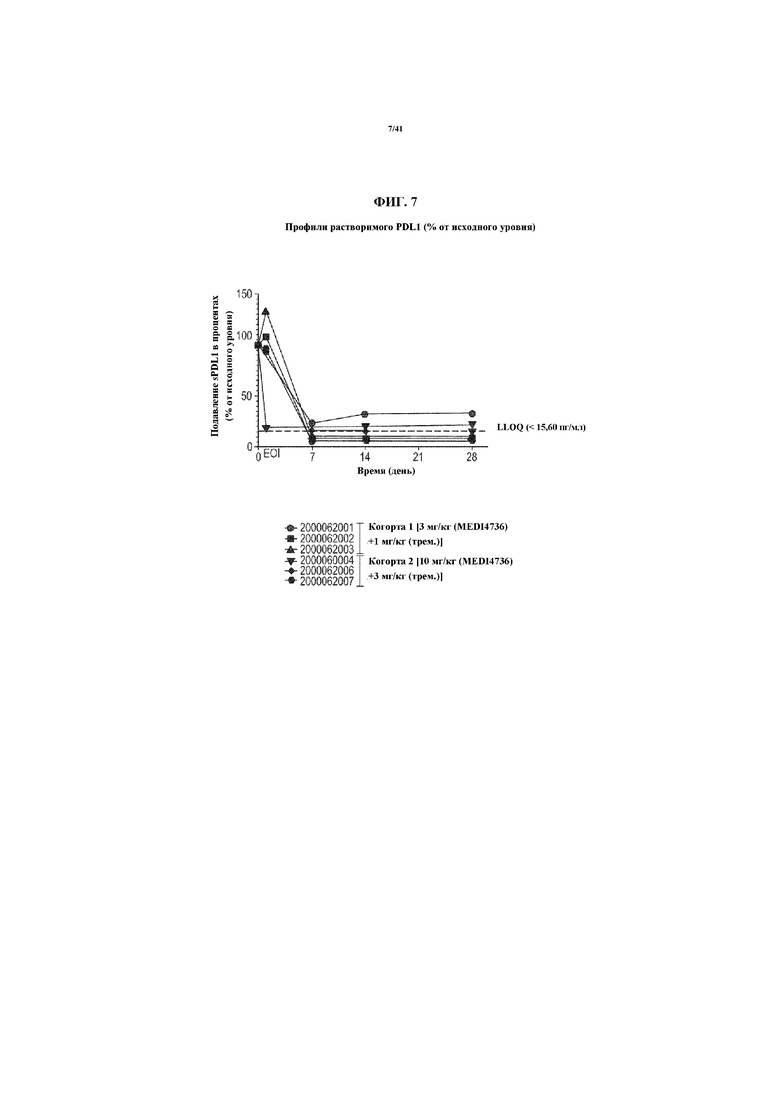





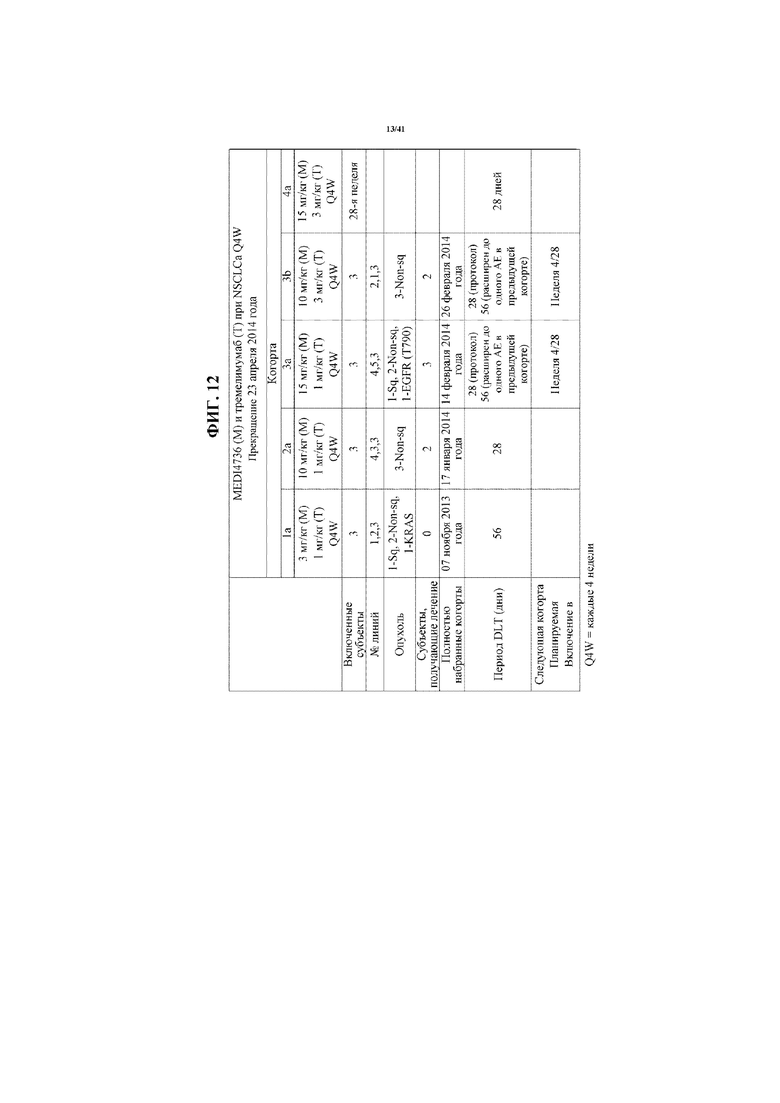
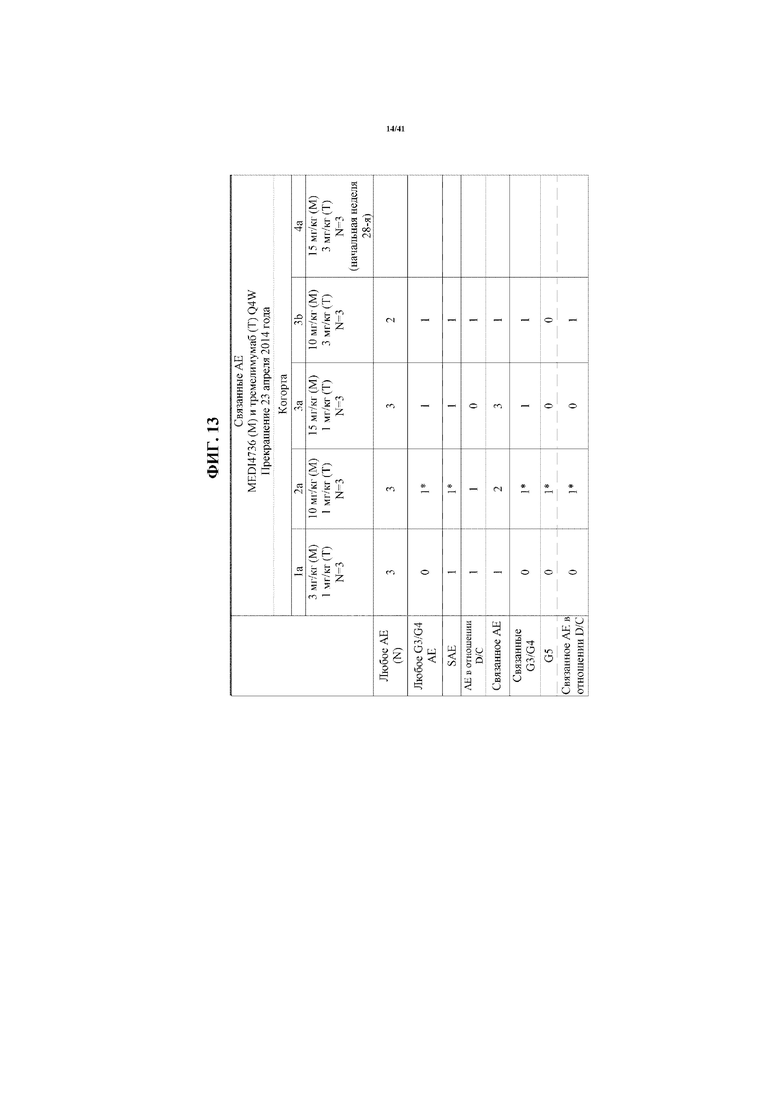
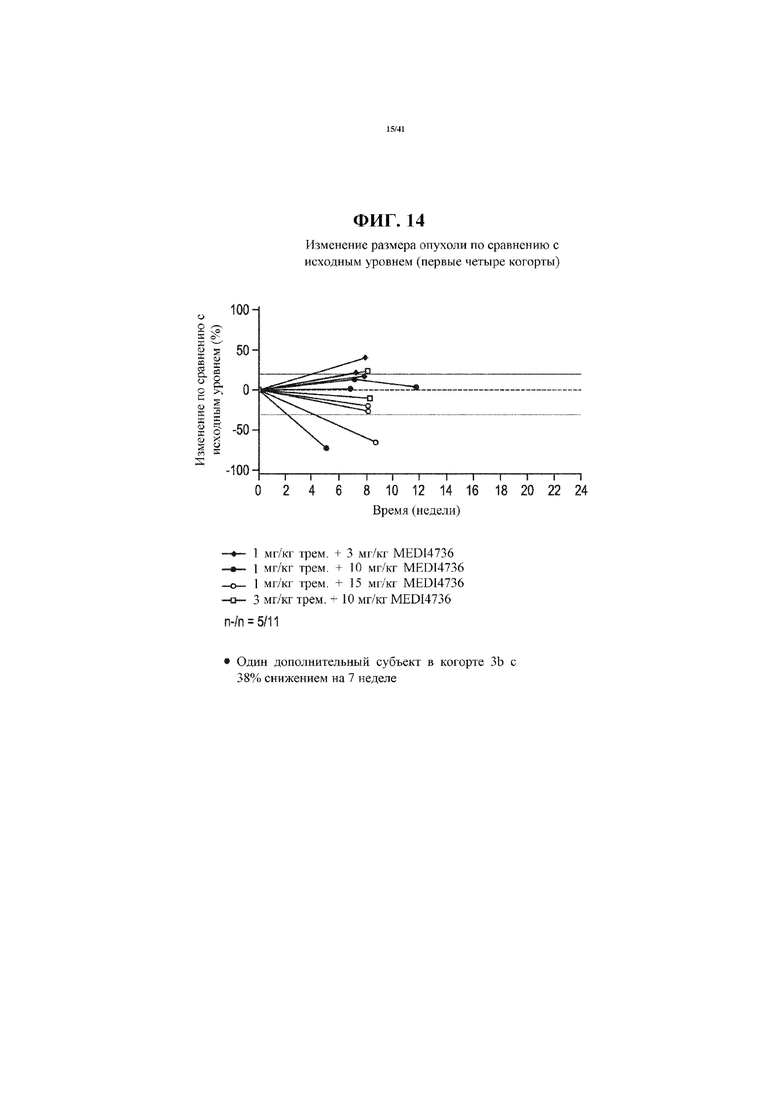
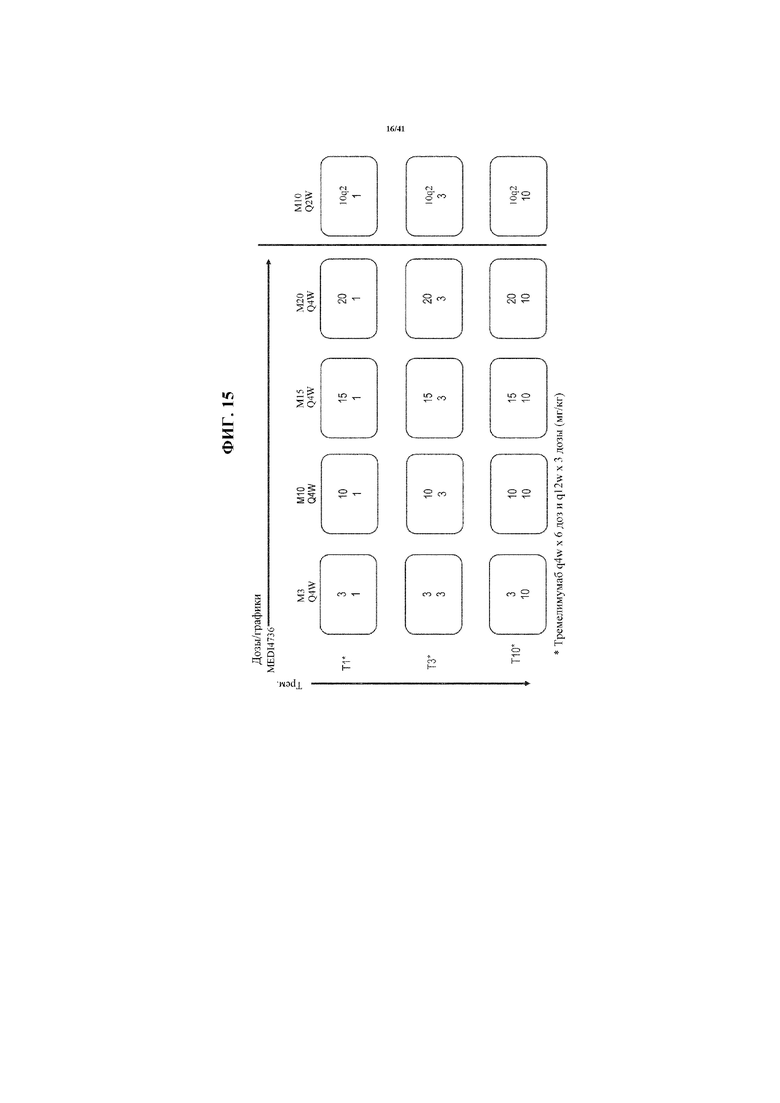
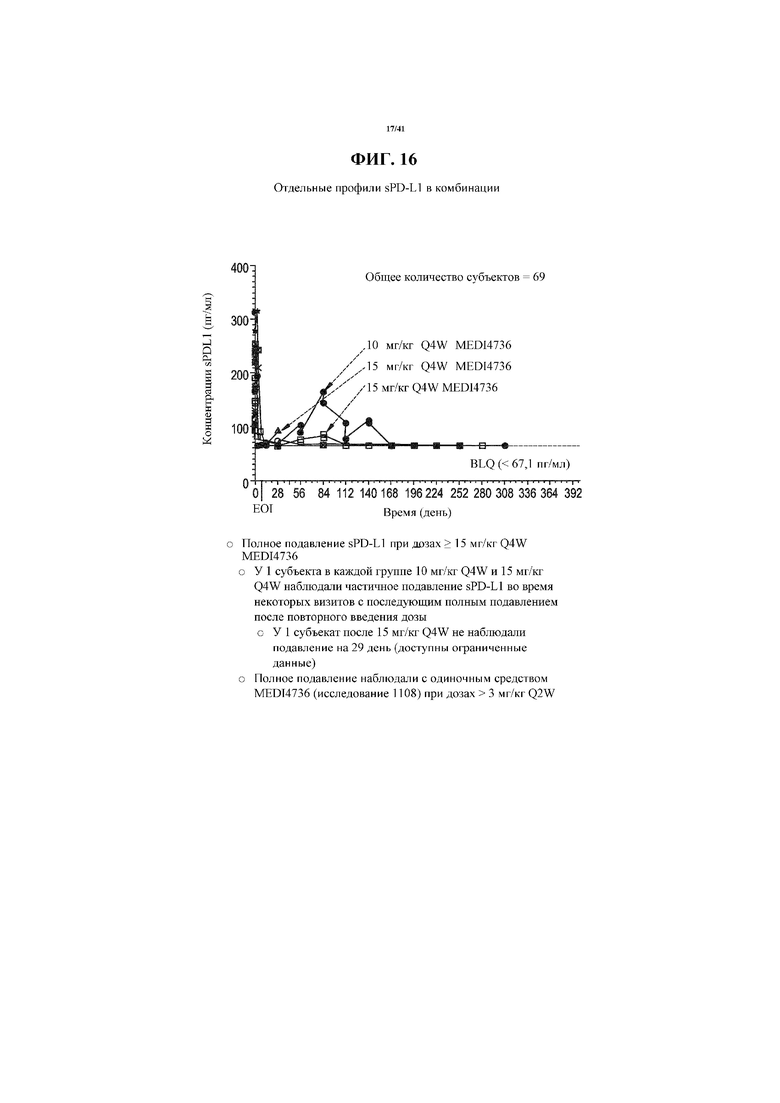

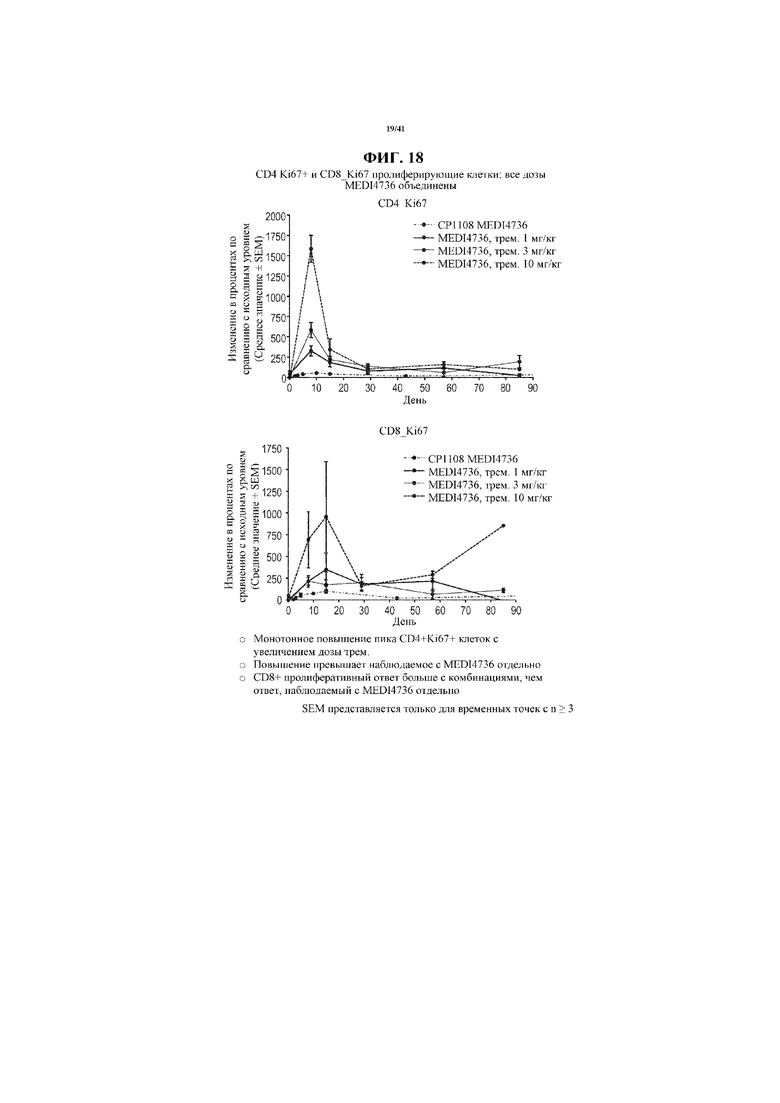
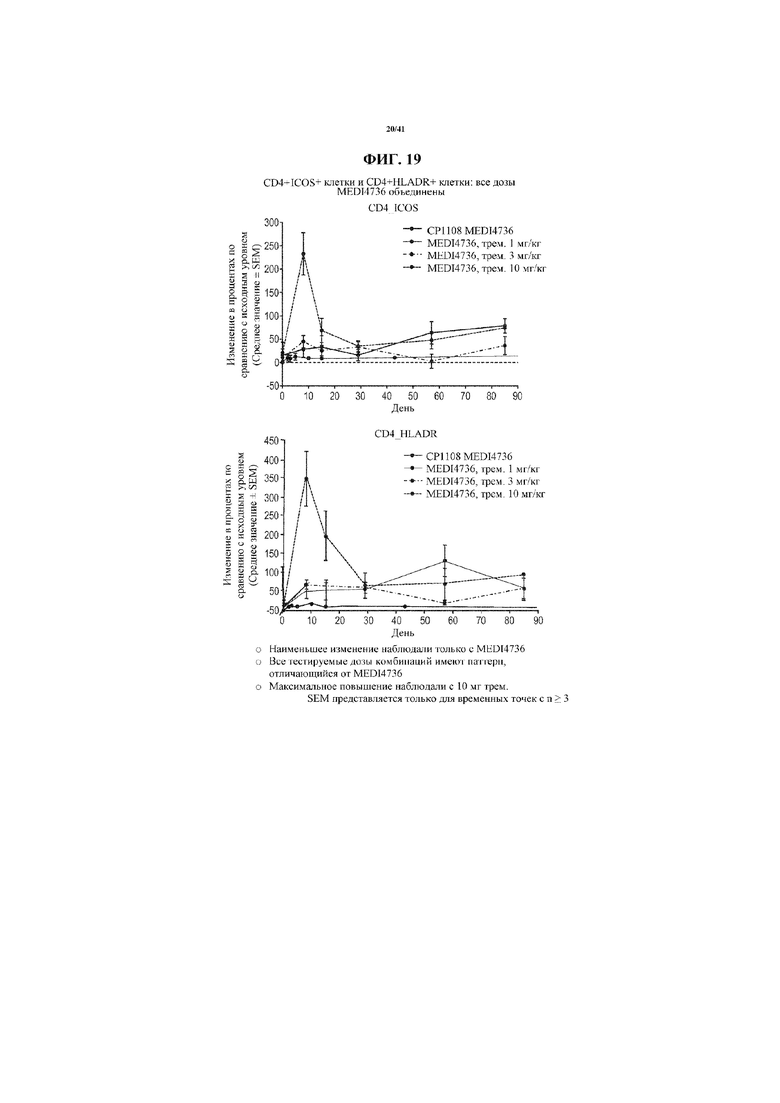
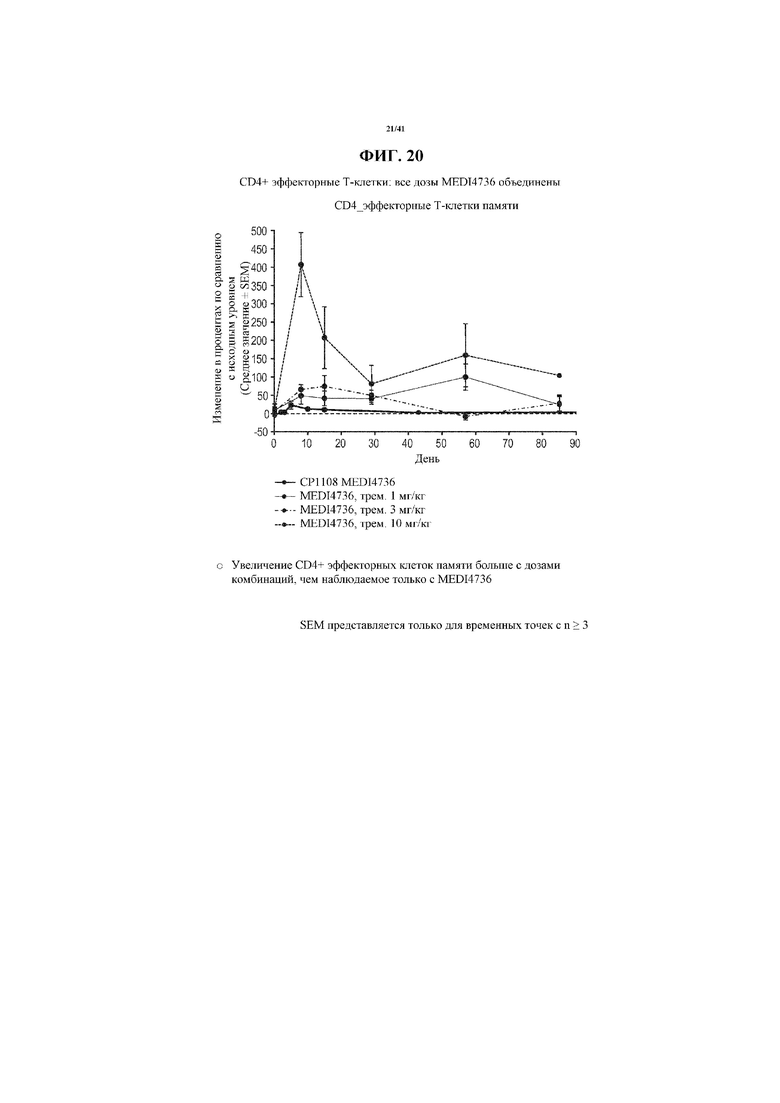
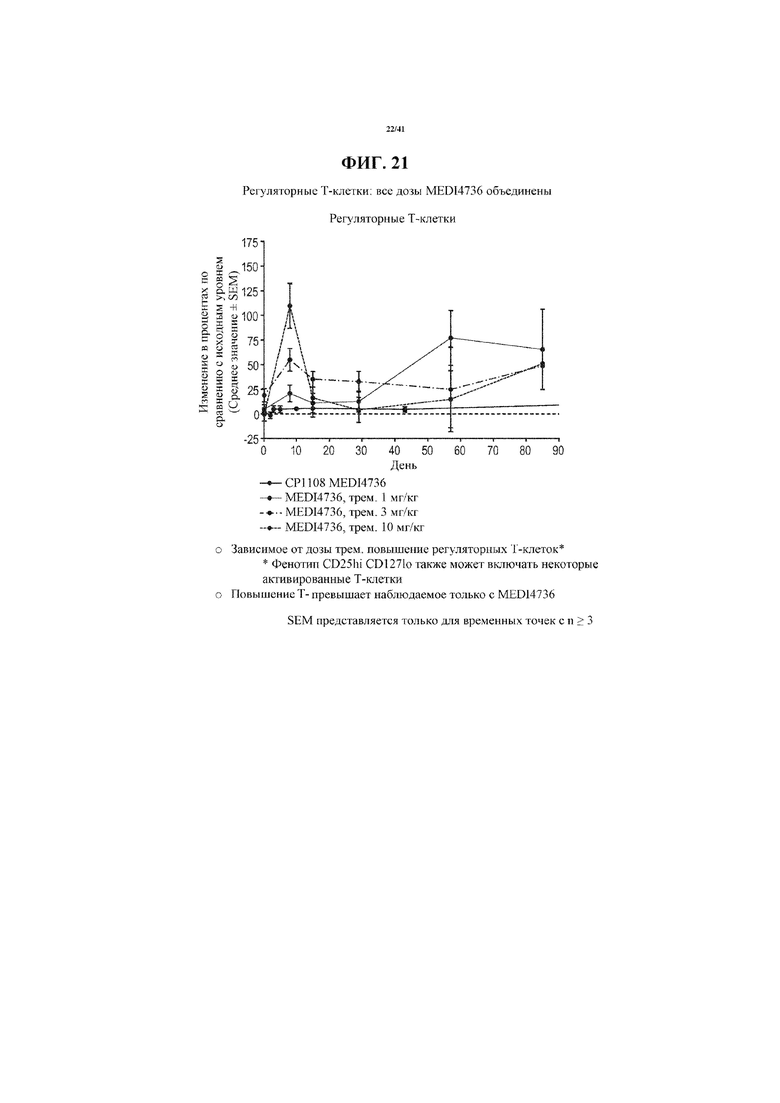
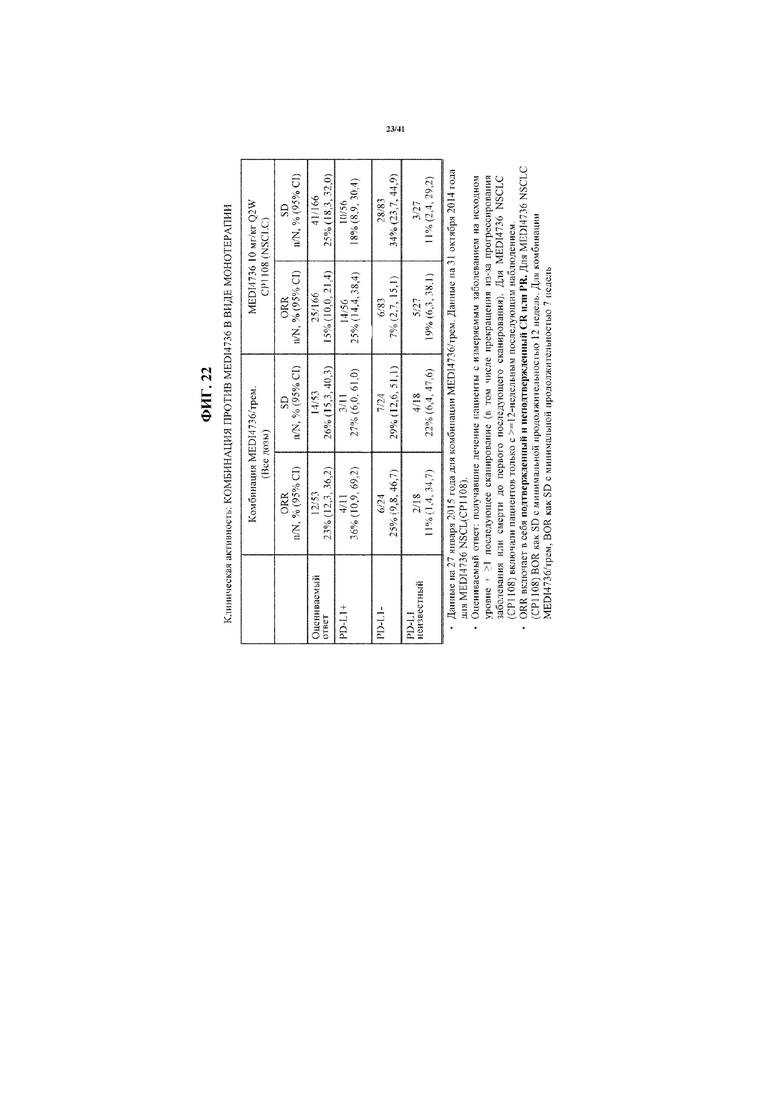
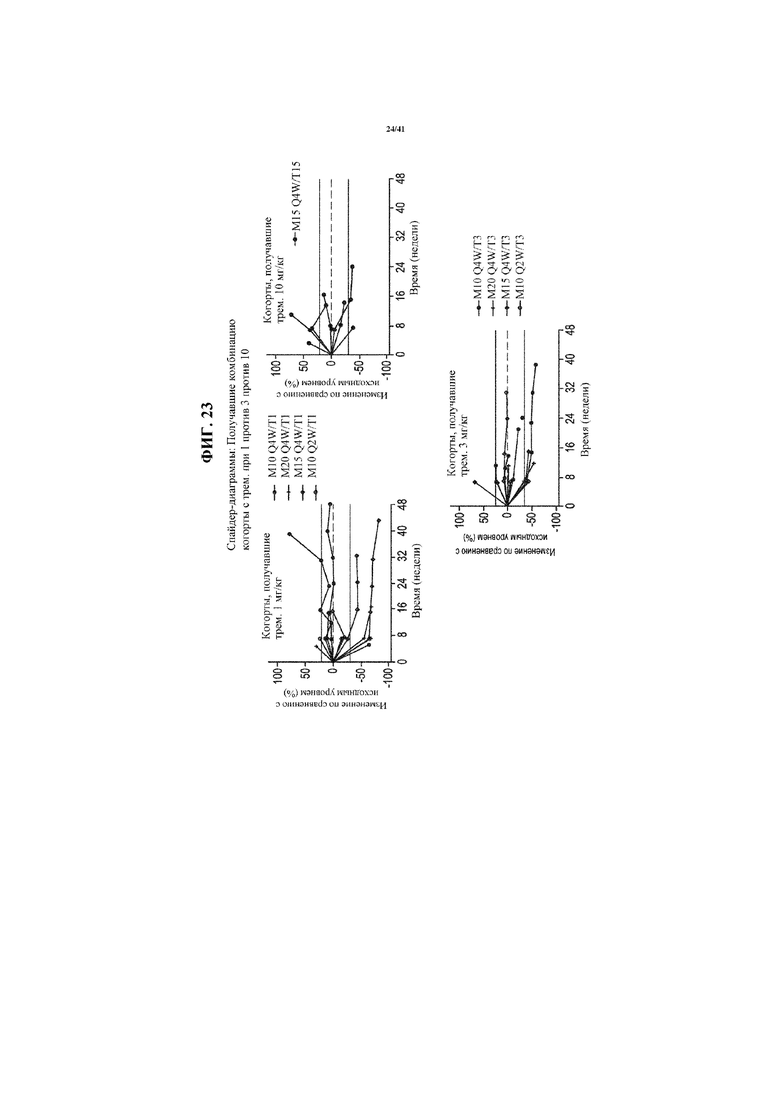
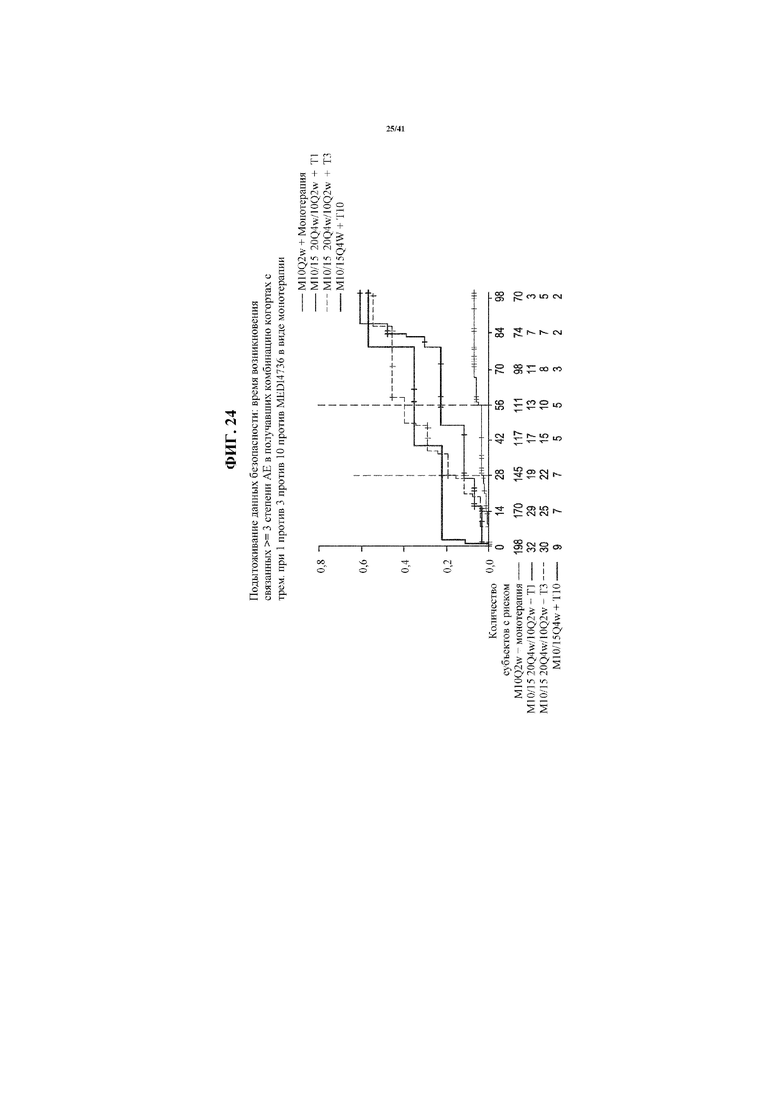
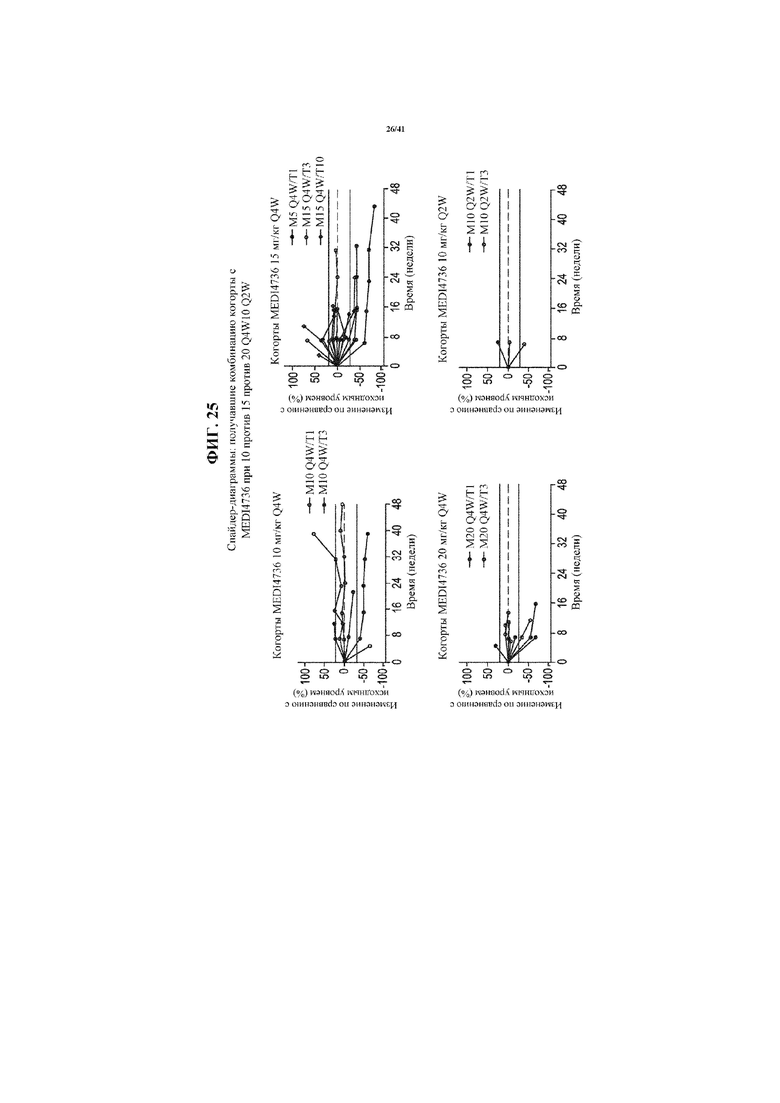
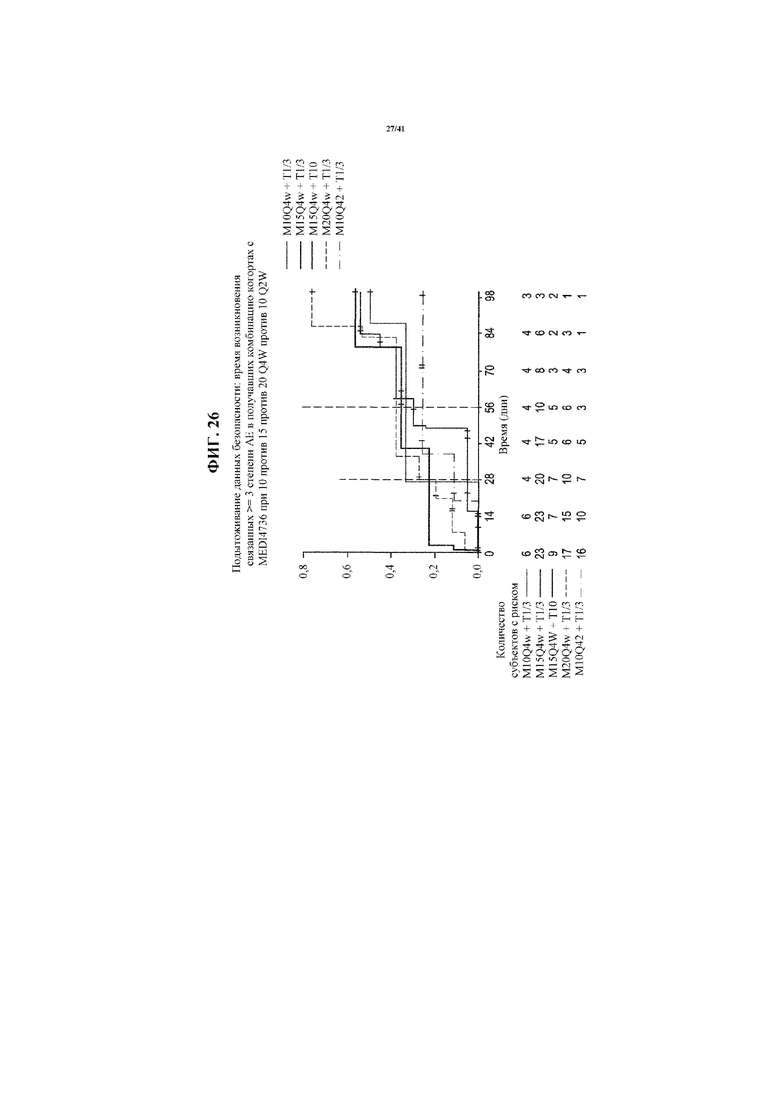
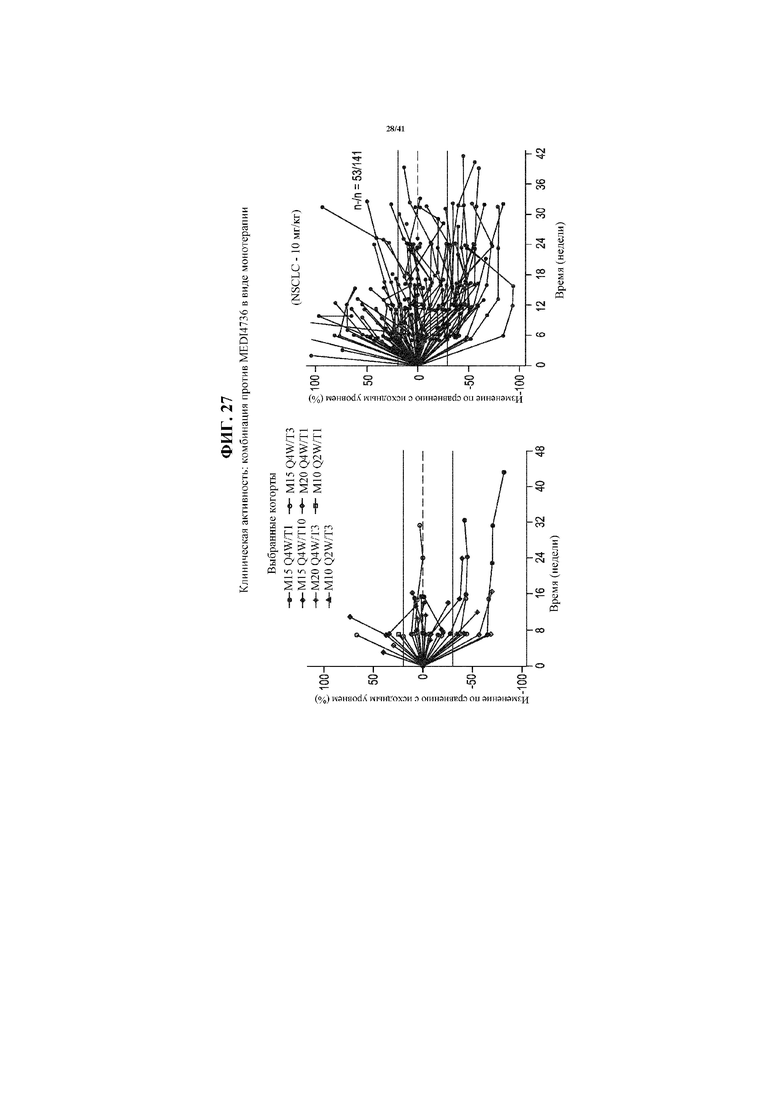

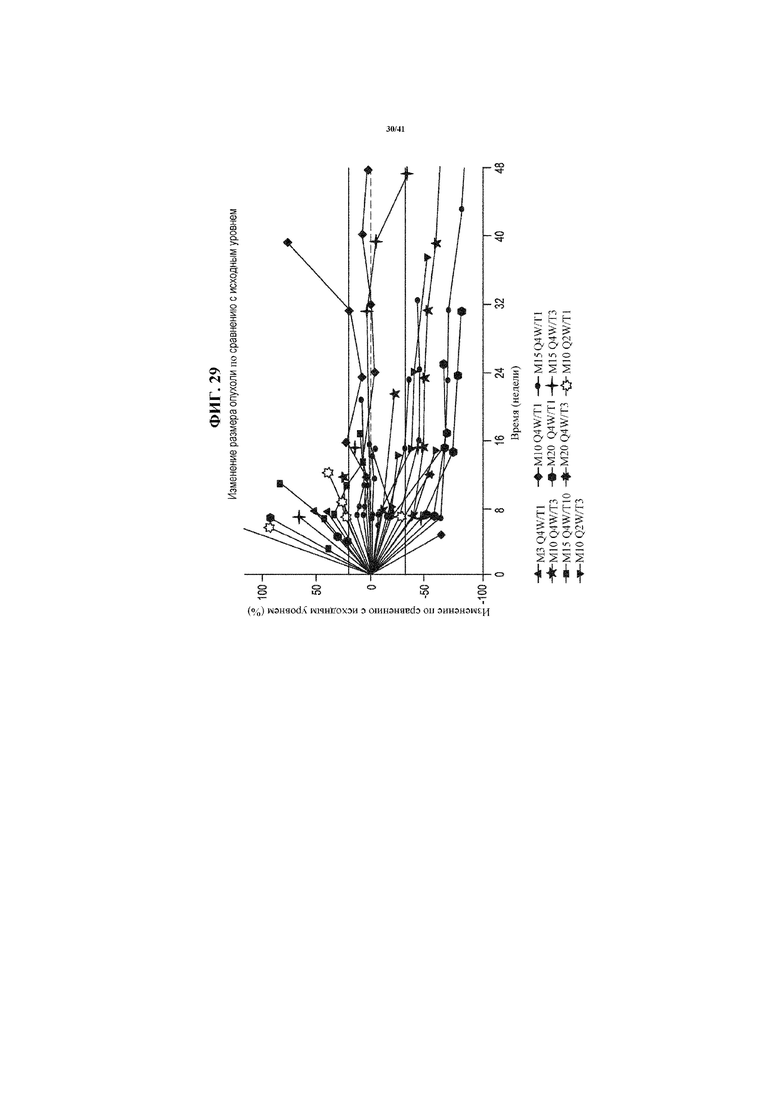
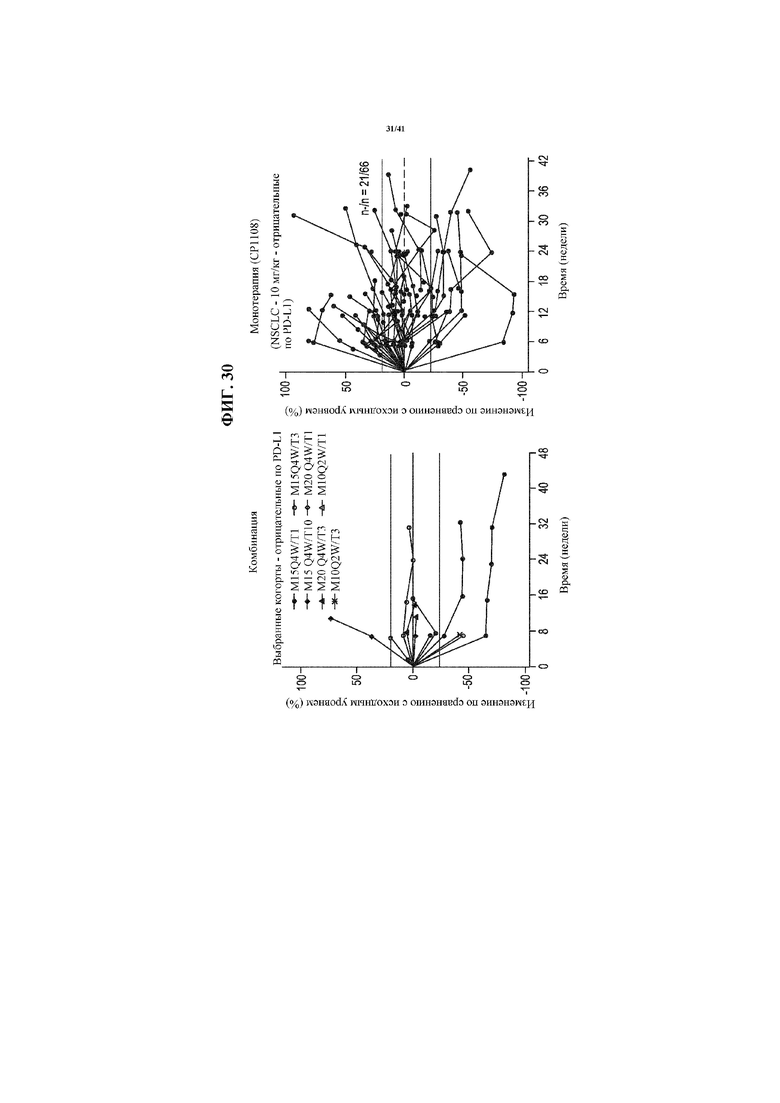
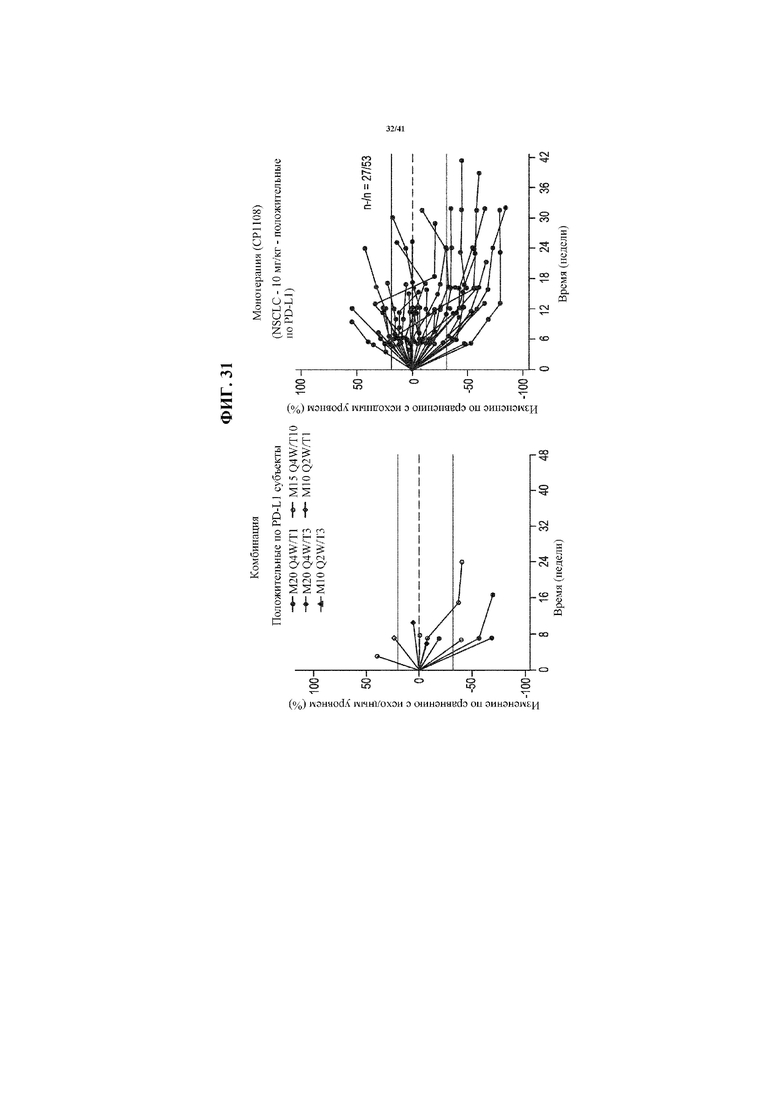
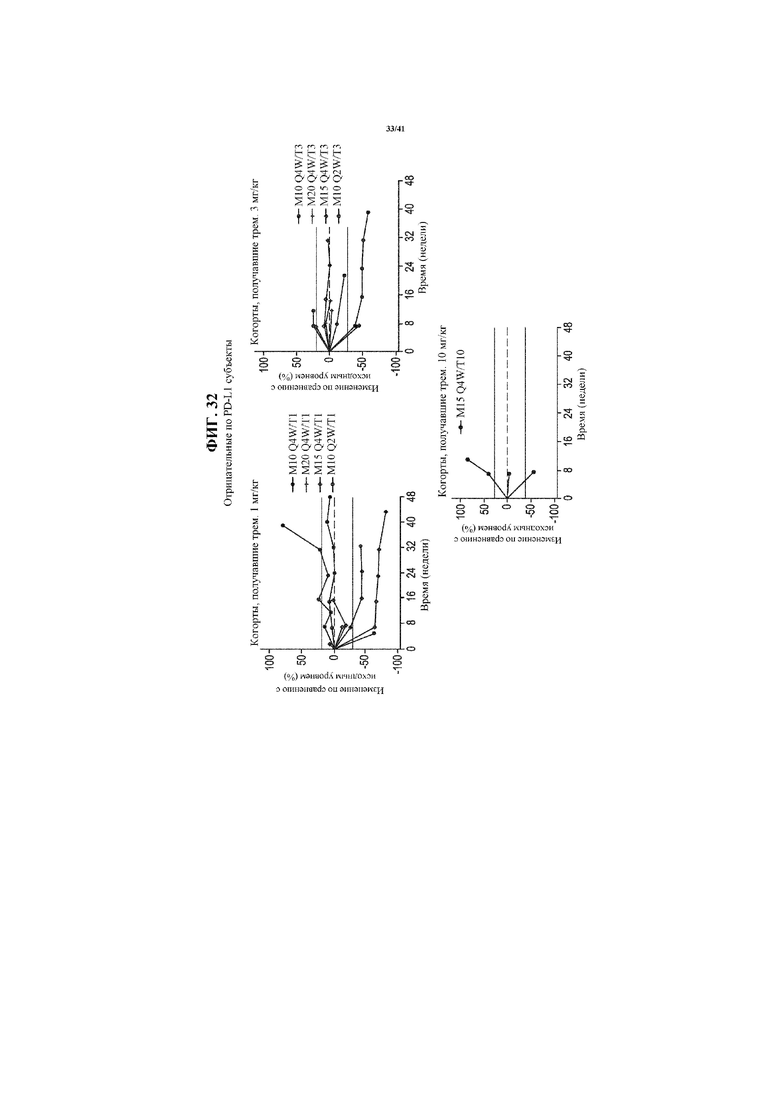
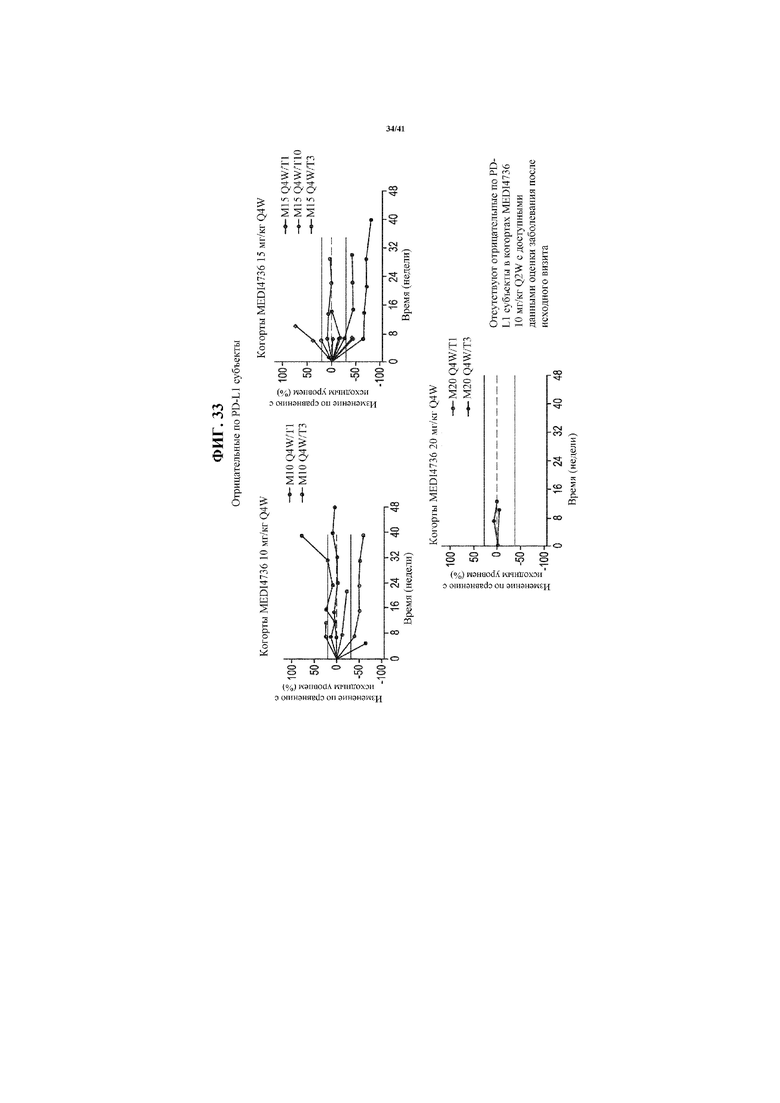
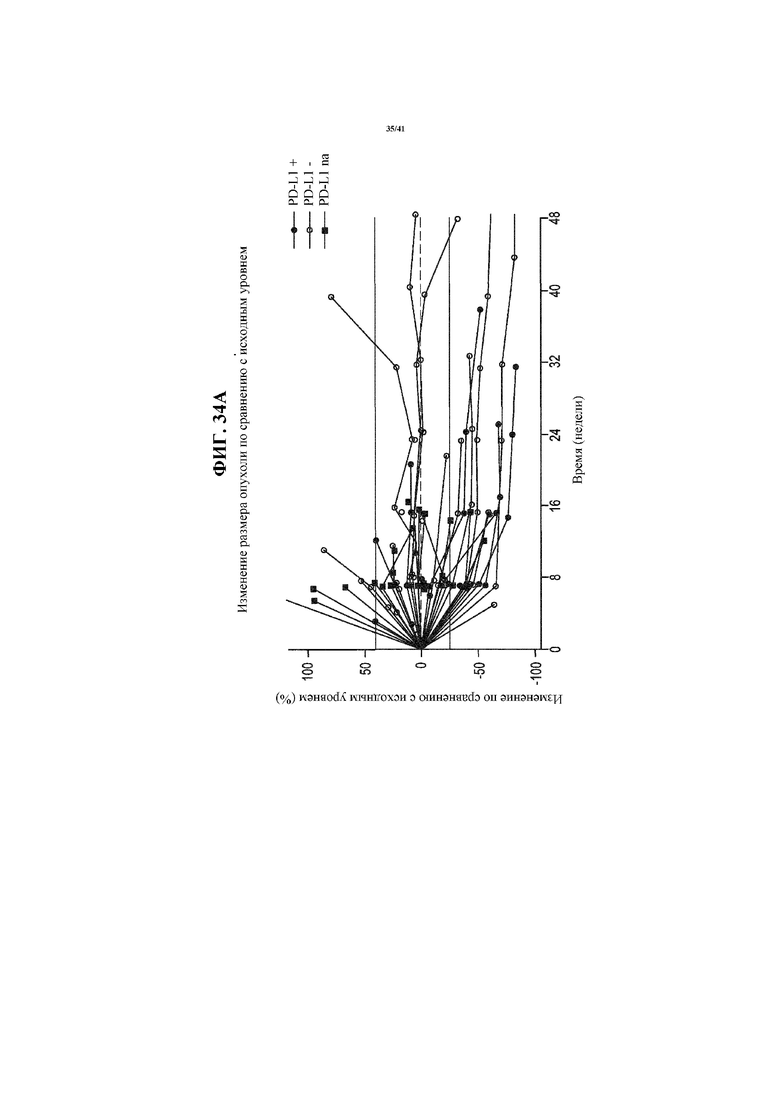
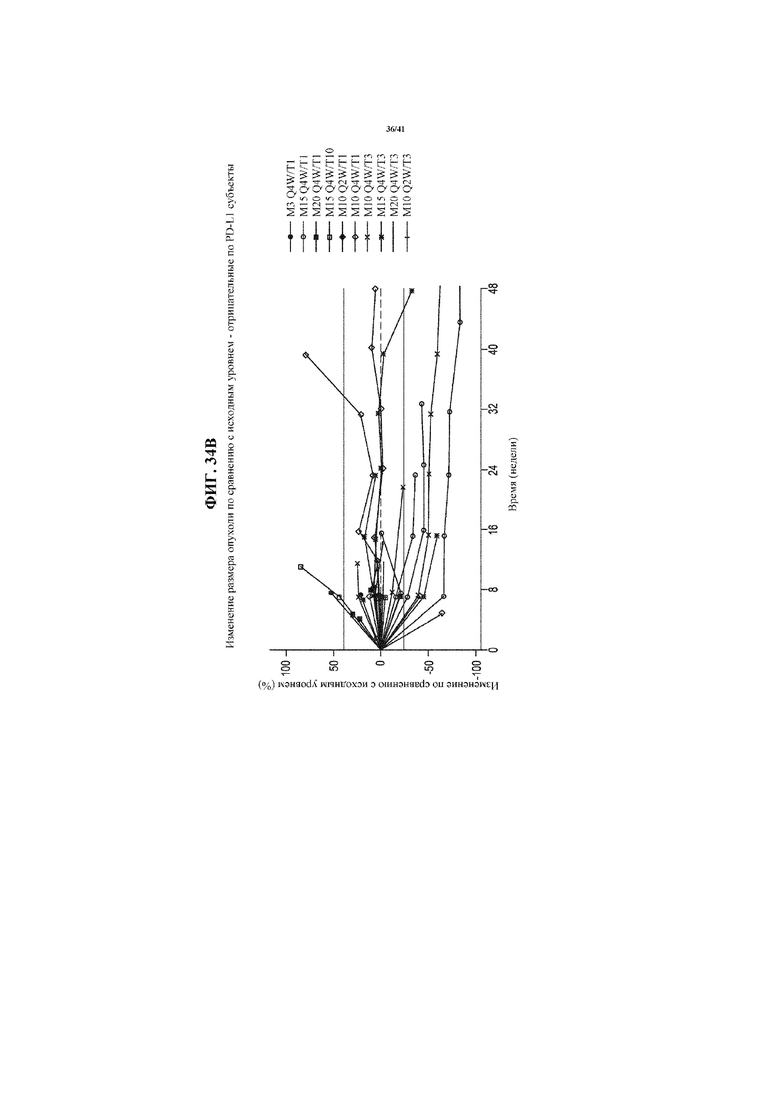
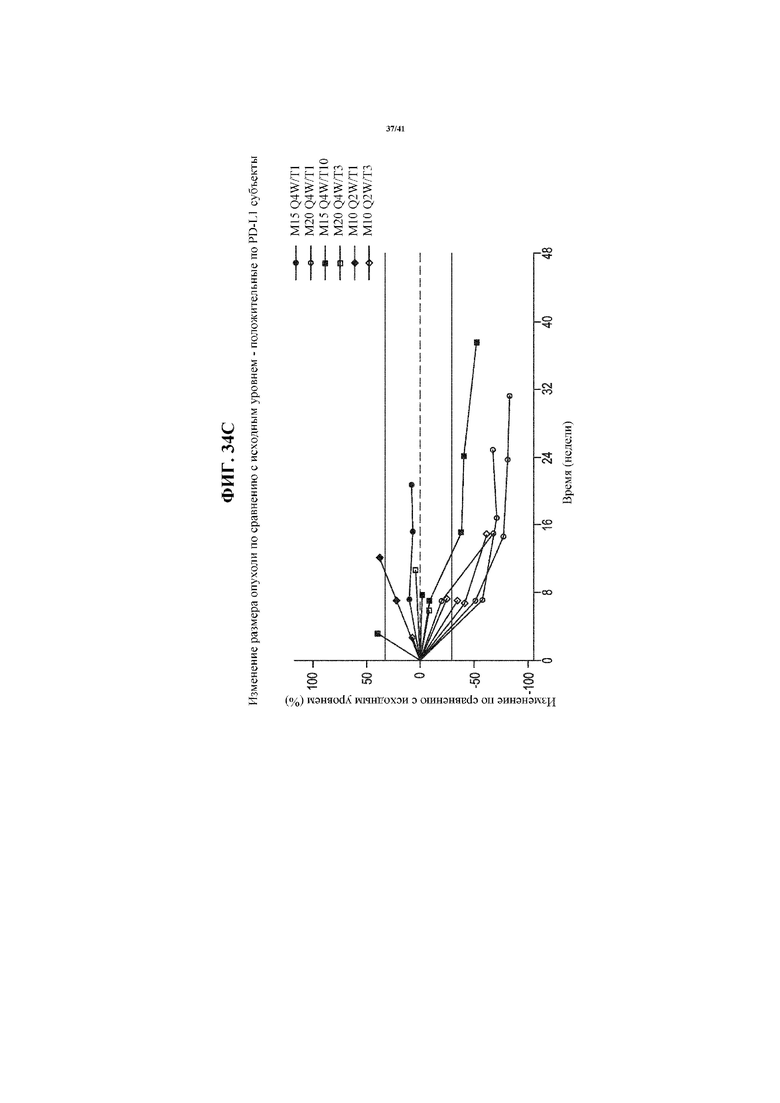
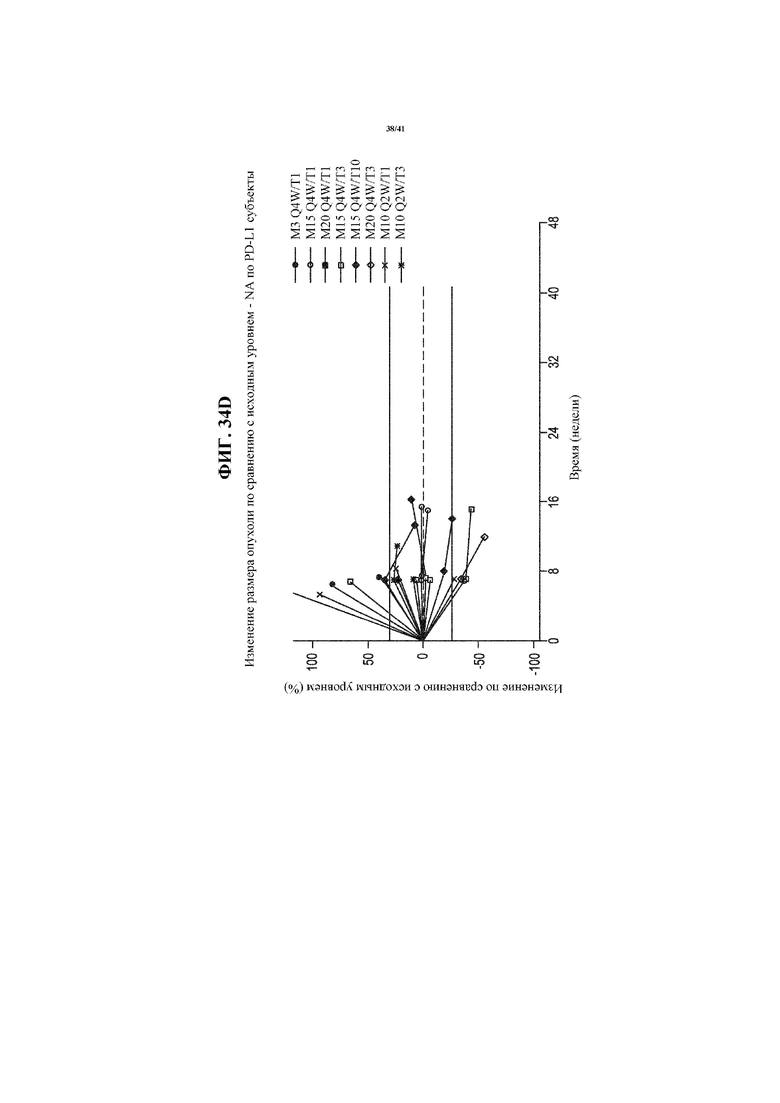
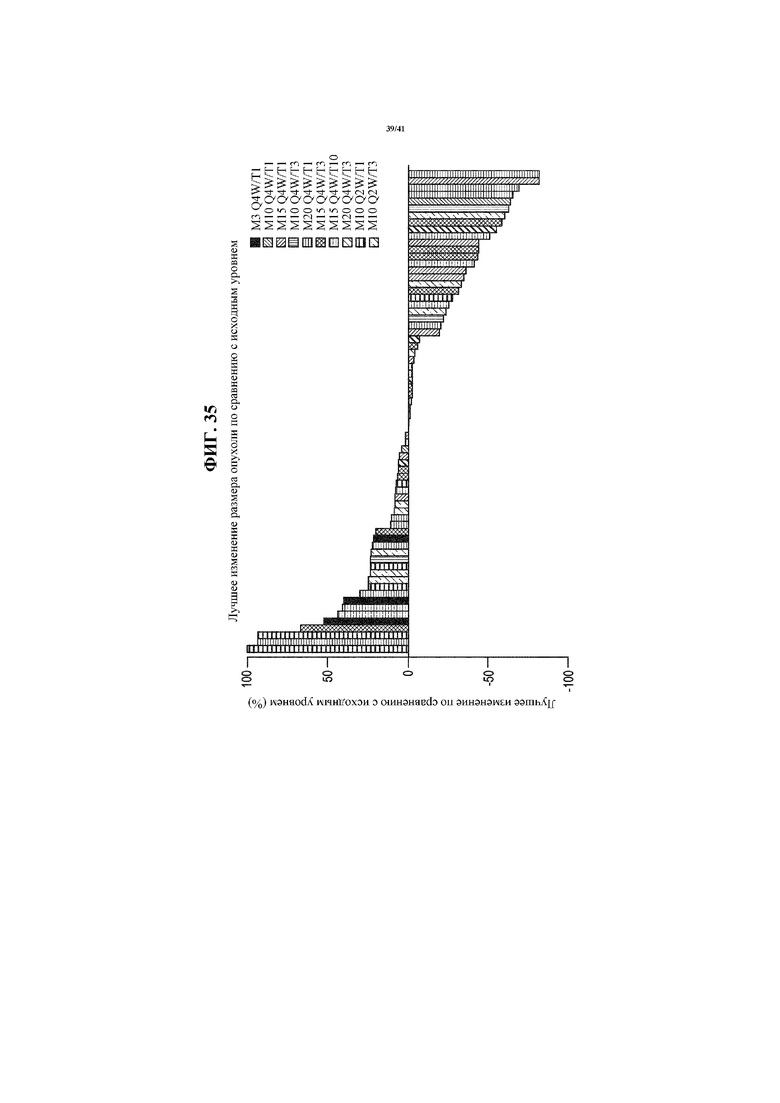
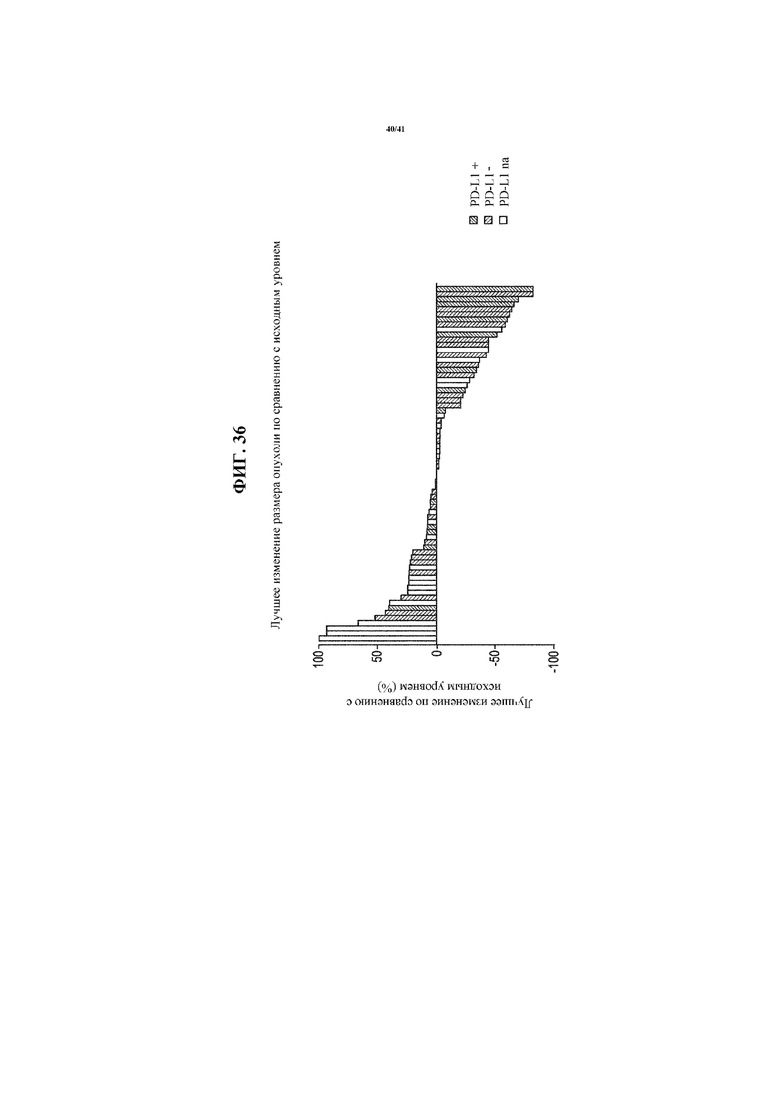
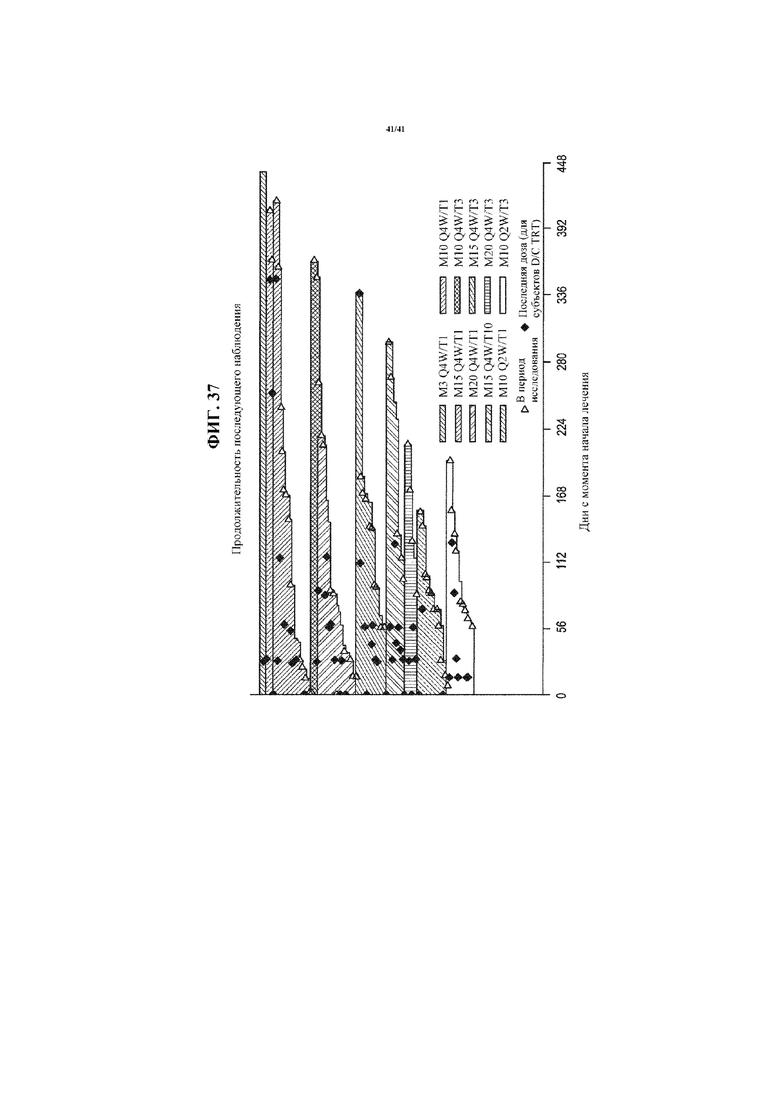
Изобретение относится к области фармацевтики и медицины, а именно к способу лечения немелкоклеточного рака легкого (NSCLC) у пациента, включающему введение MEDI4736 и тремелимумаба, где (i) введение может давать среднее Cmax со значением 266-300 мкг/мл MEDI4736 и Cmax со значением 25-30 мкг/мл тремелимумаба; (ii) MEDI4736 вводят через 1 час после введения тремелимумаба и (iii) MEDI4736 и тремелимумаб вводят каждые 4 недели в течение 16 недель, максимально. Технический результат заключается в безопасности и синергической эффективности комбинации. 8 з.п. ф-лы, 37 ил., 9 табл., 4 пр.
1. Способ лечения немелкоклеточного рака легкого (NSCLC) у пациента, включающий введение MEDI4736 и тремелимумаба, где:
(i) введение может давать среднее Cmax со значением 266-300 мкг/мл MEDI4736 и Cmax со значением 25-30 мкг/мл тремелимумаба;
(ii) MEDI4736 вводят через 1 час после введения тремелимумаба; и
(iii) MEDI4736 и тремелимумаб вводят каждые 4 недели в течение 16 недель, максимально.
2. Способ по п.1, где общая продолжительность лечения составляет 52 недели.
3. Способ по п.1 или 2, где NSCLC является устойчивым к действию по меньшей мере одного химиотерапевтического средства перед введением MEDI4736 и тремелимумаба.
4. Способ по п.3, где химиотерапевтическое средство представляет собой Вемурафениб, Эрлотиниб, Афатиниб, Цетуксимаб, Карбоплатин, Бевацизумаб, Гефитиниб или Пеметрексед.
5. Способ по любому из пп.1-4, где пациент является иммунотерапевтически наивным перед введением MEDI4736 и тремелимумаба.
6. Способ по любому из пп.1-5, где введение MEDI4736 осуществляется путем внутривенной инфузии.
7. Способ по любому из пп.1-6, где введение тремелимумаба осуществляется путем внутривенной инфузии.
8. Способ по любому из пп.1-7, где у пациента имеется местнораспространенный и метастатический немелкоклеточный рак легкого.
9. Способ по любому из пп.1-8, где NSCLC является сквамозным или несквамозным.
| WO 2014066834 A1, 01.05.2014 | |||
| Study NCT02000947 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Study NCT01975831 | |||
| Ludwig | |||
Авторы
Даты
2023-10-30—Публикация
2015-05-12—Подача