ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к медицине, в частности к медицинской технике, используемой для диагностики и/или лечения воспалительных заболеваний, аутоиммунных заболеваний, инфекционных заболеваний, доброкачественных новообразований и/или злокачественных новообразований, возникающих в полых органах и соединенных с ними органов млекопитающего, в частности заболеваний поджелудочной железы, желчевыводящих протоков, печени, желудочно-кишечного тракта, а также дефектов и травм полых органов млекопитающего, свищей, стриктур, аневризматических и дивертикулярных расширений, острого панкреатита, повреждений стенки тонкой кишки и/или т.п.
УРОВЕНЬ ТЕХНИКИ
В уровне техники известны различные устройства и приспособления, используемые в целях диагностики и/или лечения воспалительных заболеваний, аутоиммунных заболеваний, инфекционных заболеваний, доброкачественных новообразований и/или злокачественных новообразований, возникающих в полых органах млекопитающего, в частности заболеваний поджелудочной железы, желчевыводящих протоков, печени, а также дефектов стенки желудочно-кишечного тракта, повреждений стенки полого органа, аневризматического и дивертикулярного расширения, стриктур полых органов, кровотечений полых органов и некоторых других заболеваний полых органов, а также заболеваний органов, соединенных с полыми органами.
Согласно руководству по диагностике и лечению рака поджелудочной железы, основными методиками, позволяющими подтвердить гистологический тип новообразования, являются тонкоигольная чрескожная биопсия, тонкоигольная функциональная биопсия, цитологический анализ соскоба эпителия, также называемый браш-биопсией, диагностическая лапароскопия с биопсией, а также цитологический анализ смывов из брюшной полости, полученных во время лапароскпоии или лапаротомии (Pancreatic adenocarcinoma guidelines National Cancer Comprehensive Network. 2019 Version 2.2019). Данные официально рекомендуемые методики биопсии основаны на иных принципах, в связи с чем их не следует считать аналогами настоящего изобретения.
В частности, известен способ ультразвукового исследования поджелудочной железы (Минько А.Б. Комплексная лучевая диагностика заболеваний поджелудочной железы / А.Б. Минько, B.C. Пручанский, Л.И. Корытова. - СПб: Гиппократ, 2001. - 134 с; Martínez-Noguera A, Montserrat Е, Torrubia S., et al., 2001. Ultrasound of the pancreas: update and controversies. Eur Radiol 11:1594-1606). Данный способ основан на оценке изменения отражения и поглощения волн от ткани органа и позволяет оценить характер контуров железы, печени, чередования гиперэхогенных или гипоэхогенных зон. Кроме того, этот известный способ позволяет установить наличие образования и диаметр вирсунгова протока, желчевыводящих протоков, а также наличие образований и их диаметр. Главным недостатком этого известного способа является то, что результат исследования напрямую зависит от квалификации специалиста и разрешающей способности аппарата. Чувствительность ультразвукового исследования в данном случае составляет 70-80%. При размере образования менее 1,5 см эффективность этого способа резко снижается. В частности, данный способ не позволяет выявлять внутрипротоковые неоплазии, полноценно оценивать панкреатический проток, а также не позволяет оценивать биохимический состав как панкреатического сока, так и желчи, и выполнять их цитологическое исследование.
Кроме того, известен способ эндоскопического ультразвукового исследования, основанного на том же принципе, что и вышеописанный известный способ (см. Ogawa М., Kawaguchi Y., 2011, Iglesias-Garcia J., 2012). Преимуществом по сравнению с предыдущим известным способом является возможность выполнять биопсию в непосредственной близости от интересующего участка. Зонд типа Convex, если имеется, позволяет выполнить тонкоигольную функциональную биопсию подозрительного образования с последующим цитологическим исследованием. Недостатками же данного способа являются необходимость в наличии высококвалифицированного специалиста, анестезиологического пособия, а также высокая стоимость, и невозможность выполнения исследования в ряде случаев вследствие некоторых анатомических особенностей. Кроме того, этот известный способ не подходит для цитологической диагностики печени и желчевыводящих протоков, а также позволяет получить путем аспирации лишь небольшой объем цитологического материала, что затрудняет интерпретацию этого полученного цитологического материала, что в итоге приводит к получению высокой доли как ложноположительных результатов, так и ложноотрицательных результатов. Кроме того, данный известный способ не позволяет оценить количественный состав желчи или панкреатического сока.
Кроме того, известен способ тонкоигольной трепан-биопсии, используемый всегда в сочетании с двумя вышеописанными способами и позволяющий получить материал для гистологического исследования (Hruban R.H., Takaori K., Klimstra D.S. An illustrated consensus on the classification of pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms. Am. J. Surg. Pathol. 2004. V. 28(8). P. 977-87). Данный известный способ является основным для гистологической верификации заболеваний поджелудочной железы. Недостатками же данного способа являются риск осложнений: кровотечения, формирования свищей, абсцессов, диссеминации раковых клеток по ходу пункционного канала, а также неинформативные, ложно положительные или ложноотрицательные результаты гистоцитологического исследования. Кроме того, этот известный способ не подходит для диагностики заболеваний желчевыводящих протоков, желчного пузыря, а также для лабораторной оценки желчи и панкреатического сока.
Кроме того, известен способ спиральной компьютерной томографии с внутривенным контрастированием (МСКТ) (Callery М.Р. et al., 2009; Klaub М. et al., 2009). Этот способ основан на компьютерной обработке тонких «срезовых» томограмм и оценке степени поглощения контрастного вещества тканью железы, опухоли, а также на измерении диаметра протоков. Данный способ позволяет визуализировать образования, а также сделать заключение об остром или хроническом воспалительном изменении соответствующего органа на основании изменения денситометрических показателей органов. Недостатками же данного способа являются значительное снижение его чувствительности при размере образования менее 1,5 см, а также низкая чувствительность и специфичность при диагностике внутрипротоковых неоплазий. Кроме того, этот известный способ не позволяет гистологически подтвердить заболевание и выполнить анализ секрета поджелудочной железы.
Кроме того, известен способ эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) (Kawaguchi Y., Ogawa М., Omata F. Randomized controlled trial of pancreatic stenting to prevent pancreatitis after endoscopic retrograde cholangiopancreatography. World Journal of Gastroenterology 2012. Vol.18(14). P. 1635-1641). В данном известном способе очаговые образования и конкременты выявляются в виде дефектов наполнения. Недостатками же данного способа являются необходимость в наличии анестезиологического пособия, ряд ограничений, не позволяющих выполнять определенные манипуляции, и травматичность процедуры, вследствие которой может развиться деструктивный панкреатит или острый холангит.
Кроме того, известен способ аспирации панкреатического сока эндоскопически из полости двенадцатиперстной кишки с помощью стимуляции экскреторной функции поджелудочной железы с помощью препарата Chirhostim™, представляющего собой синтетический аналог секретина (Suenaga М., Sadakari Y., Almario J.A., et al. Using an endoscopic distal cap to collect pancreatic fluid from the ampulla. Gastrointest Endosc. 2017; 86(6): 1152-1156; Kanda M., Sadakari Y., Borges M., et al. Mutant TP53 in Duodenal samples of pancreatic juice from patients with pancreatic cancer or high-grade dysplasia. Clin Gastroenterol Hepatol. 2013; 11(6): 719-730). Данный известный способ применяют для забора материала с целью его последующего цитологического исследования и/или молекулярно-генетического исследования. Недостатками же данного способа являются его непризнанность общепринятой методикой, ограничение количества забираемого секрета поджелудочной железы из-за короткого действия препарата, к чему приводит короткая длительность процедуры. Следует отметить, что состав панкреатического сока при введении секретина меняется, так что забираемый в данном случае секрет поджелудочной железы не имеет свой истинный состав, в результате чего невозможно оценить истинный состав и клиренс секреции панкреатического сока, поскольку эта функция стимулируется препаратом. Не подходит этот известный способ и для сбора и анализа желчи.
Кроме того, известен способ магнитно-резонансной томографии (МРТ), который является стандартным при выявлении новообразований и воспалительных изменений поджелудочной железы и/или желчевыводящих протоков (Akisik M.F., Sandrasegaran K., Aisen A. A. Dynamic secretin enhanced MR cholangiopancreatography. RadioGraphics. 2006. Vol. 26. P. 665-677). Данный способ не является инвазивным, при этом применение в качестве дополнения контрастирования или стимуляция функции поджелудочной железы позволяет увеличить чувствительность и специфичность этого известного способа. Недостатком же этого известного способа является невозможность оценки как состава, так и клиренса желчи или панкреатического сока, а также невозможность их последующего цитологического исследования.
Кроме того, известен способ назопанкреатического или назобилиарного дренирования с последующим изолированным забором субстрата (Handa K., Minami Т., Shimizu A., et al. Roles of ERCP in the Early Diagnosis of Pancreatic Cancer. Diagnostics 2019, 9(1), 30; Будзинский С.А., Шаповальянц С.Г., Федоров Е.Д., Шабрин А.В. Эндоскопическое транс папиллярное панкреатическое стентирование в лечении свищей поджелудочной железы (с комментарием А.Г. Кригера). Хирургия. Журнал им. Н.И. Пирогова. 2017; (2): 32-44). Данный известный способ используют как для лечения воспалительных заболеваний поджелудочной железы, так и для цитологической верификации, при этом он также подходит и для анализа состава биожидкостей. Кроме того, этот известный способ является единственным способом изолированного забора как панкреатического сока, так и желчи. Недостатком же данного известного способа является сложность его реализации. Впервые применение этого способа было описано еще в 1980 году, тем не менее он не является рутинным и используется только в высокоспециализированных учреждениях, причем преимущественно для решения узкого круга задач, преимущественно для лечения острого панкреатита. В ряде случаев, в том числе вследствие наличия некоторых анатомических особенностей, этот способ может быть не выполним, а также может вызывать такие осложнения как панкреатит, холангит и кровотечения.
Кроме того, известен двухканальный зонд Дрейлинга, используемый в уровне техники для осуществления дуоденального зондирования (Stevens Т., Conwell D.L., Zuccaro G., et al. A prospective crossover study comparing secretin-stimulated endoscopic and Dreiling tube pancreatic function testing in patients evaluated for chronic pancreatitis. Gastrointestinal Endoscopy. 2008. 67(3). P. 458-466; Pollack BJ, Grendell JH. Where have all the dreiling tubes gone? Am J Gastroenterol. 2006 Feb; 101(2): 356-9). Зонд Дрейлинга позволяет осуществить атравматичный забор панкреатического сока и желчи для их последующего биохимического анализа и/или цитологического анализа и для определения суточного клиренса. Недостаток известного зонда Дрейлинга заключается в том, что он не обеспечивает возможность селективного забора содержимого двенадцатиперстной кишки, что приводит к ретроградному забору кишечного содержимого. Пассивный забор экскрета приводит к тому, что его часть вследствие перистальтики двенадцатиперстной кишки теряется в дистальных отделах. Однако следует отметить, что пассивная постановка за счет тяжести оливы в дистальной части зонда и перистальтики желудочно-кишечного тракта приводит к чрезмерным затратам времени на позиционирование зонда и рентгенологическую корректировку его положения, при этом сложно обеспечить правильное расположение каналов зонда для забора панкреатического сока и желчи. Применение стимулирующих препаратов, таких как, например, секретин, нельзя считать адекватным решением, поскольку они увеличивают лишь экскрецию бикорбонатного буфера клетками поджелудочной железы, то есть стимулируется лишь деятельность выстилающих протоки эпителиоцитов, при этом большая часть экзокринного аппарата железы остается неактивной. Таким образом, этот зонд Дрейлинга не позволяет стимулировать функции аденокарцином, муцинозных неоплазий и нейроэндокринных опухолей. Кроме того, этот известный зонд Дрейлинга по сути является альтернативой эндоскопической ретроградной холангиопанкреатографии и по сути может быть использован исключительно для диагностики хронического панкреатита, при этом внутрипротоковые муцинозные и кистозные образования, а также карциномы in situ не могут быть выявлены с его использованием. Кроме того, при использовании этого зонда Дрейлинга достаточно сложно оценить холерез из-за пассажа части желчи и панкреатического сока по двенадцатиперстной кишке, минуя указанный зонд.
Кроме того, известен назопанкреатический стент, который с помощью эндоскопической методики может быть установлен в главный проток поджелудочной железы (Osnes М., Petersen Н., Schrumpf Е. Comparison of juice obtained during duodenal aspiration and cannulation of the main pancreatic duct after stimulation with exogenous secretin in man. Scand J Gastroenterol. 1978; 13(4): 453-8.; Minami Т., Hanada K., Hirano N., et al. Clinical Usefulness of Serial Pancreatic-Juice Aspiration Cytological Examination and Endoscopic Ultrasound-Guided Fine-Needle Aspiration in Small Pancreatic Cancer. 152, Issue 5, Supplement 1, Page S897; Bi Y., Ji В., Raimondo M. How to suction pancreatic juice from the duodenum: Endoscope, catheter, or cap-assisted? 86(6).2017 Gastrointestinal endoscopy. P. 1157-1159). Применение данного назопанкреатического стента позволяет при эндоскопической папилосфинктеротомии ввести зонд и получить секрет поджелудочной железы. Недостатком данного назопанкреатического стента является его трав матичность, что может стать причиной развития панкреатита, холангита или механической желтухи. Выполнение эндоскопической ретроградной холангиопанкреатографии в 3-10% случаев может служить причиной острого панкреатита, поэтому в данном случае всем пациентам приходится назначать специальную профилактическую терапию. Кроме того, при проведении папилосфинктеротомии можно повредить крупный сосуд, что может привести к кровотечению. Следует отметить, что известный назопанкреатический стент может быть использован только в высокоспециализированных центрах при наличии опытного специалиста, владеющего данной методикой.
Кроме того, известен двупросветный дуоденальный зонд, устанавливаемый через носовой проход под контролем эндоскопа с обеспечением его продвижения через пилородуоденальную зону (Bi Y., Ji В., Raimondo М. How to suction pancreatic juice from the duodenum: Endoscope, catheter, or cap-assisted? 86(6).2017 Gastrointestinal endoscopy. P. 1157-1159; Go VL, Hofmann AF, Summerskill WH. Simultaneous measurements of total pancreatic, biliary, and gastric outputs in man using a perfusion technique. Gastroenterology 1970; 58: 321-328). Недостаток такого дуоденального зонда заключается в невозможности осуществления селективного забора панкреатического сока и желчи, а также в отсутствии препятствий перемешиванию экскрета с кишечным и желудочным содержимым, что приводит к активизации ферментов и перевариванию биологического материала в указанном зонде. Кроме того, следует отметить, что конструкция такого дуоденального зонда не позволяет влиять непосредственно на отток панкреатического сока из поджелудочной железы, вследствие чего для выполнения исследования необходимо стимулировать поджелудочную железу препаратами, например секретином.
Кроме того, известно устройство для аспирации панкреатического сока с помощью эндоскопа в виде насаживаемого на фиброскоп колпачка, который после стимулирования экзокринной функции органа позволяет собирать секрет поджелудочной железы (Suenaga М, Sadakari Y, Almario JA, et al. Using an endoscopic distal cap to collect pancreatic fluid from the ampulla (with video). Gastrointest Endosc 2017; 86: 1152-1156). Недостатками данного известного устройства являются сложность процедуры, провести которую можно лишь в высокоспециализированных центрах, и небольшое количество получаемого секрета поджелудочной железы, в то время как доступный объем секрета поджелудочной железы является критичным аспектом при молекулярном тестировании. В данном случае процедуру, основанную на использовании этого известного устройства, выполняют с использованием анестезиологического пособия, при этом она не может выполняться длительно.
Известен способ диагностики в крови вирусных гепатитов с помощью серологических и молеклярно-генетических методов, тем не менее в 20% случаев заболевание остается не верифицированным, что, в частности, обсуловлено жизненным циклом вируса, а также тропностью не только к гепатоцитам, но и к эпителию желчных протоков, что вызывает вирусный холангит, а также хронизацию заболевания (Шахгильдян И.В., Михайлов М.И., Онищенко Г.Г. Парентеральные вирусные гепатиты (эпидемиология, диагностика, профилактика). М.: ГОУ ВУНМЦ МЗ РФ, 2003; Burgart L.J. Cholangitis in Viral Disease. Mayo Clinic Proceedings; 1998. V. 73 (5); 479 - 482). Данный известный способ не позволяет получать желчь для дальнейшего лабораторного анализа.
Известен способ диагностики заболеваний печени (вирусные гепатиты, аутоиммунные гепатиты, склерозирующий холангит, опухоли печени) с помощью чрескожной биопсии, с последующим гистологическим и молекулярно-генетически анализом (Bunt Е.М. Liver Biopsy Diagnosis of Hepatitis: Clues to Clinically-Meaningful Reporting. Mo Med. 2010; 107(2): 113-118). В ряде случаев применение такого известного способа приводит к осложнениям (кровотечениям, желчному перитониту), при этом он не позволяет выявлять патологические изменения приблизительно в 30% случаев. Кроме того, данный известный способ используется исключительно для осуществления первичной диагностики и практически не применяется повторно, в том числе для мониторинга динамики или течения заболевания.
Кроме того, известен способ лечения острого панкреатита путем стентирования главного панкреатического протока для восстановления оттока ферментов поджелудочной железы. Данный способ используют для лечения и профилактики панкреатита после выполнения эндоскопической ретроградной холангиопанкреатографии (Можаровский В.В., Мутных А.Г., Жуков И.Н., Можаровский К.В. Влияние стентирования главного панкреатического протока на результаты лечения больных с острым панкреатитом. Хирургия. Журнал им. Н.И. Пирогова. 2019; (9): 13-17; Dumonceau JM., Andriulli A., Elmunzer BJ., et al. Prophylaxis of post-ERCP pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - updated June 2014. Endoscopy. 2014 Sep; 46(9): 799-815). Недостаток данного известного способа заключается в том, что процедура стентирования может быть осуществлена только в высокоспециализированных центрах, при этом в ряде случаев указанная процедура вообще не может быть осуществлена по причине анатомических особенностей строения протоковой системы пациента. Более того, она не решает проблему панкреатита по причине нарушения оттока панкреатического сока вследствие пареза двенадцатиперстной кишки.
Кроме того, как известно из уровня техники (Смотрин И.С. Обтурирующие средства для лечения свищей желудочно-кишечного тракта. Журнал ГрГМУ Практикующему врачу. - 2007. - №4), кишечные свищи возникают в среднем у 1-3% больных после операций на органах брюшной полости. Общая летальность при возникновении этой патологии колеблется в пределах от 16,5% до 57,5%, а послеоперационная летальность при возникновении этой патологии колеблется в пределах от 10% до 21,4%, при этом наибольшая летальность отмечается при несформированных кишечных свищах и колеблется в пределах от 36% до 71,7%. При сформированных же кишечных свищах летальность едва достигает 4%.
Известен способ лечения свищей желудочно-кишечного тракта с помощью систем отрицательного давления, основанный на постоянной эвакуации всего патологического отделяемого из брюшной полости с обеспечением возможности заживления дефектов (Bobkiewicz A, Walczak D, Smoliński S. et al. Management of enteroatmospheric fistula with negative pressure wound therapy in open abdomen treatment: a multicentre observational study. Int Wound J. 2017 Feb; 14(1): 255-264; D'Hondt M., Devriendt D., Van Rooy F. et al. Treatment of small-bowel fistulae in the open abdomen with topical negative-pressure therapy. Am J Surg. 2011; 202(2): e20-4). Кроме того, статистика, собранными теми же авторами, свидетельствует о том, что при применении данного известного способа такие дефекты не закрываются (не заживают) в 30-47% случаев по причине постоянного поступления содержимого из просвета полого органа.
Кроме того, как известно из уровня техники (Вицын Б.А., Благитко Е.М. Сформированные и несформированные наружные кишечные свищи. - Новосибирск: Наука. -1983. - 142 с; Макаренко Т.П., Богданов А.В. Свищи желудочно-кишечного тракта. - М.: Медицина. - 1986. - 144 с. А.с. СССР 764685, М. кл. А61М 27/00. Обтуратор для временного закрытия свища желудочно-кишечного тракта / В.М. Удод и Э.Г. Карстен. По заявке 2723729/28-13. Заявлено 22.12.78. Опубл. 23.09.80. БИ 35), существует большое количество различных устройств по типу обтураторов, направленных на разобщение просвета полого органа с дефектом в стенке, однако их большое разнообразие свидетельствует о сложности их реализации и достижения желаемого эффекта. Кроме того, все такие известные устройства направлены лишь на разобщение просвета полого органа с дефектом в стенке, но не влияют на пространство рядом с дефектом стенки.
Известны способы лечения желудочно-кишечных кровотечений, в основе которых лежит применение эндоскопических методов, клипирование, лигирование, инъекции склерозантов или вазоактивных препаратов в подслизистый слой, а также коагуляции с помощью термических и электических методов (Anjiki Н, Kamisawa Т, Sanaka М, Ishii Т, Kuyama Y. Endoscopic hemostasis techniques for upper gastrointestinal hemorrhage: A review. World J Gastrointest Endosc. 2010; 2(2): 54-60). Кроме того, в случае кровотечения из распадающейся опухоли, некротического эзофагита или неспецифических эрозивных колитов, т.е. в случае, когда происходит диффузное кровотечение из слизистой без явного источника, такие известные способы остаются неэффективными, при этом они также не позволяют объективно контролировать устойчивость гемостаза.
Известен способ диагностики аневризматических расширений сосудов с помощью введения внутрипросветных эндоваскулярных катетеров со стентами или без них, заключающийся в подведении под контролем рентгеноскопии катетера и обтурации аневризмы с помощью стента (Roszelle BN, Nair Р, Gonzalez LF, Haithem Babiker M, Ryan J, Frakes D. Comparison among different high porosity stent configurations: hemodynamic effects of treatment in a large cerebral aneurysm. J Biomech Eng. 2014 Feb; 136(2): 021013). Однако, при осуществлении данного известного способа в процессе правильной постановки катетера и выявлении дефекта может страдать периферический кровоток и продолжаться кровоизлияние из полости аневризмы, поэтому заявляемая методика отличается от существующих аналогов.
Известен способ выявления травм полых органов путем введения в полый орган различных красящих или рентгеноконтрастных веществ (Ozimok CJ, Mellnick VM, Patlas MN. An international survey to assess use of oral and rectal contrast in CT protocols for penetrating torso trauma. Emerg Radiol. 2019 Apr; 26(2): 117-121; Broder JS, Hamedani AG, Liu SW, Emerman CL. Emergency department contrast practices for abdominal/pelvic computed tomography-a national survey and comparison with the american college of radiology appropriateness criteria (J Emerg Med. 2013 Feb; 44(2): 423-33). Однако сама манипуляция лишь позволяет констатировать факт травмы, при этом это удается далеко не всегда, поскольку успешность констатирования факта травмы сильно зависит от локализации самой травмы и особенностей введения вещества. Другими словами, данный известный способ не позволяет четко позиционировать травму полого органа с одновременным осуществлением лечения указанной травмы.
Кровотечения из желудочно-кишечного тракта
Следует также отметить, что кровотечения из желудочно-кишечного тракта проявляются в виде попадания крови в просвет с последующим выходом через естественные отверстия, что проявляется в виде характерного клинико-лабораторного симптомокомплекса. Согласно рекомендациям российского общества хирургов, остановка кровотечения включает комплекс лечебных мероприятий, который можно условно разделить на две части: первая часть лечебных мероприятий, оказывающих воздействие на систему гемостаза, активирующий коагуляцию, и вторая часть лечебных мероприятий, представляющая собой инвазивный пул манипуляций, воздействующих непосредственно на источник кровотечения. Первая часть лечебных мероприятий имеет четкий перечень средств и порядок их применения, а вторая часть лечебных мероприятий является вариабельной в значительной степени. Ключевым принципом инвазивных методов является физическое воздействие на источник кровотечения (Ghassemi KA, Jensen DM. Evolving techniques for gastrointestinal endoscopic hemostasis treatment. Expert Rev Gastroenterol Hepatol. 2016;10(5):615-23. doi: 10.1586/17474124.2016.1130623). В случае, когда можно выявить кровоточащий сосуд или вену, имеется большое количество приемов остановки кровотечения (например, клипирование, лигирование, склерозирование, аргоноплазменная коагуляция и/или т.п.). При диффузном кровотечении (например, при кровотечении из опухоли, неспецифического язвенного колита, очагов при болезни Крона, гемоколита и т.п.) методы остановки кровотечения являются неспецифичными и часто направлены на создание оптимальных условий для остановки кровотечения: применение аргоноплазменной эндоскопической коагуляции, подслизистое введение сосудосуживающих лекарственных препаратов, распределение гемостатических лекарственных препаратов по поверхности или т.п.
В частности, известен способ аргоноплазменной коагуляции, представляющий собой метод физического высокотемпературного воздействия на источник кровотечения. Наиболее часто данный способ аргоноплазменной коагуляции применяют при язвенных источниках в желудке и двенадцатиперстной кишке, что в 3,5 раза снижает риск осложнений (Экономическая эффективность метода эндоскопической аргоноплазменной коагуляции при язвенных гастродуоденальных кровотечениях / А.М. Машкин, А.В. Ефанов, А.В. Малеев [и др.] // Медицинская наука и образование Урала. - 2015. Т. 16. №1(81). С. 95 98). Кроме того, авторы отмечают, что при диффузном характере поражения слизистой желудка и/или двенадцатиперстной кишки способ аргоноплазменной коагуляции часто является неэффективным, при этом для достижения гемостаза требуется комбинация различных методов, что улучшает до 98% желаемый эффект (Поваляев, А.В. Эрозивно-язвенные желудочно-кишечные кровотечения у больных групп риска: клиника, диагностика, лечение / А.В. Поваляев, В.А. Дуванский, Н.Е. Чернеховская // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. - 2020. - Т. 15. - №4. - С. 39-14. - DOI 10.25881/BPNMSC.2020.54.37.008. Шабунин А.В., Нечипай А.М. Коржева И.Ю. Комбинированный эндоскопический гемостаз с применением EndoClot у пациентов с гастродуоденальными кровотечениями язвенной этиологии // Анналы хирургии. - 2016. - Т.21. - No6. - С. 49-55. [Shabunin AV, Nechipay AM, Korzheva IYu. Combined endoscopic hemostasis using EndoClot in patients with gastroduodenal bleeding of ulcerative etiology. Annals of surgery. 2016; 21(6): 49-55).
Кроме того, известен способ эндоскопического клипирования или эндоклипирования, в основе которого лежит механическое сдавливание источника кровотечения с помощью специальной клипсы и который по сути можно сравнить с прошиванием кровоточащего места (Sung JJ, Tsoi KK, Lai LH, et al. Endoscopic clipping versus injection and thermo-coagulation in the treatment of non-variceal upper gastrointestinal bleeding: A metaanalysis. Gut. 2007; 56(10): 1364-1373. Jensen DM, Machicado GA, Hirabayashi K. Randomized controlled study of 3 different types of hemoclips for hemostasis of bleeding canine acute gastric ulcers. Gastrointest Endosc. 2006;64(5):768-773.). Недостаток такого способа эндоскопического клипирования или эндоклипирования заключается в необходимости непосредственно визуализации источника кровотечения, при этом результат применения указанного известного способа часто зависит от анатомических особенностей пациента.
Кроме того, известен способ инъекционного гемостаза или склеротерапии, заключающийся в осуществлении подслизистого введения раствора адреналина или специального склерозанта на основе этилового спирта (Marmo R, Rotondano G, Piscopo R, et al. Dual therapy versus monotherapy in the endoscopic treatment of high-risk bleeding ulcers: A meta-analysis of controlled trials. Am J Gastroenterol. 2007; 102(2):279-289. Vergara M, Bennett C, Calvet X, et al. Epinephrine injection versus epinephrine injection and a second method in high-risk bleeding ulcers. Cochrane Database Syst Rev. 2014; 10:CD005584.). Преимущество данного способа инъекционного гемостаза или склеротерапии заключается в неприцельном введении препарата вокруг источника кровотечения, при этом за счет умеренного механического давления и умеренного воздействия на сосуды снижается риск спазмирования или облитерации. Однако при применении данного способа инъекционного гемостаза или склеротерапии существуют риски травматизации более крупных сосудов или риски перфорации органа желудочно-кишечного тракта в момент вкалывания иглы в стенку указанного органа. Такой способ инъекционного гемостаза или склеротерапии часто применяют в комбинации с другими гемостатическими способами, поскольку шунтирование и интрамуральные сосудистые анастомозы обуславливают высокий риск возникновения повторного кровотечения.
Кроме того, известно применение аргоноплазменной коагуляции для реканализации опухоли при раке пищевода (Консервативное лечение местнораспространенного и неоперабельного рака пищевода: возможности и перспективы / С.В. Канаев, А.М. Щербаков, Е.И. Тюряева, А.А. Аванесян // Вопросы онкологии. - 2012. - Т. 58. - №2. - С. 199-202), однако в данном информационном источнике не раскрыт опыт применения аргоноплазменной коагуляции в случае распада и кровотечения образования.
Кроме того, известен способ эндоскопического применения гемостатического порошка на основе полисахаридов (Kevin A. Ghassemi & Dennis М. Jensen (2016): Evolving techniques for gastrointestinal endoscopic hemostasis treatment, Expert Review of Gastroenterology & Hepatology, DOI: 10.1586/17474124.2016.1130623). Применение способа эндоскопического применения гемостатического порошка на основе полисахаридов приводит к образованию барьерного сгустка и адгезии на кровоточащей поверхности, что в 85% случаев обуславливает положительный эффект (Smith LA, Stanley AJ, Bergman JJ, et al. Hemospray application in nonvariceal upper gastrointestinal bleeding: results of the Survey to Evaluate the Application of Hemospray in the Luminal Tract. J Clin Gastroenterol. 2014;48(10): e89-e92.). Однако не менее чем в 15% случаев при монотерапии может наблюдаться повторное кровотечение, что обусловлено миграцией сгустка с гемостатическим порошком за счет перистальтики пищевода, желудка и кишечника (Ibrahim М, El-Mikkawy A, Mostafa I, et al. Endoscopic treatment of acute variceal hemorrhage by using hemostatic powder TC-325: a prospective pilot study. Gastrointest Endosc. 2013;78(5):769-773.).
Следует отметить, что применение катетеров для механического сдавления источника кровотечения применяется с 50-х годов двадцатого века, при этом наиболее распространенными являются зонд Секстейкена-Блэкмора и его аналог Милуоки. В основе таких известных катетеров лежит механическое сдавление подслизистых сосудов и обтюрация непосредственно самого источника кровотечения, при этом показанием для постановки таких известных катетеров является кровотечение из варикозно-расширенных вен пищевода, кардиоэзофагеального перехода и дна желудка. Большинство специалистов и авторов согласны, что данный способ лечения кровотечения на основе применения катетеров для механического сдавления источника кровотечения является временным с длительностью не более 12 часов, при этом их частота неэффективности остается на уровне 10-15% (Yoshida Н, Mamada Y, Taniai N, Yoshioka M, Hirakata A, Kawano Y, Mizuguchi Y, Shimizu T, Ueda J, Uchida E. Treatment modalities for bleeding esophagogastric varices. J Nippon Med Sch. 2012;79(1):19-30. doi: 10.1272/jnms.79.19). Кроме того, к недостаткам способа лечения кровотечения на основе применения катетеров для механического сдавления источника кровотечения можно отнести проблему постановки таких катетеров при наличии диафрагмальных грыж, а также возникновение некротических изменений слизистой пищевода при механическом сдавлении сосудов.
Свищи желудочно-кишечного тракта
Свищи желудочно-кишечного тракта являются тяжелым осложнением, сопровождающимся высокой частотой летальности, сохраняющейся на уровне 5 20% (Vodyasov AV, Kopaliani DM, Yartsev PA, Kaloeva OK. Conservative treatment of patients with small bowel fistula. Khirurgiia (Mosk). 2021;(4):78-84. Russian. doi: 10.17116/hirurgia202104178). В процессе развития дефекта стенки органа желудочно-кишечного тракта на фоне воспалительной реакции и/или после травматического воздействия (например, травмы, операции, паразитарного воздействия и т.п.) в указанной стенке органа развивается перфорация, через которую содержимое указанного органа начинает поступать в пространства и полости, окружающие указанный орган. Процесс лечения осложняется тем, что из-за воспалительных изменений невозможно закрыть травму просто ушиванием, обтурацией, тампонированием или заклеиванием дефектной стенки. Заживление дефекта стенки органа желудочно-кишечного тракта происходит долго и обусловлено существующим инфицированным раневым процессом, поддерживающейся воспалительной реакцией, а также потерей нутритивных компонентов, микроэлементов и проблемой их восполнения, поэтому все еще актуальной задачей является поиск средств для решения проблемы заживления дефекта стенки органа желудочно-кишечного тракта.
В частности, существует способ стентирования полости поврежденного органа покрытым саморасправляющимся или пластиковым стентом, при этом происходит закрытие дефекта стенки, и разобщается полость органа от окружающего пространства, что предотвращает поступление содержимого и приводит к излечению. Согласно статистке, удачный исход заболевания наблюдается обычно лишь в 53-67% случаев, что связано с увеличение воспаления изначально инфицированной раны при недостаточном дренировании. В ряде случаев по ряду причин (в том числе анатомические особенности пациента, погрешности или отклонения в назначенной диете, продолжающееся воспаление и/или т.п.) происходит миграция стента, что может приводить как к открытию свищевого хода, так и к увеличению первичного дефекта (Brangewitz М, Voigtländer Т, Helfritz FA, Lankisch ТО, Winkler М, Klempnauer J, Manns MP, Schneider AS, Wedemeyer J. Endoscopic closure of esophageal intrathoracic leaks: stent versus endoscopic vacuum-assisted closure, a retrospective analysis. Endoscopy. 2013; 45(6):433-438. doi: 10.1055/s-0032 1326435; Tuebergen D, Rijcken E, Mennigen R et al. Treatment of thoracic esopha- geal anastomotic leaks and esophageal perforations with endoluminal stents: efficacy and current limitations. J Gastrointest Surg 2008; 12: 1168-1176).
Кроме того, существует способ вакуумной терапии для лечения дефектов стенки желудочно-кишечного тракта. Применение способа вакуумной терапии при лечении дефектов стенки желудочно-кишечного тракта обеспечивает непрерывное удаление из брюшной полости кишечного содержимого, а также гноя (Wild Т, Stortecky A, Stremitzer S, Lechner Р, Humpel G, Glaser K, Fortelny R, Karner J, Sautner T. Abdominal dressing - ein neuer Standard in der Behandlung des offenen Abdomensinfolgesekunda  Peritonitis? Zentralbl Chir 2006; 131: S111-4.). Постоянная санация брюшной полости приводит к тому, что за счет вторичных репаративных процессов раневая поверхность отграничивается от полости, уменьшается всасывание через брюшину продуктов распада и происходит постепенное полное заживление, либо происходит формирование полного наружного свища. В случае формирования полного наружного свища через шесть (6) месяцев начинается второй этап хирургического лечения. Тем не менее эффективность подобного подхода сохраняется на уровне 60 80%, поскольку с одной стороны эффективность лечения во многом зависит от восстановительных возможностей организма больного, а с другой сама вакуумная терапия может быть причиной формирования новых свищей и перфоративных отверстий (Wild Т, Goetzinger Р, Telekey В. VAC and fistula formation. Colorectal Dis. 2007 Jul;9(6):572-3. doi: 10.1111/j. 1463-1318.2007.01309. x.).
Peritonitis? Zentralbl Chir 2006; 131: S111-4.). Постоянная санация брюшной полости приводит к тому, что за счет вторичных репаративных процессов раневая поверхность отграничивается от полости, уменьшается всасывание через брюшину продуктов распада и происходит постепенное полное заживление, либо происходит формирование полного наружного свища. В случае формирования полного наружного свища через шесть (6) месяцев начинается второй этап хирургического лечения. Тем не менее эффективность подобного подхода сохраняется на уровне 60 80%, поскольку с одной стороны эффективность лечения во многом зависит от восстановительных возможностей организма больного, а с другой сама вакуумная терапия может быть причиной формирования новых свищей и перфоративных отверстий (Wild Т, Goetzinger Р, Telekey В. VAC and fistula formation. Colorectal Dis. 2007 Jul;9(6):572-3. doi: 10.1111/j. 1463-1318.2007.01309. x.).
Кроме того, существует усовершенствованный способ эндоскопической вакуумной терапии (EVAC-терапии), который основан на том же самом принципе ограничения или прекращения поступления содержимого желудочно-кишечного тракта в окружающие полости и/или пространства с последующим выполнением санации из гнойных полостей (Brangewitz М, Voigtländer Т, Helfritz FA, Lankisch ТО, Winkler М, Klempnauer J, Manns MP, Schneider AS, Wedemeyer J. Endoscopic closure of esophageal intrathoracic leaks: stent versus endoscopic vacuum-assisted closure, a retrospective analysis. Endoscopy. 2013;45(6):433-438. doi: 10.1055/s-0032-1326435). Положительный результат лечения дефекта органа желудочно-кишечного тракта путем применения EVAC-терапии находится на уровне 80%, что в целом обусловлено двумя следующими проблемами. Во-первых, аспирирующая губка регулярно забивается фибрином и содержимым кишечного тракта, в результате чего она перестает функционировать. Во-вторых, больного приходится переводить на парентеральное питание, которое часто не является полностью эффективным, при этом отсутствие питательных сред в пищеводе и кишечнике приводит к повреждению стенки.
Кроме того, существует способ проточно-промывного лечения свищей, являющийся одной из разновидностей EVAC-терапии (Vodyasov AV, Kopaliani DM, Yartsev PA, Kaloeva OK. Conservative treatment of patients with small bowel fistula. Khirurgiia (Mosk). 2021;(4):78-84. Russian, doi: 10.17116/hirurgia202104178). Данный способ проточно-промывного лечения свищей заключается в различной комбинации прводящих и отводящих дренажей, при этом по одним дренажам подают раствор, в том числе антибактерильный раствор, а по другим дренажам осуществляется забор ранее поданного раствора вместе с гноем и содержимым органа с обеспечением отведения указанной жидкой смеси в специальные контейнеры. Один из основных недостатков данного способа проточно-промывного лечения залючается в том, что не всегда возможно наладить адекватный отток содержимого. За счет органов брюшной полости (большой сальник, петли кишечника, брыжейка и т.п.) происходит отграничение дренажей, что приводит к плохому дренированию с последующим развитием абсцессов.
Наличие постоянной потери кишечного содержимого, которое удаляется дренажами, приводит к потере белков, углеводов, жиров и микроэлементов, так что остается нерешенной проблема осуществления нутритивной поддержки. Наличие постоянного поступления как гноя, так и кишечного содержимого приводит к длительному течению перитонита и всасыванию брюшиной продуктов воспаления, что приводит к развитию как системной воспалительной ответной реакции, так и полиорганной недостаточности. Острый панкреатит
Острый панкреатит является воспалительным аутолитическим процессом, развивающимся из-за активизации ферментов в клетках, протоках и межклеточном пространстве поджелудочной железы млекопитающего, при этом одновременно с таким аутолитическим процессом обычно развивается синдром системной воспалительной ответной реакции, что в дальнейшем приводит к развитию полиорганной недостаточности. Согласно международным рекомендациям 2013 года и европейским рекомендациям 2019 года по лечению острого панкреатита, лечение острого панкреатита заключается в активной инфузионной терапии и коррекции осложнений, развивающихся в результате воспаления поджелудочной железы (Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology. 2013 Jul-Aug;13(4 Suppl 2): el-15. doi: 10.1016/j.pan.2013.07.063; Leppäniemi, A., Tolonen, M., Tarasconi, A. et al. 2019 WSES guidelines for the management of severe acute pancreatitis. World J Emerg Surg 14, 27. https://doi.org/10.1186/s13017-019-0247-0).
Топографоанатомическая особенность расположения поджелудочной железы делает этот орган весьма труднодоступным для проведения манипуляций и лечения. При развитии воспаления оно зачастую носит неспецифичный характер, а осложнения распространяются на окружающие органы и пространства.
Основным способом лечения острого панкреатита, рекомендованным как в вышеописанных международных рекомендациях 2013 года и европейских рекомендациях 2019 года по лечению острого панкреатита, так и российским обществом хирургов (Острый панкреатит: Клинические рекомендации / М.Д. Дибиров, С.Ф. Багненко, Д.А. Благовестнов и соавт.; Российское общество хирургов, Ассоциация гепатопанкреатобилиарных хирургов стран СНГ. Москва: Министерство здравоохранения РФ, 2015. - 38 с), является способ лечения острого панкреатита с помощью активной инфузионной терапии. Следует отметить, что один из недостатков такого способа лечения острого панкреатита с помощью активной инфузионной терапии заключается в том, что непосредственно на само воспаление оказывается лишь опосредованное воздействие, при этом ключевое воздействие оказывается на различные патологические процессы, коррекция которых осуществляется с помощью активного вымывания воспалительных комплексов.
В патенте РФ №2607929 (далее RU 2607929), опубликованном 10 января 2017 года, описано устройство для лечения панкреатита, которое реализует способ лечения острого панкреатита путем улучшения оттока панкреатического сока и желчи с помощью контролируемого отрицательного давления (разрежения). Ввиду того, что в первые несколько суток течения острого панкреатита нарушается перистальтика двенадцатиперстной кишки, активная аспирация, создаваемая устройством согласно RU 2607929, восстанавливает физиологический отток секрета из органов. Недостаток способа лечения острого панкреатита согласно RU 2607929 заключается в конструктивных особенностях устройства согласно RU 2607929, используемого для реализации этого способа. В частности, устройство для лечения панкреатита согласно RU 2607929 содержит приспособление в виде цилиндра, которое обеспечивает оптимальное прилегание к стенке двенадцатиперстной кишки и формирует полость вокруг большого дуоденального сосочка. Принимая во внимание вариацию анатомических форм впадения панкреатического протока (одним выводным протоком или с добавочным) и возможное наличие парапапилярного дивертикула, устройство для лечения панкреатита согласно RU 2607929 может и не быть применимо к ряду пациентов, а также может вызывать обтурацию и, следовательно, даже стать причиной панкреатита. Устройство для лечения панкреатита, раскрытое в RU 2607929, при его заведении через нос может привести к травматизации носовых ходов, а при его размещении в двенадцатиперстной кишке может занять неудобное положение, в частности приспособление для прикрепления к стенке двенадцатиперстной кишки может расположиться не напротив дуоденального сосочка, что может потребовать проведения отдельной сложной эндоскопической манипуляции для разворота указанного приспособления с обеспечением его размещения напротив дуоденального сосочка.
Кроме того, в патенте США №8529612 (далее US 8529612), опубликованном 04 февраля 2010 года, раскрыт способ лечения острого панкреатита, в том числе его тяжелой формы, путем создания локальной области охлаждения. Таким образом, в основе способа лечения острого панкреатита, раскрытого в US 8529612, лежит искусственно созданная гипотермия, которая тормозит различных протеолитических ферментов и продукцию факторов воспаления, что снижает активность синдрома системного воспалительного ответа (ССВО, SIRS), либо даже остановит развитие этого синдрома. При осуществлении способа лечения острого панкреатита, раскрытого в US 8529612, гипотермию создают за счет введения катетера с одним или несколькими баллонами, при этом охлажденную жидкость подают в указанные баллоны или замещают в них с помощью насоса. Кроме того, при осуществлении способа лечения острого панкреатита, описанного в US 8529612, скорость обмена охлажденной жидкости контролируют либо путем изменения скорости подачи и забора этой охлажденной жидкости, либо автоматически с помощью датчика измерения температуры раствора, который выявляет достижение заданного значения скорости обмена охлажденной жидкости, при котором происходит включение насоса и замена жидкости в баллонах. Следует отметить, что способ лечения острого панкреатита, описанный в US 8529612, является модификацией существующего стандартного лечения панкреатита, в основе которого лежит прикладывание пузыря со льдом на переднюю брюшную стенку. Преимущество способа лечения острого панкреатита, раскрытого в US 8529612, заключается в том, что создаваемая область охлаждения находится в непосредственной близости от поджелудочной железы, что исключает влияние кожи, подкожной клетчатки и прочих органов на процесс охлаждения забрюшинного пространства. Недостатком же способа лечения острого панкреатита, раскрытого в US 8529612, является то, что авторы в US 8529612 предлагают изолированно установить баллоны с жидкостью в желудок пациента на длительный период времени, в том числе в комбинации с заведением в двенадцатиперстную кишку и тощую кишку. В частности, при наличии у больного пареза кишечника в острой фазе панкреатита и парапанкреатического инфильтрата введение баллонов с жидкостью, масса которых будет составлять более 300 г, будет приводить к неприятным ощущениям у больного (например, боли в животе, тяжесть, тошнота, рвота), особенно при заполнении жидкостью баллонов, установленных в различные отделы кишечника. Следует отметить, что длительное воздействие баллонов с жидкостью, имеющих массу более 100 г, на стенку часто приводит к ишемическим изменениям в слизистой оболочке желудка. Авторы в US 8529612 ссылаются на опыт применения баллонов для лечения ожирения, однако в случае острого панкреатита множество информационных источников из уровня техники свидетельствуют о наличии микротромбозов и изменении микроциркуляции в органах этой анатомической области при остром панкреатите (Kröner Р.Т., Wallace М.В., Raimondo М., Antwi S.O., Ma Y., Li Z., Ji В., Bi Y. Systemic anticoagulation is associated with decreased mortality and morbidity in acute pancreatitis. Pancreatology. 2021 Dec;21(8):1428-1433. doi: 10.1016/j.pan.2021.09.003). Для специалиста в данной области техники должно быть очевидно, что при осуществлении способа лечения острого панкреатита, раскрытого в US 8529612, расправление баллонов приведет к развитию обтурации просвета желудка, двенадцатиперстной и тощей кишки, однако авторы не предложили в US 8529612 вообще какого-либо решения данной проблемы, в частности не описали то, каким образом может быть осуществлено дренирование различных отделов желудочного тракта. Таким образом, установка катетера в различных его вариациях в соответствии со способом лечения острого панкреатита, раскрытым в US 8529612, не может быть осуществлена более чем на 6 часов, поскольку в противном случае у больного может развиться осложнение в виде острой механической обструктивной кишечной непроходимости, которая является очень серьезным нежелательным явлением. В US 8529612 также не решен вопрос препятствия миграции катетера и предупреждения обтурации большого дуоденального сосочка, что может приводить к ухудшению течения острого панкреатита.
Кроме того, известны способы лечения острого панкреатита путем введения различных лекарственных средств для обратной регуляции секреторной функции поджелудочной железы, например, холиноблокирующих лекарственных препаратов (Савельев B.C. и соавт. Острый панкреатит.- М.: Медицина, 1983; Чаплинский В.В., Гнатышак А.И. Острый панкреатит.- М.: Медицина, 1972), ингибиторов протеаза (Филин В.И., Костюченко А.Л. Неотложная панкреатология. - СПб, 1994, Соколов В.И. Хирургические заболевания поджелудочной железы. - М.: Медицина, 1998), даларгина (Филин В.И., Костюченко А.Л. Неотложная панкреатология. - СПб, 1994), аналогов соматотропного гормона (Филин В.И., Костюченко А.Л. Неотложная панкреатология. - С-Пб, 1994; Шапошников А.В. Рос. журн. гастроэнтерол., гепатол., колопроктол. - 1996. - 4. - с. 85-89; Uhl W. et al. Gut. -1999. - Vol. 40. - P. 424-429), трипсина (патент RU 2198680 на изобретение «Способ лечения острого панкреатита», опубликованный 20 февраля 2003 года). Согласно информационным источникам из уровня техники, при остром панкреатите развивается патологическая гиперстимуляция экскреторной функции поджелудочной железы, в связи с чем введение ряда лекарственных препаратов, в том числе локально в двенадцатиперстную кишку, направлено на снижения выработки ферментов. Анализ данных из информационных источников из уровня техники показал, что применение любого из вышеперечисленных агентов не давало значимого улучшения течения острого панкреатита и не было включено ни в одни из стандартных рекомендаций по лечению этого заболевания (за исключением аналогов соматотропного гормона), что по мнению авторов настоящей заявки связано как с токсичностью ряда лекарственных препаратов, так и с их недостаточным воздействием на все патофизиологические цепи аутолитического воспаления.
Кроме того, в патенте РФ №2263517 (далее RU 2263517), опубликованном 10 ноября 2005 года, раскрыт способ лечения и профилактики острого панкреатита путем стентирования панкреатического протока. Способ лечения и профилактики острого панкреатита, раскрытый в RU 2263517, наиболее часто применяют при лечении билиарного панкреатита, в частности для профилактики развития панкреатита после механической травматизации, например после холангиопанкреатографии. Подходы к лечению и профилактике панкреатита, аналогичные способу лечения и профилактики острого панкреатита, раскрытому в RU 2263517, были внедрены в стандартные рекомендации в качестве меры по профилактике панкреатита после различных вмешательств на протоковой системе, при это в их основе лежит обеспечение своевременного оттока панкреатического сока из железы для предотвращения активации ферментов в органе. Однако в настоящее время применение подобных подходов в случае острого панкреатита весьма ограничено, поскольку на фоне дисфункции большого дуоденального сосочка и нарушения моторики двенадцатиперстной кишки применение таких подходов часто приводит к забросу кишечного содержимого в протоковую систему и росту уровня панкреатической гипертензии, что в свою очередь может приводить к ухудшению течения острого панкреатита.
Повреждения стенки тонкой кишки
При повреждении или ранении полых органов брюшной полости телами, обладающими высокой кинетической энергией, в стенке этих полых органов происходит образование нескольких зон, включая некротическую зону и зону молекулярного сотрясения. Окончательный объем поражения полого органа брюшной полости формируется спустя 24-72 часа после получения травмы. При оказании помощи пострадавшим в пункте первичной специализированной медицинской помощи в первые часы после ранения невозможно прогнозировать и оценить окончательный объем поражения полого органа. Оставить незакрытыми дефекты или повреждения желудочно-кишечного тракта представляется невозможным, поскольку это приведет к развитию перитонита и ухудшению течения заболевания. Общепринятыми подходами к лечению дефектов или повреждений стенок травмированных полых органов брюшной полости являются простое ушивание таких повреждений стенок травмированных органов, первичная резекция поврежденных или травмированных петель кишечника или комбинация таких подходов. Ушивание повреждений стенок травмированных органов брюшной полости как один из подходов лечения таких повреждений занимает меньше времени и требует меньшей квалификации специалиста и решает вопрос развития перитонита, однако в большинстве случаев при использовании данного подхода спустя 48-96 часов в области ушивания происходит развитие повторных перфораций вследствие окончательного формирования некротической зоны (зоны некроза). Результатом ушивания повреждений стенок травмированных органов брюшной полости являются продолжительное лечение больного, занимающее несколько месяцев, высокая частота летальных исходов и высокий риск формирования свищей желудочно-кишечного тракта, требующих длительного периода реабилитации и высокотехнологичной медицинской помощи. В случае первичной резекции травмированных петель кишечника сохраняется риск того, что будет оставлен участок кишки, у которого была краевая травма, и в нем также спустя установленное время может развиться участок некроза. Еще одной проблемой первичной резекции травмированных петель кишечника является избыточное удаление петель кишечника, что может приводить к возникновению синдромов мальабсорбции или мальдигестии и к пожизненным алиментарным заболеваниям пациента.
Отдельной хирургической проблемой являются ранения двенадцатиперстной кишки и анатомической области связки Трейца (граница между двенадцатиперстной кишкой и начальными отделами тощей кишки). В связи с особенностями анатомического расположения в таких случаях невозможно выполнить стандартную резекцию, а присутствие крайне агрессивной среды, представляющей собой смесь панкреатического сока, желчи и желудочного сока, является причиной развития несостоятельности, свищей и высокой летальности больных.
В организационном плане вышеперечисленные виды ранений или повреждений полых органов брюшной полости больных требуют как наличия отдельных абдоминальных хирургов, так и большого количества времени, которое необходимо затратить на оказание первичной специализированной медицинской помощи. В среднем на любой из двух вышеописанных подходов к лечению дефектов или повреждений стенок травмированных полых органов брюшной полости требуется 1,5-3 часа, что в условиях большого объема поступающих раненых может приводить к несвоевременному оказанию медицинской помощи и, следовательно, к повышению вероятности наступления летательного исхода.
В заключение следует отметить, что в патенте США №9526874 (далее US 9526874), опубликованном 30 июля 2015 года, описан катетер для создания изолированной области в полом органе человека, который может быть выбран в качестве наиболее близкого аналога (прототипа). Катетер, описанный в US 9526874, содержит удлиненное тело, выполненное с возможностью его установки в просвет полого органа человека и оснащенное двумя баллонами, выполненными с возможностью раздувания с обеспечением возможности создания между ними изолированного пространства полого органа, причем в указанном теле проходит функциональный канал с функциональным отверстием, выполненным в указанном теле между указанными баллонами, а функциональный канал обеспечивает возможность создания в указанном изолированном пространстве разряжения воздуха с обеспечением возможности забора из него биологической текучей среды, специфичной для указанного полого органа, или возможность подачи текучей среды в указанное изолированное пространство. Недостаток катетера по US 9526874 заключается в невозможности его установки в просвет полого органа млекопитающего на длительный период времени по причине отсутствия физиологического сообщения между отделами указанного полого органа, прилегающими к области полого органа, изолированной надутыми баллонами.
Таким образом, очевидна потребность в дальнейшем совершенствовании катетеров для создания изолированной области в полом органе млекопитающего, в частности для обеспечения возможности длительного использования таких катетеров в полых органах млекопитающего.
Следовательно, техническая проблема, решаемая настоящим изобретением, состоит в создании катетера для создания изолированной области в полом органе млекопитающего, в котором по меньшей мере частично устранен обозначенный выше недостаток известного катетера, заключающийся в отсутствии возможности его установки в просвет полого органа млекопитающего на длительный период времени.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задача настоящего изобретения состоит в разработке катетера для создания изолированной области в полом органе млекопитающего, решающего по меньшей мере обозначенную выше техническую проблему.
В первом аспекте настоящего изобретения поставленная задача решена при применении для лечения повреждения стенки тощей кишки или подвздошной кишки
катетера для создания изолированной области в полом органе млекопитающего, содержащего:
удлиненное тело, выполненное с возможностью его установки в просвет полого органа млекопитающего и оснащенное двумя баллонами, выполненными с возможностью раздувания с обеспечением возможности создания между ними изолированного пространства полого органа,
причем в указанном теле проходит функциональный канал с функциональным отверстием, выполненным в указанном теле между указанными баллонами, а функциональный канал обеспечивает возможность создания в указанном изолированном пространстве отрицательного давления с обеспечением возможности забора из него текучей или газообразной среды через функциональное отверстие, или возможность подачи медицинской текучей или газообразной среды в указанное изолированное пространство через функциональное отверстие, при этом
в указанном теле проходит еще один канал, снабженный на противоположных концах соответственно впускным и выпускным отверстиями, выполненными в указанном теле за пределами его части, ограниченной указанными баллонами.
Во втором аспекте настоящего изобретения поставленная задача решена при применении для лечения повреждения стенки тощей кишки или подвздошной кишки
катетера для создания изолированной области в полом органе млекопитающего, содержащего:
удлиненное тело, выполненное с возможностью его установки в просвет полого органа млекопитающего и оснащенное двумя баллонами, выполненными с возможностью раздувания с обеспечением возможности изолирования между ними пространства полого органа,
причем в указанном теле проходит функциональный канал с функциональным отверстием, выполненным в указанном теле между указанными баллонами, а
функциональный канал обеспечивает возможность создания в указанном изолированном пространстве отрицательного давления с обеспечением возможности забора из него текучей или газообразной среды через функциональное отверстие, или возможность подачи медицинской текучей или газообразной среды в указанное изолированное пространство через функциональное отверстие, при этом
в указанном теле проходит еще один канал, снабженный на противоположных концах соответственно впускным и выпускным отверстиями, выполненными в указанном теле за пределами его части, ограниченной указанными баллонами, и
указанное тело дополнительно снабжено сеткой или оболочкой, выполненной проницаемой для текучей и/или газообразной среды, причем указанная сетка или оболочка по меньшей мере частично охватывает часть катетера, ограниченную указанными баллонами, с обеспечением покрытия указанного функционального отверстия и прикреплена к указанным баллонам или охватывает их таким образом, что их раздувание обеспечивает возможность натягивания указанной сетки или оболочки.
В третьем аспекте настоящего изобретения поставленная задача решена при применении для лечения повреждения стенки тощей кишки или подвздошной кишки катетера для создания изолированной области в полом органе млекопитающего, содержащего:
удлиненное тело, выполненное с возможностью его установки в просвет полого органа млекопитающего и оснащенное двумя баллонами, выполненными с возможностью раздувания с обеспечением возможности изолирования между ними пространства полого органа,
причем в указанном теле проходит функциональный канал с функциональным отверстием, выполненным в указанном теле между указанными баллонами, а
функциональный канал обеспечивает возможность создания в указанном изолированном пространстве отрицательного давления с обеспечением возможности забора из него текучей или газообразной среды через функциональное отверстие, или возможность подачи медицинской текучей или газообразной среды в указанное изолированное пространство через функциональное отверстие, при этом
в указанном теле проходит еще один канал, снабженный на противоположных концах соответственно впускным и выпускным отверстиями, выполненными в указанном теле за пределами его части, ограниченной указанными баллонами, а функциональное отверстие находится между двумя кольцевыми ограждающими выступами, которыми снабжено тело катетера между указанными баллонами.
В первом, втором и третьем аспектах настоящего изобретения применяемый катетер для создания изолированной области в полом органе млекопитающего обеспечивает технический результат, заключающийся в предотвращении или исключении возможности формирования застойных и/или воспалительных процессов в полом органе в виде тощей кишки или подвздошной кишки вследствие, в частности, накопления в этом полом органе слизи и прочего биологического содержимого, специфичного для указанного полого органа, за пределами одного из надутых изолирующих баллонов. В частности, формирование застойных и/или воспалительных процессов в полом органе млекопитающего предотвращена или исключена благодаря тому, что накапливающиеся в полом органе слизь и прочее биологическое содержимое, специфичное для указанного полого органа, могут попасть во впускное отверстие, выполненное в теле катетера за пределами соответствующего одного из двух баллонов катетера, и выйти из выпускного отверстия, выполненного в теле катетера за пределами другого баллона катетера.
Наличие сетчатой оболочки, покрывающей функциональное отверстие тела катетера, и возможность натягивания сетчатой оболочки при раздувании баллонов в катетере согласно второму аспекту настоящего изобретения, применяемом для создания изолированной области в полом органе млекопитающего, обеспечивает дополнительный технический результат, заключающийся в повышении нетравматичности или безопасности использования катетера, в частности благодаря предотвращению возможности всасывания или засасывания ткани полого органа в функциональное отверстие, которое могло бы привести к повреждению указанной ткани, и еще один дополнительный технический результат, заключающийся в повышении надежности катетера согласно настоящему изобретению, в частности благодаря предотвращению возможности частичного или полного блокирования или закупоривания функционального отверстия катетера, которое может быть вызвано всасыванием или засасыванием ткани полого органа в указанное функциональное отверстие и которое могло бы привести к необходимости извлечения установленного катетера из полого органа млекопитающего с последующей заменой указанного катетера на новый катетер или последующей очисткой функционального отверстия извлеченного катетера от попавшей туда ткани полого органа.
Наличие двух выступов, ограждающих функциональное отверстие, выполненное в теле катетера согласно третьему аспекту настоящего изобретения, обеспечивает дополнительный технический результат, заключающийся в повышении нетравматичности или безопасности использования катетера согласно настоящему изобретению, в частности благодаря предотвращению возможности всасывания или засасывания ткани полого органа в функциональное отверстие (ограждающие выступы не позволяют функционального отверстию катетера войти в прямой контакт с тканью полого органа или непосредственно приблизиться к ней на расстояние, достаточное для засасывания указанной ткани в функциональное отверстие при создании отрицательного давления в пространстве полого органа, изолированном баллонами катетера), которое могло бы привести к повреждению указанной ткани, и еще один дополнительный технический результат, заключающийся в повышении надежности катетера согласно настоящему изобретению, в частности благодаря предотвращению возможности частичного или полного блокирования или закупоривания функционального отверстия катетера, которое может быть вызвано всасыванием или засасыванием ткани полого органа в указанное функциональное отверстие и которое могло бы привести к необходимости извлечения установленного катетера из полого органа млекопитающего с последующей заменой указанного катетера на новый катетер или последующей очисткой функционального отверстия извлеченного катетера от попавшей туда ткани полого органа.
Выполнение двух ограждающих выступов, между которыми находится функциональное отверстие в катетере согласно третьему аспекту настоящего изобретения, именно между баллонами катетера и кольцевая форма исполнения указанных ограждающих выступов также обеспечивают сформулированный выше дополнительный технический результат, заключающийся в повышении нетравматичности или безопасности использования катетера, в частности благодаря расширению или увеличению объема изолированного пространства в полом органе млекопитающего, в котором может быть создано отрицательное давление, что позволяет существенно расширить возможности по созданию в изолированном пространстве полого органа контролируемого отрицательного давления с необходимым для забора уровнем, характерным для различных полых органов млекопитающих с различными физиологическими особенностями этих полых органов, предотвратив тем самым возможность создания в указанном изолированном пространстве избыточного отрицательного давления, которое могло бы вызвать всасывание или засасывание ткани полого органа в функциональное отверстие катетера и, следовательно, могло бы привести к повреждению указанной ткани.
Выполнение двух ограждающих выступов, между которыми находится функциональное отверстие в катетере согласно третьему аспекту настоящего изобретения, именно между баллонами катетера и кольцевая форма исполнения указанных ограждающих выступов также обеспечивают еще один сформулированный выше дополнительный технический результат, заключающийся в повышении надежности катетера согласно настоящему изобретению, в частности благодаря тому, что увеличенный объем изолированного пространства в полом органе млекопитающего, в котором может быть создано отрицательное давление, позволяет существенно расширить возможности по созданию в изолированном пространстве полого органа контролируемого отрицательного давления с необходимым для забора уровнем, характерным для различных полых органов млекопитающих с различными физиологическими особенностями этих полых органов, и, следовательно предотвратить возможности частичного или полного блокирования или закупоривания функционального отверстия катетера, которое может быть вызвано всасыванием или засасыванием ткани полого органа в указанное функциональное отверстие и которое могло бы привести к необходимости извлечения установленного катетера из полого органа млекопитающего с последующей заменой указанного катетера или последующей очисткой функционального отверстия катетера от попавшей туда ткани полого органа.
Кроме того, выполнение двух ограждающих выступов, между которыми находится функциональное отверстие в катетере согласно третьему аспекту настоящего изобретения, именно между баллонами катетера и кольцевая форма исполнения указанных ограждающих выступов также позволяют улучшить универсальность катетера согласно настоящему изобретению, в частности благодаря расширению возможностей по созданию контролируемого отрицательного давления с необходимым для забора уровнем в изолированном пространстве полого органа млекопитающего и/или подаче медицинской текучей или газообразной среды с требуемой дозой или в требуемом объеме, характерных для различных полых органов млекопитающих с различными физиологическими особенностями этих полых органов и/или характерных для различных заболеваний полых органов млекопитающих в указанное изолированное пространство, при этом такие расширенные возможности обусловлены увеличенным объемом изолированного пространства в полом органе млекопитающего, в котором может быть создано контролируемое отрицательное давление или в которое может быть подача медицинская текучая или газообразная среда.
Кроме того, выполнение двух ограждающих выступов, между которыми находится функциональное отверстие в катетере согласно третьему аспекту настоящего изобретения, именно между баллонами катетера и кольцевая форма исполнения указанных ограждающих выступов также обеспечивают возможность надлежащего центрирования указанного функционального отверстия по отношению к целевой области полого органа млекопитающего, из которой осуществляется забор текучей или газообразной среды или в которую осуществляется подача медицинской текучей или газообразной среды.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Прилагаемые чертежи, которые приведены для обеспечения лучшего понимания сущности настоящего изобретения, составляют часть настоящего документа и включены в него для иллюстрации нижеописанных вариантов реализации настоящего изобретения. Прилагаемые чертежи в сочетании с приведенным ниже описанием служат для пояснения сущности настоящего изобретения. На чертежах:
на фиг. 1 схематически показан катетер для создания изолированной области в полом органе млекопитающего согласно настоящему изобретению;
на фиг. 2 схематически показана часть катетера для создания изолированной области в полом органе млекопитающего, показанного на фиг. 1, с функциональным отверстием;
на фиг. 3 показан катетер для создания изолированной области в полом органе согласно настоящему изобретению, снабженный сетчатой оболочкой, при спущенных или сдутых баллонах;
на фиг. 4 показан катетер для создания изолированной области в полом органе согласно настоящему изобретению, снабженный сетчатой оболочкой, при надутых баллонах.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
В контексте данного документа, если явно не указано иное, термин «пациент» означает, в первую очередь, потенциально больного человека (являющегося представителем класса млекопитающих), обратившегося за медицинской помощью или находящегося под медицинским наблюдением с целью диагностики и/или лечения его(ее) заболевания, а также означает потенциально больных животных, относящихся к классу млекопитающих и находящихся под медицинским наблюдением с целью диагностики и/или лечения их заболевания.
Кроме того, в контексте данного документа, если явно не указано иное, термин «млекопитающее» означает, в первую очередь, человека, а также означает животное, в частности человекообразных и нечеловекообразных приматов, собак, кошек, лошадей, верблюдов, ослов, коров, овец, свиней и иных хорошо известных животных, относящихся к классу млекопитающих.
Кроме того, в контексте данного документа, если явно не указано иное, термин «пользователь» означает любого надлежащим образом обученного медицинского работника, уполномоченного осуществлять установку катетера согласно настоящему изобретению в полый орган млекопитающего (в частности, человека), извлечение катетера согласно настоящему изобретению из полого органа млекопитающего и/или манипуляции с установленным в полом органе млекопитающего катетером согласно настоящему изобретению, при этом указанным медицинским работником может являться, например, врач-хирург, врач-онколог, врач-эндоскопист, торакальный хирург, ангиохирург, уролог, ветеринарный врач и т.д.
В настоящее время наиболее перспективным методом диагностики и/или лечения воспалительных, аутоиммунных, инфекционных, доброкачественных и/или злокачественных заболеваний, возникающих в полых органах и связанных с ними органах млекопитающего, в частности заболеваний поджелудочной железы, желчевыводящих протоков, печени, желудочно-кишечного тракта, а также дефектов и травм полых органов млекопитающего, свищей, стриктур, аневризматических и дивертикулярных расширений и/или т.п., является жидкостная биопсия, основанная на выявлении в биологических жидкостях или текучих средах организма, специфичных для указанного полого органа и связанных с ним органов млекопитающего, признаков, являющихся характерными для вышеуказанных заболеваний. В частности, в основе метода жидкостной биопсии, используемого для диагностики и/или лечения рака поджелудочной железы млекопитающего в начальной стадии и предраковой трансформации лежит выявление в биологических жидкостях организма млекопитающего (таких как кровь и панкреатический сок) циркулирующих патологических клеток или циркулирующей опухолевой ДНК, РНК, белков, пептидов, метаболитов, а также циркулирующих опухолевых экзосом.
Одним из критических аспектов данного исследовании является количество получаемого материала, в связи с чем для выполнения диагностики необходимо иметь достаточное количество получаемого материала. Еще одним критическим аспектом данного исследовании является определение локализации опухоли, поскольку выделенный из образца патологический генетический материал может быть присущ раку различных органов. По этой причине для диагностики рака, муцинозных и интраэпителиальных неоплазм поджелудочной железы наиболее подходящей диагностической жидкостью, в которой следует выявлять циркулирующие опухолевые клетки, ДНК, экзосомы, является панкреатический сок. Однако, именно забор панкреатического сока и является наиболее сложной задачей.
Следует отметить, что малый и большой дуоденальные соски или сосочки (также называемые в уровне техники соответственно как Санториниев сосочек и Фатеров сосочек) представляют собой каждый анатомическую структуру в виде полусферического, конусовидного или уплощенного возвышения, расположенного на конце продольной складки слизистой оболочки в середине нисходящей части двенадцатиперстной кишки примерно на 12-14 см ниже привратника, при этом в большинстве случаев оно открывается в просвет двенадцатиперстной кишки одним отверстием, общим для желчного и панкреатического протоков, а в остальных случаях добавочный панкреатический проток открывается в виде малого дуоденального сосочка на 2-4 см выше большого дуоденального сосочка. В дуоденальном сосочке располагается печеночно-поджелудочная ампула, в которую поступает желчь и пищеварительные соки поджелудочной железы, а также расположен сфинктер Одди, регулирующий поступление желчи и панкреатического сока в двенадцатиперстную кишку и не допускающий попадание содержимого кишечника в желчный и панкреатический протоки. Таким образом, в двенадцатиперстной кишке человека большой дуоденальный сосочек обычно находится в 12-14 см ниже привратника, а малый дуоденальный сосочек находится на 2-4 см выше большого дуоденального сосочка.
В частности, для обеспечения попадания панкреатического сока в просвет двенадцатиперстной кишки требуется создание за счет перистальтики самого кишечника отрицательного давления вокруг фатерова или дуоденального сосочка на уровне 40-100 мм. вод. ст., являющееся физиологическим давлением (Физиология пищеварения. С. Теэсалу. 1987. Тарту. Тартуский государственный университет. С. 84; The Pancreas. Third edition. 2018. Blackwell. UK. 1300). Еще одним критерием является необходимость изолированного забора панкреатического сока без желудочного и дуоденального содержимого с неактивными пищеварительными (дигестивными) ферментами, поскольку в противном случае энзимы будут расщеплять необходимые для диагностики аминокислоты, экзосомы, ДНК и клетки.
На фиг. 1-4 схематически показан катетер 100 для создания изолированной области в полом органе согласно настоящему изобретению, который представляет собой катетер, устанавливаемый пользователем в просвет полого органа пациента, при этом корпус или тело катетера 100 выполнено в виде гибкой полой трубки, которой приданы размеры, в частности длина и толщина, подходящие для ее введения или продвижения пользователем в место установки в просвете полого органа пациента. В качестве пользователя катетера 100 может выступать любой надлежащим образом обученный медицинский работник, такой как, например, врач-хирург, врач-онколог, врач-эндоскопист, торакальный хирург, ангиохирург, уролог, ветеринарный врач, и т.п. В качестве пациента, в отношении которого используют катетер 100 для создания изолированной области в полом органе, может выступать человек или животное, относящееся к классу млекопитающих.
Катетер 100, показанный на фиг. 1, снабжен осевым отверстием 11 на своем дистальном конце, которым катетер 100 вставляют или вводят пациенту с последующим продвижением в место его установки в просвете полого органа пациента, в частности в желудочно-кишечном тракте, желчных протоках, дыхательных путях, мочевыделительной системе, сосудах пациента, полости матки и влагалища и т.п. Кроме того, катетер 100 снабжен тройником 12 на своем проксимальном конце, противоположном дистальному концу катетера 100 и находящемся за пределами тела пациента при установке катетера 100 в просвет полого органа пациента.
Как показано на фиг. 1, тройник 12 в катетере 100 представляет собой патрубок или трубку с тремя ответвлениями или выводами: центральным выводом 9 и двумя боковыми выводами 8, 10, герметически изолированными от центрального вывода 9, при этом указанные выводы 8, 9, 10 снабжены каждый на своем свободном конце соответствующим отверстием и выполнены каждый с возможностью подключения или присоединения соответствующего функционального устройства или приспособления.
Центральный вывод 9 в тройнике 12 выполнен с возможностью подключения или присоединения к нему приспособления или устройства для подачи газообразной или текучей среды (не показано), например смеси для энтерального питания. В качестве такого устройства для подачи газообразной или текучей среды, соединяемого с центральным выводом 9, может быть использован, например, медицинский шприц, наполненный, например, смесью для энтерального питания, которая может полностью обеспечивать потребность организма пациента в основных питательных веществах, энергии, витаминах, макронутриентах, микронутриентах и/или т.п., а также медицинская капельница, наполненная, например, смесью для энтерального питания, или другие устройства и приспособления, в том числе автоматические или полуавтоматические, подходящие для подключения к центральному выводу 9 с обеспечением подачи в него газообразной или текучей среды, например смеси для энтерального питания. Таким образом, устройство для подачи газообразной или текучей среды, подключенное или присоединенное к центральному выводу 9, может быть использовано для обеспечения, например, нутритивной поддержки или клинического питания пациента при установке в просвете его двенадцатиперстной кишки катетера 100. Кроме того, устройство для подачи текучей или газообразной среды, подключенное или присоединенное к центральному выводу 9, может быть использовано для санации желудка и двенадцатиперстной кишки пациента.
Боковой вывод 8 в тройнике 12 выполнен с возможностью подключения или присоединения к нему функционального устройства в виде, например, медицинского отсасывателя, аспирационного устройства или аспиратора (не показан), содержащего накопительный контейнер или накопительную емкость для сбора газообразной среды, жидкости и/или текучей среды (не показана) и воздушный компрессор (не показан) для высасывания или отсасывания воздуха.
Кроме того, боковой вывод 8 в тройнике 12 выполнен с возможностью подключения или присоединения к нему специального приспособления или устройства для подачи газообразной или текучей среды, например лекарственных средств, при этом в качестве такого устройства для подачи текучей среды может быть использован, например, медицинский шприц, наполненный подаваемой текучей средой, или медицинская капельница, наполненная подаваемой текучей средой, или другие устройства или приспособления, в том числе автоматизированные или полуавтоматизированные, подходящие для подключения к боковому выводу 8 с обеспечением возможности подачи в него указанной текучей среды.
Другой боковой вывод 10 в тройнике 12 выполнен с возможностью подключения или присоединения к нему приспособления или устройства для подачи текучей среды под напором или давлением (не показано), например воды или воздуха, при этом в качестве такого устройства для подачи текучей среды может быть использован, например, медицинский шприц, наполненный подаваемой текучей средой, а также медицинская капельница, наполненная подаваемой текучей средой, или другие устройства и приспособления, в том числе автоматизированные или полуавтоматизированные, подходящие для подключения к боковому выводу 10 с обеспечением подачи в него указанной текучей среды.
Следует отметить, что устройство для подачи текучей среды (не показано), такой как, например, смесь для энтерального питания, соединяемое с центральным выводом 9 катетера 100, функциональное устройство (не показано), соединяемое с боковым выводом 8 катетера 100, и/или устройство для подачи текучей среды (не показано), такой как, например, вода, соединяемое с боковым выводом 10 катетера 100, в сочетании с самим катетером 100, показанным на фиг. 1-4, могут образовывать систему для создания изолированной области в полом органе млекопитающего, которая может быть использована, в частности, для забора биологической жидкости (не показана), в частности биологической текучей среды, специфичной для конкретного полого органа млекопитающего, например панкреатического сока и желчи, или может входить в состав такой системы.
Кроме того, как показано на фиг. 1-4, тело катетера 100 снабжено со своей наружной стороны двумя изолирующими баллонами 4, которые представляют собой каждый расправляющийся или раздувающийся мягкий резервуар и которые расположены на заданном расстоянии друг от друга и от дистального конца катетера 100. Между изолирующими баллонами 4 в теле катетера 100 выполнено функциональное устье или отверстие 7, при этом при установке катетера 100 в просвет полого органа пациента один из изолирующих баллонов 4, наиболее удаленный от дистального конца катетера 100, оказывается расположенным дальше интересующей области в полом органе, другой изолирующий баллон оказывается изолированным до интересующей области в полом органе, а функциональное отверстие 7 находится напротив интересующей области или рядом с ним, например больших дуоденальных сосочков, кишечного свища, места травмы стенки, опухоли или т.п.
Кроме того, катетер для создания изолированной области в полом органе 100 содержит три отдельных функциональных канала, выполненных в удлиненном теле катетера 100: основной канал 1, подающий канал 2 для подачи текучей или газообразной среды, герметически изолированный от основного канала 1 и снабженный отверстиями, выполненными в теле катетера 100 и открытыми каждое внутрь соответствующего одного из изолирующих баллонов 4, и функциональный канал 3, отделенный от подающего канала 2 и герметически изолированный от основного канала 1, при этом подающий канал 2 и функциональный канал 3 проходят в пределах части основного канала 1 по его длине.
Основной канал 1, проходящий в целом по всей длине катетера 100, сообщается с центральным выводом 9 тройника 12, при этом основной канал 1 имеет входное или впускное отверстие, соответствующее отверстию, выполненному в центральном выводе 9 на проксимальном конце катетера 100, и выходное или выпускное отверстие, соответствующее осевому отверстию 11 на дистальном конце катетера 100. При установке катетера 100 в просвет полого органа пациента впускное отверстие основного канала 1 оказывается открытым наружу с обеспечением сообщения с внешней или окружающей средой, а выпускное отверстие основного канала 1 оказывается открытым в полость органа, например пищевода, желудка и двенадцатиперстной, тонкого или толстого кишечника, а также дыхательных путей, желчевыводящих путей, мочевыделительных путей, сосудов. Таким образом, при присоединении к центральному выводу 9 тройника 12 вышеописанного устройства для подачи энтерального питания (не показано) обеспечена возможность подачи под напором или давлением лекарственных средств, смеси для энтерального или парентерального питания из указанного устройства сначала в центральный вывод 9 через выполненное в нем отверстие, далее из центрального вывода 9 в основной канал 1, а затем из основного канала 1 в полость полого органа через осевое отверстие 11.
Подающий канал 2, проходящий в целом вдоль части длины катетера 100, сообщается с каждым из изолирующих баллонов 4 посредством соответствующего одного из выходных отверстий 13, 14, выполненных в теле катетера 100, как показано на фиг. 2, и сообщается с боковом выводом 10 тройника 12, при этом подающий канал 2 имеет входное или впускное отверстие, соответствующее отверстию, выполненному в боковом выводе 10 на проксимальном конце катетера 100. При установке катетера 100 в просвет полого органа пациента впускное отверстие подающего канала 2 оказывается открытым наружу с обеспечением сообщения с внешней или окружающей средой. Таким образом, при присоединении к боковому выводу 10 тройника 12 вышеописанного устройства для подачи газообразной или текучей среды (не показано) обеспечена возможность подачи под напором газообразной или текучей среды, например воды, в заданном объеме из указанного устройства сначала в боковой вывод 10 через выполненное в нем отверстие, далее из бокового вывода 10 в подающий канал 2, а затем из подающего канала 2 в оба изолирующих баллона 4 через соответствующие отверстия, выполненные в теле катетера 100, в результате чего происходит заполнение или наполнение изолирующих баллонов 4 водой или газом с использованием, в частности, подающего канала 2 катетера 100 с обеспечением их совместного раздувания, характеризующегося увеличением их размера или объема. Следует отметить, что увеличение размера или объема изолирующих баллонов 4 в результате приводит к двустороннему обтурированию или закупориванию просвета двенадцатиперстной кишки пациента, в котором установлен катетер 100, что позволяет изолировать часть катетера 100 с функциональным отверстием 7 между раздутыми изолирующими баллонами 4 в полом органе пациента. Таким образом, раздутые изолирующие баллоны 4 позволяют изолировать участок полого органа, например большой и малый дуоденальные сосочки двенадцатиперстной кишки, аневризму, дефект стенки пациента от проксимальных и дистальных отделов этого полого органа и, следовательно, исключить или предотвратить смешивание целевой биологической жидкости с иными биологическими жидкостями, а также позволяет зафиксировать катетер 100 в просвете полого органа пациента за счет плотного прилегания баллонов 4 своей наружной стороной к поверхности внутренней стенки полого органа. В одном из вариантов эти баллоны сообщаются между собой через подающий канал 2, тем самым обеспечивается равномерное перераспределение жидкой или газообразной среды, которой они расправлены, например, во время прохождения перистальтической волны кишечника или пищевода. В одном из вариантов реализации настоящего изобретения изолирующие баллоны 4 могут быть выполнены каждый в виде, например, самонадувающихся баллонов или баллонов, надуваемых воздухом, подаваемым в подающий канал 2 катетера 100 через отверстие бокового вывода 10 тройника 12, или баллонов, раздуваемый любым иным способом, известным в уровне техники.
В одном из вариантов реализации настоящего изобретения боковой вывод 10 в тройнике 12 может быть дополнительно снабжен запорным клапаном (не показан) с ручным управлением, который препятствует обратному ходу или выходу текучей среды, в частности газа или воды, находящейся в изолирующих баллонах 4, подающем канале 2 и боковом выводе 10. Следует также отметить, что вышеописанный запорный клапан может быть использован пользователем катетера 100 для регулирования степени раздувания изолирующих баллонов 4, которую пользователь может визуально контролировать посредством эндоскопа, в частности пользователь может уменьшать размеры или объем надутых изолирующих баллонов 4 путем отведения или стравливания воды из подающего канала 4 при ручном приоткрытой запорного клапана пользователем.
Функциональный канал 3, проходящий в целом вдоль части длины катетера 100, сообщается с боковым выводом 8 тройника 12, при этом функциональный канал 3 имеет входное или впускное отверстие, соответствующее функциональному отверстию 7, и выходное или выпускное отверстие, соответствующее отверстию, выполненному в боковом выводе 8 на проксимальном конце катетера 100. Таким образом, при присоединении к боковому выводу 8 тройника 12 функционального устройства (не показано) с накопительной емкостью обеспечена возможность создания и поддержания разрежения воздуха в пространстве полого органа, которое может быть изолировано надутыми изолирующими баллонами 4, как это описано выше. Разрежение воздуха (также называемое техническим вакуумом), созданное в изолированном пространстве полого органа, способствует эвакуации или выводу биологической жидкости, представляющей собой желчь и панкреатический сок или секрет поджелудочной железы или гной, или кровь, или бронхиальный секрет, с обеспечением возможности его отведения из указанного изолированного пространства сначала в функциональный канал 3 через функциональное отверстие 7, далее из функционального канала 3 в боковой вывод 8, а затем из бокового вывода 8 в накопительную емкость функционального устройства через соответствующее отверстие, выполненное в боковом выводе 8. Следует отметить, что функциональный канал 3 с функциональным отверстием 7 может быть использован не только для забора биологической текучей среды, специфичной для конкретного полого органа, но и для подачи необходимой текучей среды, например лекарственного средства, в изолированное пространство.
Следует отметить, что включение пользователем функционального устройства, присоединенного к боковому выводу 8 тройника 12, приводит в действие воздушный компрессор, входящий в состав этого функционального устройства. Приведенный в действие воздушный компрессор обеспечивает выкачивание или отсасывание воздуха из пространства двенадцатиперстной кишки пациента, изолированного надутыми изолирующими баллонами 4 вышеописанным образом, и из свободного пространства в накопительной емкости функционального устройства, которое не заполнено биологической жидкостью, представляющей собой желчь и панкреатический сок или секрет поджелудочной железы, для создания разрежения воздуха в указанном изолированном пространстве в просвете двенадцатиперстной кишки пациента, что приводит к забору указанной биологической жидкости через функциональное отверстие 7 и ее отведению или доставке посредством функционального канала 3 в накопительную емкость функционального устройства, в которой эта биологическая жидкость может постепенно накапливаться или собираться в течение заданного периода времени.
Следует отметить, что в одном из вариантов использования, через боковой вывод 8 тройника 12, может вводиться жидкое или газообразное вещество, которое проводится функциональным каналом 3 и через функциональное отверстие 7 попадает в пространство между изолирующими баллонами. Введенное газообразное или жидкое вещество, которым может быть лекарственное или красящее средство, может осуществлять воздействие на изолированную баллонами область полого органа и оказывать диагностическое и/или лечебное действие.
В одном из вариантов реализации настоящего изобретения в теле катетера 100 могут быть выполнены только вышеописанный подающий канал 2 для подачи текучей среды (например, воды) в изолирующие баллоны 4, сообщающийся с вышеописанным боковым выводом 10, и вышеописанный функциональный канал 3, сообщающийся с вышеописанным боковым выводом 8.
Кроме того, тело катетера 100 снабжено со своей наружной стороны двумя в целом одинаковыми ограничительными выпуклостями или выступами 6, которые выполнены каждая в виде кольцеобразного или кольцевидного выступа или кольца, радиус которого больше радиуса тела катетера 100 и меньше радиуса любого из надутых изолирующих баллонов 4, и каждая из которых расположена по длине тела катетера 100 по одну из сторон от функционального отверстия 7 рядом с ним или вплотную к нему, при этом выступы 6 предпочтительно расположены на одинаковом расстоянии от функционального отверстия 7 в промежутке между изолирующими баллонами 4. Следует отметить, что при установке катетера 100 в просвет полого органа пациента выступы 6, по сути выполняющие функцию выступающих бортов, ограждающих функциональное отверстие 7, предотвращают контакт или приближение функционального отверстия 7 к слизистой полого органа на расстояние, достаточное для всасывания или засасывания ткани указанной слизистой в функциональное отверстие 7 при включении пользователем функционального устройства, подключенного к функциональному каналу 3 катетера 100 и, следовательно, создании разрежения в изолированном пространстве в просвете полого органа, что может привести к повреждению ткани слизистой полого органа. В одном из вариантов реализации настоящего изобретения выступы 6 могут иметь любую другую форму, отличную от кольцевой или кольцеобразной формы, при условии эта форма позволяет исключить контакт функционального отверстия 7 со слизистой полого органа пациента или сближение функционального отверстия 7 со слизистой полого органа пациента на расстояние, достаточное для всасывания указанной слизистой в функциональное отверстие 7 при создании разрежения в изолированном пространстве полого органа, в которое открыто это функционального отверстия 7.
Кроме того, тело катетера 100, как показано на фиг. 3-4, снабжено со своей наружной стороны двумя выпуклостями или выступами 15, каждый из которых выполнен за пределами части тела катетера 100, ограниченной изолирующими баллонами 4, на заданном расстоянии от соответствующего одного из баллонов 4, и к которым прикреплена эластичная сетка или сетчатая оболочка 16, которая может полностью или по меньшей мере частично покрывать оба изолирующих баллона 4 и находящуюся между ними часть тела катетера 100, ограниченную указанными баллонами 4, с обеспечением полного или по меньшей мере частичного накрытия или покрытия функционального отверстия 7. При раздувании баллонов 4, как показано на фиг. 4, происходит натягивание или растягивание сетчатой оболочки 16, что позволяет отдалить ткань внутренней стенки полого органа на заданное расстояние или сместить ее в сторону от функционального отверстия 7. В полностью или по меньшей мере частично натянутом состоянии сетчатая оболочка 16 создает эластичный наружный футляр или каркас, который полностью или по меньшей мере частично охватывает часть тела катетера 100, ограниченную баллонами 4 или находящуюся между ними, с обеспечением полного или по меньшей мере частичного накрытия или покрытия функционального отверстия 7, при этом указанный наружный каркас, образованный сетчатой оболочкой 16, имеет цилиндрическую форму и по сути выполнен проницаемым для текучей среды благодаря своей ячеистой структуре, что позволяет биологической текучей среде, являющейся специфичной для конкретного полого органа млекопитающего, проникать или проходить через материал сетчатой оболочки 16 и попадать в функциональное отверстие 7. В частности, при подключении бокового вывода 8 к аспирирующему устройству (не показано) с обеспечением возможности создания, посредством функционального канала 3 и функционального отверстия 7 в катетере 100, низкого давления в изолированной области между изолирующими баллонами 4 натянутая или растянутая сетчатая оболочка 16 будет препятствовать приклеиванию или адгезии ткани внутренней стенки полого органа (например, стенки сосуда, слизистой кишечника, бронха, желудка, мочеточника или т.п.) к функциональному отверстию 7, что в конечном итоге позволит обеспечить возможность постоянной аспирации биологического материала или биологической текучей среды, например желчи, панкреатического сока, желчи, бронхиального отделяемого или т.п. в контейнер или емкость аспирирующего устройства.
В одном из вариантов реализации настоящего изобретения сетчатая оболочка 16 может быть прикреплена к обоим изолирующим баллонам 4 таким образом, что она полностью или по меньшей мере частично охватывает часть тела катетера 100, ограниченную баллонами 4 или находящуюся между ними, с обеспечением полного или по меньшей мере частичного накрытия или покрытия функционального отверстия 7, а при раздувании баллонов 4, как показано на фиг.4, происходит натягивание или растягивание сетчатой оболочки 16, что позволяет отдалить ткань внутренней стенки полого органа на заданное расстояние или сместить ее в сторону от функционального отверстия 7.
В другом варианте реализации настоящего изобретения сетчатая оболочка 16 может быть выполнена в виде сетчатого материала или сетки, предварительно закрепленной в натянутом или частично натянутом состоянии на выступах 6 таким образом, что она полностью или по меньшей мере частично охватывает часть тела катетера 100, ограниченную баллонами 4 или находящуюся между ними, с обеспечением полного или по меньшей мере частичного накрытия или покрытия функционального отверстия 7.
В иных вариантах реализации настоящего изобретения сетчатая оболочка 16 может быть закреплена, посредством любых подходящих известных в уровне техники крепежных средств, в предварительно натянутом состоянии на теле катетера 100 таким образом, что она полностью или по меньшей мере частично охватывает часть тела катетера 100, ограниченную баллонами 4 или находящуюся между ними, с обеспечением полного или по меньшей мере частичного накрытия или покрытия функционального отверстия 7.
В других вариантах реализации настоящего изобретения сетчатая оболочка 1 может иметь любую форму, позволяющую закреплять сетчатую оболочку на теле катетера 1, выступах 6 или изолирующих баллонах 4 с обеспечением полного или по меньшей мере частичного накрытия или покрытия функционального отверстия 7.
Кроме того, за пределами изолирующих баллонов 4 и, следовательно, части катетера 100 с функциональным отверстием 7, ограниченной изолирующими баллонами 4, в теле катетера 100 выполнены по три вспомогательных отверстия 5.1, 5.2, при этом при установке катетера 100 в просвет полого органа пациента вспомогательные отверстия 5.2, расположенные дальше от дистального конца катетера 100, выполняют функцию впускных отверстий, а вспомогательные отверстия 5.1, расположенные ближе к дистальному концу катетера 100, выполняют функцию выпускных отверстий. Следует отметить, что вспомогательные отверстия 5.1, 5.2 обеспечивают возможность пропускания содержимого полого органа, например воздух, мочу, кровь, желудочное или кишечное содержимое с неактивными пищеварительными (дигестивными) ферментами в дистальные отделы полого органа без попадания указанного содержимого в область, изолированную надутыми изолирующими баллонами 6 катетера 100, что в конечном итоге предотвращает или исключает возможность формирования застойных и/или воспалительных процессов в полом органе пациента вследствие, в частности, накопления крови, мочи, воздуха, слизи и прочего содержимого в полом органе пациента за пределами надутого изолирующего баллона 4, расположенного дальше или наиболее удаленного от дистального конца катетера 100.
В одном из вариантов реализации настоящего изобретения катетер 100 может иметь длину 130 см. В данном варианте реализации настоящего изобретения изолирующие баллоны 4 находятся соответственно на расстоянии 15 и 25 см от дистального конца катетера 100, которым его вставляют в полость желудка и просвет двенадцатиперстной кишки пациента, так что при расправлении или раздувании изолирующие баллоны 4 позволяют изолировать область двенадцатиперстной кишки длиной по меньшей мере 10 см. В данном варианте реализации настоящего изобретения функциональное отверстие 7 может находиться посередине между изолирующими баллонами 4, т.е. на расстоянии 5 см от каждого из изолирующих баллонов 4 и на расстоянии 20 см от дистального конца катетера 100. В зависимости от области применения и анатомических параметров полого органа, длина и диаметр катетера, толщина его стенок, расположение изолирующих баллонов и отверстий могут варьировать.
Использование катетера 100 согласно настоящему изобретению для создания изолированной области в полом органе пациента подробно описано ниже в качестве примера в отношении двенадцатиперстной кишки пациента, при этом не следует полагать, что использование катетера 100 ограничено исключительно двенадцатиперстной кишкой пациента, а катетер 100 может быть аналогичным образом установлен в просвете любого другого полого (трубчатого) внутреннего органа млекопитающего, например в пищеводе, желудке, двенадцатиперстной кишке, тонкой кишке, толстой кишке, дыхательных путях, мочевыделительных путях (путях мочеполовой системы), венах, артериях, влагалище, матке, маточных (фаллопиевых) трубах, позвоночном канале пациента и любом другом подходящем внутреннем трубчатом органе млекопитающего, относящемся к соответствующей функциональной системе (системе органов) организма млекопитающего из группы систем, включающей: пищеварительную систему, дыхательную систему, мочевую и половую системы (объединены в мочеполовую систему или мочеполовой аппарат), эндокринную систему, кровеносную систему и иммунную систему, а также систему скелета.
Таким образом, использование катетера 100 согласно настоящему изобретению может заключаться, например, в его установке пользователем в просвет двенадцатиперстной кишки пациента под контролем эндоскопа (не показан) или рентгенологического оборудования (например, оборудования для рентгеноскопии) таким образом, чтобы один из изолирующих баллонов 4, наиболее удаленный от дистального конца катетера 100, находился в луковице двенадцатиперстной кишки пациента, при этом манипулировать эндоскопом может как указанный пользователь, так и врач-эндоскопист, ассистирующий указанному пользователю. В частности, следует отметить, что процесс установки катетера 100 в просвет двенадцатиперстной кишки пациента, процесс удаления катетера 100 из просвета двенадцатиперстной кишки пациента после забора необходимого количества биологической жидкости и сам процесс аспирации являются атравматичными и не зависят от анатомических особенностей как самого пациента, так и новообразования.
Согласно одному из примеров, катетер 100 может быть предварительно снабжен по меньшей мере одной петлей, подходящей для ее захвата биопсийными щипцами. Для установки катетера 100 в необходимое место установки в двенадцатиперстной кишке пациента дистальный конец катетера 100, хорошо смазанный вазелиновым маслом, вводят через носовой ход и продвигают в полость желудка, в дальнейшем через ротовую полость пациента параллельно катетеру 100 в полость желудка пациента вводят или продвигают эндоскоп с обеспечением захвата биопсийными щипцами эндоскопа катетера 100 за его петли, а затем захваченный катетер 100 проводят или продвигают одновременно с эндоскопом в двенадцатиперстную кишку пациента. В дальнейшем под контролем эндоскопа один из изолирующих баллонов 4 катетера 100, наиболее удаленный от дистального конца катетера 100, размещают в луковице двенадцатиперстной кишки пациента.
Согласно еще одному примеру, в основной канал 1 катетера 100 может быть предварительно введен или вставлен металлический проволочный направитель. Для установки катетера 100 в необходимое место установки в двенадцатиперстной кишке пациента дистальный конец катетера 100, хорошо смазанный вазелиновым маслом, вводят через носовой проход и продвигают в полость желудка с использованием металлического проволочного направителя катетера 100, а затем через ротовую полость пациента параллельно катетеру 100 в полость желудка пациента вводят или продвигают эндоскоп с обеспечением захвата биопсийными щипцами эндоскопа первой лигатуры при обнаружении дистального конца катетера 100 и прижатия катетера 100 к эндоскопу путем подтягивания катетера 100 за захваченную первую лигатуру. В дальнейшем эндоскоп с прижатым к нему катетером 100 проводят через привратник в двенадцатиперстную кишку пациента и под контролем эндоскопа один из изолирующих баллонов 4 катетера 100, наиболее удаленный от дистального конца катетера 100, размещают в луковице двенадцатиперстной кишки пациента.
В дальнейшем к боковому выводу 10 тройника 12 пользователь подключает или присоединяет устройство для подачи текучей среды (не показано), которое обеспечивает подачу текучей среды, такой как, например, вода, в подающий канал 2 катетера 100 в необходимом объеме, в частности 40 мл, происходит расправление и раздувание изолирующих баллонов 4 с их плотным прилеганием к слизистой двенадцатиперстной кишки, что приводит к изолированию необходимой области двенадцатиперстной кишки пациента, содержащей большой и малый дуоденальные сосочки, в частности от попадания в нее желудочного содержимого и/или дуоденального содержимого с неактивными пищеварительными (дигестивными) ферментами. В частности, следует отметить, что автором данного документа в результате экспериментальных исследований было выявлено, что воды или воздуха в объеме 40-70 мл будет достаточно для раздувания изолирующих баллонов 4 до размеров, обеспечивающих двустороннее обтурирование или закупоривание просвета двенадцатиперстной кишки пациента, в котором установлен катетер 100.
В дальнейшем пользователь подключает или присоединяет к функциональному каналу 3 функциональное устройство (не показано), которое должно быть предварительно настроено на постоянный или переменный режим работы, обеспечивающий необходимое рабочее давление, в зависимости от поставленной цели. Включенное пользователем функциональное устройство (не показано) обеспечивает возможность отсасывания, через функциональное отверстие 7 и сообщающийся с ним функциональный канал 3, воздуха из пространства изолированной области двенадцатиперстной кишки пациента, соответствующей периампулярной зоне двенадцатиперстной кишки, с обеспечением создания в указанном пространстве отрицательного давления, соответствующего исходному давлению двенадцатиперстной кишки, создаваемому за счет перистальтики самого кишечника, в частности отрицательного давления (например, на уровне 40-100 мм. вод. ст.(9-14 кПа)).
Разрежение воздуха, созданное в изолированном пространстве двенадцатиперстной кишки пациента, способствует эвакуации или выводу биологической жидкости в виде панкреатического сока или секрета поджелудочной железы в сочетании с желчью через большой и малый дуоденальные сосочки из поджелудочной железы с обеспечением возможности ее отведения, посредством функционального отверстия 7 и функционального канала 3, из изолированной области двенадцатиперстной кишки пациента и возможности ее сбора в накопительной емкости функционального устройства (не показана). В дальнейшем биологическая жидкость, собранная в накопительной емкости функционального устройства (не показана), может быть отправлена на цитологическое исследование и/или молекулярно-генетическое исследование для оценки характеристик морфологической структуры клеточных элементов секрета поджелудочной железы, позволяющих устанавливать или выявлять наличие патологических процессов, характерных, например, для внутрипротоковых новообразований, нейроэндокринных опухолей или рака поджелудочной железы, а также выявлять новообразования на ранней стадии развития и проводить дифференциальную диагностику между различными типами опухолей путем определения экспрессии специфических маркеров (NKX2, S100P, СЕА, EFR3A/B, MUC1, MUC2, MUC5, ANXA1, А2, KRT7, ММР7, ММР9, IGFBP3, PSCA, PRSS2, SHh, KRas, ТР53, SMAD4, BRCA1, miRNA 21 и miRNA 155).
Следует отметить, что катетер 100 согласно настоящему изобретению может находиться в установленном состоянии в течение достаточно длительного периода времени, например до семи суток (т.е. до 168 часов), что позволяет собрать секрет поджелудочной железы в количестве, достаточном для достоверного выявления и верифицирования патологического опухолевого материала, что в целом улучшает эффективность диагностики и, следовательно, последующего лечения рака поджелудочной железы. Кроме того, длительный забор позволяет увеличить вероятность выявления патологических клеток не только панкреатических раков, но и желчевыводящих протоков, в том числе холангиокарцином и/или гепатоцеллюлярного рака.
Следует также отметить, что при использовании катетера 100 не требуется стимулировать выделение панкреатического сока и желчи, благодаря чему подвергающийся забору или собираемый биологический материал имеет истинный биохимический и физиологический профиль, отражающий истинную функцию печени, желчевыводящих протоков, сократительной способности желчного пузыря, а также поджелудочной железы.
При необходимости, для оценки экскреторной функции поджелудочной железы может быть исследован биохимический состав секрета поджелудочной железы, собранного вышеописанным образом в накопительной емкости (не показана) в сочетании с желчью с использованием катетера 100 согласно настоящему изобретению.
Кроме того, качественный и количественный анализ собранных панкреатического сока и желчи позволяет оценить истинный биохимический профиль обоих биологических материалов, а также установить объем суточной секреции и тем самым непосредственно диагностировать функциональное состояние органа.
В частности, при использовании катетера 100 наблюдается лечебный или терапевтический эффект, достигаемый за счет восстановления эвакуации желчи и панкреатического сока, из соответствующих протоков в двенадцатиперстную кишку. В патогенезе острых воспалительных заболеваний, таких как панкреатит и холангит, лежит соответственно нарушение оттока панкреатического сока и желчи, обусловленное, в частности, нарушениями моторики двенадцатиперстной кишки млекопитающего, так что изолированная область с контролируемым отрицательным давлением (например на уровне 40-100 мм. вод. ст), создаваемое при осуществлении аспирации панкреатического сока и желчи с использованием катетера для создания изолированной области в полом органе 100, позволяет решить эту медицинскую проблему и, следовательно, способствовать лечению вышеуказанных острых заболеваний.
Кроме того, при использовании катетера 100 наблюдается лечебный или терапевтический эффект, достигаемый за счет эвакуации кишечного содержимого из области дефекта стенки органа желудочно-кишечного тракта, так что созданная изолированная область с контролируемым отрицательным давлением (например, на уровне 40-100 мм. вод. ст.), позволяет эвакуировать все биологические жидкости из области дефекта и решить эту медицинскую проблему и, следовательно, способствовать лечению вышеуказанной проблемы пациента.
Таким образом, вышеописанный катетер 100 позволяет осуществить или выполнить функциональное исследование состояния любого полого органа, а также провести надлежащее лечение. Кроме того, исследование и/или лабораторный анализ биологической жидкости, собранной с использованием катетера 100, позволяет с высокой точностью дифференциально диагностировать воспалительные образования, доброкачественные образования и злокачественные образования, а также инфекционные болезни. За счет эвакуации специфической жидкости катетер 100 позволяет осуществлять лечение воспалительных заболеваний, кровотечений и дефектов стенок полых органов. Создание изолированной области с функцией шунтирования во время хирургической манипуляции позволяет осуществлять контроль гемостаза, а также выполнять хирургические манипуляции, в частности резекции участка сосудов с последующей их пластикой. Следует также отметить, что катетер 100 согласно настоящему изобретению или вышеописанная система для создания изолированной области в полом органе млекопитающего, в состав которой может входить катетер 100, обеспечивает возможность получения большого объема биологического материала в нормофизиологическом состоянии без дополнительной стимуляции экскреторной функции полого органа, в частности только благодаря созданию в изолированной области полого органа, в просвет которого вставлен катетер 100, отрицательного давления, соответствующего отрицательному физиологическому давлению, которое может быть создано, например, за счет перистальтики самого кишечника.
Катетер 100 согласно любому из вышеописанных вариантов реализации настоящего изобретения может быть применен и для лечения дефекта, травмы или повреждения стенки тонкой кишки, в частности повреждения стенки двенадцатиперстной кишки, тощей кишки или подвздошной кишки, т.е. любого из отделов тонкой кишки. Следует отметить, что повреждение стенки тонкой кишки может быть вызвано, например, телом, обладающим высокой кинетической энергией. Следует также отметить, что повреждение стенки тонкой кишки может привести к образованию нескольких проблемных зон, включая некротическую зону и зону молекулярного сотрясения.
Способ лечения повреждения стенки тонкой кишки, реализуемый с использованием вышеописанного катетера 100, представляет собой способ пролонгированного внутрипросветного активного контроля объема повреждения стенки тонкой кишки, который может быть применен на разных этапах оказания помощи больному с абдоминальной травмой. В частности, способ лечения повреждения стенки тонкой кишки, реализуемый с использованием вышеописанного катетера 100, представляет собой методику лечения, в основе которой лежат следующие основные операции:
(1) Раздувание проксимального и дистального баллонов 4 воздухом или жидкостью для создания между ними изолированного пространства тонкой кишки, в котором находится участок тонкой кишки с единичной или множественными травмами или повреждениями и которое изолировано от вышележащего и нижележащего отделов желудочно-кишечного тракта. Следует отметить, что баллоны 4 можно раздувать и с использованием охлажденного раствора (например, водой, желатином, гидроксиэтилированным крахмалом, декстраном и т.п.), что позволит создать локальный гипотермический эффект для блокирования активизации ферментов и остановки воспалительного процесса в тонкой кишке. Кроме того, оба баллона 4 в катетере 100 соединены подающим каналом 2, что обеспечивает равномерное распределение давления на различные отделы тонкой кишки, позволяя тем самым осуществлять профилактику перерастяжения стенки тонкой кишки и избегать сдавливания капилляров в подслизистом слое стенки тонкой кишки, что важно для предотвращения некроза указанной стенки тонкой кишки. Кроме того, раздувание проксимального и дистального баллонов 4 в тонкой кишке позволяет зафиксировать положение катетера 100 и уменьшает риск его смещения в другие отделы желудочно-кишечного тракта, что, например, может вызвать абтурирование большого дуоденального сосочка.
(2) Функциональное отверстие 7, открытое в изолированное пространство, созданное в тонкой кишке с помощью раздутых баллонов 4, с обеспечением сообщения указанного изолированного пространства с функциональным каналом 3, с которым соединяют вышеописанное функциональное устройство (например, насос контролируемого отрицательного давления), обеспечивает возможность создания пониженного (отрицательного) давления в указанном изолированном пространстве тонкой кишки, а также обеспечивает возможность постоянной эвакуации всего содержимого тонкой кишки (например, желчи, панкреатического сока, химуса в отдельности или в любом сочетании друг с другом). Кроме того, функциональное отверстие 7 может быть использовано для локального введения лекарственных препаратов или средств (например, антибиотиков, антисептиков, рентген-контрастных веществ и т.д.) в изолированное пространство тонкой кишки. Во всех случаях возможность топического введения лекарственных средств в изолированное пространство тонкой кишки обеспечивает следующие позитивные эффекты: (i) повышает безопасность применения лекарственных средств, поскольку они не попадают за пределы изолированного пространства тонкой кишки; (ii) увеличивает эффективность применения лекарственных средств благодаря увеличению времени экспозиции, обусловленному предотвращением возможности выхода лекарственных средств за пределы зоны их применения (т.е. за пределы изолированного пространства тонкой кишки); и (iii) позволяет лучше контролировать дозу лекарственного средства и время экспозиции благодаря тому, что введение лекарственных средств в изолированное пространство тонкой кишки может чередоваться с активной аспирацией этих лекарственных средств из этого изолированного пространства. Кроме того, функциональное устройство (например, насос контролируемого отрицательного давления) позволяет активно удалять содержимое тонкой кишки, что предотвращает его поступление в брюшную полость, предотвращая тем самым развитие перитонита у пациента.
(3) Шунтирование и связь посредством текучей среды между отделами желудочно-кишечного тракта, оказывающимися вышележащими (проксимальными или расположенными до баллонов 4 при установке катетера 100) и нижележащими (дистальными или расположенными после баллонов 4 при установке катетера 100) по отношению к изолированному с помощью баллонов 4 пространству, осуществляется за счет использования впускных отверстий 5.2 и выпускных отверстий 5.1, выполненных в теле катетера 100 за пределами его части, ограниченной баллонами 4, и сообщающихся с основным каналом 1, что в свою очередь обеспечивает возможность пассивного дренирования указанных вышележащих и нижележащих отделов желудочно-кишечного тракта, возможность разгрузки указанных вышележащих и нижележащих отделов желудочно-кишечного тракта и возможность проведения энтерального кормления пациента. В частности, дренирование вышележащих и нижележащих отделов желудочно-кишечного тракта при лечении пациента обеспечивает профилактику застоя содержимого в указанных отделах, нивелируя тем самым непроходимость, а также предотвращает возможность поступления указанного содержимого к травмированному или поврежденному участку тонкой кишки. Кроме того, энтеральное кормление пациента стимулирует моторику кишечника и соответствует методике «fast track» реабилитации больных.
(4) Наличие выступов 6, ограждающих функциональное отверстие 7, препятствует адгезии слизистой тонкой кишки к функциональному отверстию 7 и, следовательно, предотвращает обтурацию функционального канала 3. Таким образом, выступы 6 обеспечивают возможность поддержания отрицательного давления в изолированном пространстве тонкой кишки и возможность забора содержимого тонкой кишки. Кроме того, эти ограждающие выступы 6 могут служить и для крепления к ним сетчатой оболочки 16 или иного сетчатого материала для покрытия функционального отверстия 7, что также дополнительно предотвращает обтурацию функционального отверстия 7 слизистой стенки тонкой кишки.
(5) Сетчатая оболочка 16, прикрепленная к баллонам 4 или натянутая поверх этих баллонов 4, образует эластичный каркас, который препятствует адгезии слизистой стенки тонкой кишки и, следовательно, препятствует блокированию функционального отверстия 7. Кроме того, сетчатая оболочка 16 может быть предварительно пропитана лекарственными препаратами или средствами для обеспечения пролонгированного топического лечения.
Следует отметить, что предлагаемый способ лечения травмы или повреждения стенки тонкой кишки, реализуемый с использованием вышеописанного катетера 100, по сути является модификацией распространенной у военно-полевых хирургов тактики лечения «damage control». Ключевым отличим предлагаемого способа лечения травмы или повреждения стенки тонкой кишки в сравнении с известными подобными способами является то, что он позволяет не удалять травмированный или поврежденный орган, а оценить в динамике характер происходящих в нем изменений. В частности, если стандартный способ лечения травмы или повреждения стенки тонкой кишки в большой степени заключается в наблюдении за оперированным больным, то в предлагаемом способе лечения травмы или повреждения стенки тонкой кишки помимо наблюдения предполагается осуществлять пролонгированный внутрипросветный активный контроль объема такого повреждения и предполагается осуществлять активное лечение за счет удаления содержимого тонкой кишки, топического введения лекарственных средств и энтерального питания.
Клинические примеры
Пример №1
Пациент №1 поступает с проникающим множественным осколочным ранением органов брюшной полости. При ревизии был выполнен гемостаз, что позволило выявить множественное разноуровневое ранение петель тонкой кишки. Пациенту №1 была проведена назоинтестинальная интубация с помощью катетера 100 таким образом, чтобы при заведении или установке катетера 100 верхний баллон 4 был размещен выше проксимального дефекта, а нижний баллон 4 был размещен ниже дистального. В дальнейшем оба баллона 4 были раздуты жидкостью или воздухом с обеспечением создания между ними изолированного пространства тонкой кишки, в котором оказался весь объем травмированных петель. Весь процесс заведения или установки катетера 100 занял приблизительно 20-45 минут. Брюшная полость Пациента №1 была дренирована силиконовыми дренажами и послойно ушивалась. За пределами тела Пациента №1 катетер 100 был прикреплен к носу, при этом функциональный канал 3, который открывается функциональным отверстием 7 в изолированное между баллонами 4 пространство тонкой кишки, был подключен к насосу контролируемого отрицательного давления, что позволило создать пониженное (отрицательное) давление в указанном изолированном пространстве тонкой кишки, в результате чего все петли травмированного тонкой кишки были активно дренированы, а их содержимое (желчь, панкреатический сок, химус) было отведено наружу. В дальнейшем Пациент №1 был транспортирован в тыловой госпиталь для дальнейшего лечения. Через 24-48 часов была выполнена ревизия органов брюшной полости путем выполнения релапаротомии и определен окончательный объем пораженных петель тонкой кишки с их резекцией и формированием межкишечных анастомозов, при этом брюшная полость промывалась антисептическими растворами (водным раствором хлоргексидина) и послойно ушивалась. Для уменьшения риска несостоятельности области анастомоза или анастомозов, зона шва была оставлена изолированной катетером 100 с одновременным проведением энтерального кормления с использованием впускных отверстий 5.2 и выпускных отверстий 5.1, выполненных в теле катетера 100 за пределами его части, ограниченной баллонами 4, и сообщающихся с основным каналом 1, при этом основной канал 1 был подсоединен к сборнику в виде гибкого мешка для сбора содержимого в результате пассивного дренирования неповрежденных петель тонкой кишки. Пример №2
Пациент №2 получил ранение в области связки Трейца, при этом проводимая терапия и ушивание дефекта стенки тонкой кишки в области связки Трейца привели к развитию дуоденального свища и перитонита. Пациенту №2 в тонкую кишку был заведен или установлен катетер 100 с обеспечением раздувания его баллонов 4 для создания между ними изолированного пространства, в котором находилась зона свища или поврежденных участок стенки тонкой кишки, и проведением санации с помощью внутрипросветной вакуумной терапии, осуществляемой путем подключения насоса контролируемого отрицательного давления к функциональному каналу 3, открывающемуся функциональным отверстием 7 в указанное изолированное между баллонами 3 пространство тонкой кишки, для создания пониженного (отрицательного) давления в этом изолированном пространстве тонкой кишки. В результате такого лечения с использованием катетера 100 было предотвращено поступление агрессивной среды, состоящей из желудочного, панкреатического сока и желчи, как к поврежденному участку стенки тонкой кишки, так и в брюшную полость, при этом также была осуществлена активная аспирация содержимого тонкой кишки с помощью насоса контролируемого отрицательного давления. Кроме того, пациент №2 получал энтеральное питание с использованием впускных отверстий 5.2 и выпускных отверстий 5.1, выполненных в теле катетера 100 за пределами его части, ограниченной баллонами 4, и сообщающихся с основным каналом 1. Консервативное лечение, включавшее перевязки, активную аспирацию содержимого тонкой кишки из области связки Трейца, антибактериальную терапию, нутритивную поддержку выполнялось в течение 4 недель и привело к вторичному закрытию дефекта стенки тонкой кишки.
Таким образом, предлагаемый способ лечения повреждения стенки тонкой кишки, реализуемый с использованием вышеописанного катетера 100, позволяет получить следующие позитивные эффекты: 1) длительная изоляция травмированной зоны тонкой кишки или травмированного участка стенки тонкой кишки, 2) препятствие попаданию кишечного содержимого в брюшную полость за счет его активной аспирации из изолированного пространства тонкой кишки, 3) возможность введения лекарственных средств в изолированное пространство тонкой кишки и 4) нутритивная поддержка за счет энтерального кормления больного (пациента).
При первичном выявлении высококинетической травмы стенки тонкой кишки в ходе оказания медицинской помощи предлагаемый способ лечения повреждения стенки тонкой кишки, реализуемый с использованием вышеописанного катетера 100, позволяет не тратить время на устранение дефектов стенки тонкой кишки, а сразу изолировать зону или участок поражения или повреждения, что в конечном итоге позволяет сократить время оказания помощи с 1,5-3 часов до 20-15 минут. После этого можно транспортировать больного (пациента) в другой госпиталь, и отсрочено через 24-48 часов выполнить плановую ревизию органов брюшной полости с целью окончательной оценки объема поражения и проведения хирургического лечения.
Таким образом, предлагаемый способ лечения повреждения стенки тонкой кишки, реализуемый с использованием вышеописанного катетера 100, позволяет ускорить и улучшить процесс оказания помощи раненым, снизить частоту развития несостоятельностей и свищей желудочно-кишечного тракта, уменьшить длительность госпитализации и реабилитации (поскольку позволяет избежать открытого ведения больных с плановыми санациями брюшной полости с интервалом 2-3 дня), снизить степень летальности больных (пациентов) и уменьшить стоимость лечения. Кроме того, предлагаемый способ лечения повреждения стенки тонкой кишки, реализуемый с использованием вышеописанного катетера 100, позволяет уменьшить объем удаляемых органов желудочно-кишечного тракта, улучшая тем самым отдаленные результаты лечения больных.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЯ КАТЕТЕРА ДЛЯ СОЗДАНИЯ ИЗОЛИРОВАННОЙ ЗОНЫ В ПОЛОМ ОРГАНЕ МЛЕКОПИТАЮЩЕГО (ВАРИАНТЫ) | 2021 |
|
RU2783089C1 |
| КАТЕТЕР И СПОСОБ ДЛЯ СОЗДАНИЯ ИЗОЛИРОВАННОЙ ЗОНЫ В ПОЛОМ ОРГАНЕ МЛЕКОПИТАЮЩЕГО, А ТАКЖЕ СИСТЕМА НА ОСНОВЕ ТАКОГО КАТЕТЕРА И ПРИМЕНЕНИЕ ТАКОГО КАТЕТЕРА | 2020 |
|
RU2761080C1 |
| ПРИМЕНЕНИЯ КАТЕТЕРА ДЛЯ СОЗДАНИЯ ИЗОЛИРОВАННОЙ ЗОНЫ В ПОЛОМ ОРГАНЕ МЛЕКОПИТАЮЩЕГО (ВАРИАНТЫ) | 2022 |
|
RU2805216C1 |
| КАТЕТЕР И СПОСОБ ДЛЯ ЗАБОРА БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ ИЗ ДУОДЕНАЛЬНЫХ СОСОЧКОВ, А ТАКЖЕ СИСТЕМА НА ОСНОВЕ ТАКОГО КАТЕТЕРА И ПРИМЕНЕНИЕ ТАКОГО КАТЕТЕРА | 2019 |
|
RU2743144C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОСТРОГО ПАНКРЕАТИТА ПОСЛЕ РАДИКАЛЬНОЙ ДУОДЕНОПЛАСТИКИ ПО ПОВОДУ ОСЛОЖНЕННЫХ ОКОЛОСОСОЧКОВЫХ ЯЗВ ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ | 2006 |
|
RU2340289C2 |
| СПОСОБ ЗАВЕРШЕНИЯ ПАНКРЕАТОДУОДЕНАЛЬНОЙ РЕЗЕКЦИИ ПРИ НЕИЗМЕНЕННОЙ ТКАНИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2004 |
|
RU2272576C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ХРОНИЧЕСКОГО КИСТОЗНОГО ГОЛОВЧАТОГО ПАНКРЕАТИТА, ОСЛОЖНЕННОГО КРОВОТЕЧЕНИЕМ В КИСТУ | 2008 |
|
RU2367364C1 |
| СПОСОБ ПРОФИЛАКТИКИ ПАНКРЕАТИТА И НЕКРОЗА КУЛЬТИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ПОСЛЕ ПАНКРЕАТОДУОДЕНАЛЬНОЙ РЕЗЕКЦИИ | 2009 |
|
RU2393780C1 |
| Способ лечения перфораций задней стенки двенадцатиперстной кишки | 2018 |
|
RU2674942C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ПАНКРЕАТИТА, ОСЛОЖНЕННОГО ДУОДЕНАЛЬНОЙ НЕПРОХОДИМОСТЬЮ | 2011 |
|
RU2459587C1 |

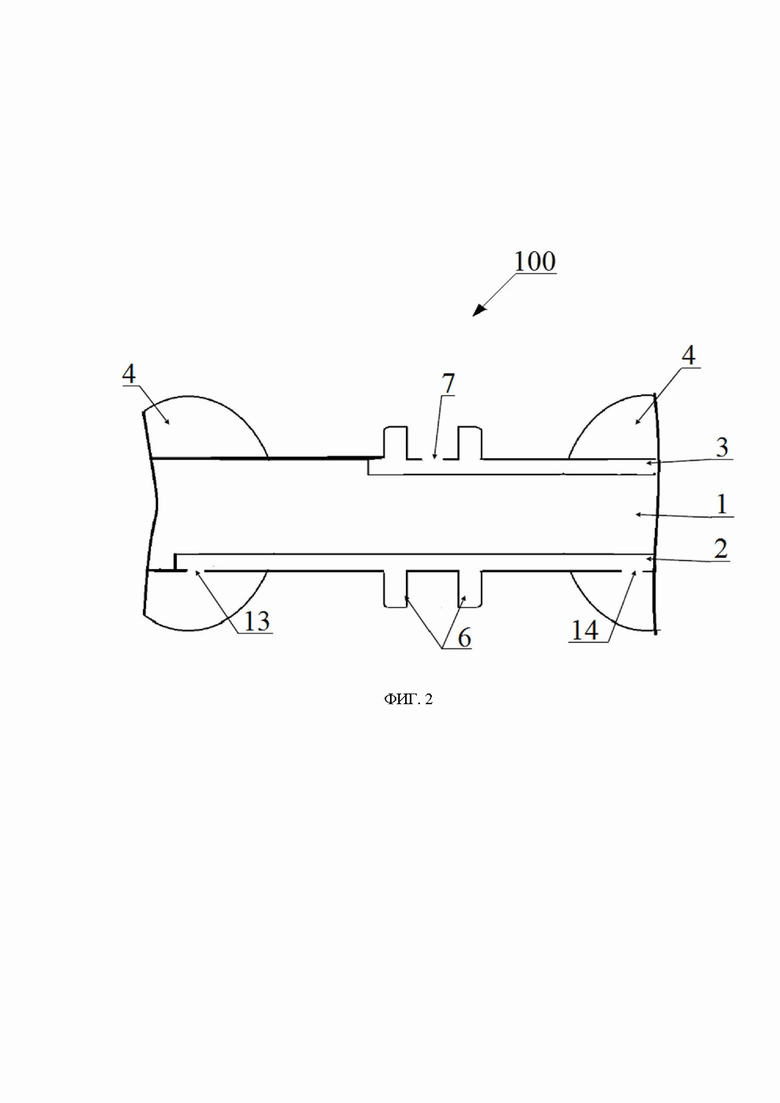

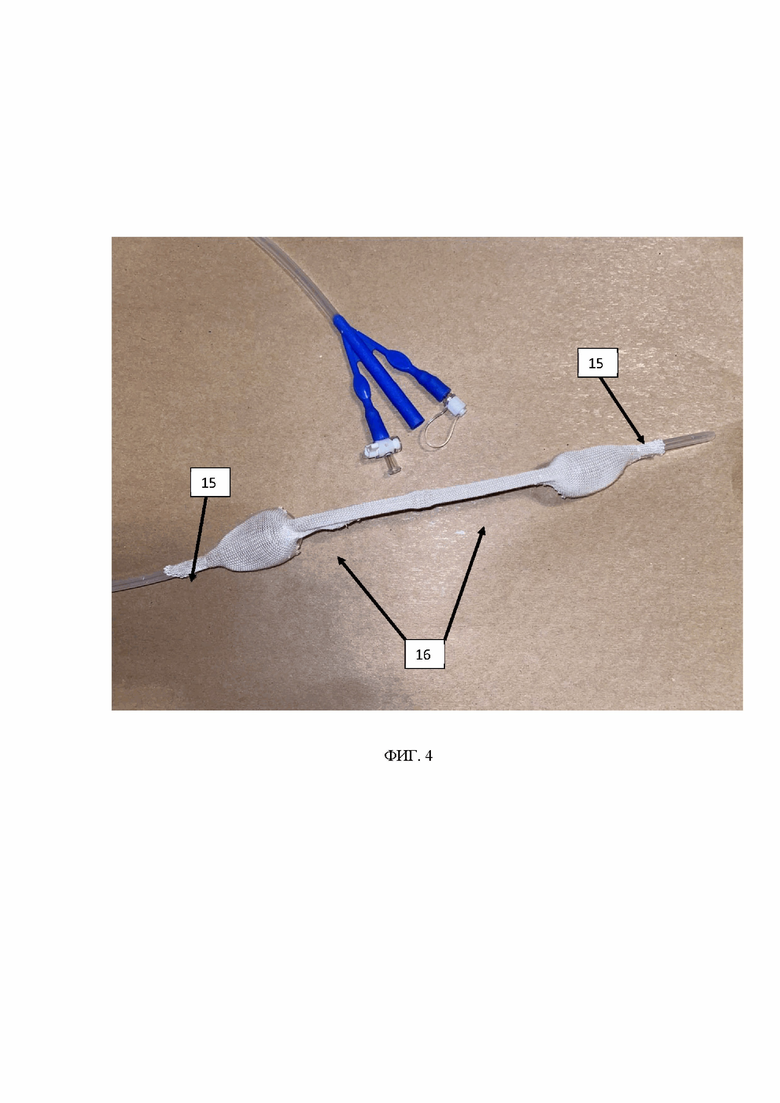
Группа изобретений относится к медицине, в частности к применению катетера для создания изолированной области в полом органе млекопитающего для лечения повреждения стенки тощей кишки или подвздошной кишки. В соответствии с первым вариантом для лечения повреждения стенки тощей кишки или подвздошной кишки применяют катетер, предназначенный для создания изолированной области в полом органе млекопитающего и содержащий удлиненное тело, выполненное с возможностью его установки в просвет полого органа млекопитающего и оснащенное двумя баллонами, выполненными с возможностью раздувания с обеспечением возможности создания между ними изолированного пространства полого органа. В удлиненном теле проходит функциональный канал с функциональным отверстием, выполненным в удлиненном теле между баллонами. Функциональный канал обеспечивает возможность создания в изолированном пространстве отрицательного давления с обеспечением возможности забора из него текучей или газообразной среды через функциональное отверстие, или возможность подачи медицинской текучей или газообразной среды в изолированное пространство через функциональное отверстие. В удлиненном теле проходит еще один канал, снабженный на противоположных концах соответственно впускным и выпускным отверстиями, выполненными в удлиненном теле за пределами его части, ограниченной баллонами. В соответствии со вторым вариантом для лечения повреждения стенки тощей кишки или подвздошной кишки применяют катетер, предназначенный для создания изолированной области в полом органе млекопитающего, в котором дополнительно к вышеописанному удлиненное тело снабжено сеткой или оболочкой, выполненной проницаемой для текучей и/или газообразной среды, причем сетка или оболочка по меньшей мере частично охватывает часть катетера, ограниченную баллонами, с обеспечением покрытия функционального отверстия и прикреплена к баллонам или охватывает их таким образом, что их раздувание обеспечивает возможность натягивания сетки или оболочки. В соответствии с третьим вариантом для лечения повреждения стенки тощей кишки или подвздошной кишки применяют катетер, предназначенный для создания изолированной области в полом органе млекопитающего, в котором дополнительно к вышеописанному первому варианту функциональное отверстие находится между двумя кольцевыми ограждающими выступами, которыми снабжено тело катетера между баллонами. В первом, втором и третьем вариантах изобретения применяемый катетер для создания изолированной области в полом органе млекопитающего обеспечивает технический результат, заключающийся в предотвращении или исключении возможности формирования застойных и/или воспалительных процессов в полом органе в виде тощей кишки или подвздошной кишки вследствие, в частности, накопления в этом полом органе слизи и прочего биологического содержимого, специфичного для указанного полого органа, за пределами одного из надутых изолирующих баллонов. 3 н.п. ф-лы, 4 ил., 2 пр.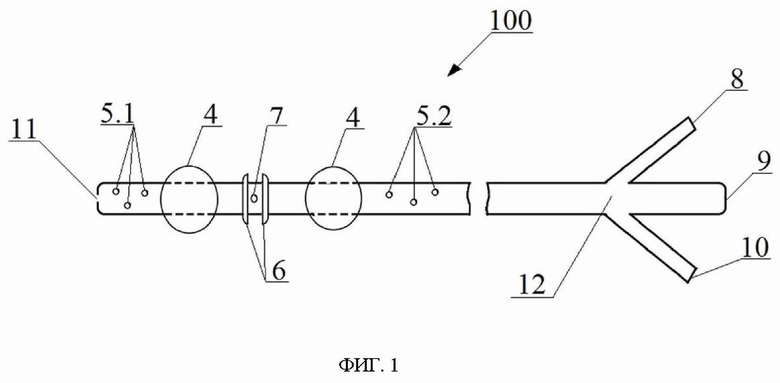
1. Применение катетера, предназначенного для создания изолированной области в полом органе млекопитающего и содержащего:
удлиненное тело, выполненное с возможностью его установки в просвет полого органа млекопитающего и оснащенное двумя баллонами, выполненными с возможностью раздувания с обеспечением возможности создания между ними изолированного пространства полого органа,
причем в указанном теле проходит функциональный канал с функциональным отверстием, выполненным в указанном теле между указанными баллонами, а
функциональный канал обеспечивает возможность создания в указанном изолированном пространстве отрицательного давления с обеспечением возможности забора из него текучей или газообразной среды через функциональное отверстие, или возможность подачи медицинской текучей или газообразной среды в указанное изолированное пространство через функциональное отверстие, при этом
в указанном теле проходит еще один канал, снабженный на противоположных концах соответственно впускным и выпускным отверстиями, выполненными в указанном теле за пределами его части, ограниченной указанными баллонами,
для лечения повреждения стенки тощей кишки или подвздошной кишки.
2. Применение катетера, предназначенного для создания изолированной области в полом органе млекопитающего и содержащего:
удлиненное тело, выполненное с возможностью его установки в просвет полого органа млекопитающего и оснащенное двумя баллонами, выполненными с возможностью раздувания с обеспечением возможности изолирования между ними пространства полого органа,
причем в указанном теле проходит функциональный канал с функциональным отверстием, выполненным в указанном теле между указанными баллонами, а
функциональный канал обеспечивает возможность создания в указанном изолированном пространстве отрицательного давления с обеспечением возможности забора из него текучей или газообразной среды через функциональное отверстие, или возможность подачи медицинской текучей или газообразной среды в указанное изолированное пространство через функциональное отверстие, при этом
в указанном теле проходит еще один канал, снабженный на противоположных концах соответственно впускным и выпускным отверстиями, выполненными в указанном теле за пределами его части, ограниченной указанными баллонами, и
указанное тело дополнительно снабжено сеткой или оболочкой, выполненной проницаемой для текучей и/или газообразной среды, причем указанная сетка или оболочка по меньшей мере частично охватывает часть катетера, ограниченную указанными баллонами, с обеспечением покрытия указанного функционального отверстия и прикреплена к указанным баллонам или охватывает их таким образом, что их раздувание обеспечивает возможность натягивания указанной сетки или оболочки,
для лечения повреждения стенки тощей кишки или подвздошной кишки.
3. Применение катетера, предназначенного для создания изолированной области в полом органе млекопитающего и содержащего:
удлиненное тело, выполненное с возможностью его установки в просвет полого органа млекопитающего и оснащенное двумя баллонами, выполненными с возможностью раздувания с обеспечением возможности изолирования между ними пространства полого органа,
причем в указанном теле проходит функциональный канал с функциональным отверстием, выполненным в указанном теле между указанными баллонами, а
функциональный канал обеспечивает возможность создания в указанном изолированном пространстве отрицательного давления с обеспечением возможности забора из него текучей или газообразной среды через функциональное отверстие, или возможность подачи медицинской текучей или газообразной среды в указанное изолированное пространство через функциональное отверстие, при этом
в указанном теле проходит еще один канал, снабженный на противоположных концах соответственно впускным и выпускным отверстиями, выполненными в указанном теле за пределами его части, ограниченной указанными баллонами, а функциональное отверстие находится между двумя кольцевыми ограждающими выступами, которыми снабжено тело катетера между указанными баллонами,
для лечения повреждения стенки тощей кишки или подвздошной кишки.
| КАТЕТЕР И СПОСОБ ДЛЯ СОЗДАНИЯ ИЗОЛИРОВАННОЙ ЗОНЫ В ПОЛОМ ОРГАНЕ МЛЕКОПИТАЮЩЕГО, А ТАКЖЕ СИСТЕМА НА ОСНОВЕ ТАКОГО КАТЕТЕРА И ПРИМЕНЕНИЕ ТАКОГО КАТЕТЕРА | 2020 |
|
RU2761080C1 |
| КАТЕТЕР И СПОСОБ ДЛЯ ЗАБОРА БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ ИЗ ДУОДЕНАЛЬНЫХ СОСОЧКОВ, А ТАКЖЕ СИСТЕМА НА ОСНОВЕ ТАКОГО КАТЕТЕРА И ПРИМЕНЕНИЕ ТАКОГО КАТЕТЕРА | 2019 |
|
RU2743144C1 |
| Катетер | 1976 |
|
SU651817A1 |
| US 20010053920 A1, 20.12.2001 | |||
| US 4781677 A1, 01.11.1988 | |||
| US 5460610 A1, 24.10.1995 | |||
| WO 2018106788 A1, 14.06.2018. | |||
Авторы
Даты
2023-11-10—Публикация
2022-12-15—Подача