Уровень техники
Классическая чума свиней (КЧС) - острое высоко контагиозное вирусное заболевание, сопровождающееся периодическими эпизоотиями и приносящее значительный экономический ущерб, в том числе в связи с ограничениями торговли с регионами, неблагополучными по КЧС. В силу своего значения для животноводства во всем мире, КЧС входит в список заболеваний международного эпизоотического бюро (МЭБ) (1, 2). Заболевание известно с начала XIX века (3) и первоначально было распространено на территории всех стран с развитым свиноводством, являясь одним из самых экономически значимых заболеваний свиней. Значение КЧС для свиноводства уже тогда было настолько значительным, что интенсивные исследования возбудителя заболевания позволили определить его вирусную природу уже в 1903 году (4). Вирус опасен как для домашних свиней, так и присутствует в популяции дикого кабана. Таким образом, инфекция постоянно сохраняется в природном очаге и в регионах с поголовьем дикого кабана постоянно сохраняется риск заноса вируса КЧС из природного очага в свиноводческие хозяйства. Основным путем распространения вируса является его контактная или опосредованная передача от диких свиней домашним ороназальным способом, а также оральное заражение через употребление контаминированного корма (5, 6). Также распространение заболевания часто связано с транспортировкой и перемещением внутри хозяйства или между различными хозяйствами инфицированных, но бессимптомных животных (7). Во время вспышек КЧС были описаны случаи аэрозольного распространения заболевания на коротких (до 500 м) дистанциях (8). Постоянная персистенция вируса КЧС в природных очагах остается основной угрозой для коммерческого свиноводства в странах, где присутствует популяция диких свиней, особенно остро эта проблема стоит на территории Западной Европы, где развитое коммерческое свиноводство сосуществует с одной из самых плотных в мире популяций дикого кабана. В то же время есть пример США, где комбинация поголовной вакцинации от КЧС с комплексом карантинных мер привели к полной эрадикации вируса КЧС на территории страны (последний случай заболевания зарегистрирован в 1978 г.) (9), что демонстрирует возможность успешной борьбы с КЧС вплоть до получения регионом или целой страной статуса территории, свободной от КЧС.
КЧС - системное заболевание, связанное с поражением различных тканей и органов. Слизистые ротовой полости и носа служат воротами инфекции, первичная репликация вируса происходит в миндалинах. Дальше вирус проникает в лимфоузлы, откуда через периферическую кровеносную систему попадает в костный мозг, висцеральные лимфоузлы и лимфоидную ткань, ассоциированную с тонким кишечником и селезенкой (10). Распространение вируса в организме пораженной свиньи обычно происходит в пределах 6 дней. Заболевание быстро прогрессирует, у пораженных животных поднимается температура, наблюдаются апатия и потеря аппетита, нарушение пищеварения, больные поросята начинают быстро терять вес, через 2-3 недели, как правило, наступает истощение и гибель животных. На вскрытии наблюдаются геморрагические поражения внутренних органов и тканей, наиболее характерны поражения тонкого кишечника и ассоциированных с ним мезентериальных лимфоузлов, некротические поражения селезенки и миндалин. Вирус КЧС подавляет иммунную систему хозяина, из-за чего появление первых вирус-нейтрализующих антител происходит через 2-3 недели после инфекции. У больных животных наблюдается лимфопения (11), сильнее всего она выражена для клеточных фракций В-лимфоцитов, Т-хелперов и цитотоксичных Т-клеток. Вирулентность различных штаммов вируса КЧС варьирует, течение заболевания также зависит от возраста, породы, условий содержания животных, поэтому бывает достаточно сложно определить вирулентность конкретного штамма вируса КЧС (12, 13). Заболевание может протекать в острой форме, заканчивающейся смертью животного, в подострой форме, когда возможен благоприятный исход, а также в хронической форме, которая через 2-3 месяца заканчивается смертью животного. Комплекс симптомов является общим для всех форм протекания КЧС, различается только степень выраженности симптомов: анорексия, вялость, конъюнктивит, респираторные признаки и запор с последующим поносом (12, 14). Животные могут начать выделять вирус через несколько дней после заражения до появления клинических признаков. У менее вирулентных штаммов период до начала болезни может занимать до 13-19 дней (15). Однако в связи с неспецифическим характером клинических признаков, особенно при инфекции штаммами средней или низкой вирулентности, вирус может оставаться незамеченным в стаде в течение 4-8 недель, что увеличивает риск дальнейшего распространения.
Floegel-Niesmann и др. (12) сравнили клинические признаки и поражения, вызванные шестью полевыми штаммами, выделенными в двухтысячные годы от домашних свиней или диких кабанов в Европе, с таковыми при инфекции эталонным штаммом (Alfort/187). Сравнение поражений кожи, подкожной и серозной оболочек, миндалин, селезенки, почек, лимфатических узлов, подвздошной и прямой кишок, головного мозга и дыхательной системы, показало, что лимфатические узлы были тканью, наиболее сильно пораженной всеми изолятами, за которой следуют некротические поражения в подвздошной кишке и гиперемия сосудов головного мозга. Таким образом, эти ткани были наиболее достоверными для диагностики КЧС. Некротические поражения селезенки и миндалин, хотя описанные как типичные в более ранней литературе, были нечастыми. Аналогично, респираторные признаки отсутствовали или были незначительными.
Контроль за КЧС может быть основан на двух принципиально разных подходах, зависящих от ряда факторов, существующих в каждой конкретной стране. Первым вариантом является соблюдение строжайших мер биобезопасности на объектах промышленного свиноводства с поддержанием наивного к вирусу КЧС поголовья свиней. В случае вспышки заболевания устанавливаются зоны карантина, и в очаге вспышки уничтожается все поголовье свиней. Однако, подобная стратегия хорошо работает в тех странах, где невысока плотность популяции дикого кабана и одновременно с этим отсутствует или исчезает практика содержания домашних свиней в подсобных хозяйствах граждан, вне оборудованных по последним стандартам биобезопасности промышленных свинокомплексов и вне эффективного контроля ветеринарной службы. Альтернативной стратегией является специфическая профилактика КЧС, в том числе в поголовье диких свиней, с помощью вакцинации. Исторически специфическая профилактика КЧС основана на применении безопасных и высокоиммуногенных живых вакцин, причем даже в тех странах, где в настоящее время используется стратегия применения высоких стандартов биобезопасности на объектах промышленного свиноводства и наивного поголовья. Так, в США и Канаде вакцинация использовалась до середины прошлого века в рамках программы по эрадикации КЧС, в Бразилии, основная часть территории которой в настоящее время имеет статус зоны, свободной от КЧС, поголовная вакцинация применялась до 90-х годов прошлого века. В России и Китае, странах с динамично развивающимся коммерческим свиноводством и одновременно с природным очагом КЧС в популяции дикого кабана и значительным числом свиней в частных подсобных хозяйствах, стратегия поголовной вакцинации выглядит наиболее адекватным подходом для контроля над КЧС.
Живые вакцины на основе аттенуированных изолятов КЧС (например, отечественная вакцина КС) давно зарекомендовали себя как эффективные и безопасные; однократного применения достаточно для формирования защитного иммунитета у животного (16). Однако, эти вакцины имеют два недостатка, которые заставляют искать новые подходы к вакцинации поголовья.
- Первый недостаток связан с хорошо известной способностью вируса КЧС к рекомбинации между различными изолятами при коинфекции (17). Рекомбинация между вакцинным и полевым штаммами вируса теоретически может привести к восстановлению вирулентности аттенуированного вакцинного штамма, свойства нового рекомбинантного вируса непредсказуемы, таким образом, применение живой вакцины несет в себе риски биобезопасности.
- Вторым недостатком в целом высокоэффективных классических живых вакцин является невозможность дифференциации переболевших и вакцинированных животных. Эта задача является критически важной при создании внутри страны в регионах с развитым промышленным свиноводством зон, свободных от КЧС, на фоне стратегии поголовной вакцинации.
В условиях Российской Федерации, где используется поголовная вакцинация свиней от КЧС, для создания свободных от КЧС зон требуется подход, позволяющий различать поствакцинальный иммунитет и антитела, образовавшиеся в ответ на инфекцию. Классические живые вакцины не позволяют дифференцировать вакцинированных и инфицированных животных. Для решения такой задачи еще в 90-е годы ветеринарными вирусологами была сформулирована стратегия DIVA (differentiating infected from vaccinated animals - дифференциация инфицированных от вакцинированных животных) (18). Краеугольным камнем этой стратегии является разработка так называемых маркированных вакцин - субъединичных, химерных, векторных и ДНК-вакцин, общей чертой которых является поддающееся дифференциальной диагностике отличие поствакцинального иммунитета от иммунитета к полевому штамму вируса. Принципиально, подобный результат может быть достигнут либо добавлением в вакцину антигена или антигенного эпитопа, отсутствующего у полевых изолятов вируса КЧС, либо, напротив, создание вакцины, дефицитной по антигену или антигенному эпитопу, общему для всех полевых изолятов вируса. В настоящий момент разработаны и одобрены к применению два типа маркированных вакцин против вируса КЧС (2): живая аттенуированная вакцина на основе химерного вируса, полученного генноинженерным путем, где ген, кодирующий основной поверхностный антиген вируса КЧС, гликопротеин Е2 штамма Alfort/187 вставлен на место аналогичного гена в родственный вирус диареи КРС, а также субъединичная маркированная вакцина на основе рекомбинантного белка Е2 вируса КЧС, полученного в бакуловирусной системе экспрессии в культуре клеток насекомых (19). Обе вакцины сертифицированы к применению в Европейском союзе (ЕС) в случае чрезвычайной ситуации с крупной вспышкой КЧС, субъединичная вакцина также доступна коммерчески. Химерные вакцины по эффективности сопоставимы с традиционными живыми вакцинами, однако их использование, как и использование любых живых вакцин, несет потенциальные риски рекомбинации вакцинного вируса с полевым. Причем присутствие в одном геноме вакцинного штамма геномных фрагментов двух разных вирусов создает дополнительные риски, связанные с потенциальным появлением в результате рекомбинации между вакцинным и полевым вирусами такого рекомбинантного вируса, который был бы невозможен в естественных условиях. И кроме того, использование генно-модифицированного живого вируса не всегда допустимо по правилам импорта продуктов животного происхождения, поэтому в качестве безопасной альтернативы живым вакцинам были разработаны субъединичные рекомбинантные вакцины на основе поверхностного гликопротеина Е2 вируса КЧС. Субъединичные вакцины вызывают менее продолжительный иммунитет, требуют больше времени для его формирования, вводятся 2-кратно, не обеспечивают стерильный иммунитет. Тем не менее они безопасны, обеспечивают защиту животных от контрольного заражения вирулентным вирусом и позволяют применять стратегию DIVA для дифференциальной диагностики вакцинированных и переболевших животных. У вакцинированных свиней методом иммуноферментного анализа (ИФА) обнаруживают антитела только к белку Е2, в то время как у ранее инфицированных полевыми штаммами вируса КЧС либо хронически зараженных животных обнаруживаются антитела не только к Е2, но и к белкам Erns и NS3. Существуют коммерческие тест-системы ИФА для дифференциальной диагностики на основе выявления антител к Е2 и Erns, например «PrioCHECK CSFV Erns» (Thermofisher, ранее Prionics) или «pigtype CSF Marker» (Qiagen).
Хотя классические живые аттенуированные вакцины против КЧС имеют длительную историю производства и применения в нашей стране и применяются в настоящее время, в России не производятся коммерческие субъединичные маркированные вакцины против классической чумы свиней. При этом особенностью эпизоотической ситуации в России является циркуляция на территории нашей страны одновременно двух генотипов вируса КЧС. Вирус КЧС на основании последовательности гена Е2 подразделяется на 3 разных генотипа. В Европе в полевых условиях в последние десятилетия встречаются только изоляты 2-го генотипа. На территории России отмечена одновременная циркуляция вирусов 1-го и 2-го генотипов. В Китайской Народной Республике одновременно циркулируют вирусы КЧС всех трех известных генотипов. Поверхностный гликопротеин Е2 является основной мишенью образования вирус-нейтрализующих антител, обеспечивающих защиту организма от вируса КЧС. В литературе описано 4 конформационных эпитопа в структуре Е2: А, В, С и D. Показано, что эпитоп А является высококонсервативным, и антитела к нему способны нейтрализовать любые полевые изоляты вируса КЧС. Эпитопы В и С вариабельны и могут различаться у вирусов разных генотипов. Антитела к эпитопам А и В, также как и антитела к эпитопам А и С, обладают эффектом синергии, тогда как для антител к эпитопам В и С взаимное усиление вируснейтрализующей активности не показано (20).
Описание аналогов. Выше отмечены преимущества субъединичных вакцин над живыми. За рубежом исследователями было разработано несколько субъединичных вакцинных препаратов против КЧС. Один из них, Porcillis Pesti, доступен коммерчески. Известно, что все они разработаны на основе какого-то одного генотипа вируса КЧС, в то время как только один консервативный вирус-нейтрализующий эпитоп на белке Е2 является общим для всех известных генотипов вируса, а всего белок несет четыре пространственных вирус-нейтрализующих эпитопа. Вакцина porcillis Pesti создана на основе рекомбинантного белка Е2 вируса КЧС генотипа 2, так как именно штаммы этого генотипа обнаруживают во время вспышек на территории Евросоюза (21). Характерным примером зарубежных разработок может быть препарат запатентованный компанией Bayer (патент №US6919085B2), где рекомбинантный белок Е2 с удаленным трансмембранным доменом получают в культуре клеток насекомых. Патент CN103319573A подробно описывает получение рекомбинантного бакуловируса методом сайт-специфической транспозиции с отбором клонов на стадии колоний E. coli, что значительно упрощает задачу получения рекомбинантного бакуловируса. Таким образом, различные зарубежные патенты содержат в себе широкий спектр используемых в настоящее время подходов к разработке маркированных субъединичных вакцин против КЧС, подчеркивая тем самым актуальность и важность этой задачи. Все они, однако, основаны на рекомбинантном белке Е2 какого-то одного генотипа вируса КЧС. В условиях России, где показана циркуляция полевых штаммов вируса КЧС 1 и 2 генотипов (22), неполная антигенная комплементарность вакцинного препарата циркулирующим в нашей стране полевым вирусам КЧС может снизить эффективность ее применения, так как с учетом описанного в литературе эффекта синергии между вирус-нейтрализующими антителами к консервативному и вариабельному эпитопам Е2 можно ожидать, что вакцина на основе Е2 только одного генотипа вируса КЧС может быть менее эффективной против гетерологичных штаммов. Присутствие в препарате рекомбинантного Е2 лишь одного генотипа является общим недостатком разработанных субъединичных вакцин. Кроме того, ни одна из аналогичных конструкций не объединяет в себе сразу несколько подходов, улучшающих производственные показатели и защитные свойства препарата. Такими подходами, используемыми одновременно в одном препарате, могут считаться, например, получение рекомбинантного штамма бакуловируса, где одновременно и независимо под разными сильными промоторами экспрессируются гены Е2 вирусов КЧС разных генотипов, в состав которых одновременно были бы введены маркерные последовательности, высокоэффективные сигналы секреции, пептидные метки позволяющие проводить очистку продукта методом металоаффинной хроматографии и некоторые другие свойства.
В техническую проблему группы изобретений входило:
- разработка вакцины субъединичной маркированной против классической чумы свиней на основе штаммов двух циркулирующих на территории РФ генотипов вируса КЧС, штамма-пробойника Шимынь генотипа 1 и штамма Альфорт-Тюбинген генотипа 2, обладающей более высокой эффективностью и удобством в производстве по сравнению с имеющимися аналогами, а также способа ее получения и применения.
Алгоритм создания заявляемого вакцинного препарата.
Создание препарата, являющегося предметом настоящего изобретения, предварялось созданием промежуточных конструкций для отработки используемых генно-инженерных и технологических решений и оценки потенциальной эффективности препарата в опыте с контрольным заражением на естественно-восприимчивых животных - свиньях.
При разработке концепции препарата мы отталкивались от уже имеющегося опыта по созданию рекомбинантных субъединичных вакцин против вируса КЧС, изучив данные полученные как западными, так и отечественными исследователями (23-25). Эти работы объединял единый принцип получения рекомбинантного эктодомена белка Е2 вируса КЧС в бакуловирусной системе экспрессии. Работу по созданию нами препарата, являющегося предметом данного изобретения, можно разделить на следующие этапы.
1. Предварительная оценка принципиальной возможности получения эффективной субъединичной вакцины против вируса КЧС.
На первом этапе нами была получена конструкция, принципиально аналогичная разработанным ранее европейским и отечественным препаратам на основе рекомбинантного Е2. На основе гена белка Е2 вируса КЧС Шимынь генотипа 1 была получена конструкция, снабженная коммерческим секреторным пептидом и лишенная родного трансмембранного домена белка Е2. Была показана принципиальная возможность получения вакцинного препарата, способного защищать свиней от контрольного заражения гомологичным штаммом вируса КЧС.
2. Разработка собственной платформы получения рекомбинантного бакуловируса, кодирующего химерную последовательность модифицированного рекомбинантного белка Е2.
Разработана концепция получения препарата и принцип модульной организации рекомбинантной последовательности ДНК, кодирующей целевой продукт, которые легли в основу данного изобретения. В отличие от первого препарата, для получения которого использовался принцип гомологичной рекомбинации с дальнейшим клонированием рекомбинантных бакуловирусов, для получения штамма продуцента в новой системе была использована сайт-специфическая рекомбинация в клетках Escherichia coli, что позволило проводить отбор рекомбинантных ДНК на стадии отдельных клонов в кишечной палочке, элиминировав необходимость трудоемкого отбора/клонирования рекомбинантных бакуловирусов в культуре клеток насекомых. Кроме того, авторами была сконструирована из трех синтетических олигонуклеотидов и помещена в вектор-носитель в рамке считывания с рекомбинантным фрагментом гена Е2 вируса КЧС, последовательность секреторного пептида белка пчелиного яда мелиттина. Сборка этой последовательности была проведена в реакции, сходной с полимеразной цепной реакцией, с использованием ДНК-полимеразы. Все последующие конструкции были выполнены на основе этой базовой системы.
Была проведена принципиальная оценка эффективности этой системы, начиная с получения рекомбинантного штамма продуцента бакуловируса ядерного полиэдроза Autographa californica с фрагментом, кодирующим часть последовательности гена Е2 вируса КЧС полевого изолята 8Z генотипа 1, и заканчивая испытанием эффективности полученного препарата в опыте на естественно восприимчивых животных. По аналогии с испытанной ранее конструкцией, последовательность сигнального пептида секреции предваряла часть гена Е2 вируса КЧС 8Z, из которой был удален фрагмент, кодирующий трансмембранный домен (31 аминокислота на С-конце). Полученный штамм продуцент бакуловируса 8Z (удостоверение на штамм №2984 в государственной коллекции вирусов института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России) был использован для оптимизации методов наработки рекомбинантного продукта и для создания экспериментального вакцинного препарата, который был испытан в серии опытов с контрольным заражением поросят для определения защитной дозы рекомбинантного белка, подбора адъюванта, определения срока хранения препарата без потери активности, оценки его иммуногенности и безвредности (26, 27). На основании данной, исходной конструкции, авторами была получена прототипная (по отношению к предмету настоящего изобретения) конструкция, в которой происходит одновременная экспрессия двух последовательностей, кодирующих фрагменты генов Е2 вирусов КЧС 1 и 2 генотипов, штаммы Шимынь и Альфорт-Тюбинген соответственно.
3. Получение прототипной конструкции.
Получен вектор носитель, а затем методом сайт-специфической рекомбинации - рекомбинантный бакуловирусный геном на его основе, в котором вместо одного гена Е2 под полиэдриновым промотором в геном бакуловируса встроены два гена Е2 разных генотипов. Один из них под контролем полиэдринового промотора, а второй под контролем промотора р10. Прототипный препарат под рабочим названием Е2+Е2, содержащий одновременно рекомбинантные белки Е2 вирусов КЧС генотипов 1 и 2, был также испытан в опыте на естественно восприимчивых животных (всего 5 голов) для оценки принципиальной возможности его использования (26). Было показано, что он не уступает исходной конструкции на основе рекомбинантного белка Е2 из штамма 8Z вируса КЧС. Прототипный препарат был признан перспективным.
4. На основе концепции прототипной конструкции методом химического синтеза ДНК был получен штамм продуцент ШАТ-22 с рядом уникальных характеристик, являющийся предметом данного изобретения.
Предлагаемый препарат несет в себе одновременно все следующие свойства, оптимизирующие технологический процесс наработки антигена и его контроль: кодон-оптимизация для наработки в клетках насекомых, удаленный трансмембранный домен Е2 для снижения его ассоциации с клеточной фракцией в сырье, добавление высокоэффективной секреторной последовательности MKFLVNVALVFMVVYISYIYA, удлиненная гистидиновая метка из 14 аминокислотных остатков, маркерные эпитопы НА и МУС для идентификации индивидуальных рекомбинантных продуктов. Удаление трансмембранного домена для повышения эффективности наработки рекомбинантного продукта и резкого снижения степени его ассоциации с клеточной фракцией при производстве вакцинного сырья является стандартным приемом, который был использован различными исследователями при разработке аналогичных препаратов для профилактики КЧС. Предварение кодирующей последовательности Е2 сигналом секреции во внеклеточное пространство также является уже опробованной технологией для дополнительного разделения рекомбинантного продукта и клеточной фракции в производственном цикле. Однако нами был использован метод сборки сигнальной последовательности из синтетических олигонуклеотидных зондов с использованием ДНК-полимеразы для получения вектора, несущего сигнальный пептид секреции токсичного белка пчелиного яда мелиттина, эффективного сигнала, обеспечивающего внеклеточную локализацию рекомбинантного продукта по данным литературы (28).
Технический результат
По сравнению с прототипом вакцина субъединичная маркированная против классической чумы свиней, полученная на основе штамма ШАТ-22, обладает более высокой эффективностью и удобством в производстве, увеличенным выходом антигена. Это достигается за счет сочетания всех внесенных в штамм-продуцент рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22 изменений, комплекс которых одновременно позволяет решить несколько задач.
Прежде всего, это повышение эффективности производства вакцины за счет снижения степени ассоциации рекомбинантных белков Е2 с клеточной фракцией, благодаря удалению ТМ домена Е2 и добавлению высокоэффективного сигнала секреции белка, типичного для насекомых, MKFLVNVALVFMVVYISYIYA.
Гистидиновая метка из 14 аминокислотных остатков позволяет эффективно очищать антиген для получения референтного производственного стандарта, наличие индивидуальных антигенных маркеров НА и MYC на белках Е2 первого и второго генотипов соответственно позволяет контролировать их одновременное присутствие в производственных сериях препарата.
Сочетание одновременного присутствия в синтетическом фрагменте ДНК двух независимо экспрессируемых последовательностей, кодирующих антигены, несущие фрагменты, гомологичные белкам Е2 вируса КЧС двух генотипов, и их кодон-оптимизации под систему экспрессии в клетках насекомых, позволяет добиться увеличения выхода продукта на 30-50% по сравнению с прототипной конструкцией.
Возможность быстрой замены последовательностей, кодирующих гены Е2 вирусов КЧС на последовательности актуальных эпидемических изолятов.
Возможность комбинации штамма ШАТ-22 и исходного штамма, в котором ген Е2 изолята 8Z вируса КЧС заменен на последовательность актуального эпидемического изолята, либо одновременное использование штамма ШАТ-22 и модифицированной прототипной конструкции, для повышения эффективности препарата в случае вспышки КЧС, вызванной вирусами генотипа 3 или неизвестного в настоящее время генотипа (в т.ч. в случае акта биотерроризма);
Для решения этих задач были получены синтетические фрагменты ДНК, а на их основе вектор-носитель, в которых помимо использованных ранее в прототипной конструкции Е2+Е2 решений (в последовательности гена Е2 удалена часть, кодирующая трансмембранный домен; оба фрагмента генов Е2 предварены сигнальной последовательностью секреции мелиттина), были применены следующие новые, не использованные ранее техники:
- фрагмент гена Е2 штамма Шимынь вируса КЧС генотипа 1, в котором частота использования кодонов, кодирующих аминокислотные остатки в белке, приведена в соответствие с наиболее часто встречающимися в ДНК насекомых кодонами (т.е. проведена кодон-оптимизация);
- фрагмент гена Е2 штамма Альфорт-Тюбинген вируса КЧС генотипа 2, в котором частота использования кодонов, кодирующих аминокислотные остатки в белке, приведена в соответствие с наиболее часто встречающимися в ДНК насекомых кодонами (т.е. проведена кодон-оптимизация);
- оба фрагмента генов Е2 снабжены удлиненной С-концевой гистидиновой меткой (14 аминокислотных остатков);
- к фрагменту гена Е2 штамма Шимынь генотипа 1 добавлен фрагмент ДНК, кодирующий маркерный эпитоп НА (аминокислотная последовательность YPYDVPDYA), для которого существуют коммерчески-доступные антитела;
- к фрагменту гена Е2 штамма Альфорт-Тюбинген генотипа 2 добавлен фрагмент ДНК, кодирующий маркерный эпитоп MYC (аминокислотная последовательность EQKLISEEDL), для которого существуют коммерчески-доступные антитела.
Методом рекомбинации между вектором-носителем и геномом бакуловируса получен штамм-продуцент бакуловируса ядерного полиэдроза Autographa californica ШАТ-22.
В целом, достижение технического результата от использования предлагаемой вакцины связано с использованием в ее составе модифицированного описанными выше дополнительными кодирующими последовательностями антигенного материала из штаммов вируса КЧС первого (Шимынь) и второго (Альфорт-Тюбинген) генотипов, являющегося фактически аналогом эктодоменов поверхностных гликопротеинов Е2 циркулирующих в РФ полевых вирусов КЧС, секретирующихся в культуральную среду и не ассоциированных с клеточной фракцией.
Технология создания и производства вакцины субъединичной маркированной против классической чумы свиней на основе белка Е2.


Штамм-продуцент рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22 является новым, ранее неизвестным оригинальным авторским штаммом, получен генно-инженерным путем. Производственный штамм-продуцент рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22 получен методом трансфекции культуры клеток Sf-9 с использованием липосомного агента. Для трансфекции была использована очищенная рекомбинантная ДНК полученного методами генной инженерии бакуловируса. Штамм депонирован в государственной коллекции вирусов института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под инвентарным номером ГКВ 2983. Штамм накапливается в высоких титрах и обладает способностью к одновременной наработке рекомбинантных антигенов, несущих фрагменты, гомологичные белкам Е2 вирусов КЧС первого и второго генотипа. Экспериментально подтверждена возможность его использования для изготовления субъединичной маркированной вакцины.
Штамм ШАТ-22 вируса ядерного полиэдроза Autographa californica характеризуется следующими признаками и свойствами.
Морфологические свойства
Штамм ШАТ-22 вируса ядерного полиэдроза Autographa californica относится к крупным ДНК-содержащим вирусам, роду Alphabaculovirus семейства Baculoviridae. Обладает характерной для вируса ядерного полиэдроза морфологией: отдельные вирионы имеют палочковидную форму и протяженность по длинной оси 250-300 нм, при этом в зараженных клетках вирионы объединяются в группы и образуют включения в виде многогранников (полиэдров) размером от 0,3 до 15 мкм.
Антигенные свойства
Отличительной чертой штамма ШАТ-22 является продукция модифицированных антигенов Е2 вирусов КЧС первого и второго генотипов, несущих дополнительные маркерные эпитопы: гистидиновую метку, метки НА и MYC, все три могут быть детектированы с помощью коммерчески доступных антител. Вирус детектируется не только коммерческими иммунореагентами для детекции гистидиновой, НА и MYC меток, но и антителами к белку Е2 вируса КЧС.
Молекулярно-биологические характеристики
Идентификацию вируса проводили методом ПЦР с олигонуклеотидными зондами, специфичными к генно-инженерной вставке, кодирующей модифицированные последовательности вируса КЧС. В результате исследований штамма ШАТ-22 было подтверждено наличие вставки ожидаемого размера.
Биотехнологические характеристики
Штамм ШАТ-22 предназначен для использования при наработке сырья для изготовления субъединичной маркированной вакцины, а также диагностических биопрепаратов. Штамм ШАТ-22 репродуцируется в культуре клеток Sa-9. В течение 96 часов инкубирования вирус накапливается с инфекционной активностью 107-5×107 БОЕ/мл.
Хемо- и генотаксономическая характеристика Штамм ШАТ-22 является ДНК-содержащим вирусом.
Вирусный геном состоит из двойной молекулы ДНК общим размером около 136 тысяч н.п, несущих информацию о 154 вирусных белках, кроме которых также добавлены последовательности, кодирующие гены Е2 вируса КЧС первого и второго генотипов. Физические свойства
Плавучая плотность в сахарозе 1,17-1,18 г/см3. Устойчивость к внешним факторам. Вирус чувствителен к инактивации липидными растворителями, детергентами, формалином, β-пропиолактоном, окислителями, разбавленными кислотами, эфиром, дезоксихолатом натрия, гидроксиламином, додецилсульфатом натрия и ионами аммония, а также инактивируется нагреванием, крайними значениями рН, неизотоничными условиями, УФ-облучением и высушиванием.
Дополнительные признаки и свойства Не способен к размножению в культурах клеток растительного и животного происхождения. Онкогенность отсутствует.
Справка о депонировании штамма прилагается.
Обоснование выбора типа вакцины и антигена, являющегося специфическим компонентом вакцины, приведены выше. После успешного испытания сначала аналога зарубежных препаратов, а затем исходной конструкции (штамм-продуцент 8Z), было принято решение о создании оптимизированной конструкции с более широким спектром защиты на основании двух циркулирующих на территории РФ генотипов вируса КЧС. В качестве прототипа для фрагмента ДНК, кодирующего последовательность, гомологичную гену Е2 вируса КЧС генотипа 1, был выбран высоко патогенный штамм-пробойник вируса КЧС Шимынь, использованный нами ранее в опытах с контрольным заражением экспериментальных свиней. За основу была взята последовательность РНК штамма Шимынь, доступная в базе данных GenBank под номером AF092448.2. Из полногеномной последовательности вирусной РНК с помощью программного обеспечения для работы по анализу нуклеиновых кислот и белков DNA-star Lasergene и доступного в онлайн-формате на сайте базы данных GenBank программного обеспечения protein Blast, был идентифицирован фрагмент вирусной РНК, кодирующий поверхностный гликопротеин Е2, локализован участок, кодирующий трансмембранный домен гликопротеина Е2. Аналогичным образом был идентифицирован участок генома вируса КЧС генотипа 2 Альфорт-Тюбинген, номер в базе данных GenBank J04358.2. Последовательности нуклеиновой кислоты, кодирующие эктодомены, т.е. лишенные трансмембранного домена, белков Е2 штаммов Шимынь и Альфорт-Тюбинген, были использованы в качестве основы для написания технического задания на получение синтетического фрагмента ДНК.
С целью предельного облегчения возможности разделить рекомбинантный продукт и клеточную фракцию, присутствие которой в вакцине нежелательно, помимо удаления последовательности, кодирующий трансмембранный домен белка Е2 (и разрывая таким образом связь рекомбинантного белка и фракции клеточных мембран), кодирующие последовательности эктодоменов Е2 были предварены высокоэффективным сигналом внеклеточной секреции от токсина пчелиного яда мелиттина. С целью повысить уровень наработки рекомбинантного продукта в культуре клеток насекомых, были выполнены две задачи. Первая - каждый из генов в синтетическом фрагменте ДНК был поставлен под свой собственный промотор, полиэдриновый либо р10, для обеспечения одновременной и независимой наработки двух рекомбинантных антигенов с одной конструкции. Вторая - проведена дивергентная кодон-оптимизация фрагментов, кодирующих последовательности, гомологичные эктодоменам Е2 вирусов КЧС Шимынь и Альфорт-Тюбинген, таким образом, чтобы с одной стороны частота использования различных кодонов соответствовала таковой в клетках насекомых, а с другой, чтобы при соблюдении этого условия добиться максимально возможного различия между двумя последовательностями, гомологичными эктодоменам Е2. Кодон-оптимизация позволяет повысить уровень экспрессии гена, а дивергентная кодон-оптимизация дополнительно стабилизирует синтетический фрагмент ДНК, снижая риск гомологичной рекомбинации с выбрасыванием фрагмента из генома штамма-продуцента ШАТ-22.
Введение в конструкцию 14 гистидиновых остатков на С-конце каждого из генов и маркерных эпитопов НА (Альфорт-Тюбинген) и MYC (Шимынь), требуется для облегчения иммунодетекции продукта, возможности дифференциальной диагностики продукта каждого из генов и для очистки рекомбинантных белков методом металло-аффинной хроматографии в том числе для получения очищенного стандарта антигена. На все перечисленные эпитопы существует широкий выбор коммерчески доступных иммунореактивов для их детекции, например: моноклональные антитела мыши к гистидиновой метке ab18184 (Abcam, США), анти-MYC моноклональные антитела мыши ab32 (Abcam, США), анти-НА моноклональные антитела мыши ab49969 (Abeam, США).
Также каждый из генов фланкирован сайтами узнавания эндонуклеаз рестрикции, что позволяет при необходимости заменить в синтетической конструкции существующий ген на другой, например на последовательность, кодирующую фрагмент, гомологичный гену Е2 более патогенного полевого изолята вируса, либо Е2 генотипа 3 в случае его заноса с территории КНР. Это придает синтетической конструкции адаптивность к динамичной картине циркуляции полевых изолятов вируса.
Вся синтетическая ДНК, включающая описанные выше два гена, фланкирована местами посадки коммерчески доступных олигонуклеотидных зондов М13 (например, Q5401, Promega, США) для обеспечения возможности контроля рекомбинации между синтетической ДНК и геномом бакуловируса.
Штамм-продуцент ШАТ-22 был получен методом сайт-специфической рекомбинации (транспозиции) синтетической ДНК и существующего в клетках Escherichia coli в виде плазмиды модифицированного генома бакуловируса дикого типа. Для этого синтетическая ДНК была вставлена в вектор-носитель, и трансформирована в клетки Escherichia coli, несущие модифицированный бакуловирусный геном. Рекомбинантные колонии Escherichia coli были отобраны с помощью цветного теста и полимеразной цепной реакции с олигонуклеотидными зондами М13. Отобранные рекомбинантные колонии были использованы для приготовления ночной культуры на среде Luria-Bertani (LB), из которой рекомбинантная бакуловирусная ДНК была выделена методом щелочного лизиса и переосаживания ДНК с изопропанолом. Выделенная рекомбинантная бакуловирусная ДНК была использована для трансфекции клеток Sf-9, культуры клеток насекомого Spodoptera frugiperda, номер в американской коллекции клеточных культур (АТСС) CRL-1711. Для трансфекции был использован коммерчески доступный липосомный агент, например Cellfectin II, каталожный номер 10362100 (ThermoFisher, США) и бессывороточная среда для клеток насекомых, например SF-900 II SFM (ThermoFisher, США). Клональную селекцию бакуловирусов осуществляли методом пошагового скрининга отдельных клонов, полученных методом сайт-специфической рекомбинации (транспозиции) в клетках Escherichia coli. Для этого десятикратными разведениями вируса, собранного после появления цитопатического действия на клетках после трансфекции, заражали монослой клеток Sf-9 и заливали их средой SF-900 II SFM, в которой был расплавлен легкоплавкий агар для культуры клеток (например, Noble агар, J10907.А1 ThermoFisher, США) для определения инфекционного титра вируса. Материал от клонов вируса, давших самые высокие титры в тесте на бляшкообразование, отбирали и замораживали при -70°С, а затем поочередно использовали для заражения клеток Sf-9 и проверяли полученный материал как методом полимеразной цепной реакции (ПЦР) с олигонуклеотидными зондами М13, так и в иммуноферментном анализе (ИФА) с моноклональными антителами к гистидиновой метке и к поверхностному гликопротеину Е2 вируса КЧС.
Высокопродуктивный положительный в ПЦР и ИФА клон был использован для дальнейшей работы и депонирован в коллекции штаммов Национального исследовательского центра эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи как штамм ШАТ-22.
Рекомбинантный вирус был исследован в динамике накопления на культуре клеток Sf-9. После трех пассажей на культуре клеток инфекционный титр вируса, дающий гибель 50% монослоя клеток (Тканевая цитопатическая доза 50, ТКД50), составил 7,5 lg. В опытах по кинетике накопления вируса в культуре клеток оптимальные титры штамма-продуцента ШАТ-22 приходились на диапазон 4-6 дней после заражения, далее титры переставали расти, а, начиная с 7 дня, массовая гибель клеток совпадала с падением в содержании живого вируса в материале.
Оптимальную множественность заражения вируса определяли в вирусных частицах на одну клетку в монослое. Для этого титровали вирус методом бляшкообразования и методом определения ТЦД50 в параллель, для выявления корреляции между этими показателями, так как тест на бляшкообразование трудоемок и чувствителен к малейшим ошибкам, в то время как титрование по ТЦД50 может рутинно использоваться в производственном цикле без затруднений. Различие между показателями установлено примерно на один порядок, ТЦД50 завышает титр по сравнению с тестом на бляшкообразование, что учитывалось далее. В ходе первых опытов с использованием теста на бляшкообразование была установлена оптимальная множественность инфекции в 5 бляшкообразующих частиц на одну клетку, для чего перед заражением осуществляли подсчет клеток на единице площади монослоя и затем экстраполировали данные на площадь всего монослоя.
Для препаративной наработки антигена используют суспензионную культуру клеток Sf-9 или Sf-21 в роллерных бутылях объемом 2 л, установленных на роллерной установке в термальной комнате при температуре 27°С. Перед заражением количество клеток в суспензионной культуре подсчитывают в камере Гаряева и заражают с множественностью заражения 5 БОЕ/клетка вирусной расплодкой, полученной на монослое клеток Sf-9, как описано выше. Наращивание рекомбинантных белков Е2 вируса КЧС осуществляется на протяжении 5-6 суток, затем материал снимают и объединяют в емкости соотвествующего объема. После выдерживания в течение 24 ч при +4С производят декантирование собранного материала - сливают отстоявшуюся культуральную среду, содержащую рекомбинантные белки Е2, с осадка клеток. Осветленную методом декантирования культуральную среду используют для инактивации бакуловирусного генома и затем для изготовления полуфабриката вакцинного сырья (антигенного материала). Антигенный материал готовится в два этапа. Прежде всего геном рекомбинантного бакуловируса инактивируется обработкой бинарным этиленимином. Затем полученный материал разводится DPBS таким образом, чтобы концентрация рекомбинантных белков Е2 в полученном разведенном материале составляла 60 мкг/мл ± 10%. Таким образом получают полуфабрикат вакцинного сырья (антигенного материала), выровненный по содержанию антигена и готовый к дальнейшему замешиванию с разбавителем, адьювантом, и консервантом в определенной схемой производства пропорции, указанной в таблицах 3 и 4. Замешивание антигенного материала и других компонентов осуществляется с помощью погружного лабораторного гомогенизатора в стерильных условиях. Содержание специфического компонента вакцины в готовом препарате должно составлять 30 мкг/мл, а так как одна доза вакцины имеет объем 2 мл, содержание рекомбинантного белка Е2 в одной дозе вакцины составляет 60 мкг с допустимой погрешностью 10%.
Для количественного определения наработки специфического компонента вакцины в культуре клеток Sf-9 нами был использован непрямой метод оценки относительно калибровки очищенного стандарта Е2 в коммерческой ИФА тест-системе PrioCheck CSFV antigen на антиген Е2 вируса КЧС. Для этого рекомбинантный продукт был очищен методом металло-аффинной хроматографии на Ni-NTA агарозной смоле в нативных условиях с имидазолом. Принцип метода заключается в том, что культуральная среда от клеток Sf-9, зараженных штаммом-продуцентом ШАТ-22, пропускается через хроматографическую колонку, снаряженную Ni-NTA агарозой, затем происходит промывка колонки в физиологических условиях при значении рН 8.0, сначала фосфатным буфером, не содержащим имидазола, затем повышающимися концентрациями имидазола и фосфатном буфере при том же значении рН. Имидазол в высоких концентрациях (250 мМ) вытесняет гистидиновые остатки, связавшиеся с атомами никеля на колонке, и рекомбинантный белок с гистидиновой меткой в этой концентрации имидазола смывается с колонки. Элюированный белок диализовали против фосфатно-солевого буфера в течение 72 часов, однократно сменив буфер. Полученный таким образом материал был проанализирован в ИФА Prionics, методом электрофореза в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ), в иммуноблоте с антигистидиновыми антителами. Концентрация белка в стандарте определена по методу Бредфорд на наборе для определения концентрации белка (Pierce, США). На основе исследования двукратных разведений полученного очищенного стандарта в ИФА PrioCheck CSFV antigen была построена калибровочная кривая, по которой далее определяли содержание специфического компонента вакцины в партиях сырья, исследуя их в ИФА PrioCheck CSFV antigen. Исходя из ранее определенной минимальной достаточной дозы специфического компонента вакцины (26), накопление антигена считалось достаточным при концентрации специфического компонента в культуральной среде в 120 мкг/л, еще лучше концентрация в 250 мкг/л, еще лучше 500 мкг/л, оптимальным диапазоном является концентрация 200-400 мкг/л. Концентрация антигена при использовании прототипной конструкции 8Z обычно лежала в пределах 120-150 мкг/л.
Секреторная форма рекомбинантного антигена, при которой весь антиген выводится из клеток в культуральную среду, позволяет легкое разделение жидкой фракции, содержащей антиген, и клеточного дебриса. В небольших объемах разделение происходит методом центрифугирования и отбрасывания осадка, в перспективе в условиях производства в биореакторах возможно простое отстаивание и декантирование вакцинного сырья. Очищенный от дебриса клеток материал, содержащий рекомбинантный Е2 оценивают методом ИФА на количественное содержание Е2 и исходя из концентрации рекомбинантного антигена подбирают соответствующее количество DPBS для приготовления антигенного материала, конечная концентрация рекомбинантного белка в котором должна составлять 60 мкг/мл. После приготовления полуфабриката содержание рекомбинатного Е2 в нем контролируют повторно, допускается отклонение в концентрации антигена не более 10% от значения 60 мкг/мл. Полуфабрикат вакцинного сырья (антигенный материал) используют затем для изготовления вакцинного препарата.


Вакцинный препарат проверяют на безопасность и иммуногенность на лабораторных животных, морских свинках. Препарат не должен негативно влиять на здоровье лабораторных животных после введения за исключением возможности образования легкого отека и уплотнения тканей в месте введения препарата. После двукратного введения препарата наличие антител к Е2 определяют в конкурентной ИФА тест-системе КЧС-серотест, как это описано в примере 4.
В опытах на животных с исходной и прототипной конструкциями была продемонстрирована способность препарата защищать свиней от летальной дозы штамма пробойника КЧС Шимынь с разными адъювантами и разными схемами применения (26). Использование масляного адъюванта ISA 61 давало возможность применять схему однократной вакцинации, однако вызывало реактогенность у опытных животных, что может быть неприемлемым в условиях коммерческого производства свинины. Полимерный адъювант после двукратного введения защищал свиней и не давал реактогенности, но изготовленный на его основе препарат был неустойчив при хранении. В итоге нами были проведены дополнительные исследования и показана возможность использования масляного адъюванта ISA 28 по схеме двукратного введения и со временем хранения при +2-8°С не менее 18 месяцев.
Для определения времени хранения препарата образцы вакцины были заложены на хранение с интервалом в 6 месяцев, и через 18 месяцев пролежавший в холодильнике полный срок препарат, хранившийся 12 и 6 месяцев, а также свежеприготовленный образец вакцины, были испытаны в опыте с контрольным заражением на свиньях. Показано, что все вакцинированные животные выжили и не теряли вес в течение 3 недель после заражения, тогда как невакцинированные зараженные животные пали.
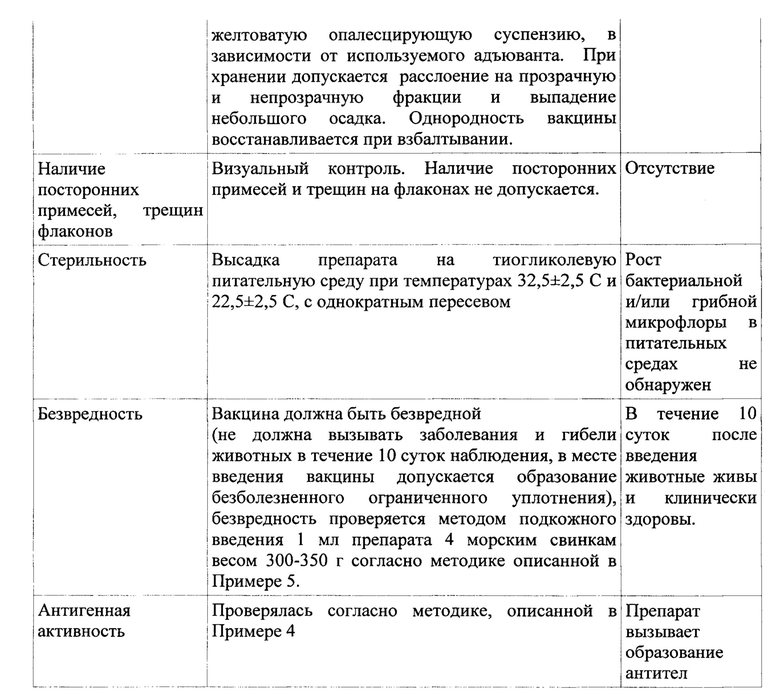
Применение вакцинного препарата
Лекарственная форма препарата - эмульсия для инъекций (вакцина рекомбинантная инактивированная). Вакцина изготовлена из рекомбинантного поверхностного гликопротеина Е2 классической чумы свиней. По внешнему виду вакцина представляет собой однородную эмульсию белого цвета. В случае использования полимерного адьюванта внешний вид препарата - желтоватая опалесцирующая суспензия. При хранении допускается расслоение на прозрачную и непрозрачную фракции и выпадение небольшого осадка. Однородность вакцины восстанавливается при взбалтывании. Срок годности вакцины - 18 мес от даты выпуска при соблюдении условий хранения и транспортирования. По истечении срока годности вакцина к применению не пригодна. Вакцину необходимо использовать в течение 8 часов после вскрытия флакона.
Вакцина расфасована по 100,0 мл в стеклянные или полимерные флаконы соответствующей вместимости, укупоренные резиновыми пробками, укрепленными алюминиевыми колпачками. Флаконы с вакциной упакованы в картонные (деревянные) или пенопластовые (коробки) ящики с разделительными перегородками, обеспечивающими их целостность и неподвижность. В каждую коробку с вакциной вложена инструкция по ее применению.
Вакцину хранят и транспортируют при температуре от 2 до 8°С. Не допускается замораживание вакцины. Вакцину вводят внутримышечно в области шеи (за ухом) по одной из схем:
- поросятам в возрасте 40-45 дней по 2,0 мл двукратно с интервалом в 21 сутки;
- ремонтным свинкам и свиноматкам - двукратно, в дозе 2,0 мл с интервалом 21 сутки, с таким расчетом, чтобы повторная вакцинация приходилась за 14-21 сутки до осеменения, с последующей ревакцинацией также двукратно перед каждым осеменением;
- хрякам-производителям 2 раза в год в дозе 2,0 мл двукратно с интервалом 20-30 суток.
Вакцина индуцирует образование антител с титром вируснейтрализующих антител к вирусу КЧС не менее 1:32, что позволяет уменьшить риск передачи патогенного вируса КЧС и существенно снизить или исключить заболеваемость свиней.
Перед применением вакцину выдерживают в течение 12-14 часов при комнатной температуре (20-24°С). В процессе применения флаконы с вакциной периодически взбалтывают до восстановления однородной консистенции препарата. Вакцинацию проводят с соблюдением общепринятых правил асептики, для инъекции используют только стерильные материалы и инструменты. Для каждого животного используют отдельную иглу.
Предполагаемое изобретение иллюстрируется следующими примерами.
Пример 1. Для изготовления вакцины используют производственные партии вируссодержащей культуральной жидкости, которые инактивируют до полной потери инфекционности. В качестве инактиванта использовали бинарный этиленимин в концентрации 10 мМ, обработку проводили в течение от 12 до 52 часов при 37°С. Остаточный бинарный этиленимин был гидролизован 15 мМ тиосульфатом натрия. Отобранные на исследование образцы инактивированного сырья хранили при 2-8°С. Кинетику инактивации изучали в следующем эксперименте: после добавления бинарного этиленимина в пул вируссодержащего материала отбирали пробы непосредственно после смешивания и через 6, 12, 24, 36, 48 и 52 часов инкубирования при температуре 37°С. Для нейтрализации бинарного этиленимина отобранные пробы были обработаны 15 мМ тиосульфитом натрия. После этого все пробы были проверены на полноту инактивации согласно стандартной методике: были проведены три последовательных пассажа в культуре клеток Sf-9. Второй и третий пассажи проводили с использованием культуральной среды предыдущего пассажа. Инактивацию вируса оценивали по наличию/отсутствию ЦПД в культуре клеток Sf-9. Результаты представлены в таблице 5:

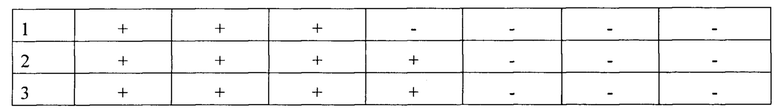
Таким образом, установили, что вирус был полностью инактивирован бинарным этиленимином в данной концентрации через 48-52 часа инкубации при температуре 37°С. Однако, учитывая необходимость гарантированной полной инактивации генно-инженерного вируса, стандартным сроком инактивации в рутинной работе установили период 52 часа, что значительно превышает нижний предел метода. После инкубации антиген хранили при температуре +(2-8)°С в течение 21 сут (карантинный срок, необходимый для проведения исследования полученного материала).
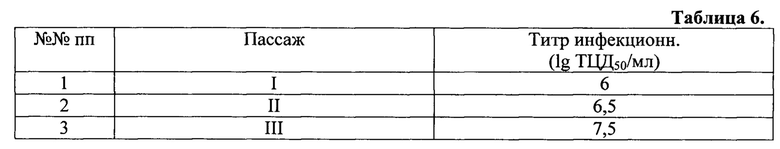
Пример 2. Для получения стабильно активных по штамму-продуценту производственных партий расплодки для дальнейшего производства рекомбинантных антигенов Е2, изготовили матровые расплодки проведением трех последовательных пассажей вируса на культуре клеток Sf-9. Биологические характеристики полученных трех генераций вируса представлены в таблице 6.
Пример 3. При оптимизации условий культивирования вируса определяли величину оптимальной заражающей дозы, для чего проводили опыты по инфицированию культуры клеток с различной множественностью заражения. Полученные результаты представлены в таблицах 7 и 8.
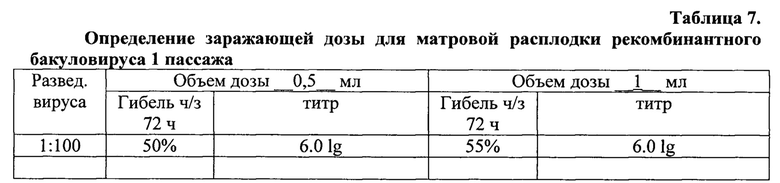
Из данных таблицы следует, что наивысшая (6,0 lg) активность партий вируса получена при использовании заражающей дозы 0,5 мл. За оптимальную заражающую дозу приняли 0,5 мл, поскольку при титровании индивидуальных проб количество более активных превалировало в этой группе. Кроме того, было установлено, что срок инкубации зараженной культуры клеток не должен превышать 168 часов, т.к. к этому моменту наблюдается массовая гибель клеток.
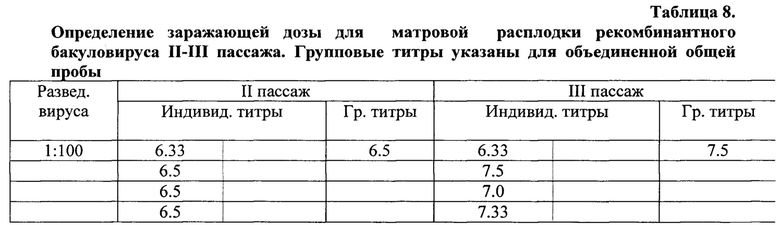
Как и в первом пассаже, наиболее высокие титры были получены при использовании дозы 0.5 мл. Таким же образом была установлена заражающая доза для наработки культурального вируса, которая составила 5 вирусных частиц на клетку.
Пример 4. Определение содержания рекомбинантного белка Е2 вируса классической чумы свиней в антигенном материале в ИФА
Для проведения исследования используют пробы суспензии перевиваемой линии клеток насекомых Hi-5, инфицированной рекомбинантным вирусом ядерного полиэдроза калифорнийской совки Autographa californica (AcNPV), штамм ШАТ-22, в объеме 10 мл.
Исследуемую пробу центрифугируют в течение 10 мин при 3000 об/мин. Надосадочную жидкость удаляют. Допускается замораживание полученного осадка (минус 20°С). Затем осадок ресуспендируют в 2 мл 0,1 М карбонат-бикарбонатного буфера и дезинтегрируют ультразвуком (во льду) 2 минуты (интервалы: 2 секунды с промежутками в 2 секунды) (мощность 100-150 Ватт). Обработанные ультразвуком лизаты переносят в микроцентрифужные пробирки объемом 1,5 мл (по 1 мл каждой пробы) и центрифугируют 10 мин при 10000 об./мин при 4°С. Надосадок используют для постановки ИФА. При необходимости материал можно заморозить и хранить при минус 20°С до выполнения ИФА.
Для количественного определения рекомбинантного антигена Е2 в исследуемом материале используют коммерческий ИФА набор PrioCHECK CSFV Ag Strip Kit (ThermoFisher, США), для чего строят калибровочную кривую по разведениям очищенного методом металлоаффинной хроматографии препарата рекомбинантного антигена Е2 известной концентрации. Постановку ИФА проводят в соответствии с инструкцией производителя набора. Общая схема постановки реакции следующая. Перед началом исследования все компоненты набора выдерживаются при комнатной температуре. Лиофилизированные контрольные образцы, входящие в состав набора, растворяют в 1,5 мл деионизованной воды. Разводят концентрированный 30× конъюгат до рабочей концентрации, добавив в него стабилизатор конъюгата. Например, на два стрипа готовят 2,1 мл рабочего раствора, смешав 400 мкл стабилизатора конъюгата с 1,63 мл буфера разведения конъюгата и 70 мкл 30× раствора конъюгата. Концентрат раствора для промывки планшета разводят 1:200 деионизованной водой. Далее во все лунки планшета, которые требуются для постановки реакции, добавляют 50 мкл буфера разведения образцов. В лунки А1 и В1 добавляют по 50 мкл контрольной сыворотки 1, в лунки C1 и D1 - по 50 мкл контрольной сыворотки 2, в лунки Е1 и F1 - по 50 мкл контрольной сыворотки 3. В оставшиеся лунки добавляют по 50 мкл исследуемых образцов. Инкубируют планшет 3 часа при комнатной температуре. Затем планшет отмывают шестикратно, нанося в лунки по 300 мкл промывочного раствора. После промывки в каждую лунку вносят 100 мкл рабочего раствора конъюгата и инкубируют 60 мин при комнатной температуре. Повторяют шестикратную промывку и вносят во все лунки 100 мкл хромоген-субстратного комплекса (ТМБ), инкубируют планшет для окрашивания 15 мин при комнатной температуре в защищенном от света месте. Реакцию останавливают добавлением 100 мкл стоп-раствора, результаты реакции учитывают на фотометре с длиной волны 450 нм. Достоверность реакции рассчитывается на основании средних значений оптических плотностей контрольных образцов. Контрольный образец 2 - фоновый сигнал, контрольный образец 1 - положительный контроль. Значение процентной положительности (ПП) контроля №3 должно быть не ниже 20%. ПП рассчитывается по формуле ПП=(ОП450 контроля 3 - ОП450 контроля 2)/(ОП450 контроля 1 - ОП450 контроля 2) × 100. Если критерии достоверности реакции выполнены, строится калибровочная кривая по серии разведений стандарта рекомбинантного Е2 известной концентрации, затем по калибровочной кривой определяется соответствие значений ОП450 рекомбинантного антигена в сырье определенной концентрации. Содержание рекомбинантного антигена в сырье не должно быть ниже 60 мкг на мл суспензии клеток.
Пример 5. Антигенную активность вакцины определяли на 3 экспериментальных сериях, для каждой из которых получали отдельные партии вирусного антигена, инактивировали их бинарным этиленимином до полной потери инфекционности штамма-продуцента, (очищали от вируса-продуцента) компоновали с масляным адъювантом ISA-28 (15%), проводили эмульгирование и расфасовывали по 100 см3 во флаконы соответствующей вместимости, укупоренные резиновыми пробками и укрепленными алюминиевыми колпачками.
Каждую из 3 полученных экспериментальных серий вакцины испытывали на 4 опытных морских свинках и 4 контрольных морских свинках массой 300-350 грамм, обоих полов, методом двукратного внутримышечного введения в наружную часть мышцы бедра с интервалом 21 день 1,0 см3 объединенной пробы вакцины, контрольным животным вводили тот же объем физиологического раствора. У всех животных брали кровь до и через 21 сутки после второй вакцинации, из которой получали сыворотку крови по общепринятой методике.
Антигенную активность проверяли методом ИФА с помощью коммерческого набора «КЧС-СЕРОТЕСТ» (организация-производитель ООО «Ветбиохим»), все исследования проводили согласно инструкции по применению с некоторыми изменениями.
В лунки планшета вносили по 75 мкл буфера для разведения сывороток (БР), из расчета по 2 лунки на каждый образец исследуемой сыворотки и по 2 лунки на положительный (К+набор) и отрицательный (К-набор) контроль из набора. В лунки А1-В1 планшета вносили по 50 мкл К+набор, в лунки C1-D1 добавляли по 50 мкл К-набор. В остальные лунки с БР вносили по 50 мкл исследуемых образцов сывороток. Планшет закрывали липкой лентой и инкубировали 90 минут при комнатной температуре.
Затем, планшет 5 раз промывали буфером из набора для отмывания планшетов (фосфатно-солевой буфер с Tween, ФСБТ) по 300 мкл/лунку, каждый раз полностью удаляя жидкость из лунок постукиванием перевернутого планшета по фильтровальной бумаге.
В каждую лунку вносили по 100 мкл раствора конъюгата. Планшет закрывали липкой лентой и инкубировали 45 минут при температуре 37°С. Затем, планшет вновь 5 раз промывали ФСБТ по 300 мкл/лунку, каждый раз полностью удаляя жидкость из лунок постукиванием перевернутого планшета по фильтровальной бумаге.
В каждую лунку вносили по 100 мкл хромоген-субстратного раствора из набора. Планшет инкубировали 20 минут в темном месте при комнатной температуре.
Реакцию останавливали добавлением в каждую лунку 50 мкл стоп-раствора из набора.
После остановки реакции измеряли оптическую плотность в каждой лунке на спектрофотометре с вертикальным лучом при длине волны 450 нм (А450).
Вычисляли среднее значение А450 для К-набор и К+набор (А450К-наборср=Т,4; А450К+наборср=0,25). В соответствии с инструкцией к набору данные результаты являются достоверными и могут быть учтены. Результаты исследования представлены в таблице 9

Установлено, что вакцина индуцировала накопление антител к поверхностному гликопротеину Е2 вируса КЧС, сероконверсия у контрольных животных отсутствовала.
Пример 6 Безвредность каждого варианта вакцины испытывали после подкожного введения морским свинкам весом 300-350 грамм экспериментальных серий вакцины в объеме 1 мл. За животными вели наблюдение в течение 10 суток, после чего провели убой и вскрытие с целью выявления патологоанатомических изменений. В течение срока наблюдения у опытных морских свинок не наблюдали случаев переболевания и снижения конверсии корма. После вскрытия местных воспалительных реакций в области инъекции обнаружено не было, что характеризует препарат как безвредный.
Пример 7. Протокол контроля стабильности в процессе хранения готового препарата по всем показателям в течение срока годности (18 месяцев).
Контроль стабильности осуществляется в момент изготовления препарата и после хранения на протяжении 3, 6, 9, 12 и 18 месяцев, т.е. с интервалом в 3 месяца до конца заявленного срока годности. За это время внешний вид флакона и содержимого, стерильность и антигенные свойства должны оставаться без изменений либо изменяться в допустимых пределах. Контролируемые параметры, методы контроля и результаты перечислены в таблице 10.

Пример 8. Определение антигенных свойств препарата в опыте с контрольным заражением естественно восприимчивых животных высокопатогенным штаммом-пробойником КЧС Шимынь.
Для опыта используют отнятых от свиноматки и переведенных на комбикорм здоровых поросят в возрасте 21 день. После 7 дней акклиматизации в общем помещении животных делят на три группы: вакцинированные, невакцинированные и контрольные животные. Вакцинированные животные получают две дозы вакцины, содержащей не менее 60 мкг рекомбинантного антигена Е2 в дозе, с интервалом в три недели. Группа невакцинированных животных получает препарат, аналогичный по составу неспецифических компонентов, но не содержащий рекомбинантного антигена Е2, полученный путем заражения культуры клеток насекомых бакуловирусом дикого типа. Контрольные животные не получают никакого препарата. Группы вакцинированных и невакцинированных животных содержатся в разных помещениях в одной зоне, контрольную группу размещают в другом здании и используют меры биобезопасности, исключающие перенос вируса КЧС от животных экспериментальных групп животным группе контрольной. Через две недели после повторного введения препарата (т.е. через 5 недель после первой иммунизации), животные экспериментальных групп подлежат контрольному заражению высокопатогенным штаммом-пробойником вируса КЧС Шимынь в дозе 5×105 ЛД50, в объеме 5 мл, причем 2,5 мл вводятся внутримышечно, а другие 2,5 мл интраназально.
После контрольного заражения проводится мониторинг состояния животных по следующим показателям: вес, температура тела, выявление вируса КЧС в крови и в назальных смывах методом ПЦР, выявление антител к вирусу КЧС в сыворотках крови, на момент окончания эксперимента и убоя животных - выявление антигена вируса КЧС в органах и тканях, а также определение титра вируснейтрализующих антител. Опыт завершается через 21 день после контрольного заражения. В группе вакцинированных животных допускается проявление клинических признаков инфекции, однако продолжительность подъема температуры тела не должна превышать 6 дней, на момент окончания опыта все животные в этой группе должны набирать вес, падеж животных, связанный с инфекцией КЧС не допускается. Титр вируснейтрализующих антител на момент контрольного заражения у вакцинированных животных должен быть не менее 1:32. В группе невакцинированных животных потеря веса наблюдается до завершения эксперимента, к 21 дню после заражения пасть должно не менее половины животных в группе, у всех животных вирус КЧС, по крайней мере, часть времени должен детектироваться в крови и/или назальных смывах. Животные контрольной группы должны равномерно набирать вес в течение эксперимента, подъем температуры или выявление РНК вируса КЧС методом ПЦР у животных этой группы не допускается. В случае появления клинических признаков КЧС у животных контрольной группы с выявлением нуклеиновой кислоты или антигена вируса КЧС опыт считается недействительным и подлежит повторению.

Таким образом, приведенная выше информация свидетельствует о выполнении при использовании предлагаемого изобретения следующей совокупности условий:
Вакцина субъединичная маркированная против классической чумы свиней, воплощающая предлагаемое изобретение, предназначена для использования в сельском хозяйстве, а именно в ветеринарной медицине и биотехнологии;
Для предлагаемого изобретения в том виде, как оно охарактеризовано в независимом пункте формулы изобретения, подтверждена возможность его осуществления с помощью описанных в заявке или известных до даты приоритета средств и методов;
Вакцина субъединичная маркированная против классической чумы свиней, изготовленная из штамма-продуцента рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22, с которого осуществляется наработка рекомбинантных белков Е2 вируса КЧС первого и второго генотипов в соответствии с предлагаемым изобретением, обладает высокой антигенной активностью и является безвредной. Следовательно, предлагаемое изобретение соответствует условию патентоспособности "промышленная применимость".
Пример 9. Определение защитной дозы вакцины
Рекомендованная доза вакцины в объеме 2 мл содержит 60 мкг рекомбинантного белка Е2 вируса КЧС. Для определения защитной дозы вакцины провели опыт, в котором животных вакцинировали последовательными двукратными разведениями рекомбинантного белка Е2 в одной иммунизирующей дозе вакцины: 60 мкг, 30 мкг, 15 мкг, 0 мкг, соответственно.
Всего сформировали 4 группы поросят (n=7) 50-55-суточного возраста, подобранных по принципу аналогов. Каждая группа содержалась в своем боксе. По 5 голов в группе иммунизировали соответствующим экспериментальным образцом вакцины, содержащим 60 мкг, 30 мкг, 15 мкг, 0 мкг, рекомбинантного белка Е2 в одной дозе, внутримышечно двукратно с интервалом 21 сутки.
Через 14 суток после второй вакцинации всех вакцинированных животных заразили вирулентным штаммом «Шимынь» вируса КЧС в дозе 10 ЛД50. При этом по два невакцинированных животных остались в тех же группах, но заражению не подвергались (контактные животные).
Продолжительность эксперимента после заражения составила 21 сутки. У всех животных, включая контактных:
- брали кровь до, после первой и второй вакцинаций, а также на 4, 8, 12, 16 и 21 сутки после заражения (у всех выживших особей), образцы сыворотки крови исследовали на наличие антител к белкам Е2 и ERNS вируса КЧС в ИФА и в РН, а также на наличие РНК вируса КЧС;
- проводили ежедневную термометрию, начиная со дня заражения и до конца эксперимента;
- вели наблюдение за общим клиническим состоянием животных после заражения и до конца эксперимента.
Иммуногенную активность (эффективность) экспериментальных образцов вакцины оценивали по проценту выживаемости (сохранности) вакцинированных поросят после экспериментального заражения, наличию и продолжительности клинических признаков болезни, включающих показатели температуры тела.
О приживляемости вирулентного вируса КЧС в организме животных судили по результатам ПЦР, в которой исследовали пробы сыворотки крови, полученные после заражения животных, а также исследовали пробы брыжеечных лимфоузлов и селезенки. Кроме того, отслеживали состояние (клинические признаки, температуру тела, наличие вируса в сыворотки крови и лимфоидных органах) у контактных поросят в каждой группе.
В результате проведенных исследований было установлено, что вакцинация животных (независимо от количества рекомбинантного белка Е2 вируса КЧС в прививной дозе) не предохраняла животных от переболевания классической чумой свиней (при этом заболевание проходило в более легкой форме), о чем свидетельствовали гипертермия, общее угнетение, отказ от корма.
Дальнейшее течение инфекционного процесса заканчивалось выздоровлением или гибелью поросят, сопровождающееся в большинстве случаев нормализацией температуры тела. Так, все вакцинированные животные в группе №4 (0 мкг) и контактные поросята в этой группе пали к концу срока наблюдения. Посмертное обследование павших животных выявило специфические патоморфологические изменения в органах и тканях (селезенка, лимфоузлы и др.), характерные для КЧС.
Результаты выживаемости поросят после заражения вирулентным штаммом вируса КЧС представлены в таблице 12.
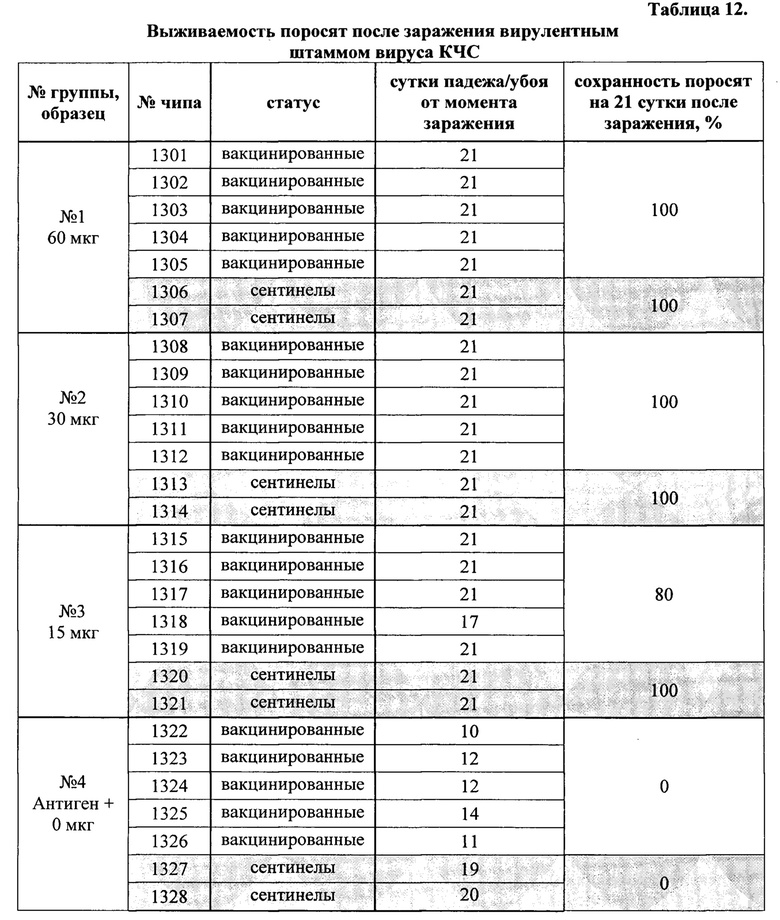
В группах поросят, иммунизированных образцами вакцины, содержащими 60 и 30 мкг белка Е2, была зафиксирована 100% сохранность, как среди вакцинированных животных, так и среди контактных поросят. В группе животных, которые получили дозу вакцины 15 мкг белка Е2, сохранность составила 80% и 100% среди вакцинированных и контактных животных, соответственно. При этом, все поросята в группе №4, которые при вакцинации не получили рекомбинантного белка, погибли к концу второй недели после заражения; кроме того контактные животные, находившиеся в этой группе, также заразились (за счет горизонтальной передачи вируса от зараженных животных) и погибли до конца эксперимента.
Пример 10. Изучение продолжительности поствакцинального иммунитета. Для проведения данного исследования использовали две группы поросят 40-45-суточного возраста: опытную (n=12) и контрольную (n=5), сформированную по принципу аналогов. Животных опытной группы иммунизировали препаратом двукратно с интервалом 21 сутки внутримышечно в дозе 2 мл. Через 8 месяцев после второй вакцинации всех свиней заразили вирулентным штаммом «Шимынь» вируса КЧС, в дозе 10 ЛД50.
Продолжительность эксперимента после заражения составила 21 сутки. При этом у всех животных:
- брали кровь до, через 21 сутки после первой и 14 суток после второй вакцинаций, а также перед заражением, образцы сыворотки крови исследовали на наличие антител к белкам Е2 и ERNS вируса КЧС в ИФА, а также на наличие вируснейтрализующих антител в РН.
- проводили ежедневную термометрию, начиная со дня заражения и до конца эксперимента;
- вели наблюдение за общим клиническим состоянием животных после заражения и до конца эксперимента.
Иммуногенную активность (эффективность) вакцины оценивали по проценту выживаемости (сохранности) вакцинированных поросят после экспериментального заражения, наличию и продолжительности клинических признаков болезни, включающих показатели температуры тела.
В результате проведенных исследований было установлено, что вакцинация не предохраняла животных от переболевания классической чумой свиней (при этом заболевание проходило в более легкой форме), о чем свидетельствовали гипертермия, общее угнетение, отказ от корма. Дальнейшее течение инфекционного процесса заканчивалось выздоровлением или гибелью поросят, сопровождающееся в большинстве случаев нормализацией температуры тела.
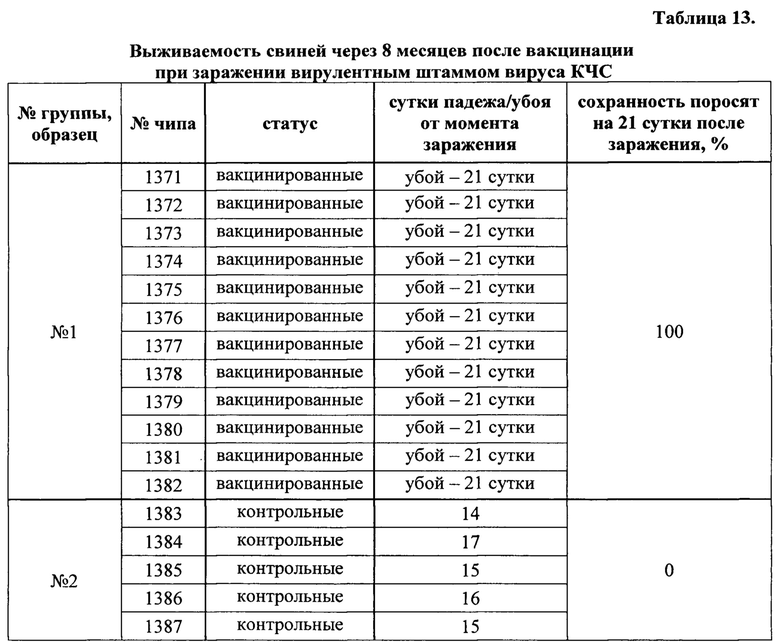
Таким образом, в группе вакцинированных свиней при заражении вирулентным штаммом вируса КЧС через 8 месяцев после второй вакцинации была зафиксирована 100% сохранность в течение 21 суток после заражения, при том, что в контрольной группе погибли все животные.
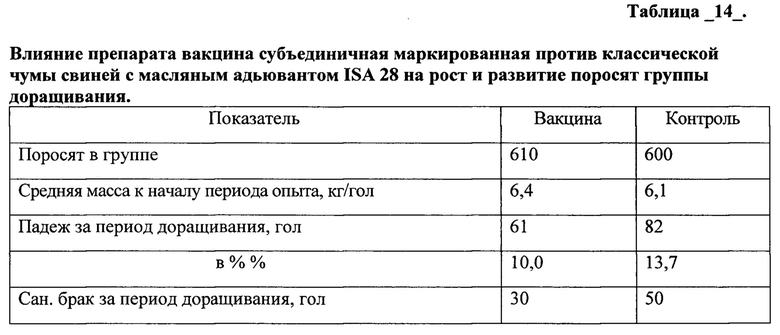

Аналогичные результаты были получены с использованием вакцины, содержащей полимерный адъювант.
Таким образом, заявляемая субъединичная маркированная вакцина против классической чумы свиней характеризуется следующей совокупностью существенных признаков:
1. антигенный материал вакцины представлен рекомбинантными поверхностными гликопротеинами Е2 вируса КЧС из штаммов Шимынь (генотип 1) и Альфорт-Тюбинген (генотип 2);
2. последовательности, кодирующие фрагменты генов Е2, получены синтетическим путем с оптимизацией кодонов, предварены секреторным сигнальным пептидом мелиттина (MKFLVNVALVFMVVYISYIYA), несут 14 аминокислотных остатков гистидина на С-конце;
3. последовательности, кодирующие фрагменты генов Е2, несут индивидуальные маркерные антигенные эпитопы НА и MYC, выявляемые с помощью коммерчески-доступных антител;
4. наработка рекомбинантных белков Е2 КЧС осуществляется в культуре клеток Sf-9, зараженной рекомбинантным бакуловирусом ядерного полиэдроза Autographa californica ШАТ-22;
5. модифицированные рекомбинантные белки Е2 из штаммов КЧС Шимынь и Альфорт-Тюбинген введены в состав вакцины с эффективным титром 60 мкг в дозе, обеспечивающим защиту поголовья от заражения высоко патогенным вирусом КЧС Шимынь в дозе 5×105 ТКИД50/мл.
Список литературы:
1. OIE - Terrestrial Animal Health Code, chapter 15.2: Classical Swine Fever. (2021).
2. OIE - Terrestrial Manual, Chapter 3.9.3.: Classical swine fever (infection with classical swine fever virus) (version adopted in May 2019)
3. Fuchs F. 1968. Schweinepest. In H Rohrer, ed. Handbuch der virusinfektionen bei Tieren, Vol. 3, Jena, Germany: Gustav Fischer Verlag.
4. Wise G. 1981. Hog cholera and its eradication. A review of the U.S. experience. APHIS, USDA, APHIS, pp. 91-55.
5. Edwards S. (2000). Survival and inactivation of classical swine fever virus. Veterinary microbiology, 73(2-3), 175-181. https://doi.org/10.1016/s0378-1135(00)00143-7
6. Fritzemeier, J., Teuffert, J., Greiser-Wilke, I., Staubach, C, Schluter, H., & Moennig, V. (2000). Epidemiology of classical swine fever in Germany in the 1990s. Veterinary microbiology, 77(1-2), 29-41. https://doi.org/10.1016/s0378-1135(00)00254-6
7. Ribbens, S., Dewulf, J., Koenen, F., Laevens, H., & de Kruif, A. (2004). Transmission of classical swine fever. A review. The veterinary quarterly, 26(4), 146-155. https://doi.org/10.1080/01652176.2004.9695177
8. Elbers, A. R., Stegeman, J. A., & de Jong, M. C. (2001). Factors associated with the introduction of classical swine fever virus into pig herds in the central area of the 1997/98 epidemic in The Netherlands. The Veterinary record, 149(13), 377-382. https://doi.org/10.1136/vr.149.13.377
9. Paton, D. J., & Greiser-Wilke, I. (2003). Classical swine fever-an update. Research in veterinary science, 75(3), 169-178. https://doi.org/10.1016/s0034-5288(03)00076-6
10. Kirkland P.D., Le Potier M.-F., Vannier P., Finlaison D. Pestiviruses. In: Diseases of swine, J.J. Zimmerman, L.A. Karriker, A. Ramirez, K.J. Schwartz, G.W. Stevenson (editors.). Wiley-Blackwell, 2012: 538-553.
11. Susa, M.,  Saalmuller, A., Reddehase, M. J., & Thiel, H. J. (1992). Pathogenesis of classical swine fever: B-lymphocyte deficiency caused by hog cholera virus. Journal of virology, 66(2), 1171-1175. https://doi.org/10.1128/JVI.66.2.1171-1175.1992
Saalmuller, A., Reddehase, M. J., & Thiel, H. J. (1992). Pathogenesis of classical swine fever: B-lymphocyte deficiency caused by hog cholera virus. Journal of virology, 66(2), 1171-1175. https://doi.org/10.1128/JVI.66.2.1171-1175.1992
12. Floegel-Niesmann, G., Blome, S., Gerss-Dulmer, H., Bunzenthal, C, & Moennig, V. (2009). Virulence of classical swine fever virus isolates from Europe and other areas during 1996 until 2007. Veterinary microbiology, 139(1-2), 165-169. https://doi.org/10.1016/j.vetmic.2009.05.008
13. Moennig, V., Floegel-Niesmann, G., & Greiser-Wilke, I. (2003). Clinical signs and epidemiology of classical swine fever: a review of new knowledge. Veterinary journal (London, England: 1997), 165(1), 11-20. https://doi.org/10.1016/s1090-0233(02)00112-0
14. Cariolet R, Bougeard S, Rault J-C, et al. 2008. Importance des observations cliniques et necroscopiques dans la detection precoce d'un cas de peste porcine classique. Journees de la Recherche Porcine 40:45-48.
15. Durand, В., Davila, S., Cariolet, R., Mesplede, A., & Le Potier, M. F. (2009). Comparison of viraemia- and clinical-based estimates of within- and between-pen transmission of classical swine fever virus from three transmission experiments. Veterinary microbiology, 135(3-4), 196-204. https://doi.org/10.1016/j.vetmic.2008.09.056
16. Сергеев В.А., Орлянкин Б.Г., Алексеев К.П,. Забережный А.Д., Алипер Т.И., Непоклонов Е.А.. Вакцины и стратегия вакцинации против классической чумы свиней. Ветеринария, 2018, 4: 3-11.
17. Не, С.Q., Ding, N. Z., Chen, J. G., & Li, Y. L. (2007). Evidence of natural recombination in classical swine fever virus. Virus research, 126(1-2), 179-185. https://doi.org/10.1016/j.virusres.2007.02.019
18. Beer, M., Reimann, I., Hoffmann, В., & Depner, K. (2007). Novel marker vaccines against classical swine fever. Vaccine, 25(30), 5665-5670. https://doi.org/10.1016/j.vaccine.2006.12.036
19. Blome, S., Moβ, C, Reimann, I., Konig, P., & Beer, M. (2017). Classical swine fever vaccines-State-of-the-art. Veterinary microbiology, 206, 10-20. https://doi.org/10.1016/j.vetmic.2017.01.001
20. Huang, Y. L., Deng, M. C, Wang, F. I., Huang, С.C, & Chang, C. Y. (2014). The challenges of classical swine fever control: modified live and E2 subunit vaccines. Virus research, 179, 1-11. https://doi.org/10.1016/j.virusres.2013.10.025
21. Blome, S., Grotha, I., Moennig, V., & Greiser-Wilke, I. (2010). Classical swine fever virus in South-Eastern Europe-retrospective analysis of the disease situation and molecular epidemiology. Veterinary microbiology, 146(3-4), 276-284. https://doi.org/10.1016/j.vetmic.2010.05.035
22. Vlasova, A., Grebennikova, Т., Zaberezhny, A., Greiser-Wilke, I., Floegel-Niesmann, G., Kurinnov, V., Aliper, Т., & Nepoklonov, E. (2003). Molecular epidemiology of classical swine fever in the Russian Federation. Journal of veterinary medicine. B, Infectious diseases and veterinary public health, 50(8), 363-367. https://doi.org/10.1046/j.1439-0450.2003.00695.x
23. Bouma, A., de Smit, A. J., de Kluijver, E. P., Terpstra, C, & Moormann, R. J. (1999). Efficacy and stability of a subunit vaccine based on glycoprotein E2 of classical swine fever virus. Veterinary microbiology, 66(2), 101-114. https://doi.org/10.1016/s0378-1135(99)00003-6
24. Кривонос A.B., Забережный А.Д., Гребенникова T.B., Мусиенко М.И., Габадулин Р.А., Цибезов В.В., Богданова B.C., Кальнов С.Л., Алипер Т.И. и Непоклонов Е.А.. Синтез и иммунохимические свойства рекомбинантного главного поверхностного гликопротеина Е2 вируса классической чумы свиней. Вопросы вирусологии, 2000, 45(2): 29-35.
25. Цибезов В.В., Богданова B.C., Забережный А.Д., Гребенникова Т.В., Кривонос А.В., Дудников Л.А., Кальнов С.Л., Алипер Т.И., Непоклонов Е.А. Синтез и иммунохимические свойства рекомбинантного основного поверхностного гликопротеина Е2 классического вируса чумы свиней. Вопросы вирусологии, 2000, 45(2): 36-43.
26. Алексеев К.П., Раев С.А., Южаков А.Г., Шемельков Е.В., Латышев О.Е., Елисеева О.В., Костина Л.В., Цибезов В.В., Стаффорд В.В., Кунаков К.Ю., Верховский О.А., Забережный А.Д., Алипер Т.И. Разработка и испытание образцов рекомбинантной маркированной вакцины против классической чумы свиней. (2019), Сельскохозяйственная биология, 54(6): 1236-1246.
27. Шемельков Е.В., Верховский О.А., Алипер Т.И., Кунаков К.Ю., Алексеев К.П. Доклинические исследования субъединичной маркированной вакцины против КЧС по показателям безвредности, антигенной активности и иммуногенности. (2022), Сельскохозяйственная биология, 2: 29-33.
28. Tessier, D. С, Thomas, D. Y., Khouri, Н. Е., Laliberte, F., & Vernet, Т. (1991). Enhanced secretion from insect cells of a foreign protein fused to the honeybee melittin signal peptide. Gene, 98(2), 177-183. https://doi.org/10.1016/0378-1119(91)90171-7
Группа изобретений относится к ветеринарной вирусологии и биотехнологии и может быть использована при изготовлении средства для специфической профилактики классической чумы свиней. Предложена вакцина субъединичная маркированная против классической чумы свиней. Вакцина содержит в своем составе следующие компоненты из расчета на 1 мл препарата: антигенный материал в количестве 30 мкг с содержанием рекомбинантных белков Е2 вируса классической чумы свиней генотипов 1 и 2, где генотип 1 включает фрагмент гена Е2 штамма Шимынь, а генотип 2 включает фрагмент гена Е2 штамма Альфорт-Тюбинген, в качестве фармацевтически приемлемых целевых добавок содержит один из следующих адъювантов: карбомер 971р в количестве 2% от объема препарата, или масляный адъювант Монтанид ISA 28 в количестве 15% от объема препаратав. Предложен штамм рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22, используемый для получения вакцины; способ получения вакцины, включающий культивирование штамма рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22, инактивацию культуральной жидкости, определение полноты инактивации производственного штамма, составление серии вакцины, контроль стерильности и безвредности вакцины, определение иммуногенной и антигенной активности вакцины. Предложен способ применения вакцины, согласно которому вакцину вводят внутримышечно в область верхней трети шеи, за ухом по одной из схем: поросятам в возрасте 40-45 дней по 2,0 мл двукратно с интервалом в 21 сутки; ремонтным свинкам и свиноматкам - двукратно, в дозе 2,0 мл с интервалом 21 сутки, с таким расчетом, чтобы повторная вакцинация приходилась за 14-21 сутки до осеменения, с последующей ревакцинацией также двукратно перед каждым осеменением; хрякам-производителям 2 раза в год в дозе 2,0 мл двукратно с интервалом 20-30 суток. Вакцина индуцирует образование антител с титром вируснейтрализующих антител к вирусу КЧС не менее 1:32, что позволяет уменьшить риск передачи патогенного вируса КЧС и существенно снизить или исключить заболеваемость свиней. Вакцина обладает более высокой эффективностью и удобством в производстве, увеличенным выходом антигена. 4 н. и 6 з.п. ф-лы, 14 табл., 10 пр.
1. Вакцина субъединичная маркированная против классической чумы свиней, содержащая в своем составе следующие компоненты из расчета на 1 мл препарата: антигенный материал в количестве 30 мкг с содержанием рекомбинантных белков Е2 вируса классической чумы свиней генотипов 1 и 2, где генотип 1 включает фрагмент гена Е2 штамма Шимынь, а генотип 2 включает фрагмент гена Е2 штамма Альфорт-Тюбинген, отличающаяся тем, что в качестве фармацевтически приемлемых целевых добавок содержит один из следующих адъювантов: карбомер 971р в количестве 2% от объема препарата, или масляный адъювант Монтанид ISA 28 в количестве 15% от объема препарата.
2. Вакцина по п. 1, отличающаяся тем, что в качестве фармацевтически приемлемых целевых добавок используют консервант в виде водного раствора мертиолята натрия 10%, вводимого в препарат из расчета 1:40000, а именно 1 часть раствора мертиолята натрия к 40000 частям препарата: на 100 литров готового препарата добавляется 0,0025 л раствора мертиолята натрия.
3. Вакцина по п. 1, отличающаяся тем, что в качестве фармацевтически приемлемых целевых добавок используют разбавитель в виде стерильного раствора фосфатно-солевого буфера по Дюльбекко в количестве, необходимом для получения 100% объема препарата.
4. Вакцина по п. 3, отличающаяся тем, что одновременно со стерильным раствором фосфатно-солевого буфера по Дюльбекко в качестве разбавителя используют раствор D-глюкозы 50% в количестве, необходимом для получения 100% объема препарата.
5. Вакцина по п. 1, отличающаяся тем, что при использовании в качестве адъюванта карбомер 971р дополнительно используют 10% гидроокись натрия для установления оптимального уровня рН 7,0-7,6.
6.. Штамм рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22, депонированный в Государственной коллекции вирусов ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» МЗ РФ под регистрационным номером ГКВ 2983, используемый для получения вакцины по п. 1.
7. Способ получения вакцины по п. 1, включающий культивирование производственного штамма, инактивацию культуральной жидкости, определение полноты инактивации производственного штамма, составление серии вакцины, контроль стерильности и безвредности вакцины, определение иммуногенной и антигенной активности вакцины, отличающийся тем, что в качестве производственного штамма используется штамм рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22, депонированный в Государственной коллекции вирусов ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» под регистрационным номером ГКВ 2983.
8. Способ по п. 7, отличающийся тем, что наработка рекомбинантных белков Е2 осуществляется в культуре клеток Sf-9, зараженной штаммом рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22.
9. Способ по п. 7, отличающийся тем, что в качестве инактиванта производственного штамма рекомбинантного бакуловируса ядерного полиэдроза Autographa californica ШАТ-22 используют бинарный этиленимин в концентрации 10 мМ, обработку которым проводят в течение 52 часов при 37°С.
10. Способ применения вакцины по п. 1, отличающийся тем, что вакцину вводят внутримышечно в область верхней трети шеи, за ухом по одной из схем:
- поросятам в возрасте 40-45 дней по 2,0 мл двукратно с интервалом в 21 сутки;
- ремонтным свинкам и свиноматкам - двукратно, в дозе 2,0 мл с интервалом 21 сутки, с таким расчетом, чтобы повторная вакцинация приходилась за 14-21 сутки до осеменения, с последующей ревакцинацией также двукратно перед каждым осеменением;
- хрякам-производителям 2 раза в год в дозе 2,0 мл двукратно с интервалом 20-30 суток.
| К.П | |||
| АЛЕКСЕЕВ и др., РАЗРАБОТКА И ИСПЫТАНИЕ ОБРАЗЦОВ РЕКОМБИНАНТНОЙ СУБЪЕДИНИЧНОЙ ВАКЦИНЫ ПРОТИВ КЛАССИЧЕСКОЙ ЧУМЫ СВИНЕЙ, СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОЛОГИЯ, 2019, том 54, N 6, с | |||
| Приспособление для ориентации машиниста в пути и подачи свистков | 1922 |
|
SU1236A1 |
| ШТАММ SWINE FEVER VIRUS ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ КЛАССИЧЕСКОЙ ЧУМЫ СВИНЕЙ | 1994 |
|
RU2057805C1 |
| ХИМЕРНЫЕ ВАКЦИННЫЕ АНТИГЕНЫ ПРОТИВ ВИРУСА КЛАССИЧЕСКОЙ ЧУМЫ СВИНЕЙ | 2007 |
|
RU2406534C2 |
| EP 3854417 A1, 28.07.2021 | |||
| CN 101736017 A, 16.06.2010 | |||
| CN 106755087, B, 26.02.2019. | |||
Авторы
Даты
2023-12-01—Публикация
2023-03-13—Подача