Область техники
Настоящее изобретение относится к области биотехнологии, а именно к дезамидированному коллагеновому биоматриксу, а также к способу получения данного дезамидированного коллагенового биоматрикса.
Предпосылки изобретения
Коллаген, являющийся основным волокнистым белком внеклеточного матрикса соединительной ткани животных, на сегодняшний день получил широчайшее распространение в качестве биоматериала для использования в различных областях медицины, в частности в хирургии, стоматологии и косметологии. Популярность данного биоматериала обусловлена в первую очередь его промышленной доступностью, высокой биосовместимостью, полной биодеградируемостью, чрезвычайно низкой, по сравнению с другими белками, межвидовой вариабельностью, наличием ряда боковых функциональных групп, позволяющих путем химической модификации видоизменять и улучшать его физико-химические свойства (Parenteau-Bareil R., Gauvin R., Berthod F. Collagen-based biomaterials for tissue engineering applications. Materials .2010, v.3, pp. 1863-1887; Muthukumar T., Sreekumar G., Sastry T.P., Chamundeeswari M. Collagen as a potential biomaterial in biomedical applications. Rev. Adv. Mater. Sci. 2018, v. 53, pp. 29-39).
Одной из разновидностей биоматериалов на основе химически модифицированного коллагена является так называемый «дезамидированный коллаген», представляющий собой белок коллаген, как правило I типа, боковые группы остатков аспарагина и глутамина которого подвергнуты гидролизу в результате обработки водными растворами щелочи с превращением их в остатки аспарагиновой и глутаминовой кислот, соответственно. Данная модификация белка приводит к увеличению числа свободных карбоксильных групп на его молекулах, что, как следствие, сопровождается понижением изоэлектрической точки, увеличением набухаемости, снижением подвижности альфа-цепей коллагена при анализе методом денатурирующего электрофореза в полиакриламидном геле, снижением термоустойчивости и ферментативной устойчивости (Radhika M., Sehgal P.K. Studies on the desamidation of bovine collagen. J. Biomed. Mater. Res. 1997, v. 35, № 4, pp. 497-503).
Физико-химические свойства дезамидированного коллагена обуславливают перспективность его использования в качестве компонента абсорбирующих и кровоостанавливающих раневых покрытий, инъекционных имплантатов, восстанавливающих тургор и увлажненность кожи, различных систем доставки положительно заряженных фармацевтических субстанций (например, антибиотиков), а также при разработке химически-модифицированных или сшитых по карбоксильным группам биосовместимых материалов на основе коллагена. Безусловным преимуществом дезамидированного коллагена, как биоматериала, является его биологическая безопасность по отношению к прионным инфекционным агентам, что связано с тем, что концентрации щелочи в растворах, применяемых для дезамидирования, обеспечивают, согласно обширным данным литературы, полную инактивацию данных патогенов (Sakudo A., Ano Y., Onodera T., Nitta K., Shintani H., Ikuta K., Tanaka Y. Fundamentals of prions and their inactivation (review). Int. J. Mol. Med. 2011, v. 27, № 34, pp. 483-489).
Из уровня техники известны методики получения дезамидированного коллагена из соединительных тканей животных.
Так, описан метод получения дезамидированого коллагена из тонких соединительнотканных мембран – серозных оболочек, а также соединительно тканных тяжей – сухожилий. Описываемый авторами метод включает обработку бычьего перикарда, подслизистой оболочки кишечника и сухожилий щелочным раствором, содержащим 6% диметилсульфоксида, соли (хлориды и сульфаты) и основания щелочных и щелочноземельных металлов. Соотношение раствора и обрабатываемых тканей при этом составляет 3 мл на г. Продолжительность обработки – до 144 часов. Обработанный щелочным раствором материал уравновешивают раствором, содержащим сульфат натрия, хлорид натрия, хлорид калия и сульфат кальция с последующей трехкратной отмывкой 3% раствором борной кислоты, деионизованной водой, 0,3% раствором ЭДТА и заключительной промывкой деионизованной водой (Bet M.R., Goissis G., Lacerda C.A. Characterization of polyanionic collagen prepared by selective hydrolysis of asparagine and glutamine carboxyamide side chains. Biomacromolecules. 2001, v. 2, № 4, pp. 1074-1079). Дезамидированный коллаген при данном способе получения выделяется в виде тонких листов (<1 мм), сравнимых по толщине с исходными обрабатываемыми серозными оболочками или же измельченных тяжей при использовании сухожилий в качестве сырья.
В другом, описанном в литературе методе получения дезамидированного коллагена, в качестве исходного биологического сырья используются обрезки шкур или ахилловы сухожилия крупного рогатого скота, консервированные при помощи соли. Метод включает промывку сырья водой, неионным смачивающим агентом с последующим золением 10% водным раствором гидроксида кальция в течение 48 часов с последующим механическим удалением волос при помощи ножа. После этого проводится обеззоливание сульфатом аммония до достижения pH дермы значения 8,5, и последующее измельчение материала сначала ножом, а затем – гомогенизатором. Для проведения дезамидирования измельченный материал обрабатывают раствором сульфата натрия-гидроксида натрия (массо-объемная концентрация 50%) и дистиллированной водой в соотношении 125г:55мл:1000мл, соответственно, в течение 7 суток в холодильнике (8°C). По завершении данной стадии набухший материал гомомогенизируют и доводят значение pH полученной пасты водным раствором соляной кислоты до 2,8, а затем диализуют полученный преципитат против дистиллированной воды (Radhika M., Sehgal P.K. Studies on the desamidation of bovine collagen. J. Biomed. Mater. Res. 1997, v. 35, № 4, pp. 497-503). Дезамидированный коллаген при данном способе получения выделяется в виде преципитированной белковой массы.
Еще один опубликованный метод описывает получение дезамидированного коллагена из шкур крупного рогатого скота, не характеризуя предварительную подготовку биологического сырья. Данный способ включает обработку сырья водным раствором, содержащим 3% гидроксида натрия и 1,9% монометиламина при 20°C в течение 2-х недель. После этого дезамидированный коллаген преципитируют диализом против 50 мМ Tris-HCl буфера (pH 7,4). Полученный преципитат растворяют в 5 mM уксусной кислоте (Hattori S., Adachi E., Ebihara T., Shirai T., Someki I., Irie S. Alkali-treated collagen retained the triple helical conformation and the ligand activity for the cell adhesion via alpha2beta1 integrin. J. Biochem. 1999, v. 125, № 4, p. 676-684). Дезамидированный коллаген при данном способе получения также выделяется в виде преципитированной белковой массы.
С точки зрения биоматериаловедения, описанные в литературе методы получения дезамидированного коллагена имеют существенный недостаток, поскольку позволяют получать белок в формах с ограниченной способностью к изготовлению различных пространственных конструкций – биоматриксов (матриц, скэффолдов), применяемых в том числе в качестве биоматериалов для тканевой инженерии и производства медицинских изделий.
Это, главным образом, связано с тем, что, коллаген, подвергнутый дезамидированию, утрачивает способность к полимеризации при нейтрализации его растворов в слабых органических кислотах (Bet M.R., Goissis G., Lacerda C.A. Characterization of polyanionic collagen prepared by selective hydrolysis of asparagine and glutamine carboxyamide side chains. Biomacromolecules. 2001, v. 2, № 4, pp. 1074-1079). В то же время, полимеризация коллагена (не подвергнутого дезамидированию) из кислотных растворов, как правило с последующим лиофильным высушиванием, является наиболее распространенным подходом к формированию различных форм биоматериалов и компонентов медицинских изделий на основе данного белка (например, губок, мембран, пленок, микрочастиц, покрытий коронарных стентов, и пр.), служащих в качестве биоматриксов. Используя возгонку кислотных растворов дезамидированного коллагена также возможно изготовить указанные биоматриксы в сухом виде. Однако, при контакте с жидкостью, такой коллагеновый материал будет подвергаться быстрому набуханию и разрушению макро- и микроструктуры матрикса, что является следствием отсутствия пространственно организованных коллагеновых микрофибрилл в его составе. В связи с вышеизложенным, при работе с препаратами дезамидированного коллагена необходимо применение иных технологических подходов к изготовлению биоматриксов. Проблема изготовления биоматриксов в форме тонких мембран при этом, очевидно, может быть решена применением первого из описанного в литературе методов получения дезамидированного коллагена (Bet M.R., Goissis G., Lacerda C.A. Characterization of polyanionic collagen prepared by selective hydrolysis of asparagine and glutamine carboxyamide side chains. Biomacromolecules. 2001, v. 2, № 4, pp. 1074-1079) в случае использования различных серозных оболочек в качестве исходного сырья. После проведения процесса дезамидирования коллаген в данном случае, сохраняет свою пространственную укладку и гидролитическую стабильность, что позволяет использовать получаемые тонкие листы из серозных оболочек в качестве резорбируемого материала (например, барьерных мембран в стоматологии). Тем не менее применение данного метода значительно ограничено как промышленной доступностью достаточного количества стандартизованных серозных оболочек, так и тем, что он не позволяет получать барьерные и абсорбирующие материалы в виде листов, толщиной, превышающей толщину обрабатываемых тканей (> 1 мм).
В то же время, существует потребность в изготовлении более объемных биоматриксов, имеющих большую толщину. Такие матриксы востребованы, например, для изготовления абсорбирующих раневых покрытий, гемостатических материалов, объемных скэффолдов для трансплантации клеток в мягкие ткани. Изготовить такие материалы из дезамидированных матриксов серозных оболочек или же из переципитированного из кислотного раствора дезамидированного коллагена не представляется возможным. Также биоматриксы большой толщины более предпочтительно использовать в качестве сырья для изготовления волокнистых мелкодисперсных материалов с применением методов ударно-истирающего помола, как, например, в патенте РФ 2735176. Это связано с тем, что по данным наших собственных исследований, использование в качестве сырья для помола биоматриксов большей толщины приводит к увеличению доли волокнистых микрочастиц в получаемом мелкодисперсном материале.
Логичным решением обозначенной проблемы ограниченной толщины получаемых биоматриксов на основе дезамидированного коллагена могло бы являться применение в качестве исходного сырья, подвергаемого дезамидированию, исходно более толстых листов волокнистых соединительных тканей, полученных из других органов. Наилучшим образом для этого подходят листы сетчатого слоя дермы кожи крупного рогатого скота, что обусловлено: 1) коммерческой доступностью данного сырья, 2) наибольшей толщиной, среди большинства видов сельскохозяйственных животных (несколько мм), 3) характерным гистологическим строением дермы, позволяющим легко отделять сетчатый слой от сосочкового и придатков кожи.
Из уровня техники известны подходы к получению биоматриксов на основе дермы кожи крупного рогатого скота с применением щелочных растворов, которые могли бы быть использованы для очистки волокнистого внеклеточного матрикса дермы, состоящего из коллагена, сопряженной одновременно с дезамидированием боковых групп аминокислотных остатков белка.
Так, в патенте РФ 2353397 описан способ получения биорассасываемой матрицы, состоящей из нативного не реконструированного коллагена I типа, включающий следующие стадии: обработку кожи животного, очищенной от волосяных луковиц и подкожно-жировой клетчатки, водой; обработку дермы животного водно-щелочным раствором, содержащим гидроксид натрия, калий дигидрофосфат и водный или безводный тетраборнокислый натрий, при температуре от 1 до 10°С; обработку дермы животного водным раствором сульфата натрия и гидроксида натрия; обработку дермы животного водным раствором сульфата натрия; обработку дермы животного водным раствором борной кислоты; причем обработку дермы животного на третьей, четвертой и пятой стадиях осуществляют при периодическом взбалтывании раствора и периодическом охлаждении до температуры от 1 до 10°С; и после каждой из стадий со второй по пятую осуществляют промывку дермы водой до достижения нейтрального значения рН промывных вод. Данный способ обеспечивает получение коллагеновой матрицы, состоящей из нативного не реконструированного коллагена I типа, которая имеет структуру коллагеновых волокон, идентичную природной коллагенсодержащей ткани. Поскольку данный способ включает обработку щелочными растворами, при использовании достаточных концентраций щелочей, он бы мог быть использован для изготовления биоматриксов на основе дезамидированного коллагена. Однако недостатком применения описанного выше способа является плохое проникновение щелочных растворов в толщу обрабатываемой ткани, что обуславливается высокой плотностью материала, а также быстрым набуханием («нажором») его поверхностных слоев при высоких значениях pH. В связи с указанными явлениями невозможно достигнуть высокого уровня дезамидирования боковых групп аминокислотных остатков коллагена, а также обеспечить воспроизводимость очистки биоматрикса от неколлагеновых белков и клеточных компонентов при использовании в качестве исходного сырья кожи (шкур) крупного рогатого скота в связи с их значительной толщиной. Еще одним недостатком данного способа является его недостаточная способность к удалению жира из обрабатываемой дермы кожи крупного рогатого скота. В связи с тем, что остаточный жир в составе биоматериалов может обладать высокой антигенностью, указанный способ не может в полной мере гарантировать биосовместимость получаемой коллагеновой матрицы.
В патенте РФ 2739565 также описан способ получения сшитого карбодиимидом устойчивого к ферментативной деградации коллагеназами коллагенового материала, включающий обработку исходного коллагенсодержащего сырья карбодиимидом, включающий стадию дезамидирования боковых групп остатков аспарагина и глутамина в составе альфа-цепей коллагена путем обработки исходного коллагенсодержащего сырья водным раствором гидроокиси лития, калия или натрия, в концентрации от 0,3 М до концентрации насыщенного раствора при температуре от 0 до 45°С в течение 8-168 часов, стадию отмывки полученного на предыдущей стадии дезамидированного коллагенового материала от водного раствора гидроокиси щелочного металла; и последующую стадию сшивания дезамидированного коллагенового материала карбодиимидом в водной, водно-органической или органической среде. Применительно к получению биоматрикса на основе дезамидированного коллагена может быть применена первая стадия данного способа. Однако использование такого подхода имеет существенные ограничения, заключающиеся в том, что указанное в примере осуществления данного способа содержание амидного азота в материале после обработки щелочным раствором, а именно 1,3 мг на г сухой массы материала, что соответствует дезамидированию 78,7% боковых групп аспарагина и глутамина, может быть, согласно нашим экспериментальным исследованиям, достигнуто только при обработке тонких листов внеклеточного матрикса сетчатого слоя дермы крупного рогатого скота, толщиной не более 1 мм. В связи с этим, при работе со шкурами крупного рогатого скота, необходимо после проведения обезволашивания, перед обработкой раствором гидроокиси лития, калия или натрия осуществлять продольную обрезку материала на листы толщиной ≤ 1 мм при помощи специализированной двоильной машины. Еще одним недостатком описанной технологической стадии является её ограниченная способность к очистке материала от гликозаминогликанов, что, по-видимому, обусловлено чрезмерным набуханием материала в щелочном растворе, препятствующем вымыванию частично гидролизованных неколлагеновых компонентов из матрикса. Таким образом данный способ может быть применим для изготовления биоматриксов на основе дезамидировнаного коллагена только в виде тонких пленок. Кроме того, он не может гарантировать полное отсутствие локальной токсичности и аллергизирующего действия получаемого материала вследствие возможных остаточных количеств гликозаминогликанов и связанных с ними веществ.
В связи с вышеизложенным в области биотехнологии и биоматериаловедения в настоящее время сохраняется необходимость создания биоматриксов на основе коллагена с высокой степенью дезамидирования боковых групп аминокислотных остатков в форме цельного волокнистого листа с толщиной, превышающей толщину серозных оболочек животных (>1 мм), чьи характеристики обеспечивали бы технологическое удобство получения из него различных материалов и компонентов медицинских изделий, а также биологическую безопасность и стабильность при хранении.
Техническая задача настоящего изобретения заключается в создании подобного продукта, обладающего высокими технологическими характеристиками и биологической безопасностью, пригодного для широкого спектра биотехнологического использования.
Краткое изложение сущности изобретения
Поставленная техническая задача решена получением дезамидированного коллагенового биоматрикса в форме цельного волокнистого листа дермы кожи крупного рогатого скота, характеризующегося содержанием амидного азота в количестве не более 1,3 мг на 1 г сухой массы, коллагена не менее 90% на сухую массу, эластина не более 6% на сухую массу, сульфатированных гликозаминогликанов не более 0,2 мкг/мг на сухой массы, жира не более 0,5 % на сухую массу, воды не менее 60% по массе, и имеющего толщину не менее 1 мм, а также разработкой способа получения указанного дезамидированного коллагенового биоматрикса, включающего:
а) отмоку шкур в растворе кальцинированной соды,
б) обработку шкур водным раствором, содержащим гидроксид кальция и сернистый натрий,
в) удаление слоя, содержащего остатки волосяных луковиц, мездрение, нарезку на листы, удаление остатков волосяных луковиц и мездры,
г) обработку листов водным раствором, содержащим каустическую соду и сернокислый натрий,
д) последовательную отмывку полученных дезамидированных листов от щелочи в растворе электролита, в растворе неорганической кислоты, в воде или буферном растворе с получением дезамидированного коллагенового матрикса в форме цельного волокнистого листа с содержанием амидного азота в количестве не более 1,3 мг на 1 г сухой массы, коллагена не менее 90 % на сухую массу, эластина не более 6% на сухую массу, сульфатированных гликозаминогликанов не более 0,2 мкг/мг на сухой массы, жира не более 0,5 % на сухую массу, воды не менее 60% по массе, который имеет толщину не менее 1 мм.
Предпочтительно, что перед отмокой шкур в растворе кальцинированной соды проводят их предварительную подготовку, включающую в себя удаление бахромистых участков по краям шкур и участков шкур, покрывающих конечности.
Предпочтительно, что предварительная подготовка шкуры животных перед отмокой в растворе кальцинированной соды включает дополнительно раскрой шкуры на участки прямоугольной формы – полы, воротковую и чепрачную части.
Предпочтительно, что водный раствор кальцинированной соды для отмоки шкур имеет значение pH в интервале 7-9.
Предпочтительно, что водный раствор кальцинированной соды для отмоки шкур содержит поверхностно-активные вещества.
Предпочтительно, что обработку шкур водным раствором, содержащим гидроксид кальция и сернистый натрий, проводят при периодическом перемешивании.
Предпочтительно, что после обработки водным раствором, содержащим гидроксид кальция и сернистый натрий, проводят мездрение и нарезку обработанных шкуры на листы квадратной или прямоугольной формы.
Предпочтительно, что листы, на которые нарезают обработанную шкуру после мездрения, характеризуются влажностью не менее 50%, толщиной не менее 2,5 мм, значением pH водных вытяжек 9-11.
Предпочтительно, что перед обработкой водным раствором каустической соды и сернокислого натрия листы шкур дополнительно обрабатывают водными буферными солевыми растворами, имеющими значение рН в диапазоне 8-9.
Предпочтительно, что обработку водным раствором каустической соды и сернокислого натрия проводят при периодическом перемешивании, периодической смене раствора и охлаждении до температуры 2-8°С.
Предпочтительно, что отмывку листов от щелочи на первом этапе проводят водным раствором сульфата натрия в концентрации 0,5-2,0 М наиболее предпочтительно 1,1-1,4 М в течение 8-32 часов при массовом соотношении раствора к обрабатываемому материалу не менее 1,0 : 1,0 при периодической смене растворов и периодическом перемешивании.
Предпочтительно, что отмывку листов от щелочи на втором этапе проводят водным раствором борной кислоты в концентрации от 0,6 М до концентрации насыщенного раствора при массовом соотношении раствора к обрабатываемому материалу не менее 1,0 : 1,0 при периодической смене растворов и перемешивании.
Предпочтительно, что отмывку листов от щелочи на заключительном этапе проводят 0,01М фосфатно-солевым буфером.
Предпочтительно, что полученные после отмывки от щелочи листы дезамидированного коллагенового биоматрикса замораживают с целью хранения.
Технический результат настоящего изобретения заключается в получении дезамидированного коллагенового биоматрикса в форме цельного волокнистого листа с высоким уровнем дезамидирования коллагена, имеющего сохраненную структуру молекул коллагена, устойчивого при дальнейшем использовании и хранении, имеющего достаточную толщину, механические и эргономические свойства, позволяющие использовать его для создания широкого спектра биомедицинских материалов и продуктов в первую очередь требующих при производстве применения листов биоматриксов с повышенными объемными значениями. Дезамидированный коллагеновый биоматрикс по изобретению характеризуется отсутствием цитотоксичности, локальной и системной токсичности, сенсибилизирующего действия за счет очистки материала от клеток и компонентов аморфного внеклеточного матрикса. Метод получения дезамидированного коллагенового биоматрикса по изобретению, включающий обработку щелочными растворами, обеспечивает его прионную безопасность. Полученный дезамидированный коллагеновый биоматрикс характеризуется высокой сорбционной способностью в сравнении с нативными коллагеновыми матриксами, стабилен при длительном хранении.
Термины и определения
Ниже приведены термины, которые могут использоваться при описании настоящего изобретения. Если не указано иное, все технические и специальные термины, использованные в описании, имеют общепринятое в данной области техники значение.
Термин «отмока» в контексте настоящего изобретения относится к процессу обработки шкуры животного в водных растворах для удаления механических и биологических загрязнений.
Термин «мездра» в контексте настоящего изобретения относится к слою шкуры (подкожной клетчатке, остаткам кожно-мышечной ткани), отделяемому от дермы при механической обработке.
Термин «мездрение» в контексте настоящего изобретения относится к процессу механической обработки шкуры животного с целью удаления внутренних слоев кожно-мышечной и жировой ткани.
Краткое описание рисунков
На Фиг. 1 показаны репрезентативные микрофотографии поперечных гистологических срезов дермы после обработки водными растворами с различной равной концентрацией гидроксида кальция и сернистого натрия в течение разного времени. Окрашивание гематоксилином и эозином.
На Фиг. 2 показан внешний вид листа дезамидированного коллагенового биоматрикса, полученного способом, описанным в настоящем изобретении.
На Фиг. 3 показаны репрезентативные микрофотографии поперечных гистологических срезов листов дезамидированного коллагенового биоматрикса, полученных из дермы, подвергнутой предварительной обработке водными растворами с различной равной концентрацией гидроксида кальция и сернистого натрия в течение разного времени. Окрашивание гематоксилином и эозином.
На Фиг. 4 показаны репрезентативные микрофотографии поперечных гистологических срезов листов дезамидированного коллагенового биоматрикса после экспериментального хранения при температуре −15°С в течение различного времени и последующей разморозки.
На Фиг. 5 показан внешний вид фрагмента лиофильно высушенного листа дезамидированного коллагенового биоматрикса, использованного для производства раневого покрытия.
На Фиг. 6 показан внешний вид стерильного раневого покрытия в первичной упаковке (двойной пакет для стерилизации), изготовленного из листа дезамидированного коллагенового биоматрикса.
На Фиг. 7 показаны участки новообразованной соединительной ткани в краевой зоне раневого дефекта на поперечных гистологических срезах центральной области ран, заживавших под фиксирующей повязкой (контроль) и под абсорбирующим раневым покрытием на основе дезамидированного коллагенового биоматрикса (биоматрикс). Окрашивание гематоксилином и эозином.
На Фиг. 8 показаны поперечные гистологические срезы центральной области ран, заживавших под фиксирующей повязкой (контроль) и под абсорбирующим раневым покрытием на основе дезамидированного коллагенового биоматрикса (биоматрикс). Пунктирными линиями выделены области, занимаемые грануляционной тканью. Окрашивание гематоксилином и эозином.
На Фиг. 9 показаны результаты морфометрического анализа площади грануляционной ткани на поперечных гистологических срезах ран, заживавших под фиксирующей повязкой (контроль) и под абсорбирующим раневым покрытием на основе дезамидированного коллагенового биоматрикса (биоматрикс). Данные представлены в виде среднего арифметического значения ± стандартное отклонение. Звездочкой отмечено значение, статистически достоверно, отличающееся от контрольной группы (p < 0,05).
На Фиг. 10 показан внешний вид мелкодисперсного материала, полученного из листов дезамидированного коллагенового биоматрикса.
На Фиг. 11 показан внешний вид стерильного мелкодисперсного инъекционного материала в первичной упаковке (укупоренный флакон), изготовленного из листа дезамидированного коллагенового биоматрикса.
На Фиг. 12 показаны результаты измерения доли волокнистых микрочастиц в мелкодисперсных материалах полученных из дезамидированных коллагеновых биоматриксов различной толщины.
Подробное описание изобретения
В качестве исходного сырья для изготовления дезамидированного коллагенового биоматрикса, может быть использована кожа крупного рогатого скота в виде шкур, снятых после убоя животных. Для проведения химической обработки могут быть использованы свежеснятые («парные») шкуры, которые могут быть дополнительно подвергнуты заморозке с целью транспортирования, а также шкуры, консервированные при помощи обработки хлоридом натрия (мокросолёные). Шкуры должны происходить от здоровых животных, что должно подтверждаться сопроводительной документацией в соответствии с действующими на законодательном уровне нормативными документами.
Перед проведением обработки следует при помощи подходящего режущего инструмента провести удаление краевых участков шкуры (бахромистых участков), а также участков шкуры, покрывавших конечности. Это связано с тем, что кожа в данных участках имеет низкую плотность и теряет свою структурную целостность в результате обработки дезамидирующим раствором.
Далее шкуры обрабатывают целиком или же для удобства предварительно раскраивают на участки прямоугольной формы, выделяя следующие топографические участки: полы, воротковую и чепрачную части. Дальнейшую обработку сырья различными растворами проводят, используя коммерчески доступное оборудование. Особенно хорошо для этой цели подходят барабаны, используемые в кожевенной промышленности для обработки шкур,
Биологическое сырье, поступающее со скотобойни, имеет значительные поверхностные загрязнения, состоящие из остатков крови, некротизированных тканей, различных механических частиц, а также частично загрязнена бактериями. Для того, чтобы обеспечить воспроизводимую степень чистоты получаемого биоматрикса от остаточных клеточных компонентов, определяемую по маркеру содержания двухцепочечной ДНК (не более 50 нг/мг сухой массы), а также воспрепятствовать размножению бактерий в материале с целью снижения уровня его последующей контаминации эндотоксинами, на первом этапе необходимо проведение отмоки шкур. Для данного процесса следует использовать водный раствор кальцинированной соды, предпочтительно имеющий значение pH в диапазоне 7-9. Водный раствор соды вызывает диссоциацию биологических загрязнений с поверхности матрикса, останавливает размножение микроорганизмов. Кроме того, сода вызывает частичное защелачивание материала, что сокращает время, необходимое на обработку материала раствором гидроксида кальция и сернистого натрия на следующем этапе.
Для проведения отмоки сырье полностью погружают в водный раствор кальцинированной соды, выдерживают в растворе в течение времени, необходимого для удаления большей части загрязнений, составляющего как правило от 30 минут до 3-х часов. Контроль удаления загрязнений проводят визуально. В течение обработки для увеличения её эффективности возможно проведение постоянного или периодического перемешивания. В случае наличия сильного загрязнения исходного сырья в раствор кальцинированной соды могут быть дополнительно внесены поверхностно-активные вещества, разрешенные для применения в пищевой или фармацевтической промышленности. Наилучшем образом для этого подходят полисорбаты 20 и 80. По завершении обработки раствор сливают.
Для проведения дезамидирования, а также очистки материала от клеточных компонентов, неколлагеновых компонентов аморфного и волокнистого внеклеточного матрикса с целью получения биоматрикса по настоящему изобретению следует использовать водный раствор каустической соды и сернокислого натрия. Однако, данный раствор характеризуется плохим проникновением в толщу шкур крупного рогатого скота, вследствие высокой плотности материала, а также быстрого уплотнения его поверхностных слоев из-за щелочного набухания пучков волокон коллагена. В связи с этим, перед дезамидированием необходимо проведение предварительной обработки материала водным раствором гидроксида кальция и сернистого натрия. Цель данного предварительного этапа – увеличить проницаемость листов дермы кожи для дезамидирующего раствора за счет «разрыхления» пучков коллагеновых волокон в материале, которое выражается в значительном увеличении пространств между ними. Благодаря этому дезамидирующий раствор на следующем этапе приобретает способность к проникновению во всю толщу листов. Каустическая сода на данном предварительном этапе производит частичный гидролиз гликозаминогликанов, скрепляющих волокна коллагена в составе пучков, обеспечивая снижение их механических свойств, а сернокислый натрий связывая свободную воду, вызывает сжатие пучков волокон коллагена.
Таким образом на следующем этапе для подготовки материала к процессу дезамидирования отмытый материал заливают водным раствором гидроксида кальция и сернистого натрия. Массовое соотношение раствора к материалу при этом должно составлять не менее 1,2 : 1,0, что позволяет достигать полного покрытия материала раствором. Для достижения последующего эффективного проникновения дезамидирующего раствора в материал концентрация гидроксида кальция и сернистого натрия в растворе должна составлять не менее 0,1 М каждого. Необходимая для последующего эффективного дезамидирования степень «разрыхления» коллагеновых волокон в материале достигается при его выдерживании в растворе в течение не менее 8 часов. Для увеличения скорости и воспроизводимости результата обработки желательно проведение периодического перемешивания материала, находящегося в растворе. Описанная обработка сырья раствором гидроксида кальция и сернистого натрия помимо улучшения проницаемости для дезамидирующих растворов сопровождается его обезволашиванием, что значительно облегчает работу с материалом на последующих стадиях. Для отделения фрагментов нерастворившихся волос по завершении обработки материал рекомендуется промыть несколько раз водопроводной водой.
Далее перед проведением дезамидирования следует провести механическое удаление мездры (подкожного жира) при помощи специализированной мездрильной машины, применяющейся в кожевенной промышленности. Необходимость данного этапа обуславливается тем, что толстый жировой слой, присутствующий на листах, препятствует проникновению дезамидирующего раствора в материал вследствие гидрофобности.
Далее проводят разрезание материала на листы, линейные размеры которых будут соответствовать желаемым линейным размерам производимых в ходе процесса листов дезамидированного коллагенового биоматрикса. Наиболее удобно в последующей обработке использование фрагментов квадратной или прямоугольной формы. На данном этапе проводят выборочный контроль образцов материала. Прошедший подготовительную обработку материал должен характеризоваться влажностью не менее 50%, толщиной не менее 2,5 мм, значением pH водных вытяжек 9-11.
Затем перед обработкой дезамидирующим раствором проводят удаление слоев, содержащих остатки волосяных луковиц и мездры при помощи двоильных машин, применяемых в кожевенной промышленности.
После этого приступают к обработке листов высокощелочным водным раствором каустической соды и сернокислого натрия. На данной технологический стадии раствор каустической соды и сернокислого натрия производит: 1) непосредственное дезамидирование боковых групп аминокислотных остатков аспарагина и глутамина в составе аминокислотных цепей коллагена, благодаря чему, при условии проведения подготовки материала на предыдущей стадии, достигается уровень дезамидирования, характеризующийся содержанием амидного азота не более 1,3 мг на 1 г сухой массы; 2) щелочной гидролиз неколлагеновых компонентов, включающих клетки, белки волокнистого внеклеточного матрикса, мукополисахариды, жиры благодаря чему достигается содержание в получаемом биоматриксе эластина не более 6% на сухую массу двухцепочечной ДНК в количестве не более 50 нг/мг сухой массы, сульфатированных гликозаминогликанов не более 0,2 мкг/мг на сухой массы, жира не более 0,5 % на сухую массу, соответственно. Каустическая сода в составе раствора обеспечивает щелочность, необходимую для осуществления гидролиза неколлагеновых компонентов. Сернокислый натрий, в свою очередь, препятствует избыточному набуханию материала в среде с высокими значениями pH. Набухание обрабатываемых листов, наблюдаемое в случае отсутствия сернокислого натрия в составе дезамидирующего раствора, приводит к чрезмерному уплотнению материала, что сильно механически затрудняет его последующую отмывку от раствора, а также может препятствовать вымыванию из него продуктов щелочного гидролиза неколлагеновых компонентов.
Концентрация каустической соды в растворе должна находиться в диапазоне от 1,0 до 4,0 М. Сернокислый натрий вносят в количестве, необходимом для достижения его концентрации в растворе не менее 0,5 М.
Подготовленный на предыдущих стадиях материал заливают раствором каустической соды и сернокислого натрия таким образом, чтобы раствор полностью его покрывал. Это достигается при значении массового соотношения раствора к материалу не менее 1,2 : 1,0. Для достижения целевых значений содержания амидного азота время выдерживания листов в растворе должно составлять не менее 8 часов.
Обработка материалов водным раствором каустической соды в концентрации 1,0 М и более в течение не менее 1 часа является доказанным методом, позволяющим полностью инактивировать прионные инфекционные агенты (McDonnell G., Dehen C., Perrin A., Thomas V., Igel-Egalon A., Burke P.A., Deslys J.P., Comoy E. Cleaning, disinfection and sterilization of surface prion contamination. Journal of Hospital Infection, 2013, v. 85, pp. 268-273). Таким образом рассматриваемый этап обработки в дополнении к перечисленному выше обеспечивает прионную безопасность получаемого биоматрикса.
Для улучшения эффективности солюбилизации и отмывки неколлагеновых компонентов из материала возможно в ходе обработки применение периодического перемешивания и периодической смены раствора для поддержания его стабильной концентрации, а также периодического охлаждения до температуры 2-8°С для разрушения целостности клеток при кристаллизации сернокислого натрия.
Для улучшения воспроизводимости процесса дезамидирования, а также для первичной отмывки от неколлагеновых белков, перед внесением раствора каустической соды и сернокислого натрия листы подготовленного материала могут быть предварительно обработаны забуференными солевыми растворами, имеющими значение pH в диапазоне 8-9. Так, например, для этого могут быть использованы растворы дигидрофосфата калия и хлорида натрия. Предпочтительное время обработки 1-3 суток.
По завершении процесса обработки на данном этапе, щелочной раствор каустической соды и сернокислого натрия сливают. Для нормализации значения pH экстрактов материала проводят последовательную отмывку полученных листов дезамидированного коллагенового биоматрикса от щелочи. На первом этапе отмывки листы отмывают водными растворами электролитов. Наилучшим образом для этого подходят растворы сульфата натрия. Возможно применение данных растворов в концентрациях 0,5-2,0 М, наиболее предпочтительно 1,1-1,4 М. Отмывку данными растворами следует проводить в течение 8-32 часов при массовом соотношении раствора к материалу не менее 1,0 : 1,0. Для улучшения эффективности отмывки следует применять периодические (один раз в несколько часов) перемешивание и смену раствора на свежеприготовленный.
На втором этапе листы дезамидированного коллагенового биоматрикса отмывают водными растворами неорганических кислот. В качестве последних могут быть использованы фосфорная или борная кислота. Наиболее предпочтительно использование в работе водных растворов борной кислоты в концентрации от 0,6 М до концентрации насыщенного раствора. Массовое соотношение отмывочного раствора к материалу при этом должно составлять не менее 1,0 : 1,0. Как и на прошлом этапе для улучшения эффективности отмывки следует применять периодические перемешивание и смену раствора на свежеприготовленный.
На заключительном этапе материал отмывают последовательными сменами воды или буферных растворов до достижения значений pH смыва материала листов диапазона 6,0-8,0, которое контролируют ионометрическим методом. Так, для заключительный отмывки может быть использован 0,01 М фосфатно-солевой буфер.
По окончании обработки полученные листы дезамидированного коллагенового биоматрикса следует подвергнуть выходном производственному контролю при помощи известных из уровня техники биохимических и физических методов.
При воздействии высокощелочного раствора все молекулы коллагена в составе биоматрикса подвергаются процессу полного или частичного дезамидирования. Для оценки общего содержания белка коллагена, подвергнутого дезамидированию, в расчете на единицу сухой массы матрикса может быть использовано фотометрическое определение гидроксипролина в образце (Woessner, J. F. The determination of hydroxyproline in tissue and protein samples containing small portions of this iminoacid. Arch. Biochem. Biophys. 1961, v. 93, p. 440-447), и должно составлять не менее 90%.
В свою очередь, уровень общего дезамидирования боковых групп аминокислотных остатков биоматрикса может быть оценена методом титрования по содержанию амидного азота (Radhika M., Sehgal P.K. Studies on the desamidation of bovine collagen. J. Biomed. Mater. Res. 1997, v. 35, № 4, pp. 497-503). Содержание амидного азота в дезамидированном коллагеновом биоматриксе по настоящему изобретению должно составлять не более 1,3 мг на 1 г сухой массы. В случае необходимости приблизительная общая доля дезамидированных остатков апарагина и глутамина может быть рассчитана как отношение полученного содержание амидного азота к расчётному содержанию амидного азота в незедамидированном коллагене, которое при допущении, что размер молекулы коллагена составляет 300 кДа, а количество остатков глутамина и аспарагина в нем – 131, составляет 6,1 мг на г сухой массы (в коллагене, полученном из соединительных тканей животных, эти значения могут немного варьировать вследствие посттрансляционных модификаций молекул). Исходя из этих допущений, дезамидированный коллагеновый биоматрикс по изобретению должен характеризоваться не менее 78,7% дезамидированных остатков апарагина и глутамина, превращенных в остатки аспарагиновой и глутаминовой кислот, соответственно.
Эффективность очистки биоматрикса от клеточных компонентов может быть оценена количественно по содержанию двухцепочечной ДНК (дцДНК) – маркера присутствия клеток в материале. Определение ДНК в биоматриксе можно проводить спектрофлуорметрическим или сперкторфотометрическим методами после её выделения из измельченного, гомогенизированного, или переваренного ферментативно материала методом фенол-хлороформной, или же, что более предпочтительно, сорбентной экстракции (Gilbert T.W., Freund J.M., Badylak S.F. Quantification of DNA in biologic scaffold materials. J. Surg. Res. 2009, v. 152, № 1, p. 135-139). Содержание дцДНК в матриксе в количестве не более 50 нг/мг сухой массы свидетельствует об эффективной очистке материала от клеток и его биобезопасности (Crapo P. M., Gilbert T. W., Badylak S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011, v. 32, № 12, p. 3233-3243.).
Также, в качестве дополнительного метода контроля очистки от клеточных компонентов могут быть использованы гистологические методы анализа парафиновых или криостатных срезов образцов биоматрикса. Для выявления клеточных компонентов на срезах могут быть применены рутинные методы окрашиваний, применяемые в гистологических исследованиях. Например, может быть использовано окрашивание гематоксилином и эозином с последующим анализом препаратов методом микроскопии светлого поля или же окрашивание красителем DAPI (4',6-диамидино-2-фенилиндолом) с последующим анализом препаратов при помощи флуоресцентного микроскопа (Keane T.J., Londono R., Turner N.J., Stephen F Badylak S.F. Consequences of ineffective decellularization of biologic scaffolds on the host response. 2012, v. 33, № 6, p. 1771-1781). Отсутствие визуально выявляемых клеточных ядер на препаратах свидетельствует в пользу эффективной очистки биоматрикса от клеток.
Очистка биоматрикса от компонентов аморфного внеклеточного матрикса может быть оценена по содержанию в нем сульфатированных гликозаминогликанов. Для анализа возможно применение метода спектрофотометрического количественного определения сульфатированных гликозаминогликанов в ферментативно переваренных образцах в реакции с красителем 1,9-диметил-метиленовым синим при длине волны 540 нм (Farndale R.W., Buttle D.J., Barrett A. J. Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue. Biochim. Biophys. Acta. 1986, v. 883, № 2, p. 173-177). Содержание сульфатированных гликозаминогликанов в образцах дезамидированного коллагенового биоматрикса должно составлять не более 0,2 мкг/мг сухой массы.
Степень чистоты биоматрикса от неколлагеновых компонентов волокнистого внеклеточного матрикса следует определять по содержанию белка – эластина. Содержание эластина в образцах биоматрикса может быть определено гравиметрически после выделения методом горячей щелочной экстракции (Atanasova M., Dimitrova A., Ruseva B., Stoyanova A., Georgieva M., Konova E. Quantification of elastin, collagen and advanced glycation end products as functions of age and Hypertension. In: Senescence. Tetsuji Nagata editor. 2012, p. 519-530). Содержание эластина в результате анализа произведенного коллагенового дезамидированного биоматрикса не должно превышать 6%.
Уровень делипидизации дезамидированного коллагенового биоматрикса может быть оценен экстракционно-гравиметрическим методом определения содержания жира (например, по методике ГОСТ 15113.9-77), с использованием хлороформ-этанола в качестве экстрагирующей смеси. Массовое содержание жира в расчёте на сухую массу в образцах получаемого биоматрикса не должно превышать 0,5%.
Толщина и линейные размеры листов дезамидированного коллагенового биоматрикса могут быть оценены как методами прямого измерения, так и инструментально, например, при помощи штангенциркуля или толщиномера. Способ по изобретению обеспечивает получение дезамидированного коллагенового биоматрикса в форме цельных волокнистых листов, толщиной более 1 мм, что позволяет использовать его, в отличии от аналогичных биоматриксов, получаемых из тканей серозных оболочек, для изготовления объемных абсорбирующих раневых покрытий, гемостатических материалов, объемных скэффолдов для трансплантации клеток в мягкие ткани, а также использовать в качестве сырья для изготовления волокнистых мелкодисперсных материалов с повышенной долей волокнистых микрочастиц.
При дезамидировании коллагена на его молекулах возникают дополнительные отрицательно-заряженные группы в виде депротонированных карбоксильных групп, притягивающие и связывающие молекулы воды. В связи с этим, получаемый дезамидированный коллагеновый биоматрикс характеризуется повышенной по сравнению с исходными листами дермы обводненностью, и может быть также охарактеризован по содержанию воды. В качестве метода анализа может быть использована инфракрасная термогравиметрия. Значение содержания воды в биоматриксе более 60% будет свидетельствовать об эффективном процессе прохождения дезамидирования.
Как правило, коллагеновый материал, подвергнутый дезамидированию в высокощелочном растворе характеризуется пониженной устойчивостью к перевариванию неспецифическими ферментами, а также пониженной термоустойчивостью в водных растворах. В качестве дополнительных методов анализа, данные показатели могут быть оценены посредством инкубации фрагментов материала в растворе трипсина с последующим анализом степени его растворения (Weadock K.S., Miller E.J., Keuffel E.L, Dunn M.G. Effect of physical crosslinking methods on collagen-fiber durability in proteolytic solutions. J. Biomed. Mater. Res. 1996, v. 32, № 2, pp. 221-226), и методом дифференциально-сканирующей калориметрии, соответственно (Samouillan V.,Delaunay F.,Dandurand J.,Merbahi N.,Gardou J.,Yousfi M.,Gandaglia A., Michel Spina M.,Lacabanne C. The use of thermal techniques for the characterization and selection of natural biomaterials. J. Funct. Biomater. 2011, v. 2, № 3, p. 230-248). Массовая доля биоматрикса по настоящему изобретению, не подвергающаяся ферментативной деградации в растворе трипсина, должна составлять в расчёте на сухую массу не более 6,0%. В свою очередь, температура денатурации должна составлять не более 50°С.
Полученные способом, описанным в настоящем изобретении, цельные волокнистые листы дезамидированного коллагенового биоматрикса сохраняют стабильность и характеристики после замораживания и оттаивания. Таким образом, с целью длительного хранения листы биоматрикса могут быть заморожены. Хранение замороженного материала возможно в морозильных камерах или низкотемпературных морозильниках, обеспечивающих температуру не выше −15°С.
Произведенный настоящим способом дезамидированный коллагеновый биоматрикс может быть использован в качестве полупродукта для производства изделий медицинского назначения и биодеградируемых медицинских материалов. Так, например, для изготовления абсорбирующих биодеградируемых раневых покрытий листы могут быть подвергнуты лиофилизации, после чего разрезаны на фрагменты, соответствующие типоразмерным характеристикам покрытий, упакованы в герметичную первичную упаковку (например, блистерную) и простерилизованы радиационным методом или при помощи оксида этилена. Также дезамидированный коллагеновый биоматрикс может быть применён для изготовления мелкодисперсных имплантируемых материалов на основе нитевидных микрочастиц, как например микроструктуризированных коллагеновых материалов, получаемых согласно патенту РФ 2735176, что связано с простотой загрузки их в роторно-ножевой измельчитель, последующего получения волокнистых тяжей, используемых для помола на различных мельницах, а также высоким показателями выхода волокнистых микрочастиц после ударно-истирающего помола. Дезамидированный коллагеновый биоматрикс по изобретению может быть использован в качестве скаффолда для культивирования и трансплантации клеток, изготовлении биомедицинских клеточных продуктов. Кроме того, дезамидированный коллагеновый биоматрикс может применяться для получения из него формованных биомедицинских материалов на основе химически модифицированного по дополнительным карбоксильным группам дезамидированного коллагена, а также материалов с иммобилизованными на них лекарственными средствами.
В связи с тем, что дезамидированный коллагеновый биоматрикс по изобретению обладает высокой влагосвязывающей способностью, еще одной дополнительной областью его применения может являться использование в измельченном виде в качестве добавки к пищевым или косметическим продуктам, применяемой с целью увеличения суммарного белкового содержания в готовой продукции, улучшения структуры, текстуры и органолептики или же с целью стабилизации эмульсий.
Описанный в настоящем изобретении способ получения дезамидированного коллагенового биоматрикса может быть реализован в промышленном масштабе на предприятиях, производящих изделия и материалы медицинского назначения, с применением коммерчески доступного фармацевтического оборудования, а также оборудования, применяемого в кожевенной промышленности, которое может быть легко адаптировано для использования на фармацевтических предприятиях. Таким образом способ является промышленно реализуемым и применимым.
Область применения
Дезамидированный коллагеновый биоматрикс, описанный в настоящем изобретении, может быть применен в области:
(1) изготовления биодеградируемых или абсорбирующих медицинских изделий на основе формованного дезамидированного коллагенового матрикса, предназначенных для стимуляции регенерации и увеличения объема мягких тканей в области восстановительной и пластической хирургии, стоматологии, гинекологии, косметологии, комбустиологии и др.;
(2) изготовления инъекционно-имплантируемых материалов на основе микрочастиц дезамидированного коллагенового биоматрикса;
(3) изготовление биомедицинских материалов, содержащих лекарственные средства, иммобилизованные на дезамидированном коллагеновом биоматриксе;
(4) изготовления биомедицинских материалов, на основе коллагена, химически модифицированного по карбоксильным группам;
(5) различных научных исследованиях, требующих проведения иммобилизации веществ на карбоксильных группах твердого носителя;
(6) изготовления субстратов или скаффолдов для культивирования клеток;
(7) изготовления биомедицинских клеточных продуктов;
(8) изготовления вспомогательных компонентов для пищевой и косметической промышленности.
Пример 1
В качестве исходного сырья для изготовления дезамидированного коллагенового биоматрикса в виде цельных волокнистых листов использовали шкуры крупного рогатого скота, консервированные мокросоленым способом при помощи хлорида натрия, полученные на бойне сельскохозяйственного предприятия. Перед проведением обработки со шкур обрезали краевые бахромистые участки и участки шкур, покрывающие конечности. После этого шкуры помещали в полипропиленовый барабан Oyster Vallero (Vallero International S.r.l., Италия). Общая масса загруженных шкур составила 500 кг. После этого в барабан заливали 650 литров водного 0,8% раствора кальцинированной соды, содержащего 0,2% Tween 80 (pH раствора 8,7). Шкуры выдерживали в растворе в течение 5 часов. Отсутствие биологических и механических загрязнений материала после обработки контролировали визуально.
Обрабатываемый материал извлекали из барабана, разделяли по массе на 9 равных частей и переносили в полипропиленовые бочки с завинчивающимися крышками. Готовили 3 водных раствора гидроксида кальция и сернистого натрия, содержащие данные вещества в следующих концентрациях, соответственно: 1) 0,05 М гидроксида кальция и 0,05 М сернистого натрия, 2) 0,1 М гидроксида кальция и 0,1 М сернистого натрия, 3)0,2 М гидроксида кальция и 0,2 М сернистого натрия. Каждый раствор заливали в три отдельные бочки с материалом таким образом, чтобы массовое соотношение растворов и обрабатываемых шкур составляло 1,2 : 1,0. Материал выдерживали в растворах при периодическом перемешивании на универсальных перемешивающих устройствах. Через различные сроки после начала инкубации (2, 8, 16 часов) сливали раствор (по одной бочке с раствором каждой концентрации на срок) и промывали водопроводной водой от остатков волос.
Шкуры, прошедшие предварительную обработку по различным схемам, обрабатывали на мездрильной машине SC 1600 (Sol Meccanica di De Stefano & Pierri S.n.c., Италия), удаляя мездру (подкожный жир). Обезжиренные шкуры разделяли ножом на прямоугольные фрагменты, размером ⁓ 15х20 см.
Отбирали образцы для анализа (по три пробы на каждый анализ). Толщину листов определяли при помощи штангенциркуля. Влажность измеряли, используя инфракрасный влагомер OHAUS MB25 (США). Для анализа pH готовили водные вытяжки инкубируя измельченные образцы в дистиллированной воде в соотношении 1г на 40 мл в течение 2-х часов, затем определяли водородный показатель вытяжки при помощи pH-метра. Для анализа микроструктуры из пластин вырезали фрагменты, толщиной 0,5 см, которые фиксировали в 10% формалине забуференном фосфатом в течение 48 часов. После этого образцы обезвоживали и заливали парафин по стандартной методике. На микротоме Microm HM325 (ThermoScientific, США) готовили поперечные срезы образцов, которые монтировали на предметные стекла. Срезы окрашивали гематоксилином и эозином по стандартной методике. Полученные препараты анализировали, используя микроскоп EclipseNi-U (Nikon, Япония).
Анализ толщины листов, характеризующей щелочное набухание («нажор») материала, выявил увеличение средних значений данного показателя, как при увеличении времени инкубации в растворе, так и при повышении концентрации реагентов (таблица 1). При этом наиболее выраженное щелочное набухание выявлялось при обработке растворами с концентрациями гидроксида кальция и сернистого натрия 0,1 и 0,2 М в течение 8 и 16 часов.
Щелочное набухание листов, очевидно, сопровождалось увеличением содержания в них воды, что выражалось в повышении значений влажности материала (таблица 2). Характер зависимости величины данного показателя от времени инкубации и концентрации реагентов был в целом сопоставим с таковой у показателя толщины листов (таблица 1).
Инкубация дермы в растворе гидроксида кальция и сернистого натрия сопровождалась защелачиванием материала, что выражалось в повышении значений pH водных вытяжек (таблица 3). Наибольшая щелочность была выявлена при обработке растворами с концентрациями 0,1 и 0,2 М в течение 8 и 16 часов (значения pH превышали 9,0).
Таблица 1. Толщина листов дермы (мм) после предварительной обработки при различных условиях.
Таблица 2. Влажность листов дермы (%) после предварительной обработки при различных условиях.
Таблица 3. Значения pH водных вытяжек листов дермы после предварительной обработки при различных условиях.
Интенсивное защелачивание обработанного материала дермы сопровождалось микроструктурными изменениями, выявляемыми при анализе его гистологических срезов (Фиг. 1). Так, образцы после обработки растворами с концентрациями каждого реагента 1,0 и 2,0 М, в течение 8 и 16 часов, характеризовались значительным уменьшением пространственной плотности пучков волокон коллагена, а также существенным увеличением размера пространств между ними. Полученные морфологические данные свидетельствуют о «разрыхлении» материала вследствие обработки при указанных условиях.
На следующем производственном этапе на двоильной машине (Camoga, Италия) со всех листов удаляли слой дермы, содержащий остатки волосяных луковиц (сосочковый слой), а также с висцеральной стороны листов срезали остатки жировой ткани. Затем проводили повторную обрезку листов, доводя их толщину до значения, находящегося в диапазоне 1-4 мм. Средняя толщина листов при этом составляла 2,6 мм.
Листы дермы, прошедшие обработку по различным схемам, помещали в отдельные пластиковые бочки объемом 25 литров. Затем материал заливали буферным солевым раствором, содержащим гидроксид калия и фосфорнокислый натрий в массовых концентрациях 20 и 7 г/л соответственно. Значение pH раствора составляло 8,6. Бочки устанавливали на универсальные перемешивающие устройства. Материал выдерживали в растворе при периодическом перемешивании в течение 3-х суток. При этом каждые сутки заменяли раствор на свежий. В ночное время бочки помещали в холодильник на 2-8°С. По завершении обработки раствор сливали.
Далее сразу же в бочки с листами вносили предварительно приготовленный дезамидирующий раствор, таким образом, чтобы массовое соотношение раствора и обрабатываемого материала составляло 1,2 : 1,0. В качестве дезамидирующего раствора применяли водный раствор каустической соды в концентрации 2,0 М и сернокислого натрия в концентрации 0,7 М. Материал выдерживали в растворе в течение 8 часов при периодическом перемешивании и однократной смене раствора через 4 часа после начала инкубирования.
По окончании обработки дезамидирующий раствор сливали, промывали листы проточной водой. Для отмывки от щелочи на первом этапе в бочки заливали водный раствор сернокислого натрия при массовом соотношении раствора и материала 1,0 : 1,0. Материал выдерживали в растворе в течение 8 часов при периодическом перемешивании на перемешивающем устройстве, затем ночью оставляли в свежей смене раствора в холодильнике при 2-8°С.
На следующем этапе отмывки листы промывали проточной водой и промывали в 5 сменах 0,01 М раствора фосфорной кислоты, затем помещали на ночь в 0,01 М фосфатно-солевой буфер (pH 7,2-7,6) в холодильник при 2-8°С. После этого проводили еще 5 отмывок в свежеприготовленных растворах фосфатно-солевого буфера при периодическом перемешивании. По окончании обработки раствор сливали. Контроль отмывки от дезамидирующего раствора проводили по анализу pH водной вытяжки, значение которого находилось в диапазоне 6,0-8,0.
В результате проведенной обработки дермы кожи крупного рогатого скота были получены прямоугольные листы белого или светло-желтого цвета (Фиг. 2).
Образцы полученного материала подвергали физико-химическому анализу. Содержание дезамидировнаного коллагена в образцах определяли по содержанию гидроксипролина в цветной реакции продукта окисления данной аминокислоты с параметилбензальдегидом, используя спектрофотометр СФ 2000 (ОКБ Спектр, Россия). Для оценки уровня дезамидирования, определяли содержание амидного азота в расчете на единицу сухой массы методом титрования (Radhika M., Sehgal P.K. Studies on the desamidation of bovine collagen. J. Biomed. Mater. Res. 1997, v. 35, № 4, pp. 497-503).
Очистку от клеточных компонентов контролировали по содержанию дцДНК. Для проведения анализа образцы биоматрикса лиофильно высушивали, измельчали ножницами. Затем из полученных фрагментов массой 25 мг выделяли ДНК сорбентным методом при помощи набора «ДНК-сорб-С» (АмплиСенс, Россия). Количество выделенной двухцепочечной ДНК определяли флуориметрически на приборе Qubit 2.0 (Invitrogen, США), используя набор реагентов Qubit dsDNA HS Assay Kit (Invitrogen, США).
Остаточное содержание компонентов аморфного внеклеточного матрикса определяли по содержанию сульфатированных гликозаминогликанов. Их определение проводили в лизате материала спекторометрически при 540 нм в реакции с 1,9-диметил-метиленовым синим, используя хондроитин сульфат из хрящей акул в качестве стандарта для построения калибровочной кривой (Farndale R.W., Buttle D.J., Barrett A. J. Improved quantitation and discrimination of sulphated glycosaminoglycans by use of dimethylmethylene blue. Biochim. Biophys. Acta. 1986, v. 883, № 2, p. 173-177).
Далее определяли остаточное содержание неколлагеновых компонентов в виде белка эластина. Из пластов вырезали образцы биоматрикса площадью ~ 1 см2. Затем на весах измеряли массу каждого фрагмента. Образцы измельчали ножницами и помещали в центрифужную пробирку объемом 15 мл с предварительно измеренной массой. В пробирку добавляли 5 мл 0,1 М NaOH и инкубировали на кипящей водяной бане, периодически перемешивая стеклянной палочкой, в течение 20 минут. После этого пробирки извлекали из водяной бани и центрифугировали в течение 30 минут при 4000 об/мин. Супернатант сливали. Осадок ресуспендировали в 5 мл 0,1 М NaOH. Инкубацию в водяной бане с последующим центрифугированием повторяли еще 2 раза. После заключительного центрифугирования сливали супернатант, а осадок высушивали в пробирке при 56°С, взвешивая каждый час до прекращения изменения массы. Гравиметрически определяли процентное содержание эластина по отношению разницы массы центрифужной пробирки с осадком и пустой центрифужной пробирке к массе исследуемого фрагмента биоматрикса.
Для оценки степени обезжиривания полученного биоматрикса проводили количественное измерение жира стандартным экстракционно-гравиметрическим методом при помощи прибора для определения жира ГФ5.184.101 (Химлаборприбор, Россия). В качестве экстрагирующей смеси использовали хлороформ/этанол в массовом соотношении 2:1.
Для контроля обводненности проводили измерение содержания воды в образцах биоматрикса при помощи инфракрасного анализатора влажности MB 23 (OHAUS, США) при температуре нагрева 105°С.
Измерение толщины листов биоматрикса проводили при помощи Толщиномера механического МТ 535 (Метротекс, Россия) в трех случайно выбранных точках. За результат испытания применяли среднее арифметическое значение данных трех измерений.
С целью дополнительной оценки удаления клеточных компонентов, а также оценки общей морфологии образцы материала фиксировали 10% формалином забуференным фосфатом в течение 48 часов, а затем обрабатывали аналогично образцам подготовленной дермы. Полученные препараты анализировали, используя микроскоп Eclipse Ni-U (Nikon, Япония). В качестве образца сравнения при проведении анализов использовали образцы дермы кожи, не подвергнутые химической обработке.
Для оценки термоустойчивости определяли температуру денатурации материала методом дифференциально-сканирующей калориметрии.
Для оценки устойчивости к ферментативной деградации образцы биоматрикса массой 10 мг инкубировали в 1 мл растворе трипсина на PBS в течение 3 сут при +37°С, затем осаждали нерастворившийся материал центрифугированием, удаляли надосадочную жидкость. Осадок высушивали на вакуумной сушке. Измеряли массу пробирки с осадком. По разнице массы исходной пробирки и пробирки с осадком определяли массу нерастворившегося материала, которую выражали в % от исходной массы образца.
Измерение содержания коллагена в пробах показало, что данный белок являлся основным преобладающим компонентом полученного биоматрикса, его среднее содержание во всех пробах находилось в диапазоне 96-99% в расчете на сухую массу (таблица 4).
Анализ содержания амидного азота, проведенный для оценки степени дезамидирования коллагена в составе коллагенового биоматрикса, выявил что как длительность предварительной обработки дермы водным раствором гидроксида кальция и сернистого натрия, так и увеличение концентрации реагентов в растворе приводит к увеличению уровня дезамидрования коллагена после обработки раствором каустической соды и сернокислого натрия (таблица 5). При этом, наиболее выраженное дезамидирование, характеризующееся содержанием амидного азота менее 1,3 мг/г сухой массы выявлялось при применении предварительной обработки растворами с концентрациями 0,1 и 0,2 М в течение 8 и 16 часов (таблица 5). Уровень содержания амидного азота при данных условиях, находился в диапазоне 1,0-1,2 мг/г сухой массы, что соответствует дезамидированию ⁓ 80,3 -83,6% боковых остатков аспарагина и глутамина.
Наблюдаемое в образцах увеличение уровня дезамидирования коллагена сопровождалось повышением содержания воды в биоматриксе (таблица 6), а также увеличением средней толщины листов, обусловленным их набуханием вследствие обводнения (таблица 7).
Измерение содержания дцДНК, как маркера содержания остаточных клеточных компонентов в составе биоматрикса (таблица 8), показало, что предварительная обработка растворами гидроксида кальция и сернистого натрия с концентрациями 0,1 и 0,2 М в течение 8 и 16 часов обеспечивает достижение общепринятого критерия децеллюляризации биоматериалов по количеству данного компонента менее 50 нг/мг сухой массы (Crapo P. M., Gilbert T. W., Badylak S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011, v. 32, № 12, p. 3233-3243.)
Также, данные параметры предварительной обработки способствовали достижению наиболее выраженной очистки от компонентов аморфного внеклеточного матрикса, наименьшего остаточного содержания неколлагеновых белков волокнистого внеклеточного матрикса, а также наиболее эффективной делипидизации, о чем свидетельствуют данные анализа содержания сульфатированных гликозаминогликанов (таблица 9), эластина (таблица 10) и жира (таблица 11), соответственно.
Таблица 4. Содержание белка коллагена в листах биоматрикса (% от сухой массы) после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Таблица 5. Содержание амидного азота в листах биоматрикса (мг/г сухой массы) – показатель степени дезамидирования коллагена, после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Таблица 6. Содержание воды в листах биоматрикса (% от массы), после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Таблица 7. Средняя толщина листов биоматрикса (мм), после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Таблица 8. Содержание дцДНК в листах биоматрикса (нг/мг сухой массы) после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Таблица 9. Содержание сульфатированных гликозаминогликанов в листах биоматрикса (мкг/мг сухой массы) после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Таблица 10. Содержание эластина в листах биоматрикса (% от сухой массы) после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Таблица 11. Содержание жира в листах биоматрикса (% от сухой массы) после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Кроме того, было выявлено, что в группах образцов, подвергнутых предварительной обработке растворами гидроксида кальция и сернистого натрия с концентрациями 0,1 и 0,2 М в течение 8 и 16 часов происходило значительное снижение температуры денатурации (таблица 12) и резкое снижение устойчивости к ферментативной деградации в растворе трипсина (таблица 13).
Таблица 12. Температура денатурации материала листов биоматрикса (°С) после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Таблица 13. Устойчивость к ферментативной деградации трипсином листов биоматрикса (% от исходной массы) после обработки раствором каустической соды и сернокислого натрия в зависимости от условий предварительной обработки раствором гидроксида кальция и сернистого натрия.
Микроскопический анализ поперечных гистологических срезов не выявил наличия клеток в составе всех материалов, прошедших обработку дезамидирующими растворами (Фиг. 3), в отличие от образца исходной дермы кожи, где наибольшее скопление клеток наблюдали в области кровеносных сосудов. Полученные данные свидетельствуют о разрушении клеточных элементов при различных вариантах обработки листов дермы. В то же время, сопоставление данных с результатами определения дцДНК позволяет заключить, что эффективная солюбилизация и удаление компонентов разрушенных клеток из материала произошло только при условии применения обработки раствором гидроксида кальция и сернистого натрия с концентрациями 0,1 и 0,2 М в течение 8 и 16 часов.
Также при применении данных условий предварительной обработки на гистологических срезах было выявлено значительное изменение микроструктуры материала листов биоматрикса (Фиг. 3). Материал приобретал слабую базофилию, утрачивал морфологию, характерную для матрикса плотной неоформленной соединительной ткани, представлял собой сеть из неравномерно утолщенных на срезе переплетающихся анастомозирующих тяжей (Фиг. 3), что является косвенными признаками образования значительного числа дополнительных отрицательных зарядов на молекулах коллагена, а также набухания пучков коллагеновых волокон.
Пример 2
В рамках процесса разработки проводили исследование стабильности дезамидированного коллагенового биоматчрикса при длительном хранении.
На первом этапе производили опытную серию биоматрикса для исследования стабильности. Для этого использовали свежеснятые («парные») шкуры крупного рогатого скота. Обрезали краевые бахромистые участки и участки шкур, покрывающие конечности, и загружали сырье в полипропиленовый барабан Oyster Vallero (Vallero International S.r.l., Италия), в котором проводили дальнейшую обработку до стадии обработки на мездрильной машине. Шкуры обрабатывали раствором кальцинированной соды и детергентов, как в Примере 1. Затем заливали водным раствором гидроксида кальция в концентрации 0,2 М и сернистого натрия в концентрации 0,1 М и выдерживали материал 8 часов. Массовое соотношение раствора к материалу составляло 2 : 1. Шкуры обрабатывали в растворе в течение 8 часов. Раствор сливали, материал промывали водой.
Шкуры, прошедшие предварительную обработку, обрабатывали на мездрильной машине и разрезали на фрагменты как в Примере 1. Измеренная толщина полученных листов составила 9,0 ± 0,3 мм, влажность 60,1 ± 2,2 %, значение pH водных вытяжек 10,2 ± 0,3.
Далее материал обрабатывали на двоильной машине, аналогично Примеру 1 и помещали в пластиковые бочки объемом 25 литров. Далее материал обрабатывали буферным солевым раствором как в Примере 1. Раствор при этом дополнительно содержал тетраборат натрия в количестве 10 г/л.
Далее обрабатывали материал водным раствором, содержащим каустическую соду в концентрации 1,0 М и сернокислый натрий в концентрации 0,5 М. Массовое соотношение раствора к материалу составляло 1,5 : 1,0. Обработку раствором проводили в течение 18 часов, из которых 12 часов обработку проводили в холодильнике при температуре 2-8°С. Далее дезамидированный материал отмывали водным раствором сернокислого натрия, как в Примере 1, а затем в трех сменах водного раствора борной кислоты в массовой концентрации 3 г/л, продолжительностью 7 часов каждая.
На заключительном этапе материал отмывали в 0,01 М фосфатно-солевом буфере (pH 7,2-7,6) идентично Примеру 1. Толщина всех полученных пластин дезамидированного коллагенового биоматрикса находилась в диапазоне 6,0-7,0 мм.
После получения проводили анализ внешнего вида пластин и контроль физико-химических параметров полученного дезамидированного коллагенового биоматрикса по показателям «содержание амидного азота», «содержание коллагена», «содержание дцДНК», «содержание сульфатированных гликозаминогликанов», «содержание эластина», «содержание жира», «толщина», «содержание воды» по методикам, полностью идентичным тем, что использовали для анализа биоматрикса в примере 1. Также для анализа микроструктуры образцов проводили микроскопический анализ поперечных гистологических срезов листов матрикса окрашенных гематоксилином и эозином, аналогично примеру 1.
Далее для оценки биобезопасности проводили анализ цитотоксичности биоматрикса методом экстрактов. Для проведения анализа клетки NIH/3T3 (эмбриональные фибробласты мыши) культивировали в среде DMEM (gibco) с добавлением 10% эмбриональной сыворотки теленка (gibco) и 2 мM L-глутамина (gibco) при 37 °C и 5% CO2. Для получения экстрактов биоматрикса его образцы взвешивали и добавляли в культуральную среду из расчета 0,1 г/мл. Полученные образцы инкубировали в течение 72 ч при 37 °C и 5% CO2. При постановке МТС теста из лунок удаляли культуральную среду и добавляли к клеткам смесь среды с МТС реагентом (CellTiter 96 AQueous Non-Radioactive Cell Proliferation Assay, Promega) из расчета 20 мкл МТС на 100 мкл ростовой среды. Клетки инкубировали в течение 3 часов в темноте в СО2-инкубаторе. Оптическую плотность полученных растворов измеряли при длине волны 490 нм с помощью спектрофотометра Thermo Scientific Multiskan GO. В качестве отрицательного контроля использовали клетки, инкубированные в культуральной среде, которая в течение 72 ч находилась в СО2-инкубаторе одновременно с образцами медицинских изделий. В качестве положительного контроля выступали клетки, инкубированные в среде с добавлением 30 % ДМСО (приводило к гибели 100% популяции). Жизнеспособность клеток, инкубированных с экстрактами биоматрикса, рассчитывали, как процент относительно клеток, культивированных в ростовой среде. Значение поглощения MTС реагента в культуральной среде без клеток принимали равным нулю.
Для проведения испытания на подтверждение срока и условий хранения полученные листы дезамидированного коллагенового биоматрикса упаковывали по 1 кг в герметичную полиэтиленовую упаковку в количестве, необходимом для проведения всех последующих анализов и помещали на хранение в морозильную камеру при −15°С.
Равное количество материала извлекали из морозильной камеры через 3, 6, 9, 12, 18, 24 и 36 мес., размораживали при комнатной температуре и проводили все указанные выше анализы, которым подвергали биоматрикс непосредственно после получения.
Анализ физико-химических показателей на различных сроках экспериментального хранения не выявил их существенного изменения вследствие хранения и сопутствующей ему заморозке/разморозке (таблица 14). Значения параметров варьировали незначительно в пределах, установленных спецификацией, зависимости изменений от времени хранения не наблюдалось (таблица 14). Внешний вид образцов до и после хранения и последующей разморозки на различных сроках не различался (таблица 14).
Микроскопическое исследование гистологических срезов листов биоматрикса, показало, что как до экспериментального хранения, так и после выдерживания при −15°С в течение различного времени микроструктура образцов была идентична: на срезах выявлялась сеть переплетающихся анастомозирующих слабобазофильных тяжей. Клеточные элементы не выявлены во всех образцах (Фиг. 4).
Полученные результаты свидетельствуют о том, что физико-химические свойства, микроструктура, а также биосовместимость дезамидированного коллагенового биоматрикса не изменяются в процессе длительного хранения при отрицательных температурах и при последующем размораживании.
Таблица 14. Физико-химические и биологические показатели дезамидированного коллагенового биоматрикса на различных сроках экспериментально хранения при −15°С.
Пример 3
В рамках доклинической оценки биобезопасности дезамидированного коллагенового матрикса проводили исследование его сенсибилизирующего действия. Для проведения данного исследования использовали биоматрикс, полученный по методике, идентичной таковой в примере 2.
Для возможности инъекционного введения материала, листы биоматрикса высушивали, затем измельчали до мелкодисперсного состояния при помощи мельниц Pulverisette 19 и Pulverisette 14. Полученный мелкодисперсный материал стерилизовали в герметичной упаковке радиационным методом дозой 14,6 кГр.
Исследование включало две группы экспериментов: 1) Изучение способности биломатрикса вызывать гиперчувствительность немедленного типа (ГНТ); исследование на мышах линии Balb/c, для выявления ГНТ использовали реакцию активной кожной анафилаксии. 2) Изучение способности биоматрикса вызывать гиперчувствительность замедленного типа (ГЗТ); исследование на морских свинках альбиносах с использованием метода максимального сенсибилизирующего воздействия.
Для исследования способности биоматрикса вызывать ГНТ материал непосредственно перед введением суспендировали в стерильном физиологическом растворе в концентрации 30 мг/мл. Исследование проводили на мышах линии Balb/c, каждая экспериментальная группа представлена десятью особями при равном соотношении по полу. Мышей сенсибилизировали трехкратно по схеме: 1-е введение – подкожно, 2-е и 3-е – через сутки – внутрикожно. Исследуемые суточные дозы – 0,3 мг и 3 мг на особь. Животные контрольных групп получали носитель по схеме введения объектов исследования. На 17 сутки после последней сенсибилизации проводили реакцию активной кожной анафилаксии (АКА) с целью выявления гиперчувствительности немедленного типа. При проведении реакции АКА мышам подопытных и контрольной групп на выстриженных участках боковой поверхности тела внутрикожно вводили разрешающую дозу суспензии биомтарикса в две точки, по 0,05 мл. На контрольном участке животным вводили 0,05 мл носителя. Через 20 минут мышам внутривенно инъецировали по 0,2 мл 1% раствора синего Эванса, спустя 30 минут животных подвергали эвтаназии и определяли наличие и размеры (в случае наличия) синего пятна экссудата на внутренней стороне кожи в месте введения РД (при положительной реакции диаметр пятна должен быть не менее 6 мм).
Анализ областей введения РД не выявил ни одного животного с положительной реакцией АКА (таблица 15). Экссудата, окрашенного синим Эванса, в местах введения разрешающих доз у мышей из групп опыта не наблюдали, так же как в группе контроля.
Таблица 15. Оценка реакции АКА после сенсибилизации мышей суспензией дезамидированного коллагенового биоматрикса.
доза (ТД)
Результат эксперимента свидетельствует об отсутствии у мышей гиперчувствительности немедленного типа к дезамидированному коллагеновому биоматриксу.
Во втором эксперименте исследовали способность биоматрикса вызывать ГЗТ у морских свинок. В исследовании использовали морских свинок альбиносов при равном соотношении по полу по 10 животных в группе. Для сенсибилизации использовали метод максимального сенсибилизирующего воздействия, который включает комбинированное введение исследуемого вещества (внутрикожное и накожные аппликации) в одной дозе/концентрации.
Для проведения сенсибилизации каждому животному на выстриженные участки кожи спины вводили внутрикожно в двух повторах, всего 6 точек: 1) полный адъювант Фрейнда (ПАФ) в смеси с физраствором в соотношении 1:1, 2) биоматрикс в дозе 3 мг (0,1 мл суспензии в физрастворе), 3) биоматрикс в смеси с ПАФ в соотношении 1:1 (контрольным животным в эту точку вводили физраствор в смеси с ПАФ). Объем каждой инъекции – 0,1 мл.
Через 7 дней после внутрикожного введения провели аппликацию биоматрикса в дозе 6 мг на межлопаточную область спины животных. За 24 часа до аппликаций участки кожи обрабатывали раствором 10 % лаурилсульфата (додецилсульфата) натрия в вазелине. Область аппликации накрывали стерильным кусочком марли в один слой, сверху – кусочком пищевой пленки и закрепляли фиксирующей повязкой, продолжительность аппликации – 48 часов. Контрольным животным проводили аппликацию физраствором.
Выявление ГЗТ проводили методом провокационной кожной пробы через 13 дней после завершения аппликации. Провокационную пробу наносили на кожу бока опытных и контрольных морских свинок, фиксирующая повязка закреплялась на 24 часа.
Реакцию кожи на провокационную пробу оценивали в соответствии с системой классификации реакции кожи (таблица 16) через 24 и 48 часов после снятия повязки.
Таблица 16. Система классификации реакции кожи (по классификации Magnusson и Kligman).
Дискретная или очаговая эритема
Умеренная и сплошная эритема
Интенсивная эритема и припухлость
1
2
3
Результаты оценки реакции кожи на провокационную пробу у подопытных животных не различалась: 0 баллов (нет видимых изменений) через 24 и 48 часов после экспозиции с провокационной пробой (таблица 17).
Таблица 17. Результаты тестирования морских свинок с целью выявления гиперчувствительности замедленного типа.
доза (ТД)
Результат эксперимента свидетельствует об отсутствии у морских свинок гиперчувствительности замедленного типа к дезамидированному коллагеновому биоматриксу.
По результатам проведенных экспериментов можно заключить, что дезамидированный коллагеновый биоматрикс не обладает аллергизирующим действием.
Пример 4
С целью производства изделий медицинского назначения дезамидированный коллагеновый биоматрикс производили по методике, полностью идентичной Примеру 2, толщиной 6,0-7,0 мм. Листы биоматрикса упаковывали по 1 кг в герметичную полиэтиленовую упаковку и замораживали при −15°С – −20°С. Материал использовали в качестве полупродукта для производства медицинских изделий.
Для производства абсобрирующих раневых покрытий, состоящих из дезамидированного коллагенового биоматрикса, листы извлекали из морозильной камеры, размораживали при комнатной температуре. Отбирали листы толщиной 6,0-7,0 мм. После этого листы укладывали на поддоны из нержавеющей стали, замораживали при −20°С и лиофильно высушивали при помощи сушки FREEZONE 2.5 Л (Labconco, США) в течение 24 часов. Высушенные листы в ламинарном шкафу разрезали при помощи резака на квадратные фрагменты, размером 3,5×3,5 см (Фиг. 5), предназначенные для использования непосредственно в качестве раневых покрытий. Оценивали абсорбирующую способность материала по разнице масс до и после инкубации в физиологическом растворе при 37°С. Абсорбирующая способность проанализированных образцов составила 302 ± 17 %. Фрагменты материала герметично упаковывали в двойные пакеты для стерилизации типа бумага/пленка, а затем стерилизовали радиационно с применением дозы 15,6 кГр. В результате были получены стерильные абсорбирующие раневые покрытия в герметичной первичной упаковке (Фиг. 6).
Доклинические испытания репаративных свойств полученных раневых покрытий проводили на модели эксцизионной полнослойной кожной раны у мышей.
Эксперимент проведен на самцах мышей линии Balb/C. Масса животных на момент начала эксперимента составила 22±2 г. Мышей содержали в индивидуальных пластиковых клетках на подстилке из стружки лиственных пород деревьев (ООО Мэст, Россия) при стандартных контролируемых значениях температуры и влажности, соблюдении равных по длительности (по 12 часов) светового и темнового периодов, а также при неограниченном доступе к питьевой воде и стандартному гранулированному корму для содержания лабораторных грызунов (ООО Мэст, Россия).
Для моделирования ран мышей наркотизировали Золетилом (Virbac, Франция) в количестве 40 мг/кг веса животного. Затем в межлопаточной области спины электрической машинкой сбривали шерсть и обрабатывали поверхность кожи 70% этиловым спиртом. При помощи скальпеля и хирургических ножниц удаляли со спины полнослойный кожный лоскут диаметром 0,7 см, создав, таким образом, раневой дефект. Непосредственно после нанесения, на раны животных опытной группы наносили фрагмент раневого покрытия, изготовленного из дезамидированного коллагеновго биомтарикса размером 1×1 см и накрывали сверху фиксирующей повязкой «Hydrofilm» (Paul Hartmann, Германия). На раны животных контрольной группы сразу наносили только фиксирующую повязку.
На 8-е сут заживления ран мышей выводили из эксперимента путем ингаляции CO2. После этого со спины животных иссекали полнослойный кожный лоскут, содержащий раневой дефект, и подвергали его качественному и количественному гистологическому исследованию. Для оценки интенсивности новообразования соединительной ткани в зоне раневого дефекта измеряли в мм2 площадь, занимаемую грануляционной тканью на срезе.
Результаты гистологического исследования показали, что раневые дефекты кожи всех мышей характеризовались наличием краевой эпителизации. Выраженные патологические изменения тканей интактной кожи, прилегающей к раневому дефекту, отсутствовали, за исключением наличия небольшой лейкоцитарной инфильтрации дермы, гиподермы и фасции Panniculus carnosus у большинства мышей, независимо от группы. Дно раневого дефекта у животных обеих групп было покрыто грануляционной тканью на всем его протяжении. При этом у контрольных мышей грануляционная ткань была преимущественно более развита по краям дефекта, нежели в центральной его части, тогда как у мышей, на раны которых накладывали раневое покрытие на основе дезамидированного коллагенового биоматрикса, грануляционная ткань была одинаково хорошо развита во всех областях раны (Фиг. 7). У животных из опытной группы наблюдали под струпом в небольшом количестве остатки раневого покрытия в виде слабобазофильных аморфных или сетчатых вкраплений.
Грануляционная ткань в ранах животных опытной группы была более зрелой, нежели в контроле. Это проявлялось в первую очередь в значительно большем количестве микрососудов, пронизывающих ткань (особенно капилляров), а также в большей доле фибробластов среди всех её клеточных элементов (Фиг. 8), определяемых на качественном уровне.
Морфометрическое исследование гистологических срезов ран выявило в среднем двукратное статистически достоверное увеличение площади грануляционной ткани у опытной группы животных по сравнению с контролем (Фиг. 9).
Полученные данные свидетельствуют о стимуляции заживления ран кожи при наложении на них абсорбирующих раневых покрытий на основе листов дезамидированного коллагенового биоматрикса.
Пример 5
Для производства инъекционного импланта на основе микрочастиц дезамидированного коллагенового биоматрикса, предназначенного для коррекции возрастных изменений кожи, листы дезамидированного коллагенового биоматрикса той же производственной серии, что и в примере 4, извлекали из морозильной камеры, размораживали при комнатной температуре. После этого материал листов биоматркиса обрабатывали по технологии, описанной в патенте РФ 2735176 C1: 1) при помощи роторно-ножевого измельчителя листы измельчали до волокнистых тяжей, 2) высушивали полученные тяжи дезамидированного коллагена в потоке воздуха до влажности менее 10%, 3) последовательно измельчали полученные тяжи сначала на мельнице со стригально-режущем типом помола, а затем на мельнице с ударно-истирающим типом помола, 4) извлекали полученный мелкодисперсный материал из сборного сосуда мельницы (Фиг. 10), расфасовывали по 0,15 г. в стеклянные флаконы, объемом 5 мл, герметично укупоривали резиновой пробкой и комбинированным колпачком из алюминия с легкосъемной полипропиленовой крышкой. Материал стерилизовали радиационно дозой 14,6 кГр (Фиг. 11).
На лабораторных животных исследовали эффективность полученного стерильного мелкодисперсного материала, состоящего из микрочастиц дезамидированного коллагенового биоматрикса, в модели фотостарения кожи у мышей.
Эксперимент проводили на самках мышей линии BALB/c nude. Для моделирования фотостарения кожи животных подвергали ультрафиолетовому облучению при помощи эритемной лампы ЛЭ-15А (люминесцентная ртутная низкого давления, ООО "НИИИС имени А.Н. Лодыгина", Россия) с излучением в эффективной области 285-380 нм. Животным интактной группы облучение не проводили. На 25 сутки по завершении курса облучения животным проводили инъекционное введение полученного мелкодисперсного материала на основе дезамидированного коллагенового биоматрикса, предварительно суспендированного непосредственно во флаконе в 5 мл стерильного физиологического раствора. Суспендированный материал отбирали в шприц и вводили в кожу спины внутрикожно папульной техникой. Животным контрольной группы инъекций не проводили.
На 7 сутки после введения животных выводили из эксперимента с помощью методом ингаляции углекислым газом с последующим обескровливанием полостей сердца. После этого отбирали фрагмент кожного лоскута спины в области введения материала и подвергали его гистологическому исследованию. Проводили морфометрический анализ гистологических препаратов, в ходе которого оценивали толщину дермы, толщину эпидермиса, выраженность гиперкератоза и воспаления, а также относительную площадь коллагеновых волокон на срезе.
Количественное гистологическое исследование показало, что ультрафиолетовое облучение вызывает в коже морфологические изменения, характерные для стареющей кожи человека: повышается толщина эпидермиса и дермы, развивается воспаление, гиперкератоз, снижается относительная площадь коллагена (таблица 17). В то же время инъекционное введение микрочастиц дезамидированного коллагенового биоматрикса приводит к статистически значимому снижению толщины дермы, уменьшению выраженности гиперкератоза и воспаления, значительному повышению относительной площади коллагена (таблица 18).
Таблица 18. Результаты количественного гистологического исследования тканей кожи мышей. Звездочкой отмечены значения, статистически достоверно отличающееся от группы контроля (p < 0,05)
Полученные данные подтверждают наличие терапевтической эффективности инъекционного введения мелкодисперсного материала на основе микрочастиц дезамидированного коллагенового матрикса при применении его для коррекции старческих изменений кожных покровов.
Пример 6
Для проведения сравнительного исследования характеристик получали биоматериалы, применяя различные способы. В качестве исходного биологического сырья использовали идентичные свежеснятые («парные») шкуры крупного рогатого скота.
Производили 3 типа биоматериалов:
1) Дезамидированный коллагеновый биоматрикс по настоящему изобретению. Для его изготовления шкуры подвергали отмоке в 1% водном растворе кальцинированной соды, содержащим 0,2% Tween 80 в течение 5 часов. Затем шкуры переносили в водный раствор 0,2 М гидроксида кальция и 0,2 М сернистого натрия Материал обрабатывали при перемешивании в течение 16 часов. После этого шкуры подвергали мездрению, удаляли слои, содержащие остатки волосяных луковиц и жировой ткани, разделяли на листы прямоугольной формы. Материал помещали в буферный раствор, состоящий из тетрабората натрия, фосфорнокислого калия и каустической соды, имеющий pH 9,0, и выдерживали в течение 4 суток, оставляя в ночное время на 2-8°С. На следующем этапе листы обработанной дермы заливали водным раствором каустической соды и сернокислого натрия в концентрациях 2,0 и 1,0 М, соответственно. Материал выдерживали в растворе в течение 15 часов при периодическом перемешивании. Обработанный материал последовательно отмывали 1,0 М водным раствором сернокислого натрия, 0,02 М водным раствором борной кислоты и очищенной водой до достижения pH водной вытяжки значения 7,6. По окончании обработки получали листы дезамидированного коллагенового биоматрикса, толщина которых находилась в диапазоне 6,0-7,0 мм.
2) Коллагеновую матрицу по способу, описанному в патенте РФ 2353397. Для её изготовления шкуры механически очищали от волосяного покрова и подкожной жировой клетчатки, промывали проточной водой, разрезали на квадратные пластины и последовательно обрабатывали водно-щелочным раствором, содержащим 0,1 М гидроксида натрия, 0,2 М калия дигидрофосфата и 0,2 М тетраборнокислого натрия при температуре 5°С, затем обрабатывали материал водным раствором 1,0 М сульфата натрия и 2,0 М гидроксида натрия в течение 15 часов при периодическом взбалтывании, помещая на 8 часов в холодильник при 6°С. После этого помещали материал в водный 1,0 М раствор сульфата натрия на 1 сутки, а затем в 0,02 М водный раствор борной кислоты на 1 сутки проводя на обоих этапах периодическое взбалтывание и оставляя в холодильнике при 6°С в ночное время. На заключительном этапе отмывали материал дистиллированной водой до достижения pH промывных вод значения 7,0. По окончании обработки получали коллагеновую матрицу, толщина которой варьировала в диапазоне 5,0-7,0 мм.
3) Коллагеновый материал, подвергнутый обработке дезамидирующим раствором, описанной в патенте РФ 2739565. Для его изготовления шкуры механически очищали от волосяного покрова и подкожной жировой клетчатки, разрезали на прямоугольные фрагменты. С целью анализа зависимости уровня дезамидирования от толщины материала при помощи двоильной машины из указанных фрагментов получали пластины различной толщины, а именно 0,5, 1,0, 2,0, 4,0 мм. Полученные пластины обрабатывали водным 2,0 М раствором гидроокиси натрия при комнатной температуре в течение 36 часов. После этого материал отмывали водой до достижения значения pH промывной воды 7,4.
Для сравнительного исследования образцы всех полученных биоматериалов, а также дермы до обработки анализировали по показателям «содержание амидного азота», «содержание коллагена», «содержание дцДНК», «содержание сульфатированных гликозаминогликанов», «содержание эластина», «содержание жира», «содержание воды» по методикам, полностью идентичным тем, что использовали для анализа биоматрикса в примере 1.
Результаты проведенного исследования (таблица 19) показали, что применение способа получения дезамидированного коллагенового биоматрикса по настоящему изобретению вызывало наиболее выраженное дезамидирование боковых групп аминокислотных остатков коллагена, определяемое по содержанию амидного азота, по сравнению с другими материалами, а также обеспечивало высокий уровень очистки от различных неколлагеновых компонентов. Сопоставимый, хотя и несколько больший, уровень содержания амидного азота среди всех образцов сравнения наблюдался (таблица 19) только в образцах коллагенового материала, дезамидированного по РФ 2739565, наименьшей толщины (0,5 мм). При этом использование данного метода обеспечивало удовлетворительную очистку от клеточных компонентов, жира и неколлагеновых белков волокнистого внеклеточного матрикса. В то же время содержание сульфатированных гликозаминогликанов в данных образцах было наибольшим среди всех коллагеновых материалов (таблица 19). В свою очередь, коллагеновая матрица по патенту РФ 2353397 характеризовалась наименьшим уровнем дезамидирования и наибольшим содержанием жира при высоком уровне очистки от клеточных компонентов, компонентов аморфного и волокнистого внеклеточного матрикса (таблица 19).
Таблица 19. Физико-химические показатели коллагеновых материалов.
Далее анализировали абсорбирующие свойства раневых покрытий, получаемых из произведенных коллагеновых материалов различных типов. Для этого готовили раневые покрытия на основе лиофильно-высушенных листов полученных материалов по методике, полностью аналогичной методике, описанной в примере №4.
Для оценки абсорбирующих свойств фрагменты полученных покрытий площадью 1 см2 инкубировали в физиологическом растворе при +37○С в течение 1 часа. По разнице масс материалов до и после инкубации рассчитывали абсорбирующую способность образцов в граммах абсорбированной жидкости на см2 материала.
Проведенный анализ показал, что абсорбирующее раневое покрытие, изготовленное на основе дезамидированного коллагенового биоматрикса по настоящему изобретению более чем в два раза превосходит покрытия на основе коллагеновых материалов сравнения (таблица 20).
Таблица 20. Абсорбирующие свойства раневых покрытий, изготовленных из различных коллагеновых материалов.
Пример 7
Для демонстрации влияния толщины обрабатываемых листов коллагенового материала на показатели содержания волокнистых микрочастиц при их измельчении с применением метода ударно-истирающего помола получали листы дезамидированного коллагенового биоматрикса по методике, полностью идентичной изложенной в примере 2. Затем на двоильной машине (Camoga, Италия) разрезали полученные листы продольно, получая пластины толщиной 0,5, 1,0, 2,0, 3,0, 4,0, 5,0 мм. Толщина исходных образцов находилась в диапазоне 6,0-7,0 мм. После этого пластины каждой группы отдельно обрабатывали: 1) при помощи роторно-ножевого измельчителя измельчали до волокнистых тяжей, 2) высушивали полученные тяжи дезамидированного коллагена в потоке воздуха до влажности 8%, 3) последовательно измельчали полученные тяжи сначала на мельнице Pulverisette 19 (Fritsch, Германия) при диаметре отверстий вставного сита в 500 мкм, а затем на мельнице с ударно-истирающим типом помола Pulverisette 14 (Fritsch, Германия) с установленным вставным кольцевым ситом с диаметром отверстий 120 мкм.
Полученные образцы исследовали методом световой микроскопии. Для этого 10 мг пробы каждого измельченного материала суспендировали в минеральном масле на вортексе в течение 5 минут, затем 50 мл полученной суспензии переносили на предметное стекло для микроскопии и заключали под покровное стекло. Полученные препараты анализировали при помощи микроскопа NikonNi-U (Nikon, Япония), используя объектив 40х. Используя цифровую камеру Nikon DS-Fi1 (Nikon, Япония), получали микрофотографии такого количества полей зрения препарата, чтобы на них содержалось не менее 300 частиц. Затем при помощи программы imageJ (NIH, США) проводили морфометрический анализ частиц на микрофотографиях: измеряли длину и ширину частиц в поле зрения, а затем для каждой частицы рассчитывали отношение длины к ширине. После измерения частиц на всех полях зрения рассчитывали долю волокнистых частиц в образце, которыми считали частицы, имеющие отношение длины к ширине не менее 4.
Результаты количественного микроскопического исследования показали, что в результате измельчения биоматрикса, толщиной 0,5 мм был получен мелкодисперсный материал, содержащий 35,1% волокнистых частиц (Фиг. 12). В то же время при увеличении толщины биомтарикса до 1,0 мм, доля волокнистых частиц в образце резко возрастала до 70,2%. При дальнейшем увеличении толщины биоматрикса, относительное количество волокнистых частиц медленно росло, достигая 79,0% в случае исходных образцов, толщиной 6-7 мм (Фиг. 12). Вероятно, данный эффект достигается за счет различных микроупругих свойств пучков волокон коллагена в образцах различной толщины, что оказывает влияние на характер измельчения при ударно-истирающем помоле.
Далее оценивали влияние содержания волокнистых микрочастиц на эргономические свойства мелкодисперсных материалов, под которым подразумевали скорость и равномерность суспендирования в физиологическом растворе (гидратации) с целью приготовления формы, предназначенной для инъекционного введения. Для этого образцы материала вносили по 0,1 г в стеклянные флаконы, укупоренные резиновыми пробками и алюминиевым колпачком. При помощи шприца с иглой через крышку вносили в каждый флакон по 4 мл физраствора. Флаконы встряхивали, после этого засекали время, визуально наблюдали и фиксировали момент достижения суспензии материала полной гомогенности, повторяя встряхивание каждые 5 минут.
Проведенный анализ выявил, что полное равномерное суспендирование материала, полученного из биомтарикса толщиной 0,5 мм, достигалось в течение 19 минут (таблица 21), тогда как образцы с большей долей волокнистых частиц характеризовались значительно меньшим временем суспендирования, находящимся в диапазоне 9-11 минут (таблица 21), что свидетельствует об улучшении эргономических свойств материалов при увеличении доли волокнистых микрочастиц в их составе.
Таблица 21. Время достижения полного равномерного суспендирования образцов мелкодисперсных материалов, полученных из биоматриксов различной толщины.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТАТИВНО УСТОЙЧИВЫХ КОЛЛАГЕНОВЫХ МАТЕРИАЛОВ | 2019 |
|
RU2739565C1 |
| ДЕРМА НАТУРАЛЬНОЙ КОЖИ И МЕХОВОГО ПОЛУФАБРИКАТА И СПОСОБЫ ИХ ВЫРАБОТКИ | 2002 |
|
RU2206620C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНА ИЗ ОТХОДОВ КОЖЕВЕННОГО ПРОИЗВОДСТВА | 2000 |
|
RU2173709C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОВОЙ ГУБКИ | 1993 |
|
RU2039766C1 |
| ПОЛУЧЕНИЕ ТРАНСПЛАНТАТА ИЗ ДЕРМЫ ЖИВОТНОГО С ПРИМЕНЕНИЕМ РАСТВОРА СУЛЬФИДА НАТРИЯ | 2012 |
|
RU2575831C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ КОЛЛАГЕНОВОЙ УКУПОРОЧНОЙ МЕМБРАНЫ ИЗ СВИНОЙ ШКУРЫ | 2000 |
|
RU2267933C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОВОГО БЕЛКА ИЗ СЫРЬЯ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ, КОЛЛАГЕНОВЫЕ ПРОДУКТЫ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2015 |
|
RU2609635C1 |
| ПРЯЖА ИЗ КОЛЛАГЕНОВОГО ВОЛОКНА ЖИВОТНОЙ КОЖИ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2005 |
|
RU2383665C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОВОЙ СУБСТАНЦИИ ИЗ СЫРЬЯ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ (ВАРИАНТЫ) | 2013 |
|
RU2551195C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТОГО ВЛАГОЕМКОГО МАТЕРИАЛА НА КОЛЛАГЕНОВОЙ ОСНОВЕ | 2021 |
|
RU2760326C1 |



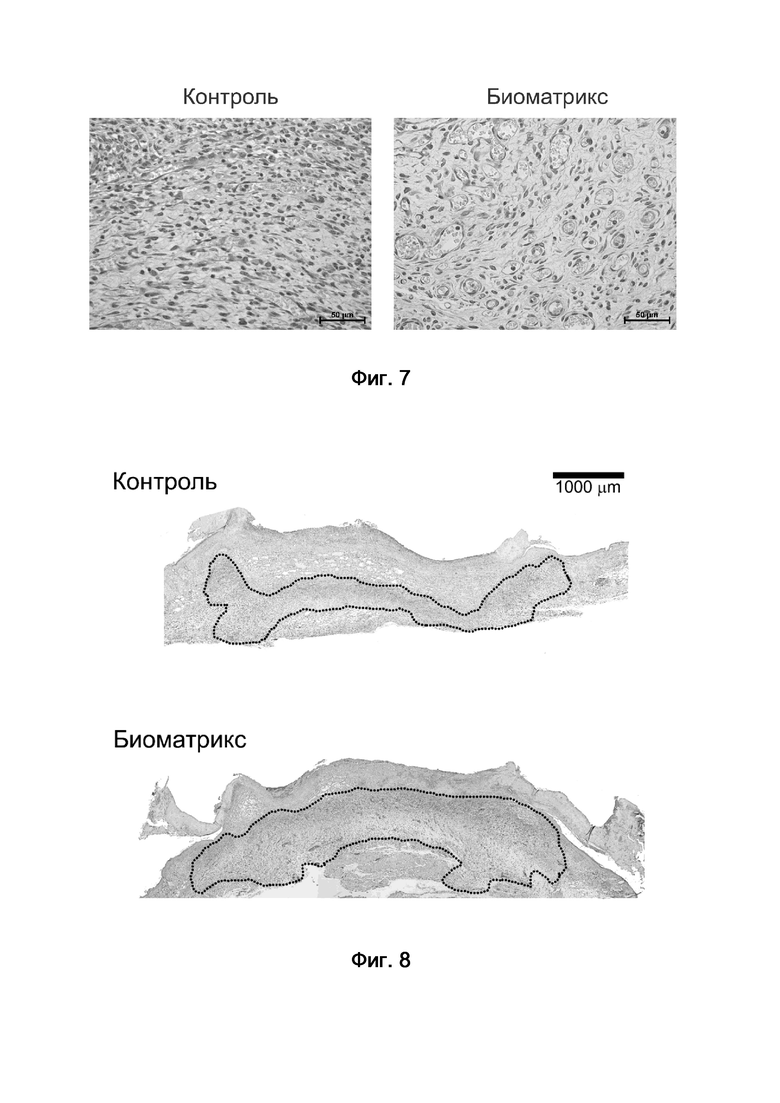
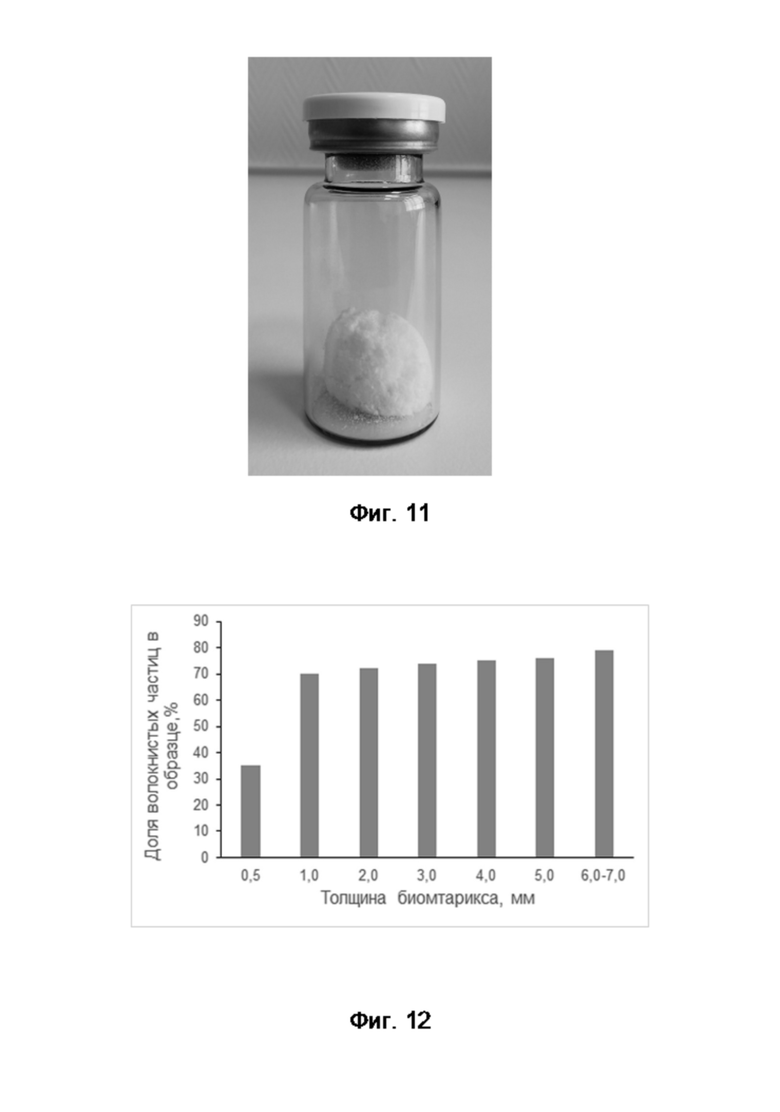
Изобретение относится к области биотехнологии, медицины и косметологии. Дезамидированный коллагеновый биоматрикс в форме цельного волокнистого листа дермы кожи крупного рогатого скота характеризуется содержанием амидного азота в количестве не более 1,3 мг на 1 г сухой массы, коллагена не менее 90% на сухую массу, эластина не более 6% на сухую массу, сульфатированных гликозаминогликанов не более 0,2 мкг/мг сухой массы, жира не более 0,5 % на сухую массу, воды не менее 60% по массе и имеет толщину не менее 1 мм. Способ получения дезамидированного коллагенового биоматрикса в форме цельного волокнистого листа дермы кожи крупного рогатого скота включает: а) отмоку шкур в растворе кальцинированной соды, б) обработку шкур водным раствором, содержащим гидроксид кальция и сернистый натрий, в) удаление слоя, содержащего остатки волосяных луковиц, мездрение, нарезку на листы, удаление остатков волосяных луковиц и мездры, г) обработку листов водным раствором, содержащим каустическую соду и сернокислый натрий, д) последовательную отмывку полученных дезамидированных листов от щелочи в растворе электролита, в растворе неорганической кислоты, в воде или буферном растворе. Предлагаемый дезамидированный коллагеновый биоматрикс в форме цельного волокнистого листа обладает высокой степенью дезамидирования боковых групп аминокислотных остатков, имеет сохраненную структуру молекул коллагена, высокие технологические характеристики, характеризуется отсутствием цитотоксичности, локальной и системной токсичности, имеет высокую биологическую совместимость, подходит для создания широкого спектра биомедицинских материалов и продуктов, а также использования в косметологии и пищевой промышленности. 2 н. и 13 з.п. ф-лы, 21 табл., 12 ил., 7 пр.
1. Дезамидированный коллагеновый биоматрикс в форме цельного волокнистого листа дермы кожи крупного рогатого скота, характеризующийся содержанием амидного азота в количестве не более 1,3 мг на 1 г сухой массы, коллагена не менее 90% на сухую массу, эластина не более 6% на сухую массу, сульфатированных гликозаминогликанов не более 0,2 мкг/мг сухой массы, жира не более 0,5% на сухую массу, воды не менее 60% по массе и имеющий толщину не менее 1 мм.
2. Способ получения дезамидированного коллагенового биоматрикса в форме цельного волокнистого листа дермы кожи крупного рогатого скота по п.1, включающий:
а) отмоку шкур в растворе кальцинированной соды,
б) обработку шкур водным раствором, содержащим гидроксид кальция и сернистый натрий,
в) удаление слоя, содержащего остатки волосяных луковиц, мездрение, нарезку на листы, удаление остатков волосяных луковиц и мездры,
г) обработку листов водным раствором, содержащим каустическую соду и сернокислый натрий,
д) последовательную отмывку полученных дезамидированных листов от щелочи в растворе электролита, в растворе неорганической кислоты, в воде или буферном растворе с получением дезамидированного коллагенового матрикса в форме цельного волокнистого листа с содержанием амидного азота в количестве не более 1,3 мг на 1 г сухой массы, коллагена не менее 90% на сухую массу, эластина не более 6% на сухую массу, сульфатированных гликозаминогликанов не более 0,2 мкг/мг сухой массы, жира не более 0,5% на сухую массу, воды не менее 60% по массе, имеющего толщину не менее 1 мм.
3. Способ по п. 2, отличающийся тем, что перед выдерживанием шкур в растворе кальцинированной соды проводят их предварительную подготовку, включающую в себя удаление бахромистых участков по краям шкур и участков шкур, покрывающих конечности.
4. Способ по пп. 2 и 3, отличающийся тем, что предварительная подготовка шкуры животных перед выдерживанием в растворе кальцинированной соды включает дополнительно раскрой шкуры на участки прямоугольной формы – полы, воротковую и чепрачную части.
5. Способ по п. 2, отличающийся тем, что водный раствор кальцинированной соды для отмоки шкур имеет значение pH в интервале 7-9.
6. Способ по п. 2, отличающийся тем, что водный раствор кальцинированной соды для отмоки шкур содержит поверхностно-активные вещества.
7. Способ по п. 2, отличающийся тем, что обработку шкур водным раствором, содержащим гидроксид кальция и сернистый натрий, проводят при периодическом перемешивании.
8. Способ по п. 2, отличающийся тем, что после обработки водным раствором, содержащим гидроксид кальция и сернистый натрий, проводят мездрение и нарезку обработанной шкуры на листы квадратной или прямоугольной формы.
9. Способ по п. 2, отличающийся тем, что листы, на которые нарезают обработанную шкуру после мездрения, характеризуются влажностью не менее 50%, толщиной не менее 2,5 мм, значением pH водных вытяжек 9-11.
10. Способ по п. 2, отличающийся тем, что перед обработкой водным раствором каустической соды и сернокислого натрия листы шкур дополнительно обрабатывают водными буферными солевыми растворами, имеющими значение рН в диапазоне 8-9.
11. Способ по п.2, отличающийся тем, что обработку водным раствором каустической соды и сернокислого натрия проводят при периодическом перемешивании, периодической смене раствора и охлаждении до температуры 2-8°С.
12. Способ по п.2, отличающийся тем, что отмывку листов от щелочи на первом этапе проводят водным раствором сульфата натрия в концентрации 0,5-2,0 М, наиболее предпочтительно 1,1-1,4 М в течение 8-32 часов при массовом соотношении раствора к обрабатываемому материалу не менее 1,0 : 1,0 при периодической смене растворов и периодическом перемешивании.
13. Способ по п.2, отличающийся тем, что отмывку листов от щелочи на втором этапе проводят водным раствором борной кислоты в концентрации от 0,6 М до концентрации насыщенного раствора при массовом соотношении раствора к обрабатываемому материалу не менее 1,0 : 1,0 при периодической смене растворов и перемешивании.
14. Способ по п.2, отличающийся тем, что отмывку листов от щелочи на заключительном этапе проводят 0,01М фосфатно-солевым буфером.
15. Способ по п.2, отличающийся тем, что полученные после отмывки от щелочи листы дезамидированного коллагенового биоматрикса замораживают с целью хранения.
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТАТИВНО УСТОЙЧИВЫХ КОЛЛАГЕНОВЫХ МАТЕРИАЛОВ | 2019 |
|
RU2739565C1 |
| БИОРАССАСЫВАЕМАЯ КОЛЛАГЕНОВАЯ МАТРИЦА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2007 |
|
RU2353397C2 |
| Способ выработки кожи | 1990 |
|
SU1805133A1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРЕЛОМОВ ПЯТОЧНОЙ КОСТИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2002 |
|
RU2238051C2 |
| СПОСОБ ВЫРАБОТКИ КОНСЕРВОВ "КОТЛЕТЫ РЫБНЫЕ В ТОМАТНОМ СОУСЕ" | 2013 |
|
RU2514844C1 |
| Станок для изготовления коленчатых валов путем изгибания | 1931 |
|
SU29103A1 |
| Гидравлический привод к тормозу бурильной лебедки | 1938 |
|
SU59265A1 |
| US 5336616 A, 09.08.1994 | |||
| M | |||
| RADHIKA AND P | |||
| K | |||
| SEHGAL "Studies on the desamidation of bovine collagen", Journal of Biomedical Materials Research, Volume 35, Issue | |||
Авторы
Даты
2023-12-12—Публикация
2023-10-26—Подача