ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области иммунотерапии опухолей, в частности относится к гуманизированному моноклональному антителу, которое связывается с VEGF.
УРОВЕНЬ ТЕХНИКИ
Развитие сосудистой системы лежит в основе многих физиологических и патологических процессов. Фактор роста эндотелия сосудов (VEGF) представляет собой группу факторов роста, обладающих важной проангиогенной активностью, которые способствуют митозу эндотелиальных клеток и антиапоптозу, увеличивают проницаемость сосудов и способствуют миграции клеток. Ген VEGF человека локализован на хромосоме 6р21.3 и принадлежит к семейству супергенов VEGF/PDGF, которое кодирует VEGF, связанные дисульфидными связями в форме димера. У людей семейство VEGF включает несколько членов с разными функциями: VEGFA (VEGF, с несколькими различными вариантами сплайсинга), VEGFB, VEGFC, VEGFD, VEGFE, VEGFF, и плацентарный фактор роста (PIGF). Недавно в это семейство был также включен сосудистый эндотелиальный фактор роста эндокринных желез (EG-VEGF). (Samson М и др., J Clin Endocrinol Metab. 2004; 89(8):4078-4088). VEGF широко распространен в тканях и органах человека, среди которых клетки пигментного эпителия сетчатки глаза, эндотелиальные клетки сосудов, нервные клетки и т.д. (Goel Н L и др., Nat Rev Cancer. 2013; 13(12): 871). Существует три типа рецепторов VEGF: VEGFR1, VEGFR2 и VEGFR3. Связывание VEGF с внеклеточным доменом рецептора запускает димеризацию рецептора и способствует аутофосфорилированию остатков тирозина во внутриклеточном домене, тем самым активируя нижестоящие сигналы, которые способствуют клеточной пролиферации, миграции, антиапоптозу и повышению проницаемости сосудов. VEGFR1 и VEGFR2 экспрессируются главным образом в сосудистых эндотелиальных клетках, a VEGFR3 в основном экспрессируется в лимфатических эндотелиальных клетках.
Было подтверждено, что VEGF играет важную роль в регуляции нормального и патологического ангиогенеза (Melincovici С S и др., Rom J Morphol Embryol. 2018; 59(2): 455-467). VEGF сверхэкспрессируется в различных опухолях, которые могут вызывать злокачественный асцит, и экспрессия VEGF в опухолях коррелирует с миграционной способностью опухолевых клеток. Концентрация VEGF у пациентов с солидными опухолями с более низкой выживаемостью, такими как рак желудочно-кишечного тракта, яичников, молочной железы и легких, положительно коррелирует со стадией заболевания (Sebastian, К и др., Oncologist. 2009; 14(12): 1242 -1251). Гипоксические условия в микроокружении опухоли индуцируют проникновение фактора транскрипции опухолевых клеток HIF-1a в ядро, затем HIF-1a связывается с HRE-элементом VEGFA, тем самым повышается уровень транскрипции VEGFA и стимулируется секреция опухолевыми клетками большого количества VEGF в микроокружение опухоли. В свою очередь, высокая концентрация VEGF воздействует на VEGFR эндотелиальных клеток сосудов, индуцируя большое количество неоваскуляризации, усиливая кровоснабжение и обеспечивая достаточное количество питательных веществ для роста опухолевых клеток. Из быстрорастущих опухолевых клеток секретируется больше VEGF, что дополнительно способствует пролиферации и миграции эндотелиальных клеток сосудов и вызывает метастазирование опухоли. Дополнительно VEGF также стимулирует превращение моноцитов в опухолевых тканях в макрофаги-супрессоры М2, продуцирующие больше негативных иммунных факторов и одновременно активирующие Treg-клетки, что синергетически снижает поражающую способность Т-клеток.
Ингибируя взаимодействие VEGF с рецепторами поверхности эндотелиальных клеток VEGFR2 и VEGFR1, моноклональное антитело против VEGF блокирует нижестоящие сигнальные пути, ингибирует пролиферацию эндотелиальных клеток и неоваскуляризацию, лишает опухолевые ткани кровоснабжения и контролирует внутреннее снабжение опухолей питательными веществами, тем самым ограничивая рост опухоли и в конечном итоге достигая противоопухолевой эффективности. Авастин (бевацизумаб, разрешен к применению 2009) является первым препаратом антитела, одобренным для ингибирования ангиогенеза опухоли, и в основном используется для лечения рака молочной железы, рака шейки матки, рака толстой и прямой кишки, глиобластомы, глиомы, немелкоклеточного рака легких, рака яичников и почечно-клеточной карциномы. Хотя Авастин использовали для лечения различных видов рака, в этой области все еще существует потребность в более мощных антителах с более сильным ингибированием VEGF и более высокой эффективностью.
Настоящее изобретение обеспечивает новое антитело человека против VEGF для лечения рака толстой и прямой кишки.
Краткое описание
В одном аспекте настоящее изобретение обеспечивает изолированное антитело против VEGF или его антиген-связывающий фрагмент, содержащий вариабельный участок тяжелой цепи, содержащий участок CDR1 тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 30, участок CDR2 тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 31, и участок CDR3 тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 32; и вариабельный участок легкой цепи, содержащий участок CDR1 легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 27, участок CDR2 легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 28, и участок CDR3 легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 29.
В одном варианте реализации указанное антитело против VEGF или его антиген-связывающий фрагмент содержит вариабельный участок тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 39, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности SEQ ID NO: 39; и вариабельный участок легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 40, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности SEQ ID NO: 40.
В одном варианте реализации указанное антитело дополнительно включает константный участок легкой цепи и константный участок тяжелой цепи, предпочтительно указанный константный участок легкой цепи представляет собой указанный константный участок легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 42, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности SEQ ID NO: 42; и/или указанный константный участок тяжелой цепи представляет собой IgG1 константный участок тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 41, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности SEQ ID NO:41.
В одном варианте реализации указанное антитело против VEGF или его антиген-связывающий фрагмент представляет собой антитело IgG, предпочтительно антитело IgG1.
В одном варианте реализации указанное антитело против VEGFR или его антиген-связывающий фрагмент представляет собой моноклональное антитело.
В одном варианте реализации аффинность связывания KD указанного антитела против VEGF или его антиген-связывающего фрагмента к рекомбинантному белку VEGF165 человека составляет 1-100 рМ, предпочтительно 5-50 рМ, и более предпочтительно 19,5 рМ.
В одном варианте реализации указанный антиген-связывающий фрагмент представляет собой Fv, Fab, Fab', Fab'-SH, F(ab')2, фрагмент Fd, фрагмент Fd', молекулу одноцепочечного антитела или однодоменное антитело; при этом указанная молекула одноцепочечного антитела предпочтительно представляет собой scFv, ди-scFv, три-scFv, диатело или scFab.
В другом аспекте настоящее изобретение обеспечивает конъюгат антитела и лекарственного средства, содержащий указанное антитело против VEGF или его антиген-связывающий фрагмент, описанный в настоящем документе и дополнительный терапевтический агент, предпочтительно указанное антитело против VEGF или его антиген-связывающий фрагмент связано с указанным дополнительным терапевтическим агентом посредством связующего звена.
В одном аспекте настоящее изобретение обеспечивает изолированное антитело против VEGF или его антиген-связывающий фрагмент, содержащий вариабельный участок тяжелой цепи, содержащий участок CDR1 тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 16, и участок CDR2 тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 17, и участок CDR3 тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 18; и вариабельный участок легкой цепи, содержащий участок CDR1 легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 13, участок CDR2 легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 14, и участок CDR3 легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 15.
В одном варианте реализации указанное антитело против VEGF или его антиген-связывающий фрагмент включает константный участок тяжелой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 25, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98%, или 99% последовательности SEQ ID NO: 25; и вариабельный участок легкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 26, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности SEQ ID NO: 26.
В одном варианте реализации указанное антитело против VEGF или его антиген-связывающий фрагмент представляет собой гуманизированное антитело или химерные антитело.
В другом аспекте настоящее изобретение обеспечивает нуклеиновую кислоту, кодирующую указанное антитело против VEGF или его антиген-связывающий фрагмент, описанный в настоящем документе.
В одном варианте реализации указанная нуклеиновая кислота включает последовательность нуклеотидов, указанную в SEQ ID NO: 7, и/или последовательность нуклеотидов, указанную в SEQ ID NO: 8; или включает последовательность нуклеотидов, указанную в SEQ ID NO: 23, и/или последовательность нуклеотидов, указанную в SEQ ID NO: 24; или включает последовательность нуклеотидов, указанную в SEQ ID NO: 47 и/или последовательность нуклеотидов, указанную в SEQ ID NO: 48.
В другом аспекте настоящее изобретение обеспечивает вектор экспрессии, содержащий указанную нуклеиновую кислоту, описанную в настоящем документе.
В другом аспекте настоящее изобретение обеспечивает клетку-хозяина, содержащую указанную нуклеиновую кислоту, описанную в настоящем документе или указанный вектор экспрессии, описанный в настоящем документе.
В другом аспекте настоящее изобретение обеспечивает способ получения указанного антитела против VEGF или его антиген-связывающий фрагмент, описанный в настоящем документе, включающий выращивание указанной клетки-хозяина, описанной в настоящем документе, в условиях, подходящих для экспрессии антитела, и выделения экспрессированного антитела из культуральной жидкости.
В другом аспекте настоящее изобретение обеспечивает фармацевтическую композицию, содержащую указанное антитело против VEGF или его антиген-связывающий фрагмент, описанный в настоящем документе, или указанный конъюгат антитела и лекарственного средства, описанный в настоящем документе, или нуклеиновую кислоту, описанную в настоящем документе, или указанный вектор экспрессии, описанный в настоящем документе, и фармацевтически приемлемый носитель.
В одном варианте реализации настоящее изобретение обеспечивает указанное антитело против VEGF или его антиген-связывающий фрагмент, описанный в настоящем документе, или конъюгат антитела и лекарственного средства, описанный в настоящем документе, или фармацевтическую композицию, описанную в настоящем документе, для применения в лечении рака толстой и прямой кишки.
В другом аспекте настоящее изобретение обеспечивает способ лечения рак толстой и прямой кишки, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества указанного антитела против VEGF или его антиген-связывающего фрагмента, описанного в настоящем документе, или конъюгата антитела и лекарственного средства, описанного в настоящем документе, или фармацевтической композиции, описанной в настоящем документе.
В другом аспекте настоящее изобретение обеспечивает применение указанного антитела против VEGF или его антиген-связывающего фрагмента, описанного в настоящем документе или конъюгата антитела и лекарственного средства, описанного в настоящем документе или фармацевтической композиции, описанной в настоящем документе в получении лекарственного средства для лечения рака толстой и прямой кишки.
В другом аспекте настоящее изобретение обеспечивает фармацевтическую комбинацию, содержащую антитело против VEGFR2 или его антиген-связывающий фрагмент, описанный в настоящем документе, или конъюгат антитела и лекарственного средства, описанный в настоящем документе, или фармацевтическую композицию, описанную в настоящем документе, и один или более других терапевтических агентов.
В другом аспекте настоящее изобретение обеспечивает набор, содержащий антитело против VEGF или антиген-связывающий фрагмент, описанный в настоящем документе, или конъюгат антитела и лекарственного средства, описанный в настоящем документе, или фармацевтическую композицию, описанную в настоящем документе, предпочтительно, дополнительно содержащий устройство для введения.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Настоящее изобретение проиллюстрировано в комбинации с приложенными рисунками, в которых:
На Фиг. 1 продемонстрировано, что антитело кролика против VEGF165 блокирует связывание VEGF165 с белком VEGFR2.
На Фиг. 2 продемонстрировано, что антитело кролика против VEGF165 нейтрализует пролиферацию HUVEC, вызванную VEGF165.
На Фиг. 3 продемонстрировано связывание гуманизированного антитела VEGF165-H988 с VEGF165, обнаруженное с помощью ИФА.
На Фиг. 4 продемонстрировано связывание гуманизированного антитела VEGF165-H988 с mVEGF165, обнаруженное с помощью ИФА.
На Фиг. 5 продемонстрировано, что указанное антитело VEGF-H988 блокирует связывание VEGF165 с белком VEGFR2, обнаруженное с помощью ИФА.
На Фиг. 6 продемонстрирован эффект антитела VEGF-H988 по нейтрализации VEGF165 при различных концентрациях.
На Фиг. 7 продемонстрирован эффект VEGF-H988 по нейтрализации пролиферации клеток HUVEC, вызванной VEGF165, VEGFC и VEGFD.
На Фиг. 8 продемонстрирована кривая зависимости средней концентрации в крови от времени для группы мышей G2, инъецированных VEGF-H988 (50 мг/кг) внутрибрюшинно.
На Фиг. 9 продемонстрирована кривая зависимости средней концентрации в крови от времени для группы мышей G4, инъецированных VEGF-H988 (50 мг/кг) внутрибрюшинно.
На Фиг. 10 продемонстрирована кривая зависимости средней концентрации в крови от времени для групп мышей G2 и G4, инъецированных VEGF-H988 (50 мг/кг) внутрибрюшинно.
На Фиг. 11 продемонстрировано сравнение эффективности VEGF-H988 и контрольного лекарственного средства в ксенотрансплантатной модели рака толстой и прямой кишки человека с линией клеток НСТ-116.
На Фиг. 12 продемонстрировано сравнение эффективностей VEGF-H988 и контрольного лекарственного средства в ксенотрансплантатной модели рака толстой и прямой кишки человека с линией клеток НСТ-116.
ПОДРОБНОЕ ОПИСАНИЕ
Различные аспекты настоящего изобретения относятся к изолированному антителу против VEGF или его антиген-связывающий фрагменту, конъюгату антитела и лекарственного средства, содержащему указанное антитело или его антиген-связывающий фрагмент, нуклеиновой кислоте и вектору экспрессии, кодирующему указанное антитело или его антиген-связывающий фрагмент, и клетке-хозяину, содержащей указанную нуклеиновую кислоту или вектор экспрессии, способ получения указанного антитела против VEGF или его антиген-связывающего фрагмента, фармацевтической композиции, содержащей указанное антитело против VEGF или его антиген-связывающий фрагмент, и способу применения указанного антитела против VEGF или его антиген-связывающего фрагмента для лечения рака толстой и прямой кишки.
Определения
Если не указано иное, все используемые здесь технические и научные термины имеют значения, обычно понятные специалистам в данной области техники, к которой относится настоящее изобретение. Для целей настоящего изобретения следующие термины определяются в соответствии со значениями, обычно понимаемыми в данной области техники.
При использовании в настоящем описании и в прилагаемой формуле изобретения формы единственного числа «один», «другой» и «указанный» включают обозначение объекта во множественном числе, если контекст явно не указывает на иное.
Термин «антитело» относится к молекуле иммуноглобулина и относится к любой форме антитела, которая проявляет желаемую биологическую активность. К ним относятся, моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и мультиспецифические антитела (например, биспецифические антитела), и даже фрагменты антитела, но не ограничиваются ими. Обычно, структуры полноразмерных антител предпочтительно включают четыре цепи полипептидов, две тяжелых (Н) цепи и две легких (L) цепи, обычно взаимосвязанных дисульфидными связями. Каждая тяжелая цепь содержит вариабельный участок тяжелой цепи и константный участок тяжелой цепи. Каждая легкая цепь содержит вариабельный участок легкой цепи и константный участок легкой цепи. В дополнение к этой обычной структуре полноразмерного антитела, указанная структура также включает другие производные формы.
Указанные вариабельный участок тяжелой цепи и вариабельный участок легкой цепи могут быть дополнительно подразделяться на более консервативные участки (называемые каркасными участками (FR)) и гипервариабельные участки (называемые участками, определяющими комплементарность (CDR)), разделенные промежутками.
Термин «участок, определяющий комплементарность» (CDR, например, CDR1, CDR2 и CDR3) относится к таким остаткам аминокислот в указанном вариабельном участке антитела, чье присутствие необходимо для связывания антигена. Каждый вариабельный участок обычно содержит три участка CDR, обозначенные как CDR1, CDR2 и CDR3. Каждый участок, определяющий комплементарность, может содержать остатки аминокислот из «участка, определяющего комплементарность» в соответствии с нумерацией Kabat (Kabat и др., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Бетесда, Мэриленд, 1991) и/или остатки из «высоковариабельной петли» (Chothia и Lesk; J MolBiol 196: 901-917(1987)).
Термин остатки «каркаса» или «FR» означает остатки в указанном вариабельном участке, отличающиеся от остатков CDR, как определено в настоящем документе.
Каждый вариабельный участок тяжелой цепи и вариабельный участок легкой цепи обычно содержит 3 CDR и до 4 FR, при этом указанные CDR и FR расположены от аминоконца к карбоксильному концу в следующем порядке, например: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4.
Участок, определяющий комплементарность, (CDR) и каркасный участок (FR) указанного антитела могут быть определены с использованием системы Kabat (Kabat и др.: Sequences of Proteins of Immunological Interest, 5th edition, US Department of Health and Human Services, PHS, NIH, NIH Publication No. 91- 3242, 1991).
Термин «константный участок» относится к такой последовательности аминокислот в легкой и тяжелой цепях антитела, которая впрямую не вовлечена в связывание указанного антитела с антигеном, но влияет на различные эффекторные функции, такие как вызываемая антителом цитотоксичность.
В соответствии с антигенными различиями последовательности аминокислот константного участка, указанная тяжелая цепь антитела может быть отнесена к одному из пяти классов: α, δ, ε, γ, и μ. Когда она образует полноразмерное антитело с легкой цепью, оно может быть отнесено к одному из пяти классов: IgA, IgD, IgE, IgG и IgM, которые могут быть дополнительно отнесены к пяти подклассам (изотипам), таким как IgG1, IgG2, IgG3, IgG4, IgA и IgA2. На основании последовательности аминокислот его константного участка, легкая цепь антитела может быть классифицирована как κ и λ.
«Антиген-связывающий фрагмент антитела» означает часть интактной молекулы антитела, у которой остается по меньшей мере некоторая специфичность связывания исходного антитела и обычно включает по меньшей мере часть антиген-связывающего участка или вариабельный участок (например, один или более CDR) исходного антитело. Примеры антиген-связывающих фрагментов включают фрагмент Fv, Fab, Fab', Fab'-SH, F(ab')2, Fd, Fd', молекулы одноцепочечных антител (например, scFv, ди-scFv или три-scFv, диатело или scFab), однодоменные антитела, но не ограничиваются ими.
Термин «фрагмент антитела» относится к молекуле неполноразмерного антитела, у которой остаются по меньшей мере некоторые биологические свойства исходного антитела, включая фрагмент Fc, в дополнение к фрагментам, описанным выше как «антиген-связывающие фрагменты», но не ограничиваются ими.
Термин «конъюгат антитела и лекарственного средства» или «ADC» относится к связывающему белку, такому как антитело или его антиген-связывающий фрагмент, который химически связан с одним или более химическим средством (также обозначенном в настоящем документе как «агент»), которое необязательно может быть терапевтическим агентом или цитотоксическим агентом. В одном из предпочтительных вариантов реализации ADC включает антитело, цитотоксическое или терапевтическое лекарственное средство, и линкер, с помощью которого указанное лекарственное средство может быть связано указанным антителом или может образовывать с ним конъюгат.ADC обычно могут содержать от 1 до 8 лекарственных средств, образующих конъюгат с указанным антителом, включая 2, 4, 6 или 8 лекарственных средств. Неограничивающими примерами лекарственных средств, которые могут быть включены в ADC, являются митотические ингибиторы, противоопухолевые антибиотики, иммуномодуляторы, векторы для генной терапии, алкилирующие агенты, антиангиогенные агенты, антиметаболиты, борсодержащие агенты, химиотерапевтические защитные агенты, гормоны, антигормональные агенты, кортикостероиды, фотоактивные терапевтические агенты, олигонуклеотиды, радионуклидные агенты, ингибиторы топоизомеразы, ингибиторы тирозинкиназы и радиосенсибилизаторы.
Термин «химерные антитело» относится к антителу, в котором часть указанной тяжелой цепи и/или легкой цепи получена из одного конкретного источника или вида, а оставшаяся часть получена из другого источника или вида. Указанное «химерное антитело» также может быть функциональным фрагментом, описанным выше. "Гуманизированное антитела" являются подмножеством «химерных антител».
Термин «гуманизированное антитело» или «гуманизированный антиген-связывающий фрагмент» в настоящем документе означает антитело или фрагмент антитела, который: (i) получен из источника, не являющегося человеком, (например, трансгенной мыши, имеющей гетерологичную иммунную систему) и основан на последовательности зародышевой линии человека; или (ii) является химерным антителом, в котором вариабельный участок имеет происхождение не из человека, а константный участок происходит из человека; или (iii) трансплантат CDR, в котором указанный CDR вариабельного участка имеет происхождение не из человека, один или более каркасных участков вариабельного участка происходят из человека и константный участок, если есть, происходит из человека. Целью «гуманизации» является устранение иммуногенности антител нечеловеческого происхождения в организме человека при сохранении максимально возможной аффинности. В качестве шаблона для гуманизации целесообразно выбрать последовательность каркаса человека, которая наиболее похожа на последовательность каркаса антитела, происходящего их источника, не являющегося человеком. В некоторых случаях может оказаться необходимым заменить одну или несколько аминокислот в каркасной последовательности человека соответствующими остатками в конструкции не из человека, чтобы избежать потери аффинности.
Термин «моноклональное антитело» относится к антителу, полученному из по существу гомогенной популяции антител, т.е. каждое отдельное антитело, входящее в указанную популяцию, является идентичным, за исключением возможных мутаций (например, природных мутаций), которые могут присутствовать в очень маленьких количествах. Таким образом, термин «моноклональное» указывает на природу рассматриваемого указанного антитела, т.е., а не на смесь неродственных антител. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела против разных эпитопов, все моноклональные антитела в препаратах моноклональных антител направлены против одного эпитопа антигена. В дополнение к его специфичности, препараты моноклональных антител имеют то преимущество, что они обычно не загрязнены другими антителами. Термин «моноклональные» не следует понимать как требующее производства указанного антитела каким-либо конкретным способом.
Указанное антитело «специфически связывается» с целевым антигеном, таким как ассоциированный с опухолью пептидный антиген-мишень (в данном случае, VEGF), т.е. связывает указанный антиген с достаточной аффинностью, чтобы сделать возможным использование указанного антитело в качестве терапевтического агента, нацеливаясь на клетку или ткань, экспрессирующую указанный антиген, и не дает значительной перекрестной реакции с другими белками или не дает значительной перекрестной реакции с белками, отличными от гомологов и вариантов белков-мишеней, упомянутых выше (например, мутантные формы, варианты сплайсинга, или укороченные формы белка, полученные в результате гидролиза).
Термин «аффинность связывания» относится к силе суммы нековалентных взаимодействий между отдельными сайтами связывания молекулы и ее партнерами по связыванию. Если не указано иное, «аффинность связывания» при использовании в настоящем документе относится к внутренней аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающей пары (например, антитело и антиген). В настоящем тексте термин «KD» относится к равновесной константе диссоциации взаимодействия антитело-антиген. В настоящем тексте термин «kon» относится к константе скорости, при которой антитело связывается с антигеном. В настоящем тексте термин «koff» относится к константе скорости, при которой антитело диссоциирует из комплекса антитело/антиген. «KD», «константа скорости связывания kon» и «константа скорости диссоциации кой» обычно используются для описания сродства между молекулой (например, антителом) и ее партнером по связыванию (например, антигеном). Аффинность, т.е., степень силы, при которой лиганд связывается с определенным белком. На аффинность связывания влияют нековалентные межмолекулярные взаимодействия, такие как водородные связи, электростатические взаимодействия, гидрофобные и ван-дер-ваальсовы силы между двумя молекулами. Кроме того, на аффинность связывания между лигандом и его целевой молекулой может влиять присутствие других молекул. Аффинность может быть проанализирована традиционными методами, известными в данной области техники, включая ИФА, описанный в настоящем документе.
Термин «эпитоп» включает любой кластер белковой детерминанты, который специфически связывается с антителом или Т-клеточным рецептором. Кластеры эпитопной детерминанты обычно состоят из химически активных поверхностных групп молекулы (например, боковых цепей аминокислот или Сахаров или их комбинации) и часто имеют специфические трехмерные структурные признаки, а также специфические характеристики заряда.
Термин «изолированное» антитело представляет собой антитело, которое было идентифицировано и выделено из компонентов клетки, где экспрессируется указанное антитело. Однако, как правило, изолированное антитело получают посредством по меньшей мере одной стадии очистки.
«Идентичность последовательностей» между двумя последовательностями полипептидов или нуклеиновых кислот указывает количество остатков, которые идентичны между указанными последовательностями в процентах от общего числа остатков, и рассчитывается на основе размера меньшей из сравниваемых молекул. При вычислении идентичности в процентах сравниваемые последовательности сопоставляются таким образом, чтобы получить максимальное совпадение между указанными последовательностями, при этом пробелы при сравнении (если они есть) разрешаются с помощью определенного алгоритма. Предпочтительные компьютерные программные методы для определения идентичности между двумя последовательностями включают наборы программ GCG, включая GAP, BLASTP, BLASTN и FASTA (Altschul и др., 1990, J. Mol. Biol. 215: 403-410), но не ограничиваются ими. Вышеупомянутые процедуры общедоступны в Международном центре биотехнологической информации (NCBI) и других источниках. Известный алгоритм Смита-Уотермана также может быть использован для определения идентичности.
Термин «Fc рецептор» или «FcR» относится к рецептору, который связывается с участком Fc антитела. Предпочтительны природные последовательности FcR человека и предпочтительно рецепторы, которые связываются с IgG антителами (гамма-рецепторы), которые включают FcγRI, FcγRII и изоформы FcγRIII, а также варианты из этих рецепторов. Все остальные FcR включены в термин «FcR». Термин также включает неонатальный рецептор (FcRn), который отвечает за транспорт материнского IgG к плоду (Guyer и др., Journal of Immunology 117: 587 (1976) и Kim и др., Journal of Immunology 24: 249 (1994)).
Термин «неонатальный Fc-рецептор», сокращенно «FcRn», связывается с участком Fc IgG-антитела. Неонатальный Fc-рецептор (FcRn) играет важную роль в метаболической судьбе IgG-подобных антител in vivo. FcRn функционирует для спасения IgG от пути лизосомной деградации, тем самым снижая его клиренс в сыворотке и удлиняя период его полужизни. Таким образом, свойства связывания FcRn /характеристики IgG in vitro указывают на его фармакокинетические свойства в кровотоке in vivo.
Термин «эффекторная функция» относится к той биологической активности, которая приписывается участку Fc антитела, которая варьирует от изотипа к изотипу. Примеры эффекторной функции антитела включают связывание C1q и комплемент-зависимую цитотоксичность (CDC), связывание рецептора Fc, антитело-зависимую клеточно-опосредованная цитотоксичность (ADCC), антителозависимый клеточный фагоцитоз (ADCP), секреция цитокинов, опосредованное иммунными комплексами поглощение антигена антигенпрезентирующими клетками, подавление рецепторов клеточной поверхности (например, рецепторов В-клеток) и активация В-клеток.
Термин «эффекторная клетка» относится к клетке, которая экспрессирует один или несколько FcR и выполняет эффекторные функции. В одном аспекте указанные эффекторные клетки экспрессируют в меньшей степени FcγRIII и выполняют эффекторные функции ADCC. Примеры клеток человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови, (РВМС), натуральные киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы. Эффекторные клетки могут быть выделены из природных источников, например, крови. Эффекторные клетки обычно представляют собой лимфоциты, ассоциированные с эффекторной фазой и функционирующие для продукции цитокинов (хелперные Т-клетки), уничтожения клеток, инфицированных патогенами (цитотоксические Т-клетки) или секреции антитела (дифференцированные В-клетки).
«Иммунные клетки» включают клетки, которые имеют гемопоэтическое происхождение и играют роль в иммунном ответе. Иммунные клетки включают: лимфоциты, такие как В-клетки и Т-клетки; естественные клетки-киллеры; и миелоидные клетки, такие как моноциты, макрофаги, эозинофилы, тучные клетки, базофилы и гранулоциты.
«Антитело-зависимая клеточно-опосредованная цитотоксичность» или «ADCC» относится к форме цитотоксичности, при которой секретируемый Ig связывается с рецепторами Fey, представленными на определенных цитотоксических клетках (например, NK-клетках, нейтрофилах и макрофагах), что позволяет этим цитотоксическим эффекторным клеткам специфически связываться с клетками-мишенями, несущими антигены, и последующего уничтожения указанных клеток-мишеней с использованием, например, цитотоксина. Для оценки ADCC-активности целевого антитела могут быть выполнены анализы ADCC in vitro, такие как анализы ADCC in vitro, задокументированные в патенте США №5,500,362 или 5,821,337 или патенте США №6,737,056 (Presta). Полезные эффекторные клетки для применения в таких случаях включают РВМС и NK-клетки.
«Комплемент-зависимая цитотоксичность» или «CDC» относится к лизису клеток-мишеней в присутствии комплемента. Классический путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителом (соответствующего подкласса), которое связывается с соответствующим антигеном. Для оценки активации комплемента проводят анализ CDC, такой как анализ CDC, описанный в Gazzano-Santoro и др., J. Immunol Methods 202: 163 (1996). Например, в патенте США №6,194,551 В1 и WO 1999/51642, описаны варианты полипептидов, содержащие измененную последовательность аминокислот участка Fc (полипептиды, содержащие вариант участка Fc) и варианты полипептидов, имеющие повышенное или пониженное связывание C1q.
Последовательность аминокислот и последовательность нуклеотидов указанного антитела согласно настоящему изобретению
В настоящем изобретении использовали рекомбинантный белок VEGF165 человека для иммунизации кролика, а затем получали клоны указанного антитела VEGF-R859, VEGF-R988, VEGF-R613 и VEGF-R812, которые специфически связываются с рекомбинантным белком VEGF165 человека посредством скрининга библиотеки фагового дисплея. Указанную последовательность нуклеотидов, кодирующую вариабельные участки тяжелой и легкой цепи антитела scFv VEGFR2-MK19, затем вводили посредством ПЦР в вектор pSTEP2, содержащий последовательность нуклеотидов, кодирующую константный участок IgG1 кролика или константный участок каппа кролика, и выращивали для экспрессии. Антитела высокой степени очистки получали посредством очистки на колонке с белком А. ИФА показал, что указанное антитело кролика было способно блокировать связывание белка VEGF165 с белком VEGFR2, a VEGF-R988 и VEGF-R613 могли эффективно снижать способность VEGF165 к стимулированию пролиферации HUVEC, и VEGF-R988 продемонстрировал наивысшую максимальную степень ингибирования.
Затем, используя классический метод гуманизированной трансплантации CDR, в качестве матрицы были выбраны вариабельные участки легкой цепи или тяжелой цепей антитела человека, последовательность которых ближе к указанной последовательности вариабельных участков легкой или тяжелой цепей кролика, гуманизированный вариабельный участок легкой цепи (VL) и вариабельный участок тяжелой цепи (VH) по очереди путем вставки каждого из трех CDR (Таблица 1) легкой цепи или тяжелой цепи антитела кролика в вариабельные участки указанного антитела человека. Поскольку ключевые сайты каркасного участка антитела кролика необходимы для поддержания стабильности активности CDR, ключевые сайты были мутированы обратно в соответствующую последовательность антитела кролика. Вектор экспрессии легкой/тяжелой цепей VEGF-H988-10 получали путем полного синтеза гена, трансфицировали его в клетки НЕК-293 и культивировали для экспрессии, культуральный супернатант очищали с использованием колонки с белком А, в результате чего получали антитела высокой чистоты. Для улучшения аффинности VEGF-H988-10 конструировали библиотеки SDM участков CDR вариабельных участков тяжелой и легкой цепей (включая LCDR1, LCDR3, HCDR2 и HCDR3), и библиотеки четырех мутантов конструировали в форме scFv и клонировали в фаговые векторы в виде слитого белка svFv-gIII; для каждого CDR проводили скрининг клонов CDR, обладающих оптимальной способностью к связыванию с растворимым антигеном VEGF, и получали конечное антитело VEGF-H988, обладающее оптимизированной аффинностью CDR и стабильностью. Нуклеиновые кислоты настоящего изобретения
Настоящее изобретение также относится к молекулам нуклеиновой кислоты, кодирующей антитела или их фрагменты согласно настоящему изобретению. Последовательности этих молекул нуклеиновый кислоты включают SEQ ID NO: 11, 19-20, 23-24, 43-51 и 53-54, но не ограничиваются ими.
Указанные молекулы нуклеиновой кислоты согласно настоящему изобретению не ограничены указанными последовательностями, описанными в настоящем документе, но также включают их варианты. Варианты в настоящем изобретении могут быть описаны со ссылкой на их физические свойства при гибридизации. Специалисту в данной области техники понятно, что с использованием методов гибридизации нуклеиновых кислот, нуклеиновые кислоты может применяться для идентификации их комплементов, а также их эквивалентов и гомологов. Также понятно, что гибридизация может происходить при комплементарности, меньшей 100%. Однако при соответствующем выборе условий методы гибридизации могут применяться для различения указанных последовательностей ДНК на основе структурной релевантности к последовательности ДНК конкретного зонда. Руководство по таким условиям смотри Sambrook и др., Molecular Cloning: А Laboratory Manual, 2nd Ed. Cold Spring Harbor Press, Cold Spring Harbor, N. Y., 1989 и Ausubel, F. M., Brent, R., Kingston, R. E., Moore, D. D., Sedman, J. G., Smith, J. A., & Struhl, K. eds. (1995). Current Protocols in Molecular Biology. New York: John Wiley and Sons.
Рекомбинантные векторы и экспрессия
Согласно настоящему изобретению также предложены рекомбинантные конструкции, содержащие одну или более последовательностей нуклеотидов согласно настоящему изобретению. Указанную рекомбинантную конструкцию согласно настоящему изобретению получают посредством вставки указанной молекулы нуклеиновой кислоты, кодирующей указанное антитело согласно настоящему изобретению, в вектор, такой как плазмида, фагмида, фаг или вирусный вектор.
Антитела, предлагаемые в настоящем документе, могут быть полученный посредством рекомбинантной экспрессии последовательности нуклеотидов, кодирующей легкую и тяжелую цепи или их части в клетке-хозяине. Для рекомбинантной экспрессии указанного антитела, указанная клетка-хозяин может быть трансфицирована одним или более рекомбинантными векторами экспрессии, несущими последовательность нуклеотидов, кодирующую легкую и/или тяжелую цепи или их части, так, что указанная легкая и тяжелая цепи экспрессируются в указанной клетке-хозяине. Стандартную методологию рекомбинантных ДНК используют для получения нуклеиновых кислот, кодирующих тяжелую и легкую цепи, для включения указанных нуклеиновых кислот в рекомбинантные векторы экспрессии и для введения указанных векторов в клетки-хозяева, например, Sambrook, Fritsch и Maniatis (eds.), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y, (1989), Ausubel, F. M. и др. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и описанную в патенте США №4,816,397 Boss и др.
Подходящими клетками-хозяевами являются прокариотические и эукариотические клетки. Примерами прокариотических клеток-хозяев являются бактерии, а примерами эукариотических клеток-хозяев являются клетки дрожжей, насекомых или млекопитающего. Следует понимать, что дизайн векторной экспрессии, включая выбор регуляторной последовательности, определяется рядом факторов, таких как выбор клетки-хозяина, уровень экспрессии желаемого белка, и является ли экспрессия конститутивной или индуцируемой..
Бактериальная экспрессия
Вектор экспрессии для применения в бактерии конструируют путем вставки структурной последовательности ДНК, кодирующей желаемое антитело вместе с соответствующими сигналами инициации и терминации трансляции и функциональными промоторами в действующую рамку считывания. Вектор содержит один или несколько маркеров фенотипической селекции и точку начала репликации, чтобы обеспечить сохранение вектора и обеспечить амплификацию в хозяине по мере необходимости. Подходящие прокариотические хозяева для трансформации включают несколько видов Е. coli, Bacillus subtilis, Salmonella typhimurium, а также Pseudomonas, Streptomyces и Staphylococcus.
Указанный бактериальный вектор может быть на основе, например, фага, плазмиды или фагмиды. Эти векторы могут содержать маркеры селекции и бактериальные точки начала репликации, которые получены из коммерчески доступных плазмид, которые обычно содержат элементы хорошо известного вектора клонирования pBR322 (АТСС 37017). после трансформации соответствующего штамма-хозяина и выращивания штамма-хозяина до соответствующей плотности клеток выбранный промотор дерепрессируют/индуцируют соответствующим методом (например, изменением температуры или химической индукцией), и клетки культивируют в течение еще некоторого времени. Клетки обычно собирают центрифугированием, разрушают физическими или химическими методами, а полученный неочищенный экстракт сохраняют для дополнительной очистки.
В бактериальной системе множество векторов экспрессии могут быть выгодно подобранными в соответствии с предполагаемым использованием экспрессированного белка. Например, когда необходимо произвести большое количество таких белков для производства антител или для скрининга библиотеки пептидов, например, может потребоваться вектор, который позволяет осуществить высокоуровневую экспрессию слитого белка продукта для легкой очистки.
Экспрессия в клетках млекопитающих и очистка
Предпочтительные регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают вирусные элементы, которые позволяют осуществить высокоуровневую экспрессию белка в клетках млекопитающего, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (например, промотор/энхансер CMV), промоторы и/или энхансеры вируса обезьян 40 (SV40) (например, промотор/энхансер SV40), промоторы и/или энхансеры аденовируса (например, главный поздний промотор аденовируса (AdMLP)) и промоторы и/или энхансеры вируса полиомы. Для дополнительного описания вирусных регуляторньгх элементов и их последовательностей, см., например, патент США №5,168,062, Stinski, патент США №4,510,245, Bell и др., и патента США №4,968,615, Schaffher и др. Указанные рекомбинантные векторы экспрессии также могут включать точку начала репликации и маркер селекции (см., например, патенты США №4,399,216, №4,634,665 и №5,179,017, Axel и др.), подходящие маркеры селекции включают гены, которые обеспечивают устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клеткам-хозяевам, в которые введен указанный вектор. Например, ген дигидрофолатредуктазы (DHFR) обеспечивает устойчивость к метотрексату, в то время как ген neo обеспечивает устойчивость к G418.
Трансфекцию указанного вектора экспрессии в клетки-хозяева можно проводить с использованием стандартных методов, таких как электропорация, осаждение с фосфатом кальция и трансфекция DEAE-декстраном.
Подходящие клетки-хозяева млекопитающих для экспрессии представленного в настоящем документе антитела включают клетки яичника китайского хомячка (клетки СНО) [включая клетки dhfr-CHO, описанные Urlaub и Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220, с применением маркера селекции DHFR, как описано, например, в R.J. Kaufinan и Р.А. Sharp (1982) Mol. Biol. 159:601-621], клетки миеломы NSO, клетки COS и клетки SP2.
Антитела согласно настоящему изобретению могут быть выделены и очищены от культуры рекомбинантных клеток известными способами, включая осаждение сульфатом аммония или этанолом, кислотную экстракцию, аффинную хроматографию на белке А, аффинную хроматографию на белке G, анионо- или катионообменную хроматография, хроматографию на фосфоцеллюлозе, хроматографию гидрофобного взаимодействия, аффинную хроматографию, хроматографию на гидроксиапатите, хроматографию на лектинах, но не ограничиваются ими. Высокоэффективная жидкостная хроматография (ВЭЖХ) также может применяться для очистки. См., например, Colligan, Current Protocols in Immunology, или Current Protocols in Protein Science, John Wiley & Sons, NY, N.Y., (1997-2001), например, главы 1, 4, 6, 8, 9, и 10, каждая из которых полностью включена в настоящий документ посредством ссылки.
Характеристики и функции антитела согласно настоящему изобретению Осуществляли анализ характеристик и функциональный анализ гуманизированного антитела VEGF-H988 согласно настоящему изобретению. Анализ показал, что указанное антитело согласно настоящему изобретению обладает следующими преимуществами: (1) способность VEGF-H988 связывать белок VEGF165 немного лучше, чем у Авастина; (2) аффинность связывания VEGF165-H988 с рекомбинантным белком VEGF165 человека немного выше, чем у Авастина, а именно примерно в 1,5 раза, чему Авастина; (3) VEGF165-H988 специфически связывается с рекомбинантным белком VEGF165 человека и перекрестно связывается с рекомбинантным белком mVEGF164 мыши; (4) антитело VEGF-H988 может эффективно ингибировать связывание белка VEGFR2 с белком VEGF165, и его ингибирующая способность слабее, чем у EYLEA, но лучше, чем у Авастина; (5) антитело VEGF-H988 может эффективно снижать способность VEGF165 инициировать пролиферацию HUVEC; (6) антитело VEGF-H988 имеет более сильный нейтрализующий эффект, чем Авастин в случае различных изоформ VEGF (VEGF165, VEGFC, VEGFD), действуя одновременно на клетки HUVEC; (7) повторенное несколько раз исследование токсичности от введения лекарственного средства на мышах показало, что не было обнаружено существенных реакций токсичности, связанной с лекарственным средством - антителом VEGF-H988; и (8) тест по подавлению опухоли в модели ксенотрансплантата опухоли НСТ-116 показал, что VEGF-H988 обладает лучшим эффектом по подавлению опухоли, чем Авастин.
Применения
Антитела согласно настоящему изобретению могут применяться для лечения рака толстой и прямой кишки. Указанное антитело согласно настоящему изобретению также может быть использовано для получения лекарственных средств для лечения указанных заболеваний.
Фармацевтические композиции
Антитела согласно настоящему изобретению могут быть получены с по меньшей мере одним другим агентом (например, стабильным соединением) с образованием фармацевтической композиции, содержащий антитело согласно настоящему изобретению и один или более фармацевтически приемлемые носители, разбавители или вспомогательные вещества. Указанная фармацевтическая композиция необязательно может содержать дополнительные терапевтические агенты.
Наборы
Настоящее изобретение также относится к фармацевтическому набору и набору, содержащему один или более контейнеров, где указанные контейнеры содержат указанные выше фармацевтические композиции согласно настоящему изобретению. К таким контейнерам могут прилагаться спецификации по форме, установленной государственным органом, регулирующим производство, использование или распространение лекарственного средства или биологического продукта, которые отражают одобрение его введения человеку указанным органом страны, в которой указанный продукт производится, используется или распространяется.
Получение и хранение
Указанная фармацевтическая композиция согласно настоящему изобретению может быть получена способом, известным в данной области техники, например, традиционными методами смешивания, растворения, грануляции, приготовления пастилок, измельчения, эмульгирования, инкапсуляции, заливки или лиофилизации.
Будучи приготовленными, фармацевтические композиции, содержащие соединения согласно настоящему изобретению, изготовленные в виде лекарственной формы в приемлемом носителе, они могут быть помещены в соответствующие контейнеры и помечены для лечения указанного состояния. Такая маркировка должна включать количество, частоту и способы введения препарата.
Комбинации
Указанная фармацевтическая композиция, содержащая антитела согласно настоящему изобретению, описанные выше, также может быть скомбинирована с одним или более другими терапевтическими агентами, такими как противоопухолевые агенты, если при этом полученная комбинация не вызывает неприемлемых побочных эффектов.
Последующие примеры способствуют лучшему пониманию настоящего изобретения, но не предназначены для ограничения рамок настоящего изобретения. Все экспериментальные методы в последующих примерах, если не указано иное, являются обычными методами. Экспериментальные материалы, использованные в последующих примерах, если не указано иное, были приобретены у обычных дистрибьюторов биохимических реагентов.
ПРИМЕРЫ
Пример 1: Скрининг антител кролика, которые блокируют связывание VEGF165 с VEGFR1/VEGFR2 с использованием библиотека фагового дисплея антител
1.1 Иммунизация кроликов
Рекомбинантный белок VEGF165 человека (от Sino Biological, Inc, кат. №11066-HNAH) использовали для иммунизации кроликов. Последовательность аминокислот внеклеточного участка Met1-Arg191 белка VEGF165 человека (UniProt P15692-4) приведена в SEQ ID NO: 1.
Подробное описание метода следующее: рекомбинантный белок VEGF165 человека смешивали с адъювантом Фрейнда, кроликов подкожно иммунизировали указанной смесью 4 раза с интервалами 3 недели, 2 недели и 2 недели, соответственно, дозировкой 500 мкг каждый раз. После четвертой иммунизации кровь собирали через 4 дня после иммунизации через медиальное кантальное сплетение глаза. Титр антитела против VEGF165 в сыворотке кролика измеряли методом ИФА с использованием покрытия рекомбинантным белком VEGF165 человека. Титр в сыворотке после четвертой иммунизации достигал 1:250000, и кроликам вводили бустер внутривенно с 25 мкг рекомбинантного белка VEGF165 человека через 9 недель после четвертой иммунизации. Через 7 дней, кроликов умерщвляли, а ткань селезенки удаляли и замораживали в жидком азоте.
1.2 Скрининг библиотеки фагового дисплея антител
РНК экстрагировали из ткани селезенки кролика с использованием TriPure Isolation Reagent (от Roche, кат.№11 667 165 001), и получали кДНК обратной транскрипцией РНК с использованием набора для обратной транскрипции (от Invitrogen кат.№18080-051). Конструировали 10 пар праймеров для амплификации последовательности вариабельного участка легкой цепи антитела кролика и 4 пары праймеров для амплификации последовательности вариабельного участка тяжелой цепи (Barbas С F и др., CSHL Press. 2004). Указанные последовательности, кодирующую вариабельные участки легкой и тяжелой цепей антитела кролика объединяли с последовательностью нуклеотидов, кодирующей scFv, с помощью ПЦР с удлинением перекрывающихся участков, вариабельные участки легкой и тяжелой цепей соединяли (Jones S Т и др., Bio/technology. 1991; 9(1): 88) с помощью следующего линкера:
TCTAGTGGTGGCGGTGGTTCGGGCGGTGGTGGAGGTGGTAGTTCTAGATCTTCC (SSGGGGSGGGGGGSSRSS) (SEQ ID NO: 2);
затем лигировали в фаговый вектор рСотЬЗх (от Sino Biological, Inc.) с помощью эндонуклеазы рестрикции Sfi I (от Fermentas), и электротрансформировали в компетентые клетки Х-Blue для получения библиотеки фагового дисплея антител scFv кролика. Рекомбинантный белок VEGF165 человека наносили в качестве покрытия на чашку для ИФА, и фаговую библиотеку, обогащенную положительными антителами против VEGF165, скринировали в соответствии с указанным фаговым способом сортировки антител (O'Brien, РМ, & Aitken, R. (Eds.), Springer Science & Business Media. 2002; ISBN: 9780896037113). Для экспрессии из обогащенной библиотеки были отобраны одиночные колонии фагов, а их связывание с рекомбинантным белком VEGF165 человека определяли с помощью ИФА. Клоны scFv антител, которые специфически связываются с рекомбинантным VEGF165 человека, отбирали и направляли в компанию, осуществляющую услуги по секвенированию, в результате чего получали последовательности нуклеотидов антител, при этом несколько клонов 5 scFv антител дали производные VEGF-R859, VEGF-R988, VEGF-R613, VEGF-R812 способом, описанным в Примере 1.3. Последовательности нуклеотидов антител клонов scFV приведены в SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
1.3 Получение антител кролика, связывающихся с VEGF165
10 Используя VEGF-R988 в качестве примера, указанную последовательность нуклеотидов, кодирующую вариабельный участок тяжелой цепи scFv антитела VEGF-R988, амплифицировали с помощью ПЦР и вставляли в вектор pSTEP2, разрезанный Sea I + Kpn I (Fermentas), несущий последовательность нуклеотидов, кодирующую сигнальный пептид тяжелой цепи (SEQ ID NO: 45) и константный
15 участок IgGl кролика (SEQ ID NO: 9), методом слияния с получением вектора экспрессии тяжелой цепи (SEQ ID NO: 53). Указанную последовательность нуклеотидов, кодирующую вариабельный участок легкой цепи scFv антитела VEGF-R988, амплифицировали с помощью ПЦР и вставляли в pSTEP2 вектор, разрезанный Sea I + ВатН I (Fermentas), несущий последовательность нуклеотидов,
20 кодирующую сигнальный пептид легкой цепи (SEQ ID NO: 46) и константный участок каппа кролика (SEQ ID NO: 10), методом слияния с получением вектора экспрессии легкой цепи (SEQ ID NO: 54). Указанные рекомбинантные плазмиды экстрагировали, трансфицировали ими клетки HEK-293 и выращивали для экспрессии в течение 7 суток, супернатант культуры очищали на колонке с белком А в 25 результате чего получали высокоочищенные антитела.
Праймеры для амплификации вариабельного участка тяжелой цепи:

Праймеры для амплификации вариабельного участка легкой цепи:

1.4 Функциональный анализ антител кролика, связывающихся с VEGF165
1.4.1 Антитело кролика блокирует связывание VEGF165 с VEGFR2-his
Белок VEGF165 (от SinoBiological, Inc.) при концентрации 1 мкг/мл наносили в качестве покрытия на 96-луночный планшет в количестве 100 мкл на лунку в течение ночи при 4°С. Планшет промывали на следующий день и блокировали при комнатной температуре в течение 1 ч. Добавляли 100 мкл раствора белка VEGFR2 концентрации 5 мкг/мл (от SinoBiological, Inc.) и указанного антитела, связывающегося с VEGF165, при различных концентрациях и совместно инкубировали. Планшет промывали для удаления несвязавшихся антител, инкубировали со стрептавидином/HRP (от Beijing ZSGB-Bio Co., Ltd.), а затем несколько промывали, и раствор хромогенного субстрата добавляли для появления окраски. Измеряли OD450 после появления окраски. Принимая концентрацию антитела кролика, связывающегося с VEGF165, в качестве горизонтальной координаты и степень ингибирования Р1% в качестве вертикальной координаты, использовали программное обеспечение graphPad Prism 6.0 для анализа данных и строили график кривой зависимости. Степень ингибирования (%) = (ODконтроль - ODобразец)/ ODконтроль × 100%, где ОDконтроль обозначает значение OD для лунок только с добавленным VEGFR2-биотин, но без антитела кролика, а ODобразец обозначает значение OD лунки с добавленными VEGFR2-биотин и антителом кролика.
Как видно на Фиг. 1, белок VEGFR2 может эффективно связываться с покрытием из белка VEGF165, и антитела кролика VEGF-R859, VEGF-R988, VEGF-R613, VEGF-R812 могут эффективно ингибировать связывание белка VEGFR165 с белком VEGFR2.
Антитело ингибирует эффект пролиферации VEGF165 на эндотелиальных клетках пупочной вены
1.4.2 Антитело кролика ингибирует пролиферацию HUVEC
Эффект антитела, нейтрализующего пролиферацию эндотелиальных клеток пупочной вены, индуцированную VEGF165, определяли с использованием метода WST-8. Эндотелиальные клетки HUVEC пупочной вены человека инокулировали в 96-луночный планшет в количестве 4×103 клеток на лунку, выращивали в среде M199, содержащей 10% ФБС и 5% L-Gln в течение 4 часов, а затем различные концентрации антител кролика добавляли в количестве 50 мкл на лунку, затем VEGF-165 в конечной концентрации 10 нг/мл добавляли в количестве 10 мкл на лунку, 96-луночный планшет инкубировали при 37°С, 5% СО2 в инкубаторе клеток в течение 3 суток, и использовали пустую лунку В (без клеток), отрицательный контроль М (клетки инокулировали, без образца антитела, добавлен VEGF-165) и М' (клетки инокулировали, без образца антитела и без VEGF-165). После инкубации добавляли 10 мкл на лунку хромогенного раствора WST-8, и указанный 96-луночный планшет инкубировали в инкубаторе СО2 до появления окраски, измеряли OD450 и OD630 с помощью считывателя микропланшетов после стабилизации появления окраски. Для каждой лунки считанное значение составляло (OD450 - OD630), и степень нейтрализации для указанного антитела, рассчитанное как значение OD для каждой группы, определяли как считанное значение группы минус считанное значение пустой лунки В, степень нейтрализации % = (значение OD отрицательного контроля М - значение OD образца) / (значение OD отрицательного контроля М - значение OD М') × 100%. Стандартную кривую рассчитывали с использованием функции автоматического анализа статистического программного обеспечения GraphPad Prism, выбирая концентрацию образца указанного антитела в качестве горизонтальной координаты и степень нейтрализации в качестве вертикальной координаты, и уравнение логистической регрессии с четырьмя параметрами использовали для соответствия стандартной кривой «S» для расчета половины максимальной эффективной концентрации (ЕС50) образца указанного антитела.
Результаты, показанные на Фиг. 2 демонстрируют, что VEGF-R988 и VEGF-R613 эффективно снижают способность VEGF165 инициировать пролиферацию HUVEC, при этом VEGF-R988 продемонстрировало самую максимальную степень ингибирования, VEGF-R812 по существу не обладает ингибирующей способностью, в то время как VEGF-R859 вообще не обладает ингибирующей способностью.
Пример 2: Гуманизация, модификация и получение антитела кролика VEGF-R988
На основании результатов функционального антитела кролика из Примера 1, антитело VEGF-R988 выбрали для гуманизации и получения.
2.1 Определение последовательностей CDR легкой и тяжелой цепей антитела кролика VEGF-R988
На основании указанной последовательности нуклеотидов scFv антитело VEGF-R988, определенной в Примере 1.2, получали последовательность аминокислот вариабельных участков тяжелой цепи и легкой цепи VEGF-R988 scFv, смотри SEQ ID NO: 11/12.
Принимая во внимание индекс Кабат и систему нумерации IMGT, определяли последовательность аминокислот каждого трех CDR легкой и тяжелой цепей антитела кролика VEGF-R988-scFv, см. Таблицу 1. Указанные выше соответствующие три CDR указанной легкой цепи и тяжелой цепи переносили в гуманизированное антитело VEGF-R988-scFv в последующих стадиях, см. Пример 2.2.
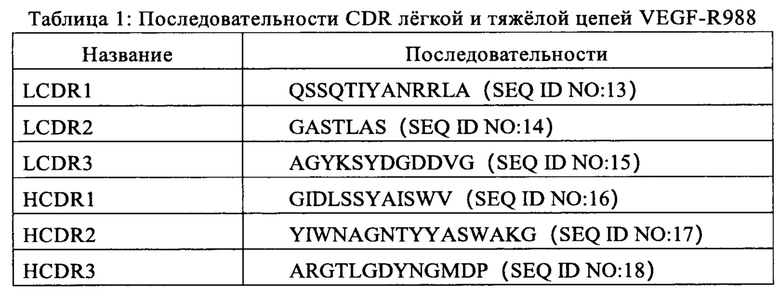
2.2 Трансплантация CDR антитела кролика VEGF-R988
Гуманизацию антитела кролика осуществляли с использованием классического способа гуманизации трансплантацией CDR. Вариабельные участки легкой или тяжелой цепи антитела, человека, чьи последовательности являются наиболее близкими указанным последовательностям вариабельных участков легкой или тяжелой цепи кролика, выбирали в качестве матрицы, и каждый из трех CDR (Таблица 1) легкой или тяжелая цепи кролика вставляли в указанные вариабельные участки антитела человека, в результате чего получали последовательности гуманизированного вариабельного участка легкой цепи (VL) или вариабельного участка тяжелой цепи (VH), соответственно. Матрицей человека для вариабельного участка легкой цепи VEGF-R988 является IGKV1-27*01, который на 65,30% гомологичен легкой цепи VEGF-R988, и матрицей человека для вариабельного участка тяжелой цепи является IGHV4-4*08, который на 53,20% гомологичен тяжелой цепи VEGF-R988.
2.3 Обратные мутации в каркасном участке гуманизированного вариабельного участка
Поскольку некоторые ключевые аминокислоты в каркасном участке кролика необходимы для поддержания активности CDR, ключевые аминокислоты были обратно мутированы в соответствующие последовательности аминокислот антитела кролика, следующие сайты были обратно мутированы: в легкой цепи, позиция 1 была обратно мутирована в Е, позиция 2 была обратно мутирована в L, позиция 4 была обратно мутирована в L, и позиция 63 была обратно мутирована в K; в то время как в тяжелой цепи позиция 3 была обратно мутирована в V, позиция 37 была обратно мутирована в V, позиция 47 была обратно мутирована в Y, позиция 78 была обратно мутирована в V, позиция 79 была обратно мутирована в D, и позиция 91 была обратно мутирована в F; все вышеперечисленные сайты были пронумерованы по схеме нумерации Кабата. Гуманизированное антитело VEGF-H988-10 получали гуманизированной трансплантацией CDR и обратными мутациями каркасного участка.
2.4 Получение гуманизированного моноклонального антитела VEGF-H988-10 и аффинная модификация CDR
Вариабельный участок тяжелой цепи VEGF-H988-10 (SEQ ID NO: 23) получали методом синтеза полного гена, а затем вводили инфузионным методом в предварительно разрезанный Sea I + Nhe I (Fermentas) вектор pSTEP2 вектор, несущий последовательность нуклеотидов, кодирующую сигнальный пептид тяжелой цепи (SEQ ID NO: 45) и последовательность нуклеотидов, кодирующую константный участок IgG1 человека (SEQ ID NO: 49), в результате чего получали вектор экспрессии тяжелой цепи VEGF-H988-10 (SEQ ID NO: 19). Вариабельный участок легкой цепи VEGF-H988-10 (SEQ ID NO: 24) получали методом синтеза полного гена, а затем вводили инфузионным методом в предварительно разрезанный SeaI + BsiW I (Fermentas) вектор pSTEP2 вектор, несущий последовательность нуклеотидов, кодирующую сигнальный пептид легкой цепи (SEQ ID NO: 46) и последовательность нуклеотидов, кодирующую константный участок каппа человека (SEQ ID NO: 50), в результате чего получали (SEQ ID NO: 20) вектор экспрессии легкой цепи VEGF-H988-10. Плазмиды экстрагировали и совместно трансфицировали в клетки НЕК-293, указанный клетки выращивали в течение 7 суток. Супернатант культуры очищали на колонке с белком А, в результате чего получали высокоочищенные антитела.
Праймеры для синтеза полного гена вариабельного участка тяжелой цепи

Праймеры для синтеза полного гена вариабельного участка легкой цепи


Для улучшения аффинности VEGF-H988-10, конструировали библиотеки SDM участков CDR вариабельных участков тяжелой и легкой цепи (включая три библиотеки, насыщенные мутациями LCDR1, LCDR3, и HCDR2); тем временем, для улучшения химической стабильности указанного антитела, остатки аминокислот, способные подвергаться дезамидированию или изомеризации, должны быть модифицированы другими остатками аминокислот. Дезаминирование аспарагина может происходить, такого как NG, NS, NA, NT и т.д., что приводит к образованию остатков изоаспарагиновой кислоты, влияющих на стабильность или биологическую функцию указанного антитела. Вариабельный участок HCDR3 VEGF-H988 содержит (а) участок(ки), восприимчивый(е) к дезамидированию, поэтому конструировали библиотеки SDM для улучшения химической стабильности и биологической функции указанного антитела. Вышеупомянутые четыре библиотеки мутантов сконструировали в форме scFv и клонировали в фаговый вектор в виде слитого белка scFv-gIII; для каждого CDR, скринировали клоны CDR, имеющие оптимальную способность к связыванию с растворимым антигеном VEGF, и наконец получали указанное антитело VEGF-H988, содержащее оптимизированную аффинность и стабильность CDR. Указанные последовательности CDR легкой и тяжелой цепи VEGF-H988 показаны в Таблице 2.
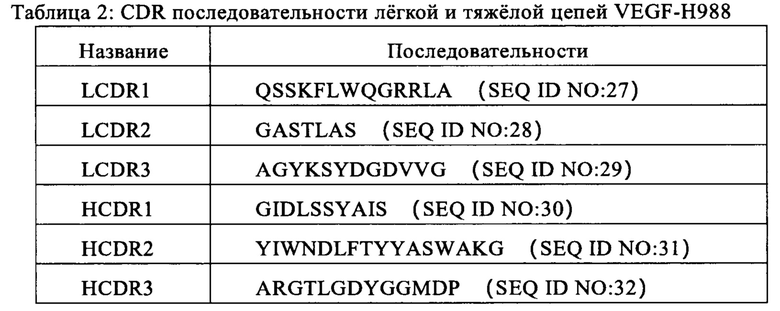
2.5 Получение гуманизированного моноклонального антитела VEGF-H988
Последовательность нуклеотидов (SEQ ID NO: 44), кодирующую легкую цепь и сигнальный пептид указанного выше антитела VEGF-H988, которая в следующем порядке содержит последовательность нуклеотидов, кодирующую сигнальный пептид легкой цепи (SEQ ID NO: 46), вариабельный участок легкой цепи гуманизированного антитела (SEQ ID NO: 48) и константный участок каппа легкой цепи антитела человека (SEQ ID NO: 50), амплифицировали с помощью ПЦР и вставляли в саморазвитый вектор pGS (Kpn I + Xba I) инфузионным методом, и правильность последовательности плазмиды проверяли секвенированием. Последовательность нуклеотидов (SEQ ID NO: 43), кодирующую тяжелую цепь и сигнальный пептид указанного выше антитела VEGF-H988, которая в следующем порядке содержит последовательность нуклеотидов, кодирующую сигнальный пептид тяжелой цепи (SEQ ID NO: 45), вариабельный участок тяжелой цепи гуманизированного антитела (SEQ ID NO: 47) и константный участок каппа тяжелой цепи антитела человека (SEQ ID NO: 49), амплифицировали с помощью ПЦР и инфузионным методом вставляли в вектор pGS (Nhe I + Not I), который содержит легкую цепь, правильность последовательности которой была проверена, и правильность последовательностей векторов, экспрессирующих как легкую, так и тяжелую цепи VEGF-R988, проверяли секвенированием. Эти векторы экспрессии являются эукариотическими векторами экспрессии, содержащими гены GS в качестве маркеров селекции и элементы экспрессии легкой и тяжелой цепи указанного антитела. Эти векторы экспрессии трансфицировали в CHO-K1-GS-дефицитные клетки и линии клеток с высокой экспрессией VEGF-H988 получали в результате скрининга MSX. Клоны с высокой экспрессией антитела экспрессия отбирали методом ИФА, и указанные линии клеток с высокой экспрессией выбирали, принимая во внимание как статус роста клеток, так и ключевые характеристики качества для лекарственного препарата антитела. Суспензионные культуры без сыворотки использовали для выращивания линии клеток СНО, продуцирующей VEGF-H988, в результате чего получали антитела VEGF-H988 высокой чистоты и качества.
Пример 3: Характеристический анализ гуманизированного антитела VEGF-H988
3.1 Характеристический анализ гуманизированного антитела VEGF-H988, связывающегося с VEGF165
3.1.1 Гуманизированное антитело VEGF-H988 специфически связывается с VEGF165
Рекомбинантный белок VEGF165 человека (от SinoBiological, Inc.) при различных концентрациях (0,15 нг/мл, 0,46 нг/мл, 1,37 нг/мл, 4,12 нг/мл, 12,35 нг/мл, 37,04 нг/мл, 111,11 нг/мл, 333,33 нг/мл, 1000 нг/мл и 3000 нг/мл) наносили на 96-луночный планшет в течение ночи при 4°С в количестве 100 мкл на лунку. Планшет промывали на следующий день и блокировали при комнатной температуре в течение 1 часа. После инкубации с 100 мкл 1 мг/мл VEGF165-H988, Авастином (от Roche) или антителом H7N9-R1 в качестве отрицательного контроля, соответственно, планшет промывали для удаления несвязавшихся антител, затем инкубировали с F(ab')2 козы против IgG F(ab')2/HRP человека (от Jackson ImmunoResearch Laboratories, Inc.) и промывали несколько раз, а затем добавляли раствор хромогенного субстрата до появления окраски. OD450 измеряли после завершения образования окраски. Используя концентрацию рекомбинантного белка VEGF165 человека в качестве горизонтальной координаты и значение OD450 в качестве вертикальной координаты, использовали программное обеспечение graphPad Prism 6.0 для получения кривой графика "S" и анализировали связывание указанного антитела с рекомбинантным белком VEGF165 человека.
Результаты, показанные на Фиг. 3, демонстрируют значение ЕС50 гуманизированной молекулы VEGF165-H988, специфически связывающейся с рекомбинантным VEGF165 человека, составляет 2,42 нг/мл, R2=0,999; значение ЕС50 Авастина, связывающегося с рекомбинантным VEGF165 человека, составляет 2,77 нг/мл, R2=1,000. Это указывает на то, что способность VEGF165-H988 связываться с рекомбинантным белком VEGF165 человека немного лучше, чем у Авастина. Антитело H7N9-R1, использованное в качестве отрицательного контроля, не обладает способностью связываться с рекомбинантным белком VEGF165 человека.
3.1.2 Тест на аффинность связывания гуманизированного антитела VEGF-H988 с рекомбинантным белком VEGF165
Аффинности VEGF165-H988 и Авастина (от Roche) измеряли при различных концентрациях с использованием сенсора, покрытого стрептавидином, и иммобилизованного белка VEGF165, меченного биотином.
Сначала рекомбинантный белок VEGF165 человека метили биотином в молярном соотношении 1:2 в ходе следующего процесса: буфер (20 мМ Трис, 150 мМ NaCl, рН 8,0) рекомбинантного белка VEGF замещали ФБС методом упьтрафильтрации в пробирке для ультрафильтрации центрифугированием 5000 MW и получали 567,57 мкг белка, измеренного методом количественной оценки с помощью УФ, полученные белки смешивали с 20 мМ раствором биотина в молярном соотношении 1:2 для инкубации в течение 30 мин при комнатной температуре в темноте, затем снова фильтровали в пробирке для ультрафильрации центрифугированием 5000 MW для удаления несвязавшегося биотина. После оценки количества методом УФ, меченые биотином белки получали путем добавления равного объема глицерина и БСА до финальной концентрации 0.1%. Концентрация белка VEGF165, определенная с помощью УФ, составляла 2,08 мг/мл.
Затем измеряли аффинности VEGF165-H988 и Авастина при различных концентрациях с биотинилированными рекомбинантными белками VEGF человека, и полученные значения KD означали финальные аффинности.
Результаты, показанные в Таблице 3 демонстрируют, что, значение аффинности связывания KD VEGF165-H988 с рекомбинантным белком VEGF165 человека составило 19,5 пМ, значение константы связывания kon составило 3,44Е + 05 М-1с-1, и значение константы диссоциации kdis составляло 6,70Е-06 с-1; значение аффинности связывания KD Авастина с белком VEGF составило 29,2Е-11 пМ, значение константы связывания коп составило 1,87Е+05 М-1с-1 и значение константы диссоциации kdis составило 5.46Е-06 с-1, как показано в Таблице 3. На основании этих результатов можно сделать вывод, что аффинность, VEGF165-H988 немного выше, чем у Авастина, т.е. примерно в 1,5 раза выше, чем аффинность Авастина.

3.1.3 Определение видоспецифичной кросс-реактивности гуманизированного антитела VEGF165-H988
Рекомбинантный белок VEGF165 человека или рекомбинантный белок mVEGF164 мыши разбавляли до 0,1 мкг/мл, 1 мкг/мл и 10 мкг/мл, соответственно, и наносили на 96-луночный планшет в течение ночи при 4°С в количестве 100 мкл на лунку. Планшет промывали на следующий день, блокировали при комнатной температуре в течение 1 ч. 100 мкл VEGF165-H988, Авастин (от Roche) или антитело H7N9-R1 в виде отрицательного контроля добавляли соответственно в концентрации 1 мкг/мл и инкубировали в течение 1 ч. Планшет промывали для удаления несвязавшихся антител. Планшет инкубировали с F(ab')2 козы против IgG F(ab')2/HRP человека (Jackson ImmunoResearch Laboratories, Inc.) и затем несколько раз промывали, и добавляли раствор хромогенного субстрата до появления окраски. После завершения образования окраски измеряли OD450. Выбирая концентрацию белка в качестве горизонтальной координаты и значение OD450 в качестве вертикальной координаты, использовали программное обеспечение graphPad Prism 6.0 для построения гистограммы.
Результаты, показанные на Фиг. 4 демонстрируют, что VEGF165-H988 специфически связывается с рекомбинантным белком VEGF165 человека и обладает перекрестным связыванием с рекомбинантным белком mVEGF164 мыши.
3.2 Свойства гуманизированного антитела VEGF-H988 по блокированию рецептора
Белок VEGF165 (от SinoBiological, Inc.) в концентрации 1 мкг/мл наносили на 96-луночный планшет в количестве 100 мкл/на лунку в течение ночи при 4°С.На следующий день планшет промывали и блокировали при комнатной температуре в течение 1 ч. В каждую лунку добавляли 100 мкл 2 мкг/мл белка VEGFR2-his (от SinoBiological, Inc.), различные концентрации антитела VEGF-H988, EYLEA, Авастин (от Roche) или антитело H7N9-R1 в качестве отрицательного контроля, соответственно, и совместно инкубировали. Планшет промывали для удаления несвязавшихся антител. Планшет инкубировали с C-his-R023/HRP и затем несколько раз промывали, и добавляли раствор хромогенного субстрата до появления окраски. Для каждой исследованной группы измеряли OD450 в двух повторах после стабилизации появления окраски. Используя концентрацию указанного антитела в качестве горизонтальной координаты и степень ингибирования Р1% в качестве вертикальной координаты, использовали программное обеспечение graphPad Prism 6.0 для анализа данных и строили график кривой зависимости для расчета значения IC50.
Степень ингибирования (%) = (ODконтроль - ОDобразец)/ ODконтроль × 100%, где ODконтроль обозначает значение OD лунки только с добавленным VEGFR2-his, но без добавки гуманизированного антитела, а ODобразец обозначает значение OD лунки как с добавленным VEGFR2-his, так и с гуманизированным антителом.
Как видно на Фит.5, белок VEGFR2 может эффективно связываться с белком VEGF165 на подложке, а антитела VEGF-H988 могут эффективно ингибировать связывание белка VEGFR2 с белком VEGFR165, с несколько более слабой ингибирующей способностью, чем EYLEA, но сильнее, чем Авастин, а антитело, использованное в качестве отрицательного контроля, не обладает ингибирующим эффектом.
3.3 Ингибирование пролиферации клеток HUVEC с помощью гуманизированного антитела
3.3.1 Нейтрализующий эффект VEGF165 при различных концентрациях гуманизированного антитела VEGF-H988
Эффект VEGF-H988 по нейтрализации пролиферации клеток HUVEC, вызванной VEGF165, определяли с использованием метода WST-8. Клетки HUVEC инокулировали в 96-луночный планшет в количестве 4×103 клеток на лунку, выращивали в среде Ml99, содержащей 10% ФБС и 5% L-Gln в течение 4 ч, а затем добавляли VEGF-H988, EYLEA или Авастин (от Roche) при различных концентрациях в количестве 50 мкл на лунку, затем добавляли VEGF-165 в конечных концентрациях 1000 нг/мл, 100 нг/мл или 10 нг/мл в количестве 10 мкл на лунку, указанный 96-луночный планшет инкубировали при 37°С, 5% СО2 в инкубаторе клеток в течение 3 суток, и использовали контрольную лунку В (без клеток), отрицательный контроль М (с добавлением клеток, без добавления образца антитела, с добавлением VEGF-165) и М'(с добавлением клеток, без добавления образца антитела и без добавления VEGF-165). После инкубации добавляли 10 мкл на лунку хромогенного раствора WST-8 и указанный 96-луночный планшет инкубировали в инкубаторе с СО2 до появления окраски, OD450 и OD630 измеряли с помощью считывателя микропланшетов после стабилизации появления окраски. Для каждой лунки считывали значение (OD450 - OD630), и степень нейтрализации указанного антитела рассчитывали как значение OD для каждой группы, определенное как считанное значение указанной группы минус считанное значение пустой лунки В, степень нейтрализации, % = (значение OD отрицательного контроля М - значение OD образца) / (значение OD отрицательного контроля М - значение OD М') × 100%. Стандартную кривую рассчитывали с использованием функции автоматического анализа статистического программного обеспечения GraphPad Prism, используя концентрацию образца указанного антитела в качестве горизонтальной координаты и степень нейтрализации в качестве вертикальной координаты, и использовали уравнение логистической регрессии с 4 параметрами для построения стандартной кривой «S» для расчета половины максимальной эффективной концентрации (ЕС50) образца указанного антитела.
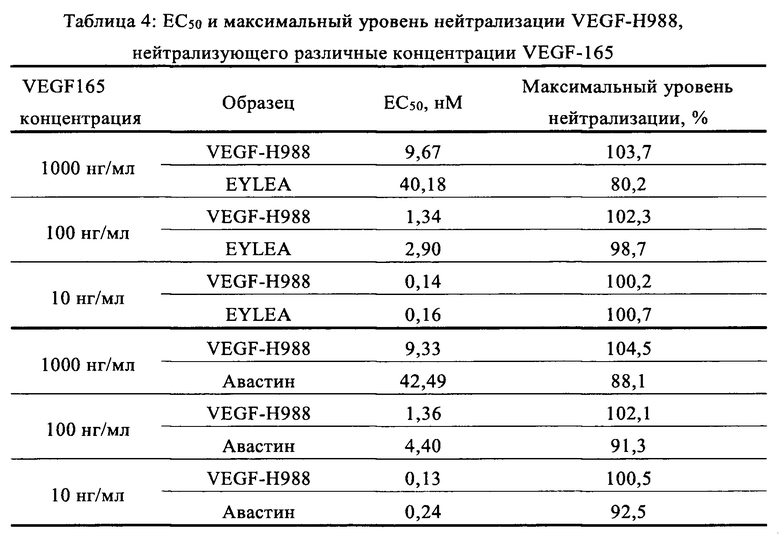
Как видно на Фиг. 6 и 7, антитело VEGF-H988 может эффективно снижать способность VEGF165 по инициации пролиферации HUVEC. Нейтрализующая способность VEGF-H988 была более сильной, чем у EYLEA и Авастина при различных концентрациях рекомбинантного VEGF165 человека; и различия в нейтрализующей способности были более сильными при увеличении концентрации VEGF165. При высоких концентрациях VEGF165, VEGF-H988 все еще обладало низкой нейтрализующей ЕС50 и имело максимальный нейтрализующий уровень, в то время как нейтрализующая ЕС50 EYLEA и Авастина постепенно увеличивалась и сопровождалась снижением максимальной степени нейтрализации. Половинные максимальные эффективные концентрации (ЕС50) и максимальные уровни нейтрализации каждого антитела, нейтрализующего VEGF165 при различных концентрациях, приведены в Таблице 4.
3.3.2 Нейтрализующий эффект различных подтипов VEGF с помощью гуманизированного антитела VEGF-H988
Метод WST-8 использовали для обнаружения эффекта VEGF-H988 по нейтрализации пролиферации клеток HUVEC, вызванной различными подтипами VEGF (VEGF165, VEGFC и VEGFD). Клетки HUVEC инокулировали в 96-луночный планшет в количестве 4×103 клеток на лунку, выращивали в среде M199, содержащей 10% ФБС и 5% L-Gln в течение 4 ч, а затем добавляли различные концентрации VEGF-H988 или Авастина (от Roche) в количестве 50 мкл на лунку, затем добавляли смесь VEGF-165, VEGFC и VEGFD (конечные концентрации составляли 25 нг/мл, 1000 нг/мл, 6000 нг/мл соответственно) в количестве 10 мкл на лунку, указанный 96-луночный планшет инкубировали при 37°С, 5% СО2 в инкубаторе клеток в течение 3 суток, и использовали контрольную лунку В (без клеток), отрицательный контроль М (с добавлением клеток, без добавления образца антитела, с добавлением VEGF) и М'(с добавлением клеток, без добавления образца антитела и без смеси VEGF). После инкубации добавляли 10 мкл на лунку хромогенного раствора WST-8, и указанный 96-луночный планшет инкубировали в инкубаторе с СО2 до появления окраски, измеряли OD450 и OD630 с помощью считывателя микропланшетов после стабилизации появления окраски. Для каждой лунки считанное значение составляло (OD450 - OD630), и степень нейтрализации указанного антитела рассчитывали как значение OD для каждой группы, определенное как считанное значение для указанной группы минус считанное значение для пустой лунки В, степень нейтрализации % = (значение OD отрицательного контроля М - значение OD образца) / (значение OD отрицательного контроля М - значение OD для М') × 100%. Стандартную кривую рассчитывали с использованием функции автоматического анализа статистического программного обеспечения GraphPad Prism, используя концентрацию образца указанного антитела в качестве горизонтальной координаты и степень нейтрализации в качестве вертикальной координаты, и использовали уравнение логистической регрессии с 4 параметрами для построения стандартной кривой «S» для расчета половины максимальной эффективной концентрации (ЕС50) образца указанного антитела.
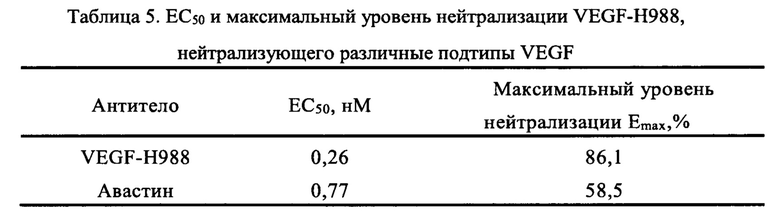
Как видно на Фит.8, в случае различных подтипов VEGF (VEGF165, VEGFC, VEGFD), действующих одновременно на клетки HUVEC, антитело VEGF-H988 имеет более сильный нейтрализующий эффект, чем Авастин. В диапазоне концентраций 0,016-4,000 нМ, VEGF-H988 имеет меньшую EC50, чем Авастин, равную 0,26 нМ и 0,77 нМ, соответственно; и VEGF-H988 обладает более высокой степенью нейтрализации, чем Авастин, равную 86,1% и 58,5% соответственно. Половинные максимальные эффективные концентрации (ЕС50) и максимальные уровни нейтрализации VEGF и Авастина по нейтрализации различных подтипов VEGF, приведены в Таблице 5.
Пример 4: Изучение токсичности антитела VEGF-H988 на мышах при нескольких введениях
Использовали мышей CD-1, по 8 животных в каждой из групп: группа возрастных животных (35 недели) и группа животных обычно используемого возраста (9 недели), половина самцов и половина самок. Мышей разделяли на четыре группы (G1-G4) в соответствии с методом полной рандомизации, по четыре мыши в каждой группе, половина самцов и половина самок. Конкретное группирование было следующим: G1: группа возрастных мышей, контрольная группа с использованием растворителя; G2: подопытная группа возрастных мышей; G3: контрольная группа мышей обычного возраста с растворителем; G4: подопытная группа мышей обычного возраста. Антитело VEGF-H988 несколько раз вводили в подопытных группах, а контрольные группы получали равный объем растворителя. Дозировка составляла 50 мг/кг, объем каждого введения составлял 5 мл/кг (с 1-й по 8-ю дозировку) и 10 мл/кг (с 9-й по 16-ю дозировку), соответственно; способ введения - внугрибрюшинное (в/б) введение, с частотой два раза в неделю. У всех мышей брали образцы орбитальной крови перед первым введением и через 0,5 ч, 2 ч, 4 ч, 6 ч, 24 ч, 48 ч, 72 ч после первого введения, а также перед первым введением и через 1 ч после каждого второго введения для фармакокинетических и иммуногенных анализов. Массу тела мышей измеряли и записывали перед каждым введением дозировки. Подробный режим дозирования показан в Таблице 6.
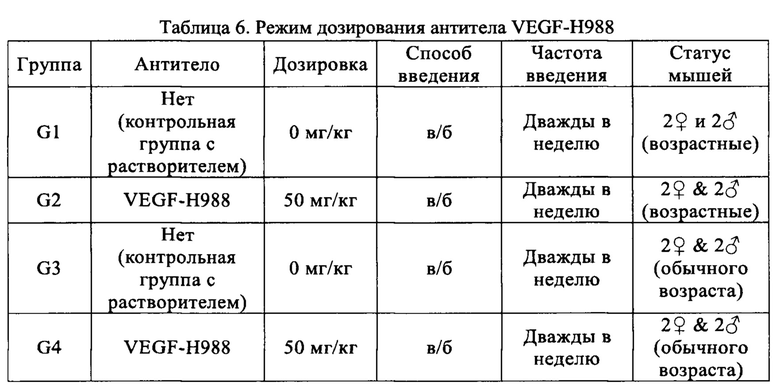
Масса тела мышей в группах с антителом VEGF-H988 была аналогична массе тела мышей соответствующих контрольных групп с растворителем, что указывает на то, что антитело VEGF-H988 не влияло на массу тела мышей. В ходе исследования клинические отклонения наблюдались в группах с антителом VEGF-H988. Всех мышей подвергали макроскопическому вскрытию, видимых аномалий в тканях и органах не было обнаружено. Гистопатологическое исследование показало, что у всех мышей имелся венозный застой в печени, легких и почках, но достоверной разницы между контрольными и исследуемыми группами не было. У редких особей мышей наблюдались розовые серозные или эритроцитарные застои в селезенке и воспалительно-клеточная инфильтрация в почках, что считалось индивидуальным отличием и не было связано с введением препарата. Токсикокинетические параметры мышей после введения первой дозы суммированы в Таблице 7.
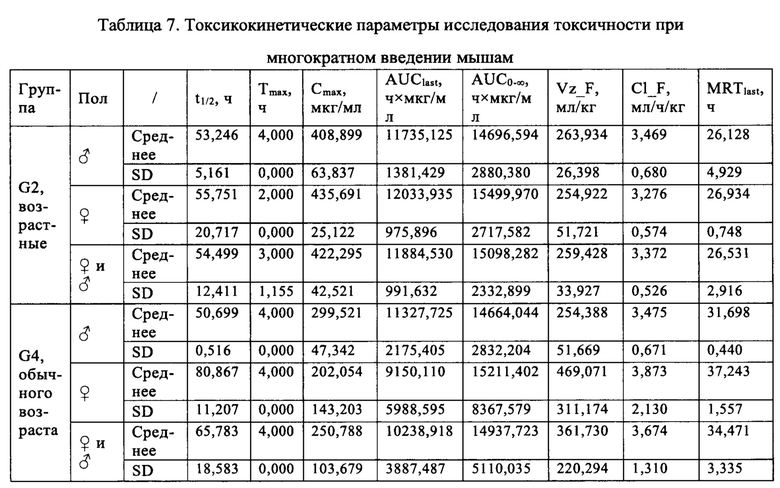
Как показано на кривой зависимости концентрации лекарственного средства в крови от времени на Фиг. 9-11, не было существенной разницы в тенденции изменения концентрации в крови между самцами и самками животных в каждой из групп. Не наблюдалось значительного изменения после многократного приема в обеих группах, что может быть связано с достижением уровней насыщения в группах, получавших более высокие дозы. Пиковые концентрации в крови в группе G2 (возрастные) и в группе G4 (обычного возраста) были в основном одинаковыми, а минимальные концентрации в возрастной группе были несколько ниже, что может быть связано с большими индивидуальными различиями внутри группы.
У мышей в каждой из групп не наблюдалось значительного увеличения или даже некоторого снижения концентрации препарата в крови через 1 ч после введения, что плохо коррелировало с иммуногенностью (данные испытаний иммуногенности см. в Таблице 8). Кроме того, аномальная концентрация препарата в крови через 1 ч после введения также может быть связана со скоростью распределения препарата in vivo и индивидуальными особенностями.
Хотя результаты теста на иммуногенность показали положительные результаты у части испытуемых, разница между SNR и пороговым значением SCP была небольшой, на самом деле они очень близки, таким образом, сильный положительный результат не показан, и считается, что вышеуказанные положительные результаты вероятно были ложноположительными. В Таблице 8 суммированы результаты иммуногенности исследования токсичности при повторяющемся дозировании антитела VEGF-H988 на мышах.
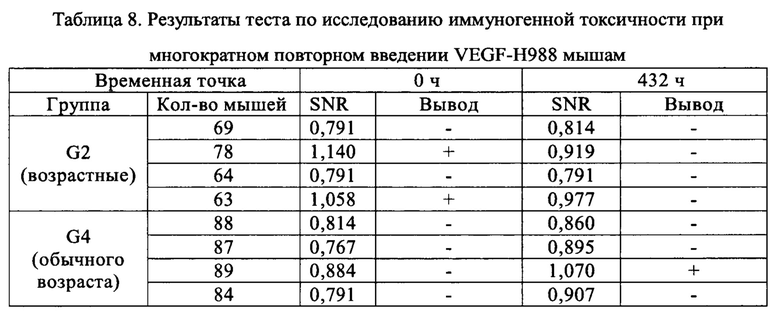
Исследование повторного многократного введение на токсичность на мышах показало, что никаких значительных токсических эффектов, связанных с лекарственным средством, не наблюдалось, когда указанное антитело VEGF-H988 вводили несколько раз в дозировке 50 мг/кг дважды в неделю путем внутрибрюшинной инъекции возрастным мышам CD-1 и мышам CD-1 обычного возраста в количестве 16 доз.
Пример 5: Исследование эффективности в людях в ксенотрансплантатной модели рака толстой и прямой кишки с линией клеток НСТ-116
Самки голых мышей Balb/c-nu были получены из Beijing Vital River Laboratory Animal Technology Co., Ltd. (лицензия на использование животных №SCXK (Пекин) 2016-0006, сертификат качества №11400700373019). Образцы опухоли НСТ116 получали из мышей, привиты клеточной линией НСТ116 собственной разработки. Самкам голых мышей Balb/c-nu возраста 6 недель инокулировали подкожно опухоль НСТ116 размера 2×2×2 мм3, а когда объем опухоли достигал примерно 300 мм3, мышам вводили по группам внутрибрюшинно 1 мг/кг VEGF-H988 или Авастина (от SinoCelltech Co., Ltd.) или соответствующий растворитель, соответственно, дважды в неделю. Еженедельно измеряли объемы опухолей для оценки противоопухолевой эффективности VEGF-H988 по сравнению с Авастином.
Как видно на Фиг. 12, в случае большего исходного объема опухоли от примерно 300 мм3 и меньшей дозы (1 мг/кг) скорость роста опухоли постепенно снижалась в группе, получавшей VEGF-H988, по сравнению с контрольной группой, не получавшей дозу, начиная с 7-го дня после введения. Ингибирующее действие Авастина на рост опухоли начиналось на 11-й день после введения, позднее, чем в группе, получавшей эквивалентную дозу VEGF-H988. Исследования ингибирования опухоли в моделях ксенотрансплантата опухоли НСТ-116 показали, что ингибирующее действие VEGF-H988 на рост опухоли лучше, чем у Авастина.




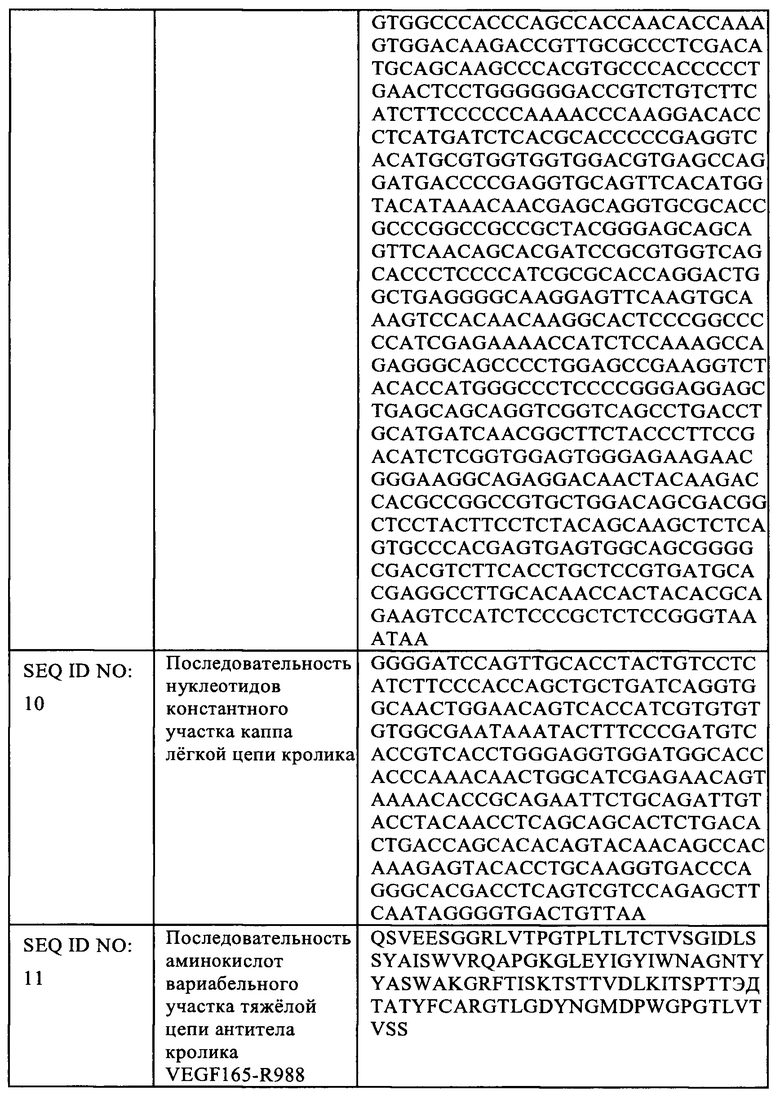


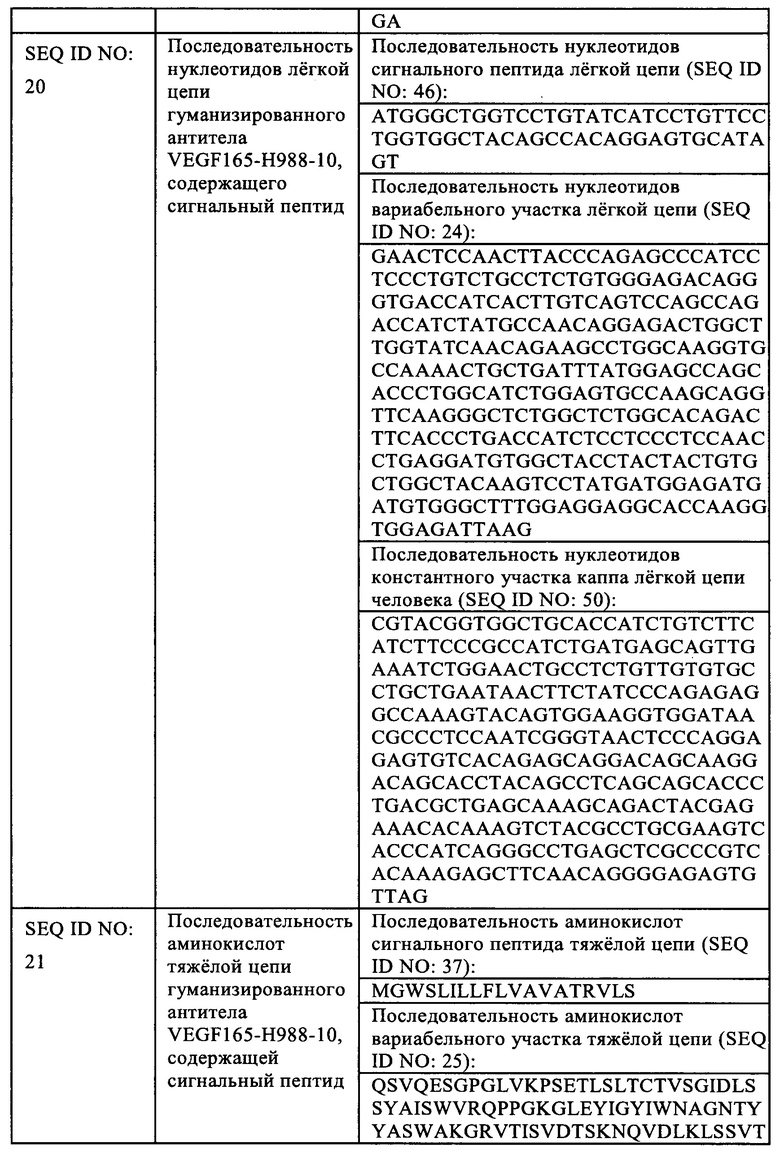
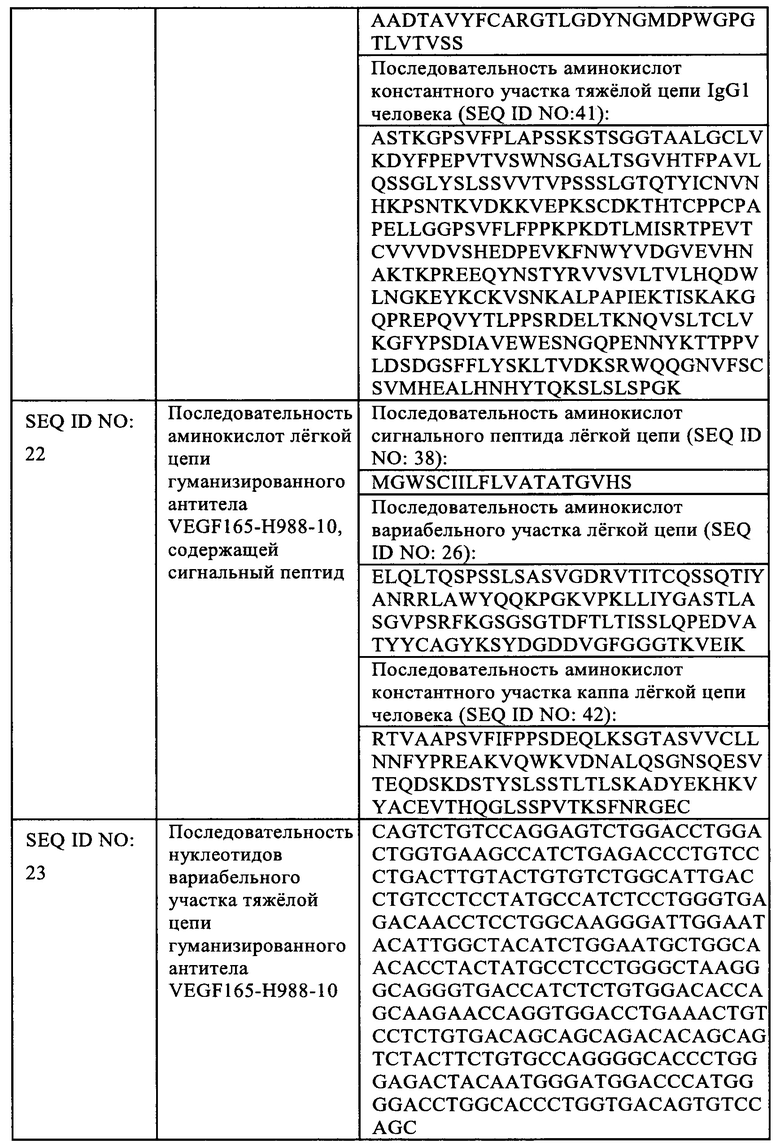

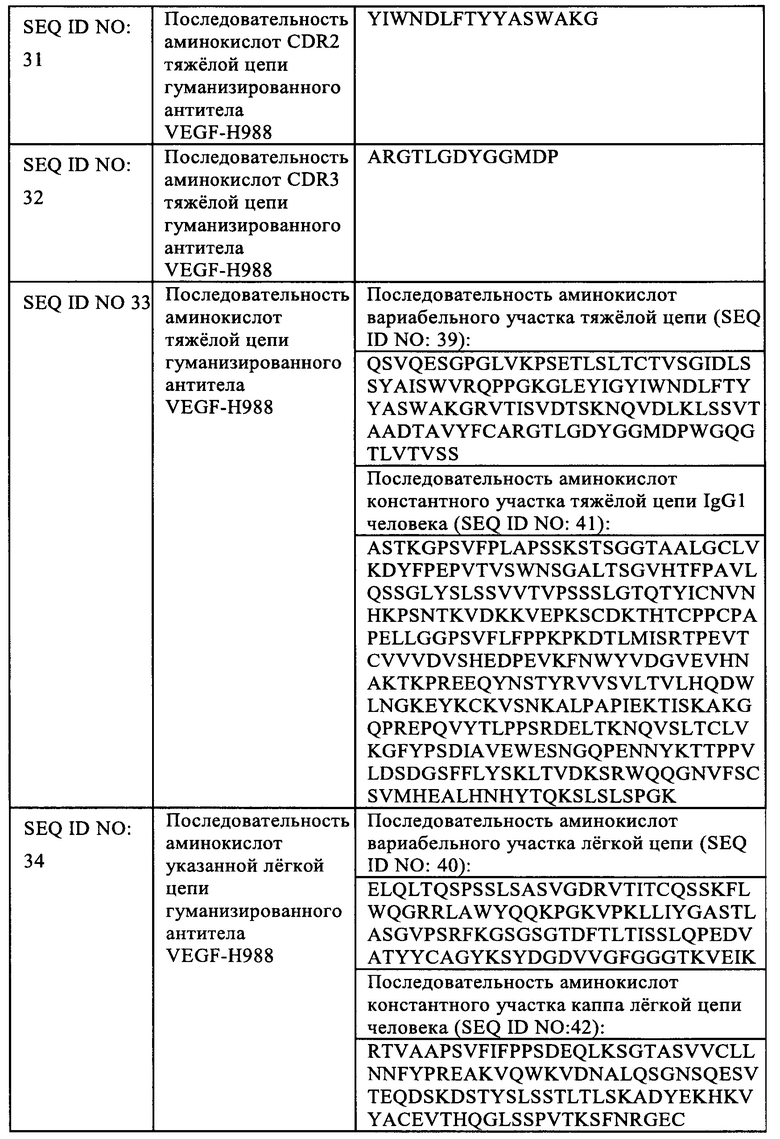
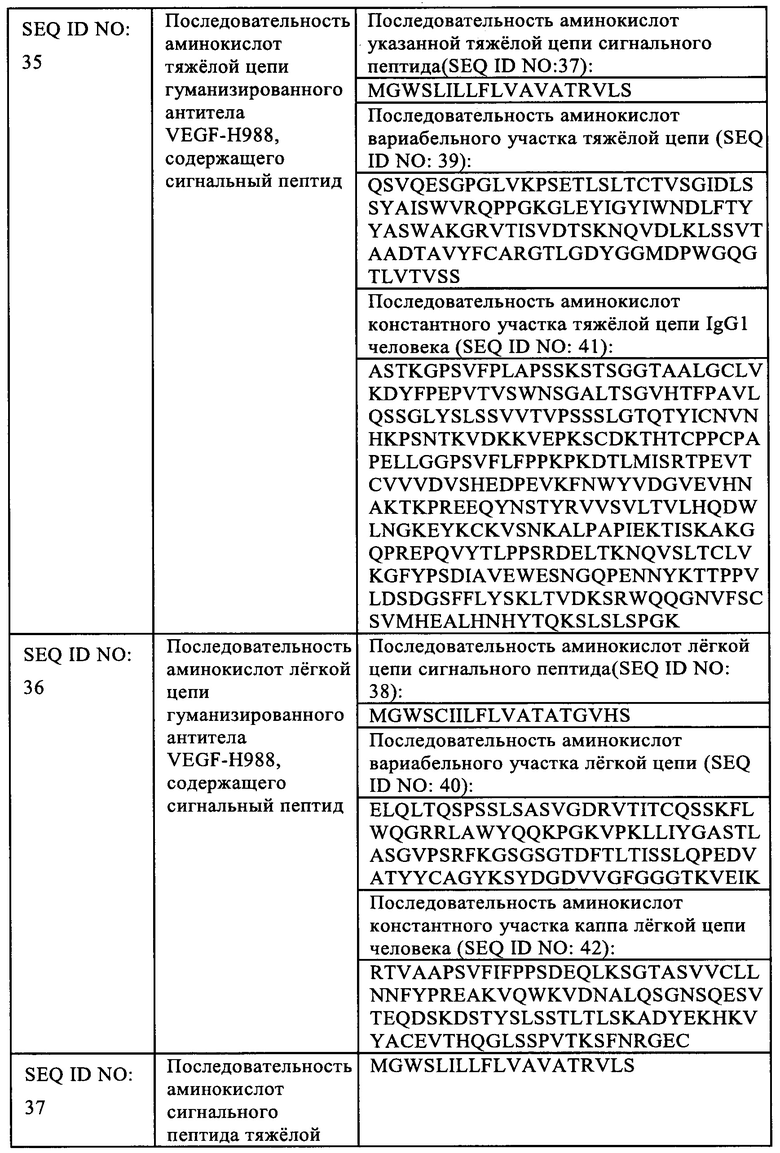




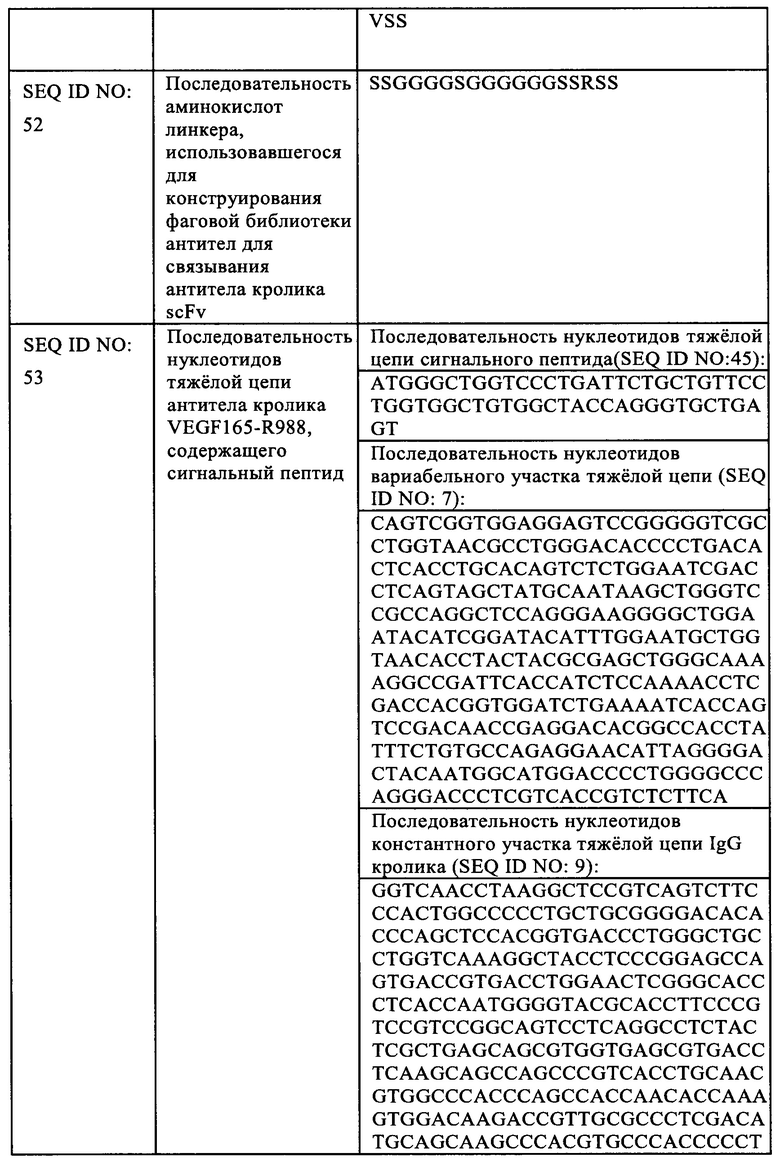

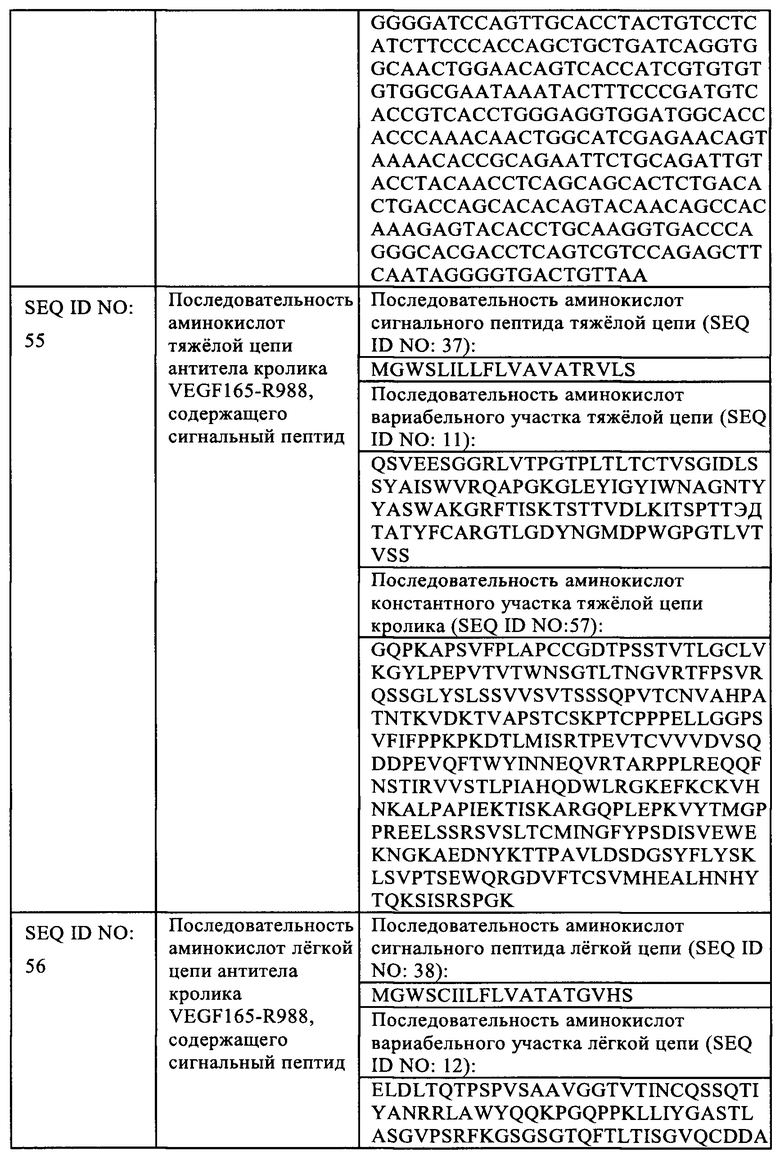
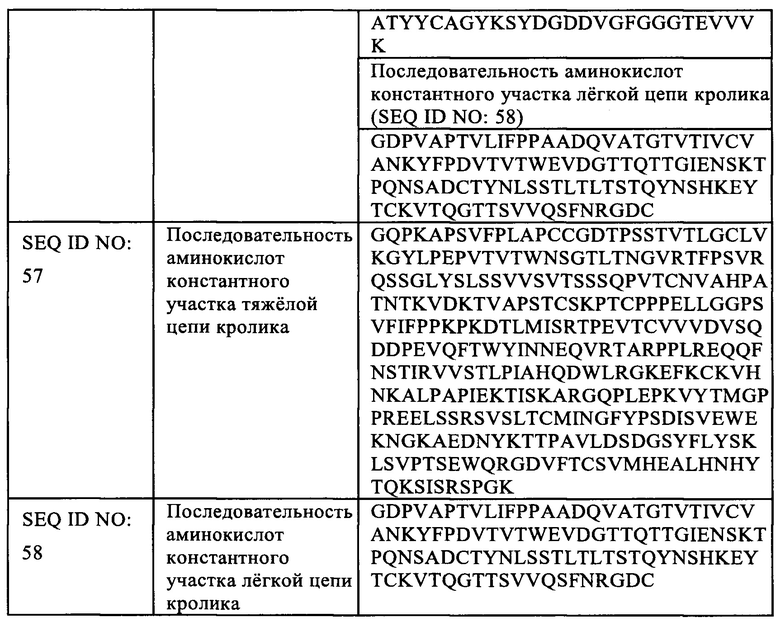
| название | год | авторы | номер документа |
|---|---|---|---|
| Fab ФРАГМЕНТ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ VEGF И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2802960C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2009 |
|
RU2531523C9 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2016 |
|
RU2648152C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2014 |
|
RU2640253C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2009 |
|
RU2588467C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2009 |
|
RU2542382C2 |
| ГУМАНИЗАЦИЯ АНТИТЕЛ КРОЛИКА С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАРКАСА АНТИТЕЛА | 2018 |
|
RU2696202C1 |
| ГУМАНИЗАЦИЯ АНТИТЕЛ КРОЛИКА С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАРКАСА АНТИТЕЛА | 2009 |
|
RU2567006C2 |
| ГУМАНИЗАЦИЯ АНТИТЕЛ КРОЛИКА С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАРКАСА АНТИТЕЛА | 2014 |
|
RU2652907C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2018 |
|
RU2696972C1 |
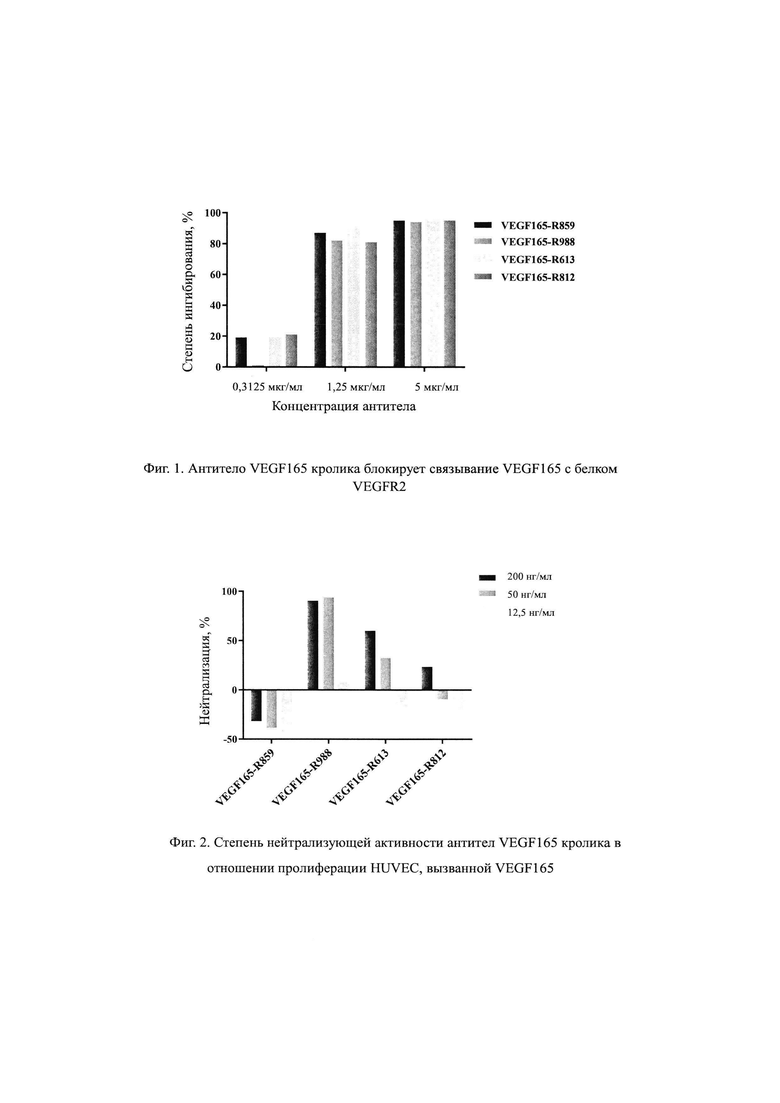
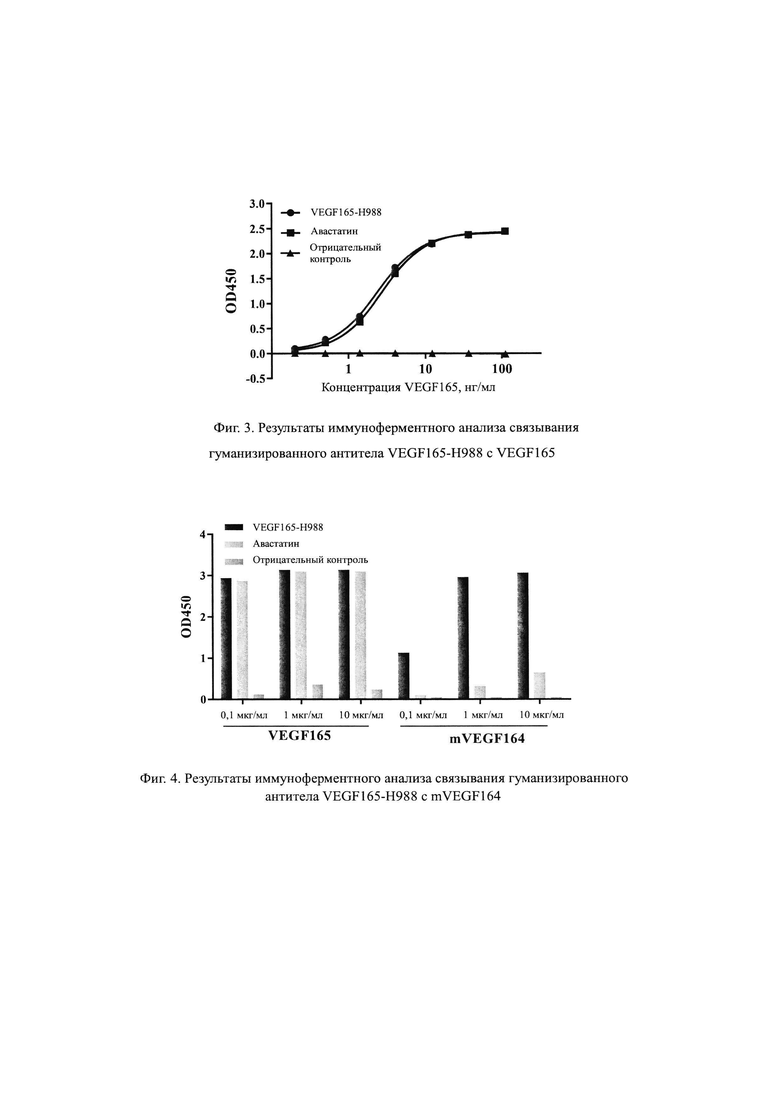
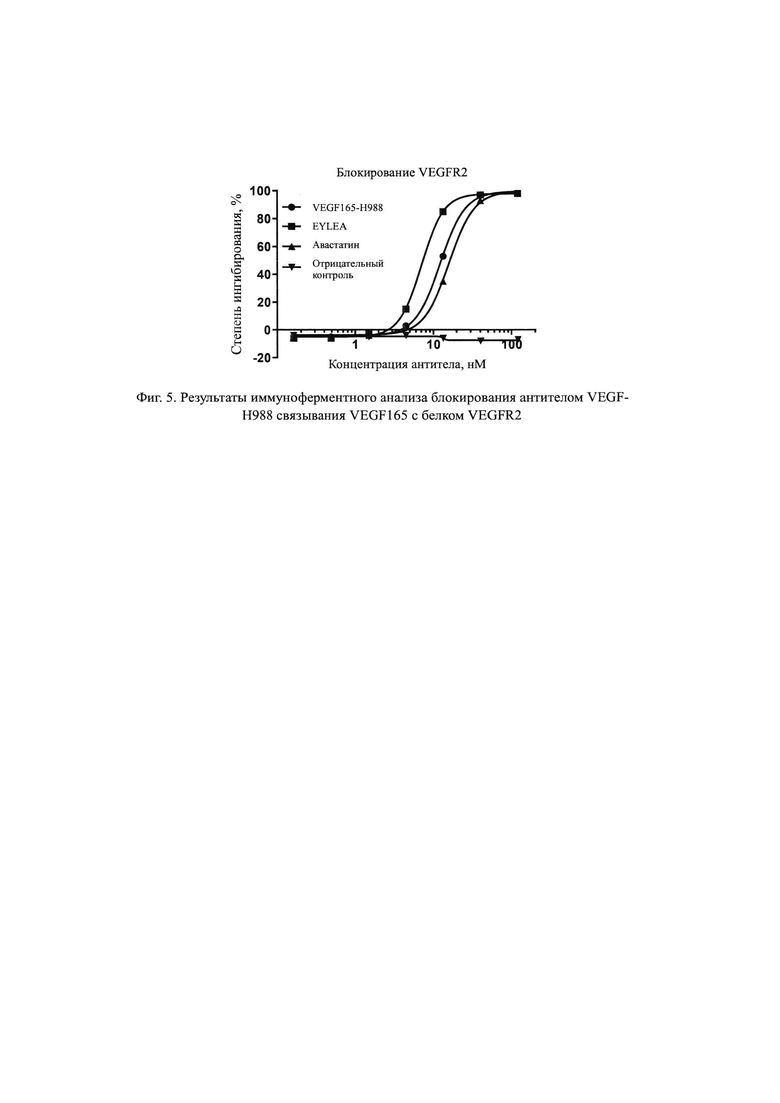
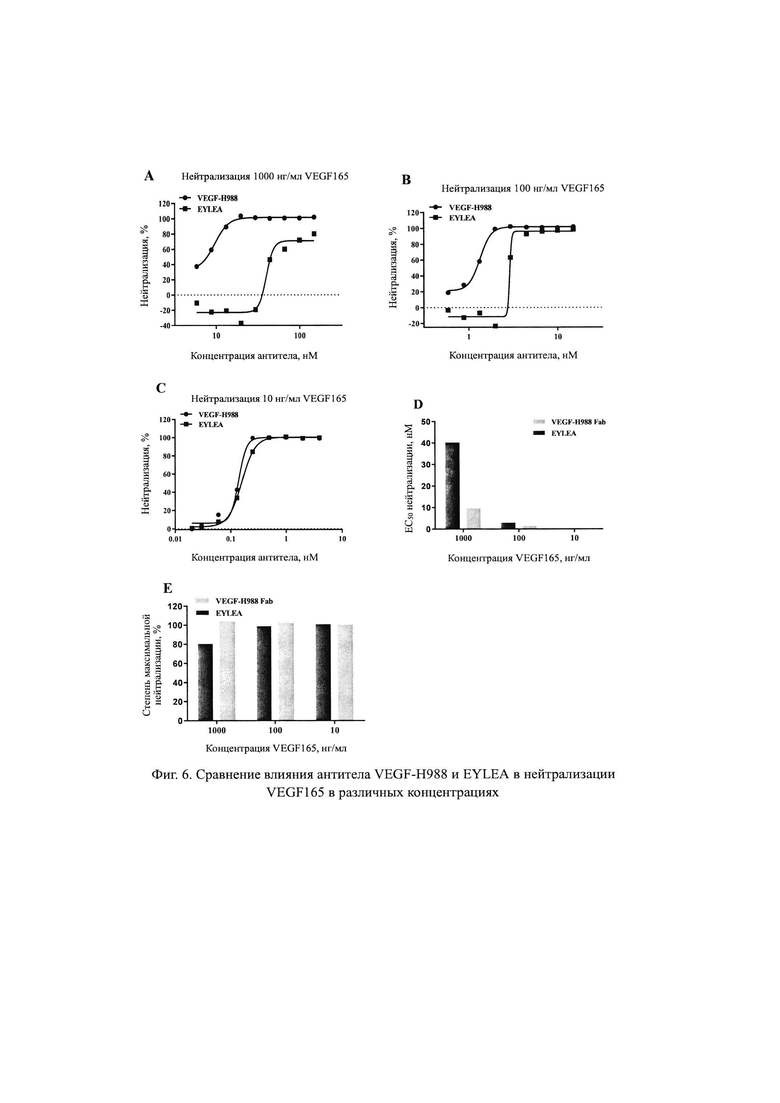
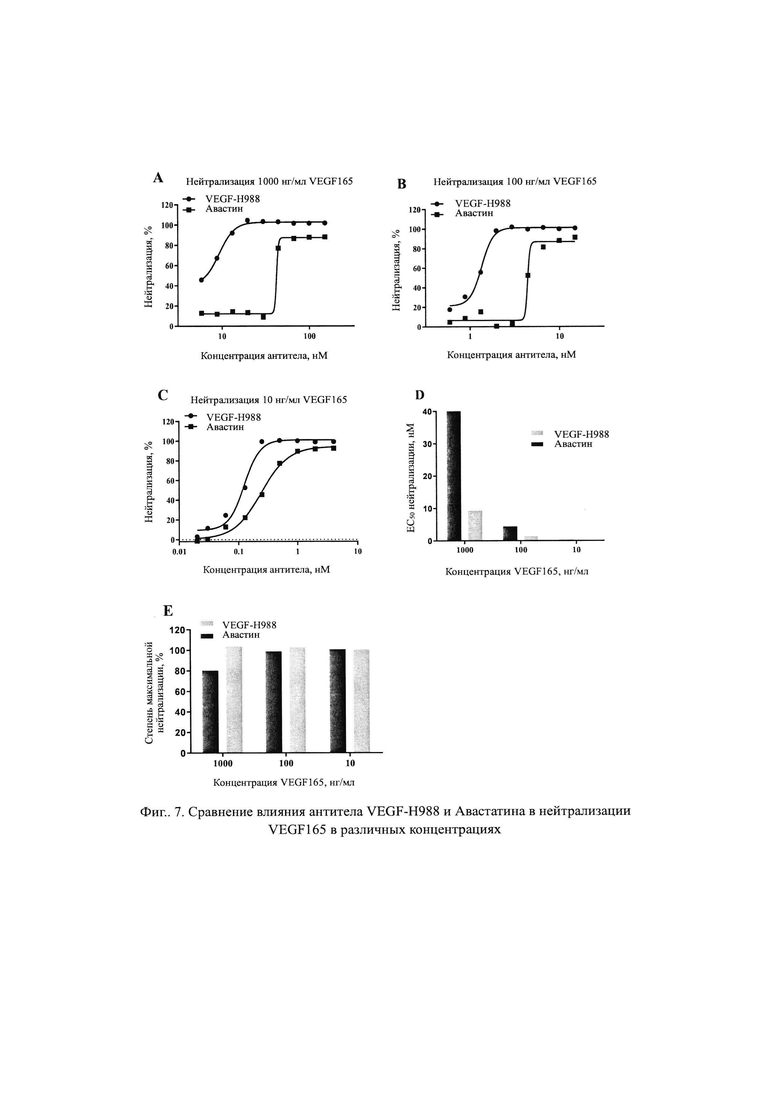
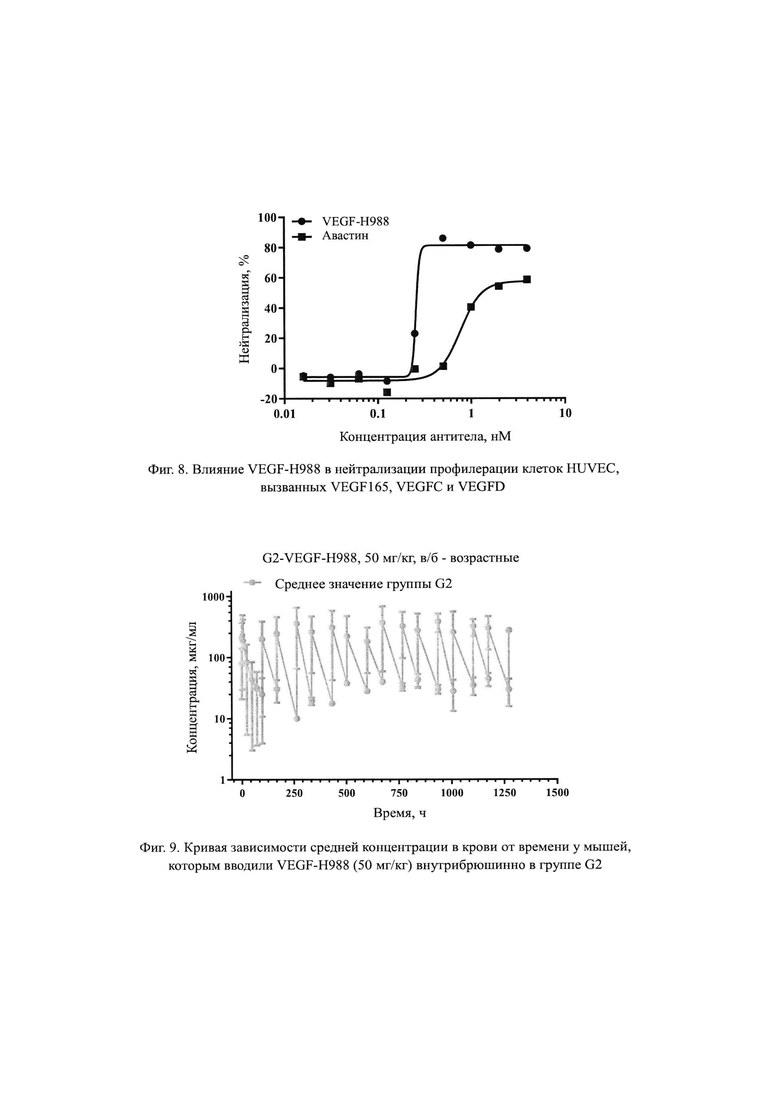
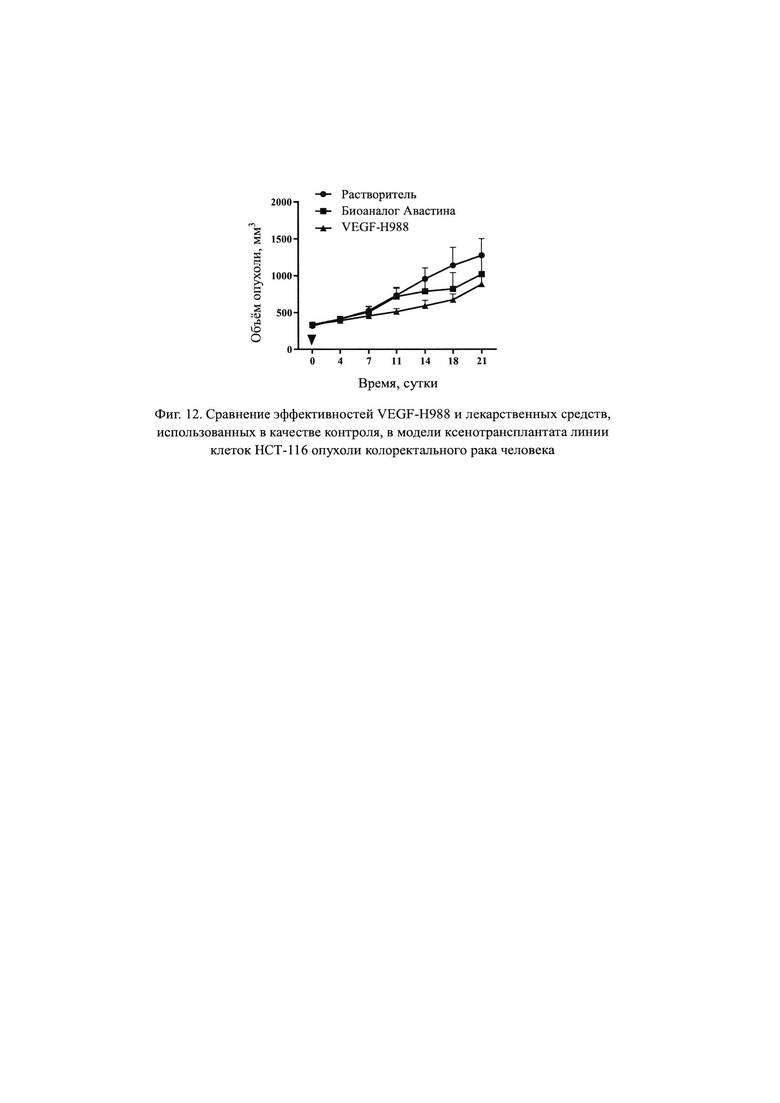
Настоящее изобретение относится к изолированным антителам против VEGF или их антиген-связывающим фрагментам. Указанное антитело, описанное в настоящем изобретении, может специфически связываться с VEGF с высокой аффинностью и блокировать связывание VEGF с рецептором VEGFR2. Указанные антитела также нейтрализуют эффект пролиферации белка VEGF165 и множества подтипов VEGF в клетках HUVEC и могут применяться при клиническом лечении заболеваний, ассоциированных c повышенной экспрессией VEGF. Также заявленное изобретение относится к нуклеиновой кислоте, кодирующей антитело против VEGF или его антиген-связывающий фрагмент, вектору экспрессии, содержащему нуклеиновую кислоту, клетке-хозяину, способу получения антитела против VEGF или его антиген-связывающего фрагмента, фармацевтической композиции для лечения заболевания, ассоциированного с повышенной экспрессией VEGF, способу лечения рака толстой и прямой кишки, применению антитела против VEGF или его антиген-связывающего фрагмента для получения лекарственного средства для лечения рака толстой и прямой кишки, фармацевтической комбинации для лечения заболевания, ассоциированного с повышенной экспрессией VEGF и к набору для лечения заболевания, ассоциированного с повышенной экспрессией VEGF. 12 н. и 12 з.п. ф-лы, 5 пр., 12 ил., 8 табл.
1. Изолированное антитело против VEGF или его антиген-связывающий фрагмент, содержащий вариабельный участок тяжёлой цепи, содержащий участок CDR1 тяжёлой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 30, и участок CDR2 тяжёлой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 31, и участок CDR3 тяжёлой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 32; и вариабельный участок лёгкой цепи, содержащий участок CDR1 лёгкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 27, участок CDR2 лёгкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 28, и участок CDR3 лёгкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 29, при этом указанный антиген-связывающий фрагмент не является Fаb-фрагментом.
2. Антитело против VEGF или его антиген-связывающий фрагмент по п. 1, содержащий вариабельный участок тяжёлой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 39, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности, указанной в SEQ ID NO: 39, и вариабельный участок лёгкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 40, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности, указанной в SEQ ID NO: 40.
3. Антитело против VEGF или его антиген-связывающий фрагмент по п. 1 или 2, отличающийся тем, что указанное антитело дополнительно содержит константный участок лёгкой цепи и константный участок тяжёлой цепи, предпочтительно указанный константный участок лёгкой цепи содержит последовательность аминокислот, указанную в SEQ ID NO: 42, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности, указанной в SEQ ID NO: 42, и/или указанный константный участок тяжёлой цепи является константным участком тяжёлой цепи IgG1 и имеет последовательность аминокислот, указанную в SEQ ID NO:41, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности, указанной в SEQ ID NO: 41.
4. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-3, отличающийся тем, что указанное антитело против VEGF или его антиген-связывающий фрагмент является гуманизированным антителом или химерным антителом.
5. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-4, отличающиеся тем, что указанное антитело против VEGF или его антиген-связывающий фрагмент представляет собой моноклональное антитело.
6. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-5, отличающийся тем, что указанное антитело против VEGF или его антиген-связывающий фрагмент представляет антитело IgG, предпочтительно антитело IgG1.
7. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-6, отличающийся тем, что указанное антитело против VEGF или его антиген-связывающий фрагмент имеют аффинность связывания KD 1-100 пM, предпочтительно 5-50 пM, более предпочтительно 19,5 пМ с рекомбинантным белком VEGF165 человека.
8. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-7, отличающийся тем, что указанный антиген-связывающий фрагмент представляет собой фрагмент Fv, Fab', Fab’-SH, F(ab')2, Fd, Fd', молекулу одноцепочечного антитела или однодоменное антитело; при этом указанная молекула одноцепочечного антитела предпочтительно представляет собой антитело scFV, ди-scFV, три-scFv, диатело или scFab.
9. Изолированное антитело против VEGF или его антиген-связывающий фрагмент, содержащий вариабельный участок тяжёлой цепи, содержащий участок CDR1 тяжёлой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 16, участок CDR2 тяжёлой цепи, содержащий последовательность аминокислот, указанную B SEQ ID NO: 17, и участок CDR3 тяжёлой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 18; и вариабельный участок лёгкой цепи, содержащий участок CDR1 лёгкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 13, участок CDR2 лёгкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 14, и участок CDR3 лёгкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 15.
10. Антитело против VEGF или его антиген-связывающий фрагмент по п. 9, содержащий вариабельный участок тяжёлой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 25, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности, указанной в SEQ ID NO: 25, и вариабельный участок лёгкой цепи, содержащий последовательность аминокислот, указанную в SEQ ID NO: 26, или последовательность аминокислот, идентичную по меньшей мере на 90%, 92%, 95%, 98% или 99% последовательности, указанной в SEQ ID NO: 26.
11. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 9, 10, отличающийся тем, что указанное антитело против VEGF или его антиген-связывающий фрагмент представляет собой гуманизированное антитело или химерное антитело.
12. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 9-11, отличающийся тем, что указанное антитело против VEGF или его антиген-связывающий фрагмент представляет собой моноклональное антитело.
13. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 9-12, отличающийся тем, что указанный антиген-связывающий фрагмент представляет собой фрагмент Fv, Fab, Fab’, Fab'-SH, F(ab’)2, Fd, Fd', молекулу одноцепочечного антитела или однодоменное антитело; при этом указанная молекула одноцепочечного антитела предпочтительно представляет собой scFV, ди-scFv, три-scFv, диатело или scFab.
14. Нуклеиновая кислота, кодирующая антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-13.
15. Нуклеиновая кислота по п. 14, содержащая последовательность нуклеотидов, указанную в SEQ ID NO: 7, и/или последовательность нуклеотидов, указанную в SEQ ID NO: 8; или последовательность нуклеотидов, указанную в SEQ ID NO: 23, и/или последовательность нуклеотидов, указанную в SEQ ID NO: 24; или последовательность нуклеотидов, указанную в SEQ ID NO: 47, и/или последовательность нуклеотидов, указанную в SEQ ID NO: 48.
16. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 14 или 15.
17. Клетка-хозяин для получения антитела против VEGF или его антиген-связывающего фрагмента по любому из пп. 1-13, содержащая нуклеиновую кислоту по п. 14 или 15 или вектор экспрессии по п. 16.
18. Способ получения антитела против VEGF или его антиген-связывающего фрагмента по любому из пп. 1-13, включающий выращивание клетки—хозяина по п. 17 в условиях, подходящих для экспрессии антитела и выделения экспрессированного антитела из культуральной жидкости.
19. Фармацевтическая композиция для лечения заболевания, ассоциированного с повышенной экспрессией VEGF, содержащая антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-13, или нуклеиновую кислоту по любому из пп. 14, 15, или вектор экспрессии по п. 16, и фармацевтически приемлемый носитель.
20. Антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-13, или фармацевтическая композиция по п. 19 для применения в лечении и диагностики рака толстой и прямой кишки.
21. Способ лечения рака толстой и прямой кишки, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества антитела против VEGF или его антиген-связывающего фрагмента по любому из пп. 1-13, или фармацевтической композиции по п. 19.
22. Применение антитела против VEGF или его антиген-связывающего фрагмента по любому из пп. 1-13, или фармацевтической композиции по п. 19 для получения лекарственного средства для лечения рака толстой и прямой кишки.
23. Фармацевтическая комбинация для лечения заболевания, ассоциированного с повышенной экспрессией VEGF, содержащая антитело против VEGF или его антиген-связывающий фрагмент по любому из пп. 1-13, или фармацевтическую композицию по п. 19 с одним или более терапевтическим агентом.
24. Набор для лечения заболевания, ассоциированного с повышенной экспрессией VEGF, содержащий: а) антитело против VEGF или eгo антиген-связывающий фрагмент по любому из пп. 1-13, или фармацевтическую композицию по п. 19, или фармацевтическую комбинацию по п. 23 и б) устройство для введения.
| LIEN S | |||
| et al., Therapeutic anti-VEGF antibodies, Therapeutic antibodies, 2008, pp.131-150 | |||
| АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ (VEGF) | 2008 |
|
RU2514148C2 |
| ЛЕЧЕНИЕ АНТИТЕЛАМИ ПРОТИВ VEGF | 2004 |
|
RU2519669C2 |
| Стабильная водная композиция антитела против фактора роста эндотелия сосудов (VEGF) | 2016 |
|
RU2699544C2 |
| FERRARA N | |||
| et al., Bevacizumab (Avastin), a humanized anti-VEGF monoclonal antibody for cancer therapy, Biochemical and biophysical research communications, 2005, Vol.333, N2, | |||
Авторы
Даты
2023-12-15—Публикация
2020-07-17—Подача