В данной заявке декларируется приоритет предварительной заявки США No.60/474480, зарегистрированной 30 мая 2003 г., раскрытие которой включено здесь в качестве ссылки.
Область техники, к которой относится изобретение
Данное изобретение относится в целом к лечению заболеваний и патологических состояний человека. Более конкретно изобретение относится к антиангиогенной терапии рака, либо одной, либо в сочетании с другой противораковой терапией.
Известный уровень техники
Рак остается одной из наиболее смертельных опасностей для здоровья человека. В США рак каждый год поражает около 1,3 миллиона новых больных и является второй лидирующей причиной смерти после заболеваний сердца, вызывая по расчетам приблизительно 1 из 4 смертей. Предсказывается также, что рак в пределах 5 лет может опередить сердечно-сосудистые заболевания по смертности, став причиной смерти номер один. Солидные опухоли ответственны за большинство из данных смертей. Хотя существуют значительные успехи в медицинском лечении определенных видов рака, везде 5-летняя выживаемость для всех типов рака улучшилась только приблизительно на 10% в последние 20 лет. Рак, или злокачественные опухоли, метастазируют и растут быстро, неконтролируемым образом, что делает предельно трудным их своевременное выявление и лечение. Более того, рак может возникнуть почти в любой ткани организма путем злокачественной трансформации одной или нескольких нормальных клеток в ткани, и каждый тип рака, происходящий из конкретной ткани, отличается от других.
Имеющиеся в настоящее время способы лечения рака являются относительно неизбирательными. Хирургическим путем удаляется пораженная ткань; радиотерапия вызывает уменьшение солидных опухолей; и химиотерапия уничтожает быстро делящиеся клетки. Химиотерапия ведет, в частности, к многочисленным побочным эффектам, в некоторых случаях настолько тяжелым, что это ограничивает дозу, которая может быть дана и, следовательно, мешает использованию потенциально эффективных лекарств. Более того, при раке часто развивается резистентность к химиотерапевтическим препаратам.
Таким образом, существует срочная потребность в специфических и более эффективных способах лечения рака.
Ангиогенез представляет собой важное клеточное событие, при котором клетки эндотелия сосудов пролиферируют, удаляются и реорганизуются для формирования новых сосудов из предсуществующей сосудистой сети. Существуют убедительные доказательства того, что развитие сосудов для кровоснабжения существенно для нормальных и патологических пролиферативных процессов (Folkman и Klagsbrun (1987) Science 235:442-447). Доставка кислорода и питательных веществ, а также удаление продуктов катаболизма представляют собой лимитирующие скорость стадии для большинства ростовых процессов, происходящих в многоклеточных организмах. Таким образом, обычно предполагается, что участие сосудов необходимо не только для развития и дифференцировки органов в эмбриогенезе, но также для заживления ран и репродуктивных функций у взрослого.
Ангиогенез также вовлечен в патогенез различных нарушений, включая, но не ограничиваясь этим, опухоли, пролиферативные ретинопатии, связанную с возрастом атрофию кожи, ревматоидный артрит (RA) и псориаз. Ангиогенез существенен для роста большинства первичных опухолей и их последующего метастазирования. Опухоли могут поглощать достаточное количество питательных веществ и кислорода путем простой диффузии до их размера в 1-2 мм, с этого момента их дальнейший рост требует развития сосудов. Данный процесс, как считается, включает вовлечение прилегающей зрелой сосудистой сети хозяина в прорастание новых капиллярных кровеносных сосудов, которые растут в направлении опухолевой массы и затем инфильтрируют ее. Кроме того, ангиогенез опухоли включает вовлечение циркулирующих эндотелиальных клеток-предшественников из костного мозга для стимуляции неоваскуляризации. Kerbel (2000) Carcinogenesis 21:505-515; Lynden et al. (2001) Nat. Med. 7:1194-1201.
В то время как индукция новых кровеносных сосудов рассматривается как преобладающий способ ангиогенеза опухоли, последние данные показали, что некоторые опухоли могут расти с помощью кооптирования существующих кровеносных сосудов хозяина. Кооптированная васкуляризация затем регрессирует, ведя к регрессии опухоли, что в конечном итоге является обратимым за счет ангиогенеза, индуцируемого гипоксией по краю опухоли. Holash et al. (1999) Science 284:1994-1998.
Ввиду существенной физиологической и патологической важности ангиогенеза много работ было посвящено выяснению факторов, способных регулировать данный процесс. Предполагается, что процесс ангиогенеза регулируется за счет баланса между про- и антиангиогенными молекулами и он нарушается при различных заболеваниях, особенно при раке. Carmeliet и Jain (2000) Nature 407:249-257.
Фактор роста клеток эндотелия сосудов (VEGF), который также обозначают VEGF-A или фактор проницаемости сосудов (VPF), описан как ключевой регулятор как нормального, так и аномального ангиогенеза. Ferrara и Davis-Smyth (1997) Endocrine Rev. 18:4-25; Ferrara (1999) J. Mol. Med. 77:527-543. По сравнению с другими факторами роста, которые вносят вклад в процессы образования сосудов, VEGF является уникальным по своей высокой специфичности в отношении эндотелиальных клеток сосудистой системы. VEGF важен для эмбрионального васкулогенеза и ангиогенеза. Carmeliet et al. (1996) Nature 380:435-439; Ferrara et al. (1996) Nature 380:439-442. Более того, VEGF требуется для циклической пролиферации кровеносных сосудов в женском репродуктивном тракте и для роста костей и образования хряща. Ferrara et al. (1998) Nature Med. 4:336-340; Gerber et al. (1999) Nature Med. 5:623-628.
Являясь ангиогенным фактором при ангиогенезе и васкулогенезе, VEGF, кроме того, в качестве плейотропного ростового фактора оказывает множественные биологические эффекты при других физиологических процессах, таких как выживание эндотелиальных клеток, проницаемость сосудов и вазодилатация, хемотаксис моноцитов и приток кальция. Ferrara и Davis-Smyth (1997), выше. Более того, в последних исследованиях сообщалось о митогенных эффектах VEGF на некоторые не эндотелиальные типы клеток, такие как эпителиальные пигментные клетки сетчатки, клетки протоков поджелудочной железы и швановские клетки. Guerrin et al. (1995) J. Cell Physiol. 164:385-394; Oberg-Welsh et al. (1997) Mol. Cell. Endocrinol. 126:125-132; Sondell et al. (1999) J. Neurosci. 19:5731-5740.
Существенные доказательства свидетельствуют также о критической роли VEGF в развитии состояний или заболеваний, которые включают патологический ангиогенез. мРНК VEGF гиперэкспрессируется большинством исследованных опухолей человека (Berkman et al. J.Clin. Invest 91:153-159 (1993); Brown et al. Human Pathol. 26:86-91 (1995); Brown et al. Cancer Res. 53:4727-4735 (1993); Mattern et al. Brit. J. Cancer. 73:931-934 (1996); и Dvorak et al. Am J. Pathol. 146:1029-1039 (1995)). Концентрация VEGF в жидкостях глаза также высоко коррелирует с наличием активной пролиферации кровеносных сосудов у больных с диабетической и другими связанными с ишемией ретинопатиями (Aiello et al. N. Engl. J. Med. 331:1480-1487 (1994)). Более того, последние исследования продемонстрировали локализацию VEGF в хороидальных неоваскулярных мембранах у больных, страдающих AMD (Lopez et al. Invest. Ophtalmo. Vis. Sci. 37:855-868 (1996)).
Учитывая его центральную роль в стимуляции опухолевого роста, VEGF является привлекательной мишенью для терапевтического воздействия. Действительно, для лечения неопластических заболеваний в настоящее время разрабатываются разнообразные терапевтические стратегии, направленные на блокаду VEGF или системы проведения сигнала его рецепторами. Rosen (2000) Oncologist 5:20-27; Ellis et al. (2000) Oncologist 5:11-15; Kerbel (2001) J. Clin. Oncol. 19:45S-51S. До сих пор блокада VEGF/рецептора VEGF моноклональными антителами и ингибирование проведения сигнала рецепторами с помощью ингибиторов тирозинкиназ являются наиболее изученными подходами. Исследуются также рибозимы VEGFR-1, конъюгаты токсинов VEGF и растворимые рецепторы VEGF.
Антитело против VEGF «бевацизумаб (BV)», также известное как «rhuMAb VEGF» или «AvastinTM», представляет собой рекомбинантное гуманизированное моноклональное антитело против VEGF, созданное в соответствии с Presta et al. (1997) Cancer Res. 57:4593-4599. Оно включает мутантные области рамки считывания IgG1 человека и антигенсвязывающие области, определяющие комплементарность, от моноклонального антитела A.4.6.1 против hVEGF мыши, что блокирует связывание VEGF человека со своими рецепторами. Приблизительно 93% аминокислотной последовательности бевацизумаба, включая большую часть областей рамки считывания, происходит от IgG1 человека и приблизительно 7% последовательности происходит от антитела A4.6.1 мыши. Бевацизумаб имеет молекулярную массу приблизительно 149000 дальтон и является гликозилированным. Бевацизумаб исследуется клинически для лечения различных типов рака, и некоторые ранние стадии испытаний продемонстрировали многообещающие результаты. Kerbel (2001) J. Clin. Oncol. 19:45S-51S; De Vore et al. (2000) Proc. Am. Soc. Clin. Oncol. 19:485a; Johnson et al. (2001) Proc. Am. Soc. Clin. Oncol. 20:315a; Kabbinavar et al. (2003) J. Clin. Oncol. 21:60-65.
Краткое изложение сущности изобретения
Настоящее изобретение касается способов применения антитела против VEGF для лечения заболеваний и патологических состояний. В частности, в изобретении предлагается эффективный подход к лечению рака, частично основанный на неожиданных результатах о том, что добавление антитела против VEGF к стандартной химиотерапии ведет к статистически значимым и клинически выраженным улучшениям у больных раком.
Соответственно, в одном аспекте в изобретении предлагается способ лечения рака у больного человека, включающий введение больному эффективных количеств антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент.
Рак, поддающийся лечению с помощью настоящего изобретения, включает, но не ограничивается этим, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких типов рака включают плоскоклеточный рак, рак легких (включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких), рак брюшной полости, гепатоцеллюлярный рак, рак желудка или отделов, относящихся к желудку (включая рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки или относящийся к почке, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карциному печени и различные типы рака головы и шеи, а также B-клеточную лимфому (включая низко злокачественную/фолликулярную не-ходжкинскую лимфому (NHL); мелколимфоцитарную (SL) NHL; среднезлокачественную/фолликулярную NHL; среднезлокачественную, диффузную NHL; высокозлокачественную иммунобластную NHL; высокозлокачественную лимфобластную NHL; высокозлокачественную мелкоклеточную с нерасщепленными ядрами NHL; массированное заболевание NHL; оболочечноклеточную лимфому; лимфому, связанную со СПИДом; и макроглобулинемию Вальденстрома); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); лейкозный ретикулоэндотелиоз; хронический миелобластный лейкоз; и пострансплантационное лимфопролиферативное нарушение (PTLD), а также аномальную пролиферацию сосудов, связанную с факоматозом, отеком (таким как связанный с опухолями мозга), и синдром Мейга. Предпочтительно, рак выбран из группы, состоящей из рака молочной железы, колоректального рака, ректального рака, немелкоклеточного рака легких, не-ходжкинской лимфомы (NHL), почечноклеточного рака, рака простаты, рака печени, рака поджелудочной железы, саркомы мягких тканей, саркомы Капоши, карциноидной опухоли, рака головы и шеи, меланомы, рака яичников, мезотелиомы и множественной миеломы. Более предпочтительно, рак представляет собой колоректальный рак. Злокачественные состояния, поддающиеся лечению по изобретению, включают метастатический рак. Способ настоящего изобретения особенно подходит для лечения васкуляризированных опухолей.
Любой химиотерапевтический агент, проявляющий противораковую активность, может быть применен в соответствии с настоящим изобретением. Предпочтительно химиотерапевтический агент выбран из группы, состоящей из алкилирующих агентов, антиметаболитов, аналогов фолиевой кислоты, аналогов пиримидина, аналогов пурина и относящихся к этому ингибиторов, алкалоидов барвинка, токсинов эпиподофилла, антибиотиков, L-аспарагиназы, ингибитора топоизомеразы, интерферонов, координационных комплексов платины, замещенной антрацендионом мочевины, производных метилгидразина, супрессанта коры надпочечников, адренокортикостероидов, прогестинов, эстрогенов, антиэстрогена, андрогенов, антиандрогена и аналога гонадотропин-рилизинг гормона. Более предпочтительно химиотерапевтический агент выбран из группы, состоящей из 5-фторурацила (5-FU), лейковорина (LV), иринотекана, оксалиплатина, капецитабина, паклитаксела и доксетаксела. Два или более химиотерапевтических агента могут быть применены в коктейле при введении в сочетании с введением антитела против VEGF. Одна предпочтительная сочетанная химиотерапия представляет собой химиотерапию на основе фторурацила, включающую 5-FU и один или более другие химиотерапевтический(ие) агент(ы). Подходящие режимы дозировки сочетанной химиотерапии известны в данной области техники и описаны, например, в Saltz et al. (1999) Proc ASCO 18:233a и Douillard et al. (2000) Lancet 355:1041-7.
В одном аспекте в настоящем изобретении предлагается способ увеличения продолжительности выживания у человека, больного раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции эффективно увеличивает продолжительность выживания.
В другом аспекте в настоящем изобретении предлагается способ увеличения безрецидивного периода выживания у человека, больного раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции эффективно увеличивает продолжительность безрецидивного периода выживания.
Далее, в настоящем изобретении предлагается способ лечения группы людей, больных раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции эффективно увеличивает показатель ответной реакции в группе больных.
В еще одном аспекте в настоящем изобретении предлагается способ увеличения продолжительности ответа у человека, больного раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции эффективно увеличивает продолжительность ответа.
В изобретении также предлагается способ лечения больного человека, предрасположенного к колоректальному раку или с его диагнозом, включающий введение больному эффективных количеств антитела против VEGF. Колоректальный рак может быть метастатическим. Лечение антителом против VEGF может дополнительно сочетаться со стандартной для колоректального рака химиотерапией, такой как режим Saltz (5-FU/LV/иринотекан), описанный Saltz et al. (1999).
В одном предпочтительном осуществлении в изобретении предлагается способ лечения больного человека или группы больных людей с метастатическим колоректальным раком, включающий введение больному эффективных количеств композиции антитела против VEGF и антинеопластической композиции, где указанная антинеопластическая композиция включает, по меньшей мере, один химиотерапевтический агент, в результате чего совместное введение антитела против VEGF и антинеопластической композиции ведет к статистически значимому и клинически выраженному улучшению у больного, подвергаемого лечению, измеренному по продолжительности выживания, безрецидивного периода, показателю ответной реакции или продолжительности ответа. Предпочтительно, чтобы антинеопластическая композиция представляла собой схему сочетаний на основе фторурацила. Более предпочтительно, чтобы схема сочетаний включала S-FU+лейковорин, 5-FU+лейковорин+иринотекан (IFL) или 5-FU+лейковорин+оксалиплатин (FOLFOX).
В изобретении предлагается промышленный продукт, включающий контейнер, композицию в контейнере, включающую антитело против VEGF, и вкладыш-инструкцию по использованию композиции для введения больному раком композиции антитела против VEGF и антинеопластической композиции, включающей, по меньшей мере, один химиотерапевтический агент.
В изобретении также предлагается набор для лечения рака у больного, включающий упаковку, содержащую композицию антитела против VEGF, и инструкции по использованию композиции антитела против VEGF и антинеопластической композиции, включающей, по меньшей мере, один химиотерапевтический агент, для лечения рака у больного.
Краткое описание фигур
На фиг.1 представлено определение выживаемости по Каплану-Мейеру. Медиана продолжительности выживаемости (указанная пунктирными линиями) составляла 20,3 месяцев в группе, получавшей иринотекан, фторурацил и лейковорин (IFL) плюс бевацизумаб, по сравнению с 15,6 месяцами у группы, получавшей IFL плюс плацебо, что соответствует отношению опасности смерти 0,66 (P<0,001).
На фиг.2 представлено определение безрецидивного периода выживаемости по Каплану-Мейеру. Медиана продолжительности безрецидивного выживания (указанная пунктирными линиями) составляла 10,6 месяцев в группе, получавшей иринотекан, фторурацил и лейковорин (IFL) плюс бевацизумаб, по сравнению с 6,2 месяцами у группы, получавшей IFL плюс плацебо, что соответствует отношению опасности смерти 0,54 (P<0,001).
На фиг. 3A-3C представлен анализ продолжительности выживаемости в различных подгруппах больных, разделенных по основным характеристикам.
На фиг. 4 представлено определение выживаемости по Каплану-Мейеру при сравнении группы, получавшей 5-FU/LV плюс плацебо, c группой, получавшей 5-FU/LV плюс бевацизумаб (BV).
На фиг. 5 представлено определение безрецидивного периода выживаемости по Каплану-Мейеру при сравнении группы, получавшей 5-FU/LV плюс плацебо, c группой, получавшей 5-FU/LV плюс бевацизумаб (BV).
Подробное описание
предпочтительных вариантов осуществления
I. Определения
Термины «VEGF» и «VEGF-A» применяются взаимозаменяемо для обозначения фактора роста клеток сосудистого эндотелия из 165 аминокислот и относящихся к нему факторов роста клеток сосудистого эндотелия из 121, 189 и 206 аминокислот, как описано Leung et al. Science, 246:1306 (1989) и Houck et al. Mol. Endocrin., 5:1806 (1991), вместе с их существующими в природе аллельными вариантами и формами процессинга. Термин «VEGF» применяется также для обозначения укороченных форм полипептида, включающих аминокислоты с 8 по 109 или с 1 по 109 из 165 аминокислот фактора роста клеток сосудистого эндотелия человека. Ссылка на любую из таких форм VEGF может быть найдена в настоящей заявке, например, под обозначением “VEGF(8-109)”, “VEGF(1-109)” или “VEGF165”. Положения аминокислот «укороченного» нативного VEGF нумеруются, как указано в нативной последовательности. Например, положение 17 аминокислоты (метионин) в укороченном нативном VEGF также представляет собой положение 17 (метионин) в нативном VEGF. Укороченный нативный VEGF обладает связывающим сродством для KDR и рецепторов Flt-1, сравнимым с нативным VEGF.
«Антитело против VEGF» представляет собой антитело, которое связывается с VEGF со значительным сродством и специфичностью. Предпочтительно, чтобы антитело против VEGF изобретения могло быть использовано в качестве терапевтического агента для направленности и вмешательства в заболевания или состояния, в которые вовлечена активность VEGF. Антитело против VEGF обычно не должно связываться ни с другими гомологами VEGF, такими как VEGF-B или VEGF-C, ни с другими факторами роста, такими как PIGF, PDGF или bFGF. Предпочтительное антитело против VEGF является моноклональным антителом, которое связывается с тем же эпитопом, что и моноклональное антитело A4.6.1, продуцируемое гибридомой ATCC HB 10709. Более предпочтительно, чтобы антитело против VEGF представляло собой рекомбинантное моноклональное гуманизированное антитело против VEGF, созданное в соответствии с Presta et al. (1997) Cancer Res. 57:4593-4599, включая, но не ограничиваясь этим, антитело, известное как бевацизумаб (BV; AvastinTM).
«Антагонист VEGF» относится к молекуле, способной нейтрализовать, блокировать, ингибировать, аннулировать, снижать или вмешиваться в активность VEGF, включая его связывание с одним или более рецепторов VEGF. Антагонисты VEGF включают антитела против VEGF и их антигенсвязывающие фрагменты, рецепторные молекулы и производные, которые специфически связываются с VEGF, тем самым препятствуя его связыванию с одним или более рецепторами, антитела против рецептора VEGF и антагонисты рецепторов VEGF, такие как низкомолекулярные ингибиторы VEGFR-тирозинкиназ.
В настоящем описании и формуле изобретения нумерация остатков в тяжелой цепи иммуноглобулина соответствует индексу EU, как в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), определенно включенного здесь в качестве ссылки. «Индекс EU, как в Kabat» относится к нумерации остатков антитела IgG1 EU человека.
«Нативная последовательность» полипептида включает полипептид, обладающий той же последовательностью аминокислот, что и полипептид природного происхождения. Таким образом, нативная последовательность полипептида может обладать аминокислотной последовательностью полипептида, существующего в природе любого млекопитающего. Такие нативные последовательности полипептида могут быть выделены из природных источников или могут быть получены рекомбинантным или синтетическим способами. Термин «нативная последовательность» полипептида конкретно охватывает существующие в природе укороченные или секретируемые формы полипептида (например, последовательность внеклеточного домена), существующие в природе варианты форм (например, формы альтернативного сплайсинга) и существующие в природе аллельные варианты полипептида.
Полипептидный «вариант» обозначает биологически активный полипептид, имеющий, по меньшей мере, приблизительно 80% идентичности аминокислотной последовательности с нативной последовательностью полипептида. Такие варианты включают, например, полипептиды, в которых один или более аминокислотных остатков добавлены или удалены на N- или C-конце полипептида. Обычно вариант должен иметь, по меньшей мере, приблизительно 80% идентичности аминокислотной последовательности, более предпочтительно, по меньшей мере, приблизительно 90% идентичности аминокислотной последовательности и даже более предпочтительно, по меньшей мере, приблизительно 95% идентичности аминокислотной последовательности с нативной последовательностью полипептида.
Термин «антитело» применяют в широком смысле, и он включает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, мультивалентные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител (смотри ниже), до тех пор, пока они проявляют желаемую биологическую активность.
Если не указано иначе, выражение «мультивалентное антитело» применяют в данном описании для обозначения антитела, включающего три или более антигенсвязывающих сайта. Мультивалентное антитело предпочтительно конструируют как имеющее три или более антигенсвязывающих сайтов, и это обычно не нативная последовательность антитела IgM или IgA.
«Фрагменты антител» включают только часть интактного антитела, обычно включая антигенсвязывающий сайт интактного антитела и, таким образом, сохраняя способность связывать антиген. Примеры фрагментов антител, охватываемых настоящим изобретением, включают: (i) Fab фрагмент, имеющий домены VL, CL, VH и CH1; (ii) Fab' фрагмент, который представляет собой Fab фрагмент, имеющий один или более цистеиновых остатков на С-конце домена CH1; (iii) Fd фрагмент, имеющий домены VH и CH1; (iv) Fd' фрагмент, имеющий домены VH и CH1 и один или более цистеиновых остатков на С-конце домена CH1; (v) Fv фрагмент, имеющий домены VL и VH одного плеча антитела; (vi) dAb фрагмент (Ward et al., Nature 341, 544-546 (1989)), который состоит из домена VH; (vii) выделенных областей CDR; (viii) F(ab')2 фрагментов, двухвалентного фрагмента, включающего два Fab' фрагмента, соединенных дисульфидным мостиком в шарнирной области; (ix) одноцепочечных молекул антител (например, одной цепи Fv; scFv) (Bird et al., Science 242:423-426 (1988); и Huston et al., PNAS (USA) 85:5879-5883 (1988)); (x) «двойные антитела» с двумя антигенсвязывающими сайтами, включающими вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же самой полипептидной цепи (смотри, например, европейский патент EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); (xi) «линейные антитела», включающие пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые совместно с полипептидами комплементарной легкой цепи образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng. 8(10):1057-1062 (1995); и патент США No. 5641870).
Применяемый здесь термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными за исключением возможных возникающих в природе мутаций, которые могут присутствовать в минорном количестве. Моноклональные антитела являются высокоспецифичными, будучи направленными против единственного эпитопа. Более того, в отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. Модификация «моноклональное» не была создана как требующая получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые в соответствии с настоящим изобретением, могут быть получены с помощью гибридомного способа, впервые описанного Kohler et al., Nature 256:495 (1975), или могут быть получены путем способов рекомбинантной ДНК (смотри, например, патент США No. 4816567). «Моноклональные антитела» могут быть также выделены из фаговых библиотек антител с применением способов, описанных, например, в Clackson et al., Nature 352:624-628 (1991) or Marks et al., J. Mol. Biol. 222:581-597 (1991).
Моноклональные антитела здесь конкретно включают «гибридные» антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, происходящих от конкретных видов или принадлежащих к конкретному классу или подклассу антител, в то время как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям в антителах, происходящих от других видов или принадлежащих к другому классу или подклассу антител, то же относится к фрагментам антител, до тех пор пока они проявляют желаемую биологическую активность (патент США No. 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Приближенные к человеческим», или «гуманизированные» формы антител не человека (например, мыши) представляют собой гибридные антитела, которые содержат минимальную часть последовательности иммуноглобулина не от человека. Главным образом гуманизированные антитела представляют собой иммуноглобулины человека (антитело реципиента), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области видов, отличных от человека (антитело донора), таких как мышь, крыса, кролик или примат, не являющийся человеком, имеющими желаемую специфичность, аффинность и емкость. В некоторых случаях остатки области рамки считывания (FR) иммуноглобулина человека заменяют соответствующими остатками не от человека. Более того, гуманизированные антитела могут включать остатки, которые не найдены в антителе реципиента или в антителе донора. Данные модификации делаются для дополнительного усовершенствования создания антитела. В целом гуманизированное антитело должно включать по существу все из, по меньшей мере, одного и обычно двух вариабельных доменов, в которых все или по существу все из гипервариабельных петель соответствуют таковым от иммуноглобулина, не относящегося к человеку, и все или по существу все из FRs относятся к последовательности иммуноглобулина человека. Гуманизированное антитело необязательно должно также включать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно таковую от иммуноглобулина человека. Для дополнительных подробностей смотри Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
«Антитело человека» представляет собой такое, которое обладает аминокислотной последовательностью, соответствующей таковой антитела, продуцируемого человеком, и/или создано с применением любого из способов для создания антител человека, как раскрывается здесь. Данное определение антитела человека конкретно исключает гуманизированное антитело, включающее антигенсвязывающие остатки не от человека. Антитела человека могут быть получены с применением различных способов, известных в данной области техники. В одном осуществлении антитело человека выбрано из библиотеки фагов, где библиотека фагов экспрессирует антитела человека (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. PNAS (USA) 95:6157-6162 (1998)); Hoogenboom и Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)). Антитела человека могут быть также созданы путем введения локусов иммуноглобулина человека в трансгенных животных, например мышей, у которых эндогенные гены иммуноглобулина были частично или полностью инактивированы. При нагрузке наблюдается продукция антитела человека, которое имеет близкое сходство с имеющимся у людей во всех отношениях, включая реорганизацию гена, сборку и репертуар антител. Данный подход описан, например, в патентах США 5545807; 5545806; 5,569,825; 5625126; 5633425; 5661016, и в следующих научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368:812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg и Huszar, Intern. Rev. Immunol. 13:65-93 (1995). Альтернативно, антитело человека может быть получено путем иммортализации В-лимфоцитов человека, продуцирующих антитело, направленное против антигена-мишени (такие В-лимфоциты могут быть получены от индивидуума или могут быть проиммунизированы in vitro). Смотри, например, Cole et al., Monoclonal Antibodies и Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147 (1):86-95 (1991); и патент США No. 5750373.
Антитело со «зрелой аффинностью» представляет собой антитело с одним или более изменений в одной или более его CDRs, что ведет к улучшению аффинности антитела в отношении антигена по сравнению с родительским антителом, которое не обладает таким(ми) изменением(ями). Предпочтительные антитела со зрелой аффинностью должны иметь наномолярную или даже пикомолярную аффинность в отношении антигена-мишени. Антитела со зрелой аффинностью получают с помощью способов, известных в данной области техники. Marks et al. Bio/Technology 10:779-783 (1992) описывает созревание аффинности путем перестановки доменов VH и VL. Случайный мутагенез CDR и/или остатков рамки считывания описывается: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al, J. Mol. Biol. 226:889-896 (1992).
«Выделенный» полипептид представляет собой полипептид, который идентифицирован и отделен или получен из компонента своего природного окружения. Загрязняющие компоненты его природного окружения представляют собой материалы, которые будут препятствовать диагностическому или терапевтическому применению полипептида, и могут включать ферменты, гормоны и другие белковые или не белковые растворы. В предпочтительных осуществлениях полипептид должен быть очищен (1) до более 95% по массе полипептида при определении методом Лоури и наиболее предпочтительно до более 99% по массе, (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-конца или внутренней аминокислотной последовательности при применении секвенатора с роторным стаканом, или (3) до гомогенности с помощью ПААГЭ с ДДС-Na при восстанавливающих или невосстанавливающих условиях с применением Кумасси синего или, предпочтительно, окраски серебром. Выделенный полипептид включает полипептид in situ в рекомбинантных клетках, так как, по меньшей мере, один компонент природного окружения полипептида не будет присутствовать. Обычно, однако, выделенный полипептид должен быть получен с помощью, по меньшей мере, одной стадии очистки.
«Функциональный антигенсвязывающий сайт» антитела представляет собой такой, который способен связывать антиген-мишень. Антигенсвязывающее сродство антигенсвязывающего сайта необязательно так сильно, как родительского антитела, из которого происходит антигенсвязывающий сайт, но способность связывать антиген должна быть измеримой при применении одного или различных способов, известных для оценки связывания антитела с антигеном. Более того, здесь не требуется, чтобы антигенсвязывающее сродство каждого из антигенсвязывающих сайтов мультивалентного антитела было количественно тем же самым. Для мультимерных антител здесь количество функциональных антигенсвязывающих сайтов может быть оценено с применением анализа с помощью ультрацентрифугирования, как описано в примере 2 ниже. В соответствии с данным способом анализа различные отношения антиген-мишень и мультимерное антитело объединяются в разных отношениях и рассчитывается средняя молекулярная масса комплексов, предполагающая различное число функциональных связывающих сайтов. Данные теоретические величины сравнивают с действительными экспериментальными величинами, полученными для того, чтобы оценить число функциональных связывающих сайтов.
Антитело, имеющее «биологическую особенность» обозначенного антитела, представляет собой антитело, которое обладает одной или более биологических особенностей данного антитела, которые отличают его от других антител, связывающихся с тем же антигеном.
Для скрининга антител, которые связываются с эпитопом на антигене, связанном интересующим антителом, может быть применен общепринятый тест перекрестного блокирования, такой как описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow и David Lane (1988).
«Антитело-агонист» представляет собой антитело, которое связывается с рецептором и активирует его. Обычно способность антитела-агониста к активации рецептора должна быть, по меньшей мере, качественно сходной (и может быть по существу количественно сходной) с нативным лигандом агонистом рецептора. Примером антитела-агониста является такое, которое связывается с рецептором суперсемейства рецепторов TNF и индуцирует апоптоз клеток, экспрессирующих рецептор TNF. Тесты для определения индукции апоптоза описаны, например, в WO98/51793 и WO99/37684, обе из которых особо включены здесь в качестве ссылки.
«Нарушение» представляет собой любое состояние, которое должно улучшиться при лечении антителом. Оно включает хронические и острые нарушения или заболевания, включая те патологические состояния, которые предрасполагают млекопитающего к рассматриваемому нарушению. Неограничивающие примеры нарушений, подвергаемых здесь лечению, включают доброкачественные и злокачественные опухоли; лейкозы и злокачественные новообразования лимфоидной системы; нарушения нейронов, глии, астроцитов, гипоталамуса и другие нарушения желез, макрофагов, эпителия, стромальных клеток и бластоцеля; и воспалительные, ангиогенные и иммунологические нарушения.
Термин «терапевтически эффективное количество» относится к количеству лекарства, эффективному для лечения заболевания или нарушения у млекопитающего. В случае рака терапевтически эффективное количество лекарства может снизить количество раковых клеток; снизить размер опухоли; ингибировать (т.е. до некоторой степени замедлить и предпочтительно остановить) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. до некоторой степени замедлить и предпочтительно остановить) метастазирование опухоли; ингибировать до некоторой степени рост опухоли; и/или смягчить до некоторой степени один или более симптомов, связанных с нарушением. В определенной степени лекарство может предотвратить рост и/или уничтожить существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Для лечения рака эффективность in vivo может, например, быть измерена с помощью оценки продолжительности выживаемости, времени прогрессирования заболевания (TTP), показателям ответной реакции (RR), продолжительности ответа и/или качеству жизни.
«Лечение» относится как к терапевтическому лечению, так и к профилактическим и превентивным мерам. Нуждающиеся в лечении включают тех, которые уже имеют нарушение, а также тех, у которых нарушение должно быть предотвращено.
Термины «рак» и «раковый» относятся к или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, но не ограничиваются этим, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких типов рака включают плоскоклеточный рак, рак легких (включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и мелкоклеточную карциному легких), рак брюшной полости, гепатоцеллюлярный рак, рак желудка или отделов, относящихся к желудку (включая рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки или относящийся к почке, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карциному печени и различные типы рака головы и шеи, а также В-клеточную лимфому (включая низко злокачественную/фолликулярную не-ходжкинскую лимфому (NHL); мелколимфоцитарную (SL) NHL; среднезлокачественную/фолликулярную NHL; среднезлокачественную, диффузную NHL; высокозлокачественную иммунобластную NHL; высокозлокачественную лимфобластную NHL; высокозлокачественную мелкоклеточную с нерасщепленными ядрами NHL; массированное заболевание NHL; оболочечноклеточную лимфому; лимфому, связанную со СПИДом; и макроглобулинемию Вальденстрома); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); лейкозный ретикулоэндотелиоз; хронический миелобластный лейкоз; и пострансплантационное лимфопролиферативное нарушение (PTLD), а также аномальную пролиферацию сосудов, связанную с факоматозом, отеком (таким как связанный с опухолями мозга), и синдром Мейга.
Применяемый здесь термин «хозяин-млекопитающее» относится к любому совместимому для трансплантации реципиенту. Под «совместимым» подразумевается хозяин-млекопитающее, который должен принять донорский трансплантат. Предпочтительно хозяином является человек. Если как донор трансплантата, так и хозяин являются людьми, они предпочтительно совместимы по антигенам класса II HLA, так чтобы улучшить гистосовместимость.
Применяемый здесь термин «цитотоксический агент» относится к веществу, которое ингибирует или препятствует функции клеток и/или вызывает деструкцию клеток. Термин предназначен для включения радиоактивных изотопов (например, (e.g. At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтических агентов и токсинов, таких как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты.
Термин «антинеопластическая композиция» относится к композиции, пригодной для лечения рака, включающей, по меньшей мере, один терапевтический агент, способный ингибировать или предотвращать рост или функционирование опухоли и/или вызывать деструкцию опухолевых клеток. Терапевтические агенты, подходящие для антинеопластической композиции для лечения рака, включают, но не ограничиваются этим, химиотерапевтические агенты, радиоактивные изотопы, токсины, цитокины, такие как интерфероны, и антагонистические агенты, направленные на цитокины, рецепторы цитокинов или антигены, связанные с опухолевыми клетками. Например, терапевтические агенты, применимые в настоящем изобретении, могут представлять собой антитела, такие как антитело против HER-2 и антитело против CD20, или низкомолекулярные ингибиторы тирозинкиназ, такие как ингибиторы рецептора VEGF и ингибиторы рецептора EGF. Предпочтительно терапевтический агент представляет собой химиотерапевтический агент.
«Химиотерапевтический агент» представляет собой химическое соединение, пригодное для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид CYTOXAN®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбохион, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленемеламин, триэтиленфосфорфмид, триэтилентрифосфоримид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекана); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидроксид мехлоретамина оксида, мелфалан, новембишин, фенестерин, преднимустин, трофосфамид, урациловое производное иприта; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в особенности калихеамицин гамма 1I и калихеамицин омега I1 (смотри, например, Agnew, Chem Intl. Ed. Engl. 33:183-186 (1994)); динемицин, включая динемицин A; бифосфонаты, такие как клодронат; эсперамицин; а также неокарзиностатиновый хромофор и родственные хромопротеиновые хромофоры антибиотика энедиина), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® доксорубицин (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, хеламицин, родорубицин, стрептомигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболитные агенты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналовые агенты, такие как аминоглутетимид, митотан, трилостан; добавка к фолиевой кислоте, такая как фролиновая кислота; ацеглатон; альдофосфамидный гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтансиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (в особенности T-2 токсин, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепа; таксоиды, например, TAXOL® паклитаксель (Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE™ Cremophor-free, созданный на основе альбумина состав наночастиц паклитакселя (American Pharmaceutical Partners, Schaumberg, Illinois), и TAXOTERE® доксетаксель (Rhône-Poulenc Rorer, Antony, France); хлоранбуцил; GEMZAR® гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; координационные комплексы платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (например, CPT-11); ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин и фармацевтически приемлемые соли, кислоты или производные любых из указанных выше.
В данное определение также включаются антигормональные агенты, которые действуют для регуляции или ингибирования гормонального действия на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогенов (SERMs), включая, например, тамоксифен (включая NOLVADEX® тамоксифен), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и FARESTON торенифен; ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, MEGASE® мегэстрола ацетат, AROMASIN® эксеместан, форместан, фадрозол, RIVISOR® ворозол, FEMARA® летрозол и ARIMIDEX® анастрозол; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (1,3-диоксоланнуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в особенности те, которые ингибируют экспрессию генов в путях сигнализации, вовлеченных в аномальную клеточную пролиферацию, таких как, например, PKC-альфа, Ralf и H-Ras; рибозимы, такие как ингибитор экспрессии VEGF (например, ANGIOZYME® рибозим) и ингибитор экспрессии HER2; вакцины, такие как вакцины для генной терапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; PROLEUKIN® rИЛ-2; ингибитор топоизомеразы 1 LURTOTECAN®; ABARELIX® rmRH; и фармацевтически приемлемые соли, кислоты или производные любых из указанных выше.
«Агент, ингибирующий рост» при применении здесь относится к соединению или композиции, которые ингибируют рост клетки in vitro или in vivo. Таким образом, агент, ингибирующий рост, может быть агентом, который существенно снижает процент клеток в S-фазе. Примеры агентов, ингибирующих рост, включают агенты, которые блокируют прогрессию клеточного цикла (на стадии, отличной от S фазы), такие агенты, как индуцирующие остановку на G1-фазе и остановку на M-фазе. Классические блокаторы включают винкас (винкристин и винбластин), TAXOL(R) ингибиторы топо II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Те агенты, которые останавливают цикл на G1-фазе, также действуют на остановку в M-фазе, например алкилирующие ДНК агенты, такие как тамоксифен, преднизолон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ара-C. Дополнительная информация может быть найдена в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, под названием "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно p. 13.
Термин «цитокин» является общим термином для белков, секретируемых одной клеточной популяцией, которые действуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются гормон роста, такой как гормон роста человека, N-метионильное производное гормона роста человека и гормон роста быка; паратиреоидные гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеидные гормоны, такие как фолликулостимулирующий гормон (ФСГ), тиреотропный гормон (ТТГ) и лютеинизирующий гормон (ЛГ); эпидермальный фактор роста; печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей альфа и бета; антимюллеров гормон; связанный с гонадотропином пептид мыши; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоетин(TPO); факторы роста нервов, такие как NGF-альфа; фактор роста тромбоцитов; трансформирующие факторы роста (TGFs), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста I и II; эритропоетин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и гамма, колоние-стимулирующие факторы (CSFs), такие как макрофаг-CSF (M-CSF); гранулоцит-макрофаг-CSF (GM-CSF); и гранулоцит-CSF (G-CSF); интерлейкины (ИЛ), такие как ИЛ-1, ИЛ-1-альфа, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-11, ИЛ-12; фактор некроза опухолей, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, включая LIF и лиганд kit (KL). Применяемый здесь термин цитокин включает белки из различных природных источников или из рекомбинантной клеточной культуры и биологически активные эквиваленты природных последовательностей цитокинов.
Применяемый в данной заявке термин «пролекарство» относится к форме предшественника или производного фармацевтически активного вещества, которая является менее токсичной для опухолевых клеток по сравнению с родительской формой лекарства и способна при ферментативной активации или превращении превращаться в более активную родительскую форму. Смотри, например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., «Prodrugs: A Chemical Approach to Targeted Drug Delivery, » Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства данного изобретения включают, но не ограничиваются этим, фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, модифицированные D-аминокислотами пролекарства, гликозилированные пролекарства, бета-лактам-содержащие пролекарства, необязательно замещенные феноксиацетамид-содержащие пролекарства или необязательно замещенные фенилацетамид-содержащие пролекарства, 5-фторцитозин и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарство. Примеры цитотоксических лекарств, которые могут быть превращены в пролекарственную форму для применения в данном изобретении, включают, но не ограничиваются этим, те химиотерапевтические агенты, которые описаны выше.
Термин «внутривенная инфузия» относится к введению лекарства в вену животного или больного человека в течение периода времени, большего, чем приблизительно 5 минут, предпочтительно между приблизительно от 30 до 90 минут, хотя в соответствии с изобретением внутривенную инфузию альтернативно осуществляют в течение 10 часов или менее.
Термин «внутривенный болюс» или «внутривенное быстрое введение» относится к введению лекарства в вену животного или человека так, чтобы организм получал лекарство в течение 15 минут или менее, предпочтительно 5 минут или менее.
Термин «подкожное введение» относится к введению лекарства под кожу животного или больного человека, предпочтительно в карман между кожей и подлежащей тканью, с помощью относительно медленной, поддерживаемой доставки из резервуара с лекарством. Карман может быть создан с помощью захвата или подтягивания кожи вверх и от подлежащей ткани.
Термин «подкожная инфузия» относится к введению лекарства под кожу животного или больного человека, предпочтительно в карман между кожей и подлежащей тканью, с помощью относительно медленной, поддерживаемой доставки из резервуара с лекарством в течение периода времени, включая, но не ограничиваясь этим, 30 минут или менее, или 90 минут или менее. Необязательно инфузия может быть осуществлена с помощью подкожной имплантации помпы для доставки лекарства, имплантированной под кожу животного или больного человека, где помпа доставляет предварительно определенное количество лекарства в течение предварительно определенного периода времени, такого как 30 минут, 90 минут или период времени, охватывающего длительность схемы лечения.
Термин «подкожный болюс» относится к введению лекарства под кожу животного или больного человека, где болюсная доставка лекарства занимает предпочтительно менее приблизительно 15 минут, более предпочтительно менее 5 минут и наиболее предпочтительно менее 60 секунд. Введение предпочтительно осуществляют в карман между кожей и подлежащей тканью, где карман создают, например, с помощью захвата или подтягивания кожи вверх и от подлежащей ткани.
«Ангиогенный фактор» представляет собой фактор роста, который стимулирует развитие кровеносных сосудов. Предпочтительным ангиогенным фактором здесь является фактор роста эндотелия сосудов (VEGF).
Слово «метка» при применении здесь относится к определяемому соединению или композиции, которые конъюгированы прямо или не прямо с полипептидом. Метка может быть определяемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или в случае ферментных меток может катализировать химическое изменение соединения или композиции субстрата, которое является определяемым. «Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена от, по меньшей мере, одного загрязняющего молекулу нуклеиновой кислоты вещества, с которым она обычно связана в природном источнике нуклеиновой кислоты для полипептида. Выделенная молекула нуклеиновой кислоты отлична по форме или окружению, в котором она находится в природе. Выделенные молекулы нуклеиновой кислоты, следовательно, отличаются от молекулы нуклеиновой кислоты, существующей в клетках в природе. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно экспрессируют полипептид, где, например, молекула нуклеиновой кислоты находится в хромосоме в положении, отличном от такового в клетках в природе.
Выражение «контролирующие последовательности» относится к последовательностям ДНК, необходимым для экспрессии оперативно связанной кодирующей последовательности в конкретном организме-хозяине. Контролирующие последовательности, которые подходят для прокариот, например, включают промотор, необязательно последовательность оператора и рибосом-связывающий сайт. Эукариотные клетки, как известно, используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является «оперативно связанной», когда она расположена в функциональной взаимосвязи с последовательностью другой нуклеиновой кислоты. Например, ДНК для препоследовательности или лидирующей последовательности для секреции оперативно связана с ДНК для полипептида, если он экспрессируется как препротеин, который участвует в секреции полипептида; промотор или энхансер оперативно связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или рибосом-связывающий сайт оперативно связан с кодирующей последовательностью, если он расположен так, что способствует трансляции. Обычно «оперативно связанный» означает, что последовательности ДНК, будучи связанными, являются соседними и в случае лидирующей последовательности для секреции соседними и в фазу считывания. Однако энхансеры не должны быть соседними. Присоединение осуществляется путем лигирования по традиционным сайтам рестрикции. Если такие сайты не существуют, применяют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с общепринятой практикой.
Применяемые здесь выражения «клетка», «клеточная линия» и «клеточная культура» применяют взаимозаменяемо, и все такие обозначения включают их потомков. Таким образом, слова «трансформант» и «трансформированные клетки» включают первичную целевую клетку и культуры, которые произошли из нее независимо от количества пассажей. Также понятно, что все потомки могут не быть целиком идентичными по содержанию ДНК из-за преднамеренных или случайных мутаций. Включаются мутантные потомки, которые имеют ту же функцию или биологическую активность, что и первоначально трансформированная клетка. Где планируются особые обозначения, они будут ясны из контекста.
II. Получение антител против VEGF
A. Получение антител
(i) Антиген VEGF
Способы получения и характеристики антител хорошо известны в данной области техники. Описание придерживается примеров способов продукции антител против VEGF, применяемых в соответствии с настоящим изобретением. Антиген VEGF, применяемый для продукции антител, может быть, например, молекулой VEGF165, а также другими изоформами VEGF или его фрагментом, содержащим желаемый эпитоп. Другие формы VEGF, пригодные для выработки антител против VEGF изобретения, должны быть ясны специалистам в данной области техники.
VEGF человека получен первичным скринингом библиотеки кДНК, полученной от клеток человека, с применением кДНК VEGF быка в качестве гибридизационного зонда. Leung et al. (1989) Science, 246:1306. Одна идентифицированная таким образом кДНК кодирует белок из 165 аминокислот, имеющий более 95% гомологии с VEGF быка; данный белок из 165 аминокислот обычно обозначается как VEGF человека (hVEGF)или VEGF165. Митотическая активность VEGF человека подтверждена экспрессией кДНК VEGF человека в клетках-хозяевах млекопитающих. Среды, кондиционированные клетками, трансфецированными кДНК VEGF человека, стимулировали пролиферацию эндотелиальных клеток капилляров, в то время как в случае контрольных клеток не действовали. Leung et al. (1989) Science, выше.
Хотя фактор роста эндотелиальных клеток сосудов может быть выделен и очищен из природных источников для последующего терапевтического применения, относительно низкие концентрации белка в фолликулярных клетках и высокая цена как в плане усилий, так и стоимости получаемого VEGF, делает это коммерчески невыгодным. Соответственно, предпринимались дополнительные попытки клонирования и экспрессии VEGF с помощью способов рекомбинантной ДНК. (Смотри, например, Ferrara (1995) Laboratory Investigation 72:615-618, и цитируемые здесь ссылки).
VEGF экспрессируется в различных тканях в виде множественных гомодимерных форм (121, 145, 165, 189 и 206 аминокислот на мономер) в результате альтернативного сплайсинга РНК. VEGF121 представляет собой растворимый митоген, который не связывает гепарин; более длинные формы VEGF связывают гепарин с прогрессивно увеличивающимся сродством. Гепаринсвязывающие формы VEGF могут быть расщеплены на карбоксиконце плазмином с высвобождением способных(ной) к диффузии форм(ы) VEGF. Аминокислотная последовательность карбоксиконцевого пептида, идентифицированная после расщепления плазмином, представляет собой Arg110-Arg111. Аминоконцевой белок «основы», VEGF (1-110), выделенный в виде гомодимера, связывается с нейтрализующими моноклональными антителами (такими как антитела, обозначенные как 4.6.1 и 3.2E3.1.10) и с растворимыми формами рецепторов VEGF со сходным сродством по сравнению с интактным гомодимером VEGF165.
Недавно было также идентифицировано несколько молекул, структурно сходных с VEGF, включая фактор роста плаценты (PIGF), VEGF-B, VEGF-C, VEGF-D и VEGF-E. Ferrara and Davis-Smyth (1987) Endocr. Rev., выше; Ogawa et al. (1998) J. Biological Chem. 273:31273-31281; Meyer et al. (1999) EMBO J., 18:363-374. Рецепторная тирозинкиназа, Flt-4 (VEGFR-3), была идентифицирована в качестве рецептора VEGF-C и VEGF-D. Joukov et al. (1996) EMBO. J. 15:1751; Lee et al. (1996) Proc. Natl. Acad. Sci. USA 93:1988-1992; Achen et al. (1998) Proc. Natl. Acad. Sci. USA 95:548-553. VEGF-C, как недавно было показано, вовлечен в регуляцию ангиогенеза лимфатической ткани. Jeltsch et al. (1997) Science 276:1423-1425.
Было идентифицировано два рецептора VEGF, Flt-1 (также называемый VEGFR-1) и KDR (также называемый VEGFR-2). Shibuya et al. (1990) Oncogene 8:519-527; de Vries et al. (1992) Science 255:989-991; Terman et al. (1992) Biochem. Biophys. Res. Commun. 187:1579-1586. Нейропилин-1, как было показано, является селективным рецептором VEGF, способным связывать гепаринсвязывающие изоформы VEGF (Soker et al. (1998) Cell 92:735-45). Как Flt-I, так и KDR принадлежат к семейству рецепторных тирозинкиназ (RTKs). RTKs составляют большое семейство трансмембранных рецепторов с различной биологической активностью. В настоящее время идентифицировано, по меньшей мере, девятнадцать (19) подсемейств отдельных RTK. Семейство рецепторных тирозинкиназ (RTK) включает рецепторы, которые являются ключевыми для роста и дифференцировки различных типов клеток (Yarden and Ullrich (1988) Ann. Rev. Biochem. 57:433-478; Ullrich and Schlessinger (1990) Cell 61:243-254). Функция, присущая RTKs, активируется при связывании с лигандом, что ведет к фосфорилированию рецептора и множества клеточных субстратов и в последующем к разнообразным клеточным ответам (Ullrich & Schlessinger (1990) Cell 61:203-212). Таким образом, передача сигнала, опосредованная рецепторной тирозинкиназой, инициируется путем внеклеточного взаимодействия со специфическим фактором роста (лигандом), за которой обычно следует димеризация рецептора, стимуляция присущей белковой тирозинкиназе активности и трансфосфорилирование рецептора. В результате этого создаются связывающие сайты для внутриклеточных молекул, передающих сигнал, это ведет к образованию комплексов со спектром цитоплазматических сигнальных молекул, что способствует клеточному ответу. (Например, делению, дифференцировке, метаболическим эффектам, изменениям во внеклеточном микроокружении), смотри Schlessinger and Ullrich (1992) Neuron 9:1-20. Структурно как Flt-1, так и KDR имеют во внеклеточном домене семь иммуноглобулинподобных доменов, одну трансмембранную область и консенсусную тирозинкиназную последовательность, которая прервана вставочным киназным доменом. Matthews et al. (1991) Proc. Natl. Acad. Sci. USA 88:9026-9030; Terman et al. (1991) Oncogene 6:1677-1683.
(ii) Поликлональные антитела
Поликлональные антитела предпочтительно вырабатываются у животных с помощью множественных подкожных (п/к) или внутрибрюшинных (в/б) инъекций подходящего антигена и адъюванта. Может быть полезной конъюгация подходящего антигена с белком, который является иммуногенным у иммунизируемых видов, например, гемоцианином моллюска фиссуреллии, сывороточным альбумином, тироглобулином быка или ингибитором трипсина сои, с применением бифункционального или дериватизирующего агента, например малеимидбензоилсульфосукцинимидного эфира (конъюгация через цистеиновые остатки), N-гидроксисукцинимида (через остатки лизина), глутаральдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 представляют собой различные алкильные группы.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных с помощью сочетания, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов и мышей соответственно) с 3 объемами полного адъюванта Фрейнда и введения раствора внутрикожно во множественные участки. Через один месяц животным делают бустерную инъекцию от 1/5 до 1/10 от первоначального количества пептида или конъюгата в полном адъюванте Фрейнда с помощью подкожной инъекции во множественные участки. Через от семи до 14 дней у животных берут кровь и сыворотку тестируют на титр антител. Животным делают бустерную инъекцию до тех пор, пока титр не достигнет плато. Предпочтительно животным делают бустерную инъекцию конъюгатом того же антигена, но конъюгированного с другим белком и/или через другой поперечно сшивающий реагент. Конъюгаты также могут быть получены в рекомбинантной клеточной культуре в виде гибридных белков. Также агрегирующие агенты, такие как квасцы, подходят для применения для увеличения иммунного ответа.
(iii) Моноклональные антитела
Моноклональные антитела могут быть получены с применением гибридомного способа, впервые описанного Kohler et al., Nature, 256:495 (1975), или могут быть созданы способами рекомбинантной ДНК (патент США No. 4816567).
В гибридомном способе мышь или другое подходящее животное-хозяин, такое как хомяк или обезьяна макака, иммунизируют, как описано здесь выше, для получения лимфоцитов, которые продуцируют или способны продуцировать антитела, которые должны специфически связываться с белком, применяемым для иммунизации. Альтернативно, лимфоциты могут иммунизироваться in vitro. Лимфоциты затем сливают с миеломными клетками с применением подходящего агента для слияния, такого как полиэтиленгликоль, для образования гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки рассаживают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или более веществ, которые ингибируют рост или выживание неслитых родительских миеломных клеток. Например, если у родительских миеломных клеток нет фермента гипоксантингуанинфосфорибозилтрансферазы (HGPRT или HPRT), культуральная среда для гибридом обычно должна включать гипоксантин, аминоптерин и тимидин (среда HAT), вещества которой препятствуют росту клеток с дефицитом HGPRT.
Предпочтительными миеломными клетками являются такие, которые эффективно сливаются, поддерживают стабильно высокий уровень продукции антитела отобранными продуцирующими антитела клетками и являются чувствительными к такой среде, как HAT среда. Среди данных предпочтительных линий миеломных клеток находятся линии миеломных клеток мыши, такие как происходящие от опухолей мышей MOPC-21 и MPC-11, доступные от Salk Institute Cell Distribution Center, San Diego, Calif. USA, и клетки SP-2 или X63-Ag8-653, доступные от American' Type Culture Collection, Rockville, Maryland, USA. Для получения моноклональных антител человека также описаны клеточные линии миеломы человека и гетеромиеломы мыши-человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральная среда, в которой растут клетки гибридомы, тестируется на продукцию моноклональных антител, направленных против антигена. Предпочтительно специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяется с помощью иммунопреципитации или путем теста на связывание in vitro, такого как радиоиммунный анализ (РИА) или иммуноферментный анализ (ИФА).
После идентификации гибридомных клеток, которые продуцируют антитела желаемой специфичности, аффинности и/или активности, клоны могут быть субклонированы путем процедур лимитирующего разведения и выращивания с помощью стандартных способов (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)). Подходящие культуральные среды для данной цели включают, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут быть выращены in vivo в виде асцитных опухолей у животного.
Моноклональные антитела, секретируемые субклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки с помощью общепринятых способов очистки иммуноглобулинов, таких как, например, протеин A-сефароза, хроматография на гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующая моноклональные антитела, легко выделить и секвенировать с применением общепринятых способов (например, с помощью применения олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи моноклональных антител). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть помещена в экспрессионные векторы, которые затем трансфецируются в клетки-хозяева, такие как клетки E. coli, клетки COS обезьян, клетки яичников китайского хомячка (CHO), или клетки миеломы, которые в других обстоятельствах не продуцируют иммуноглобулиновые белки, для достижения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Рекомбинантная продукция антител будет описана более подробно ниже.
В дополнительном осуществлении антитела или фрагменты антител могут быть выделены из фаговых библиотек антител, созданных с применением способов, описанных в McCafferty et al., Nature, 348:552-554 (1990). Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описывают выделение антител мыши и человека, соответственно, с применением фаговых библиотек. Последующие публикации описывают получение высокоаффинных (в диапазоне нМ) антител человека с помощью перестановки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторного инфицирования и рекомбинации in vivo в качестве стратегии для конструирования очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993)). Таким образом, данные способы являются жизнеспособными альтернативами традиционным способам выделения моноклональных антител из гибридом, вырабатывающих моноклональные антитела.
ДНК может быть также модифицирована, например, с помощью замены кодирующей последовательностью константных доменов тяжелой и легкой цепей человека вместо гомологичных последовательностей мыши (патент США No. 4816567; Morrison, et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984)) или путем ковалентного присоединения к кодирующей последовательности иммуноглобулина всей или части кодирующей последовательности полипептида, не являющегося иммуноглобулином.
Обычно такими полипептидами, не являющимися иммуноглобулинами, заменяют константные домены антитела или их используют для замены вариабельных доменов одного из антиген-сочетанных сайтов антитела для создания гибридного двухвалентного антитела, включающего один антиген-сочетанный сайт, обладающий специфичностью к антигену, и другой антиген-сочетанный сайт, обладающий специфичностью к другому антигену.
(iv) Гуманизированные антитела и антитела человека
Гуманизированное антитело имеет один или более аминокислотных остатков, введенных в него от источника, не являющегося человеком. Данные аминокислотные остатки не от человека часто обозначают как «импортные» остатки, которые обычно берутся от «импортного» вариабельного домена. Гуманизирование может быть по существу осуществлено, следуя способу Winter и соавторов (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), путем замены последовательностей CDRs или CDR грызуна на соответствующие последовательности антитела человека. Соответственно такие «гуманизированные» антитела представляют собой гибридные антитела (патент США No. 4816567), в которых по существу меньше, чем интактный вариабельный домен человека был заменен соответствующей последовательностью от видов, не являющихся человеком. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из гомологичных сайтов антител грызунов.
Выбор вариабельных доменов человека как легкой, так и тяжелой цепей для применения при создании гуманизированных антител очень важен для снижения антигенности. В соответствии со способом «наилучшей подгонки» проводят скрининг последовательности вариабельного домена антитела грызуна против полной библиотеки известных последовательностей вариабельных доменов человека. Последовательность человека, которая наиболее близка к таковой грызуна, затем принимается как рамка считывания (FR) человека для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). В другом способе применяется конкретная рамка считывания, происходящая от консенсусной последовательности всех антител человека конкретной подгруппы легкой или тяжелой цепей. Такая же рамка считывания может быть применена для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993)).
Также важно, чтобы антитела были гуманизированы с сохранением высокой аффинности в отношении антигена и других благоприятных биологических свойств. Для достижения данной цели в соответствии с предпочтительным способом гуманизированные антитела получают в процессе анализа родительских последовательностей и различных предполагаемых продуктов, приближенных к человеческим, с применением трехмерных моделей для родительских последовательностей и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов коммерчески доступны и знакомы специалистам в данной области техники. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Проверка данных изображений позволяет анализировать возможную роль остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность кандидатного иммуноглобулина связывать свой антиген. Таким путем могут быть выбраны и скомбинированы остатки FR от реципиента и импортных последовательностей таким образом, чтобы была достигнута желаемая характеристика антитела, такая как увеличенная аффинность в отношении антигена(ов)-мишени(ей). В целом, остатки CDR являются прямо и наиболее существенно вовлеченными во влияние на связывание антигена.
Альтернативно, в настоящее время можно получить трансгенных животных (например, мышей), которые способны при иммунизации продуцировать полный репертуар антител человека в отсутствие эндогенной продукции иммуноглобулинов. Например, было описано, что гомозиготная делеция гена области антитела, соединяющей тяжелую цепь (JH), у химерных мышей и мышей с зародышевой мутацией ведет к полному подавлению продукции эндогенных антител. Перенос зародышевого набора генов иммуноглобулинов человека таким мышам с зародышевой мутацией должен приводить к продукции антител человека при нагрузке антигеном. Смотри, например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); и Duchosal et al. Nature 355:258 (1992). Антитела человека могут также происходить из библиотек фагового дисплея (Hoogenboom et al., J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Vaughan et al. Nature Biotech 14:309 (1996)).
(v) Фрагменты антител
Разработаны различные способы для получения фрагментов антител. Обычно данные фрагменты получали в результате протеолитического расщепления интактных антител (смотри, например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако данные фрагменты сейчас могут быть получены прямо с помощью рекомбинантных клеток-хозяев. Например, фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, Fab'-SH фрагменты могут быть прямо получены из E. coli и химически соединены с образованием F(ab')2 фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом F(ab')2 фрагменты могут быть выделены прямо из культуры рекомбинантных клеток-хозяев. Другие способы получения фрагментов антител должны быть ясны специалисту в данной области техники. В других осуществлениях выбранным антителом является одноцепочечный фрагмент Fv (scFv). См. WO 93/16185.
(vi) Мультиспецифичные антитела
Мультиспецифичные антитела имеют специфичность связывания в отношении, по меньшей мере, двух различных антигенов. В то время как такие молекулы обычно должны связывать только два антигена (т.е. биспецифичные антитела, BsAbs), антитела с дополнительной специфичностью, такие как триспецифичные антитела, при применении здесь охватываются данным выражением. Примеры BsAbs включают такие, у которых одно плечо направлено против антигена опухолевых клеток, а другое плечо направлено против цитотоксической пусковой молекулы, такие как против FcγRI/против CD15, против p185HER2/FcγRIII (CD16), против CD3/против злокачественных В-клеток (1D10), против CD3/против p185HER2, против CD3/против p97, против CD3/против почечноклеточной карциномы, против CD3/против OVCAR-3, против CD3/L-D1 (против карциномы ободочной кишки), против CD3/против аналога меланоцитстимулирующего гормона, против рецептора EGF /против CD3, против CD3/против CAMA1, против CD3/против CD19, против CD3/MoV18, против молекулы адгезии нервных клеток (NCAM)/против CD3, против фолатсвязывающего белка (FBP)/против CD3, против антигена, ассоциированного с панкарциномой (AMOC-31)/против CD3; BsAbs с одним плечом, которое специфически связывается с опухолевым антигеном, и с одним плечом, которое связывается с токсином, такие как против сапорина/против Id-1, против CD22/против сапорина, против CD7/против сапорина, против CD38/против сапорина, против CEA/против цепи A рицина, против интерферона-α(IFN-α)/против идиотипа гибридомы, против CEA/против алкалоида барвинка; BsAbs для превращения активируемых ферментом пролекарств, такие как против CD30/против щелочной фосфатазы (которая катализирует превращение пролекарства митомицин-фосфат в митомицин-спирт); BsAbs, которые могут быть использованы в качестве фибринолитических агентов, такие как против фибрина/против тканевого активатора плазминогена (tPA), против фибрина/против активатора плазминогена урокиназного типа (uPA); BsAbs для направленной доставки иммунных комплексов к рецепторам клеточной поверхности, такие как против липопротеида низкой плотности (LDL)/против рецептора Fc (например, FcγRI, FcγRII или FcγRIII); BsAbs для применения при терапии инфекционных заболеваний, такие как против CD3/против вируса простого герпеса (HSV), против комплекса T-клеточный рецептор:CD3/против вируса гриппа, против FcγR/против ВИЧ; BsAbs для определения опухолей in vitro или in vivo, такие как против CEA/против EOTUBE, против CEA/против DPTA, против p185HER2/против гаптена; BsAbs в качестве адъювантов вакцин; и BsAbs в качестве инструментов диагностики, такие как против кроличьих IgG/против ферритина, против пероксидазы хрена (HRP)/против гормона, против соматостатина/против вещества P, против HRP/против FITC, против CEA/против β-галактозидазы. Примеры триспецифичных антител включают антитела против CD3/против CD4/против CD37, против CD3/против CD5/против CD37 и против CD3/против CD8/против CD37. Биспецифичные антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, биспецифичных антител F(ab')2).
Способы создания биспецифичных антител известны в данной области техники. Общепринятое получение полноразмерных биспецифичных антител основывается на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулинов, где две цепи имеют разную специфичность (Millstein et al., Nature, 305:537-539 (1983)). Из-за случайного ассортимента тяжелых и легких цепей иммуноглобулинов данные гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Очистка правильной молекулы, которая обычно осуществляется с помощью стадий аффинной хроматографии, является достаточно обременительной, и выходы продукта являются низкими. Сходные процедуры раскрыты в WO 93/08829 и в Traunecker et al., EMBO J., 10:3655-3659 (1991).
В соответствии с другим подходом вариабельные домены антитела с желаемыми специфичностями связывания (антитело-антиген-сочетанные сайты) соединяются с последовательностями константных доменов иммуноглобулина. Соединение предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, включающим, по меньшей мере, часть шарнира, областей CH2 и CH3. Предпочтительно иметь первую константную область тяжелой цепи (CH1), содержащую участок, необходимый для связывания легкой цепи, присутствующую в, по меньшей мере, одном из гибридов. ДНК, кодирующие гибриды тяжелых цепей иммуноглобулина и, если это желательно, легкую цепь, включают в отдельные экспрессионные векторы, и они котрансфецируются в подходящем организме-хозяине. Это обеспечивает большую гибкость в подгонке взаимных пропорций трех полипептидных фрагментов в осуществлениях, когда неравные отношения трех применяемых полипептидных цепей в конструкте обеспечивает оптимальные выходы. Однако возможно включать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессионный вектор, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных отношениях ведет к высоким выходам, или когда отношения не имеют особого значения.
В предпочтительном осуществлении данного подхода биспецифичные антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой связывающей специфичностью в одном плече и гибридной пары тяжелая цепь-легкая цепь иммуноглобулина (обеспечивающей вторую связывающую специфичность) в другом плече. Было обнаружено, что асимметричная структура облегчает отделение желаемого биспецифичного соединения от нежелательных сочетаний цепей иммуноглобулинов, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифичной молекулы обеспечивает легкий путь выделения. Данный подход раскрыт в WO 94/04690. Для дополнительных подробностей создания биспецифичных антител смотри, например, Suresh et al., Methods in Enzymology, 121:210 (1986). В соответствии с другим подходом, описанным в WO 96/27011, может быть сконструирована область контакта между парой молекул антител для максимального процента гетеродимеров, которые получают из рекомбинантной клеточной культуры. Предпочтительная область контакта включает, по меньшей мере, часть домена CH3 константного домена антитела. В данном способе одну или более аминокислот с небольшими боковыми цепями из области контакта первой молекулы антитела заменяют аминокислотами с более длинными боковыми цепями (например, тирозином или триптофаном). Компенсаторные «полости» идентичного или сходного размера с большой(ими) боковой(ыми) цепью(ями) создаются в области контакта второй молекулы антитела путем замены аминокислот с длинными боковыми цепями на таковые с более короткими цепями (например, на аланин или треонин). Это обеспечивает механизмом увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифичные антитела включают перекрестно сшитые «гетероконъюгаты» антител. Например, одно из антител в гетероконъюгате может быть соединено с авидином, другое - с биотином. Такие антитела, например, как предполагается, направляют клетки иммунной системы к нежелательным клеткам (патент США No. 4676980) и пригодны для лечения ВИЧ инфекции (WO 91/00360, WO 92/200373, и EP 03089). Гетероконъюгаты антител могут быть созданы с применением общепринятых способов поперечной сшивки. Подходящие поперечно сшивающие агенты хорошо известны в данной области техники и раскрыты в патенте США No. 4676980, вместе с рядом способов поперечной сшивки.
Способы создания биспецифичных антител из фрагментов антител также были описаны в литературе. Например, биспецифичные антитела можно получить при применении химической сшивки. Brennan et al., Science, 229: 81 (1985) описывает процедуру, в которой интактные антитела расщепляют протеолитически для создания F(ab')2 фрагментов. Данные фрагменты восстанавливают в присутствии дитиолового комплексообразователя, арсенита натрия для стабилизации соседних дитиолов и предотвращения образования внутримолекулярных дисульфидных связей. Созданные Fab' фрагменты затем превращают в производные тионитробензоата (TNB). Одно из производных Fab'-TNB затем заново превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с образованием биспецифичного антитела. Полученные биспецифичные антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Новейший прогресс облегчил прямое получение фрагментов Fab'-SH из E. coli, которые могут быть химически соединены с образованием биспецифичных антител. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описывает получение полностью приближенной к человеческой молекулы F(ab')2 биспецифичного антитела. Каждый Fab' фрагмент отдельно секретировался E. coli и подвергался прямому химическому соединению in vitro с образованием биспецифичного антитела. Биспецифичное антитело, образованное таким образом, было способно связываться с клетками, гиперэкспрессирующими рецептор VEGF, и нормальными Т-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека в отношении опухолей молочной железы человека в качестве мишеней.
Описаны также различные способы создания и выделения фрагментов биспецифичных антител прямо из рекомбинантной клеточной культуры. Например, биспецифичные антитела получали, применяя лейциновые застежки. Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992). Пептиды лейциновой застежки из белков Fos и Jun соединяли с частями Fab' двух различных антител с помощью гибридного гена. Гомодимеры антител восстанавливали в области шарнира с образованием мономеров и затем заново окисляли с образованием гетеродимеров антител. Данный способ может быть также использован для получения гомодимеров антител. Способ «двойных антител», описанный Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), обеспечил альтернативным механизмом создания фрагментов биспецифичных антител. Фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) с помощью линкера, который является слишком коротким для того, чтобы позволить образоваться парам между двумя доменами на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента вынуждены образовывать пару с комплементарными доменами VH и VL другого фрагмента, в результате чего образуется два антигенсвязывающих сайта. Описана также другая стратегия создания фрагментов биспецифичных антител с помощью применения димеров одноцепочечных Fv (sFv). Смотри, Gruber et al., J. Immunol., 152:5368 (1994).
Рассматриваются антитела с более чем двумя валентностями. Например, могут быть получены триспецифичные антитела. Tutt et al. J. Immunol. 147: 60 (1991).
(vii) Создание эффекторной функции
Может быть желательным модифицировать антитело изобретения в отношении эффекторной функции, так чтобы, например, увеличить эффективность антитела при лечении рака. В качестве примера в область Fc может(гут) быть введен(ы) остаток(ки) цистеина, тем самым позволяя образоваться дисульфидному мостику между цепями в данной области. Гомодимерное антитело, созданное таким образом, может иметь улучшенную способность к интернализации и/или увеличенную способность к уничтожению клеток, опосредуемую комплементом, и зависимую от антитела клеточную цитотоксичность (ADCC). Смотри, Caron et al., J. Exp Med. 176:1191-1195 (1992) и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с увеличенной противоопухолевой активностью могут быть также получены с применением гетеробифункциональных поперечно сшивающих агентов, как описано в Wolff et al. Cancer Research 53:2560-2565 (1993). Альтернативно может быть сконструировано антитело, которое имеет двойные области Fc и может в результате этого иметь увеличенную способность к лизису с комплементом и ADCC. Смотри, Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989).
(viii) Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам, включающим описанное здесь антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
Химиотерапевтические агенты, пригодные для создания таких иммуноконъюгатов, описаны выше. Ферментативно активные токсины и их фрагменты, которые могут быть применены, включают цепь A дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, экзотоксин A цепи (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модесцина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII, и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, еномицин и трикотецены. Различные радионуклиды доступны для получения радиоконъюгатов антител. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re.
Конъюгаты антитела и цитотоксического агента создают с применением разнообразных бифункциональных агентов присоединения к белку, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активных эфиров (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как (п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазоний-бензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al. Science 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента для конъюгации радионуклида с антителом. Смотри WO94/11026.
В другом осуществлении антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для применения в предварительной направленной доставке к опухоли, где конъюгат антитело-рецептор вводят больному с последующим удалением несвязанного конъюгата из циркуляции с применением хелатирующего агента и затем вводят «лиганд» (например, авидин), который конъюгирован с цитотоксическим агентом (например, радионуклидом).
(ix) Иммунолипосомы
Раскрытое здесь антитело может быть также составлено в виде иммунолипосом. Липосомы, содержащие антитела, получают с помощью способов, известных в данной области техники, таких как описанные в Epstein et al., Proc. Natl. Acad. Sci. USA, 82:3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77:4030 (1980); и в патентах США Nos. 4485045 и 4544545. Липосомы с увеличенным временем циркуляции раскрыты в патенте США No. 5013556.
Особенно пригодные липосомы могут быть созданы с помощью способа упаривания в обращенной фазе с липидной композицией, включающей фосфатидилхолин, холестерин и дериватизированный ПЭГ фосфатидилэтаноламин (ПЭГ-ФЭ). Липосомы продавливают через фильтры с определенным размером пор для выхода липосом с желаемым диаметром. Fab' фрагменты антитела настоящего изобретения могут быть конъюгированы с липосомами, как описано в Martin et al. J. Biol. Chem. 257: 286-288 (1982), с помощью реакции дисульфидного взаимообмена. Химиотерапевтический агент (такой как доксорубицин) необязательно содержится в липосоме. Смотри, Gabizon et al. J. National Cancer Inst. 81(19)1484 (1989)
(x) Зависимая от антитела, опосредуемая ферментом терапия пролекарством (ADEPT)
Антитело настоящего изобретения может быть также использовано в ADEPT путем конъюгации антитела с ферментом, активирующим пролекарство, который превращает пролекарство (например, пептидильный химиотерапевтический агент, смотри WO81/01145) в активное противораковое лекарство. Смотри, например, WO 88/07378 и патент США No. 4975278.
Ферментный компонент иммуноконъюгата, пригодный для ADEPT, включает любой фермент, способный действовать на пролекарство таким образом, чтобы превратить его в его более активную, цитотоксическую форму.
Ферменты, которые пригодны в способе данного изобретения, включают, но не ограничиваются этим, щелочную фосфатазу, пригодную для превращения фосфатсодержащих пролекарств в свободные лекарства; арилсульфатазу, пригодную для превращения сульфатсодержащих пролекарств в свободные лекарства; цитозиндезаминазу, пригодную для превращения нетоксичного 5-фторцитозина в противораковое лекарство 5-фторурацил; протеазы, такие как протеаза зубатки, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины B и L), которые пригодны для превращения пептидсодержащих пролекарств в свободные лекарства; D-аланилкарбоксипептидазы, пригодные для превращения пролекарств, которые содержат D-аминокислотные заместители; ферменты, расщепляющие углеводы, такие как β-галактозидаза и нейраминидаза, пригодные для превращения гликозилированных пролекарств в свободные лекарства; β-лактамазу, пригодную для превращения лекарств, дериватизированных β-лактамами в свободные лекарства; и амидазы пенициллина, такие как амидаза пенициллина V или амидаза пенициллина G, пригодные для превращения лекарств, дериватизированных по азотам их аминов феноксиацетильными или фенилацетильными группами соответственно в свободные лекарства. Альтернативно антитела с ферментативной активностью, также известные в данной области техники как «абзимы», могут быть использованы для превращения пролекарств изобретения в свободные активные лекарства (смотри, например, Massey, Nature 328: 457-458 (1987)). Конъюгаты антитело-абзим могут быть получены, как описано здесь, для доставки абзима к популяции опухолевых клеток.
Ферменты данного изобретения могут быть ковалентно связаны с антителом с помощью способов, хорошо известных в данной области техники, таких как применение гетеробифункциональных поперечно сшивающих агентов, рассмотренных выше. Альтернативно гибридные белки, включающие, по меньшей мере, антигенсвязывающую область антитела изобретения, соединенную, по меньшей мере, с функционально активной частью фермента изобретения, могут быть созданы с применением методов рекомбинантных ДНК, хорошо известных в данной области техники (смотри, например, Neuberger et al., Nature, 312: 604-608 (1984)).
(xi) Гибриды антитело-извлеченный рецептор-связывающий эпитоп
В определенных осуществлениях изобретения может быть желательно применять фрагмент антитела, отличный от интактного антитела, например, для увеличения проникновения в опухоль. В данном случае может быть желательно модифицировать фрагмент антитела, для того чтобы увеличить полупериод его жизни в сыворотке. Это может быть достигнуто, например, с помощью включения извлеченного рецепторсвязывающего эпитопа во фрагмент антитела (например, путем мутации в подходящей области фрагмента антитела или путем включения эпитопа в пептидную метку, которая затем соединяется с фрагментом антитела на его конце или в середине, например, с помощью синтеза ДНК или пептида).
Извлеченный рецепторсвязывающий эпитоп предпочтительно состоит из области, в которой любой из одного или более аминокислотных остатков из одной или двух петель домена Fc переносится в аналогичное положение фрагмента антитела. Даже более предпочтительно, чтобы переносились три или более остатков из одной или двух петель домена Fc. Еще более предпочтительно, чтобы эпитоп извлекали из домена CH2 области Fc (например, от IgG) и переносили в область CH1, CH3, или VH антитела или в более чем одну такую область. Альтернативно, эпитоп извлекают из домена CH2 области Fc и переносят в область CL, или в область VL фрагмента антитела, или в обе области.
(xii) Другие ковалентные модификации антитела
Ковалентные модификации антитела включаются в объем данного изобретения. Они могут быть осуществлены с помощью химического синтеза или путем ферментативного или химического расщепления антитела, если это применимо. Другие типы ковалентных модификаций антитела вводятся в молекулу с помощью взаимодействия целевых аминокислотных остатков антитела с органическим дериватизирующим агентом, который способен взаимодействовать с выбранными боковыми цепями N- или C-концевых остатков.
Остатки цистеина наиболее часто вводят в реакцию с α-галоацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, с получением карбоксиметильных или карбоксиамидометильных производных. Остатки цистеина также могут быть дериватизированы с помощью реакции с бромтрифторацетоном, α-бром-β-(5-имидозоил)пропионовой кислотой, хлорацетилфосфатом, н-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, п-хлормеркурибензоатом, 2-хлормеркури-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом.
Остатки гистидина дериватизируют с помощью реакции с диэтилпирокарбонатом при рН 5,5-7,0, потому что данный агент относительно специфичен для боковой цепи остатка гистидина. Пригоден также пара-бромфенацилбромид; реакцию предпочтительно проводят в 0,1 М какодилате натрия при рН 6,0.
Остатки лизина и аминоконцевые остатки вводят в реакцию с ангидридами янтарной или другой карбоновой кислотой. Дериватизация данными агентами вызывает изменение на противоположный заряда остатков лизина. Другие подходящие реагенты для дериватизации α-аминосодержащих остатков включают имидоэфиры, такие как метилпиколинимидат, пиридоксаль фосфат, пиридоксаль, хлорборгидрид, тринитробензолсульфоновую кислоту, O-метилизомочевину, 2,4-пентандион и катализируемую трансаминазой реакцию с глиоксилатом.
Остатки аргинина модифицируют с помощью реакции с одним или несколькими традиционными реагентами, среди которых фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. Дериватизация остатков аргинина требует, чтобы реакцию проводили в щелочных условиях из-за высокой pKa гуанидиновой функциональной группы. Более того, данные реагенты могут взаимодействовать с группами лизина, а также с эпсилон-аминогруппой аргинина.
Может быть осуществлена специфическая модификация остатков тирозина с особым акцентом на введение спектральных меток в остатки тирозина с помощью реакции с соединениями ароматического диазония или тетранитрометана. Чаще всего применяют N-ацетилимидазол и тетранитрометан для образования классов O-ацетилтирозила и 3-нитропроизводных соответственно. Остатки тирозина иодируют с применением 125I или 131I для получения меченых белков для применения в радиоиммуноанализе.
Карбоксильные боковые группы (аспартил или глутамил) избирательно модифицируют с помощью реакции с карбодиимидами (R-N=C=N-R'), где R и R' представляют собой разные алкильные группы, такие как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азониа-4.4-диметилпентил)карбодиимид. Более того, аспартиловые и глутамиловые остатки превращают в аспарагиниловые и глутаминиловые с помощью реакции с ионами аммония.
Глутаминиловые и аспарагиниловые остатки часто дезамидируют до соответствующих глутамиловых и аспартиловых остатков соответственно. Данные остатки дезамидируют в нейтральных или щелочных условиях. Дезамидированная форма данных остатков попадает в объем данного изобретения.
Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серина и треонина, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевого амина и амидирование любой C-концевой карбоксильной группы.
Другой тип ковалентной модификации включает химическое или ферментативное присоединение гликозидов к антителу. Данные способы имеют преимущества в том, что они не требуют получения антитела в клетке-хозяине, которая способна гликозилировать по N- или O-сайтам гликозилирования. В зависимости от применяемого способа сахар(а) может(гут) быть присоединен(ы) к (a) аргинину и гистидину, (b) свободным карбоксильным группам, (c) свободным сульфгидрильным группам, таким как таковые цистеина, (d) свободным гидроксильным группам, таким как таковые серина, треонина или гидроксипролина, (e) ароматическим остаткам, таким как таковые фенилаланина, тирозина или триптофана, или (f) амидной группе глютамина. Данные способы описаны в WO 87/05330, опубликованной 11 сентября 1987 г., и в Aplin and Wriston, CRC Crit. Rev. Biochem., pp. 259-306 (1981).
Удаление любых углеводных частей, присутствующих в антителе, может быть осуществлено химически или ферментативно. Химическое дегликозилирование требует экспозиции антитела с соединением трифторметансульфокислоты или эквивалентным соединением. Данная обработка ведет к отщеплению большинства или всех сахаров за исключением линкерного сахара (N-ацетилглюкозамина или N-ацетилгалактозамина), в то время как антитело остается интактным. Химическое дегликозилирование описано Hakimuddin, et al. Arch. Biochem. Biophys. 259:52 (1987) и Edge et al. Anal. Biochem., 118:131 (1981). Ферментативное отщепление углеводных частей антител может быть достигнуто с помощью применения различных эндо- и экзогликозидаз, как описано Thotakura et al. Meth. Enzymol. 138:350 (1987).
Другой тип ковалентной модификации антитела включает соединение антитела с одним из различных небелковых полимеров, например полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, способом, представленным в патентах США No. 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337.
B. Векторы, клетки-хозяева и рекомбинантные способы
Антитело против VEGF изобретения может быть получено рекомбинантным путем с помощью легко доступных способов и материалов.
Для рекомбинантного получения антитела против VEGF кодирующую его нуклеиновую кислоту выделяют и вставляют в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или экспрессии. ДНК, кодирующая моноклональное антитело, легко выделяется и секвенируется с применением традиционных способов (например, с применением олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела). Пригодны многие векторы. Компоненты вектора обычно включают, но не ограничиваются этим, одно или более из следующих: сигнальную последовательность, ориджин репликации, один или более маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(i) Компонент сигнальной последовательности
Антитело данного изобретения может быть получено рекомбинантным путем не только прямо, но и в виде гибридного полипептида с гетерологичным полипептидом, который предпочтительно представляет собой сигнальную последовательность или другой полипептид, содержащий сайт специфического расщепления на N-конце зрелого белка или полипептида. Предпочтительно выбираемой гетерологичной сигнальной последовательностью является такая, которая узнается и подвергается процессингу (т.е. расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотных клеток-хозяев, которые не распознают и не подвергают процессингу природную сигнальную последовательность антитела, сигнальную последовательность заменяют прокариотной сигнальной последовательностью, выбранной, например, из группы лидеров щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II. Для секреции дрожжами природная сигнальная последовательность может быть заменена, например, лидером инвертазы дрожжей, лидером α-фактора (включая лидеры α-фактора Saccharomyces и Kluyveromyces) или лидером кислой фосфатазы, лидером глюкоамилазы C. albicans, или сигнальной последовательностью, описанной в патенте WO 90/13646. При экспрессии в клетках млекопитающих пригодны сигнальные последовательности млекопитающих, а также вирусные секреторные лидеры, например gD сигнал простого герпеса.
ДНК для такой области предшественника лигируют в рамке считывания с ДНК, кодирующей антитело.
(ii) Компонент ориджина репликации
И экспрессионные, и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая обеспечивает способность вектора к репликации в одной или более выбранных клетках-хозяевах. Обычно в клонирующих векторах данная последовательность является такой, которая дает возможность вектору реплицироваться независимо от хромосомной ДНК хозяина, и включает ориджины репликации или последовательности автономной репликации. Такие последовательности хорошо известны для множества бактерий, дрожжей и вирусов. Ориджин репликации из плазмиды pBR322 пригоден для большинства грам-отрицательных бактерий, ориджин плазмиды 2µ пригоден для дрожжей, а различные вирусные ориджины (SV40, полиомы, аденовируса, VSV или BPV) пригодны для клонирующих векторов в клетках млекопитающих. Обычно компонент ориджина репликации не является необходимым для экспрессионных векторов для млекопитающих (обычно ориджин SV40 может применяться только благодаря тому, что он содержит ранний промотор).
(iii) Компонент гена селекции
Экспрессионные и клонирующие векторы могут содержать ген селекции, называемый также маркером селекции. Обычно гены селекции кодируют белки, которые (a) придают устойчивость к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (b) дополняют ауксотрофную недостаточность или (c) обеспечивают питательными веществами, отсутствующими в сложных средах, например ген, кодирующий рацемазу D-аланина, для Bacilli.
В одном примере схемы селекции применяют лекарство для остановки роста клетки-хозяина. Те клетки, которые были успешно трансформированы гетерологичным геном, продуцируют белок, обеспечивающий устойчивость к лекарству, и, таким образом, выживают в режиме селекции. Примеры такой доминантной селекции включают применение лекарств неомицина, микофеноловой кислоты и гигромицина.
Другими примерами подходящих маркеров селекции для клеток млекопитающих являются те, которые обеспечивают идентификацию клеток, компетентных в захвате нуклеиновой кислоты антитела, такие как DHFR, тимидинкиназа, металлотионеин-I и II, предпочтительно гены металлотионеина приматов, аденозиндезамининаза, орнитиндекарбоксилаза и т.д.
Например, клетки, трансформированные геном селекции DHFR, сначала идентифицируют культивированием всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином при использовании DHFR дикого типа является линия клеток яичника китайского хомячка (CHO), лишенная активности DHFR.
Альтернативно клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенную DHFR), трансформированные или котрансформированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой маркер селекции, такой как аминогликозид 3'-фосфотрансфераза (APH), могут быть отобраны выращиванием клеток в среде, содержащей агент селекции для маркера селекции, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418. Смотри патент США No. 4965199.
Подходящим геном селекции для применения в дрожжах является ген trp1, находящийся в дрожжевой плазмиде Yrp7 (Stinchcomb et al., Nature, 282:39 (1979)). Ген trp1 обеспечивает маркер селекции для мутантного штамма дрожжей, лишенного способности расти в триптофане, например ATCC No. 44076 или PEP4-1. Jones, Genetics, 85:12 (1977). Наличие повреждения trp1 в геноме дрожжевой клетки-хозяина, таким образом, обеспечивает эффективную среду для выявления трансформации путем выращивания в отсутствие триптофана. Сходным образом штаммы дрожжей с недостаточностью Leu2 (ATCC 20622 или 38626) дополняют известными плазмидами, несущими ген Leu2.
Кроме того, векторы, берущие начало от 1,6 мкм круговой плазмиды pKD1, могут быть применены для трансформации дрожжей Kluyveromyces. Альтернативно сообщалось об экспрессионной системе для K. lactis для крупномасштабного получения рекомбинантного химозина коровы. Van den Berg, Bio/Technology, 8:135 (1990). Были раскрыты также стабильные многокопийные экспрессионные векторы для секреции зрелого рекомбинантного альбумина сыворотки человека промышленными штаммами Kluyveromyces. Fleer et al., Bio/Technology, 9:968-975 (1991).
(iv) Промоторный компонент
Экспрессионные и клонирующие векторы обычно содержат промотор, который распознается организмом хозяина и оперативно связан с нуклеиновой кислотой антитела. Промоторы, пригодные для применения с прокариотными хозяевами, включают промотор phoA, промоторные системы β-лактамазы и лактозы, щелочной фосфатазы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac. Пригодны, однако, и другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах также должны включать последовательность Shine-Dalgarno (S.D.), оперативно связанную с ДНК, кодирующей антитело.
Промоторные последовательности известны для эукариот. Практически все эукариотные гены содержат область, обогащенную AT, расположенную на расстоянии приблизительно от 25 до 30 оснований выше сайта, с которого инициируется транскрипция. Другой последовательностью, обнаруживаемой на расстоянии от 70 до 80 оснований выше старта транскрипции многих генов, является область CNCAAT, где N может быть любым нуклеотидом. На 3'-конце большинства эукариотных генов находится последовательность AATAAA, которая может быть сигналом для добавления хвоста поли-A к 3'-концу кодирующей последовательности. Все данные последовательности соответствующим образом вставляются в эукариотные экспрессионные векторы.
Примеры подходящих промоторных последовательностей для применения с хозяевами-дрожжами включают промоторы для 3-фосфоглицераткиназы или других гликолитических ферментов, таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другими промоторами дрожжей, которые являются индуцибельными промоторами, имеющими дополнительное преимущество транскрипции, контролируемой условиями выращивания, являются промоторные области для алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, ферментов деградации, связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для применения для экспрессии у дрожжей дополнительно описаны в патенте EP 73657. С промоторами дрожжей также успешно применяют энхансеры дрожжей.
Транскрипция антитела с векторов в клетках-хозяевах млекопитающих контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус оспы птиц, аденовирус (такой как аденовирус 2), вирус папилломы коров, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита B и наиболее предпочтительно вирус обезьян 40 (SV40), из гетерологичных промоторов млекопитающих, например промотора актина или промотора иммуноглобулина, из промоторов теплового шока, предлагаемыми так, что такие промоторы совместимы с системами клетки-хозяина.
Ранний и поздний промоторы вируса SV40 удобно получать в виде фрагмента рестрикции, который также содержит вирусный ориджин репликации SV40. Немедленный ранний промотор цитомегаловируса человека удобно получать в виде фрагмента рестрикции HindIII E. Система для экспрессии ДНК в хозяевах млекопитающих с применением вируса папилломы быка в качестве вектора раскрыта в патенте США No. 4419446. Модификация данной системы описана в патенте США No. 4601978. Смотри также Reyes et al., Nature 297:598-601 (1982) об экспрессии кДНК β-интерферона человека в клетках мыши под контролем промотора тимидинкиназы вируса простого герпеса. Альтернативно в качестве промотора может быть применен длинный концевой повтор вируса саркомы Рауса.
(v) Компонент энхансерного элемента
Транскрипция ДНК, кодирующей антитело данного изобретения, высшими эукариотами часто увеличивается в результате вставки в вектор энхансерной последовательности. Известны многие энхансерные последовательности из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Обычно, однако, применяют энхансер из вируса эукариотной клетки. Примеры включают энхансер SV40 на поздней стороне ориджина репликации (п.н. 100-270), энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне ориджина репликации и энхансеры аденовирусов. Смотри также Yaniv (1982) Nature 297:17-18 относительно энхансерных элементов для активации промоторов эукариот. Энхансер может быть встроен в вектор в положении 5' или 3' относительно кодирующей антитело последовательности, но предпочтительно он размещается в сайте, расположенном в 5' положении относительно промотора.
(vi) Компонент терминации транскрипции
Экспрессионные векторы, применяемые в эукариотных клетках-хозяевах (клетках дрожжей, грибов, насекомых, растений, животных, человека или содержащих ядро клетках других многоклеточных организмов), должны также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно могут быть получены из 5' и иногда 3' нетранслируемых областей эукариотных или вирусных ДНК или кДНК. Данные области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилируемых фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним из подходящих компонентов терминации транскрипции является область полиаденилирования гормона роста быка. Смотри патент WO94/11026 и раскрытый в нем экспрессионный вектор.
(vii) Селекция и трансформация клеток-хозяев
Подходящими клетками-хозяевами для клонирования или экспрессии ДНК в применяемых здесь векторах являются описанные выше клетки прокариот, дрожжей или высших эукариот. Подходящие для данной цели прокариоты включают истинные бактерии, такие как грам-отрицательные или грам-положительные организмы, например, Enterobacteriaceae, такие как Escherichia, например E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, раскрытая в патенте DD 266710, опубликованном 12 апреля 1989), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Одним из предпочтительных хозяев E. coli для клонирования является E. coli 294 (ATCC 31446), хотя пригодны другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537), и E. coli W3110 (ATCC 27325). Данные примеры являются иллюстративными, но не ограничивающими.
В дополнение к прокариотам эукариотные микробы, такие как нитчатые грибы или дрожжи, являются подходящими хозяевами для клонирования или экспрессии кодирующих антитело векторов. Saccharomyces cerevisiae, или обычные хлебопекарные дрожжи, является наиболее часто применяемым хозяином среди низших эукариотных микроорганизмов. Однако здесь пригоден ряд других широко доступных родов, видов и штаммов, таких как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thernotolerans, и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium, и хозяева Aspergillus, такие как A. nidulans и A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела берут начало от многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки-хозяева насекомых от таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка), и Bombyx mori. Публично доступно множество вирусных штаммов для трансфекции, например L-1 вариант Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть применены здесь в качестве вируса согласно настоящему изобретению, в частности, для трансфекции клеток Spodoptera frugiperda. В качестве хозяев могут быть также применены клетки культур растений, таких как хлопок, кукуруза, картофель, соя, петуния, помидоры и табак.
Однако наибольший интерес был проявлен к клеткам позвоночных, и размножение клеток позвоночных в культуре (культуре ткани) стало обычной процедурой. Примерами пригодных линий клеток-хозяев млекопитающих являются линия почек обезьяны CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); линия почки эмбриона человека (клетки 293 или клетки 293, субклонированные для выращивания в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы-буйвола (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TR1 (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4 и линия гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессионными или клонирующими векторами для получения антитела и культивируют в традиционных питательных средах, модифицированных соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих желаемые последовательности.
(viii) Культивирование клеток-хозяев
Клетки-хозяева, применяемые для получения антитела данного изобретения, можно культивировать в различных средах. Для культивирования клеток-хозяев пригодны имеющиеся в продаже среды, такие как Ham's F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная по Дульбекко среда Игла ((DMEM), Sigma). Кроме того, в качестве культуральных сред для клеток-хозяев могут быть применены любые среды, описанные в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США Nos. 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или патенте США Re. 30985. К любым из данных сред могут быть при необходимости добавлены гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия, кальций, магний и фосфат), буферы (такие как HEPES), нуклеотиды (такие как аденозин и тимидин), антибиотики (такие как лекарственное средство GENTAMYCINTM), микроэлементы (определяемые как неорганические соединения, обычно присутствующие в конечной концентрации в микромолярном диапазоне) и глюкоза или эквивалентный источник энергии. Могут быть также включены любые другие необходимые добавки в подходящих концентрациях, которые должны быть известны специалистам в данной области техники. Условия культивирования, такие как температура, pH и тому подобное, являются такими, которые ранее применяли с клетками-хозяевами для экспрессии и должны быть очевидны для специалиста.
(ix) Очистка антитела
При применении рекомбинантных способов антитело может быть образовано внутриклеточно, в периплазматическом пространстве или прямо секретировано в среду. Если антитело образуется внутриклеточно, в качестве первого этапа удаляют частичковые обломки либо клеток-хозяев, либо лизированных фрагментов, например, центрифугированием или ультрафильтрацией. Carter et al., Bio/Technology 10:163-167 (1992) описывают процедуру выделения антител, которые секретируются в периплазматическое пространство E. coli. Вкратце, сгусток клеток размягчают в присутствии ацетата натрия (pH 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) на протяжении приблизительно 30 мин. Обломки клеток можно удалить центрифугированием. При секреции антитела в среду супернатанты таких экспрессионных систем обычно сначала концентрируют с применением имеющегося в продаже фильтра для концентрирования белка, например единицы для ультрафильтрации Amicon или Millipore Pellicon. На любой из предшествующих стадий может быть включен ингибитор протеаз, такой как PMSF, для ингибирования протеолиза и могут быть включены антибиотики для предотвращения роста случайных примесей.
Полученная из клеток композиция антитела может быть очищена, например, хроматографией на гидроксилапатите, гель-электрофорезом, диализом и аффинной хроматографией, причем аффинная хроматография является предпочтительным способом очистки. Пригодность протеина A в качестве аффинного лиганда зависит от вида и изотипа любого иммуноглобулинового Fc домена, который находится в антителе. Протеин A может быть применен для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Протеин G рекомендуется для всех изотипов мыши и γ3 человека (Guss et al., EMBO J. 5:15671575 (1986)). Матриксом, к которому присоединяют аффинный лиганд, чаще всего является агароза, но пригодны и другие матриксы. Механически стабильные матриксы, такие как стекло с контролируемой пористостью или поли(стиролдивинил)бензол, допускают большую скорость потока и меньшее время обработки по сравнению с теми, которые могут быть достигнуты с агарозой. Когда антитело включает домен CH3, для очистки пригодна смола Bakerbond ABXTM (J. T. Baker, Phillipsburg, N.J.). В зависимости от подлежащего выделению антитела пригодны другие способы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на диоксиде кремния, хроматография на гепарин-сефарозеTM, хроматография на анионо- или катионообменивающей смоле (такой как колонка полиаспарагиновой кислоты), хроматофокусирование, ДДС-Na-ПАГЭ и осаждение сульфатом аммония.
После любой(любых) стадии(стадий) предварительной очистки смесь, включающая антитело против VEGF и загрязнения, может быть подвергнута хроматографии гидрофобного взаимодействия при низком pH с применением элюирующего буфера при pH между приблизительно 2,5-4,5, предпочтительно проводимой при низких концентрациях соли (например, от приблизительно 0-0,25 М соли).
III. Фармацевтические составы
Терапевтические составы антител, применяемые согласно настоящему изобретению, получают для хранения смешиванием антитела, имеющего желаемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями и стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. [1980]) в форме лиофилизованных составов или водных растворов. Приемлемые носители, наполнители и стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексааммония; хлорид бензалкония; хлорид бензэтония; феноловый, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; образующие соль противоионы, такие как натрий; комплексы металла (например, комплексы Zn-белок) и/или неионные поверхностно-активные вещества, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (ПЭГ). Предпочтительные лиофилизованные составы антитела против VEGF описаны в патенте WO 97/04801, специально включенном здесь в качестве ссылки.
Состав здесь может также содержать более одного активного компонента, если это необходимо для конкретного подлежащего лечению показания, предпочтительно с дополняющими активностями, которые не оказывают неблагоприятного действия друг на друга. Например, может быть желательным дополнительное введение антител, которые связываются с EGFR, VEGF (например, антитела, которое связывает другой эпитоп на VEGF), VEGFR или ErbB2 (например, Herceptin®), в одном составе. Альтернативно или дополнительно композиция может включать цитотоксичный агент, цитокин, агент, ингибирующий рост, и/или низкомолекулярный антагонист VEGFR. Такие молекулы соответственно находятся в сочетании в количествах, которые являются эффективными для желаемой цели.
Активные ингредиенты могут быть также заключены в микрокапсулы, полученные, например, способами коацервации или полимеризации на поверхности раздела, например гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметацилатные) микрокапсулы соответственно, в коллоидные системы доставки лекарства (например, липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Составы, подлежащие применению введением in vivo, должны быть стерильными. Этого легко достичь фильтрованием через стерильные фильтрующие мембраны.
Могут быть получены препараты с продолжительным высвобождением. Подходящие примеры препаратов с продолжительным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, причем такие матрицы находятся в виде оформленных изделий, например пленок или микрокапсул. Примеры матриц с продолжительным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США No. 3773919), сополимеры L-глутаминовой кислоты и γ этил-L-глутамата, недеградируемый этиленвинилацетат, деградируемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM (микросферы для инъекций, составленные из сополимера молочная кислота-гликолевая кислота и леупролидацетата) и поли-D-(-)-3-гидроксимасляную кислоту. В то время как полимеры, такие как этиленвинилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы на протяжении 100 дней, некоторые гидрогели высвобождают белки на протяжении более коротких периодов времени. Когда инкапсулированные антитела остаются в организме в течение долгого времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°С, что ведет к утрате биологической активности и возможным изменениям в иммуногенности. Может быть разработана рациональная стратегия для стабилизации в зависимости от вовлеченного механизма. Например, если обнаружено, что механизм агрегации заключается в образовании межмолекулярной S-S связи через тио-дисульфидный взаимообмен, стабилизация может быть достигнута модификацией сульфгидрильных остатков, лиофилизированием из кислых растворов, контролем содержания влаги, применением подходящих добавок и созданием специфических полимерных матриксных композиций.
IV. Терапевтическое применение антител против VEGF
Подразумевается, что согласно настоящему изобретению антитела против VEGF могут применяться для лечения различных новообразований и не-неопластических состояний, отличающихся патологическим ангиогенезом. Отличные от неопластических состояния, которые подлежат лечению, включают ревматоидный артрит, псориаз, атеросклероз, диабетические и другие пролиферативные ретинопатии, включая ретинопатию недоношенных, ретролентальную фиброплазию, неоваскулярную глаукому, связанную со старением дегенерацию мышц, гиперплазии щитовидной железы (включая болезнь Грейвса), трансплантацию роговицы и других тканей, хроническое воспаление, воспаление легких, нефротический синдром, преэклампсию, асциты, перикардиальное излияние (такое, как связанное с перикардитом) и плевральное излияние.
Антитела изобретения предпочтительно применяют для лечения опухолей, в которых ангиогенез играет важную роль в опухолевом росте, включая раковые и доброкачественные опухоли. Примеры подлежащего здесь лечению рака включают, но не ограничиваются этим, карциномы, лимфомы, бластомы, саркомы и лейкозы. Более конкретные примеры таких раков включают плоскоклеточный рак, рак легких (включая мелкоклеточный рак легких, не-мелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких), рак брюшной полости, гепатоцеллюлярный рак, рак желудка или отделов, относящихся к желудку (включая рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки или относящийся к почке, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карциному печени и другие типы рака головы и шеи, а также В-клеточную лимфому (включая низко злокачественную/фолликулярную не-ходжкинскую лимфому (NHL); мелколимфоцитарную (SL) NHL; среднезлокачественную/фолликулярную NHL; среднезлокачественную, диффузную NHL; высокозлокачественную иммунобластную NHL; высокозлокачественную лимфобластную NHL; высокозлокачественную мелкоклеточную с нерасщепленными ядрами NHL; массированное заболевание NHL; оболочечноклеточную лимфому; лимфому, связанную со СПИДом; и макроглобулинемию Вальденстрома); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); лейкозный ретикулоэндотелиоз; хронический миелобластный лейкоз и пострансплантационное лимфопролиферативное нарушение (PTLD), а также аномальную пролиферацию сосудов, связанную с факоматозом, отеком (таким, как связанный с опухолями мозга), и синдром Мейга. Более предпочтительно раки, подлежащие лечению антителами изобретения, включают рак молочной железы, колоректальный рак, ректальный рак, немелкоклеточный рак легких, не-ходжкинскую лимфому (NHL), почечноклеточный рак, рак простаты, рак печени, рак поджелудочной железы, саркому мягких тканей, саркому Капоши, карциноидную опухоль, рак головы и шеи, меланому, рак яичников, мезотелиому и множественную миелому. Более предпочтительно способы изобретения применяют для лечения колоректального рака у больного человека.
Настоящее изобретение охватывает ангиогенную терапию, новую стратегию лечения рака, предназначенную для ингибирования развития кровеносных сосудов опухоли, необходимых для снабжения питательными веществами для поддержания роста опухоли. Поскольку ангиогенез принимает участие и в росте первичной опухоли, и в метастазировании, предлагаемое изобретением ангиогенное лечение способно ингибировать неопластический рост опухоли в исходном месте, а также предотвращать метастазирование опухолей во вторичных местах, тем самым давая возможность для атаки опухолей другими терапевтическими агентами.
Сочетанная терапия
Подразумевается, что при применении для лечения различных заболеваний, таких как опухоли, антитела изобретения могут сочетаться с другими терапевтическими агентами, пригодными для тех же или сходных заболеваний. При применении для лечения рака антитела настоящего изобретения могут применяться в сочетании с традиционными средствами терапии рака, такими как хирургия, радиотерапия, химиотерапия и их сочетания.
В определенных аспектах другие терапевтические агенты, пригодные для сочетанной терапии рака с антителом изобретения, включают другие антиангиогенные агенты. Были выявлены и известны в данной области техники многие антиангиогенные агенты, включая те, которые перечислены Carmeliet and Jain (2000). Предпочтительно антитело изобретения против VEGF применяют в сочетании с другим антагонистом VEGF или антагонистом рецептора VEGF, таким как варианты VEGF, растворимые фрагменты рецептора VEGF, аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие антитела против VEGFR, низкомолекулярные ингибиторы тирозинкиназ VEGFR и их любые сочетания. Альтернативно или дополнительно больному можно совместно вводить два или более антител против VEGF.
В некоторых других аспектах другие терапевтические агенты, пригодные для сочетанной с антителом изобретения терапии опухоли, включают антагонисты других факторов, участвующих в росте опухоли, таких как EGFR, ErbB2 (известного также как Her2) ErbB3, ErbB4 или TNF. Иногда может быть выгодным также введение больному одного или более цитокинов. В предпочтительном осуществлении антитело против VEGF вводят совместно с агентом, ингибирующим рост. Например, ингибирующий рост агент можно вводить сначала, а затем антитело против VEGF. Однако рассматривается также одновременное введение или введение сначала антитела против VEGF. Подходящими дозами для ингибирующего рост агента являются те, которые применяются в настоящее время, и они могут быть снижены благодаря сочетанному действию (синергии) ингибирующего рост агента и антитела против VEGF.
Химиотерапевтические агенты
В некоторых аспектах в настоящем изобретении предлагается способ лечения рака посредством введения эффективных количеств антитела против VEGF и одного или более химиотерапевтических агентов больному, у которого предполагается или диагностирован так. Множество химиотерапевтических агентов может быть применено в сочетанных способах лечения изобретения. Иллюстративный и не ограничивающий перечень предполагаемых химиотерапевтических агентов представлен здесь в разделе «Определение».
Специалисты в данной области техники должны понимать, что подходящие дозы химиотерапевтических агентов обычно должны находиться около тех, которые уже применяются при клинической терапии, при которой химиотерапевтические агенты вводят самостоятельно или в сочетании с другими химиотерапевтическими агентами. Изменение дозы должно, очевидно, происходить в зависимости от подлежащего лечению состояния. Контролируемое врачом лечение обычно должно обеспечивать определение подходящей дозы для конкретного субъекта.
Лишь с целью иллюстрации ниже здесь описано химиотерапевтическое лечение метастатического колоректального рака.
В одном предпочтительном осуществлении способы изобретения применяют для лечения колоректального рака, включая метастатический колоректальный рак. Колоректальный рак является третьей из наиболее распространенных причин смертности от рака в Соединенных Штатах. Установлено, что в 1999 г. в Соединенных Штатах было диагностировано приблизительно 129000 новых случаев колоректального рака, и 56000 смертей произошло из-за колоректального рака, Landis et al., Cancer J. Clin. 49:8-31 (1999). Приблизительно у 70% больных колоректальным раком заболевание потенциально может быть излечено путем хирургического удаления, August et al., Cancer Metastasis Rev 3:303-24 (1984). Однако прогноз для 30% с прогрессирующим или метастатическим заболеванием и для 20% тех, у кого возник рецидив после резекции, является плохим. Средняя выживаемость тех, у кого имеется метастатическое заболевание, составляет 12-14 месяцев, Advanced Colorectal Cancer Meta-Analysis Project, J.Clin. Oncol. 10:896-903 (1992).
Стандартное лечение метастатического колоректального рака в Соединенных Штатах до недавнего времени заключалось в химиотерапии 5-фторурацилом (5-FU) плюс биохимический модулятор 5-FU, лейковорин, Advanced Colorectal Cancer Meta-Analysis Project, J.Clin. Oncol. 10:896-903 (1992); Moertel N Engl J Med 330:1136-42 (1994). Сочетание 5-FU/лейковорин обеспечивает нечастое, временное уменьшение колоректальных опухолей, но при этом не было показано, что оно увеличивает длительность выживания по сравнению с одним 5-FU (Advanced Colorectal Cancer Meta-Analysis Project, J.Clin. Oncol. 10:896-903 (1992)), и не было показано, что 5-FU продлевает выживаемость по сравнению с неэффективной терапией плюс наилучший поддерживающий уход, Ansfield et al. Cancer 39:34-40 (1977). Отсутствие выявляемого благоприятного действия 5-FU/лейковорина на выживаемость может быть отчасти обусловлено неадекватным объемом клинических испытаний. В широком рандомизированном испытании больных, получавших адъювантную химиотерапию подлежащего резекции колоректального рака 5-FU/лейковорин проявили увеличенную продолжительность выживания по сравнению с ломустином (MeCCNU), винкристином и 5-FU (MOF; Wolmark et al. J.Clin. Oncol. 11: 1879-87 (1993).
В Соединенных Штатах химиотерапию 5-FU/лейковорин обычно производят согласно одной из двух схем: режимов Mayo Clinic и Roswell Park. Режим Mayo Clinic состоит из интенсивного курса 5-FU плюс низкая доза лейковорина (425 мг/м 2 5-FU плюс 20 мг/м 2 лейковорина, вводимых ежедневно внутривенным [в/в] впрыскиванием в течение 5 дней с курсами, повторяющимися с от 4- до 5-недельными интервалами), Buroker et al. J.Clin. Oncol. 12:14-20 (1994). Режим Roswell Park состоит из еженедельных введений 5-FU плюс высокая доза лейковорина (500-600 мг/м 2 5-FU, вводимого в/в впрыскиванием, плюс 500 мг/м 2 лейковорина, вводимого в виде 2-часовой инфузии, еженедельно на протяжении 6 недель с курсами, повторяющимися каждые 8 недель), Petrelli et al., J.Clin. Oncol. 7:1419-26 (1989). Клинические испытания по сравнению с режимами Mayo Clinic и Roswell Park не показали различия в эффективности, но они, как оказалось, не были способны осуществить это, Buroker et al., J.Clin. Oncol. 12:14-20 (1994); Poon et al., J.Clin. Oncol. 7:1407-18 (1989). Профили токсичности двух режимов различны, причем режим Mayo Clinic приводит к большей лейкопении и стоматиту, а режим Roswell Park приводит к более частой диарее. Больные с впервые диагностированным метастатическим колоректальным раком, получающие любой режим, могут ожидать медиану времени прогрессии заболевания 4-5 месяцев и медиану выживаемости 12-14 месяцев, Petrelli et al., J.Clin. Oncol. 7:1419-26 (1989); Advanced Colorectal Cancer Meta-Analysis Project, J.Clin. Oncol. 10:896-903 (1992); Buroker et al., J.Clin. Oncol. 12:14-20 (1994); Cocconi et al., J.Clin. Oncol. 16:2943-52 (1998).
Недавно появилась новая первоочередная терапия метастатического колоректального рака. В двух рандомизированных клинических испытаниях, каждое с приблизительно 400 больными, была произведена оценка иринотекана в сочетании с 5-FU/лейковорином, Saltz et al., Proc ASCO 18:233a (1999); Douillard et al., Lancet 355:1041-7 (2000). В обоих исследованиях сочетание иринотекан/5-FU/лейковорин показало статистически значимое увеличение выживания (на 2,2 и 3,3 месяца), времени до прогрессии заболевания и показателя ответной реакции по сравнению с одним 5-FU/лейковорином. Выгоды иринотекана приходят ценой повышенной токсичности: добавление иринотекана к 5-FU/лейковорину было связано с повышенной частотой диареи 3/4 степени по критериям общей токсичности Национального института рака (NCI-CTC), 3/4 степени рвоты, 4 степени нейтропении и астении по сравнению с одним 5-FU/лейковорином. Имеется также доказательство того, что в качестве единственного агента иринотекан продлевает выживание при применении на втором этапе терапии, Cunningham et al., Lancet 352:1413-18 (1998); Rougier et al., Lancet 352:1407-12 (1998). Два рандомизированных исследования показали, что иринотекан продлевает выживаемость у больных, у которых происходила прогрессия после терапии 5-FU. В одном исследовании было произведено сравнение иринотекана с наилучшим поддерживающим уходом и было показано 2,8-месячное удлинение выживания; в другом исследовании производили сравнение иринотекана с инфузией 5-FU, и было показано 2,2-месячное удлинение выживания. Вопрос о том, оказывает ли иринотекан большее действие на выживание при первоочередной терапии или на втором этапе терапии, не исследовался хорошо контролируемым образом.
Дозировка и введение
Антитела и химиотерапевтические агенты изобретения вводят больному человеку в соответствии с известными способами, такими как внутривенное введение в виде болюса или путем продолжительной инфузии на протяжении определенного периода времени, внутримышечным, внутрибрюшинным, интрацереброспинальным, подкожным, внутрисуставным, интрасиновиальным, внутрь оболочки сухожилия, пероральным, местным или ингаляционным путями. Предпочтительно внутривенное или подкожное введение антитела.
В одном осуществлении лечение настоящего изобретения включает сочетанное введение антитела против VEGF и одного или более химиотерапевтических агентов. В настоящем изобретении предусматривается введение смесей различных химиотерапевтических агентов. Сочетанное введение включает совместное введение с применением раздельных составов или единого фармацевтического состава и последовательное введение в любом порядке, при котором предпочтительно имеется период времени, когда оба (или все) активные агенты одновременно проявляют свою биологическую активность. Получение и схемы дозировки для таких химиотерапевтических агентов могут соответствовать указаниям производителя или могут быть определены эмпирически практикующим специалистом. Получение и схемы дозировки для химиотерапии описаны также в Chemotherapy Service Ed., M. C. Perry, Williams & Wilkins, Baltimore, Md. (1992). Химиотерапевтический агент может предшествовать или следовать за введением антитела или может даваться одновременно с ним.
Для профилактики или лечения заболевания подходящая дозировка антитела должна зависеть от типа подлежащего лечению заболевания, как определено выше, тяжести и развития заболевания, целей введения антитела для профилактики или лечения, предшествующей терапии, истории болезни пациента и ответа на антитело и выбора лечащего врача. Антитело подходящим образом вводят больному один раз или на протяжении серии курсов лечения. При сочетанном режиме терапии композиции настоящего изобретения вводят в терапевтически эффективном или синергичном количестве. В применении здесь терапевтически эффективное количество является таким, что совместное введение антитела против VEGF и одного или более терапевтических агентов или введение композиции настоящего изобретения приводит к снижению или ингибированию подлежащего лечению заболевания или состояния. Терапевтически синергичное количество представляет собой такое количество антитела против VEGF и одного или более терапевтических агентов, которое необходимо для синергичного или значительного подавления или снятия состояний или симптомов, связанных с конкретным заболеванием.
В зависимости от тяжести заболевания исходная предлагаемая доза для введения больному составляет от приблизительно 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) антитела путем однократного или многократного введения или посредством продолжительной инфузии. Обычная дневная доза может варьировать от приблизительно 1 мкг/кг до приблизительно 50 мг/кг или более в зависимости от упомянутых вше факторов. Для повторных введений на протяжении нескольких дней или более в зависимости от состояния лечение продолжают до достижения желаемого подавления симптомов заболевания. Могут применяться, однако, другие режимы дозировки. В предпочтительном аспекте антитело изобретения вводят на каждую вторую или третью неделю в дозе, варьирующей от приблизительно 5 мг/кг до приблизительно 15 мг/кг. Более предпочтительно такой режим дозировки применяют в сочетании с режимом химиотерапии в качестве первоочередной терапии для лечения метастатического колоректального рака. В некоторых аспектах режим химиотерапии включает традиционное прерывистое введение высокой дозы. В некоторых других аспектах химиотерапевтические агенты вводят меньшими и более частыми дозами без запланированных перерывов («равномерная терапия»). Эффективность терапии изобретения легко отслеживается с помощью традиционных способов и анализов.
Дополнительная информация о подходящих дозах предлагается в примере ниже.
Эффективность лечения
Главным преимуществом лечения настоящего изобретения является способность оказывать противораковое действие у больного человека без индукции значительной токсичности или побочных эффектов, так что больной в целом выигрывает от лечения. Эффективность лечения изобретения может быть измерена по различным конечным результатам, обычно применяемым для оценки лечения рака, включая, но не ограничиваясь этим, регрессию опухоли, снижение массы или размера опухоли, время прогрессии, длительность выживания, выживание без прогрессии, общий показатель ответа, продолжительность ответа и качество жизни. Поскольку антиангиогенные агенты изобретения направлены против сосудов опухоли, а необязательно против самих неопластических клеток, они представляют собой уникальный класс противораковых лекарств, и, следовательно, для клинических ответов на данные лекарства могут потребоваться уникальные показатели и определения. Например, уменьшение опухоли на 50% при 2-мерном анализе представляет собой стандартную линию раздела для проявляемого ответа. Однако антитело против VEGF изобретения может вызывать ингибирование метастатического распространения без уменьшения первичной опухоли или может оказывать останавливающее рост опухоли действие. Следовательно, для оценки эффективности антиангиогенной терапии следует применять новые подходы, включая, например, измерение маркеров ангиогенеза плазмы или мочи и измерение ответа с помощью радиологической визуализации.
В одном осуществлении настоящее изобретение может быть применено для увеличения длительности выживания больного человека с подозреваемым или диагностированным раком. Длительность выживания определяется как время от первого введения лекарства до смерти. В предпочтительном аспекте антитело против VEGF изобретения вводят больному человеку в сочетании с одним или более терапевтическими агентами, что тем самым эффективно увеличивает длительность выживания больного по сравнению с одной химиотерапией. Например, группа больных, подвергнутых лечению антителом против VEGF в сочетании с химиотерапевтической смесью из, по меньшей мере, двух, предпочтительно трех химиотерапевтических агентов, может иметь медиану продолжительности выживания, которая, по меньшей мере, приблизительно на 2 месяца, предпочтительно между приблизительно 2 и приблизительно 5 месяцами превышает таковую группы больных, подвергнутых лечению той же самой химиотерапевтической смесью отдельно, причем указанное увеличение является статистически значимым. Длительность выживания может быть также измерена с помощью стратифицированного отношения риска (HR) подвергаемой лечению группы по сравнению с контрольной группой, который представляет собой риск смерти для больного во время лечения. Предпочтительно сочетанное лечение антителом против VEGF и одним или более химиотерапевтическими агентами значительно снижает риск смерти, по меньшей мере, на 30% (т.е. стратифицированное HR приблизительно 70%), предпочтительно, по меньшей мере, на 35% (т.е. стратифицированное HR приблизительно 65%) по сравнению с одной химиотерапией.
В другом осуществлении в настоящем изобретении предлагаются способы увеличения выживания без прогрессии у больного человека с подозреваемым или диагностированным раком. Время прогрессии заболевания определяют как время от введения лекарства до прогрессии заболевания. В предпочтительном осуществлении сочетанное лечение изобретения с применением антитела против VEGF и одного или более химиотерапевтических агентов значительно увеличивает выживаемость без прогрессии, по меньшей мере, на 2 месяца, предпочтительно от приблизительно 2 до приблизительно 5 месяцев по сравнению с лечением одной химиотерапией.
В еще одном осуществлении лечение настоящего изобретения значительно увеличивает показатель ответной реакции в группе больных людей с подозреваемым или диагностированным раком, которых лечат с помощью различных терапевтических агентов. Показатель ответной реакции определяется как процент подвергнутых лечению больных, которые реагировали на лечение. В одном аспекте сочетанное лечение изобретения с применением антитела против VEGF и одного или более химиотерапевтических агентов значительно увеличивает показатель ответной реакции в подвергнутой лечению группе больных по сравнению с группой, подвергнутой лечению одной химиотерапией, причем указанное увеличение имеет величину p по критерию хи-квадрат менее 0,005.
В одном аспекте в настоящем изобретении предлагаются способы увеличения продолжительности ответа у больного человека или группы больных людей с подозреваемым или диагностированным раком. Продолжительность ответа определяют как время от первоначального ответа до прогрессии заболевания. При сочетанном лечении изобретения с применением антитела против VEGF и одного или более химиотерапевтических агентов достижимо и предпочтительно статистически значимое увеличение продолжительности ответа, по меньшей мере, на 2 месяца.
Безопасность лечения
В настоящем изобретении предлагаются способы эффективного лечения рака без значительных неблагоприятных эффектов у подвергнутого лечению больного человека. Клинические последствия лечения согласно изобретению являются в некоторой мере неожиданными в том, что некоторые неблагоприятные эффекты, которые, как полагали, связаны с антиангиогенной терапией, не наблюдаются в ходе лечения согласно настоящему изобретению. Например, в предшествующих клинических исследованиях предполагалось, что лечение антителами против VEGF может вызывать тромбоз (в некоторых случаях фатальный), гипертензию, протеинурию и эпистаксис (кровотечение). Однако сочетанная терапия изобретения с применением антитела против VEGF в сочетании с химиотерапевтической смесью, включающей, по меньшей мере, два, предпочтительно три химиотерапевтических агента, не повышает значительно частоту случаев данных неблагоприятных эффектов по сравнению с оной химиотерапией. Таким образом, лечение настоящего изобретения неожиданно содержит побочные эффекты на приемлемом уровне и в то же время значительно улучшает противораковую эффективность.
V. Промышленные продукты
В другом осуществлении изобретения предлагается промышленный продукт, содержащий материалы, пригодные для лечения заболеваний, описанных выше. Промышленный продукт включает контейнер, этикетку и вкладыш. Подходящие контейнеры включают, например, флаконы, сосуды, шприцы и т.д. Контейнеры могут быть сделаны из множества материалов, таких как стекло или пластик. Контейнер содержит композицию, которая является эффективной для лечения состояния и может содержать вход для стерильного доступа (например, может быть мешочком с раствором для внутривенного введения или сосудом, содержащим пробку, протыкаемую иглой для подкожных инъекций. По меньшей мере, одним активным агентом в композиции является антитело против VEGF. Этикетка на контейнере или присоединенная к нему указывает, что композиция применяется для лечения предпочтительного состояния. Промышленный продукт может дополнительно включать второй контейнер, включающий фармацевтически приемлемый буфер, такой как забуференный фосфатом солевой раствор, раствор Рингера и раствор декстрозы. Он может дополнительно включать другие материалы, желательные с коммерческой и пользовательской точек зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы. Кроме того, промышленный продукт включает вкладыш с указаниями по применению, включая, например, предупреждение о том, что композицию не следует применять в сочетании с химиотерапевтическим агентом типа антациклина, например доксорубицином или эпирубицином, или инструкцию для пользователя композиции по введению больному композиции антитела против VEGF и антинеопластической композиции.
Депонирование материалов
Следующая гибридомная линия клеток была депонирована по условиям Будапештского соглашения с Американской коллекцией типов культур (ATCC), Manassas, Va., USA:
Следующие примеры предназначены лишь для иллюстрации практического осуществления настоящего изобретения и не предлагаются как способ ограничения. Раскрытие всех цитированных здесь патентных и научных литературных источников специально включено во всей их полноте в качестве ссылки.
VI. Примеры
Пример 1. Добавление антитела против VEGF в болюс иринотекан/фторурацил/лейковорин (IFL) первоочередной терапии метастатического колоректального рака
Было произведено многоцентровое с фазой III рандомизированное испытание для оценки эффективности и безопасности бевацизумаба при добавлении к стандартной первоочередной химиотерапии, применяемой для лечения метастатического колоректального рака. Испытание охватывало более 900 больных с гистологически подтвержденным, ранее не подвергавшимся лечению, двумерно-измеряемым метастатическим колоректальным раком.
Способы и материалы
Антитело против VEGF бевацизумаб
Антитело против VEGF “Bevacizumab (BV)”, известное также как “rhuMAb VEGF” или “AvastinTM”, представляет собой гуманизированное антитело, получаемое согласно Presta et al. (1997) Cancer Res. 57:4593-4599. Оно включает мутированные каркасные области IgG1 человека и антигенсвязывающие определяющие комплементарность области из моноклонального антитела A.4.6.1 мыши против hVEGF, которое блокирует связывание VEGF человека со своими рецепторами. Патент США No. 6582959; WO 98/45331. Приблизительно 93% аминокислотной последовательности бевацизумаба, включая большую часть каркасных областей, берет начало от IgG1 человека и приблизительно 7% последовательности берет начало от антитела мыши A4.6.1. Бевацизумаб имеет молекулярную массу приблизительно 149000 дальтон и гликозилирован.
Идентичность полипептида и сайтов гликозилирования устанавливались на основании аминокислотного состава и пептидных карт. Характеристики размера и заряда молекулы и чистота клинических партий были показаны с помощью электрофореза в полиакриламидном геле с додецилсульфатом или капиллярного электрофореза без просеивания через гель, изоэлектрического фокусирования, а также ионообменной и исключающей по размеру хроматографии. Активность бевацизумаба количественно оценивали с помощью ИФА или анализа рецепторных киназ для рекомбинантного VEGF человека.
Бевацизумаб получали способом рекомбинантной ДНК с применением генетически модифицированной линии клеток яичника китайского хомячка. Белок очищали из культуральной среды клеток традиционными способами колоночной хроматографии и фильтрации. Конечный продукт тестировали на количество, идентичность, безопасность, чистоту, действенность, эффективность и состав композиции наполнитель/агент в соответствии с правилами Управления США по санитарному надзору за качеством пищевых продуктов и медикаментов. Чистота бевацизумаба составляет >95%. Бевацизумаб поставляется в виде от прозрачной до слегка опалесцирующей жидкости, готовой для парентерального введения.
Отбор больных
Подходящие больные имели гистологически подтвержденную метастатическую колоректальную карциному с двумерно измеряемым заболеванием. Другие добавочные критерии включали возраст, по меньшей мере, 18 лет, статус состояния 0 или 1 по классификации Eastern Cooperative Oncology Group (ECOG) (Oken et al. (1982) Am. J. Clin. Oncol. 5:649-55), ожидаемую продолжительность жизни более трех месяцев и подписанное согласие, основанное на получении информации. Необходимы также были адекватные гематологические, печеночные и почечные функции (включая экскрецию с мочой не более 500 мг белка в сутки).
Критерии исключения включали предшествующую химиотерапию или биологическую терапию метастатического заболевания (адъювантное или радиосенсибилизирующее применение фторпиримидинов с лейковорином или левамизолом или без них более чем за 12 месяцев до разрешения начала исследования), получение радиотерапии в пределах 14 дней до начала лечения исследования, общую хирургию в пределах 28 дней до начала лечения исследования, клинически значимое сердечно-сосудистое заболевание, клинически выявляемый асцит, беременность или лактацию, регулярное потребление аспирина (более 325 мг в день) или других нестероидных противовоспалительных агентов, ранее имевшиеся кровоточащий диатез или коагулопатию или необходимость в антикоагуляции с полноразмерной дозировкой или известные метастазы в центральной нервной системе.
Организация исследования
Подходящих больных распределяли для лечения с помощью алгоритма динамической рандомизации, который был разработан для достижения общего баланса между группами; рандомизацию производили по иерархии согласно определяемому исследовательским центром исходному статусу состояния ECOG (0 или 1), локализации первичного заболевания (ободочная или прямая кишка) и количеству сайтов метастазирования (одного или более одного). Исходно больных случайным образом распределяли в соотношении 1:1:1 для получения IFL плюс плацебо, IFL плюс бевацизумаб или фторурацил и лейковорин плюс бевацизумаб (таблица 1), лечение каждым из которых продолжалось до прогрессии заболевания или наступления неприемлемых неблагоприятных эффектов или достижения максимума в 96 недель.
Фторурацил
Лейковорин
Плацебо
500 мг/м2
20 мг/м2
Каждые 2 нед.
Фторурацил
Лейковорин
Бевацизумаб
500 мг/м2
20 мг/м2
5 мг/кг массы тела
Каждые 2 нед.
Лейковорин
500 мг/м2
Был составлен график внутреннего анализа по отслеживанию 300 больных, подвергнутых рандомизации, причем для независимой, отслеживающей раскрытые результаты комиссии имелся доступ к безопасности применения IFL плюс бевацизумаб на основе всей имеющейся информации о безопасности, включая количество смертей в каждой группе, но при отсутствии информации, касающейся ответа опухоли. Если отслеживающая данные комиссия находила нежелательными неблагоприятные эффекты, приписываемые добавлению бевацизумаба к IFL, включение больных в группу, предназначенную для получения фторурацила и лейковорина плюс бевацизумаб, прекращалось, и дополнительные больные распределялись случайным образом в соотношении 1:1 для получения либо IFL плюс плацебо, либо IFL плюс бевацизумаб. Однако если отслеживающая данные комиссия заключала, что профиль безопасности IFL плюс бевацизумаб является неприемлемым, распределение для данного лечения прекращалось, и вместо этого больных случайным образом распределяли в соотношении 1:1 для получения либо сочетания фторурацила и лейковорина плюс бевацизумаб, либо IFL плюс плацебо.
Ответ и прогрессию опухоли определяли с применением критериев оценки ответа солидных опухолей. Therasse et al. (2000) J. Natl. Cancer Inst. 92:205-16. Во время прогрессии заболевания распределение для лечения раскрывалось, и больным могло быть назначено лечение второй очереди. Такие больные в группе, предназначенной для содержащего бевацизумаб лечения, имели возможность выбора приема бевацизумаба во время лечения второй очереди. Не допускалось перекреста в группе, получавшей IFL плюс плацебо. Пациенты, предназначенные для лечения с включением бевацизумаба, которые не проявляли признаков прогрессии заболевания в конце 96-недельного периода исследования, могли продолжать прием бевацизумаба в отдельном расширяющем исследовании. Больные в группе, получавшей бевацизумаб, у которых был подтвержден полный ответ или у которых наблюдались неприемлемые неблагоприятные эффекты химиотерапии, могли прекратить химиотерапию и получать только бевацизумаб.
Бевацизумаб (или плацебо) вводили одновременно с химиотерапией. Дозы бевацизумаба и химиотерапии пересчитывали, если масса больного изменялась, по меньшей мере, на 10 процентов во время испытания. У больных с неблагоприятными эффектами, связанными с лечением, допускались изменения в стандартных дозах иринотекана и фторурацила (согласно вкладышу в упаковку) в пределах цикла и между циклами. Дозы лейковорина и бевацизумаба не меняли.
При анализе выживания и последующего лечения всех больных отслеживали до наступления смерти, выбывания до конца или прекращения испытания.
Оценки
После базовой оценки оценивали состояние опухоли каждые 6 недель на протяжении первых 24 недель исследования и затем каждые 12 недель для оставшихся после терапии. Для всех случаев полного или частичного ответа требовалось подтверждение, по меньшей мере, через четыре недели после их первоначальной фиксации.
Безопасность оценивали на основании сообщений о неблагоприятных эффектах, результатов лабораторных тестов и измерений основных показателей состояния организма. Неблагоприятные эффекты распределяли по категориям согласно критериям общей токсичности Национального института рака, версия 2, где степень 1 обозначает слабые неблагоприятные эффекты, степень 2 обозначает умеренные неблагоприятные эффекты, степень 3 обозначает тяжелые неблагоприятные эффекты, а степень 4 обозначает угрожающие жизни неблагоприятные эффекты. Заранее оговоренные измерения безопасности включали случаи наступления всех неблагоприятных эффектов, все тяжелые неблагоприятные случаи и неблагоприятные случаи, которые были связаны с бевацизумабом - гипертензии, тромбоза, кровотечения 3 или 4 степени или протеинурии - а также диареи 3 или 4 степени или отклонениями от базового уровня различных лабораторных величин и основных показателей состояния организма.
Для отслеживания безопасности режима IFL плюс плацебо и IFL плюс бевацизумаб во время испытания производилось отслеживание раскрытым образом комиссией по наблюдению за безопасностью данных случаев смерти, неблагоприятных тяжелых случаев, диареи 3 или 4 степени, кровотечения 3 или 4 степени из любого источника и тромбоза до завершения участия испытуемых или времени проведения промежуточного анализа эффективности, в зависимости от того, что наступало первым.
Статистический анализ
Первичным итоговым показателем являлась продолжительность общего выживания; выживание измеряли независимо от последующего лечения. Между группами не было, однако, перекрещивания. Применяли способы анализа выживания, такие как способ Каплана-Мейера, логарифмический ранговый критерий и модель пропорциональных интенсивностей отказов Кокса. Вторичными итоговыми показателями служили выживание без прогрессии, объективные показатели ответной реакции (полные и частичные ответы), длительность ответов и качество жизни.
Для больных, которые оставались живы к моменту проведения анализа, данные по выживанию ограничивались временем последнего контакта. Выживание без прогрессии определялось как время от рандомизации до прогрессии или смерти во время испытания, причем смерть во время испытания определяли как любую смерть, наступившую в пределах 30 дней после последней дозы бевацизумаба или химиотерапии. Для больных без прогрессии заболевания к моменту проведения конечного анализа данные о выживании без прогрессии прерывали на последней оценке состояния опухоли или на день 0, если не производилась дополнительная оценка после исходной. Больных без адекватных, доведенных до конца данных относили к категории не проявляющих ответ.
Для определения отношения риска смерти 0,75 в группе, получавшей IFL плюс бевацизумаб, по сравнению с контрольной группой было необходимо приблизительно 385 смертей. Все расчеты производили с помощью логарифмического рангового критерия и включали двухсторонние величины P при величине альфа 0,05, статистическая значимость 80 процентов, и одного промежуточного анализа эффективности.
Промежуточный анализ проводили в открытом режиме. Промежуточный анализ безопасности производили после случайного распределения приблизительно 100 больных в каждую группу. Повторный промежуточный анализ безопасности и эффективности производили после 193 происшедших смертей (половины необходимого количества случаев).
Анализ эффективности производили в соответствии с принципом намерения-лечения. Анализы безопасности включали всех больных, которые получали, по меньшей мере, одну дозу исследуемого лекарства.
Результаты
Характеристика больных
На протяжении периода приблизительно двадцати месяцев 923 больных были подвергнуты рандомизации в 164 местах Соединенных Штатов, Австралии и Новой Зеландии. После случайного распределения 313 больных в одну из трех групп - 100 в группу IFL плюс плацебо, 103 в группу IFL плюс бевацизумаб и 110 в группу фторурацил, лейковорин и бевацизумаб - распределение в группу, получавшую фторурацил, лейковорин и бевацизумаб, было прекращено (результаты данной группы не сообщаются). Данная стадия потребовалась протоколом после первого формального промежуточного анализа безопасности, заключившим, что режим IFL плюс бевацизумаб имеет приемлемый профиль безопасности и что распределение в данную группу может быть продолжено.
Анализ цель-лечение для первичного конечного результата общего выживания включал 411 больных в группе, получавшей IFL плюс плацебо, и 402 больных в группе, получавшей IFL плюс бевацизумаб. В таблице 2 показаны отдельные демографические и базовые характеристики, которые были хорошо сбалансированы между группами. Сходное количество больных в каждой группе раннее было подвергнуто хирургической операции или получали терапию облучением или адъювантную терапию колоректального рака.
Лечение
Медиана продолжительности терапии составляла 27,6 недель в группе, получавшей IFL плюс плацебо, и 40,4 недель в группе, получавшей IFL плюс бевацизумаб. Процент запланированной дозы иринотекана, который был получен, был сходен в двух группах (78 процентов в группе, получавшей IFL плюс плацебо, и 73 процента в группе, получавшей IFL плюс бевацизумаб).
В качестве данных на момент прекращения испытания 33 больных в группе, получавшей IFL плюс плацебо, и 71 в группе, получавшей IFL плюс бевацизумаб, еще продолжали принимать исходно назначенную терапию. Коэффициент применения терапии второй очереди, которая могла повлиять на выживание, такой как оксалиплатин или метастазэктомия, был хорошо сбалансирован между двумя группами. В обеих группах приблизительно 50 процентов больных получали терапию второй очереди в определенной форме; 25 процентов всех больных получали оксалиплатин и менее 2 процентов больных подвергались метастазэктомии.
(N=411)
(N=402)
Эффективность
Медиана продолжительности общего выживания, первичный конечный показатель, была значительно большей в группе, получавшей IFL плюс бевацизумаб, по сравнению с группой, получавшей IFL плюс плацебо (20,3 месяцев против 15,6 месяцев), что соответствует отношению риска смерти 0,66 (P<0,001) (таблица 3 и фиг. 1) или снижению на 34 процента риска смерти в группе бевацизумаба. Показатель выживания в течение одного года составлял 74,3 процента в группе, получавшей IFL плюс бевацизумаб, и 63,4 процента в группе, получавшей IFL плюс плацебо (P<0,001). В подгруппе больных, которые получали лечение второй очереди оксалиплатином, медиана продолжительности общего выживания составляла 25,1 месяцев в группе, получавшей IFL плюс бевацизумаб, и 22,2 месяцев в группе, получавшей IFL плюс плацебо (P<0,001).
Добавление бевацизумаба к IFL было связано с повышением медианы продолжительности выживания без прогрессии (10,6 месяцев против 6,2 месяцев; отношение риска прогрессии 0,54 при сравнении с группой, получавшей IFL плюс плацебо; P<0,001); показателя ответной реакции (44,8 процентов против 34,8 процентов; P=0,004); и медианы продолжительности ответа (10,4 месяцев против 7,1 месяцев; отношение риска прогрессии 0,62; P=0,001) (таблица 3). На фигуре 2 показано определение по Каплану-Мейеру выживания без прогрессии. Эффекты лечения совмещались с предварительно установленными подгруппами, включая определенные по возрасту, полу, расе, статусу состояния ECOG, локализации первичной опухоли, наличию или отсутствию предшествующей адъювантной терапии, длительности метастатического заболевания, количеству мест метастазирования, по годам после установления диагноза колоректального рака, наличию или отсутствию предшествующей радиотерапии, исходному размеру опухоли и по концентрациям в сыворотке альбумина, щелочной фосфатазы и лактатдегидрогеназы.
Безопасность
В таблице 4 представлена частота отдельных неблагоприятных случаев 3 или 4 степени во время назначенного лечения без поправки на медиану продолжительности терапии (27,6 недель в группе, получавшей IFL плюс плацебо, и 40,4 недель в группе, получавшей IFL плюс бевацизумаб). Частота любых неблагоприятных случаев 3 или 4 степени была приблизительно на 10 процентных пунктов выше у больных, получавших IFL плюс бевацизумаб, главным образом из-за повышения частоты гипертензии 3 степени (требующей лечения) и небольшого повышения частоты диареи и лейкопении 4 степени. Однако не было значимой разницы в частоте неблагоприятных случаев, ведущих к госпитализации или прекращению лечения исследования или в 60-дневном показателе смертности по любой причине.
**P<0,01. Включены лишь больные, которые получали, по меньшей мере, одно лечение исследуемым лекарством.
В испытаниях фазы 1 и 2 были выявлены геморрагия, тромбоэмболия, протеинурия и гипертензия в качестве возможных связанных с бевацизумабом неблагоприятных эффектов. Однако в настоящем исследовании лишь частота гипертензии явно возрастала в группе, получавшей IFL плюс бевацизумаб, по сравнению с группой, получавшей IFL плюс плацебо. Все случаи гипертензии поддавались лечению стандартными пероральными антигипертензивными агентами (например, блокаторами кальциевых каналов, ингибиторами ангиотензинпревращающего фермента и диуретиками). Не было случаев прекращения терапии бевацизумабом, гипертензивных кризов или смертей, связанных с гипертензией в группе бевацизумаба.
Показатели протеинурии 2 или 3 степени (не было случаев протеинурии 4 степени или нефротического синдрома) и кровотечения 3 или 4 степени по любой причине были сходны в двух группах, хотя все три случая кровотечения 4 степени были в группе, получавшей IFL плюс бевацизумаб. Частота всех случаев венозного и артериального тромбоза составляла 19,4 процента в группе, получавшей IFL плюс бевацизумаб, и 16,2 процента в группе, получавшей IFL плюс плацебо (P=0,26).
Желудочно-кишечное прободение имело место у шести больных (1,5 процента), получавших IFL плюс бевацизумаб. Один больной умер в качестве прямого следствия данного события, тогда как пятеро других выздоровели (трое из них были готовы к возобновлению лечения без последующих осложнений). Из шести больных с прободением у троих был подтвержден полный или частичный ответ на IFL плюс бевацизумаб. Факторами, отличными от лечения исследования, которые могли быть связаны с желудочно-кишечным прободением, являлись хирургия ободочной кишки в пределах двух месяцев у двух больных и язвенная болезнь желудка и двенадцатиперстной кишки у одного больного.
Результаты данной III фазы исследования служат прямой поддержкой для широкого применения антиангиогенных агентов при лечении рака. Добавление бевацизумаба, антитела против VEGF, к химиотерапии IFL подтвердило клинически явное и статистически значимое улучшение у больных раком при оценке, например, по общему выживанию, выживанию без прогрессии, показателю ответной реакции и длительности ответа. Повышение на 4,7 месяцев медианы продолжительности выживания, приписываемое бевацизумабу, является столь же значительным или большим по сравнению с наблюдаемым при любом другом испытании для лечения колоректального рака стадии 3. Goldberg et al. (2004) J. Clin. Oncol. 22:23-30. Медиана выживания в 20,3 месяца в популяции, лечившейся бевацизумабом, имела место, несмотря на ограниченную доступность оксалиплатина для терапии второй очереди в данном испытании.
По сравнению с введением только IFL режим IFL плюс бевацизумаб повышал выживание без прогрессии от медианы 6,2 месяцев до 10,6 месяцев, общий показатель ответной реакции с 34,8 процентов до 44,8 процентов и медиану продолжительности ответа с 7,1 месяцев до 10,4 месяцев. Улучшения являются клинически явными. Не предполагалось, что абсолютное улучшение показателя ответной реакции в 10 процентов при применении IFL плюс бевацизумаб может быть связано с увеличением на такую же величину выживания. Данное наблюдение позволяет предполагать, что первичным механизмом действия бевацизумаба является ингибирование роста опухоли, а не снижение количества клеток.
Данное клиническое преимущество сопровождалось относительно умеренным повышением побочных эффектов лечения, с которыми было легко справиться. Происходило абсолютное повышение приблизительно на 10 процентов всех случаев неблагоприятных эффектов 3 и 4 степени, обусловленных преимущественно требующей лечения гипертензией, диареей и лейкопенией. Показатели 60-дневной смерти по любой причине, госпитализации и прекращения лечения не увеличивались значительно при добавлении бевацизумаба к IFL.
Предшествующие клинические испытания 1 и 2 позволяли предполагать, что лечение одним бевацизумабом или химиотерапией приводит к увеличению случаев тромбоза, кровотечений, протеинурии и гипертензии. Kabbinavar et al. (2003) J. Clin. Oncol. 21:60-65; Yang et al. (2003) New Engl. J. Med. 349:427-34. За исключением гипертензии не было выявлено избыточности данных побочных эффектов по сравнению с их частотой в группе, получавшей IFL плюс плацебо, что тем самым подчеркивает важность рандомизированных, контролируемых плацебо исследований для оценки безопасности, а также эффективности. Одним из новых, потенциально неблагоприятных эффектов явилось желудочно-кишечное прободение. Данное осложнение явилось неожиданным и имело различные клинические проявления. Сообщалось о тяжелых кишечных осложнениях, в особенности у больных с нейтропенией, при режимах IFL и другой химиотерапии колоректального рака, и в одной серии сообщалось о фистулах у более 2 процентов больных, подвергавшихся лечению в режимах, основанных на фторурациле. Saltz et al. (2000) New Engl. J. Med. 343:905-914; Rothenberg et al. (2001) J. Clin. Oncol. 19:3801-7; Tebbutt et al. (2003) Gut 52:568-73. Таких случаев не происходило в группе, получавшей IFL плюс плацебо, тогда как шесть случаев наблюдалось в группе, получавшей IFL плюс бевацизумаб (1,5 процентов), иногда в условиях общего ответа опухоли. Хотя трое их данных шести больных были способны к возобновлению лечения без последующих осложнений, один больной умер, и у двоих терапия была прекращена постоянно из-за данного осложнения.
Хотя предшествующие исследования на животных и клинические испытания ранней стадии предполагали применение антиангиогенной терапии для лечения рака, в настоящем изобретении было впервые показано, что применение ангиогенного ингибитора, такого как антитело против VEGF, действительно приводит к статистически значимым и клинически явным преимуществам для больных раком.
Пример 2.
Добавление бевацизумаба к болюсу 5-FU/лейковорин при первоочередном лечении метастатического колоректального рака.
В данном рандомизированном испытании II фазы сравнивали бевацизумаб плюс 5-фторурацил и лейковорин (5-FU/LV) с плацебо плюс 5-FU/LV в качестве первоочередной терапии больных, рассматривавшихся как неоптимальные кандидаты для первоочередного лечения иринотеканом.
Больные и способы
Отбор больных
Отбирали больных с гистологически подтвержденным, ранее не подвергавшимся лечению, поддающимся измерению метастатическим колоректальным раком, если они, по мнению исследователя, не являлись оптимальными кандидатами для первоочередной содержащей иринотекан терапии и имели, по меньшей мере, одно из следующих отличительных свойств: возраст свыше 65 лет, ECOG PS 1 или 2, сывороточный альбумин, равный или менее 3,5 г/дл, или предшествующая радиотерапия области живота или таза. Больных исключали, если они подвергались общим хирургическим процедурам или открытой биопсии или пережили значительное травматическое повреждение в пределах 28 дней до начала исследования; если для рецидивов требовалась общая хирургия в ходе исследования; если больные в настоящий момент или недавно получали терапевтические антикоагулянты (за исключением необходимых для установки катетера), тромболитическую терапию или хроническое, ежедневное лечение аспирином (≥325 мг/день) или нестероидные противовоспалительные лекарства; имели тяжелую, незаживающую рану, язву или перелом кости; имели в истории болезни или указание на метастазы в ЦНС; были беременными или лактировали; или имели протеинурию или клинически значимое ухудшение функции почек в исходном состоянии. Всеми больными было подписано согласие, основанное на получении информации, на их участие.
Организация исследования и лечения
Для случайного распределения отобранных больных в одну из двух групп лечения: 5-FU/LV плюс плацебо или 5-FU/LV плюс бевацизумаб, применяли интерактивную систему с речевым ответом. Применяли динамический алгоритм рандомизации для достижения общего баланса и баланса внутри каждой из следующих категорий: исследовательский центр, исходный статус состояния ECOG (0 или ≥ 1), место первичного заболевания (ободочная или прямая кишка) и количество мест метастазирования (1 или >1). Лечение 5-FU/LV, включающее LV 500 мг/м2 на протяжении 2 часов и 5-FU 500 мг/м2 в виде болюса на середине инфузии LV (Roswell Park regimen; Petrelli et al. (1989) J. Clin. Oncol. 7:1419-1426) вводили еженедельно на протяжении первых 6 недель каждого 8-недельного цикла. Химиотерапию продолжали до завершения исследования (96 недель) или прогрессии заболевания. Бевацизумаб 5 мг/кг или плацебо вводили каждые 2 недели. Больные в группе бевацизумаба, у которых был подтвержден полный ответ или которые испытывали неприемлемую токсичность в результате лечения химиотерапией, освобождались от продолжения введения 5-FU/LV и продолжали получать только бевацизумаб в качестве первоочередного лечения. В момент прогрессии заболевания распределение больных по типу лечения раскрывали, и они могли получать любое лечение второй очереди по выбору исследователя. Лишь больные, которые были случайным образом отнесены к группе бевацизумаба, могли получать бевацизумаб в качестве компонента лечения второй очереди. После завершения исследования больных отслеживали по любому последующему лечению и выживанию каждые 4 месяца до смерти, убытия до завершения или прекращения исследования.
Оценки исследования
Больных подвергали оценке на состояние опухоли в начале и по завершении каждого 8-недельного цикла с помощью подходящих радиографических способов, обычно винтового CT сканирования. Ответ опухоли, или прогрессия, определялись как исследователем, так и независимыми радиологическими средствами (IRF) с применением Response Evaluation Criteria in Solid Tumors. Therasse et al. (2000). Оценку IRF производили, не зная распределения для лечения и оценку исследователя. Кроме того, больные заполняли Functional Assessment of Cancer Therapy-Colorectal (FACT-C), версия 4, утвержденный инструмент для оценки качества жизни (QOL) у больных колоректальным раком, исходно и перед каждым циклом лечения до прогрессии заболевания. Ward et al. (1999) Qual. Life Res. 8:181-195.
Безопасность оценивали по сообщениям о неблагоприятных случаях, результатам лабораторных тестов и измерениям основных показателей состояния организма. Неблагоприятные случаи и аномальные лабораторные результаты распределяли по категориям с помощью National Cancer Institute Common Toxicity Criteria (NCI-CTC), версия 2. Предварительно оговоренные пределы безопасности включали четыре неблагоприятных случая, представляющих особый интерес (гипертензии, протеинурии, тромбоза и кровотечения) на основании данных предшествующих клинических испытаний бевацизумаба.
Статистический анализ
Первичным итоговым показателем служила продолжительность общего выживания. Вторичные итоговые показатели включали выживание без прогрессии, объективный показатель ответной реакции (полной или частичной), продолжительность ответа и изменение показателя FACT-C QOL. Продолжительность выживания определяли как время от рандомизации до смерти. Для больных, остававшихся живыми на время анализа, продолжительность выживания ограничивали датой последнего контакта. Выживание без прогрессии определялось как время от рандомизации до прогрессии заболевания или смерти при испытании, определяемой как смерть по любой причине в пределах 30 дней после последней дозы исследуемого лекарства или химиотерапии. Для больных без прогрессии заболевания к моменту проведения анализа выживание без прогрессии прерывали на последней оценке состояния их опухоли или на день 1 (первом дне лечения исследования), если не производилась дополнительная оценка после исходной. При анализе объективного ответа больных без оценок опухоли относили к категории не проявляющих ответ. Анализы прогрессии заболевания и ответа основывались на оценках IRF. Изменение в качестве жизни анализировали как время до ухудшения в QOL (TDQ), определяемое как время от рандомизации до наиболее раннего снижения на ≥3 пункта по сравнению с исходным специфичного для рака ободочной кишки показателя подшкалы FACT-C (CCS), прогрессию заболевания или смерть при испытании. TDQ определяли также для TOI-C (суммы CCS, физического и функционального благополучия) и общего FACT-C для отклонений от исходного значения на 7 и 9 пунктов, соответственно.
Для определения отношения риска смерти 0,61 в группе 5-FU/LV/бевацизумаб по отношению к группе 5-FU/LV/плацебо требовалось приблизительно 133 смерти. При расчетах применяли критерий на основе двойной выборки, логарифмический ранговый критерий при уровне значимости 0,05 с показателем 80% и два промежуточных анализа. Промежуточный анализ проводили в открытом режиме. Промежуточные анализы производились независимой Комиссией по отслеживанию результатов (DMC) с открытым доступом. Промежуточный анализ безопасности проводился после 44 смертей, а второй промежуточный анализ безопасности и эффективности производился после 89 смертей. При промежуточном анализе эффективности руководствовались формальным правилом последовательной групповой остановки, основанным на функции затрат О'Брайна-Флеминга. Для определения медианы выживания, выживания без прогрессии и продолжительности ответной реакции для каждой группы лечения применяли методологию Каплана-Мейера. Отношения риска для группы бевацизумаба по сравнению с группой плацебо определяли с помощью модели послойных пропорциональных интенсивностей отказов Кокса. Для сравнения двух групп применяли двусторонний послойный логарифмический ранговый критерий. Послойный анализ включал базовый статус состояния ECOG, место первичного заболевания и количество сайтов метастазирования. Объективные показатели ответной реакции сравнивали с помощью теста хи-квадрат. В качестве исследовательского анализа для определения влияния факторов риска на изменения действия лечения на продолжительность выживания и выживания без прогрессии применяли модель пропорциональных интенсивностей отказов Кокса. Анализ эффективности производили на популяции намерения-лечения, определяемой как все рандомизированные больные. Анализы безопасности включали всех больных, которые получали, по меньшей мере, одну дозу исследуемого лекарства.
Результаты
Характеристика больных
На период в двадцать три месяца 209 больных были рандомизированы в 60 местах в Соединенных Штатах и Австралии/Новой Зеландии. Для анализа намерения-лечения первичного конечного результата (общего выживания) имелось 105 больных в группе 5-FU/LV/плацебо и 104 больных в группе 5-FU/LV/бевацизумаб. Отобранные демографические и базовые характеристики, сходные с описанными в примере 1, были приемлемым образом сбалансированы между группами лечения. Низкий уровень сывороточного альбумина (≤3,5 г/дл) в начале испытания встречался реже в группе бевацизумаба по сравнению с группой плацебо.
Лечение
Медиана продолжительности лечения составляла 23 недели в группе 5-FU/LV/плацебо и 31 неделю в группе 5-FU/LV/бевацизумаб, а интенсивность дозы 5-FU (процент действительно полученных от запланированных доз 5-FU) в двух группах была сходной (92% против 84%) в ходе курса лечения. Что касается данных на момент крайнего срока, то 1 больной из группы 5-FU/LV/плацебо и 7 из группы 5-FU/LV/бевацизумаб оставались на исходно предписанной терапии. Последующая терапия, которая могла повлиять на выживание, применялась у приблизительно 50% больных в обеих группах, хотя лечению активными агентами иринотеканом и оксалиплатином подвергалось большее количество больных в группе 5-FU/LV/плацебо.
Эффективность
Общее выживание, первичный конечный результат, было большим в группе 5-FU/LV/бевацизумаб (медиана 16,6 месяцев), чем в группе 5-FU/LV/плацебо (медиана 12,9 месяцев) с тенденцией к значимой разнице. Отношение риска смерти было определено равным 0,79 (95% CI, от 0,56 до 1,10; P=0,16; таблица 5 и фиг. 4). Добавление бевацизумаба к 5-FU/LV было связано с увеличением медианы выживания без прогрессии (9,2 и 5,5 месяцев; отношение риска=0,50; 95% CI, от 0,34 до 0,73; P=0,0002, таблица 5 и фиг. 4), показателя ответной реакции (26,0% против 15,2%, P=0,055) и медианы продолжительности ответа (9,2 месяцев и 6,8 месяцев; отношение риска=0,42; 95% CI от 0,15 до 1,17; P=0,088). Дополнительный анализ влияния лечения на общее выживание по базовым характеристикам показал, что больные с низким начальным сывороточным альбумином (≤3,5 г/дл), по-видимому, получают значительный выигрыш в выживании (отношение риска=0,46; 95% CI, от 0,29 до 0,74; P=0,001).
плацебо (N=105)
бевацизумаб (N=104)
Лечение бевацизумабом не оказывало отрицательного воздействия на качество жизни, и результаты TDQ позволяют предполагать положительное благоприятное действие. Медиана TDQ, измеренная по показателю CCS, равнялась 3,0 месяцам в группе 5-FU/LV/плацебо и 3,1 месяцам в группе 5-FU/LV/бевацизумаб (отношение риска=0,79, P=0,188). Медиана TDQ, измеренная для больных, лечившихся плацебо и бевацизумабом, измеренная по вторичным показателям TDQ, равнялась 2,3 и 3,2 месяцам (TOI-C; отношение риска=0,71, P=0,048) и 2,6 и 3,6 месяцам (общий FACT-C; отношение риска=0,66, P=0,016).
Безопасность
Популяция по безопасности включала в общей сложности 204 больных (104 FU/LV/плацебо и 100 5-FU/LV/бевацизумаб), которые получали, по меньшей мере, одну дозу исследуемого лекарства. У больных, получавших бевацизумаб, наблюдалось 16% повышение (71% против 87%) общей токсичности 3 и 4 степени. Неблагоприятные эффекты, ведущие к смерти или прекращению исследования, были сходными в двух группах, как и неблагоприятные эффекты, которые, как известно, связаны с 5-FU/LV (в особенности диарея и лейкопения). У двух больных, оба в группе 5-FU/LV/бевацизумаб, произошло прободение кишечника. Данные события имели место на 110 и 338 дни лечения и оба, как было определено при хирургическом обследовании, были связаны с дивертикулом ободочной кишки. Один больной умер в результате данного осложнения. В предшествующих клинических испытаниях в качестве возможной связанной с бевацизумабом токсичности предполагались геморрагия, тромбоэмболия, протеинурия и гипертензия; однако в данном исследовании не наблюдалось увеличения венозного тромбоза, кровотечения ≥3 степени или клинически значимой (≥3 степени) протеинурии. Случаи артериального тромбоза (инфаркт миокарда, удар или случай тромбоза периферической артерии) имели место у 10 больных в группе 5-FU/LV/бевацизумаб по сравнению с 5 больными в группе 5-FU/LV/плацебо.
Группа 5-FU/LV/плацебо имела более высокую 60-дневную смертность по всем причинам по сравнению с группой 5-FU/LV/бевацизумаб (13,5% против 5,0%). Смерть из-за прогрессии заболевания в первые 60 дней была сходной (5,8% против 4,0%) в двух группах. В группе 5-FU/LV/плацебо причины смерти в первые 60 дней, не обусловленной прогрессией заболевания, относили к следующим: сердечной недостаточности (1), сепсису (3), диарее (2), респираторной недостаточности (1) и легочной эмболии (1). В группе 5-FU/LV/бевацизумаб единственная ранняя смерть, не обусловленная прогрессией заболевания, была связана с инфарктом миокарда.
Результаты данного клинического испытания дополнительно демонстрируют, что бевацизумаб, приближенное к человеческому моноклональное антитело против VEGF, обеспечивает важное клиническое преимущество при добавлении к первоочередной химиотерапии для лечения метастатического колоректального рака. По сравнению с одним 5-FU/LV добавление бевацизумаба увеличивает медиану выживания на 3,7 месяцев, выживание без прогрессии на 3,7 месяцев и продолжительность ответа на 2,4 месяцев и повышает показатель ответной реакции на 11%.
Данные результаты следует рассматривать в контексте исследуемой популяции. Специально отобранные больные были плохими кандидатами на первоочередную содержащую иринотекан терапию либо из-за низкой вероятности пользы, либо из-за высокой вероятности, связанной с лечением токсичности. Тщательный анализ базовых испытаний иринотекана показал, что клиническая выгода от данного агента ограничена больными с нормальным статусом состояния ECOG (PS=0).21, 22. Пожилой возраст, предшествующая рентгенотерапия таза, ухудшенный статус состояния и низкий сывороточный альбумин - все они, как сообщалось, повышают связанную с иринотеканом токсичность. 23-27 больных с данными характеристиками нуждаются в альтернативных терапевтических подходах. Ретроспективный подгрупповой анализ из меньшего рандомизированного испытания фазы II был проведен ранее с оценкой бевацизумаба и 5-FU/LV в CRC, и было отмечено, что бевацизумаб обеспечивает значительный лечебный эффект в подгруппе больных с базовым PS 1 или 2 (медиана выживания 6,3 месяцев и 15,2 месяцев), в подгруппе с возрастом ≥65 лет (11, 2 месяцев и 17,7 месяцев) и в подгруппе с сывороточным альбумином ≤ 3,5 (8,1 месяцев и 14,1 месяцев). Данные результаты вдохновили заявителей на разработку настоящего испытания, конкретно включающего популяцию исследования с плохим прогнозом и усиливающего испытание для определения эффекта широкого лечения на выживание. Заявители в значительной мере преуспели в охвате популяции, отличной от той, на которой одновременно проводилось основное испытание IFL/плацебо по сравнению с IFL/бевацизумаб. По сравнению с основным испытанием больные в настоящем испытании имели большую медиану возраста (72 против 61 года) и значительно большее количество больных имело статус состояния >0 (72% против 43%) и альбумин ≤3,5 мг/дл (46% против 33%).
Несмотря на высокий риск исследуемой популяции режим 5-FU/LV/бевацизумаб, по-видимому, хорошо переносится. Хорошо описанный связанный с бевацизумабом неблагоприятный эффект в виде гипертензии 3 степени наблюдался у 16% больных в группе 5-FU/LV/бевацизумаб против 3% в группе 5-FU/LV/плацебо. Случаев гипертензии 4 степени не было. Протеинурия любой степени наблюдалась в 38% случаев в группе 5-FU/LV/бевацизумаб против 19% в группе 5-FU/LV/плацебо; однако лишь у одного больного в группе бевацизумаба развилась протеинурия 3 степени, и не было случаев протеинурии 4 степени. У больных, лечившихся бевацизумабом, не наблюдалось повышения кровотечения 3 или 4 степени или случаев венозного тромбоза. Имелось расхождение в количестве случаев артериального тромбоза: 10% в группе 5-FU/LV/бевацизумаб по сравнению с 4,8% в группе 5-FU/LV/плацебо. Сходное расхождение наблюдалось в базовом испытании бевацизумаба (1% в группе IFL/плацебо и 3,3% в группе IFL/бевацизумаб). Возможно, более пожилой возраст популяции, включенной в настоящее исследование, внес вклад в более высокую частоту данного неблагоприятного действия, однако расхождение в обоих исследованиях заслуживает внимания. Для последующего определения частоты и потенциальных факторов риска для данных и других необычных неблагоприятных эффектов, связанных с терапией бевацизумабом, могут потребоваться широкие испытания по наблюдению за безопасностью.
В заключение, данные результаты показывают, что бевацизумаб при сочетании с болюсом 5-FU/LV обеспечивает существенный клинический выигрыш для больных с ранее не лечившимся метастатическим колоректальным раком, которые, как полагают, являются плохими кандидатами для содержащей иринотекан терапии. Вместе с результатами базового испытания данные результаты усиливают доказательную базу того, что основанную на бевацизумабе, содержащую 5-FU/LV терапию следует рассматривать в качестве стандартного варианта для первоначального лечения метастатического колоректального рака.
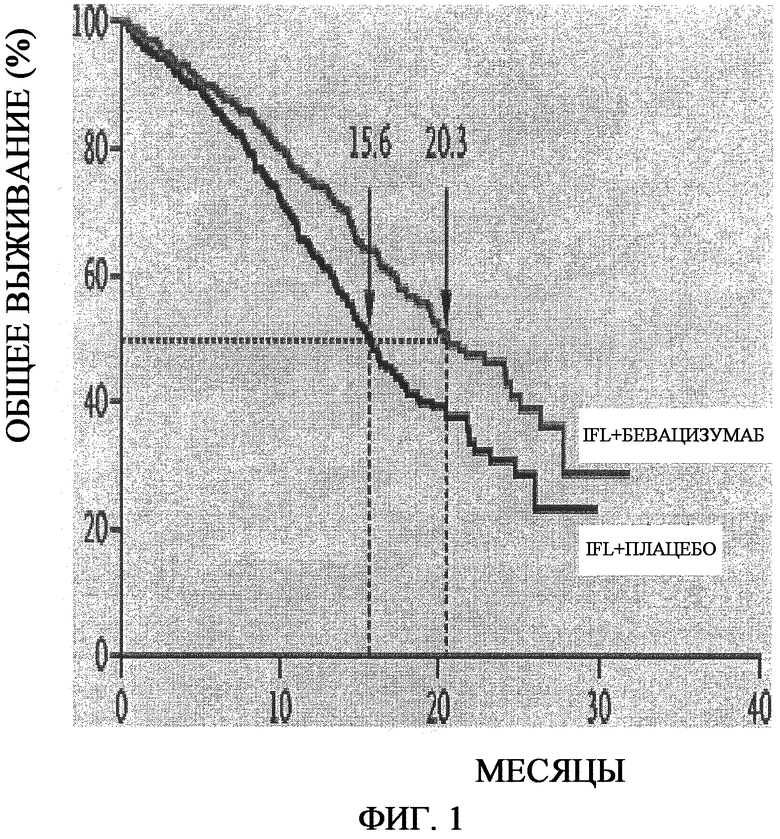
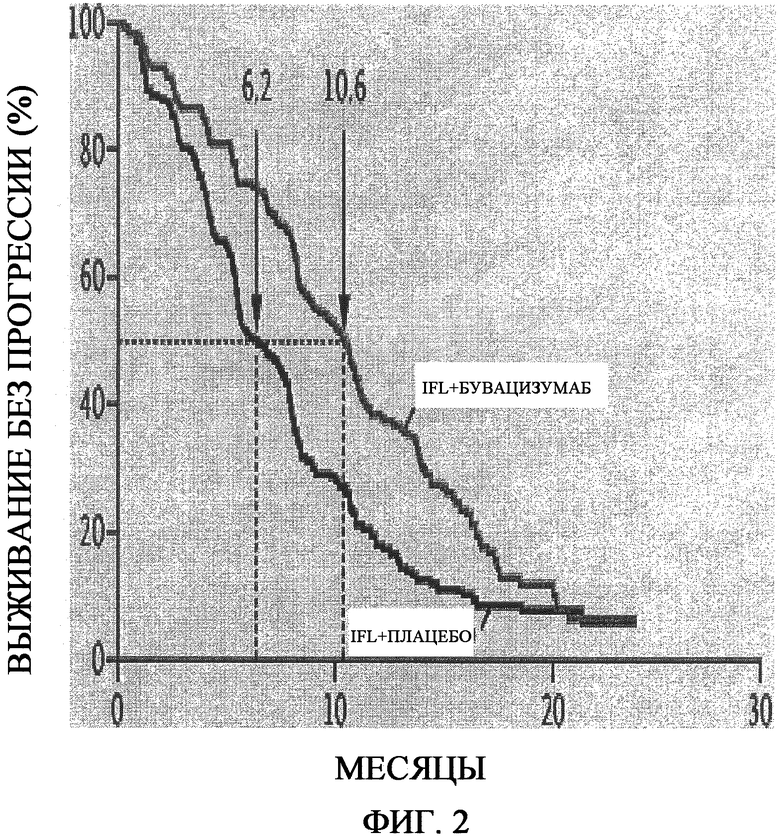

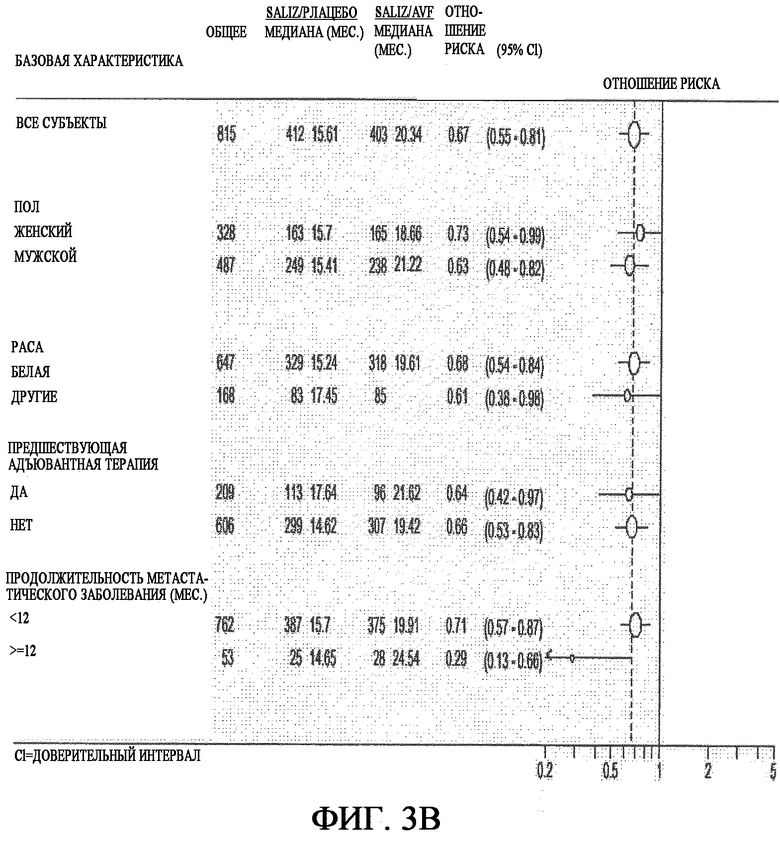
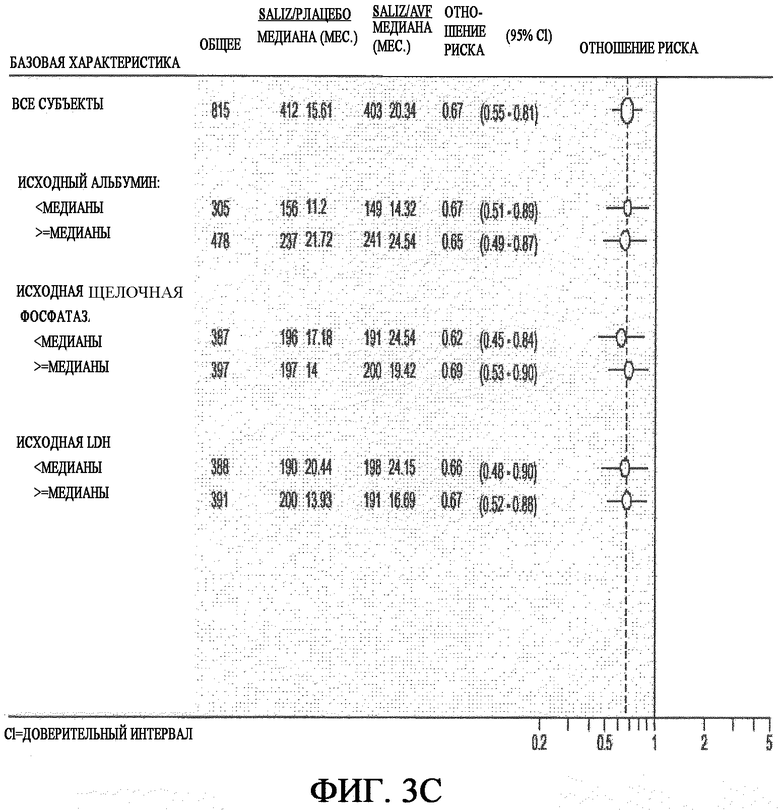
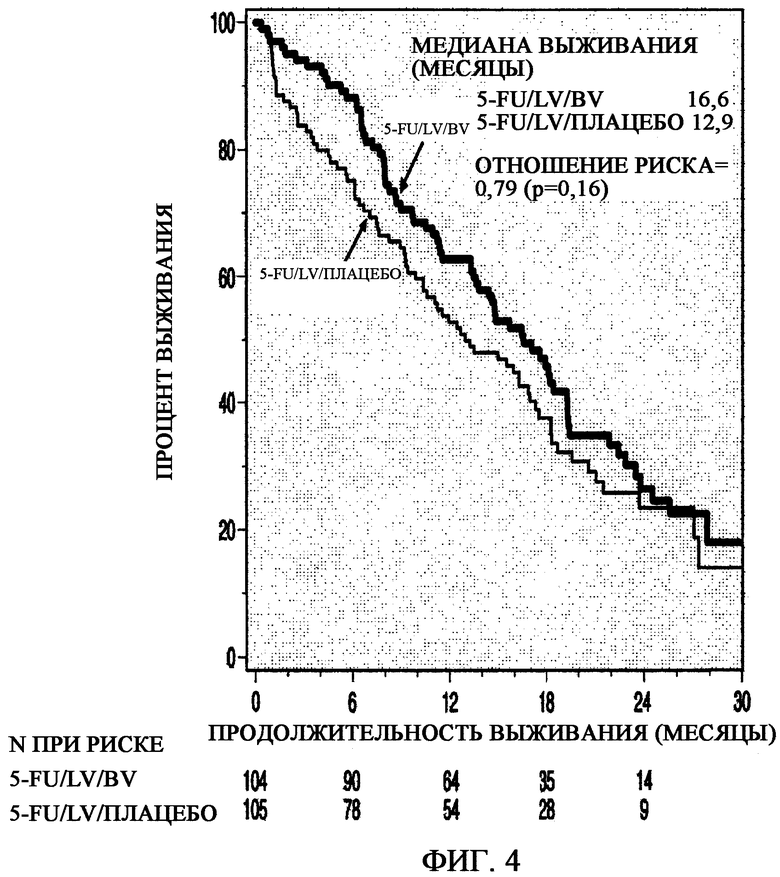
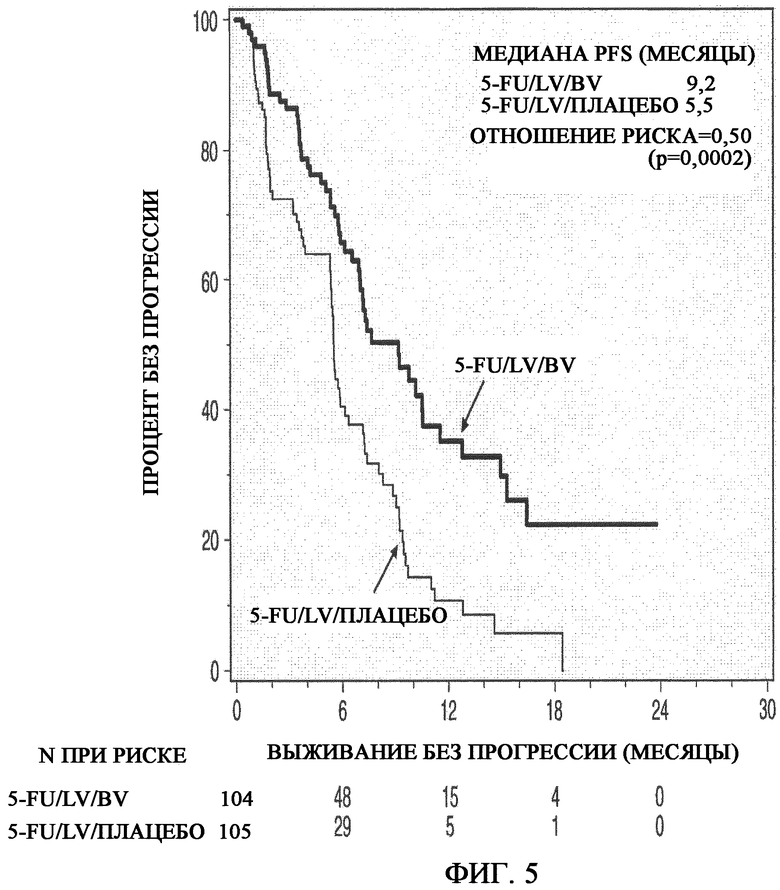
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения рака у пациента человека. Для этого пациенту вводят эффективное количество антитела против VEGF (бевацизумаб). И при этом отслеживают пациента на желудочно-кишечное прободение. Также предложены промышленный продукт и набор для лечения рака у пациента человека. Группа изобретений обеспечивает расширение арсенала противоопухолевых лекарственных средств. 4 н. и 28 з.п. ф-лы, 5 табл., 7 ил., 2 пр.
1. Способ лечения рака у пациента человека, включающий введение пациенту эффективного количества антитела против VEGF и отслеживание пациента на желудочно-кишечное прободение.
2. Способ по п.1, дополнительно включающий введение пациенту антинеопластического агента, где указанный антинеопластический агент включает, по меньшей мере, один химиотерапевтический агент,
3. Способ по любому из пп.1 или 2, где рак выбран из группы, состоящей из рака молочной железы, колоректального рака, ректального рака, немелкоклеточного рака легких, не-ходжкинской лимфомы (NHL), почечно-клеточного рака, рака простаты, рака печени, рака поджелудочной железы, саркомы мягких тканей, саркомы Капоши, карциноидной опухоли, рака головы и шеи, меланомы, рака яичников, мезотелиомы, множественной миеломы и глиобластомы.
4. Способ по любому из пп.1 или 2, где рак является метастатическим.
5. Способ по любому из пп.1 или 2, где больной ранее не подвергался лечению.
6. Способ по п.2, где химиотерапевтический агент выбран из группы, состоящей из алкилирующих агентов, антиметаболитов, аналогов фолиевой кислоты, аналогов пиримидина, аналогов пурина и относящихся к этому ингибиторов, алкалоидов барвинка, токсинов эпиподофилла, антибиотиков, L-аспарагиназы, ингибитора топоизомеразы, интерферонов, координационных комплексов платины, замещенной антрацендионом мочевины, производных метилгидразина, супрессанта коры надпочечников, адренокортикостероидов, прогестинов, эстрогенов, антиэстрогена, андрогенов, антиандрогена и аналога гонадотропин-рилизинг гормона.
7. Способ по п.6, где химиотерапевтический агент выбран из группы, состоящей из 5-фторурацила (5-FU), лейковорина, иринотекана, оксалиплатина, капецитабина, паклитаксела и доксетаксела.
8. Способ по п.2, где антинеопластический агент включает сочетание, по меньшей мере, двух химиотерапевтических агентов.
9. Способ по п.8, где антинеопластический агент включает 5-FU и лейковорин.
10. Способ по п.8, где антинеопластический агент включает 5-FU, лейковорин и иринотекан.
11. Способ по п.1, где после завершения лечения антителом против VEGF больной дополнительно получает химиотерапевтическое лечение, по меньшей мере, одним химиотерапевтическим агентом.
12. Способ по п.11, где химиотерапевтический агент, применяемый для дополнительного химиотерапевтического лечения, выбран из группы, состоящей из 5-FU, лейковорина, иринотекана, оксалиплатина, капецитабина, паклитаксела и доксетаксела.
13. Способ по п.12, где химиотерапевтический агент представляет собой оксалиплатин.
14. Способ по любому из пп.1 или 2, где указанное антитело против VEGF связывает тот же эпитоп, что и моноклональное антитело А4.6.1 против VEGF, продуцируемое гибридомой АТСС НВ 10709.
15. Способ по любому из пп.1 или 2, где антитело против VEGF представляет собой антитело человека.
16. Способ по любому из пп.1 или 2, где антитело против VEGF представляет собой гуманизированное антитело.
17. Способ по п.16, где антитело против VEGF представляет собой гуманизированное антитело А4.6.1 или его фрагмент.
18. Способ по любому из пп.1 или 2, где антитело против VEGF вводят внутривенной инфузией.
19. Способ по любому из пп.1 или 2, где антитело против VEGF вводят пациенту в дозе приблизительно 5 мг/кг каждые 2-3 недели.
20. Способ лечения пациента человека с диагнозом колоректальный рак, включающий введение пациенту эффективного количества антитела против VEGF и отслеживание пациента на желудочно-кишечное прободение.
21. Способ по п.20, где колоректальный рак является метастатическим.
22. Способ по п.20, где указанное антитело против VEGF связывает тот же эпитоп, что и моноклональное антитело А4.6.1 против VEGF, продуцируемое гибридомой АТСС НВ 10709.
23. Способ п.20, где антитело против VEGF представляет собой антитело человека.
24. Способ п.20, где антитело против VEGF представляет собой гуманизированное антитело.
25. Способ по п.24, где антитело против VEGF представляет собой гуманизированное антитело А4.6.1 или его фрагмент.
26. Способ п.20, где антитело против VEGF вводят внутривенной инфузией.
27. Способ п.20, где антитело против VEGF вводят пациенту в дозе приблизительно 5 мг/кг каждые 2-3 недели.
28. Способ по п.20, дополнительно включающий введение пациенту одного или более химиотерапевтических агентов.
29. Способ по п.28, где химиотерапевтический агент выбран из группы, состоящей из алкилирующих агентов, антиметаболитов, аналогов фолиевой кислоты, аналогов пиримидина, аналогов пурина и относящихся к этому ингибиторов, алкалоидов барвинка, токсинов эпиподофилла, антибиотиков, L-аспарагиназы, ингибитора топоизомеразы, интерферонов, координационных комплексов платины, замещенной антрацендионом мочевины, производных метилгидразина, супрессанта коры надпочечников, адренокортикостероидов, прогестинов, эстрогенов, антиэстрогена, андрогенов, антиандрогена и аналога гонадотропин-рилизинг гормона.
30. Способ по п.29, где химиотерапевтический агент выбран из группы, состоящей из 5-фторурацила, лейковорина, иринотекана, оксалиплатина, капецитабина, паклитаксела и доксетаксела.
31. Промышленный продукт для лечения рака, включающий
1) контейнер,
2) композицию в контейнере, включающую антитело против VEGF, и
3) вкладыш-инструкцию по использованию композиции для введения пациенту больному раком композиции антитела против VEGF и предупреждающей использующего композицию о риске желудочно-кишечного прободения.
32. Набор для лечения рака у пациента человека, включающий
1) упаковку, включающую композицию антитела против VEGF, и
2) инструкции по использованию композиции антитела против VEGF и предупреждающие использующего композицию о риске желудочно-кишечного прободения.
| US 6416758 B1, 09.07.2002 | |||
| СПОСОБ ЛЕЧЕНИЯ ИНФИЛЬТРАТИВНО-ОТЕЧНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2001 |
|
RU2177349C1 |
| Helen X | |||
| Chen et al | |||
| Current Clinical Trials of the Anti-VEGF Monoclonal Antibody Bevacizumab// Clinical Trials Referral Resource, ONCOLOGY | |||
| Vol | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Kindler HL et al | |||
| Metastatic | |||
Авторы
Даты
2014-06-20—Публикация
2004-05-28—Подача