ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка имеет преимущества и приоритет заявки на патент Китая CN 201910104953.5, поданной в Государственное ведомство интеллектуальной собственности Китая 1 февраля 2019 года, описание которой включено в данное описание посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к области медицины и, в частности, к кристаллу диарилтиогидантоинового соединения, способу его получения и его применению в получении лекарственных средств для лечения андроген-опосредованных заболеваний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Андрогеновый рецептор (AR) является стероидным рецептором в суперсемействе ядерных рецепторов. При связывании с андрогенами (такими как тестостерон и дигидротестостерон) AR высвобождается из комплекса, образованного белками теплового шока, для реакции фосфорилирования с образованием димера. Димер переносится в ядро и связывается с ассоциированным с ним фрагментом ДНК, тем самым стимулируя транскрипцию его гена-мишени. Транскрипционная активность андрогеновых рецепторов, активируемых посредством связывания с лигандом, координируется белками-коактиваторами. Антагонисты AR выполняют основную функцию лечения рака предстательной железы, напрямую предотвращая связывание тестостерона или дигидротестостерона с андрогеновыми рецепторами и, таким образом, блокируя действие андрогенов на клетки, играя роль препятствия действию андрогенов и ингибируя рост клеток, что в конечном итоге приводит к апоптозу. В продаже появился энзалутамид, антагонист андрогеновых рецепторов, разработанный Medivation & Astell as.
Ввиду важной роли антагонистов андрогеновых рецепторов особенно важно разработать антагонисты андрогеновых рецепторов, подходящие для использования в качестве терапевтических лекарственных средств.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
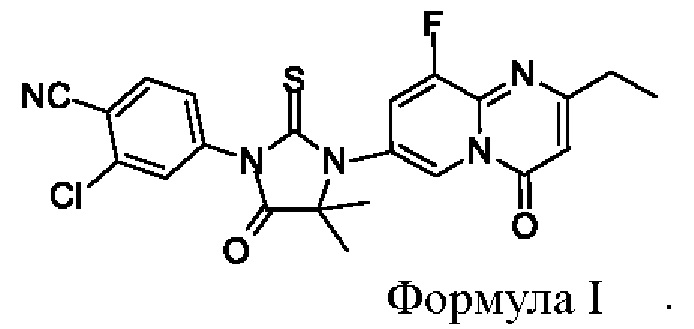
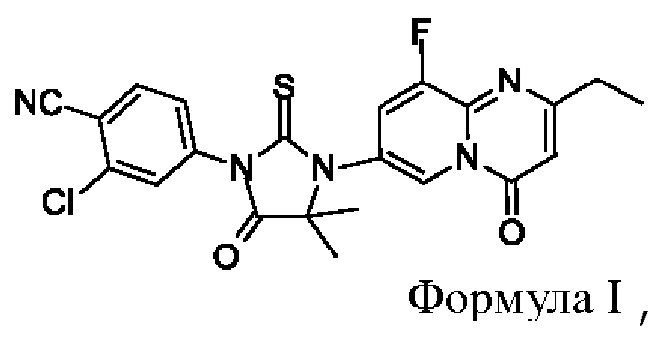
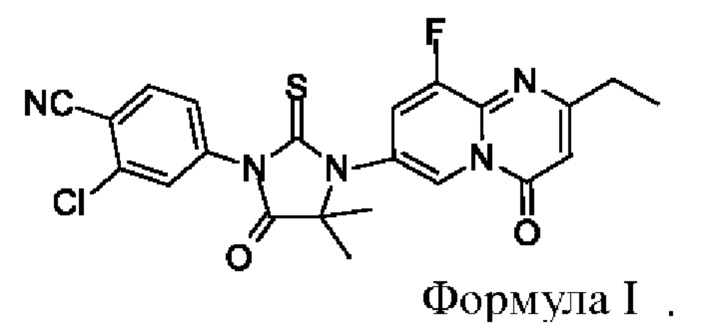
Согласно настоящей заявке, предложен кристалл диарилтиогидантоинового соединения, 2-хлор-4-(3-(2-этил-9-фтор-4-оксо-4Н-пиридо[1,2-а]пиримидин-7-ил)-4,4-диметил-5-оксо-2-тиоимидазолидин-1-ил)бензонитрила, (соединения формулы I) для применения в качестве антагониста андрогеновых рецепторов, который является превосходным с точки зрения по меньшей мере одного из следующих показателей: биологическая активность, безопасность, фармакокинетика, биодоступность, гигроскопичность, стабильность, растворимость, чистота, легкость получения и тому подобное, и, таким образом, отвечает требованиям получения, хранения, приготовления и тому подобного для лекарственных средств.
В одном аспекте, согласно настоящей заявке, предложен кристалл соединения формулы I
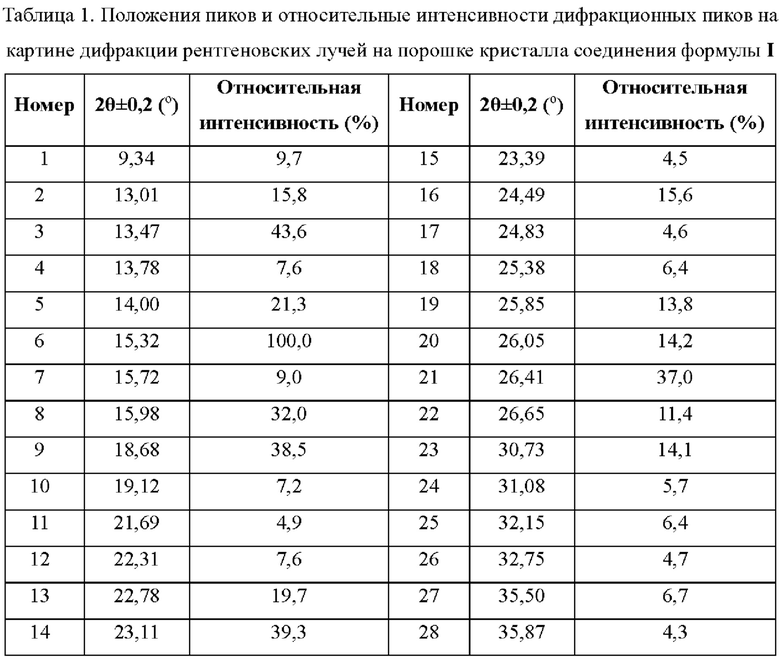
В другом аспекте, согласно настоящей заявке, предложен кристалл соединения формулы I, у которого на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 13,47°±0,2°, 15,32°±0,2°, 15,98°±0,2°, 18,68°±0,2°, 23,11°±0,2° и 26,41°±0,2°.
В некоторых воплощениях настоящей заявки предложен кристалл соединения формулы I, раскрытого здесь, у которого на картине дифракции рентгеновских лучей на порошке при использовании С Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 13,01°±9,2°, 13,47°±9,2°, 14,09°±9,2°, 15,32°±9,2°, 15,98°±0,2°, 18,68°±0,2°, 22,78°±0,2°, 23,11°±0,2°, 24,49°±0,2° и 26,41°±0,2°; в некоторых воплощениях настоящей заявки предложен кристалл соединения формулы I, раскрытого здесь, у которого на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 9,34°±0,2°, 13,01°±0,2°, 13,47°±0,2°, 14,00°±0,2°, 15,32°±0,2°, 15,98°±0,2°, 18,68°±0,2°, 22,78°±0,2°, 23,11°±0,2°, 24,49°±0,2°, 25,85°±0,2°, 26,41° ±0,2° и 30,73°±0,2°; в некоторых воплощениях настоящей заявки предложен кристалл соединения формулы I, раскрытого здесь, у которого на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 9,34°±0,2°, 13,01°±0,2 °, 13,47°±0,2°, 13,78°±0,2°, 14,00°±0,2°, 15,32°±0,2°, 15,72°±0,2°, 15,98°±0,2°, 18,68°±0,2°, 22,31°±0,2°, 22,78°±0,2°, 23,11°±0,2°, 24,49°±0,2°, 25,85°±0,2°, 26,05°±0,2°, 26,41°±0,2°, 26,65°±0,2° и 30,73°±0,2°; в некоторых воплощениях настоящей заявки предложен кристалл соединения формулы I, раскрытого здесь, у которого на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 9,34°±0,2°, 13,01°±0,2°, 13,47°±0,2°, 13,78°±0,2°, 14,00°±0,2°, 15,32°±0,2°, 15,72°±0,2°, 15,98°±0,2°, 18,68°±0,2°, 19,12°±0,2°, 21,69°±0,2°, 22,31°±0,2°, 22,78°±0,2°, 23,11°±0,2°, 23,39°±0,2°, 24,49°±0,2°, 24,83°±0,2°, 25,38°±0,2°, 25,85°±0,2°, 26,05°±0,2°, 26,41°±0,2°, 26,65°±0,2°, 30,73°±0,2°, 31,08°±0,2°, 32,15°±0,2°, 32,75°±0,2°, 35,50°±0,2° и 35,87°±0,2°.
В некоторых воплощениях настоящей заявки на картине дифракции рентгеновских лучей на порошке кристалла соединения формулы I, раскрытого в данном описании, при использовании Cu Kα излучения положения пиков и относительные интенсивности дифракционных пиков показаны в таблице 1 ниже:
В некоторых воплощениях настоящей заявки картина дифракции рентгеновских лучей на порошке (ДРЛП) кристалла соединения формулы I, раскрытого в данном описании, показана на Фиг. 1.
В некоторых воплощениях настоящей заявки кристалл соединения формулы I, раскрытого в данном описании, имеют пик поглощения при 238,92°С согласно его анализу посредством метода дифференциальной сканирующей калориметрии (ДСК).
В некоторых воплощениях настоящей заявки термограмма дифференциальной сканирующей калориметрии (ДСК) кристалла соединения формулы I, раскрытого в данном описании, показана на Фиг. 2.
В некоторых воплощениях настоящей заявки термограмма термогравиметрического анализа (ТГА) кристалла соединения формулы I, раскрытого в данном описании, показана на Фиг. 3.
В другом аспекте согласно настоящей заявке предложен способ получения кристалла соединения формулы I, включающий смешивание соединения формулы I с растворителем для осаждения кристалла.
В некоторых воплощениях настоящей заявки в способе получения кристалла соединения формулы I, описанном выше, время смешивания составляет не менее 48 часов.
В некоторых воплощениях настоящей заявки в способе получения кристалла соединения формулы I, описанном выше, смешивание проводят посредством встряхивания или перемешивания. В некоторых воплощениях настоящей заявки смешивание проводят посредством перемешивания.
В некоторых воплощениях настоящей заявки способ получения кристалла соединения формулы I, описанный выше, включает добавление соединения формулы I к растворителю для получения суспензии и затем перемешивание суспензии для осаждения кристалла.
В некоторых воплощениях настоящей заявки в способе получения кристалла соединения формулы I, описанном выше, растворитель выбран из группы, состоящей из метанола, этанола, этилацетата, тетрагидрофурана, ацетонитрила, ацетона, смеси метанола и воды, смеси этанола и воды и смеси ацетона и воды.
В некоторых воплощениях настоящей заявки в способе получения кристалла соединения формулы I, описанном выше, растворитель выбран из метанола.
В некоторых воплощениях настоящей заявки требуемый объем растворителя составляет 5-50 мл на 1 г соединения формулы I.
В некоторых воплощениях настоящей заявки требуемый объем растворителя составляет 40 мл на 1 г соединения формулы I.
В некоторых воплощениях настоящей заявки способ получения кристалла соединения формулы I, описанный выше, осуществляют в условиях нагревания, например, при температуре нагревания 35-70°С; в некоторых воплощениях настоящей заявки температура нагревания составляет 40-60°С; в некоторых воплощениях настоящей заявки температура нагревания составляет 40°С.
В некоторых воплощениях настоящей заявки в способе получения кристалла соединения формулы I стадию смешивания проводят в отсутствие света.
В некоторых воплощениях настоящей заявки способ получения кристалла соединения формулы I дополнительно включает выделение осажденного кристалла, например выделение посредством фильтрации или центрифугирования; в некоторых конкретных воплощениях настоящей заявки способ дополнительно включает сушку выделенного кристалла.
В другом аспекте согласно настоящей заявке предложена кристаллическая композиция, содержащая не менее 50% (мас.), предпочтительно не менее 80% (мас.), более предпочтительно не менее 90% (мас.), наиболее предпочтительно не менее 95% (мас.) кристалла соединения формулы I.
В другом аспекте согласно настоящей заявке предложена фармацевтическая композиция, содержащая терапевтически эффективное количество кристалла соединения формулы I или его кристаллической композиции. В некоторых воплощениях раскрытая в данном описании фармацевтическая композиция дополнительно содержит фармацевтически приемлемый эксципиент.
В еще одном аспекте согласно настоящей заявке предложен способ лечения андроген-опосредованных заболеваний у млекопитающих, включающий введение млекопитающему, предпочтительно человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристалла соединения формулы I, или его кристаллической композиции, или его фармацевтической композиции, где заболевания включают клеточное пролиферативное заболевание (например рак), но не ограничиваются им.
В еще одном аспекте согласно настоящей заявке предложено применение кристалла соединения формулы I, или его кристаллической композиции, или его фармацевтической композиции в получении лекарственных средств для лечения андроген-опосредованных заболеваний, где заболевания включают клеточное пролиферативное заболевание (например рак), но не ограничиваются им.
В еще одном аспекте согласно настоящей заявке предложено применение кристалла соединения формулы I, или его кристаллической композиции, или его фармацевтической композиции в лечении андроген-опосредованных заболеваний, где заболевания включают клеточное пролиферативное заболевание (например рак), но не ограничиваются им.
В еще одном аспекте согласно настоящей заявке предложен кристалл соединения формулы I, или его кристаллическая композиция, или его фармацевтическая композиция для лечения андроген-опосредованных заболеваний, где заболевания включают клеточное пролиферативное заболевание (например рак), но не ограничиваются им.
В некоторых воплощениях настоящей заявки заболевание представляет собой рак предстательной железы.
В настоящей заявке прибор для спектрометрии дифракции рентгеновских лучей на порошке представляет собой рентгеновский дифрактометр D8 Advance фирмы Bruker (рентгеновская трубка: Cu, K-альфа, 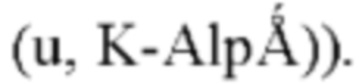
В настоящей заявке спектр ДСК определяют при следующих условиях: прибор: дифференциальный сканирующий калориметр Q2000 фирмы ТА; температурный диапазон: 30-300°С; скорость нагрева: 10°С/мин при 50 мл/мин N2.
В настоящей заявке термогравиметрический анализ ТГА проводят при следующих условиях: прибор: термогравиметрический анализатор Q5000IR фирмы ТА; температурный диапазон: от комнатной температуры до 300°С или потеря при высыхании 20%; скорость нагрева: 10°С/мин при 50 мл/мин N2.
Для любой данной кристаллической формы относительные интенсивности дифракционных пиков могут изменяться из-за предпочтительной ориентации, обусловленной, например морфологией кристалла, что хорошо известно в области кристаллографии. Интенсивность пика изменяется в месте, где присутствует предпочтительный эффект ориентации, тогда как положение дифракционного пика кристаллической формы невозможно изменить. Кроме того, могут быть небольшие ошибки в положениях пиков для любой данной кристаллической формы, что также хорошо известно в области кристаллографии. Например, положения пиков могут сдвигаться из-за изменений температуры, движения образца или калибровки прибора при анализе образца, и погрешность измерения 29 иногда составляет приблизительно ±0,2 градуса, и поэтому специалистам в данной области техники хорошо известно, что эту ошибку следует принимать во внимание при определении каждой кристаллической структуры.
Температуру перехода определяют посредством ДСК, когда кристалл поглощает или выделяет тепло из-за изменения кристаллической структуры или плавления кристалла. Для одних и тех же кристаллических форм одного и того же соединения погрешности в температурах теплового перехода и температурах плавления в последовательных анализах обычно находятся в пределах приблизительно 5°С, и данный пик ДСК или температура плавления соединения, когда упоминается, означает пик ДСК или температуру плавления ±5°С.ДСК обеспечивает вспомогательный способ идентификации различных кристаллических форм. Различную морфологию кристалла можно идентифицировать по разным температурам перехода. Следует отметить, что для смеси ее пик ДСК или температура плавления могут изменяться в большем диапазоне. Кроме того, температура плавления связана со скоростью нагрева из-за разложения вещества в процессе плавления.
Термин "фармацевтически приемлемый" использован в данном описании в отношении соединений, веществ, композиций и/или лекарственных форм, которые в рамках здравого медицинского суждения являются подходящими для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергических реакций или других проблем или осложнений, и соизмеримы с разумным соотношением польза/риск.
Термин "фармацевтически приемлемая соль", в качестве фармацевтически иприемлемой соли могут быть упомянуты соль металла, соль аммония, соль, образованная с органическим основанием, соль, образованная с неорганической кислотой, соль, образованная с органической кислотой, соль, образованная с основной или кислой аминокислотой, или тому подобные.
"Фармацевтически приемлемый эксципиент" относится к инертному веществу, вводимому с активным ингредиентом для облегчения введения активного ингредиента, включая, без ограничения, любой скользящий агент, подсластитель, разбавитель, консервант, краситель/красящее вещество, усилитель вкуса и аромата, поверхностно-активное вещество, смачивающее вещество, диспергирующее вещество, разрыхлитель, суспендирующий агент, стабилизатор, изотонический агент, растворитель или эмульгатор, приемлемые для применения у людей или животных (например домашних животных), как разрешено Национальным управлением по изделиям медицинского назначения. Неограничивающие примеры эксципиентов включают карбонат кальция, фосфат кальция, различные сахара и виды крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Термин "фармацевтическая композиция" относится к смеси, состоящей из одного или более чем одного соединения или его фармацевтически приемлемой соли, раскрытых в данном описании, и фармацевтически приемлемого эксципиента. Фармацевтическая композиция предназначена для облегчения введения соединения в живой организм.
Фармацевтическая композиция, раскрытая в данном описании, может быть получена посредством объединения соединения, раскрытого в данном описании, с подходящим фармацевтически приемлемым эксципиентом и может быть приготовлена в виде, например твердых, полутвердых, жидких или газообразных препаратов, таких как таблетка, пилюля, капсула, порошок, гранула, мазь, эмульсия, суспензия, суппозиторий, инъекция, средство для ингаляции, гель, микросфера и аэрозоль.
Типичные пути введения кристаллической формы или ее фармацевтической композиции, описанных в данном описании, включают пероральное, ректальное, местное, ингаляционное, парентеральное, сублингвальное, интравагинальное, интраназальное, внутриглазное, интраперитонеальное, внутримышечное, подкожное и внутривенное введение, но не ограничиваются ими.
Фармацевтическая композиция, раскрытая в данном описании, может быть приготовлена посредством общеизвестных в данной области техники способов, таких как традиционное смешивание, растворение, гранулирование, дражирование, растирание в порошок, эмульгирование и лиофилизация.
В некоторых воплощениях фармацевтическая композиция находится в форме для перорального введения. Для перорального введения фармацевтическая композиция может быть приготовлена посредством смешивания активных соединений с фармацевтически приемлемыми эксципиентами, хорошо известными в данной области техники. Эти эксципиенты дают возможность приготовить соединения, раскрытые в данном описании, в виде таблеток, пилюль, пастилок, драже, капсул, жидкостей, гелей, взвесей, суспензий и тому подобного для перорального введения пациенту.
Терапевтические дозы соединения, раскрытого в данном описании, могут быть определены в соответствии, например, с конкретно применяемым лечением, способом введения соединения, здоровьем и состоянием пациента и заключением лечащего врача. Доля или концентрация соединения, раскрытого в данном описании, в фармацевтической композиции может не являться фиксированной и зависит от множества факторов, включая дозировку, химические свойства (например гидрофобность) и путь введения.
Термин "лечение" означает введение соединения или композиции, описанных в данном описании, для ослабления или устранения заболевания или одного или более чем одного симптома, связанного с заболеванием, и включает:
I) подавление заболевания или болезненного состояния, то есть подавление его развития; и
II) облегчение заболевания или болезненного состояния, то есть осуществление его регрессирования.
Термин "предупреждение" означает введение соединения или композиции, описанного в данном описании, для предупреждения одного или более чем одного симптома, связанного с заболеванием, и включает: предупреждение возникновения заболевания или болезненного состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к болезненному состоянию, но еще не диагностировано, что страдает болезненным состоянием.
Терапевтически эффективное количество кристаллической формы, описанной в данном описании, составляет от приблизительно 0,0001 до 20 мг/кг массы тела/сутки, например от 0,001 до 10 мг/кг массы тела/сутки.
Частоту введения кристаллической формы, описанной в данном описании, определяют в соответствии с потребностями каждого пациента, например один раз в сутки, два раза в сутки или несколько раз в сутки. Введение может быть прерывистым, например, пациент получает суточную дозу кристаллической формы в течение периода в несколько суток, за которым следует период в несколько суток или более, во время которого пациент не получает суточную дозу кристаллической формы.
Термин "терапевтически эффективное количество" относится к количеству соединения, раскрытого в данном описании, для (I) лечения или предупреждения конкретного заболевания, состояния или расстройства, (II) облегчения, ослабления или устранения одного или более чем одного симптома конкретного заболевания, состояния или расстройства или (III) предупреждения или задержки возникновения одного или более чем одного симптома конкретного заболевания, состояния или расстройства, описанных в данном описании. Количество соединения, раскрытого в данном описании, составляющее «терапевтически эффективное количество», изменяется в зависимости от соединения, болезненного состояния и его тяжести, способа введения и возраста млекопитающего, которого лечат, но может быть определено согласно обычной практике специалистами в данной области техники в соответствии с их знаниями и настоящим описанием.
В нижеследующее описание включены некоторые конкретные детали для обеспечения полного понимания различных раскрытых воплощений. Однако специалистам в соответствующей области техники будет понятно, что воплощения могут быть реализованы на практике с помощью других способов, компонентов, материалов и тому подобного, а не с помощью одной или более чем одной конкретной детали.
Если не оговорено особо, слово "содержать" и его варианты, такие как "содержит" или "содержащий", используемые в описании и формуле изобретения, следует понимать в открытом, неисключающем смысле, то есть "включающий, но не ограничивающийся ими".
Фразы "одно воплощение", "воплощение", "в другом воплощении" или "в некоторых воплощениях", используемые в описании, означают, что конкретный ссылочный элемент, структура или характеристика, описанные в рамках воплощения, включены по меньшей мере в одно воплощение. Таким образом, фразы "в одном воплощении", "в воплощении", "в другом воплощении" и "в некоторых воплощениях" в различных местах описания необязательно относятся к одному и тому же воплощению. Кроме того, конкретные элементы, структуры или характеристики могут быть объединены любым подходящим способом в одном или более чем одном воплощении.
Следует понимать, что, если четко не оговорено особо, формы единственного числа, используемые в описании и прилагаемой формуле изобретения, включают множественные ссылки. Таким образом, например, упомянутое взаимодействие, включающее "катализатор", включает один катализатор или два или более катализаторов. Следует понимать, что, если четко не оговорено особо, термин "или" обычно используют в том смысле, в котором он включает "и/или".
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 представлена картина ДРЛП кристалла соединения формулы I, полученного в примере 2;
на Фиг. 2 представлена термограмма ДСК кристалла соединения формулы I, полученного в примере 2;
на Фиг. 3 представлена термограмма ТГА кристалла соединения формулы I, полученного в примере 2; и
на Фиг. 4 представлена картина динамической сорбции паров (ДСП) кристалла соединения формулы I, полученного в примере 2.
ПОДРОБНОЕ ОПИСАНИЕ
Следующие конкретные примеры представлены, чтобы дать возможность специалистам в данной области техники более четко понимать и применять на практике настоящую заявку. Эти конкретные примеры не следует рассматривать как ограничивающие объем настоящей заявки, а следует рассматривать просто как иллюстративное описание и показательные примеры для настоящей заявки. Специалистам в данной области техники следует понимать, что существуют другие пути синтеза соединений по настоящей заявке, и представлены следующие неограничивающие примеры.
Если не оговорено особо, все исходные вещества, использованные в настоящей заявке, имеются в продаже и используются без дополнительной очистки. Все растворители, используемые в настоящей заявке, имеются в продаже и используются без специальной обработки.
Пример 1: получение соединения формулы I
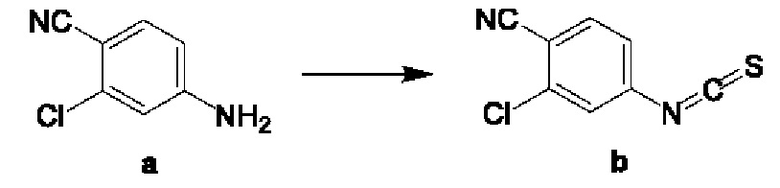
Стадия 1: в одногорлую колбу добавляли воду (10 мл) с последующим добавлением по каплям тиофосгена (1,13 г). Реакционный раствор перемешивали при 25°С в течение 0,5 часа в атмосфере азота, затем добавляли порциями соединение а (1,00 г) и перемешивали при 25°С в течение 2 часов. Реакционный раствор экстрагировали дихлорметаном (10 мл×3), и органическую фазу промывали насыщенным рассолом (15 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали, и остаток очищали посредством колоночной хроматографии с получением соединения b. 1Н ЯМР (ядерный магнитный резонанс) (400 МГц, CDCl3) δ м.д. 7.67 (d, J=8,38 Гц, 1H), 7.37 (d, J=l,98 Гц, 1H) 7.21 (dd, J=8,38, 1,98 Гц, 1H).
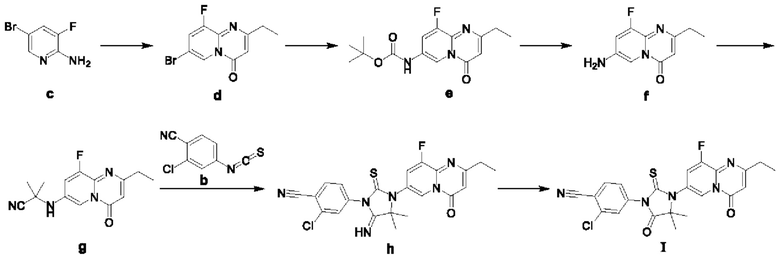
Стадия 2: к раствору соединения с (4,00 г) в уксусной кислоте (40 мл) добавляли метилпропионилацетат (4,00 г). Реакционный раствор нагревали до 110°С и перемешивали в течение 94 часов. В реакционный раствор затем добавляли метилпропионилацетат (8,26 г), перемешивали в течение 16 часов и концентрировали. Концентрат разбавляли этилацетатом (80 мл) и добавляли насыщенный водный раствор бикарбоната натрия (80 мл). После разделения жидкостей органическую фазу промывали насыщенным рассолом (80 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток очищали посредством колоночной хроматографии на силикагеле с получением соединения d. 1Н ЯМР (400 МГц, CDCl3) δ м.д. 8.89 (s, 1H), 7.45 (dd, J=2,0, 8,0 Гц, 1Н), 6.36 (s, 1H), 2.70 (q, J=7,5 Гц, 2Н), 1.25 (t, J=7,5 Гц, 3Н).
Стадия 3: в пробирку для микроволновой печи добавляли соединение d (500 мг), трет-бутилкарбамат (324 мг), карбонат цезия (1,50 г), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (107 мг), бис(дибензилиденацетон)палладий (170 мг) и толуол (6 мл). Пробирку герметизировали, и реакционный раствор подвергали взаимодействию в микроволновой печи при 120°С в течение 30 минут. Реакционный раствор фильтровали и промывали этилацетатом (20 мл), и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле с получением соединения е. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8.90 (s, 1Н), 8.15 (br s, 1Н), 7.57 (br s, 1Н), 6.32 (s, 1Н), 2.71 (q, J=7,5 Гц, 2Н), 1.49 (s, 9Н), 1.26 (t, J=7,5 Гц, 3Н).
Стадия 4: к раствору соединения е (200 мг) в дихлорметане (2 мл) добавляли трифторуксусную кислоту (0,4 мл). Полученный реакционный раствор перемешивали при 26°С в течение 4 часов, добавляли насыщенный водный раствор бикарбоната натрия (значение рН приблизительно 7) и экстрагировали дихлорметаном (20 мл). Органическую фазу промывали насыщенным рассолом (15 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением соединения f. ЖХ-МС (жидкостная хроматография-масс-спектрометрия) (ИЭР (ионизация электрораспылением)) m/z: 208 (М+1).
Стадия 5: в сухую реакционную колбу добавляли соединение f (300 мг), хлорид цинка (59 мг), сульфат натрия (823 мг), ацетон (505 мг), триметилсилилцианид (431 мг) и тетрагидрофуран (3 мл). Реакционный раствор подвергали взаимодействию при 25°С в течение 4 часов в атмосфере азота. Реакционный раствор непосредственно концентрировали, и остаток очищали посредством препаративной ТСХ (тонкослойная хроматография) с получением соединения g. 1Н ЯМР (400 МГц, CDCl3) δ м.д. 8.52 (s, 1Н), 7.33 (dd, J=9,98, 2,32 Гц, 1Н), 6.46 (s, 1Н), 2.78 (q, J=7,65 Гц, 2Н), 1.78 (s, 6Н), 1.33 (t, J=7,59 Гц, 3Н).
Стадия 6: в сухую реакционную колбу добавляли соединение g (200 мг), соединение b (568 мг), толуол (2 мл) и DMF (0,5 мл). В атмосфере азота в реакционный раствор добавляли гидрид натрия (44 мг; чистота 60%) и повергали взаимодействию при 25°С в течение 0,5 часа. Реакционный раствор концентрировали, и остаток очищали посредством колоночной хроматографии с получением соединения h.
Стадия 7: в сухую реакционную колбу добавляли соединение h (110 мг), толуол (1,1 мл) и ледяную уксусную кислоту (1,1 мл). Реакционный раствор подвергали взаимодействию при 110°С в течение 16 часов в атмосфере азота. Реакционный раствор концентрировали, и остаток очищали посредством препаративной ВЭЖХ (высокоэффективная жидкостная хроматография) с получением соединения формулы I в аморфной форме, как определяли посредством дифракции рентгеновских лучей на порошке. 1Н ЯМР (400 МГц, CDCl3) δ м.д. 8.83 (s, 1H), 7.84 (d, J=8,16 Гц, 1H), 7.68 (d, J=l,98 Гц, 1H), 7.51 (dd, J=8,27, 2,09 Гц, 1H), 7.41 (dd, J=8,71, 2,09 Гц, 1H), 6.49 (s, 1H), 2.82 (q, J=7,57 Гц, 2H), 1.68 (s, 6Н), 1.36 (t, J=7,61 Гц, 3Н). ЖХ-МС (ИЭР) m/z: 470 (М+1).
Пример 2: получение кристалла соединения формулы I
В реакционную колбу (4,0 мл) добавляли соединение формулы I (50,1 мг), полученное согласно примеру 1, и метанол (2,0 мл) с получением суспензии. Суспензию помещали на магнитную мешалку с подогревом (40°С) для перемешивания (в отсутствие света), перемешивали при 40°С в течение 2 суток и центрифугировали для отделения твердого вещества. Твердое вещество сушили в течение ночи с получением кристалла соединения формулы I. Результаты ДРЛП полученного кристалла показаны на Фиг. 1, результаты ДСК показаны на Фиг. 2, и результаты ТГА показаны на Фиг. 3.
Пример 3: антагонизм соединения формулы I в отношении переноса в ядро андрогеновых рецепторов (AR)
1. Клетки линии PathHunter NHR размораживали, культивировали и амплифицировали.
2. Перед тестированием клетки высевали в 384-луночный планшет и инкубировали при 37°С. Сыворотку для культур фильтровали с помощью смеси древесный уголь-декстран для снижения уровня гормонов в ней.
3. При обнаружении антагонистической функции соединение добавляли к клеткам и инкубировали в течение 60 мин, и рабочие концентрации соединения формулы I, полученные посредством разбавления от 10 мкМ при 3-кратном градиенте концентраций, составляли 10000 нМ, 3333,3 нМ, 1111,1 нМ, 370,4 нМ, 123,5 нМ, 41,2 нМ, 13,7 нМ и 4,67 нМ. Затем агонист 6α-фтортестостерон в концентрации 0,06 мкМ (концентрация составляет ЕС80, т.е. концентрация соединения для 80% агонизма). Затем смесь инкубировали при 37°С или комнатной температуре в течение 3-16 часов.
4. Детектирование сигнала: добавляли 12,5 мкл или 15 мкл (50%, об./об.) детекционной смеси PathHunter (набор: DiscoverX; номер по каталогу: серия 93-0001), и смесь инкубировали при комнатной температуре в течение 1 часа. Сигнал хемилюминесценции считывали с помощью прибора PerkinElmer Envision™.
5. Анализ данных: активность соединения анализировали при использовании программного обеспечения для анализа данных CBIS (ChemInnovation, СА), и процент ингибирования антагониста рассчитывали следующим образом: степень ингибирования IC50 (%)=100%×(1-(среднее значение RLU (относительные единицы люминесценции) тестируемого соединения-среднее значение RLU контрольной группы с холостой пробой)/(среднее значение RLU контроля EC80-среднее значение RLU контрольной группы с холостой пробой)).
Результаты исследования антагонизма соединения формулы I из примера 1 в отношении переноса в ядро андрогеновых рецепторов (AR) показывают, что IC50 составляет 0,95 мкМ.
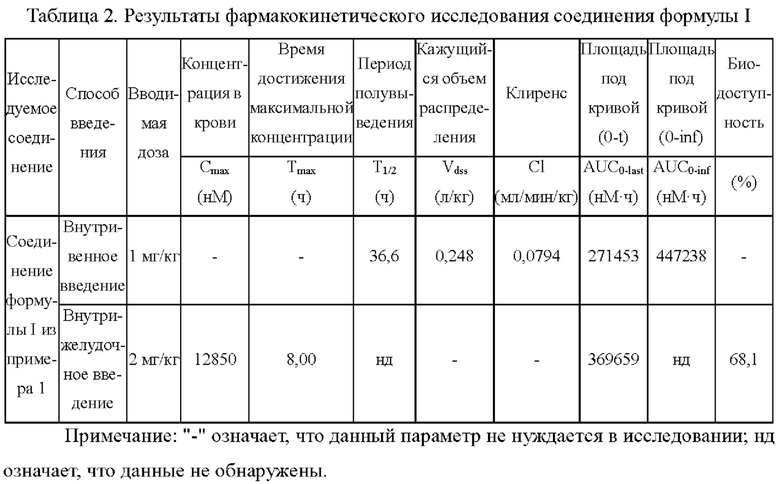
Пример 4: исследование фармакокинетики соединения формулы I
1. Аннотация
Концентрации лекарственного средства в плазме мышей в различные моменты времени после внутривенного и внутрижелудочного введения соединения формулы I определяли посредством метода ЖХ/МС/МС (жидкостная хроматография-тандемная масс-спектрометрия), взяв самцов мышей линии CD-1 в качестве подопытных животных. Этот пример направлен на исследование фармакокинетических показателей соединения формулы I на мышах и оценку фармакокинетических свойств.
2. Схема проведения эксперимента
2.1. Исследуемое лекарственное средство: соединение формулы I
2.2. Подопытные животные: 4 взрослых здоровых самца мышей линии CD-1, которых разделили на 2 группы (по 2 мыши в каждой группе) в соответствии с массой тела. Животные были приобретены у Shanghai Sippe-Bk Lab Animal Co., Ltd., номер лицензии на производство животных SCXK (Шанхай) 2013-0016.
2.3. Приготовление лекарственного средства
Соответствующее количество образца взвешивали и последовательно добавляли соответствующее количество DMSO (диметилсульфоксид), PEG400 (полиэтиленгликоль 400) и воды в соответствии с объемным соотношением 10:40:50, и смесь перемешивали и обрабатывали ультразвуком до прозрачного состояния (0,4 мг/мл) для внутривенного введения.
Соответствующее количество образца взвешивали и добавляли в раствор 0,5% CMC (карбоксиметилцеллюлоза) плюс 0,2% Tween 80 (полисорбат), смесь перемешивали и обрабатывали ультразвуком до состояния суспензии (0,4 мг/мл) для внутрижелудочного введения.
2.4. Введение
Четырех самцов мышей линии CD-1 делили на 2 группы, и после голодания в течение ночи мышам в первой группе проводили внутривенное введение в объеме 2,5 мл/кг и дозе 1 мг/кг, а мышам во второй группе проводили внутрижелудочное введение в объеме 5 мл/кг и дозе 2 мг/кг.3.
Ход исследования
У самцов мышей линии CD-1 после внутривенного введения соединения формулы I проводили отбор 30 мкл крови через 0,0833, 0,25, 0,5, 1, 2, 4, 8, 24 и 48 часов, и кровь помещали в пробирки, содержащие 2 мкл EDTA-K2 (этилендиаминтетрауксусная кислота). У самцов мышей линии CD-1 после внутрижелудочного введения соединения формулы I проводили отбор 30 мкл крови через 0,25, 0,5, 1, 2, 4, 8, 24 и 48 часов, и кровь помещали в пробирки, содержащие 2 мкл EDTA-K2. Пробирки центрифугировали при 3000 g в течение 15 мин для отделения плазмы, которую хранили при -60°С. Через 4 часа после введения животные получали доступ к еде.
Метод ЖХ/МС/МС использовали для определения содержания исследуемого соединения в плазме мышей после внутривенного и внутрижелудочного введения. Линейный диапазон метода составлял 2,00-6000 нмоль/л; образцы плазмы анализировали после обработки ацетонитрилом для осаждения белков.
Результаты фармакокинетического исследования соединения формулы I показаны в таблице 2 ниже.
Пример 5: исследование тканевого распределения соединения формулы I
1. Аннотация
Концентрации лекарственного средства в плазме и головном мозге мышей после внутрижелудочного введения соединения формулы I определяли посредством метода ЖХ/МС/МС, взяв самцов мышей линии CD-1 в качестве подопытных животных.
2. Схема проведения эксперимента
2.1. Исследуемое лекарственное средство: соединение формулы I
2.2. Подопытные животные: 2 взрослых здоровых самца мышей линии CD-1. Животные были приобретены у Shanghai Sippe-Bk Lab Animal Co., Ltd.
2.3. Приготовление лекарственного средства
Соответствующее количество образца добавляли в водный раствор 0,5% CMC/0,2% Tween, и смесь перемешивали и обрабатывали ультразвуком до состояния суспензии (0,4 мг/мл).
2.4. Введение
Двум самцам мышей линии CD-1 после голодания в течение ночи проводили внутрижелудочное введение в объеме 5 мл/кг и дозе 2 мг/кг.
3. Ход исследования
У самцов мышей линии CD-1 после внутрижелудочного введения соединения формулы I проводили отбор 100 мкл крови посредством пункции сердца через 4 часа, и кровь помещали в пробирки, содержащие 2 мкл EDTA-K2, и центрифугировали при 3000 g в течение 15 мин для отделения 30 мкл плазмы, которую хранили при -60°С. В то же время ткани головного мозга собирали, промывали, гомогенизировали с помощью 9-кратной смеси 15 мМ PBS (фосфатно-солевой буферный раствор)/МеОН (об./об., 2:1) и хранили при -60°С.Через 4 часа после введения животные получали доступ к еде.
Метод ЖХ/МС/МС использовали для определения содержания исследуемого соединения в плазме и головном мозге мышей после внутрижелудочного введения. Линейный диапазон метода составлял 2,00-6000 нмоль/л; образцы плазмы анализировали после обработки ацетонитрилом для осаждения белков.
Результаты исследования тканевого распределения показаны в таблице 3.


Пример 6: фармакодинамическое исследование соединения формулы I in vivo на подкожной модели ксенотрансплантата опухоли, состоящей из клеток LNCaP-FGC рака предстательной железы человека
1. Дизайн эксперимента



2. Материалы эксперимента
2.1. Экспериментальные животные Вид: мышь
Линия: мышь СВ-17 SCID
Возраст в неделях и масса тела: 6-8-недельная, масса тела 18-22 г Пол: мужской
Поставщик: Beijing Vital River Laboratory Animal Technology Co., Ltd. Номер сертификата на животное: 11400700184227
3. Способы и методики проведения эксперимента
3.1. Клеточная культура
LNCaP-FGC клетки рака предстательной железы человека (АТСС, Manassas, VA) культивировали in vitro в виде монослоя в среде RPMI1640, содержащей 10% фетальной бычьей сыворотки при 37°С и 5% СО2. Обычное ферментативное расщепление смесью панкреатин-EDTA проводили дважды в неделю для пассирования. Когда степень насыщения клеток составляет 80-90%, клетки собирают, подсчитывают и инокулируют.
3.2. Инокулирование опухолевых клеток 0,2 мл (10×106) клеток LNCaP-FGC (10×106 плюс матригель, 1:1) подкожно инокулировали в правую часть спины каждой мыши СВ-17 SCID. Мышей делили на группы для введения, когда средний объем опухоли достигал 100-150 мм3.
3.3. Измерение опухоли
Диаметры опухолей измеряли дважды в неделю с помощью штангенциркуля с нониусом. Формула расчета объема опухоли была следующей: V=0,5а×b2, где а и b представляют собой длинный и короткий диаметры опухоли соответственно. Противоопухолевый терапевтический эффект соединения оценивали по TGI (ингибирование роста опухоли) (%) или относительной скорости пролиферации опухоли Т/С (%). TGI (%)=[(1-(средний объем опухоли в группе лечения в конце введения - средний объем опухоли в группе лечения в начале введения))/(средний объем опухоли в контрольной группе носителя в конце лечения - средний объем опухоли в контрольной группе носителя в начале лечения)] × 100%. Формула расчета для относительной скорости пролиферации опухоли Т/С (%) была следующей: T/C%=TRTV/CRTV×100% (TRTV: RTV группы лечения; CRTV: RTV группы отрицательного контроля). Относительный объем опухоли (RTV) рассчитывали на основании результатов измерения опухоли. Формула расчета была следующей: RTV=Vt/V0, где V0 представлял собой средний объем опухоли, измеренный во время распределения по группам и введения (то есть d0), Vt представлял собой средний объем опухоли при некотором измерении, и данные TRTV и CRTV. были получены на те же сутки. 3.4.
Статистический анализ
Статистический анализ включал среднее значение и стандартную ошибку среднего (SEM) объема опухоли в каждый момент времени для каждой группы. Группа лечения показала лучший лечебный эффект на 21 сутки после введения в конце эксперимента, и поэтому статистический анализ был проведен на основе данных для оценки различий между группами. Сравнение между двумя группами анализировали при использовании Т-теста, сравнение между тремя или более группами было проанализировано с использованием однофакторного дисперсионного анализа. Если значения F существенно различались, для тестирования использовали метод Геймса-Хауэлла. Если не было значительной разницы в значениях F, для анализа использовали метод Даннета (двусторонний). Анализ всех полученных данных проводили с помощью пакета программ SPSS 17.0. "Р<0,05" было определено как значимое различие.
4. Результаты эксперимента
На 21 сутки после введения соединение формулы I демонстрировало значительный эффект ингибирования опухоли как в дозе 10 мг/кг, так и в дозе 20 мг/кг по сравнению с контрольной группой растворителя (Т/С=43,93% и 32,37%, соответственно; TGI=62,75% и 76,16% соответственно; р=0,003 и р<0,001, соответственно). В то же время животные обладали хорошей переносимостью исследуемого соединения, описанного выше.
Пример 7: изучение гигроскопичности кристалла соединения формулы I
Модель прибора: DVS Advantage компании SMS
Условия испытаний: образец (10-15 мг) кристалла соединения формулы I, полученный в примере 2, помещали в лоток для образцов ДСП для тестирования. Подробные параметры ДСП были следующими:
Уравновешивание: dm/dt=0,01%/мин (самое короткое: 10 минут, самое длинное: 180 минут)
Сушка: сушка при 0% относительной влажности в течение 120 мин.
Температура: 25°С
Исследуемый градиент относительной влажности (%): 10%
Диапазон исследуемого градиента относительной влажности (%): 0% -90% -0%
Результаты эксперимента:
Результирующая картина динамической сорбции паров (ДСП) показана на Фиг. 4, где ΔW%=1,018%.
Примечание: ΔW% представляет собой приращение влажности исследуемого соединения при 25±1°С и 80±2% относительной влажности.
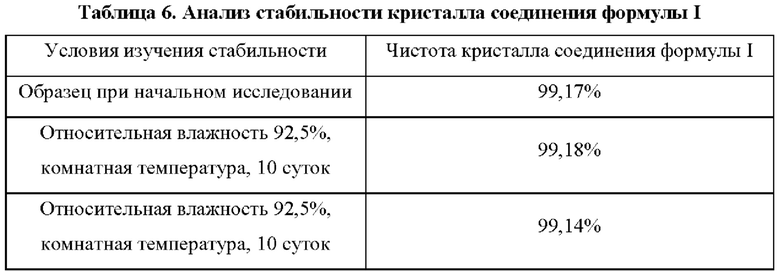
Пример 8: эксперимент по испытанию стабильности в твердом состоянии кристалла соединения формулы I
Были сделаны ссылки на требования в «Руководстве по испытанию стабильности АФИ и препаратов» (Приложение ХГХ С второго тома Китайской фармакопеи, издание 2010 г.) в отношении условий и способа испытания стабильности кристалла, и стабильность кристаллического твердого вещества в условиях различных факторов влияния изучали на кристалле, полученном в примере 2, в качестве исследуемого образца.
Высокоэффективная жидкостная хроматография (ВЭЖХ): колонка: Waters Xbridge shiled RP18 (150 мм×4,6 мм; 3,5 мкм); каталожный номер: 186003045; длина волны: 228 нм; подвижная фаза А: рН 4,5, буферный раствор ацетата натрия 5 ммоль/л (рН регулировали фосфорной кислотой); подвижная фаза В: ацетонитрил; режим элюирования: градиентное элюирование. Результаты эксперимента представлены в таблице 6.

| название | год | авторы | номер документа |
|---|---|---|---|
| СОКРИСТАЛЛЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2014 |
|
RU2675270C2 |
| СО-КРИСТАЛЛЫ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2014 |
|
RU2823603C2 |
| СОЛЬ АРИЛАМИНОХИНАЗОЛИН-СОДЕРЖАЩЕГО СОЕДИНЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2833198C1 |
| МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ СЕЛЕКТИВНОГО МОДУЛЯТОРА РЕЦЕПТОРОВ ЭСТРОГЕНОВ В КОМБИНАЦИИ С ПРЕДШЕСТВЕННИКАМИ ПОЛОВЫХ СТЕРОИДНЫХ ГОРМОНОВ | 1999 |
|
RU2246947C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА СОЕДИНЕНИЯ, ПОДАВЛЯЮЩЕГО АКТИВНОСТЬ ПРОТЕИНКИНАЗЫ, И ЕЁ ПРИМЕНЕНИЕ | 2017 |
|
RU2744264C2 |
| Кристалл ингибитора DPP-IV длительного действия и его соли | 2017 |
|
RU2753335C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА (S)-N-(5-((R)-2-(2,5-ДИФТОРФЕНИЛ)-ПИРРОЛИДИН-1-ИЛ)-ПИРАЗОЛО[1,5-A]ПИРИМИДИН-3-ИЛ)-3-ГИДРОКСИПИРРОЛИДИН-1-КАРБОКСАМИДА ГИДРОСУЛЬФАТА | 2015 |
|
RU2723990C2 |
| ДИАРИЛТИОГИДАНТОИНОВЫЕ СОЕДИНЕНИЯ | 2007 |
|
RU2449993C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ N1,N4-БИС-(БУТА-1,3-ДИЕНИЛ)БУТАН-1,4-ДИАМИНА И СПОСОБЫ ЕЕ ПРИМЕНЕНИЯ | 2007 |
|
RU2448693C2 |
| КРИСТАЛЛЫ АЗАБИЦИКЛИЧЕСКОГО СОЕДИНЕНИЯ | 2016 |
|
RU2697521C2 |


Изобретение относится к кристаллу диарилтиогидантоинового соединения формулы I, где на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 13,47±0,2°, 15,32±0,2°, 15,98±0,2°, 18,68±0,2°, 23,11±0,2° и 26,41±0,2°. Кристалл соединения формулы I имеет пик поглощения при 238,92°С согласно анализу посредством метода дифференциальной сканирующей калориметрии. Способ получения кристалла соединения формулы I осуществляют путем смешивания соединения формулы I с растворителем при температуре 35-70°С для осаждения кристалла, где растворитель выбран из группы, состоящей из метанола, этанола, этилацетата, тетрагидрофурана, ацетонитрила, ацетона, смеси метанола и воды, смеси этанола и воды и смеси ацетона и воды. Изобретение относится к фармацевтической композиции для лечения андроген-опосредованного рака, содержащей терапевтически эффективное количество кристалла соединения формулы I по изобретению и фармацевтически приемлемый эксципиент. Изобретение также относится к способу лечения андроген-опосредованного рака у млекопитающих, включающему введение млекопитающему, предпочтительно человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристалла соединения формулы I или фармацевтической композиции по изобретению. Кристалл соединения формулы I или фармацевтическую композицию по изобретению применяют для лечения андроген-опосредованного рака. Технический результат - кристалл диарилтиогидантоинового соединения для лечения андроген-опосредованного рака, обладающий стабильностью и низкой гигроскопичностью. 7 н. и 8 з.п. ф-лы, 4 ил., 6 табл., 8 пр.

1. Кристалл соединения формулы I
где на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 13,47±0,2°, 15,32±0,2°, 15,98±0,2°, 18,68±0,2°, 23,11±0,2° и 26,41±0,2°.
2. Кристалл соединения формулы I по п.1, где на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 13,01±0,2°, 13,47±0,2°, 14,00±0,2°, 15,32±0,2°, 15,98±0,2°, 18,68±0,2°, 22,78±0,2°, 23,11±0,2°, 24,49±0,2° и 26,41±0,2°.
3. Кристалл соединения формулы I по п.1, где на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 9,34±0,2°, 13,01±0,2°, 13,47±0,2°, 14,00±0,2°, 15,32±0,2°, 15,98±0,2°, 18,68±0,2°, 22,78±0,2°, 23,11±0,2°, 24,49±0,2°, 25,85±0,2°, 26,41±0,2° и 30,73±0,2°.
4. Кристалл соединения формулы I по п.1, где на картине дифракции рентгеновских лучей на порошке при использовании Cu Kα излучения дифракционные пики находятся при следующих значениях угла 2θ: 9,34±0,2°, 13,01±0,2°, 13,47±0,2°, 13,78±0,2°, 14,00±0,2°, 15,32±0,2°, 15,72±0,2°, 15,98±0,2°, 18,68±0,2°, 22,31±0,2°, 22,78±0,2°, 23,11±0,2°, 24,49±0,2°, 25,85±0,2°, 26,95±0,2°, 26,41±0,2°, 26,65±0,2° и 30,73±0,2°.
5. Кристалл соединения формулы I по п. 1, где картина дифракции рентгеновских лучей на порошке этого кристалла показана на Фиг. 1.
6. Кристалл соединения формулы I, имеющий пик поглощения при 238,92°С согласно анализу посредством метода дифференциальной сканирующей калориметрии
7. Кристалл соединения формулы I по п. 6, где термограмма дифференциальной сканирующей калориметрии этого кристалла показана на Фиг. 2.
8. Способ получения кристалла соединения формулы I по любому из пп. 1-7, включающий смешивание соединения формулы I с растворителем при температуре 35-70°С для осаждения кристалла, где растворитель выбран из группы, состоящей из метанола, этанола, этилацетата, тетрагидрофурана, ацетонитрила, ацетона, смеси метанола и воды, смеси этанола и воды и смеси ацетона и воды.
9. Способ получения кристалла соединения формулы I по п. 8, где требуемый объем растворителя составляет 5-50 мл на 1 г соединения формулы I.
10. Фармацевтическая композиция для лечения андроген-опосредованного рака, содержащая терапевтически эффективное количество кристалла соединения формулы I по любому из пп. 1-7 и фармацевтически приемлемый эксципиент.
11. Способ лечения андроген-опосредованного рака у млекопитающих, включающий введение млекопитающему, предпочтительно человеку, нуждающемуся в таком лечении, терапевтически эффективного количества кристалла соединения формулы I по любому из пп. 1-7 или фармацевтической композиции по п. 10.
12. Применение кристалла соединения формулы I по любому из пп. 1-7 или фармацевтической композиции по п. 10 в получении лекарственных средств для лечения андроген-опосредованного рака.
13. Применение кристалла соединения формулы I по любому из пп. 1-7 или фармацевтической композиции по п. 10 в лечении андроген-опосредованного рака.
14. Кристалл соединения формулы I по любому из пп. 1-7 или фармацевтическая композиция по п. 10 для лечения андроген-опосредованного рака.
15. Способ по п. 11, применение по п. 12 или 13, или кристалл, или фармацевтическая композиция по п. 14, где рак представляет собой рак предстательной железы.
| WO 2015018356 A1, 12.02.2015 | |||
| WO 2018009678 A1, 11.01.2018 | |||
| CN 104341352 A, 11.02.2015 | |||
| MINO.R.CAIRA, Crystalline polymorphism of organic compounds, TOPICS IN CURRENT CHEMISTRY, Springer Verlag Berlin Heidelberg, 1998, V.198, p.163-208 | |||
| Narayan Variankav al; et al.: "From form to function: Crystallization of active pharmaceutical ingredients", |
Авторы
Даты
2023-12-25—Публикация
2020-01-22—Подача