Изобретение относится к химии фторорганических соединений, а именно к получению α,β,β-трифторстирола.
α,β,β-Трифторстирол (1) является важным и перспективным мономером для получения полимеров, главная цепь которых полностью фторирована, что придает им высокую хемо- и термостабильность, а наличие фенильных фрагментов делает возможным введение функциональных групп для получения разнообразных модифицированных полимеров. Такие модифицированные полимеры на основе α,β,β-трифторстирола применяют в качестве материалов для топливных элементов [CN 114210532, 2022, CN 113786743, 2021] мембран для диализа [CN 113786743, 2021], ионообменных мембран [US 7550216, 2009], носителей для хроматографии и др.
α,β,β-Трифторстирол (1) впервые был получен Коэном в 1949 году [Cohen S.G, Wolosinski Н.Т, Scheuer P.J., J. Am. Chem. Soc, 1949; 71, 3439-3440] многостадийным синтезом по следующей схеме:

Впоследствии α,β,β-трифторстирол получали взаимодействием ариллитиевых соединений с тетрафторэтиленом [Dixon S.J., J. Org. Chem., 1956, 21, 400], кросс-сочетанием арилйодидов с трифторвинилцинком или оловом, катализируемым комплексами палладия [Qibo L., Burton D.J., J. Fluorine Chemistry, 2011, 132(2), 78-87]. Однако помимо необходимости инертной атмосферы, сложности работы с палладиевыми комплексами, а также их высокой стоимости, исходные трифторвинилйодид или бромид, необходимые для получения трифторвинильных металлоорганических реагентов, являются крайне труднодоступными соединениями.
Известны способы получения α,β,β-трифторстирола взаимодействием тетрафторэтилена с производными фенилборной кислоты под давлением катализируемым комплексами палладия [Ohashi М., Saijo Н., Shibata М.; Ogoshi, S., European Journal of Organic Chemistry, 2013, 3, 443-447], а также с арильным реактивом Гриньяра и цинкарильными и силильными производными, катализируемыми комплексами палладия, однако все эти способы не нашли промышленного применения из-за высоких требований к чистоте растворителей, необходимости инертной атмосферы для работы с такими комплексами и специальной аппаратуры для работы под давлением, кроме того, из-за высокой стоимости применяемых комплексов палладия.
Известен способ получения α,β,β-трифторстирола, предложенный Кнунянцем и Беккером [DE 2425550 (А1), 1975], взаимодействием полифторхлорацетонов с бензолом по реакции Фриделя-Крафтса с последующим дегидрохлорированием полученных третичных полифторхлоркарбинолов (2) с образованием α-окисей (3) и последующим раскрытием таких окисей под действием оснований с получением соответствующего фторангидрида (4) и получением соли (5), пиролиз которой дает α,β,β-трифторстирол (1). Однако если 1,2-дихлортетрафторацетон ранее был доступным промышленным продуктом, поскольку являлся одним из полупродуктов при фторировании гексахлорацетона в промышленном синтезе одного из наиболее востребованных фторорганических продуктов - гексафторацетона, теперь в производстве используют другую технологию, фторирование гексахлорацетона в промышленности больше не производится, и промежуточные продукты этого процесса перестали быть доступны.

Все известные способы получения α,β,β-трифторстирола (1) многостадийны или требуют использования специального оборудования и дорогостоящих реагентов и работы в инертной атмосфере, поэтому поиск новых способов его синтеза является актуальным.
Задачей настоящего изобретения является разработка способа получения α,β,β-трифторстирола из доступных реагентов, не требующего использования специальной аппаратуры для работы под давлением и инертной атмосферы.
Задача решается предложенным способом получения α,β,β-трифторстирола, включающим взаимодействие метилового эфира 2-бромтетрафторпропионовой кислоты с йодбензолом с образованием метилового эфира α-фенилтетрафторпропионовой кислоты, получение калиевой соли этой кислоты и ее декарбоксилирование с образованием целевого продукта (1).
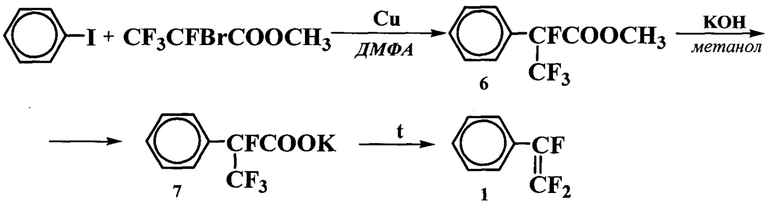
Взаимодействие метилового эфира 2-бромтетрафторпропионовой кислоты с йодбензолом и металлической медью осуществляют при нагревании от 90 до 120°С в полярном апротонном растворителе, например диметилформамиде; при мольном соотношении реагентов метиловый эфир а 2-бромтетрафторпропионовой кислоты: йодбензол: металлическая медь 1:1-1,2:1,5-3, и получаемый метиловый эфир α-фенилтетрафторпропионовой кислоты (6) выделяют из реакционной смеси перегонкой с паром и последующим фракционированием при пониженном давлении, затем эфир (6) подвергают взаимодействию с гидроксидом калия в метаноле, после упаривания реакционной смеси полученную калиевую соль α-фенилтетрафторпропионовой кислоты (7) декарбоксилируют путем нагревания ее до 110-130°С в полярном апротонном растворителе, таком как N-метилпирролидон, с одновременной отгонкой трифторстирола (1). Суммарный выход α,β,β-трифторстирола составляет от 35 до 55%.
Исходный метиловый эфир 2-бромтетрафторпропионовой кислоты легко получается из окиси гексафторпропилена, одного из основных крупнотоннажных фторсодержащих мономеров [Лебедев Н.В., Беренблит В.В., Старобин Ю.К., Губанов В.А., Журнал Прикладной Химии, т.78(10), 2005, с. 1668-1673].
Метиловый эфир 2-бромтетрафторпропионовой кислоты в абсолютном диметилформамиде реагирует с йодбензолом в присутствии металлической меди, в результате образуется метиловый эфир 2-фенилтетрафторпропионовой кислоты (6).
Реакция проходит за 2 часа при 60°С, 20 минут при 90°С и практически мгновенно при 110-120°С. При более низких температурах основным продуктом реакции становится продукт сдваивания метилового эфира 2-бромтетрафторпропионовой кислоты, при более высоких температурах наблюдается значительное образование 2Н-тетрафторпропионовой кислоты, по-видимому, за счет реакции медного производного бромтетрафторуксусной кислоты с растворителем. Образование бифенила в данных условиях не наблюдается.
Наилучший выход был получен при использовании 2,5 эквивалентов металлической меди и проведении реакции при 115-120°С.
По окончании реакции в реакционную смесь добавляют 10-20% воды и отгоняют продукт с паром до тех пор, пока в приемной колбе не перестанет отслаиваться органический слой. Затем органический слой отделяют и фракционируют в вакууме.
Далее из метилового эфира 2-фенилтетрафторпропионовой кислоты (6) получают калиевую соль (7) взаимодействием с гидроксидом калия в метаноле, выпаривают метанол и декарбоксилируют соль, нагревая ее в полярном апротонном растворителе, таком как N-метилпирролидон или сульфолан, (при добавлении ингибитора полимеризации) до температуры 110-130°С с одновременной отгонкой образующегося α,β,β-трифторстирола в вакууме.
Техническим результатом предлагаемого изобретения является новый способ получения трифторстирола (1) из доступных реагентов, не требующий для своего осуществления специального оборудования.
Изобретение иллюстрируется примерами 1-5.
Пример 1. Получение метилового эфира α-фенилтетрафторпропионовой кислоты (6). Йодбензол (224 г, 1,1 моль) и порошок меди (172 г, 2,7 моль) в 400 мл абсолютного ДМФА при перемешивании нагревают до 115-120°С, добавляют по каплям 239 г (1 моль) метилового эфира 2-бромтетрафторпропионовой кислоты, поддерживая температуру 115-120°С, перемешивают еще 10 минут, охлаждают до комнатной температуры, добавляют 200 мл воды и отгоняют сырец с водой. Нижний слой отгона отделяют и фракционируют при пониженном давлении, собирая фракцию с т.кип. 62-70°С/2 Торр. Получают 144 г метилового эфира α-фенилтетрафторпропионовой кислоты (6) в виде бесцветной жидкости. Выход 61%.
ЯМР 1H, δ.: 3.6 (с, 3Н, СН3) 7.2 (м, 3Н, С6Н5), 7.5 (с, 2Н, С6Н5). ЯМР 19F, δ.: -173.3 (м, 1F, CF), -78.1 (с, 3F, CF3).
Здесь и далее 1Н, 19F ЯМР спектры записаны на спектрометре "Bruker AVANCE-300" при 300 и 282 MHz соответственно, внешний стандарт - CDCl3. Химические сдвиги для 1Н ЯМР спектров приведены в м.д. относительно ТМС. Химические сдвиги спектров 19F ЯМР приведены в м.д. относительно CFCl3.
Пример 2. Получение метилового эфира α-фенилтетрафторпропионовой кислоты (6). Йодбензол (224 г, 1,1 моль) и порошок меди (172 г, 2,7 моль) в 400 мл абсолютного ДМФА при перемешивании нагревают до 90°С, добавляют 239 г (1 моль) метилового эфира 2-бромтетрафторпропионовой кислоты, после выпадения осадка йодида меди выдерживают 30 минут при этой температуре, охлаждают до комнатной температуры, добавляют 200 мл воды и отгоняют сырец с водой. Нижний слой отгона отделяют и фракционируют при пониженном давлении, собирая фракцию с т. кип.62-70°С/2 Торр. Получают 95 г метилового эфира α-фенилтетрафторпропионовой кислоты (6) в виде бесцветной жидкости. Выход 40%.
Спектры ЯМР 1Н и 19F соответствуют описанным в предыдущем примере.
Пример 3. Получение α-фенилтетрафторпропионата калия (7). Метиловый эфир α-фенилтетрафторпропионовой кислоты (6) (144 г, 0,61 моль) по каплям добавляют к раствору 38 г KOH (0,67 моль) в 150 мл метанола, кипятят в течение часа, выливают в фарфоровую чашку и досуха упаривают, затем сушат в колбе на кипящей водяной бане при <0.5 Торр до постоянного веса. Получают 146 г 2-фенилтетрафторпропионата калия (7) в виде белого порошка. Выход 91%.
ЯМР 1Н, (D2O) δ: 7.3 (м, 3Н, С6Н5), 7.6 (м, 2Н, С6Н5);
ЯМР 19F, δ: -161 (с, 1F, CF), -76 (с, 3F, CF3).
Пример 4. Получение α,β,β-трифторстирола (1) в N-метилпирролидоне. К раствору 2-фенилтетрафторпропионата калия (7) (146 г, 0,56 моль) в 150 мл абс. N-метилпирролидона, добавляют 1 г ТЕМПО ((2,2,6,6-тетраметилпиперидин-1-ил)оксила) и нагревают в вакууме 60 Торр, создаваемом регулируемым водоструйным насосом, до начала декарбоксилирования (110-115°С), после окончания декарбоксилирования (температура около 130°С) в вакууме 30 Торр отгоняют продукт в охлаждаемую приемную колбу. Получают 84 г α,β,β-трифторстирола (1) в виде бесцветной жидкости чистотой по ГХ 97,5%. Выход 96%.
ЯМР 1Н, δ: 7.1 (м, 3Н, С6Н5), 7,25 (м, 2Н, С6Н5).
ЯМР 19F, δ: -102.7 (дд, 2JFF=71 Гц, 3JFF=30 Гц, CFC=CFACFB), -117.2 (дд, 2JFF=70 Гц, 3JFF=108 Гц, CFC=CFACFB). -178.6 (дд, 3JFF=109 Гц, CFC=CFACFB).
Пример 5. Получение α,β,β-трифторстирола (1) в сульфолане. К раствору 2-фенилтетрафторпропионата калия (7) (146 г, 0,56 моль) в 150 мл сульфолана, добавляют 1 г ТЕМПО и нагревают в вакууме 60 Торр, создаваемом регулируемым водоструйным насосом, до начала декарбоксилирования (115-120°С), после окончания декарбоксилирования в вакууме 30 Торр отгоняют продукт в охлаждаемую приемную колбу. Получают 79 г α,β,β-трифторстирола (1) в виде бесцветной жидкости чистотой 97,5% (ГХ). Выход 90%.
Спектры ЯМР 1Н и 19F соответствуют описанным в предыдущем примере.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКСООБРАЗУЮЩИЕ БЕНЗОСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ β-ДИКАРБОНИЛЬНЫЙ ЗАМЕСТИТЕЛЬ С ФТОРИРОВАННЫМИ РАДИКАЛАМИ | 2007 |
|
RU2373200C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОРАЛКИЛЙОДИДОВ И БРОМИДОВ | 2020 |
|
RU2739762C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРФТОРАЛКИЛЙОДИДОВ | 2020 |
|
RU2748928C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОНО- И ДИГИДРОКСИПОЛИФТОРБЕНЗОЛОВ | 2013 |
|
RU2536872C1 |
| ПРОИЗВОДНЫЕ ЦИКЛОПЕНТАН- ИЛИ ЦИКЛОПЕНТЕН -β- АМИНОКИСЛОТ И ИХ СОЛИ, КОМПОЗИЦИЯ, АКТИВНАЯ В ОТНОШЕНИИ ШТАММОВ S.AUREUS CANDIDA И TRICHOPHYTON | 1993 |
|
RU2126379C1 |
| ОКСА- И ПОЛИОКСАПЕРФТОРАЛКИЛБРОМИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2497801C1 |
| КОМПЛЕКСООБРАЗУЮЩИЕ ДИБЕНЗОСОДЕРЖАЩИЕ ПЯТИЧЛЕННЫЕ ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ДВА СИММЕТРИЧНЫХ БЕТА-ДИКАРБОНИЛЬНЫХ ЗАМЕСТИТЕЛЯ С ФТОРИРОВАННЫМИ РАДИКАЛАМИ | 2005 |
|
RU2296756C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСАПЕРФТОРАЛКАНСУЛЬФОКИСЛОТ И ИХ СОЛЕЙ | 2012 |
|
RU2503659C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛ-2-ФТОРАКРИЛАТА | 2014 |
|
RU2558147C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИМАТИНИБА И ЕГО ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2007 |
|
RU2480461C2 |
Изобретение относится к способу получения α,β,β-трифторстирола, включающему взаимодействие метилового эфира 2-бромтетрафторпропионовой кислоты с йодбензолом и металлической медью при 90-120°С в полярном апротонном растворителе с образованием метилового эфира α-фенилтетрафторпропионовой кислоты, выделение его перегонкой с паром с последующим фракционированием при пониженном давлении, взаимодействие последнего с гидроксидом калия в метаноле, упаривание реакционной смеси и декарбоксилирование полученной калиевой соли α-фенилтетрафторпропионовой кислоты нагреванием в полярном апротонном растворителе до 110-130°С с одновременной отгонкой α,β,β-трифторстирола в вакууме с добавлением ингибитора полимеризации. Технический результат: создание нового способа синтеза α,β,β-трифторстирола из доступного исходного сырья, не требующего использования специального оборудования для работы под высоким давлением и в инертной атмосфере. 4 з.п. ф-лы, 5 пр.
1. Способ получения α,β,β-трифторстирола, включающий взаимодействие метилового эфира 2-бромтетрафторпропионовой кислоты с йодбензолом и металлической медью при 90-120°С в полярном апротонном растворителе с образованием метилового эфира α-фенилтетрафторпропионовой кислоты, выделение его перегонкой с паром с последующим фракционированием при пониженном давлении, взаимодействие последнего с гидроксидом калия в метаноле, упаривание реакционной смеси и декарбоксилирование полученной калиевой соли α-фенилтетрафторпропионовой кислоты нагреванием в полярном апротонном растворителе до 110-130°С с одновременной отгонкой α,β,β-трифторстирола в вакууме с добавлением ингибитора полимеризации.
2. Способ по п. 1, в котором взаимодействие метилового эфира 2-бромтетрафторпропионовой кислоты с йодбензолом и металлической медью проводят в диметилформамиде.
3. Способ по п. 1, в котором мольное соотношение реагентов при взаимодействии метилового эфира 2-бромтетрафторпропионовой кислоты с йодбензолом и металлической медью 1:1-1,2:1,5-3.
4. Способ по п. 1, в котором декарбоксилирование соли проводят в N-метилпирролидоне.
5. Способ по п. 1, в котором декарбоксилирование соли проводят в сульфолане.
| CN 103708988 B, 10.02.2016 | |||
| CN 103274896 A, 04.09.2013 | |||
| СПОСОБ ПОЛУЧЕНИЯ ДИАБЕТИЧЕСКИХ ВАФЕЛЬ (ВАРИАНТЫ) | 2010 |
|
RU2425550C1 |
| OHASHI M | |||
| et al., Palladium‐Catalyzed Base‐Free Suzuki-Miyaura Coupling Reactions of Fluorinated Alkenes and Arenes via a Palladium Fluoride Key Intermediate | |||
| European Journal of Organic Chemistry, 2013, vol | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| pp | |||
| Шахтно-ступенчатая топка с цепной решеткой для торфа | 1920 |
|
SU443A1 |
| NIKITINA T | |||
| S | |||
Авторы
Даты
2024-01-15—Публикация
2023-01-31—Подача