Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет и преимущество предварительной заявки США с серийным номером 62/676,638, которая была подана 25 мая 2018 г. и предварительной заявки США с серийным номером 62/688,641, которая была подана 22 июня 2018 г., содержание которых полностью включено в настоящую заявку посредством ссылки.
Область, к которой относится изобретение
[0001] Область относится к ингибиторам фосфодиэстеразы 1 (PDE1), полезным для лечения некоторых видов рака и опухолей, таких как опухоли центральной нервной системы. Эта область также относится к введению ингибиторов фосфодиэстеразы 1 (PDE1) для лечения некоторых видов рака и опухолей, таких как опухоли центральной нервной системы, или для лечения связанных с этим состояний, характеризующихся повышенной экспрессией в PDE1.
Предпосылки создания изобретения
[0002] Глиобластома является наиболее распространенной злокачественной опухолью головного мозга у взрослых, на нее приходится более половины всех первичных опухолей головного мозга с частотой от 2 до 3 на 100000 в западных развитых странах. Прогнозы почти всегда плохие: средняя выживаемость составляет 6-9 месяцев, а пятилетняя выживаемость составляет менее 3%. Brodbelt A, et al.; (UK) National Cancer Information Network Brain Tumour Group. Glioblastoma in England: 2007-2011. Eur. J. Cancer. 2015 Mar; 51(4):533-42.
[0003] Глиобластома представляет собой агрессивную опухоль, которая характеризуется быстрым ростом и инвазией в здоровый мозг. Эффективность существующих методов лечения снижается из-за необходимости сохранить нормальную функцию мозга во время операции, из-за присущей опухолям резистентности к лучевой терапии и неспособности многих лекарственных средств проникать через гематоэнцефалический барьер. За последние три десятилетия не было значительных улучшений для взрослых пациентов с глиобластомой, поскольку последующая фаза III испытаний лекарственных средств направленного действия не показала улучшение выживаемости (Touat M, et al., Glioblastoma targeted therapy: updated approaches from recent biological insights. Ann. Oncol. 2017 Jul 1; 28(7):1457-1472), и темозоламид (алкилирующее соединение, способное преодолевать гематоэнцефалический барьер) остается одним из единственных эффективных химиотерапевтических средств, доступных для лечения глиобластомы. Даже при максимальном лечении с операцией по уменьшению объема опухоли, лучевой терапией и темозоломидом медиана выживаемости составляет всего 14,6 месяцев. Stupp R, et al., Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma; N Engl J Med. 2005 Mar 10;352(10):987-96.
[0004] В настоящее время существует огромная неудовлетворенная потребность в эффективном способе лечения опухолей центральной нервной системы, таких как мультиформная глиобластома. Срочно требуются улучшенные терапевтические композиции и способы лечения таких состояний.
[0005] Было идентифицировано одиннадцать семейств фосфодиэстераз (PDE), но было показано, что только PDE в Семействе I, Ca2+/кальмодулин-зависимые фосфодиэстеразы (CaM-PDE), которые активируются Ca2+/кальмодулином и опосредуют сигнальные пути кальция и циклических нуклеотидов (например, cGMP и cAMP). Три известных CaM-PDE гена, PDE1A, PDE1B и PDE1C, все экспрессируются в ткани центральной нервной системы. PDE1A экспрессируется в головном мозге, легких и сердце. PDE1B преимущественно экспрессируется в центральной нервной системе, но также обнаружен в моноцитах и нейтрофилах и, как было показано, участвует в воспалительных ответах этих клеток. PDE1C экспрессируется в обонятельном эпителии, гранулярных клетках мозжечка, полосатом теле, сердце и гладких мышцах сосудов. Было продемонстрировано, что PDE1C является основным регулятором пролиферации гладких мышц в гладких мышцах человека.
[0006] Фосфодиэстеразы циклических нуклеотов подавляют внутриклеточную передачу сигналов cAMP и cGMP путем гидролиза этих циклических нуклеотидов до их соответствующих 5’-монофосфатов (5’АМР и 5’GMP), которые неактивны с точки зрения внутриклеточных сигнальных путей. Оба, cAMP и cGMP, являются центральными внутриклеточными вторичными мессенджерами, и они играют роль в регуляции различных клеточных функций. PDE1A и PDE1B предпочтительно гидролизуют cGMP, а не cAMP, в то время как PDE1C демонстрирует примерно равный гидролиз cGMP и cAMP.
[0007] Что касается, в частности, PDE1C, недавно полученные данные указывают на то, что PDE1C является геном, связанным с пролиферацией, поскольку он экспрессируется исключительно в пролиферирующих клетках гладких мышц сосудов. (Rybalkin SD, et al., Calmodulin-stimulated cyclic nucleotide phosphodiesterase (PDE1C) is induced in human arterial smoothmuscle cells of the synthetic, proliferative phenotype. J Clin Invest 1997; 100:2611-2621). Кроме того, были отдельные сообщения об экспрессии PDE1C вместе с другими подтипами PDE в экспериментальных моделях опухолей, таких как меланома (Watanabe Y, et al., Phosphodiesterase 4 regulates the migration of B16-F10 melanoma cells. Exp Ther Med 2012;4:205-210,), нейробластома (Jang IS, Juhnn YS. Adaptation of cAMP signaling system in SH-SY5Y neuroblastoma cells following expression of a constitutively active timulatory G protein alpha, Q227L Gsalpha. Exp Mol Med 2001;33:37-45) и остеосаркома (Ahlström M, et al., Cyclic nucleotide phosphodiesterases (PDEs) in human osteoblastic cells; the effect of PDE inhibition on cAMP accumulation. Cell Mol Biol Lett 2005;10:305-319).
[0008] Предыдущие исследования показали, что ингибирование PDE1 (в частности, изоформы PDE1B) индуцирует апоптоз в лейкозных клетках человека. Jiang X, Paskind M, Weltzien R, Epstein PM. Expression and regulation of mRNA for distinct isoforms of mitogen-stimulated and leukemic human lymphocytes. Cell Biochem Biophys 1998; 28:135-60. Исследования также показали, что пять из шести клеточных линий глиобластомы человека из Национального института рака демонстрируют высокую экспрессию PDE1 (преимущественно PDE1C) и лишь незначительную экспрессию PDE4. Marko D, Pahlke G, Merz KH, Eisenbrand G. Cyclic 3’,5’-nucleotide phosphodiesterases: potential targets for antitumor therapy. Chem Res Toxicol 2000;13:944-8. Аналогичным образом, мРНК PDE1C сверхэкспрессируется в клетках, экспрессирующих ассоциированный со злокачественной меланомой человека антиген (MAA), и рост ингибируется неселективным ингибитором PDE1 винпоцетином. Zhao AZ, et al., Recent advances in the study of Ca2+/CaM-activated phosphodiesterases: expression and physiological functions. Adv Second Messenger Phosphoprotein Res 1997;31:237-51. Более поздние исследования показывают значительную сверхэкспрессию PDE1C в 20% глиобластомы по сравнению с нормальным мозгом человека, миРНК-опосредованный сайленсинг PDE1C ингибирует пролиферацию (45-50%) и инвазию (40-60%) в культурах клеток глиобластомы, полученных от пациентов. Rowther FB, et al., Cyclic nucleotide phosphodiesterase-1C (PDE1C) drives cell proliferation, migration and invasion in glioblastoma multiforme cells in vitro. Mol Carcinog. 2016 Mar; 55(3):268-79.
[0009] Опухоль-промотирующую клеточную пролиферацию, миграцию, тканевую инвазию и воспаление считают обязательными характеристиками развития рака. Каждый из этих процессов является время-зависимым, вариабельным и сложным и включает множество путей сигнальной трансдукции. Считают, что лекарственные средства мультинаправленного действия дают больше пользы по сравнению с наблюдаемой при однонаправленных терапиях, имеют приемлемые профили переносимости и активны против более широкого диапазона типов опухолей. Регуляция сигналов циклических нуклеотидов соответственно рассматривается как совокупность множества составляющих путей, вовлеченных в различные аспекты функции опухолевых клеток. Нарушение генерации cAMP описано при различных раковых патологиях. Попытки непосредственно регулировать циклические нуклеотиды в раковых клетках, хотя и были антипролиферативными, но оказались нерподуктивными по причине высокой цитотоксичности. Необходимы новые, более безопасные и селективные стратегии модуляции cAMP в раковых клетках.
Сущность изобретения
[0010] Авторы изобретения ранее показали, что ингибирование активности PDE1 с использованием раскрытых в настоящем изобретении соединений может безопасно восстановить функцию cAMP при широком спектре патологических состояний, включая модели нейродегенерации и нейровоспаления, сердечной недостаточности, легочной гипертензии и периферического воспаления, а также у людей с некоторыми заболеваниями. Совсем недавно авторы изобретения показали, что ингибиторы PDE1 препятствуют клеточной миграции микроглии и моноцитов. Последние данные показывают, что PDE1, особенно изоформа PDE1C, сверхэкспрессирована в экспериментальных моделях опухолей, таких как меланома, нейробластома и остеосаркома. Кроме того, было продемонстрировано фокальное геномное доминирование PDE1C в клетках мультиформной глиобластомы (GBM). Геномное усиление PDE1C связано с повышенной экспрессией в культурах клеток, полученных из GBM, и имеет важное значение для управления клеточной пролиферацией, миграцией и инвазией в раковых клетках.
[0011] Многие типы раковых клеток сверхэкспрессируют активность PDE1, которая идентифицируется посредством различных биомаркеров, таких как повышенная экспрессия РНК, количество копий ДНК, связывание PDE1 (PET или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативная активность. Эти раковые клетки также демонстрируют низкие уровни cAMP, которые могут быть увеличены ингибиторами PDE1. Такие характеристики можно лечить при помощи ингибиторов PDE-1 отдельно или в комбинации с химиотерапевтическими средствами, генными терапевтическими средствами и/или иммунологическими подходами. Ингибирование PDE1 вызывает апоптотическую гибель клеток, предотвращает миграцию, ограничивает метастазирование и уменьшает воспаление. Таким образом, ингибиторы PDE1 обладают синергическим действием с химиотерапевтическими и иммунологическими подходами.
[0012] Кроме того, известно, что многие методы генной терапии и подходы с применением антител вызывают синдром высвобождения цитокинов (CRS). CRS вызывается большим и быстрым высвобождением цитокинов в кровь иммунными клетками, на которые воздействует иммунотерапия. Ранее было показано, что PDE1 снижает экспрессию воспалительных цитокинов IL1β, TNFα и Ccl2. См. международную патентную публикацию WO2018/049147. Ингибирование PDE1 полезно в этих случаях с профилактической целью, и ингибитор PDE1 можно вводить вместе с кортикостероидами и антигистаминными препаратами для предотвращения CRS.
[0013] Не ограничиваясь теорией можно предположить, что нарушение генерации cAMP (или cGMP) возникает из-за сверхэкспрессии изоформ PDE1 при различных раковых патологиях. Ингибирование селективных изоформ PDE1, которое повышает уровни внутриклеточного cAMP (и/или cGMP), индуцирует апоптоз и остановку клеточного цикла в широком спектре опухолевых клеток и регулирует опухолевое микроокружение, предотвращая клеточную миграцию, воспаление и тканевую инвазию. Следовательно, разработка и клиническое применение ингибиторов, специфических в отношении отдельной PDE1 и ее изоформ, особенно PDE1c, может селективно восстанавливать нормальную внутриклеточную передачу сигналов, обеспечивая противоопухолевую терапию с уменьшенными побочными эффектами.
[0014] Настоящее раскрытие относится к применению ингибитора PDE1 для лечения рака или опухоли, включая, например, карциномы, меланомы и астроцитомы. В предпочтительном варианте осуществления ингибитор PDE1 является селективным. Предыдущие исследования продемонстрировали, что PDE1 (т.е. PDE1C) значительно сверхэкспрессируется у пациентов с глиобластомой по сравнению со здоровыми пациентами (то есть теми, кто не страдает глиобластомой). Было показано, что миРНК-опосредованный сайленсинг PDE1C ингибирует пролиферацию и инвазию в культурах клеток глиобластомы, полученных от пациентов. Не ограничиваясь какой-либо теорией, ингибирование PDE1, такой как PDE1C, может быть эффективным при терапевтическом вмешательстве при некоторых типах рака или опухолей, таких как глиобластома.
[0015] В частности, для лечения опухолей головного мозга требуются соединения, обладающие способностью преодолевать гематоэнцефалический барьер. Соединения по настоящему изобретению являются сильными ингибиторами PDE1. В частности, раскрытые в настоящей заявке соединения демонстрируют высокую селективность в отношении обеих изоформ, PDE1A и PDE1C, и способны проникать через гематоэнцефалический барьер.
[0016] Таким образом, в различных вариантах осуществления настоящее изобретение предоставляет способы лечения состояния, выбранного из рака или опухоли, включающие введение фармацевтически приемлемого количества ингибитора PDE1, раскрытого в настоящей заявке, нуждающемуся в этом субъекту. В некоторых вариантах осуществления рак или опухоль представляет собой глиому, лейкоз, меланому, нейробластому или остеосаркому. В некоторых вариантах осуществления рак или опухоль представляет собой астроцитому, такую как мультиформная глиобластома. В некоторых вариантах осуществления ингибитор PDE1 вводят в комбинации с противоопухолевым средством.
[0017] В различных вариантах осуществления настоящее изобретение предоставляет способы ингибирования пролиферации, миграции и/или инвазии опухолевых клеток, включающие введение фармацевтически приемлемого количества ингибитора PDE1, раскрытого в настоящей заявке, нуждающемуся в этом субъекту. В некоторых вариантах осуществления рак или опухоль представляет собой глиому, лейкоз, меланому, нейробластому или остеосаркому. В некоторых вариантах осуществления рак или опухоль представляет собой астроцитому, такую как мультиформная глиобластома. В некоторых вариантах осуществления ингибитор PDE1 вводят в комбинации с противоопухолевым средством.
[0018] В различных вариантах осуществления в настоящей заявке представлен способ лечения глиомы, включающий введение фармацевтически приемлемого количества ингибитора PDE1 нуждающемуся в этом субъекту. В некоторых вариантах осуществления рак или опухоль представляет собой астроцитому, такую как мультиформная глиобластома. В некоторых вариантах осуществления ингибитор PDE1 вводят в комбинации с противоопухолевым средством.
[0019] В другом аспекте настоящее изобретение также включает ингибитор PDE1 формулы I, Ia, II, III и/или IV, описанной ниже, в свободной форме или в форме соли. В предпочтительном варианте осуществления ингибитор PDE1 представляет собой селективный ингибитор PDE1. В другом варианте осуществления изобретение также предоставляет фармацевтическую композицию, включающую ингибитор PDE1 в свободной форме или в форме фармацевтически приемлемой соли в смеси с фармацевтически приемлемым носителем.
[0020] В различных вариантах осуществления настоящее изобретение предоставляет комбинированные терапии, включающие ингибитор PDE1 формулы I, Ia, II, III и/или IV, описанной ниже, в свободной форме или в форме соли и противоопухолевое средство. Комбинированную терапию можно использовать в сочетании с любым из способов, описанных в настоящей заявке. В некоторых вариантах осуществления противоопухолевое средство вводят одновременно с введением, до или после введения ингибитора PDE1.
[0021] В различных вариантах осуществления настоящее изобретение также предоставляет фармацевтические композиции, содержащие соединения по настоящему изобретению, полученные с использованием обычных разбавителей или эксципиентов и методов, известных в данной области техники. Таким образом, пероральные лекарственные формы могут включать таблетки, капсулы, растворы, суспензии и т.п.
[0022] В различных вариантах осуществления настоящее изобретение также предоставляет ингибиторы PDE1 в соответствии с Формулой I, Ia, II, III и/или IV, описанной ниже, в свободной форме или в форме соли для использования для лечения состояния, выбранного из рака или опухоли, ингибирования пролиферации, миграции и/или инвазии опухолевых клеток, или лечения глиомы.
Краткое описание чертежей
[0023] Фиг. 1 показывает экспрессию PDE1C в краткосрочных культурах клеток мультиформной глиобластомы (GBM).
[0024] Фиг. 2 показывает изменение экспрессии PDE1C в свежезамороженных образцах биопсии GBM, представленных в сравнении с нормальными астроцитами человека.
[0025] Фиг. 3 показывает клеточную пролиферацию исследуемых культур клеток GBM после миРНК-опосредованной деплеции PDE1C.
[0026] Фиг. 4 показывает сравнение клеточной миграции через поликарбонатную мембрану клеток, модифицированных для специфического таргетирования PDE1C, и нетаргетирующих клеток.
[0027] Фиг. 5 показывает сравнение клеточной инвазии через покрытую эктрацеллюлярной мембраной поликарбонатную мембрану клеток, модифицированных для специфического таргетирования PDE1C, и нетаргетирующих клеток.
[0028] Фиг. 6 показывает уменьшение количества клеток, которые мигрировали в области раны, в клетках, модифицированных для специфического таргетирования PDE1C, по сравнению с неетаргетирующими клетками в трех культурах (IN1472, IN1760 и U251MG).
[0029] Фиг. 7 показывает активность PDE в нескольких клеточных линиях GBM, измеренную как в присутствии, так и в отсутствие системы Ca2+/кальмодулин.
Подробное описание изобретения
Соединения для применения в способах по изобретению
[0030] В одном варианте осуществления ингибиторы PDE1 для применения в способах лечения и профилактики, описанных в настоящей заявке, являются селективными ингибиторами PDE1.
Ингибиторы PDE1
[0031] В одном варианте осуществления изобретение предусматривает, что ингибиторы PDE1 для применения в способах лечения и профилактики, описанных в настоящей заявке, представляют собой соединения формулы I:
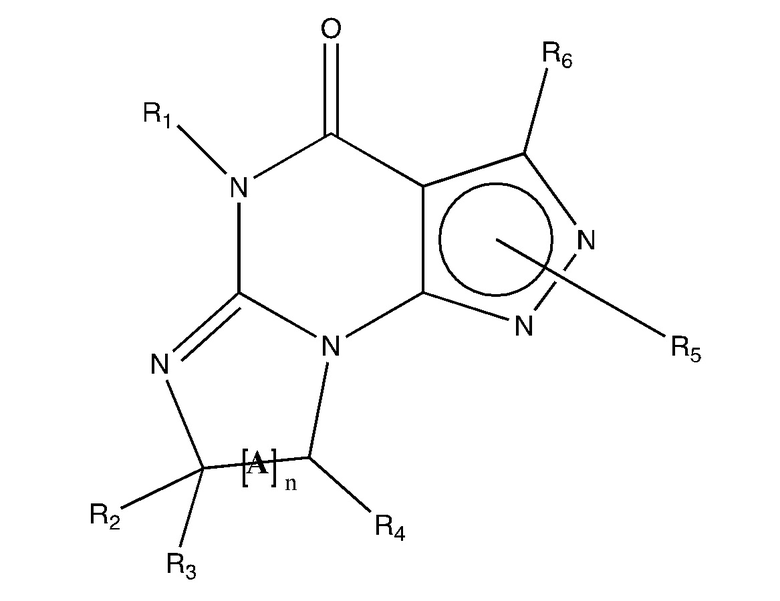
Формула I
где
(i) R1 представляет собой H или C1-4 алкил (например, метил);
(ii) R4 представляет собой H или C1-4 алкил, и R2 и R3 независимо представляют собой H или C1-4 алкил
(например, R2 и R3 оба представляют собой метил, или R2 представляет собой H, а R3 представляет собой изопропил), арил, гетероарил, (необязательно гетеро)арилалкокси или (необязательно гетеро)арилалкил; или
R2 представляет собой H, и R3 и R4 вместе образуют ди-, три- или тетраметиленовый мостик
(предп., где R3 и R4 вместе имеют цис-конфигурацию, например, где атомы углерода, несущие R3 и R4, имеют конфигурации R и S, соответственно);
(iii) R5 представляет собой замещенный гетероарилалкил, например, замещенный галогеналкилом;
или R5 присоединен к одному из атомов азота на пиразоло-части формулы I и представляет собой фрагмент формулы A
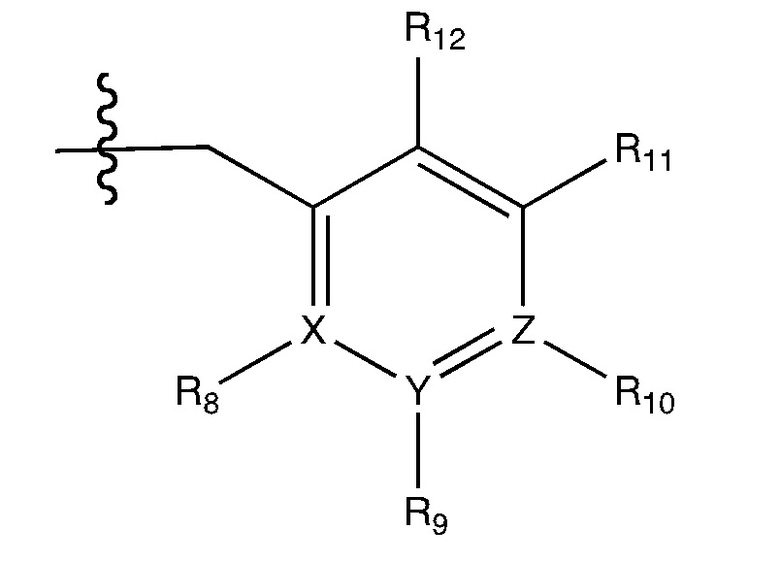
Формула A
где X, Y и Z независимо представляют собой N или C, и R8, R9, R11 и R12 независимо представляют собой H или галоген (например, Cl или F), и R10 представляет собой галоген, алкил, циклоалкил, галогеналкил (например, трифторметил), арил (например, фенил), гетероарил (например, пиридил (например, пирид-2-ил) необязательно замещенный галогеном, или тиадиазолил (например, 1,2,3-тиадиазол-4-ил)), диазолил, триазолил, тетразолил, арилкарбонил (например, бензоил), алкилсульфонил (например, метилсульфонил), гетероарилкарбонил или алкоксикарбонил; при условии, что, когда X, Y, или Z представляет собой азот, R8, R9, или R10, соответственно, отсутствует; и
(iv) R6 представляет собой H, алкил, арил, гетероарил, арилалкил (например, бензил), ариламино (например, фениламино), гетероариламино, N, N-диалкиламино, N, N-диариламино или N-арил-N-(арилалкил)амино (например, N-фенил-N-(1,1’-бифен-4-илметил)амино); и
(v) n=0 или 1;
(vi) когда n=1, A представляет собой -C(R13R14)-
где R13 и R14 независимо представляют собой H или C1-4 алкил, арил, гетероарил, (необязательно гетеро)арилалкокси или (необязательно гетеро)арилалкил;
в свободной форме, в форме соли или пролекарства, включая его энантиомеры, диастереоизомеры и рацематы.
[0032] В другом варианте осуществления изобретение предусматривает, что ингибиторы PDE1 для применения в способах, описанных в настоящей заявке, представлены Формулой 1a:
Формула Ia
где
(i) R2 и R5 независимо представляют собой H или гидрокси, и R3 и R4 вместе образуют три- или тетра-метиленовый мостик [предп. с атомами углерода, несущими R3 и R4, имеющими конфигурацию R и S, соответственно]; или R2 и R3 каждый представляет собой метил, и R4 и R5 каждый представляет собой H; или R2, R4 и R5 представляют собой H, а R3 представляет собой изопропил [предп. атом углерода, несущий R3, имеет R-конфигурацию];
(ii) R6 представляет собой (необязательно галоген-замещенный) фениламино, (необязательно галоген-замещенный) бензиламино, C1-4алкил или C1-4алкилсульфид; например, фениламино или 4-фторфениламино;
(iii) R10 представляет собой C1-4алкил, метилкарбонил, гидроксиэтил, карбоновую кислоту, сульфонамид, (необязательно галоген- или гидрокси-замещенный) фенил, (необязательно галоген- или гидрокси-замещенный) пиридил (например, 6-фторпирид-2-ил) или тиадиазолил (например, 1,2,3-тиадиазол-4-ил); и
X и Y независимо представляют собой C или N,
в свободной форме, форме фармацевтически приемлемой соли или пролекарства, включая его энантиомеры, диастереоизомеры и рацематы.
[0033] В другом варианте осуществления изобретение предусматривает, что ингибиторы PDE1 для применения в способах лечения и профилактики, описанных в настоящей заявке, представляют собой соединения формулы II:
Формула II
(i) Х представляет собой C1-6алкилен (например, метилен, этилен или проп-2-ин-1-илен);
(ii) Y представляет собой простую связь, алкинилен (например, -C≡C-), арилен (например, фенилен) или гетероарилен (например, пиридилен);
(iii) Z представляет собой H, арил (например, фенил), гетероарил (например, пиридил, например, пирид-2-ил), галоген (например, F, Br, Cl), галогенC1-6алкил (например, трифторметил), -C(O)-R1, -N(R2)(R3) или C3-7циклоалкил, необязательно содержащий по меньшей мере один атом, выбранный из группы, состоящей из N или O (например, циклопентил, циклогексил, тетрагидро-2H-пиран-4-ил или морфолинил);
(iv) R1 представляет собой C1-6алкил, галогенC1-6алкил, -OH или -OC1-6алкил (например, -OCH3);
(v) R2 и R3 независимо представляют собой H или C1-6алкил;
(vi) R4 и R5 независимо представляют собой H, C1-6алкил или арил (например, фенил), необязательно замещенный одним или более галогенами (например, фторфенил, например, 4-фторфенил), гидрокси (например, гидроксифенил, например, 4-гидроксифенил или 2-гидроксифенил) или C1-6алкокси;
(vii) где X, Y и Z независимо и необязательно замещены одним или более галогенами (например, F, Cl или Br), C1-6алкилом (например, метилом), галогенC1-6алкилом (например, трифторметилом), например, Z представляет собой гетероарил, например, пиридил, замещенный одним или более галогенами (например, 6-фторпирид-2-ил, 5-фторпирид-2-ил, 6-фторпирид-2-ил, 3-фторпирид-2-ил, 4-фторпирид-2-ил, 4,6-дихлорпирид-2-ил), галогенC1-6алкилом (например, 5-трифторметилпирид-2-ил) или C1-6-алкилом (например, 5-метилпирид-2-ил), или Z представляет собой арил, например, фенил, замещенный одним или более галогенами (например, 4-фторфенил),
в свободной форме, форме соли или пролекарства.
[0034] Еще в одном варианте осуществления изобретение предусматривает, что ингибиторы PDE1 для применения в способах лечения и профилактики, описанных в настоящей заявке, представлены Формулой III:
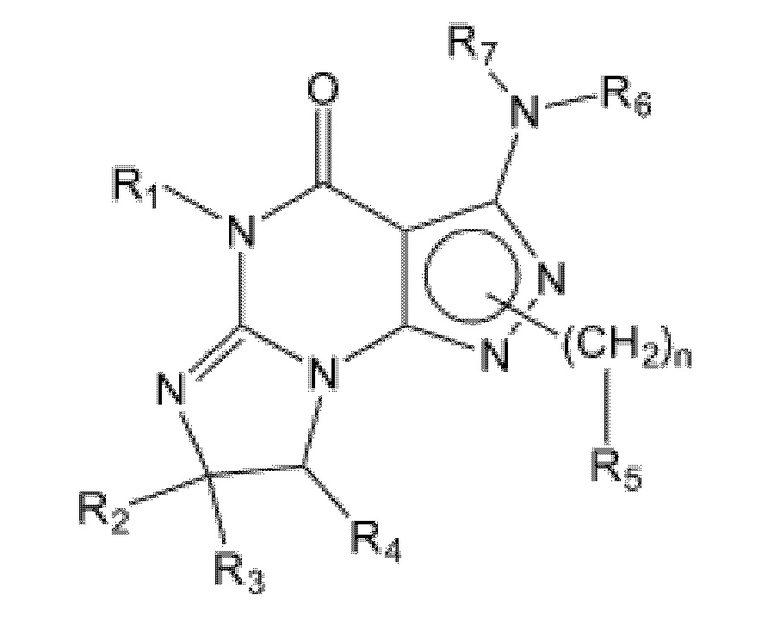
Формула III
где
(i) R1 представляет собой H или C1-4 алкил (например, метил или этил);
(ii) R2 и R3 независимо представляют собой H или C1-6 алкил (например, метил или этил);
(iii) R4 представляет собой H или C1-4 алкил (например, метил или этил);
(iv) R5 представляет собой арил (например, фенил), необязательно замещенный одной или более группами, независимо выбранными из -C(=O)-C1-6 алкила (например, -C(=O)-CH3) и C1-6-гидроксиалкила (например, 1-гидроксиэтила);
(v) R6 и R7 независимо представляют собой H или арил (например, фенил), необязательно замещенный одной или более группами, независимо выбранными из C1-6 алкила (например, метила или этила) и галогена (например, F или Cl), например незамещенный фенил или фенил, замещенный одним или более галогенами (например, F), или фенил, замещенный одним или более C1-6 алкилами и одним или более галогенами, или фенил, замещенный одним C1-6 алкилом и одним галогеном, например 4-фторфенил, или 3,4-дифторфенил, или 4-фтор-3-метилфенил; и
(vi) n имеет значение 1, 2, 3 или 4,
в свободной форме или в форме соли.
[0035] Еще в одном варианте осуществления изобретение предусматривает, что ингибиторы PDE1 для применения в способах лечения и профилактики, описанных в настоящей заявке, представлены Формулой IV
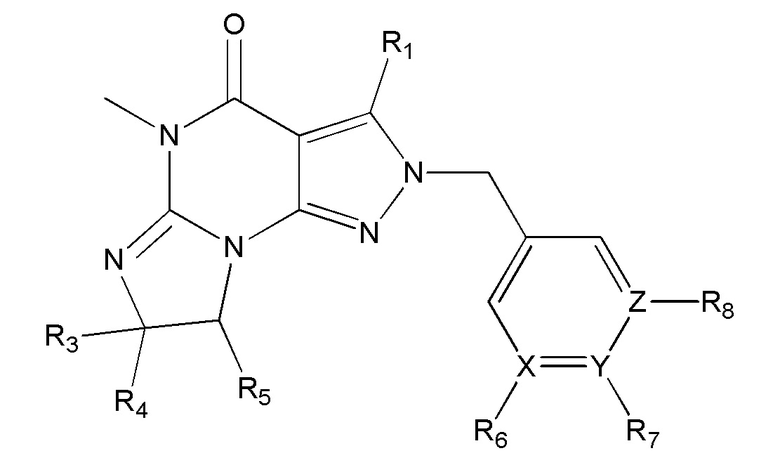
Формула IV
в свободной форме или в форме соли, где
(i) R1 представляет собой C1-4алкил (например, метил или этил) или -NH(R2), где R2 представляет собой фенил, необязательно замещенный галогеном (например, фтором), например, 4-фторфенил;
(ii) X, Y и Z независимо представляют собой, N или C;
(iii) R3, R4 и R5 независимо представляют собой H или C1-4алкил (например, метил); или R3 представляет собой H, и R4 и R5 вместе образуют триметиленовый мостик (предп., где R4 и R5 вместе имеют цис-конфигурацию, например, где атомы углерода, несущие R4 и R5, имеют конфигурации R и S, соответственно),
(iv) R6, R7 и R8 независимо представляют собой:
H,
C1-4алкил (например, метил),
пирид-2-ил, замещенный гидрокси группой, или
-S(O)2-NH2;
(v) При условии, что, когда X, Y и/или Z представляют собой N, тогда R6, R7 и/или R8, соответственно, отсутствуют; и когда X, Y и Z все представляют собой C, тогда по меньшей мере один из R6, R7 или R8 представляет собой -S(O)2-NH2 или пирид-2-ил, замещенный гидрокси группой.
[0036] В одном варианте осуществления изобретение предоставляет введение ингибитора PDE1 для лечения или профилактики воспаления или связанного с воспалением заболевания или расстройства, где ингибитор представляет собой соединение в соответствии со следующей формулой:
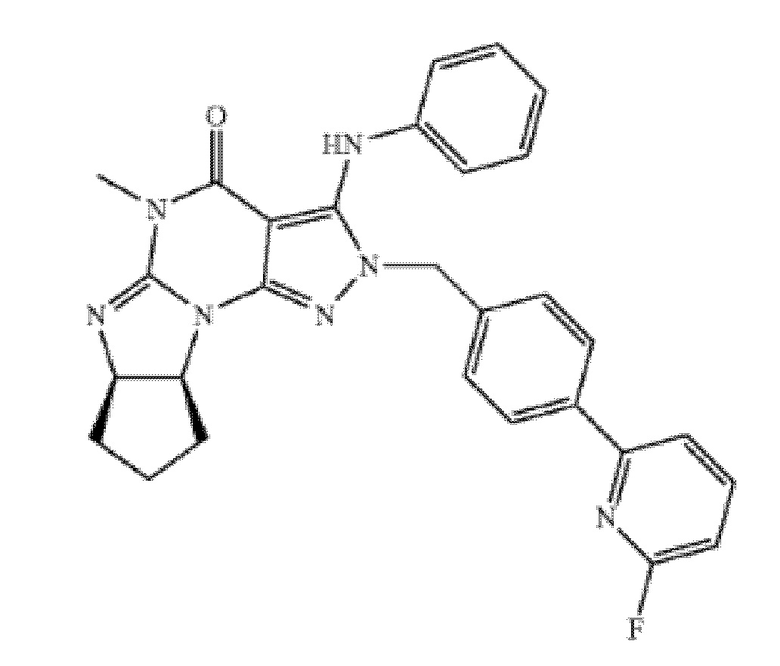
в свободной форме или в форме фармацевтически приемлемой соли.
[0037] Еще в одном варианте осуществления изобретение предоставляет введение ингибитора PDE1 для лечения или профилактики воспаления или связанного с воспалением заболевания или расстройства, где ингибитор представляет собой соединение в соответствии со следующей формулой:
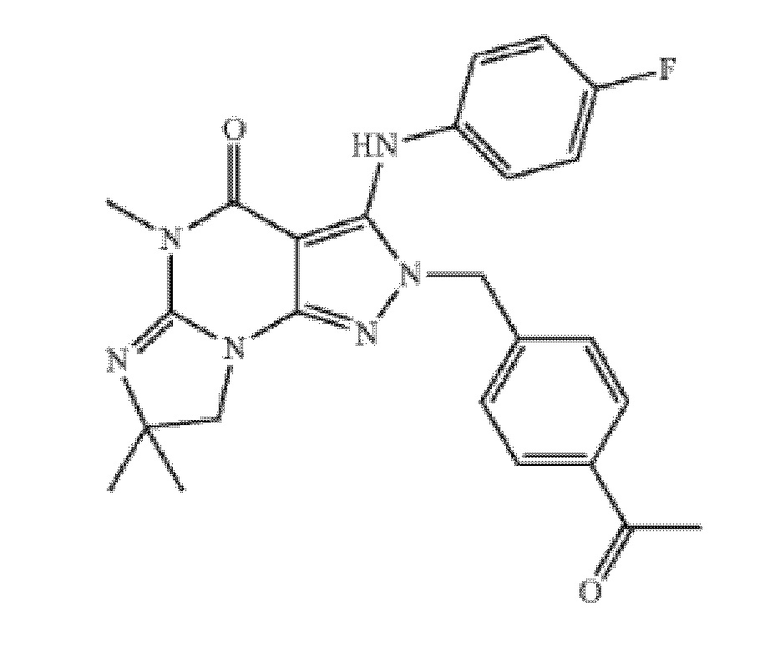
в свободной форме или в форме фармацевтически приемлемой соли.
[0038] Еще в одном варианте осуществления изобретение предоставляет введение ингибитора PDE1 для лечения или профилактики воспаления или связанного с воспалением заболевания или расстройства, где ингибитор представляет собой соединение в соответствии со следующей формулой:
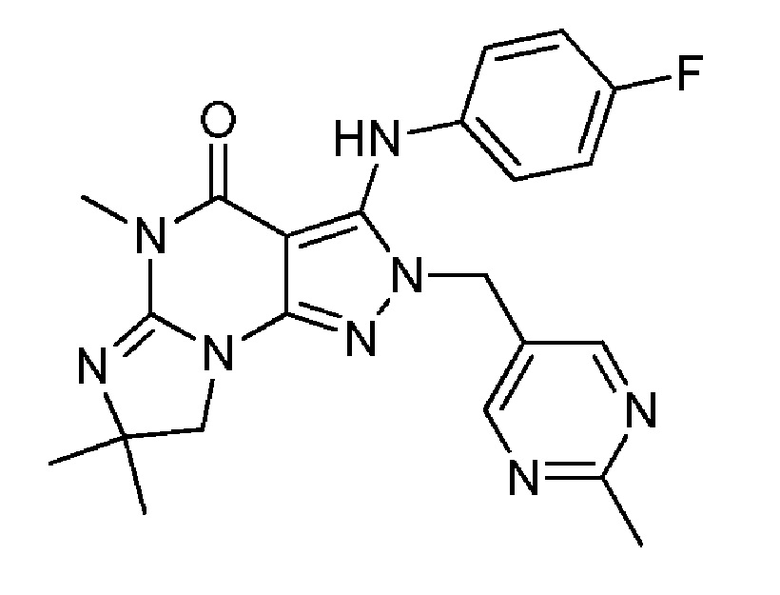
в свободной форме или в форме фармацевтически приемлемой соли.
[0039] Еще в одном варианте осуществления изобретение предоставляет введение ингибитора PDE1 для лечения или профилактики воспаления или связанного с воспалением заболевания или расстройства, где ингибитор представляет собой соединение в соответствии со следующей формулой:
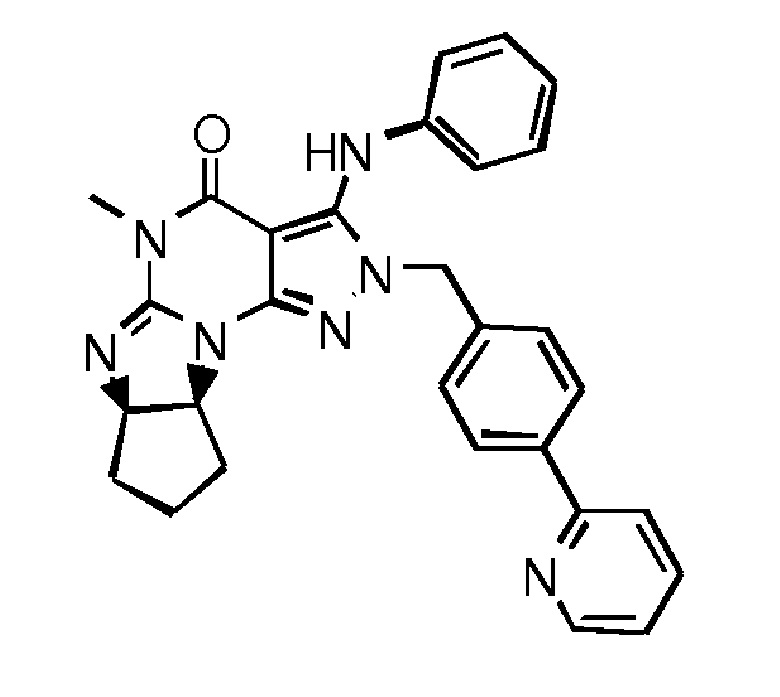
в свободной форме или в форме фармацевтически приемлемой соли.
[0040] Еще в одном варианте осуществления изобретение предоставляет введение ингибитора PDE1 для лечения или профилактики воспаления или связанного с воспалением заболевания или расстройства, где ингибитор представляет собой соединение в соответствии со следующей формулой:
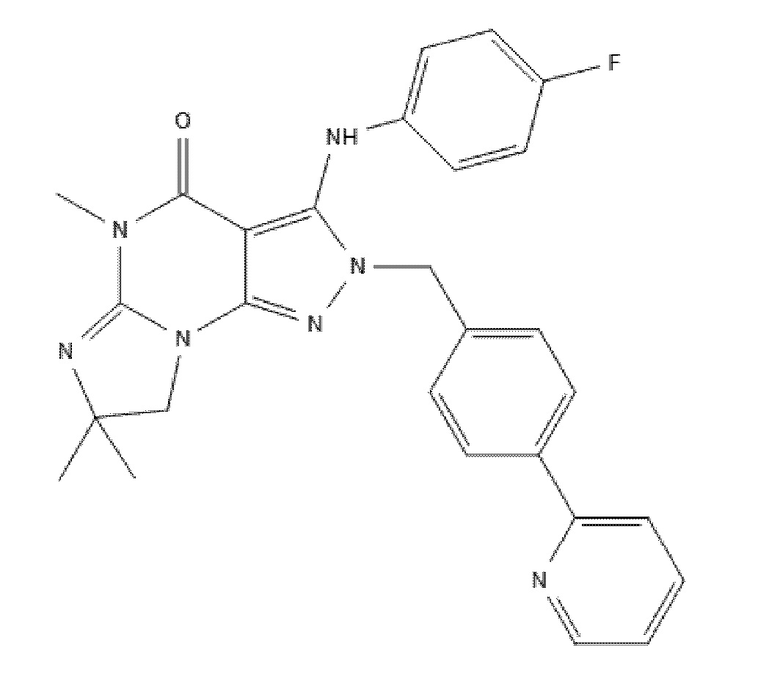
в свободной форме или в форме фармацевтически приемлемой соли.
[0041] В одном варианте осуществления селективные ингибиторы PDE1 любой из предыдущих формул (например, формулы I, Ia, II, III и/или IV) представляют собой соединения, которые ингибируют фосфодиэстераза-опосредованный (например, PDE1-опосредованный, особенно PDE1B-опосредованный) гидролиз cGMP, например, предпочтительные соединения имеют значение IC50 менее 1мкM, предпочтительно менее 500 нM, предпочтительно менее 50 нM и предпочтительно менее 5 нM в PDE анализе на основе афинности к иммобилизованному металлу, в свободной форме или в форме соли.
[0042] В других вариантах осуществления изобретение предоставляет введение ингибитора PDE1 для лечения состояния, выбранного из рака или опухоли; для ингибирования пролиферации, миграции и/или инвазии опухолевых клеток; и/или для лечения глиомы, где ингибитор представляет собой соединение в соответствии со следующей формулой:
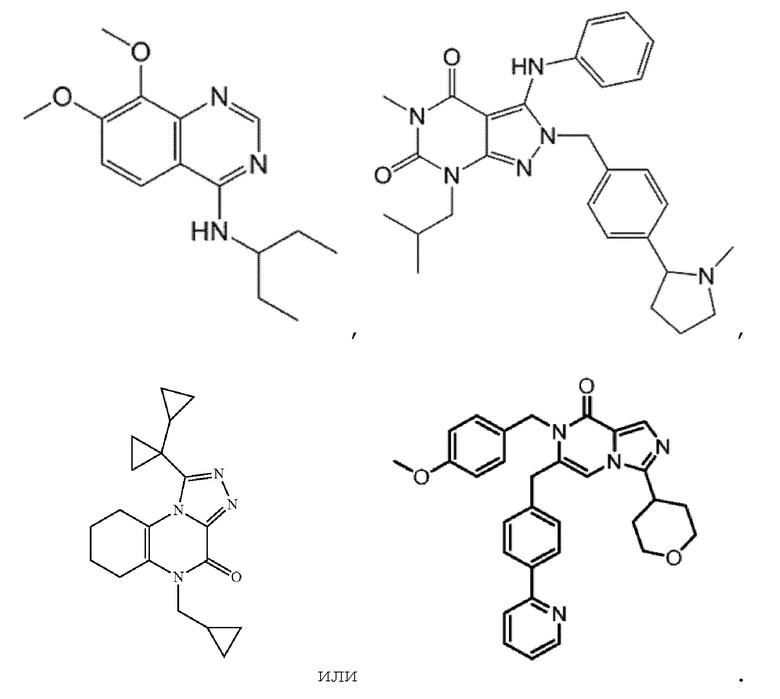
[0043] Другие примеры ингибиторов PDE1, подходящих для применения в способах и лечении, обсуждаемых в настоящей заявке, можно найти в международной публикации WO2006133261A2; Патенте США 8273750; Патенте США 9000001; Патенте США 9624230; Международной публикации WO2009075784A1; Патенте США 8273751; Патенте США 8829008; Патенте США 9403836; Международной публикации WO2014151409A1, Патенте США 9073936; Патенте США 9598426; Патенте США 9556186; Публикации США 2017/0231994A1, Международной публикации WO2016022893A1 и Публикации США 2017/0226117A1, при этом каждый из вышеперечисленных документов включен посредством ссылки во всей полноте.
[0044] Другие примеры ингибиторов PDE1, подходящих для применения в способах и лечении, обсуждаемых в настоящей заявке, можно найти в Международной публикации WO2018007249A1; Публикации США 2018/0000786; Международной публикации WO2015118097A1; Патенте США 9718832; Международной публикации WO2015091805A1; Патенте США 9701665; Публикации США 2015/0175584A1; Публикации США 2017/0267664A1; Международной публикации WO2016055618A1; Публикации США 2017/0298072A1; Международной публикации WO2016170064A1; Публикации США 2016/0311831A1; Международной публикации WO2015150254A1; Публикации США 2017/0022186A1; Международной публикации WO2016174188A1; Публикации США 2016/0318939A1; Публикации США 2017/0291903A1; Международной публикации WO2018073251A1; Международной публикации WO2017178350A1; и Публикации США 2017/0291901A1; каждая из которых включена посредством ссылки во всей полноте. В любой ситуации, когда утверждения любых документов, включенных посредством ссылки, противоречат или несовместимы с любыми утверждениями, сделанными в настоящем раскрытии, следует понимать, что преимущество имеют утверждения настоящего раскрытия.
[0045] Если не указано иное или не ясно из контекста, следующие термины в данном документе имеют следующие значения:
(a) “Селективный ингибитор PDE1” в контексте настоящей заявки относится к ингибитору PDE1 с по меньшей мере 100-кратной селективностью в отношении ингибирования PDE1 по сравнению с ингибированием любой другой изоформы PDE.
(b) “Алкил” в контексте настоящей заявки означает насыщенную или ненасыщенную углеводородную группу, предпочтительно насыщенную, предпочтительно содержащую от одного до шести атомов углерода, которая может быть линейной или разветвленной и может быть необязательно моно-, ди- или тризамещенной, например, галогеном (например, хлором или фтором), гидрокси или карбокси.
(c) “Циклоалкил” в контексте настоящей заявки представляет собой насыщенную или ненасыщенную неароматическую углеводородную группу, предпочтительно насыщенную, предпочтительно содержащую от трех до девяти атомов углерода, по меньшей мере некоторые из которых образуют неароматическую моно- или бициклическую или мостиковую циклическую структуру, и которая может быть необязательно замещенной, например, галогеном (например, хлором или фтором), гидрокси или карбокси. Когда циклоалкил необязательно содержит один или более атомов, выбранных из N, O и/или S, указанный циклоалкил также может быть гетероциклоалкилом.
(d) “Гетероциклоалкил” представляет собой, если не указано иное, насыщенную или ненасыщенную неароматическую углеводородную группу, предпочтительно насыщенную, предпочтительно содержащую от трех до девяти атомов углерода, по меньшей мере некоторые из которых образуют неароматическую моно- или бициклическую или мостиковую циклическую структуру, где по меньшей мере один атом углерода замещен N, O или S, при этом гетероциклоалкил может быть необязательно замещен, например, галогеном (например, хлором или фтором), гидрокси или карбокси.
(e) “Арил” в контексте настоящей заявки представляет собой моно- или бициклический ароматический углеводород, предпочтительно фенил, необязательно замещенный, например, алкилом (например, метилом), галогеном (например, хлором или фтором), галогеналкилом (например, трифторметилом), гидрокси, карбокси или дополнительным арилом или гетероарилом (например, бифенилом или пиридилфенилом).
(f) “Гетероарил” в контексте настоящей заявки означает ароматическую группу, в которой один или более атомов, составляющих ароматическое кольцо, представляют собой серу или азот, а не углерод, например, пиридил или тиадиазолил, который может быть необязательно замещен, например, алкилом, галогеном, галогеналкилом, гидрокси или карбокси.
[0046] Соединения по настоящему изобретению, например, ингибиторы PDE1, как описано в настоящей заявке, могут существовать в свободной форме или в форме соли, например, в виде кислотно-аддитивных солей. В данном описании, если не указано иное, такие термины как “Соединения по настоящему изобретению” следует понимать, как охватывающие соединения в любой форме, например, в свободной форме или форме кислотно-аддитивной соли, или, когда соединения содержат кислотные заместители, в форме основно-аддитивной соли. Соединения по настоящему изобретению предназначены для использования в качестве фармацевтических препаратов, поэтому фармацевтически приемлемые соли являются предпочтительными. Соли, непригодные для фармацевтического применения, могут быть полезны, например, для выделения или очистки свободных соединений по изобретению или их фармацевтически приемлемых солей, поэтому также включены.
[0047] Соединения по настоящему изобретению могут в некоторых случаях также существовать в форме пролекарств. Форма пролекарства представляет собой соединение, которое превращается в организме в соединение по настоящему изобретению. Например, когда соединения по настоящему изобретению содержат гидрокси- или карбокси-заместители, эти заместители могут образовывать физиологически гидролизуемые и приемлемые сложные эфиры. В контексте настоящей заявки “физиологически гидролизуемый и приемлемый сложный эфир” означает сложные эфиры соединений по настоящему изобретению, которые гидролизуются в физиологических условиях с образованием кислот (в случае соединений по изобретению, которые имеют гидрокси заместители) или спиртов (в случае соединений по изобретению, которые имеют карбокси заместители), которые сами по себе являются физиологически приемлемыми при дозах, предусмотренных для введения. Следовательно, если соединение по настоящему изобретению содержит гидрокси группу, например, Соединение-OH, ацилэфирное пролекарство такого соединения, т.е., Соединение-O-C(O)-C1-4алкил, может гидролизоваться в организме с образованием физиологически гидролизуемого спирта (Соединение-OH) с одной стороны и кислоты с другой (например, HOC(O)-C1-4алкил). В качестве альтернативы, если соединение по настоящему изобретению содержит карбоновую кислоту, например, Соединение-C(O)OH, пролекарство, являющееся сложным эфиром кислоты такого соединения, Соединение-C(O)O-C1-4алкил, может гидролизоваться с образованием Соединение-C(O)OH и HO-C1-4алкила. Должно быть понятно, что термин, таким образом, охватывает обычные фармацевтические формы пролекарств.
[0048] В другом варианте осуществления изобретение также предоставляет фармацевтическую композицию, включающую ингибитор PDE1 в комбинации с противоопухолевым средством, каждый в свободной форме или в форме фармацевтически приемлемой соли, в смеси с фармацевтически приемлемым носителем. Термин “комбинация”, в контексте настоящей заявки, охватывает одновременное, последовательное или совпадающее по времени введение ингибитора PDE1 и противоопухолевого средства. В другом варианте осуществления изобретение предоставляет фармацевтическую композицию, содержащую такое соединение. В некоторых вариантах осуществления комбинация ингибитора PDE1 и противоопухолевого средства позволяет вводить противоопухолевое средство в более низкой дозе, чем та, которая была бы эффективна при введении в качестве единственной монотерапии.
Способы применения соединений по настоящему изобретению
[0049] В другом варианте осуществления настоящая заявка предоставляет способ (Способ 1) лечения состояния, выбранного из рака или опухоли, включающий введение фармацевтически приемлемого количества ингибитора PDE1 (т.е. ингибитора PDE1 в соответствии с Формулой I, Ia, II, III и/или IV) нуждающемуся в этом субъекту.
1.1 Способ 1, где рак или опухоль характеризуются повышенной экспрессией PDE1 по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
1.2 Любой предшествующий способ, где рак или опухоль характеризуются повышенной экспрессией PDE1C по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
1.3 Любой из предшествующих способов, где раковые клетки демонстрируют одно или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки.
1.4 Любой предшествующий способ, где состояние представляет собой опухоль.
1.5 Любой предшествующий способ, где опухоль выбрана из одной или более из акустической невриномы, астроцитомы, хордомы, лимфомы ЦНС, краниофарингиомы, глиом (например, глиомы ствола головного мозга, эпендимомы, смешанной глиомы, глиомы зрительного нерва), субэпендимомы, медуллобластомы, менингиомы, метастатических опухолей головного мозга, олигодендроглиомы, опухолей гипофиза, примитивной нейроэктодермальной опухоли (PNET), шванномы, аденом (например, базофильной аденомы, эозинофильной аденомы, хромофобной аденомы, аденомы паращитовидной железы, островковой аденомы, фиброаденомы), фибромиом (фиброзной гистиоцитомы), фибром, гемангиом, липом (например, ангиолипомы, миелолипомы, фибролипомы, веретеноклеточной липомы, гиберномы, атипичной липомы), миксомы, остеомы, предлейкоза, радомиомы, папилломы, себорейного кератоза, кожных аднексальных опухолей, аденом печени, тубулярной аденомы почек, аденомы желчного протока, переходно-клеточной папилломы, хорионаденом, ганглионевромы, менингомы, неврилеммомы, нейрофибромы, С-клеточной гиперплазии, феохромоцитомы, инсулиномы, гастриномы, карциноидов, хемодэктомы, параганглиомы, невуса, актинического кератоза, дисплазии шейки матки, метаплазии (например, метаплазии легкого), лейкоплакии, гемангиомы, лимфангиомы, карциномы (например, плоскоклеточной карциномы, эпидермоидной карциномы, аденокарциномы, гепатомы, гепатоцеллюлярной карциномы, почечно-клеточной карциномы, холангиокарциномы, переходно-клеточной карциномы, карциномы эмбриональных клеток, карциномы паращитовидной железы, медуллярной карциномы щитовидной железы, карциномы бронхов, карциномы овсяных клеток, карциномы островковых клеток, злокачественного карциноида), саркомы (например, фибросаркомы, миксосаркомы, липосаркомы, хондросаркомы, остеосаркомы, злокачественной фиброзной гистиоцитомы, гемангиосаркомы, ангиосаркомы, лимфангиосаркомы, лейомиосаркомы, рабдомиосаркомы, нейрофибросаркомы), бластомы (например, медуллобластомы и глиобластомы, типов опухоли головного мозга, ретинобластомы, опухоли сетчатки глаза, остеобластомы, костных опухолей, нейробластомы), герминогенной опухоли, мезотелиомы, злокачественных кожных аднексальных опухолей, гипернефромы, семиномы, глиомы, злокачественной менингиомы, злокачественной шванномы, злокачественной феохромоцитомы, злокачественной параганглиомы, меланомы, опухоли из клеток Меркеля, филлоидных цистосарком или опухоли Вильмса.
1.6 Любой предшествующий способ, где состояние представляет собой глиому, остеосаркому, меланому, лейкоз или нейробластому.
1.7 Любой предшествующий способ, где состояние представляет собой глиому (например, эпендимому, астроцитому, олигодендроглиому, глиому ствола головного мозга, глиому зрительного нерва или смешанные глиомы, например, олигоастроцитомы).
1.8 Способ 1.6, где глиома представляет собой астроцитому (например, мультиформную глиобластому).
1.9 Любой предшествующий способ, где состояние представляет собой мультиформную глиобластому.
1.10 Любой из способов 1-1.2, где состояние представляет собой рак.
1.11 Любой из способов 1-1.2 или 1.10, где состояние представляет собой лейкоз.
1.12 Способ 1.11, где лейкоз представляет собой лимфолейкоз или миелогенный лейкоз.
1.13 Любой предшествующий способ, дополнительно включающий стадию введения пациенту противоопухолевого средства.
1.14 Способ 1.13, где противоопухолевое средство вводят одновременно с ингибитором PDE1.
1.15 Способ 1.13, где противоопухолевое средство вводят до введения ингибитора PDE1.
1.16 Способ 1.13, где противоопухолевое средство вводят после введения ингибитора PDE1.
1.17 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят с лучевой терапией или химиотерапией.
1.18 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят одновременно с лучевой терапией или химиотерапией.
1.19 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят перед лучевой терапией или химиотерапией.
1.20 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят после лучевой терапии или химиотерапии.
1.21 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим и/или иммунологическим лечением.
1.22 Любой из предшествующих способов, где введение ингибитора PDE1 эффективно для индукции в раковых или опухолевых клетках одного или более из следующего: апоптотическая гибель клеток, ингибирование миграции, ингибирование метастазирования и/или уменьшение воспаления.
1.23 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим, иммунологическим лечением, кортикостероидом и/или антигистаминным средством.
1.24 Любой из предшествующих способов, где рак или опухоль опосредованы PDE.
1.25 Любой из предшествующих способов, где рак или опухоль опосредованы PDE1.
1.26 Любой из предшествующих способов, где рак или опухоль опосредованы PDE1C.
1.27 Любой из предшествующих способов, где рак или опухоль характеризуется потерей кальций/кальмодулинового контроля.
1.28 Любой из предшествующих способов, где ферменты PDE1 в раковых или опухолевых клетках претерпели структурное изменение, которое изменяет контроль PDE1 активности кальцием/кальмодулином.
[0050] Настоящее изобретение также предоставляет ингибитор PDE1 для применения в способе лечения состояния, выбранного из рака или опухоли, например, для применения в любом из способов 1 и последующих.
[0051] Настоящее изобретение также предоставляет применение ингибитора PDE1 для получения лекарственного средства для применения в способе лечения состояния, выбранного из рака или опухоли, например, лекарственного средства для применения в любом из способов 1 и последующих.
[0052] Настоящее изобретение также предоставляет фармацевтическую композицию, включающую ингибитор PDE1, например, любое из соединений формулы I, Ia, II, III и/или IV, для применения в любом из способов 1 и последующих.
[0053] В другом варианте осуществления настоящая заявка предоставляет способ (Способ 2) ингибирования пролиферации, миграции и/или инвазии раковых или опухолевых клеток, включающий введение фармацевтически приемлемого количества ингибитора PDE1 (т.е. ингибитора PDE1 в соответствии с Формулой I, Ia, II, III и/или IV) нуждающемуся в этом субъекту.
2.1 Способ 2, где способ предназначен для ингибирования пролиферации раковых или опухолевых клеток.
2.2 Любой предшествующий способ, где раковые или опухолевые клетки характеризуются повышенной экспрессией PDE1 по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
2.3 Любой предшествующий способ, где раковые или опухолевые клетки характеризуются повышенной экспрессией PDE1C по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
2.4 Любой из предшествующих способов, где раковые клетки демонстрируют одно или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например, микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки.
2.5 Любой предшествующий способ, где состояние представляет собой опухоль.
2.6 Любой предшествующий способ, где опухоль выбрана из одной или более из акустической невриномы, астроцитомы, хордомы, лимфомы ЦНС, краниофарингиомы, глиом (например, глиомы ствола головного мозга, эпендимомы, смешанной глиомы, глиомы зрительного нерва), субэпендимомы, медуллобластомы, менингиомы, метастатических опухолей головного мозга, олигодендроглиомы, опухолей гипофиза, примитивной нейроэктодермальной опухоли (PNET), шванномы, аденом (например, базофильной аденомы, эозинофильной аденомы, хромофобной аденомы, аденомы паращитовидной железы, островковой аденомы, фиброаденомы), фибромиом (фиброзной гистиоцитомы), фибром, гемангиом, липом (например, ангиолипомы, миелолипомы, фибролипомы, веретеноклеточной липомы, гиберномы, атипичной липомы), миксомы, остеомы, предлейкоза, радомиомы, папилломы, себорейного кератоза, кожных аднексальных опухолей, аденом печени, тубулярной аденомы почек, аденомы желчного протока, переходно-клеточной папилломы, хорионаденом, ганглионевромы, менингомы, неврилеммомы, нейрофибромы, С-клеточной гиперплазии, феохромоцитомы, инсулиномы, гастриномы, карциноидов, хемодэктомы, параганглиомы, невуса, актинического кератоза, дисплазии шейки матки, метаплазии (например, метаплазии легкого), лейкоплакии, гемангиомы, лимфангиомы, карциномы (например, плоскоклеточной карциномы, эпидермоидной карциномы, аденокарциномы, гепатомы, гепатоцеллюлярной карциномы, почечно-клеточной карциномы, холангиокарциномы, переходно-клеточной карциномы, карциномы эмбриональных клеток, карциномы паращитовидной железы, медуллярной карциномы щитовидной железы, карциномы бронхов, карциномы овсяных клеток, карциномы островковых клеток, злокачественного карциноида), саркомы (например, фибросаркомы, миксосаркомы, липосаркомы, хондросаркомы, остеосаркомы, злокачественной фиброзной гистиоцитомы, гемангиосаркомы, ангиосаркомы, лимфангиосаркомы, лейомиосаркомы, рабдомиосаркомы, нейрофибросаркомы), бластомы (например, медуллобластомы и глиобластомы, типов опухоли головного мозга, ретинобластомы, опухоли сетчатки глаза, остеобластомы, костных опухолей, нейробластомы), герминогенной опухоли, мезотелиомы, злокачественных кожных аднексальных опухолей, гипернефромы, семиномы, глиомы, злокачественной менингиомы, злокачественной шванномы, злокачественной феохромоцитомы, злокачественной параганглиомы, меланомы, опухоли из клеток Меркеля, филлоидных цистосарком или опухоли Вильмса.
2.7 Любой предшествующий способ, где состояние представляет собой глиому, остеосаркому, меланому, лейкоз или нейробластому.
2.8 Любой предшествующий способ, где состояние представляет собой глиому (например, эпендимому, астроцитому, олигодендроглиому, глиому ствола головного мозга, глиому зрительного нерва или смешанные глиомы, например, олигоастроцитомы).
2.9 Способ 2.5, где глиома представляет собой астроцитому (например, мультиформную глиобластому).
2.10 Любой предшествующий способ, где состояние представляет собой мультиформную глиобластому.
2.11 Любой из способов 2-2.3, где состояние представляет собой рак.
2.12 Любой из способов 2-2.3 или 2.11, где состояние представляет собой лейкоз.
2.13 Способ 2.11, где лейкоз представляет собой лимфолейкоз или миелогенный лейкоз.
2.14 Любой предшествующий способ, дополнительно включающий стадию введения пациенту противоопухолевого средства.
2.15 Способ 2.14, где противоопухолевое средство вводят одновременно с ингибитором PDE1.
2.16 Способ 2.14, где противоопухолевое средство вводят до введения ингибитора PDE1.
2.17 Способ 2.14, где противоопухолевое средство вводят после введения ингибитора PDE1.
2.18 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят с лучевой терапией или химиотерапией.
2.19 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят одновременно с лучевой терапией или химиотерапией.
2.20 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят перед лучевой терапией или химиотерапией.
2.21 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят после лучевой терапии или химиотерапии.
2.22 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим и/или иммунологическим лечением.
2.23 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим, иммунологическим лечением, кортикостероидом и/или антигистаминным средством.
2.24 Любой из предшествующих способов, где рак или опухоль опосредованы PDE.
2.25 Любой из предшествующих способов, где рак или опухоль опосредованы PDE1.
2.26 Любой из предшествующих способов, где рак или опухоль опосредованы PDE1C.
2.27 Любой из предшествующих способов, где рак или опухоль характеризуется потерей кальций/кальмодулинового контроля.
2.28 Любой из предшествующих способов, где ферменты PDE1 в раковых или опухолевых клетках претерпели структурное изменение, которое изменяет контроль PDE1 активности кальцием/кальмодулином.
2.29 Любой из предшествующих способов, дополнительно включающий стадию оценки у субъекта степени чувствительности к кальцию/кальмодулину в экспрессированной PDE1, восстановления уровней циклических нуклеотидов, экспрессии РНК PDE1 или мутации гена PDE1.
[0054] Настоящее изобретение также предоставляет ингибитор PDE1 для применения в способе для ингибирования пролиферации, миграции и/или инвазии раковых или опухолевых клеток, например, для применения в любом из способов 2 и последующих.
[0055] Настоящее изобретение также предоставляет применение ингибитора PDE1 для получения лекарственного средства для применения в способе ингибирования пролиферации, миграции и/или инвазии раковых или опухолевых клеток, например, лекарственного средства для применения в любом из способов 2 и последующих.
[0056] Настоящее изобретение также предоставляет фармацевтическую композицию, включающую ингибитор PDE1, например, любое из соединений формулы I, Ia, II, III и/или IV, для применения в любом из способов 2 и последующих.
[0057] В другом варианте осуществления настоящая заявка предоставляет способ (Способ 3) лечения глиомы, включающий введение фармацевтически приемлемого количества ингибитора PDE1 (т.е. ингибитора PDE1 в соответствии с Формулой I, Ia, II, III и/или IV) нуждающемуся в этом субъекту.
3.1 Способ 3, где глиома характеризуется повышенной экспрессией PDE1 по сравнению с нормальными клетками того же типа ткани, что и пораженные глиальные клетки.
3.2 Любой предшествующий способ, где глиома характеризуется повышенной экспрессией PDE1C по сравнению с нормальными клетками того же типа ткани, что и пораженные глиальные клетки.
3.3 Любой из предшествующих способов, где глиома характеризуется одним или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки.
3.4 Любой предшествующий способ, где глиома представляет собой астроцитому (например, мультиформную глиобластому).
3.5 Любой предшествующий способ, где состояние представляет собой мультиформную глиобластому.
3.6 Любой предшествующий способ, дополнительно включающий стадию введения пациенту противоопухолевого средства.
3.7 Способ 3.6, где противоопухолевое средство вводят одновременно с ингибитором PDE1.
3.8 Способ 3.6, где противоопухолевое средство вводят до введения ингибитора PDE1.
3.9 Способ 3.6, где противоопухолевое средство вводят после введения ингибитора PDE1.
3.10 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят с лучевой терапией или химиотерапией.
3.11 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят одновременно с лучевой терапией или химиотерапией.
3.12 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят перед лучевой терапией или химиотерапией.
3.13 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят после лучевой терапии или химиотерапии.
3.14 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим и/или иммунологическим лечением.
3.15 Любой из предшествующих способов, где введение ингибитора PDE1 эффективно для индукции в глиоме одного или более из следующих: апоптотическая гибель клеток, ингибирование миграции, ингибирование метастазирования и/или уменьшение воспаления.
3.16 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим, иммунологическим лечением, кортикостероидом и/или антигистаминным средством.
3.17 Любой из предшествующих способов, где глиома опосредована PDE.
3.18 Любой из предшествующих способов, где глиома опосредована PDE1.
3.19 Любой из предшествующих способов, где глиома опосредована PDE1C.
3.20 Любой из предшествующих способов, где глиома характеризуется потерей кальций/кальмодулинового контроля.
3.21 Любой из предшествующих способов, где ферменты PDE1 в клетках глиомы претерпели структурное изменение, которое изменяет контроль PDE1 активности кальцием/кальмодулином.
[0058] Настоящее изобретение также предоставляет ингибитор PDE1 для применения в способе для лечения глиомы, например, для применения в любом из способов 3 и последующих.
[0059] Настоящее изобретение также предоставляет применение ингибитора PDE1 для получения лекарственного средства для применения в способе лечения глиомы, например, лекарственного средства для применения в любом из способов 3 и последующих.
[0060] Настоящее изобретение также предоставляет фармацевтическую композицию, включающую ингибитор PDE1, например, любое из соединений формулы I, Ia, II, III и/или IV, для применения в любом из способов 4 и последующих.
[0061] В другом варианте осуществления настоящая заявка предоставляет способ (Способ 4) лечения рака у пациента, где раковые клетки имеют повышенную активность или экспрессию PDE1, например, где раковые клетки демонстрируют одно или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки, включающий введение пациенту эффективного количества ингибитора PDE1 (т.е. ингибитора PDE1 в соответствии с Формулой I, Ia, II, III и/или IV) отдельно или в комбинации с химиотерапевтическими средствами, генными терапевтическими средствами и/или иммунологическими методами лечения нуждающегося в этом субъекта.
4.1 Способ 4, где способ предназначен для ингибирования пролиферации раковых или опухолевых клеток.
4.2 Любой предшествующий способ, где раковые или опухолевые клетки характеризуются повышенной экспрессией или активностью PDE1 по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
4.3 Любой предшествующий способ, где раковые или опухолевые клетки характеризуются повышенной экспрессией PDE1C по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
4.4 Любой из предшествующих способов, где раковые клетки демонстрируют одно или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки.
4.5 Любой предшествующий способ, где состояние представляет собой опухоль.
4.6 Любой предшествующий способ, где опухоль выбрана из одной или более из акустической невриномы, астроцитомы, хордомы, лимфомы ЦНС, краниофарингиомы, глиом (например, глиомы ствола головного мозга, эпендимомы, смешанной глиомы, глиомы зрительного нерва), субэпендимомы, медуллобластомы, менингиомы, метастатических опухолей головного мозга, олигодендроглиомы, опухолей гипофиза, примитивной нейроэктодермальной опухоли (PNET), шванномы, аденом (например, базофильной аденомы, эозинофильной аденомы, хромофобной аденомы, аденомы паращитовидной железы, островковой аденомы, фиброаденомы), фибромиом (фиброзной гистиоцитомы), фибром, гемангиом, липом (например, ангиолипомы, миелолипомы, фибролипомы, веретеноклеточной липомы, гиберномы, атипичной липомы), миксомы, остеомы, предлейкоза, радомиомы, папилломы, себорейного кератоза, кожных аднексальных опухолей, аденом печени, тубулярной аденомы почек, аденомы желчного протока, переходно-клеточной папилломы, хорионаденом, ганглионевромы, менингомы, неврилеммомы, нейрофибромы, С-клеточной гиперплазии, феохромоцитомы, инсулиномы, гастриномы, карциноидов, хемодэктомы, параганглиомы, невуса, актинического кератоза, дисплазии шейки матки, метаплазии (например, метаплазии легкого), лейкоплакии, гемангиомы, лимфангиомы, карциномы (например, плоскоклеточной карциномы, эпидермоидной карциномы, аденокарциномы, гепатомы, гепатоцеллюлярной карциномы, почечно-клеточной карциномы, холангиокарциномы, переходно-клеточной карциномы, карциномы эмбриональных клеток, карциномы паращитовидной железы, медуллярной карциномы щитовидной железы, карциномы бронхов, карциномы овсяных клеток, карциномы островковых клеток, злокачественного карциноида), саркомы (например, фибросаркомы, миксосаркомы, липосаркомы, хондросаркомы, остеосаркомы, злокачественной фиброзной гистиоцитомы, гемангиосаркомы, ангиосаркомы, лимфангиосаркомы, лейомиосаркомы, рабдомиосаркомы, нейрофибросаркомы), бластомы (например, медуллобластомы и глиобластомы, типов опухоли головного мозга, ретинобластомы, опухоли сетчатки глаза, остеобластомы, костных опухолей, нейробластомы), герминогенной опухоли, мезотелиомы, злокачественных кожных аднексальных опухолей, гипернефромы, семиномы, глиомы, злокачественной менингиомы, злокачественной шванномы, злокачественной феохромоцитомы, злокачественной параганглиомы, меланомы, опухоли из клеток Меркеля, филлоидных цистосарком или опухоли Вильмса.
4.7 Любой предшествующий способ, где состояние представляет собой глиому, остеосаркому, меланому, лейкоз или нейробластому.
4.8 Любой предшествующий способ, где состояние представляет собой глиому (например, эпендимому, астроцитому, олигодендроглиому, глиому ствола головного мозга, глиому зрительного нерва или смешанные глиомы, например, олигоастроцитомы).
4.9 Способ 4.8, где глиома представляет собой астроцитому (например, мультиформную глиобластому).
4.10 Любой предшествующий способ, где состояние представляет собой мультиформную глиобластому.
4.11 Любой из способов 4-4.3, где состояние представляет собой рак.
4.12 Любой из способов 4-4.3 или 4.11, где состояние представляет собой лейкоз.
4.13 Способ 4.12, где лейкоз представляет собой лимфолейкоз или миелогенный лейкоз.
4.14 Любой предшествующий способ, дополнительно включающий стадию введения пациенту противоопухолевого средства.
4.15 Способ 4.14, где противоопухолевое средство вводят одновременно с ингибитором PDE1.
4.16 Способ 4.14, где противоопухолевое средство вводят до введения ингибитора PDE1.
4.17 Способ 4.14, где противоопухолевое средство вводят после введения ингибитора PDE1.
4.18 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят с лучевой терапией или химиотерапией.
4.19 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят одновременно с лучевой терапией или химиотерапией.
4.20 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят перед лучевой терапией или химиотерапией.
4.21 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят после лучевой терапии или химиотерапии.
4.22 Любой из предшествующих способов, где введение ингибитора PDE1 эффективно для индукции в раковых клетках одного или более из следующего: апоптотическая гибель клеток, ингибирование миграции, ингибирование метастазирования и/или уменьшение воспаления.
4.23 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим, иммунологическим лечением, кортикостероидом и/или антигистаминным средством.
4.24 Любой из предшествующих способов, где рак или опухоль опосредованы PDE.
4.25 Любой из предшествующих способов, где рак или опухоль опосредованы PDE1.
4.26 Любой из предшествующих способов, где рак или опухоль опосредованы PDE1C.
4.27 Любой из предшествующих способов, где рак характеризуется потерей кальций/кальмодулинового контроля.
4.28 Любой из предшествующих способов, где ферменты PDE1 в раковых клетках претерпели структурное изменение, которое изменяет контроль PDE1 активности кальцием/кальмодулином.
[0062] Настоящее изобретение также предоставляет ингибитор PDE1 для применения в способе лечения рака у пациента, где раковые клетки имеют повышенную активность или экспрессию PDE1, например, где раковые клетки демонстрируют одно или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например, микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки, например, для применения в любом из способов 4 и последующих.
[0063] Настоящее изобретение также предоставляет применение ингибитора PDE1 для получения лекарственного средства для применения в способе лечения рака у пациента, где раковые клетки имеют повышенную активность или экспрессию PDE1, например, где раковые клетки демонстрируют одно или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1), потери контроля кальций/кальмодулин, фермент становится конститутивно активным, или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки, например, лекарственного средства для применения в любом из способов 4 и последующих.
[0064] Настоящее изобретение также предоставляет фармацевтическую композицию, содержащую ингибитор PDE1, например, любое из соединений формулы I, Ia, II, III и/или IV, для применения в любом из способов 4 и последующих.
[0065] В другом варианте осуществления настоящая заявка предоставляет способ (Способ 5) ингибирования синдрома высвобождения цитокинов, включающий введение эффективного количества ингибитора PDE1 нуждающемуся в этом пациенту, например, где пациент страдает от рака и получает одно или более из химиотерапевтического лечения, иммунологического лечения, генной терапии и/или терапии антителами (включая антитела, направленные на раковые антигены и/или антитела к мишеням иммунных контрольных точек), и где способ необязательно дополнительно включает введение пациенту кортикостероидов и/или антигистаминных препаратов.
5.1 Способ 5, где пациент страдает от рака.
5.2 Любой предшествующий способ, где раковые или опухолевые клетки характеризуются повышенной экспрессией или активностью PDE1 по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
5.3 Любой предшествующий способ, где раковые или опухолевые клетки характеризуются повышенной экспрессией PDE1C по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
5.4 Любой из способов 5.1-5.3, где раковые клетки демонстрируют одно или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки.
5.5 Любой предшествующий способ, где пациент страдает от опухоли.
5.6 Любой предшествующий способ, где пациент страдает от опухоли, выбранной из одной или более из акустической невриномы, астроцитомы, хордомы, лимфомы ЦНС, краниофарингиомы, глиом (например, глиомы ствола головного мозга, эпендимомы, смешанной глиомы, глиомы зрительного нерва), субэпендимомы, медуллобластомы, менингиомы, метастатических опухолей головного мозга, олигодендроглиомы, опухолей гипофиза, примитивной нейроэктодермальной опухоли (PNET), шванномы, аденом (например, базофильной аденомы, эозинофильной аденомы, хромофобной аденомы, аденомы паращитовидной железы, островковой аденомы, фиброаденомы), фибромиом (фиброзной гистиоцитомы), фибром, гемангиом, липом (например, ангиолипомы, миелолипомы, фибролипомы, веретеноклеточной липомы, гиберномы, атипичной липомы), миксомы, остеомы, предлейкоза, радомиомы, папилломы, себорейного кератоза, кожных аднексальных опухолей, аденом печени, тубулярной аденомы почек, аденомы желчного протока, переходно-клеточной папилломы, хорионаденом, ганглионевромы, менингомы, неврилеммомы, нейрофибромы, С-клеточной гиперплазии, феохромоцитомы, инсулиномы, гастриномы, карциноидов, хемодэктомы, параганглиомы, невуса, актинического кератоза, дисплазии шейки матки, метаплазии (например, метаплазии легкого), лейкоплакии, гемангиомы, лимфангиомы, карциномы (например, плоскоклеточной карциномы, эпидермоидной карциномы, аденокарциномы, гепатомы, гепатоцеллюлярной карциномы, почечно-клеточной карциномы, холангиокарциномы, переходно-клеточной карциномы, карциномы эмбриональных клеток, карциномы паращитовидной железы, медуллярной карциномы щитовидной железы, карциномы бронхов, карциномы овсяных клеток, карциномы островковых клеток, злокачественного карциноида), саркомы (например, фибросаркомы, миксосаркомы, липосаркомы, хондросаркомы, остеосаркомы, злокачественной фиброзной гистиоцитомы, гемангиосаркомы, ангиосаркомы, лимфангиосаркомы, лейомиосаркомы, рабдомиосаркомы, нейрофибросаркомы), бластомы (например, медуллобластомы и глиобластомы, типов опухоли головного мозга, ретинобластомы, опухоли сетчатки глаза, остеобластомы, костных опухолей, нейробластомы), герминогенной опухоли, мезотелиомы, злокачественных кожных аднексальных опухолей, гипернефромы, семиномы, глиомы, злокачественной менингиомы, злокачественной шванномы, злокачественной феохромоцитомы, злокачественной параганглиомы, меланомы, опухоли из клеток Меркеля, филлоидных цистосарком или опухоли Вильмса.
5.7 Любой предшествующий способ, где пациент страдает от глиомы, остеосаркомы, меланомы, лейкоза или нейробластомы.
5.8 Любой предшествующий способ, где пациент страдает от глиомы (например, эпендимомы, астроцитомы, олигодендроглиомы, глиомы ствола головного мозга, глиомы зрительного нерва или смешанных глиом, например, олигоастроцитом).
5.9 Способ 5.8, где пациент страдает от астроцитомы (например, мультиформной глиобластомы).
5.10 Любой предшествующий способ, где пациент страдает от мультиформной глиобластомы.
5.11 Любой предшествующий способ, где пациент страдает от рака.
5.12 Любой предшествующий способ, где пациент страдает от лейкоза.
5.13 Способ 5.12, где лейкоз представляет собой лимфолейкоз или миелогенный лейкоз.
5.14 Любой предшествующий способ, дополнительно включающий стадию введения пациенту противоопухолевого средства.
5.15 Способ 5.14, где противоопухолевое средство вводят одновременно с ингибитором PDE1.
5.16 Способ 5.14, где противоопухолевое средство вводят до введения ингибитора PDE1.
5.17 Способ 5.14, где противоопухолевое средство вводят после введения ингибитора PDE1.
5.18 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят с лучевой терапией или химиотерапией.
5.19 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят одновременно с лучевой терапией или химиотерапией.
5.20 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят перед лучевой терапией или химиотерапией.
5.21 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят после лучевой терапии или химиотерапии.
5.22 Любой из предшествующих способов, где указанный выше способ, в котором введение ингибитора PDE1 эффективно для индукции в раковых клетках одного или более из следующего: апоптотическая гибель клеток, ингибирование миграции, ингибирование метастазирования и/или уменьшение воспаления.
5.23 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим, иммунологическим лечением, кортикостероидом и/или антигистаминным средством.
5.24 Любой из способов 5.1-5.23, где рак или опухоль опосредованы PDE.
5.25 Любой из способов 5.1-5.24, где рак или опухоль опосредованы PDE1.
5.26 Любой из способов 5.1-5.25, где рак или опухоль опосредованы PDE1C.
5.27 Любой из способов 5.1-5.26, где рак или опухоль характеризуется потерей кальций/кальмодулинового контроля.
5.28 Любой из способов 5.1-5.26, где ферменты PDE1 в раковых или опухолевых клетках претерпели структурное изменение, которое изменяет контроль PDE1 активности кальцием/кальмодулином.
[0066] Настоящее изобретение также предоставляет ингибитор PDE1 для применения в способе ингибирования синдрома высвобождения цитокинов, например, для применения в любом из способов 5 и последующих.
[0067] Настоящее изобретение также предоставляет применение ингибитора PDE1 для получения лекарственного средства для применения в способе ингибирования синдрома высвобождения цитокинов, например, лекарственного средства для применения в любом из способов 5 и последующих.
[0068] Настоящее изобретение также предоставляет фармацевтическую композицию, включающую ингибитор PDE1, например, любое из соединений формулы I, Ia, II, III и/или IV, для применения в любом из способов 5 и последующих.
[0069] В другом варианте осуществления настоящая заявка предоставляет способ (Способ 6) лечения рака или опухоли, характеризующихся конститутивно активной PDE1, при этом способ включает введение эффективного количества ингибитора PDE1 (т.е. ингибитора PDE1 в соответствии с Формулой I, Ia, II, III и/или IV) нуждающемуся в этом пациенту.
6.1 Способ 6, где PDE1 в раковых или опухолевых клетках стал независимым от опосредования Ca2+/кальмодулином.
6.2 Способ 6 или 6.1, где PDE1 представляет собой PDE1A.
6.3 Способ 6 или 6.1, где PDE1 представляет собой PDE1B.
6.4 Способ 6 или 6.1, где PDE1 представляет собой PDE1C.
6.5 Любой предшествующий способ, где рак или опухоль характеризуются повышенной экспрессией PDE1 по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
6.6 Любой предшествующий способ, где рак или опухоль характеризуются повышенной экспрессией PDE1C по сравнению с нормальными клетками того же типа ткани, что и раковые или опухолевые клетки.
6.7 Любой из предшествующих способов, где рак или опухоль характеризуется одним или более из повышенной экспрессии РНК PDE1, числа копий ДНК, связывания PDE1 (например, ПЭТ или удержание радиоизотопов в молекулах ингибиторов PDE1) или ферментативной активности PDE1 (например, как измерено в ферментативном анализе или как отражено в низких уровнях cAMP в раковых клетках или субклеточном домене, например микротрубочковых доменах, раковых клеток) по сравнению с нормальными клетками того же типа ткани, что и раковые клетки.
6.8 Любой предшествующий способ, где состояние представляет собой опухоль.
6.9 Любой предшествующий способ, где опухоль выбрана из одной или более из акустической невриномы, астроцитомы, хордомы, лимфомы ЦНС, краниофарингиомы, глиом (например, глиомы ствола головного мозга, эпендимомы, смешанной глиомы, глиомы зрительного нерва), субэпендимомы, медуллобластомы, менингиомы, метастатических опухолей головного мозга, олигодендроглиомы, опухолей гипофиза, примитивной нейроэктодермальной опухоли (PNET), шванномы, аденом (например, базофильной аденомы, эозинофильной аденомы, хромофобной аденомы, аденомы паращитовидной железы, островковой аденомы, фиброаденомы), фибромиом (фиброзной гистиоцитомы), фибром, гемангиом, липом (например, ангиолипомы, миелолипомы, фибролипомы, веретеноклеточной липомы, гиберномы, атипичной липомы), миксомы, остеомы, предлейкоза, радомиомы, папилломы, себорейного кератоза, кожных аднексальных опухолей, аденом печени, тубулярной аденомы почек, аденомы желчного протока, переходно-клеточной папилломы, хорионаденом, ганглионевромы, менингомы, неврилеммомы, нейрофибромы, С-клеточной гиперплазии, феохромоцитомы, инсулиномы, гастриномы, карциноидов, хемодэктомы, параганглиомы, невуса, актинического кератоза, дисплазии шейки матки, метаплазии (например, метаплазии легкого), лейкоплакии, гемангиомы, лимфангиомы, карциномы (например, плоскоклеточной карциномы, эпидермоидной карциномы, аденокарциномы, гепатомы, гепатоцеллюлярной карциномы, почечно-клеточной карциномы, холангиокарциномы, переходно-клеточной карциномы, карциномы эмбриональных клеток, карциномы паращитовидной железы, медуллярной карциномы щитовидной железы, карциномы бронхов, карциномы овсяных клеток, карциномы островковых клеток, злокачественного карциноида), саркомы (например, фибросаркомы, миксосаркомы, липосаркомы, хондросаркомы, остеосаркомы, злокачественной фиброзной гистиоцитомы, гемангиосаркомы, ангиосаркомы, лимфангиосаркомы, лейомиосаркомы, рабдомиосаркомы, нейрофибросаркомы), бластомы (например, медуллобластомы и глиобластомы, типов опухоли головного мозга, ретинобластомы, опухоли сетчатки глаза, остеобластомы, костных опухолей, нейробластомы), герминогенной опухоли, мезотелиомы, злокачественных кожных аднексальных опухолей, гипернефромы, семиномы, глиомы, злокачественной менингиомы, злокачественной шванномы, злокачественной феохромоцитомы, злокачественной параганглиомы, меланомы, опухоли из клеток Меркеля, филлоидных цистосарком или опухоли Вильмса.
6.10 Любой предшествующий способ, где состояние представляет собой глиому, остеосаркому, меланому, лейкоз или нейробластому.
6.11 Любой предшествующий способ, где состояние представляет собой глиому (например, эпендимому, астроцитому, олигодендроглиому, глиому ствола головного мозга, глиому зрительного нерва или смешанные глиомы, например, олигоастроцитомы).
6.12 Предшествующий способ, где глиома представляет собой астроцитому (например, мультиформную глиобластому).
6.13 Любой предшествующий способ, где состояние представляет собой мультиформную глиобластому.
6.14 Любой предшествующий способ, где состояние представляет собой мультиформную глиобластому, характеризующуюся присутствием конститутивно активной PDE1 (например, PDE1C).
6.15 Любой из способов 6-6.7, где состояние представляет собой рак.
6.16 Любой из способов 6-6.7 или 6.15, где состояние представляет собой лейкоз.
6.17 Предшествующий способ, где лейкоз представляет собой лимфолейкоз или миелогенный лейкоз.
6.18 Любой предшествующий способ, дополнительно включающий стадию введения пациенту противоопухолевого средства.
6.19 Способ 6.18, где противоопухолевое средство вводят одновременно с ингибитором PDE1.
6.20 Способ 6.18, где противоопухолевое средство вводят до введения ингибитора PDE1.
6.21 Способ 6.18, где противоопухолевое средство вводят после введения ингибитора PDE1.
6.22 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят с лучевой терапией или химиотерапией.
6.23 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят одновременно с лучевой терапией или химиотерапией.
6.24 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят перед лучевой терапией или химиотерапией.
6.25 Любой из предшествующих способов, где ингибитор PDE1 и, необязательно, противоопухолевое средство вводят после лучевой терапии или химиотерапии.
6.26 Любой из предшествующих способов, где ингибитор PDE1 вводят вместе с противоопухолевым средством, химиотерапевтическим, геннотерапевтическим и/или иммунологическим лечением.
6.27 Любой из предшествующих способов, где рак или опухоль опосредованы PDE.
6.28 Любой из предшествующих способов, где рак или опухоль опосредованы PDE1.
6.29 Любой из предшествующих способов, где рак или опухоль опосредованы PDE1C.
6.30 Любой из предшествующих способов, где рак или опухоль характеризуется потерей кальций/кальмодулинового контроля.
6.31 Любой из предшествующих способов, где ферменты PDE1 в раковых или опухолевых клетках претерпели структурное изменение, которое изменяет контроль PDE1 активности кальцием/кальмодулином.
[0070] Настоящее изобретение также предоставляет ингибитор PDE1 для применения в способе лечения рака или опухоли, характеризующихся конститутивно активной PDE1, например, для применения в любом из способов 6 и последующих.
[0071] Настоящее изобретение также предоставляет применение ингибитора PDE1 для получения лекарственного средства для применения в способе лечения рака или опухоли, характеризующихся конститутивно активной PDE1, например, лекарственного средства для применения в любом из способов 6 и последующих.
[0072] Настоящее изобретение также предоставляет фармацевтическую композицию, включающую ингибитор PDE1, например, любое из соединений формулы I, Ia, II, III и/или IV, для применения в любом из способов 6 и последующих.
[0073] В некоторых вариантах осуществления фармацевтические композиции вводят в комбинации с одним или более противоопухолевыми лекарственными средствами, например лекарственными средствами, которые известны как имеющие эффект при лечении или устранении различных типов рака и/или опухолей. Неограничивающими примерами противоопухолевых лекарственных средств являются Абемациклиб, Абиратерона ацетат, Абитрексат (Метотрексат), Абраксан (стабилизированный альбумином состав наночастиц паклитаксела), ABVD, ABVE, ABVE-PC, AC, Акалабрутиниб, AC-T, Адцетрис (Брентуксимаб ведотин), ADE, Адо-трастузумаб эмтанзин, Адриамицин (Доксорубицина гидрохлорид), Афатиниба дималеат, Афинитор (Эверолимус), Акинзео (Нетупитант и Палоносетрона гидрохлорид), Алдара (Имиквимод), Альдеслейкин, Алеценза (Алектиниб), Алектиниб, Алемтузумаб, Алимта (Пеметрексед динатрий), Аликопа (Копанлисиб гидрохлорид), Алкеран для инъекций (Мелфалан гидрохлорид), Алкеран таблетки (Мелфалан), Алокси (Палоносетрона гидрохлорид), Алунбриг (Бригатиниб), Амбохлорин (Хлорамбуцил), Амбоклорин (Хлорамбуцил), Амифостин, Аминолевулиновая кислота, Анастрозол, Апрепитант, Аредиа (Памидронат динатрия), Аримидекс (Анастрозол), Аромазин (Экземестан), Арранон (Неларабин), Триоксид мышьяка, Арзерра (Офатумумаб), Аспарагиназа Erwinia chrysanthemi, Атезолизумаб, Авастин (Бевацизумаб), Авелумаб, Аксикабтаген силолейсел, Акситиниб, Азацитидин, Бавенсио (Авелумаб), BEACOPP, Беценум (Кармустин), Белеодак (Белиностат), Белиностат, Бендамустина гидрохлорид, BEP, Беспонса (Инотузумаба озогамицин), Бевацизумаб, Бексаротен, Бикалутамид, BiCNU (Кармустин), Блеомицин, Блинатумомаб, Блинцито (Блинатумомаб), Бортезомиб, Босулиф (Бозутиниб), Бозутиниб, Брентуксимаб ведотин, Бригатиниб, BuMel, Бусульфан, Бусульфекс (Бусульфан), Кабазитаксел, Кабометикс (Кабозантиниб-S-малат), Кабозантиниб-S-малат, CAF, Калквенс (Акалабрутиниб), Кампат (Алемтузумаб), Камптозар (Иринотекана гидрохлорид), Капецитабин, CAPOX, Carac (Фторурацил--для местного применения), Карбоплатин, КАРБОПЛАТИН-ТАКСОЛ, Карфилзомиб, Кармубрис (Кармустин), Кармустин, Кармустина имплантат, Касодекс (Бикалутамид), CEM, Церитиниб, Церубидин (Даунорубицина гидрохлорид), Серварикс (рекомбинантная двухвалентная вакцина против ВПЧ), Цетуксимаб, CEV, Хлорамбуцил, ХЛОРАМБУЦИЛ-ПРЕДНИЗОН, CHOP, Цисплатин, Кладрибин, Клафен (Циклофосфамид), Клофарабин, Клорафекс (Клофарабин), Clolar (Клофарабин), CMF, Кобиметиниб, Кометрик (Кабозантиниб-S-малат), Копанлисиб гидрохлорид, COPDAC, COPP, COPP-ABV, Космеген (Дактиномицин), Котеллик (Кобиметиниб), Кризотиниб, CVP, Циклофосфамид, Цифос (Ифосфамид), Цирамза (Рамуцирумаб), Цитарабин, Цитарабин липосомальный, Цитозар-U (Цитарабин), Цитоксан (Циклофосфамид), Дабрафениб, Дакарбазин, Дакоген (Децитабин), Дактиномицин, Даратумумаб, Дарзалекс (Даратумумаб), Дазатиниб, Даунорубицина гидрохлорид, Даунорубицина гидрохлорид и Цитарабин липосомальный, Децитабин, Дефибротид натрия, Дефителио (Дефибротид натрия), Дегареликс, Денилейкин дифтитокс, Деносумаб, DepoCyt (Цитарабин липосомальный), Дексаметезон, Дексразоксана гидрохлорид, Динутуксимаб, Доцетаксел, Доксил (Доксорубицина гидрохлорид липосомальный), Доксорубицина гидрохлорид, Доксорубицина гидрохлорид липосомальный, Dox-SL (Доксорубицина гидрохлорид липосомальный), DTIC-Dome (Дакарбазин), Дурвалумаб, Эфудикс (Фторурацил--для местного применения), Элитек (Расбуриказа), Элленс (Эпирубицина гидрохлорид), Элотузумаб, Элоксатин (Оксалиплатин), Элтромбопаг оламина, Эменд (Апрепитант), Эмплисити (Элотузумаб), Энасидениба мезилат, Энзалутамид, Эпирубицина гидрохлорид, EPOCH, Эрбитукс (Цетуксимаб), Эрибулина мезилат, Эриведж (Висмодегиб), Эрлотиниб гидрохлорид, Эрвиназа (Аспарагиназа Erwinia chrysanthemi), Этиол (Амифостин), Этопофос (Этопозидфосфат), Этопозид, Этопозидфосфат, Эвацет (Доксорубицина гидрохлорид липосомальный), Эверолимус, Эвиста (Ралоксифен гидрохлорид), Эвомела (Мелфалан гидрохлорид), Экземестан, 5-FU (Фторурацил инъекция), 5-FU (Фторурацил--для местного применения), Фарестон (Торемифен), Фаридак (Панобиностат), Фазлодекс (Фулвестрант), FEC, Фемара (Летрозол), Филграстим, Флудара (Флударабин фосфат), Флударабин фосфат, Флюороплекс (Фторурацил--для местного применения), Фторурацил инъекция, Фторурацил-для местного применения, Флутамид, Фолекс (Метотрексат), Фолекс PFS (Метотрексат), FOLFIRI, FOLFIRI-Бевацизумаб, FOLFIRI-Цетуксимаб, Фолфиринокс, Фолфокс, Фолотин (Пралатрексат), FU-LV, Фулвестрант, Гардасил (четырехвалентная рекомбинантная вакцина против ВПЧ), Гардасил 9 (девятивалентная рекомбинантная вакцина против ВПЧ), Газива (Обинутузумаб), Гефитиниб, Гемцитабин гидрохлорид, Гемцитабин-Цисплатин, Гемцитабин-Оксалиплатин, Гемтузумаб озогамицин, Гемзар (Гемцитабин гидрохлорид), Гилотриф (Афатиниба дималеат), Гливек (Иматиниба мезилат), Глиадел (Кармустина имплантат), Глиадел вафли (Кармустина имплантат), Глюкарпидаза, Гозерелина ацетат, Халавен (Эрибулина мезилат), Гемангиол (Пропранолол гидрохлорид), Герцептин (Трастузумаб), Вакцина против вируса папилломы человека двухвалентная, рекомбинантная; Вакцина против вируса папилломы человека девятивалентная, рекомбинантная; Вакцина против вируса папилломы человека четырехвалентная, рекомбинантная; Гикамтин (Топотекан гидрохлорид), Гидреа (Гидроксимочевина), Гидроксимочевина, Hyper-CVAD, Ибранса (Палбоциклиб), Ибритутомаб тиуксетан, Ибрутиниб, ICE, Иклусиг (Понатиниб гидрохлорид), Идамицин (Идарубицин гидрохлорид), Идарубицин гидрохлорид, Иделалисиб, Айдхифа (Энасидениба мезилат), Ifex (Ифосфамид), Ифосфамид, Ifosfamidum (Ифосфамид), IL-2 (Альдеслейкин), Иматиниба мезилат, Имбрувика (Ибрутиниб), Имфинзи (Дурвалумаб), Имиквимод, Имлигик (Талимоген лагерпарепвек), Инлита (Акситиниб), Инотузумаба озогамицин, Интерферон альфа-2b рекомбинантный, Интерлейкин-2 (Альдеслейкин), Интрон A (Рекомбинантный интерферон альфа-2b), Ипилимумаб, Иресса (Гефитиниб), Иринотекана гидрохлорид, Иринотекана гидрохлорид липосомальный, Истодакс (Ромидепсин), Иксабепилон, Иксазомиба цитрат, Икземпра (Иксабепилон), Джакави (Руксолитиниб фосфат), JEB, Джевтана (Кабазитаксел), Кадсила (Адо-трастузумаб эмтанзин), Кеоксифен (Ралоксифен гидрохлорид), Кепиванс (Палифермин), Китруда (Пембролизумаб), Кискали (Рибоциклиб), Кимрия (Тисагенлеклейсел), Кипролис (Карфилзомиб), Ланреотид ацетат, Лапатиниба дитозилат, Лартруво (Оларатумаб), Леналидомид, Ленватиниб мезилат, Ленвима (Ленватиниб мезилат), Летрозол, Лейковорин кальция, Лейкеран (Хлорамбуцил), Лейпрорелина ацетат, Леустатин (Кладрибин), Левулан (Аминолевулиновая кислота), Линфолизин (Хлорамбуцил), Липодокс (Доксорубицина гидрохлорид липосомальный), Ломустин, Лонсурф (Трифлуридина и Типирацила гидрохлорид), Lupron (Лейпрорелина ацетат), Lupron Depot (Лейпрорелина ацетат), Lupron Depot-Ped (Лейпрорелина ацетат), Линпарза (Олапариб), Маркибо (Винкристин сульфат липосомальный), матулан (прокарбазина гидрохлорид), Мехлорэтамина гидрохлорид, Мегестрола ацетат, Мекинист (Траметиниб), Мелфалан, Мелфалан гидрохлорид, Меркаптопурин, Месна, Меснекс (Месна), Метазоластон (Темозоломид), Метотрексат, Метотрексат LPF (Метотрексат), Метилналтрексона бромид, Мексат (Метотрексат), Мексат-AQ (Метотрексат), Мидостаурин, Митомицин C, Митоксантрон гидрохлорид, Митозитрекс (Митомицин C), MOPP, Мозобаил (Плериксафор), Мустарген (Мехлорэтамина гидрохлорид), Мутамицин (Митомицин C), Милеран (Бусульфан), Милосар (Азацитидин), Милотарг (Гемтузумаб озогамицин), Паклитаксел на основе наночастиц (Стабилизированный альбумином состав наночастиц паклитаксела), Навельбин (Винорелбина тартрат), Нецитумумаб, Неларабин, Неосар (Циклофосфамид), Нератиниб малеат, Нерлинкс (Нератиниб малеат), Нетупитант и Палоносетрона гидрохлорид, Неуласта (Пегфилграстим), Нейпоген (Филграстим), Нексавар (Сорафениба тозилат), Ниландрон (Нилутамид), Нилотиниб, Нилутамид, Нинларо (Иксазомиба цитрат), Нирапариба тозилата моногидрат, Ниволумаб, Нолвадекс (Тамоксифена цитрат), Энплейт (Ромиплостим), Обинутузумаб, Одомзо (Сонидегиб), OEPA, Офатумумаб, OFF, Олапариб, Оларатумаб, Омацетаксина мепесукцинат, Онкаспар (Пегаспагаза), Ондансетрон гидрохлорид, Онивайд (Иринотекана гидрохлорид липосомальный), Онтак (Денилейкин дифтитокс), Опдиво (Ниволумаб), OPPA, Осимертиниб, Оксалиплатин, Паклитаксел, Стабилизированный альбумином состав наночастиц паклитаксела, PAD, Палбоциклиб, Палифермин, Палоносетрона гидрохлорид, Палоносетрона гидрохлорид и Нетупитант, Памидронат динатрия, Панитумумаб, Панобиностат, Параплат (Карбоплатин), Параплатин (Карбоплатин), Пазопаниба гидрохлорид, PCV, PEB, Пегаспаргаза, Пегфилграстим, Пэгинтерферон альфа-2b, PEG-Интрон (Пэгинтерферон альфа-2b), Пембролизумаб, Пеметрексед динатрий, Перьета (Пертузумаб), Пертузумаб, Платинол (Цисплатин), Платинол-AQ (Цисплатин), Плериксафор, Помалидомид, Помалист (Помалидомид), Понатиниб гидрохлорид, Портразза (Нецитумумаб), Пралатрексат, Преднизон, Прокарбазина гидрохлорид, Пролейкин (Альдеслейкин), Пролиа (Деносумаб), Промакта (Элтромбопаг оламина), Пропранолол гидрохлорид, Провенж (Сипулейцел-T), Пуринетол (Меркаптопурин), Пуриксан (Меркаптопурин), Радия-223 дихлорид, Ралоксифен гидрохлорид, Рамуцирумаб, Расбуриказа, R-CHOP, R-CVP, Рекомбинантная двухвалентная вакцина против вируса папилломы человека (ВПЧ), Рекомбинантная девятивалентная вакцина против вируса папилломы человека (ВПЧ), Рекомбинантная четырехвалентная вакцина против вируса папилломы человека (ВПЧ), Рекомбинантный интерферон альфа-2b, Регорафениб, Релистор (Метилналтрексона бромид), R-EPOCH, Ревлимид (Леналидомид), Ревматрекс (Метотрексат), Рибоциклиб, R-ICE, Ритуксан (Ритуксимаб), Ритуксан Хицела (Ритуксимаб и Гиалуронидаза человека), Ритуксимаб, Ритуксимаб и Гиалуронидаза человека, Ролапитант гидрохлорид, Ромидепсин, Ромиплостим, Рубидомицин (Даунорубицина гидрохлорид), Рубрака (Рукапариб камзилат), Рукапариб камзилат, Руксолитиниб фосфат, Райдапт (Мидостаурин), внутриплевральный аэрозоль Sclerosol (Тальк), Силтуксимаб, Сипулейцел-T, Соматулин депо (Ланреотид ацетат), Сонидегиб, Сорафениба тозилат, Спрайсел (Дазатиниб), STANFORD V, Стерильная тальковая присыпка (Тальк), Steritalc (Тальк), Стиварга (Регорафениб), Сунитиниба малат, Сутент (Сунитиниба малат), Силатрон (Пэгинтерферон альфа-2b), Сильвант (Силтуксимаб), Синрибо (Омацетаксина мепесукцинат), Tabloid (Тиогуанин), TAC, Тафинлар (Дабрафениб), Тагриссо (Осимертиниб), Тальк, Талимоген лагерпарепвек, Тамоксифена цитрат, Тарабин PFS (Цитарабин), Тарцева (Эрлотиниб гидрохлорид), Таргретин (Бексаротен), Тасигна (Нилотиниб), Таксол (Паклитаксел), Таксотер (Доцетаксел), Тецентрик (Атезолизумаб), Темодар (Темозоломид), Темозоломид, Темсиролимус, Талидомид, Талидомид (Талидомид), Тиогуанин, Тиотепа, Тисагенлеклейсел, Толак (Фторурацил--для местного применения), Топотекан гидрохлорид, Торемифен, Торизел (Темсиролимус), Тотект (Дексразоксана гидрохлорид), TPF, Трабектедин, Траметиниб, Трастузумаб, Треанда (Бендамустина гидрохлорид), Трифлуридина и Типирацила гидрохлорид, Тризенокс (Триоксид мышьяка), Тайкерб (Лапатиниба дитозилат), Унитуксин (Динутуксимаб), Уридина триацетат, VAC, Валрубицин, Валстар (Валрубицин), Вандетаниб, VAMP, Варуби (Ролапитант гидрохлорид), Вектибикс (Панитумумаб), VeIP, Velban (Винбластина сульфат), Велкейд (Бортезомиб), Велсар (Винбластина сульфат), Вемурафениб, Венклекста (Венетоклакс), Венетоклакс, Верзенео (Абемациклиб), Виадур (Лейпрорелина ацетат), Видаза (Азацитидин), Винбластина сульфат, Винкасар PFS (Винкристин сульфат), Винкристина сульфат, Винкристина сульфат липосомальный, Винорелбина тартрат, VIP, Висмодегиб, Вистогард (Уридина триацетат), Вораксаз (Глюкарпидаза), Вориностат, Вотриент (Пазопаниба гидрохлорид), Виксеос (Даунорубицина гидрохлорид и Цитарабин липосомальный), Веллковорин (Лейковорин кальция), Ксалкори (Кризотиниб), Кселода (Капецитабин), XELIRI, XELOX, Эксджива (Деносумаб), Ксофиго (Радия-223 дихлорид), Кстанди (Энзалутамид), Ервой (Ипилимумаб), Ескарта (Аксикабтаген силолейсел), Йонделис (Трабектедин), Залтрап (Зив-афлиберцепт), Зарксио (Филграстим), Зеджула (Нирапариба тозилата моногидрат), Зелбораф (Вемурафениб), Зевалин (Ибритутомаб тиуксетан), Зинекард (Дексразоксана гидрохлорид), Зив-афлиберцепт, Зофран (Ондансетрон гидрохлорид), Золадекс (Гозерелина ацетат), Золедроновая кислота, Золинза (Вориностат), Зомета (Золедроновая кислота), Зиделиг (Иделалисиб), Зикадия (Церитиниб), Зитига (Абиратерона ацетат).
[0074] В контексте настоящей заявки термин “противоопухолевое средство” относится к любым химическим агентам или лекарственным средствам, эффективным для предотвращения или ингибирования образования или роста рака или опухолей. Противоопухолевые средства, обсуждаемые в настоящей заявке, могут охватывать алкилирующие агенты, антиметаболиты, натуральные продукты, гормоны и/или антитела. Лечение опухолей или рака может включать ограничение пролиферации, миграции и/или инвазии раковых или опухолевых клеток в организме или ограничение симптомов, связанных с указанным раком или опухолью. В контексте настоящей заявки противоопухолевые средства следует понимать как охватывающие противораковые средства или же синонимичные противораковым средствам.
Способы получения соединений по настоящему изобретению
[0075] Ингибиторы PDE1 по настоящему изобретению и их фармацевтически приемлемые соли можно получить с использованием способов, описанных и проиллюстрированных в US 8273750, US 2006/0173878, US 8273751, US 2010/0273753, US 8697710, US 8664207, US 8633180, US 8536159, US 2012/0136013, US 2011/0281832, US 2013/0085123, US 2013/0324565, US 2013/0338124, US 2013/0331363, WO 2012/171016 и WO 2013/192556, а также способами, аналогичными им, и способами, известными в области химии. Такие способы включают описанные ниже способы, но не ограничиваются этим. Если они не являются коммерчески доступными, исходные вещества для этих способов можно получить при помощи процедур, выбранных из области химии, с использованием методов, подобных или аналогичных методам синтеза известных соединений.
[0076] Различные ингибиторы PDE1 и исходные вещества для них можно получить с использованием способов, описанных в US 2008-0188492 A1, US 2010-0173878 A1, US 2010-0273754 A1, US 2010-0273753 A1, WO 2010/065153, WO 2010/065151, WO 2010/065151, WO 2010/065149, WO 2010/065147, WO 2010/065152, WO 2011/153129, WO 2011/133224, WO 2011/153135, WO 2011/153136, WO 2011/153138. Все цитируемые в настоящей заявке документы полностью включены в настоящую заявку посредством ссылки.
[0077] Другие ингибиторы PDE1 и соответствующие способы раскрыты в предварительной заявке США 62/833481, которая полностью включена в настоящую заявку посредством ссылки. Дополнительные родственные ингибиторы PDE1 и соответствующие способы раскрыты в международной публикации WO2018/049417, которая полностью включена в настоящую заявку посредством ссылки.
[0078] Соединения по настоящему изобретению включают их энантиомеры, диастереомеры и рацематы, а также их полиморфы, гидраты, сольваты и комплексы. Некоторые отдельные соединения в рамках настоящего раскрытия могут содержать двойные связи. Представление двойных связей в настоящем раскрытии подразумевает включение как E, так и Z изомера двойной связи. Кроме того, некоторые соединения в рамках настоящего раскрытия могут содержать один или более центров асимметрии. Настоящее изобретение включает применение любого из оптически чистых стереоизомеров, а также любой комбинации стереоизомеров.
[0079] Также подразумевается, что соединения по изобретению включают их стабильные и нестабильные изотопы. Стабильные изотопы представляют собой нерадиоактивные изотопы, которые содержат один дополнительный нейтрон по сравнению с распространенными нуклидами того же вида (т.е. элемента). Ожидают, что активность соединений, включающих такие изотопы, будет сохраняться, и такое соединение также будет полезно для измерения фармакокинетики неизотопных аналогов. Например, атом водорода в определенном положении в соединениях по изобретению может быть замещен дейтерием (стабильным изотопом, который не является радиоактивным). Примеры известных стабильных изотопов включают, но не ограничиваются этим, дейтерий, 13C, 15N, 18O. В качестве альтернативы, нестабильные изотопы, которые представляют собой радиоактивные изотопы, которые содержат дополнительные нейтроны по сравнению с распространенными нуклидами того же вида (т.е. элемента), например, 123I, 131I, 125I, 11C, 18F, могут замещать соответствующие распространенные виды I, C и F. Другим примером полезного изотопа соединения по настоящему изобретению является изотоп 11C. Эти радиоизотопы полезны для радиационной визуализации и/или фармакокинетических исследований соединений по настоящему изобретению.
[0080] Температуры плавления не скорректированы, и (разл.) означает “разложение”. Температура указана в градусах Цельсия (°C); если не указано иное, процедуры осуществляют при комнатной температуре или температуре окружающей среды, т.е. при температуре в диапазоне 18-25°C. Хроматография означает флэш-хроматографию на силикагеле; тонкослойную хроматографию (ТСХ) осуществляют на пластинах с силикагелем. Данные ЯМР представлены в виде дельта-значений основных диагностических протонов, выраженных в миллионных долях (м.д.) относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта. Используют общепринятые сокращения для формы сигнала. Константы взаимодействия (J) указаны в Гц. Для масс-спектров (МС) основной ион с наименьшей массой сообщается для молекул, в которых изотопное расщепление приводит к множественным пикам масс-спектра. Композиции смесей растворителей представлены в виде объемных процентов или объемных соотношений. В случаях комплексных спектров ЯМР указаны только диагностические сигналы.
[0081] Слова "лечение" и "лечащий" следует понимать, соответственно, как охватывающие лечение или облегчение симптомов заболевания, а также лечение причины заболевания.
[0082] Для способов лечения слово “эффективное количество” предназначено для обозначения терапевтически эффективного количества для лечения конкретного заболевания или расстройства.
[0083] Термин “пациент” включает пациента-человека или пациента, не относящегося к человеку (то есть животного). В конкретном варианте осуществления раскрытие охватывает как человека, так и отличное от человека животное. В другом варианте осуществления раскрытие охватывает отличное от человека животное. В другом варианте осуществления термин охватывает человека.
[0084] Термин “включающий” в контексте настоящего раскрытия предполагается как неограничивающий и не исключает дополнительных, не перечисленных элементов или стадий способа.
[0085] Дозировки, используемые при практическом применении настоящего изобретения, конечно, будут варьироваться в зависимости, например, от конкретного заболевания или состояния, подлежащего лечению, конкретных используемых соединений по настоящему изобретению, способа введения и желаемой терапии. Соединения по настоящему изобретению можно вводить любым подходящим путем, включая пероральное, парентеральное, трансдермальное введение или введение путем ингаляции, но предпочтительно пероральное введение. В целом удовлетворительные результаты, например, для лечения заболеваний, как указано выше, должны быть получены при пероральном введении в дозах порядка от около 0,01 до 2,0 мг/кг. У более крупных млекопитающих, например, людей, указанная суточная доза для перорального введения обоих ингибиторов PDE1 будет соответственно находиться в диапазоне от около 0,50 до 300 мг, которую удобно вводить один раз или в виде раздельных доз 2-4 раза в день или в форме с замедленным высвобождением. Таким образом, стандартные лекарственные формы для перорального введения могут включать, например, от около 0,2 до 150 или 300 мг, например, от около 0,2 или 2,0 до 10, 25, 50, 75 100, 150 или 200 мг соединения по настоящему изобретению, вместе с его фармацевтически приемлемым разбавителем или носителем.
[0086] Соединения по настоящему изобретению, особенно для применения или введения в любом из способов 1-6 и последующих, можно вводить в более высоких дозах, если это необходимо для лечения рака или опухоли, например, мультиформной глиобластомы. Предполагается, что введение ингибитора PDE1 для такого способа может составлять от около 50 мг до 1000 мг в день. Например, пациенту, которому вводят ингибитор PDE1 для состояния в соответствии с любым из способов 1-6 и последующих, можно вводить ингибитор PDE1 в соответствии с Формулой, I, Ia, II, III или IV в количестве 50 мг - 1000 мг в день, 50 мг - 900 мг в день, 50 мг - 800 мг в день, 50 мг - 700 мг в день, 50 мг - 600 мг в день, 50 мг - 500 мг в день, 50 мг - 400 мг в день, 50 мг - 350 мг в день, 50 мг - 300 мг в день, 50 мг - 250 мг в день, 50 мг - 200 мг в день, 50 мг - 150 мг в день или 50 мг - 100 мг в день.
[0087] Соединения по настоящему изобретению можно вводить любым приемлемым путем, в том числе перорально, парентерально (внутривенно, внутримышечно или подкожно) или трансдермально, но предпочтительно вводить перорально. В некоторых вариантах осуществления соединения по изобретению, например, в депо-составе, предпочтительно вводят парентерально, например, путем инъекции.
[0088] Соединения по настоящему изобретению и фармацевтические композиции по настоящему изобретению можно использовать в комбинации с одним или более дополнительными терапевтическими средствами, особенно в более низких дозах, чем при использовании отдельных средств в качестве монотерапии, чтобы усилить терапевтическую активность комбинированных средств, не вызывая нежелательных побочных эффектов, обычно наблюдаемых при традиционной монотерапии. Следовательно, соединения по настоящему изобретению можно вводить одновременно, отдельно, последовательно или в одно время с другими средствами, полезными для лечения заболевания. В другом примере побочные эффекты могут быть уменьшены или минимизированы путем введения соединения по настоящему изобретению в комбинации с одним или более дополнительными терапевтическими средствами в свободной форме или в форме соли, где дозы (i) второго терапевтического средства(средств), или (ii) и соединения по настоящему изобретению и второго терапевтического средства, ниже, чем когда средство/соединение вводят в виде монотерапии. В качестве неограничивающего примера такие дополнительные терапевтические средства могут включать ингибиторы ACE, антагонисты рецепторов ангиотензина II, блокаторы кальциевых каналов и т.д.
[0089] Термин “одновременно”, относящийся к терапевтическому применению, означает введение двух или более активных ингредиентов в одно и то же время или примерно в одно и то же время одним и тем же путем введения.
[0090] Термин “раздельно”, относящийся к терапевтическому применению, означает введение двух или более активных ингредиентов в одно и то же время или примерно в одно и то же время разными путями введения.
[0091] Фармацевтические композиции, включающие соединения по настоящему изобретению, можно получить с использованием обычных разбавителей или эксципиентов и методов, известных в области медицины. Таким образом, пероральные лекарственные формы могут включать таблетки, капсулы, растворы, суспензии и т.п.
ПРИМЕРЫ
[0092] Данные, приведенные ниже в примерах 1-4, были опубликованы в F. Rowther, et al. 2016, Cyclic nucleotide phosphodiesterase-1C (PDE1C) drives cell proliferation, migration and invasion in glioblastoma multiforme cells in vitro. Molecular Carcinogenesis. 55(3):268-79.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 1: Экспрессия PDE1C в ткани мультиформной глиобластомы
[0093] Краткосрочные культуры клеток получали из ткани биопсии мультиформной глиобластомы (GBM) взрослого человека, как ранее описано в Lewandowicz GM, et al., Chemosensitivity in childhood brain tumours in vitro: Evidence of differential sensitivity to lomustine (CCNU) and vincristine. Eur J Cancer 2000; 36:1955. Образцы поддерживали в питательной смеси Hams F10 [Invitrogen, UK], содержащей 10% фетальной телячьей сыворотки, в инкубаторе при 37°C без CO2. Также были включены нормальные человеческие астроциты (NHA) [Lonza, UK] и установившаяся клеточная линия U251-MG. Разрешенные образцы биопсии GBM получали из Brain Tumor NW Research Tissue Bank, Preston, UK. Гистологическую оценку тканей GBM осуществляли на месте и опухоли классифицировали в соответствии со схемой классификации ВОЗ 2007 года. Контрольные образцы нормального мозга человека, включая весь мозжечок и мозолистое тело плода, также использовали для определения экспрессии PDE1C.
[0094] ДНК экстрагировали из культур GBM с использованием мини-набора QIAmp DNA [Qiagen, UK]. Тотальную РНК экстрагировали из краткосрочных культур GBM (106 клеток) или из приблизительно 5 мг мгновенно замороженных тканей биопсии с использованием мини-набора RNeasy [Qiagen, UK]. ДНК и тотальную РНК определяли количественно при помощи NanoDrop ND-2000 [Thermo Scientific, UK]. кДНК синтезировали из тотальной РНК (500 нг) с использованием QuantiTect Reverse Transcription [Qiagen, UK].
[0095] Количественную ПЦР в реальном времени осуществляли из 20 нг/лунка (96-луночный) культур, полученных из GBM, используя анализ числа копий PDE1C TaqMan с FAM репортером (Hs01364699_cn [Life Technologies, UK]. Местоположения зондов были выбраны в той же локализации в геноме, где aCGH обнаружил фокальное прибавление. Taqman анализ на TERT использовали [Life Technologies, UK] в качестве эндогенного контроля (VIC репортер), и количество копий PDE1C было нормализовано до его уровней. Эталонную ДНК получали смешиванием равного количества мужской и женской геномной ДНК [Promega, UK] и использовали в качестве нормального контроля {несущего диплоидные копии PDE1C для анализа}. кПЦР амплификации осуществляли в трех повторах в трех независимых экспериментах для получения точных данных о количестве копий.
[0096] Для анализа экспрессии, кПЦР осуществляли с использованием анализа экспрессии гена Solaris QPCR PDE1C с FAM репортером [Thermo Scientific, Великобритания] на системе обнаружения последовательностей ABI 7500 [Applied Biosystems, UK]. 2 мкл кДНК амплифицировали в реакционном объеме 20 мл с использованием 1x мастер-микса Solaris для кПЦР с низким ROX [Thermo Scientific, UK], и амплификации осуществляли в трех повторах. Уровни экспрессии PDE1C нормализовали к GAPDH, и относительную экспрессию определяли с использованием метода 2ΔΔCT. Контрольные образцы нормального мозга (тотальная РНК мозга, мозжечок и мозолистое тело человека) получали от Clontech [France].
[0097] Результаты кПЦР анализа обобщенно представлены в Таблице 1 ниже.
кПЦР анализ числа копий PDE1C
[0098] Как показано выше, кПЦР анализ подтверждает прибавление PDE1C в краткосрочных культурах клеток GBM. Экспрессия PDE1C в краткосрочных культурах с использованием кПЦР анализа и связь между геномной сверх-репрезентацией и экспрессией PDE1C была очевидна (Фиг. 1), поскольку повышенная экспрессия (по сравнению с нормальными астроцитами человека) присутствовала во всех протестированных культурах клеток с геномной сверх-репрезентацией, за исключением контрольной культуры IN2045. По сравнению с контрольной культурой, наблюдали значительно повышенную экспрессию в каждой краткосрочной культуре в 23-360 раз (P<0,0001).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 2: Определение роли PDE1C в пролиферации GBM
[0099] Трансфекции миРНК облегчали с использованием реагента для трансфекции DharmaFECT-1 в среде, содержащей сыворотку, и эффективность трансфекции оценивали с использованием положительного контроля миРНК циклофилина-B [Thermo Scientific, UK]. Культуры трансфицировали параллельно с нецелевым пулом миРНК, в той же концентрации. Нецелевая миРНК и PDE1C-специфическая миРНК сокращенно обозначается как siNT и siPD. Клетки высевали при 40-50% конфлюэнтности и инкубировали в течение 48 часов перед началом трансфекции. В конце первоначальной 48-часовой инкубации клетки трансфицировали и инкубировали в течение 4 дней. На 5 день клетки обрабатывали трипсином, повторно высевали в свежую колбу и оставляли для прилипания в течение ночи. Клетки повторно трансфицировали на 6 день (либо с использованием siNT, либо siPD) и инкубировали дополнительно в течение четырех дней перед сбором для дальнейших экспериментов. siNT и siPD клеткам давали возможность расти в течение 72 часов и осуществляли анализ пролиферации с использованием SRB, как описано в Vichai V, Kirtikara K. Sulforhodamine B colorimetric assay for cytotoxicity screening. Nat Protoc 2006; 1:1112-1116. Винпоцетин растворяли в DMSO и использовали диапазон доз серийных разведений от 500 мкМ до 0,977 мкМ.
[00100] Как показано на Фиг. 3, после прекращения трансфекции оценивали способность клеток к пролиферации. Независимо от исходного уровня экспрессии PDE1C, истощение PDE1C последовательно снижало пролиферацию на 45-54% по сравнению с PDE1C-экспрессирующими клетками (P <0,05) во всех культурах, кроме IN2045. Активность cAMP и cGMP также оценивали после истощения PDE1C. Наблюдали, что увеличение активности как cAMP, так и cGMP (P<0,05), было обнаружено в siPD клетках по сравнению с siNT клетками, за исключением контрольной культуры IN2045.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 3: Определение роли PDE1C в миграции и инвазии клеток GBM
[00101] Потенциал миграции и инвазии siNT и siPD оценивали с использованием анализа миграции и инвазии в 24-луночном формате CytoSelect [Cell Biolabs, Inc., USA]. 20000 siNT или siPD клеток высевали на поликарбонатную мембрану (8 мМ) в бессывороточной среде, и среду, содержащую сыворотку, использовали в качестве хемоаттрактанта. По окончании времени инкубации мигрировавшие клетки удаляли, а немигрирующие клетки на мембране окрашивали с использованием кристаллического фиолетового и количественно оценивали колориметрическим методом. Для анализа инвазии использовали поликарбонатные мембраны, предварительно покрытые белками внеклеточного матрикса (ЕСМ) [Cell Biolabs, Inc., USA].
[00102] Миграцию клеток также оценивали при помощи 24-луночного анализа заживления ран CytoSelect [Cell Biolabs, Inc., США], следуя инструкциям изготовителя. % Миграции рассчитывали по формуле:
[(клетки, мигрировшие в область раны)/(общее количество клеток на предметном стекле)] × 100,
[00103] Миграцию в siNT принимали за 100%. Что касается винпоцетина, лечение продолжали в течение всего периода исследования.
[00104] Как проиллюстрировано на Фиг. 4 и 5, siPD клетки продемонстрировали пониженную способность как к миграции (через поликарбонатную мембрану), так и к проникновению (через поликарбонатную мембрану, покрытую ECM) по сравнению с siNT клетками. Мигрировавшие и инвазированные клетки определяли количественно, и было отмечено снижение миграционного и инвазивного потенциала на 40-60% в siPD клетках по сравнению с siNT. В культурах IN1472 и IN1760 снижение миграции и инвазии клеток было статистически значимым (P<0,05). Интересно отметить, что относительная степень ингибирования миграции и инвазии была очень схожей в каждой из отдельных культур. Как и в случае пролиферации, не было ингибирования миграции или инвазии в siPD IN2045 клетках. Результаты анализа с использованием камеры Бойдена были подтверждены в анализе заживления ран (Фиг. 6), в котором количество клеток, которые мигрировали в области раны, было значительно снижено в siPD клетках по сравнению с siNT клетками в трех культурах (IN1472, IN1760 и U251MG). Эти данные показывают, что PDE1C также действует в направлении вверх от миграционных и инвазивных путей в клетках GBM.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 4: Идентификация нижележащих эффекторов PDE1C
[00105] Для полногеномного анализа экспрессии 1 мг тотальной РНК подвергали обратной транскрипции с использованием набора MessageAmpTM IIBiotin Enhanced Kit [Ambion; Life Technologies, UK] и гибридизовали с геномом человека U133 Plus 2.0 [Affymetrix, UK]. Микрочипы промывали в GeneChip Fluidics Station 450 и сканировали с использованием GeneChip Scanner 3000 7G [Affymetrix, UK]. Микрочипы получали в трех повторах для siNT и siPD обработок.
[00106] Необработанные данные микрочипов из файлов Affymetrix CEL для каждого из биологических повторов siNT и siPD нормализовали с использованием стандартного протокола. Фон микрочипов, Q значения, и средняя интенсивность находились в допустимых диапазонах для всех микрочипов. Статистические сравнения и визуализацию данных осуществляли с использованием GeneSpring GX12 (Agilent Technologies, UK). Во-первых, было выявлено ≥2-кратное изменение уровней экспрессии в siPD клетках по сравнению с siNT, с последующей идентификацией статистически значимых генов с использованием однофакторного дисперсионного анализа ANOVA (P <0,05) и теста Бенджамини-Хохберга для контроля доли ложных отклонений при множественной проверке. Существенные биологические, технологические сети, процессы генной онтологии (GO) и маркеры заболеваний, на которые влияет истощение PDE1C, были идентифицированы с использованием MetacoreTM [GeneGo, Thompson Reuters, USA]. Портал cBIO canver genomics использовали для исследования статуса экспрессии генов, подверженных негативному влиянию PDE1C, в The Cancer Genome Atlas(TCGA) GBM когортах и для корреляции с исходом для пациентов.
[00107] Анализ экспрессии на уровне полного генома осуществляли на культурах IN1472 и IN1760, где эффект истощения PDE1C на пролиферацию, инвазию и миграцию был наиболее значимым (Фиг. 2C, 4B, 4D и 4F). С учетом дифференциальной экспрессии на основании кратного изменения экспрессии в ≥2 раза и статистической значимости P <0,05 между siNT и siPD клетками было идентифицировано 565 транскриптов (465 генов). Для IN1760 было обнаружено 411 дифференциально экспрессируемых генов, из которых 146 были положительно регулированы, а 265 отрицательно регулированы. В IN1472, 49 генов были положительно регулированы и 5 были отрицательно регулированы в siPD клетках. Успешный нокдаун PDE1C также был установлен в экспрессионном биочипе, поскольку это был нокдаун в 3 и 13 раз для IN1472 и IN1760, соответственно. Этот анализ также установил, что пул миРНК PDE1C, используемый в текущем исследовании, является высокоспецифическим для PDE1C, поскольку авторы не обнаружили никаких изменений в экспрессии других PDE.
[00108] В клетках IN1760-siPD обычно отрицательно регулированные гены, которые продемонстрировали 3-13-кратную даунрегуляцию, включали IL8, PDE1C, KCTD4, PLD5, CXCL6, IL11, B3GALT2, INHBE, OPCML, ELAVL2 и EXT1 (Дополнительный файл A). Аналогичным образом, SPARCL1, APOE, CFI, COMP, FABP3, CLU, FAM107A, PTGDS, CHI3L1, MAN1C1, TDO2 и QPRT показали 4-8-кратную апрегуляцию в клетках IN1760-siPD. Напротив, в IN1472 PDE1C был единственным геном, который показал более чем 3-кратную даунрегуляцию в siPD клетках (Дополнительный файл B). TNFSF15 также был единственным геном, который показал >3-кратное в IN1472-siPD клетках. Четыре гена дифференциально экспрессировались как в клетках IN1760-siPD, так и в IN1472-siPD, включая APOE (положительно регулированный), HSD11B1 (положительно регулированный), ST6GALNAC5 (отрицательно регулированный) и PDE1C (отрицательно регулированный).
[00109] Было показано, что истощение PDE1C изменяет гены, вовлеченные в важные клеточные пути в клетках GBM. Гены, вовлеченные в наиболее значимые пути, на которые влиял нокдаун PDE1C, были идентифицированы, как показано ниже в Таблицах 2-4.
Пути, включающие взаимодействия клетка-матрица, ремоделирование ECM и взаимодействия тромбоцит-эндотелий-лейкоцит
Пути, включающие гены клеточного цикла (митоза) и контроля пролиферации
Пути, включающие глиома-специфические гены
[00110] Было обнаружено, что дифференциально экспрессируемые гены как следствие истощения PDE1C сильно коррелировали с профилями экспрессии генов TCGA GBM когорт. В объединенном перечне дифференциальной экспрессии генов siPD IN1760 и IN1472 клеток 32% PDE1C-опосредованных апрегулированных генов были даунрегулированы в TCGA когортах, и 53% PDE1C- опосредованных даунрегулированных генов были апрегулированы в TCGA когортах. В этом перечне TCGA генов, апрегуляция по меньшей мере одного или более запрашиваемых генов, т.е. IL8, CXCL2, FOSB, NFE2L3, SUB1, SORBS2, WNT5A и MMP1, была связана с худшим исходом у пациентов (P=0,0165), и PDE1C нокдаун приводил к даунрегуляции их экспрессии. Следовательно, хотя экспрессия PDE1C сама по себе не связана с исходом, изменение экспрессии ее нижележащих эффекторов, как следствие истощения PDE1C, имеет потенциал для улучшения выживаемости.
ПРИМЕР 1: Определение способности соединений 1 и 2 ингибировать пролиферацию, инвазию и миграцию GBM
[00111] Культуры клеток GBM получали из ткани биопсии мультиформной глиобластомы (GBM) взрослого человека, как описано в Сравнительных Примерах 2 и 3. Соединения 1 и 2 вводят в культуры для оценки их эффекта на пролиферацию, инвазию и миграцию GBM. Соединения 1 и 2 представляют собой:
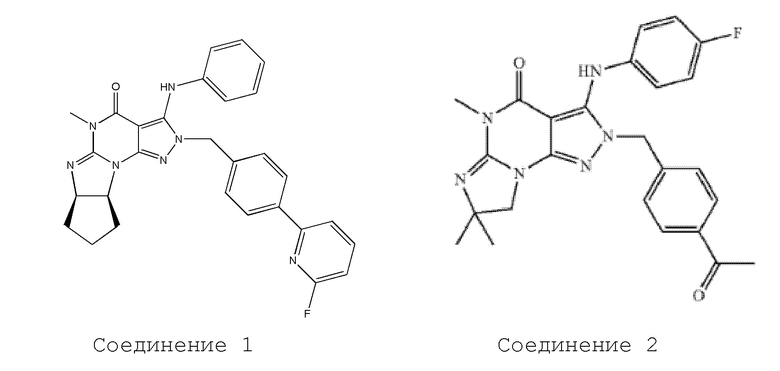
[00112] После получения культур клеток, как обсуждается выше в Сравнительном Примере 2, оценивали способность клеток, обработанных соединением 1 или соединением 2, к пролиферирации. Успешные испытания соединений будут показывать уменьшенную пролиферацию по сравнению с PDE1C-экспрессирующими клетками во всех культурах, кроме контроля. Повышение активности как cAMP, так и cGMP будет обнаружено в siPD клетках по сравнению с siNT клетками, за исключением контрольной культуры.
[00113] Также оценивали способность клеток, обработанных соединением 1 или соединением 2, мигрировать и пролиферировать. Успешные испытания соединений будут показывать уменьшенную миграцию и/или пролиферацию по сравнению с контрольными культурами.
ПРИМЕР 2: Эффект ингибиторов PDE1 на различные клеточные линии GBM.
[00114] Семь различных клеточных линий, полученных из биопсий GBM, получали и подготавливали в краткосрочных гранулированных питательных средах, каждая из которых, соответственно, содержала 3-4 миллиона клеток. Чтобы подготовить к использованию в IMAP-анализе на PDE активность, клеточные осадки промывали один раз TBS (150нМ NaCl, 50мМ Tris-HCl, pH 7,4). Затем осадки центрифугировали и супернатант удаляли. Клетки лизировали в 0,15 мл буфера для лизиса (50 мМ Трис-HCl, pH 7,4, 5 мМ MgCl2, смесь ингибиторов протеаз). Полученный раствор дважды обрабатывали ультразвуком в течение 30 секунд, а затем центрифугировали при 15000 об/мин в течение 15 минут при 4ºC. Супернатант переносили в новый сосуд и немедленно замораживали. Затем клетки анализировали на экспрессию PDE1 и чувствительность к ингибированию соединениями 1 и 2, как определено в Примере 1. Результаты представлены в Таблице 3 ниже.
Экспрессия PDE1 и чувствительность к соединениям 1 и 2 в различных клеточных популяциях
[00115] Как показано выше, уровень PDE1C был повышен во всех клеточных линиях, при этом некоторые клеточные линии показали 75-кратное увеличение экспрессии PDE1C. Как соединение 1, так и соединение 2 показали одинаковую эффективность во всех тестируемых клеточных линиях.
[00116] Дальнейшие исследования осуществляли для проверки эффекта Соединения 1 и 2 на пролиферацию и выживаемость клеток GBM. Пролиферацию каждой клеточной популяции тестировали против соединения 1 и 2 при концентрациях 10 мкМ и 20 мкМ. Результаты, касающиеся изменений в клеточной популяции, наблюдали и записывали ежедневно в течение 8 дней. Во всех случаях обработанные клеточные линии пролиферировали медленнее по сравнению с необработанными образцами. В UWLV301, UWLV304, IN1951, U251MG и IN2045 обработанные GBM клеточные популяции показали общее уменьшение к 8-му дню.
[00117] Таким образом, оба соединения 1 и 2 показали высокую эффективность в замедлении или устранении пролиферации клеточных линий GBM.
ПРИМЕР 3: Анализ клеточных линий GBM на PDE1 активность, включая кальциевую зависимость и корреляцию
[00118] Клеточные осадки, используемые в Примере 2, анализировали для измерения кальций-зависимой PDE активности в качестве средства для оценки относительного присутствия полноразмерных ферментов по сравнению с усеченными. У усеченных ферментов отсутствует N-концевой регуляторный домен, и, таким образом, они становятся конститутивно активными в этом анализе. Анализы были подготовлены в соответствии с протоколом Примера 2.
[00119] Анализ активности PDE1 в клеточных линиях показан на Фиг. 7. Как показано, клеточные линии UWLV301 и UWLV304 показали высокоактивную PDE как в присутствии, так и в отсутствие Ca2+/кальмодулина. Это показывает, что активность PDE в этих клеточных линиях не зависит от кальция. На активность PDE с использованием cAMP в качестве субстрата не влияло отсутствие Ca2+/кальмодулина в этих двух клеточных линиях. С другой стороны, некоторые из клеточных линий, такие как IN1528 и U251MG, показали гораздо более высокие уровни активности в присутствии Ca2+/кальмодулина, чем в его отсутствие.
[00120] Это предполагает, что прогрессирование GBM может вызвать конститутивную активацию PDE1 в клетках мозга. Для изучения этого момента были осуществлены дополнительные испытания, которые обобщенно представлены в Таблице 4 ниже. Как показано, различные клеточные линии были протестированы в присутствии и в отсутствие Ca2+/кальмодулина, а также в присутствии EGTA, хелатора кальция, в различных концентрациях. Эти испытания подтвердили, что клеточные линии UWLV301 и UWLV304 были конститутивно активными, т.е. что они остаются активными без регуляции Ca2+/кальмодулином.
Процент PDE активности в различных клеточных линиях
[00121] Осуществляли дополнительные испытания для подтверждения изоформы PDE, преимущественно ассоциированной с пролиферацией клеток GBM. Значения константы ингибирования (Ki) для Соединения 1 в отношении различных семейств ферментов PDE представлены в Таблице 5 ниже.
Значения константы ингибирования для соединения 1 против PDE
[00122] Ранее наблюдали, что увеличение экспрессии PDE1C связано с клетками GBM. Результаты показали, что IC50 для ингибирования PDE активности в клеточных линиях UWLV301 и UWLV304 для Соединения 1 близко соответствует значению Ki, полученному для очищенного PDE1C, что подтверждает идею о том, что обнаруженная активность PDE в этих линиях относится за счет PDE1C.
[00123] Не ограничиваясь теорией, можно предположить, что PDE1C была структурно изменена, вызывая конститутивную активацию клеточных линий UWLV301 или UWLV304. При дальнейшем исследовании ни UWLV301, ни UWLV304 не показали никакой обнаруживаемой полноразмерной PDE1C. Во время испытания это было подкреплено доказательствами, поскольку антитела к N-концу PDE1C больше не могли обнаруживать PDE1C в тех клетках, которые утратили чувствительность к кальцию. С другой стороны, клеточные линии IN1528 и U251MG, которые обе остаются регулируемыми системой Ca2+/кальмодулин, показали определяемую полноразмерную PDE1C. Таким образом, эти испытания предполагают, что пораженные GBM раком клетки могут вызывать дисрегуляцию и структурные изменения PDE1C.
[00124] Альтернативные комбинации и вариации представленных примеров станут очевидными на основе раскрытия. Невозможно предоставить конкретные примеры для всех из множества возможных вариаций описанных вариантов осуществления, но такие комбинации и вариации могут быть пунктами формулы изобретения, которая в итоге заявлена.
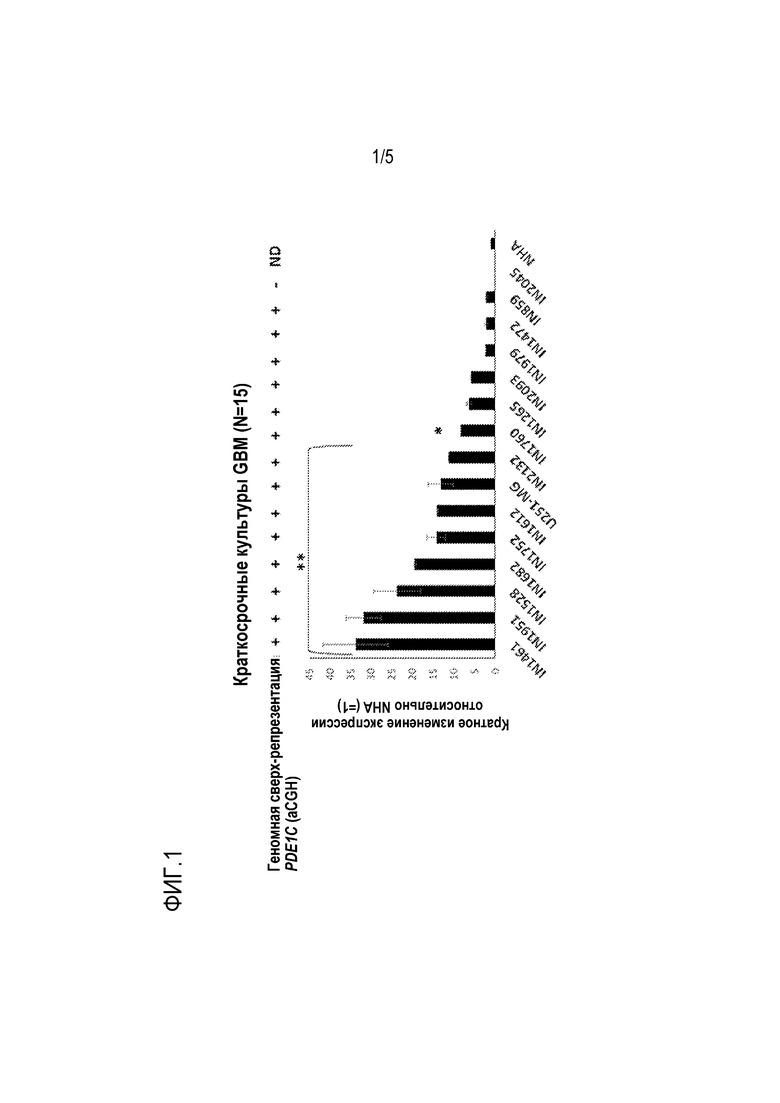
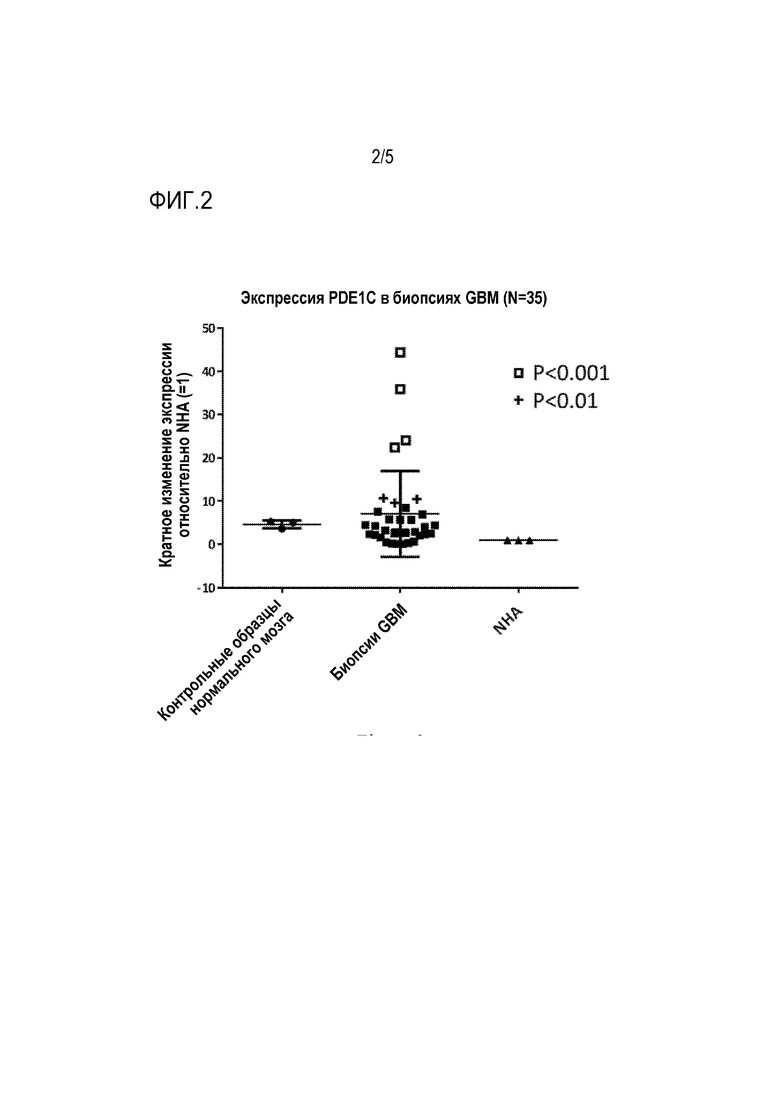
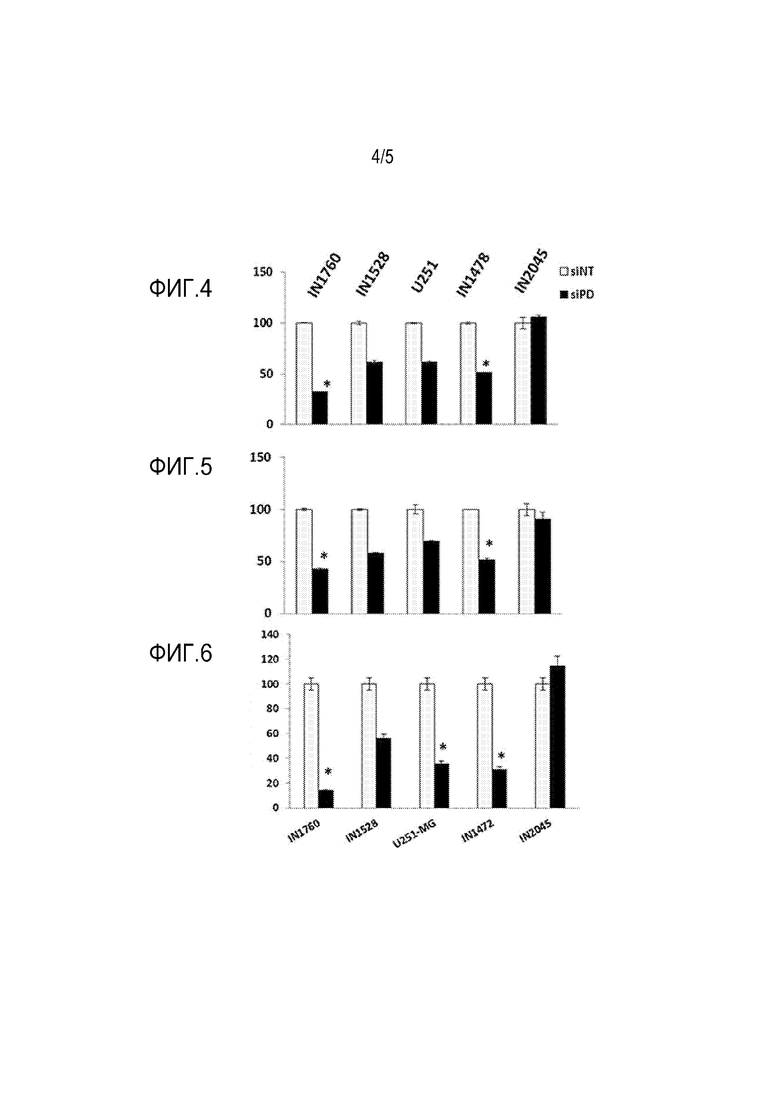
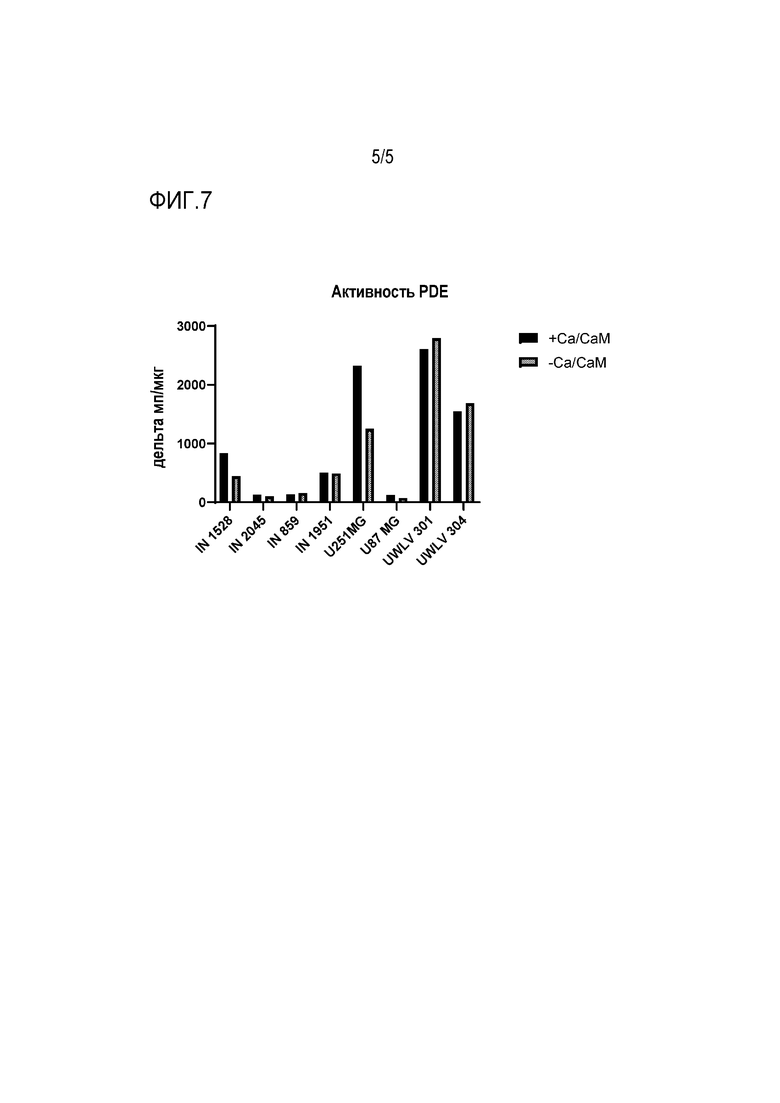
Группа изобретений относится к области медицины, в частности к онкологии, и раскрывает способ лечения глиомы, включающий введение фармацевтически приемлемого количества ингибитора PDE1 нуждающемуся в этом субъекту, где ингибитор PDE1 выбран из любого из следующих соединений в свободной форме или в форме фармацевтически приемлемой соли. Также раскрыт способ ингибирования синдрома высвобождения цитокинов. Техническим результатом является реализация назначения заявленных способов. 2 н. и 4 з.п. ф-лы, 5 табл., 7 ил., 3 пр.
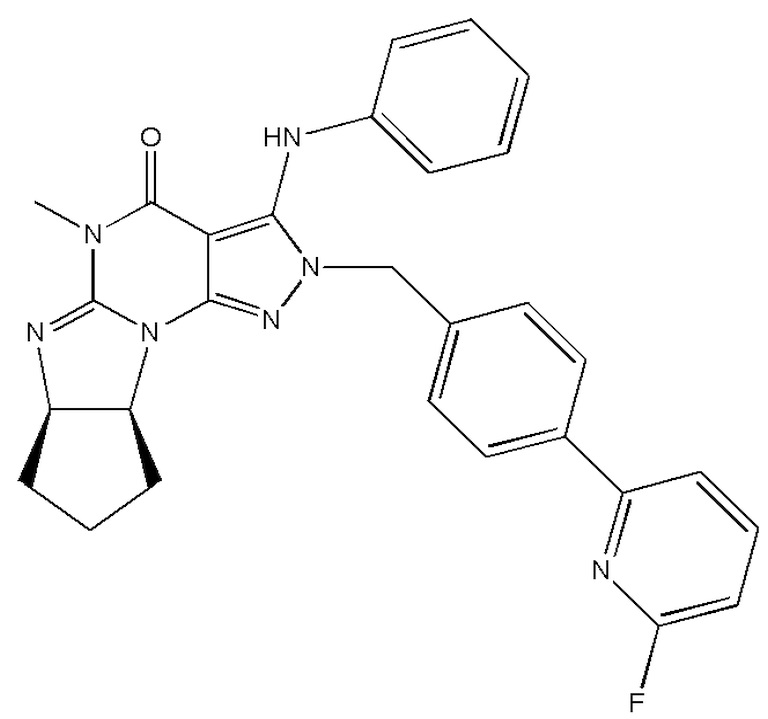
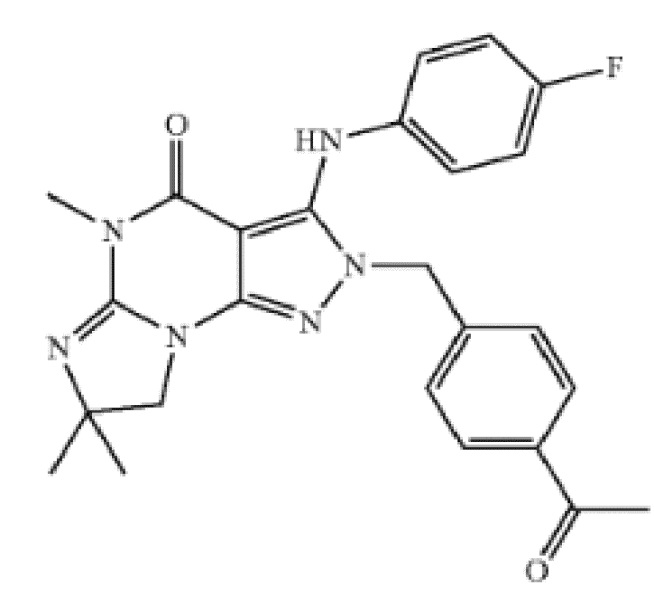
1. Способ лечения глиомы, включающий введение фармацевтически приемлемого количества ингибитора PDE1 нуждающемуся в этом субъекту, где ингибитор PDE1 выбран из любого из следующих:
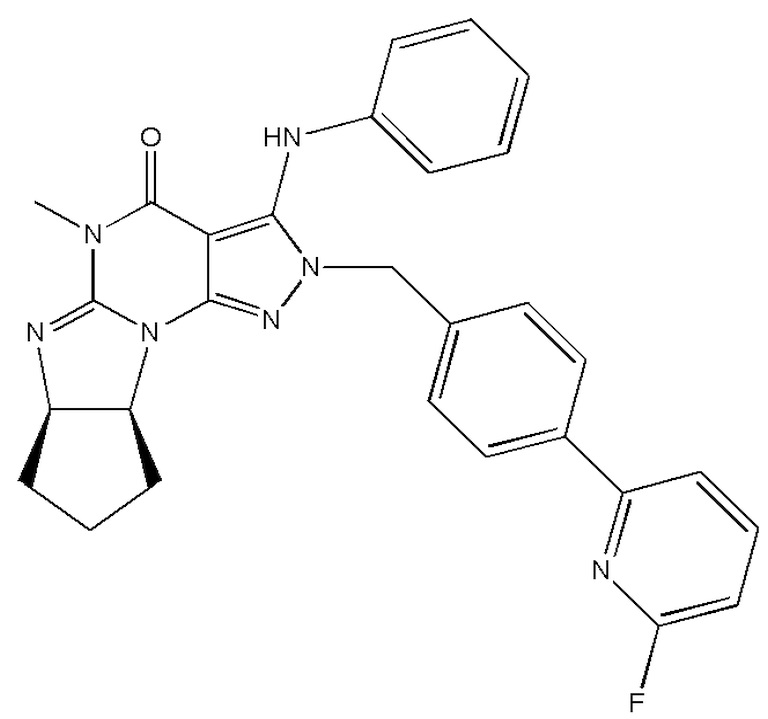 или
или 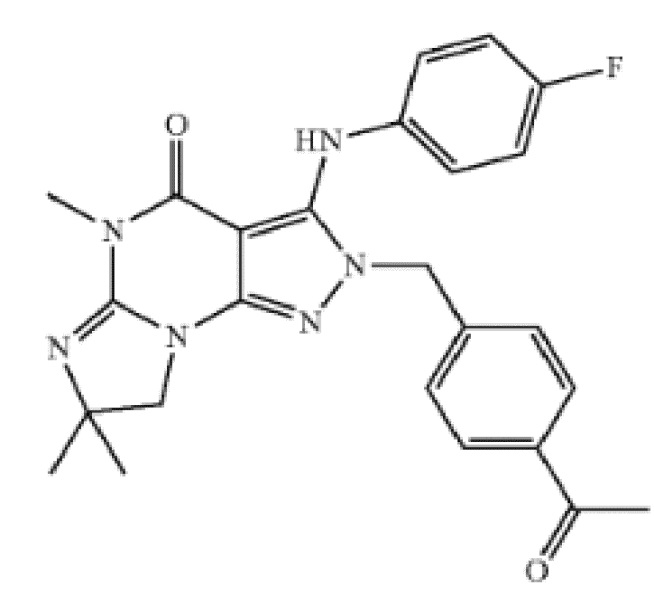
в свободной форме или в форме фармацевтически приемлемой соли.
2. Способ по п. 1, где глиома представляет собой мультиформную глиобластому.
3. Способ по п. 1 или 2, где ингибитор PDE1 вводят в комбинации с противоопухолевым средством.
4. Способ ингибирования синдрома высвобождения цитокинов, включающий введение эффективного количества ингибитора PDE1 пациенту, страдающему от глиомы и получающему одно или более из химиотерапевтического лечения, иммунологического лечения, генной терапии и/или терапии антителами, где ингибитор PDE1 выбран из любого из следующих:
 или
или 
в свободной форме или в форме фармацевтически приемлемой соли.
5. Способ по п. 4, где глиома представляет собой мультиформную глиобластому.
6. Способ по п. 4 или 5, где ингибитор PDE1 вводят в комбинации с противоопухолевым средством.
| US 20140235556 A1, 21.08.2014 | |||
| US 9073936 B2, 07.07.2015 | |||
| US 8273751 B2, 25.09.2012 | |||
| US 4690935 A1, 01.09.1987 | |||
| WO 2016044667 A1, 24.03.2016 | |||
| WO 2018093591 A1, 24.05.2018 | |||
| ROWTHER, F.B., et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Molecular | |||
Авторы
Даты
2024-01-18—Публикация
2019-05-24—Подача