Изобретение относится к способам получения аминокислот из белков животного или растительного сырья. Амидные (пептидные) связи способны гидролизоваться как в кислой, так и в щелочной среде.
Пептиды и белки гидролизуются с образованием либо более коротких цепей - это так называемый частичный гидролиз, либо смеси α-аминокислот при полном гидролизе.
Уровень техники.
Известно, что белки представляют наиболее важную составную часть организмов. Они содержатся в протоплазме и ядре всех растительных и животных клеток и являются главными носителями жизни.
Функции белков в организме многообразны.
Белки служат тем пластическим материалом, из которого построены опорные мышечные и покровные ткани. С помощью белков осуществляется перенос веществ в организме, например доставка кислорода из легких в ткани и выведение образовавшегося оксида углерода.
Белки-ферменты катализируют в организме многочисленные химические реакции. Для каждой химической реакции, протекающей в организме существует свой отдельный белок-катализатор (фермент).
В процессе переваривания пищи происходит гидролиз белков под влиянием ферментов. В желудке они расщепляются на более или менее крупные "осколки" - полипептиды, которые далее в кишечнике гидролизуются до аминокислот. В отличие от углеводов и жиров аминокислоты в запас не откладываются. Основная масса аминокислот в организме расходуется на синтез белков, которые идут на увеличение белковой массы организма при его росте и на обновление всех белков, распадающихся в процессе жизнедеятельности. Синтез белков идет с поглощением энергии.
Обычно гидролиз осуществляют в кислой среде. Щелочной гидролиз практически не используется из-за неустойчивости многих α-аминокислот в щелочной среде. При щелочном гидролизе белков образуются остатки лаптионина и лизиноаланина которые являются токсичными для организма человека и животных. При таком гидролизе разрушаются аргинин, лизин и цистин, поэтому для получения гидролизатов его практически не используют.
Полный гидролиз любых пептидов и белков в кислой среде достигается при кипячении их с 6н(~20%) хлороводородной кислотой в течение 24 часов.
Недостатком кислотного гидролиза является полное разрушение триптофана, частичное оксиаминокислот (серина и треонина), дезаминирование амидных связей аспарагина и глутамина, с образованием аммиачного азота, разрушение витаминов. Кроме того, при нейтрализации кислотных гидролизатов образуется большое количество солей, хлоридов или сульфатов.
Широко используется ферментативный гидролиз, катализируемые пептидазами.
Этим путем в основном проводят частичный гидролиз. В группе пептидаз имеются ферменты, избирательно гидролизующие пептидные связи либо внутри белковой молекулы - эндопептидазы, либо на конце цепи - отщепляющие аминокислоту с N или С-конца.
Многие пептидазы расщепляют пептидные связи только между определенными аминокислотами остатками. Так трипсин гидролизует пептидные связи, образованные с участием лизина или аргинина с другими аминокислотами, химотрипсин - пептидную связь, образованную фенилаланином, триптофаном или тирозином с другими аминокислотами, а пепсин расщепляет пептидную связь между двумя аминокислотами с неполярными (гидрофобными) радикалами, например между валином и лейцином.
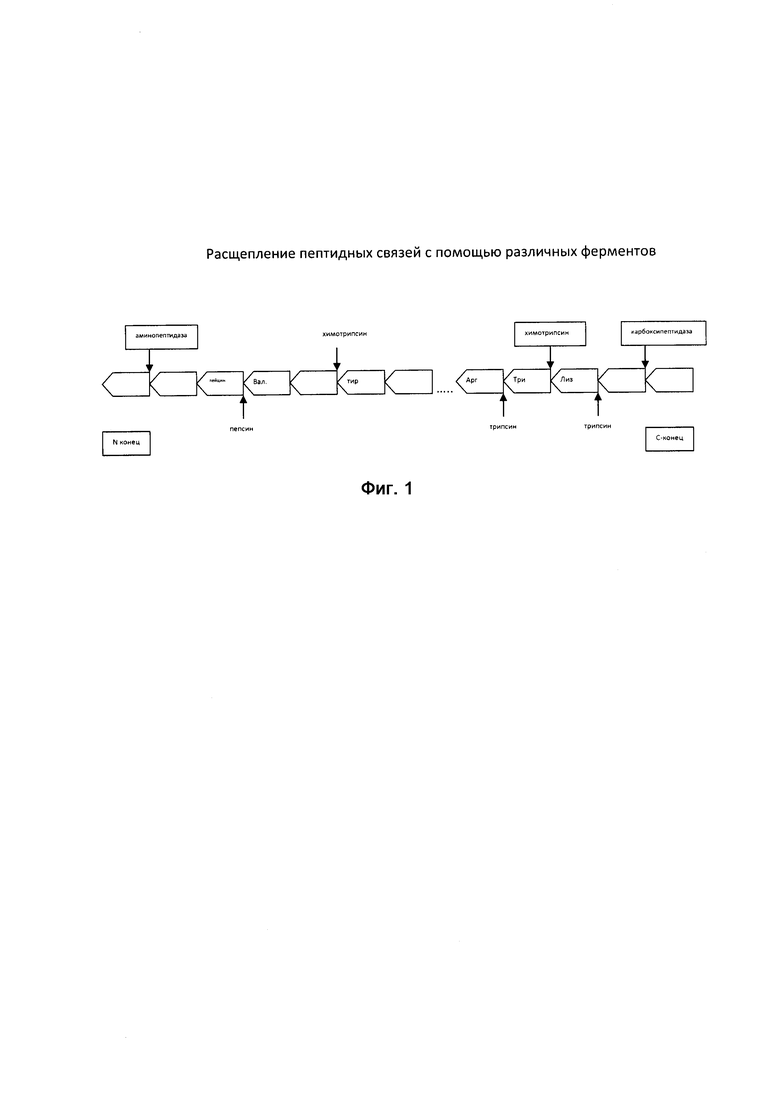
Для полного гидролиза необходим широкий набор пептидаз. В целом белки пищи подвергаются в желудочно-кишечном тракте полному расщеплению, поскольку организм может усваивать только свободные α-аминокислоты. На ФИГ-1 изображено расщепление пептидных связей с помощью различных ферментов.
Таким образом, из ФИГ-1 видно, что для осуществления ферментативного способа получения аминокислот требуются протеолитические ферменты (трипсин, химотрипсин, карбоксипептидаза, эластаза, коллагеназа, аминопептидазы), которые начинают действовать во рту (слюна), в желудке, + желчь, + в тонком кишечнике.
В результате взаимодействия всех ферментов белки гидролизуются до α-аминокислот и мелких пептидов.
Для осуществления расщепления белков на аминокислоты вне организма нужна простая технология, которая сможет быстро осуществлять разделение белков на отдельные аминокислоты в присутствии воды, в достаточном количестве, для протекания реакций гидролиза. Для примера укажем реакции полного гидролиза одного трипептида, изображенного на ФИГ-2.
Из литературных источников известно что белки подразделяются на простые (протеины) и сложные (протеиды). При гидролизе протеинов в качестве продуктов расщепления образуется только α-аминокислоты. Протеиды при гидролизе распадаются на белковую часть состоящую из α-аминокислот, и не белковую, то есть другие органические и неорганические соединения. Небелковую часть называют простетической группой. Примерами сложных белков служат транспортные белки миоглобин и гемоглобин. В них белковая часть-глобин - соединена с с простетической группой-гемом.
Протеиды принято классифицировать по характеру простетических групп. Гликопротеины содержат в качестве небелковой части углеводы, липопротеиды - липиды, нуклеопротеиды-нуклеиновые кислоты, фосфопротеиды-остаток фосфорной кислоты. Металлопротеиды-широкая группа протеидов, к которым, например, относятся железопорфиринсодержащие белки (миоглобин, гемоглобин), а также множество металлоферментов.
В организме биополимеры относительно редко встречаются в "чистом" виде. В основном они входят в состав сложных образований с высоким уровнем организации, включающих в качестве субъединиц различные биополимеры и другие соединения.
Примером таких образований служат:
- материал клеточных стенок бактерий;
- соединительная ткань;
- групповые вещества крови;
- вирусы.
Гидролиз протеидов - фундаментальная реакция в химии биополимеров.
Она лежит в основе гидролитического расщепления биополимеров, осуществляемого в организме, а также используемого во многих промышленных процессах.
Изобретение ориентировано на получение α-аминокислот, путем гидродинамического кавитационного воздействия на белки животного и растительного сырья, без привлечения кератиносодержащего сырья (перья, волосы, щетина, копыта, когти, клювы, панцири черепах, китовый ус, иглы дикобраза, чешуя рыб).
Перед использованием кератиносодержащего сырья его необходимо обработать в щелочной среде, нейтрализовать в кислоте, тщательно промыть от остатков кислоты и солей, а затем проводить кислотный гидролиз, путем кавитационного воздействия, в "присутствии" кислоты.
Сущность изобретения.
Настоящее изобретение относится к универсальному способу получения α-аминокислот из белкового сырья органического и растительного происхождения, путем кавитационного воздействия в "присутствии" кислоты.
Для увеличения площади контакта белкового сырья органического происхождения с кавитационными пузырьками, его предварительно измельчают в дробилке или мясорубке. Зерновую часть растительного происхождения обрабатывают в плющилке или дробилке. Затем в органическое сырье животного происхождения или растительного происхождения добавляют воду в количестве 1:3.
Запускаем кавитационный генератор-диспергатор КГД - 2,08/60 в работу и добавляем на 40 кг смеси - 40 г концентрированной соляной кислоты (36,9%).
Сырье по всасывающему рукаву поступает 8 кавитационный генератор-диспергатор и по напорному рукаву возвращается в емкость.
После набора сырьем температуры 60°-65°С работу прекращаем. Гидролиз белков при наборе температуры 60°С почти закончен, а температура 65°С необходима для гидролиза крахмала.
Известна "водорастворимая кормовая добавка из органического сырья и способ ее получения", патент России №2335918.
Изобретение относится к кормопроизводству. Водорастворимая кормовая добавка из органического сырья содержит тонкодиспергированную твердую фазу, структурированную гелеобразную воду, химически связанную с дисперсными частицами упомянутой твердой фазы, и свободную воду при следующем соотношении масс (%): тонкодиспергированная твердая фаза 15-25; структурированная гелеобразующая химически связанная вода 55-65; свободная вода остальное.
Недостатками названного изобретения являются:
- необходимость кавитационного тонкодисперсного измельчения твердой фазы корма (до субмикронного уровня).
- отсутствие гидролиза органического сырья в аминокислоты.
Известно изобретение, патент России №2272418 "Способ получения гидролизатов из костных отходов мяса, птицы, рыбы".
Способ получения гидролизатов из отходов мясо-, птице-, и рыбоперерабатывающих производств, включающий гидролиз сырья водой и соляной кислотой, с последующей нейтрализацией гидроксидом натрия, очистку от жира и взвешенных твердых частиц, гомогенизацию и сушку полученного гидролизата. Процесс гидролиза проводят в три стадии: после водного гидролиза, проводимого при температуре 100°-120°С и массовом соотношение сырья и воды 1:2-1:3, в течении 4-5 часов, отделяют жидкую фракцию (гидролизат) которую очищают от жира и взвешенных частиц и сушат, в твердый остаток вносят раствор соляной кислоты 1-2% в соотношении сырья и раствора 1:1-1:2 и гидролизуют 4-5 часов при температуре 100°-120°С, отделяют жидкую фракцию (гидролизат 2), которую нейтрализуют гидроксидом натрия, очищают от жира и взвешенных частиц и сушат. А в твердый костный остаток добавляют 3-4% раствор соляной кислоты в соотношении сырья и раствора 1:1-1:2, гидролизуют 4-5 часов при температуре 120°-140°С (гидролизат 3), нейтрализуют гидроксидом натрия, гомогенизируют и сушат. Прототип.
Недостатками названного изобретения являются:
- трехступенчатый гидролиз мясокостного сырья;
- трехкратная сушка изолята и последующее измельчение;
- отсутствие данных о содержании в изоляте α-аминокислот.
Известно изобретение, патент России №2484638 "Способ получения аминокислотного биокомпозита из отрубей".
Способ предусматривает получение в механоакустическом гомогенизаторе суспензии из отрубей, смешанных с водой, внесение в нее протеолитических ферментов (Протосубтилин ГХЗ) и последующий гидролиз при температуре 45°-55° в течении 5-6 часов, полученный биокомпозит содержит до 16% белка и аминокислот до 11,4%.
Недостатками названного изобретения являются:
- длительность процесса;
- необходимость применения протеолитических ферментов;
- большое количество белка не подвергшегося гидролизу;
- малое количество незаменимых аминокислот (3 из 7-8 шт. ).
Известно изобретение, патент России №2501296 "Способ получения витаминно-аминокислотного кормового комплекса из зерна пшеницы".
Способ получения витаминно-аминокислотного кормового комплекса из зерна пшеницы включает измельчение зерна, выдержку его в подогретой до 45°-50°С воде в течении 3 часов для активации растительных ферментов зерна, кавитация в течение 30-40 минут. По окончании кавитации в полученную массу вносят комплекс молочнокислых бактерий. При этом температура массы поддерживается в пределах 37°-40°С в течении 12-16 часов.
Положительные качества изобретения: выделение 15 аминокислот и 7 витаминов.
Недостатками изобретения являются:
- длительность процесса расщепления белков и синтеза витаминов - 12-16 часов;
- не использование кавитации для разделения молекул белков на α-аминокислоты. (Прототип).
Подробное описание.
Настоящее изобретение относится к универсальному способу получения α-аминокислот из белкового сырья животного и растительного происхождения, путем кавитационного воздействия высокой плотности в "присутствии" кислоты.
Для увеличения площади контакта белкового сырья с кавитационными пузырьками, его предварительно моют, измельчают в дробилке или мясорубке.
Зерновую часть растительного происхождения предварительно моют в воде, а затем обрабатывают в плющилке или дробилке.
Затем в органическое сырье животного происхождения или растительного происхождения добавляем воду, из расчета 3 объема воды на 1 объем белкового сырья. Опускаем всасывающий и напорный шланги кавитационного генератора-диспергатора КГД 2.08/60 в работу и добавляем на 10 кг смеси 10 г концентрированной соляной кислоты (концентрация НСС в кислоте 36,9%). Смесь белкового сырья и воды по всасывающему рукаву поступает в кавитационный генератор-диспергатор, проходит кавитационную обработку и по напорному рукаву возвращается в емкость.
После набора сырьем температуры 60°-65°С работу прекращаем.
Кавитация большой плотности в жидкости сопровождается образованием большого количества кавитационных пузырьков. Ударные волны, образующиеся от схлопывания пузырьков легко разделяют белки на аминокислоты. Одновременно с белками вода разлагается на водород и группу ОН-, что ускоряет "залечивание" обеих концов аминокислот делая их нейтральными. Окончания молекул аминокислот (карбоксильная группа и аминогруппа) химически активны и, находясь в воде, они нейтрализуют концы аминокислот присоединением к карбоксильной группе - ОН-, а к аминогруппе Н+. Гидролиз белков при наборе температуры 60°С почти окончен, а температура 65°С необходима для гидролиза крахмала и гликопротеидов.
Далее полученную массу выдерживают в течение 1-2 часов при температуре 60°-65°С для более полного протекания гидролиза крахмала и гликопротеидов.
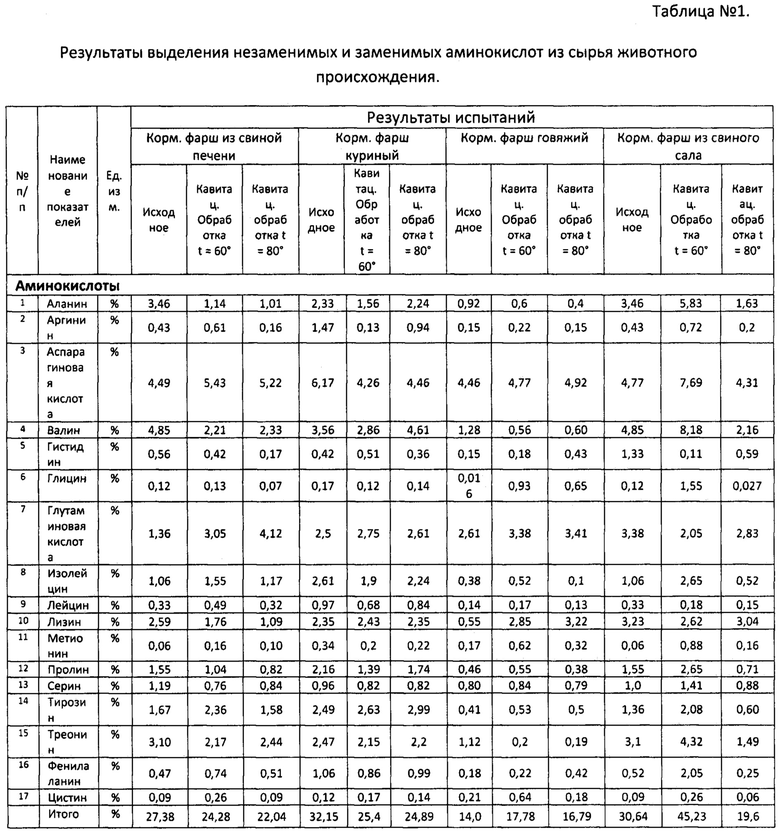
Результаты выделения незаменимых и заменимых аминокислот из сырья животного происхождения (Таблица №1) показывают, что наиболее выгодной температурой является 60°С. При 80°С происходит резкое снижение содержания аминокислот почти во всех образцах:
Пример №1.
Выделение аминокислот из фарша свиной печени при температуре 60°С увеличились, по сравнению с исходным материалом по следующим аминокислотам.
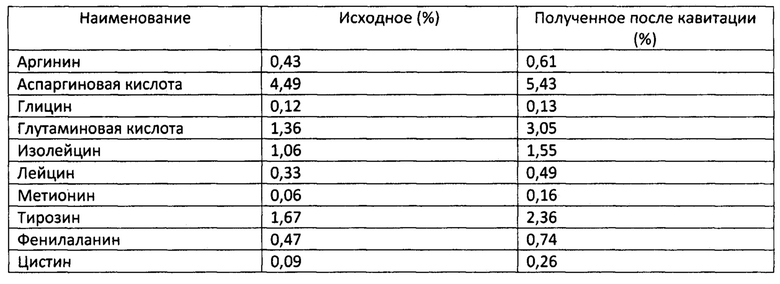
Пример №2.
Выделение аминокислот из фарша куриных отходов при температуре 60°С.
Увеличение содержания аминокислот по сравнению с исходным количеством произошло по следующим аминокислотам:

Пример №3
Выделение аминокислот из фарша говяжьего при температуре 60°С.

Пример №4.
Выделение аминокислот из фарша свиного сала при температуре 60°С.
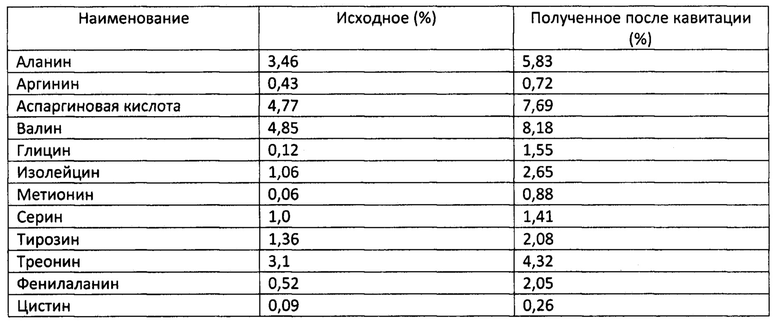
Анализируя прирост аминокислот после кавитационной обработки различного сырья животного происхождения видим, что наибольший прирост происходит в свином сале.
Механизмы кавитационного гидролиза белков происходят по следующей схеме.
Кавитационные пузырьки, при большой плотности кавитации, разрывают белковые цепочки на отдельные аминокислоты.
Окончания молекул аминокислот (карбоксильная группа и аминогруппа) химически активны и, находясь в воде, они нейтрализуют концы аминокислот присоединением к карбоксильной группе - ОН, а к аминогруппе - Н.
В случае недостаточного для полного гидролиза всех аминокислот, часть аминокислот может образовывать внутренние соли. Карбокильная группа, входящая в состав аминокислот обладает кислотными свойствами (может отщеплять протон), аминогруппа - основными свойствами (может присоединять протон). За счет взаимодействия этих двух групп аминокислоты могут образовывать внутренние соли, например:
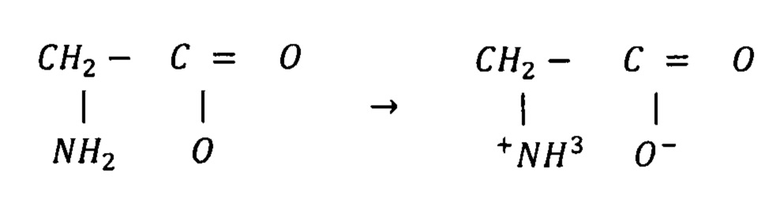
Это свойство аминокислот объясняет причину отсутствия кислой или щелочной реакции растворов этих соединений.
Основную «прибавку)) аминокислот после кавитационного гидролиза дают протеиды, которые при гидролизе разделяются на белковую часть, состоящую из α-аминокислот, и небелковую, которая называется простетической группой (гликопротеиды, липопротеиды, нуклеопротеиды, фосфопротеиды). В дальнейшем, кавитация разделяет полученные белки на аминокислоты, а простетиды (протеиды) подвергаются своим реакциям гидролиза путем гидродинамического кавитационного расщепления.
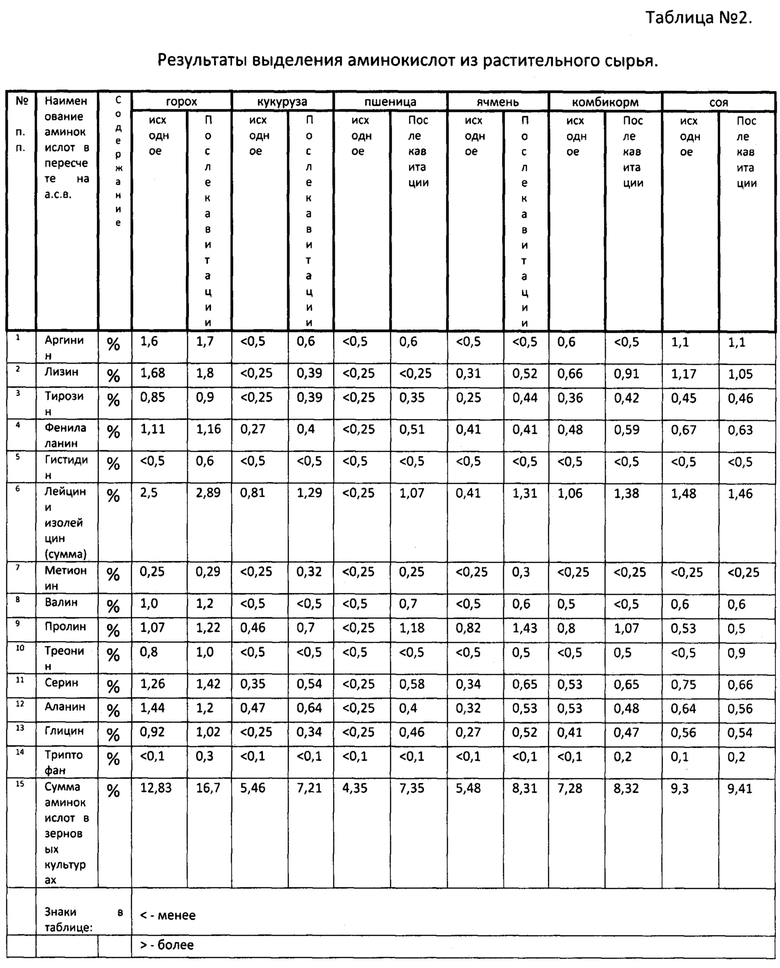
Таблица №2 отражает результаты выделения аминокислот из растительного сырья. Известно, что зерновые злаки растительного сырья содержат белки двух типов - переваримого белка, состоящего из α-аминокислот и протеиды.
Из таблицы №1 видно, что большая часть α-аминокислот получила прибавку за счет кавитационного разложения протеидов е только содержание на α-аминокислоты и гидролизуемые протеиды.
Например, в горохе только содержание аланина уменьшилось после кавитации, в кукурузе, пшенице, ячмене произошло увеличение содержания α-аминокислот, а по некоторым (аргинин, лизин, гистидин, метионин, треонин, триптофан) содержание аминокислот сохранилось на исходном уровне.
Кавитационный гидролиз белков растительного сырья показывает, что расщепление можно провести вне организма, а имея подобные данные по всем компонентам корма, например для свиней и птицы, можно составлять рационы на основе выделенных α-аминокислот прописывая оптимальные уровни без закладывания «больше, чем надо), как это происходит при использование плохоперевариваемого протеинового сырья.
Обмен веществ в организмах свиней и птицы, потребляющих сбалансированные по аминокислотам рационы менее интенсивен, животным и птице не требуется расходовать дополнительную энергию на выделение азота из организма, и, таким образом, температура тела снижается, а полезная энергия тратится продуктивно на увеличение веса или производство яйца.
Идеальный рацион протеина в кормах, с выделением части или полностью аминокислот вне организма означает, что незаменимые и заменимые аминокислоты входят в состав рациона в количестве, строго необходимом для удовлетворения потребностей животных и птицы без выделения избыточного азота в окружающую среду.
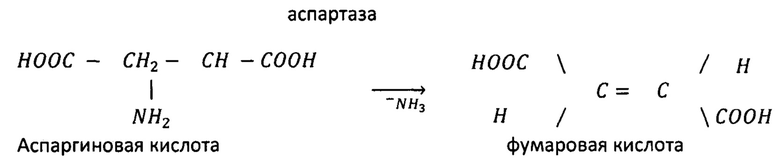
Потеря аминогруппы без участия кислорода происходит путем отщепления аммиака под действием ферментов с образованием α и β-непредельных кислот. С помощью этой реакции снижается избыток незаменимых и заменимых α-аминокислот в организме, которые входили в состав рациона, выше необходимых количеств для удовлетворения потребностей организма, за счет действия ферментов, оксидаз и кофермента НАД+ с выделением NH3. Образующийся аммиак включается в организм в цикл мочевины. Азот, который не был использован на увеличение веса или производство яйца, должен перейти в нетоксичную форму (мочевая кислота) и выделиться из организма, а производство метаболита азота - мочевой кислоты требует существенного количества обменной энергии, так необходимой для растущих организмов.
Список использованной литературы:
1. Цветков Л.А. «Органическая химия» учебник для 10 класса, М., Просвещение, 1982 год., стр. 145-147, 151-164, 176-191.
2. Хомченко Н.Г. «Общая химия». г. Москва, Новая Волна. ОНИКС - 2000 г. Стр. 443-450.
3. Кузьменко Н.Е., Еремин В.В., Попков В.А. «Начала химии», современный курс для поступающих в ВУЗы. Экзамен, ОНИКС - 21 век, Москва - 2001. Стр. 575-650.
4. Тюкавкина Н.А., Бауков Ю.Н. «Биорганическая химия». Москва, «Медицина», 1985 г. Стр 295-328, 349-361, 368-370, 378-382, 384-401, 431-442.
5. Максимюк Н.Н., Марьяновская Ю.В. «О преимуществах ферментативного способа получения белковых гидролизатов» // Современные проблемы науки и образования - 2009 г. - №1.
6. Маркевич Д.В., Путятин Ю.В., Таврыкина О.М. «Сравнительный анализ состава незаменимых аминокислот в основной продукции зерновых культур». «Почвоведение и агрохимия» №1(50) 2013 г. УДК 636.087.74:633.1
7. Антипова Л.В., Сторублевцев С.А. «Перспективы использования вторичных продуктов убоя сельскохозяйственных животных на пищевые цели и получение коллагеновых субстанций» УДК 664.696.2
8. Крупская Т.К., Лосева Л.П., Землякова Е.С., Мезенова Н.Ю., Волков В.В. «Изучение элементного состава поверхностных тканей рыб». УДК 543.427.4.
9. Воробьев В.И., Нижникова Е.В. «Исследования и применение рыбной чешуи в различных отраслях промышленности (обзор)». УДК 591.471.13:54(06)
10. Кун К. кафедра птицеводства Университета штата Арканзас, США, e-mait: ccoon@uark, edu. Идеальное аминокислотное соотношение в рационах бройлеров.
11. Патент России №2667427 «Пищевой белковый ингридиент и способы его получения».
12. Патент России №2601125 «Способы получения щелочных гидролизатов растительных белков».
13. Патент России №2272418 «Способ получения гидролизатов из костных отходов мяса, птицы, рыбы».
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРИГОТОВЛЕНИЯ ОБЕЗЗАРАЖЕННЫХ ЖИДКИХ КОРМОВ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2366270C1 |
| КАВИТАЦИОННЫЙ СПОСОБ ПРИГОТОВЛЕНИЯ ТЕСТА ИЗ ПРОРОЩЕННОГО ЗЕРНА ПШЕНИЦЫ И РЖИ | 2014 |
|
RU2555141C1 |
| КАВИТАЦИОННЫЙ СПОСОБ ОБЕЗЗАРАЖИВАНИЯ ЖИДКОГО НАВОЗА И ПОМЕТА И ТЕХНОЛОГИЧЕСКАЯ ЛИНИЯ ДЛЯ БЕЗОТХОДНОГО ПРИГОТОВЛЕНИЯ ОРГАНОМИНЕРАЛЬНЫХ УДОБРЕНИЙ | 2013 |
|
RU2527851C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЖИДКИХ КОРМОВ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2006 |
|
RU2316227C1 |
| БУЛЬОН С ПРОФИЛАКТИЧЕСКИМИ СВОЙСТВАМИ, СОДЕРЖАЩИЙ БЕЛКОВЫЙ ГИДРОЛИЗАТ, И СПОСОБ ПОЛУЧЕНИЯ ЭТОГО БЕЛКОВОГО ГИДРОЛИЗАТА | 2007 |
|
RU2366263C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОРГАНОМИНЕРАЛЬНЫХ УДОБРЕНИЙ И ТЕХНОЛОГИЧЕСКАЯ ЛИНИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2005 |
|
RU2296731C2 |
| БЕЛКОВО-ПЕПТИДНЫЙ МОДУЛЬ ДЛЯ ПРОИЗВОДСТВА ПРОДУКТОВ ФУНКЦИОНАЛЬНОГО И СПЕЦИАЛИЗИРОВАННОГО ПИТАНИЯ ДЛЯ ЛИЦ, ПОДВЕРЖЕННЫХ ИНТЕНСИВНЫМ ФИЗИЧЕСКИМ НАГРУЗКАМ | 2008 |
|
RU2388350C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КАВИТАЦИОННОГО ВОДОУГОЛЬНОГО ТОПЛИВА (КаВУТ) И ТЕХНОЛОГИЧЕСКАЯ ЛИНИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2006 |
|
RU2380399C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВИТАМИННО-АМИНОКИСЛОТНОГО КОРМОВОГО КОМПЛЕКСА ИЗ ЗЕРНА ПШЕНИЦЫ | 2010 |
|
RU2501296C2 |
| Способ получения белково-коллагеновой эмульсии на основе мясокостного остатка для использования в производстве продуктов питания | 2018 |
|
RU2689729C1 |

Изобретение относится к биотехнологии. Предложен способ получения α-аминокислот из белкового сырья животного и растительного происхождения. Способ включает мойку сырья, измельчение в дробилке или плющилке, в измельченное белковое сырье животного или растительного происхождения сырье добавляют воду из расчета 3 объема на 1 объем белкового сырья, смесь обрабатывают в кавитационном генераторе-диспергаторе КГД-2,08/60, воздействие гидродинамической кавитацией высокой плотности проводят в присутствии соляной кислоты, нагревая водно-белковую субстанцию до 60-65°С, при этом концентрированную соляную кислоту из расчета 10 г на 10 кг смеси используют в качестве катализатора. Изобретение позволяет получать α-аминокислоты из белкового сырья животного и растительного происхождения. 2 ил., 2 табл., 4 пр.
Способ получения α-аминокислот из белкового сырья животного и растительного происхождения, включающий мойку сырья, измельчение в дробилке или плющилке, воздействие гидродинамической кавитацией высокой плотности в присутствии соляной кислоты, нагревая водно-белковую субстанцию до 60-65°С, отличающийся тем, что в измельченное белковое сырье животного или растительного происхождения добавляют воду из расчета 3 объема на 1 объем белкового сырья, смесь обрабатывают в кавитационном генераторе-диспергаторе КГД-2,08/60, при этом концентрированную соляную кислоту из расчета 10 г на 10 кг смеси используют в качестве катализатора.
| Кавитационная технология приготовления кормов, 12.04.2021, весь документ https://kavut.ru/%D0%BA%D0%B0%D0%B2%D0%B8%D1%82%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F-%D1%82%D0%B5%D1%85%D0%BD%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F-%D0%BF%D1%80%D0%B8%D0%B3%D0%BE%D1%82%D0%BE%D0%B2%D0%BB%D0%B5/ | |||
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТОВ ИЗ КОСТНЫХ ОТХОДОВ МЯСА, ПТИЦЫ, РЫБЫ | 2004 |
|
RU2272418C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИНОКИСЛОТНОГО БИОКОМПОЗИТА ИЗ ОТРУБЕЙ | 2011 |
|
RU2484638C2 |
Авторы
Даты
2024-02-29—Публикация
2022-07-19—Подача