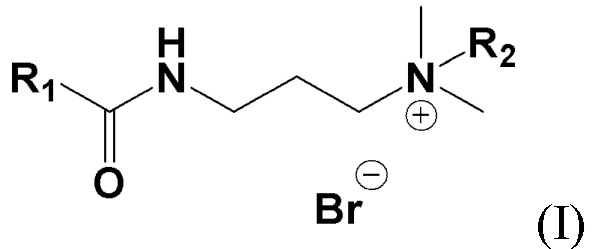
Изобретение относится в целом к медицине, более детально к новым четвертичным аммониевым соединениям на основе терпенов общей формулы I, проявляющим противомикробные свойства. Соединения могут найти применение в медицине и ветеринарии.
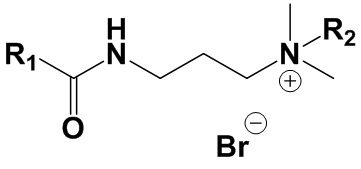
где:
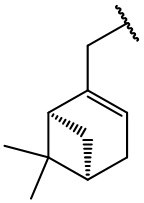
остаток (+)-миртенола
остаток (+)-миртенола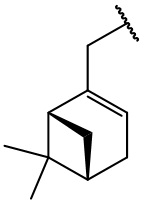
остаток (-)-миртенола
остаток (-)-миртенола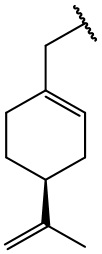
остаток (-)-периллового спирта
остаток (-)-периллового спирта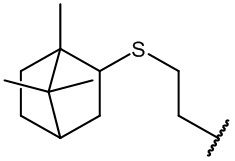
остаток (+)-этилтиоборнеола
остаток (+)-этилтиоборнеола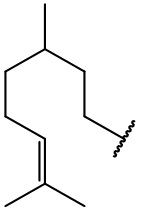
остаток (-)-цитронеллола
остаток (-)-цитронеллола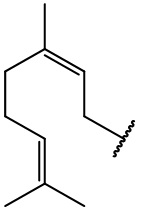
остаток гераниола
остаток гераниола
Инфекционные заболевания являются одной из важнейших проблем мирового здравоохранения. В последние годы во всем мире наблюдается взрывной рост распространенности локальных и системных бактериальных и грибковых инфекций, вызываемых не чувствительными к антибиотикам и антисептикам штаммами. Подобный рост наблюдается как для внутрибольничных инфекций, возникающих в лечебно-профилактических учреждениях вследствие распространения микробов от пациента к пациенту, так и для внебольничных случаев заражения. Все это обуславливают необходимость разработки принципиально новых высокоэффективных в отношении, прежде всего, резистентных штаммов микроорганизмов противомикробных средств [Brown G.D., Denning D.W., Gow N.A.R., Levitz S.M., Netea M.G., White T.C. Hidden killers: human fungal infections / Sci. Transl. Med. - 2012. - V. 4, Iss. 165. - P.165rv13].
Четвертичные аммониевые соединения (ЧАС) уже более 100 лет применяются в лечебной практике в качестве антисептических средств и в настоящее время являются важнейшим сегментом рынка антисептических препаратов как в РФ, так и во всем мире. Они имеют широкую область применения, в частности, в терапии местных гнойно-воспалительных процессов, обработке неповрежденной кожи перед операциями, консервировании глазных капель, инъекционных растворов, косметических средств, а также дезинфекции и очистке поверхностей и медицинского оборудования. Механизм антибактериального действия ЧАС заключается в их адсорбции и проникновении через клеточную стенку микроорганизмов с последующим взаимодействием с фосфолипидами цитоплазматической мембраны, что приводит к полной структурной дезорганизации и последующей гибели клетки [McDonnell G., Russell A.D. Antiseptics and Disinfectants: Activity, Action, and Resistance / Clinical Microbiology Reviews. - 1999 - V. 12, №. 1. - P. 147-179]. Среди представителей данного класса соединений стоит выделить высокоэффективные антисептические препараты мирамистин, деквалиния хлорид, цетилпиридиния хлорид, дидецилдиметиламмония хлорид, бензалкония хлорид и ряд других [Gilbert P., Moore L.E. Cationic antiseptics: Diversity of action under a common epithet / J. Appl. Microbiol. - 2005. - V. 99, Iss. 4. - P. 703-715]. Обладая широким спектром противомикробной активности в отношении грамположительных и грамотрицательных бактерий, грибов, вирусов и простейших, они не лишены некоторых недостатков. Главными недостатками этих соединений являются, с одной стороны, выработка к ним резистентности, а с другой - достаточно высокая токсичность. Кроме этого, ЧАС недостаточно активны в отношении спор, простых вирусов, грамотрицательных бактерий, микобактерий и грибов [Jennings M.C., Minbiole K.P.C., Wuest W.M. Quaternary ammonium compounds: an antimicrobial mainstay and platform for innovation to address bacterial resistance / ACS Infect. Dis. - 2015. - V. 1, Iss. 7. - P. 288-303].
Прототипом можно определить известный антисептик мирамистин, поскольку он обладает схожим действием и близкой структурой, отличающийся от заявленных соединений прежде всего наличием бензильного фрагмента вместо терпенового.
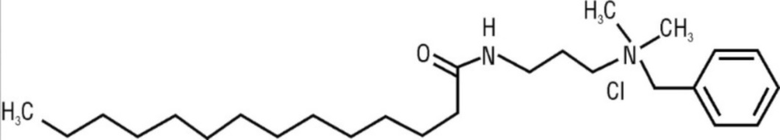
Мирамистин ((бензилдиметил[3-(миристоиламино)пропил]-аммонийхлорид моногидрат) - антисептик, обладающий широким спектром бактерицидного действия в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp. и др.), аэробных и анаэробных бактерий, патогенных грибов и вирусов, включая клинические штаммы с полирезистентностью к антибиотикам [Регистр лекарственных средств России РЛС Энциклопедия лекарств. - 20-й вып. Гл.ред. Г.Л. Вышковский. - М.: ЛИБРОФАРМ, 2011. - С. 1368]. Препарат применяется в профилактике нагноений и лечении гнойных ран, лечении и профилактике кандидозов кожи и слизистых оболочек, комплексном лечении острых и хронических отитов, лечении и профилактике инфекционно-воспалительных заболеваний полости рта (стоматитов, гингивитов, пародонтитов, периодонтитов), индивидуальной профилактике заболеваний, передаваемых половым путем (сифилиса, гонореи, хламидиоза, генитального герпеса и др.) [Блатун Л.А. Мирамистин в комплексной программе борьбы с госпитальной инфекцией в хирургическом стационаре // В сб.: Мирамистин: применение в хирургии, травматологии и комбустиологии. М. - 2006. - С. 27-33.; Макеева И.М. Е.В. Боровский, М.В. Матавкина, Е.А. Бровенко. Применение препарата Мирамистин в комплексном лечении заболеваний слизистой оболочки рта. Фарматека. - 2013. - №3 - С. 1].
Следует отметить, что описанные выше лекарственные препараты, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному изобретению вследствие того, что они не совпадают с заявляемыми соединениями по химической структуре, хотя и обладают противомикробной активностью, т.к. совпадают по назначению, зачастую уступающей заявленному техническому решению в отношении более высокой эффективности, при использовании по назначению (см. примеры, представленные далее).
Терпены и их производные, обычно встречающиеся в эфирных маслах, как сообщается, проявляют умеренные противомикробные свойства и низкую токсичность [Zielińska-Błajet, M.; Feder-Kubis, J. Monoterpenes and their derivatives-Recent development in biological and medical applications. Int. J. Mol. Sci. 2020, 21, 7078.], таким образом использование терпенов и их производных в разработке противомикробных препаратов является многообещающим подходом в медицинской химии. Заявленное техническое решение представлено молекулами, содержащими в себе одновременно как терпеновый фрагмент, так и фрагмент ЧАС.
Заявленное техническое решение иллюстрируется чертежом.
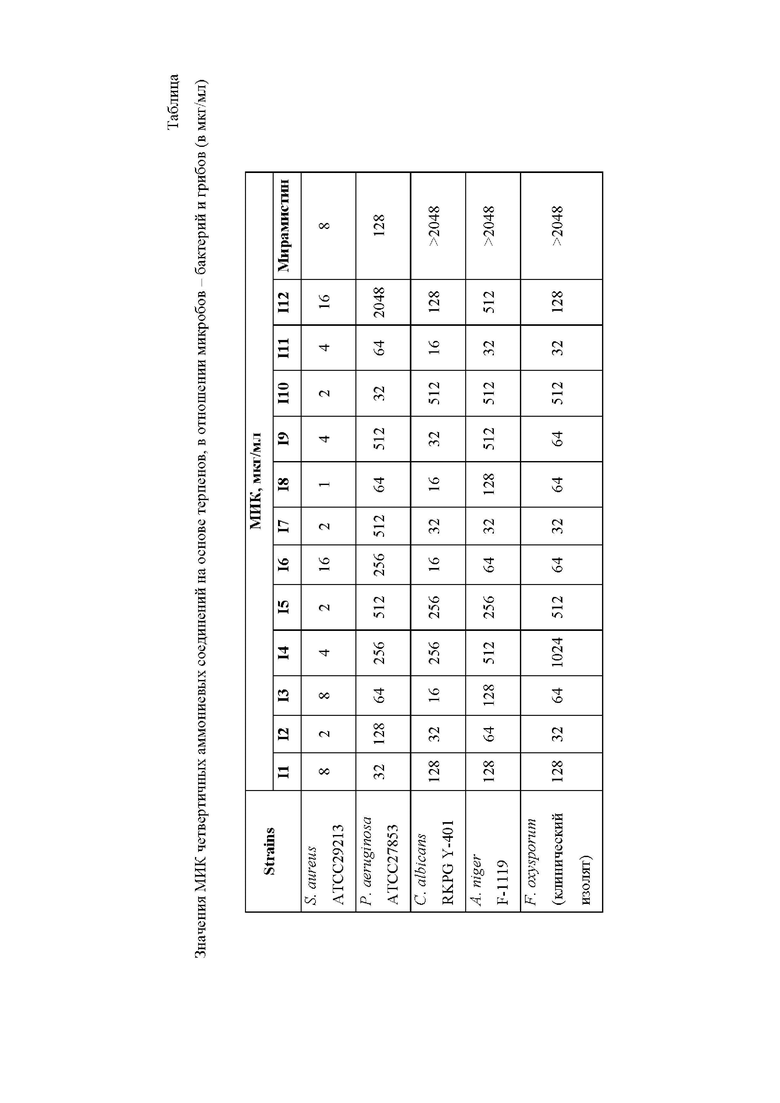
На чертеже приведена Таблица 1, в которой представлены значения МИК (минимальная ингибирующая концентрация) четвертичных аммониевых соединений на основе терпенов в отношении микробов - бактерий и грибов.
Технической проблемой, решаемой заявленным изобретением, и техническим результатом заявленного технического решения является расширение арсенала известных средств указанного назначения путем создания новых соединений общей формулы (I), содержащих в своем составе фрагмент терпена и четвертичный аммониевый фрагмент, и обладающих противомикробной активностью.
Сущностью заявленного технического решения являются четвертичные аммониевые соединения на основе терпенов общей формулы (I):

где:

остаток (+)-миртенола
остаток (+)-миртенола
остаток (-)-миртенола
остаток (-)-миртенола
остаток (-)-периллового спирта
остаток (-)-периллового спирта
остаток (+)-этилтиоборнеола
остаток (+)-этилтиоборнеола
остаток (-)-цитронеллола
остаток (-)-цитронеллола
остаток гераниола
остаток гераниола
Четвертичные аммониевые соединения на основе терпенов по п.1, обладающие противомикробной активностью.
Далее заявителем приведено осуществление заявленного технического решения, а именно представлен способ его получения (примеры 1 - 12) и противомикробные свойства (пример 13).
Заявленные соединения получают в целом по схеме 1.
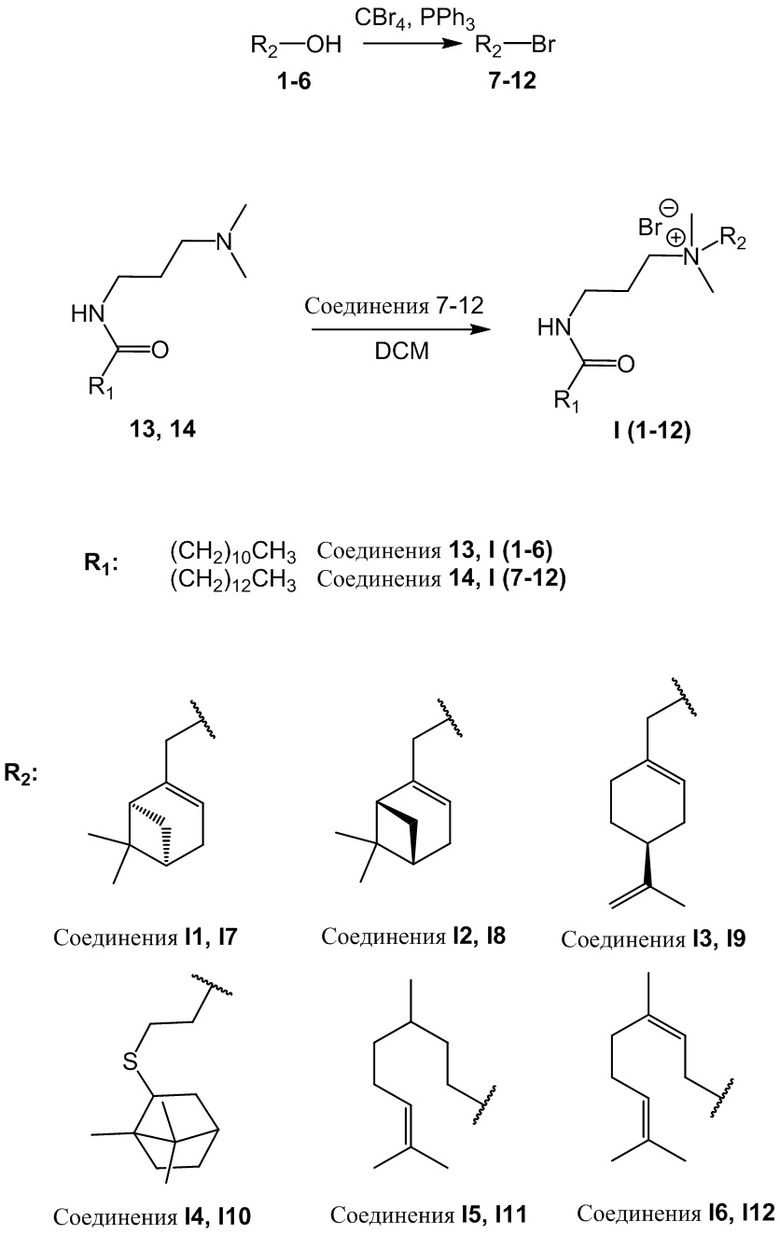
Схема 1. Получение соединений формулы I.
Характеристики новых соединений приведены далее в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами масс-спектрометрии, 1Н, 13С ЯМР- и ИК-спектроскопии (ЯМР - ядерный магнитный резонанс, ИК - инфракрасная спектроскопия).
Спектры ЯМР регистрировали на приборе Bruker AVANCE-II-500. Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13С).
Углы вращения луча поляризованного света оптически деятельных соединений определяли на поляриметре Р8000-Т (A. KRUSS Optronic GmbH, Гамбург, Германия).
ИК-спектры регистрировались на ИК-Фурье спектрометре Spectrum Two PerkinElmer с приставкой UATR (Single Reflection Diamond).
HRMS-эксперимент (HRMS - масс-спектрометрия высокого разрешения) был проведен с использованием масс-спектрометра высокого разрешения Impact II с системой Elute UHPLC ("Bruker Daltonik GmbH", Бремен, Германия), метод ионизации ESI - ионизация электроспреем.
Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates.
Примеры конкретного выполнения заявленного технического решения
Следующие соединения были получены по известным литературным методикам:
- соединения 7-12, 25, 26 [Nikitina, L.E.; Gilfanov, I.R.; Pavelyev, R.S.; Lisovskaya, S.A.; Trizna, E.Y.; Rakhmatullin, I.Z.; Klochkov, V.V.; Davletshin, R.R.; Babaeva, O.B.; Kolesnikova, A.I.; et al. N-(((1S,5R)-6,6-Dimethylbicyclo[3.1.1]hept-2-en-2-yl)methyl)-3-dodecan/tetradecanamido-N,N-dimethylpropan-1-aminium Bromide / Molbank 2023, 2023, M1704. https://doi.org/10.3390/M1704]. Краткая сущность получения соединений 7-12 по первой стадии заключается в проведении реакции Аппеля с использованием в качестве исходных спиртов соединений 1-6. Реакцию проводят в присутствии четырехбромистого углерода (CBr4) и трифенилфосфина (PPh3) без растворителя при комнатной температуре. Соединения 13 и 14 получают кипячением в толуоле исходных кислот (лауриновая и миристиновая) в присутствии N,N-диметиламинопропиламина и пара-толуолсульфокислоты с насадкой Дина-Старка с азеотропной отгонкой воды, выделяющейся в ходе реакции. Вторая стадия получения соединений I1-I12 прописана в примерах 1-12.
Пример 1. Получение N-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-3-додеканамидо-N,N-диметилпропил-1-аминиум бромид (I1).
К раствору N-(3-(диметиламино)пропил)додеканамида 25 (0.099 г) в дихлорметане (10 мл) был добавлен терпенбромид 19 (0.225 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I1.
Желтое аморфное вещество. Выход 91%. ИК, v, cm-1: 3416, 3259 (N-H), 1650 (C=O), 1541 (N-C=O). 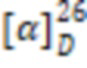 = +8.8 (1.06 c; MeOH).
= +8.8 (1.06 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.86 (с, 6H), 0.88 (т, 3H, J = 6.7), 1.18 (д, 2H, J = 9.4), 1.25 (с, 16H), 1.61 (с, 1H), 2.13 (м, 2H), 2.19 (м, 1H), 2.30 (м, 2H), 2.42 (м, 2H), 2.54 (м, 2H), 3.16 (с, 3H), 3.18 (с, 3H), 3.37 (м, 2H), 3.82 (м, 2H), 4.15 and 3.90 (AB система, 2H, J = 12.6), 6.16 (с, 1H), 7.86 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 21.3, 22.7, 25.9, 29.6, 31.9, 32.1, 36.2, 36.5, 38.1, 39.7, 47.1, 50.2, 63.1, 69.9, 135.9, 136.6, 174.7.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C27H51N2O+ 419.3996, получено 419.3998.
Таким образом было получено соединение I1 и подтверждена его структура.
Пример 2. Получение N-(((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-3-додеканамидо-N,N-диметилпропил-1-аминиум бромид (I2).
К раствору N-(3-(диметиламино)пропил)додеканамида 25 (0.102 г) в дихлорметане (10 мл) был добавлен терпенбромид 20 (0.232 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I2.
Белое аморфное вещество. Выход 87%. ИК, v, cm-1: 3257 (N-H), 1661 (C=O), 1541 (N-C=O). 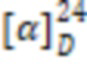 = -12.8° (0.22 c; MeOH).
= -12.8° (0.22 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.86 (с, 6H), 0.88 (т, 3H, J = 6.7), 1.18 (д, 2H, J = 9.4), 1.25 (с, 16H), 1.61 (с, 1H), 2.13 (м, 2H), 2.19 (м, 1H), 2.30 (м, 2H), 2.42 (м, 2H), 2.54 (м, 2H), 3.16 (с, 3H), 3.18 (с, 3H), 3.37 (м, 2H), 3.82 (м, 2H), 4.15 and 3.90 (AB система, 2H, J = 12.6), 6.16 (с, 1H), 7.86 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 21.3, 22.7, 25.9, 29.6, 31.9, 32.1, 36.2, 36.5, 38.1, 39.7, 47.1, 50.2, 63.1, 69.9, 135.9, 136.6, 174.7.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C27H51N2O+ 419.3996, получено 419.3996.
Таким образом было получено соединение I2 и подтверждена его структура.
Пример 3. Получение (S)-3-додециламидо-N,N-диметил-N-((4-(проп-1-ен-2-ил)циклогекс-1-ен-1-ил)метил)пропил-1-аминиум бромид (I3).
К раствору N-(3-(диметиламино)пропил)додеканамида 25 (0.105 г) в дихлорметане (10 мл) был добавлен терпенбромид 21 (0.238 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I3.
Бурое аморфное вещество. Выход 84%. ИК, v, cm-1: 3259 (N-H), 1646 (C=O), 1539 (N-C=O). 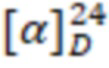 = -20.4° (0.27 c; MeOH).
= -20.4° (0.27 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.85 (т, 3H, J=7.0), 1.23 (с, 16H), 1.51 (с, 2H), 1.58 (с, 2H), 1.64 (с, 2H), 1.67 (с, 2H), 1.72 (с, 2H), 1.72 (с, 3H), 1.83 (с, 2H), 2.11 (с, 2H), 2.11 (с, 2H), 2.24 (с, 1H), 2.26 (т, 2H, J=7.5), 3.18 (с, 6H), 3.35 (с, 2H), 3.71 (т, 2H, J=8.0), 4.03 (с, 2H), 4.68 (с, 2H), 4.76 (с, 2H), 5.29 (с, 1H), 7.81 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 20.8, 22.7, 23.1, 25.9, 27.2, 29.5, 29.5, 30.7, 31.1, 31.9, 36.5, 39.5, 43.1, 50.6, 63.2, 71.2, 109.5, 126.0, 140.2, 148.1, 174.7.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C27H51N2O+ 419.3996, получено 419.3999.
Таким образом было получено соединение I3 и подтверждена его структура.
Пример 4. Получение 3-додециламидо-N,N-диметил-N-(2-((1,7,7-триметилбицикло[2.2.1]гептан-2-ил)тио)этил)пропил-1-аминиум бромид (I4).
К раствору N-(3-(диметиламино)пропил)додеканамида 25 (0.075 г) в дихлорметане (10 мл) был добавлен терпенбромид 22 (0.219 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I4.
Желтоватое аморфное вещество. Выход 71%. ИК, v, cm-1: 3263 (N-H), 1650 (C=O), 1538 (N-C=O). 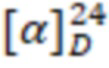 = +12.1° (0.08 c; MeOH).
= +12.1° (0.08 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.81 (с, 3H), 0.86 (с, 3H), 0.91 (с, 3H), 0.97 (с, 3H), 1.23 (с, 2H), 1.23 (с, 2H), 1.23 (с, 16H), 1.59 (с, 1H), 1.59 (с, 2H), 1.59 (с, 2H), 1.67 (с, 2H), 1.72 (с, 2H), 1.80 (с, 2H), 1.97 (с, 2H), 2.07 (с, 2H), 2.28 (с, 1H), 2.91 (с, 2H), 3.33 (с, 6H), 3.36 (с, 2H), 3.61 (с, 2H), 3.82 (с, 2H), 7.77 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 20.0, 20.4, 22.7, 23.0, 25.9, 26.9, 27.2, 29.5, 29.5, 29.5, 31.9, 36.5, 38.2, 45.9, 49.7, 51.3, 55.3, 55.8, 63.1, 64.3, 174.7.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C29H57N2OS+ 481.4186, получено 481.4182.
Таким образом было получено соединение I4 и подтверждена его структура.
Пример 5. Получение N-(3-додециламидопропил)-N,N,3,7-тетраметилокт-6-ен-1-аминиум бромид (I5).
К раствору N-(3-(диметиламино)пропил)додеканамида 25 (0.106 г) в дихлорметане (10 мл) был добавлен терпенбромид 23 (0.245 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I5.
Белое аморфное вещество. Выход 90%. ИК, v, cm-1: 3278 (N-H), 1649 (C=O), 1544 (N-C=O). 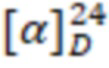 = -5.8° (0.13 c; MeOH).
= -5.8° (0.13 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.85 (т, 3H, J=7.0), 0.95 (д, 3H, J=6.0), 1.29 (с, 16H), 1.58 (с, 2H), 1.58 (с, 2H), 1.58 (с, 1H), 1.58 (с, 2H), 1.66 (с, 6H), 2.09 (с, 2H), 2.09 (с, 2H), 2.23 (т, 2H, J=7.0), 2.86 (с, 6H), 3.20 (т, 2H, J=7.0), 3.25 (с, 2H), 3.36 (с, 2H), 5.64 (с, 1H), 7.41 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 22.6, 24.6, 25.2, 25.7, 29.5, 29.5, 29.5, 30.4, 31.3, 35.9, 36.4, 43.1, 51.1, 55.6, 124.7, 131.3, 174.8.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C27H55N2O+ 423.4309, получено 423.4309.
Таким образом было получено соединение I5 и подтверждена его структура.
Пример 6. Получение N-(3-додециламидопропил)-N,N,3,7-тетраметилокта-2,6-диен-1-аминиум бромид (I6).
К раствору N-(3-(диметиламино)пропил)додеканамида 25 (0.101 г) в дихлорметане (10 мл) был добавлен терпенбромид 24 (0.231 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I6.
Бурое аморфное вещество. Выход 86%. ИК, v, cm-1: 3281 (N-H), 1649 (C=O), 1539 (N-C=O).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.86 (т, 3H, J=7.0), 1.23 (с, 16H), 1.58 (с, 2H), 1.66 (с, 3H), 1.83 (с, 3H), 1.83 (с, 3H), 2.03 (с, 2H), 2.15 (с, 2H), 2.15 (с, 2H), 2.23 (с, 2H), 3.14 (с, 6H,), 3.34 (т, 2H, J=6.0), 3.64 (т, 2H, J=8.1), 4.03 (д, 2H, J=7.9), 5.00 (с, 1H), 5.29 (т, 1H, J=7.8), 7.76 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 17.5, 17.8, 22.7, 24.7, 25.8, 25.8, 25.8, 29.5, 31.9, 36.2, 36.5, 40.1, 49.7, 55.7, 62.3, 110.2, 123.0, 132.7, 152.7, 174.8.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C27H53N2O+ 421.4152, получено 421.4146.
Таким образом было получено соединение I6 и подтверждена его структура.
Пример 7. Получение N-(((1S,5R)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-3-тетрадециламидо-N,N-диметилпропил-1-аминиум бромид (I7).
К раствору N-(3-(диметиламино)пропил)тетрадеканамида 26 (0.099 г) в дихлорметане (10 мл) был добавлен терпенбромид 19 (0.206 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I7.
Желтоватое аморфное вещество. Выход: 90%. ИК, v, cm-1: 3413, 3261 (N-H), 1663 (C=O), 1540 (N-C=O). 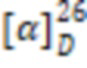 = +8.5° (0.74 c; MeOH).
= +8.5° (0.74 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.85 (с, 6H), 0.88 (т, 3H, J = 6.7), 1.18 (д, 2H, J = 9.4), 1.25 (с, 20H), 1.61 (м, 1H), 2.14 (м, 2H), 2.29 (м, 1H), 2.31 (м, 2H), 2.41 (м, 2H), 2.54 (м, 2H), 3.17 (с, 3H), 3.18 (с, 3H), 3.37 (м, 2H), 3.82 (м, 2H), 4.15 and 3.90 (AB система, 2H, J = 12.6), 6.16 (с, 1H), 7.83 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 21.3, 22.7, 23.0, 25.9, 29.7, 31.9, 36.2, 36.5, 38.1, 39.7, 47.1, 50.1, 63.0, 69.8, 135.9, 136.6, 174.7.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C29H55N2O+ 447.4309, получено 447.4309.
Таким образом было получено соединение I7 и подтверждена его структура.
Пример 8. Получение N-(((1R,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-3тетрадециламидо-N,N-диметилпропил-1-аминиум бромид (I8).
К раствору N-(3-(диметиламино)пропил)тетрадеканамида 26 (0.103 г) в дихлорметане (10 мл) был добавлен терпенбромид 20 (0.215 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I8.
Желтоватое аморфное вещество. Выход 91%. ИК, v, cm-1: 3296 (N-H), 1640 (C=O), 1541 (N-C=O). 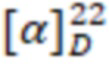 = -15.4° (0.24 c; MeOH).
= -15.4° (0.24 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.85 (с, 6H), 0.88 (т, 3H, J = 6.7), 1.18 (д, 2H, J = 9.4), 1.25 (с, 20H), 1.61 (м, 1H), 2.14 (м, 2H), 2.29 (м, 1H), 2.31 (м, 2H), 2.41 (м, 2H), 2.54 (м, 2H), 3.17 (с, 3H), 3.18 (с, 3H), 3.37 (м, 2H), 3.82 (м, 2H), 4.15 and 3.90 (AB система, 2H, J = 12.6), 6.16 (с, 1H), 7.83 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 21.3, 22.7, 23.0, 25.9, 29.7, 31.9, 36.2, 36.5, 38.1, 39.7, 47.1, 50.1, 63.0, 69.8, 135.9, 136.6, 174.7.
HRMS (ESI), m/z: [M-Br]+ рассчитано для C29H55N2O+ 447.4309, получено 447.4308.
Таким образом было получено соединение I8 и подтверждена его структура.
Пример 9. Получение (S)-3-тетрадециламидо-N,N-диметил-N-((4-(проп-1-ен-2-ил)циклогекс-1-ен-1-ил)метил)пропил-1-аминиум бромид (I9).
К раствору N-(3-(диметиламино)пропил)тетрадеканамида 26 (0.108 г) в дихлорметане (10 мл) был добавлен терпенбромид 21 (0.223 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I9.
Бурое аморфное вещество. Выход 85%. ИК, v, cm-1: 3245 (N-H), 1650 (C=O), 1542 (N-C=O). 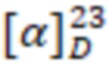 = -22.4° (0.28 c; MeOH).
= -22.4° (0.28 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.88 (т, 3H, J=7.0), 1.24 (с, 20H), 1.53 (с, 2H), 1.60 (с, 2H), 1.66 (с, 2H), 1.69 (с, 2H), 1.74 (с, 2H), 1.74 (с, 3H), 1.85 (с, 2H), 2.12 (с, 2H), 2.12 (с, 2H), 2.24 (с, 1H), 2.30 (т, 2H, J=7.5), 3.21 (с, 6H), 3.37 (с, 2H), 3.76 (т, 2H, J=8.0), 4.05 (с, 2H), 4.69 (с, 2H), 4.78 (с, 2H), 5.31 (с, 1H), 7.81 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 20.8, 22.7, 23.1, 25.9, 27.2, 29.4, 29.7, 30.7, 31.1, 31.9, 36.5, 39.5, 43.1, 50.6, 63.2, 71.2, 109.5, 126.0, 140.3, 148.1, 174.8.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C29H55N2O+ 447.4309, получено 447.4311.
Таким образом было получено соединение I9 и подтверждена его структура.
Пример 10. Получение 3-тетрадециламидо-N,N-диметил-N-(2-((1,7,7-триметилбицикло[2.2.1]гепт-2-ил)тио)етил)пропил-1-аминиум бромид (I10).
К раствору N-(3-(диметиламино)пропил)тетрадеканамида 26 (0.081 г) в дихлорметане (10 мл) был добавлен терпенбромид 22 (0.216 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I10.
Желтоватое аморфное вещество. Выход 69%. ИК, v, cm-1: 3254 (N-H), 1650 (C=O), 1548 (N-C=O).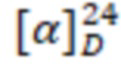 = +8.4° (0.07 c; MeOH).
= +8.4° (0.07 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.82 (с, 3H), 0.87 (с, 3H), 0.92 (с, 3H), 0.98 (с, 3H), 1.25 (с, 2H), 1.25 (с, 2H), 1.25 (с, 20H), 1.60 (с, 1H), 1.60 (с, 2H), 1.60 (с, 2H), 1.68 (с, 2H), 1.73 (с, 2H), 1.82 (с, 2H), 2.08 (с, 2H), 2.10 (с, 2H), 2.29 (с, 1H), 2.92 (с, 2H), 3.33 (с, 6H), 3.37 (с, 2H), 3.60 (с, 2H), 3.89 (с, 2H), 7.76 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 20.1, 20.4, 22.7, 23.0, 25.9, 26.9, 27.2, 29.7, 29.7, 29.7, 31.9, 36.5, 38.2, 45.9, 49.7, 51.3, 55.3, 55.8, 63.1, 64.3, 174.8.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C31H61N2OS+ 509.4499, получено 509.4504.
Таким образом было получено соединение I10 и подтверждена его структура.
Пример 11. Получение N-(3-тетрадециламидопропил)-N,N,3,7-тетраметилокт-6-ен-1-аминиум бромид (I11).
К раствору N-(3-(диметиламино)пропил)тетрадеканамида 26 (0.104 г) в дихлорметане (10 мл) был добавлен терпенбромид 23 (0.219 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I11.
Белое аморфное вещество. Выход 80%. ИК, v, cm-1: 3284 (N-H), 1650 (C=O), 1545 (N-C=O). 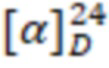 = -1.7° (0.17 c; MeOH).
= -1.7° (0.17 c; MeOH).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.88 (т, 3H, J=7.0), 0.98 (д, 3H, J=6.0), 1.26 (с, 20H), 1.61 (с, 2H), 1.61 (с, 2H), 1.61 (с, 1H), 1.69 (с, 2H), 1.61 (с, 6H), 2.12 (с, 2H), 2.12 (с, 2H), 2.26 (т, 2H, J=7.0), 2.87 (с, 6H), 3.18 (т, 2H, J=7.0), 3.27 (с, 2H), 3.41 (с, 2H), 5.64 (с, 1H), 7.26 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 22.7, 24.6, 25.8, 25.8, 29.5, 29.5, 29.5, 32.0, 35.9, 35.9, 36.6, 43.1, 55.6, 124.7, 131.3, 174.8.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C29H59N2O+ 451.4622, получено 451.4620.
Таким образом было получено соединение I11 и подтверждена его структура.
Пример 12. Получение N-(3-тетрадециламидопропил)-N,N,3,7-тетраметилокта-2,6-диен-1-аминиум бромид (I12).
К раствору N-(3-(диметиламино)пропил)тетрадеканамида 26 (0.103 г) в дихлорметане (10 мл) был добавлен терпенбромид 24 (0.217 г). Реакционную смесь оставили на 1 час при комнатной температуре. После выпаривания растворителя в вакууме продукт промывали гексаном, фильтровали и затем сушили под низким давлением с получением целевого соединения I12.
Бурое аморфное вещество. Выход 82%. ИК, v, cm-1: 3288 (N-H), 1650 (C=O), 1542 (N-C=O).
Спектр ЯМР 1H (500 МГц, CDCl3) δ, м.д.: 0.86 (т, 3H, J=7.0), 1.23 (с, 20H), 1.58 (с, 2H), 1.66 (с, 3H), 1.84 (с, 3H), 1.84 (с, 3H), 2.11 (с, 2H), 2.16 (с, 2H), 2.16 (с, 2H), 2.28 (с, 2H), 3.16 (с, 6H), 3.36 (с, 2H), 3.74 (с, 2H), 4.07 (с, 2H), 5.00 (с, 1H), 5.29 (т, 1H, J=7.8), 7.80 (с, 1H).
Спектр ЯМР 13C {1H} (125 МГц, CDCl3) δ, м.д: 14.1, 17.5, 17.9, 22.7, 23.0, 25.9, 25.9, 25.9, 29.5, 32.0, 36.2, 36.5, 40.1, 49.6, 55.6, 62.3, 110.2, 123.0, 132.7, 152.8, 174.7.
HRMS (ESI), m/z: [M - Br]+ рассчитано для C29H57N2O+ 449.4465, получено 449.4467.
Таким образом было получено соединение I12 и подтверждена его структура.
Пример 13. Исследование противомикробной активности заявленных четвертичных аммониевых соединений на основе терпенов in vitro
Исследование антибактериальной активности заявленных соединений проводилось на музейных штаммах Staphylococcus aureus ATCC® 29213™ и Pseudomonas aeruginosa ATCC® 27853™. Сравнительная оценка спектра антибактериального действия на эталонных штаммах бактерий проводилась с использованием микрометода определения минимальной ингибирующей концентрации (МИК, также часто в литературе встречается «минимальная подавляющая концентрация» - МПК, что одно и то же) методом серийных разведений в бульоне Мюллера-Хинтон [Определение чувствительности микроорганизмов к антибактериальным препаратам (Методические указания МУК 4.2.1890-04) / М.: Федеральный центр госсанэпиднадзора Минздрава России, 2004. - 91 с.]. Бактерии инкубировали при 37 °С в течение 24 ч. МИК определялась как наименьшая концентрация при которой не наблюдалось видимого роста.
Штаммы грибов Candida albicans NCTC-885-653, Candida tropicalis Y-1513/784, Aspergillus niger F-1119 и Rhizopus nigricans F-1537/1722 были получены из Всероссийской коллекции микроорганизмов (Москва, Россия). Fusarium oxysporum C2611-17 (клинический изолят с кожи) был получен из Казанского института микробиологии и эпидемиологии (Казань, Россия). Все штаммы выращивали в бульоне RPMI или Sabouraud. Минимальные ингибирующие концентрации (МИК) соединений определяли методом бульонного разведения в пробирках с бульоном RPMI (для дрожжевых грибов) и бульоном сабуро (для нитчатых грибов) в соответствии с рекомендациями EUCAST по определению чувствительности к антимикробным препаратам [Leclercq, R.; Canton, R.; Brown, D.F.J.; Giske, C.G.; Heisig, P.; MacGowan, A.P.; Mouton, J.W.; Nordmann, P.; Rodloff, A.C.; Rossolini, G.M.; et al. EUCAST expert rules in antimicrobial susceptibility testing. Clin. Microbiol. Infect. 2013, 19, 141-160.]. Дрожжи и нитчатые грибы инкубировали при 30 °С в течение 2 и 5 дней соответственно. МИК определялась как наименьшая концентрация при которой не наблюдалось видимого роста.
Как видно из Таблицы 1 на чертеже, все заявленные соединения превосходят мирамистин по показателю МИК на грибах (C. albicans RKPG Y-401, A. niger F-1119, F. oxysporum (клинический изолят)). На бактерии S. aureus ATCC29213 большая часть соединений проявляет меньшую или такую же МИК как и мирамистин, однако соединения I6 и I12 несколько хуже по данному показателю (16 мкг/мл для данных соединений против 8 мкг/мл для мирамистина). По отношению к бактерии P. aeruginosa ATCC27853 соединения I4-I7, I9 и I12 менее эффективны мирамистина и имеют МИК от 256 до 2048 мкг/мл, остальные соединения более эффективны (или аналогичны по своей активности).
Таким образом, из описанного выше можно сделать вывод, что заявителем решена техническая проблема и достигнут заявленный технический результат, а именно - расширен арсенал известных средств указанного назначения путем создания новых соединений общей формулы (I), содержащих в своем составе фрагмент терпена и четвертичный аммониевый фрагмент, и обладающих высокой противомикробной активностью, в т.ч. в отношении клинических штаммов.
Заявленное техническое решение соответствует условию патентоспособности «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует условию патентоспособности «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует условию патентоспособности «промышленная применимость», так как может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных отечественных материалов и технологий.
| название | год | авторы | номер документа |
|---|---|---|---|
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| Четвертичные аммониевые соединения на основе 3-гидроксипиридина, обладающие антибактериальной активностью | 2021 |
|
RU2778507C1 |
| Бис-аммониевые соединения на основе пиридоксина, обладающие антибактериальными и антимикотическими свойствами | 2020 |
|
RU2731999C1 |
| Оксазолидиноны на основе производных пиридоксина, обладающие антибактериальной активностью | 2024 |
|
RU2836570C1 |
| ПРОИЗВОДНЫЕ 2-((4-(4-(БЕНЗИЛОКСИ)ПИРИМИДИН-2-ИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛА В КАЧЕСТВЕ НИЗКОМОЛЕКУЛЯРНЫХ АГОНИСТОВ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1 | 2024 |
|
RU2838323C1 |
| 6,7-МОДИФИЦИРОВАННЫЕ ПАКЛИТАКСЕЛЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1993 |
|
RU2125998C1 |
| Способ получения гибридных соединений на основе (5Z,9Z)-алка-5,9-диеновых кислот и монокарбонильных производных куркуминоидов | 2022 |
|
RU2807922C1 |
| СПОСОБ СИНТЕЗА ЦИКЛИЧЕСКИХ ДЕПСИПЕПТИДОВ | 2018 |
|
RU2817013C1 |
| ЛЕЧЕНИЕ ИНФЕКЦИЙ H. PYLORI С ПРИМЕНЕНИЕМ ИНГИБИТОРОВ MTAN | 2015 |
|
RU2663803C2 |
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3-АМИНОЗАМЕЩЕННЫЕ 6-(3,5-ДИМЕТИЛПИРАЗОЛ-1-ИЛ)-1,2,4,5-ТЕТРАЗИНЫ | 2012 |
|
RU2519218C2 |
Изобретение относится к новым четвертичным аммониевым соединениям на основе терпенов общей формулы (I), которые проявляют противомикробную активность и могут найти применение в медицине и ветеринарии. Значения R1 и R2 приведены ниже. 1 з.п. ф-лы, 1 ил., 13 пр.
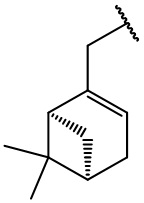
остаток (+)-миртенола
остаток (+)-миртенола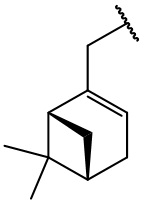
остаток (-)-миртенола
остаток (-)-миртенола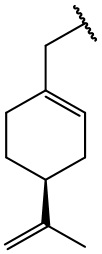
остаток (-)-периллового спирта
остаток (-)-периллового спирта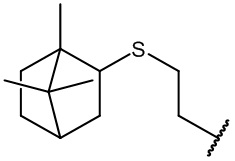
остаток (+)-этилтиоборнеола
остаток (+)-этилтиоборнеола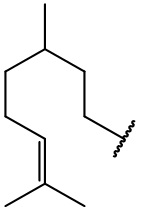
остаток (-)-цитронеллола
остаток (-)-цитронеллола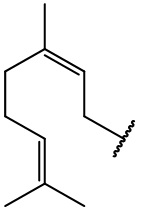
остаток гераниола
остаток гераниола
1. Четвертичные аммониевые соединения на основе терпенов общей формулы (I)
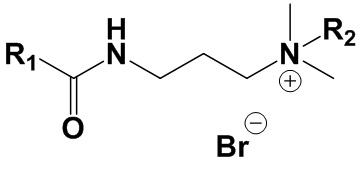 , где
, где
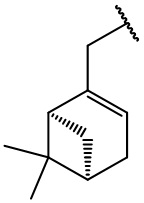
остаток (+)-миртенола
остаток (+)-миртенола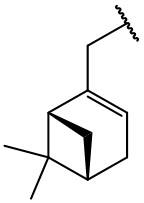
остаток (-)-миртенола
остаток (-)-миртенола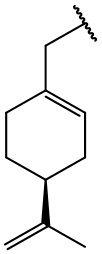
остаток (-)-периллового спирта
остаток (-)-периллового спирта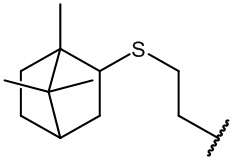
остаток (+)-этилтиоборнеола
остаток (+)-этилтиоборнеола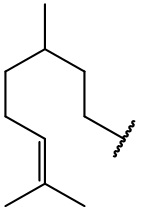
остаток (-)-цитронеллола
остаток (-)-цитронеллола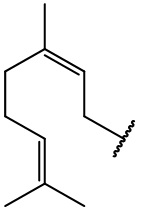
остаток гераниола
остаток гераниола
2. Четвертичные аммониевые соединения на основе терпенов по п. 1, обладающие противомикробной активностью.
| I | |||
| R | |||
| GILFANOV ET AL., N-(((1S,5R)-6,6-Dimethylbicyclo[3.1.1]hept-2-en-2-yl)methyl)-3-((1R,5S)-6,6-dimethylbicyclo[3.1.1]hept-2-ene/ane-2-carboxamido)-N,N-dimethylpropan-1-aminium Bromide, MOLBANK, 2023, Vol | |||
| Электромагнитный прерыватель | 1924 |
|
SU2023A1 |
| S | |||
| V | |||
| SAPOZHNIKOV ET AL., Design, synthesis, antibacterial activity and toxicity of novel quaternary | |||
Авторы
Даты
2024-05-07—Публикация
2023-12-05—Подача