ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области молочных смесей для младенцев и маленьких детей и улучшения здоровья кишечника.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Младенцы, получающие грудное молоко, имеют более низкую частоту инфекций, чем младенцы, получающие молочную смесь. Множество компонентов в человеческом молоке, включая иммуноглобулины (такие как sIgA), интерлейкин (IL)-1, IL-6, IL-8, IL-10, интерферон-γ (IFN-γ), иммунокомпетентные клетки, трансформирующий фактор роста -β (TGF-β), лактоферрин, нуклеотиды и олигосахариды человеческого молока (HMO) считаются играющими роль в защите против инфицирования патогенами.
HMO являются главным компонентом человеческого молока и представляют собой неперевариваемые олигосахариды (NDO). Олигосахариды человеческого молока играют важную роль в постнатальном росте и развитии кишечника и иммунной системы. Они могут обеспечивать рост полезных бактерий в кишечном тракте. Также известно, что некоторые HMO непосредственно предотвращают адгезию патогенов к стенке кишечника.
Человеческое молоко является предпочтительным питанием для младенцев. Однако не всегда возможно или желательно грудное вскармливание младенца. В таких случаях молочная смесь 1-го уровня или молочная смесь 2-го уровня являются хорошей альтернативой. Такие смеси должны иметь оптимальный состав с целью имитации полезных эффектов человеческого молока настолько близко, насколько возможно.
Было обнаружено, что галакто-олигосахариды (GOS), широко используемые в молочных смесях, защищают кишечный эпителиальный барьер посредством поддержания плотной соединенной сети и модулируют воспалительные ответы (Akbari et al., The Journal of Nutrition, 145(7), 2015, P 1604-1613). Структура GOS основана на лактозе, пролонгированной одной или более галактозами, и GOS включают несколько структур, идентичных ядерным молекулам в трисахаридной фракции HMO. Одна специфическая функциональная структура HMO основана на элонгации лактозы (галактоза-глюкоза) дополнительным остатком галактозы, образующим три иммуноактивных галактозил-лактоз (Gal-Lac или GL), а именно 3’-галактозил лактоза, 4’-галактозил лактоза и 6’-галактозил лактоза (Newburg et al., 2016, J Nutr 146:358-367). 3’-галактозил-лактозу, 4’-галактозил-лактозу и 6’-галактозил-лактозу в настоящем описании также называют как 3’-GL, 4’-GL и 6’-GL, соответственно.
В WO 2005/122790 описан способ стимуляции целостности барьера посредством введения композиции, включающей эйкозапентаноевую кислоту (EPA), докозагексаеновую кислоту (DHA) и арахидоновую кислоту (ARA), и по меньшей мере два отдельных олигосахарида. Олигосахариды действуют опосредованно посредством ферментации короткоцепочечных жирных кислот (SCFA) кишечной микробиотой. SCFA являются активным ингредиентом, который поддерживает барьерную функцию кишечника.
В WO 2010/023422 описано применение галакто-олигосахаридов для профилактики или лечения воспаления. Тестирована смесь галакто-олигосахаридов.
В WO 2016/013935 описано применение неперевариваемых олигосахаридов в получении композиции для обеспечения питания младенца, страдающего от повышенного риска пищевой аллергии. Младенец предпочтительно имеет повышенный риск воздействия микотоксина трихотецена, например, в результате потребления большого количества зерновых. В примерах VivinalGOS является источником галакто-олигосахаридов.
В WO 2013/016111 описаны питательные композиции с галакто-олигосахаридами для профилактики повреждения и/или улучшения заживления желудочно-кишечного тракта. Тестировали смесь галакто-олигосахаридов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения обнаружили, что способность структурно различных галактозил-лактоз (GL) защищать функцию кишечного эпителиального барьера сильно зависит от специфической структуры GL. Монослои человеческих эпителиальных Caco-2 клеток выращенные в трансвел-системе, которая является моделью барьерной функции кишечника, предварительно обрабатывали различными галактозил-лактозами, включая бета 1,3’-галактозиллактозу, альфа1,3’- галактозиллактозу, бета1,4- галактозиллактозу и бета1,6’- галактозиллактозу, до воздействия грибкового токсина деоксиниваленола. Измеряли целостность трансэпителиального барьера и высвобождение провоспалительных цитокинов. Было обнаружено, что бета1,3’-галактозиллактоза предотвращала потерю целостности эпителиального барьера в гораздо большей степени, чем другие галактозиллактозы. Однако, все галактозиллактозы были способны снижать высвобождение IL-8, что является показательным для противовоспалительного эффекта. Когда различные смеси GOS сравнивали, смесь, которая была богата бета1,3’-галактозиллактозой, была более эффективной и даже в меньшей дозе, в улучшении барьерной функции кишечника, чем смесь GOS, которая не содержала или содержала очень маленькие количества бета1,3’-галактозиллактозы. Это является показателем применения для улучшения барьерной функции кишечника у младенцев бета1,3’-галактозиллактозы. Такие результаты показывают, что бета1,3’-галактозиллактоза обладает эффектом увеличения барьерной функции кишечника. Кроме того, бета1,3’-галактозиллактоза может быть использована для профилактики и/или лечения нарушения кишечного барьера. Результаты дополнительно показывают, что бета1,3’-галактозиллактоза является эффективной для лечения, профилактики и/или облегчения токсического воздействия и/или облегчения состояний, ассоциированных с токсическим воздействием. Токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен и наиболее предпочтительно токсином является деоксиниваленол (DON).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к трисахариду Gal (бета 1-3)-Gal (бета 1-4)-Glc для применения в увеличении барьерной функции кишечника и/или для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта.
Изобретение дополнительно относится к питательной композиции для применения в увеличении барьерной функции кишечника и/или для применения в профилактике нарушения кишечного барьера у субъекта, где питательная композиция включает трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc (бета1,3’-галактозиллактоза) в качестве активного ингредиента.
Изобретение дополнительно относится к питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc, для применения в лечении, профилактике и/или облегчении состояния, ассоциированного с токсическим воздействием, у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, еще более предпочтительно токсином является деоксиниваленол.
Настоящее изобретение также относится к молочной смеси 1-го уровня, молочной смеси 2-го уровня или молочной смеси 3-го уровня, предпочтительно молочной смеси 1-го уровня, молочной смеси 2-го уровня, включающей:
a. 1,6-4 г белка на основании 100 ккал,
b. 5-20 г перевариваемых углеводов на основании 100 ккал,
c. 3-7 г липидов на основании 100 ккал, где липиды включают:
i. LCPUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании общего количества жирных кислот, и/или
ii. по меньшей мере 0,1 масс% EPA на основании всех жирных кислот и по меньшей мере 0,5 масс% DHA на основании всех жирных кислот и необязательно дополнительно по меньшей мере 0,25 масс% ARA на основании всех жирных кислот,
d. 0,25-2,5 г неперевариваемых олигосахаридов на 100 мл готовой смеси, где неперевариваемые олигосахариды включают Gal (бета 1-3)-Gal (бета 1-4)-Glc в количестве 10-500 мг на 100 мл готовой смеси.
В некоторых компетенциях настоящее изобретение может быть сформулировано, как применение трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc для получения питательной композиции для увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушения кишечного барьера у субъекта.
В некоторых компетенциях изобретение дополнительно относится к применению трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc для получения питательной композиции для лечения, профилактики и/или облегчения состояния, ассоциированного с токсическим воздействием у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, наиболее предпочтительно токсином является деоксиниваленол.
В некоторых компетенциях изобретение дополнительно относится к применению трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc для увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушения кишечного барьера у субъекта.
В некоторых компетенциях изобретение дополнительно относится к применению питательной композиции для увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушений кишечного барьера у субъекта, где питательная композиция включает трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc (бета1,3’-галактозиллактоза) в качестве активного ингредиента.
В некоторых компетенциях изобретение дополнительно относится к применению питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc, для лечения, профилактики и/или облегчения состояния, ассоциированного с токсическим воздействием у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, наиболее предпочтительно токсином является деоксиниваленол.
В некоторых компетенциях изобретение может быть сформулировано, как способ для увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушения кишечного барьера у субъекта, способ включает введение трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc субъекту.
В некоторых компетенциях изобретение также относится к способу увеличения барьерной функции кишечника и/или для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта, способ включает введение субъекту питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc в качестве активного ингредиента.
В некоторых компетенциях изобретение дополнительно относится к способу лечения, профилактики и/или облегчения состояний, ассоциированных с токсическим воздействием у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен и наиболее предпочтительно токсином является деоксиниваленол, способ включает введение питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc субъекту.
В некоторых компетенциях введение питательной композиции младенцу расценивается нетерапевтическим. В таких компетенциях, следовательно, вышеуказанный аспект настоящего изобретения может быть сформулирован как нетерапевтический метод увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушения кишечного барьера у субъекта, способ включает введение субъекту трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc.
Аналогично вышеуказанный аспект настоящего изобретения может быть сформулирован, как нетерапевтический способ для увеличения барьерной функции кишечника и/или для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта, способ включает введение субъекту питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc в качестве активного ингредиента.
Аналогично вышеуказанный аспект настоящего изобретения может быть сформулирован, как нетерапевтический способ для лечения, профилактики и/или облегчения состояния, ассоциированного с токсическим воздействием, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен и наиболее предпочтительно токсином является деоксиниваленол, способ, включающий введение субъекту питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc.
Трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc в настоящем описании также называют как бета1,3’-галактозиллактоза или бета3’-GL.
В контексте настоящего изобретения термин “профилактика” обозначает “уменьшение риска” или “уменьшение тяжести”. Термин “профилактика определенного состояния” также включает “лечение субъекта с риском указанного состояния”.
В настоящем документе и его формуле изобретения, глагол "включать" и его сочетания используют в неограничивающем смысле, обозначая, что пункты следующие за словом, включаются, но пункты, специфически не упомянутые, не исключаются. Кроме того, ссылка на элемент с неопределенным артиклем "a" или "an" не исключает возможности, что более чем один элемент присутствует, если контекст четко не требует, что там должен быть один и только один элемент. Неопределенный артикль "a" или "an", следовательно, обычно обозначает "по меньшей мере один”.
Галакто-олигосахариды и бета1,3’-галактозиллактоза
Настоящее изобретение относится к трисахариду Gal-(бета 1,3)-Gal-(бета 1,4)-Glc, в настоящем описании называемому как бета1,3’-галактозиллактоза или бета3’-GL, для применения в увеличении барьерной функции кишечника у субъекта. Изобретение также относится к трисахариду Gal-(бета 1,3)-Gal-(бета 1,4)-Glc для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта. Такой трисахарид можно вводить в чистой форме, в подходящей матрице, или в питательной композиции. Трисахарид может быть, например, частью смеси галакто-олигосахаридов (GOS), предпочтительно бета-галакто-олигосахаридов (BGOS).
В предпочтительном варианте осуществления изобретения бета1,3’-галактозиллактозу используют, как таковую. В другом предпочтительном варианте осуществления изобретения бета1,3’-галактозиллактоза присутствует в питательной композиции. Следовательно, изобретение также относится к бета1,3’-галактозиллактозе для применения в увеличении барьерной функции кишечника у субъекта, где бета1,3’-галактозиллактоза присутствует в питательной композиции и к бета1,3’-галактозиллактозе для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта, где бета1,3’-галактозиллактоза присутствует в питательной композиции. Кроме того, изобретение относится к питательной композиции для применения в увеличении барьерной функции кишечника у субъекта, где питательная композиция включает трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc (бета1,3’-галактозиллактоза) в качестве активного ингредиента, и к питательной композиции для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта, где питательная композиция включает трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc (бета1,3’-галактозиллактоза) в качестве активного ингредиента.
Питательная композиция для применения по изобретению, питательная композиция в способах и применениях настоящего изобретения и питательная композиция, включающая трисахарид для применения, т.е. включающая бета1,3’-галактозиллактозу для применения, по настоящему изобретению, в настоящем описании также называют, как настоящая питательная композиция, или питательная композиция по настоящему изобретению, или финальная питательная композиция. Питательная композиция по настоящему изобретению не является человеческим молоком.
Питательная композиция по настоящему изобретению предпочтительно включает 0,07-3,75 масс%, более предпочтительно 0,1-2 масс%, Gal (бета 1-3)-Gal (бета 1-4)-Glc, на основании сухой массы питательной композиции. В предпочтительном варианте осуществления изобретения питательная композиция включает 0,07-0,375 масс% Gal (бета 1-3)-Gal (бета 1-4)-Glc, на основании сухой массы питательной композиции. В другом предпочтительном варианте осуществления изобретения питательная композиция включает 1,125-1,725 масс% Gal (бета 1-3)-Gal (бета 1-4)-Glc, на основании сухой массы питательной композиции.
Питательная композиция по настоящему изобретению предпочтительно включает 15-750 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc, на 100 ккал питательной композиции. В предпочтительном варианте осуществления изобретения питательная композиция включает 15-75 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc, на 100 ккал питательной композиции. В другом предпочтительном варианте осуществления изобретения питательная композиция включает 225-375 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc, на 100 ккал питательной композиции.
Питательная композиция по настоящему изобретению предпочтительно включает 10-500 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc, на 100 мл питательной композиции. В предпочтительном варианте осуществления изобретения питательная композиция включает 10-50 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc, на 100 мл питательной композиции. В другом предпочтительном варианте осуществления изобретения питательная композиция включает 150-250 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc, на 100 мл питательной композиции.
И когда Gal (бета 1-3)-Gal (бета 1-4)-Glc используется, как таковой, и когда он присутствует в питательной композиции, предпочтительно, чтобы Gal (бета 1-3)-Gal (бета 1-4)-Glc вводили в суточной дозе по меньшей мере 0,075 г, предпочтительно по меньшей мере 0,10 г или 0,15 г. Предпочтительно, чтобы максимальная суточная доза составляла 6 г, предпочтительно 1,5 г, 1,3 г или 0,5 г. Предпочтительно Gal (бета 1-3)-Gal (бета 1-4)-Glc вводят в суточной дозе 0,1-1,3 г, более предпочтительно 0,1 г-0,5 г.
Предпочтительно, чтобы питательная композиция по настоящему изобретению включала 0,07-3,75 масс%, более предпочтительно 0,1-2 масс%, Gal (бета 1-3)-Gal (бета 1-4)-Glc, на основании сухой массы питательной композиции и что Gal (бета 1-3)-Gal (бета 1-4)-Glc вводят в суточной дозе 0,10-6 г. Предпочтительно Gal (бета 1-3)-Gal (бета 1-4)-Glc вводят в суточной дозе 0,1-1,3 г, более предпочтительно 0,1-0,5 г.
Когда бета1,3’-галактозиллактоза присутствует в питательной композиции, в предпочтительном варианте осуществления изобретения питательная композиция является молочной смесью 1-го уровня, молочной смесью 2го уровня или молочной смесью 3го уровня.
Как описано выше, бета1,3’-галактозиллактоза может быть частью смеси галакто-олигосахаридов (GOS), предпочтительно бета-галакто-олигосахаридов (BGOS).
Подходящим путем получения GOS является обработка лактозы бета-галактозидазами. В зависимости от специфичности используемого фермента, галактозный фрагмент гидролизуется из лактозы и связывается с другим лактозным фрагментом посредством бета-связи с образованием трисахарида. Галактозный фрагмент также может быть связан с другим отдельным галактозным фрагментом с образованием дисахарида. Последующие фрагменты галактозы связаны с формированием олигосахаридов. Большинство полученных таким образом олигосахаридов имеют степень полимеризации (DP) 7 или меньше. В зависимости от фермента, такие связи между остатками галактозы могут быть преимущественно бета1,4’, бета1,6’ или бета1,3’.
Подходящим путем получения бета1,6’ и/или бета1,4’ GOS является использование бета-галактозидазы из Bacillus circulans. Коммерчески доступным источником BGOS является Vivinal-GOS от FrieslandCampina Domo (Amersfoort, The Netherlands). Vivinal-GOS включает BGOS главным образом с DP2-8 (пик на DP3) и главным образом с бета1,4’ и бета1,6’ связями, с бета1,4’ связями более предпочтительными. Бета1,4’- и бета1,6’-галактозиллактозы могут быть обогащены или очищены из таких смесей GOS, как известно в области техники, например, посредством эксклюзионной хроматографии по размерам. Другими коммерчески доступными источниками BGOS и преимущественно бета1,4’ и/или бета 1,6’ связями являются Oligomate 55 и 50 от Yakult, и Cup Oligo от Nissin Sugar. Альтернативно бета1,4’- и бета1,6’-галактозиллактоза является коммерчески доступной в виде отдельных компонентов (Carbosynth).
Подходящим путем получения бета1,3’ GOS является использование бета-галактозидазы от S. thermophilus. Особенно предпочтительным является применение бета-галактозидазы от штамма CNCM I-1470 и/или CNCM I-1620 в процессе, как описано в примере 4 FR2723960 или примере 6 EP0778885. S. thermophilus CNCM I-1620 хранился в Budapest Treaty 23 августа 1995 в Collection Nationale de Cultures de Microorganisms van Institute Pasteur, Paris, France Compagnie Gervais Danone. Strain S. thermophilus CNCM I-1620 также называют как штамм S. thermophilus ST065. S. thermophilus CNCM I-1470 хранился в Budapest Treaty 25 августа 1994 в Collection Nationale de Cultures de Microorganisms van Institute Pasteur, Paris, France Compagnie Gervais Danone. Композиция указанного GOS также описана более подробно в LeForestier et. al., 2009 Eur J Nutr, 48:457-464. Оба штамма также были опубликованы в WO 96/06924. Другим коммерчески доступным GOS, богатым бета1,3 и бета1,6 галакто-олигосахаридами, является Bimuno от Clasado, или Purimune от GTC Nutrition. Бета1,6’- и бета1,3’-галактозиллактоза может быть обогащенной или очищенной из таких смесей GOS, как известно в области техники, например, посредством хроматографии, исключительной по размерам. Альтернативно, чистая бета1,3’-галактозиллактоза является коммерчески доступной (Carbosynth).
GOS, включая BGOS, являются неперевариваемыми. Человеческие пищеварительные ферменты (включая человеческую лактазу) неспособны гидролизовать GOS. GOS когда потребляется, следовательно, достигает толстой кишки интактной и способна к ферментации кишечной микробиотой.
Предпочтительно питательная композиция по настоящему изобретению включает по меньшей мере 250 мг GOS на 100 мл, более предпочтительно по меньшей мере 400, еще более предпочтительно по меньшей мере 600 мг на 100 мл. Предпочтительно композиция не включает более чем 2500 мг GOS на 100 мл, предпочтительно не более чем 1500 мг, более предпочтительно не более чем 1000 мг. Более предпочтительно, питательная композиция по настоящему изобретению включает GOS в количестве 250-2500 мг/100 мл, еще более предпочтительно в количестве 400-1500 мг/100мл, еще более предпочтительно в количестве 600-1000 мг/100 мл.
Предпочтительно питательная композиция по настоящему изобретению включает по меньшей мере 1,75 масс% GOS на основании сухой массы общей композиции, более предпочтительно по меньшей мере 2,8 масс%, еще более предпочтительно по меньшей мере 4,2 масс%, все на основании сухой массы общей композиции. Предпочтительно композиция не включает более чем 17,5 масс% GOS на основании сухой массы общей композиции, более предпочтительно не более чем 10,5 масс%, еще более предпочтительно не более чем 7 масс%. Питательная композиция по настоящему изобретению предпочтительно включает GOS в количестве 1,75 -17,5 масс%, более предпочтительно в количестве 2,8-10,5 масс%, наиболее предпочтительно в количестве 4,2-7 масс%, все на основании сухой массы общей композиции.
Предпочтительно питательная композиция по настоящему изобретению включает по меньшей мере 0,35 г GOS на 100 ккал, более предпочтительно по меньшей мере 0,6 г, еще более предпочтительно по меньшей мере 0,8 г на 100 ккал. Предпочтительно композиция не включает более чем 3,7 г GOS на 100 ккал, предпочтительно не более чем 2,5 г на 100 ккал, более предпочтительно не более чем 1,5 г на 100 ккал. Более предпочтительно, питательная композиция по настоящему изобретению включает GOS в количестве 0,35-3,7 г на 100 ккал, еще более предпочтительно в количестве 0,6-2,5 г на 100 мл, еще более предпочтительно в количестве 0,8-1,5 г на 100 мл.
Меньшие количеств приводят к менее эффективной композиции, тогда как присутствие более высоких количеств GOS может приводить к побочным эффектам, таким как осмотические расстройства, боль в животе, вздутие, образование газа и/или метеоризм.
Преимущественно иметь общее количество GOS, присутствующие в настоящей питательной композиции, кроме специфической бета1,3’-галактозиллактозы (бета3’-GL). Смесь GOS с различными размерами и связями будет оказывать больший полезный эффект на микробиоту и улучшенную продукцию короткоцепочечных жирных кислот, которые в свою очередь имеют дополнительный улучшенный полезный эффект на барьерную функцию кишечника. Присутствие GOS, иных чем бета3’-GL, будет в частности иметь дополнительный эффект на барьерную функцию кишечника в толстом кишечнике и конце тонкой кишки, тогда как бета3’-GL также будет и наиболее эффективными в тонком кишечнике.
Общее количество GOS, которое определяют для настоящей питательной композиции, включают количество бета1,3’-галактозиллактозы.
В предпочтительном варианте осуществления изобретения питательная композиция по настоящему изобретению включает 0,25-2,5 г галакто-олигосахаридов на 100 мл, где 10 мг-500 мг на 100 мл галакто-олигосахаридов является Gal (бета 1-3)-Gal (бета 1-4)-Glc. В другом предпочтительном варианте осуществления изобретения питательная композиция по настоящему изобретению включает 0,25-2,5 г галакто-олигосахаридов на 100 мл, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20 масс% на основании всех галакто-олигосахаридов. В другом предпочтительном варианте осуществления изобретения питательная композиция по настоящему изобретению включает 0,25-2,5 г галакто-олигосахаридов на 100 мл, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет 10-500 мг на 100 мл. В другом предпочтительном варианте осуществления изобретения питательная композиция по настоящему изобретению включает 0,25-2,5 г галакто-олигосахаридов на 100 мл, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20 масс% на основании всех галакто-олигосахаридов, и где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет от 150 мг до 250 мг на 100 мл.
В другом предпочтительном варианте осуществления изобретения питательная композиция по настоящему изобретению включает 0,25-2,5 г галакто-олигосахаридов на 100 мл, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет от 10 мг до 50 мг на 100 мл.
Предпочтительным источником бета1,3’-галактозиллактозы в получении GOS, полученных с бета-галактозидазой от S. thermophilus, как описано более подробно выше и в примере 3. Особенно подходящим является препарат GOS, полученный посредством использования бета-галактозидазы от штамма CNCM I-1470 и/или CNCM I-1620 (также называемого как штамм S. thermophilus ST065). Как уже описано выше, такой препарат GOS описан более подробно в WO 96/06924, FR2723960 и EP0778885, и в LeForestier et. al., 2009 Eur J Nutr, 48:457-464. Количество бета1,3’-галактозиллактозы в таком препарате GOS находится в диапазоне 60-65 масс% на основании общего количества галакто-олигосахаридов (за исключением лактозы, галактозы и глюкозы).
Другие предпочтительные источники бета1,3’-галактозиллактозы включают Bimuno (Clasado) или Purimune (GTC Nutrition).
Предпочтительно питательная композиция по настоящему изобретению также включает фрукто-олигосахариды (FOS), как описано более подробно ниже.
Предпочтительно питательная композиция по настоящему изобретению дополнительно включает источник белка, источник липидов и источник перевариваемых углеводов, как описано более подробно ниже.
Питательная композиция
Предпочтительно трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc присутствует в питательной композиции. Питательная композиция для применения по изобретению, питательная композиция в способах и применении по настоящему изобретению, и питательная композиция, включающая трисахарид для применения, т.е. включающая бета1,3’-галактозиллактозу для применения, по настоящему изобретению в настоящем описании также называют, как настоящая питательная композиция, или питательная композиция по настоящему изобретению или конечная питательная композиция. Питательная композиция по настоящему изобретению не является человеческим молоком.
Настоящую композицию предпочтительно вводят энтерально, более предпочтительно перорально.
Настоящая композиция предпочтительно является молочной смесью 1-го уровня, молочной смесью 2го уровня, молочной смесью 3го уровня. Примерами молочной смеси 3го уровня является молоко для малышей, молочная смесь третьего уровня, и молочная смесь для детей 1-3 лет. Более предпочтительно питательная композиция является молочной смесью 1 уровня или молочной смесью 2 уровня. Настоящая питательная композиция может преимущественно применяться как полное питание для младенцев. Молочную смесь 1 уровня определяют как смесь для применения у младенцев и она может быть, например, молочной смесью 1 уровня, предназначенной для младенцев 0-6 или 0-4 месяцев. Молочная смесь 2 уровня предназначена для младенцев 4 или 6 месяцев до 12 месяцев жизни. В этом возрасте младенцы начинают употреблять другую пищу. Молочная смесь 3го уровня или или молоко или смесь для тоддлеров или растущих детей, предназначена для детей 12-36 месяцев. Предпочтительно настоящая питательная композиция является молочной смесью 1-го уровня.
Настоящая питательная композиция предпочтительно включает липид, белок и углевод и предпочтительно вводится в жидкой форме. Настоящая питательная композиция также может быть в форме сухой пищи, предпочтительно в форме порошка, который сопровождается инструкциями, как смешивать указанную сухую пищу, предпочтительно порошок, с подходящей жидкостью, предпочтительно водой. Настоящая питательная композиция, следовательно, может быть в форме порошка, подходящего для восстановления водой, для обеспечения готовой к употреблению питательной композиции, предпочтительно готовой к употреблению молочной смесью 1-го уровня, молочной смесью 2го уровня или молочной смесью 3го уровня, более предпочтительно готовой к употреблению молочной смесь 1-го уровня или молочной смеси 2го уровня. Питательная композиция по изобретению предпочтительно включает другие фракции, такие как витамины, минералы, микроэлементы и другие микронутриенты с целью формирования полной питательной композиции. Предпочтительно молочные смеси включают витамины, минералы, микроэлементы и другие микронутриенты в соответствии с международными требованиями.
Настоящая питательная композиция предпочтительно включает липиды, белки и перевариваемые углеводы, где липиды обеспечивают 25-65% общей калорийности, белок обеспечивает 6,5-16% общей калорийности и перевариваемые углеводы обеспечивают 20-80% общей калорийности. Предпочтительно, в настоящей питательной композиции липиды обеспечивают 30-55% общей калорийности, белок обеспечивает 7-9% общей калорийности, и перевариваемые углеводы обеспечивают 35-60% общей калорийности. Для расчета % общей калорийности необходимо принимать во внимание общую энергию белка, обеспеченная белками, пептидами и аминокислотами.
Предпочтительно липиды обеспечивают 3-7 г липидов на 100 ккал, предпочтительно 3,5-6 г на 100 ккал, белок обеспечивает 1,6-4 г на 100 ккал, предпочтительно 1,7-2,3 г на 100 ккал и перевариваемые углеводы обеспечивают 5-20 г на 100 ккал, предпочтительно 8-15 г на 100 ккал питательной композиции. Предпочтительно настоящая питательная композиция включает липиды, обеспечивающие 3,5-6 г на 100 ккал, белок, обеспечивающий 1,7-2,3 г на 100 ккал и перевариваемые углеводы, обеспечивающие 8-15 г на 100 ккал питательной композиции.
Предпочтительно липиды обеспечивают 2,5-6,5 г липидов на 100 мл, предпочтительно 2,5-4 г на 100 мл, белок обеспечивает 1-3 г на 100 мл, предпочтительно 1-1,5 г на 100 мл и перевариваемые углеводы обеспечивают 3-13 г на 100 мл, предпочтительно 5-10 г на 100 мл питательной композиции. Предпочтительно настоящая питательная композиция включает липиды, обеспечивающие 2,0-6,5 г на 100 мл, белок обеспечивает 1-3 г на 100 мл и перевариваемые углеводы обеспечивают 5-10 г на 100 мл питательной композиции.
Предпочтительно липиды обеспечивают 15-45 масс%, предпочтительно 20-30 масс%, на основании сухой массы композиции, белок обеспечивает 8-20 масс%, предпочтительно 8,5-11,5 масс%, на основании сухой массы композиции и перевариваемые углеводы включают 25-90 масс%, предпочтительно 40-75 масс%, на основании сухой массы композиции. Предпочтительно настоящая питательная композиция включает липид, обеспечивающий 20-30 масс%, белок, обеспечивающий 8,5-11,5 масс% и перевариваемые углеводы обеспечивающие 40-75 масс%, все основанные на сухой массе композиции.
Настоящая композиция предпочтительно включает липиды. Предпочтительно настоящая композиция включает по меньшей мере один липид, выбираемый из группы, состоящей из растительных липидов. Предпочтительно настоящая композиция включает комбинацию растительных липидов и по меньшей мере одно масло, выбираемое из группы, состоящей из рыбьего жира, масло водорослей, грибного масла и бактериального масла. Липид настоящей питательной композиции предпочтительно обеспечивает 3-7 г на 100 ккал питательной композиции, предпочтительно липид обеспечивает 3,5-6 г на 100 ккал. В жидкой форме, например, в виде готовой к кормлению жидкости, питательная композиция предпочтительно включает 2,0-6,5 г липида на 100 мл, более предпочтительно 2,5-4,0 г на 100 мл. На основании сухой массы настоящая питательная композиция предпочтительно включает 15-45 масс% липида, более предпочтительно 20-30 масс%. Предпочтительно липиды включают незаменимые жирные кислоты альфа-линоленовую кислоту (ALA), линолевую кислоту (LA) и/или длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFA). LC-PUFA, LA и/или ALA могут быть обеспечены в виде свободных жирных кислот, в форме триглицеридов, в форме диглицеридов, в форме моноглицеридов, в форме фосфолипидов, или в виде смеси одного или более из вышеуказанного. Предпочтительно настоящая питательная композиция включает по меньшей мере один, предпочтительно по меньшей мере два источника липидов, выбираемых из группы, состоящей из рапсового масла (такого как сурепное масло, рапсовое масло с низким содержанием эруковой кислоты и масло канола), высокоолеиновое подсолнечное масло, высокоолеиновое саффлоровое масло, оливковое масло, масла из морепродуктов, микробные масла, кокосовое масло, пальмоядровое масло.
Настоящая композиция предпочтительно включает длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFA). LC-PUFA представляют собой жирные кислоты или жирные ацильные цепи с длиной от 20 до 24 атомов углерода, предпочтительно 20 или 22 атомов углерода, включающие две или более ненасыщенных связей. Предпочтительно композиция включает по меньшей мере одну, предпочтительно две, более предпочтительно три LC-PUFA, выбираемые из докозагексаеновой кислоты (DHA), эйкозапентаеновой кислоты (EPA) и арахидоновой кислоты (ARA). Такие LC-PUFA улучшают барьерную функцию кишечника и могут, следовательно, быть особенно предпочтительно комбинированы с бета1,3’-галактозиллактозой с целью дальнейшего улучшения кишечного барьера. Такая комбинация имеет неожиданные преимущественные эффекты и предпочтительно работает синергически. Предпочтительно композиция включает повышенное количество таких LC-PUFA. Существующие молочные смеси 1-го уровня, в случае, когда они включают такие LC-PUFA, обычно имеют количество суммы DHA, ARA и EPA 0,4-0,9 масс% на основании всех жирных кислот. В питательной композиции по настоящему изобретению, предпочтительно количество таких LC-PUFA составляет более 1 масс%, предпочтительно более 1,1 масс%, на основании всех жирных кислот. Предпочтительно количество таких LC-PUFA составляет не более чем 15 масс%, предпочтительно не более чем 5 масс%, на основании всех жирных кислот. Дополнительно предпочтительно, чтобы количество таких LC-PUFA находится в диапазоне 1-15 масс%, предпочтительно 1,1-5 масс%, на основании всех жирных кислот. Это расценивают как наиболее оптимальный диапазон для использования в молочной смеси для улучшения барьерной функции кишечника.
Предпочтительно количество DHA составляет по меньшей мере 0,4, предпочтительно по меньшей мере 0,5 масс% на основании всех жирных кислот. Предпочтительно количество DHA составляет не более чем 1 масс% на основании всех жирных кислот. Предпочтительно питательная композиция включает количество EPA по меньшей мере 0,09 масс%, предпочтительно по меньшей мере 0,1 масс%, на основании всех жирных кислот, и предпочтительно не более чем 0,4 масс%. Предпочтительно питательная композиция включает количество ARA по меньшей мере 0,25 масс% на основании всех жирных кислот, более предпочтительно по меньшей мере 0,5 масс% и предпочтительно не более чем 1 масс%. Предпочтительно питательная композиция включает DHA в количестве от 0,4 до 1,0 масс% на основании всех жирных кислот, и EPA в количестве от 0,09 до 0,4 масс% на основании всех жирных кислот. Более предпочтительно, питательная композиция включает DHA в количестве от 0,5 до 0,7 масс% на основании всех жирных кислот и EPA в количестве от 0,1 до 0,2 масс% на основании всех жирных кислот. Особенно предпочтительно, чтобы питательная композиция включала DHA в количестве более чем 0,5 масс% на основании всех жирных кислот, и EPA в количестве более чем 0,1 масс% на основании всех жирных кислот. Предпочтительно питательная композиция включает DHA, EPA, и ARA в количестве от 0,4 до 1,0 масс%, от 0,09 до 0,4 масс%, и от 0,25 до 1,0 масс % на основании всех жирных кислот, соответственно. Более предпочтительно питательная композиция включает DHA, EPA, и ARA в количестве от 0,5 до 0,7 масс%, от 0,1 до 0,2 масс%, и от 0,5 до 0,7 масс % на основании всех жирных кислот, соответственно.
Предпочтительно питательная композиция включает DHA в количестве от 20 до 50 мг/100 ккал и EPA в количестве 4,3 до 10,8 мг/100 ккал. Более предпочтительно питательная композиция включает DHA в количестве от 25 до 33,5 мг/100 ккал и EPA в количестве от 5,4 до 7,2 мг/100 ккал. Наиболее предпочтительно питательная композиция включает DHA в количестве около 25 мг/100 ккал и EPA в количестве около 5,4 мг/100 ккал. В таких вариантах осуществления изобретения присутствие ARA является необязательным. При наличии, количество ARA составляет предпочтительно от 12,5 до 50 мг, более предпочтительно от 25 до 33,5 мг и наиболее предпочтительно около 25 мг на 100 ккал.
Предпочтительно массовое соотношение DHA/ARA составляет от 0,9 до 2.
Предпочтительно массовое соотношение DHA/EPA/ARA составляет 1:(0,19-0,7):(0,9-2,0). Такие количества и/или соотношения DHA, EPA и ARA являются оптимальными для дополнительного улучшения барьерной функции кишечника. LC-PUFA могут быть обеспечены в виде свободных жирных кислот, в форме триглицеридов, в форме диглицеридов, в форме моноглицеридов, в форме фосфолипидов или в виде смеси одного или более из вышеуказанного. Подходящими источниками таких LC-PUFA являются, например, рыбий жир и масло из Mortierella alpina.
В одном варианте осуществления изобретения композиция по настоящему изобретению, следовательно, включает липиды, где липиды включают LC-PUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, и где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании всех жирных кислот. В другом варианте осуществления изобретения липиды включают по меньшей мере 0,1 масс% EPA кислоты на основании всех жирных кислот и по меньшей мере 0,5 масс% DHA на основании всех жирных кислот, и необязательно дополнительно по меньшей мере 0,25 масс% ARA на основании всех жирных кислот. Более предпочтительно липиды включают по меньшей мере 0,1 масс% EPA, по меньшей мере 0,5 масс% DHA и по меньшей мере 0,25 масс% ARA, все на основании всех жирных кислот. Еще более предпочтительно липиды включают LC-PUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании общей массы жирных кислот, и где липиды включают по меньшей мере 0,1 масс% EPA, по меньшей мере 0,5 масс% DHA и по меньшей мере 0,5 масс% ARA, все на основании всех жирных кислот.
Предпочтительно питательная композиция по настоящему изобретению включает липиды, где липиды включают LC-PUFA, выбираемый из группы, состоящей из DHA, EPA и ARA, и где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании всех жирных кислот, и где липиды включают DHA в количестве от 0,4 до 1,0 масс% на основании всех жирных кислот, EPA в количестве 0,09 до 0,4 масс% на основании всех жирных кислот и ARA в количестве 0,25-1 масс% на основании всех жирных кислот. В таком варианте осуществления изобретения дополнительно предпочтительно, чтобы липиды включали DHA в количестве от 0,5 до 0,7 масс% на основании всех жирных кислот, EPA в количестве от 0,1 до 0,2 масс% на основании всех жирных кислот и ARA в количестве от 0,5 до 0,7 масс% на основании всех жирных кислот. Более предпочтительно липиды включают DHA в количестве по меньшей мере 0,5 масс%, EPA в количестве по меньшей мере 0,1 масс% масс% и ARA в количестве по меньшей мере 0,5 масс%, все на основании всех жирных кислот.
Настоящая питательная композиция предпочтительно включает белок. Белок, используемый в питательной композиции, предпочтительно выбирают из группы, состоящей из нечеловеческих животных белков, предпочтительно белков молока, растительных белков, таких как предпочтительно белок сои и/или рисовый белок и их смеси. Настоящая питательная композиция предпочтительно содержит казеин и/или белок сыворотки, более предпочтительно белок коровьей сыворотки и/или коровий казеин. Следовательно, в одном варианте осуществления изобретения белок в настоящей питательной композиции включает белок, выбираемый из группы, состоящей из белка сыворотки и казеина, предпочтительно белка сыворотки и казеина, предпочтительно белок сыворотки и/или казеин происходят из коровьего молока. Предпочтительно белок включает менее чем 5 масс% на основании общего белка свободных аминокислот, дипептидов, трипептидов или гидролизованного белка. Настоящая питательная композиция предпочтительно включает казеин и белки сыворотки в массовом соотношении казеин:белок сыворотки 10:90-90:10, более предпочтительно 20:80-80:20, еще более предпочтительно 35:65-55:45.
Масс% белка на основании сухой массы настоящей питательной композиции рассчитывают в соответствии с методом Kjeldahl посредством измерения общего азота и использования фактора конверсии 6,38 в случае казеина, или фактора конверсии 6,25 для иных белков, чем казеин. Термин ‘белок’ или ‘белковый компонент’, как используется в настоящем изобретении, относится к сумме белков, пептидов и свободных аминокислот.
Настоящая питательная композиция предпочтительно включает белок, обеспечивающий 1,6-4,0 г белка на 100 ккал питательной композиции, предпочтительно обеспечивая от 11,7 до 2,3 г на 100 ккал питательной композиции. Слишком низкое содержание белка на основании общей калорийности приведет к менее адекватному росту и развитию у младенцев и маленьких детей. Слишком высокое количество даст метаболическую нагрузку, например, на почки младенцев и маленьких детей. Находясь в жидкой форме, в виде готовой к кормлению жидкой формы, питательная композиция предпочтительно включает от 1,0 до 3,0 г, более предпочтительно от 1,0 до 1,5 г белка на 100 мл. На основании сухой массы настоящая питательная композиция предпочтительно включает 8-20 масс% белка, более предпочтительно 8,5-11,5 масс%, на основании сухой массы всей питательной композиции.
Настоящая питательная композиция предпочтительно включает перевариваемые углеводы, обеспечивающие 5-20 г на 100 ккал, предпочтительно 8-15 г на 100 ккал. Предпочтительно количество перевариваемых углеводов в настоящей питательной композиции составляет 25-90 масс%, более предпочтительно 8,5-11,5 масс%, на основании общей сухой массы композиции. Предпочтительные перевариваемые углеводы представляют собой лактозу, глюкозу, сахарозу, фруктозу, галактозу, мальтозу, крахмал и мальтодекстрин. Лактоза является основным перевариваемым углеводом, присутствующим в человеческом молоке. Настоящая питательная композиция предпочтительно включает лактозу. Предпочтительно настоящая питательная композиция не включает высоких количеств углеводов, иных чем лактоза. По сравнению с перевариваемыми углеводами, такими как мальтодекстрин, сахароза, глюкоза, мальтоза и другие перевариваемые углеводы с высоким гликемическим индексом, лактоза имеет меньший гликемический индекс и, следовательно, является предпочтительной. Настоящая питательная композиция предпочтительно включает перевариваемые углевода, где по меньшей мере 35 масс%, более предпочтительно по меньшей мере 50 масс%, более предпочтительно по меньшей мере 60 масс%, более предпочтительно по меньшей мере 75 масс%, еще более предпочтительно по меньшей мере 90 масс%, наиболее предпочтительно по меньшей мере 95 масс% перевариваемых углеводов является лактоза. На основании сухой массы настоящая питательная композиция предпочтительно включает по меньшей мере 25 масс% лактозы, предпочтительно по меньшей мере 40 масс%, более предпочтительно по меньшей мере 50 масс% лактозы.
В одном варианте осуществления изобретения питательная композиция по изобретению включает перевариваемые углеводы, белки и липиды, где липиды включают LCPUFA выбираемые из группы, состоящей из DHA, EPA и ARA, и где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании всех жирных кислот.
Настоящая питательная композиция предпочтительно включает неперевариваемые олигосахариды (NDO). Термин “олигосахариды”, как используется в настоящем описании, относится к сахаридам со степенью полимеризации (DP) от 2 до 250, предпочтительно DP 2-100, более предпочтительно 2-60, еще более предпочтительно 2-10. Если олигосахарид с DP 2-100 включают в настоящую питательную композицию, это приводит к композициям, которые могут содержать олигосахариды с DP 2-5, DP 50-70 и/или DP 7-60. Термин “неперевариваемые олигосахариды” (NDO), как используется в настоящем изобретении, относится к олигосахаридам, которые не перевариваются в кишечнике посредством действия кислот или пищеварительных ферментов, присутствующих в верхней части пищеварительного тракта человека, например, тонкой кишке и желудке, но которые предпочтительно ферментируются человеческой микробиотой кишечника. Например, сахароза, лактоза, мальтоза и мальтодекстрины расцениваются перевариваемыми.
Предпочтительно настоящие неперевариваемые олигосахариды являются растворимыми. Термин "растворимый", как используется в настоящем описании, со ссылками на полисахариды, волокна или олигосахариды, обозначает, что вещество является по меньшей мере растворимым в соответствии со способом, описанным L. Prosky et al., J. Assoc. Off. Anal. Chem. 71, 1017-1023 (1988).
Бета1,3’-галактозиллактоза расценивается как неперевариваемый олигосахарид, больше, в частности, неперевариваемый галакто-олигосахарид. Как описано выше, бета1,3’-галактозиллактоза может присутствовать в питательной композиции по изобретению, как таковая, или в виде части смеси галакто-олигосахаридов (GOS), предпочтительно бета-галакто-олигосахариды (BGOS). В предпочтительном варианте осуществления изобретения бета1,3’-галактозиллактоза присутствует в виде смеси галакто-олигосахаридов.
Галакто-олигосахариды, и предпочтительные варианты осуществления настоящей питательной композиции, включающей галакто-олигосахариды, описаны более подробно выше.
В одном варианте осуществления изобретения питательная композиция по изобретению включает 1,6-4 г белка, 5-20 г перевариваемых углеводов и 0,35-3,7 г галакто-олигосахаридов на 100 ккал композиции, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20 масс% на основании всех галакто-олигосахаридов. В другом варианте осуществления изобретения питательная композиция по изобретению включает 1,6-4 г белка, 5-20 г перевариваемых углеводов и 0,35-3,7 г галакто-олигосахаридов на 100 ккал композиции, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет от 150 мг до 250 мг на 100 мл. В еще одном варианте осуществления изобретения питательная композиция по изобретению включает 1,6-4 г белка, 5-20 г перевариваемых углеводов и 0,35-3,7 г галакто-олигосахаридов на 100 ккал композиции, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20 масс% на основании всех галакто-олигосахаридов и где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет от 150 мг до 250 мг на 100 мл.
В другом варианте осуществления изобретения питательная композиция по изобретению включает 1,6-4 г белка, 5-20 г перевариваемых углеводов и 0,35-3,7 г галакто-олигосахаридов на 100 ккал композиции, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет между 10 мг и 50 мг на 100 мл.
Предпочтительно настоящая питательная композиция также включает фрукто-олигосахариды (FOS). Термин “фрукто-олигосахариды”, как используется в настоящем изобретении, относится к углеводам, состоящим из более 50%, предпочтительно более 65% блоков фруктозы на основании мономерных субъединиц, в которых по меньшей мере 50%, более предпочтительно по меньшей мере 75%, еще более предпочтительно по меньшей мере 90%, блоки фруктозы связаны вместе посредством бета-гликозидной связи, предпочтительно бета-2,1 гликозидной связи. Блоки глюкозы могут присутствовать в восстанавливаемом конце цепи блоков фруктозы. Предпочтительно фрукто-олигосахариды имеют DP или средний DP в диапазоне от 2 до 250, более предпочтительно 2-100, еще более предпочтительно 10-60. Термин “фрукто-олигосахариды” включает леван, гидролизированный леван, инулин, гидролизированный инулин, и синтезированные фрукто-олигосахариды. Предпочтительно препарат включает короткоцепочечные фрукто-олигосахариды со средней степенью полимеризации (DP) 3-6, более предпочтительно гидролизированный инулин или синтетический фрукто-олигосахарид. Предпочтительно препарат включает длинноцепочечные фрукто-олигосахариды со средним DP выше 20. Предпочтительно препарат включает и короткоцепочечные и длинноцепочечные фрукто-олигосахариды. Фрукто-олигосахарид, подходящий для применения в композиции по изобретению, также являются легко коммерчески доступными, например, RaftilineHP (Orafti). Предпочтительно питательная композиция по настоящему изобретению включает по меньшей мере 25 мг FOS на 100 мл, более предпочтительно по меньшей мере 40, еще более предпочтительно по меньшей мере 60 мг. Предпочтительно композиция не включает более чем 250 мг FOS на 100 мл, более предпочтительно не более чем 150 мг на 100 мл и наиболее предпочтительно не более чем 100 мг на 100 мл. Количество FOS составляет предпочтительно 25-250 г фрукто-олигосахаридов на 100 мл, предпочтительно 40-150 г на 100 мл, более предпочтительно 60-100 г на 100 мл. Предпочтительно питательная композиция по настоящему изобретению включает по меньшей мере 0,15 масс% FOS на основании сухой массы, более предпочтительно по меньшей мере 0,25 масс%, еще более предпочтительно по меньшей мере 0,4 масс%. Предпочтительно композиция не включает более чем 1,5 масс% FOS на основании сухой массы общей композиции, более предпочтительно не более чем 2 масс%. Присутствие FOS показывает дополнительный улучшенный эффект на микробиоту и его продукцию SCFA.
Предпочтительно настоящая питательная композиция включает смесь галакто-олигосахаридов (включая бета1,3’-галактозиллактоза) и фрукто-олигосахаридов. Предпочтительно смесь галакто-олигосахаридов и фрукто-олигосахаридов присутствует в массовом соотношении от 1/99 до 99/1, более предпочтительно от 1/19 до 19/1, более предпочтительно от 1/1 до 19/1, более предпочтительно от 2/1 до 15/1, более предпочтительно от 5/1 до 12/1, еще более предпочтительно от 8/1 до 10/1, еще более предпочтительно в соотношении около 9/1. Такое массовое соотношение является особенно предпочтительным, когда галакто-олигосахариды имеют низкое среднее DP и фрукто-олигосахариды имеют относительно высокое DP. Наиболее предпочтительной является смесь галакто-олигосахаридов со средним DP ниже 10, предпочтительно ниже 6, и фрукто-олигосахариды со средней DP выше 7, предпочтительно выше 11, еще более предпочтительно выше 20.
В предпочтительном варианте осуществления настоящая питательная композиция включает смесь короткоцепочечных (sc) фрукто-олигосахаридов и длинноцепочечных (lc) фрукто-олигосахаридов. Предпочтительно смесь короткоцепочечных фрукто-олигосахаридов и длинноцепочечных фрукто-олигосахаридов в массовом соотношении от 1/99 до 99/1, более предпочтительно от 1/19 до 19/1, еще более предпочтительно от 1/10 до 19/1, более предпочтительно от 1/5 до 15/1, более предпочтительно от 1/1 до 10/1. Предпочтительной является смесь короткоцепочечных фрукто-олигосахаридов со средним DP ниже 10, предпочтительно ниже 6 и фрукто-олигосахаридов со средним DP выше 7, предпочтительно выше 11, еще более предпочтительно выше 20.
В другом предпочтительном варианте осуществления настоящая питательная композиции включает смесь короткоцепочечных (sc) фрукто-олигосахаридов и короткоцепочечных (sc) галакто-олигосахаридов. Предпочтительно смесь короткоцепочечных фрукто-олигосахаридов и короткоцепочечных галакто-олигосахаридов присутствует в массовом соотношении от 1/99 до 99/1, более предпочтительно от 1/19 до 19/1, еще более предпочтительно от 1/10 до 19/1, более предпочтительно от 1/5 до 15/1, более предпочтительно от 1/1 до 10/1. Предпочтительной является смесь короткоцепочечных фрукто-олигосахаридов и короткоцепочечных галакто-олигосахаридов со средним DP ниже 10, предпочтительно ниже 6.
Настоящая питательная композиция предпочтительно включает от 1,75 до 17,5 масс% общих неперевариваемых олигосахаридов, более предпочтительно от 2,8 до 10,5 масс%, наиболее предпочтительно от 4,2 до 7 масс%, на основании сухой массы питательной композиции. На основании 100 мл настоящая питательная композиция предпочтительно включает от 0,25 до 2,5 г всех неперевариваемых олигосахаридов, более предпочтительно от 0,4 до 1,5 г, наиболее предпочтительно от 0,6 до 1 г, на основании 100 мл питательной композиции. Меньшее количество неперевариваемых олигосахаридов будет менее эффективным в улучшении барьерной функции кишечника, тогда как лишком высокое количество приведет к побочным эффектам вздутия и дискомфорта в животе. Общее количество неперевариваемых олигосахаридов включает галакто-олигосахариды, включая бета3’-GL, фрукто-олигосахариды и любые дополнительные неперевариваемые олигосахариды, которые могут дополнительно присутствовать в композиции.
Настоящая питательная композиция включает трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc, также называемый как бета1,’3-галактозиллактоза или бета3’-GL. Предпочтительно композиция включает по меньшей мере 10 мг на 100 мл бета3’-GL. Предпочтительно питательная композиция включает как минимум 500 мг бета3’-GL на 100 мл. Предпочтительно питательная композиция включает бета3’-GL в количестве 10-500 мг на 100 мл. Предпочтительно питательная композиция включает бета3’-GL в количестве от 15 до 750 мг на 100 ккал. Предпочтительно питательная композиция включает бета3’-GL в количестве от 0,07 до 3,75 масс% на основании сухой массы композиции.
Низкие дозы бета3’-GL могут быть использованы, как было обнаружено, что бета3’-GL уже были эффективными в низкой дозе в улучшении барьерной функции кишечника. Предпочтительно питательная композиция включает бета3’-GL в количестве от 10 до 75 мг на 100 мл, наиболее предпочтительно в количестве от 10 до 50 мг/100 мл. Предпочтительно питательная композиция включает бета3’-GL в количестве от 15 до 75 мг на 100 ккал. Предпочтительно питательная композиция включает бета3’-GL в количестве от 0,07 до 0,375 масс%, на основании сухой массы композиции.
В другом варианте осуществления изобретения количество бета3’-GL является относительной высоким. В этом варианте осуществления изобретения композиция включает по меньшей мере 150 мг бета3’-GL на 100 мл. Предпочтительно питательная композиция включает по меньшей мере 500 мг, предпочтительно по меньшей мере 250 мг бета3’-GL на 100 мл. Более предпочтительно питательная композиция включает от 150 до 500 мг бета3’-GL на 100 мл, наиболее предпочтительно питательная композиция включает от 150 до 250 мг бета3’-GL на 100 мл. Предпочтительно питательная композиция включает бета3’-GL в количестве от 225 до 375 мг на 100 ккал. Предпочтительно питательная композиция включает бета3’-GL в количестве от 1,125 до 1,725 масс%, на основании сухой массы композиции.
Предпочтительно композиция включает по меньшей мере 1 масс% бета3’-GL на основании общего GOS. Предпочтительно питательная композиция включает по меньшей мере 70 масс% бета3’-GL на основании общего GOS. Более предпочтительно питательная композиция включает от 1,3 до 10 масс% бета3’-GL на основании общего GOS, наиболее предпочтительно от 1,3 до 7 масс% бета3’-GL на основании общей GOS. Предпочтительно композиция включает по меньшей мере 0,8 масс% бета3’-GL на основании общей NDO. Предпочтительно питательная композиция включает как минимум 65 масс% бета3’-GL на основании общей NDO. Более предпочтительно питательная композиция включает от 1,1 до 9 масс% бета3’-GL на основании общей NDO, наиболее предпочтительно от 1,1 до 6,5 масс% на основании общей NDO.
Также важно, чтобы питательная композиция по настоящему изобретению не имела избыточной калорийности, однако, все еще обеспечивала достаточное количество калорий, чтобы накормить субъекта. Следовательно, жидка пища предпочтительно имеет калорийность от 0,1 до 2,5 ккал/мл, более предпочтительно калорийность от 0,5 до 1,5 ккал/мл, еще более предпочтительно от 0,6 до 0,8 ккал/мл, и наиболее предпочтительно от 0,65 до 0,7 ккал/мл.
В предпочтительном варианте осуществления изобретения питательной композиции по настоящему изобретению, питательной композицией является молочная смесь 1-го уровня, молочная смесь 2го уровня или молочная смесь 3-го уровня. Следовательно, изобретение также относится к молочной смеси 1-го уровня, молочной смеси 2-го уровня или молочной смеси 3-го уровня, предпочтительно молочная смесь 1-го уровня, молочная смесь 2го уровня, включающая:
a. от 1,6 до 4 г белка на основании 100 ккал,
b. от 5 до 20 г перевариваемых углеводов на основании 100 ккал,
c. от 3 до 7 г липидов на основании 100 ккал, где липиды включают:
i. LC-PUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании всех жирных кислот, и/или
ii. по меньшей мере 0,1 масс% EPA на основании всех жирных кислот и по меньшей мере 0,5 масс % DHA на основании всех жирных кислот, и необязательно по меньшей мере 0,25 масс% ARA на основании всех жирных кислот,
d. от 0,25 до 2,5 г неперевариваемых олигосахаридов на 100 мл готовой к употреблению смеси, где неперевариваемые олигосахариды включают Gal (бета 1-3)-Gal (бета 1-4)-Glc в количестве от 10 до 500 мг на 100 мл готовой к употреблению питьевой смеси.
Молочная смесь 1-го уровня, молочная смесь 2го уровня или молочная смесь 3го уровня могут быть в форме жидкости, предпочтительно готовой к употреблению жидкости или в форме порошка. В одном варианте осуществления изобретения молочная смесь 1-го уровня или молочная смесь 2-го уровня или молочная смесь 3-го уровня находится в форме порошка, подходящего для восстановления водой для обеспечения готовой к употреблению молочной смеси 1-го уровня, молочной смеси 2-го уровня или молочной смеси 3-го уровня. Понимают, что когда молочная смесь 1го уровня или молочная смесь 2-го уровня или молочная смесь 3го уровня по изобретению находится в форме порошка, количество неперевариваемых олигосахаридов и бета3’-галактозиллактозы в указанной смеси определяют, как количества, которые будут присутствовать после восстановления порошка водой, т.е. количества определяют в мг на 100 мл готовой к употреблению смеси.
В этом варианте осуществления изобретения предпочтительно, чтобы сумма DHA, ARA и EPA составляла по меньшей мере 1 масс% на основании всех жирных кислот и что липиды включают по меньшей мере 0,1 масс% EPA и по меньшей мере 0,5 масс% DHA на основании всех жирных кислот. Липиды необязательно дополнительно включают по меньшей мере 0,25 масс% ARA, на основании всех жирных кислот. Более предпочтительно, сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании всех жирных кислот и липиды включают по меньшей мере 0,1 масс% EPA, по меньшей мере 0,5 масс% DHA на основании и по меньшей мере 0,25 масс% ARA, на основании всех жирных кислот.
Предпочтительно молочная смесь 1-го уровня или молочная смесь 2 го уровня или молочная смесь 3го уровня по изобретению включают от 0,25 до 2,5 г галакто-олигосахаридов на 100 мл, предпочтительно от 0,4 до 1,5 г на 100 мл, более предпочтительно от 0,6 до 1,0 г на 100 мл. Предпочтительно, молочная смесь 1-го уровня или молочная смесь 2го уровня или молочная смесь 3го уровня по изобретению включает от 0,025 до 0,25 г фрукто-олигосахаридов на 100 мл, предпочтительно от 0,04 до 0,15 г на 100 мл, более предпочтительно от 0,06 до 0,1 г на 100 мл. Более предпочтительно, молочная смесь 1-го уровня или молочная смесь 2 го уровня или молочная смесь 3го уровня по изобретению включает от 0,4 до 1,5 г галакто-олигосахаридов и от 0,04 до 0,15 г фрукто-олигосахаридов на 100 мл. Еще более предпочтительно, молочная смесь 1-го уровня или молочная смесь 2го уровня или молочная смесь 3го уровня по изобретению включает от 0,6 до 1,0 г галакто-олигосахаридов и от 0,06 до 0,1 г фрукто-олигосахаридов на 100 мл.
Молочная смесь 1-го уровня или молочная смесь 2 го уровня или молочная смесь 3го уровня по изобретению предназначена для применения в обеспечении питания младенца или маленького ребенка, предпочтительно младенца.
Изобретение дополнительно относится к молочной смеси 1-го уровня или молочной смеси 2-го уровня или молочной смеси 3го уровня, предпочтительно молочной смеси 1го уровня или молочной смеси 2-го уровня, включающей:
a. от 1,6 до 4 г белка на основании 100 ккал,
b. от 5 до 20 г перевариваемых углеводов на основании 100 ккал,
c. от 3 до 7 г липидов на основании 100 ккал, где липиды включают:
i. LC-PUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании всех жирных кислот и/или
ii. по меньшей мере 0,1 масс% EPA на основании всех жирных кислот и по меньшей мере 0,5 масс % DHA на основании всех жирных кислот, и необязательно дополнительно по меньшей мере 0,25 масс% ARA на основании всех жирных кислот,
d. от 0,25 до 2,5 г неперевариваемых олигосахаридов на 100 мл готовой к питьевой смеси, где неперевариваемые олигосахариды включают Gal (бета 1-3)-Gal (бета 1-4)-Glc в количестве от 10 до 500 мг на 100 мл готовой к употреблению смеси,
для применения в увеличении барьерной функции кишечника и/или для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта; или для применения в лечении, профилактике и/или облегчении состояния, ассоциированного с токсическим воздействием у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, наиболее предпочтительно деоксиниваленол.
Предпочтительные варианты осуществления изобретения, описанного выше, для молочной смеси 1-го уровня или молочной смеси 2 го уровня или молочной смеси 3го уровня по изобретению также применяются к настоящей молочной смеси 1-го уровня для применения, молочной смеси 2 го уровня для применения, и молочной смеси 3го уровня для применения.
Применение
Было обнаружено, что специфически бета1,3’-галактозиллактоза имеет неожиданно преимущественный эффект на увеличение барьерной функции кишечника. Следовательно, бета1,3’-галактозиллактоза может быть использована для профилактики и/или лечения нарушения кишечного барьера и дополнительно, что бета1,3’-галактозиллактоза является эффективной для лечения, профилактики и/или облегчения состояния, ассоциированного с токсическим воздействием.
Следовательно, настоящее изобретение относится к трисахариду Gal (бета 1-3)-Gal (бета 1-4)-Glc для применения в увеличении барьерной функции кишечника и/или для применения в профилактике и/или лечении барьерной функции кишечника у субъекта. Иными словами, изобретение относится к способу увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушения кишечного барьера у субъекта, способ включает введение субъекту трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc.
Изобретение дополнительно относится к питательной композиции для применения в увеличения барьерной функции кишечника и/или для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта, где питательная композиция включает трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc (бета1,3’-галактозиллактоза) в качестве активного ингредиента. Иными словами, изобретение относится к способу увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушения кишечного барьера у субъекта, способ включает введение питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc в качестве активного ингредиента субъекту.
Изобретение дополнительно относится к питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc, для применения в лечении, профилактике и/или облегчении состояния, ассоциированного с токсическим воздействием у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, наиболее предпочтительно токсином является деоксиниваленол. Состояние, ассоциированное с токсическим воздействием, представляет собой опосредованное токсином нарушение кишечного барьера. Иными словами, изобретение относится к способу лечения, профилактики и/или облегчения состояния, ассоциированного с токсическим воздействием у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, и наиболее предпочтительно токсином является деоксиниваленол, способ включает введение питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc субъекту. Состояние, ассоциированное с токсическим воздействием, представляет собой опосредованное токсином нарушение кишечного барьера.
В случае введения питательной композиции младенцу расценивается нетерапевтическим, настоящее изобретение может быть сформулировано как нетерапевтический способ увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушения кишечного барьера у субъекта, способ включает введение трисахарида Gal(бета 1-3)- Gal(бета 1-4)-Glc субъекту или введение субъекту питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc в качестве активного ингредиента. В одном варианте осуществления изобретение относится к нетерапевтическому способу лечения, профилактики и/или облегчения состояния, ассоциированного с токсическим воздействием у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, и наиболее предпочтительно токсином является деоксиниваленол, способ включает введение субъекту питательной композиции, включающей трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc. Состояние, ассоциированное с токсическим воздействием, представляет собой опосредованное токсином нарушение кишечного барьера.
Трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc в настоящем описании также называют как бета1,3’-галактозиллактоза или бета3’-GL.
В контексте настоящего изобретения термин “профилактика” обозначает “уменьшение риска” или “уменьшение тяжести”. Термин “профилактика определенного состояния” также включает “лечение субъекта, имеющего риск развития указанного состояния”.
Способы и применения по настоящему изобретению, включающие введение настоящей питательной композиции субъекту, нуждающемуся в этом, также относится к введению эффективного количества питательной композиции субъекту.
В предпочтительном варианте осуществления изобретения питательная композиция по изобретению представляет собой молочную смесь 1-го уровня, молочную смесь 2-го уровня или молочную смесь 3го уровня, предпочтительно молочную смесь 1-го уровня. В контексте настоящего изобретения младенца определяют как человека, имеющего возраст 0-12 месяцев и маленького ребенка, имеющего возраст 13-36 месяцев. Следовательно, настоящую питательную композицию предпочтительно вводят младенцу или маленькому ребенку, более предпочтительно младенцу в возрасте от 0 до 12 месяцев, наиболее предпочтительно младенцу в возрасте от 0 до 6 месяцев. В предпочтительном варианте осуществления изобретения способы или применения по настоящему изобретению предназначены для здоровых младенцев, предпочтительно для здоровых доношенных младенцев. У новорожденных кишечный тракт полностью не развит, и младенцы нуждаются в поддержке для развития барьерной функции кишечника и/или резистентности к патогенам и/или аллергенам. В одном варианте осуществления изобретения младенцы, рожденные посредством кесарева сечения, нуждаются в поддержке устойчивости кишечного барьера и/или функции в соответствии с настоящим изобретением.
В предпочтительном варианте осуществления изобретения субъектом в настоящем изобретении является субъект, имеющий нарушенный кишечный барьер или имеющий риск развития нарушения кишечного барьера. В одном варианте осуществления изобретения субъектом является преждевременно или недоношенные рожденные младенцы. Особенно эта подгруппа младенцев может получить пользу от применения трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc, так как органы, составляющие кишечный тракт недоношенных являются незрелыми, в противоположность к доношенным младенцам и, следовательно, нуждаются в увеличении барьерной функции кишечника, улучшении целостности кишечного барьера, уменьшении проницаемости кишечного барьера и/или уменьшении нарушения кишечного барьера.
У младенцев функция кишечного барьера может легко быть определена без необходимости в инвазивных технологиях, например, посредством теста абсорбции маннита-лактулозы, см. Jalonen, J Allergy Clin Immunol 1991; 88:737-742.
Кишечный эпителиальный стресс или повреждение могут участвовать в аллергической сенсибилизации против определенных пищевых антигенов. Bol-Schoenmakers et al. (Mucosal Immunol. 2016 Nov;9(6):1477-1486) продемонстрировали, что деоксиниваленол (DON) усиливает аллергическую сенсибилизацию к пищевым белкам и такое развитие сенсибилизации может быть индуцировано различными молекулярными механизмами и местным иммунным ответом (IL8). Следовательно, предполагают, что пищевые загрязнители, включая DON, участвуют в аллергической сенсибилизации у человека.
Микотоксины представляют собой вторичные метаболиты, продуцируемые плесенью и грибками, загрязняющими определенные зерновые, а также кормовые растения, фрукты, пищу и пищевые продукты, а также окружение (например, почва, вода и воздух посредством аэрозольного микотоксикоза и др.). Микотоксины могут иметь опасный эффект на здоровье человека и животных. Особенно интересными являются микотоксины трихотецены, которые являются классом соединений, продуцируемым видом Fusarium graminearum. Такое большое семейство сексвитерпеновых эпоксидов близко связано и они варьируются по положению и количеству гидроксилирований и замен основной химической структуры. Главным трихотеценом, продуцируемым Fusarium graminearum, является деоксиниваленол (DON) также известный как вомитоксин, по его способности индуцировать рвоту. Влияние DON на абсорбцию питательных веществ человеческими эпителиальными клетками кишечника исследовали в Maresca et al. "The mycotoxin deoxynivalenol affects nutrient absorption in human intestinal epithelial cells" J. Nutr. Vol. 132 (2002) 2723-2731, и в Avantaggiato et al. "Evaluation of the intestinal absorption of deoxynivalenol and nivalenol by an in vitro gastrointestinal model, and the binding efficacy of activated carbon and other absorbent materials" Food and Chemical Toxicology vol. 42 (2004) 817-824.
Микотоксины могут появляться в пищевой цепи в результате грибковой инфекции растительных продуктов (например, корма, зерновые, растительный белок, обработанные продукты обработки зерновых, сырье и меласса), и могут быть или съедены непосредственно людьми или введены с контаминированными зерновыми, кормом для скота или другими продуктами кормления животных. Так как DON часто появляется в токсикологически значимых концентрациях в зерновых и крупах, он может быть квалифицирован как настоящая проблема для всех людей и животных, потребляющих питание, включающее злаки и/или зерновые. Это особенно касается младенцев и принимая это во внимание Codex Committees on Contaminants in Food (CCCF) решил обеспечить максимальные пределы для уровня деоксиниваленола, которые все еще считаются приемлемыми в сырых зернах злаков, таких как зерна пшеницы и ячменя, и молочные смеси.
В одном варианте осуществления настоящего изобретения трисахарид для применения, питательную композицию для применения или питательную композицию в способах и применениях по изобретению вводят субъектам с риском, предпочтительно младенцам и маленьким детям, которые потребляют зерновые или зерносодержащие продукты, в частности два дня или более в неделю, например три дня или четыре дня или пять дней или шесть дней в неделю или ежедневно, и/или младенцами или маленькими детьми, которые страдают от или имеют повышенный риск пищевой аллергии и/или атопического дерматита. Младенец с повышенным риском или развитием пищевой аллергии представляет собой младенца, рожденного от родителей, из которых один или оба страдают от атопического заболевания, или младенцем, который имеет одного или более сиблингов, страдающих от атопического заболевания. Такие младенцы и маленькие дети имеют более высокий риск получить аллергию на определенные продукты, например, на пищевые белки, в частности белки коровьего молока.
СПИСОК ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
1. Трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc (бета1,3’-галактозиллактоза) для применения в увеличении барьерной функции кишечника и/или для применения в профилактике и/или лечении нарушения кишечного барьера у субъекта.
2. Трисахарид для применения по варианту осуществления изобретения 1, где трисахарид присутствует в питательной композиции.
3. Питательная композиция для применения в увеличении барьерной функции кишечника и/или для применения в профилактике и/или лечении нарушений кишечного барьера у субъекта, где питательная композиция включает трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc (бета1,3’-галактозиллактоза) в качестве активного ингредиента.
4. Питательная композиция, включающая трисахарид Gal (бета 1-3)-Gal (бета 1-4)-Glc, для применения в лечении, профилактике и/или облегчении состояний, ассоциированных с токсическим воздействием у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, наиболее предпочтительно токсином является деоксиниваленол (DON).
5. Питательная композиция по варианту осуществления 4, где состоянием, ассоциированным с токсическим воздействием, является нарушение кишечного барьера, опосредованное токсинами.
6. Трисахарид для применения по вариантам осуществления изобретения 1 или 2, или питательная композиция для применения по любому из вариантов осуществления изобретения 3-5, где указанный трисахарид или указанная питательная композиция предназначены для введения младенцам или маленьким детям в возрасте 0- 36 месяцев, предпочтительно младенцам.
7. Трисахарид для применения по любому из вариантов осуществления изобретения 1, 2 или 6, или питательная композиция для применения по любому из вариантов осуществления 3-6, где указанный трисахарид или указанная питательная композиция предназначены для введения субъекту с риском, предпочтительно младенцам или маленьким детям, которые потребляют зерновые или продукты, включающие зерновые, предпочтительно два или более раз в неделю и/или младенцам или маленьким детям, которые страдают от или имеют повышенный риск развития пищевой аллергии и/или атопического дерматита.
8. Питательная композиция, включающая трисахарид для применения по варианту осуществления 2, или питательная композиция для применения по любому из вариантов осуществления изобретения 3-7, где питательная композиция является молочной смесью 1-го уровня, молочной смесью 2-го уровня или молочной смесью 3-
го уровня.
9. Питательная композиция, включающая трисахарид для применения по варианту осуществления 2 или варианту осуществления 8, или питательная композиция для применения по любому из вариантов осуществления 3-8, где питательная композиция включает 0,07-3,75 масс% Gal (бета 1-3)-Gal (бета 1-4)-Glc, на основании сухой массы питательной композиции и/или где вводимая суточная доза 0,10-6 г Gal (бета 1-3)-Gal (бета 1-4)-Glc.
10. Питательная композиция, включающая трисахарид для применения по варианту осуществления 2, 8 или 9, или питательная композиция для применения по любому из вариантов осуществления изобретения 3-9, где питательная композиция включает 10-500 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc на 100 мл композиции.
11. Питательная композиция, включающая трисахарид, для применения по любому из вариантов осуществления изобретения 2 или 8-10, или питательная композиция для применения по любому из вариантов осуществления 3-10, где питательная композиция включает 1,6-4 г белка, 5-20 г перевариваемых углеводов и 0,35-3,7 г галакто-олигосахаридов на 100 ккал композиции, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20 масс% на основании всех галакто-олигосахаридов и/или где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет от 150 мг до 250 мг на 100 мл.
12. Питательная композиция, включающая трисахарид, для применения по любому из вариантов осуществления 2, или 8-10, или питательная композиция для применения по любому из вариантов осуществления 3-10, где питательная композиция включает от 1,6 до 4 г белка, 5-20 г перевариваемых углеводов и 0,35-3,7 г галакто-олигосахаридов на 100 ккал композиции, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет от 10 мг до 50 мг на 100 мл.
13. Питательная композиция, включающая трисахарид, для применения по любому из вариантов осуществления 2 или 8-12, или питательная композиция для применения по любому из вариантов осуществления 3-12, где питательная композиция дополнительно включает перевариваемые углеводы, белок и липиды, и где липиды включают LC-PUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, где предпочтительно сумма DHA, ARA и EPA составляет по меньшей мере 1 масс% на основании всех жирных кислот.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1:
Эффекты различных галактозиллактоз (GLs) на DON-индуцированное повреждение целостности монослоя клеток Caco-2. На фиг. 1A и 1B показана трансэпителиальная электрическая резистентность (TEER) для различных GL. На фиг. 1C и 1D показана транслокация люцифер желтого (LYF) в базолатральный отдел. TEER выражают, как процент исходного значения и LYF выражают в нг/см2 x ч, т.е. в нг/мл. Альфа3’-GL представляет собой Gal (альфа 1-3)-Gal (бета 1-4)-Glc; бета3’-GL представляет собой Gal (бета 1-3)-Gal (бета 1-4)-Glc; бета4’-GL представляет собой Gal (бета 1-4)-Gal (бета 1-4)-Glc’; бета6’-GL представляет собой Gal (бета 1-6)-Gal (бета 1-4)-Glc. Данные представляют собой среднее±s.e. *: p < 0,05 по сравнению с контролем, **: p < 0,01 по сравнению с контролем, ***: p < 0,001 по сравнению с контролем, ^: p < 0,05 по сравнению с DON контролем, ^^ p< 0,01 по сравнению с DON контролем, ^^^ p< 0,001 по сравнению с DON контролем.
Фиг. 2:
Различные эффекты GL на DON-индуцированное увеличение высвобождения IL8 клетками Caco-2. Секреция IL-8 выражается как пг/мл как среднее±s.e. альфа3’-GL представляет собой Gal (альфа 1-3)-Gal (бета 1-4)-Glc; бета3’-GL представляет собой Gal (бета 1-3)-Gal (бета 1-4)-Glc , бета4’-GL представляет собой Gal (бета 1-4)-Gal (бета 1-4)-Glc , бета6’-GL представляет собой Gal (бета 1-6)-Gal (бета 1-4)-Glc. Данные представляют собой среднее±s.e. *: p < 0,05 по сравнению с контролем, **: p < 0,01 по сравнению с контролем, ***: p < 0,001 по сравнению с контролем, ^: p < 0,05 по сравнению с DON контролем, ^^ p< 0,01 по сравнению с DON контролем, ^^^ p< 0,001 по сравнению с DON контролем.
ПРИМЕРЫ
Пример 1: Нацеленный без метки LC-ESI-MS2 анализ бета3’-[и бета6’]-галактозиллактозы в человеческом молоке с усиленной структурной селективностью
Образцы свежего человеческого молока добровольцев с различных стадий лактации обогащали по внутренним стандартам, включая, например, α-арабинопентаозу. Затем, 3 анонимных обогащенных образца молока (2 здоровых донора, 3 различные стадии лактации), анонимные обогащенные образцы молока разводили 1:10 H2O и подвергали ультрафильтрации (UF) с отсечкой 3 кДа. Пермеаты UF анализировали жидкостной хроматографией электрораспыления ионизации тандемной масс-спектрометрии (LC-ESI-MS2). LC-разделение галактозиллактоз (GL) и других соединений человеческого молока осуществляли посредством 2,1×30мм+2,1×10 мм пористых графитизированных углеродных ВЭЖХ колонок, соединенных в линию с линейной масс-спектрометрической ионной ловушкой.
Градиентная элюция GL начиналась с 0,3% NH4OH в H2O на 0 мин и заканчивали с 0,3% NH4OH в 95% метаноле на 27 мин. Постоянная скорость тока была 0,4 мл/мин и колонки держали при 45 градусах Цельсия. Элюированные GL характеризовали мониторингом множественных реакций отрицательных ионов (MRM) LC-ESI-MS2. Используемые переходы MRM определяли ранее посредством экспериментов MS/MS с помощью коммерчески доступных чистых GL-стандартов с использованием фрагментации, индуцированной столкновениями диссоциации (CID). Дополнительные подробности методов могут быть обнаружены в Mank M, Welsch P, Heck A J R, Stahl B, Anal Bioanal Chem 2019, 411 (1):231-250.
Бета3’-GL и бета6’-GL определяли непосредственно в образцах человеческого молока на различных стадиях лактации (4, 125 и 159 дней после родов). Результаты показаны в таблице 1. Интересно, обогащенность бета3’-GL оказывается относительно стабильной между молозивом и зрелым молоком, тогда как количество бета6’-GL сильно снижалось с течением времени.
Таблица 1. Бета3’-GL и бета6’-GL в образцах человеческого молока с различных стадий лактации
Пример 2: Бета1,3’-галактозиллактоза специфически защищает против нарушения кишечного барьера и предотвращает увеличение проницаемости
Бета1,3’-галактозиллактозу (бета3’-GL), бета1,4’-галактозиллактозу (бета4’-GL) и бета1,6’-галактозиллактозу (бета6’-GL) получали от Carbosynth (Berkshire, UK). Альфа1,3’-галактозиллактозу (альфа3’-GL) получали от Elicityl (Crolles, France). Очищенный деоксидиваленол (DON) (D0156; Sigma Aldrich, St Luis, MO, USA) растворяли в чистом этаноле и хранили при -20°C. Клетки человеческой эпителиальной колоректальной аденокарциномы (Caco-2) получали от American Type Tissue Collection (Code HTB-37) (Manasse, VA, USA, passage 90-102).
Клетки Caco-2 использовали в соответствии с установленными методами. Коротко: клетки культивировали в среде Eagle, модифицированной Дульбекко (DMEM) и сеяли с плотностью клеток 0,3×105 в 0,3 см2 вставках с высокой плотностью пор (0,4 мкм) с мембраной полиэтилентерфталата (BD Biosciences, Franklin Lakes, NJ, USA) помещенных в 24-луночный планшет. Клетки Caco-2 сохраняли в увлажненной атмосфере 95% воздуха и 5% CO2 при 37°C. После 17-19 дней культивирования сливающийся монослой получали со средним трансэпителиальным электрическим сопротивлением (TEER), превосходящим 400 Ώ см2, измеренным посредством вольтметра Millicell-Electrical Resistance System (Millipore, Temecula, CA, USA).
Монослои клеток Caco-2 затем выращивали в трансвел-системе, который является моделью функции кишечного барьера. Монослои предварительно обрабатывали в течение 24 ч различными GL, включая бета3’-GL, альфа3’-GL, бета4’-GL и бета6’-GL в концентрации 0,75 масс% GL, до воздействия грибкового токсина деоксиниваленола (DON), который является триггером, и соединением-моделью для нарушения кишечного барьера. DON разводили до конечной концентрации 4,2 мкМ в полной клеточной среде и добавляли к апикальной стороне, а также к базолатеральной стороне трансвелл-вставок. Такая концентрация DON не влияет на выживаемость клеток Caco-2. Инкубация DON составила 24 ч.
Измерения трансэпителиального электрического сопротивления (TEER) и проницаемость для люцифер желтого (LY) проводили для исследования целостности барьера. Для измерения TEER вольтметр Millicel-ERS, соединенный с парой палочек электродов, использовали для измерения значений TEER. Результаты выражали, как процент исходного значения. Для анализа параклеточного следового тока непроницаемый для мембраны люцифер желтый (LY) (Sigma, St Luis, MO, USA) добавляли в концентрации 16 мкг/мл в апикальный отдел в трансвелл-планшете в течение 4 ч, и параклеточный ток определяли посредством измерения интенсивности флуоресценции в базолатеральном отделе с помощью спектрофлуориметра (FLUOstar Optima, BMG Labtech, Offenburg, Germany), установленного на длины волн возбуждения и излучения на 410 и 520 нм, соответственно. Высвобождение интерлейкина -8 (IL-8 или CXCL8), который является типичным маркером воспаления, оценивали количественно в среде апикальной стороны и базолатеральной стороны Caco-2 трансвелл-вставок в ответ на обработку. Концентрации CXCL8 измеряли посредством использования анализа ELISA человеческого IL-8 (BD Biosciences, Pharmingem, San Diego, CA, USA) в соответствии с инструкциями производителя. Для больших подробностей по материалам и методам см. Akbari et al, 2016, Eur J Nutr. 56(5):1919-1930.
Результаты показаны на фиг. 1 A, B, C и D и на фиг. 2. На фиг. 1 показаны эффекты различных галактозиллактоз (GL) на DON-индуцированные нарушения целостности монослоя клеток Caco-2. На фиг. 1A и 1B показано трансэпителиальное электрическое сопротивление (TEER) для различных GL. На фиг. 1C и 1D показана транслокация люцифер желтого (LYF) в базолатеральный отдел. TEER выражали как процент исходного значения и LYF экспрессировали в нг/см2xч. Альфа3’-GL представляет собой Gal (альфа 1-3)-Gal (бета 1-4)-Glc; бета3’-GL представляет собой Gal (бета 1-3)-Gal (бета 1-4)-Glc; бета4’-GL представляет собой Gal (бета 1-4)-Gal (бета 1-4)-Glc; бета6’-GL представляет собой Gal (бета 1-6)-Gal (бета 1-4)-Glc. Данные представлены как среднее±s.e. *: p < 0,05 по сравнению с контролем, **: p < 0,01 по сравнению с контролем, ***: p < 0,001 по сравнению с контролем, ^: p < 0,05 по сравнению с DON контролем, ^^ p< 0,01 по сравнению с DON контролем, ^^^ p< 0,001 по сравнению с DON контролем.
Как может быть видно из фиг. 1A-D, присутствие DON нарушало барьерную функцию, как показано сниженным значением TEER и увеличенным током LY для образцов DON-контроля. Кроме того, присутствие DON увеличивало высвобождение CXCL8 (IL-8), как показано на фиг. 2. На фиг. 1A-D дополнительно показано, что присутствие бета3’-GL предотвращало DON-индуцированную потерю целостности эпителиального барьера, что измеряли по увеличенным значениям TEER и уменьшению DON-пораженного тока LY через монослой кишечного эпителия. Бета4’-GL и бета6’-GL не показали значительного эффекта на барьерную функцию кишечного эпителия. Интересно, бета3’-GL, т.е.галактозиллактоза с β1-3 гликозидной связью, была эффективной в защите барьерной функции кишечника, тогда как альфа3’-GL, т.е. галактозиллактоза с α1-3 гликозидной связью не предотвращала DON-индуцированного нарушенного кишечного барьера. Наоборот, все галактозиллактозы были способны снижать DON-индуцированное высвобождение IL-8, как показано на фиг. 2.
Такие результаты являются показательными для специфического эффекта бета3’-GL (здесь также называемого как бета1,3’-галактозиллактоза или Gal (бета 1-3)-Gal (бета 1-4)-Glc) на защиту барьерной функции кишечного эпителия, в частности в условиях воздействий, которые происходят за пределами и/или являются независимыми от эффекта предотвращения воспалительного ответа, и/или эффекта на или посредством микробиоты. Такие результаты следовательно являются показательными для эффекта, что бета3’-GL увеличивают функцию кишечного барьера и/или профилактику и/или лечение нарушения кишечного барьера. Кроме того, полученные результаты являются показателями эффекта бета3’-GL на лечение, профилактику и/или облегчение состояния, ассоциированного с токсическим воздействием у субъекта, в частности, когда токсином является токсин трикотецен и точнее, когда токсином является деоксиниваленол.
Пример 3: Также в смесях галакто-олигосахаридов бета3’-GL специфически защищает против нарушения кишечного барьера и предотвращает увеличение проницаемости
Несколько препаратов GOS, включающих различные количества бета3’-GL, тестировали в этом эксперименте.
В качестве источника бета4’-GL и бета6’-GL использовали VivinalGOS (VGOS). VivinalGOS доступен от FrieslandCampina Domo (Amersfoort, The Netherlands) и содержит около 59% GOS в сухом веществе. DP3 такого GOS является главным образом 4’GL и 6’G.
Другой препарат GOS, называемый здесь как TOS, получали на месте посредством инкубации смеси лактозы со штаммом Streptococcus thermophilus ST065 (такой штамм также называют, как штамм S. thermophilus CNCM I-1620), как описано более подробно в WO 96/06924, FR2723960 и EP0778885, и в LeForestier et. al., 2009 Eur J Nutr, 48:457-464, с дополнительной стадией, что материал обломков клеток S. thermophilus удаляли центрифугированием. Полученный TOS использовали в качестве источника бета4’-GL, бета6’-GL и бета3’-GL. Количество галакто-олигосахаридов (за исключением лактозы, галактозы и глюкозы) составило 10,2 масс% на 100 мл, из которых около 60-65 масс% (62 масс%) было бета3’-GL, остаток был 6’-GL и неперевариваемые олигосахариды с DP 2, 4 и 5 (см. также WO 96/06924, FR2723960 и EP0778885 и LeForestier et. al., 2009 Eur J Nutr, 48:457-464).
Эксперименты барьерной функции проводили таким же образом, как в примере 2, с использованием следующих концентраций Vivinal GOS (VGOS): 0 (Контроль), 0,25 масс% (VGOS 0,25), 0,5 масс% (VGOS 0,5), 0,75 масс% (VGOS 0,75), 1 масс% (VGOS 1), 1,5 масс% (VGOS 1,5) и 2 масс% (VGOS 2). Для концентраций TOS тестировали 0,25 масс% (TOS 0,25) и 0,5 масс% (TOS 0,5). Результаты показаны в таблицах 2 и 3.
Эффекты различных смесей GOS на DON-индуцированные нарушения целостности монослоя клеток Caco-2 оценивали. Различные GL тестировали в отношении трансэпителиального электрического сопротивления (TEER), как показано в таблице 2, и для транслокации люцифер желтого (LYF) к базолатеральному отделу, как показано в таблице 3. TEER выражали, как процент исходного значения и LYF выражали в нг/см2xч. GOS представляет собой VivinalGOS. TOS представляет собой смесь галакто-олигосахаридов, полученную посредством S. thermophilus ST065 бета галактозидазы и содержащей около 65 масс% бета3’-GL на основании всех галакто-олигосахаридов. Данные в таблицах 2 и 3 представляют собой среднее±s.e.
*: p < 0,05 по сравнению с контролем,
**: p < 0,01 по сравнению с контролем;
***: p < 0,001 по сравнению с контролем;
^: p < 0,05 по сравнению с DON контролем;
^^ p< 0,01 по сравнению с DON контролем;
^^^ p< 0,001 по сравнению с DON контролем.
Таблица 2. Трансэпителиальное электрическое сопротивление (TEER) для различных смесей GOS, где TEER выражают как процент от исходного значения.
0,25
0,5
0,75
1
1,5
2
0,25
0,5
***
***
***
***
***
***
^^
^^^^
^^
Таблица 3. Транслокация люцифер желтого (LYF) к базолатеральному отделу для различных смесей GOS, где LYF выражают в нг/см2xч.
0,25
0,5
0,75
1
1,5
2
0,25
0,5
***
^ ***
***
***
** ^^
^^^
^^^
^^^
^^^
VGOS только улучшали барьерную функцию, что определяли по предотвращению снижения TEER в относительно высокой концентрации 2 масс%. Также ток LY только предотвращался относительно высокими концентрациями VGOS 1 масс% или выше. TOS, с другой стороны, были уже эффективными в концентрации 0,25 масс%. Так как главным различием между VGOS и TOS является присутствие GOS с бета1.3’ связью между доменами галактозы в TOS, и точнее присутствие высокого количества бета3’-GL в TOS, что снова является показательным для эффекта бета3’-GL на барьерную функцию кишечника и этот эффект сохраняется в присутствии других структур GOS. Также такой эффект наблюдали с бета3’-GL концентрациями ниже, чем около 0,17 масс%.
Пример 4: LC-PUFA с продуктами ферментации короткоцепочечных жирных кислот улучшают барьерную функцию кишечника
Эффект длинноцепочечных полиненасыщенных жирных кислот (LC-PUFA) и смеси короткоцепочечных жирных кислот (смесь SCFA), имеющих профиль концентрации, который является типичным для ферментации смеси галакто-олигосахаридов (TOS), полученных от VivinalGOS, и длинноцепочечных фрукто-олигосахаридов (RaftilineHP) в соотношении 9/1 (масс/масс) на проницаемость барьера, как описано в примере 3 EP2100520 (включенном в виде ссылки в настоящее описание). Смесь SCFA имеет профиль жирных кислот, как показано на фиг. 3A EP2100520 (включенном в виде ссылки в настоящее описание) (см. второй столбик на фиг. 3A), т.е. около 75% уксусной кислоты.
Способы
Человеческие клетки эпителия кишечника T84 обычно использовали для исследования целостности кишечного барьера in vitro. Клетки T84 (ATCC, USA) культивировали на 12 мм трансвелл-вставках (0,4 мкм, Corning Costrar, USA) в DMEM-F12 глютамакс с пенициллин стрептомицином (100 МЕ/мл), дополненной 5% FBS-HI. Клетки T84 использовали через 14 дней после достижения слияния. Монослои T84, культивируемые на трансвелл-фильтрах, предварительно инкубировали с LC-PUFA, смесью SCFA или их комбинацией. EPA-содержание образцы инкубировали в течение дополнительных 48 ч в присутствии IL-4 (25 нг/мл). IL-4 добавляли к базолатеральному отделу; среду и добавки меняли каждые 24 ч.
Целостность эпителиального барьера оценивали посредством измерения трансэпителиального сопротивления (TEER; Ώ x см2) с эпителиальным вольтметром (EVOM; World Precision Instruments, Germany). Измерения TEER проводили до обновления среды при 0, 24, 48, 72, 96 ч инкубации.
Результаты показаны в таблице 4.
Таблица 4. Эффект LC-PUFA на функцию кишечного барьера
(C2-C4 жирные кислоты)
Среднее (s.d.)
Этот пример демонстрирует улучшенный эффект LC-PUFA на барьерную функцию кишечника и, в частности, в комбинации с продуктами ферментации. Следовательно, такой пример является показательным для дополнительно улучшенного эффекта на функцию кишечного барьера в композиции, когда комбинация бета3’-GL, увеличивает уровни LC-PUFA (EPA, DHA и ARA) и продукты ферментации GOS. Бета3’-GL и LC-PUFA будут иметь прямой эффект на барьерную функцию кишечника, тогда как дополнительные неперевариваемые олигосахариды, в частности GOS, иные чем бета3’GL, будут благоприятно влиять на барьерную функцию кишечника посредством образования SCFA.
Пример 5: Молочная смесь 1-го уровня
Молочная смесь 1-го уровня, представленная в виде порошка в упаковке с инструкциями для восстановления водой до готовой к употреблению молочной смеси. При восстановлении смесь содержит на 100 мл:
- 68 ккал
- около 1,4 г белка (главным образом белок сыворотки и казеин коровы)
- около 3,2 г липидов, где количество DHA составляет 0,52 масс%, EPA составляет 0,11 масс% и ARA составляет 0,52 масс% на основании всех жирных кислот
- около 8,1 г перевариваемых углеводов (главным образом лактоза)
- от около 815 до 830 мг неперевариваемых олигосахаридов, включающих от 735 до 750 мг галакто-олигосахаридов, из которых от 15 до 30 мг бета3’-GL (источники Vivinal GOS и GOS продуцируемые бетагалактозидазой от S. thermophilus CNCM-I-1620) и около 80 мг lcFOS (источник RaftilinHP)
- минералы, микроэлементы и другие микронутриенты, как известно в области техники, и в соответствии с международными руководствами для молочных смесей 1-го уровня.
Пример 6: Молочная смесь 2-го уровня
Молочная смесь 2го уровня, представленная в виде порошка в упаковке с инструкциями для восстановления водой до готовой к употреблению смеси. При восстановлении смесь содержит на 100 мл:
- 68 ккал
- около 1,4 г белка (главным образом белок сыворотки и казеин коровы)
- около 3,2 г липидов, где количество DHA составляет 0,52 масс%, EPA составляет 0,11 масс% и ARA составляет 0,52 масс% на основании всех жирных кислот
- около 8,1 г перевариваемых углеводов (главным образом лактоза)
- около 720 мг галакто-олигосахаридов, из которых около 140 мг бета3’-GL, (500 мг от Vivinal GOS и 220 мг от GOS продуцируемый бетагалактозидазой от S. thermophilus CNCM-I-1620, соответственно) и около 80 мг lcFOS (источник RaftilinHP)
- минералы, микроэлементы, витамины и другие микронутриенты, как известно в области техники и в соответствии с международными руководствами для молочных смесей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ 2'ФУКОЗИЛЛАКТОЗУ И 3'ГАЛАКТОЗИЛЛАКТОЗУ | 2020 |
|
RU2818570C2 |
| ПИЩЕВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ 2’-ФУКОЗИЛЛАКТОЗУ И ПИЩЕВОЙ БУТИРАТ | 2020 |
|
RU2820217C2 |
| СМЕСЬ, СОДЕРЖАЩАЯ ГАЛАКТОМАННАНОВУЮ КАМЕДЬ И НЕУСВАИВАЕМЫЕ ОЛИГОСАХАРИДЫ | 2021 |
|
RU2830980C1 |
| ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ ПОВЫШЕНИЯ ЦЕЛОСТНОСТИ КИШЕЧНОГО БАРЬЕРА, ПОЛУЧЕНИЕ КОМПОЗИЦИИ И СПОСОБ ЛЕЧЕНИЯ | 2018 |
|
RU2788854C2 |
| ПИТАТЕЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ СОДЕЙСТВИЯ ЗДОРОВОМУ РАЗВИТИЮ И РОСТУ | 2009 |
|
RU2508121C2 |
| НЕПЕРЕВАРИВАЕМЫЕ ОЛИГОСАХАРИДЫ ДЛЯ СНИЖЕНИЯ ТОЛСТОКИШЕЧНОЙ ФЕРМЕНТАЦИИ БЕЛКА | 2020 |
|
RU2816647C2 |
| УЛУЧШЕНИЕ ЦЕЛОСТНОСТИ ИНТЕСТИНАЛЬНОГО БАРЬЕРА | 2004 |
|
RU2402240C2 |
| СПОСОБЫ СОХРАНЕНИЯ ЭНДОГЕННОГО TGF-БЕТА | 2009 |
|
RU2547590C2 |
| ДЕТСКОЕ ПИТАНИЕ ДЛЯ УЛУЧШЕНИЯ СОСТАВА ЖИРНЫХ КИСЛОТ В МЕМБРАНАХ КЛЕТОК МОЗГА | 2011 |
|
RU2692627C2 |
| ДЕТСКОЕ ПИТАНИЕ ДЛЯ УЛУЧШЕНИЯ СОСТАВА ЖИРНЫХ КИСЛОТ В МЕМБРАНАХ КЛЕТОК МОЗГА | 2011 |
|
RU2692920C2 |
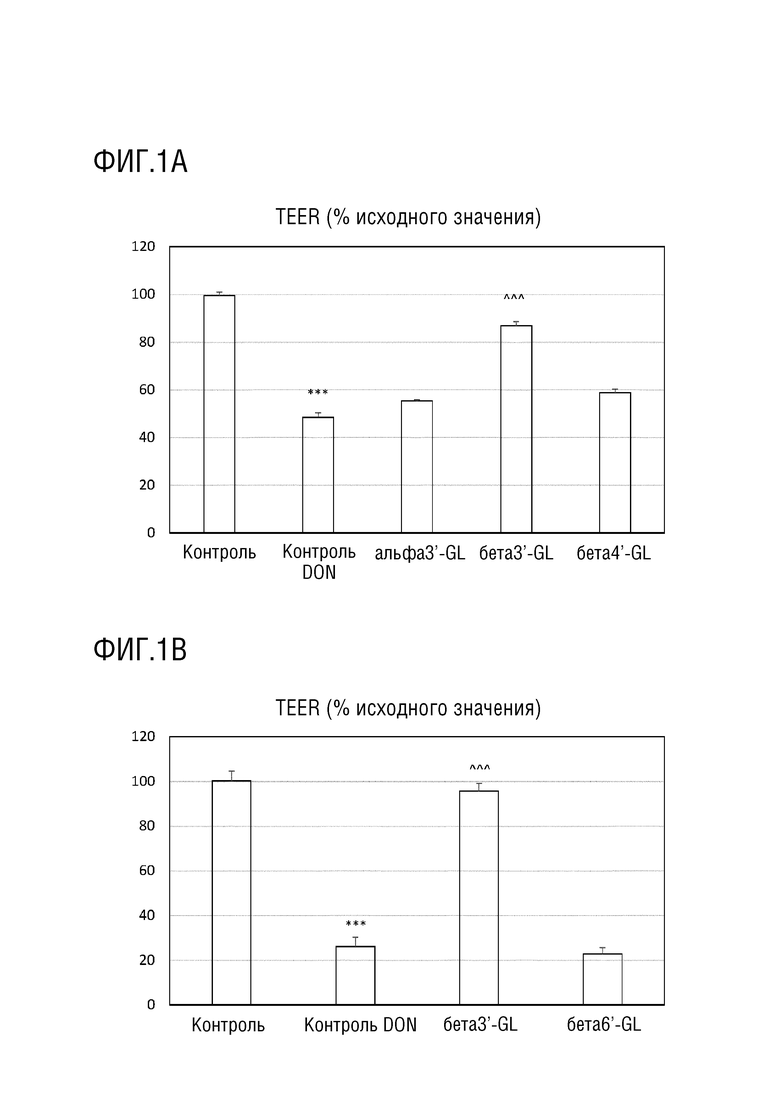
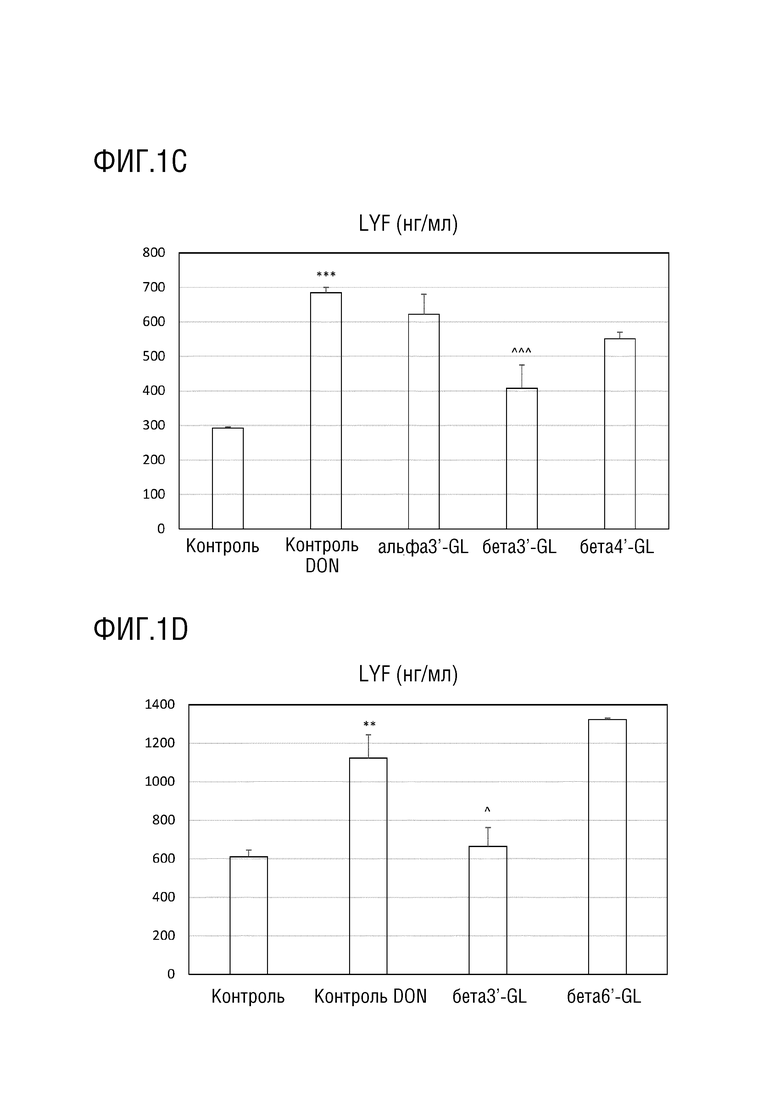
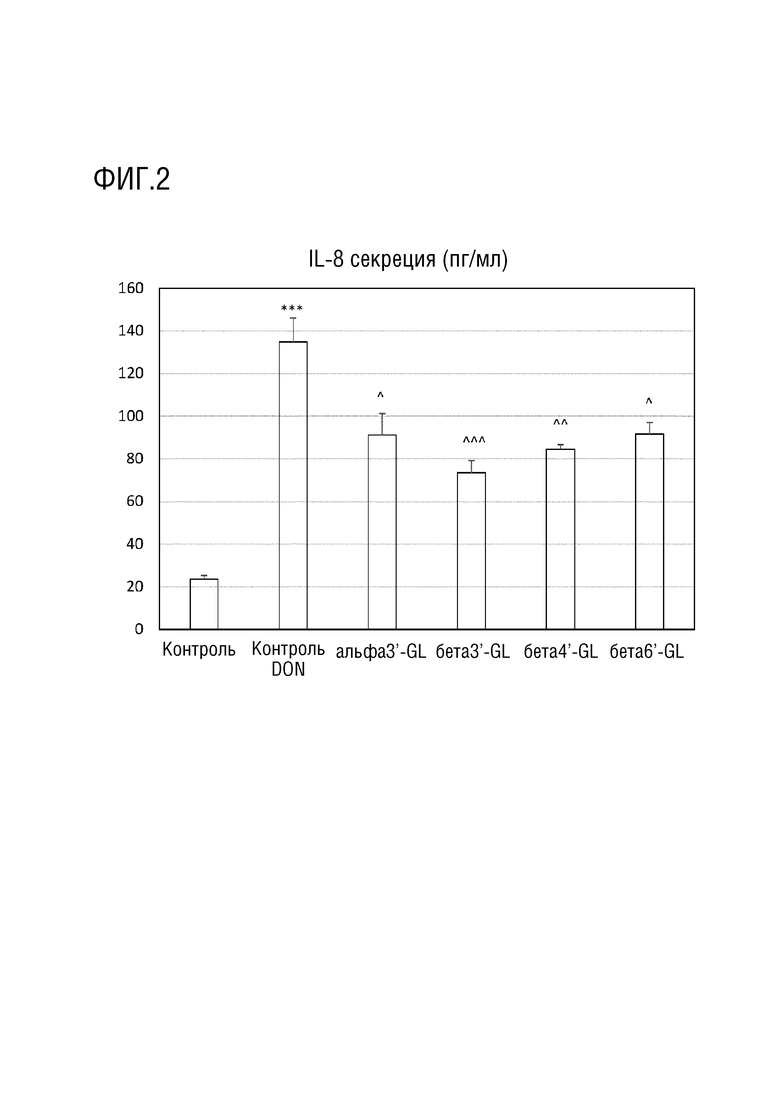
Изобретение относится к применению трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc для получения питательной композиции для увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушений кишечного барьера у субъекта, а также для получения питательной композиции для лечения, профилактики и/или облегчения состояния, ассоциированного с токсическим воздействием у субъекта. Также раскрывается молочная смесь 1-го уровня, 2-го уровня и 3-го уровня, включающая: a. 1,6-4 г белка на основании 100 ккал, b. 5-20 г перевариваемых углеводов 100 ккал, c. 3-7 г липидов на основании 100 ккал, где липиды включают: i. LC-PUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс.% на основании всех жирных кислот и/или по меньшей мере 0,1 масс.% EPA на основании всех жирных кислот и по меньшей мере 0,5 масс.% DHA на основании всех жирных кислот, d. 0,25-2,5 г неперевариваемых олигосахаридов на 100 мл готовой к употреблению молочной смеси, где неперевариваемые олигосахариды включают Gal (бета 1-3)-Gal (бета 1-4)-Glc в количестве от 10 до 500 мг на 100 мл готовой к употреблению смеси. 3 н. и 18 з.п. ф-лы, 2 ил., 4 табл., 6 пр.
1. Применение трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc для получения питательной композиции для увеличения барьерной функции кишечника и/или для профилактики и/или лечения нарушений кишечного барьера у субъекта.
2. Применение трисахарида Gal (бета 1-3)-Gal (бета 1-4)-Glc для получения питательной композиции для лечения, профилактики и/или облегчения состояния, ассоциированного с токсическим воздействием у субъекта.
3. Применение по п. 2, где состоянием, ассоциированным с токсическим воздействием, является опосредованное токсином нарушение кишечного барьера.
4. Применение по любому из предшествующих пунктов, где субъектом является младенец или маленький ребенок в возрасте от 0 до 36 месяцев.
5. Применение по любому из предшествующих пунктов, где субъект страдает от или имеет повышенный риск страдания от пищевой аллергии и/или атопического дерматита.
6. Применение по любому из предшествующих пунктов, где питательная композиция является молочной смесью 1-го уровня, молочной смесью 2-го уровня или молочной смесью 3-го уровня.
7. Применение по любому из предшествующих пунктов, где питательная композиция включает от 0,07 до 3,75 масс.% Gal (бета 1-3)-Gal (бета 1-4)-Glc, на основании сухой массы питательной композиции.
8. Применение по любому из пп. 2-6, где питательная композиция включает от 10 до 500 мг Gal (бета 1-3)-Gal (бета 1-4)-Glc на 100 мл композиции.
9. Применение по любому из предшествующих пунктов, где суточная доза Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет 0,10-6 г.
10. Применение по любому из предшествующих пунктов, где питательная композиция включает от 1,6 до 4 г белка, 5-20 г перевариваемых углеводов и от 0,35 до 3,7 г галакто-олигосахаридов на 100 ккал композиции, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет более чем 20 масс.% на основании всех галакто-олигосахаридов.
11. Применение по любому из предшествующих пунктов, где питательная композиция включает Gal (бета 1-3)-Gal (бета 1-4)-Glc в количестве от 150 мг до 250 мг на 100 мл.
12. Применение по любому из пп. 1-9, где питательная композиция включает от 1,6 до 4 г белка, от 5 до 20 г перевариваемых углеводов и от 0,35 до 3,7 г галакто-олигосахаридов на 100 ккал композиции, где количество Gal (бета 1-3)-Gal (бета 1-4)-Glc составляет от 10 мг до 50 мг на 100 мл.
13. Применение по любому из предшествующих пунктов, где питательная композиция дополнительно включает перевариваемые углеводы, белки и липиды, и где липиды включают LC-PUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, где предпочтительно сумма DHA, ARA и EPA составляет по меньшей мере 1 масс.% на основании всех жирных кислот.
14. Молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3-го уровня, включающая:
a. 1,6-4 г белка на основании 100 ккал,
b. 5-20 г перевариваемых углеводов 100 ккал,
c. 3-7 г липидов на основании 100 ккал, где липиды включают:
i. LC-PUFA, выбираемые из группы, состоящей из DHA, EPA и ARA, где сумма DHA, ARA и EPA составляет по меньшей мере 1 масс.% на основании всех жирных кислот и/или по меньшей мере 0,1 масс.% EPA на основании всех жирных кислот и по меньшей мере 0,5 масс.% DHA на основании всех жирных кислот,
d. 0,25-2,5 г неперевариваемых олигосахаридов на 100 мл готовой к употреблению молочной смеси, где неперевариваемые олигосахариды включают Gal (бета 1-3)-Gal (бета 1-4)-Glc в количестве от 10 до 500 мг на 100 мл готовой к употреблению смеси.
15. Молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3го уровня по п. 14, где смесь включает по меньшей мере 0,25 масс.% ARA на основании всех жирных кислот.
16. Молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3-го уровня по п. 14 или 15, где смесь включает от 0,25-2,5 г галакто-олигосахаридов на 100 мл, предпочтительно 0,4-1,5 г на 100 мл, более предпочтительно 0,6-1,0 г на 100 мл.
17. Молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3-го уровня по п. 14-16, где смесь включает 0,025-0,25 г фрукто-олигосахаридов на 100 мл, предпочтительно 0,04-0,15 г на 100 мл, более предпочтительно 0,06-0,1 г на 100 мл.
18. Молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3-го уровня по пп. 14-17, где молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3-го уровня находится в форме порошка, подходящего для восстановления водой, для обеспечения готовой к употреблению молочной смеси 1-го уровня, молочной смеси 2-го уровня или молочной смеси 3-го уровня.
19. Молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3-го уровня по пп. 14-18, для применения в обеспечении питания младенца или маленького ребенка, предпочтительно младенца.
20. Молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3-го уровня по любому из пп. 14-19, для применения в увеличении барьерной функции кишечника и/или для применения в профилактике и/или лечении нарушений кишечного барьера у субъекта; или для применения в лечении, профилактике и/или облегчении состояния, ассоциированного с токсическим воздействием, у субъекта, где токсином предпочтительно является микотоксин, более предпочтительно токсин трикотецен, наиболее предпочтительно деоксиниваленол.
21. Молочная смесь 1-го уровня, молочная смесь 2-го уровня, или молочная смесь 3-го уровня по любому из пп. 14-20, где смесь представляет собой молочную смесь 1-го уровня или молочную смесь 2-го уровня.
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОБРАБОТКИ ЗВУКОВОГО СИГНАЛА | 2007 |
|
RU2404507C2 |
| DAVID S | |||
| NEWBURG | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| THE JOURNAL OF NUTRITION, 23.12.2015, vol | |||
| Приспособление, увеличивающее число оборотов движущихся колес паровоза | 1919 |
|
SU146A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO 2010023422 A1, | |||
Авторы
Даты
2024-05-07—Публикация
2020-05-15—Подача