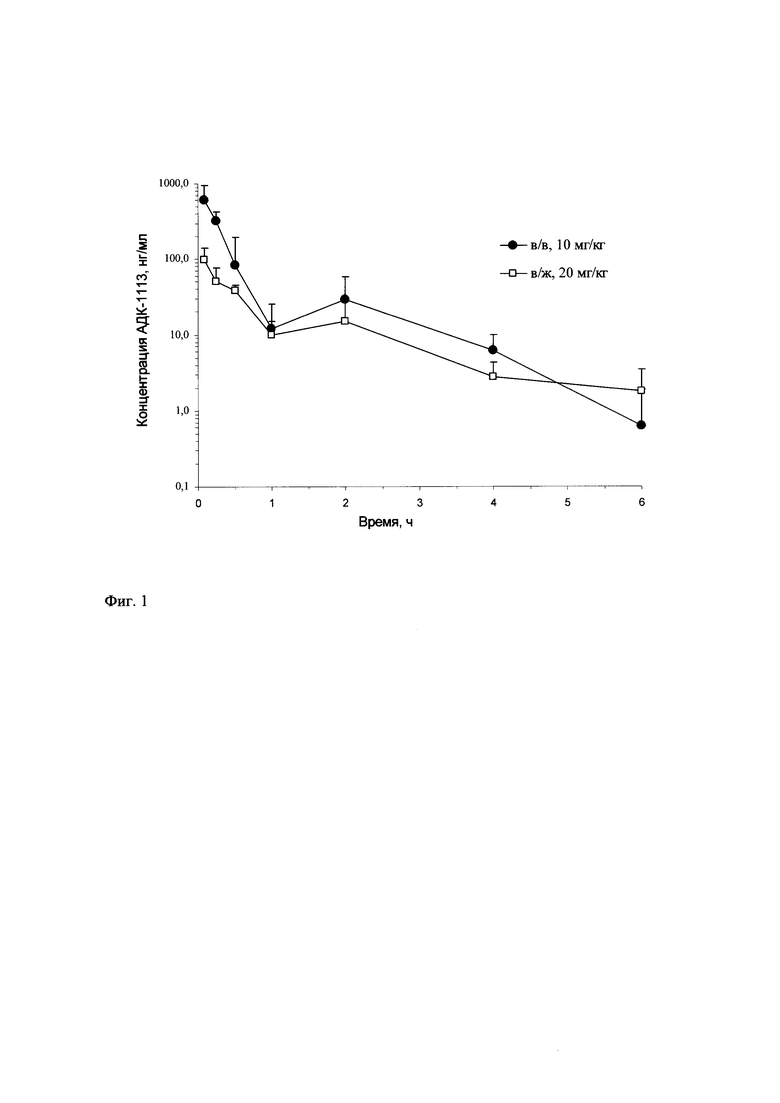
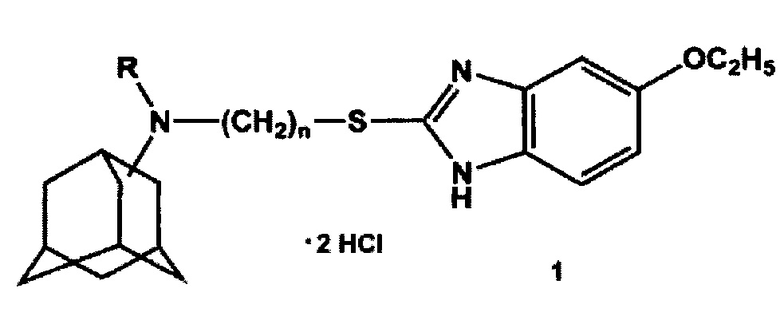
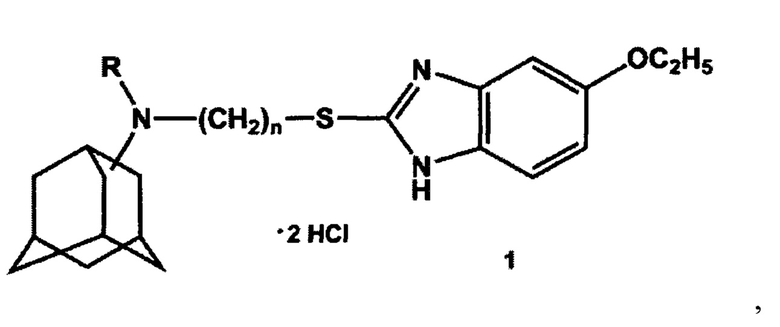
Изобретение относится к области химии и медицины, конкретно к новой группе адамантильных производных бензимидазола, а именно к дигидрохлоридам N-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)алкил)адамантиламина общей формулы 1:
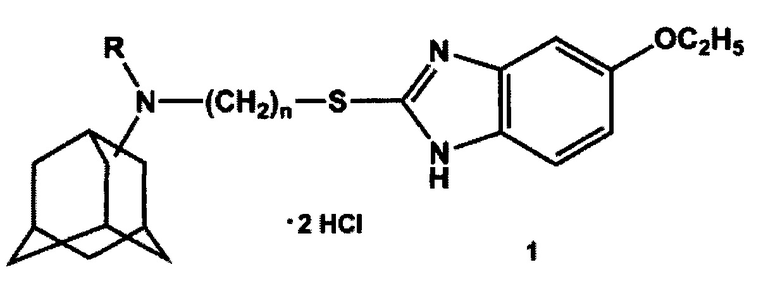
где n может иметь значения 2 или 3, R - Н или СН3.
Заявляемые соединения обладают антипаркинсонической активностью.
Создание и внедрение в клиническую практику новых высокоэффективных лекарственных средств, обладающих антипаркинсонической активностью, сочетающих нейропротекторные, дофаминпозитивные свойства, снижающие экстрапирамидную симптоматику, является одной из наиболее приоритетных задач, стоящих перед современной медициной.
Болезнь Паркинсона (БП) или идиопатический паркинсонизм - это сложное прогрессирующее нейродегенеративное заболевание, являющееся наиболее частым вариантом паркинсонических расстройств (паркинсонического синдрома). Патологически БП определяется потерей дофаминергических нейронов в компактной части черной субстанции, нарушением функции базальных ганглиев и появлением телец Леви, представляющих собой цитоплазматические включения с нерастворимыми агрегатами альфа-синуклеина, а молекулярными механизмами нейродегенерации являются оксидативный стресс и нейровоспаление и митохондриальные дисфункции, включающие нарушение энергетического обмена в виде дефицита комплекса I дыхательной цепи митохондрий, редукцию синтеза АТФ, повышение продукции свободных радикалов, мутации митохондриальной ДНК и нарушение репаративных митохондриальных путей [S.R. Subramaniam, et al. Prog. Neurobiol. 2013; №106-107: 17-32]. Кроме того БП характеризуется более распространенной патологией в других областях мозга и вовлекает также недофаминергические нейроны. Клинический диагноз БП основан в первую очередь на моторных признаках, таких как медленно прогрессирующий ассиметричный тремор в состоянии покоя, ригидность и брадикинезия, а также немоторные признаки, которые могут развиться за годы до появления моторного дефицита и включают аносмию, запор, депрессию, расстройство сна, когнитивные расстройства, включающие нарушение внимания, памяти, исполнительных и зрительно-пространственных функций и др.
Заболеваемость БП колеблется от 5/100 000 до 35/100 000 и более новых случаев в год и возрастает в 5-10 раз в период с 60 по 90 лет жизни; ожидается, что по мере старения населения во всем мире распространенность БП резко возрастет, удвоившись в ближайшие два десятилетия [D.K. Simon et al. Clin Geriatr Med. 2020; 36(1): 1-12]. Одновременно с увеличение заболеваемости БП растет социальное и экономическое бремя, что определяет необходимость поиска более эффективных методов лечения или средств профилактики.
Важную роль в патогенезе БП играет возрастающая, вследствие гибели дофаминергических нейронов и дегенарации дофаминергических путей активность глутаматергической системы, активирующей NMDA и He-NMDA-рецепторы и оказывающей эксайтотоксический эффект. Антагонисты глутаматергических NMDA-рецепторов (амантадин, мидантан) применяются в клинике для терапии БП, и эффективны в условиях экспериментальных моделей паркинсонического синдрома (ПС).
Известен Амантадин (1-Аминоадамантана гидрохлорид), изначально использовавшийся для профилактики гриппа типа А как противовирусный препарат, который у пациентов с БП значительно уменьшал гипокинезию, скованность и тремор [А.А. Пилипович и др. Медицинский совет.2016; №11: 52-6]. Амантадин оказывает комплексное влияние на несколько основных медиаторных систем мозга: стимулирует выделение дофамина из пресинаптических окончаний, стимулирует синтез и снижает обратный захват дофамина, блокирует глутаматные рецепторы NMDA (N-метил-Баспартатного) типа, оказывает мягкое антихолинергическое действие (за счет блокады высвобождения ацетилхолина, опосредованного NMDA-рецепторами) и др. Для терапии БП, кроме дофаминергических свойств, особый интерес представляет способность амантадина блокировать NMDA-рецепторы, что клинически реализуется в модуляции моторных осложений леводопотерапии и в нейропротективном эффекте препарата, который связан с подавлением глутаматной эксайтотоксичности. Так, в клеточных культурах в дофаминергических нейронах черной субстанции, обработанных нейротоксином 1-метил-4- фенил-1,2,3,6-тетрагидропиридином (МФТП), антагонисты глутамата оказывали нейропротективный эффект [А.А. Пилипович и др., 2016]. Однако существенными недостатками Амантадина является недостаточная эффективность и широта действия, а также наличие существенных побочных эффектов со стороны нервной и сердечно-сосудистой систем.
Известен Гимантан (N-(2-адамантил)-гексаметиленимина гидрохлорид) - разработанный в НИИ фармакологии имени В.В. Закусова оригинальный отечественный препарат из группы производных 2-аминоадамантана, обладающий высокой активностью и широким спектром антипаркинсонических эффектов [патенты №1825499, №2423981, №2520758, №2559777]. Гимантан проявляет противопаркинсоническую активность как на экспериментальных моделях [А.В. Непоклонов и др. Эксп.и клин. фарм. 2012; 75(11): 3-6; Е.А. Иванова и др. Бюл. Эксп.биол. и мед. 2015; 159(3): 362-5], так и в клинических исследованиях у пациентов с начальными стадиями болезни Паркинсона [Е.А. Катунина и др. Журн. невролог, и психиатр, имени С.С. Корсакова. 2008; 108(6): 24-7]. Показано, что соединение обладает дофаминпозитивным действием, имеет свойства низкоаффинного неконкурентного блокатора ионного канала глутаматных рецепторов NMDA подтипа, обратимого ингибитора моноаминооксидазы МАО-В, проявляет умеренную антирадикальную и иммунотропную активность [Вальдман Е.А. Автореферат дис. д.м.н. Москва, 2001. 44 с.]. Доказаны преимущества Гимантана по сравнению с рядом имеющихся противопаркинсонических препаратов. На модели МФТП-индуцированного ПС активность Гимантана проявлялась в меньших дозах по сравнению с мидантаном (амантадина сульфат), на модели нейролептической каталепсии - была сопоставима с эффектами L-ДОФА и циклодола и превосходила мидантан, а на моделях тремора, вызванного оксотреморином и ареколином, Гимантан, в противоположность мидантану, устранял дрожательные проявления, не уступая по выраженности эффекта циклодолу [Е.А. Вальдман, 2001]. Показана способность Гимантана уменьшать леводопа-индуцированные дискенизии [И.Г. Капица и др. Эксп. и клин. фарм. 2014; 77(5): 3-5].
В качестве одной из потенциальных мишеней средств патогенетической терапии БП рассматриваются сигма1R-шапероны, способные регулировать внутриклеточные сигнальные каскады, функции митохондрий, транспорт липидов, эндогенные защитные механизмы, обеспечивающие выживание клеток, модулировать синаптическую передачу, оказывающие опосредованное влиянии на дофаминовую, серотониновую и холинергическую системы. Методом позитронно-эмиссионной томографии у пациентов с БП показано снижение плотности сигма1R-шаперонов в областях мозга наиболее затронутых процессом нейродегенерации с превалированием в переднем отделе скорлупы стриатума. Примечательно, что уменьшение плотности молекул белка дофаминового транспортера DAT также наиболее ярко проявлялось в переднем отделе скорлупы [Д.А. Абаимов и др. Нейрохимия. 2011; 28(2): 93-103].
В НИИ фармакологии имени В.В. Закусова создан мультитаргетный препарат фабомотизол (Афобазол) - производное 2-меркапто-бензимидазола: 5-этокси 2-[2-(морфолино) этилтио]-бензимидазол, - агонист сигма1R-шаперона, ингибитор регуляторного сайта хинонредуктазы-2, обратимый и селективный ингибитор МАО-А, агонист мелатониновых рецепторов 1 типа, ассоциированных с G-белками [M.V. Voronin et al. Experim. and clinic. Pharmacology. 2021; 84(2): 15-22]. Препарат обладает нейропротекторной активностью, механизм которой связан со снижением глутаматной токсичности и оксидантного стресса [Т.А. Зенина и др. Бюл. экспер. биол. и мед. 2005; 40(8): 161-3], и проявивший антипаркинсоническую активность на моделях ПС [И.Г. Капица и др. Эксп. и клин. фарм. 2015; 78(S): 29; И.Г. Капица и др. Эксп.и клин. фарм. 2017; №6: 3-7]. Показана способность фабомотизола предупреждать и уменьшать двигательные экстрапирамидные нарушения, вызванные нейролептиками (нейролептический паркинсонизм) [патент №2421222].
Задачей изобретения является создание эффективного лекарственного средства, обладающего спектром фармакологической активности, необходимой для профилактики и лечения паркинсонизма. Технический результат изобретения - получение эффективного лекарственного средства для терапии паркинсонизма, расширение арсенала терапевтических средств, обладающих антипаркинсонической активностью и способных уменьшать выраженность коморбидных состояний и побочных эффектов Леводопы.
С учетом высокой фармакологической активности производных адамантана и бензимидазола (в частности, фабоматизола) поставленная задача решалась получением адамантильных производных бензомидазола по нижеприведенной схеме.
Синтез целевых дигидрохлоридов М-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)алкил)адамантиламинов общей формулы 1 осуществлялся по следующей схеме:
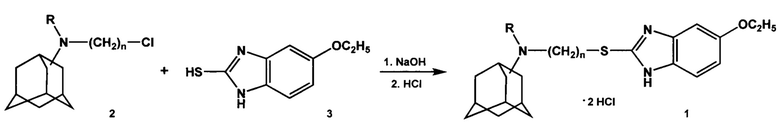
Адамантиламиноалкилхлориды общей формулы 2 вводили во взаимодействие с 5-этокси-2-меркаптобензимидазолом 3 путем нагревания в щелочной среде в водно-спиртовых растворах. Основания соединений 1 очищали при помощи экстракции хлороформом. Гидрохлориды 1 получали при взаимодействии соответствующих оснований с соляной кислотой в ацетоне с последующей перекристаллизацией продуктов из этанола. Выходы конечных веществ 1 составляли 44-64%. Они представляли собой высокоплавкие водорастворимые белые порошки. Строение веществ общей формулы 1 подтверждено данными спектров ЯМР 1Н.
Учитывали следующие физико-химические характеристики полученных веществ: температуры плавления определяли на столике Кофлера без корректировки; спектры 1Н-ЯМР регистрировали в шкале δ, м. д. на спектрометре Bruker FOURIER 300 HD (Bruker Corporation, Leipzig, Germany, 300 МГц) в растворах DMSO-d6, внутренний стандарт тетраметилсилан (0 м.д.). Константа спин-спинового взаимодействия J, Гц. Для обозначения резонансных сигналов использовали следующие сокращения: с - синглет, д -дублет, т - триплет, м - мультиплет. Тонкослойную хроматографию (ТСХ) выполняли на алюминиевых силикагелевых пластинах DC-Kieselgel 60 G/F254 (Merck, Германия) с обнаружением в УФ-свете и парах иода.
Общая методика синтеза дигидрохлоридов N-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)алкил)адамантиламинов
К раствору 1,88 г гидроксида натрия и 3,88 г (20 ммоль) 5-этокси-2-меркаптобензимидазола в 50 мл этанола и 8 мл воды последовательно прибавляют 22 ммоль адамантиламиноалкилхлорида и 5 мл воды. Реакционную смесь кипятят в течение 4-13 часов, контролируя ход протекания реакции при помощи тонкослойной хроматографии, после чего ее упаривают досуха. К остатку прибавляют 60 мл воды, и продукт экстрагируют 4 раза по 50 мл хлороформа. Объединенный хлороформенный раствор промывают 2 раза по 20 мл воды, сушат над сульфатом натрия и активированным углем и упаривают досуха. Остаток растворяют в 50 мл сухого ацетона, и к раствору прибавляют соляную кислоту до рН 2-3. Полученную смесь оставляют на ночь при +4°С. Выпавший осадок отфильтровывают, промывают ацетоном и растворяют при нагревании в этаноле. Раствор кипятят с активированным углем, уголь отфильтровывают, и фильтрат оставляют на ночь при +4°С. Выпавший осадок отфильтровывают и сушат, получая целевой дигидрохлорид N-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)алкил)адамантиламина.
Ниже представлены примеры, демонстрирующие способы получения соединений АДК-1111, АДК-1112 и АДК-1113 и их фармакологические свойства.
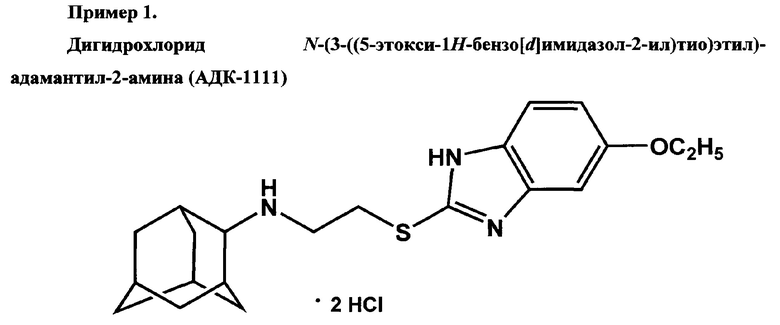
Получен из N-(2-хлороэтил)адамантил-2-амина. Время кипячения реакционной смеси - 5 часов. Выход - 64%. Белый порошок. Т.пл. 205,5-207,5°С.Спектр ЯМР 1Н (DMSO, δ, м.д., J/Гц): 1.36 (т, 3 Н, СН3, J3=6.6); 1.48-1.90 (м, 10 Н, 5 CH2(Ad)); 2.20 (м, 4 Н, 4 CH(Ad)); 3.40 (м, 3 Н, NHCH и SCH2); 3.90 (м, 2 Н, NHCH2); 4.07 (кв, 2 Н, 2 СН2СН3, H3=6.6); 7.02 (д, 1 Н, ArH(4), J3=8.8); 7.10 (с, 1 Н, АrН(6)); 7.54 (д, 1 Н, ArH(3), J3=8.8); 9.37 (уш.с, 2 Н, 2 NH).
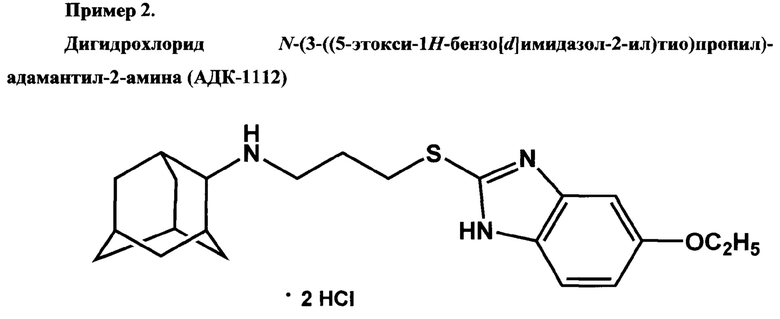
Получен из N-(3-хлорпропил)адамантил-2-амина. Время кипячения реакционной смеси - 13 часов. Выход - 44%. Белый порошок. Т.пл. 214-216°С.Спектр ЯМР 1Н (DMSO, δ, м.д., J/Гц): 1.35 (т, 3 Н, СН3, J3=6.8); 1.48-1.90 (м, 10 Н, 5 CH2(Ad)); 2.09-2.30 (м, 6 Н, 4 CH(Ad) и CH2CH2CH2); 3.11 (м, 2 Н, SCH2); 3.29 (м, 1 Н, NHCH); 3.63 (м, 2 Н, NHCH2); 4.07 (кв, 2 Н, 2 СН2СН3, J3=6.8); 7.02 (д, 1 Н, ArH(4), J3=8.8); 7.12 (с, 1 Н, АrН(6)); 7.55 (д, 1 Н, АrН(3), J3=8.8); 8.97 (уш.с, 2 Н, 2 NH).
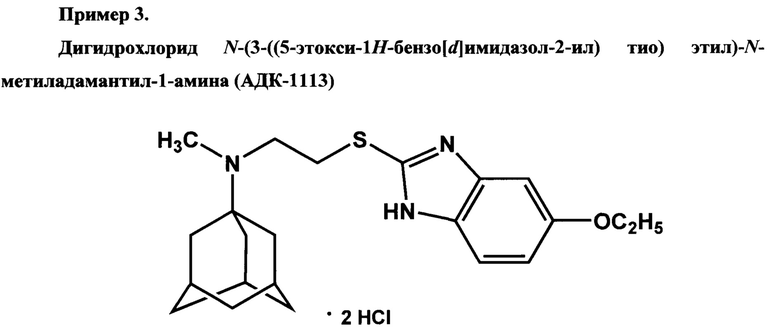
Получен из N-(2-хлороэтил)-Nг-метиладамантил-1-амина. Время кипячения реакционной смеси - 4 часа. Выход - 56%. Белый порошок. Т.пл. 212-215°С.Спектр ЯМР 1Н (DMSO, δ, м.д., J/Гц): 1.35 (т, 3 Н, СН2СН3, J3=6.9); 1.61 (м, 6 Н, 3 CH2(Ad)); 1.98 (м, 6 Н, 3 C'H2(Ad)); 2.14 (м, 4 Н, 4 CH(Ad)); 2.80 (с, 3 Н, NCH3); 3.30-3.98 (уш. м, 4 Н, CH2CH2); 4.07 (кв, 2 Н, 2 CH2СН3, J3=6.9); 7.02 (д, 1 Н, ArH(4), J3=8.8); 7.11 (с, 1 Н, АrН(6)); 7.55 (д, 1 Н, ArH(3), J3=8.8); 10.7 (уш.с, 1 Н, NH).
Экспериментальные исследования in vivo
Экспериментальные исследования выполнены на самцах аутбредных белых мышах массой 26-30 г, самцах мышей инбредной линии С57 В1/6 массой 24-27 г, и самцах мышей линии BALB/c, рандомизированно распределенных по группам по 6-10 особей. Животных получали из филиала «Столбовая» ФГБУН «Научный центр биомедицинских технологий ФМБА» (Московская область). Мышей содержали в стандартных условиях вивария при свободном доступе к корму и воде при 12-часовом световом режиме в соответствии с ГОСТ 33216-2014 и 33215-2014. Эксперименты проводили в соответствии с международными правилами: Директивой 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 года по охране животных, используемых в научных целях, и с одобрения Комиссии по биомедицинской этике ФГБНУ «НИИ фармакологии имени В.В. Закусова».
Исследование антипаркинсонической активности соединений проводили в соответствии с методическими рекомендациям [Т.А. Воронина и др. В кн. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К, 2012. С.219-34], и согласно приведенным в научной литературе тестам, приемлемым для оценки нарушений на фоне ПС.
Изучение антикаталептогенного действия новых соединений было проведено на белых аутбредных мышах в тесте антагонизма с галоперидолом (Гедеон Рихтер АО, Венгрия), вызывающим экстрапирамидные нарушения. Галоперидол, производное бутирофенона, является типичным нейролептиком, механизм действия которого связан с блокадой дофаминовых рецепторов, центральным альфа-адреноблокирующим действием и нарушением процесса обратного нейронального захвата и депонирования адреналина. Наиболее частым побочным эффектом галоперидола являются экстрапирамидные расстройства.
Каталепсию у мышей вызывали внутрибрюшинным (в/б) введением галоперидола в дозе 1 мг/кг через 10 минут после введения изучаемых соединений или физиологического раствора и оценивали по способности животного находиться в позе «лектора». Установка для теста представляет собой горизонтальный стержень диаметром 0,5 см, закрепленный на высоте 4 см у которого помещали мышь таким образом, чтобы оно опиралось на обе передние лапки (поза «лектора»). Число попыток придать животному нужную позу не превышало 5-и, а общая продолжительность наблюдения составляла 2-е мин. Продолжительность каталепсии - нахождение мышей в позе лектора - измеряли через 1,5-3 часа после введения галоперидола. Антагонизм с галоперидолом оценивали по способности исследуемых соединений уменьшать длительность каталептогенного состояния у животных.
Моделирование ПС проводили у мышей линии C57BL/6 однократным введением нейротоксина 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП) (Sigma-Aldrich Company) в дозе 30 мг/кг в/б, вызывающего избирательное повреждение дофаминовых нейронов.
Оценка экстрапирамидных нарушений у мышей с ПС проводилась с использованием теста оценки ригидности и тестов, применяемых для оценки проявлений олигокинезии и моторного дефицита: «Вертикальный стержень», «Открытое поле», «Двигательная активность в актометре».
Оценку ригидности проводили через 10-12 минут после введения МФТП по изменению длины шага у мышей (Stride Length Test) [J.L. Tillerson et al. J Neurosci Methods. 2003; 123(2): 189-200]. Каждое животное с предварительно окрашенными нетоксичными красками лапами помещали на маркировочную ленту, выстилающую пенал (высота стенок 8 см, ширина 8 см, длина 50 см). Измеряли расстояние (по прямой) между следами лапок в 4-6 шагах мыши. Шаги в начале и в конце аллеи не учитывали.
Через 90 минут после введения нейротоксина проводили тест «Вертикальный стержень» [К. Matsuura et al. J Neurosci Methods. 1997; 73 (1): 45-8], который является одним из хорошо воспроизводимых методов для оценки экстрапирамидных нарушений у грызунов с ПС. Установка представляет собой металлический стержень высотой 50 см и диаметром 1 см, обернутый по всей длине бинтом, с пробковым окончанием на вершине диаметром 1,5 см, закрепленным на вершине стержня. Стержень, жестко закрепленный в тяжелом металлическом основании, удерживающем его в вертикальном положении, помещают в «домашнюю» клетку с опилками. Мышь помещают на верхушку вертикального стержня носом вверх и регистрируют в течение 120 секунд латентное время, необходимое животному для ориентирования: поворота в направлении спуска (t-поворота), и продолжительность спуска в клетку (t-спуска).
Через 110 минут после введения нейротоксина оценивали выраженность олигокинезии по изменению двигательной активности в актометре «Орго Varimex» (Columbus Instruments, USA), представляющего собой квадратную арену со стороной 39 см и высотой 20 см, с располагающимися по периметру регистрирующими передвижения животных фотоэлементами. Учитывали среднюю величину перемещений за 1 минуту в пересчете на одно животное для каждой группы (общее время наблюдения 3 минуты).
Через 24 часа после введения МФТП проводили стимулирование каталепсии введением галоперидола в малой дозе 0,1 мг/кг в/б, не вызывающей развития каталептогенного состояния у интактных животных (не получавших нейротоксин).
АДК-1111, АДК-1112 и АДК-1113 вводили в дозах 5 и/или 10, и/или 20 мг/кг; гимантан - 10 или 20 мг/кг в/б или перорально внутрижелудочно (в/ж). Контрольные животные получали физиологический раствор или дистиллированную воду в/б или в/ж в эквивалентном объеме (0,1 мл на 10 г веса).
С целью выявления возможного влияния АДК-1113 на дофаминергическую систему проводили эксперименты с использованием неселективного агониста дофаминовых рецепторов апоморфина (2,5 мг/кг п/к) и антагониста дофаминовых рецепторов галоперидола (1 и 0,05 мг/кг). Исследование проводили на белых беспородных мышах в тестах «Галоперидоловая каталепсия», «Апоморфиновая вертикализация», а также с предшественником дофамина Леводопой (L-ДОФА) (100 и 500 мг/кг в/б) регистрируя поведения мышей в тесте «Открытое поле».
Тест «Апоморфиновой вертикализации» выполняли согласно методическим указаниям по изучению нейролептической активности лекарственных средств [Р.У. Островская и др. В кн. Руководство по проведению доклинических исследований лекарственных средств. Ч.1., Глава 16, М.: Гриф и К, 2012. С. 251-63]. Тест проводили на мышах линии С57 В1/6. Животных, сразу после введения апоморфина (2 мг/кг/однократно подкожно), помещали в цилиндрические стандартные камеры с плексиглазовым дном, высотой 14 см и диаметром 12 см, изготовленные из проволочного прутка толщиной 2 мм и расстоянием между прутьями 1 см. Через 10 минут после введения апоморфина начинали регистрацию стереотипного поведения, которую проводили каждые 2 минуты на протяжении 1 часа. Фиксировали число лап животного на прутьях (интенсивность вертикализации). В условиях теста оценивали влияние соединения АДК-1113 (5, 20 мг/кг/однократно, в/б) влиять на феномен вертикалиации, а также его способность потенциировать действие апоморфина или галоперидола у мышей С57 В1/6.
Предшественник дофамина Леводопа (L-ДОФА) в дозе 500 мг/кг в/б и выше вызывает возбуждение, изменение двигательной активности, гипертермию, а также стереотипию и другие двигательные и вегетативные нарушения [Н.И. Андреева. В кн. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под общ. ред. Р.У., Хабриева. М.: ОАО «Изд. «Медицина», 2005. с. 246].
Способность соединений потенцировать действие L-ДОФА изучается при их предварительном введении до L-ДОФА в дозе 100-200 мг/кг и появлении эффектов, характерных для больших доз L-ДОФА. Влияние соединения АДК-1113 в дозе 10 мг/кг/однократно/в/б, которое вводили за 35-40 минут до инъекции L-ДОФА (100 мг/кг/однократно в/б) в сравнении с эффектом L-ДОФА (500 мг/кг/однократно в/б) оценивали по поведению мышей С57 В1/6 в тесте «Открытое поле» при 3-х последовательных посадках через 35-40 минут, 2 и 3 часа после инъекции L-ДОФА.
Установка «Открытое поле» (ООО «НПК Открытая наука»), представляет собой круглую арену диаметром 63 см с бортиком высотой 32 см, пол которой расчерчен на 19 секторов примерно одинаковой площади, располагающихся в 3 ряда и имеющих 13 круглых отверстий по 1 см в диаметре. Регистрировали горизонтальную и вертикальную двигательную активности животных, число обследованных отверстий и эпизоды груминга за 3 мин наблюдения. Дополнительно в течение всего времени наблюдения у мышей регистрировали подергивания, тремор головы или тела, потряхивания головой, ротации, ригидность и пилоэрекцию, присваивая по 1 баллу за каждое вышеуказанное проявление.
Антидепрессивное действие АДК-1113 (10 мг/кг/однократно в/б) исследовали в тесте «Подвешивание за хвост» [L. Stem et al. Psychopharmacology. (Berl). 1985; 85(3): 367-70]. Данный тест является моделью поведения отчаяния, основанной на том, что кратковременный неизбегаемый стресс провоцирует иммобильность у животных. Мышей подвешивают за хвост с помощью широкой клейкой ленты на расстоянии 40 см от пола. Длительность иммобильности (состояние, при котором животные висят без каких-либо движений) регистрировали в течение 6 минут.
Для оценки влияния соединения АДК-1113 на сигма1R-шаперон использовали анализатор - антагонист сигма1R BD-1047 (5 мг/кг/однократно в/б). Эксперимент проводили на мышах С57 В1/6, руководствуясь тем, что антидепрессивный эффект агонистов сигма1R-шаперона может зависеть от содержания прогестерона, который является их эндогенным лигандом, а у мышей данной линии уровень прогестерона в 2 раза ниже, чем у аутбредных мышей [V.-L. Phan et al. Eur J Neurosci. 2002; 15(9): 1523-34].
Оценку анксиолитической активности соединения АДК-1113 проводили в условиях теста «Приподнятый крестообразный лабиринт» (ПКЛ). Тест ПКЛ (установка TS0502-M3, ООО «НПК Открытая Наука», Россия) представляет собой приподнятый над полом на высоту 30 см крестообразный лабиринт с чередующимися двумя открытыми (светлыми без стенок) и двумя закрытыми (темными) рукавами шириной 5 см и длиной 30 см и квадратной центральной площадкой 5×5 см, соединяющей рукава. Животных помещают в ярко освещенный центральный отсек лабиринта головой к открытому рукаву и в течение 5 минут регистрируют время, проведенное на центральной площадке, в светлых и темных рукавах и число заходов в них. Контрольные интактные животные предпочитают большую часть времени проводить в закрытых, темных рукавах. Тревожность животного оценивали по снижению числа заходов в светлые рукава и времени нахождения в них, без увеличения общего числа заходов. Время нахождения на центральной площадке позволяет оценить показатель принятия решения. По общему числу заходов в открытые и закрытые рукава можно оценить общую двигательную активность.
Статистическую обработку проводили с использованием пакета Statistica 10.0. Нормальность распределения проверяли с помощью критерия Шапиро-Уилка, равенство дисперсий оценивали с помощью критерия Левена. В случае нормального распределения в группе и равенства дисперсий между группами применяли t-критерий (Стьюдента). В обратном случае использовали непараметрический критерий Манна-Уитни. Данные представлены как среднее±стандартная ошибка среднего - Mean±SEM, значимость различий отмечена при р<0,05.
Пример 4.
Изучение влияния новых адамантильных производных бензимидазола АДК-1111, АДК-1112 и АДК-1113 на выраженность галоперидоловой каталепсии у белых аутбредных мышей
Галоперидол (1 мг/кг в/б) вызывал развитие каталептогенного состояния у мышей (табл. 1). Соединения АДК-1111, АДК-1112 и АДК-1113 при их внутрибрюшинном введении в дозе 20 мг/кг незначимо уменьшали выраженность каталепсии у аутбредных мышей на 9%, 13,2% и 23,9%, соответственно (табл.1).

Уменьшение дозы изучаемых соединений вызывало снижение каталептогенного состояния у мышей на фоне введения новых соединений. Так, через 1 час после введения галоперидола (1 мг/кг в/б) в группе мышей, получавшей АДК-1113 в дозе 5 мг/кг, длительность каталепсии была на 31,5% меньше, а через 2 часа - на 36,5% по сравнению с группой «Галоперидол». В группах, которым вводили АДК-1111 в дозах 5 и 10 мг/кг, также отмечалось значимое снижение каталептогенного состояния, но только через 2 часа после введения галоперидола (табл. 2). Отмеченная активность соединений превышала таковую на фоне гимантана (10 мг/кг в/б).

Пример 5.
Изучение влияния новых адамантильных производных бензимидазола АДК-1111; АДК-1112; АДК-1113 при их внутрибрюшинном введении на модели МФТП-вызванного ПС у мышей линии C57BL/6
Соединения АДК-1111, АДК-1112 и АДК-1113 вводили однократно в/б за 35-40 мин до МФТП. Однократное системное введение МФТП в дозе 30 мг/кг приводило к появлению выраженной ригидности мышц, что проявлялось уже через 10-12 минут после введения нейротоксина в уменьшении длины шага у мышей С57 В1/6 на 22,8% по сравнению с группой «Контроль». На фоне введения АДК-1111 и АДК-1113 в дозе 20 мг/кг отмечалось снижение выраженности ригидности мышц, что выражалось в достоверном увеличении длины шага мышей по сравнению с группой «МФТП» (табл. 3).
Мыши линии С57 В1/6 через 90 минут после введения МФТП демонстрировали снижение точной координации движений в тесте «Вертикальный стержень». Так, животным группы «МФТП» было значительно труднее осуществить разворот на 180° на узком набалшнике на верхушке стержня и требовалось в 4,9 раза (р<0,05) больше времени для спуска по стержню в домашнюю клетку (табл. 3). АДК-1111 и АДК-1112 корригировали вызванное МФТП нарушение координации и моторики движений: время поворота мышей головой вниз для спуска в клетку было в 7,1 и 4,3 раз, а время спуска - в 2,9 и 2,3 раз значимо меньше, соответственно, чем у животных группы «МФТП»; АДК-1113 уменьшил время выполнения соответствующих задач теста в 2,2 и 1,5 раз, но только в виде тенденции.
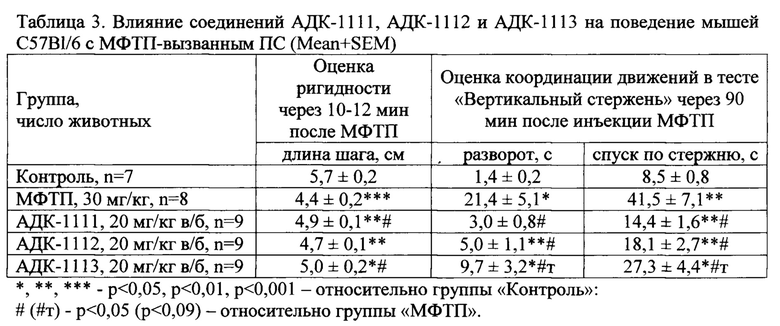
Через 24 часа после инъекции МФТП проводили стимуляцию каталептогенного состояния у животных с ПС введением малой дозой галоперидола (0,1 мг/кг). Выявлено значимое увеличение длительности каталептогенного состояния у мышей группы «МФТП». АДК-1111, АДК-1112 и АДК-1113 уменьшили выраженность каталепсии у мышей с ПС в 2,4, 2,7 и 1,9 раз, соответственно, относительно группы «МФТП» (табл. 4).

Таким образом, проведенное исследование выявило наличие антипаркинсонической активности у АДК-1111, АДК-1112 и АДК-1113 при их однократном в/б введении в дозе 20 мг/кг на модели ПС, вызванного однократным системным введением нейротоксина МФТП.
Пример 6.
Изучение влияния новых адамантильных производных бензимидазола АДК-1111; АДК-1112; АДК-1113 при их пероральном введении на модели МФТП-вызванного ПС у мышей линии C57BL/6
Изучение антипаркинсонической активности новых соединений при их пероральном введении (внутрижелудочно (в/ж), при помощи специального зонда) в дозе 20 мг/кг в течение 3 последовательных дней (ежедневно, последняя инъекция - за 1 час до однократного введения МФТП) проводилась на мышах линии C57BL/6.
Однократное введение МФТП в дозе 30 мг/кг мышам С57Вl/6 приводило к выраженному нарушению координации движений в тесте «Вертикальный стержень», что выразилось в увеличение продолжительности их разворота и спуска в 6,5 и 2,3 раз, соответственно, по сравнению с группой «Контроль». АДК-1111 и АДК-1112 не оказали влияния на координацию движений мышей с ПС, а на фоне АДК-1113 отмечалось уменьшение продолжительности разворота, что выразилось в отсутствии различий с показателями группы «Контроль», и в 2,3 раза более быстром спуске по стержню по сравнению с группой «МФТП» (табл. 5).
Оценка олигокинезии в актометре у мышей с ПС через 90-110 мин после введения МФТП выявила снижение регистрируемых параметров в группе «МФТП» по сравнению с контрольной группой. Новые соединения не оказали влияния на олигокинезию, однако двигательная активность у мышей с ПС, получавших АДК-1113, была в 1,3 раза больше чем в группе «МФТП» (табл. 5).

Введение галоперидола в малой дозе (0,1 мг/кг в/б) стимулировало проявление каталептогенного состояния у мышей с ПС, вызванным предварительным (за сутки) введением МФТП. В группах мышей с ПС, получавших перорально АДК-1111 и АДК-1112 в дозе 20 мг/кг в/ж выраженность каталепсии по сравнению с группой «МФТП» не уменьшалась. АДК-1113 оказал выраженное антикаталептогенное действие, уменьшив продолжительность удержания мышей в неудобной позе как через 1,5, так и через 3 часа после введения галоперидола по сравнению с группой «МФТП» (табл. 6).

Изучение антипаркинсонической активности нового адамантильного производного бензимидазола АДК-1113 на модели МФТП-вызванного ПС у мышей линии C57BL/6
Оценка антипаркинсонической активности соединения АДК-1113 проводилась на модели ПС, вызванного МФТП, в сравнении с гимантаном с использованием тестов оценки степени экстрапирамидных нарушений: «Шаговый тест», «Вертикальный стержень», оценка олигокинезии в актометре в течение 5 дней после введения нейротоксина.
Оценка экстрапирамидных нарушений, вызванных МФТП (30 мг/кг однократно в/б), выявила выраженную ригидность мышц у мышей С57В1/6, которая проявлялась уже через 10-12 мин после инъекции нейротоксина в уменьшении длины шага на 37% по сравнению с группой «Контроль». В группах мышей с ПС, получавших АДК-1113, в дозах 5, 10 и 20 мг/кг, отмечалось увеличение длины шага на 17,1% и 14,8%, 27,2% соответственно, по сравнению с показателем группы «МФТП». Гимантан в дозе 20 мг/кг уменьшал проявления ригидности на 15,5% по сравнению с группой «МФТП» (табл. 7). Различий между соединениями по влиянию на уменьшение ригидности не отмечалось.
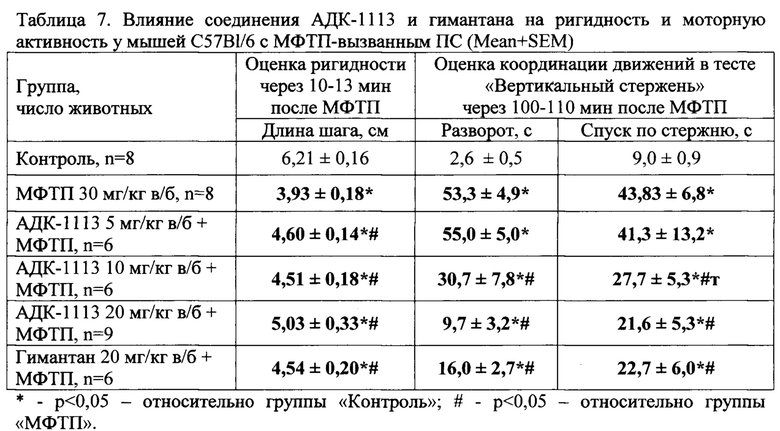
В тесте «Вертикальный стержень» мыши группы «МФТП» демонстрировали выраженное нарушение координации движений, что выразилось в увеличении длительности разворота и спуска в клетку по сравнению с группой «Контроль». АДК-1113 в дозе 10 и 20 мг/кг уменьшал проявления олигокинезии, вызванной МФТП, что выражалось в уменьшении длительности разворота в 1,7 и 5,5 раз и в увеличении скорости спуска по стержню в 1,6 и 2 раз, соответственно, по сравнению с группой «МФТП» (табл. 7). Показатели животных с ПС, получавших гимантан, в тесте «Вертикальный стержень» превосходили соответствующие данные группы «МФТП» и были сходными с данными групп, которым вводили АДК-1113 в дозах 10 и 20 мг/кг (табл. 7).
Оценка олигокинезии у мышей с ПС через 100-110 мин после введения МФТП в актометре выявила снижение регистрируемых параметров (число горизонтальных и вертикальных перемещений) во всех группах, получавших «МФТП», по сравнению с контрольной группой (табл. 8).

Анализ поведения мышей с ПС при повторном помещении в актометр (на 3 сутки после введения МФТП) выявил рост двигательной активности до показателей группы «Контроль», регистрируемых при первой посадке в установку (число перемещений: вертикальных - 4,3±0,5 и горизонтальных - 296,5±33,2). Причем рост вертикальной активности отмечался только для опытных групп, получавших наряду с МФТП новые соединения. На 5-ый день эксперимента показатели групп, которым вводили АДК-1113 в дозах 5 и 10 мг/кг не отличались от значений в контрольной группе, а в группе «МФТП» и «Гимантан» превышали их (табл. 9).
Повышение вертикальной двигательной активности у животных с ПС, получавших АДК-1113 и гимантан, может свидетельствовать об активации ориентировочно-исследовательского поведения, заторможенного ранее введением нейротоксина, что не наблюдалось в группе «МФТП», а спад двигательной активности в группах «АДК-1113», и особенно в группе, получавшей дозу 5 мг/кг, к 5-у дню тестирования (помещение в актометр в течение трех последовательных дней), может указывать на более быстрый процесс привыкания к знакомой обстановке и снижение интереса к ней, т.е. на облегчение неассоциативного обучения, не наблюдаемое в группах «МФТП» и «Гимантан+МФТП».
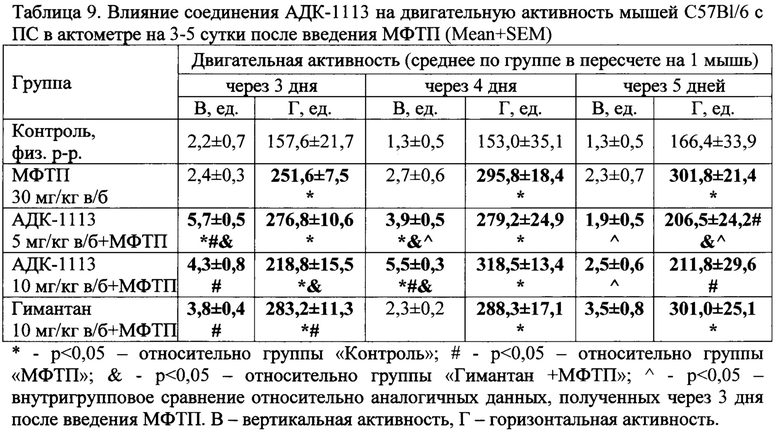
Таким образом, АДК-1113 на модели МФТП-индуцированного ПС снижает ригидность, уменьшает проявления олигокинезии, улучшает ориентировочно-исследовательское поведение и облегчает неассоциативное обучение.
Полученные на модели ПС данные о влиянии АДК-1113 на процесс габитуации подтверждаются в эксперименте, выполненном на интактных самцах аутбредных мышей. Мышей тестировали в актометре через 35-40 минут после инъекции АДК-1113 в дозе 20 мг/кг (однократно в/б) в течение 16 минут с поминутной регистрацией двигательной активности. Для нивелирования реакций на руку экспериментатора и посадку в незнакомую установку 1-я и 2-я минуты теста не учитывались.
Как следует из результатов, представленных в таблице 10, уровень двигательной активности у мышей группы «АДК-1113» за все время наблюдения (3-16 мин) не отличался от контрольного. Однако при анализе начального и конечного интервалов теста (по 7 мин) выявлено, что животные группы «АДК-1113» совершали в 1,5 раза значимо меньше двигательных актов по сравнению с контрольными животными (10-16 минуты теста), и также, при внутригрупповом сравнении, демонстрировали достоверное снижение на 57% числа горизонтальных перемещений на последних 7-и минутах относительно первых (табл. 10), тогда как в группе «Контроль» это снижение составляло 26,5%. Полученные данные свидетельствуют о способности АДК-1113 улучшать адаптивные процессы, оказывая положительное влияние на неассоциативное обучение.

Таким образом, полученные данные об активности соединения АДК-1113 при его внутрибрюшинном и интрагастральном введении в дозах 5-20 мг/кг в тесте галоперидоловой каталепсии и на модели МФТП-вызванного ПС, свидетельствуют о наличии у соединения АДК-1113 выраженной антипаркинсонической активности, что определяет перспективность его разработки в качестве антипаркинсонического средства.
Пример 8.
Изучение роли дофаминергической системы и сигмаШ-шаперонов в реализации антипаркинсонических эффектов соединения АДК-1113
Влияние АДК-1113 на дофаминергическую систему исследовали в тестах «Апоморфиновая вертикализация» и «Открытое поле» при комбинированном введении с L-ДОФА, а также ранее в тесте «Галоперидоловая каталепсия», который дополнен в данном примере.
Соединение АДК-1113 снижало каталептогенное состояние у аутбредных мышей. Так, через 1 час после введения антагониста дофаминовых рецепторов галоперидола у мышей группы, получавшей АДК-1113 в дозе 20 мг/кг в/б, продолжительность каталепсии была на 42% меньше чем в группе «Галоперидол»; через 2 часа отмеченный эффект наблюдался на фоне соединения во всех изученных дозах в пределах от 32% до 42% (табл. 11).
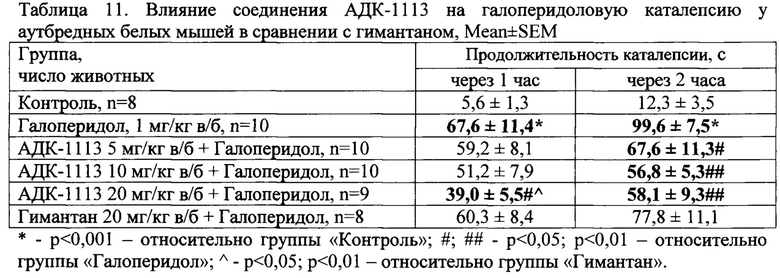
Таким образом, соединение АДК-1113 проявило выраженную активность в дозах 5-20 мг/кг в тесте галоперидоловой каталепсии, превосходя эффекты гимантана.
При взаимодействии с неселективным агонистом дофаминовых рецепторов апоморфином (2,5 мг/кг п/к) и антагонистом дофаминовых рецепторов галоперидолом (0,5 мг/кг) в тесте «Апоморфиновая вертикализация» показано, что АДК-1113 (10 мг/кг) не уменьшал феномен верикализации, вызванный апоморфином, но усиливал действие галоперидола в дозе 0,05 мг/кг при совместном с ним введении (табл.12).

Способность АДК-1113 оказывать влияние на дофаминергическую систему также оценивали в тесте взаимодействия с предшественником дофамина L-ДОФА при его введении в дозе 100 мг/кг в/б в сравнении с L-ДОФА в дозе 500 мг/кг в/б по изменению двигательной активности и появлению стереотипии и других неврологических нарушений в тесте «Отрытое поле».
На фоне введения L-ДОФА в дозе 500 мг/кг уже через 35-40 минут отмечалось значимое снижение двигательной активности и ориентировочно-исследовательского поведения в тесте «Открытое поле», а также появление у 100% мышей группы подергиваний, тремора головы или всего тела, ротаций, ригидности, пилоэрекции, потряхивания головой, которые сохранялись на протяжении всех 3 часов наблюдения (табл. 13).
Через 35-40 минут после введения L-ДОФА в дозе 100 мг/кг мышам, которые предварительно за 30-40 минут получали АДК-1113 в дозе 10 мг/кг, отмечали значимое снижение двигательной активности и ориентировочно-исследовательского поведения в тесте «Открытое поле», аналогичные изменениям в группе мышей, получавших L-ДОФА в дозе 500 мг/кг (табл.13). Совместное применение АДК-1113 с L-ДОФА приводило к появлению у 1/4 мышей группы тремора, подрагивания и потряхивания головой, уступавшие по представленности симптомов группе «L-ДОФА 500» в 3,3 раза (табл. 13).
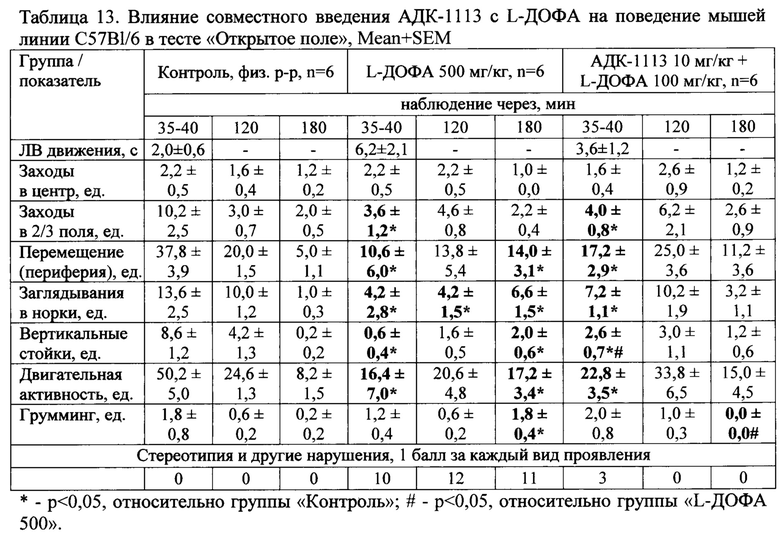
Отмеченные изменения двигательной активности, ориентировочно-исследовательского поведения и побочные проявления на фоне введения L-ДОФА в дозе 100 мг/кг мышам, предварительно получавших АДК-1113, регистрировались только при первом наблюдении (через 35-40 минут после введения L-ДОФА) и нивелировались в дальнейшем (наблюдение через 2 и 3 часа), не отличаясь от данных группы «Контроль» (табл. 13).
Таким образом, АДК-1113 кратковременно стимулировал действие L-ДОФА в малой дозе (100 мг/кг), что выразилось в воспроизведении эффекта (изменение двигательной активности), аналогичного действию L-ДОФА в дозе 500 мг/кг, но значительно уменьшал степень стереотипных и других неврологических нарушений в этот период.
Изучение способности АДК-1113 взаимодействовать с сигма1-рецепторами проводили в тесте «Подвешивание за хвост» при комбинированном введении с антагонистом сигма1-рецепторов BD-1047 (5 мг/кг в/б).
АДК-1113 в дозе 10 мг/кг в/б уменьшал иммобильность мышей в тесте «Подвешивание за хвост» на 23% за все время наблюдения (6 минут), и на 35% и 16,5%, соответственно при разбивке времени тестирования на первые и вторые 3-х минутные интервалы по сравнению с группой «Контроль» (табл. 14).
Совместное введение АДК-1113 с BD-1047 отменяло выявленный антидепрессивный эффект АДК-1113, что свидетельствует о влиянии соединения на сигма1-рецепторы.
Антагонист сигма1-рецепторов BD-1047 не уменьшал длительность иммобильности у мышей линии С57 В1/6 в тесте «подвешивание за хвост» по сравнению с показателями группы «Контроль» и при комбинированном применении блокировал проявление антидепрессивного эффекта соединения АДК-1113 (табл. 14).

Таким образом, проведенное исследование выявило наличие антипаркинсонической активности у адамантильных производных бензимидазола. Так, соединения АДК-1113 и АДК-1111 в дозах 5 и 10 мг/кг в/б снижали продолжительность каталептогенного состояния у аутбредных мышей, вызванного галоперидолом, превышая эффекты гимантана (10 мг/кг в/б). На модели ПС, вызванного однократным системным введением нейротоксина МФТП, новые адамантильные производные бензимидазола в дозе 20 мг/кг в/б уменьшали ригидность мышц (АДК-1111 и АДК-1113) и корригировали вызванное МФТП нарушение координации и моторики движений (АДК-1111, АДК-1112 и АДК-1113); а при трехкратном в/ж введении в дозе 20 мг/кг позитивное действие соединений отмечалось только на фоне АДК-1113 в виде уменьшения выраженности олигокинезии и каталепсии, при ее стимуляции малой дозой галоперидола.
Установлено, что АДК-1113 на модели МФТП-индуцированного ПС в дозах 5-20 мг/кг в/б снижает ригидность, в дозах 10-20 мг/кг уменьшает проявления олигокинезии, и также в дозах 5-10 мг/кг улучшает ориентировочно-исследовательское поведение и адаптивные процессы, облегчая неассоциативное обучение. Причем, эффекты АДК-1113 в дозе 10 мг/кг на данной модели были сходными с эффектами гимантана в дозе 20 мг/кг.
Соединение АДК-1113 в дозах 5, 10 и 20 мг/кг в/б обладает дофаминпозитивным действием, что выражается в уменьшении длительности галоперидоловой каталепсии, что было более эффективно, чем под действием гимантана; усилении нейролептической активности галоперидола в тесте «Апоморфиновой вертикализации», без влияния на феномен веритикализации; кратковременном потенцировании действия L-ДОФА в дозе 100 мг/кг, что выражалось в изменении двигательной активности, подобно изменениям, вызываемым L-ДОФА в большой дозе (500 мг/кг), сопряженное с уменьшением развития стереотипии и других побочных эффектов, характерных для большой дозы L-ДОФА.
АДК-1113 в дозе 10 мг/кг в/б мышам С57 В1/6 оказывает антидепрессивное действие, которое блокировалось антагонистом сигма1RBD-1047, что свидетельствует об участии сигмаlR-шаперона в механизме действия соединения.
Пример 9.
Изучение анксиолитической активности нового адамантильного производного бензимидазола АДК-1113 у мышей линии BALB/c
АДК-1113 (однократно в/б) увеличил в 2,6 раза число заходов мышей BALB/c в открытые рукава и в 5,7 раза длительность нахождения (р<0,05) в них, что выразилось в значимом увеличении индекса предпочтения «тревожных» открытых рукавов перед закрытыми в сравнении с показателями группы «Контроль» (табл. 15). При этом различий в двигательной активности животных всех групп не наблюдалось.
Различий между эффектами Афобазола и АДК-1113 при их однократном введении в дозе 10 мг/кг не зарегистрировано (табл. 15).
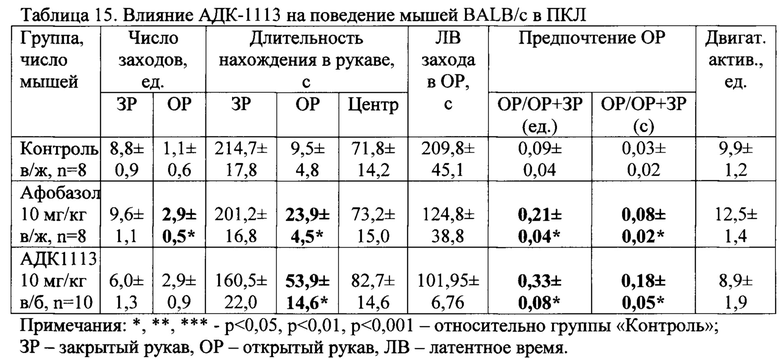
Таким образом новое соединение АДК-1113 обладает анксиолитической активностью.
Пример 10.
Изучение острой токсичности новых адамантильных производных бензимидазола АДК-1111, АДК-1112, АДК-1113 на мышах
Оценка острой токсичности соединений АДК-1111, АДК-1112, АДК-1113 и АДК-1132 проводилась при их в/б и в/ж введении на белых аутбредных мышах-самцах массой 26-28 г по гибели животных. При изучении острой токсичности соединения вводили однократно в дозах, вызывающих гибель части или всех животных в группе.
Соединения АДК-1111, АДК-1112, АДК-1113 при их в/б введении вызывали гибель животных в дозах свыше 150, 130 и 100 мг/кг, соответственно (табл. 16). LD50 (средняя летальная доза, вызывающая гибель в 50% наблюдений) для АДК-1111, АДК-1112, АДК-1113 составило 175, 150 и 142 мг/кг, соответственно. Таким образом для соединения АДК-1111 средняя летальная доза, превышала терапевтическую - 20 и 10 мг/кг,- в 8,75 и 17,5 раз; для соединения АДК-1112 - в 7,5 и 15 раз, а для АДК-1113 - в 7,1 и 14,2 раз, а для дозы 5 мг/кг - в 28,4 раза.
При оценке острой токсичности новых производных адамантана при их введении в/ж отмечалось значительное повышение пороговых доз, вызывающих гибель. Так АДК-1111 не вызывал гибели мышей в дозе 1500 мг/кг, а АДК-1112 и АДК-1113 не вызывали гибели животных в дозе 1000 мг/кг (табл. 17).
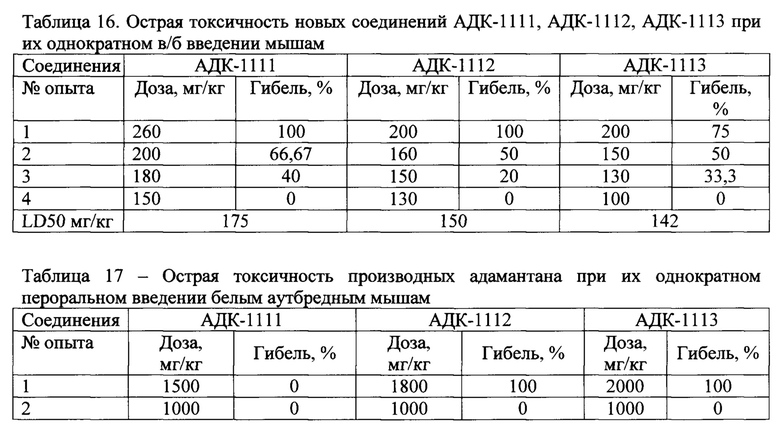
Таким образом, новые соединения относятся к 3 классу токсичности (умеренно токсичные) [И.В. Березовская. Хим.-фарм. журн. 2003; 37(3): 32-34].
Пример 11.
Изучение фармакокинетики соединения АДК-1113 после его однократного перорального или внутривенного введения мышам
Необходимым этапом разработки оригинального лекарственного средства (ЛС) является доклиническое изучение его фармакокинетики (ФК). Изучение ФК АДК-1113 после в/ж и внутривенного (в/в) введений проводили на белых аутбредных мышах-самцах с массой тела 21±2 г. Фармацевтическую субстанцию АДК-1113 вводили животным однократно в физиологическом растворе (истинный раствор) в/ж в дозе 20 мг/кг и в/в в дозе 10 мг/кг. Содержание АДК-1113 определяли в плазме крови до введения (фон) и через 0.083, 0.25, 0.5, 1, 2, 4 и 6 ч после введения. На каждый временной интервал использовали по 5 животных. Пробы крови, полученные при декапитацией мышей, центрифугировали при 13500 об/мин в течение 15 мин для отделения плазмы (антикоагулянт - 5% К2ЭДТА). Полученные образцы плазмы крови замораживали при -40°С и хранили без добавления консервантов до анализа.
Количественное определение АДК-1113 в плазме крови мышей осуществляли с помощью валидированной методики высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (масс-спектрометр - тройной квадруполь TSQ Altis, Thermo Scientific, США). Детектирование АДК-1113 проводили методом ионизации электроспрей, регистрируя положительные ионы в MRM-режиме (MRM -Multiple Reaction Monitoring - режим мониторинга множественных реакций). MRM переход целевого соединения: 386.3 → 192.2 m/z. Хроматографическое разделение осуществляли на колонке Luna С18(2), 3.0 мкм, 20×4.0 мм (Phenomenex, США) в градиентном режиме элюирования (скорость потока 1 мл/мин, общее время анализа 3.5 мин). Подвижная фаза состояла из ацетонитрила и воды, содержащих 0.1% муравьиной кислоты. В этих условиях время удерживания АДК-1113 составило 0.95±0.02 мин (Mean±SD). Для извлечения АДК-1113 из биоматериала и осаждения белков плазмы крови использовали ацетонитрил. Нижний предел количественного определения АДК-1113 в плазме крови животного составлял 2,5 нг/мл.
На основании данных «концентрация (С, нг/мл) - время (t, ч)» непараметрическим методом интегральных статистических моментов были рассчитаны следующие ФК параметры [В.И. Сергиенко и др. Прикладная фармакокинетика: основные положения и клиническое применение, Изд. РАМН. Москва, 2003; И.И. Мирошниченко. Основы фармакокинетики. ГЭОТАР-МЕД, Москва, 2002]:
AUC0→t (нгхч/мл) - площадь под ФК кривой «концентрация ЛС - время». AUC0→t рассчитывается с использованием линейно-логарифмического метода трапеций от момента введения до конкретного временного интервала;
AUC0→∞ (нгхч/мл) - площадь под ФК кривой «концентрация ЛС - время». AUC0→∞ рассчитывается с использованием линейно-логарифмического метода трапеций от момента введения до бесконечности (сумма AUC(0→t) и экстраполируемой площади, вычисленной на основании значения последней наблюдаемой концентрации и kel);
С0 (нг/мл) - концентрация ЛС в плазме крови сразу после импульсного (болюсного) внутрисосудистого введения. Определяется как величина отрезка, отсекаемого на оси ординат при экстраполяции прямой (линейной зависимости в координатах lg[C(t)]-1) к точке t=0;
Сmax (нг/мл) - максимальная концентрация ЛС в плазме крови при внесосудистом введении;
Тmax (ч) - время достижения максимальной концентрации ЛС в плазме крови при внесосудистом введении;
Cmax/AUC (1/ч) - ФК параметр, характеризующий скорость всасывания ЛС в системный кровоток при внесосудистом введении;
kel (1/ч) - константа скорости элиминации - параметр, характеризующий скорость выведения вещества из плазмы крови - абсолютное значение наклона конечного логарифмически линейного участка, идентифицированного на фармакокинетической кривой;
t1/2 (ч) - период полувыведения - период, за который выводится половина введенной и всосавшейся дозы ЛС - рассчитывается, как t1/2=ln2/kel;
Vd (л/кг) - кажущийся объем распределения - мера кажущегося пространства, в котором были бы равномерно распределены молекулы ЛС, если бы они имели ту же концентрацию (С0), что и в плазме крови, Vd=D/AUC×kel, где D - доза (после внутрисосудистого введения);
CL (л/ч/кг) - клиренс - объем плазмы, который очищается от препарата в единицу времени, Cl=Vd×kel или Cl=D/AUC (после внутрисосудистого введения);
ƒa (%) - абсолютная биодоступность - степень абсорбции вещества в системный кровоток при внесосудистом введении.
Существуют разные подходы для расчета абсолютной биодоступности ƒа.
Наиболее общий: ƒa(1)=(AUCEV×DIV)/(AUCIV×DEV), где AUCEV и AUCIV - соответственно площади под кривыми зависимости «концентрация (С, нг/мл) - время (t, ч)» после внесосудистого и внутривенного введений (AUC0→∞); DIV и DEV - соответственно величины доз для соответствующих путей введения. Использовали AUC0→∞.
Для получения достоверных результатов идеальными условиями являются те, при которых как внутрисосудистое, так и внесосудистое введение изучаемого вещества проводиться на одних и тех же объектах исследования. В данном исследования использовались разные группы животных (внутри- и межиндивидуальные вариации в элиминации), поэтому проводилась коррекция по наблюдаемой терминальной константе скорости элиминации (kel) [Н.Н. Каркищенко и др. Фармакокинетика. Феникс, Ростов-на-Дону, 2001], а именно:
ƒa(2)=(kel×AUC)ev×DIV/(kel×AUC)IV×DEV, где AUCev и AUCIV - соответственно площади под кривыми зависимости «концентрация (С, нг/мл) - время (t, ч)» после внесосудистого и внутривенного введений (AUC0→∞); DIV и Dev - соответственно величины доз для соответствующих путей введения; kelEV и kelIV -соответственно величины констант скоростей элиминации для соответствующих путей введения.
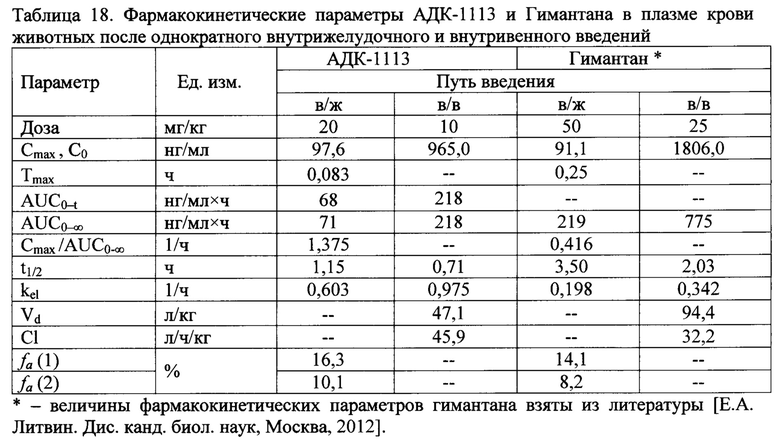
Усредненные ФК профили АДК-1113 в плазме крови мышей после однократного в/ж и в/в введений представлены на фиг. 1. Поскольку на каждую временную точку использовали по 5 мышей, результирующие ФК кривые были построены по усредненным концентрациям и поэтому при расчетах ФК параметров отсутствует статистическая обработка результатов. ФК характеристики исследуемого соединения в плазме крови животных после однократного в/жив/в введений представлены в табл.18.
После в/ж введения мышам АДК-1113 быстро всасывалось из желудочно-кишечного тракта (максимальная концентрация (Сmax - 97,6 нг/мл) в плазме крови регистрировалась через 0,083 ч (Тmax), а скорость всасывания - Cmax /AUC0→∞ составила 1,375 1/ч и определялось в плазме крови на протяжении 6 ч. При этом значение такого ФК параметра, как t1/2el (1,15 ч) указывает на относительно недолгое нахождение исследуемого вещества в системном кровотоке животных [Е.Н. Kerns et al. Drug-like properties: concepts, structure design and methods: from ADME to toxicity optimization, 1st ed., Elsevir, Amsterdam-Boston-London, 2008] в отличие от Гимантана, который выводится медленнее (t1/2el=3,5 ч) и более медленно всасывается (Cmax/AUC0→∞ в 3,3 раза ниже, чем у АДК-1113) в системный кровоток при внесосудистом введении [Е.А. Литвин. 2012].
После в/в введения АДК-1113 так же, как и в случае в/ж введения, определялся в плазме крови на протяжении 6 ч (t1/2el составил 0,71 ч). Кажущаяся начальная концентрация (С0) АДК-1113 в плазме крови мышей составила 965,0 нг/мл. Величина кажущегося объема распределения (Vd) АДК-1113 после в/в введения составила 47,1 л/кг.Vd обычно не эквивалентен физиологическому объему, а отражает распределение препарата и степень его связывания в организме. Так, если ЛС связывается преимущественно белками крови, Vd будет меньше, чем реальный. С другой стороны, преимущественное связывание ЛС во внесосудистом пространстве приводит к превышению значения Vd над реальным объемом. В нашем случае, расчет величины Vd показал достаточно высокие значения, указывающие на то, что АДК-1113 распределяется во внесосудистом пространстве (органах) животных и может накапливаться в тканях [В.И. Сергиенко, 2003; Е.Н. Kerns, 2008], так же как и Гимантан, Vd которого в 2 раза больше и составляет 94,4 л/кг.
Абсолютная биодоступность (ƒa) АДК-1113 после в/ж введения, рассчитанная разными способами ƒa (1) и ƒа (2), составила 16,3% и 10,1%, соответственно. Полученные значения абсолютной биодоступности для АДК-1113 незначительно превышают показатели аналогичного ФК параметра для гимантана после в/ж введения: ƒa (1)=14,1% и ƒ/а(2)=8,2%.
Таким образом, соединение АДК-1113 по своим ФК характеристикам и профилю является конкурентноспособным Гимантану. Описание чертежей.
Фиг. 1. Усредненные фармакокинетические профили АДК-1113 в плазме крови мышей после однократного внутривенного (в/в) или внутрижелудочного (в/ж) введения (n=5; Mean±SD).
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНЪЕКЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ И ПРИМЕНЕНИЕ | 2011 |
|
RU2520758C2 |
| СРЕДСТВО ДЛЯ ПРЕДУПРЕЖДЕНИЯ И КОРРЕКЦИИ ДВИГАТЕЛЬНЫХ, ЭКСТРАПИРАМИДНЫХ НАРУШЕНИЙ, ВЫЗВАННЫХ НЕЙРОЛЕПТИКАМИ | 2009 |
|
RU2421222C2 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2006 |
|
RU2324492C1 |
| БИОЛОГИЧЕСКИ АКТИВНЫЙ ГЕТЕРОГЛИКОЗИД ДЛЯ КОРРЕКЦИИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2006 |
|
RU2335289C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2009 |
|
RU2418577C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ СИНДРОМА ХРОНИЧЕСКОЙ УСТАЛОСТИ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2003 |
|
RU2267319C2 |
| 2-МЕТОКСИ-4[(3aR,7aS)-3,3,6-ТРИМЕТИЛ-1,3,3a,4,5,7a-ГЕКСАГИДРО-2-БЕНЗОФУРАН-1-ИЛ]ФЕНОЛ - НОВОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2010 |
|
RU2436782C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПСИХОТИЧЕСКОГО РАССТРОЙСТВА | 2004 |
|
RU2366464C2 |
| СПОСОБ ЛЕЧЕНИЯ СИНДРОМА ПАРКИНСОНИЗМА | 1994 |
|
RU2057529C1 |
| АНТИДЕПРЕССАНТНОЕ СРЕДСТВО ДЛЯ КОРРЕКЦИИ НЕЖЕЛАТЕЛЬНЫХ ПОБОЧНЫХ ЭФФЕКТОВ НЕЙРОЛЕПТИКОВ | 2019 |
|
RU2746012C2 |
Изобретение относится к области химии и медицины, а именно дигидрохлориду N-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)алкил)адамантиламина общей формулы 1, где n может иметь значения 2 или 3, R - Н или СН3. Технический результат заключается в получении альтернативных соединений, обладающих антипаркинсонической активностью и способных уменьшать выраженность коморбидных состояний и побочных эффектов Леводопы. 5 з.п. ф-лы, 1 ил., 18 табл., 11 пр.
1. Дигидрохлорид N-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)алкил)адамантиламина общей формулы 1:
где n может иметь значения 2 или 3, R - Н или СН3.
2. Соединение по п. 1, представляющее собой дигидрохлорид N-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)этил)-адамантил-2-амина (АДК-1111).
3. Соединение по п. 1, представляющее собой дигидрохлорид N-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)пропил)-адамантил-2-амина (АДК-1112).
4. Соединение по п. 1, представляющее собой дигидрохлорид N-(3-((5-этокси-1H-бензо[d]имидазол-2-ил)тио)этил)-N-метиладамантил-1-амина (АДК-1113).
5. Соединение по пп. 1-4, обладающее антипаркинсонической активностью.
6. Соединение по п. 4, обладающее анксиолитической и антидепрессивной активностями.
| Состав для тушения пожаров | 1972 |
|
SU421222A1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ РАССТРОЙСТВ АУТИСТИЧЕСКОГО СПЕКТРА | 2017 |
|
RU2666598C1 |
| СРЕДСТВО ДЛЯ ТЕРАПИИ БОЛИ И ВОСПАЛЕНИЯ ПРИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ | 2012 |
|
RU2559777C2 |
| WO 2020132522 А1, 25.06.2020 | |||
| MAURICE T., Bi-phasic dose response in the preclinical and clinical developments of sigma-1 receptor ligands for the treatment of neurodegenerative disorders | |||
| Expert Opinion on Drug Discovery, 2021, vol | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Устройство для одновременного приема и передачи по радиотелефону | 1921 |
|
SU373A1 |
Авторы
Даты
2024-06-03—Публикация
2023-07-06—Подача