Область техники, к которой относится изобретение
Изобретение относится к области технологий синтеза экологически безопасных наноматериалов, в частности к способу получения белковых наночастиц из молекул иммуноглобулинов, а также к тест-системе для диагностики, содержащей упомянутые наночастицы. Возможно их применение при противораковой, противопухолевой или противомикробной терапии, тераностике, в качестве биосенсора, а также для биовизуализации, культивирования тканей организма и вакцинации. Способ удобен и безопасен при эксплуатации и подходит для промышленного производства.
Описание предшествующего уровня техники
В последнее время наблюдается неуклонный рост использования нанотехнологий в биологии и медицине, а также других областях науки и техники.
По мнению Всемирной организации здравоохранения с появлением наномедицины стало возможным решение многих задач в сфере здравоохранения, в частности, использование наночастиц помогает созданию новых иммунобиологических препаратов, с помощью которых можно контролировать как инфекционные, так эпидемические процессы. В первую очередь - это вакцинные препараты. В настоящее время разработаны вакцины против 34 инфекционных заболеваний, а человеческую популяцию поражает более 400 их видов.
На нанотехнологий возлагают надежды по лечению таких серьезных заболеваний, как ВИЧ и гепатит С. Кроме того, сейчас активно ведутся работы по созданию биологических наночипов для диагностики соматических и инфекционных заболеваний, а также медицинских нанороботов, способных устранять дефекты в организме больного человека путем управляемых нанохирургических вмешательств.
Минюстом зарегистрирован совместный приказ Минпромторга и Минздрава России №1605/308н от 19 мая 2016 г. «Об утверждении перечня биомишеней для разработки схожих по фармакотерапевтическому действию и улучшенных аналогов инновационных лекарственных препаратов». Утвержденный перечень должен послужить ориентиром для организаций, занимающихся исследованием нанопрепаратов, которые претендуют на получение компенсации затрат на их разработку согласно соответствующему постановлению Правительства России №1503 от 30 декабря 2015 г.
Известны как традиционные методы получения наночастиц, так и передовые, например, метод микроэмульсии, гидротермальный метод, золь-гель метод.
Традиционные методы получения наночастиц делятся на физические и химические. Физические методы включают механическое измельчение и физическое осаждение из паровой фазы. К недостаткам можно отнести сложное технологическое оборудование, низкий выход и сложности крупномасштабного производства. Метод микроэмульсии и метод пиролиза распылением обычно подвергаются высокотемпературной термообработке, в результате чего частицы легко агломерируются и происходит аномальный рост частиц. Однако обычный цикл гидротермальной реакции является длительным, и обычно он занимает несколько часов, даже несколько дней времени реакции, и неизбежен значительный рост частиц. Получение наночастиц металла с помощью химического электролиза является относительно зрелым и промышленным методом производства, но полученный металлический порошок обычно необходимо подвергать шаровой мельнице, просеивание и тому подобное, чтобы окончательно получить сверхмелкозернистые частицы металла, а отработанная жидкость электролита содержит большое количество ионов металла. Любой сброс приведет к неэффективному использованию ресурсов и загрязнению окружающей среды, что ограничивает широкомасштабное применение метода. Метод жидкофазного восстановления является относительно активным методом получения наночастиц в последние годы, но этот метод обычно требует большого количества органических растворителей или высокотоксичных добавочных компонентов, что вызывает серьезное загрязнение при производстве, и его применение сильно ограничено. Поэтому очень важно изучить экологически чистую и эффективную технологию получения наночастиц с использованием воды в качестве реакционной среды. Любой сброс приведет к неэффективному использованию ресурсов и загрязнению окружающей среды, что ограничивает широкомасштабное применение метода. Метод жидкофазного восстановления является относительно активным методом получения наночастиц в последние годы, но этот метод обычно требует большого количества органических растворителей или высокотоксичных добавочных компонентов, что вызывает серьезное загрязнение при производстве, и его применение сильно ограничено. Поэтому очень важно изучить экологически чистую и эффективную технологию получения наночастиц с использованием воды в качестве реакционной среды. Любой сброс приведет к неэффективной трате ресурсов и загрязнению окружающей среды, что ограничивает широкомасштабное применение этого метода. Метод жидкофазного восстановления является относительно активным методом получения наночастиц в последние годы, но для этого метода обычно требуется большое количество органических растворителей или высокотоксичных добавочных компонентов, что вызывает серьезное загрязнение при производстве, и его применение сильно ограничено. Поэтому очень важно изучить экологически чистую и эффективную технологию получения наночастиц с использованием воды в качестве реакционной среды, но для этого метода обычно требуется большое количество органических растворителей или высокотоксичных добавочных компонентов, что вызывает серьезное загрязнение при производстве, и его применение сильно ограничено. Поэтому очень важно изучить экологически чистую и эффективную технологию получения наночастиц с использованием воды в качестве реакционной среды, но для этого метода обычно требуется большое количество органических растворителей или высокотоксичных добавочных компонентов, что вызывает серьезное загрязнение при производстве, и его применение сильно ограничено. Поэтому очень важно изучить экологически чистую и эффективную технологию получения наночастиц с использованием воды в качестве реакционной среды.
Известен гидротермальный метод синтеза, который имеет преимущества простого оборудования, легкого доступа к сырью, высокой чистоты получаемого продукта, хорошей однородности и точного контроля химического состава и т.д., что имеет предпочтение у многих исследователей. Гидротермальный метод заключается в создании отражающей среды с высокой температурой и высоким давлением за счет нагрева реакционной системы до критической температуры или близкой к критической температуре в специально созданном закрытом реакторе/ автоклаве с использованием таких жидкостей, как вода, органические растворители или реакционные вещества. Это эффективный метод для ускорения реакции, проводимой в жидкой фазе или в газовой фазе, для растворения и перекристаллизации первоначально нерастворимых веществ, а затем для получения продукта путем разделения и термической обработки. Гидротермальный метод имеет следующие преимущества: 1) В нем используется регулировка жидкой фазы при средней температуре, обычно от 120 до 200°С, потребление энергии относительно низкое, а область применения широкая. Его можно использовать как для получения наночастиц небольшого размера, так и для монокристаллов большого размера; 2) Сырье относительно дешевое и его легко получить, реакция проводится в жидкой фазе с быстрой конвекцией, выход высокий, фаза однородная, чистота высокая, кристаллизация хорошая, форма и размер можно контролировать; 3) в воде. В ходе термического процесса цель эффективного управления реакцией и характеристиками роста кристаллов может быть достигнута путем регулирования температуры реакции, давления, времени, рН, прекурсоров и поверхностно-активных веществ; 4) Реакция проводится в герметичном контейнере.
Эффективность и безопасность терапевтических агентов можно повысить с помощью наноразмерных систем доставки лекарств. Системы доставки лекарств в наномасштабе локализуют лекарственные средства в тканях-мишенях в увеличенном количестве, увеличивают стабильность лекарств и проницаемость через биологические мембраны, тем самым улучшая их биодоступность и терапевтическую эффективность.
Наночастицы на основе белка привлекают внимание благодаря своей биоразлагаемости, биосовместимости, простоте модификации поверхности и контролю размеров. На сегодняшний день доступны химические, физические и биотехнологические методы создания белковых наночастиц с использованием альбумина, фиброина, желатина, ферритина, меланина, липопротеинов, проникающих в клетки белков, вирусных капсидных белков и т.д.
Однако эти методы имеют следующие ограничения:
i) неблагоприятные условия синтеза, приводящие к полной или частичной денатурации белка (это относится к десольватации, электрораспылению, высаливанию);
ii) крупный размер и/или широкое распределение наночастиц по размеру (это относится к коацервации, поперечному сшиванию, эмульгированию);
iii) ограниченное количество белков, с которыми совместим метод (это относится к самосборке).
Эти методы требуют значительного количества энергии, воды и реагентов, а также использования растворителей, поверхностно-активных веществ или даже тяжелых металлов. Кроме того, почти все типы наночастиц модифицируются лигандом или рецептором, чтобы действовать в качестве прицельного наноагента. Эти модификации часто требуют сложных многоступенчатых операций синтеза. Таким образом, экологически чистый, универсальный и простой синтез прицельных белковых наночастиц представляет большой интерес.
Агрегация белков, вызванная нагреванием, является хорошо известным и изученным фактом. Однако мы бы хотели переосмыслить роль этого явления. В частности, агрегацию иммуноглобулинов можно рассматривать не как препятствие, которого следует избегать, а как устойчивый подход к проектированию/ разработке функциональных наночастицы. Среди упомянутых методов десольватация (добавление органического растворителя), высаливание (увеличение ионной силы), коацервация (добавление взаимодействия с белковым агентом) и агрегация нагнетательным электрораспылением, а также STF. Однако, производственная база нанодиапазона для белковой наномедицины накладывает на метод следующие условия: белок должен сохранять свои функциональные свойства (например, сходство), размер продукта должен контролироваться так, чтобы он не превышал сотен нанометров.
С точки зрения термодинамики агрегация означает, что белок находится в некотором состоянии, при котором связь с другим белком снижает/ уменьшает свободную энергию/ термодинамический потенциал. Известны многие механизмы агрегации, такие как на основе нативных/ естественных мономеров, вызванная конъюгацией модификация (случай STF), обусловленные химической модификацией, вызванные нуклеацией и поверхностно-индуцированные. Существует множество факторов, которые делают иммуноглобулины термоагрегируемыми, например, множественные внутри- и междоменные гидрофобные взаимодействия, неспаренные сульфгидрильные группы, сложная многодоменная структура со значительной стоимостью свободной энергии.
Из публикации CN102048695 (опубл. 11.05.2011) известен наиболее близкий способ получения белковых наночастиц, включающий стадии (а) получение раствора альбумина в условиях 55 ~ 75°С и рН 6-8 путем растворения белка в первом растворителе; (b) в денатурирующем агенте или подходящих денатурирующих условиях добавление паклитаксела к упомянутому белковому раствору; (с) диализ наночастиц для удаления избытка низкомолекулярных соединений.
Однако известный способ имеет следующие ограничения: в качестве белка используется альбумин, что приводит к слабой специфичности созданных частиц к клеткам-мишеням, т.е. к отсутствия выраженной специфичности к раковым или иным клеткам, а также невозможности влиять на специфичность получаемых частиц к мишеням.
Таким образом, требуемый технический результат заключается в возможности точной настройки специфичности наночастиц на определенные мишени - как для целей создания диагностических тест-систем, так и для создания агентов доставки лекарств.
Краткое содержание изобретения
Целью настоящего изобретения явилась разработка экологически чистого коммерческого процесса получения белковых наночастиц из молекул иммуноглобулина на основе процесса разработанного авторами метода STF (swift thermal formation).
Другой целью настоящего изобретения явилось получение продукта в виде белковых наночастиц из молекул иммуноглобулинов для диагностики, при противораковой, противопухолевой или противомикробной терапии, тераностике, в качестве биосенсора, а также для биовизуализации, культивирования тканей организма.
Еще одной целью настоящего изобретения явилось использование полученного продукта в тест-системе для диагностики.
Еще одной целью настоящего изобретения явилось применение полученного продукта в медицинских изделиях.
Для решения перечисленных выше и других целей, которые очевидны для квалифицированного специалиста, был предложен следующий способ.
Способ получения белковых наночастиц из молекул иммуноглобулинов, включающий по крайней мере следующие стадии:
i) водный раствор иммуноглобулина в концентрации не менее 0.1 мг/мл с рН от 3 до 7 нагревают до температуры 50-99°С для получения начальной суспензии;
ii) в полученную начальную суспензию добавляют раствор кросс-линкера.
Кроме того, белковые наночастицы из молекул иммуноглобулинов для диагностики, при противораковой, противопухолевой или противомикробной терапии, тераностике, в качестве биосенсора, а также для биовизуализации, культивирования тканей организма, полученные упомянутым способом.
Кроме того, тест-система для диагностики, содержащая белковые наночастицы из молекул иммуноглобулинов, полученные упомянутым способом.
Кроме того, применение белковых наночастиц из молекул иммуноглобулинов, полученных упомянутым способом, в медицинских изделиях.
Сущность изобретения поясняется чертежами
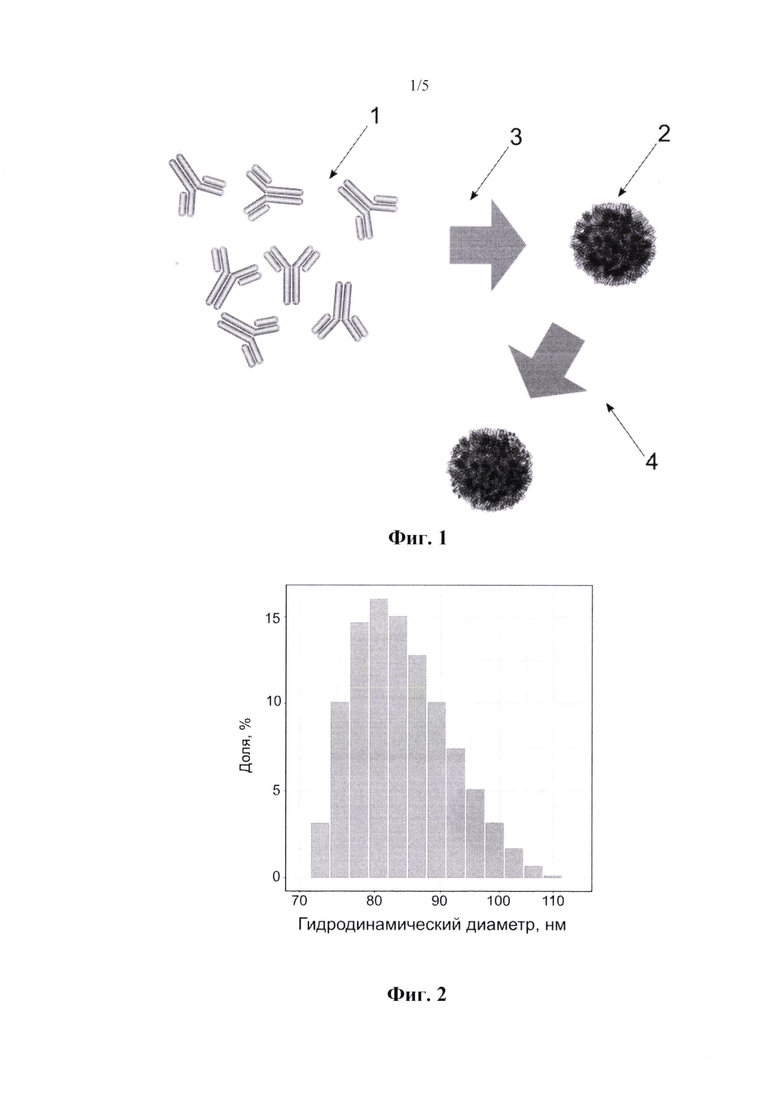
На фиг. 1 представлена схема получения белковых наночастиц из молекул иммуноглобулинов.
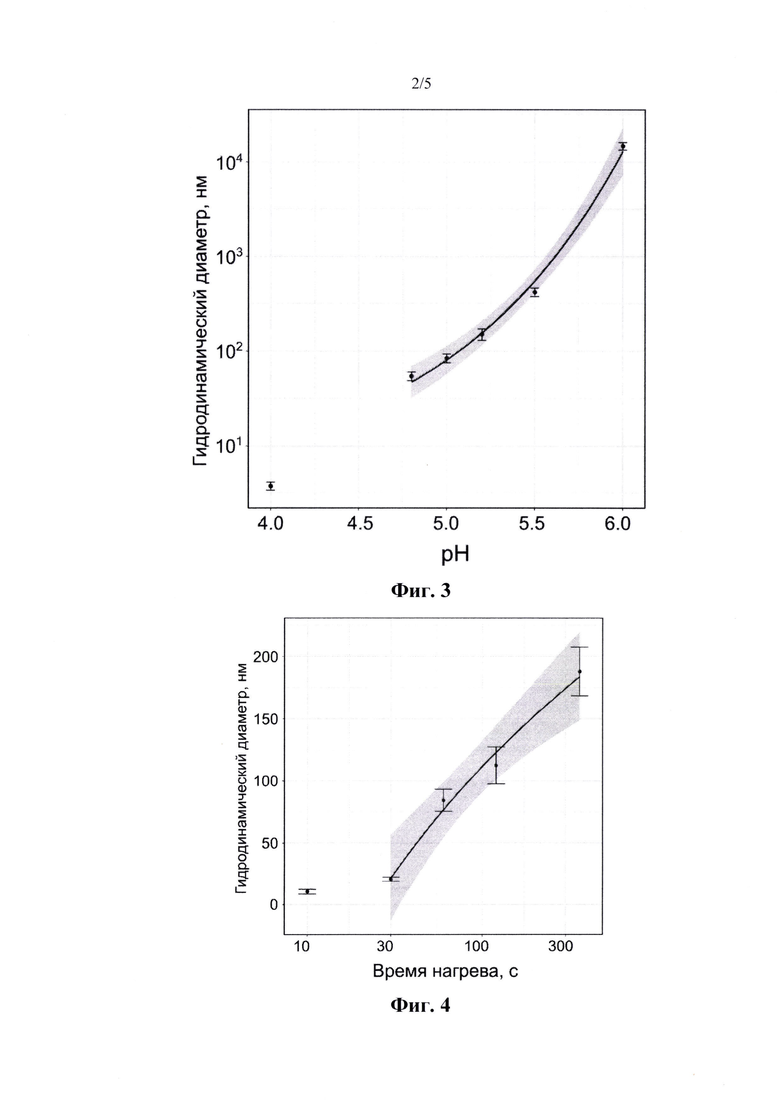
На фиг. 2 представлен профиль распределения IgNPs по размерам, измеренный с помощью анализа DLS (динамического рассеяния света).
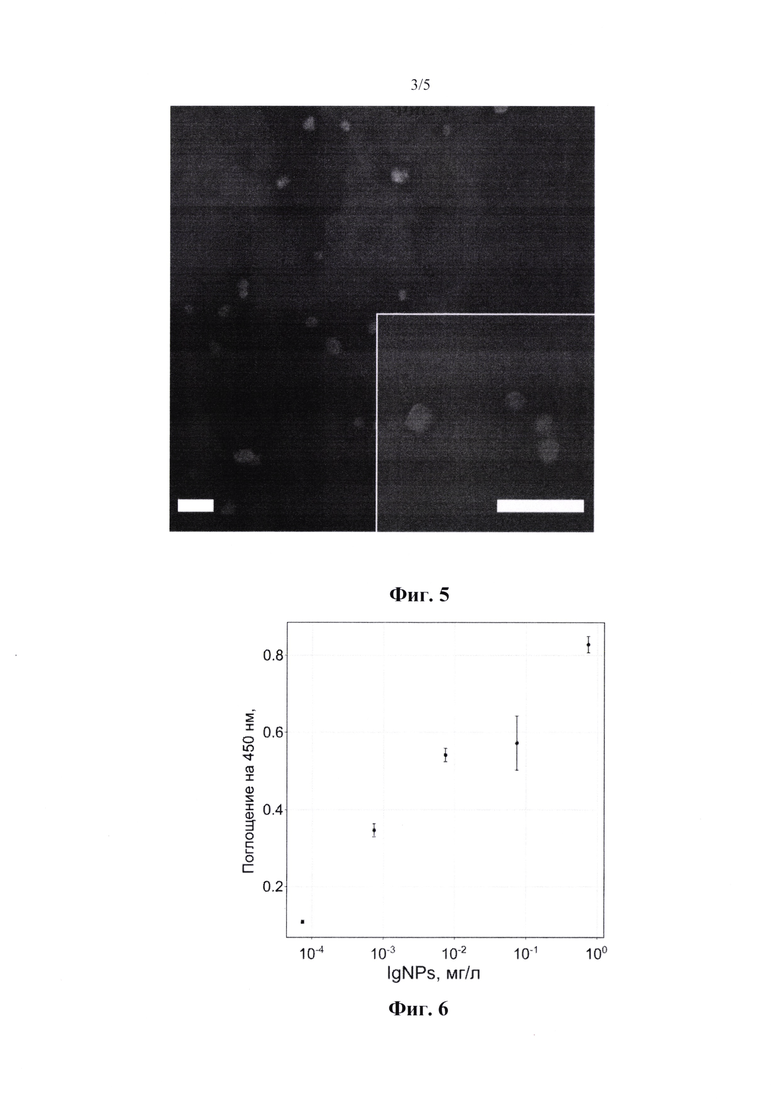
На фиг. 3 показано влияние рН раствора, нагретого в течение 1 минуты, на размер наночастиц; линия тренда экспоненциальна.
На фиг. 4 представлен профиль роста наночастицы, синтезированных при рН 5,0; линия тренда логарифмическая.
Для фиг. 3 и 4 данные представлены в виде среднего значения ± стандартная ошибка среднего; заштрихованные области показывают 95% диапазона применения.
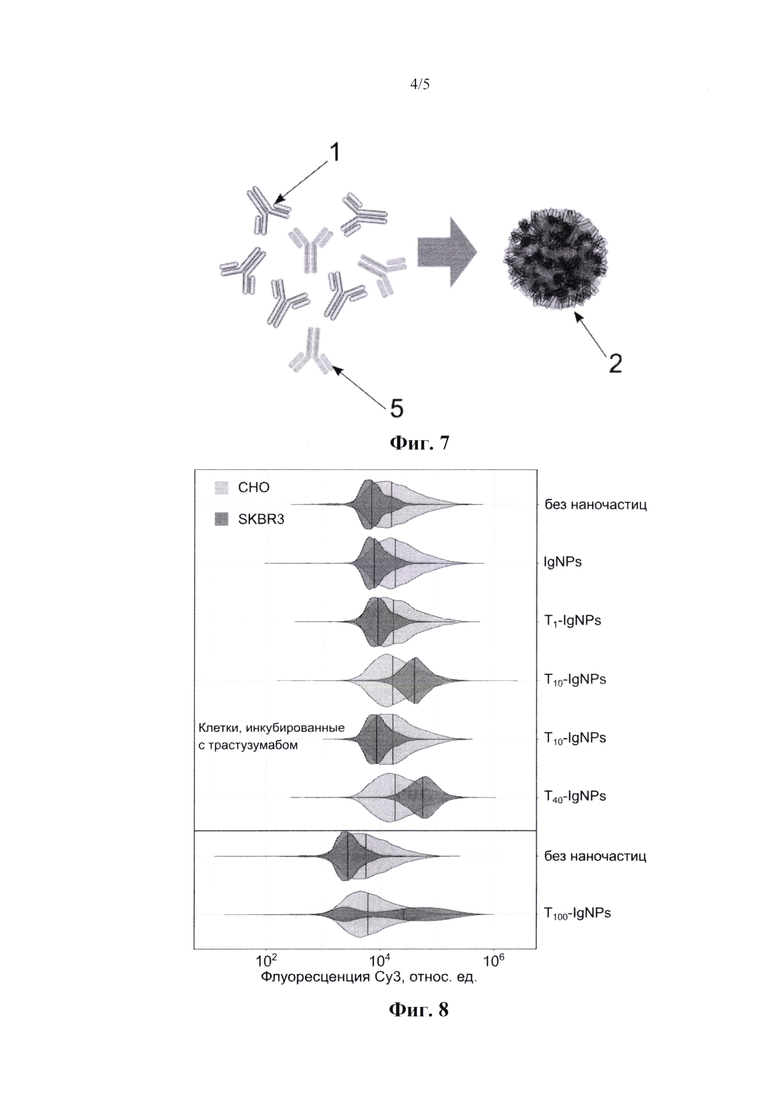
На фиг. 5 представлено SEM-изображение (сканирующая электронная микроскопия) IgNPs, масштабные полосы - 500 нм.
На фиг. 6 приведено распознавание адсорбированных IgNPs антителами человека способом ELISA. Для фиг.6 данные представлены в виде среднего значения ± стандартная ошибка среднего.
На фиг. 7 представлена схема синтеза наночастиц, содержащих трастузумаб.
На фиг. 8 представлен проточно-цитометрический анализ при взаимодействии помеченных Су3 наночастиц с различным содержанием трастузумаба с клеточными линиями СНО и SKBR3; вертикальные линии обозначают медианы; измерения с Т100 - IgNP проводились с использованием возбуждающего лазера мощностью 50 мВт, а для остальных наночастиц 200 мВт.
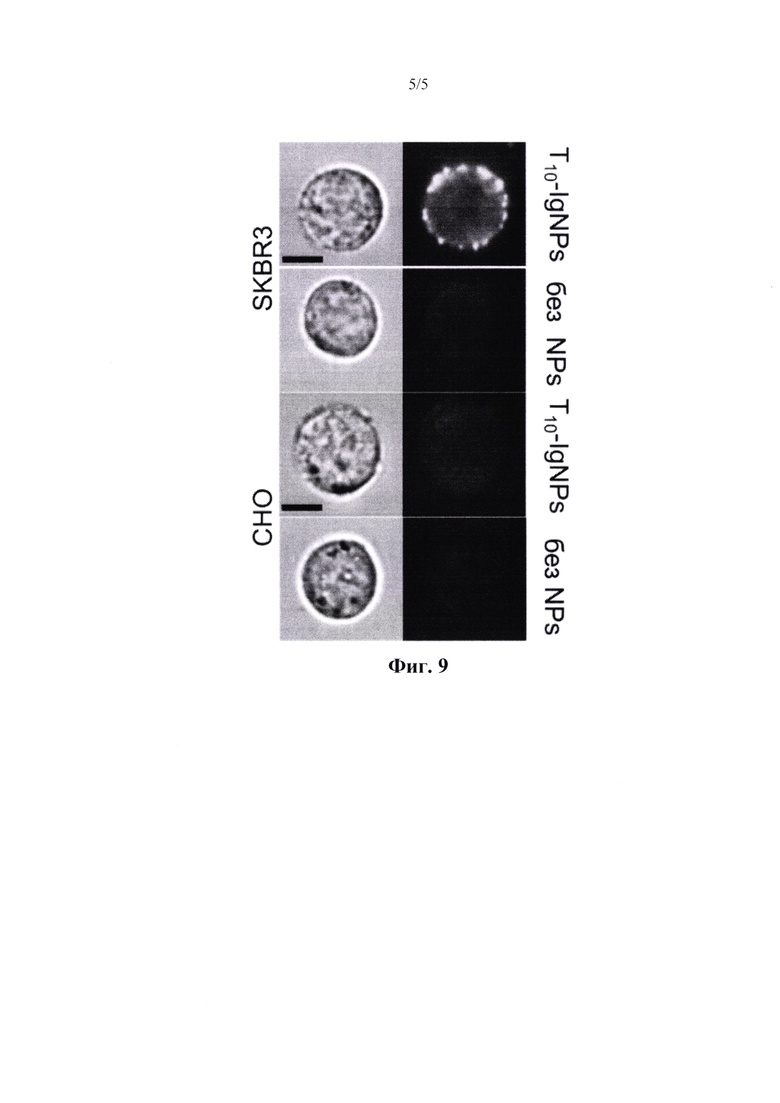
На фиг. 9 представлена визуализация взаимодействия клеток с Т10 - IgNPs, которая проводилась с использованием визуализации проточной цитометрии; шкала составляла 10 мкм.
На чертежах цифрами обозначены:
1. - иммуноглобулины
2. - наночастицы
3. - процесс получения наночастиц
4. - стабилизация наночастиц
5. - трастузумаб Подробное описание изобретения
Далее будут описаны варианты осуществления настоящего изобретения более полно со ссылкой на прилагаемые чертежи, на которых приведены лишь некоторые, но не все варианты осуществления изобретения.
В рамках данного изобретения предложен способ получения белковых наночастиц из молекул иммуноглобулинов, включающий по крайней мере следующие стадии:
i) водный раствор иммуноглобулина в концентрации не менее 0.1 мг/мл с рН от 3 до 7 нагревают до температуры 50-99°С для получения начальной суспензии;
ii) в полученную начальную суспензию добавляют раствор кросс-линкера.
Кроме того, способ, в котором после стадии добавления кросс-линкера, полученные кросс-сшитые белковые наночастицы промывают на центрифуге, удаляя несвязанные молекулы кросс-линкера.
Кроме того, способ, в котором упомянутый иммуноглобулин является гамма-иммуноглобулином.
Кроме того, способ, в котором упомянутый иммуноглобулин является смесью нескольких гамма-иммуноглобулинов.
Кроме того, способ, в котором упомянутый иммуноглобулин включает в себя антитело против молекулярной или клеточной мишени.
Кроме того, способ, в котором не более 10% упомянутого иммуноглобулина является упомянутым антителом против молекулярной или клеточной мишени.
Кроме того, способ, в котором не менее 5% упомянутого иммуноглобулина является упомянутым антителом против молекулярной или клеточной мишени.
Кроме того, способ, в котором упомянутый иммуноглобулин включает в себя противоопухолевое антитело.
Кроме того, способ, в котором упомянутый иммуноглобулин включает в себя антитело против молекулярной или клеточной мишени.
Кроме того, способ, в котором, после между стадиями нагревания и добавления кросс-линкера, полученную начальную суспензию обрабатывают ультразвуком.
Кроме того, способ, в котором после упомянутого нагрева упомянутую суспензию остужают до комнатной температуры с помощью метода активного охлаждения.
Кроме того, способ, в котором упомянутый раствор имммуноглобулина имеет рН от 4.5 до 6.0.
Кроме того, способ, в котором упомянутый раствор имммуноглобулина имеет рН меньший значения изоэлектрической точки имммуноглобулина на от 0.1 до 1.
Кроме того, способ, в котором упомянутый раствор имммуноглобулина имеет рН больший значения изоэлектрической точки имммуноглобулина на от 0.1 до 1.
Кроме того, способ, в котором упомянутое нагревание проводят от 50 до 55 градусов.
Кроме того, способ, в котором упомянутое нагревание проводят от 55 до 75 градусов.
Кроме того, способ, в котором упомянутое нагревание проводят от 75 до 95 градусов.
Кроме того, способ, в котором упомянутое нагревание проводят в течение от 30 секунд до 3 минут.
Кроме того, способ, в котором упомянутое нагревание проводят в течение от 3 секунд до 10 минут.
Кроме того, способ, в котором упомянутый кросс-линкер является формальдегидом, глутаральдегидом или диглицидиловым эфиром полиэтиленгликоля.
Кроме того, способ, в котором после упомянутого кратковременного нагрева смеси дополнительно проводят ее инкубацию с концентрированным раствором формальдегида при конечной концентрации формальдегида не более 0.1% в течение ночи при комнатной температуре.
Кроме того, способ, в котором для облегчения обнаружения наноагентов in vitro и in vivo на стадии смешения в смесь добавляют раствор флуорофора.
Кроме того, способ, в котором для облегчения обнаружения частиц in vitro и in vivo на стадии смешения в смесь добавляют водный раствор эфира флуорофора.
Кроме того, способ, в котором добавляют электролит для увеличения ионной силы раствора.
Кроме того, способ, в котором упомянутый электролит является хлоридом натрия. Кроме того, способ, в котором концентрация упомянутого электролита в смеси не более 500 ммоль/л.
Кроме того, способ, в котором концентрация упомянутого электролита в смеси не менее 50 ммоль/л.
Кроме того, способ, в котором рН реакционной смеси от 3 до 7.
Кроме того, способ, в котором упомянутый белок имеет изоэлектрическую точку в диапазоне значений pI от 3 до 7.
Кроме того, способ, в котором упомянутый белок имеет изоэлектрическую точку в диапазоне значений pI от 7 до 11.
Кроме того, способ, в котором упомянутые белковые наночастицы имеют размер от 50 до 100 нм.
Кроме того, способ, в котором упомянутые белковые наночастицы имеют размер от 100 до 200 нм.
Кроме того, способ, в котором упомянутые белковые наночастицы имеют размер от 200 до 400 нм.
Кроме того, белковые наночастицы из молекул иммуноглобулинов для диагностики, при противораковой, противопухолевой или противомикробной терапии, тераностике, в качестве биосенсора, а также для биовизуализации, культивирования тканей организма, полученные упомянутым способом.
Кроме того, тест-система для диагностики, содержащая белковые наночастицы из молекул иммуноглобулинов, полученные упомянутым способом.
Кроме того, применение белковых наночастиц из молекул иммуноглобулинов, полученных упомянутым способом, в медицинских изделиях.
Для облегчения понимания сути данного изобретения здесь, ранее и далее в этом тексте используются следующие термины.
Белковые наночастицы из молекул иммуноглобулинов, описанные в настоящем изобретении, могут содержать фармакологически активные вещества, которые составляют от 1% до 40% от общей массы белковых наночастиц. Средний размер частиц белковых наночастиц, описанных в техническом решении настоящего изобретения, составляет от 50 до 400 нм, оптимизированный - от 75 до 250 нм и оптимальный - от 100 до 200 нм.
Под белковым раствором здесь понимается раствор, включающий белок и растворитель, способный растворять белок. После того, как белок будет развернут, его можно свернуть или собрать самостоятельно. Рефолдинг, как здесь используется, относится к процессу, с помощью которого развернутый или денатурированный белок может быть повторно свернут до правильной трехмерной структуры. Используемый здесь термин "самосборка" относится к процессу, посредством которого повторно свернутые белки связываются вместе с образованием наночастиц. Специалистам в данной области известно, что процесс рефолдинга белка может осуществляться при многих условиях. Первый раствор, используемый в белковом растворе, представлен следующим образом, но не ограничивается этим: вода, физиологический раствор, сахар.
В более точном диапазоне растворители в белковых растворах включают воду, фосфат, ацетат и растворы хлорида натрия. Концентрация растворителя в белковом растворе, используемом в настоящем изобретении, возможна до тех пор, пока он подходит для растворения белка и рефолдинга белка. Как правило, содержание растворителя в растворе белка составляет от 0,001 до 1,6 М. Диапазон оптимизации составляет от 0,03 до 1,5 млн. Диапазон повторной оптимизации составляет от 0,05 млн до 0,8 млн. Более оптимизированный диапазон от 0,1 М до 0,3 М. Специалисты в данной области поймут, что количество растворителя, используемого для растворения белка, будет варьироваться в зависимости от количества белка и концентрации раствора белка.
Под водным раствором иммуноглобулина подразумевается, например, раствор очищенной фракции иммуноглобулинов в концентрации не менее 0.1 мг/мл с рН от 3 до 7. Коммерчески доступен.
Влияние состава: подбор условий (рН, соль).
В одном воплощении метода для получения частиц выбирают рН раствора, а также ионную силу раствора. Изменения рН раствора добиваются, например, путем титрования раствора нужным количеством таких сильных кислот как соляная, серная, азотная и др., сильных щелочей - гидроксид натрия, гидроксид калия, или слабых кислот - угольной, уксусной, и др., или слабых щелочей - гидроксид аммония и др. Ионную силу изменяют (доводят) путем, например, добавления (титрования) различных солей сильных и слабых кислот и щелочей, например, хлорид натрия, хлорид калия, сульфат аммония, хлорид аммония и др.
Кроме того, в одном воплощении метода рН и концентрацию раствора белка доводят до нужных значений с помощью добавления к раствору белка буферного раствора или непосредственна за счет растворения белка в буферном растворе.
Однако, параметр рН и ионной силы - это взаимосвязанные параметры, обоюдно влияющие на параметры получаемых частиц. Как показано в Примерах, для таких белков как альбумин, иммуноглобулин, овальбумин, и др. - чем выше рН, тем больше ионной силы (соли) требуется для генерации частиц.
Кросс-сшивка
В одном воплощении метода, полученные частицы кросс-сшивают для обеспечения большей стабильности частиц с точки зрения дезинтеграции (растворения за счет перехода индивидуальных белковых молекул из наночастиц обратно в раствор; или за счет деградации различными ферментами организма (например, протеазами) или клеток или иных биологических систем).
В одном воплощениии метода для кросс-сшивки наночастиц, их смешивают с бифункциональными кросс-линкерами. Это может быть глутаровый альдегид, формальдегид, диглицидиловый эфир, генипин и т.п. В одном воплощении метода, используют такой кросс-линкер, который оставляет частицы или делает их высокоспецифичными с точки зрения распознавания/связывания со своей биологической мишенью. В частности, кросс-сшивка формальдегидом или диглицидиловым эфиром предпочтительнее использования глутарового альдегида, т.к. как правило позволяет добиться более специфичных частиц. В то же время, для таких задач как неспецифическая трансфекция клеток генетическим материалом предпочтительно использовать кросс-сшивающий агент, который приводит не к избирательности частиц, а наоборот позволяет им высокоэффективно связываться с различными мишенями. Так, например, глутаровый альдегид приводит к образованию оснований Шиффа, которые обладают частичным положительным зарядом, а потому будут эффективно выполнять задачу связывания ДНК (которая заряжена отрицательно) для целей доставки генетического материала в клетки. Дополнительные компоненты:
Как уже было упомянуто выше, помимо белковых молекул, реакционная смесь может содержать другие вещества и компоненты - буферные соли, кислоты, щелочи, различные терапевтические, диагностические наночастицы и молекулы. Такими частицами могут быть золотые наночастицы, наночастицы магнетита, полимерные частицы и пр. А молекулы могут быть как макромолекулярные, так и низкомолекулярными - растворители (диметилсульфоксид, диметилформамид, ацетон, этанол и т.п.), флуорофоры (родамин, флуоресцеин), фотосенсибилизаторы, цитостатики и цитотоксические вещества -доксорубицин, паклитаксел и т.п.
Помимо того, что упомянутые наночастицы или молекулы добавляют для их инкапсуляции и загрузки в белковые наночастицы (о чем будет сказано подробнее ниже), в одном воплощении, данные частицы и молекулы добавляют для обеспечения растворимости, стабильности других компонент реакционной смеси. Например, для создания высокой концентрации красителя орсеина в реакционной смеси, орсеин предварительно растворяют в ДМСО и этот раствор уже добавляют в реакционную смесь.
Кроме того, в одном воплощении метода также используют ПАВы и другие стабилизаторы эмульсий и т.п., добавляя их в реакционную смесь. Так, например, можно добиться получения стабильных частиц в тех комбинациях рН и ионной силы, где при обработке излучением образуется белковые макроагрегаты. С одной стороны, как было отмечено выше, это имеет существенные недостатки перед системами, свободными от использования ПАВ. С другой стороны, этот метод позволяет получать частицы в тех рН, где могут быть намного более растворимы или стабильные лекарственные молекулы терапевтической нагрузки.
Нагрузка
Описанными способами можно эффективно загружать различные агенты. Во-первых, это могут быть наночастицы такие как золотые наночастицы, магнитные наночастицы, другие кристаллические частицы, полимерные наночастицы и микрочастицы, квантовые точки, наноалмазы, нанофосфоры, нанорубины. Кроме того, это могут быть различные молекулы, малые молекулы (родамин, флуоресцеин и т.п.), фотосенсибилизаторы, цитостатики и цитотоксические вещества (доксорубицин, паклитаксел, даунорубицин, и другие).
Способ загрузки
Кроме того, в одном воплощении метода можно получать белковые наночастицы, нагруженные различными терапевтическими агентами. В одном воплощении метода раствор или суспензию терапевтического агента добавляют в реакционную смесь до облучения. При этом достигается крайне высокая эффективность загрузки терапевтического агента в белковую матрицу наночастицы. Важно, что терапевтическоий агент может быть растворен либо ресуспендирован в дополнительных растворителях таких как этанол, ацетон, диметилсульфоксид, диметилформамид. Добавление подобного рода растворителей либо не мешает генерации наночастиц, либо требует малого изменения других параметров реакционной смеси таких как рН, ионная сила и режимов облучение микроволновым излучением. Это дает возможность использовать как сильно гидрофобные терапевтические агенты, так и гидрофильные, и амфифильные. В случае использования наночастиц в качестве терапевтического агента и/или нагрузки создаваемых частиц, они также могут быть ресуспендированы в любом подходящем растворителе. Изобретение позволяет существенно улучшить параметры нагрузки белковых наночастиц за счет использование водного раствора как основной среды, в которой происходит синтез. В отличие от коацерватного синтеза белковых наночастиц, водная среда вокруг получаемых наночастиц препятствуют выходу гидрофобных терапевтических агентов из объема наночастиц. Отметим, что в коацерватном методе синтеза белковых наночастиц высокое содержание более гидрофобных растворителей (этанол, ацетон), наоборот, способствует плохому включению гидрофобного терапевтического агента в матрицу получаемых наночастиц, так как сродство такого агента к раствору получается больше, чем к белковой матрице. Наоборот, генерация белковых наночастиц в рамках предлагаемого изобретения лишена такого недостатка. А именно гидрофобный терапевтический агент предпочитает активнее включаться в белковую матрицу наночастицы, чем оставаться в растворе.
Кроме того, в одном воплощении метода терапевтический агент может быть включен (инкапсулирован) в уже полученные наночастицы путем сорбции, основанной на электростатическом, гидрофобно-гидрофильном, координационным или ином взаимодействии.
Кроме того, в одном воплощении метода терапевтический агент может быть присоединен к сформированным белковом наночастицам за счет ковалентной или не ковалентной конъюгации. В таком случае для высвобождения данного терапевтического агента требуется использование известных в литературе приемов обратимой конъюгации. То есть могут быть использованы различные лабильные связи, которые тем или иным способом разрушаются для высвобождения терапевтического агента.
Количество нагрузки
Фармакологически активный агент(ы) могут присутствовать в широком диапазоне концентраций в композиции изобретения, как определено конечными применениями композицией изобретения. Например, фармакологически активный функциональный агент (агенты) может присутствовать в составе изобретения в диапазоне: от примерно 0.0001% до примерно 95% массы в единице объема, по результатам измерения в смеси перед выпариванием и лиофилизацией. В одном варианте осуществления, когда фармакологически активным агентом является паклитаксел, концентрация фармакологически активного агента в органическом растворителе (растворителях) (т.е. перед добавлением любых других необязательных компонентов смеси) может находиться в диапазоне от примерно 0,001 мг/мл до примерно 1000 мг/мл.
Можно включить каждое из активных веществ, перечисленных в приведенном выше списке активных агентов в матрицу частиц белковой системы-носителя. Однако, из-за различных физико-химических свойств активных ингредиентов (например, растворимость, изотермы адсорбции, связывание с белками плазмы, значения рК) для конкретного лекарственного средства может потребоваться оптимизировать процесс изготовления лекарственно-содержащих наночастиц.
Кроме того, в одном воплощении изобретения, используют функциональное агент, являющийся ионом, заряженным веществом, заряженной молекулой или молекулами (и т.п.) в совокупности с хелатирующим агентом (хелатором). Например, в одном воплощении изобретения для эффективного включения ионов железа может быть использован хелатор дефероксамин (Deferoxamine), для включения в до наночастицы ионов гадолиния используют DTPA или другой хелатор.
Изоэлектрическая точка иммуноглобулина - кислотность среды (рН), при которой молекулы иммуноглобулина или их поверхность не несет электрического заряда. Растворимость амфотерных молекул, как правило, является минимальной при рН равной или близкой к изоэлектрической точке pI. Часто они в своей изоэлектрической точке выпадают в осадок. Многие биологические молекулы, такие как аминокислоты и белки, являются по своей природе амфотерными, так как содержат и кислотные, и основные функциональные группы. Общий заряд белка определяется боковыми группами аминокислот, которые могут быть положительно- или отрицательно-заряженными, нейтральными или полярными. Общий заряд белка при рН ниже изоэлектрической точки является положительным. Наоборот, при рН выше изоэлектрической точки общий заряд белка - отрицательный. В самой изоэлектрической точке сумма положительных зарядов на белковой молекуле равна сумме отрицательных зарядов, поэтому будучи помещена в электрическое поле такая молекула не двигается.
Как известно, коагуляция белковых веществ наступает в изоэлектрической зоне и оптимальна в изоэлектрической точке или рядом с ней.
Кроме того, способ синтеза функционального белкового наноагента из молекул иммуноглобулинов, который характеризуется тем, что включает следующие стадии:
i) водный раствор иммуноглобулина с рН от 4,5 до 6,0 инкубируют в течение 30-300 секунд при температуре 60-70°С, при этом иммуноглобулин имеет конечную концентрацию не менее 1 мг/мл, получают суспензию А;
ii) полученную суспензию А обрабатывают ультразвуком в течение не более 30 секунд при комнатной температуре, получают суспензию В;
iii) полученную суспензию В смешивают с концентрированным раствором формальдегида до конечной концентрации формальдегида не более 0,1%, перемешивают и инкубируют в течение ночи при комнатной температуре, получают функциональный белковый наноагент в виде наночастиц;
iv) полученный функциональный белковый наноагент в виде наночастиц трижды промывают на центрифуге, 10000 g в течение 10 минут.
При этом, для целей маркировки функционального белкового наноагента в виде наночастиц на стадии iii) вместе с формальдегидом добавляют водный раствор эфира сульфо-цианина 3 NHS (Су3) с исходной концентрацией 10 мг/мл.
Кроме того, функциональному белковому наноагенту из молекул иммуноглобулинов, полученному упомянутым способом, для диагностики, при противораковой, противопухолевой или противомикробной терапии, тераностике, в качестве биосенсора, а также для биовизуализации, культивирования тканей организма.
Кроме того, тест-системе для диагностики, содержащей функциональный белковый наноагент из молекул иммуноглобулинов, полученный упомянутым способом.
Кроме того, способ применения функционального белкового наноагента из молекул иммуноглобулинов, полученного упомянутым способом, в медицинских изделиях.
Полученный функциональный белковый наноагент в виде наночастиц трижды промывают на центрифуге, 10000 g в течение 10 минут. Для маркировки наночастиц вместе с формальдегидом добавляют водный раствор эфира сульфо-цианина 3 NHS (Су3) с исходной концентрацией 10 мг/мл.
Далее мы демонстрируем одноэтапный, синтез наночастиц иммуноглобулина (IgNPs) с возможностью управлять размером синтеза. Такие наночастицы сохраняют специфичность родительских антител и нацелены на раковые клетки лиганд-зависимым образом. Мы демонстрируем биосовместимость наночастиц и их применимость in vivo.
Иммуноглобулины человека в водном растворе с рН, который ниже изоэлектрической точки белка, были кратковременно нагреты, охлаждены и стабилизированы. Наночастицы были относительно монодисперсными, гидродинамический диаметр составлял 84±8 нм, профиль распределения показан на фиг. 2. Мы выбрали рН 5,0 и время инкубации 1 мин в качестве сбалансированных условий. Однако время нагрева, а также рН повлияли на размер наночастиц (фиг. 3, 4). Таким образом, синтез контролировался по размеру. Кроме того, наночастицы продемонстрировали почти сферическую геометрию, согласно анализу SEM-изображения (растровый/ сканирующий электронный микроскоп) (фиг. 5). Мы измерили выход синтеза с помощью гравиметрического анализа - около 11% и анализа ВСА (бицинхониновая кислота) - около 15%. Мы предположили, что анализ ВСА завысил выход, такой эффект был продемонстрирован для наночастиц с низким содержанием сшитых белков. Наконец, STF является воспроизводимым синтезом, относительное стандартное отклонение гидродинамических диаметров было рассчитано как 10% (n=10). Наконец, мы изучили IgNPs с помощью анализа ELISA (иммуноферментный анализ) и обнаружили, что наночастицы все еще распознаются антивидовыми антителами (фиг. 6). Таким образом, мы пришли к выводу, что иммуноглобулины, образованные наночастицами, не были полностью денатурированы и, возможно, способны проявлять надлежащее сродство и специфичность.
Для изучения способности наночастиц взаимодействовать со специфическими лигандами мы синтезировали наночастицы (Т100- IgNPs), полученные из одобренного FDA трастузумаба моноклонального антитела против рецептора HER2/neu. Кроме того, мы синтезировали наночастицы, полученные из различных смесей иммуноглобулинов человека / трастузумаба (Т х -IgNPs, х - фракция трастузумаба, фиг.7).
Мы изучили взаимодействия Тх -IgNPs с клеточными линиями SKBR3 (сверхэкспрессия HER2/neu) и СНО (отрицательный контроль) с использованием визуализации проточной цитометрии (фиг. 8, 9). Скрининг показал, что даже Т10 -IgNP по-прежнему обладают высокой специфичностью. Этот результат показывает, что STF может быть применен для создания/ разработки наноагентов, нацеленных на многие лиганды, и позволяет сократить использование ключевых антитела. К счастью, на сегодняшний день многие терапевтические антитела клинически одобрены и коммерчески доступны, все они могут быть использованы для разработки специфически нацеленных наноагентов на основе иммуноглобулинов. Мы хотели бы отметить, что сыворотка пациентов может использоваться в качестве источника иммуноглобулинов. Такая стратегия может быть применена для разработки персонализированной наномедицины.
Нагретые белки теряют нативную кон формацию и имеют тенденцию к агрегации. Однако агрегация, вызванная денатурацией, может существенно не влиять на сродство иммуноглобулинов из-за различных температур денатурации домена. В частности, домен СН2 (часть области Fc) имеет значительно более низкую температуру перехода, чем домены области Fab. Кроме того, кислотные условия могут стабилизировать домены VH и VL (части области Fab). Авторы не видят препятствий для применения STF для создания наночастиц на основе других белков. Мы считаем, что белок должен иметь функциональный домен и, по крайней мере, один менее термостойкий домен, который становится «липким» при нагревании и может способствовать образованию наночастиц. Стоит отметить, что белок может быть тонко настроен с помощью подходов белковой инженерии. Оптимизированные или химерные белки могут образовывать наночастицы в особо мягких условиях.
Устойчивость синтеза IgNP можно количественно оценить с использованием проверенного десятилетиями показателя Е-фактор, который представляет собой отношение массы отходов к полученному продукту. Таким образом, чем меньше значение Е-фактора, тем больше устойчивым является процесс. Ожидается, что значения Е-фактора для синтеза наночастиц будут находиться в диапазоне от 102 до 106. Однако такие огромные значения Е-фактора относятся к методам изготовления нефункционализированных и нецелевых наночастиц, например, золота, кремнезема и т.д. В отличие от этого, STF демонстрирует чрезвычайно низкое воздействие на окружающую среду со значением коэффициента 16,9 (подробности расчета приведены во вспомогательной информации). Такое сравнение показывает, что STF является уникальным методом получения целевых наночастиц с крайне низким воздействием на окружающую среду.
Нагретые белки теряют нативную конформацию и имеют тенденцию к агрегации. Однако агрегация, вызванная денатурацией, может существенно не влиять на сродство иммуноглобулинов из-за различных температур денатурации домена. В частности, домен СН2 (часть области Fc) имеет значительно более низкую температуру перехода, чем домены области Fab. Кроме того, кислотные условия могут стабилизировать домены VH и VL (части области Fab). Нет препятствий для применения STF для создания наночастиц на основе других белков. В одном воплощении, белок имеет функциональный домен и, по крайней мере, один менее термостойкий домен, который становится «липким» при нагревании и может способствовать образованию наночастиц. Белок может быть тонко настроен с помощью подходов белковой инженерии.
Быстрое термическое образование (STF) позволяет синтезировать наночастицы на основе иммуноглобулинов и контролировать их свойства. Наночастицы сохраняют сродство к фракциям иммуноглобулинов. Способ также может быть применим для синтеза гибридных наночастиц без дополнительных химических модификаций. Наноагенты специфическим образом взаимодействуют с рецепторами клеток, не обладают токсичностью и подходят для применения in vivo. Кроме того, мы предполагаем, что STF позволяет синтезировать наночастицы из материалов пациентов и это может стать прорывом в области персонализированной медицины. Рассчитанный Е-фактор доказывает, что STF оказывает впечатляюще низкое воздействие на окружающую среду по сравнению с современными технологиями синтеза наноматериалов. Таким образом, STF является перспективной и экологически чистой синтетической стратегией, которая может применяться во многих биомедицинских областях благодаря своей гибкости и биобезопасность.
Устойчивость синтеза IgNP можно количественно оценить с использованием проверенного десятилетиями показателя Е-фактор, который представляет собой отношение массы отходов к полученному продукту. Таким образом, чем меньше значение Е-фактора, тем больше устойчивым является процесс. Ожидается, что значения Е-фактора для синтеза наночастиц будут находиться в диапазоне от 102 до 106. Однако такие огромные значения Е-фактора относятся к методам изготовления нефункционализированных и нецелевых наночастиц, например, золота, кремнезема и т.д. В отличие от этого, STF демонстрирует чрезвычайно низкое воздействие на окружающую среду со значением коэффициента 16,9. Подробности расчета приведены во вспомогательной информации. Такое сравнение показывает, что STF является уникальным методом получения целевых наночастиц с крайне низким воздействием на окружающую среду.
Далее настоящее изобретение будет подробно описано в сочетании со следующими примерами, чтобы специалисты в данной области могли лучше понять настоящее изобретение, при этом, настоящее изобретение не ограничивается следующими примерами.
Пример 1. Синтез белковых наночастиц из молекул иммуноглобулинов.
50 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 100 мкл воды MilliQ и 50 мкл диализированного раствора иммуноглобулина с концентрацией 20 мг/мл смешивали в 0,6 мл микроцентрифужной пробирке. Пробирку вставлялась в гнездо предварительно нагретого термовибратора TS-100 (Biosan, Латвия) при температуре 98°С и инкубировали в течение 60 с. Затем пробирку обрабатывали ультразвуком в течение 10 с при комнатной температуре в ультразвуковой ванне (35 кГц, 40 Вт, SONOREX RK 31, Bandelin, Германия). Затем в пробирку добавляли 1,6 мкл 37%-ного раствора формальдегида, перемешивали и инкубировали в течение ночи на ротаторе при комнатной температуре. Наконец, наночастицы трижды центрифугировали (5 мин, 10000 g) и промывали водой MilliQ.
Иммуноглобулины человека в водном растворе с рН, который ниже изоэлектрической точки белка, были кратковременно нагреты, охлаждены и стабилизированы. Наночастицы были относительно монодисперсными, гидродинамический диаметр составлял 84±8 нм, профиль распределения показан на фиг. 2. Мы выбрали рН от 4,5 до 6,0 и время инкубации 1 мин в качестве сбалансированных условий. Однако время нагрева, а также рН повлияли на размер наночастиц (фиг. 3, 4). Таким образом, синтез контролировался по размеру. Кроме того, наночастицы продемонстрировали почти сферическую геометрию, согласно анализу SEM-изображения (растровый/ сканирующий электронный микроскоп) на фиг. 6. Мы измерили выход синтеза с помощью гравиметрического анализа (около 11%) и анализа ВСА (бицинхониновая кислота) (около 15%). Мы предположили, что анализ ВСА завысил выход, такой эффект был продемонстрирован для наночастиц с низким содержанием сшитых белков. Наконец, STF является воспроизводимым синтезом, относительное стандартное отклонение гидродинамических диаметров было рассчитано как 10% (n=10). Наконец, мы изучили IgNPs с помощью ELISA (иммуноферментный анализ) и обнаружили, что наночастицы все еще распознаются антивидовыми антителами (фиг. 6). Таким образом, мы пришли к выводу, что иммуноглобулины, образованные наночастицами, не были полностью денатурированы и, возможно, способны проявлять надлежащее сродство и специфичность.
Пример 2. Маркировка наночастиц флуорофором.
Синтезировали частицы как в Примере 1, но вместе с формальдегидом добавляли 1,2 мкл 10 мг/мл водного раствора эфира сульфо-цианин 3 NHS (Су3).
Пример 3. Синтез белковых наночастиц из молекул гамма-иммуноглобулинов человека.
50 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 100 мкл воды MilliQ и 50 мкл диализированного раствора гамма-иммуноглобулина человека с концентрацией 20 мг/мл смешивали в 0,6 мл микроцентрифужной пробирке. Пробирку вставлялась в гнездо предварительно нагретого термовибратора TS-100 (Biosan, Латвия) при температуре 98°С и инкубировали в течение 60 с. Затем пробирку обрабатывали ультразвуком в течение 10 с при комнатной температуре в ультразвуковой ванне (35 кГц, 40 Вт, SONOREX RK 31, Bandelin, Германия). Затем в пробирку добавляли 1,6 мкл 37%-ного раствора формальдегида, перемешивали и инкубировали в течение ночи на ротаторе при комнатной температуре. Наконец, наночастицы трижды центрифугировали (5 мин, 10000 g) и промывали водой MilliQ.
Пример 4. Синтез белковых наночастиц из трастузумаба.
Для синтеза 100%) наночастиц трастузумаба, проводят синтез как в Примере 3, со следующими компонентами: 100 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 50 мкл воды MilliQ и 50 мкл диализованного раствора трастузумаба с концентрацией 20 мг/мл.
Кроме того, мы синтезировали наночастицы, полученные из различных смесей иммуноглобулинов человека/трастузумаба (Tx-IgNPs, х - фракция трастузумаба, фиг. 7).
Пример 5. Синтез белковых наночастиц из гамма-иммуноглобулинов мыши.
Для синтеза белковых наночастиц из гамма-иммуноглобулинов мыши, проводят синтез как в Примере 3, со следующими компонентами: 100 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 50 мкл воды MilliQ и 50 мкл диализованного раствора гамма-иммуноглобулинов мыши с концентрацией 10-50 мг/мл.
Пример 6. Синтез белковых наночастиц из ритуксимаба.
Для синтеза белковых наночастиц из ритуксимаба, проводят синтез как в Примере 3, со следующими компонентами: 100 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 50 мкл воды MilliQ и 50 мкл диализованного раствора ритуксимаба с концентрацией 10-50 мг/мл.
Кроме того, мы синтезировали наночастицы, полученные из различных смесей иммуноглобулинов человека/ритуксимаб (Rx-IgNPs, х - фракция ритуксимаба).
Пример 7. Синтез белковых наночастиц из гамма-иммуноглобулинов человека, нагруженных доксорубицином.
Проводят синтез как в Примере 3, со следующими компонентами: 90 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 50 мкл воды MilliQ и 50 мкл диализованного раствора гамма-иммуноглобулинов человека с концентрацией 10-50 мг/мл, и 10 мкл раствора доксорубицина в концентрации 1-10 г/л..
Пример 8. Синтез белковых наночастиц из гамма-иммуноглобулинов человека, нагруженных флуорофором - нильским красным.
Проводят синтез как в Примере 3, со следующими компонентами: 90 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 50 мкл воды MilliQ и 50 мкл диализованного раствора гамма-иммуноглобулинов человека с концентрацией 10-50 мг/мл, и 10 мкл раствора нильского красного в концентрации 1-10 г/л.
Пример 9. Синтез белковых наночастиц из гамма-иммуноглобулинов человека, нагруженных нильским красным.
Проводят синтез как в Примере 3, со следующими компонентами: 90 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 50 мкл воды MilliQ и 50 мкл диализованного раствора гамма-иммуноглобулинов человека с концентрацией 10-50 мг/мл, и 10 мкл раствора нильского красного в ДМСО в концентрации 0.1-1 г/л.
Пример 10. Синтез белковых наночастиц из гамма-иммуноглобулинов человека без кросс-линкера.
50 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 100 мкл воды MilliQ и 50 мкл диализированного раствора гамма-иммуноглобулина человека с концентрацией 20 мг/мл смешивали в 0,6 мл микроцентрифужной пробирке. Пробирку вставлялась в гнездо предварительно нагретого термовибратора TS-100 (Biosan, Латвия) при температуре 98°С и инкубировали в течение 60 с. Затем пробирку обрабатывали ультразвуком в течение 10 с при комнатной температуре в ультразвуковой ванне (35 кГц, 40 Вт, SONOREX RK 31, Bandelin, Германия).
Пример 11. Синтез белковых наночастиц из молекул гамма-иммуноглобулинов человека, кросс-сшитого диглицедиловым эфиром ПЭГ.
50 мкл 0,1 М ацетатного буфера (рН от 4,5 до 6,0), 100 мкл воды MilliQ и 50 мкл диализированного раствора гамма-иммуноглобулина человека с концентрацией 20 мг/мл смешивали в 0,6 мл микроцентрифужной пробирке. Пробирку вставлялась в гнездо предварительно нагретого термовибратора TS-100 (Biosan, Латвия) при температуре 98°С и инкубировали в течение 60 с. Затем пробирку обрабатывали ультразвуком в течение 10 с при комнатной температуре в ультразвуковой ванне (35 кГц, 40 Вт, SONOREX RK 31, Bandelin, Германия). Затем в пробирку добавляли 30 мкл 1%-ного раствора диглицедилового эфира ПЭГ, перемешивали и инкубировали в течение ночи на ротаторе при комнатной температуре. Наконец, наночастицы трижды центрифугировали (5 мин, 10000 g) и промывали водой MilliQ.
Пример 12. Направленных таргетинг клеток-мишеней наночастицами из трастузумаба.
Было изучено взаимодействие белковых наночастиц из Примера 4 - Тх -IgNPs с клеточными линиями SKBR3 (сверхэкспрессия HER2/neu) и СНО (отрицательный контроль) с использованием визуализации проточной цитометрии (фиг. 8, 9). Скрининг показал, что даже Т10-IgNP по-прежнему обладают высокой специфичностью. Этот результат показывает, что STF может быть применен для создания/ разработки наноагентов, нацеленных на многие лиганды, и позволяет сократить использование ключевых антитела. На сегодняшний день многие терапевтические антитела клинически одобрены и коммерчески доступны, все они могут быть использованы для разработки специфически нацеленных наноагентов на основе иммуноглобулинов. Сыворотка пациентов может также использоваться в качестве источника иммуноглобулинов. Такая стратегия может быть применена для разработки персонализированной наномедицины.
Пример 13. Изучение влияния введения белковых наночастиц из иммуноглобулинов на параметры крови.
Синтезированные наночастицы из Примеров 1-3 внутривенно вводят мышам BALB/c в дозе 300 мкг/мышь. Спустя 1-24 ч. проводят забор крови и анализируют на основные параметры токсичности. Уровни активности лактатдегидрогеназы, количество эритроцитов, концентрация гемоглобина, средняя корпускулярная концентрация гемоглобина и гематокрита находятся в пределах нормы BALB/c. Изменения в количестве лейкоцитов и моноцитов незначительны и менее чем на 15% превышает верхние пределы нормальных уровней.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ синтеза стабилизированных магнитных наноагентов | 2021 |
|
RU2838141C2 |
| Способ синтеза трансфецирующего наноагента для генотерапевтических применений (варианты) | 2021 |
|
RU2838201C1 |
| Способ биоимиджинга | 2023 |
|
RU2838135C1 |
| Способ проведения микроскопического анализа клеточного образца | 2023 |
|
RU2835203C1 |
| Способ синтеза функциональных углеродных квантовых точек | 2023 |
|
RU2824005C1 |
| Способ проведения цитометрического анализа образца | 2023 |
|
RU2835213C1 |
| Способ доставки нуклеиновой кислоты в клетку | 2023 |
|
RU2835201C1 |
| Способ конкурентного иммуноферментного анализа для детекции аналита в образце с помощью мультимодальных наночастиц | 2023 |
|
RU2836697C1 |
| Способ детекции аналита в образце с помощью иммунохроматографии | 2023 |
|
RU2835200C1 |
| МАГНИТНЫЕ НАНОЧАСТИЦЫ, ФУНКЦИОНАЛИЗИРОВАННЫЕ ПИРОКАТЕХИНОМ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2015 |
|
RU2687497C2 |
Настоящее изобретение относится к области биотехнологии. Изобретение раскрывает новый способ получения белковых наночастиц из молекул иммуноглобулинов (STF, Swift Thermal Formation), основанный на быстром кратковременном нагреве водного раствора иммуноглобулина до температуры 50-99°С и обработке его ультразвуком с последующим добавлением раствора кросс-линкера для обеспечения стабильности наночастиц. Антитела в составе полученных согласно настоящему изобретению белковых наночастиц сохраняют свою способность специфично связываться с соответствующим антигеном. Изобретение также может быть применимо в различных областях медицины при получении наноформ лекарственных препаратов. 32 з.п. ф-лы, 9 ил., 13 пр.
1. Способ получения белковых наночастиц из молекул иммуноглобулинов млекопитающих, включающий по крайней мере следующие стадии:
i) водный раствор иммуноглобулина в концентрации не менее 0.1 мг/мл с рН от 4,5 до 6,5 нагревают до температуры 50-99°С в течении нескольких минут с последующей обработкой ультразвуком в течении нескольких секунд для получения начальной суспензии;
ii) в полученную начальную суспензию добавляют раствор низкомолекулярного кросс-линкера, обеспечивающий стабильность наночастиц.
2. Способ по п. 1, в котором после шага добавления кросс-линкера, полученные кросс-сшитые белковые наночастицы промывают на центрифуге, удаляя несвязанные молекулы кросс-линкера.
3. Способ по п. 1, в котором упомянутый иммуноглобулин является гамма-иммуноглобулином.
4. Способ по п. 1, в котором упомянутый иммуноглобулин является смесью нескольких гамма-иммуноглобулинов.
5. Способ по п. 1, в котором упомянутый иммуноглобулин включает в себя антитело против молекулярной или клеточной мишени.
6. Способ по п. 1, в котором не более 10% упомянутого иммуноглобулина является упомянутым антителом против молекулярной или клеточной мишени.
7. Способ по п. 1, в котором не менее 5% упомянутого иммуноглобулина является упомянутым антителом против молекулярной или клеточной мишени.
8. Способ по п. 1, в котором упомянутый иммуноглобулин включает в себя противоопухолевое антитело.
9. Способ по п. 1, в котором упомянутый иммуноглобулин включает в себя антитело против молекулярной или клеточной мишени.
10. Способ по п. 1, в котором, после между шагами нагревания и добавления кросс-линкера, полученную начальную суспензию обрабатывают ультразвуком.
11. Способ по п. 1, в котором после упомянутого нагрева упомянутую суспензию остужают до комнатной температуры с помощью метода активного охлаждения.
12. Способ по п. 1, в котором упомянутый раствор иммуноглобулина имеет рН от 4.5 до 6.0.
13. Способ по п. 1, в котором упомянутый раствор иммуноглобулина имеет рН меньший значения изоэлектрической точки иммуноглобулина на от 0.1 до 1.
14. Способ по п. 1, в котором упомянутый раствор иммуноглобулина имеет рН больший значения изоэлектрической точки иммуноглобулина на от 0.1 до 1.
15. Способ по п. 1, в котором упомянутое нагревание проводят от 50 до 55 градусов.
16. Способ по п. 1, в котором упомянутое нагревание проводят от 55 до 75 градусов.
17. Способ по п. 1, в котором упомянутое нагревание проводят от 75 до 95 градусов.
18. Способ по п. 1, в котором упомянутое нагревание проводят в течение от 30 секунд до 3 минут.
19. Способ по п. 1, в котором упомянутое нагревание проводят в течение от 3 секунд до 10 минут.
20. Способ по п. 1, в котором упомянутый кросс-линкер является формальдегидом, глутаральдегидом или диглицидиловым эфиром полиэтиленгликоля.
21. Способ по п. 1, в котором после упомянутого кратковременного нагрева смеси дополнительно проводят ее инкубацию с концентрированным раствором формальдегида при конечной концентрации формальдегида не более 0.1% в течение ночи при комнатной температуре.
22. Способ по п. 1, в котором для облегчения обнаружения наноагентов in vitro и in vivo на шаге смешения в смесь добавляют раствор флуорофора.
23. Способ по п. 1, в котором для облегчения обнаружения частиц in vitro и in vivo на шаге смешения в смесь добавляют водный раствор эфира флуорофора.
24. Способ по п. 1, в котором добавляют электролит для увеличения ионной силы раствора.
25. Способ по п. 1, в котором упомянутый электролит является хлоридом натрия.
26. Способ по п. 1, в котором концентрация упомянутого электролита в смеси не более 500 ммоль/л.
27. Способ по п. 1, в котором концентрация упомянутого электролита в смеси не менее 50 ммоль/л.
28. Способ по п. 1, в котором рН реакционной смеси от 3 до 7.
29. Способ по п. 1, в котором упомянутый белок имеет изоэлектрическую точку в диапазоне значений pI от 3 до 7.
30. Способ по п. 1, в котором упомянутый белок имеет изоэлектрическую точку в диапазоне значений pI от 7 до 11.
31. Способ по п. 1, в котором упомянутые белковые наночастицы имеют размер от 50 до 100 нм.
32. Способ по п. 1, в котором упомянутые белковые наночастицы имеют размер от 100 до 200 нм.
33. Способ по п. 1, в котором упомянутые белковые наночастица имеют размер от 200 до 400 нм.
| US 0010993994 B2, 04.05.2021 | |||
| СИСТЕМА-НОСИТЕЛЬ В ФОРМЕ НАНОЧАСТИЦ НА ОСНОВЕ ПРОТЕИНА ДЛЯ КЛЕТОЧНО-СПЕЦИФИЧЕСКОГО ОБОГАЩЕНИЯ ДЕЙСТВУЮЩИХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ | 2005 |
|
RU2388463C2 |
| CN 102048695 A, 11.05.2011 | |||
| WO 2017085740 A1, 26.05.2017 | |||
| СПОСОБ СИНТЕЗА ЖЕЛАТИНОВЫХ НАНОЧАСТИЦ | 2020 |
|
RU2751885C1 |
| LI F | |||
| et al.: "Controlled Release of Bevacizumab Through Nanospheres for Extended Treatment of Age-Related Macular Degeneration", Open Ophthalmol | |||
| J., 2012, v | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| LOHCHAROENKAL W | |||
| et al.: "Protein | |||
Авторы
Даты
2024-06-03—Публикация
2021-12-20—Подача