ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым твердым формам (2S,3S,4S,5R,6S)-3,4,5-тригидрокси-6-(((4aR,10aR)-7-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)тетрагидро-2Н-пиран-2-карбоновой кислоты, которая представляет собой соединение для применения в лечении нейродегенеративных заболеваний и нарушений, таких как болезнь Паркинсона.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Болезнь Паркинсона (PD) представляет собой распространенное нейродегенеративное нарушение, которое становится все более распространенным с возрастом и затрагивает от семи до десяти миллионов человек во всем мире. Болезнь Паркинсона является многогранным заболеванием, характеризующимся как моторными, так и немоторными симптомами. Моторные симптомы включают тремор в покое (дрожание), брадикинезию/акинезию (медлительность и скудность движений), мышечную ригидность, постуральную неустойчивость и дисфункцию походки; при этом немоторные симптомы включают нейропсихиатрические нарушения (например депрессию, психотические симптомы, тревожность, апатию, умеренное когнитивное нарушение и деменцию), а также вегетативные дисфункции и нарушения сна (Poewe et al., Nature Review, (2017) vol. 3, article 17013: 1-21).
Ключевой характерной особенностью патофизиологии болезни Паркинсона является потеря пигментированных дофаминергических нейронов в компактном слое черного вещества, который обеспечивает дофаминергическую иннервацию полосатого тела и других зон головного мозга. Такая прогрессирующая нейродегенерация приводит к уменьшению уровней дофамина в полосатом теле, что в конечном итоге вызывает ряд изменений межнейронных связей в базальных ганглиях, что в конечном итоге приводит к появлению четырех основных моторных признаков болезни Паркинсона. Основной мишенью дофамина в полосатом теле являются срединные шипиковые GABA-ергические нейроны (MSN), селективно экспрессирующие рецепторы D1 или D2, продолжающиеся в виде их топографических проекций. GABA-ергический MSN, проецирующийся во внешний отдел бледного шара, также называемый стриатопаллидалыным 'непрямым путем', экспрессирует рецепторы D2 (MSN-2); при этом GABA-ергический MSN, проецирующийся в ретикулярную часть черного вещества и внутренний отдел бледного шара, также называемый стриатонигральным "прямым путем", экспрессирует рецепторы D1 (MSN-1). Уменьшение количества дофамина вследствие потери нейронов приводит к несбалансированной активности двух путей, что приводит к заметному уменьшению на выходе таламической и кортикальной активности и, в конечном итоге, моторным дисфункциям (Gerfen et al., Science (1990) 250: 1429-32; Delong, (1990) Trends in Neuroscience 13: 281-5; Alexander et Crutcher, (1990) Trends in Neuroscience 13: 266-71; и для обзора Poewe et al., Nature Review (2017) vol. 3 article 17013: 1-21).
Наиболее эффективными терапевтическими стратегиями, доступными для пациентов, страдающих болезнью Паркинсона, и направленными на контроль моторных симптомов, в основном являются непрямые и прямые агонисты дофамина. Классическая и общепринятая стандартная схема лечения включает постоянный пероральный прием L-3,4-дигидроксифенилаланина (L-DOPA), который декарбоксилируется в головном мозге с образованием дофамина. Другие подходы заключаются во введении агонистов дофаминовых рецепторов, таких как апоморфин, который действует как на подтипы рецепторов D1, так и на подтипы рецепторов D2, или прамипексол, ропинирол и другие, которые преимущественно направлены на подтипы рецепторов D2. Оптимальное облегчение в отношении моторных симптомов обеспечивается с помощью применения как L-DOPA, так и апоморфина за счет активации ими как подтипов рецепторов D1, так и подтипов рецепторов D2 и целостного уравновешивания непрямых и прямых путей (т.е. агонисты D2 при этом способствуют устранению только дисфункции непрямого пути).
L-DOPA и апоморфин, характеризующиеся структурами, изображенными ниже, в настоящее время представляют собой наиболее эффективные лекарственные средства для лечения PD в клинической практике.
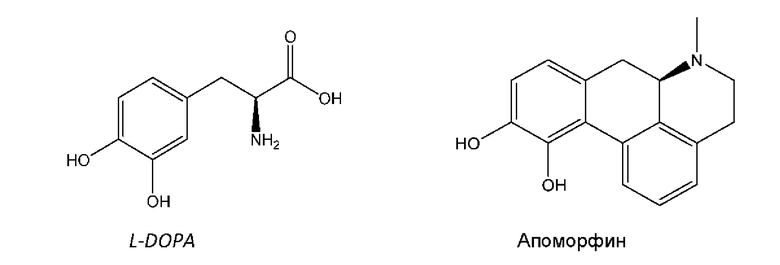
L-DOPA представляет собой пролекарство дофамина и остается наиболее эффективным лекарственным средством при лечении болезни Паркинсона с моторными симптомами. Однако после нескольких лет лечения (т.е. периода "медового месяца") возникают осложнения вследствие присущего заболеванию прогрессирования (т.е. длительной потери дофаминергических нейронов), а также плохого фармакокинетического (PK) профиля L-DOPA. Эти осложнения включают: 1) дискинезию, которая представляет собой ненормальные непроизвольные движения, возникающие во время оптимального "своевременного воздействия" препарата; и 2) отсутствие колебаний - периоды, в течение которых положительный эффект L-DOPA ослабевает и симптомы появляются повторно или ухудшаются (Sprenger and Poewe, CNS Drugs (2013), 27: 259-272).
Прямые агонисты дофаминовых рецепторов способны активировать ауторецепторы дофамина, а также постсинаптические дофаминовые рецепторы, расположенные на срединных шипиковых нейронах MSN-1 и MSN-2. Апоморфин относится к классу агонистов дофамина с 1,2-дигидроксибензольным (катехольным) фрагментом. В сочетании с фенетиламиновым мотивом, катехоламины часто обладают низкой пероральной биодоступностью или не обладают ей, как в случае с апоморфином. Апоморфин применяют в клинической терапии PD, хотя и с использованием непероральной доставки (как правило, посредством периодического подкожного введения или непрерывной парентеральной инфузии с помощью насоса в течение дня). В случае апоморфина исследования на животных показали, что трансдермальная доставка или доставка с помощью имплантатов могут обеспечивать возможные формы введения. Однако при исследовании доставки апоморфина из имплантатов у обезьян (Bibbiani et al., Chase Experimental Neurology (2005), 192: 73-78) было установлено, что в большинстве случаев животные должны были подвергаться лечению с помощью иммунодепрессанта дексаметазона для предупреждения местного раздражения и других осложнений после операции по имплантации. Были тщательно изучены альтернативные стратегии доставки для апоморфиновой терапии при PD, такие как ингаляционные и сублинизальные составы (см., например, Grosset et al., Acta Neurol Scand. (2013), 128:166-171 and Hauser et al., Movement Disorders (2016), Vol.32 (9): 1367-1372). Однако эти меры еще не применяются в клинической практике для лечения PD.
Альтернатива составам для неперорального применения на основе катехоламинов предусматривает применение пролекарства, обеспечивающего маскировку свободных гидроксильных групп катехола, чтобы обеспечить возможность перорального введения. Однако известной проблемой, связанной с разработкой пролекарств для клинического применения, являются трудности, связанные с прогнозированием превращения в исходное соединение в организме людей.
В литературе описаны различные пролекарства на основе сложных эфиров катехоламинов, такие как N-пропилнорапорфин с энтеросолюбильным покрытием (NPA) и монопивалоиловый сложный эфир апоморфина для доставки в двенадцатиперстную кишку (см., например, WO 02/100377) и D1-подобный агонист адроголид, пролекарство на основе диацетила А-86929 (Giardina and Williams; CNS Drug Reviews (2001), Vol.7 (3): 305-316). Адроголид подвергается активному метаболизированию при первичном прохождении через печень в организме человека после перорального введения дозы и вследствие этого обладает низкой пероральной биодоступностью (прибл. 4%). У пациентов с PD внутривенный (IV) адроголид имеет противопаркинсоническую эффективность, сравнимую с эффективностью L-DOPA (Giardina and Williams; CNS Drug Reviews (2001), Vol.7 (3): 305-316).
В дополнение к сложноэфирным пролекарствам на основе катехоламинов альтернативный подход к пролекарству включает защиту двух гидроксильных групп катехола в виде соответствующего производного метилендиокси или производного диацеталила. Этот принцип получения пролекарства был описан, например, в Campbell et al., Neuropharmacology (1982); 21(10): 953-961 и в US 4543256, WO 2009/026934 и WO 2009/026935.
Еще одним предлагаемым подходом для пролекарства на основе катехоламина является образование производного енона, как предложено, например, в WO 2001/078713 и в Liu et al., Bioorganic Med. Chem. (2008), 16: 3438-3444. Дополнительные примеры пролекарств на основе катехоламина см., например, в Sozio et al., Exp.Opin. Drug Disc. (2012); 7(5): 385-406.
Соединение (4aR,10aR)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6,7-диол, изображенное как соединение (I) ниже, раскрыто в WO 2009/026934. Транс-изомер был раскрыт ранее в Liu et al., J. Med. Chem. (2006), 49: 1494-1498 и затем в Liu et al., Bioorganic Med. Chem. (2008), 16: 3438-3444, включая фармакологические данные, указывающие на то, что соединение обладает низкой пероральной биодоступностью у крыс. Рацемат впервые был раскрыт в Cannon et al., J. Heterocyclic Chem. (1980); 17: 1633-1636.
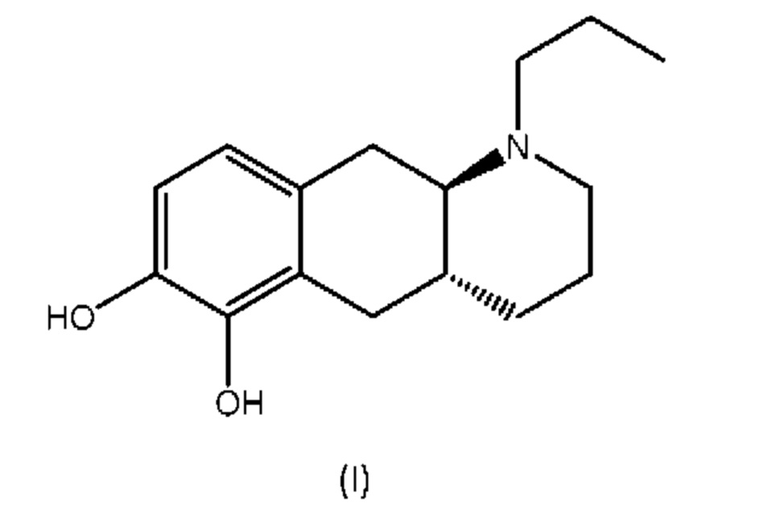
Соединение (I) является агонистом дофаминовых рецепторов со смешанной активностью в отношении D1 и D2. Три производных пролекарства на основе соединения (I) известны из уровня техники.
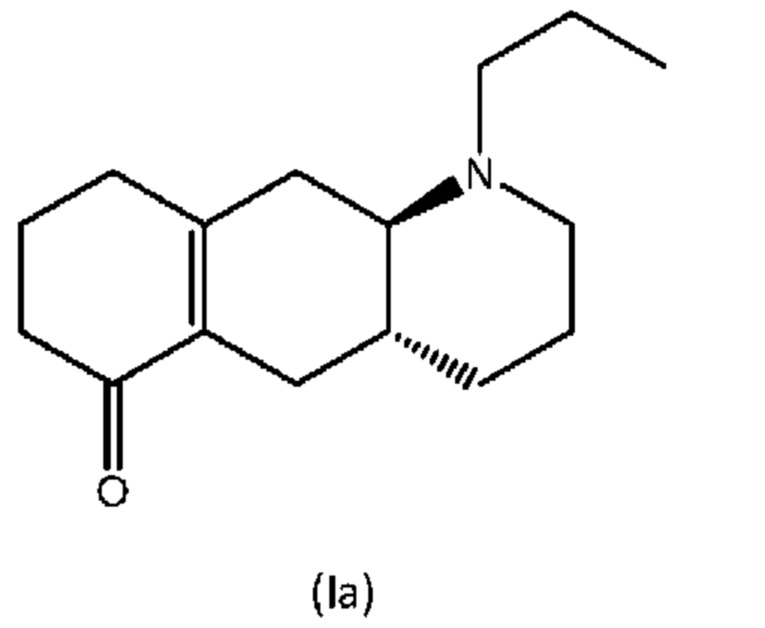
В Liu et al., J. Med. Chem. (2006), 49:1494-1498 и Liu et al., Bioorganic Med. Chem. (2008), 16: 3438-3444 раскрыто производное енона формулы (Ia), изображенной ниже, которое, как было показано, превращается в активное соединение (I) в организме крыс.
В WO 2009/026934 и WO 2009/026935 раскрыты два типа производных пролекарства на основе соединения (I), включая производное метилендиокси (MDO) с формулой (Ib) ниже:
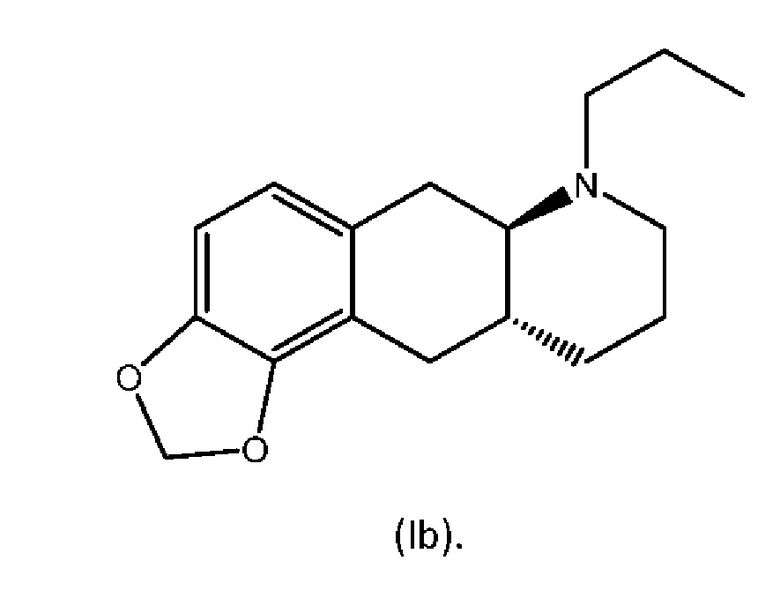
Превращение соединения (Ib) в соединение (I) в гепатоцитах крысы и человека было продемонстрировано в WO 2010/097092. Кроме того, фармакология in vivo соединений (Ia) и (Ib), а также активного "исходного соединения" (I) была протестирована на различных животных моделях, соответствующих болезни Паркинсона (WO 2010/097092). Было обнаружено, что как соединение (I), так и соединения (Ia) и (Ib) являются эффективными, что указывает на то, что соединения (Ia) и (Ib) превращаются in vivo в соединение (I). Сообщалось, что все три соединения характеризовались продолжительностью действия, которая была больше, чем наблюдаемая для L-dopa и апоморфина.
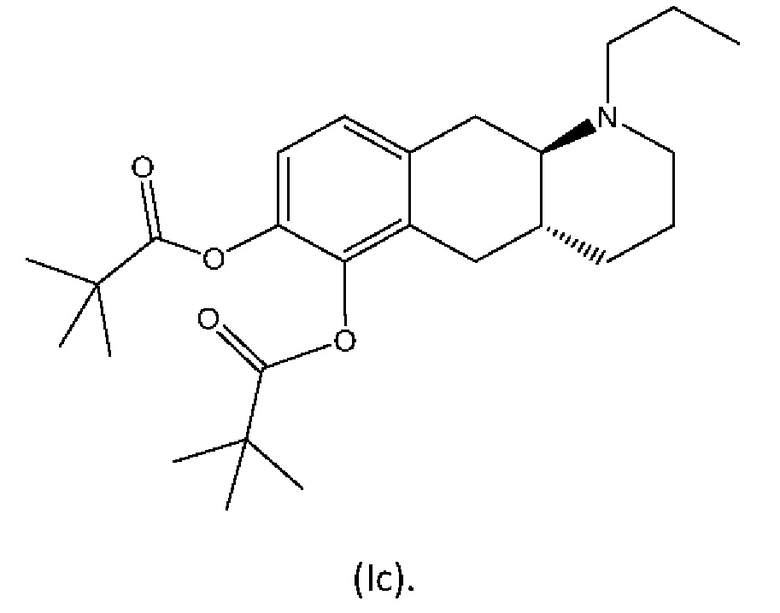
Другое пролекарство на основе соединения (I), описанное в WO 2009/026934 и WO 2009/026935, представляет собой пролекарство на основе сложных эфиров формулы (Ic):
Несмотря на долголетний интерес в данной области, очевидно, что по-прежнему существует неудовлетворенная потребность в разработке эффективных, хорошо переносимых и активных при пероральном применении лекарственных средств для лечения PD. Производное пролекарства смешанного D1/D2-агониста, характеризующееся стабильным PK-профилем, которое может обеспечить непрерывную дофаминергическую стимуляцию, может удовлетворить такие неудовлетворенные потребности.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
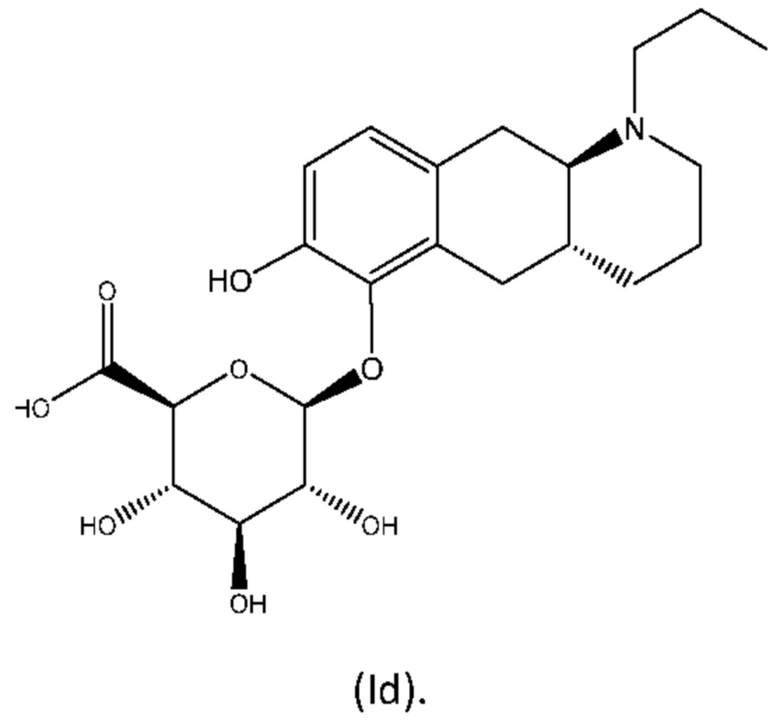
Авторы настоящего изобретения неожиданно обнаружили, что (2S,3S,4S,5R,6S)-3,4,5-тригидрокси-6-(((4aR,10aR)-7-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)тетрагидро-2Н-пиран-2-карбоновая кислота, соединение (Id), является преимущественным, поскольку тестирование in vivo и in vitro показало, что соединение отличается от пролекарств Ia, Ib и Ic, как продемонстрировано в примерах 6-10 данного документа. Кроме того, изобретатели дополнительно идентифицировали несколько новых твердых форм соединения формулы (Id), из которых особенно преимущественными являются гептагидрат цвиттер-иона, дигидрат цвиттер-иона и калиевая соль, как описано в примерах 1-5. Более конкретно, калиевая соль и дигидратная твердая форма цвиттер-иона соединения (Id), как было обнаружено, обладают преимущественной стабильностью (см. примеры 4 и 5). В частности, было показано, что дигидрат цвиттер-иона соединения (Id) является очень стабильным с точки зрения тестирования стабильности, водопоглощения и десорбции, а также физической стабильности после измельчения и прессования (см. примеры 4 и 5).
Настоящее изобретение относится к новым твердым формам (2S,3S,4S,5R,6S)-3,4,5-тригидрокси-6-(((4aR,10aR)-7-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)тетрагидро-2Н-пиран-2-карбоновой кислоты с формулой (Id) ниже:
Соответственно, изобретение относится к твердой форме соединения формулы (Id), где указанная твердая форма выбрана из:
a) формы цвиттер-иона соединения (Id);
b) соли щелочного металла соединения формулы (Id) и
c) галогенсодержащей соли соединения формулы (Id).
В конкретном варианте осуществления твердая форма является кристаллической. В другом конкретном варианте осуществления твердая форма является кристаллической и выбрана из группы, состоящей из твердых форм, перечисленных в таблице 2.
В конкретном варианте осуществления твердая форма соединения формулы (Id) представляет собой гептагидрат цвиттер-иона соединения (Id), дигидрат цвиттер-иона соединения (Id) или соль щелочного металла соединения формулы (Id), предпочтительно калиевая соль соединения формулы (Id). Предпочтительно, твердая форма соединения формулы (Id) представляет собой дигидрат цвиттер-иона соединения (Id), характеризующийся одним или несколькими пиками XRPD, перечисленными в группе (а) таблицы 2, или соль щелочного металла соединения формулы (Id), такую как калиевая соль соединения формулы (Id), например, такую как калиевая соль соединения формулы (Id), характеризующаяся одним или несколькими пиками XRPD, перечисленными в группе (а) таблицы 2.
В еще более конкретном варианте осуществления твердая форма соединения формулы (Id) представляет собой дигидратную твердую форму цвиттер-иона соединения формулы (Id) (DH1), характеризующуюся одним или несколькими пиками XRPD, перечисленными в группе (а) таблицы 2.
В одном варианте осуществления изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество твердой формы в соответствии с настоящим изобретением соединения формулы (Id) и одно или несколько фармацевтически приемлемых вспомогательных веществ.
В одном варианте осуществления изобретение относится к твердой форме в соответствии с настоящим изобретением соединения формулы (Id) для применения в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость.
В одном варианте осуществления изобретение относится к способу лечения нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость; при этом способ включает введение терапевтически эффективного количества твердой формы в соответствии с настоящим изобретением соединения формулы (Id).
В одном варианте осуществления изобретение относится к применению твердой формы соединения формулы (Id), как представлено в данном документе, в изготовлении лекарственного препарата для лечения нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или для лечения нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость.
ОПРЕДЕЛЕНИЯ
Пролекарство
В контексте настоящего изобретения термины "пролекарство" или "производное пролекарства" обозначают соединение, которое после введения живому субъекту, такому как млекопитающее, предпочтительно человек; превращается в организме в фармакологически активный фрагмент. Превращение предпочтительно происходит в организме млекопитающего, например в организме мыши, крысы, собаки, карликовой свиньи, кролика, обезьяны и/или человека. В настоящем контексте "пролекарство на основе соединения (4aR,10aR)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6,7-диол", или "пролекарство на основе соединения формулы (I)", или "пролекарство на основе соединения (I)" понимается как соединение, которое после введения превращается в организме в соединение (4aR,10aR)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6,7-диол. Указанное введение можно осуществлять любым традиционным путем введения фармацевтических композиций, известным из уровня техники, предпочтительно путем перорального введения.
В контексте настоящего изобретения термины "исходное соединение" и "исходная молекула" обозначают фармакологически активный фрагмент, полученный при превращении соответствующего пролекарства. Например, "исходное соединение" соединения формулы (Id) следует понимать как соединение формулы (I).
Фармакокинетические определения и сокращения
Используемый в данном документе термин "PK-профиль" является сокращением термина "фармакокинетический профиль". Фармакокинетические профили и фармакокинетические параметры, описанные в данном документе, основаны на данных зависимости концентрации в плазме от времени, полученных для соединения формулы (I) после перорального введения дозы соединения формулы (Id), с использованием некомпартментного моделирования. Сокращенными PK-параметрами являются: Cmax (максимальная концентрация); tmax (время до Cmax); t½ (период полувыведения); AUC 0-24 (площадь под кривой от времени введения дозы и через 24 часа после введения дозы) и "воздействие через 24 ч." представляет собой концентрацию в плазме, измеренную через 24 часа после введения дозы.
Терапевтически эффективное количество
В настоящем контексте термин "терапевтически эффективное количество" соединения или твердой формы соединения (Id) означает количество, достаточное для облегчения, остановки, частичной остановки, удаления или задержки проявлений, например, клинических проявлений данного заболевания и его осложнения при терапевтическом вмешательстве, включающем введение указанного соединения. Количество, достаточное для осуществления этого, определяется как "терапевтически эффективное количество". Эффективные количества для каждой цели будут зависеть, например, от тяжести заболевания или повреждения, а также от веса и общего состояния субъекта.
В контексте настоящего изобретения "терапевтически эффективное количество" соединения формулы (Id) или его твердой формы обозначает количество указанного соединения изобретения, способное обеспечить количество соединения (I), которое является достаточным для облегчения, остановки, частичной остановки, устранения или задержки клинических проявлений данного заболевания и его осложнений, когда указанное соединение по настоящему изобретению вводят, предпочтительно пероральным путем, млекопитающему, предпочтительно человеку.
Лечение и осуществление лечения
В контексте настоящего изобретения термины "лечение" или "осуществление лечения" предназначены для обозначения ведения пациента и ухода за ним с целью облегчения, остановки, частичной остановки, устранения или задержки развития клинического проявления заболевания. Пациентом, подлежащим лечению, предпочтительно является млекопитающее, в частности человек.
Состояния, подлежащие лечению
Твердые формы соединения (Id), полученные с помощью способа по настоящему изобретению, предназначены для лечения нейродегенеративных и нейропсихиатрических заболеваний и нарушений, таких как болезнь Паркинсона, и/или других состояний, при которых лечение агонистом дофамина является терапевтически полезным.
Терапевтические показания включают ряд нарушений центральной нервной системы, характеризующихся моторными и/или немоторными нарушениями и для которых компонентом лежащей в основе патофизиологии является дисфункция межнейронных связей, опосредованных полосатым телом. Такие функциональные нарушения можно наблюдать при нейродегенеративных заболеваниях, таких как без ограничения болезнь Паркинсона (PD), синдром беспокойных ног, болезнь Хантингтона и болезнь Альцгеймера, а также при нейропсихиатрических заболеваниях, таких как без ограничения шизофрения, синдром дефицита внимания с гиперактивностью и наркотическая зависимость.
В дополнение кнейродегенеративным заболеваниям и нарушениям существуют другие состояния, при которых увеличение дофаминергического обмена может быть благоприятным, связанные с улучшением психических функций, в том числе различных аспектов когнитивных функций. Это также может иметь положительный эффект у пациентов с депрессией, и это также можно использовать в лечении ожирения в качестве анорексигенного средства и в лечении наркотической зависимости. Это может обеспечить улучшение в случае минимальной мозговой дисфункции (MBD), нарколепсии, синдрома дефицита внимания с гиперактивностью и, возможно, негативных, позитивных, а также когнитивных симптомов шизофрении.
Синдром беспокойных ног (RLS) и синдром периодических движений конечностей (PLMD) являются альтернативными показаниями, которые клинически лечат агонистами дофамина. Кроме того, в случае импотенции, эректильной дисфункции, половой дисфункции, индуцированной SSRI, синдрома гиперстимуляции яичников (OHSS) и некоторых видов опухоли гипофиза (пролактиномы) также, вероятно, можно обеспечить улучшение путем лечения агонистами дофамина. Дофамин участвует в регуляции сердечно-сосудистой и мочевыделительной систем, и, соответственно, почечную недостаточность и гипертензию можно рассматривать как альтернативные показания для применения соединения формулы (Id) и его твердых форм.
Настоящее изобретение охватывает применение соединения формулы (Id), полученного с помощью способа по настоящему изобретению, для лечения перечисленных выше заболеваний и нарушений.
Пути введения
Фармацевтические композиции, содержащие твердую форму соединения формулы (Id) либо в виде единственного активного соединения, либо в комбинации с другим активным соединением, могут быть, в частности, составлены для введения любым подходящим путем, таким как пероральный, ректальный, назальный, трансбуккальный, сублингвальный, пульмональный, трансдермальный и парентеральный (например, подкожный, внутримышечный и внутривенный) пути. В контексте настоящего изобретения пероральный путь является предпочтительным путем введения.
Следует принять во внимание, что путь будет зависеть от общего состояния и возраста субъекта, подлежащего лечению, природы патологического состояния, подлежащего лечению, и активного ингредиента.
Фармацевтические составы и вспомогательные вещества
Далее термин "вспомогательное вещество" или "фармацевтически приемлемое вспомогательное вещество" относится к фармацевтическим вспомогательным веществам, в том числе без ограничения носителям, наполнителям, разбавителям, средствам против прилипания, связующим, покрытиям, красителям, разрыхлителям, ароматизаторам, веществам, улучшающим скольжение, смазывающим средствам, консервантам, сорбентам, подсластителям, растворителям, средам-носителям и вспомогательным средствам.
В настоящем изобретении также предусмотрена фармацевтическая композиция, содержащая твердые формы соединение формулы (Id), такое как одно из соединений, раскрытых в экспериментальном разделе данного документа. В настоящем изобретении также предусмотрен способ получения фармацевтической композиции, содержащей твердую форму соединения формулы (Id). Фармацевтические композиции в соответствии с настоящим изобретением можно составлять с фармацевтически приемлемыми вспомогательными веществами в соответствии с традиционным методиками, такими как раскрытые в Remington, "The Science and Practice of Pharmacy", 22-е изд. (2013), под редакцией Allen, Loyd V., Jr.
Фармацевтическая композиция, содержащая твердую форму соединения (Id) по настоящему изобретению, предпочтительно представляет собой фармацевтическую композицию для перорального введения. Фармацевтические композиции для перорального введения включают твердые пероральные лекарственные формы, такие как таблетки, капсулы, порошки и гранулы; и жидкие пероральные лекарственные формы, такие как растворы, эмульсии, суспензии и сиропы, а также порошки и гранулы для растворения или суспендирования в подходящей жидкости.
Твердые лекарственные формы для перорального применения могут быть представлены в виде отдельных единиц (например, таблеток или твердых или мягких капсул), каждая из которых содержит предварительно определенное количество активного ингредиента и предпочтительно одно или несколько подходящих вспомогательных веществ. При необходимости твердые лекарственные формы можно покрывать оболочкой разных типов, таких как энтеросолюбильные оболочки, или их можно составлять так, чтобы обеспечивать регулируемое высвобождение активного ингредиента, такое как замедленное или пролонгированное высвобождение, в соответствии со способами, хорошо известными из уровня техники. При необходимости твердая лекарственная форма может представлять собой лекарственную форму, распадающуюся под действием слюны, такую как, например, таблетка, диспергируемая в полости рта.
Примеры вспомогательных веществ, пригодных для перорального твердого состава, включают без ограничения микрокристаллическую целлюлозу, кукурузный крахмал, лактозу, маннит, повидон, кроскармеллозу натрия, сахарозу, циклодекстрин, тальк, желатин, пектин, стеарат магния, стеариновую кислоту и низшие алкиловые простые эфиры целлюлозы. Аналогичным образом, твердый состав может включать вспомогательные вещества для составов с замедленным или пролонгированным высвобождением, известные в области техники, такие как глицерилмоностеарат и гипромеллоза. Если для перорального введения применяют твердый материал, то состав можно получать, например, путем смешивания активного ингредиента с твердыми вспомогательными веществами, а затем прессования смеси в стандартной таблетирующей машине; или состав, например, в виде порошка, гранулы или мини таблетки, может быть помещен, например, в твердую капсулу. Количество твердого вспомогательного вещества в стандартной дозе будет существенно варьировать, но, как правило, будет находиться в пределах от приблизительно 25 мг до приблизительно 1 г.
Жидкие лекарственные формы для перорального применения могут быть представлены в виде, например, настоек, сиропов, капель для перорального применения или наполненных жидкостью капсул. Жидкие лекарственные формы для перорального применения также могут быть представлены в виде порошков для растворения или суспендирования в водной или неводной жидкости. Примеры вспомогательных веществ, пригодных для перорального жидкого состава, включают без ограничения этанол, пропиленгликоль, глицерин, полиэтиленгликоли, полоксамеры, сорбит, полисорбат, моно- и диглицериды, циклодекстрины, кокосовое масло, пальмовое масло и воду. Жидкие лекарственные формы для перорального применения можно получать, например, растворением или суспендированием активного ингредиента в водной или неводной жидкости, или путем включения активного ингредиента в жидкую эмульсию типа "масло-в-воде" или "вода-в-масле".
В твердых и жидких пероральных составах могут использоваться дополнительные вспомогательные вещества, такие как красители, вкусовые добавки и консерванты и т.п.
Фармацевтические композиции для парентерального введения включают стерильные водные и неводные растворы, дисперсии, суспензии или эмульсии для инъекции или вливания, концентраты для инъекции или вливания, а также стерильные порошки, подлежащие ресуспендированию в стерильных растворах или дисперсиях для инъекции или вливания перед применением. Примеры вспомогательных веществ, пригодных для парентерального состава, включают без ограничения воду, кокосовое масло, пальмовое масло и растворы циклодекстринов. Водные составы должны быть подходящим образом забуферены, если необходимо, и приведены в состояние изотоничности с помощью достаточного количества соляного раствора или глюкозы.
Другие типы фармацевтических композиций включают суппозитории, ингаляторы, кремы, гели, кожные пластыри, имплантаты и составы для трансбуккального или подъязычного введения.
Необходимо, чтобы вспомогательные вещества, используемые для любого фармацевтического состава, соответствовали предполагаемому пути введения и были совместимы с активными ингредиентами.
Дозы
В одном варианте осуществления твердые формы соединения (Id) по настоящему изобретению вводят в количестве от приблизительно 0,0001 мг/кг массы тела до приблизительно 5 мг/кг веса тела в день. В частности, ежедневная дозировка может находиться в диапазоне от 0,001 мг/кг массы тела до приблизительно 1 мг/кг массы тела в день. Точная дозировка будет зависеть от частоты и способа введения, пола, возраста, веса и общего состояния подлежащего лечению субъекта, природы и тяжести подлежащего лечению состояния и каких-либо сопутствующих подлежащих лечению заболеваний, предполагаемого эффекта лечения, а также других факторов, известных специалистам в данной области.
Типичная дозировка твердой формы соединения (Id) по настоящему изобретению для перорального введения взрослым будет находиться в диапазоне 0,01-100 мг/день, как например 0,05-50 мг/день, как например, 0,1-10 мг/день или 0,1-5 мг/день. Для удобства соединения по настоящему изобретению вводят в единичной лекарственной форме, содержащей указанные соединения в количестве от приблизительно 0,01 до 50 мг, как например, 0,05 мг, 0,1 мг, 0,2 мг, 0,5 мг, 1 мг, 5 мг, 10 мг, 15 мг, 20 мг или не более 50 мг соединения по настоящему изобретению.
Негигроскопичный
Используемый в данном документе термин "негигроскопичный" означает, что увеличение массы лекарственного вещества при относительной влажности от приблизительно 0 процента до 80 процентов составляет менее чем 0,2 процента.
Галогенсодержащая соль
Термин "галогенсодержащая соль", используемый в данном документе, означает галогенидную соль соединения (Id). Галогенидная соль представляет собой, например, гидрогалогенидную соль, такую как соль HBr или HCl.
XRPD
Термин "твердая форма, характеризующаяся пиками XRPD" или т.п. используется для обозначения твердой формы, которую можно идентифицировать посредством порошковой рентгеновской дифрактометрии, определяемой перечисленными пиками. В частности, пики, перечисленные в группе (а) таблицы 2 для каждой твердой формы, полезны для идентификации твердых форм по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1: РК-профили у крыс линии Wistar, полученные после перорального введения дозы в соответствии с примером 9. Профили получены на основе средних значений концентрации в плазме крови у 3 субъектов для каждого соединения. Ось X: время (часы); ось Y: Концентрация в плазме соединения (I) (пг/мл), полученная после введения доз следующих соединений λ: соединения (1а); π: соединения (Ib);  соединения (Id).
соединения (Id).
Фигуры 2 и 3: динамика двигательной активности (фигура 2) и общее пройденное расстояние (фигура 3) после лечения с помощью среды-носителя (H2O, р.о.) или соединения (Id) (10, 30, 100 или 300 мкг/кг, р.о.) и по сравнению с видами лечения с использованием стандартов лечения (SoC): апоморфин (АРО, 3 мг/кг, s.c), прамипексол (РРХ, 0,3 мг/кг, s.c). Животным вводили дозу при t=60 минут после 60 мин. периода привыкания в испытательных камерах, а затем контролировали активность в течение 350 минут. Данные оценивали с применением критерия Крускала-Уоллиса с тестом множественных сравнений Данна, в результате чего получали общее значение Р<0,0001.
Фигура 2. Ось X: время (мин.); ось Y: Пройденное расстояние (см) (SEM/5-минутные интервалы.
Фигура 3. Ось Y: общее пройденное расстояние (см) (SEM. Указаны уровни значимости для апостериорных сравнений (относительно группы, обработанной средой-носителем): *<0,05, **<0,01, ***<0,001, ****<0,0001.
Фигуры 4 и 5: взаимосвязь между концентрациями соединения (Id) и соединения (I) в плазме крови и гиперактивностью, вызванной соединением (Id) (100 мкг/кг, р.о.) (фигура 4), и соответствующая взаимосвязь между значениями концентрации в плазме крови апоморфина и гиперактивностью, вызванной апоморфином (3 мг/кг, s.c.) (фигура 5).
Ось X: время (мин.); ось Y слева: пройденное расстояние (см) (SEM/5-минутные интервалы; ось Y справа (фигура 4): концентрация соединения (I) в плазме (пг/мл); ось Y справа (фигура 5): концентрация апоморфина в плазме (нг/мл).
 пройденное расстояние (см),
пройденное расстояние (см),  - концентрация в плазме.
- концентрация в плазме.
Фигура 6. Превращение соединения (Id) в соединение (I) в гепатоцитах крысы (фигура 6а) и человека (фигура 6b); ось X: время (мин); ось Y: концентрация соединения (I) (пг/мл).
Фигура 7. Превращение соединения (Id) в цельной крови крысы (фигура 7а) и человека (фигура 7b).
Ось X: время (мин.); ось Y: концентрация соединения (I) (пг/мл).
Фигура 8. Характеристика дигидрата (DH1) соединения (Id) с помощью XRPD (фигура 8а) и TGA (фигура 8b).
Фигура 9. Характеристика ангидрата (АН1) соединения (Id) с помощью XRPD (фигура 9а) и TGA (фигура 9b).
Фигура 10. Характеристика гептагидрата соединения (Id) с помощью XRPD (фигура 10а) и TGA (фигура 10b).
Фигура 11. Характеристика формы А соединения (Id) с помощью XRPD.
Фигура 12. Характеристика формы В соединения (Id) с помощью XRPD.
Фигура 13. Характеристика формы С соединения (Id) с помощью XRPD.
Фигура 14. Характеристика моногидрата (МН1) соединения (Id) с помощью XRPD (фигура 14а) и TGA (фигура 14b).
Фигура 15. Характеристика калиевой соли соединения (Id) с помощью XRPD (фигура 15а) и TGA (фигура 15b).
Фигура 16. Характеристика натриевой соли формы 1 соединения (Id) с помощью XRPD (фигура 16а) и TGA (фигура 16b).
Фигура 17. Характеристика натриевой соли формы 2 соединения (Id) с помощью XRPD (фигура 17а) и TGA (фигура 17b).
Фигура 18. Характеристика гидрохлоридной соли соединения (Id) с помощью XRPD.
Фигура 19. Характеристика гидробромидной соли соединения (Id) с помощью XRPD.
Фигура 20. Характеристическая кривая DVS дигидрата DH1 цвиттер-иона соединения (Id). Ось X: время в минутах, ось Y слева: изменение в мас. % - сухой, ось Y справа: целевая относительная влажность в % Р/Ро. Тонкая пунктирная линия обозначает относительную влажность, которая увеличивалась и уменьшалась ступенчато от 5-10% RH (относительной влажности) до 5-90% RH и более широкая линия обозначает изменение массы дигидрата DH1 соединения (Id).
Фигура 21. Характеристическая кривая DVS калиевой соли соединения (Id). Ось X: время в минутах, ось Y слева: изменение в мас. % - сухой, ось Y справа: целевая относительная влажность в % Р/Ро. Тонкая пунктирная линия обозначает относительную влажность, которая увеличивалась и уменьшалась ступенчато, составляя 5-10% RH, и при этом более широкая линия обозначает изменение массы калиевой соли соединения (Id).
Порошковые рентгеновские дифрактограммы (XRPD) в соответствии с фигурами 8-19 измеряли на рентгеновском дифрактометре PANalytical X'Pert PRO с использованием излучения CuKα1 (λ=1,5406 Å). Образцы измеряли в режиме отражения в диапазоне 2θ 2-40 или 3-40 с использованием детектора X'celerator. Ось Y показывает интенсивность (количества), и ось X показывает углы 2θ(°).
Термогравиметрический анализ (TGA) в соответствии с фигурами 8, 9, 10, 14, 15, 16 и 17 измеряли с использованием прибора TA-instruments Discovery TGA. Образец 1-10 мг нагревали со скоростью 10°/мин. в открытой кастрюле в потоке азота. Ось X показывает температуру (°С), и ось Y показывает потерю веса (%).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым твердым формам соединения (2S,3S,4S,5R,6S)-3,4,5-тригидрокси-6-(((4aR,10aR)-7-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)тетрагидро-2Н-пиран-2-карбоновой кислоты формулы (Id) ниже и его солей:
Соединение формулы (Id) является пролекарством на основе (4aR,10aR)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6,7-диола [соединение (I)], которое является двойным агонистом D1/D2 сданными in vitro, перечисленными в таблице 7 из примера 8.
Авторы настоящего изобретения наблюдали, что соединение (I) конъюгировано в гепатоцитах крысы и человека с производными сульфата и глюкуронида, включая соединение (Id). Было показано, что конъюгаты превращаются в соединение (I) посредством конъюгации и деконъюгации в организме.
Известно, что глюкуронидные и сульфатные производные нестабильны в кишечнике. Производные образуются в виде высокополярных и растворимых метаболитов для облегчения элиминации соединений из организма и впоследствии легко выводятся из организма. Например, у крыс с канюлированным желчным протоком глюкуронидные и сульфатные конъюгаты часто обнаруживаются в желчи, тогда как их деконъюгат (т.е. исходное соединение) обнаруживается в фекалиях. Обратное превращение глюкуронидных и сульфатных конъюгатов в кишечнике в исходное соединение, которое затем время от времени реабсорбируется, известно как часть процесса кишечно-печеночной рециркуляции. Как упоминалось ранее, пероральное введение дозы фенэтилкатехоламинов, таких как апоморфин, в целом оказалось безрезультатным из-за их низкой биодоступности. Аналогично, соединение (I) имеет недостаток в виде низкой пероральной биодоступности (Liu et al., Bioorganic Med. Chem. (2008), 16: 3438-3444). Учитывая все вышеперечисленное и принимая во внимание нестабильность конъюгатов глюкуронида и сульфата в желудочно-кишечном тракте, не следует ожидать, что пероральное введение доз соединений по настоящему изобретению может использоваться для достижения достаточного воздействия соединения в плазме.
Принцип применения глюкуронидных производных в качестве пролекарств для пероральной доставки был исследован для ретиноевой кислоты (Goswami et al., J. Nutritional Biochem. (2003) 14: 703-709) и для морфина (Stain-Texier et al., Drug Metab. and Disposition (1998) 26 (5): 383-387). Оба исследования показали очень низкие уровни концентрации исходных соединений после перорального введения дозы производных. Другое исследование предполагает применение буденозид-β-D-глюкуронида в качестве пролекарства для местной доставки буденозида в толстый кишечник для лечения язвенного колита исходя из плохого всасывания пролекарства самого по себе из пищеварительной системы (Nolen et al., J. Pharm Sci. (1995), 84 (6): 677-681).
Тем не менее, неожиданно было обнаружено, что пероральное введение дозы соединения (Id), которое было идентифицировано как метаболит соединения (I) у крыс и минисвиней, обеспечивает системное воздействие соединения (I) в плазме, что предполагает полезность указанного соединения в качестве перорально активного пролекарства соединения (I).
Профиль соединения (I) в плазме крови, полученный в результате перорального введения дозы соединений (Ia) и (Ib) и соединения (Id) крысам Wistar в соответствии с примером 9, показан на фигуре 1. Для всех соединений дозы скорректировали по молекулярной массе до дозы, равной 300 мкг/кг соединения (Ib), соответствующей 287 мкг/кг соединения (I). Авторы настоящего изобретения обнаружили, что пероральное введение дозы соединений (Ia) и (Ib) крысам линии Wistar обеспечивает ранние и высокие пиковые концентрации соединения (I). Такие высокие пиковые концентрации у людей могут быть ассоциированы с дофаминергическими побочными эффектами, такими как, например, тошнота, рвота и головокружение. Напротив, введение дозы соединения (Id) приводит к более медленной скорости абсорбции, избегая быстрых пиковых концентраций, сопровождаемых длительным воздействием соединения (I) в плазме. Кроме того, концентрация в плазме крови соединения (I) у крыс линии Wistar сохраняется в течение 24 часов, хотя полученное значение AUC соединения (I), как правило, ниже, чем значение AUC, полученное после введения дозы соединения (Ib). Однако, поскольку пиковые концентрации соединения (I), которые, как ожидается, вызывают побочные эффекты, являются более низкими, то можно вводить более высокие дозы соединения (Id) для потенциально более высоких общих концентраций соединения (I) в плазме по сравнению с тем, что можно получить при введении доз соединений (Ia) и (Ib). При исследовании фармакокинетических свойств соединения (Ic) изобретатели обнаружили, что концентрации соединения (I) в плазме были чрезвычайно низкими, что делало соединение (Ic) непригодным в качестве пролекарства соединения (I) для перорального введения и подтверждало, что пероральная биодоступность, продемонстрированная для соединения формулы (Id), была очень непредсказуема. Параметры РК для исследований РК на крысах Wistar перечислены в таблице 8 из примера 9.
Превращение соединения (Id) в соединение (I) in vivo также наблюдалось после перорального введения дозы соединения (Id) минисвиньям.
Биоконверсия соединения (Id) у человека подтверждается экспериментами из примера 6, показывающими превращение в соединение формулы (I) в гепатоцитах крысы и человека и в крови крысы и человека (фигуры 6 и 7).
Таким образом, в заключение, соединение формулы (Id) полезно в качестве перорально активного пролекарства соединения (I), и, как наблюдали у крыс, оно обеспечивает профиль РК, избегая пика Cmax, наблюдаемого для известных пролекарств (Ia) и (Ib), и обеспечивает значительно более высокую AUC соединения (I), чем соединения (Ic).
Соединение (Id) дополнительно исследовали в анализе двигательной активности крыс в соответствии с примером 10. Анализ продемонстрировал дофаминергический эффект, полученный после перорального введения соединения (Id) c.f., фигуры 2, 3 и 4. Тот факт, что соединение формулы (Id) не обладает дофаминергической активностью in vitro, c.f., пример 7 и таблица 3, дополнительно указывает на то, что эффект соединения (Id) в анализе двигательной активности крыс достигается превращением соединения (Id) в соединение (I).
В заключение, важной проблемой, связанной с соединением (Ib) из уровня техники, является то, что данное соединение является агонистом рецептора 5-НТ2 В. Поскольку агонисты рецептора 5-НТ2 В связаны с патогенезом порока клапана сердца (VHD) после их длительного воздействия, такие соединения не подходят для применения в лечении хронических заболеваний (Rothman et al., Circulation (2000), 102: 2836-2841; and Cavero and Guillon, J. Pharmacol. Toxicol. Methods (2014), 69: 150-161). Таким образом, дополнительное преимущество соединений по настоящему изобретению состоит в том, что они не являются агонистами 5-НТ2 В c.f., пример 8 и таблица 7.
Соединение формулы (Id) полезно в лечении нейродегенеративных заболеваний и нарушений, таких как болезнь Паркинсона, и/или других состояний, для которых лечение агонистом дофамина является терапевтически полезным. Соединение, подходящее для перорального введения, может обеспечить новую парадигму лечения болезни Паркинсона.
В WO 2019101917 описано соединение (Id), способы получения соединения (Id) и применения соединения (Id).
Настоящее изобретение обеспечивает новые твердые формы соединения (Id).
Соединение формулы (Id) имеет три значения рКа, которые могут приводить к различным основным видам ионизации, как показано в таблице 1 ниже.
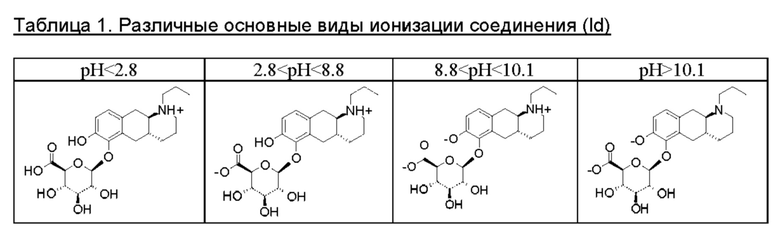
При физиологическом рН соединение существует в основном в форме цвиттер-иона. Настоящее изобретение включает семь твердых форм цвиттер-иона, которые были идентифицированы и охарактеризованы.
При низком рН кислотно-аддитивные соли могут быть образованы с неорганическими и/или органическими кислотами на атоме азота соединения (Id). Настоящее изобретение включает две кислотно-аддитивные соли, которые были идентифицированы и охарактеризованы. Это гидрохлоридная соль и гидробромидная соль.
При высоком рН основно-аддитивные соли могут образовываться с неорганическими и/или органическими основаниями на кислотных группах соединения формулы (Id). Настоящее изобретение включает две основно-аддитивные соли, которые были идентифицированы и охарактеризованы. Они представляют собой натриевую соль и калиевую соль.
Объем настоящего изобретения охватывает твердые формы соединения (Id), выбранные из твердых форм цвиттер-иона соединения (Id); соли щелочных металлов соединения формулы (Id) и галоген содержащие соли соединения формулы (Id). Твердые формы по настоящему изобретению включают гидратные и безводные формы и различные полиморфные формы.
Примеры твердых форм, охватываемых настоящим изобретением, и способ получения указанных форм кратко описаны ниже.
Дигидрат (DH1) цвиттер-иона соединения (Id), образованный кристаллизацией при комнатной температуре из смеси вода: EtOH, содержащей 10-30% об. воды, предпочтительно 15-20%.
Ангидрат (АН1) цвиттер-иона соединения (Id), полученный кристаллизацией при комнатной температуре из смесей вода: EtOH, содержащих 1-5% об. воды, или с помощью кристаллизации при температуре 37°С или выше из смесей вода: EtOH, содержащих 10% об. воды.
Гептагидрат (НН) цвиттер-иона соединения (Id), образованный кристаллизацией соединения (Id) из воды.
Формы А, В и С цвиттер-иона соединения (Id), при этом все формы представляют собой нестехиометрические гидраты. Форму А получали с помощью хранения НН при комнатной температуре и RH ~5%. Форму В получали с помощью хранения НН при комнатной температуре и RH ~10%. Форму С получали с помощью хранения НН при комнатной температуре и RH ~15%.
Моногидрат (МН1) цвиттер-иона соединения (Id). МН1 получали нагреванием DH1 до 105°С и последующей сорбцией воды в условиях окружающей среды. МН1 также может быть получен путем высушивания DH1 при комнатной температуре до 0% RH и последующей сорбции воды в условиях окружающей среды.
Калиевую соль соединения (Id), форму натриевой соли 1 и форму натриевой соли 2 соединения (Id) получали в соответствии с экспериментальным разделом в данном документе.
Гидрохлоридные и гидробромидные соли соединения (Id) получали в соответствии с экспериментальным разделом в данном документе.
В одном конкретном варианте осуществления твердые формы, представленные в настоящем изобретении, представляют собой кристаллические формы.
В одном варианте осуществления настоящее изобретение предусматривает твердые формы, которые при анализе с помощью XRPD демонстрируют по меньшей мере один пик XRPD, как показано на фигуре 8-19 или включено в таблицу 2. В одном конкретном варианте осуществления каждая из указанных твердых форм при анализе с помощью XRPD демонстрирует соответственно по меньшей мере 5 или больше пиков углов 2θ включенных в таблицу 2, для каждой конкретной формы ±0,2° 2θ, как например, по меньшей мере 5-10 пиков, например, 6, 7, 8 или 9 пиков углов 2θ, включенных в таблицу 2, для каждой конкретной формы ± 0,2° 2θ, или, как например, по меньшей мере 10-15 пиков, например, 11, 12, 13 или 14 пиков углов 2θ, включенных в таблицу 2±0,2° 2θ, для каждой конкретной формы.
В дополнительном конкретном варианте осуществления каждая из указанных твердых форм характеризуется соответственно по меньшей мере 5 или больше пиками углов 2θ, включенными в таблицу 2, для каждой конкретной формы ±0,2° 2θ, как например, по меньшей мере 5-10 пиками, например, 6, 7, 8 или 9 пиками углов 2θ, включенными в таблицу 2, для каждой конкретной формы ±0,2° 2θ, или, как например, по меньшей мере 10-15 пиками, например, 11, 12, 13 или 14 пиками углов 2θ, включенными в таблицу 2 ±0,2° 2θ, для каждой конкретной формы.
В другом более конкретном варианте осуществления каждая из указанных твердых форм при анализе с помощью XRPD демонстрирует соответственно по меньшей мере 5 или больше пиков углов 2θ, включенных в таблицу 2, для каждой конкретной формы ±0,1° 2θ, как например, по меньшей мере 5-10 пиков, например, 6, 7, 8 или 9 пиков углов 2θ, включенных в таблицу 2, для каждой конкретной формы ±0,1° 2θ, или, как например, по меньшей мере 10-15 пиков, например, 11, 12, 13 или 14 пиков углов 2θ, включенных в таблицу 2 ±0,1° 2θ, для каждой конкретной формы.
В дополнительном конкретном варианте осуществления каждая из указанных твердых форм характеризуется соответственно по меньшей мере 5 или больше пиками углов 2θ, включенными в таблицу 2, для каждой конкретной формы ±0,2° 2θ, как например, по меньшей мере 5-10 пиками, например, 6, 7, 8 или 9 пиками углов 2θ включенными в таблицу 2, для каждой конкретной формы ±0,1° 2θ, или, как например, по меньшей мере 10-15 пиками, например, 11, 12, 13 или 14 пиками углов 2θ, включенными в таблицу 2 ±0,1° 2θ, для каждой конкретной формы.
В одном варианте осуществления настоящее изобретение предусматривает твердые формы по настоящему изобретению с XRPD, как показано на фигурах 8-19.
В одном варианте осуществления твердые формы по настоящему изобретению находятся в очищенной форме. Термин "очищенная форма" предназначен для обозначения того, что твердая форма по сути свободна от других соединений или других форм того же соединения, в зависимости от обстоятельств.
В одном конкретном варианте осуществления твердая форма по настоящему изобретению представляет собой очищенную форму гептагидрата цвиттер-иона соединения (Id), дигидрата цвиттер-иона соединения (Id) или соль щелочного металла соединения формулы (Id), предпочтительна калиевую соль соединения формулы (Id).
В еще более конкретном варианте осуществления настоящего изобретения твердая форма представляет собой очищенную форму дигидрата цвиттер-иона соединения (Id).
Способы получения приведенных в качестве примеров твердых форм приведены в экспериментальном разделе.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Раскрыты следующие варианты осуществления настоящего изобретения. Первый вариант осуществления обозначен Е1, второй вариант осуществления обозначен Е2 и т.д.
Е1. Твердая форма соединения формулы (Id),
где указанная твердая форма выбрана из:
a) твердой формы цвиттер-иона соединения (Id);
b) соли щелочного металла соединения формулы (Id) и
c) галогенсодержащей соли соединения формулы (Id).
Е2. Твердая форма согласно варианту осуществления 1, где указанная твердая форма представляет собой а) твердую форму цвиттер-иона соединения (Id).
Е3. Твердая форма согласно любому из вариантов осуществления 1-2, где указанная твердая форма представляет собой дигидрат (DH1) цвиттер-иона соединения (Id).
Е4. Твердая форма согласно варианту осуществления 3, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 10,4, 11,6, 12,3, 13,1, 13,6, 14,3, 15,6, 16,0, 16,8 и 18,5°.
Е5. Твердая форма согласно любому из вариантов осуществления 3-4, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 12,3, 13,1,13,6, 16,0, 16,8, 18,5, 18,9, 19,4, 20,5, 21,4, 23,5, 24,7, 25,4, 26,9 и 28,7°.
Е6. Твердая форма согласно любому из вариантов осуществления 3-5, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 8а.
Е7. Твердая форма согласно любому из вариантов осуществления 1-2, где указанная твердая форма представляет собой ангидрат цвиттер-иона соединения (Id).
Е8. Твердая форма согласно любому из вариантов осуществления 1-2 и 7, где указанная твердая форма представляет собой ангидрат (АН1) цвиттер-иона соединения (Id).
Е9. Твердая форма согласно варианту осуществления 8, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 8,5, 11,1, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0 и 21,2°.
Е10. Твердая форма согласно любому из вариантов осуществления 8-9, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 8,5, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0, 21,2, 21,5, 22.2, 23,0, 24,2, 27,3 и 28,3°.
Е11. Твердая форма согласно любому из вариантов осуществления 8-10, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 9а.
Е12. Твердая форма согласно любому из вариантов осуществления 1-2, где указанная твердая форма представляет собой гептагидрат (НН) цвиттер-иона соединения (Id).
Е13. Твердая форма согласно варианту осуществления 12, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 13,4, 14,0, 14,5, 17,0 и 17,4°.
Е14. Твердая форма согласно любому из вариантов осуществления 12-13, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 14,0, 17,0, 22,2, 25,9, 27,3, 28.3, 30,8, 34,0, 34,8 и 35,2°.
Е15. Твердая форма согласно любому из вариантов осуществления 12-14, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 10а.
Е16. Твердая форма согласно любому из вариантов осуществления 1-2, где указанная твердая форма представляет собой форму А цвиттер-иона соединения (Id).
Е17. Твердая форма согласно варианту осуществления 16, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 7,6, 9,5, 10,0, 11,2, 12,0, 14,3, 14,6, 15,3, 15,5 и 19,3°.
Е18. Твердая форма согласно любому из вариантов осуществления 16-17, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 7,6, 9,5, 10,0, 11,2, 12,0, 14,3, 14,6, 15,3, 15,5, 18,7, 19,3, 23,9, 28,8, 33,7 и 38,7°.
Е19. Твердая форма согласно любому из вариантов осуществления 16-18, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 11.
Е20. Твердая форма согласно любому из вариантов осуществления 1-2, где указанная твердая форма представляет собой форму В цвиттер-иона соединения (Id).
Е21. Твердая форма согласно варианту осуществления 20, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 7,6, 9,0, 10,9, 12,3, 14,3, 15,0, 21,5, 22,1, 22,6 и 23,7°.
Е22. Твердая форма согласно любому из вариантов осуществления 20-21, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 12.
Е23. Твердая форма согласно любому из вариантов осуществления 1-2, где указанная твердая форма представляет собой форму С цвиттер-иона соединения (Id).
Е24. Твердая форма согласно варианту осуществления 23, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ:7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5 и 20,6°.
Е25. Твердая форма согласно любому из вариантов осуществления 23-24, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5, 20,6, 21,6, 22,9, 23,1, 24,0 и 25,4°.
Е26. Твердая форма согласно любому из вариантов осуществления 23-25, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 13.
Е27. Твердая форма согласно любому из вариантов осуществления 1-2, где указанная твердая форма представляет собой моногидрат (МН1) цвиттер-иона соединения (Id).
Е29. Твердая форма согласно варианту осуществления 27, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 9,2, 10,2, 11,8, 12,6, 13,6, 15,7, 16,0, 16,5, 17,5 и 18,1°.
Е30. Твердая форма согласно любому из вариантов осуществления 27-28, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 9,2, 10,2, 11,8, 12,6, 13,6, 16,0, 16,5, 17,5, 18,1, 18,7, 19,6, 22,9, 24,7, 25,4 и 26,0°.
Е31. Твердая форма согласно любому из вариантов осуществления 27-29, где указанная твердая форма имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 14.
Е32. Твердая форма согласно варианту осуществления 1, где указанная твердая форма представляет собой b) соль щелочного металла соединения формулы (Id).
Е33. Твердая форма согласно любому из вариантов осуществления 1 и 32, где указанная соль представляет собой калиевую соль соединения формулы (Id).
Е34. Твердая форма согласно варианту осуществления 33, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 17,1, 18,0, 18,4, 18,8 и 19,4°.
Е35. Твердая форма согласно любому из вариантов осуществления 33-34, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 18,0, 19,4, 21,8, 24,7, 27,1, 29,8, 33,3, 35,6, 38,6 и 39,6°.
Е36. Твердая форма согласно любому из вариантов осуществления 33-35, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 15.
Е37. Твердая форма согласно любому из вариантов осуществления 1 и 36, где указанная соль представляет собой натриевую соль соединения формулы (Id).
Е38. Твердая форма согласно варианту осуществления 37, где указанная натриевая соль представляет собой форму натриевой соли 1 соединения формулы (Id).
Е39. Твердая форма согласно любому из вариантов осуществления 37-38, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 5,9, 8,9, 11,9,12,8, 13,8, 14,9, 17,7, 18,6, 19,0 и 19,5°.
Е40. Твердая форма согласно любому из вариантов осуществления 38-39, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 8,9, 12,8, 13,8, 14,9, 17,7, 18,6, 19,0, 19,5, 21,5, 21,8, 22,2, 22,6, 22,9, 23,4 и 25,1°.
Е41. Твердая форма согласно любому из вариантов осуществления 38-40, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 16.
Е42. Твердая форма согласно варианту осуществления 37, где указанная натриевая соль представляет собой форму натриевой соли 2 соединения формулы (Id).
Е43. Твердая форма согласно любому из вариантов осуществления 37 и 42, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 5,6, 8,5, 12,6, 13,6, 14,1, 15,0, 16,7, 17,0, 18,8 и 19,8°.
Е44. Твердая форма согласно любому из вариантов осуществления 37 и 42-43, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 5,6, 8,5, 12,6, 13,6, 14,1, 15,0, 17,0, 18,8, 19,8, 21,0, 23,4, 28,5, 34,3, 37,3 и 38,5°.
Е45. Твердая форма согласно любому из вариантов осуществления 37 и 42-44, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 17.
Е46. Твердая форма согласно варианту осуществления 1, где указанная твердая форма представляет собой галогенсодержащую соль соединения формулы (Id).
Е47. Твердая форма согласно любому из вариантов осуществления 1 и 46, где указанная соль представляет собой гидрохлоридную соль соединения формулы (Id).
Е48. Твердая форма согласно варианту осуществления 47, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 5,7, 7,3, 10,6, 13,3, 15,3, 15,4, 16,2, 20,1, 22,5 и 23,0°.
Е49. Твердая форма согласно любому из вариантов осуществления 47-48, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 5,1, 5,7, 7,3, 10,6, 13,3, 15,3, 15,4, 16,2, 16,7, 18,1, 20,1, 22,5, 23,0, 23,6 и 23,8°.
Е50. Твердая форма согласно любому из вариантов осуществления 47-49, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 18.
Е51. Твердая форма согласно любому из вариантов осуществления 1 и 46, где указанная соль представляет собой гидробромидную соль соединения формулы (Id).
Е52. Твердая форма согласно варианту осуществления 51, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 12,5, 13,9, 14,5, 15,6, 18,6, 18,9, 19,8, 21,3, 22,0 и 22,4°.
Е53. Твердая форма согласно любому из вариантов осуществления 51-52, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), демонстрирующей пики при следующих значениях угла 2θ: 12,5, 13,9, 14,5, 15,6, 18,6,18,9, 19,8, 21,3, 22,0, 22,4, 23,3, 24,4, 25,5, 28,2 и 28,9°.
Е54. Твердая форма согласно любому из вариантов осуществления 51-53, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как показано на фигуре 19.
Е55. Твердая форма соединения формулы (Id) согласно любому из вариантов осуществления 1-54 для применения в терапии.
Е56. Твердая форма соединения формулы (Id) согласно любому из вариантов осуществления 1-54 для применения в качестве лекарственного препарата.
Е57. Твердая форма соединения формулы (Id) согласно варианту осуществления 56, где указанный лекарственный препарат представляет собой лекарственный препарат для перорального применения, такой как таблетка или капсула для перорального введения.
Е58. Фармацевтическая композиция, содержащая терапевтически эффективное количество твердой формы соединения формулы (Id) согласно любому из вариантов осуществления 1-54 и одно или несколько фармацевтически приемлемых вспомогательных веществ.
Е59. Фармацевтическая композиция согласно варианту осуществления 58, где указанная фармацевтическая композиция предназначена для перорального введения.
Е60. Фармацевтическая композиция согласно любому из вариантов осуществления 58-59, где указанная фармацевтическая композиция представляет собой фармацевтическую композицию для перорального применения.
Е61. Фармацевтическая композиция согласно любому из вариантов осуществления 58-60, где указанная фармацевтическая композиция представляет собой твердую лекарственную форму для перорального применения.
Е62. Фармацевтическая композиция согласно любому из вариантов осуществления 58-61, где указанная фармацевтическая композиция представляет собой таблетку или капсулу для перорального введения.
Е63. Фармацевтическая композиция согласно любому из вариантов осуществления 58-62, где указанная фармацевтическая композиция дополнительно содержит другое средство, которое является применимым в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона.
Е64. Фармацевтическая композиция согласно любому из вариантов осуществления 58-63, где указанная фармацевтическая композиция дополнительно содержит соединение, выбранное из группы, состоящей из L-DOPA, дроксидопы, фолиглуракса, ингибитора МАО-В, такого как селегилин или разагилин, ингибитора СОМТ, такого как энтакапон или толкапон, антагониста аденозина 2а, такого как истрадефиллин, антиглутаматергического средства, такого как амантадин или мемантин, ингибитора ацетилхолинэстеразы, такого как ривастигмин, донепезил или галантамин, антипсихотического средства, такого как кветиапин, клозапин, рисперидон, пимавансерин, оланзапин, галоперидол, арипипразол или брекспипразол; или антитела, нацеленного на белок альфа-синуклеин, тау-белок или белок А-бета.
Е65. Твердая форма соединения формулы (Id) согласно любому из вариантов осуществления 1-54 для применения в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость.
Е66. Твердая форма соединения формулы (Id) согласно любому из вариантов осуществления 1-54 для применения в лечении согласно варианту осуществления 65, где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
Е67. Твердая форма соединения формулы (Id) согласно любому из вариантов осуществления 1-54 для применения в лечении согласно любому из вариантов осуществления 65-66, где указанное соединение должно использоваться в комбинации с другим средством, которое является применимым в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона.
Е68. Твердая форма соединения формулы (Id) согласно любому из вариантов осуществления 1-54 для применения в лечении согласно любому из вариантов осуществления 66-67, где указанное соединение подлежит применению в комбинации с соединением, выбранным из группы, состоящей из L-DOPA, дроксидопы, фолиглуракса, ингибитора МАО-В, такого как селегилин или разагилин, ингибитора СОМТ, такого как энтакапон или толкапон, антагониста аденозиновых 2а-рецепторов, такого как истрадефиллин, антиглутаматергического средства, такого как амантадин или мемантин, ингибитора ацетилхолинэстеразы, такого как ривастигмин, донепезил или галантамин, антипсихотического средства, такого как кветиапин, клозапин, рисперидон, пимавансерин, оланзапин, галоперидол, арипипразол или брекспипразол; или в комбинации с антителом, нацеленным на белок альфа-синуклеин, тау-белок или белок А-бета.
Е69. Твердая форма соединения формулы (Id) согласно любому из вариантов осуществления 1-54 для применения в лечении согласно любому из вариантов осуществления 66-68, где указанное лечение осуществляют с помощью перорального введения указанного соединения.
Е70. Твердая форма соединения формулы (Id) согласно любому из вариантов осуществления 1-54 для применения в лечении согласно любому из вариантов осуществления 66-69, где указанное соединение содержится в пероральной фармацевтической композиции, такой как таблетка или капсула для перорального введения.
Е71. Способ лечения нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость; этот способ включает введение терапевтически эффективного количества твердой формы соединения формулы (Id) по любому из вариантов осуществления 1-54 пациенту, нуждающемуся в этом.
Е72. Способ согласно варианту осуществления 71, где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
Е73. Способ согласно любому из вариантов осуществления 71-72, где указанное соединение или его фармацевтически приемлемую соль согласно любому из вариантов осуществления 1-54 применяют в комбинации с другим средством, которое является применимым в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона.
Е74. Способ согласно любому из вариантов осуществления 72-73, где указанное соединение или его фармацевтически приемлемую соль согласно любому из вариантов осуществления 1-23 применяют в комбинации с соединением, выбранным из группы, состоящей из L-DOPA, дроксидопы, фолиглуракса, ингибитора МАО-В, такого как селегилин или разагилин, ингибитора СОМТ, такого как энтакапон или толкапон, антагониста аденозиновых 2а-рецепторов, такого как истрадефиллин, антиглутаматергического средства, такого как амантадин или мемантин, ингибитора ацетилхолинэстеразы, такого как ривастигмин, донепезил или галантамин, антипсихотического средства, такого как кветиапин, клозапин, рисперидон, пимавансерин, оланзапин, галоперидол, арипипразол или брекспипразол; или в комбинации с антителом, нацеленным на белок альфа-синуклеин, тау-белок или белок А-бета.
Е75. Способ согласно любому из вариантов осуществления 71-74, где указанное введение осуществляют пероральным путем.
Е76. Способ согласно любому из вариантов осуществления 71-75, где указанное соединение или его фармацевтически приемлемая соль согласно любому из вариантов осуществления 1-23 содержатся в фармацевтической композиции для перорального применения, такой как таблетка или капсула для перорального введения.
Е77. Применение твердой формы соединения формулы (Id) по любому из вариантов осуществления 1-54 в изготовлении лекарственного препарата для лечения нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или для лечения нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость.
Е78. Применение согласно варианту осуществления 77, где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
Е79. Применение согласно любому из вариантов осуществления 77-78, где указанный лекарственный препарат применяют в комбинации с другим средством, которое является применимым в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона.
Е80. Применение согласно любому из вариантов осуществления 78-79, где указанный лекарственный препарат применяют в комбинации с соединением, выбранным из группы, состоящей из L-DOPA, дроксидопы, фолиглуракса, ингибитора МАО-В, такого как селегилин или разагилин, ингибитора СОМТ, такого как энтакапон или толкапон, антагониста аденозиновых 2а-рецепторов, такого как истрадефиллин, антиглутаматергического средства, такого как амантадин или мемантин, ингибитора ацетилхолинэстеразы, такого как ривастигмин, донепезил или галантамин, антипсихотического средства, такого как кветиапин, клозапин, рисперидон, пимавансерин, оланзапин, галоперидол, арипипразол или брекспипразол; или в комбинации с антителом, нацеленным на белок альфа-синуклеин, тау-белок или белок А-бета.
Е81. Применение согласно любому из вариантов осуществления 77-80, где указанный лекарственный препарат представляет собой лекарственный препарат для перорального применения, такой как таблетка или капсула для перорального введения.
ПУНКТЫ
Следующие пункты служат для дальнейшего определения изобретения.
Пункт 1. Твердая форма соединения формулы (Id),
где указанная твердая форма выбрана из:
a) формы цвиттер-иона соединения (Id);
b) соли щелочного металла соединения формулы (Id) и
c) галогенсодержащей соли соединения формулы (Id).
Пункт 2. Твердая форма согласно пункту 1, где указанная твердая форма представляет собой кристаллическую форму.
Пункт 3. Твердая форма согласно любому из пунктов 1-2, где указанная твердая форма представляет собой твердую форму цвиттер-иона соединения (Id).
Пункт 4. Твердая форма согласно любому из пунктов 1-3, где указанная твердая форма представляет собой гидрат цвиттер-иона соединения (Id).
Пункт 5. Твердая форма согласно любому из пунктов 1-4, где указанная твердая форма представляет собой твердую гид ратную форму цвиттер-иона соединения (Id), выбранную из группы, состоящей из моногидратной формы, дигидратной формы и гепта гид ратной формы.
Пункт 6. Твердая форма согласно любому из пунктов 1-5, где указанная твердая форма представляет собой гидрат цвиттер-иона соединения (Id), выбранного из группы, состоящей из дигидратной формы и гептагидратной формы.
Пункт 7. Твердая форма согласно любому из пунктов 1-6, где указанная твердая форма представляет собой дигидрат (DH1) цвиттер-иона соединения (Id).
Пункт 8. Твердая форма согласно пункту 7, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 10,4, 11,6, 12,3, и 13,1, и 13,6°.
Пункт 9. Твердая форма согласно любому из пунктов 7-8, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 10,4, 11,6, 12,3,13,1 и 13,6°.
Пункт 10. Твердая форма по любому из пунктов 8-9, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 14,3, 15,6, 16,0, 16,8 и 18,5°.
Пункт 11. Твердая форма согласно любому из пунктов 8 и 10, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 10,4, 11,6, 12,3, 13,1, 13,6, 14,3, 15,6, 16,0, 16,8 и 18,5°.
Пункт 12. Твердая форма согласно любому из пунктов 9-10, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 10,4, 11,6, 12,3, 13,1, 13,6, 14,3, 15,6, 16,0, 16,8 и 18,5°.
Пункт 13. Твердая форма согласно любому из пунктов 7, 8, 10 и 11, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 10,4, 11,6, 12,3, 13,1, 13,6, 14,3, 15,6, 16,0, 16,8 и 18,5°.
Пункт 14. Твердая форма согласно любому из пунктов 7, 9 и 12, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ:10,4, 11,6, 12,3, 13,1, 13,6, 14,3, 15,6, 16,0, 16,8 и 18,5°.
Пункт 15. Твердая форма согласно любому из пунктов 7, 8, 10, 11 и 13, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 12,3, 13,1, 13,6, 16,0, 16,8, 18,5, 18,9, 19,4, 20,5, 21,4, 23,5, 24,7, 25,4, 26,9 и 28,7°.
Пункт 16. Твердая форма согласно любому из пунктов 7, 9 и 14, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 12,3, 13,1, 13,6, 16,0, 16,8, 18,5, 18,9, 19,4, 20,5, 21,4, 23,5, 24,7, 25,4, 26,9 и 28,7°.
Пункт 17. Твердая форма согласно любому из пунктов 7-16, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 8а.
Пункт 18. Твердая форма согласно любому из пунктов 7-17, демонстрирующая потерю веса, составляющую приблизительно 7,6% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 30°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 19. Твердая форма согласно любому из пунктов 7-18, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 8b.
Пункт 20. Твердая форма согласно любому из пунктов 1-3, где указанная твердая форма представляет собой ангидрат цвиттер-иона соединения (Id).
Пункт 21. Твердая форма согласно любому из пунктов 1-3 и 20, где указанная твердая форма представляет собой ангидрат (АН1) цвиттер-иона соединения (Id).
Пункт 22. Твердая форма согласно любому из пунктов 20-22, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 8,5, 11,1, 12,4,12,9 и 15,6°.
Пункт 23. Твердая форма согласно любому из пунктов 20-22, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 8,5, 11,1, 12,4,12,9 и 15,6°.
Пункт 24. Твердая форма согласно любому из пунктов 22-23, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 16,7, 18,9, 19,3, 20,0 и 21,2°.
Пункт 25. Твердая форма согласно любому из пунктов 20-22 и 24, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 8,5, 11,1, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0 и 21,2°.
Пункт 26. Твердая форма согласно любому из пунктов 20-25, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 8,5, 11,1, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0 и 21,2°.
Пункт 27. Твердая форма согласно любому из пунктов 20-25, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 8,5, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0, 21,2, 21,5, 22,2, 23,0, 24,2, 27,3 и 28,3°.
Пункт 28. Твердая форма согласно любому из пунктов 20-27, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 8,5, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0, 21,2, 21,5, 22,2, 23,0, 24,2, 27,3 и 28,3°.
Пункт 29. Твердая форма согласно любому из пунктов 20-28, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 9а.
Пункт 30. Твердая форма согласно любому из пунктов 20-29, демонстрирующая потерю веса, составляющую менее чем приблизительно 1% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 30°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 31. Твердая форма согласно любому из пунктов 20-30, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 9b.
Пункт 32. Твердая форма согласно любому из пунктов 1-6, где указанная твердая форма представляет собой гептагидрат (НН) цвиттер-иона соединения (Id).
Пункт 33. Твердая форма согласно пункту 32, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1 и 11,9°.
Пункт 34. Твердая форма согласно любому из пунктов 32-33, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,0, 8,6, 10,2,11,1 и 11,9°.
Пункт 35. Твердая форма согласно любому из пунктов 33-34, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 13,4, 14,0, 14,5, 17,0 и 17,4°.
Пункт 36. Твердая форма согласно любому из пунктов 32-33 и 35, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 13,4, 14,0, 14,5, 17,0 и 17,4°.
Пункт 37. Твердая форма согласно любому из пунктов 32-36, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 13,4, 14,0, 14,5, 17,0 и 17,4°.
Пункт 38. Твердая форма согласно любому из пунктов 32-33 и 35-36, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 14,0, 17,0, 22,2, 25,9, 27,3, 28,3, 30,8, 34,0, 34,8 и 35,2°.
Пункт 39. Твердая форма согласно любому из пунктов 32-38, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 14,0, 17,0, 22,2, 25,9, 27,3, 28,3, 30,8, 34,0, 34,8 и 35,2°.
Пункт 40. Твердая форма согласно любому из пунктов 32-39, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 10а.
Пункт 41. Твердая форма согласно любому из пунктов 32-40, демонстрирующая потерю веса, составляющую приблизительно 21% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 42. Твердая форма согласно любому из пунктов 32-41, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 10b.
Пункт 43. Твердая форма согласно любому из пунктов 1-4, где указанная твердая форма представляет собой форму А цвиттер-иона соединения (Id).
Пункт 44. Твердая форма согласно пункту 43, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2 и 12,0°.
Пункт 45. Твердая форма согласно любому из пунктов 43-44, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,6, 9,5, 10,0,11,2 и 12,0°.
Пункт 46. Твердая форма согласно любому из пунктов 44-45, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 14,3, 14,6, 15,3, 15,5 и 19,3°.
Пункт 47. Твердая форма согласно любому из пунктов 43-44 и 46, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2, 12,0, 14,3, 14,6, 15,3, 15,5 и 19,3°.
Пункт 48. Твердая форма согласно любому из пунктов 43-47, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,6, 9,5, 10,0, 11,2, 12,0, 14,3, 14,6, 15,3, 15,5 и 19,3°.
Пункт 49. Твердая форма согласно любому из пунктов 43-44 и 46-47, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2, 12,0, 14,3, 14,6, 15,3, 15,5, 18,7, 19,3, 23,9, 28,8, 33,7 и 38,7°.
Пункт 50. Твердая форма согласно любому из пунктов 43-49, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,6, 9,5, 10,0, 11,2, 12,0, 14,3, 14,6, 15,3, 15,5, 18,7, 19,3, 23,9, 28,8, 33,7 и 38,7°.
Пункт 51. Твердая форма согласно любому из пунктов 43-50, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 11.
Пункт 52. Твердая форма согласно любому из пунктов 1-4, где указанная твердая форма представляет собой форму В цвиттер-иона соединения (Id).
Пункт 53. Твердая форма согласно пункту 52, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,6, 9,0, 10,9, 12,3 и 14,3°.
Пункт 54. Твердая форма согласно любому из пунктов 52-53, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,6, 9,0, 10,9,12,3 и 14,3°.
Пункт 55. Твердая форма согласно любому из пунктов 53-54, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ±0,2° 2θ: 15,0, 21,5, 22,1, 22,6 и 23,7°.
Пункт 56. Твердая форма согласно любому из пунктов 52-53 и 55, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,6, 9,0, 10,9, 12,3, 14,3, 15,0, 21,5, 22,1, 22,6 и 23,7°.
Пункт 57. Твердая форма согласно любому из пунктов 52-57, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 12.
Пункт 58. Твердая форма согласно любому из пунктов 1-4, где указанная твердая форма представляет собой форму С цвиттер-иона соединения (Id).
Пункт 59. Твердая форма согласно пункту 58, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,5, 8,1, 10,3, 12,6 и 13,5°.
Пункт 60. Твердая форма согласно любому из пунктов 58-59, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,5, 8,1, 10,3,12,6 и 13,5°.
Пункт 61. Твердая форма согласно любому из пунктов 59-60, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 13,8, 14,9, 17,5, 18,5 и 20,6°.
Пункт 62. Твердая форма согласно любому из пунктов 58-59 и 61, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5 и 20,6°.
Пункт 63. Твердая форма согласно любому из пунктов 58-59 и 61 -62, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5 и 20,6°.
Пункт 64. Твердая форма согласно любому из пунктов 58-63, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5 и 20,6°.
Пункт 65. Твердая форма согласно любому из пунктов 58-59 и 61 -63, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5, 20,6, 21,6, 22,9, 23,1, 24,0 и 25,4°.
Пункт 66. Твердая форма согласно любому из пунктов 58-65, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5, 20,6, 21,6, 22,9, 23,1, 24,0 и 25,4°.
Пункт 67. Твердая форма согласно любому из пунктов 58-66, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 13.
Пункт 68. Твердая форма согласно любому из пунктов 1-6, где указанная твердая форма представляет собой моногидрат (МН1) цвиттер-иона соединения (Id).
Пункт 69. Твердая форма согласно пункту 68, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ:9,2, 10,2, 11,8, 12,6, 13,6°.
Пункт 70. Твердая форма согласно любому из пунктов 68-69, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 9,2, 10,2, 11,8,12,6, 13,6°.
Пункт 71. Твердая форма согласно любому из пунктов 69-70, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ±0,2° 2θ: 15,7, 16,0, 16,5, 17,5 и 18,1°.
Пункт 72. Твердая форма согласно любому из пунктов 68-69 и 71, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 9,2, 10,2, 11,8, 12,6, 13,6, 15,7, 16,0, 16,5, 17,5 и 18,1°.
Пункт 73. Твердая форма согласно любому из пунктов 68-72, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 9,2, 10,2, 11,8, 12,6, 13,6, 15,7, 16,0, 16,5, 17,5 и 18,1°.
Пункт 74. Твердая форма согласно любому из пунктов 68-69 и 71-72, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой,
полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 9,2, 10,2, 11,8, 12,6, 13,6, 16,0, 16,5, 17,5, 18,1, 18,7, 19,6, 22,9, 24,7, 25,4 и 26,0°.
Пункт 75. Твердая форма согласно любому из пунктов 68-74, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 9,2, 10,2, 11,8, 12,6, 13,6, 16,0, 16,5, 17,5, 18,1, 18,7, 19,6, 22,9, 24,7, 25,4 и 26,0°.
Пункт 76. Твердая форма согласно любому из пунктов 68-75, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 14а.
Пункт 77. Твердая форма согласно любому из пунктов 68-76, демонстрирующая потерю веса, составляющую приблизительно 4% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 78. Твердая форма согласно любому из пунктов 68-77, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 14b.
Пункт 79. Твердая форма согласно любому из пунктов 1 и 2, где указанная твердая форма представляет собой соль щелочного металла соединения формулы (Id).
Пункт 80. Твердая форма согласно пункту 79, где указанная твердая форма представляет собой соль щелочного металла соединения формулы (Id), выбранную из группы, состоящей из соли калия и соли натрия.
Пункт 81. Твердая форма согласно любому из пунктов 79-80, где указанная соль представляет собой калиевую соль соединения формулы (Id).
Пункт 82. Твердая форма согласно пункту 81, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6 и 15,0°.
Пункт 83. Твердая форма согласно любому из пунктов 81-82, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 3,0, 9,0, 12,6,13,6 и 15,0°.
Пункт 84. Твердая форма согласно любому из пунктов 81-83, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 17,1, 18,0, 18,4, 18,8 и 19,4°.
Пункт 85. Твердая форма согласно любому из пунктов 81-82 и 84, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 17,1, 18,0, 18,4, 18,8 и 19,4°.
Пункт 86. Твердая форма согласно любому из пунктов 81-85, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 17,1, 18,0, 18,4, 18,8 и 19,4°.
Пункт 87. Твердая форма согласно любому из пунктов 81-82 и 84-85, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 18,0, 19,4, 21,8, 24,7, 27,1, 29,8, 33,3, 35,6, 38,6 и 39,6°.
Пункт 88. Твердая форма согласно любому из пунктов 81-87, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 18,0, 19,4, 21,8, 24,7, 27,1, 29,8, 33,3, 35,6, 38,6 и 39,6°.
Пункт 89. Твердая форма согласно любому из пунктов 81-88, где указанная калиевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 15а.
Пункт 90. Твердая форма согласно любому из пунктов 81-89, демонстрирующая потерю веса, составляющую менее чем приблизительно 1% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 91. Твердая форма согласно любому из пунктов 81-90, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 15b.
Пункт 92. Твердая форма согласно любому из пунктов 1, 2 и 79-80, где указанная соль представляет собой натриевую соль соединения формулы (Id).
Пункт 93. Твердая форма согласно пункту 92, где указанная натриевая соль представляет собой форму натриевой соли 1 соединения формулы (Id).
Пункт 94. Твердая форма согласно пункту 93, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ:5,9, 8,9, 11,9, 12,8, 13,8°.
Пункт 95. Твердая форма согласно любому из пунктов 93-94, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 5,9, 8,9, 11,9,12,8, 13,8°.
Пункт 96. Твердая форма согласно любому из пунктов 94-95, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 14,9, 17,7, 18,6, 19,0 и 19,5°.
Пункт 97. Твердая форма согласно любому из пунктов 93-94 и 95-96, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 5,9, 8,9, 11,9, 12,8, 13,8, 14,9, 17,7, 18,6, 19,0 и 19,5°.
Пункт 98. Твердая форма согласно любому из пунктов 93-97, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 5,9, 8,9, 11,9, 12,8, 13,8, 14,9, 17,7, 18,6, 19,0 и 19,5°.
Пункт 99. Твердая форма согласно любому из пунктов 93-94 и 96-97, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 8,9, 12,8, 13,8, 14,9, 17,7, 18,6, 19,0, 19,5, 21,5, 21,8, 22,2, 22,6, 22,9, 23,4 и 25,1°.
Пункт 100. Твердая форма согласно любому из пунктов 93-99, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 8,9, 12,8, 13,8, 14,9, 17,7, 18,6, 19,0, 19,5, 21,5, 21,8, 22,2, 22,6, 22,9, 23,4 и 25,1°.
Пункт 101. Твердая форма согласно любому из пунктов 93-100, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 16а.
Пункт 102. Твердая форма согласно любому из пунктов 93-101, демонстрирующая потерю массы приблизительно 2% вес/вес по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 175°С (скорость нагрева 10°С/мин.), как например, при измерении с помощью термогравиметрического анализа.
Пункт 103. Твердая форма согласно любому из пунктов 93-102, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 16b.
Пункт 104. Твердая форма согласно пункту 92, где указанная натриевая соль представляет собой натриевую соль формы 2 соединения формулы (Id).
Пункт 105. Твердая форма согласно пункту 104, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ:5,6, 8,5, 12,6, 13,6, 14,1°.
Пункт 106. Твердая форма согласно любому из пунктов 104-105, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 5,6, 8,5, 12,6,13,6, 14,1°.
Пункт 107. Твердая форма согласно любому из пунктов 105-106, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 15,0, 16,7, 17,0, 18,8 и 19,8°.
Пункт 108. Твердая форма согласно любому из пунктов 104-105 и 107, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 5,6, 8,5, 12,6, 13,6, 14,1, 15,0, 16,7, 17,0, 18,8 и 19,8°.
Пункт 109. Твердая форма согласно любому из пунктов 104-108, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 5,6, 8,5, 12,6, 13,6, 14,1, 15,0, 16,7, 17,0, 18,8 и 19,8°.
Пункт 110. Твердая форма согласно любому из пунктов 104-105 и 107-108, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 5,6, 8,5, 12,6, 13,6, 14,1, 15,0, 17,0, 18,8, 19,8, 21,0, 23,4, 28,5, 34,3, 37,3 и 38,5°.
Пункт 111. Твердая форма согласно любому из пунктов 104-110, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 5,6, 8,5, 12,6, 13,6, 14,1, 15,0, 17,0, 18,8, 19,8, 21,0, 23,4, 28,5, 34,3, 37,3 и 38,5°.
Пункт 112. Твердая форма согласно любому из пунктов 104-111, где указанная натриевая соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 17а.
Пункт 113. Твердая форма согласно любому из пунктов 104-112, демонстрирующая потерю массы приблизительно 5% вес/вес по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 175°С (скорость нагрева 10°С/мин.), как например, при измерении с помощью термогравиметрического анализа.
Пункт 114. Твердая форма согласно любому из пунктов 104-113, где указанная твердая форма представляет собой кристаллическую форму, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 17b.
Пункт 115. Твердая форма согласно любому из пунктов 1-2, где указанная твердая форма представляет собой галогенидную соль соединения формулы (Id).
Пункт 116. Твердая форма согласно пунктам 1 и 115, где указанная твердая форма представляет собой галогенидную соль соединения формулы (Id), выбранную из группы, состоящей из гидрохлорид ной соли и гидробромидной соли соединения формулы (Id).
Пункт 117. Твердая форма согласно любому из пунктов 1 и 115-116, где указанная соль представляет собой гидрохлоридную соль соединения формулы (Id).
Пункт 118. Твердая форма согласно любому из пунктов 115-117, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 5,7, 7,3, 10,6, 13,3, 15,3°.
Пункт 119. Твердая форма согласно любому из пунктов 115-118, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2Å ±0,1° 2θ: 5,7, 7,3, 10,6, 13,3, 15,3°.
Пункт 120. Твердая форма согласно любому из пунктов 118-119, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 15,4, 16,2, 20,1, 22,5 и 23,0°.
Пункт 121. Твердая форма согласно любому из пунктов 115-118 и 120, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 5,7, 7,3, 10,6, 13,3, 15,3, 15,4, 16,2, 20,1, 22,5 и 23,0°.
Пункт 122. Твердая форма согласно любому из пунктов 115-121, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 5,7, 7,3, 10,6, 13,3, 15,3, 15,4, 16,2, 20,1, 22,5 и 23,0°.
Пункт 123. Твердая форма согласно любому из пунктов 115-118 и 121, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 5,1, 5,7, 7,3, 10,6, 13,3, 15,3, 15,4, 16,2, 16,7, 18,1, 20,1, 22,5, 23,0, 23,6 и 23,8°.
Пункт 124. Твердая форма согласно любому из пунктов 115-123, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 5,1, 5,7, 7,3, 10,6, 13,3, 15,3, 15,4, 16,2, 16,7, 18,1, 20,1, 22,5, 23,0, 23,6 и 23,8°.
Пункт 125. Твердая форма согласно любому из пунктов 115-124, где указанная гидрохлоридная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 18а.
Пункт 126. Твердая форма согласно любому из пунктов 1 и 115-116, где указанная соль представляет собой гидробромидную соль соединения формулы (Id).
Пункт 127. Твердая форма согласно пункту 126, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ:12,5, 13,9, 14,5,15,6, 18,6°.
Пункт 128. Твердая форма согласно любому из пунктов 126-127, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 12,5, 13,9, 14,5, 15,6, 18,6°.
Пункт 129. Твердая форма согласно любому из пунктов 127-128, где указанная порошковая рентгеновская дифрактограмма дополнительно содержит один или несколько пиков, выбранных из группы, состоящей из пиков при следующих значениях угла 2θ ±0,2° 2θ: 18,9, 19,8, 21,3, 22,0 и 22,4°.
Пункт 130. Твердая форма согласно любому из пунктов 126-127 и 129, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (A=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 12,5, 13,9, 14,5, 15,6, 18,6, 18,9, 19,8, 21,3, 22,0 и 22,4°.
Пункт 131. Твердая форма согласно любому из пунктов 126-130, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 12,5, 13,9, 14,5, 15,6, 18,6, 18,9, 19,8, 21,3, 22,0 и 22,4°.
Пункт 132. Твердая форма согласно любому из пунктов 126-127 и 129-131, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ: 12,5, 13,9, 14,5, 15,6, 18,6, 18,9, 19,8, 21,3, 22,0, 22,4, 23,3, 24,4, 25,5, 28,2 и 28,9°.
Пункт 133. Твердая форма согласно любому из пунктов 126-132, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), содержащей пики при следующих значениях угла 2θ ±0,1° 2θ: 12,5, 13,9, 14,5, 15,6, 18,6, 18,9, 19,8, 21,3,22,0,22,4, 23,3, 24,4, 25,5, 28,2 и 28,9°.
Пункт 134. Твердая форма согласно любому из пунктов 126-133, где указанная гидробромидная соль имеет кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406 Å), как по сути изображено на фигуре 19.
Пункт 135. Твердая форма соединения формулы (Id), выбранная из группы, состоящей из DH1, как определено в пунктах 7-19, НН, как определено в пунктах 32-42, и калиевой соли, как определено в пунктах 80-91.
Пункт 136. Твердая форма соединения формулы (Id), выбранная из группы, состоящей из DH1, как определено в пунктах 7-19, и калиевой соли, как определено в пунктах 80-91.
Пункт 137. Твердая форма цвиттер-иона соединения (Id), при этом указанная твердая форма демонстрирует потерю веса, составляющую приблизительно 7,6% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 30°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 138. Твердая форма цвиттер-иона соединения (Id), указанная твердая форма, где указанная твердая форма представляет собой кристаллическую форму, характеризуется термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 8b.
Пункт 139. Твердая форма цвиттер-иона соединения (Id), при этом указанная твердая форма демонстрирует потерю веса, составляющую менее чем приблизительно 1% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 30°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 140. Твердая форма цвиттер-иона соединения (Id), где указанная твердая форма характеризуется термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 9b.
Пункт 141. Твердая форма цвиттер-иона соединения (Id), где указанная твердая форма демонстрирует потерю веса, составляющую приблизительно 21% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 142. Твердая форма цвиттер-иона соединения (Id), где указанная твердая форма характеризуется термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 10b.
Пункт 143. Твердая форма цвиттер-иона соединения (Id), где указанная твердая форма демонстрирует потерю веса, составляющую приблизительно 4% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 144. Твердая форма цвиттер-иона соединения (Id), где указанная твердая форма характеризуется термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 14b.
Пункт 145. Твердая форма соединения (Id), где указанная твердая форма представляет собой калиевую соль, демонстрирующую потерю веса, составляющую менее чем приблизительно 1% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 150°С (скорость нагрева 10°С/мин.), как измерено с помощью термогравиметрического анализа.
Пункт 146. Твердая форма соединения (Id), где указанная твердая форма представляет собой калиевую соль, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 15b.
Пункт 147. Твердая форма соединения (Id), где указанная твердая форма представляет собой форму натриевой соли, демонстрирующую потерю веса, составляющую приблизительно 2% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 175°С (скорость нагрева 10°С/мин.), как например, при измерении с помощью термогравиметрического анализа.
Пункт 148. Твердая форма цвиттер-иона соединения (Id), где указанная твердая форма представляет собой форму натриевой соли, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 16b.
Пункт 149. Твердая форма соединения (Id), где указанная твердая форма представляет собой форму натриевой соли, демонстрирующую потерю веса, составляющую приблизительно 5% вес/вес, по сравнению с исходным весом при нагревании от приблизительно 20°С до приблизительно 175°С (скорость нагрева 10°С/мин.), как например, при измерении с помощью термогравиметрического анализа.
Пункт 150. Твердая форма соединения (Id), где указанная твердая форма представляет собой натриевую соль, характеризующуюся термогравиметрическим анализом (с использованием скорости нагрева 10°С/мин.), как по сути изображено на фигуре 17b.
Пункт 151. Твердая форма соединения формулы (Id) согласно любому из пунктов 1-150 для применения в терапии.
Пункт 152. Форма DH1 согласно любому из пунктов 7-19для применения в терапии.
Пункт 153. Форма калиевой соли согласно любому из пунктов 80-91 для применения в терапии.
Пункт 154. Твердая форма соединения формулы (Id) согласно любому из пунктов 1-150 для применения в качестве лекарственного препарата.
Пункт 155. Твердая форма DH1 согласно любому из пунктов 7-19 для применения в качестве лекарственного препарата.
Пункт 156. Твердая форма калиевой соли согласно любому из пунктов 80-91 для применения в качестве лекарственного препарата.
Пункт 157. Твердая форма соединения формулы (Id) согласно любому из пунктов 151-156, где указанный лекарственный препарат представляет собой лекарственный препарат для перорального применения, такой как таблетка или капсула для перорального введения.
Пункт 158. Фармацевтическая композиция, содержащая терапевтически эффективное количество твердой формы соединения формулы (Id) согласно любому из пунктов 1-150 и одно или несколько фармацевтически приемлемых вспомогательных веществ.
Пункт 159. Фармацевтическая композиция согласно пункту 158, где указанная твердая форма представляет собой дигидрат цвиттер-иона соединения формулы (Id) DH1 согласно любому из пунктов 7-19.
Пункт 160. Фармацевтическая композиция согласно пункту 158, где указанная твердая форма представляет собой калиевую соль соединения формулы (Id) согласно любому из пунктов 80-91.
Пункт 161. Фармацевтическая композиция согласно любому из пунктов 158-160, где указанная фармацевтическая композиция предназначена для перорального введения.
Пункт 162. Фармацевтическая композиция согласно любому из пунктов 158-161, где указанная фармацевтическая композиция представляет собой фармацевтическую композицию для перорального применения.
Пункт 163. Фармацевтическая композиция согласно любому из пунктов 158-162, где указанная фармацевтическая композиция представляет собой твердую лекарственную форму для перорального применения.
Пункт 164. Фармацевтическая композиция согласно любому из пунктов 158-163, где указанная фармацевтическая композиция представляет собой таблетку или капсулу для перорального введения.
Пункт 165. Фармацевтическая композиция согласно любому из пунктов 158-164, где указанная фармацевтическая композиция дополнительно содержит другое средство, которое является применимым в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона.
Пункт 166. Фармацевтическая композиция согласно любому из пунктов 158-165, где указанная фармацевтическая композиция дополнительно содержит соединение, выбранное из группы, состоящей из L-DOPA, дроксидопы, фолиглуракса, ингибитора МАО-В, такого как селегилин или разагилин, ингибитора СОМТ, такого как энтакапон или толкапон, антагониста аденозина 2а, такого как истрадефиллин, антиглутаматергического средства, такого как амантадин или мемантин, ингибитора ацетилхолинэстеразы, такого как ривастигмин, донепезил или галантамин, антипсихотического средства, такого как кветиапин, клозапин, рисперидон, пимавансерин, оланзапин, галоперидол, арипипразол или брекспипразол; или антитела, нацеленного на белок альфа-синуклеин, тау-белок или белок А-бета.
Пункт 167. Твердая форма соединения формулы (Id) согласно любому из пунктов 1-150 для применения в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость.
Пункт 168. Твердая форма для применения согласно пункту 167, где указанная твердая форма представляет собой дигидрат цвиттер-иона соединения формулы (Id) DH1 согласно любому из пунктов 7-19.
Пункт 169. Твердая форма для применения согласно пункту 167, где указанная твердая форма представляет собой форму калиевой соли соединения формулы (Id), как определено в любом из пунктов 80-91.
Пункт 170. Твердая форма соединения формулы (Id) для применения согласно любому из пунктов 167-169, где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
Пункт 171. Твердая форма для применения согласно пункту 170, где указанная твердая форма представляет собой дигидрат цвиттер-иона соединения формулы (Id) DH1 согласно любому из пунктов 7-19, и где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
Пункт 172. Твердая форма для применения согласно пункту 170, где указанная твердая форма представляет собой форму калиевой соли соединения формулы (Id), как определено в любом из пунктов 80-91, и где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
Пункт 173. Твердая форма для применения согласно любому из пунктов 167-172, где указанную твердую форму применяют в комбинации с другим средством, которое является применимым в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона.
Пункт 174. Твердая форма согласно любому из пунктов 167-173, где указанную твердую форму применяют в комбинации с соединением, выбранным из группы, состоящей из L-DOPA, дроксидопы, фолиглуракса, ингибитора МАО-В, такого как селегилин или разагилин, ингибитора СОМТ, такого как энтакапон или толкапон, антагониста аденозиновых 2а-рецепторов, такого как истрадефиллин, антиглутаматергического средства, такого как амантадин или мемантин, ингибитора ацетилхолинэстеразы, такого как ривастигмин, донепезил или галантамин, антипсихотического средства, такого как кветиапин, клозапин, рисперидон, пимавансерин, оланзапин, галоперидол, арипипразол или брекспипразол; или в комбинации с антителом, нацеленным на белок альфа-синуклеин, тау-белок или белок А-бета.
Пункт 175. Твердая форма для применения согласно любому из пунктов 167-174, где указанное лечение осуществляют с помощью перорального введения указанного соединения.
Пункт 176. Твердая форма для применения согласно любому из пунктов 167-175, где указанное соединение содержится в пероральной фармацевтической композиции, такой как таблетка или капсула для перорального введения.
Пункт 177. Способ лечения нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость; этот способ включает введение терапевтически эффективного количества твердой формы соединения формулы (Id) по любому из пунктов 1-150 пациенту, нуждающемуся в этом.
Пункт 178. Способ согласно пункту 177, который включает введение терапевтически эффективного количества дигидрата цвиттер-иона соединения формулы (Id) согласно любому из пунктов 7-19 пациенту, нуждающемуся в этом.
Пункт 179. Способ согласно пункту 177, который включает введение терапевтически эффективного количества твердой формы калиевой соли соединения формулы (Id), как определено в любом из пунктов 80-91, пациенту, нуждающемуся в этом.
Пункт 180. Способ согласно любому из пунктов 177-179, где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
Пункт 181. Способ согласно любому из пунктов 177 и 180, который включает введение терапевтически эффективного количества дигидрата цвиттер-иона соединения формулы (Id) согласно любому из пунктов 7-19 пациенту, нуждающемуся в этом, и где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона
Пункт 182. Способ согласно пунктам 177, 179 и 180, который включает введение терапевтически эффективного количества твердой формы калиевой соли соединения формулы (Id), как определено в любом из пунктов 80-91, пациенту, нуждающемуся в этом, и где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона
Пункт 183. Способ согласно любому из пунктов 177-182, где указанную твердую форму соединения (Id) применяют в комбинации с другим средством, которое является применимым в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона.
Пункт 184. Способ согласно любому из пунктов 177-183, где указанную твердую форму соединения (Id) применяют в комбинации с соединением, выбранным из группы, состоящей из L-DOPA, дроксидопы, фолиглуракса, ингибитора МАО-В, такого как селегилин или разагилин, ингибитора СОМТ, такого как энтакапон или толкапон, антагониста аденозиновых 2а-рецепторов, такого как истрадефиллин, антиглутаматергического средства, такого какамантадин или мемантин, ингибитора ацетилхолинэстеразы, такого как ривастигмин, донепезил или галантамин, антипсихотического средства, такого как кветиапин, клозапин, рисперидон, пимавансерин, оланзапин, галоперидол, арипипразол или брекспипразол; или в комбинации с антителом, нацеленным на белок альфа-синуклеин, тау-белок или белок А-бета.
Пункт 185. Способ согласно любому из пунктов 177-184, где указанное введение осуществляют пероральным путем.
Пункт 186. Способ согласно любому из пунктов 177-185, где указанная твердая форма содержится в пероральной фармацевтической композиции, такой как таблетка или капсула для перорального введения.
Пункт 187. Применение твердой формы соединения формулы (Id) согласно любому из пунктов 1-150 в изготовлении лекарственного препарата для лечения нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона, болезнь Хантингтона, синдром беспокойных ног или болезнь Альцгеймера; или для лечения нейропсихиатрического заболевания или нарушения, такого как шизофрения, синдром дефицита внимания и гиперактивности или наркотическая зависимость.
Пункт 188. Применение согласно пункту 187, при этом указанная твердая форма представляет собой цвиттер-ион соединения формулы (Id) DH1 согласно любому из пунктов 7-19.
Пункт 189. Применение согласно пункту 187, при этом указанная твердая форма представляет собой форму калиевой соли соединения формулы (Id) как определено в любом из пунктов 80-91.
Пункт 190. Применение согласно любому из пунктов 172-174, где указанное нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
Пункт 191. Применение согласно любому из пунктов 187-190, где указанный лекарственный препарат применяют в комбинации с другим средством, которое является применимым в лечении нейродегенеративного заболевания или нарушения, такого как болезнь Паркинсона.
Пункт 192. Применение согласно любому из пунктов 187-191, где указанный лекарственный препарат применяют в комбинации с соединением, выбранным из группы, состоящей из L-DOPA, дроксидопы, фолиглуракса, ингибитора МАО-В, такого как селегилин или разагилин, ингибитора СОМТ, такого как энтакапон или толкапон, антагониста аденозиновых 2а-рецепторов, такого как истрадефиллин, антиглутаматергического средства, такого какамантадин или мемантин, ингибитора ацетилхолинэстеразы, такого как ривастигмин, донепезил или галантамин, антипсихотического средства, такого как кветиапин, клозапин, рисперидон, пимавансерин, оланзапин, галоперидол, арипипразол или брекспипразол; или в комбинации с антителом, нацеленным на белок альфа-синуклеин, тау-белок или белок А-бета.
Пункт 193. Применение согласно любому из пунктов 187-192, где указанный лекарственный препарат представляет собой лекарственный препарат для перорального применения, такой как таблетка или капсула для перорального введения.
Все ссылки, включая публикации, патентные заявки и патенты, цитируемые в данном документе, включены в данный документ посредством ссылки во всей своей полноте и в той же степени, как если бы было указано, что каждая ссылка индивидуально и конкретно включена посредством ссылки и приведена во всей своей полноте (в максимальной степени допускаемой законом).
Заголовки и подзаголовки применяются в данном документе исключительно для удобства, и их не следует рассматривать как ограничивающие каким-либо образом настоящее изобретение.
Описание в данном документе любого аспекта или аспектов настоящего изобретения с использованием таких терминов, как "включающий", "имеющий", "в том числе" или "содержащий", по отношению к элементу или элементам предназначено для подтверждения аналогичного аспекта или аспектов настоящего изобретения, который "состоит из", "состоит практически из" данного конкретного элемента или элементов или "по сути содержит" их, если не указано иное или это однозначно не противоречит контексту (например, композиция, описанная в данном документе как содержащая определенный элемент, должна также пониматься как описывающая композицию, состоящую из данного элемента, если не указано иное или это однозначно не противоречит контексту).
Использование всевозможных примеров или вводного слова перед примерами (в том числе "как например", "например", "к примеру" и "собственно") в данном описании предназначено исключительно для лучшего освещения настоящего изобретения и не предусматривает ограничение объема настоящего изобретения, если не указано иное.
Следует понимать, что различные аспекты, варианты осуществления, пункты, реализации и признаки настоящего по настоящему изобретению, упомянутые в данном документе, могут быть заявлены по отдельности или в любой комбинации.
Настоящее изобретение включает все модификации и эквиваленты объекта, изложенного в прилагаемой к данному документу формуле изобретения согласно действующему законодательству.
ЭКСПЕРИМЕНТАЛЬНЫЙ РАЗДЕЛ
Пример 1. Получение соединения (Id)
Соединение формулы (Id) можно получать с помощью способа, описанного ниже, вместе со способами синтеза, известными в области органической химии, или модификациями, с которыми знакомы специалисты в данной области. Исходные материалы, используемые в данном документе, являются коммерчески доступными, или их можно получить с помощью традиционных способов, известных из уровня техники, таких как способы, описанные в стандартной справочной литературе, такой как "Compendium of Organic Synthetic Methods, Vol. I-XN" (опубликованный Wiley-Interscience). Предпочтительные способы включают без ограничений способы, описанные ниже.
На схемах представлены способы, пригодные в синтезе соединений согласно настоящему изобретению. Они никоим образом не предназначены для ограничения объема настоящего изобретения.
Соединение (I), которое, например, можно получать, как раскрыто в WO 2009/026934, применяли в качестве промежуточного соединения в синтезе соединений по настоящему изобретению.
В WO 2019101917 дополнительно описаны способы получения соединения (Id).
Способы LC-MS
Аналитические данные LC-MS получали с применением способов, определенных ниже.
Способ 550. LC-MS проводили на приборе Waters Aquity UPLC-MS, состоящем из Waters Aquity, включающем управляющее устройство колонки, бинарную градиентную систему управления, органайзер для образцов, детектор PDA (работающий при 254 нМ), детектор ELS и TQ-MS, оборудованный APPI-источником, работающем в режиме положительных ионов.
Условия LC. Колонка представляла собой Acquity UPLC ВЕН С18 1,7 мкм; 2,1 × 50 мм, работающую при 60°С с 1,2 мл/мин бинарного градиента, состоящего из воды + 0,05% трифторуксусной кислоты (А) и ацетонитрил/вода (95:5) + 0,05% трифторуксусной кислоты.
Градиент (линейный):
Общее время прогона: 1,15 минуты.
Способ 551. LC-MS проводили на приборе Waters Aquity UPLC-MS, состоящем из Waters Aquity, включающем управляющее устройство колонки, бинарную градиентную систему управления, органайзер для образцов, детектор PDA (работающий при 254 нМ), детектор ELS и TQ-MS, оборудованный APPI-источником, работающем в режиме положительных ионов.
Условия LC. Колонка представляла собой Acquity UPLC HSS ТЗ 1,8 мкм; 2,1 × 50 мм, работающую при 60°С с 1,2 мл/мин. бинарного градиента, состоящего из воды + 0,05% трифторуксусной кислоты (А) и ацетонитрил/вода (95:5) + 0,05% трифторуксусной кислоты.
Градиент (линейный):
Общее время прогона: 1,15 минуты.
Способ 555. LC-MS проводили на приборе Waters Aquity UPLC-MS, состоящем из Waters Aquity, включающем управляющее устройство колонки, бинарную градиентную систему управления, органайзер для образцов, детектор PDA (работающий при 254 нМ), детектор ELS и TQ-MS, оборудованный APPI-источником, работающем в режиме положительных ионов.
Условия LC. Колонка представляла собой Acquity UPLC ВЕН С18 1,7 мкм; 2,1 × 150 мм, работающую при 60°С с 0,6 мл/мин бинарного градиента, состоящего из воды + 0,05% трифторуксусной кислоты (А) и ацетонитрил/вода (95:5) + 0,05% трифторуксусной кислоты.
Градиент (линейный):
Общее время прогона: 3,6 минуты.
Препаративную LCMS проводили с применением способа, указанного ниже.
Система Waters AutoPurification с применением комбинированного масс/УФ-обнаружения.
Колонка: Sunfire 30×100 мм, частицы размером 5 мкм. Колонка работала при 40°С с 90 мл/мин. бинарного градиента, состоящего из воды + 0,05% трифторуксусной кислоты (А) и ацетонитрил/вода (3:5) + 0,05% трифторуксусной кислоты.
Градиент (линейный):
HighRes MS проводили на Bruker Compact qTOF, оборудованном источником электрораспыления, работающем в положительном и отрицательном режиме. Применяли прямую инфузию и выполняли калибровку с помощью формиата натрия.
Соединение (Id) получали вместе с соединением (Id'), изображенным ниже, и два соединения были изолированы друг от друга на последней стадии.
Пример 2. Получение промежуточных соединений для получения соединений (Id) и (Id')
Промежуточные соединения:
(4aR,10aR)-1-пропил-7-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ол и (4aR,10aR)-1-пропил-6-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ол.
(4aR,10aR)-1-Пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6,7-диола гидрохлорид (2,21 г, 7,43 ммоль) суспендировали в дихлорметане (80 мл) в атмосфере азота при комнатной температуре, добавляли N,N-диизопропилэтиламин (4,44 г, 6,0 мл, 34,4 ммоль), затем добавляли триизопропилсилилхлорид (2,73 г, 3,0 мл, 14,16 ммоль) и смесь перемешивали при комнатной температуре в течение 92 часов. Добавляли 10 мл МеОН, и неочищенную смесь выпаривали, дважды выпаривали совместно с дихлорметаном/гептаном, повторно растворяли в дихлорметане и выпаривали непосредственно на вспомогательном фильтровальном веществе и очищали с помощью колоночной хроматографии (элюент: н-гептан/этилацетат/триэтиламин, 100:0:0-35:60:5) с получением 3,14 г смеси (4aR,10aR)-1-пропил-7-((триизопропилсилил) окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ола (3,14 г) и (4aR,10aR)-1-пропил-6-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ола в виде масла.
Результаты ЯМР (CDCl3) демонстрировали смесь силилированных изомеров >30:1.
Промежуточные соединения:
трет-бутил((4aR,10aR)-1-пропил-7-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)карбонат [А] и трет-бутил((4aR,10aR)-1-пропил-6-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)карбонат [В].
Смесь из предыдущей стадии в виде (4aR,10aR)-1-пропил-7-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ола и (4aR,10aR)-1-пропил-6-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ола (2,94 г, 7,04 ммоль) растворяли в дихлорметане (30 мл) в атмосфере азота и охлаждали до 0°С. Добавляли пиридин (6,00 мл) с последующим добавлением ди-трет-бутилдикарбоната (6,30 г), и обеспечивали нагревание реакционной смеси до комнатной температуры в течение 3-4 часов и затем перемешивали при комнатной температуре в течение ночи. Добавляли 10 мл МеОН, и реакционную смесь выпаривали, выпаривали совместно с дихлорметан/н-гептан дважды, растворяли в дихлорметане и выпаривали на вспомогательном фильтровальном веществе.
Очистка с помощью колоночной хроматографии (элюент: н-гептан/этилацетат/триэтиламин, 100:0:0-75:20:5) обеспечивала получение смеси трет-бутил((4aR,10aR)-1-пропил-7-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)карбоната [А] и трет-бутил((4aR,10aR)-1-пропил-6-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)карбоната [В] (3,6 г) в виде масла.
Результаты ЯМР (CDCl3) после высушивания демонстрировали смесь региоизомеров.
Промежуточные соединения:
(4aR,10aR)-6-((трет-бутоксикарбонил)окси)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-илацетат и (4aR,10aR)-7-((трет-бутоксикарбонил)окси)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-илацетат.
трет-Бутил-((4aR,10aR)-1-пропил-7-((триизопропилсилил)окси)-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)карбонат (3,600 г, 6,95 ммоль) (смесь [А]:[В] из предыдущей стадии) растворяли в THF (150 мл) в атмосфере азота при 0°С, добавляли триэтиламинтригидрофторид (2,97 г, 3,00 мл, 18,42 ммоль) и смесь перемешивали при 0°С. Через 3 часа при 0°С добавляли пиридин (10,0 мл, 124 ммоль) и уксусный ангидрид (4,33 г, 4,00 мл, 42,4 ммоль) непосредственно в реакционную смесь при 0°С и обеспечивали нагревание реакционной смеси до комнатной температуры. Через 16 часов добавляли 20 мл МеОН и реакционную смесь выпаривали, повторно растворяли в дихлорметане/н-гептане и выпаривали на вспомогательном фильтровальном веществе с последующей очисткой с помощью хроматографии под вакуумом на сухой колонке с получением (4aR,10aR)-6-((трет-бутоксикарбонил)окси)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-илацетата и (4aR,10aR)-7-((трет-бутоксикарбонил)окси)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-илацетата в виде масла/пены.
LCMS (способ 550) rt = 0,56 минуты, [М+Н]+ = 404 масса/заряд.
Промежуточные соединения:
(2S,3R,4S,5S,6S)-2-(((4aR,10aR)-7-ацетокси-1-пропил-1,2,3,4,4a,5,10,10a-октагидробензо[g]хинолин-6-ил)окси)-6-(метоксикарбонил)тетрагидро-2Н-пиран-3,4,5-триилтриацетат и (2S,3R,4S,5S,6S)-2-(((4aR,10aR)-6-ацетокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)окси)-6-(метоксикарбонил)тетрагидро-2Н-пиран-3,4,5-триилтриацетат.
(4aR,10aR)-6-((Трет-бутоксикарбонил)окси)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-илацетат (2,489 г, 6,17 ммоль) (смесь (4aR,10aR)-6-((трет-бутоксикарбонил)окси)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-илацетата и предположительно (4aR,10aR)-7-((трет-бутоксикарбонил)окси)-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-илацетата) растворяли в дихлорметане (60 мл) в атмосфере азота при комнатной температуре, добавляли (2S,3R,4S,5S,6S)-6-(метоксикарбонил)тетрагидро-2Н-пиран-2,3,4,5-тетраилтетраацетат (7,529 г, 20,01 ммоль) с последующим добавлением диэтилового эфирата трифторида бора (6,72 г, 6,0 мл, 47,3 ммоль) и смесь перемешивали при комнатной температуре в течение 5 дней. Смесь разбавляли с помощью дихлорметана и МеОН и выпаривали на вспомогательном фильтровальном веществе. Очистку проводили с помощью хроматографии под вакуумом на сухой колонке с получением смеси (2S,3R,4S,5S,6S)-2-(((4aR,10aR)-7-ацетокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)-6-(метоксикарбонил)тетрагидро-2Н-пиран-3,4,5-триилтриацетата и (2S,3R,4S,5S,6S)-2-(((4aR,10aR)-6-ацетокси-1-пропил-1,2,3,4,4a,5,10,10a-октагидробензо[g]хинолин-7-ил)окси)-6-(метоксикарбонил)тетрагидро-2Н-пиран-3,4,5-триилтриацетата (4,37 г) в виде пены/твердого вещества.
LC-MS (способ 555) rt = 1,94 минуты, [М+Н]+ = 620 масса/заряд.
(Id)
(2S,3S,4S,5R,6S)-3,4,5-Тригидрокси-6-(((4aR,10aR)-7-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)тетрагидро-2Н-пиран-2-карбоновая кислота и
(Id')
(2S,3S,4S,5R,6S)-3,4,5-Тригидрокси-6-(((4aR,10aR)-6-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)окси)тетрагидро-2Н-пиран-2-карбоновая кислота и
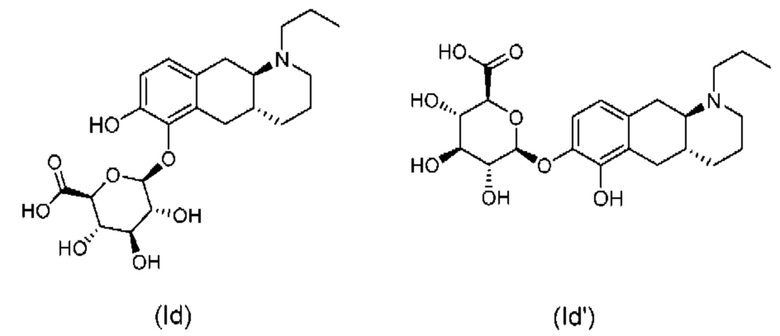
Смесь (2S,3R,4S,5S,6S)-2-(((4aR,10aR)-7-ацетокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)-6-(метоксикарбонил)тетрагидро-2Н-пиран-3,4,5-триилтриацетата и (2S,3R,4S,5S,6S)-2-(((4aR,10aR)-6-ацетокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)окси)-6-(метоксикарбонил)тетрагидро-2Н-пиран-3,4,5-триилтриацетата (3,82 г, 6,17 ммоль) растворяли в МеОН (100 мл) и воде (20 мл), охлаждали до 0°С, добавляли цианид калия (7,295 г, 112 ммоль) и обеспечивали медленное нагревание суспензии до комнатной температуры в течение 17,5 часа. Неочищенную смесь выпаривали на вспомогательном фильтровальном веществе и высушивали. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/МеОН/вода 100:0:0 - 0:50:50) с получением соотношения (Id') и (Id), составляющего 5-6:1. Смесь разделяли с помощью препаративной LCMS.
Собранные фракции, соответствующие пику 1, содержащие (Id'), объединяли, выпаривали и объединяли с другой партией 186 мг (Id')-TFA, которая была получена подобным образом с применением МеОН, выпаривали и высушивали с получением твердого вещества. (Id') повторно суспендировали в 10 мл EtOH и добавляли 100 мл МТВЕ, и полученную суспензию перемешивали при комнатной температуре в течение 8 часов, суспензию фильтровали, и осадок промывали с помощью 2×10 мл МТВЕ и высушивали в вакуумной печи в течение ночи с получением 1,601 г (Id') в виде твердого вещества, соответствующего (2S,3S,4S,5R,6S)-3,4,5-тригидрокси-6-(((4aR,10aR)-6-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)окси)тетрагидро-2Н-пиран-2-карбоновой кислоте.
Собранные фракции, соответствующие пику 2, содержащие (Id), объединяли, выпаривали, переносили в меньшую колбу с МеОН, выпаривали, повторно растворяли в приблизительно 12 мл МеОН и повторно очищали с помощью препаративной LCMS, и выпаривали с получением пены/твердого вещества. Соответствующие фракции объединяли, выпаривали, переносили с МеОН в меньшую колбу и выпаривали и объединяли с другой партией 40,7 мг (Id), которая была получена подобным образом. Объединенную партию растворяли в 2,5 мл EtOH, добавляли 25 мл МТВЕ, и суспензию перемешивали при комнатной температуре. Через 8 часов суспензию фильтровали и осадок промывали с помощью 2×2,5 мл МТВЕ и высушивали в вакуумной печи в течение ночи с получением 362,2 мг (Id) в виде твердого вещества. (Id) суспендировали в приблизительно 10 мл EtOH, добавляли 50 мл МТВЕ, и суспензию перемешивали при комнатной температуре и фильтровали через 19 часов, и осадок промывали с помощью 2×10 мл МТВЕ и высушивали в вакуумной печи при 40°С с получением 0,279 г (2S,3S,4S,5R,6S)-3,4,5-тригидрокси-6-(((4aR,10aR)-7-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)тетрагидро-2Н-пиран-2-карбоновой кислоты (Id) в виде твердого вещества.
(Id')
LCMS (способ 551) rt = 0,37 минуты, [М+Н]+ = 438,1 масса/заряд.
1Н ЯМР (600 МГц, Метанол-d4) δ 7,02 (d, J=8,4 Гц, 1Н), 6,65 (d, J=8,4 Гц, 1Н),4,73 (d, J=7,7 Гц, 1Н), 3,89 (d, J=9,7 Гц, 1Н), 3,68 - 3,58 (m, 2Н), 3,54 (dd, J=9,3, 7,7 Гц, 1 Н), 3,49 (t, J=9,1 Гц, 1 Н), 3,47 - 3,36 (m, 2Н), 3,30 (dt, J=11,2, 5,6 Гц, 1Н), 3,21 - 3,11 (m, 3Н), 2,85 (dd, J=15,4, 11,3 Гц, 1Н),2,35 (dd, J=17,6, 11,5 Гц, 1Н), 2,12 - 2,02 (m, 2Н), 2,02-1,84 (m, 3Н), 1,81-1,71 (m, 1Н), 1,49 (qd, J=13,0, 3,7 Гц, 1Н), 1,09 (t, J=7,3 Гц, 3Н).
(Id)
LCMS (способ 551) rt = 0,39 минуты, [М+Н]+ = 438,1 масса/заряд.
1Н ЯМР (600 МГц, Метанол-d4) δ 6,87 (d, J=8,3 Гц, 1Н), 6,74 (d, J=8,4 Гц, 1Н),4,62 (d, J=7,9 Гц, 1 Н), 3,75 (dd, J=17,7, 4,9 Гц, 1Н), 3,66-3,62 (m, 2Н), 3,61-3,51 (m, 2Н), 3,50-3,35 (m, 3Н), 3,31-3,22 (m, 1Н), 3,14 (qd, J=12,7, 4,0 Гц, 2Н), 2,83 (dd, J=15,2, 11,3 Гц, 1Н), 2,37 (dd, J=17,7, 11,7 Гц, 1Н), 2,12 (d, J=13,4 Гц, 1Н), 2,08-2,00 (m, 1Н), 1,98 -1,83 (m, 3Н), 1,81 -1,71 (m, 1Н), 1,44 (qd, J=13,2,3,9 Гц, 1Н), 1,09 (t, J=7,3 Гц, 3Н).
Пример 3. Получение примеров твердых форм по настоящему изобретению
В настоящем примере описаны способы получения твердых форм по настоящему изобретению и характеристика твердых форм на основе порошковых рентгеновских дифрактограмм (XRPD) и термогравиметрического анализа (TGA). Характеристика была выполнена с использованием способов, описанных ниже.
XRPD
Порошковые рентгеновские дифрактограммы измеряли на рентгеновском дифрактометре PANalytical X'Pert PRO с использованием излучения CuKα1 (λ=1,5406 Å). Образцы измеряли в режиме отражения в диапазоне 2θ 2-40 или 3-40 с использованием детектора X'celerator.
Выбранные пики
Пики были найдены путем поиска пиков на дифрактограмме с использованием программы "HighScore Plus" от panalytical. 10 пиков, выбранных в качестве характеристических для соединений, перечислены в таблице 2 ниже (а), а также 15 пиков с наивысшей интенсивностью для каждого соединения (b). Данные дифракции указаны ±0,1°. Хорошо известно, что значения относительной интенсивности между характеристиками партий одной и той же твердой формы могут значительно различаться из-за эффектов предпочтительной ориентации.

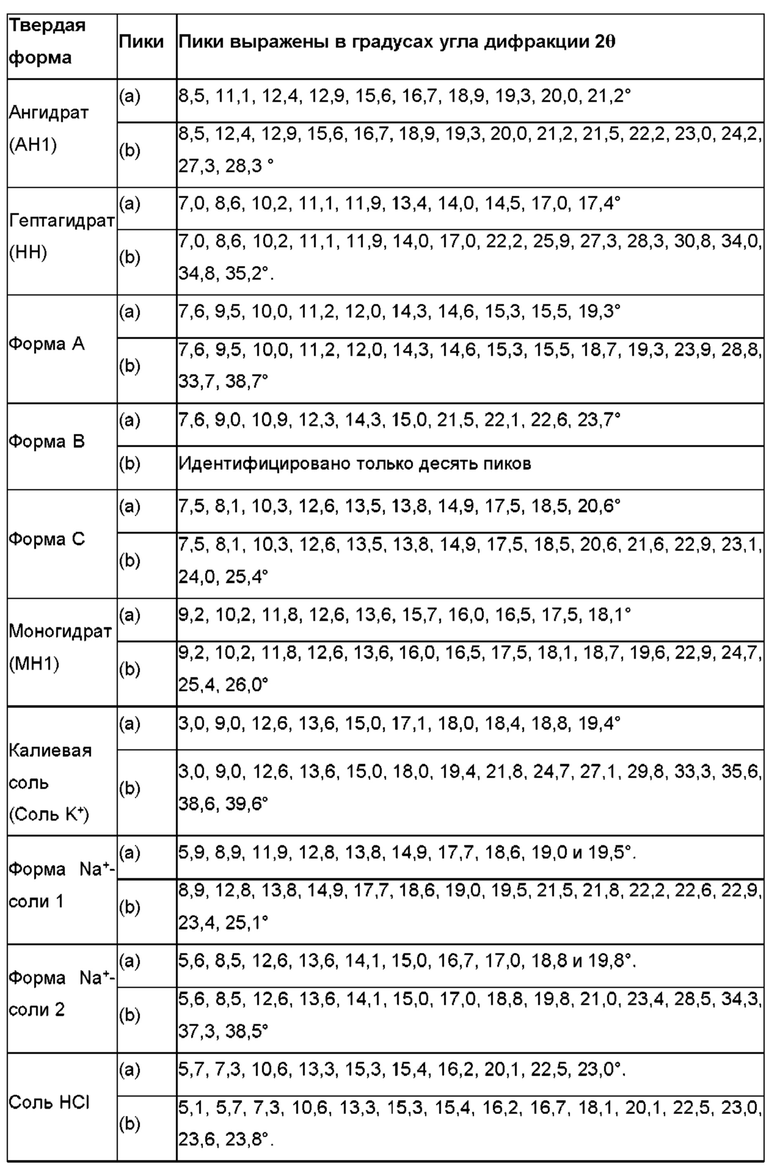

TGA
Измерения в рамках термогравиметрического анализа (ТГА) выполняли с использованием TA-instruments Discovery TGA. Образец 1 -10 мг нагревают со скоростью 10°/мин в открытом сосуде в потоке азота. Размер образцов составляет от 2 до 6,4 мг.
Получение дигидрата (DH1) соединения (Id)
Пример а)
1-горлую круглодонную колбу объемом 250 мл загружали соединением (Id) (4,0 г, включая некоторое количество гидратной воды), воду (12 мл) и этанол (12 мл). Белую суспензию нагревали до 75°С, при этом получали прозрачный раствор. Раствор охлаждали до 55°С. Добавляли этанол (56 мл) при 50-55°С в течение 10 минут. Суспензию перемешивали в течение ночи при 50°С. Суспензию охлаждали в течение 6 часов до 23°С и фильтровали. Осадок на фильтре дважды промывали этанолом (2×10 мл). Белый осадок на фильтре переносили в лоток для сушки и высушивали на воздухе в вытяжном шкафу в течение 1 дня до достижения постоянной массы. Выход 3,8 грамма DH1.
Пример b)
3-горлую круглодонную колбу объемом 5 л загружали соединением (Id) (197 г, включая некоторое количество гидратной воды), воду (0,60 л) и этанол (0,60 л). Белую суспензию нагревали с обратным холодильником, при этом получали прозрачный раствор. Раствор продолжали нагревать с обратным холодильником в течение 30 минут и затем охлаждали в течение 35 минут до 54°С. При 54°С суспензию дигидрата (DH1) соединения (Id) (6,9 г) в этаноле (0,10 л) добавляли одной порцией, а затем добавляли дополнительный этанол (0,10 л). Температуру полученной суспензии повышали с 52-54°С за 5 минут с последующим добавлением этанола (1,60 л) в течение 17 минут, поддерживая температуру суспензии на уровне 53-55°С во время добавления.
Суспензию перемешивали 1 час при 53°С и затем медленно охлаждали в течение ночи до 23°С. Суспензию фильтровали и полученный осадок на фильтре дважды промывали этанолом (2×0,40 л). Белый осадок на фильтре переносили в лоток для сушки и высушивали на воздухе в вытяжном шкафу в течение 2 дней до достижения постоянной массы. Выход 188 г DH1.
Полученный DH1 характеризовали с помощью XRPD (см. таблицу 2 и фигуру 8) и TGA (см. фигуру 8).
Получение ангидрата (АН1) соединения (Id)
Пример а)
В круглодонной колбе объемом 500 мл, оборудованной мешалкой, 8,8 г соединения (Id) (выпаренный маточный раствор из других партий) суспендировали в смеси 9:1 EtOH/Н20 (90 мл) и нагревали до 95°С. Суспензию перемешивали (320 об/мин) в течение 1 ч. 20 минут при 95°С. Затем тепловую баню выключали и смесь перемешивали (320 об/мин) в течение 2 ч., пока температура ванны не достигала к. т.Осадок собирали посредством вакуумного фильтрования и колбу/осадок на фильтре промывали EtOH (2×50 мл). Полученное твердое вещество высушивали на фильтровальной подушке (в вакууме) в течение 1 часа, затем соскребали в чашу для кристаллизации и высушивали на воздухе в течение 48 часов. Выход: 7,4 г АН1.
Пример b)
В 1-горлую круглодонную колбу объемом 250 мл загружали соединение (Id) (3,0 г), воду (9 мл) и этанол (9 мл). Суспензию нагревали до 75°С, при этом получали прозрачный раствор. Раствор охлаждали до 55°С. Добавляли этанол (162 мл) при 50-55°С в течение 15 минут. При добавлении этанола наблюдалось осаждение. Суспензию перемешивали в течение ночи при 50С.Суспензию охлаждали в течение 6 часов до 23°С и фильтровали. Осадок на фильтре дважды промывали этанолом (2×10 мл). Осадок на фильтре переносили в лоток для сушки и высушивали на воздухе в вытяжном шкафу в течение 1 дня до достижения постоянной массы. Выход 2,7 г АН1.
Полученный АН1 характеризовали с помощью XRPD (см. таблицу 2 и фигуру 9А) и TGA (см. фигуру 9В).
Получение гептагидрата (НН) соединения (Id)
Гептагидрат (НН) соединения (Id) получали посредством осаждения из воды. Добавляли 45,5 мг DH1 соединения (Id), полученного в примере b выше, в 0,5 мл воды и встряхивали в течение ~2 минут. Влажные кристаллы удаляли из раствора и анализировали с помощью XRPD, показав, что образовался НН (см. таблицу 2 и фигуру 10А). НН дополнительно анализировали с помощью TGA (см. фигуру 10b).
Получение формы А соединения (Id)
Форму А получают с помощью хранения гептагидрата соединения (Id) (НН) при комнатной температуре и RH ~5%.
Полученную форму А соединения (Id) характеризовали с помощью XRPD (см. таблицу 2 и фигуру 11).
Получение формы В соединения (Id)
Форму В получали с помощью хранения гептагидрата соединения (Id) (НН) при комнатной температуре и RH ~10%.
Полученную форму В соединения (Id) характеризовали с помощью XRPD (см. таблицу 2 и фигуру 12).
Получение формы С соединения (Id)
Форму С получали с помощью хранения гептагидрата соединения (Id) (НН) при комнатной температуре и RH ~15%.
Полученную форму С соединения (Id) характеризовали с помощью XRPD (см. таблицу 2 и фигуру 13).
Получение моногидрата (МН1) соединения (Id)
(МН1) образовывался вследствие нагревания (DH1) до 105°С и последующей сорбции воды в условиях окружающей среды с получением моногидрата. Его также можно получить путем высушивания (DH1) при комнатной температуре до 0% RH и последующей сорбции воды в условиях окружающей среды.
Полученный МН1 характеризовали с помощью XRPD (см. таблицу 2 и фигуру 14а) и TGA (см. фигуру 14b).
Получение калиевой соли соединения (Id)
В круглодонную колбу объемом 25 мл с магнитной мешалкой загружали гептагидрат соединения (Id) (0,50 г). Затем добавляли воду (0,5 мл) и водный гидроксид калия (0,11 г, 0,075 мл, 0,90 ммоль, 46% (мас./мас.)) и смесь становилась суспензией. Смесь нагревали до 80°С, затем охлаждали до 50-60°С. Добавляли дополнительную воду (0,2 мл), получая почти прозрачный раствор. По каплям добавляли i-PrOH (1,5 мл), сначала получали прозрачный раствор, затем в осадок выпадало белое твердое вещество. Температуру повышали до 80°С и получали прозрачный раствор. По каплям добавляли i-PrOH (2,5 мл), затем смесь нагревали с обратным холодильником и отгоняли 1-2 мл, добавляли i-PrOH (1-2 мл) и повторяли отгонку/добавление один раз. Смесь медленно охлаждали до 5°С и фильтровали, получая 0,41 г калиевой соли соединения (Id).
Полученную калиевую соль характеризовали с помощью XRPD (см. таблицу 2 и фигуру 15а) и TGA (см. фигуру 15b).
Получение натриевой соли формы 1 соединения (Id)
В круглодонную колбу объемом 25 мл с магнитной мешалкой загружали гептагидрат (Id) (0,5 г). Затем добавляли воду (0,500 мл) и NaOH (0,083 мл, 10,8 моль) и смесь становилась суспензией). Смесь нагревали до 50°С, затем добавляли дополнительное количество воды (0,500 мл), получая прозрачный раствор. Температуру повышали до 80°С и по каплям добавляли i-PrOH (3,50 мл), и гелеобразное твердое вещество выпадало в осадок. Смесь перемешивали в течение 30 минут и затем обеспечивали медленное остывание до комнатной температуры и затем до 5°С. Затем осадок выделяли посредством очень медленного фильтрования (фильтрование в течение периода не менее 6 часов) и осадок промывали 2×0,5 мл iPrOH. Твердое вещество высушивали в вакуумной печи при 40°С в течение ночи. Это обеспечивало получение натриевой соли соединения (Id) (0,35 г) в виде твердого вещества.
Полученную натриевую соль формы 1 характеризовали с помощью XRPD (см. таблицу 2 и фигуру 16а) и TGA (см. фигуру 16b).
Получение натриевой соли формы 2 соединения (Id)
Добавляли 51,73 мг в 70 мкл воды и смесь нагревали до 60°С до растворения, после чего добавляли 150 мкл iPrOH. Затем смесь нагревали до 60°С, добавляли 250 мкл iPrOH и смесь нагревали до 60°С. После выдерживания при комнатной температуре выпадал осадок. Жидкость отсасывали и твердую часть помещали при 90°С, что привело к частичному растворению, поэтому ее снова переставали нагревать и получали натриевую соль формы 2.
Полученную натриевую соль формы 2 характеризовали с помощью XRPD (см. таблицу 2 и фигуру 17а) и TGA (см. фигуру 17b).
Получение гидрохлоридной соли соединения (Id)
Взвешивали приблизительно 500 мг гептагидрата соединения (Id), затем суспендировали в 3,75 мл IPA и добавляли 1,05 эквивалента HCl в 2,5 мл IPA. Температуру смеси API/противоион/растворитель меняли от температуры окружающей среды до 40°С в 4-часовых циклах. Через приблизительно 1 день наблюдалось, что препарат растворяется при 40°С и содержит небольшое количество смолистого материала при температуре окружающей среды. Обеспечивали выпаривание в рамках эксперимента при температуре окружающей среды. Материал выглядел как смола после неполного выпаривания и повторного суспендирования с использованием IPA, 500 мкл IPA.
Масштабирование повторно получали с использованием меньшего количества IPA, взвешивали приблизительно 500 мг гептагидрата соединения (Id), затем суспендировали в 0,9 мл IPA и добавляли 1,05 эквивалента HCI в 2,5 мл IPA. Температуру смеси API/противоион/растворитель меняли от температуры окружающей среды до 40°С в 4-часовых циклах. Через приблизительно 1 день обеспечивали выпаривание препарата при комнатной температуре из-за ограниченного количества присутствующих твердых веществ. После неполного выпаривания материал соскребали шпателем, отделяли посредством фильтрования на центрифуге и высушивали в вакууме при температуре окружающей среды в течение приблизительно 20 часов.
Полученную гидрохлоридную соль характеризовали с помощью XRPD (см. таблицу 2 и фигуру 18).
Получение гид роб ром ид ной соли соединения (Id)
Взвешивали приблизительно 500 мг гептагидрата соединения (Id) и суспендировали в 3,75 мл IPA и добавляли 1,05 эквивалента HBr в 2,5 мл IPA. Температуру смеси API/противоион/растворитель меняли от температуры окружающей среды до 40°С в 4-часовых циклах в течение приблизительно 3 дней.
Полученную гидробромидную соль характеризовали с помощью XRPD (см. таблицу 2 и фигуру 19).
Пример 4. Исследования стабильности выбранных твердых форм
Исследования стабильности проводили на гептагидрате (НН), дигидрате (DH1) и калиевой соли соединения (Id) (соль K+). Вещества были упакованы индивидуально в закрытые полиэтиленовые пакеты с картонной коробкой в качестве вторичного упаковочного материала. Во время исследования стабильности различные партии были протестированы в отношении внешнего вида, примесей и содержания воды с помощью анализа (безводный, т.е. рассчитанный как безводное соединение). Кроме того, XRPD выполняли, как описано в примере 3, в выбранные моменты времени.
Кроме того, исследования стабильности в стрессовых условиях выполняли для гептагидрата (НН), дигидрата (DH1) и калиевой соли соединения (Id) (соль K+). Для исследований стабильности в стрессовых условиях вещества хранили в открытых чашках в темноте при 40°С/75% RH, 60°С и 60°С/80% RH.
Для характеристики использовались следующие способы
LC-УФ способы (анализ и примеси)
LC-УФ проводили на приборе Agilent для HPLC, состоящего из Agilent 1200 для HPLC или эквивалента, включая автоматический пробоотборник и детектор DAD (работающий при 278 нм).
Условия LC. Колонка представляла собой Synergi Polar-RP 4 мкм; 4,6×150 мм, работающую при 40°С с 1,0 мл/мин бинарного градиента, состоящего из воды/ацетонитрила+2 мл TFA/мл (90:10) (А) и воды/аиетонитрила+2 мл TFA/мл (35:65) (В).
Градиент
Общее время прогона: 19 минут.
Количество примесей определяли как % площади пика примеси по отношению к площади основного пика.
Определение по Карлу Фишеру (определение воды)
Содержание воды определяли посредством кулонометрического титрования по Карлу Фишеру в соответствии с Европейской фармакопеей, глава 2.5.32 (устройство для обработки препаратов в сушильной камере Metrohm 874 и KF-колонометр Metrohm 851).
Содержащуюся воду выпаривали путем нагревания образцов до 150°С и водяной пар переносили с помощью азота в камеру для титрования, где его титровали до конечной точки с использованием реагента для титрования Hydranal Coulomat AG Oven (артикул 34739).
Результаты Стабильность
Разрушение, составляющее менее 0,1%, как определено методом LC-UV, наблюдали как для гептагидрата (НН), так и для калиевой соли (соль K+) и дигидрата (DH1) соединения (Id). Изменения внешнего вида, содержания воды и физической формы (XRPD) наблюдались для гептагидрата (НН). Через 3 месяца при 40°С/75% RH гептагидрат изменил внешний вид на слегка серый цвет и превратился в дигидрат. При 25°С/60% RH с течением времени наблюдается небольшое изменение цвета в дополнение к явному изменению физической формы. Результаты представлены в таблице 3 ниже.
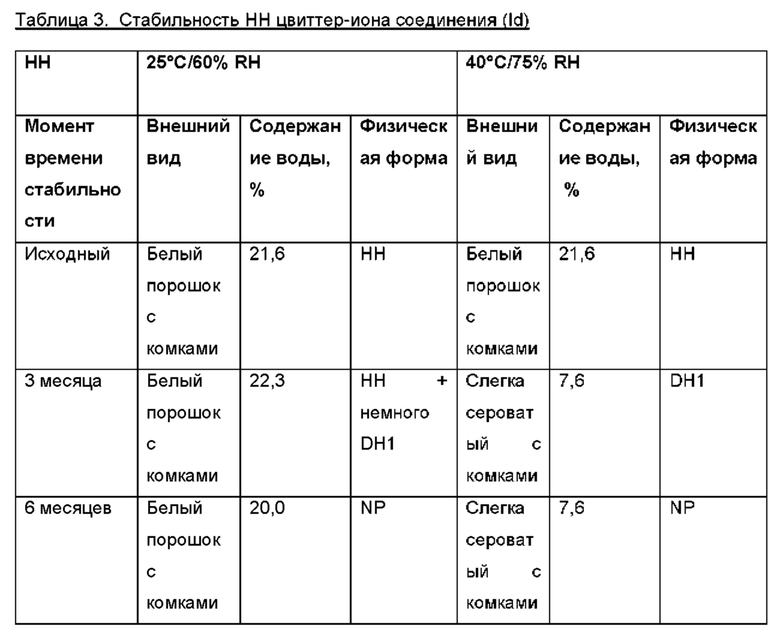
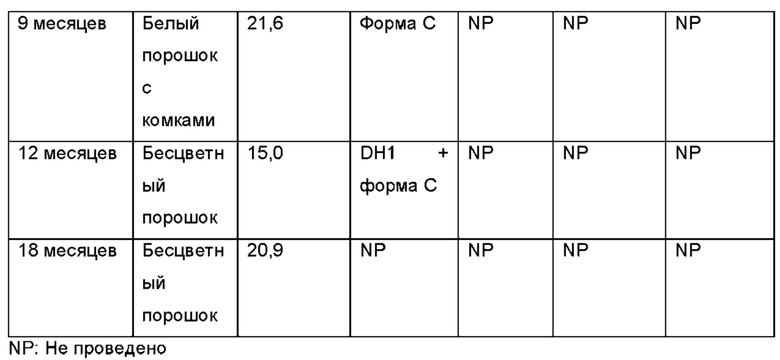
Для калиевой соли результаты показали, что образцы остались в той же физической форме, что была определена с помощью XRPD. Однако наблюдались некоторые изменения в содержании воды, и во время тестирования стабильности также наблюдалось образование коричневых комков. Обобщение результатов для калиевой соли соединения (Id) показано в таблице 4 ниже.
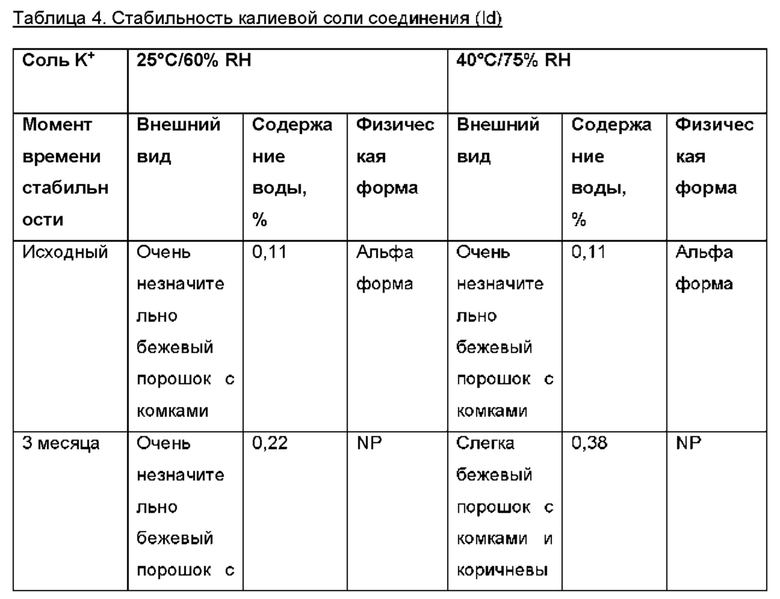
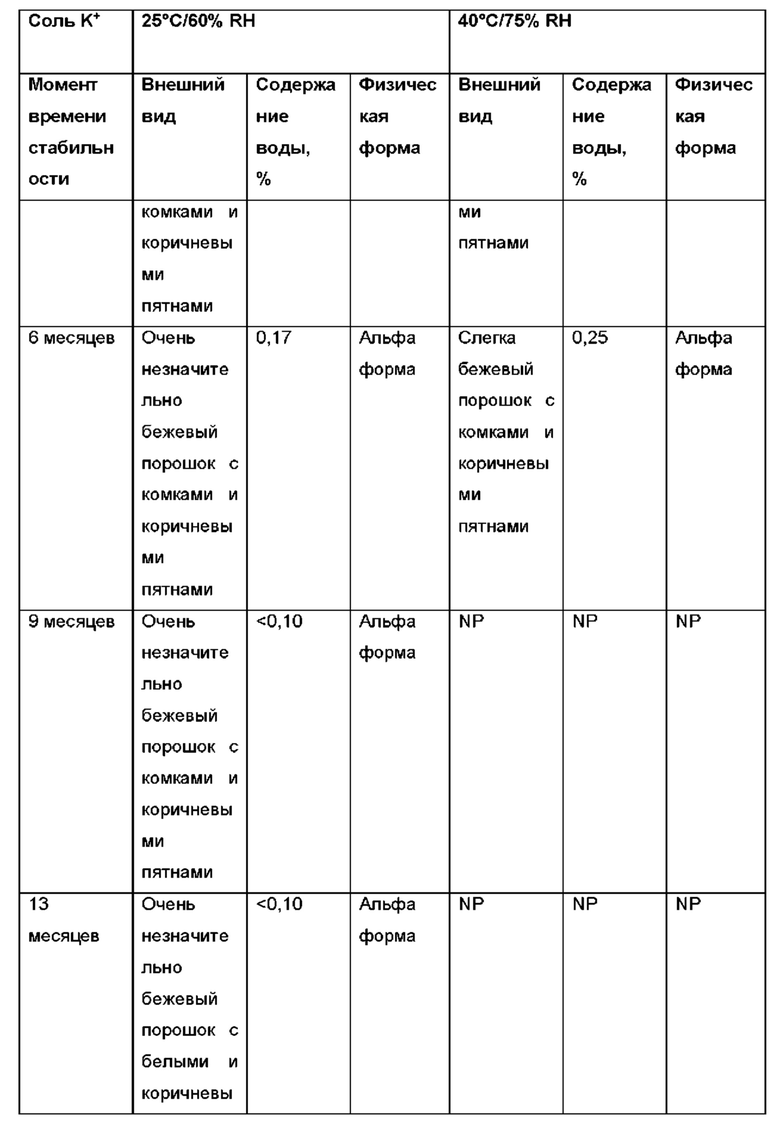
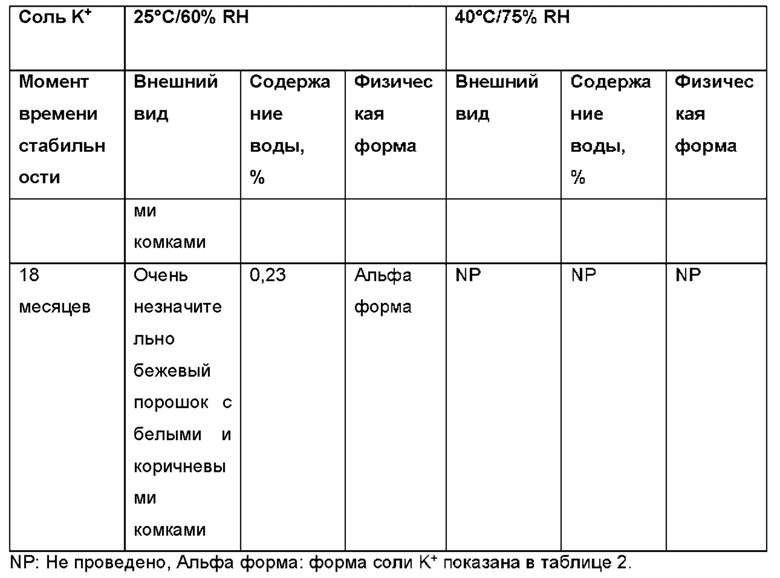
Для дигидрата никаких изменений внешнего вида, содержания воды или физической формы (XRPD) не наблюдалось в течение 6 месяцев тестирования стабильности при 40°С/75% RH и 25°С/60% RH. Даже через 10 месяцев при 25°С/60% RH не наблюдалось никаких изменений внешнего вида и содержания воды. Обобщение результатов для дигидрата соединения (Id) показано в таблице 5 ниже.
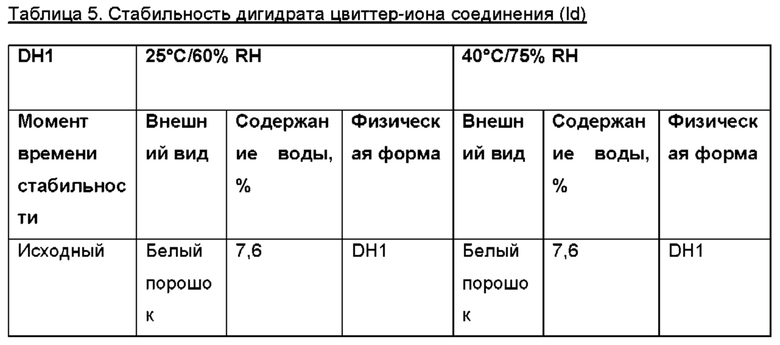
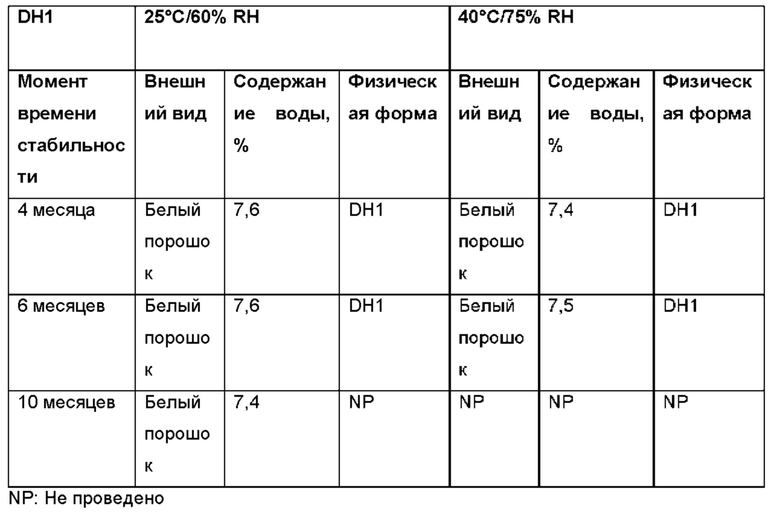
Результаты исследований стабильности показали, что дигидрат цвиттер-иона соединения (Id) (DH1) имел наилучшую стабильность в отношении внешнего вида, содержания воды и физической формы, как измерено при 40°С/75% RH и при 25°С/60% RH в течение 6 месяцев.
Стабильность в стрессовых условиях
Испытание на стабильность в стрессовых условиях проводили, как описано выше, и количество продуктов разрушения определяли на основе способа LC-UV, описанного выше.
Общая сумма примесей через 6 месяцев хранения показана в таблице 6 ниже.
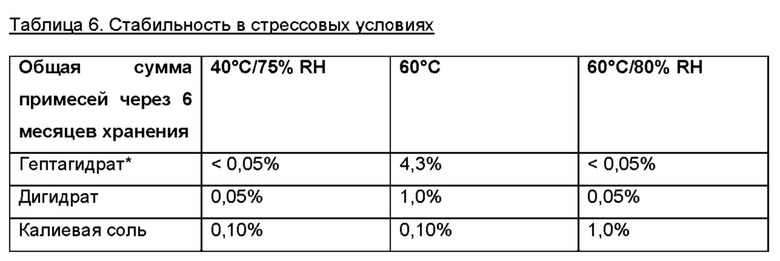
* Гептагидрат превратился в дигидрат при 40°С/75% RH и 60°С/80% RH. При 60°С гептагидрат превратился в форму А.
Из результатов испытания на стабильности в стрессовых условиях в таблице 6 можно видеть, что тестированные твердые формы были относительно стабильными в отношении химического разрушения, в частности, дигидрат и калиевая соль.
Пример 5. Дополнительные исследования стабильности выбранных твердых форм
В следующем примере описываются дополнительные характеристики гептагидрата (НН), дигидрата (DH1) соединения (Id) и калиевой соли соединения (Id).
DVS
Для оценки выбранных твердых форм в дальнейшем использовали динамическую сорбцию паров (DVS). Гигроскопичность и поведение при обезвоживании можно исследовать с помощью анализа DVS. Эксперименты DVS проводились с использованием прибора для DVS Advantage 01 от Surface Measurement Systems. Для анализа использовали образцы твердых форм по 4-10 мг. Абсорбцию воды/десорбцию целевого твердого вещества контролировали при изменении относительной влажности от приблизительно 0% до приблизительно 90% с шагом приблизительно 5-10% RH.
На фигурах 20 и 21 показаны результирующие кривые для DH1 и соли K+.
Для DH1 анализ DVS показал, что содержание воды в DH1 является очень стабильным в диапазоне влажности 5-90% RH. Абсорбируется или десорбируется менее 0,1% воды.
Для формы калиевой соли соединения (Id) (соль K+) DVS показал постепенное изменение массы до 0,6% при 80% RH и еще 1% при 90% RH. Только при 95% RH наблюдалось устойчивое увеличение массы, однако из кривой можно видеть, что вода десорбируется, как только влажность снова понижается. Кривая второго цикла показала то же поведение, что и первый цикл, таким образом, никаких изменений в кристаллической решетке не произошло, и соль является устойчивой к изменению влажности.
Анализ DVS гептагидрата (НН) показал, что гептагидрат абсорбирует и десорбирует воду при влажности от 20% RH до 95% RH без изменения кристаллической формы. При влажности ниже 20% гептагидрат (НН) превращается в другие менее гидратированные формы и не превращается обратно в гептагидрат, если материал не подвергается воздействию высокой влажности.
Таким образом, из анализа DVS можно сделать вывод, что DH1 негигроскопичен в диапазоне влажности от 5 до 80% RH.
Измельчение и прессование НН соединения (Id)
Образец гептагидрата измельчали вручную, используя ступку и пестик, в течение 2 минут и затем анализировали с помощью XRPD.
Результаты XRPD сравнивали с результатами XRPD перед измельчением. После измельчения отражения стали немного шире и стал виден аморфный ореол. Измельченный образец хранили при 95% RH в течение 1 недели, и последующий анализ XRPD показал, что отражения соответствовали исходному образцу перед измельчением. Таким образом, гептагидрат восстановил степень кристалличности после хранения.
DH1 соединения (Id)
Образец DH1 соединения (Id) измельчали вручную, используя ступку и пестик, в течение 2 минут, и образец подвергали прессованию с давлением 300 фунтов на квадратный дюйм в течение 5 минут.
Впоследствии образец анализировали с помощью XRPD. Результаты XRPD после обработок не показали признаков снижения степени кристалличности по сравнению с результатами XRPD исходного образца до измельчения и испытания прессованием.
Далее измельчали другой образец DH1 соединения (Id). Результаты XRPD размолотого образца по сравнению с немолотым материалом не показали никаких различий в диаграмме XRPD. Таким образом, сравнение XRPD показало, что не было видимого изменения степени кристалличности образца DH1.
Таким образом, можно сделать вывод, что DH1 соединения (Id) очень устойчив к физическому стрессу.
Калиевая соль соединения (Id)
Образцы формы соли K+, как описано в таблице 2 Примера 3, либо измельчали в ступке с пестиком, либо прессовали в IR-прессе в течение 5 минут. После обработки образцы анализировали с помощью XRPD. Затем образцы помещали при 95% RH на 1 неделю и повторно анализировали с помощью XRPD.
Результаты. Измельчение привело к сильному расширению отражений XRPD, но последующее воздействие высокой влажности снова привело к резким отражениям. Воздействие высокого давления также приводит к некоторому расширению отражений XRPD, хотя и в меньшей степени, чем измельчение. Резкие отражения восстанавливаются при воздействии влажности. Таким образом, форма соли K+ восстановила степень кристалличности после хранения при высокой влажности.
В заключение, исследования DVS и измельчения в настоящем примере показали, что дигидрат цвиттер-иона соединения (Id) был наиболее стабильной твердой формой, поскольку он не является гигроскопичным, и также был обнаружено, что он является стабильным при тестировании после измельчения и давления.
Примеры 6-10. Характеристика соединения (Id) in vitro и in vivo
Пример 6a. Превращение соединения формулы (Id) в гепатоцитах крысы и человека
Соединение (Id) инкубировали при 1 мкг/мл с гепатоцитами человека или крысы, суспендированными в DMEM (среда Игла, модифицированная по Дульбекко) с HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) при рН 7,4. Концентрация клеток при инкубации составляла 1×106 жизнеспособных клеток/мл. Инкубации проводили в стеклянных пробирках при 37°С с общим инкубируемым объемом 3,5 мл и с проведением инкубации в двух повторностях для каждого исследуемого образца. 3,5 мл суспензии гепатоцитов уравновешивали в течение 10 минут на водяной бане, установленной на 37°С, где затем инициировали инкубацию путем добавления 3,5 мкл исходного раствора исследуемого образца в DMSO (диметилсульфоксиде) и осторожного переворачивания пробирок. Конечная концентрация растворителя в инкубируемых средах составляла 0,1% DMSO. Образцы объемом 600 мкл отбирали из инкубируемых сред в заданные моменты времени, равные 0,25, 5, 15, 30 и 60 минутам, после обеспечения гомогенности суспензий гепатоцитов. Извлеченный объем добавляли в криопробирки Nunc объемом 1 мл на влажном льду, содержащие 60 мкл ледяной аскорбиновой кислоты (100 мг/мл) и 30 мкл охлажденного льдом 100 мМ 1,4-лактона сахарной кислоты в 0,5 М лимонной кислоте. Содержимое пробирок смешивали и добавляли 35 мкл раствора охлажденной льдом 20% муравьиной кислоты. Содержимое пробирок тщательно смешивали и хранили при -80°С в ожидании анализа. Способ анализа и оборудование, применяемое для анализа (I) при введении доз соединения (Id), являлись такими, как описано в примерах 9 и 10 ниже в разделе "Оборудование, применяемое для анализа соединения (I) при введении доз соединения (1 с) и (Id.)".
На фигуре 7 показано зависимое от времени превращение в соединение (I) из (Id) как в гепатоцитах крысы, так и в гепатоцитах человека.
Пример 6b. Превращение соединения формулы (Id) в свежей крови крысы и человека
Превращение (Id) в крови человека (в среднем от 3 доноров) и крови крыс (в среднем от 45 доноров) в (I) было показано в свежей крови при 37°С с добавлением 1 мкг/мл (Id). Уровень (I) измеряли через 0, 5, 15, 30 и 60 минут в выделенной плазме крови. Способ анализа и оборудование являются такими, как описано в примерах 9 и 10 ниже в разделе "Оборудование, применяемое для анализа соединения (I) при введении доз соединений (Ic) и (Id)".
На фигуре 8 показано зависимое от времени превращение в соединение (I) из (Id) как в крови крысы, так и в крови человека.
Пример 7. Дофаминовая агонистическая активность
Агонизм дофаминового рецептора D1
Агонизм дофаминового рецептора D1 измеряли с применением HTRF сАМР от CisBio с использованием протокола, разработанного HD Biosciences (Китай). Вкратце, анализ представляет собой анализ способом резонансного переноса энергии гомогенной флуоресценции с временным разрешением (HTRF), в котором измеряют продуцирование сАМР клетками в конкурентном иммуноанализе между нативным сАМР, продуцируемым клетками, и сАМР, меченным XL-665. Меченное криптатом антитело к сАМР визуализирует метку. Анализ проводили в соответствии с инструкциями от производителя.
Исследуемые соединения добавляли в лунки микропланшетов (384-луночный формат). Клетки HEK-293, экспрессирующие рецептор D1 человека, высевали при 1000 клеток/лунка и инкубировали 30 минут при комнатной температуре. Метку сАМР-d2 добавляли в лунки, и затем добавляли препарат на основе меченного криптатом антитела к сАМР, и инкубировали в течение 1 часа при комнатной температуре в темноте. Измеряли HTRF сАМР путем возбуждения донора лазером при 337 нм ("световая единица TRF") и последующим (время задержки 100 микросекунд) измерением эмиссии криптата и d2 при 615 нм и 665 нм в течение временного промежутка 200 микросекунд с временным промежутком 2000 микросекунд между повторениями/100 импульсов). Измерения HTRF проводили на считывающем устройстве для микропланшетов Envision (PerkinElmer). Сигнал HTRF рассчитывали как соотношение эмиссии при 665 нм и 615 нм. Показатель соотношения HTRF для тестируемых соединений нормализовали до 0% и 100% стимуляции с использованием контрольных лунок с растворителем DMSO или 30 мкМ дофамина. Эффективность исследуемого соединения (ЕС50) оценивали с помощью нелинейной регрессии с использованием сигмоидальной кривой доза-ответ (переменный угловой коэффициент) с применением Xlfit 4 (IDBS, Гилфорд, Суррей, Великобритания, модель 205).
y=(A+((B-A)/(1+((C/x)∧D)))),
где у представляет собой нормализованное значение измеренного соотношения HTRF для заданной концентрации исследуемого соединения, х представляет собой концентрацию исследуемого соединения, А представляет собой расчетную эффективность при бесконечном разбавлении соединения, и В представляет собой максимальную эффективность. С представляет собой значение ЕС50, и D представляет собой угловой коэффициент Хилла. Оценки ЕС50 получали из независимого эксперимента, и рассчитывали логарифмическое среднее значение.
Агонизм дофаминового рецептора D2
Агонизм дофаминового рецептора D2 измеряли с применением протокола анализа мобилизации кальция, разработанного HD Biosciences (Китай). Вкратце, клетки HEK293/G15, экспрессирующие рецептор D2 человека, высеивали при плотности 15000 клеток/лунка в покрытых матригелем 384-луночных планшетах с прозрачным дном и выращивали в течение 24 часов при 37°С в присутствии 5% СО2. Клетки инкубировали с чувствительным к кальцию флуоресцентным красителем Fluo8 в течение 60-90 минут при 37°С в темноте. Исследуемые соединения получали в 3-кратно концентрированном растворе в буфере 1xHBSS с Са2+ и Mg2+. Сигнал потока кальция регистрировался непосредственно после добавления соединений из планшета для соединений в клеточный планшет для FLIPR (Molecular Devices). Данные флуоресценции подвергали нормализации с получением ответов на отсутствие стимуляции (буфер) и полную стимуляцию (1 мкМ дофамина), составляющих 0% и 100% стимуляцию соответственно. Эффективность исследуемого соединения (ЕС50) оценивали с помощью нелинейной регрессии с использованием сигмоидальной кривой доза-ответ (переменный угловой коэффициент) с применением Xlfit 4 (IDBS, Гилфорд, Суррей, Великобритания, модель 205).
y=(A+((B-A)/(1+((C/x)∧D)))),
где у представляет собой нормализованное значение измеренного соотношения для заданной концентрации исследуемого соединения, х представляет собой концентрацию исследуемого соединения, А представляет собой расчетную эффективность при бесконечном разбавлении соединения, и В представляет собой максимальную эффективность. С представляет собой значение ЕС50, и D представляет собой угловой коэффициент Хилла. Оценки ЕС50 получали из независимого эксперимента, и рассчитывали логарифмическое среднее значение.
Пример 8. Анализ агонистической активности в отношении 5-НТ2 В и связывания
Анализ агонистической активности в отношении 5-НТ2 В
Оценку агонистической активности соединений (I), (Ia) и (Ib) в отношении рецептора 5-НТ2 В человека проводили Eurofins/Cerep (Франция) с измерением влияния соединений на продуцирование инозитолмонофосфата (IP1) с применением способа обнаружения с HTRF. Вкратце, рецептор 5-НТ2 В человека экспрессировался в трансфицированных клетках СНО. Клетки суспендировали в буфере, содержащем 10 мМ Hepes/NaOH (рН 7,4), 4,2 мМ KCl, 146 мМ NaCl, 1 мМ CaCl2, 0,5 мМ MgCl2, 5,5 мМ глюкозу и 50 мМ LiCl, затем распределяли в микропланшеты при плотности 4100 клеток/лунка и инкубировали в течение 30 минут при 37°С в присутствии буфера (базальный контроль), исследуемого соединения или эталонного агониста. Для контрольного измерения при стимулировании отдельные лунки для анализа содержали 1 мкМ 5-НТ. После инкубации клетки лизировали и добавляли акцептор флуоресценции (фторфен-02-меченный IP1) и донор флуоресценции (антитело к IP1, меченное криптатом европия). Через 60 минут при комнатной температуре перенос энергии флуоресценции измеряли при lambda(Ex) 337 нм и lambda(Em) 620 и 665 нм с использованием считывающего устройства для микропланшетов (Rubystar, BMG). Концентрацию IP1 определяли путем деления значения сигнала, измеренного при 665 нм, на значение сигнала, измеренного при 620 нм (соотношение). Результаты выражали в виде процента контрольного ответа на 1 мкМ 5-НТ. Стандартным эталонным агонистом являлся 5-НТ, который тестировали в каждом эксперименте при нескольких концентрациях для получения кривой концентрация-ответ, из которой рассчитывали его значение ЕС50, как описано выше для функциональных анализов в отношении дофамина.
Анализ связывания 5-НТ2В
Оценку аффинности соединения (Id) к рецептору 5-НТ2 В человека определяли в анализе связывания радиолиганда в Eurofins/Cerep (Франция). Гомогенаты мембран получали из клеток СНО, экспрессирующих рецептор 5НТ2 В человека, инкубировали в течение 60 минут при комнатной температуре с 0,2 нМ [125l](±)DOI (1-(4-йод-2,5-диметоксифенил)пропан-2-амин) в отсутствие или в присутствии исследуемого соединения в буфере, содержащем 50 мМ трис-HCl (рН 7,4), 5 мМ MgCl, 10 мкМ паргилин и 0,1% аскорбиновую кислоту. Неспецифическое связывание определяют в присутствии 1 мкМ (±)DOI. После инкубации образцы быстро фильтровали в вакууме через фильтры из стекловолокна (GF/B, Packard), предварительно пропитанные 0,3% полиэтиленимином (PEI), и ополаскивали несколько раз охлажденным льдом 50 мМ трис-HCl с применением коллектора клеток на 96 образцов (Unifilter, Packard). Фильтры высушивали и измеряли радиоактивность посредством сцинтилляционного счетчика (Topcount, Packard) с применением сцинтилляционного коктейля (Microscint 0, Packard). Результаты выражены в проценте ингибирования специфического связывания контрольного радиолиганда. Стандартное эталонное соединение представляло собой (±)DOI, которое тестировали в каждом эксперименте при нескольких концентрациях с получением кривой конкуренции, из которой рассчитывали его IC50.
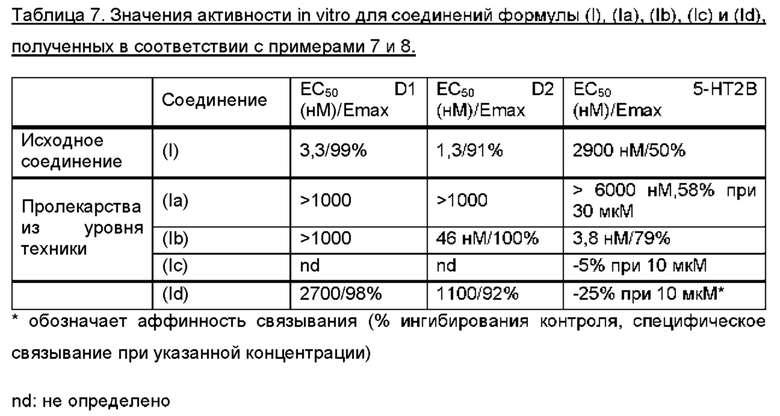
Пример 9. РК-эксперименты в отношении крыс
Для всех экспериментов образцы крови объемом примерно 0,68 мл брали из хвостовой или подъязычной вены и помещали в пробирки K3EDTA, которые были предварительно охлаждены и получены с использованием стабилизирующего раствора, состоящего из 80 мкл аскорбиновой кислоты и 40 мкл 100 мМ 1,4 лактона D-сахарной кислоты в воде. Пробирки осторожно переворачивали 6-8 раз, чтобы обеспечить тщательное перемешивание, а затем помещали в жидкий лед. Пробирку для сбора образцов помещали в жидкий лед на срок до 30 минут до центрифугирования. После удаления из жидкого льда немедленно начинали центрифугирование. Сразу после окончания центрифугирования образцы возвращали в жидкий лед. Три подобразца по 130 мкл плазмы крови переносили в каждую из трех соответствующим образом меченных криопробирок, содержащих 6,5 мкл предварительно охлажденной муравьиной кислоты (20%) (в пробирки предварительно осуществляли добавление и хранили охлажденными до применения). Крышку пробирки немедленно заменяли, и раствор плазмы крови тщательно смешивали путем осторожного переворачивания 6-8 раз. Образцы хранили замороженными при номинальной температуре -70°С в течение 60 минут после отбора образцов. Условия центрифугирования: при 3000 G в течение 10 минут при 4°С. После сбора плазму крови помещали на водный лед. Конечное хранение проводили при примерно -70°С.
Образцы плазмы крови анализировали с помощью твердофазной экстракции или непосредственного осаждения белка с последующей UPLC-MS/MS. Осуществляли MS-обнаружение с применением электрораспыления в режиме положительных ионов с мониторингом конкретного отношения массы к заряду при переходах для соединения (I) с применением внутренних стандартов для корректирования ответа. Анализировали данные зависимости концентрации от времени с применением стандартного программного обеспечения с применением подходящих некомпартментных методик с получением оценок полученных PK-параметров.
Оборудование, применяемое для анализа соединения (I) после введения дозы соединения (Ia)
Масс-спектрометр (LC-MS/MS) Waters Acquity -Sciex API 5000. Аналитическая колонка представляла собой колонку Waters ВЕН UPLC Phenyl 100×2,1 мм, размер частиц 1,7 мкм. Подвижная фаза А: 20 мМ формиат аммония (водн.) + 0,5% муравьиная кислота. Подвижная фаза В: ацетонитрил. Градиент изменяется от 95/5% до 2/98 за 6,1 минуты. Расход 0,5 мл/мин. Осуществляли MRM-мониторинг (мониторинг множественных реакций) исследуемого образца и добавленных аналитических стандартов.
Введение дозы и забор образцов крови. Крысы линии Wistar Han предоставлены от Charles River Laboratories, Зульцфельд, Германия. Поддерживали искусственный автоматически контролируемый 12-часовой цикл света и темноты. Крысы получали стандартный лабораторный корм от Brogaarden (пеллеты Altromin 1324). Крысы имели неограниченный доступ к корму. Во время исследования (4-недельное исследование токсичности) крысы перорально получали один раз в день дозы (Ia) через желудочный зонд. У крыс, которым давали 300 мкг/кг (Ia), собирали образцы крови) у 3 самцов сателлитных животных в следующие моменты времени в день 29: 0,5, 1, 2, 4, 6, 8, 12 и 24 часа после введения дозы.
Оборудование, применяемое для анализа соединения (I) после введения дозы соединения (Ib)
Масс-спектрометр (LC-MS/MS) Waters Acquity -Sciex API 5000. Аналитическая колонка представляла собой колонку Waters ВЕН UPLC Phenyl 100×2,1 мм, размер частиц 1,7 мкм. Подвижная фаза А: 20 мМ формиат аммония (водн.) + 0,5% муравьиная кислота. Подвижная фаза В: ацетонитрил. Градиент изменяется от 95/5% до 2/98 за 6,1 минуты. Расход 0,5 мл/мин. Осуществляли MRM-мониторинг исследуемого образца и добавленных аналитических стандартов.
Введение дозы и забор образцов крови Крысы линии Wistar Han предоставлены от Charles River Laboratories, Великобритания. Поддерживали искусственный автоматически контролируемый 12-часовой цикл света и темноты. Крысы получали стандартный лабораторный корм (корм Teklad 2014С). Крысы имели неограниченный доступ к корму. Во время исследования (26-недельное исследование токсичности) крысы перорально получали один раз в день дозы (Ib) через желудочный зонд. У крыс, которым давали 300 мкг/кг (Ib), собирали образцы крови у 3 самцов сателлитных животных в следующие моменты времени в день 182: 0,5, 1, 2, 4, 8 и 24 часа после введения дозы.
Оборудование, применяемое для анализа соединения (I) при введении доз соединений (1 с) и (Id).
Масс-спектрометр (LC-MS/MS) Waters Acquity-Waters Xevo TQ-S. Аналитическая колонка Acquity ВЕН C18 100×2,1 мм, 1,7 мкм. Подвижная фаза А: 20 мМ NH4-формиат + 0,2% муравьиная кислота. Подвижная фаза В: ацетонитрил + 0,2% муравьиная кислота. Градиент изменяется от 95/5% до 5/95% за 11,0 минуты. Расход 0,3 мл/мин. Осуществляли MRM-мониторинг исследуемого образца и добавленных аналитических стандартов.
Введение дозы и забор крови для соединения (Id). Крысы линии Wistar Han предоставлены от Charles River Laboratories, Wiga GmbH, Германия. Поддерживали искусственный автоматически контролируемый 12-часовой цикл света и темноты. Крысы получали стандартный лабораторный корм от Brogaarden (пеллеты Altromin 1324). Крысы имели неограниченный доступ к корму. Самцам крыс Han Wistar перорально через желудочный зонд вводили однократную пероральную дозу соединения (Id) перорально через желудочный зонд. Крысам вводили 633 мкг/кг соединения (Id), образцы крови у 3 самцов животных собирали в следующие моменты времени в день 1: 1, 2, 4, 6, 8 и 24 часа после введения дозы.
Введение дозы и забор крови для соединения (Ic). Крысы линии Wistar Han предоставлены от Envigo, Великобритания. Поддерживали искусственный автоматически контролируемый 12-часовой цикл света и темноты. Крысы получали стандартный лабораторный корм Teklad 2014С. Крысы имели неограниченный доступ к корму. Самцам крыс Han Wistar перорально через желудочный зонд вводили однократную дозу (Ic) 494 мкг/кг. Собирали образцы крови у 3 самцов животных в следующие моменты времени в день 1: 1, 2, 4, 6, 8 и 24 часа после введения дозы.
Оборудование, применяемое для анализа апоморфина:
Масс-спектрометр (UPCLC-MS/MS) Waters Acquity l-Class-Waters Xevo TQ-S. Аналитическая колонка Acquity HSS Т3 C18 50 × 2,1 мм, 1,8 мкм. Подвижная фаза А: 10 мМ NH4-формиат, 0,2% муравьиная кислота:ацетонитрил (95:5). Подвижная фаза В: 10 мМ NH4-формиат, 0,2% муравьиная кислота:ацетонитрил (5:95). Градиент изменяется от 95/5% до 5/95% за 2,40 минуты. Расход 0,3 мл/мин. Осуществляли MRM-мониторинг исследуемых образцов и добавленных аналитических стандартов.
Введение дозы и забор крови на апоморфин.
Животные для исследования были такими, как описано в примере 10. Дополнительно крысам вводили однократную дозу апоморфина подкожно. У крыс, которым вводили 3000 мкг/кг (апоморфин), собирали образцы крови у 3 самцов животных в следующие моменты времени в день 1: 0,25, 0,5, 1, 1½, 2, 3, 5 и 7 часов после SC введения дозы.
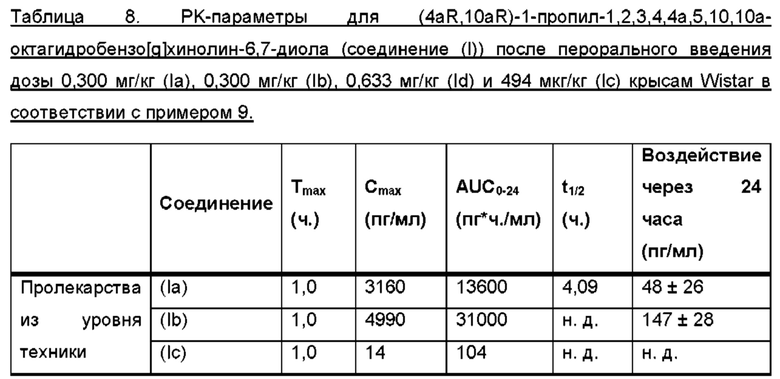

Пример 10. PK/PD соединения (Id)/соединения (I) в анализе гиперактивности на крысах Животные
Всего в исследовании использовали 206 самцов крыс CD (Charles River, Германия) весом 200-250 грамм (165-190 грамм по прибытии). Животных содержали при стандартной температуре (22±1°С) и в среде с контролируемым освещением (свет включен с 7 утра до 8 вечера) с доступом к пище и воде по желанию. Эксперимент, описанный ниже, проводили в соответствии со стандартными рабочими процедурами Charles River Discovery Research Services Finland Ltd. и в соответствии с руководством национального совета по экспериментам на животных Финляндии (Eläinkoelautakunta, ELLA) в отношении испытаний на животных.
Исследование локомоторной активности, тест "открытое поле"
Испытательное устройство представляет собой квадратную плексигласовую площадку (размером 40×40×40 см), на которой регистрируют траектории движения крыс с помощью монитора активности (Med. Associates Inc.). Перед началом периода испытаний крысам давали привыкнуть к их клетке для испытаний в течение 60 минут. После завершения привыкания животных обрабатывали либо соединением, либо средой-носителем и помещали обратно в установку "открытое поле". Основным измеряемым параметром теста является пройденное расстояние (регистрировали через 5-минутные отрезки времени). Общее время измерения после получения начальной обработки составляло 360 минут. Общий период наблюдения в исследовании составлял 420 минут, включая 60 минут привыкания.
Результаты
Оценивали пероральное введение соединения (Id) в анализе двигательной активности крыс и данные функциональные показатели затем коррелировали со значениями концентрации соединения (I) в плазме крови. Апоморфин и прамипексол также одновременно исследовали в данном анализе в качестве препаратов сравнения (т.е. известного стандарта лечения (SoC) в области терапии болезни Паркинсона), и анализировали концентрацию в плазме крови в отношении апоморфина.
Как показано на фигуре 2, соединение (Id) (от 10 до 300 мкг/кг, р.о.) увеличивает двигательную активность с эффектом, начинающимся примерно через 2 часа после введения (приблизительно 180-минутный момент времени) и сохраняющимся до конца регистрирования (в 415-минутный момент времени). Напротив, увеличение двигательной активности (гиперактивность), вызванное апоморфином (3 мг/кг, s.c), является немедленным, но непродолжительным, поскольку эффект исчезает через 1,5 часа после введения (в 150-минутный момент времени). Прамипексол (0,3 мг/кг, s.c.) также вызывает увеличение активности, но его эффект проявляется через приблизительно 1 час после введения и исчезает через 2,5 часа (в 270-минутный момент времени). Общее пройденное расстояние, как видно на фигуре 3, демонстрирует значительно увеличенную активность как для соединения (Id), так и для двух исследуемых препаратов сравнения, и данный эффект является эффектом, который следует ожидать от агонистов дофамина.
Параллельно с оценкой двигательной активности отбирали образцы плазмы крови у сателлитных животных в 6 различных моментов времени (1,5, 2, 3, 4, 5 и 7 часов) после введения дозы для животных, обработанных соединением (Id)). Фармакокинетический анализ демонстрирует, что влияние на поведение соединения (Id) (100 мкг/кг, р.о.) коррелирует со значениями концентрации соединения (I) в плазме крови (см. фигуру 4) с подтверждением того, что влияние на поведение соединения (Id) обусловлено соединением (I), а не соединением (Id) самим по себе. В соответствующем анализе воздействия апоморфина при введении подкожно (через 1,25,1,5, 2, 3, 5 и 7 часов после введения дозы) в результате получали корреляцию между значениями концентрации апоморфина в плазме крови и гиперактивным поведением (см. фигуру 5).
СПИСОК ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
US 4543256
WO 2001/078713
WO 02/100377
WO 2009/026934
WO 2009/026935
WO 2010/097092
WO 2019101917
Alexander et Crutcher, (1990) Trends in Neuroscience 13: 266-71;
Bibbiani et al., Chase Experimental Neurology (2005), 192: 73-78;
Campbell et al., Neuropharmacology (1982); 21(10): 953-961;
Cannon et al., J. Heterocyclic Chem. (1980); 17: 1633-1636;
Cavero and Guillon, J. Pharmacol. Toxicol. Methods (2014), 69: 150-161;
Delong, (1990) Trends in Neuroscience 13: 281-5; Gerfen et al., Science (1990) 250: 1429-32;
Giardina and Williams; CNS Drug Reviews (2001), Vol.7 (3): 305-316;
Goswami et al., J. Nutritional Biochem. (2003) 14: 703-709;
Grosset et al., Acta Neurol Scand. (2013), 128:166-171;
Hauser et al., Movement Disorders (2016), Vol.32 (9): 1367-1372;
Liu et al., J. Med. Chem. (2006), 49: 1494-1498;
Liu et al., Bioorganic Med. Chem. (2008), 16: 3438-3444;
Nolen et al., J. Pharm Sci. (1995), 84 (6): 677-681;
Poewe et al., Nature Review, (2017) vol. 3, article 17013: 1-21;
Remington, "The Science and Practice of Pharmacy", 22th revised ed. (2013), Edited by Allen, Loyd V., Jr.
Rothman et al., Circulation (2000), 102: 2836-2841;
Sprenger and Poewe, CNS Drugs (2013), 27: 259-272;
Sozio et al., Exp.Opin. Drug Disc. (2012); 7(5): 385-406;
Stain-Texier et al., Drug Metab. and Disposition (1998) 26 (5): 383-387;
Wiley-lnterscience (publisher): Compendium of Organic Synthetic Methods, Vol. I-XII.
| название | год | авторы | номер документа |
|---|---|---|---|
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ (R)-5-[3-ХЛОР-4-(2, 3-ДИГИДРОКСИПРОПОКСИ)БЕНЗ[Z]ИЛИДЕН]-2-([Z]-ПРОПИЛИМИНО)-3-о-ТОЛИЛТИАЗОЛИДИН-4-ОНА | 2009 |
|
RU2519548C2 |
| КРИСТАЛЛИЧЕСКИЕ СОЛЬВАТЫ ГИДРОХЛОРИДА 6-(ПИПЕРИДИН-4-ИЛОКСИ)-2Н-ИЗОХИНОЛИН-1-OHA | 2012 |
|
RU2619129C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ СВОБОДНОГО ОСНОВАНИЯ | 2014 |
|
RU2675851C2 |
| КРИСТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2016 |
|
RU2789672C2 |
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ НАТРИЕВОЙ СОЛИ(4-{ 4-[5-(6-ТРИФТОРМЕТИЛ-ПИРИДИН-3-ИЛАМИНО) ПИРИДИН-2-ИЛ] ФЕНИЛ} ЦИКЛОГЕКСИЛ) УКСУСНОЙ КИСЛОТЫ | 2011 |
|
RU2612556C2 |
| Способ для производства альфа-формы вортиоксетина HBr | 2018 |
|
RU2778239C2 |
| АМИННЫЙ СОЛЬВАТ ИНГИБИТОРА НАТРИЙ-ГЛЮКОЗНОГО КОТРАНСПОРТЕРА И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2017 |
|
RU2710230C1 |
| СОЛЬ АГОНИСТА ОПИОИДНОГО РЕЦЕПТОРА (MOR), КРИСТАЛЛИЧЕСКАЯ ФОРМА I ЕГО ФУМАРАТНОЙ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2018 |
|
RU2779119C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА ИНГИБИТОРА PARP-1 И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2018 |
|
RU2792620C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 3-[5-(2-ФТОРФЕНИЛ)-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ]БЕНЗОЙНОЙ КИСЛОТЫ, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ПОЛУЧЕНИЯ | 2007 |
|
RU2474577C2 |
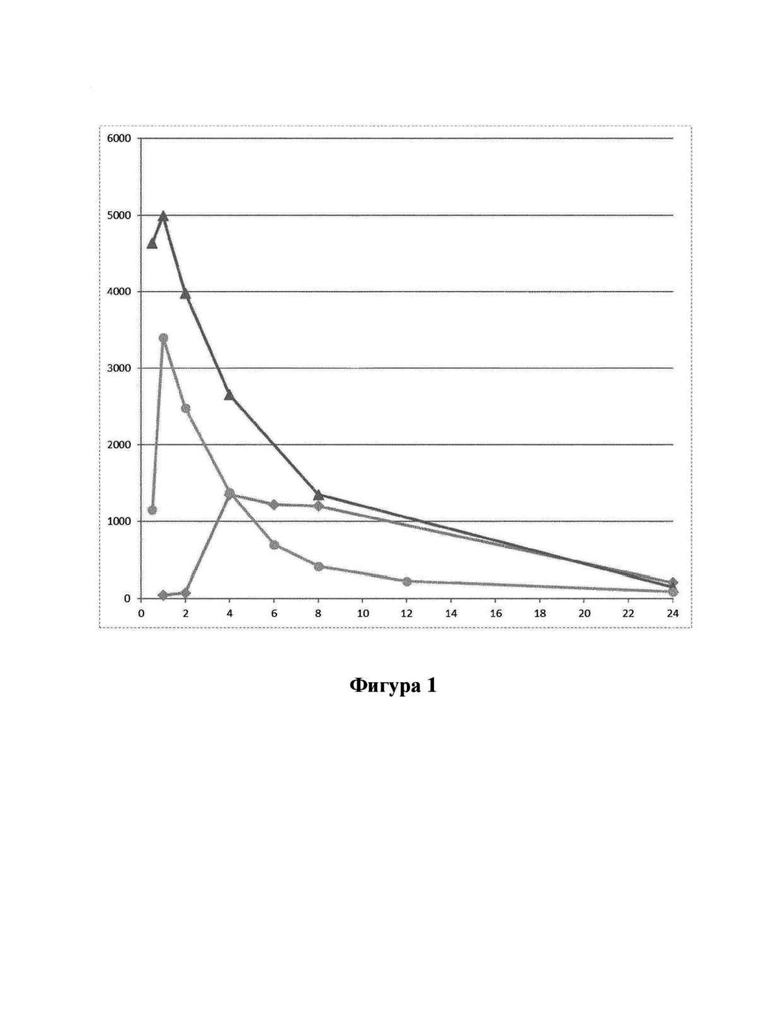
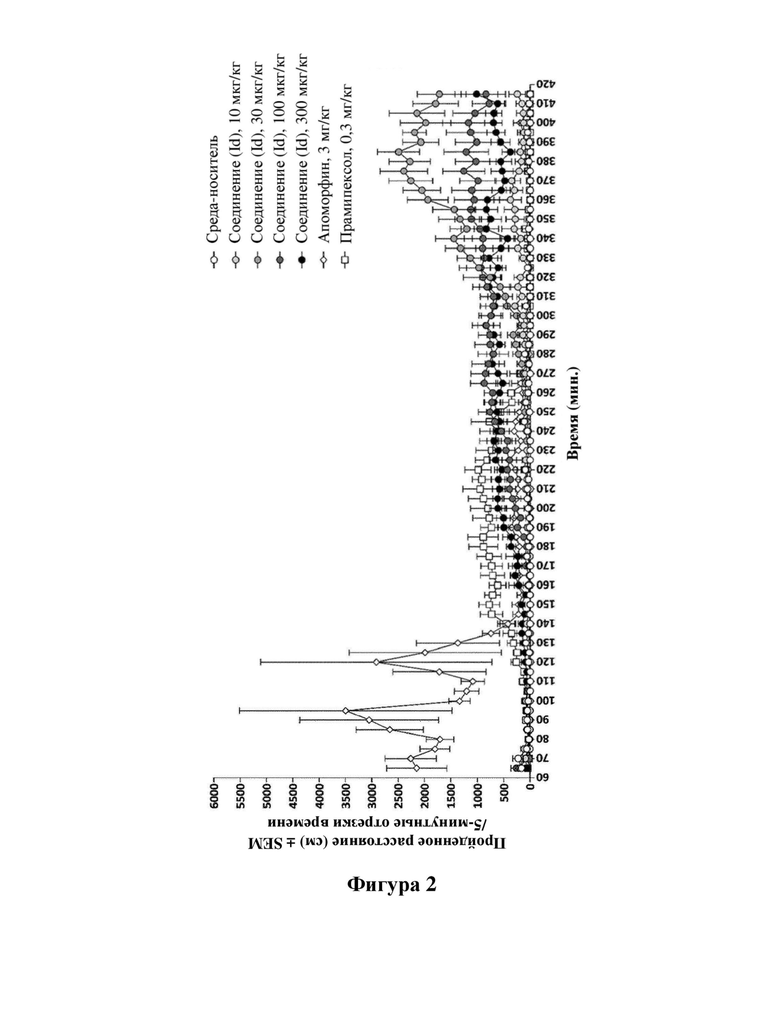
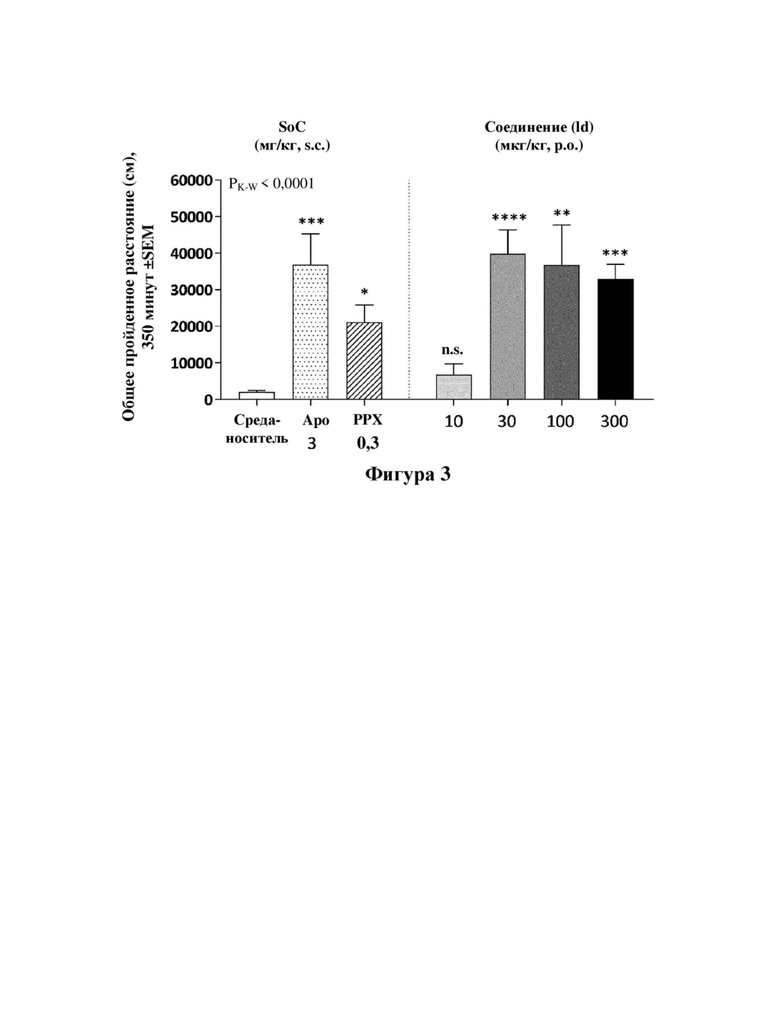
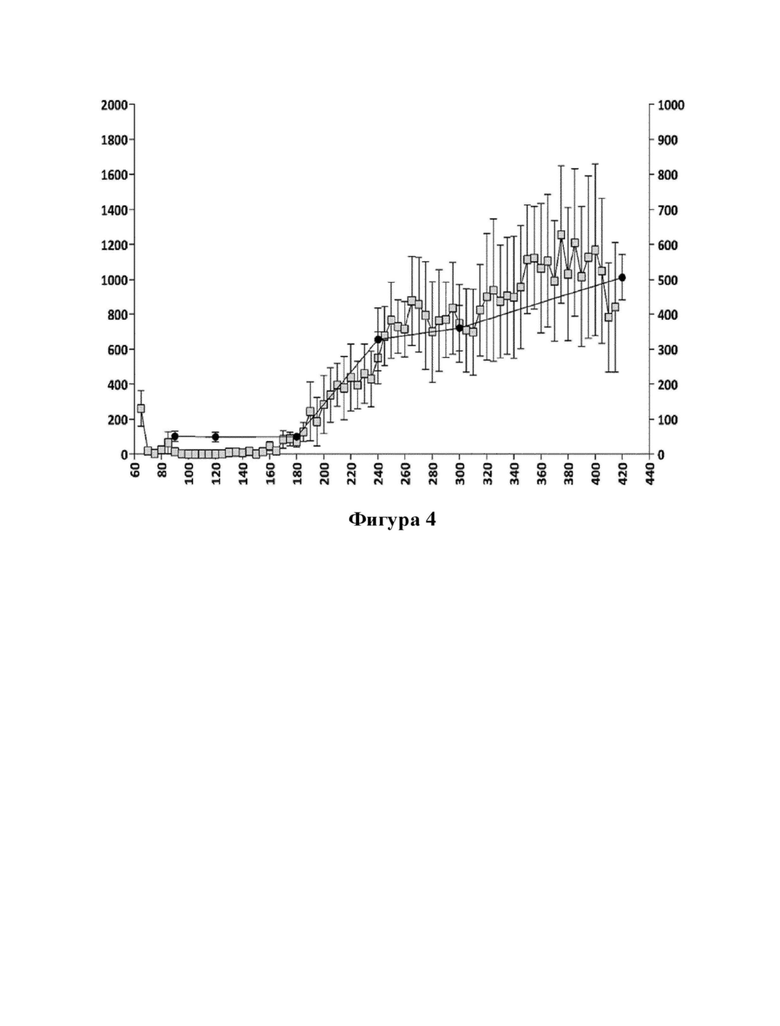
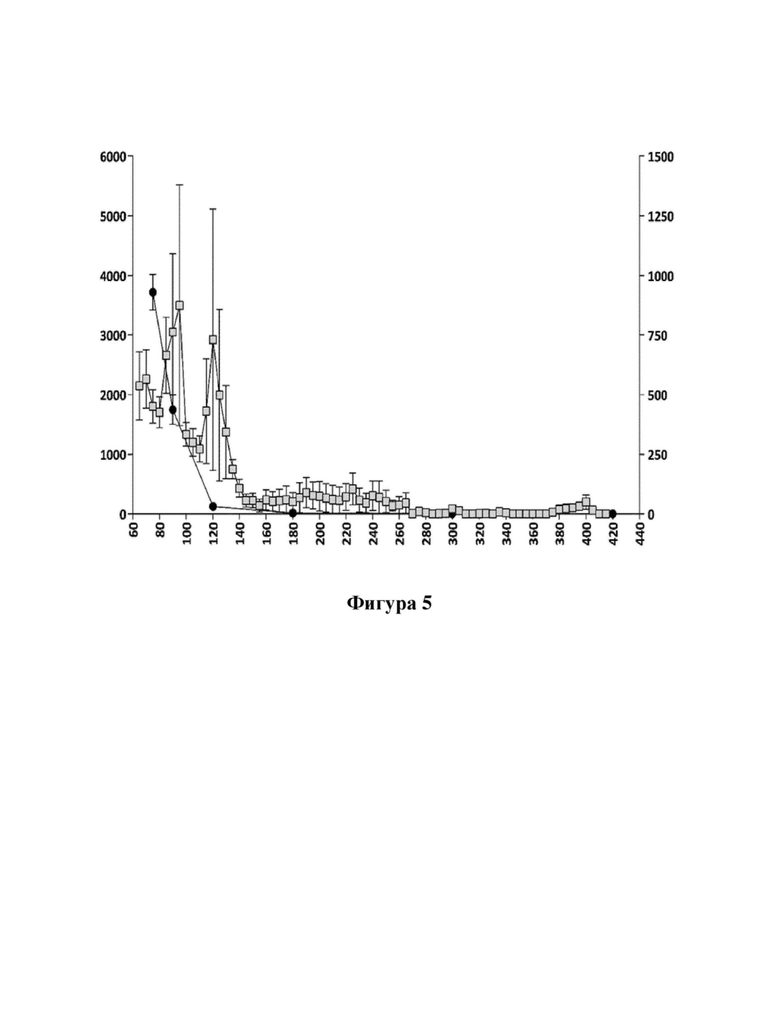
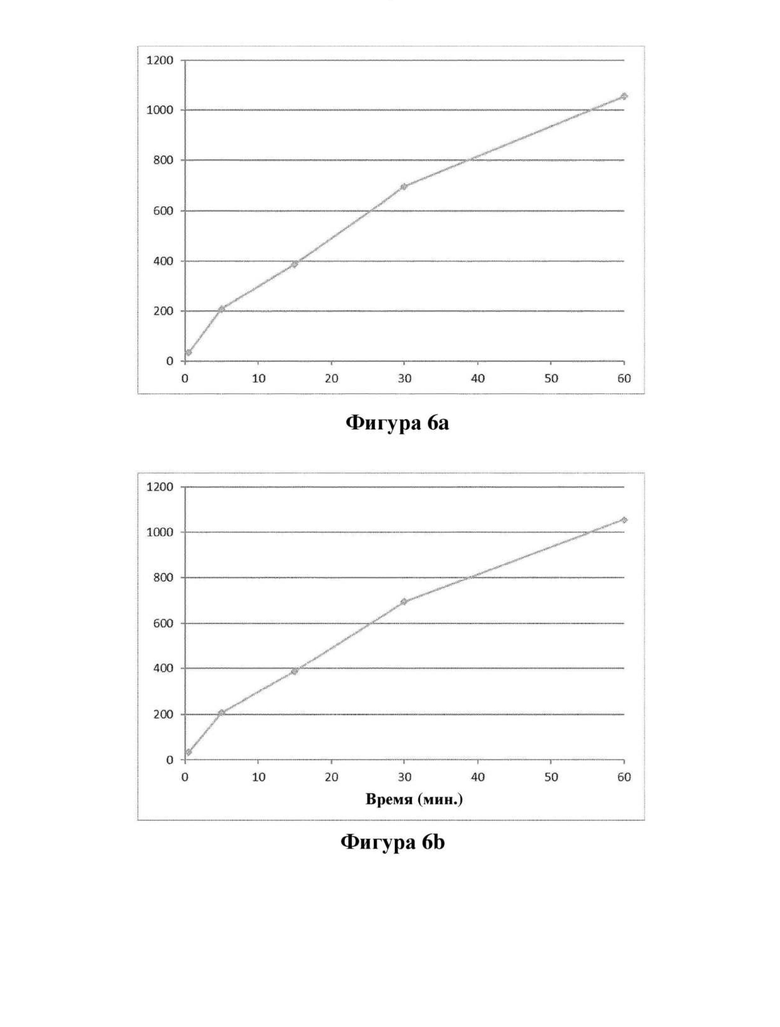
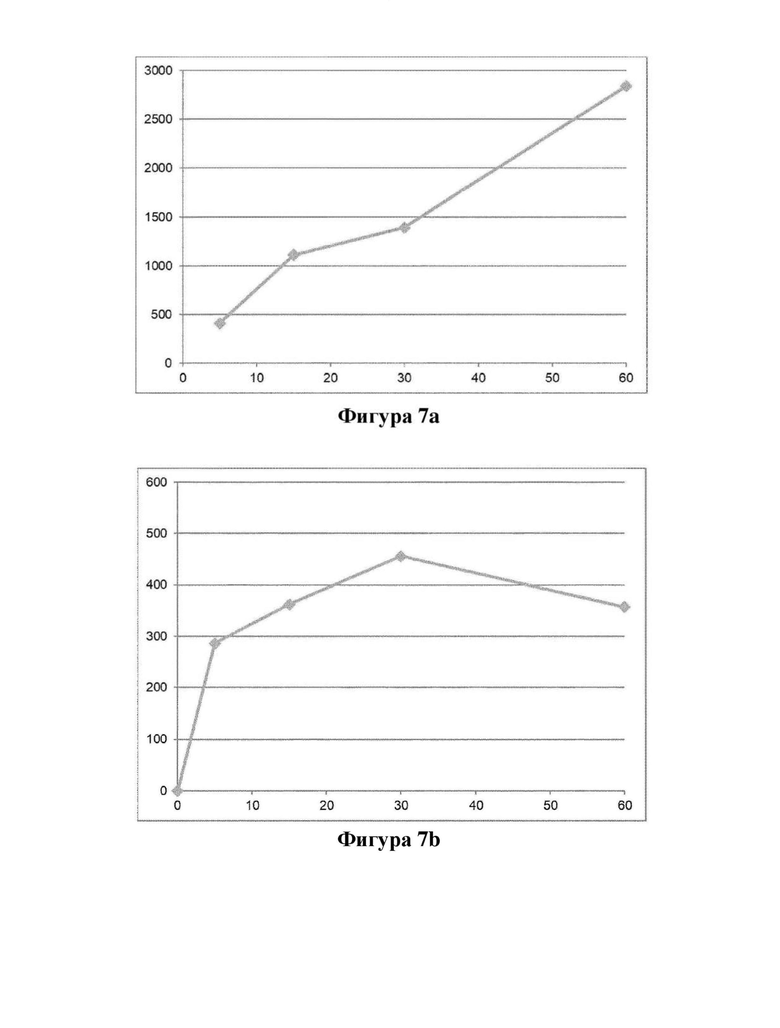
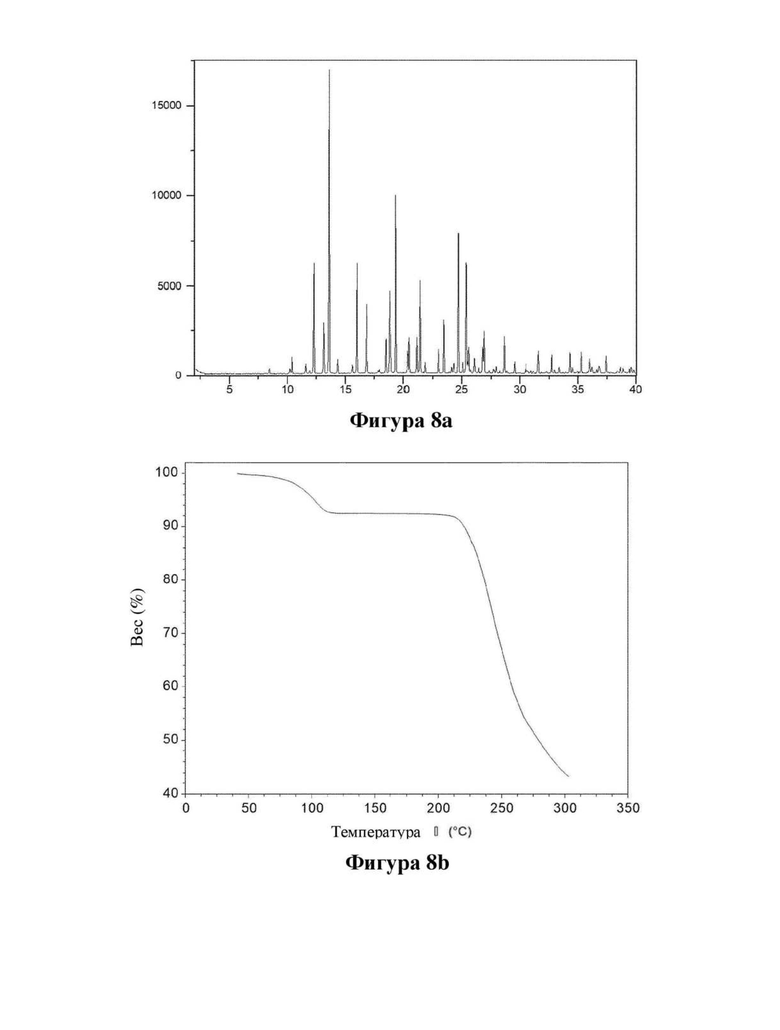
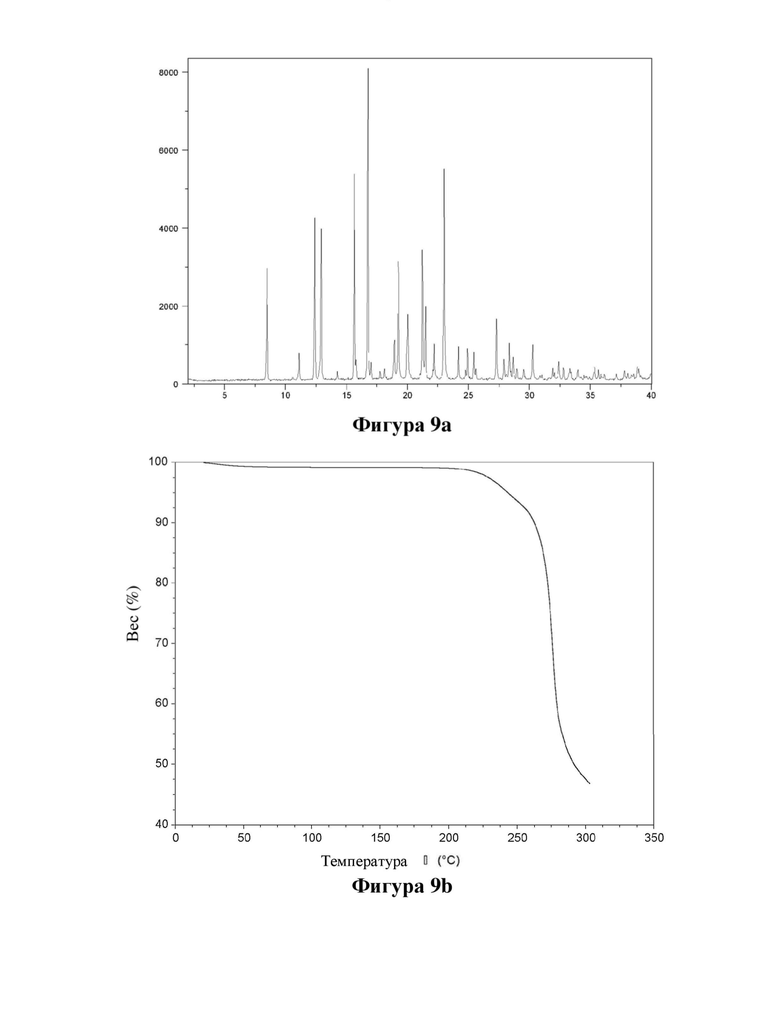
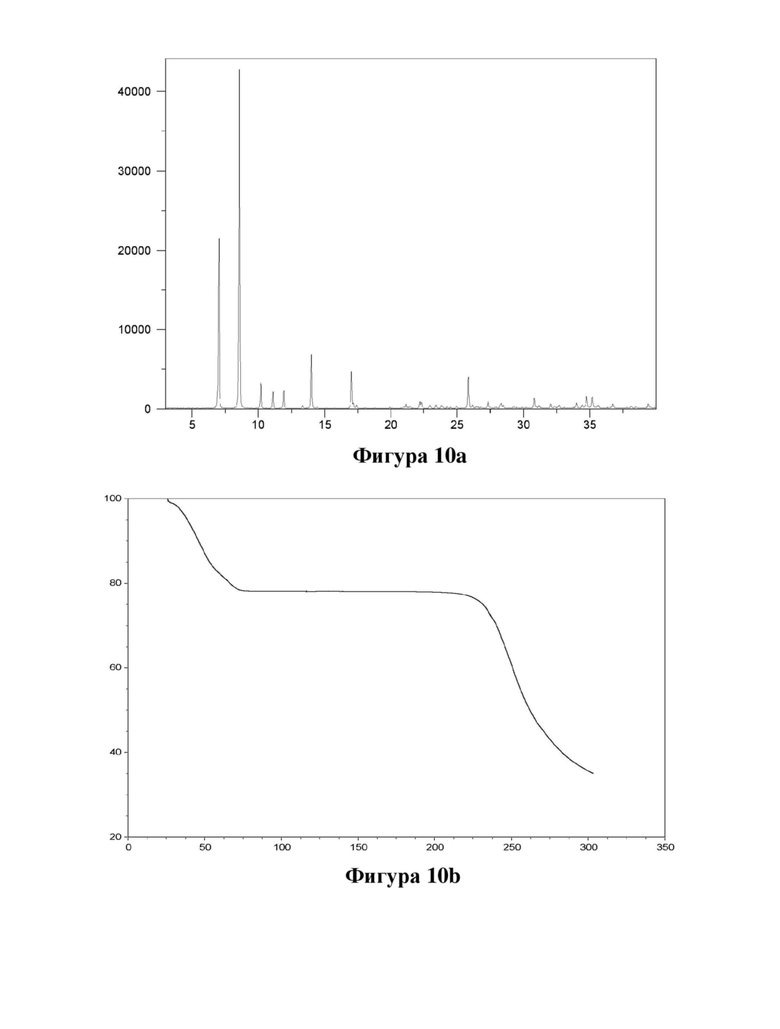
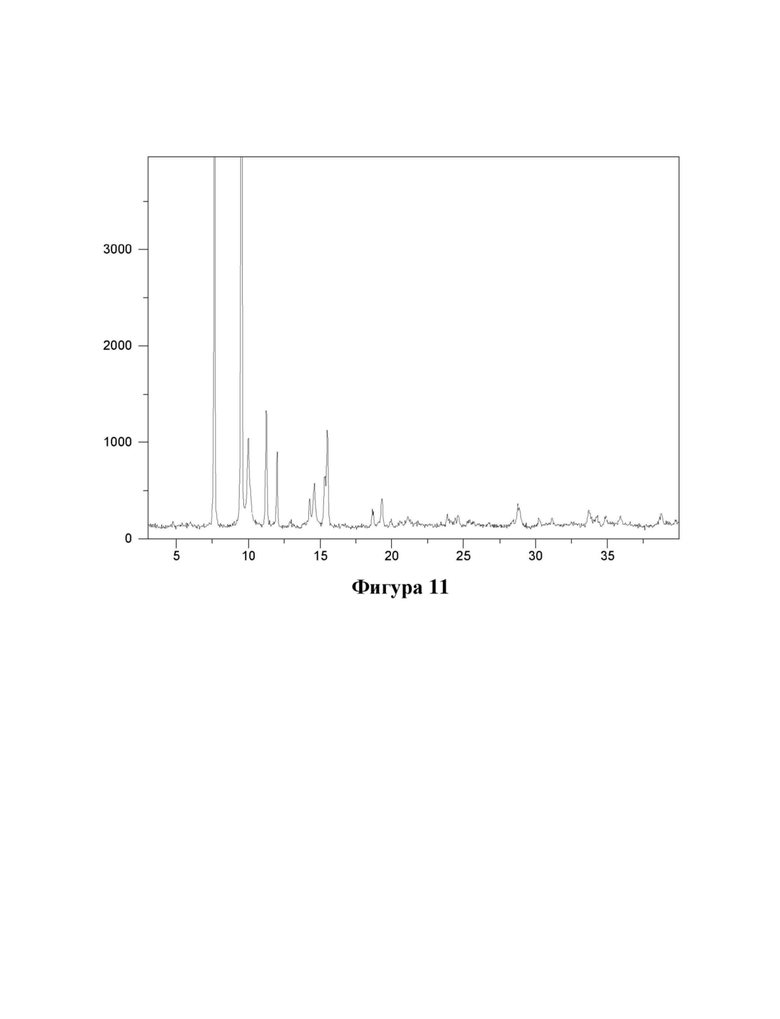
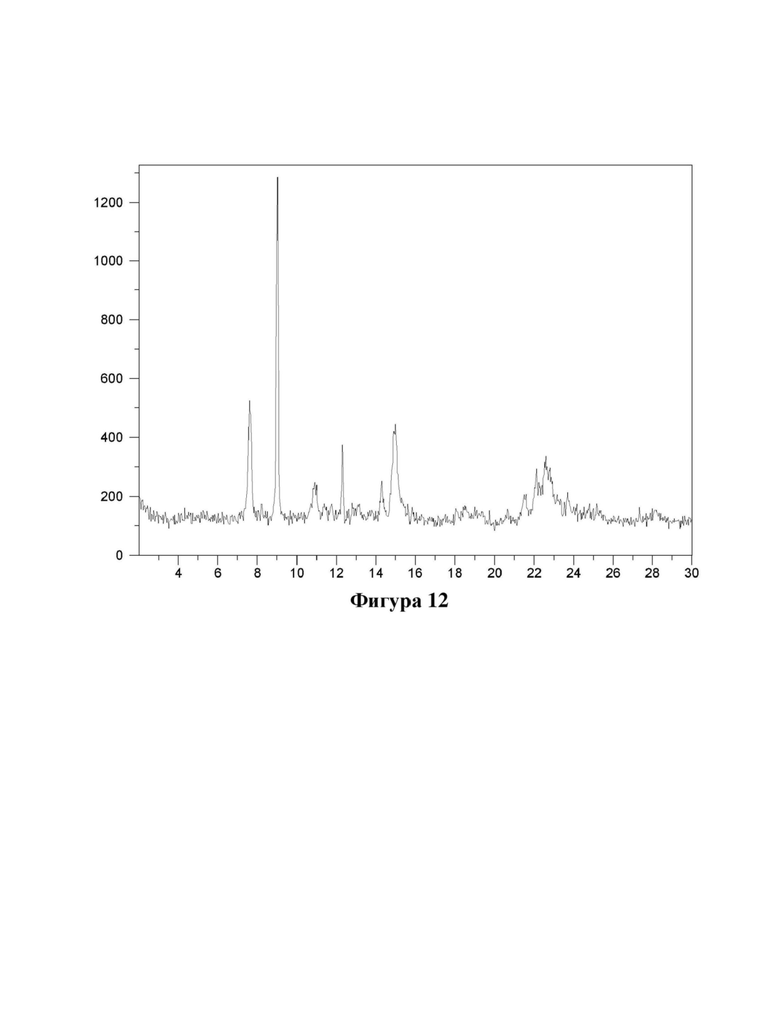
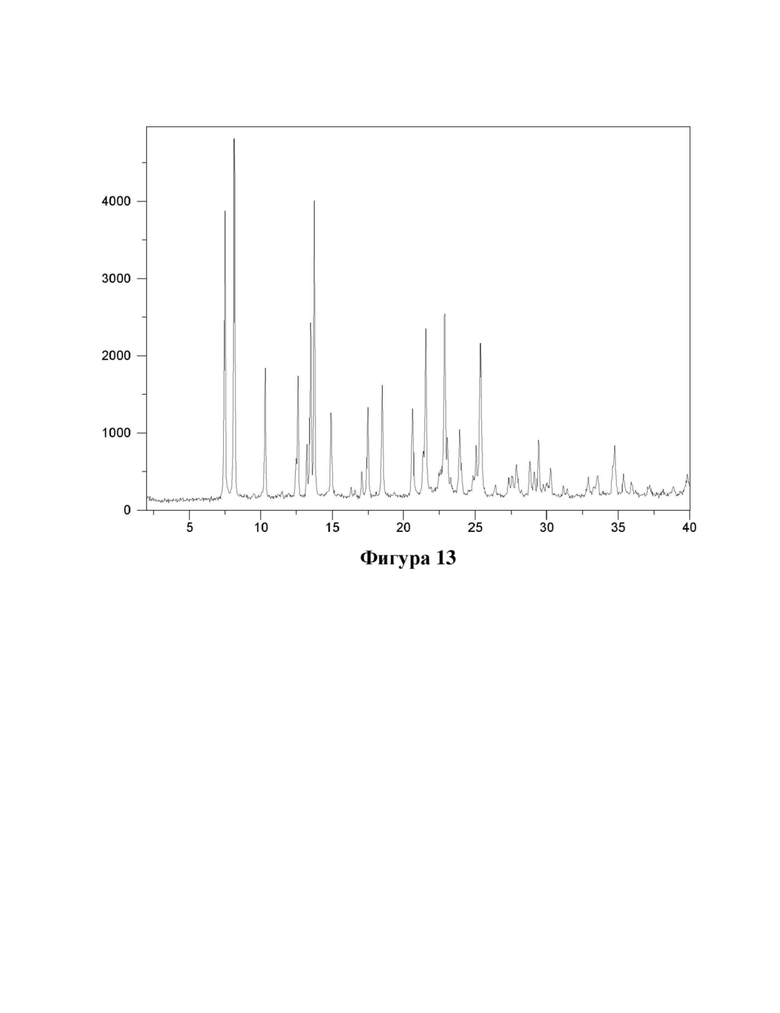
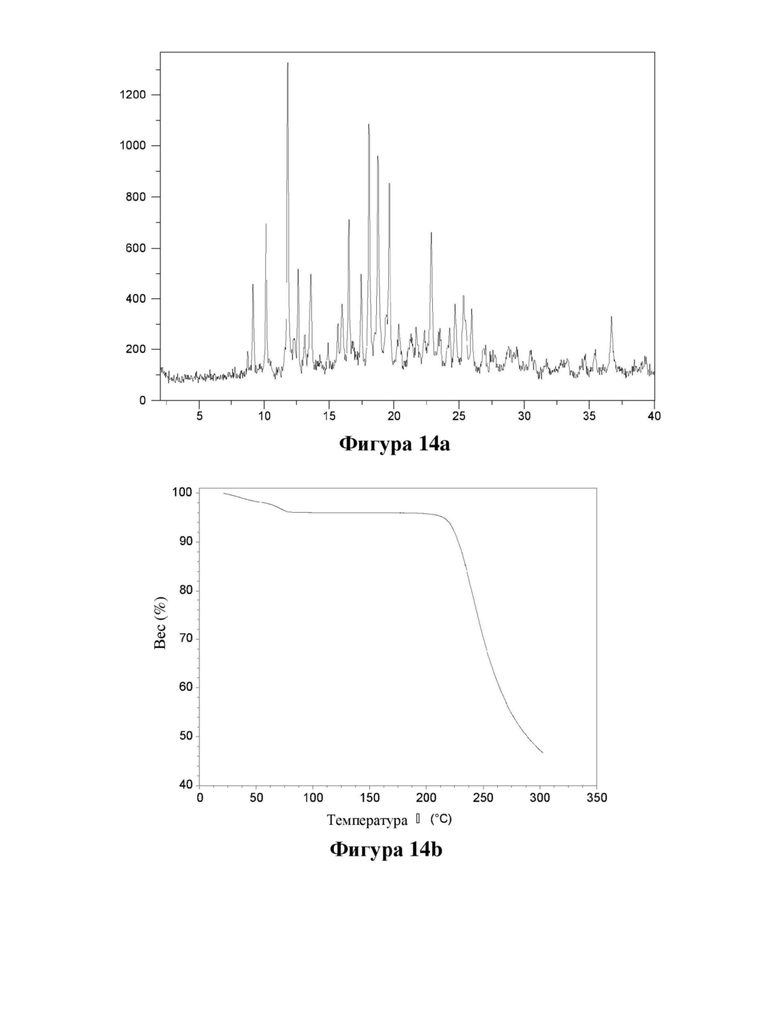
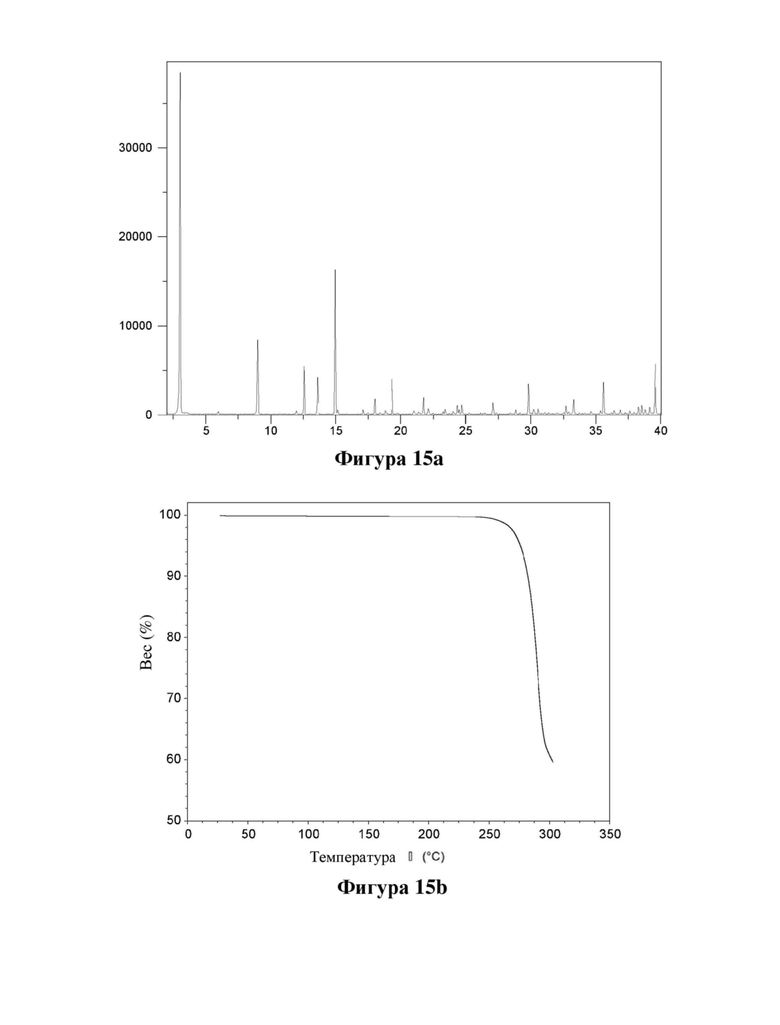
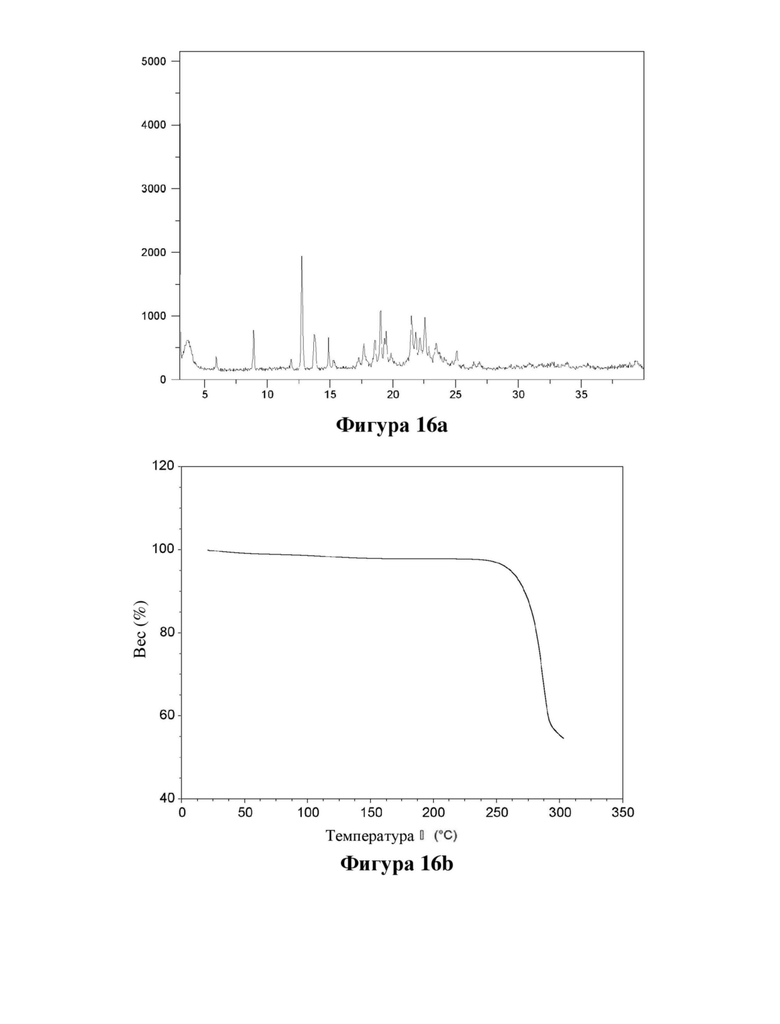
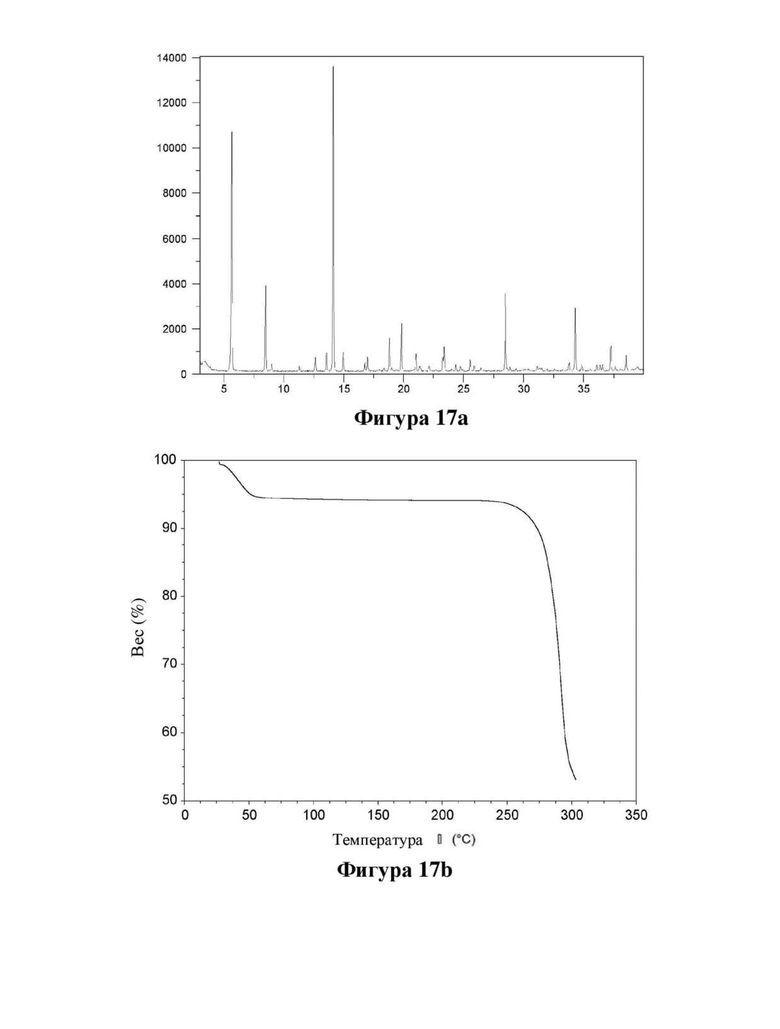
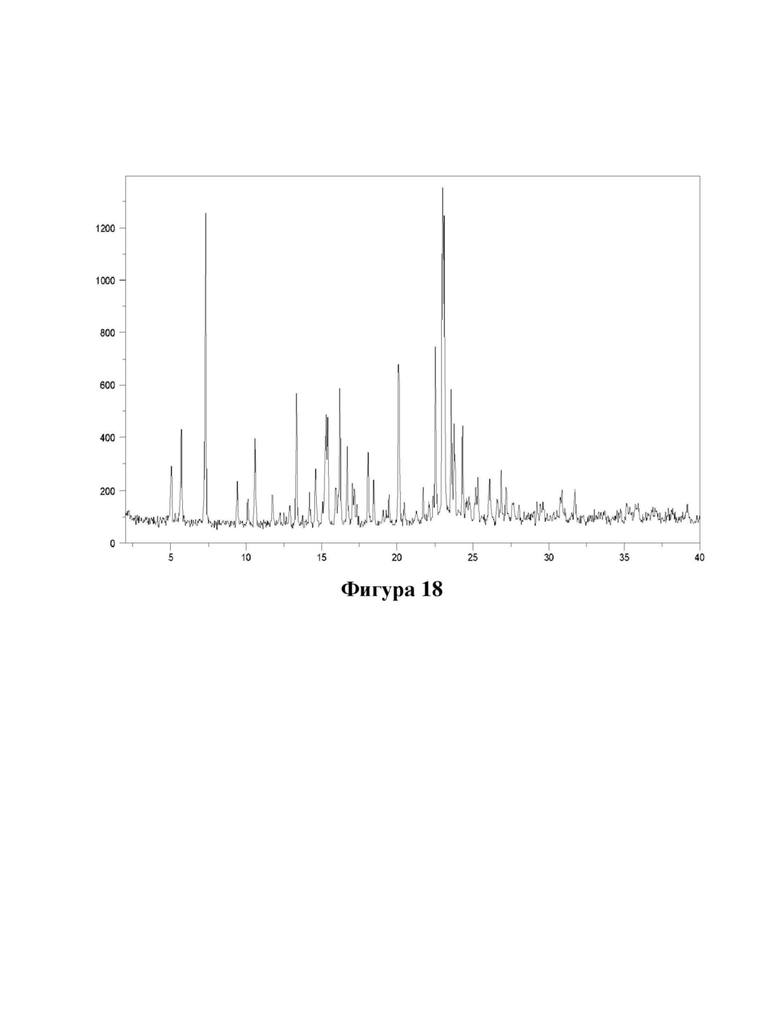
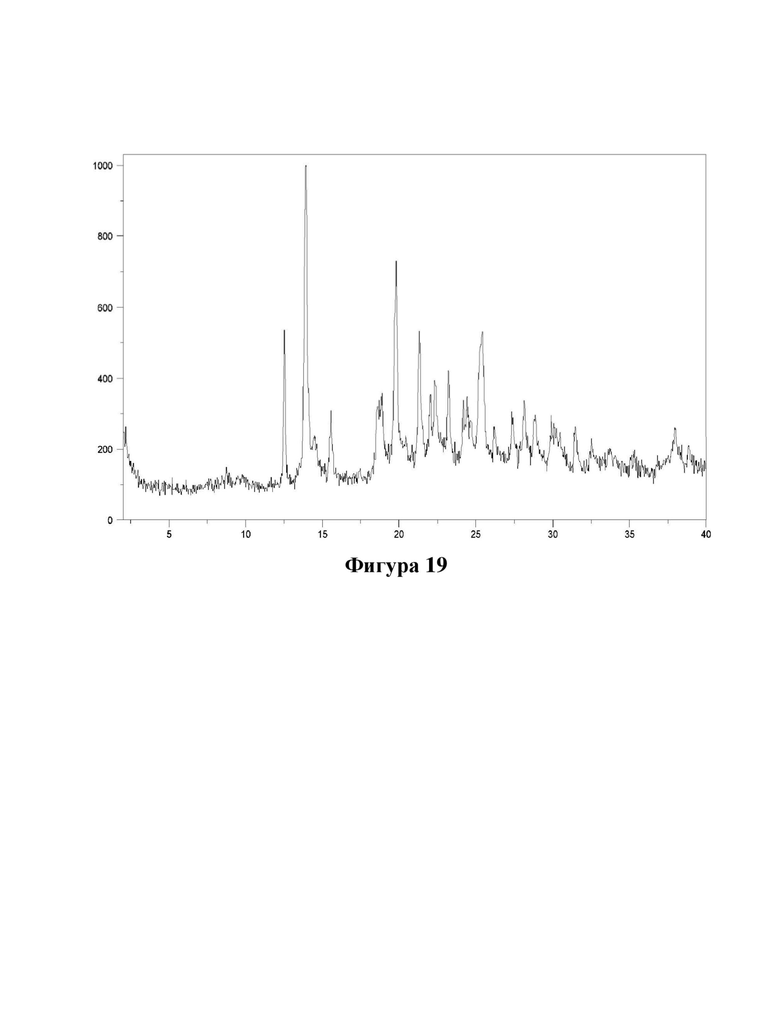
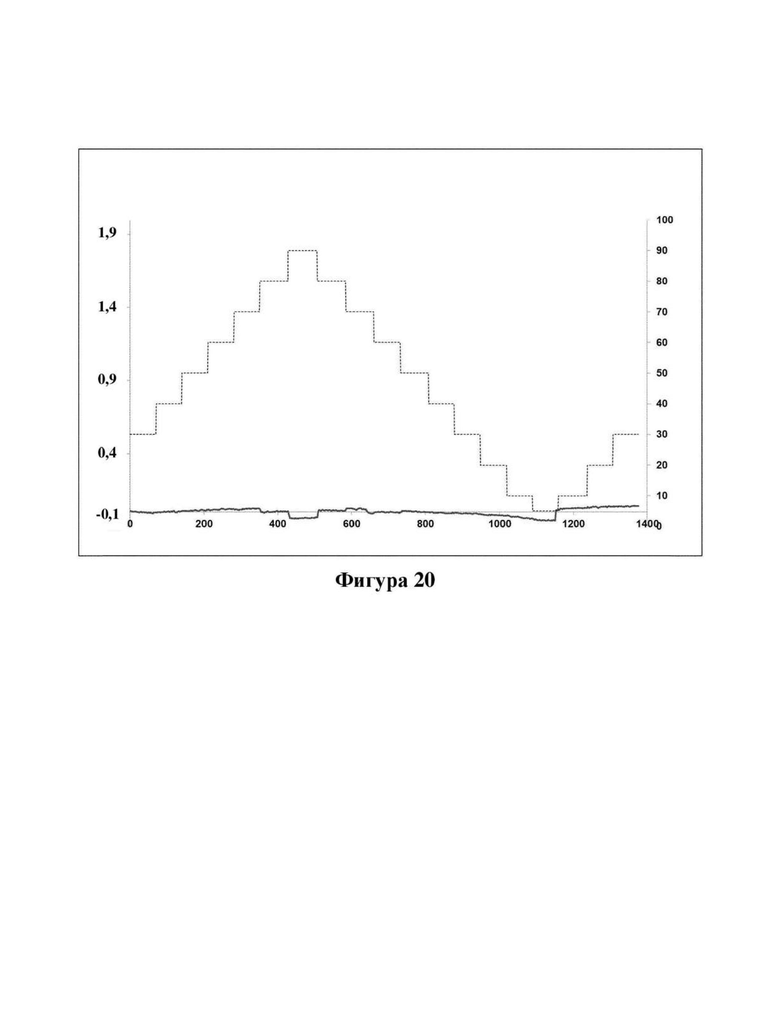
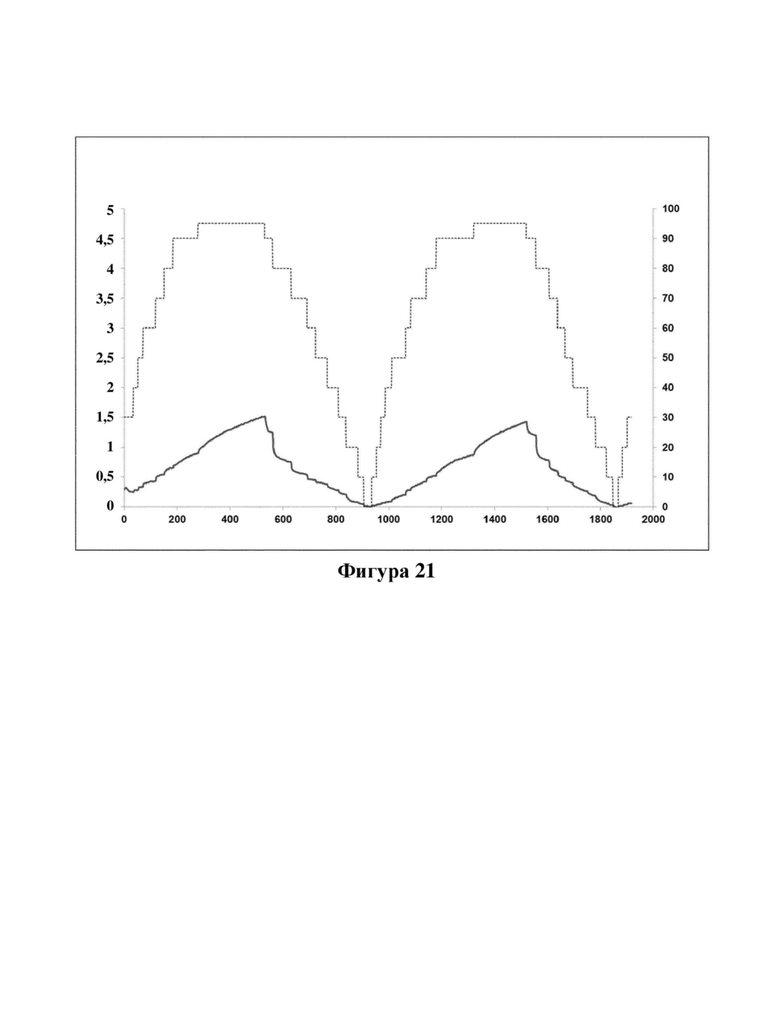
Изобретение относится к твердой форме соединения формулы (Id), где указанная твердая форма выбрана из группы, состоящей из дигидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ:10,4, 11,6, 12,3, и 13,1, и 13,6°; ангидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ:10,4, 11,6, 12,3, и 13,1, и 13,6°; ангидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 8,5, 11,1, 12,4, 12,9 и 15,6°; гептагидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 8,5, 11,1, 12,4, 12,9 и 15,6°; гептагидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1 и 11,9°; формы A, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1 и 11,9°; формы A, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2 и 12,0°; формы B, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2 и 12,0°; формы B, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ:7,6, 9,0, 10,9, 12,3 и 14,3°; формы C, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ:7,6, 9,0, 10,9, 12,3 и 14,3°; формы C, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ:7,5, 8,1, 10,3, 12,6 и 13,5°; моногидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ ±0,2° 2θ:7,5, 8,1, 10,3, 12,6 и 13,5°; моногидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ:9,2, 10,2, 11,8, 12,6 и 13,6°; калиевой соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ:9,2, 10,2, 11,8, 12,6 и 13,6°; калиевой соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6 и 15,0°; формы натриевой соли 1, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6 и 15,0°; формы натриевой соли 1, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 5,9, 8,9, 11,9, 12,8 и 13,8°; формы натриевой соли 2, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 5,9, 8,9, 11,9, 12,8 и 13,8°; формы натриевой соли 2, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ5,6, 8,5, 12,6, 13,6 и 14,1°; гидрохлоридной соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ5,6, 8,5, 12,6, 13,6 и 14,1°; гидрохлоридной соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ5,7, 7,3, 10,6, 13,3 и 15,3°; и гидробромидной соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ5,7, 7,3, 10,6, 13,3 и 15,3°; и гидробромидной соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 12,5, 13,9, 14,5, 15,6 и 18,6°. Изобретение относится к фармацевтической композиции для лечения нейродегенеративного заболевания или нарушения, содержащей терапевтически эффективное количество твердой формы соединения формулы (Id) по изобретению и одно или несколько фармацевтически приемлемых вспомогательных веществ. Твердая форма соединения формы соединения (2S,3S,4S,5R,6S)-3,4,5-тригидрокси-6-(((4aR,10aR)-7-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)тетрагидро-2Н-пиран-2-карбоновой кислоты формулы (Id) предназначена для применения при лечении нейродегенеративного заболевания или нарушения, выбранного из болезни Паркинсона, болезни Хантингтона, синдрома беспокойных ног и болезни Альцгеймера. 5 н. и 29 з.п. ф-лы, 8 табл., 21 ил., 10 пр.
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 12,5, 13,9, 14,5, 15,6 и 18,6°. Изобретение относится к фармацевтической композиции для лечения нейродегенеративного заболевания или нарушения, содержащей терапевтически эффективное количество твердой формы соединения формулы (Id) по изобретению и одно или несколько фармацевтически приемлемых вспомогательных веществ. Твердая форма соединения формы соединения (2S,3S,4S,5R,6S)-3,4,5-тригидрокси-6-(((4aR,10aR)-7-гидрокси-1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-6-ил)окси)тетрагидро-2Н-пиран-2-карбоновой кислоты формулы (Id) предназначена для применения при лечении нейродегенеративного заболевания или нарушения, выбранного из болезни Паркинсона, болезни Хантингтона, синдрома беспокойных ног и болезни Альцгеймера. 5 н. и 29 з.п. ф-лы, 8 табл., 21 ил., 10 пр.
 (Id)
(Id)
1. Твердая форма соединения формулы (Id),
 (Id),
(Id),
где указанная твердая форма выбрана из группы, состоящей из:
дигидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 10,4, 11,6, 12,3, и 13,1, и 13,6°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 10,4, 11,6, 12,3, и 13,1, и 13,6°;
ангидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 8,5, 11,1, 12,4, 12,9 и 15,6°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 8,5, 11,1, 12,4, 12,9 и 15,6°;
гептагидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1 и 11,9°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1 и 11,9°;
формы A, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2 и 12,0°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2 и 12,0°;
формы B, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,0, 10,9, 12,3 и 14,3°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,0, 10,9, 12,3 и 14,3°;
формы C, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,5, 8,1, 10,3, 12,6 и 13,5°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,5, 8,1, 10,3, 12,6 и 13,5°;
моногидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 9,2, 10,2, 11,8, 12,6 и 13,6°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 9,2, 10,2, 11,8, 12,6 и 13,6°;
калиевой соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6 и 15,0°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6 и 15,0°;
формы натриевой соли 1, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 5,9, 8,9, 11,9, 12,8 и 13,8°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 5,9, 8,9, 11,9, 12,8 и 13,8°;
формы натриевой соли 2, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 5,6, 8,5, 12,6, 13,6 и 14,1°;
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 5,6, 8,5, 12,6, 13,6 и 14,1°;
гидрохлоридной соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 5,7, 7,3, 10,6, 13,3 и 15,3°; и
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 5,7, 7,3, 10,6, 13,3 и 15,3°; и
гидробромидной соли, характеризующейся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 12,5, 13,9, 14,5, 15,6 и 18,6°.
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 12,5, 13,9, 14,5, 15,6 и 18,6°.
2. Твердая форма по п. 1, где указанная твердая форма выбрана из группы, состоящей из дигидрата цвиттер-иона соединения (Id), гептагидрата цвиттер-иона соединения (Id) и калиевой соли соединения (Id).
3. Твердая форма по любому из пп.1-2, где указанная твердая форма представляет собой дигидрат цвиттер-иона соединения (Id) или калиевую соль соединения (Id).
4. Твердая форма по любому из пп. 1-3, где указанная твердая форма представляет собой дигидратную кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 10,4, 11,6, 12,3, 13,1, 13,6, 14,3, 15,6, 16,0, 16,8 и 18,5°.
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 10,4, 11,6, 12,3, 13,1, 13,6, 14,3, 15,6, 16,0, 16,8 и 18,5°.
5. Твердая форма по любому из пп. 1-3, где указанная твердая форма представляет собой дигидратную кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 12,3, 13,1, 13,6, 16,0, 16,8, 18,5, 18,9, 19,4, 20,5, 21,4, 23,5, 24,7, 25,4, 26,9 и 28,7°.
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 12,3, 13,1, 13,6, 16,0, 16,8, 18,5, 18,9, 19,4, 20,5, 21,4, 23,5, 24,7, 25,4, 26,9 и 28,7°.
6. Твердая форма по любому из пп. 1-5, где указанная твердая форма представляет собой дигидратную кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), как изображено на фигуре 8a.
), как изображено на фигуре 8a.
7. Твердая форма по любому из пп. 1-6, где указанная твердая форма представляет собой дигидратную форму демонстрирующую потерю веса, составляющую 7,6% вес/вес, по сравнению с исходным весом при нагревании от 30°C до 150°C (скорость нагрева 10°C/мин), измеренную с помощью термогравиметрического анализа.
8. Твердая форма по любому из пп. 1-3, где указанная твердая форма представляет собой калиевую соль, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 17,1, 18,0, 18,4, 18,8 и 19,4°.
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 17,1, 18,0, 18,4, 18,8 и 19,4°.
9. Твердая форма по любому из пп. 1-3, где указанная твердая форма представляет собой калиевую соль, имеющую кристаллическую форму, характеризующуюся XRPD, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 18,0, 19,4, 21,8, 24,7, 27,1, 29,8, 33,3, 35,6, 38,6 и 39,6°.
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 3,0, 9,0, 12,6, 13,6, 15,0, 18,0, 19,4, 21,8, 24,7, 27,1, 29,8, 33,3, 35,6, 38,6 и 39,6°.
10. Твердая форма по любому из пп. 1-3 и 8-9, при этом указанная твердая форма представляет собой форму калиевой соли, демонстрирующую потерю веса, составляющую менее чем 1% вес/вес, по сравнению с исходным весом при нагревании от 20°C до 150°C (скорость нагрева 10°C/мин), измеренную с помощью термогравиметрического анализа.
11. Твердая форма по любому из пп. 1-3 и 8-10, где указанная твердая форма представляет собой гептагидратную кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 13,4, 14,0, 14,5, 17,0 и 17,4°.
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 13,4, 14,0, 14,5, 17,0 и 17,4°.
12. Твердая форма по любому из пп. 1-3 и 11, где указанная твердая форма представляет собой гептагидратную кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 14,0, 17,0, 22,2, 25,9, 27,3, 28,3, 30,8, 34,0, 34,8 и 35,2°.
), содержащей пики при следующих значениях угла 2θ±0,2° 2θ: 7,0, 8,6, 10,2, 11,1, 11,9, 14,0, 17,0, 22,2, 25,9, 27,3, 28,3, 30,8, 34,0, 34,8 и 35,2°.
13. Твердая форма по любому из пп. 1-3 и 11-12, где указанная твердая форма представляет собой гептагидратную кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), как показано на Фигуре 10a.
), как показано на Фигуре 10a.
14. Твердая форма по любому из пп. 1-3 и 11-13, причем указанная твердая форма представляет собой гептагидратную форму, демонстрирующую потерю веса, составляющую 21% вес./вес., по сравнению с исходным весом при нагревании от 20°C до 150°C (скорость нагрева 10°C/мин), измеренную с помощью термогравиметрического анализа.
15. Твердая форма по п. 1, причем твердая форма представляет собой ангидрат, характеризующийся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ ±0,2° 2θ: 8,5, 11,1, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0 и 21,2°.
), демонстрирующей пики при следующих значениях угла 2θ ±0,2° 2θ: 8,5, 11,1, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0 и 21,2°.
16. Твердая форма по п. 1, причем твердая форма представляет собой ангидратную кристаллическую форму, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 8,5, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0, 21,2, 21,5, 22,2, 23,0, 24,2, 27,3 и 28,3°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 8,5, 12,4, 12,9, 15,6, 16,7, 18,9, 19,3, 20,0, 21,2, 21,5, 22,2, 23,0, 24,2, 27,3 и 28,3°.
17. Твердая форма по п. 1, причем твердая форма представляет собой ангидрат, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), как показано на Фигуре 9a.
), как показано на Фигуре 9a.
18. Твердая форма по п. 1 и 15-18, причем твердая форма представляет собой ангидратную кристаллическую форму, демонстрирующую потерю веса, составляющую менее чем 1% вес/вес, по сравнению с исходным весом при нагревании от 30°C до 150°C (скорость нагрева 10°C/мин), измеренную с помощью термогравиметрического анализа.
19. Твердая форма по п. 1, причем твердая форма представляет собой форму A, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2, 12,0, 14,3, 14,6, 15,3, 15,5 и 19,3°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,5, 10,0, 11,2, 12,0, 14,3, 14,6, 15,3, 15,5 и 19,3°.
20. Твердая форма по п. 1, причем твердая форма представляет собой форму B, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,0, 10,9, 12,3, 14,3, 15,0, 21,5, 22,1, 22,6 и 23,7°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 7,6, 9,0, 10,9, 12,3, 14,3, 15,0, 21,5, 22,1, 22,6 и 23,7°.
21. Твердая форма по п. 1, причем твердая форма представляет собой форму C, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5 и 20,6°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 7,5, 8,1, 10,3, 12,6, 13,5, 13,8, 14,9, 17,5, 18,5 и 20,6°.
22. Твердая форма по п. 1, причем твердая форма представляет собой моногидрат, характеризующийся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 9,2, 10,2, 11,8, 12,6, 13,6, 15,7, 16,0, 16,5, 17,5 и 18,1°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 9,2, 10,2, 11,8, 12,6, 13,6, 15,7, 16,0, 16,5, 17,5 и 18,1°.
23. Твердая форма по п. 1, причем твердая форма представляет собой форму натриевой соли 1, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 5,9, 8,9, 11,9, 12,8, 13,8, 14,9, 17,7, 18,6, 19,0 и 19,5°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 5,9, 8,9, 11,9, 12,8, 13,8, 14,9, 17,7, 18,6, 19,0 и 19,5°.
24. Твердая форма по п. 1, причем твердая форма представляет собой форму натриевой соли 2, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 5,6, 8,5, 12,6, 13,6, 14,1, 15,0, 16,7, 17,0, 18,8 и 19,8°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 5,6, 8,5, 12,6, 13,6, 14,1, 15,0, 16,7, 17,0, 18,8 и 19,8°.
25. Твердая форма по п. 1, причем твердая форма представляет собой гидрохлоридную соль, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 5,7, 7,3, 10,6, 13,3, 15,3, 15,4, 16,2, 20,1, 22,5 и 23,0°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 5,7, 7,3, 10,6, 13,3, 15,3, 15,4, 16,2, 20,1, 22,5 и 23,0°.
26. Твердая форма по п. 1, причем твердая форма представляет собой гидробромидную соль, характеризующуюся порошковой рентгеновской дифрактограммой, полученной с использованием излучения CuKα1 (λ=1,5406  ), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 12,5, 13,9, 14,5, 15,6, 18,6, 18,9, 19,8, 21,3, 22,0 и 22,4°.
), демонстрирующей пики при следующих значениях угла 2θ±0,2° 2θ: 12,5, 13,9, 14,5, 15,6, 18,6, 18,9, 19,8, 21,3, 22,0 и 22,4°.
27. Фармацевтическая композиция для лечения нейродегенеративного заболевания или нарушения, содержащая терапевтически эффективное количество твердой формы соединения формулы (Id) по любому из пп. 1-26 и одно или несколько фармацевтически приемлемых вспомогательных веществ.
28. Фармацевтическая композиция по п. 27, причем нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
29. Применение твердой формы соединения формулы (Id) по любому из пп. 1-26 для лечения нейродегенеративного заболевания или нарушения, выбранного из болезни Паркинсона, болезни Хантингтона, синдрома беспокойных ног и болезни Альцгеймера.
30. Применение по п. 29, причем нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
31. Способ лечения нейродегенеративного заболевания или нарушения, выбранного из болезни Паркинсона, болезни Хантингтона, синдрома беспокойных ног и болезни Альцгеймера, причем способ включает введение терапевтически эффективного количества твердой формы соединения формулы (Id) по любому из пп. 1-26 пациенту, нуждающемуся в этом.
32. Способ по п. 31, причем нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
33. Применение твердой формы соединения формулы (Id) по любому из пп. 1-26 в изготовлении лекарственного препарата для лечения нейродегенеративного заболевания или нарушения, выбранного из болезни Паркинсона, болезни Хантингтона, синдрома беспокойных ног и болезни Альцгеймера.
34. Применение по п. 33, причем нейродегенеративное заболевание или нарушение представляет собой болезнь Паркинсона.
| Шарнирное крепление двух деталей самолета | 1929 |
|
SU23778A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Yan Sun et al.Oral bioavailability and brain penetration of (-)-stepholidine, a tetrahydroprotoberberine agonist at dopamine D(1) and antagonist at D(2) receptors, in rats BRITISH JOURNAL OF PHARMACOLOGY, 2009, vol.158, no.5, | |||
Авторы
Даты
2024-06-04—Публикация
2020-05-19—Подача