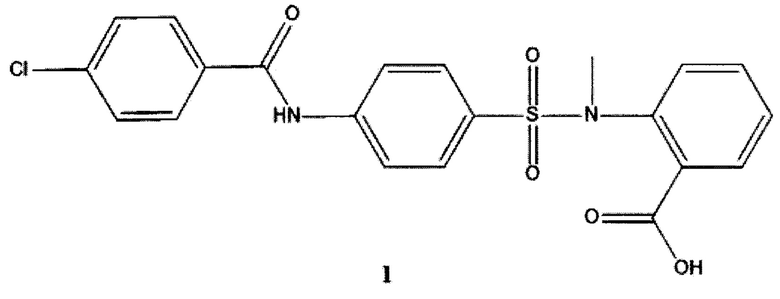
Изобретение относится к химии и медицине, а именно к новому биологически активному органическому соединению, производному антраниловой кислоты формулы 1:
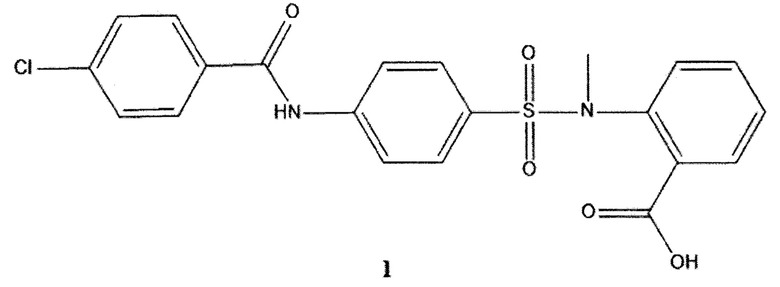
и их физиологически приемлемым солям, предпочтительно натриевым, которые обладают нейропротекторной, антигипоксической, анальгетической и мнемотропной активностью.
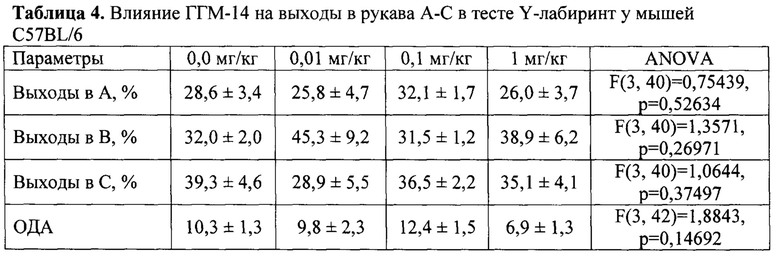
Матриксные металлопротеиназы (ММП) относятся к семейству цинк-зависимых эндопептидаз, способных разрушать основные компоненты белков внеклеточного матрикса, который составляет основу соединительной ткани, обеспечивает механическую поддержку клеток и транспорт химических веществ, а также участвует во многих физиологических процессах в организме [Cabral-Pacheco G.A. et al. Int. J. Mol. Sci. 2020; 21(24): 9739-93]. Среди ММП наиболее исследованными ферментами считаются желатиназы (ММП-2 и ММП-9). В целом, все ММП имеют общие структурные элементы: сигнальный домен, пропептид (блокирующий активный центр в проэнзимах), каталитический домен с цинксодержащим активным центром, подвижный домен и гемопексиновый домен, который отвечает за связывание тканевых ингибиторов с ферментом [Rowsell S. et. al. J. Mol. Biol. 2002;V. 319: 173-81] (фиг.1).
В организме ММП вырабатываются в форме зимогенов (про-ММП), которые в процессе воспаления и окислительного стресса активируются до активных ММП [Nissinen L. et al. Biochim. Biophys. Acta. 2014; V. 1840(8): 2571-80], что оказывает пагубное воздействие на компоненты белков внеклеточного матрикса (например, коллаген, ламинин, фибронектин) и приводит к развитию многих патологических состояний, включая нейродегенеративные и сердечно-сосудистые заболевания [Рогова Л.Н. и др. Вестник Нов. Мед. Технол. 2011; XVIII(2): 86-9].
Гипоксия, характеризующаяся снижением содержанием кислорода в тканях, является отличительной чертой множества патофизиологических состояний. Основной причиной гипоксии при инфаркте миокарда и инсульте является снижение кровотока, связанное с закупорками сосудов и атеросклерозом [Eltzschig Н.K. et. al. Nat. Med. 2011; 17: 1391-401]. При ишемии мозга дефицит кислорода запускает высвобождение глутамата, отвечающего за эксайтотоксичность, с последующей активацией воспалительного ответа и нейронной NO-синтазы, образованием активных форм кислорода и гибели нейронов [Sun М.K. et. al. IUBMB Life. 1999; 48(4): 373-8; Не Q. et. al. Front. Immunol. 2021; 12: 801985]. Нередко при ишемическом инсульте возникает головная боль различной интенсивности, частота которой составляет от 7 до 60% случаев [Koudstaal P.J. et. al. Stroke. 1991; №22: 754-9; Lebedeva E.R. et. al. J. Headache. Pain. 2022; 202223(1): 103], a также когнитивные нарушения и деменция (от 15 до 70% случаев), возникающие после инсульта [Rist P.M. et. al. Stroke. 2013; V.44: 1790-5; Douiri A. et. al. Stroke. 2013; 44: 138-45; Sachdev P.S. et. al. Dement. Geriatr. Cogn. Disord. 2006; 21: 275-83] и приводящие к инвалидизации [Zietemann V. et. al. Neurol. 2018; V.91: e1838-e1850; Melkas S. et. al. J. Neurol. Neurosurg. Psych. 2009; 80: 865-70].
Согласно проведенным исследованиям, в сыворотке крови пациентов во время острой фазы ишемического инсульта (ИИ) отмечается значительное повышение концентрации ММП-9 [Kurzepa J. et. al. J. Clin. Neurosci. 2010; 17: 997-9; Cojocarui I.M. et. al. Rom. J. Intern. Med. 2012; 50:155-8]. В гомогенатах мозга крыс, полученных из пораженного полушария, активность желатиназ повышается в день инсульта по сравнению с контралатеральной стороной [Park K.Р. et. al. Stroke. 2009. 40: 2836-42]. Благодаря плейотропной активности, желатиназы вовлечены в многочисленные патофизиологические процессы при ишемии головного мозга (фиг.2).
ММП-9 участвует в воспалительной реакции, вызванной ишемией головного мозга. Как TNF-α, так и IL-6 могут активировать экспрессию ММП-9, которая вовлечена в дальнейшую активацию IL-1β и CXCL-8 [Montaner J. et. al. Rev. Neurol. 2001; 33: 115-8]. Однако, наибольшая опасность ММП-9, по-видимому, связана с разрушением гематоэнцефалического барьера (ГЭБ). В дополнение к расщеплению коллагена IV типа, ММП-9 способна «переваривать» важнейшие компоненты белков плотных соединений в ГЭБ [Yamada Н. et. al. Biochem. Pharm. 2013; 85: 1770-82]. Появление активной формы фермента в плазме в результате введения рекомбинантного тканевого активатора плазминогена (rtPA) увеличивает риск кровотечения. rtPA повышает высвобождение ММП-9 из гранул нейтрофилов, что приводит к увеличению ММП-9 в плазме [Cuadrado Е. et. al. J. Leukoc. Biol. 2008; 84: 207-14]. Как протеолитический фермент rtPA участвует в каскаде активации ММП; rtPA активирует плазминоген до плазмина, который активирует про-ММП-3 до ММП-3. Основой для активного ММП-3 является, среди прочего, про-ММП-9, который преобразуется в активный ММП-9 [Suzuki Y. J. Pharmacol. Sci. 2010; 113: 203-7]. Описание взаимосвязи между rtPA и ММП-9 показывает, что более высокая концентрация ММП-9 у пациентов, получавших тканевой активатор плазминогена, приводит к неблагоприятному клиническому исходу и более высокому риску геморрагической трансформации [Castillo J. et. al. Cerebrovasc. Dis. 2004; 17 (S1): 7-18].
Механизм экспрессии желатиназы ММП-2 медленнее, чем у ММП-9. Предполагается, что этот фермент играет роль на поздней стадии ишемии во время формирования глиального рубца в поврежденной области [Copin J.C. et. al. Brain. Res. 2007; 1150: 167-73].
В отличие от хорошо охарактеризованных внеклеточных функций желатиназ, их внутриядерная роль остается во многом неизученной. Известно, что повышенная внутриядерная активность обеих желатиназ разрушает белки репарации ядерной ДНК и способствует накоплению поврежденной ДНК в нейронах головного мозга крыс через 3 ч реперфузии после ИИ [Hill J.W. et al. Neuroscience. 2012; 220: 277-90]. Желатиназы расщепляют два белка, важных для катаболизма ДНК, поли-АДФ-рибозополимеразу-1 (PARP-1) и рентгеновский кросс-комплементарный белок 1 (XRCC1) [Yang Y. et. al. J. Neurochem. 2010; 112: 134-49].
Некоторые данные, относящиеся к вовлечению желатиназ в патофизиологические механизмы формирования ишемии головного мозга, были получены в экспериментах с животными-нокаутами. У мышей-нокаутов по гену, кодирующему ММП-9, объем ишемического очага при моделировании ИИ был значительно меньше по сравнению с животными дикого типа. Наблюдалось уменьшение объема инфаркта мозга с помощью ингибитора ММП ВВ-94 у мышей дикого типа, но не нокаутов, подвергнутых фокальной ишемии головного мозга [Asahi М. et. al. J. Cereb. Blood. Flow. Metab. 2000; 20: 1681-9].
Согласно клиническим исследованиям, была установлена взаимосвязь между повышенным уровнем ММП-9 в сыворотке крови больных в краткосрочной фазе ишемического инсульта и 3-месячными когнитивными нарушениями [Chongke Z. et. al. J. Am. Heart. Assoc. 2018; 7(1): e007776], а также доказана важная роль ММП-9 и полиморфизм rs3918242 ММП-9 в возникновении и развитии постинсультных когнитивных нарушений или деменции [Zhao J. et. al. J. Integr. Neurosci. 2022; 21(6): 160].
Принимая во внимание значительную роль желатиназ при ишемии головного мозга, их ингибирование является перспективным подходом к терапии цереброваскулярных нарушений. Множество различных ММП, их плейотропная активность и сходная структура приводят к тому, что конструирование селективных ингибиторов представляет собой непростую задачу [Roycik M.D. et. al. Curr. Mol. Med. 2013; 13: 1299-313].
Исследование Rosenberg G.A. и др. (1998) показало, что применение синтетического ингибитора ММП на основе гидроксамовой кислоты (ВВ-1101) способствовало уменьшению проницаемости ГЭБ через 3 ч и снижению отека мозга через 24 ч реперфузии [Rosenberg G.A. et. al. Stroke. 1998; 29: 2189-95]. Кроме того, при использовании ВВ-1101 снижалась деградация клаудина-5 и окклюдина после реперфузии, что предотвращало нарушения ГЭБ [Yang Y. et. al. J. Cereb. Blood. Flow. Metab. 2007; 27: 697-709]. Ингибирование желатиназ синтетическим ингибитором р-аминобензоил-gly-pro-D-leu-D-ala-гидроксамата (AHA) перед моделированием транзиторной очаговой ишемии головного мозга также значительно снижало повреждение ГЭБ [Gasche Y. et. al. J. Cereb. Blood. Flow. Metab. 2001; 21: 1393-400]. Батимастат, или соединение BB-94 (4-(N-гидроксиамино)-2R-изобутил-3S-(тиофен-2-ил-тиометил)-сукцинил-L-фенилаланин-N-метиламид), является мощным синтетическим ингибитором широкого спектра матриксных металлопротеиназ, включая интерстициальную ММП-1 (IC50=3 нМ), ММП-3 (IC50=20 нМ), ММП-2 (IC50=4 нМ), ММП-9 (IC50=4 нМ) и ММП-7 (IC50=6 нМ). Стабилизация ГЭБ с помощью ВВ-94, введенного до лечения рекомбинантным тканевым активатором плазминогена, сокращала смертность и риск, связанный с тромболизисом [Pfefferkorn Т. et. al. Stroke. 2003; 34: 2025-30]. Мыши, получавшие ингибитор металлопротеиназ широкого спектра действия ВВ-94 (50 мг/кг, внутривенно), демонстрировали снижение активности желатиназ гиппокампа после транзиторной глобальной ишемии головного мозга, и у животных отмечали значительное уменьшение повреждения гиппокампальных нейронов по сравнению с контрольной группой [Lee S.R. et. al. J. Neurosci. 2004; 24(3): 671-8]. Попытки уменьшить ММП-опосредованное повреждение головного мозга с помощью ингибиторов ММП широкого спектра действия (таких как производные гидроксамата) давали многообещающие результаты в экспериментальных моделях инсульта, однако, низкая специфичность и, следовательно, системная токсичность гидроксаматов стала препятствием к использованию этих ингибиторов в клинических исследованиях [Coussens L.M. et. al. Science. 2002; 295: 2387-92; Overall C.M. et. al. Nat. Rev. Cancer. 2002; 2: 657-72].
В 2005 г. Gu Z. et al. впервые представили новый ингибитор желатиназы (соединение SB-3CT), который блокирует активность ММП-2 и ММП-9 со значениями Ki 13,9 и 600 нМ, соответственно, включая опосредованное ММП-9 расщепление ламинина, тем самым защищая нейроны от апоптоза. SB-3CT (2-[[(4-феноксифенил) сульфонил]метил]тииран) устраняет неврологический дефицит после транзиторной очаговой ишемии [Gu Z. et. al. J. Neurosci. 2005; 25(27): 6401-8] и эмболической очаговой ишемии головного мозга [Cui J. et. al. Mol. Neurodegener. 2012; 7: 21] у мышей.
Антибиотики, относящиеся к семейству тетрациклинов, обладают нейропротекторными свойствами при лечении ишемического повреждения головного мозга [Wang Z. et. al. J. Mol. Neurosci. 2012; 47: 89-100]. Исследование Бургграфа и др. показало, что доксициклин ингибировал активность ММП путем блокирования активатора плазминогена урокиназы, что снижало активность системы плазминоген/ММП [Burggraf D. et. al. Neurobiol. Dis. 2007; 25: 506-13]. Однако, доксициклин, как липофильный агент, может проникать через ГЭБ в ткань головного мозга [Barza М. et. al. Antimicrob. Agents. Chemother. 1975; 8: 713-20]. Исследование Wang и соавт.[Wang Z. et. al., 2012] показало, что доксициклин значительно снижал проницаемость ГЭБ и объем инфаркта головного мозга у крыс не только за счет ингибирования активности ММП-2 и ММП-9, но и за счет снижения экспрессии желатиназы на уровне мРНК. Введение доксициклина за 30 мин до и через 2 ч после транзиторной глобальной ишемии головного мозга снижало активность ММП-9 в ткани головного мозга [Lee Н. et. al. Neurobiol. Dis. 2009; 34: 189-98]. Благодаря способности защищать ГЭБ от расщепления желатиназами, тетрациклин рассматривается как средство для снижения риска кровотечений во время тромболитической терапии.
Миноциклин, другой представитель антибиотиков тетрациклинового ряда, уменьшал объем инфаркта головного мозга, уровень ММП-9 в плазме крови и риск кровотечения во время позднего, 6-часового тромболизиса с помощью тканевого активатора плазминогена после эмболической фокальной ишемии [Murata Y. et. al. Stroke. 2008; 39: 3372-7]. Высказано предположение, что комбинированная терапия rtPA с миноциклином, который является более селективным ингибитором ММП-9, может расширить терапевтическое окно для тромболизиса.
Таким образом, многочисленные исследования указывают на то, что ингибиторы ММП способны блокировать гибель нейронов при ишемии головного мозга.
Одним из значимых достижений в области исследований ММП считается новое понимание роли, которую играют эти ферменты в ноцицепции и гипералгезии. Хотя доказательств прямого влияния ММП на периферические ноцицепторы остается очень мало, ММП являются важными компонентами в возникновении боли, вызванной воспалением и поражением нейронов, благодаря сложной взаимосвязи с цитокинами, хемокинами, факторами роста и молекулами адгезии, к которым чувствительны ноцицепторы [Scholz J. et. al. Nature. Neuroscience. 2007; 10(11): 1361-68].
Ранее на основании структур известных ингибиторов ММП-2 и ММП-9 [Peterson T.J. et. al. Circulation. 2001; 103: 2303-9], а также описанных в литературе структурных требований к ингибиторам желатиназ А и Б [Verma R.P. et al. Bioorg. Med. Chem. 2007; 5: 2223-268], нами была предложены возможные фармакофорные единицы новых ингибиторов [Григоркевич О.С. и др. Хим.-фарм. журн. 2018; 52(1): 8-14]. Фармакофор содержит в себе необходимые структурные элементы для связывания с активным центром желатиназ: цинк-связывающую карбоксильную группу, протяженную биароматическую липофильную группу для связывания с сайтом S1' и циклический участок для связывания с сайтом S1 (фиг.3).
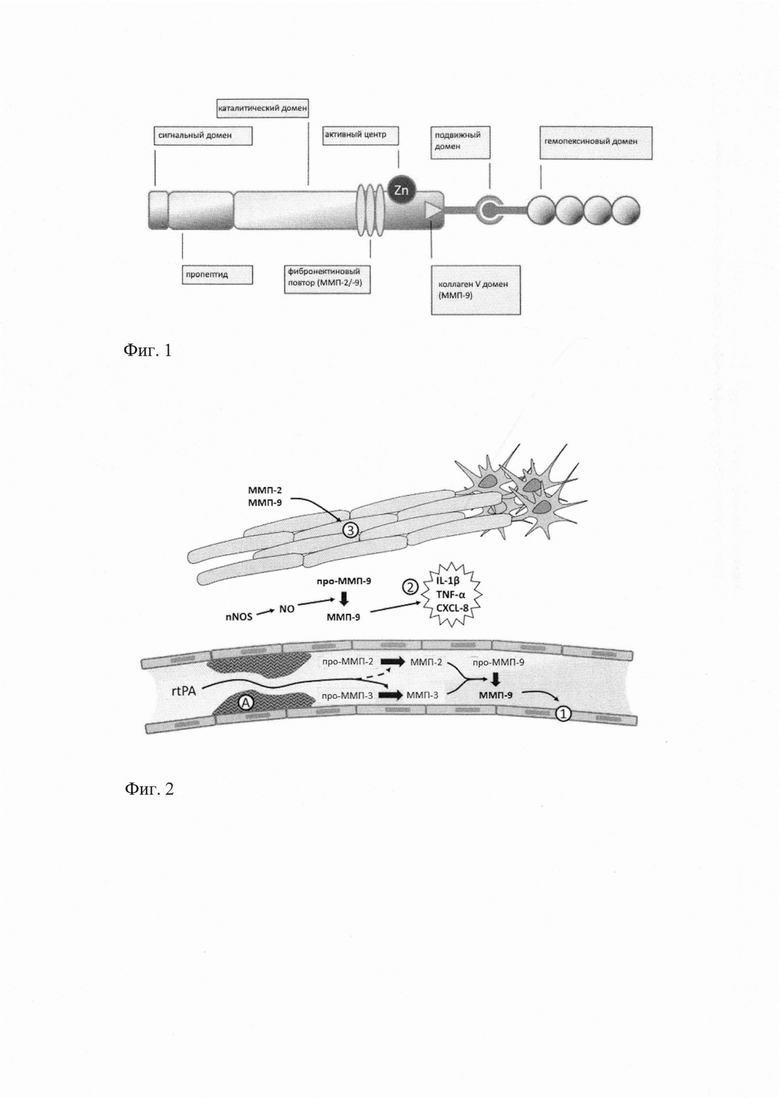
На основании этого фармакофора было предложено новое соединение, 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойная кислота (ГГМ-14), с предполагаемой ингибиторной активностью по отношению к ММП-2 и ММП-9.
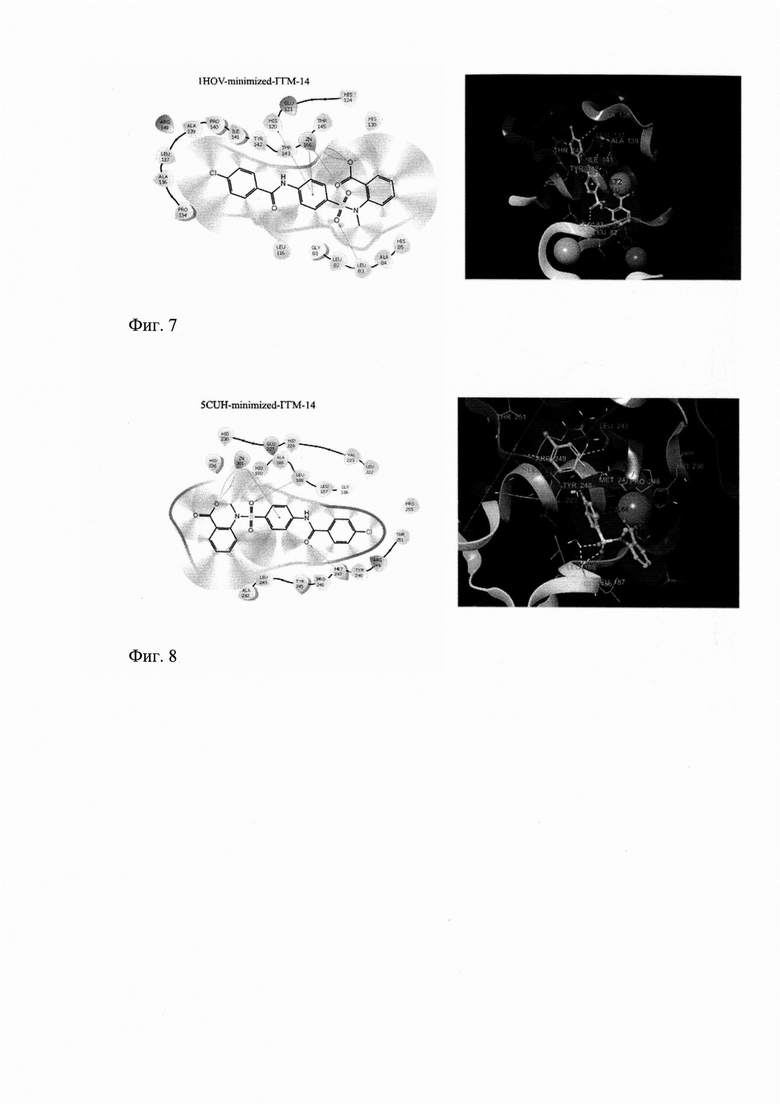
Для молекулярного докинга использовались 3D структуры белков ММП-2 (PDB ID: 1HOV) и ММП-9 (PDB ID: 5CUH). Белки 5CUH(ММП-9), 1HOV(ММП-2) подготавливали с помощью Schrodinger Protein Preparation Wizard с использованием стандартного протокола [Schrodinger Release 2015-2: LigPrep, Schrodinger, LLC, NY, 2015]. Конформации лигандов рассчитывали в модуле LigPrep. Координаты сетки были отцентрированы по исходным лигандам на расстоянии 20А. Стыковку выполняли в Glide v9.1. с использованием ХР высокого предсказания [Schrodinger Release 2015-4: Maestro, Version 10.4, Schrodinger, LLC, NY, 2015.]. Для оценки связывания лиганд-цинк использовали модуль Epik. Позы были визуализированы в Maestro 12.8 (фиг.4).
Предложенное соединение содержит в себе необходимые структурные элементы для связывания с активным центром желатиназ (фиг.5):
1. Карбоксильную группу для связывания с ионом цинка;
2. Протяженную биароматическую липофильную группу для связывания с сайтом S1';
3. Циклический участок для связывания с сайтом S1 (N-метилантраниловую кислоту и др.).
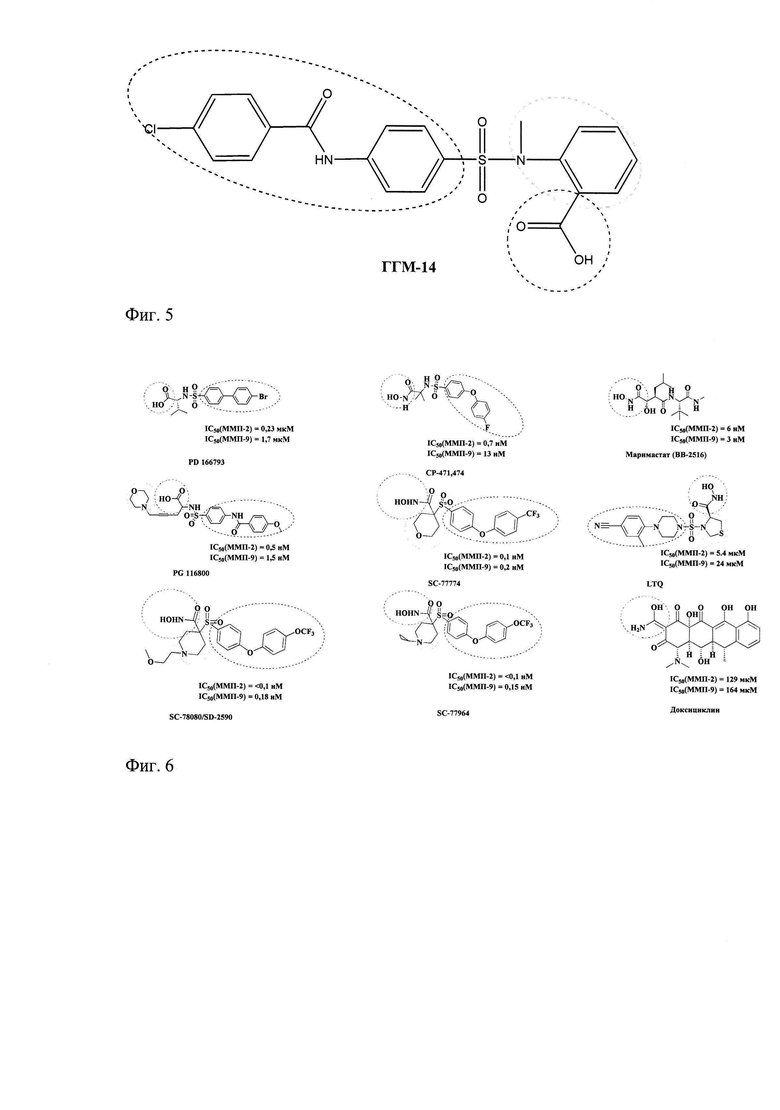
В качестве сравнения были отобраны соединения - ранее описанные ингибиторы ММП-2 и ММП-9 (фиг.6) [Peterson Т.J. et al., 2001; Rohde L.E. et. al. J. Am. Heart Assoc. 1999: 3063-70; Yarbrough W.M. et al. Circulation. 2003; 108: 1753-9; Becker D.P. et al. J. Med. Chem. 2010; 53: 6653-80; Cathcart J.M. et al. Frontiers in Bioscience, Landmark, 2015; 20: 1164-78; Whittaker M. et al. Celltransmissions. 2001; 17(1): 3-14].
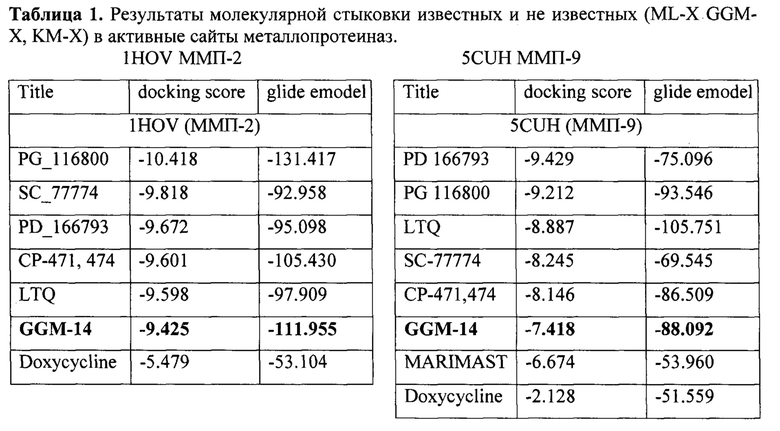
Визуализированные результаты молекулярного докинга в 2D и 3D-проекциях по отношению к активному центру ММП-2 (1HOV) представлены на фиг.7. Соединение ГГМ-14 имеет среди ключевых взаимодействий связывание карбоксильной группы с катионом цинка. Так же имеется π-π-стэкинг между ароматической группой исследуемого соединения и имидазольной группой His120. За счет водородных связей происходит взаимодействие между сульфонильной группой ГГМ-14 и Leu83 фермента. Дополнительная стабилизация происходит благодаря катион-π взаимодействию цинка с одним из ароматических колец исследуемого соединения (фиг.7).
Визуализированные результаты молекулярного докинга в 2D и 3D-проекциях по отношению к активному центру ММП-9 (5CUH) представлены на фиг.8. Соединение ГГМ-14 имеет среди ключевых взаимодействий связывание карбоксильной группы с катионом цинка. За счет водородных связей происходит взаимодействие между сульфонильной группой ГГМ-14 и Leu188, а также амидной группой и Met247. Дополнительная стабилизация происходит благодаря катион-π взаимодействию цинка с одним из ароматических колец исследуемого соединения (фиг.8).
Таким образом сконструирован новый потенциальный ингибитор желатиназ 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойная кислота (ГГМ-14).
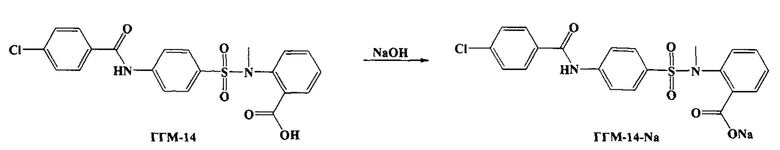
Для упрощения проведения исследований в дальнейшем, также было решено получить водорастворимую натриевую соль 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойной кислоты (ГГМ-14-Na).
Соединение, описанное в вышеприведенных ссылках, не открывает и не предполагает структуры патентуемого соединения.
Целью настоящего изобретения является разработка нового биологически активного соединения, обладающего нейропротекторной, антигипоксической, анальгетической и мнемотропной активностью, в ряду новых ингибиторов ММП-2 и ММП-9. Эта цель была достигнута путем получения потенциального ингибитора ММП-2 и ММП-9 на основе производного антраниловой кислоты общей формулы 1.
Соединение формулой 1, его свойства и способ получения в специальной и патентной литературе не описаны.
Соединение формулы 1 настоящего изобретения: 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойная кислота (ГГМ-14) и его физиологически приемлемая натриевая соль.
Техническим результатом изобретения является расширение арсенала лекарственных средств для лечения заболеваний и состояний организма, требующих применения средств, обладающих нейропротекторной, антигипоксической, анальгетической и мнемотропной активностью.
Синтез производного антраниловой кислоты
Синтез бензоиламино(фенилсульфонил)-о-(N-метиламино) бензойной кислоты (ГГМ-14) и ее натриевой соли (ГГМ-14-Na) осуществлялся по следующим схемам:
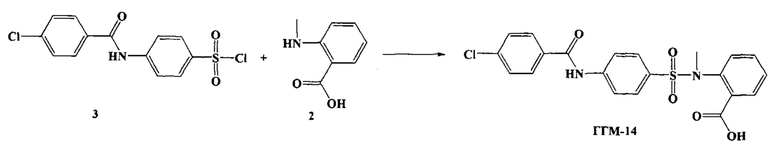
К избытку антраниловой кислоты (2) в полярных растворителях, таких как вода, тетрагидрофуран, диоксан, диметилсульфоксид, диметилформамид, в присутствии избытка акцепторов кислот, таких как, гидроксиды щелочных металлов, карбонаты щелочных металлов, аммиак или третичные амины, при температурах кипячения добавляют арилсульфонилхлорид (3) и перемешивают 1 час, затем еще сутки при комнатной температуре. Реакционную массу подкисляют до нейтральной среды, выпавший осадок отфильтровывают и промывают водой. Выпавший осадок бензоиламино(фенилсульфонил)-антраниловой кислоты (ГГМ-14) перекристаллизовывают из спирта, в качестве которого может быть использован этанол или другой спирт.
Для получения соли бензоиламино(фенилсульфонил)-антраниловой кислоты (ГГМ-14-Na) в эквимолярных соотношениях в воде, смешивают бензоиламино(фенилсульфонил)- антраниловую кислоту (ГГМ-14) с гидроксидами щелочных металлов. Полученный раствор упаривают досуха и получают соль бензоиламино(фенилсульфонил)-замещенной антраниловой кислоты (ГГМ-14-Na).
Пример 1. Способ получения 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойной кислоты (ГГМ-14)
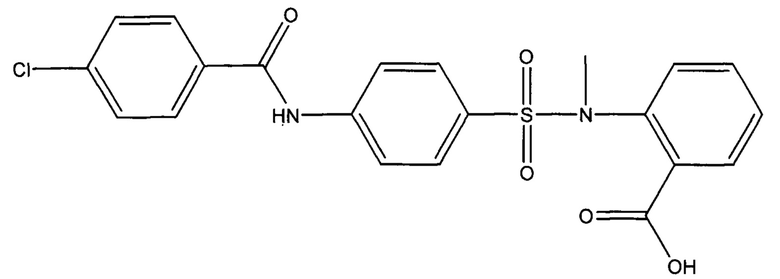
К раствору 0,55 г (0,0036 моль) N-метилантраниловой кислоты и 0,48 г (0,012 моль) гидроксида натрия в 50 мл дистиллированной воды прибавляют 1 г (0,003 моль) 4-[(4-хлорбензоил)амино]бензолсульфонилхлорида. Полученную массу перемешивают в течении 2 часов при нагревании на водяной бане до 75°С, затем при комнатной температуре в течении суток. Реакционную массу отфильтровывают от оставшегося осадка. К оставшемуся раствору прикапывают 0,1 М HCl до значения рН 1. Выпавший осадок отфильтровывают, промывают дистиллированной водой до нейтрального значения среды и сушат при 70°С. Полученный осадок перекристаллизовывают из минимального количества 96%-ного этанола, получая 0,53 г продукта в виде белого порошка (выход 40%).
Спектр ЯМР 1H (DMSO, δ, м.д., J/Гц): 3.17 (с, 3 Н, СН3); 6.87 (м, 1 Н, Н(6``)); 7.6 (м, 2 Н, Н(3), Н(5)); 7.62 (м, 4 Н, Н(4``), Н(2`), Н(6`), Н(3``)); 7.65 (м, 1 Н, Н(5``)); 7.74 (м, 4 Н, Н(2), Н(6), Н(3`), Н(5`)); 10.71 (с, 1 Н, NH), 12.95 (с, 1 Н, С(О)-ОН). ТСХ: CHCl3:МеОН:H2O=26:14:3 Rƒ=0,81. Т.пл. 199-201°С (разл).
Пример 2. Способ получения натриевой соли 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойной кислоты (ГГМ-14-Na)
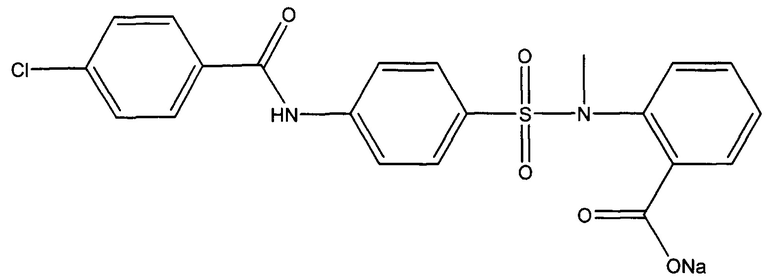
К суспензии 0,1 г (0,22 ммоль) 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойной кислоты в 10 мл дистиллированной воды прикапывают раствор 0,01 г (0,22 ммоль) гидроксида натрия в 5 мл дистиллированной воды. Полученный раствор упаривают досуха, получая 0,034 г натриевой соли 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойной кислоты в виде белого порошка (выход 31%).
Спектр ЯМР 1H (DMSO, δ, м.д., J/Гц): 3.12 (с, 3 Н, СН3); 6.86 (м, 1 Н, Н(6``)); 7.15 (м, 2 Н, Н(3), Н(5)); 7.39 (м, 1 Н, Н(4``)); 7.61 (м, 2 Н, Н(2`), Н(6`)); 7.86 (м, 2 Н, Н(3``), Н(5``)); 8.03 (м, 4 Н, Н(2), Н(6), Н(3), Н(5`)); 10.97 (с, 1 Н, NH). ТСХ: CHCl3:МеОН:H2O=26:14:3 Rƒ=0,85. Т.пл.>250°С.
Фармакологическое изучение заявляемых соединений
Пример 3. Антигипоксическая активность ГГМ-14
Исследование выполнено на аутбредных белых мышах-самцах массой 21-29 г, полученных из ФГБНУ «Научный центр биомедицинских технологий ФМБА» (филиал «Столбовая»). Животных содержали по 5 особей в клетке в условиях вивария при естественной смене светового режима со свободным доступом к стандартному гранулированному корму (ГОСТ Р 50258-92) и воде в течение 7 суток до начала тестирования в соответствии с ГОСТ 33216-2014. Эксперименты проводили в соответствии с решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. №81 "Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств". Хендлинг проводили дважды в неделю (совместно с чисткой). Эксперименты проводили с 10 до 16 часов. Манипуляции с животными были одобрены Комиссией по биомедицинской этике ФГБНУ «НИИ фармакологии имени В.В. Закусова» (протокол №5 от 19.04.2022 г).
Антигипоксическая активность соединения ГГМ-14 была исследована на модели нормобарической гипоксии с гиперкапнией в гермообъеме («баночная» гипоксия») в соответствии с методическими рекомендациями по доклиническому изучению лекарственных средств с ноотропным типом действия [Воронина, Т.А., и др. В кн. Руководство по проведению доклинических исследований лекарственных средств, Миронова А.Н. (ред) Гриф и К, Москва, 2012: 276-96]. За 1 час до начала эксперимента животным внутрибрюшинно (в/б) вводили исследуемое соединение в диапазоне доз от 0,01 мг/кг до 1 мг/кг или пирацетам в дозе 1000 мг/кг, или доксициклин в дозе 60 мг/кг. Все вещества вводили в виде суспензии в 1% водном растворе Twin-80. Животные контрольной группы получали аналогичный объем (0,1 мл на 10 г веса тела) 1% водного раствора Twin-80 [Граник В.Г. и др. Хим.-фарм. журн. 1989; 23(10): 1186-93]. Мышей помещали в индивидуальные герметически закрытые сосуды вместимостью 250 мл (высота 10 см, диаметр 5,8 см) и фиксировали наступление смерти по времени последнего атонального вздоха.
Для статистической оценки использовали критерий Краскела-Уоллиса с последующими попарными межгрупповыми сравнениями с помощью теста Данна.
В качестве препарата сравнения было выбрано ноотропное лекарственное средство - пирацетам, которое проявляет антигипоксический эффект на модели гипоксической гипоксии с гиперкапнией в дозе 1000 мг/кг, в/б (р<0,001) [Граник В.Г. и др., 1989; Колясникова К.Н. и др. Экспер. и клин, фармакол. 2012; 75(9): 3-6]] и зарегистрированный FDA ингибитор ММП-2 и ММП-9 - доксициклин в дозе 60 мг/кг, в/б [Sadowski Т. et. al. Inflamm. Res. 2001; 50(3): 175-182]. 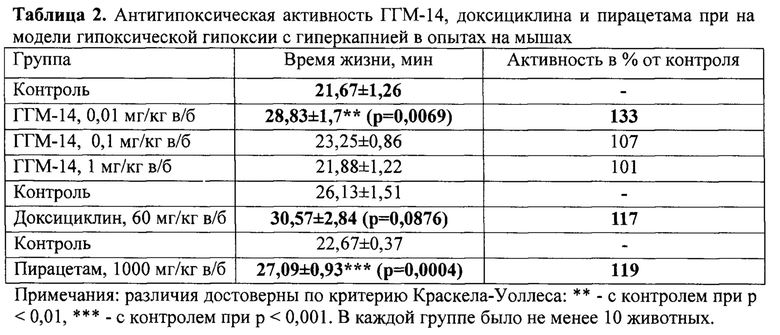
Соединение ГГМ-14 проявляет антигипоксическую активность в дозе 0,01 мг/кг, в/б (р<0,01) (табл.2).
Таким образом производное антраниловой кислоты ГГМ-14 (1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойная кислота) в дозе 0,01 мг/кг, в/б обладает антигипоксическим действием, что выражается в способности вещества увеличивать продолжительность жизни животных в условиях нормобарической гипоксии с гиперкапнией. Эффект соединения ГГМ-14 по выраженности сравним с таковым для пирацетама, но в дозе на пять порядков меньше.
Пример 4. Нейропротекторная активность ГГМ-14-Na
Для эксперимента было выбрано растворимое в воде соединение ГТМ-14-Na. Для оценки нейропротекторной активности соединения ГГМ-14-Na использовалась модель окислительного стресса. Иммортализованные клетки гиппокампа мыши линии НТ-22 рассеивали в 96-луночных планшетах с плотностью 3,5×103 на лунку в среде DMEM (HyClon, США), содержащей 5% телячьей эмбриональной сыворотки (Invitrogen, США) и 2 мМ L-глутамина (ICN, США), и инкубировали при 37°С в 5% CO2 до образования монослоя.
Для моделирования окислительного стресса использовали Н2О2 в конечной концентрации 1,5 мМ. Клетки с Н2О2 инкубировали в атмосфере 5% СО2 при 37°С 30 мин [Jackson G.R. et al. Brain Res. 1992; 592(1): 239-248]. Далее среду заменяли на нормальную и через. 4 ч определяли жизнеспособность клеток с помощью бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия (МТТ) (Applichem, Германия) [UedaY. et al. Neurosci. Lett. 1994; 165: 203-207]. Оптическую плотность измеряли на спектрофотометре "Multiscan EX" (Thermo, США) при длине волны 600 нм.
Активность в опытах по противодействию окислительному стрессу рассчитывалась по формуле А(%)=(Dэксп - Dн2о2) / (Dконтр - Dн2о2) × 100%, где Dэксп - оптическое поглощение раствора в опыте, Dн2о2 - оптическое поглощение раствора активного контроля (с Н2О2), Dконтр - оптическое поглощение; пассивного контроля (без Н2О2).
Внесение соединения. ГГМ-14-Na за 24 ч и сразу после повреждения клеток в конечных концентрациях от 10-5 до 10-8 М.
Статистическую обработку данных проводили с использованием критерия Краскела-Уоллиса с последующим тестом по Данну (ANOVA). Данные представлены с указанием стандартного отклонения mean ± s.d. Результаты считались достоверными при р≤0,05.
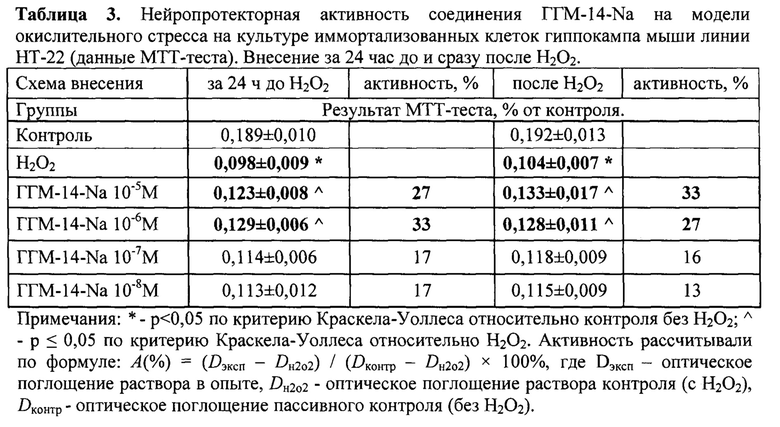
Окислительный стресс, вызванный Н2О2 (1,5 мМ), приводил к достоверному снижению жизнеспособности гиппокампальных клеток линии НТ-22. ГГМ-14-Na защищал клетки от повреждения Н2О2 в концентрациях 10-5 - 10-6М при внесении за 24 часа до перекиси водорода и 10-5 - 10-6 М при внесении соединения после смены среды, (табл.3).
Пример 5. Анальгетическая активность ГГМ-14
Эксперимент выполнен на инбредных мышах-самцах линии С57В1/6 (n=32) с массой тела 18-22 г. (ФГБНУ «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая»). Животных содержали по 5 особей в клетке в условиях вивария при естественной смене светового режима со свободным доступом к стандартному гранулированному корму (ГОСТ Р 50258-92) и воде в течение 7 суток до начала тестирования в соответствии с ГОСТ 33216-2014. Эксперименты проводили в соответствии с решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. №81 "Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств". Все манипуляции с животными были одобрены Комиссией по биомедицинской этике ФГБНУ «НИИ фармакологии имени В.В. Закусова» (протокол №5 от 19.04.22 г.).
Соединение ГГМ-14 в дозах 0,01, 0,1 и 1,0 мг/кг (суспензия в 1% водном растворе Твин-80) вводили однократно в/б из расчета 0,1 мл на 10 г веса мыши. Животные контрольной группы получали 1% водный раствор Твин-80 в/б в эквивалентном объеме.
Для оценки ноцицептивной реакции, возникающей в ответ на термическое раздражение ноцицепторов, использовали стандартный тест «горячая пластина», который позволяет оценить механизмы формирования болевой реакции на супраспинальном уровне. С помощью анальгезиметра «Ugo Basile» (Италия) регистрировали латентное время реакции (лизание задней лапы или прыжок) мыши на нагретую до 55±0.5°С пластину. За 1-2 ч до начала опыта проводили отбор мышей по их базовой реактивности в условиях данной модели, исключая тех, у которых латентное время ответной реакции было больше 10 с. Латентный период в 20 с (максимальное время экспозиции) расценивали как 100% анальгезию. Фиксировали время появления реакции у мышей через 30, 60, 90 и 120 мин после однократного введения изучаемого соединения. Полученные результаты выражали в виде максимально возможного эффекта (МВЭ) в %. МВЭ = (латентный период реакции после введения соединения минус фоновый латентный период реакции)/(максимальное время экспозиции минус фоновый латентный период реакции) × 100% [Le Bars D. et. al. Pharmacol. Rev. 2001; 53(4): 597-652].
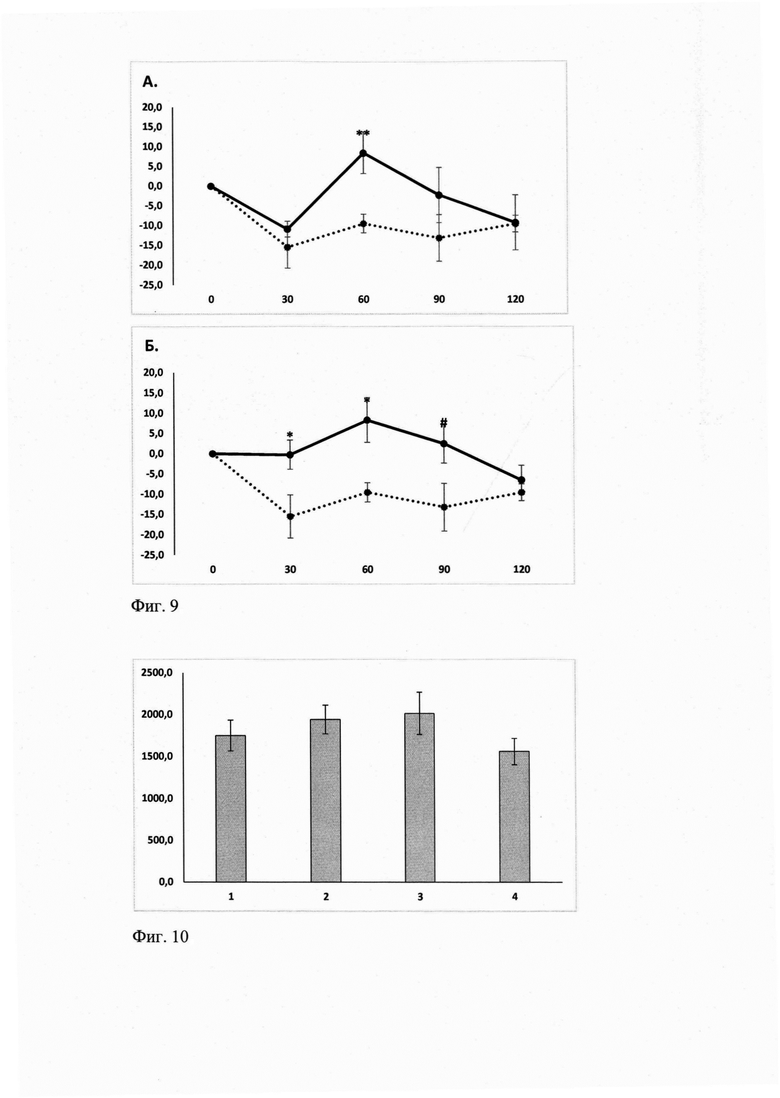
ГГМ-14 в минимальной изученной дозе 0,01 мг/кг не влиял на пороги болевой реакции в изученном временном диапазоне. Через 30 мин после введения ГГМ-14 в дозе 1,0 мг/кг статистически значимо увеличивал латентный период реакции при термической стимуляции ноцицепторов по сравнению с контрольной группой (р<0.05). Через 60 мин после введения ГТМ-14 в дозах 0,1 и 1,0 мг/кг увеличивал пороги ноцицептивной реакции по сравнению с контрольной группой (р<0,01 и р<0,05, соответственно), что указывает на наличие обезболивающего действия в спектре фармакологической активности ГГМ-14. Через 90 мин после введения ГГМ-14 только в максимальной дозе 1,0 мг/кг сохранял умеренное анальгетическое действие (р<0,06) по сравнению с контрольной группой. На 120 мин наблюдения ГГМ-14 ни в одной из изученных доз не проявлял антиноцицептивной активности (фиг.9А-Б).
Пример 6. Оценка влияния ГГМ-14 на спонтанную двигательную активность
Эксперимент выполнен на инбредных мышах-самцах линии С57В1/6 (n=54) массой тела 18-22 г. (ФГБНУ «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая»). Животных содержали по 5 особей в клетке в условиях вивария при естественной смене светового режима со свободным доступом к стандартному гранулированному корму (ГОСТ Р 50258-92) и воде в течение 7 суток до начала тестирования в соответствии с ГОСТ 33216-2014. Эксперименты проводили в соответствии с решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. №81. Манипуляции с животными были одобрены Комиссией по биомедицинской этике ФГБНУ «НИИ фармакологии имени В.В. Закусова» (протокол №5 от 19 апреля 2022 г.).
Соединение ГГМ-14 (суспензия в 1% водном растворе Твин-80) в дозах 0,01, 0,1 и 1,0 мг/кг вводили однократно в/б из расчета 0,1 мл/10 г веса мыши за 60 мин до начала тестирования в актометре. Животные контрольной группы получали 1% водный раствор Твин-80 в/б в эквивалентном объеме.
Оценку психостимулирующего и/или седативного действия нового соединения ГГМ-14 проводили по спонтанной двигательной активности мышей в актометре Opto-Varimex 4 (Columbus Instruments, США) [Besusso D. et al. Nat. Commun. 2013; 4: 2031]. Установка представляет собой квадратную плексигласовую арену со сторонами 42x42 см и высотой 20 см, по периметру которой расположены 4-е пары чувствительных оптоэлектронных датчиков (λ=875 нм) на высоте 2 см от пола, автоматически регистрирующие параметры двигательной активности животных и передающие их на блок управления, соединенный с компьютером. Активность животных регистрировали непрерывно в течение 10 минут.
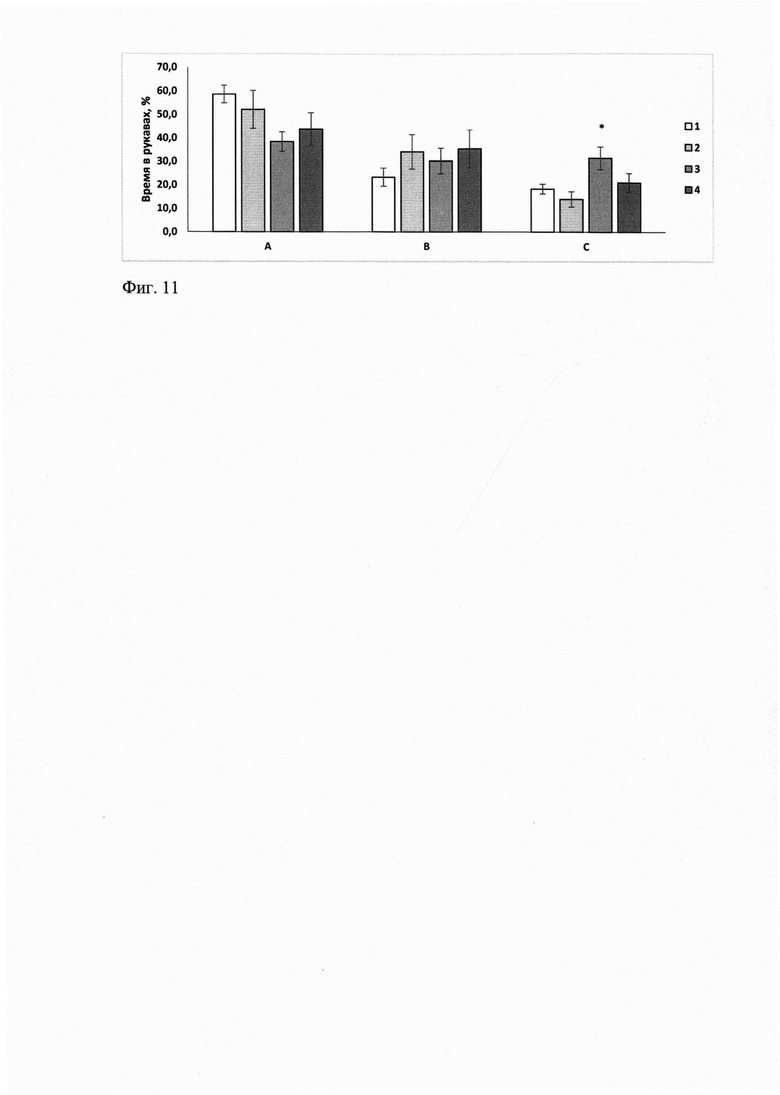
Соединение ГГМ-14 в диапазоне изученных доз 0,01-1,0 мг/кг, в/б, не влияло (ANOVA F(3, 50)=1,0267, р=0,38881) на спонтанную двигательную активность мышей С57В1/6(фиг.10).
Пример 7. Мнемотропная активность ГГМ-14
Эксперимент выполнен на инбредных мышах-самцах линии С57В1/6 (n=45) с массой тела 18-22 г. (ФГБНУ «Научный центр биомедицинских технологий Федерального медико-биологического агентства», филиал «Столбовая»). Животных содержали по 5 особей в клетке в условиях вивария в соответствии с ГОСТ Р 50258-92 и ГОСТ 33216-2014. Эксперименты проводили в соответствии с решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. №81. Манипуляции с животными были одобрены Комиссией по биомедицинской этике ФГБНУ «НИИ фармакологии имени В.В. Закусова» (протокол №6 от 25.05. 2022 г.).
Соединение ГГМ-14 (суспензия в 1% водном растворе Твин-80) в дозах 0,01, 0,1 и 1,0 мг/кг вводили однократно в/б за 60 мин до первого помещения животных в Y-лабиринт (1 фаза). Животные контрольной группы получали 1% водный раствор Твин-80 в/б в эквивалентном объеме.
Оценку мнемотропной активности выполняли с использованием установки «Y-лабиринт» (НПК Открытая Наука, Россия), которая позволяет оценить пространственную кратковременную память. Тест основан на природном инстинкте грызунов исследовать неизвестные среды. Y-образный лабиринт представляет собой установку серого цвета с равными рукавами длиной (32.5 см), шириной (8.5 см) и высотой (15 см) каждая, соединенных между собой под углом 120°. Каждый рукав обозначена отдельной буквой (А-стартовый, В-открытый, С-новый).
1-я фаза эксперимента. Перегородка блокирует рукав С для посещения. Мышь помещают в рукав А установки, где она свободно исследует рукав А и В в течении 5 минут.
2-я фаза эксперимента. Перегородку удаляют и освобождают рукав С для исследования. Через 30 минут мышь повторно помещают в рукав А и позволяют свободно исследовать три открытых рукава (А, В и С) в течение последующих 5 минут.
Регистрировали время пребывания в каждом отдельном рукаве и число выходов в рукава. Процент пребывания в каждом рукаве рассчитывали по формуле [Garcia Y. et. al. Behav. Sci. (Basel). 2018; 8(1): 14]: процент времени, пребывания в рукаве А, В или С (%) = время, затраченное на посещение рукава (с) × 100/ Общее время посещения трех рукавов. Процент выходов в рукава рассчитывали по формуле: процент выходов в рукава А, В или С (%) = количество выходов в исследуемый рукав × 100 / Общее количество выходов (А+В+С). Общую двигательную активность (ОДА) рассчитывали, как сумму всех посещений рукавов (А+В+С).
Соединение ГГМ-14 в дозе 0,1 мг/кг, в/б, увеличивало время пребывания в новом для исследования рукаве С, что свидетельствует о положительном влиянии на функцию кратковременной пространственной памяти. В дозах 0,01 и 1,0 мг/кг мнемотропного эффекта не зарегистрировано (фиг.11).
Соединение ГГМ-14 в диапазоне изученных доз (0,01-1,0 мг/кг в/б) не оказывало статистически значимого влияния ни на общую двигательную активность, ни на выходы в отдельные рукава Y-лабиринта мышей С57В1/6 (табл.4), что согласуется с данными об отсутствии влияния ГГМ-14 на спонтанную двигательную активность в актометре.
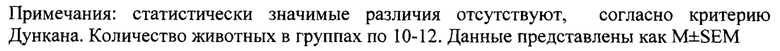
Таким образом установлено, что соединение 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойная кислота (ГГМ-14) в дозе 0,01 мг/кг в/б обладает выраженным антигипоксическим действием, что выражается в способности вещества увеличивать продолжительность жизни животных в условиях нормобарической гипоксии с гиперкапнией.
Соединение натриевая соль 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойной кислоты (ГГМ-14-Na) обладает нейропротекторным действием в концентрациях 10-5 - 10-6 М при внесении за 24 часа до перекиси водорода и в концентрациях 10-5- 10-6 М при внесении соединения после смены среды.
Соединение 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойная кислота (ГГМ-14) обладает дозозависимым анальгетическим действием с наиболее выраженным эффектом в дозе 0,1 мг/кг в/б при отсутствии влияния на спонтанную двигательную активность.
Соединение 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N(-метиламино)бензойная кислота (ГГМ-14) обладает дозозависимым мнемотропным действием с наиболее выраженным эффектом в дозе 0,1 мг/кг в/б при отсутствии влияния на общую двигательную активность.
Описание чертежей:
Фиг. 1. Общая схема структуры ММП-2 и ММП-9 (с адаптацией Kurzepa J. et al. International Journal of Neuroscience, 2014; 124(10): 707-716).
Фиг. 2. Активность желатиназ в очаге ишемии. После реперфузии (спонтанной или вследствие проведения системного тромболизиса рекомбинантным тканевым активатором плазминогена (rtPA)) запускается каскад ММП. rtPA обладает способностью активировать про-ММП-3 и косвенно про-ММП-2. Как ММП-3, так и ММП-2 могут расщеплять пропептид в ММП-9, превращая его в активный фермент. В мозговой ткани про-ММП-9 может быть активирован NO - продуктом нейронной NO-синтазы (nNOS). Активность ММП-2 и ММП-9 направлена на: нарушение гематоэнцефалического барьера за счет расщепления коллагена IV типа и белков, образующих плотные соединения (1); активацию провоспалительных цитокинов TNF-α, IL-1β и хемокина CXCL-8 (2); разрушение основного белка миелина (МВР) (3). (А) - сгусток, (с адаптацией Kurzepa J. et al., 2014).
Фиг. 3. Группа бензоиламино(фенилсульфонил)-замещенных циклических аминокислот.
Фиг. 4. Координаты сетки стыковки на расстоянии 20А от лиганда SC-74020 в активном центре 1HOV проекция 3D.
Фиг. 5. Структура соединения 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойной кислоты (ГГМ-14). Цинк-связывающая группа выделена красной пунктирной окружностью; биароматическая липофильная группа - синей пунктирной окружностью; циклический участок - зеленой пунктирной окружностью.
Фиг. 6. Описанные ингибиторы ММП-2 и ММП-9. Цинк-связывающие группы выделены красными пунктирными окружностями; биароматические липофильные группы - синими пунктирными окружностями; циклические участки - зелеными пунктирными окружностями.
Фиг. 7. Результат молекулярной стыковки ГГМ-14 с 1HOV 2D и 3D проекции.
Фиг. 8. Результат молекулярной стыковки ГГМ-14 с 5CUH 2D и 3D проекции.
Фиг. 9. Влияние ГГМ-14 на латентный период реакции мышей С57В1/6 в тесте «горячая пластина». 3А.
По оси абсцисс - время развития эффекта (мин).
По оси ординат - максимально возможный эффект (МВЭ), %.
Экспериментальные группы:
I - «Контроль» - черный круг, линия из точек;
II - "ГГМ-14 0,1 мг/кг" - черный круг, черная линия
Примечания: ** - р<0,01 - статистически значимо по отношению к группе "Контроль" для соответствующего отрезка времени согласно критерия Стьюдента. Число животных в группах n=8. Данные представлены в виде M±SEM 3Б.
По оси абсцисс - время развития эффекта (мин).
По оси ординат - максимально возможный эффект (МВЭ), %.
Экспериментальные группы:
I - «Контроль» - черный круг, линия из точек;
II - "ГГМ-14 1,0 мг/кг" - черный круг, черная линия
Примечания: * - р<0,05, # - р<0,06 по отношению к группе "Контроль" для соответствующего отрезка времени согласно критерия Стьюдента. Число животных в группах n=8. Данные представлены в виде M±SEM.
Фиг. 10. Оценка влияния ГГМ-14 на спонтанную двигательную активность у мышей С57В1/6.
По оси абсцисс - экспериментальные группы: 1 - «Контроль», 2 - «0,01 мг/кг», 3 - «0,1 маг/кг», 4 - «1,0 мг/кг. По оси ординат - пройденное расстояние, см.
Примечания: число животных в группах n=12-14. Данные представлены в виде M±SEM
Фиг. 11. Влияние ГГМ-14 на время пребывания в отдельных рукавах А, В и С в тесте Y-лабиринт у мышей С57В1/6
По оси абсцисс - рукава Y-лабиринта.
По оси ординат - время пребывания в рукавах лабиринта, %.
Экспериментальные группы:
1 - «Контроль», белый столбец
2 - «0,01 мг/кг», светло-серый столбец
3 - «0,1 мг/кг», серый столбец
4 - «1 мг/кг», темно-серый столбец
Примечания: * - р<0,05 по отношению к группе "Контроль", ANOVA, критерий Дункана. Число животных в группах n=10-12. Данные представлены в виде M±SEM. А- рукав А (стартовый), В - рукав В (открытый), С - рукав С (новый).
| название | год | авторы | номер документа |
|---|---|---|---|
| Ингибитор матриксных металлопротеиназ 2-го и 9-го типов из ряда производного бензоиламино(фенилсульфонил)-L-оксипролина, обладающий нейропротекторной и противоопухолевой активностью | 2023 |
|
RU2826902C1 |
| Ингибиторы цинк-зависимых металлопротеиназ (ММП-2 и ММП-9) в ряду бензоиламино(фенилсульфонил)-замещенных циклических аминокислот как потенциальные лекарственные средства, препятствующие постинфарктному ремоделированию левого желудочка сердца | 2016 |
|
RU2646752C2 |
| Производные оксимов дибензофуранов, обладающие противосудорожной и нейропротективной активностью | 2018 |
|
RU2744758C2 |
| N-[2,2-ДИМЕТИЛ-1S-(ПИРИДИН-2-ИЛКАРБАМОИЛ)ПРОПИЛ]-N-ГИДРОК СИ-2R-ИЗОБУТИЛ-3S-МЕТОКСИСУКЦИНАМИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ГИДРАТ ИЛИ СОЛЬВАТ | 1997 |
|
RU2198164C2 |
| Новые глипролины с ноотропной, антигипоксической, нейропротективной и анксиолитической активностью | 2016 |
|
RU2646604C2 |
| ДИНАТРИЕВАЯ СОЛЬ 3-ГИДРОКСИГИППУРОВОЙ КИСЛОТЫ, ОБЛАДАЮЩАЯ АНТИГИПОКСИЧЕСКОЙ И ЦЕРЕБРОПРОТЕКТИВНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2559875C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОГИПОКСИЧЕСКОЙ, АНТИАМНЕСТИЧЕСКОЙ И НЕЙРОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2750418C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АКТОПРОТЕКТОРНОЙ, ПРОТИВОГИПОКСИЧЕСКОЙ, НЕЙРОПРОТЕКТОРНОЙ, АНТИАМНЕСТИЧЕСКОЙ И ТЕРМОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2460529C1 |
| СЕЛЕКТИВНЫЕ АНТАГОНИСТЫ РЕЦЕПТОРА EP4 ДЛЯ ЛЕЧЕНИЯ РАКА | 2010 |
|
RU2563817C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОКАЗЫВАЮЩЕЕ ПРОТИВОСУДОРОЖНОЕ И АНТИГИПОКСИЧЕСКОЕ ДЕЙСТВИЕ | 2008 |
|
RU2393857C2 |

Изобретение относится к химии и медицине, а именно к новому биологически активному органическому производному антраниловой кислоты - 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойной кислоте. Технический результат – разработка нового соединения, обладающего антигипоксической, анальгетической и мнемотропной активностью. 1 з.п. ф-лы, 11 ил., 4 табл., 7 пр.
1. Соединение 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-о-(N-метиламино)бензойная кислота формулы 1.
2. Соединение по п. 1, обладающее антигипоксической, анальгетической и мнемотропной активностью.
| US 20140234939 A1, 21.08.2014 | |||
| Khanfar, M | |||
| A., et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| European Journal of Medicinal Chemistry, 2014, 76, 414-426 | |||
| WO 2004018414 A2, 04.03.2004 | |||
| WO 2004018461 A2, 04.03.2004 | |||
| EA 200601442 A1, 27.02.2007. | |||
Авторы
Даты
2024-06-04—Публикация
2023-06-28—Подача