Изобретение относится к области биологически активных соединений, конкретно к новой группе бензоиламино(фенилсульфонил)-замещенных циклических аминокислот общей формулы (1),

где R1, R2, R3, R4, R5, R6, R7 могут быть водородами, атомами галогенов, (C1-C4)-алкильными группами, нитрогруппами; «n» может равняться 1-3, и к их физиологически приемлемым солям общей формулы 2,
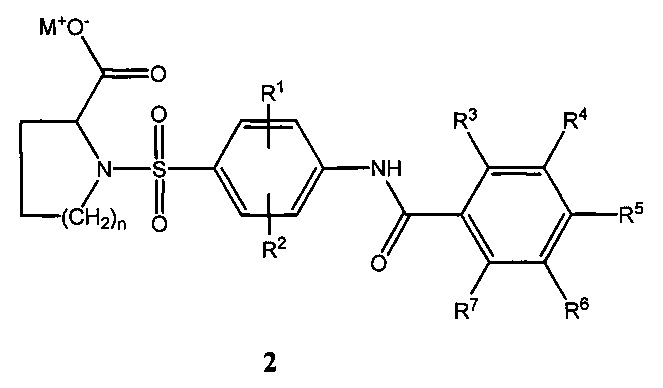
где М+ - катион щелочных металлов, a R1, R2, R3, R4, R5, R6, R7 и n имеют вышеуказанные значения.
Заявляемые соединения обладают кардиопротективной активностью и препятствуют развитию дезадаптивного ремоделирования левого желудочка сердца в острейшую фазу инфаркта миокарда.
Ремоделирование сердца - комплекс структурно-геометрических изменений, преимущественно левого желудочка сердца, возникающий под влиянием патологического процесса и трансформирующий физиологическую и анатомическую норму в патологию.
В условиях острого трансмурального инфаркта миокарда в результате гибели большого количества сократительных кардиомиоцитов инициируются процессы, приводящие к значительным изменениям размеров, геометрии и функции левого желудочка сердца. Этот патологический процесс хорошо изучен как в клинике [Tiyyagura S.R., Pinney S.P. Mt. Sinai J. Med. 2006; 73 (6): 840-851; Chang S.A. et al. Am. J. Cardiol. 2009; 104 (1): 19-23; Hori M., Nishida K. Cardiovasc. Res. 2009; 81 (3): 457-464 и др.], так и в эксперименте [Jugdutt B.J. Card. Fail. 2002; 8 (6 Suppl): S472-S475; Zhou S.X. et al. Nan Fang Yi Ke Da Xue Xue Bao. 2008; 28 (11): 2030-2034; Henderson K.K. et al. Circ. Heart Fail 2009; 2 (3): 243-252 и др.] и носит название ранее постинфарктное ремоделирование сердца. В результате многочисленных крупномасштабных клинических исследований, выполненных в последние десятилетия, прослежена прямая взаимосвязь между увеличением конечно-систолического [Haykowsky М. et al. Trials. 2011, 12: 92; Ruwald М.Н. et al. Circulation. 2014] и конечно-диастолического [Thune J.J. Solomon S.D. Curr. Heart Fal. Rep. 2006; 3 (4): 170-174; von Bibra H., St. John Sutton M. Curr. Heart Fail. Rep. 2011; 8 (4): 242-251] объемов левого желудочка сердца, снижением его сократительной способности [Болдуева С.А. с соавт. Сердечная недостаточность. 2008; 9 (3): 111-11, Kuch М. et al. Med. Sci. Monit. 2009; 15 (6): PH40-PH48] и риском развития тяжелой сердечной недостаточности [Struthers A.D. Heart. 2005. Suppl. 2: ii14-16; Mill J.G. et al. Braz. J. Med. Biol. Res. 2011; 44 (9): 890-898] или внезапной сердечной смерти [Solomon S.D. et al. N. Engl. J. Med. 2005; 352 (25): 2581-2588, Santangeli P. et al. Internal Med. J. 2011; 41: 55-60].
Патогенез раннего постинфарктного ремоделирования миокарда к настоящему времени достаточно хорошо изучен. Полагают, что ключевую роль в этом процессе играют матриксные металлопротеиназы (ММП) - энзимы, вовлекающие межклеточный матрикс миокарда в процесс структурно-функционального ремоделирования, как правило, посредством деградации цепей коллагена [Gallagher G.L. et al. Front. Biosci. 2007; 12: 1410-1419, Spinale F.G. Physiol. Rev. 2007; 87: 1285-1342 и др.]. В этом плане наибольший интерес представляют цинк-зависимые матриксные металлопротеиназы 2-го и 9-го типов (желатиназы) - ММП-2 и ММП-9, поскольку известно, что, с одной стороны, они имеют тропность к коллагену I и III типа, составляющего основу межклеточного матрикса миокарда, а с другой стороны, что находящийся в очаге ишемии коллаген подвергается конформационным изменениям, в результате чего его трехмерная спираль начинает «раскручиваться», и он переходит в одномерную фрагментированную цепочку, представляющую собой желатин, который и является акцептором действия ММП-2 и ММП-9. [Гасанов А.Г., Бершова Т.В. Биомед химия. 2009; 55 (2): 155-168, Shamhart Р.Е., Meszaros J.G. J. Mol. Cell. Cardiol. 2010; 48 (3): 530-537]. Помимо этого, показано, что ММП-2 помимо внеклеточной имеет и внутриклеточную локализацию, в том числе на мембранах саркоплазмотического ретикулума и митохондрий, а также в ядре клетки [Kandasamy A.D. et al. Cardiovasc. Res. 2010; 85 (3): 413-423, Hughes B.G. et al. Am. J. Physiol. Heart Circ. Physiol. 2014; 306 (5): H764-H770], где она, по-видимому, играет важную роль в развитии раннего этапа сократительной дисфункции поврежденных кардиомиоцитов [Ali М.А. et al. Trends Cardiovasc. Med. 2011; 21 (4): 112-118].
В последние годы проводятся достаточно интенсивные исследования по поиску и внедрению в широкую клиническую практику лекарственных средств, селективно блокирующих гиперактивность ММП-2 и ММП-9 в ишемизированном миокарде [Lindsey M.L. et al. Global J. Hum. Anat. Physiol. Res. 2014; 1: 6-9], однако эта проблема все еще далека от своего окончательного разрешения.
Одним из возможных подходов к решению этой проблемы является поиск кардиопротективных, средств, потенциально обладающих способностью блокировать активность ММП-2 и ММП-9 в ряду новых представителей бензоиламино(фенилсульфонил)-замещенных циклических аминокислот общей формулы 1, поскольку эти соединения отвечают всем основным требованиям фармакофорной модели строения ингибиторов ММП-2 и ММП-9.
В качестве эталонного препарата использован антибиотик доксициклин, поскольку известно, что тетрациклины, в частности доксициклин, помимо собственно антибактериальной активности обладают рядом плейотропных эффектов, в том числе и способностью блокировать гиперпродукцию ММП-2 и ММП-9 как в ишемизированном, так и интактном миокарде и тем самым препятствовать потере экстрацеллюлярного матрикса, приводящей к раннему постинфарктному ремоделированию миокарда [Zhou S.X. et al. Nan Fang Yi Ke Da Xue Xue Bao. 2008; 28 (11): 2030-2034; Henderson K.K. et al. Circ. Heart Fail. 2009; 2 (3): 243-252 и др.].
Наиболее близкими прототипами по химическому строению являются: 2-[({4-[(4-хлоробензоил)амино]фенил}сульфонил)амино]уксусная кислота [K. Sakaki, et al. US Patent 6177466 (2001)] и (3aS,6aS)-1-({4-[(2,4-дихлоробензоил)амино]фенил}сульфонил)октагидроциклопента[b]-пиррол-2-карбоновая кислота [M. Schudok, et al. US Patent 2005/0004166 (2005)].
Приведенные прототипы являются ингибиторами матриксных металлопротеиназ, однако для них не была показана способность препятствовать развитию постинфарктного ремоделирования левого желудочка сердца. Они отличаются от заявляемых веществ общей структуры 1 строением аминоксилотного фрагмента молекул.
Технический результат
В основу настоящего изобретения положена задача получения новых ингибиторов ММП-2 и ММП-9 с высокой кардиопротекторной активность с целью нахождения препарата для предотвращения развития дезадаптивного ремоделирования левого желудочка сердца в острую фазу инфаркта миокарда.
Предлагаемое техническое решение - бензоиламино(фенилсульфонил)-замещенные циклические аминокислоты общей формулы (1) и их физиологически приемлемые соли присоединения оснований общей формулы (2).
Соединения общей формулы 1 в специальной и патентной литературе не описаны. В качестве примеров соединений формулы 1 настоящего изобретения следует назвать:
1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролин,
1-({4-[(2-хлорбензоил)амино]фенил}сульфонил-L-пролин,
1-({4-[(4-фторбензоил)амино]фенил}сульфонил-L-пролин,
1-({4-[(2,4-дихлорбензоил)амино]фенил}сульфонил-L-пролин,
1-({4-[(4-нитробензоил)амино]фенил}сульфонил-L-пролин,
1-({4-[(3-нитробензоил)амино]фенил}сульфонил-L-пролин,
1-({4-[(4-хлорбензоил)амино]фенил}сульфонил)-2-пиперидинкарбоновая кислота,
1-({4-[(2-хлорбензоил)амино]фенил}сульфонил)-2-пиперидинкарбоновая кислота,
1-({4-[(4-хлорбензоил)амино]-3,5-диметилфенил}сульфонил)-L-пролин,
1-({4-[(4-нитробензоил)амино]фенил}сульфонил-2-пиперединкарбоновая кислота.
Получение заявляемых соединений.
В соответствии с настоящим изобретением соединения общей формулы 1 можно получить по следующей общей схеме:

Анилины общей формулы 3 вводят во взаимодействие в хлорангидридами бензойных кислот общей формулы 4 в инертных растворителях, таких как, например, дихлорметан, бензол или ацетон, в присутствии акцепторов кислот, таких как, например, карбонаты щелочных металлов или третичные амины.
Соединения общей формулы 5 вводят далее во взаимодействие с хлорсульфоновой кислотой в избытке кислоты или в инертных растворителях, таких как, например, бензол или толуол, при температуре от комнатной до 60°C. В результате реакции образуются арилсульфонилхлориды общей формулы 6.
Реакцией соединений 6 с циклическими аминокислотами общей формулы 7 в полярных растворителях, таких как вода, тетрагидрофуран, диоксан, диметилсульфоксид, диметилформамид, в присутствии акцепторов кислот, таких как, например, гидроксиды щелочных металлов, карбонаты щелочных металлов, аммиак или третичные амины, при температурах от комнатной до 100°C. В результате реакции образуются продукты общей формулы 1. Для получения физиологически приемлемых солей присоединения оснований 2 кислоты 1 вводят во взаимодействие с гидроксидами щелочных металлов, предпочтительно с гидроксидом натрия.
Соединения 1 представляют собой белые твердые кристаллические вещества нерастворимые в воде, растворимые в некоторых органических растворителях, таких как ацетон, дихлорметан. Соли 2 представляют собой белые кристаллические вещества, растворимые в воде и нерастворимые в эфирах, например, диэтиловом эфире, и ароматических растворителях, например, бензоле, толуоле.
Строение веществ общей формулы 1 подтверждены данными спектров ЯМР 1Н, а их чистота - данными элементного анализа.
Пример 1.
1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролин (1a).

1.1. N-(4-хлорофенил)бензамид (5а).
К раствору 200 ммоль (18.63 г) анилина и 240 ммоль (24.29 г) триэтиламина в 300 мл этилацетата при перемешивании прикапывают раствор 210 ммоль (36.75 г) п-хлорбензоилхлорида в 150 мл этилацетата в течение 40 минут при комнатной температуре. Реакционную массу перемешивают в течение 8 часов, белый осадок отфильтровывают, фильтрат упаривают досуха, остаток промывают 150 мл смеси гесан-этилацетат (5:1) и тремя порциями воды по 100 мл и сушат при температуре 80°C в течение 3 часов, получая 44.3 г N-(4-хлорофенил)бензамида в виде белого порошка (выход 96%). Т.пл. 194-196°C.
1.2. 4-[(4-хлорбензоил)амино]бензолсульфонилхлорид (6а).
К 500 ммоль (58.26 г) хлорсульфоновой кислоты присыпают при перемешивании 100 ммоль (23.17 г) N-(4-хлорофенил)бензамида (5а) и перемешивал смесь при температуре 45°C в течение 4 часов, после чего ее при перемешивании выливают в 300 г льда. Выпавший осадок отфильтровывают, промывают водой до нейтрального значения среды и сушат при температуре 80°C в течение 3 часов, получая 24.75 г 4-[(4-хлорбензоил)амино]бензолсульфонилхлорида в виде белого порошка (выход 75%). Т.пл. 163-165°C. ЯМР 1H (DMSO, δ, м.д.): 7.58 (д, 2 Н, Н(3), Н(5), 3J=8.5 Гц); 7.60 (д, 2 Н, H(3`), H(5`), 3J=8.4 Гц); 7.73 (д, 2 Н, Н(2), Н(6), 3J=8.5 Гц); 7.99 (д, 2 Н, H(2`), Н(6`), 3J=8.4 Гц); 10.43 (с, 1 Н, NH).
1.3. 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролин (1а).
К раствору 12 ммоль (1.4 г) L-пролина и 24 ммоль (1.2 г) гидроксида натрия в 50 мл воды присыпают 12 ммоль (4.0 г) 4-[(4-хлорбензоил)амино]бензолсульфонилхлорида (6а) и реакционную смесь перемешивают при температуре 75°C в течение 45 минут, после чего - в течение суток при комнатной температуре. Затем к раствору прикапывают 0.1 М HCl до значения pH 1, выпавший осадок отфильтровывают, промывают водой до нейтрального значения среды и сушат при 80°C в течение трех часов, получая 3.6 г 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролина в виде белого порошка (выход 70%). Т.пл. 215-217°C. Найдено (%): С, 52.69; Н, 4.28; N, 6.85; S, 7.64; Сl, 8.69. C18H17N2O5SCl. Вычислено (%): С, 52.88; Н, 4.19; N, 6.85; S, 7.84; Сl, 8.67. ЯМР 1H (DMSO, δ, м.д.): 1.56, 1.85 (два м, 4 Н, H2C(3)Prl, H2C(4)Prl); 3.16, 3.36 (два м, 2 Н, H2C(5)Prl); 4.10 (дд, 1 Н, НС(2)Prl, 3J=7.8 Гц; 3J=4.4 Гц); 7.64 (д, 2 Н, Н(3`), Н(5`), 3J=8.8 Гц); 7.83 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 8.00 (д, 2 Н, H(2`), Н(6`), 3J=8.8 Гц); 8.02 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 10.69 (с, 1 Н, NH).
1.4. Натриевая соль 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролина (2а).
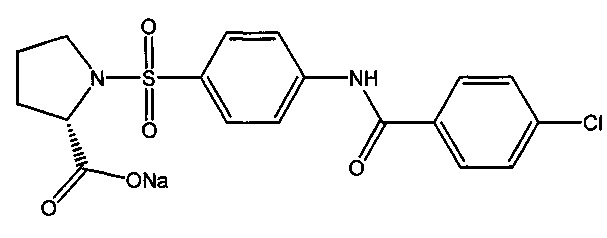
К суспензии 2.44 ммоль (1.0 г) 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролина (1а) в 20 мл дистиллированной воды прикапывают раствор 2.44 ммоль (98 мг) гидроксида натрия в 5 мл дистиллированной воды. Полученный раствор упаривают досуха, получая 1.05 г натриевой соли 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролина в виде белого порошка (выход 98%). Т.пл. 196-201°C. Найдено (%): С, 50.30; Н, 3.58; N, 6.42; S, 7.51; Cl, 8.42. C18H16N2O5SClNa. Вычислено (%): С, 50.18; Н, 3.74; N, 6.50; S, 7.44; Cl, 8.23. ЯМР 1Н (DMSO, δ, м.д.): 1.47, 1.74 (два м, 4 Н, H2C(3)Prl, H2C(4)Prl); 3.19, 3.30 (два м, 2 Н, H2C(5)Prl); 3.89 (дд, 1 Н, НС(2)Prl, 3J=7,8 Гц; 3J=4.4 Гц); 7.61 (д, 2 Н, H(3`), Н(5`), 3J=8.8 Гц); 7.81 (д, 2 Н, Н(3), H(5), 3J=8.8 Гц); 8.00 (д, 2 Н, H(2`), Н(6`), 3J=8.8 Гц); 8.04 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 10.95 (с, 1 Н, NH).
Пример 2.
1-({4-[(2-хлорбензоил)амино]фенил}сульфонил-L-пролин (1б).

2.1. N-(2-хлорофенил)бензамид (5б)
Получали в соответствии с пунктом 1.1. Примера 1 из анилина и о-хлорбензоилхлорида. Выход 94%. Белый порошок, т.пл. 116-118°C.
2.2. 4-[(2-хлорбензоил)амино]бензолсульфонилхлорид (6б).
Получали в соответствии с пунктом 1.2. Примера 1 из хлорсульфоновой кислоты и N-(2-хлорофенил)бензамида (5б). Выход 77%. Белый порошок, т.пл. 121-123°C. ЯМР 1Н (DMSO, δ, м.д.): 7.42-7.61 (м и д, 6 Н, Н(3), Н(5), H(3`), Н(4`); H(5`), H(6`), 3J=8.8 Гц); 7.66 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 10.57 (с, 1H, NH).
2.3. 1-({4-[(2-хлорбензоил)амино]фенил}сульфонил-L-пролин (1б).
Получали в соответствии с пунктом 1.3. Примера 1 из L-пролина и 4-[(2-хлорбензоил)амино]бензолсульфонилхлорида (6б). Выход 72%. Белый порошок, т.пл. 215-217°C. Найдено (%): С, 52.82; Н, 4.44; N, 6.95; S, 7.80; Cl, 8.67. C18H17N2O5SCl. Вычислено (%): С, 52.88; Н, 4.19; N, 6.85; S, 7.84; Cl, 8.67. ЯМР 1Н (DMSO, δ, м.д.): 1.60, 1.85 (два м, 4 Н, H2C(4)Prl, H2C(3)Prl); 3.18, 3.38 (два м, 2 Н, H2C(5)Prl); 4.10 (дд, 1 Н, HC(2)Prl, 3J=8.1 Гц; 3J=4.4 Гц); 7.43-7.66 (м, 4 Н, Н(3`), Н(4`), Н(5`), Н(6`)); 7.83 (д, 2 Н, Н(3), H(5), 3J=8.8 Гц); 7.95 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 10.96 (с, 1 Н, NH).
Пример 3.
1-({4-[(4-фторбензоил)амино]фенил}сульфонил-L-пролин (1в).
3.1. N-(4-фторофенил)бензамид (5в)
Получали в соответствии с пунктом 1.1. Примера 1 из анилина и п-фторбензоилхлорида. Выход 87%. Белый порошок, т.пл. 183-184°C.
3.2. 4-[(4-фторбензоил)амино]бензолсульфонилхлорид (6в).
Получали в соответствии с пунктом 1.2. Примера 1 из хлорсульфоновой кислоты и N-(4-фторофенил)бензамида (5в). Выход 75%. Белый порошок, т.пл. 210-211°C. ЯМР 1Н (DMSO, δ, м.д.): 7.36 (т, 2 Н, Н(3`), Н(5`), 3J1=3J2=8.8 Гц); 7.59 (д, 2 Н, Н(3), Н(5), 3J=8.3 Гц); 7.75 (д, 2 Н, Н(2), Н(6), 3J=8.3 Гц); 8.06 (м, 2 Н, H(2`), Н(6`)); 10.38 (с, 1 Н, NH).
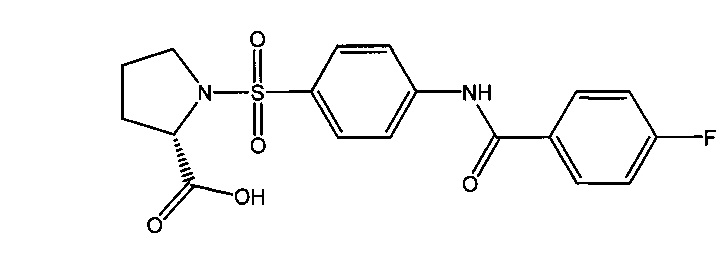
3.3. 1-({4-[(4-фторбензоил)амино]фенил}сульфонил-L-пролин (1в).
Получали в соответствии с пунктом 1.3. Примера 1 из L-пролина и 4-[(4-фторбензоил)амино]бензолсульфонилхлорида (6в). Выход 69%. Белый порошок, т.пл. 96-97°C. Найдено (%): С, 55.01; Н, 4.19; N, 7.37; S, 8.17. C18H17N2O5SF. Вычислено (%): С, 55.10; Н, 4.37; N, 7.14; S, 8.17. ЯМР 1Н (DMSO, δ, м.д.): 1.56, 1.86 (два м, 4 Н, H2C(4)Prl, H2C(3)Prl); 3.17, 3.36 (два м, 2 Н, H2C(5)Prl); 4.10 (дд, 1 Н, HC(2)Prl, 3J=8.1 Гц; 3J=4.4 Гц); 7.38 (д.д, 2 Н, Н(3`), Н(5`), 3J1=3J2=8.8 Гц); 7.83 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 8.02 (д, 2 Н, H(2`)), Н(6`), 3J=8.8 Гц); 8.05 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 10.64 (с, 1 Н, NH).
3.4. Натриевая соль 1-({4-[(4-фторбензоил)амино]фенил}сульфонил-L-пролина (2в).
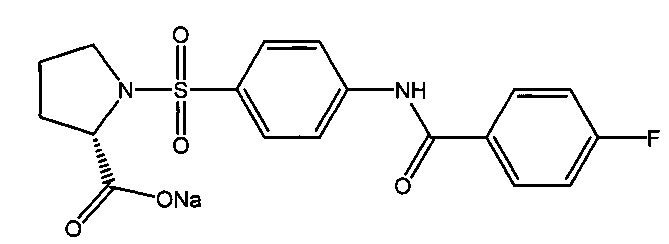
Получали в соответствии с пунктом 1.4. Примера 1 из 1-({4-[(4-фторбензоил)амино]фенил}сульфонил-L-пролина (1в). Выход 97%. Белый порошок, т.пл. 189-194°C. Найдено (%): С, 52.24; Н, 3.77; N, 6.79; S, 7.76. C18H16N2O5SFNa. Вычислено (%): С, 52.17; Н, 3.89; N, 6.76; S, 7.74. ЯМР 1H (DMSO, δ, м.д.): 1.47, 1.76 (два м, 4 Н, H2C(4)Prl, H2C(3)Prl; 3.17, 3.27 (два м, 2 Н, H2C(5)Prl); 3.92 (дд, 1 Н, HC(2)Prl, 3J=8.1 Гц; 3J=4.4 Гц); 7.36 (д.д, 2 Н, Н(3`), Н(5`), 3J1=3J2=8.8 Гц); 7.81 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 8.02 (д, 2 Н, H(2`), H(6`), 3J=8.8 Гц); 8.12 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 11.02 (с, 1 Н, NH).
Пример 4.
1-({4-[(2,4-дихлорбензоил)амино]фенил}сульфонил-L-пролин (1 г).
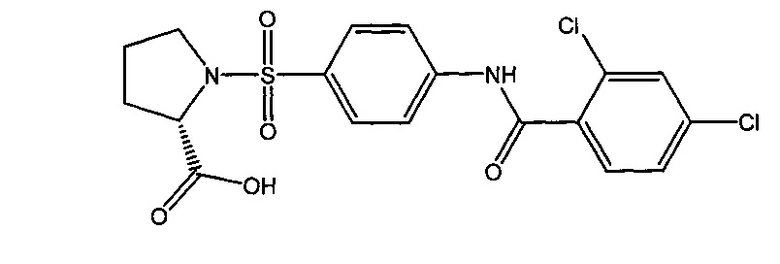
4.1. N-(2,4-дихлорфенил)бензамид (5г).
Получали в соответствии с пунктом 1.1. Примера 1 из анилина и 2,4-дихлорбензоилхлорида. Выход 85%. Белый порошок, т.пл. 148-149°C.
4.2. 4-[(2,4-дихлорбензоил)амино]бензолсульфонилхлорид (6г).
Получали в соответствии с пунктом 1.2. Примера 1 из хлорсульфоновой кислоты и N-(2,4-дихлорфенил)бензамида (5 г). Выход 69%. Белый порошок, т.пл. 121-122°C. ЯМР 1H (DMSO, δ, м.д.): 7.51-7.75 (м, 7 Н, Н(2), Н(3), Н(5), Н(6), H(3`), H(5`), Н(6`)); 10.66 (с, 1 Н, NH).
4.3. 1-({4-[(2,4-дихлорбензоил)амино]фенил}сульфонил-L-пролин (1г).
Получали в соответствии с пунктом 1.3. Примера 1 из L-пролина и 4-[(2,4-дихлорбензоил)амино]бензолсульфонилхлорида (6г). Выход 81%. Белый порошок, т.пл. 93-98°C. Найдено (%): С, 48.55; Н, 3.70; N, 6.31; S, 7.45; Cl, 15.95. C18H16N2O5SCl2. Вычислено (%): С, 48.77; Н, 3.64; N, 6.32; S, 7.23; Cl, 15.99. ЯМР 1Н (DMSO, δ, м.д.): 1.59, 1.86 (два м, 4 Н, H2C(4)Prl, H2C(3)Prl); 3.16, 3.36 (два м, 2 Н, H2C(5)Prl); 4.10 (дд, 1 Н, НС(2)Prl, 3J=8.0 Гц; 3J=4.4 Гц); 7.58 (д, 1 Н, Н(5`), 3J=8.1 Гц); 7.68 (д, 1 Н, H(6`), 3J=8.1 Гц); 7.80 (с, 1 Н, H(3`)); 7.83 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 7.93 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 10.98 (с, 1 Н, NH).
4.4. Натриевая соль 1-({4-[(2,4-дихлорбензоил)амино]фенил}сульфонил-L-пролина (2 г).
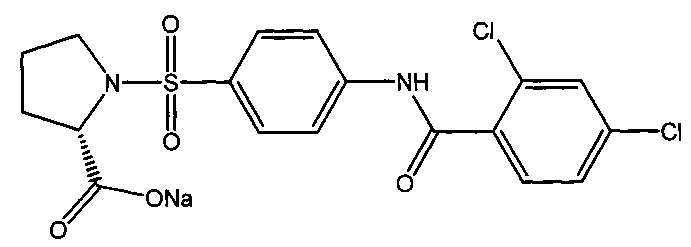
Получали в соответствии с пунктом 1.4. Примера 1 из 1-({4-[(2,4-дихлорбензоил)амино]фенил}сульфонил-L-пролина (2 г). Выход 87%. Белый порошок, т.пл. 288-290°C. Найдено (%): С, 46.70; Н, 3.19; N, 5.82; S, 6.88; Cl, 15.51. C18H15N2O5SCl2Na. Вычислено (%): С, 46.47; Н, 3.25; N, 6.02; S, 6.89; Cl, 15.24. ЯМР 1H (DMSO, δ, м.д.): 1.50, 1.76 (два м, 4 Н, H2C(4)Prl) H2C(3)Prl); 3.18, 3.29 (два м, 2 Н, H2C(5)Prl); 3.91 (дд, 1 Н, HC(2)Prl, 3J=8.1 Гц; 3J=5.7 Гц); 7.57 (д, 1 Н, Н(5`), 3J=8.8 Гц); 7.66 (д, 1 Н, Н(6`), 3J=8.3 Гц); 7.76 (д, 1 Н, Н(3`), 3J=1.96 Гц); 7.84 (д, 2 Н, Н(3), Н(5), 3J=8.9 Гц); 7.90 (д, 2 Н, Н(2), Н(6), 3J=8.7 Гц); 10.71 (с, 1 Н, NH).
Пример 5.
1-({4-[(4-нитробензоил)амино]фенил}сульфонил-L-пролин (1д).

5.1. N-(4-нитрофенил)бензамид (5д).
Получали в соответствии с пунктом 1.1. Примера 1 из анилина и п-нитробензоилхлорида. Выход 95%. Белый порошок, т.пл. 199-200°C.
5.2. 4-[(4-нитробензоил)амино]бензолсульфонилхлорид (6д).
Получали в соответствии с пунктом 1.2. Примера 1 из хлорсульфоновой кислоты и №(4-нитрофенил)бензамида (5д). Выход 72%. Белый порошок, т.пл. 220-221°C. ЯМР 1Н (DMSO, δ, м.д.): 7.61 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 7.76 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 8.21 (д, 2 Н, Н(2`), H(2`), 3J=8.8 Гц); 8.36 (д, 2 Н, Н(3`), H(5`), 3J=8.8 Гц); 10.69 (с, 1 Н, NH).
5.3. 1-({4-[(4-нитробензоил)амино]фенил}сульфонил-L-пролин (1д).
Получали в соответствии с пунктом 1.3. Примера 1 из L-пролина и 4-[(4-нитробензоил)амино]бензолсульфонилхлорида (6д). Выход 75%. Белый порошок, т.пл. 235-240°C. Найдено (%): С, 51.43; Н, 4.32; N, 10.35; S, 7.65. C18H17N3O7S. Вычислено (%): С, 51.55; Н, 4.09; N, 10.02; S, 7.64. ЯМР 1Н (DMSO, δ, м.д.): 1.56, 1.84 (два м, 4 Н, H2C(4)Prl, H2C(3)Prl); 3.18, 3.37 (два м, 2 Н, H2C(5)Prl); 4.11 (дд, 1 Н, НС(2)Prl, 3J=8.1 Гц; 3J=4.4 Гц); 7.87 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 8.03 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 8.20 (д, 2 Н, H(2`), Н(6`), 3J=8.8 Гц); 8.39 (д, 2 Н, Н(3`), Н(5`), 3J=8.8 Гц); 10.96 (с, 1 Н, NH).
5.4. Натриевая соль 1-({4-[(4-нитробензоил)амино]фенил}сульфонил)-L-пролина (2д).

Получали в соответствии с пунктом 1.4. Примера 1 из 1-({4-[(4-нитробензоил)амино]фенил}сульфонил)-L-пролина (1д). Выход 92%. Белый порошок, т.пл. 287-288°C. Найдено (%): С, 49.79; Н, 3.72; N, 9.30; S, 7.30. C18H16N3O7SNa. Вычислено (%): С, 49.98; Н, 3.65; N, 9.52; S, 7.26. ЯМР 1H (DMSO, δ, м.д.): 1.57, 1.85 (два м, 4 Н, H2C(4)Prl, H2C(3)Prl); 3.19, 3.36 (два м, 2 Н, H2C(5)Prl); 4.13 (дд, 1 Н, HC(2)Prl, 3J=7.63 Гц; 3J=4.4 Гц); 7.85 (д, 2 Н, Н(3), H(5), 3J1=3J2=8.7 Гц); 8.07 (д, 2 Н, Н(2), Н(6), 3J=8.7 Гц); 8.25 (д, 2 Н, Н(2`), Н(6`), 3J=8.7 Гц); 8.35 (д, 2 Н, H(3`), Н(5`), 3J=8.8 Гц); 11.12 (с, 1 Н, NH).
Пример 6.
1-({4-[(3-нитробензоил)амино]фенил}сульфонил-L-пролин (1е).

6.1. N-(3-нитрофенил)бензамид (5е).
Получали в соответствии с пунктом 1.1. Примера 1 из анилина и м-нитробензоилхлорида. Выход 96%. Белый порошок, т.пл. 149-150°C.
6.2. 4-[(3-нитробензоил)амино]бензолсульфонилхлорид (6е).
Получали в соответствии с пунктом 1.2. Примера 1 из хлорсульфоновой кислоты и N-(3-нитрофенил)бензамида (5е). Выход 70%. Белый порошок, т.пл. 205-206°C. ЯМР 1Н (DMSO, δ, м.д.): 7.61 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 7.76 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 7.87 (м, 1 Н, Н(5`)); 8.43 и 8.48 (оба д, по 1 Н, Н(4`), H(6`), 3J=8.0 и 3J=8.1 Гц); 8.81 (с, 1 Н, Н(2`)); 10.72 (с, 1 Н, NH).
6.3. 1-({4-[(3-нитробензоил)амино]фенил}сульфонил-L-пролин (1е).
Получали в соответствии с пунктом 1.3. Примера 1 из L-пролина и 4-[(3-нитробензоил)амино]бензолсульфонилхлорида (6е). Выход 77%. Белый порошок, т.пл. 210-211°C. Найдено (%): С, 51.60; Н, 4.34; N, 10.05; S, 7.39. C18H17N3O7S. Вычислено (%): С, 51.55; Н, 4.09; N, 10.02; S, 7.64. ЯМР 1H (DMSO, δ, м.д.): 1.57, 1.87 (два м, 4 Н, H2C(4)Prl, H2C(3)Prl); 3.19, 3.36 (два м, 2 H, H2C(5)Prl); 4.11 (дд, 1 Н, HC(2)Prl, 3J=8.1 Гц; 3J=4.4 Гц); 7.86 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 7.88 (м, 1 Н, Н(5`)); 8.05 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 8.42 и 8.46 (оба д, по 1 Н, Н(4`), H(6`), 3J=8.0 и 3J=8.2 Гц); 8.80 (с, 1 Н, H(2`)); 10.94 (с, 1 Н, NH).
Пример 7.
1-({4-[(4-хлорбензоил)амино]фенил}сульфонил)-2-пиперидинкарбоновая кислота (1ж).
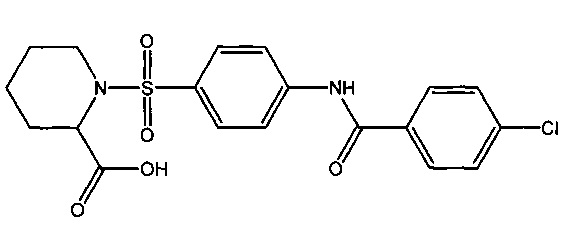
7.1. 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил)-2-пиперидинкарбоновая кислота (1ж).
К раствору 15 ммоль (1.94 г) D,L-пипеколиновой кислоты и 50 ммоль (5.06 г) триэтиламина в 20 мл воды и 20 мл тетрагидрофурана прибавляют 12 ммоль (4.0 г) 4-[(4-хлорбензоил)амино]бензолсульфонилхлорида (6а) и реакционную смесь перемешивают в течение суток. К раствору прибавляют 35 мл дихлорметана и прикапывают 0.1 М HCl до значения pH 1 для водного слоя. Смесь перемешивают, органический слой отделяют, промывают, профильтровывают через бумажный фильтр и упаривают досуха. Остаток перекристаллизовывают из смеси дихлорметан-гексан (1:1) и сушат при 80°C в течение 3 часов, получая 3.15 г 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил)-2-пиперидинкарбоновую кислоту в виде белого порошка (выход 62%). Т.пл. 102-107°C. Найдено (%): С, 53.88; Н, 4.75; N, 6.34; S, 7.70; Cl, 8.48. C19H19N2O5SCl. Вычислено (%): С, 53.97; Н, 4.53; N, 6.62; S, 7.58; Cl, 8.38. ЯМР 1H (DMSO, δ, м.д.): 1.02-2.08 (м, 6 H, H2C(3)Ppr, H2C(4)Ppr и H2C(5)Ppr); 3.19,3.65 (оба м, по 1 Н, H2C(6)Ppr); 4.56 (м, 1 Н, НС(2)Ppr); 7.63 (д, 2 Н, 3`), H(5`), 3J=8.8 Гц); 7.78 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 7.98 (д, 2 Н, H (2`), Н(6`), 3J=8.8 Гц); 8.01 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 10.66 (с, 1 Н, NH).
7.2. Натриевая соль 1-({4-[(4-хлоробензоил)амино]фенил}сульфонил)-2-пиперидинкарбоновой кислоты (2ж).
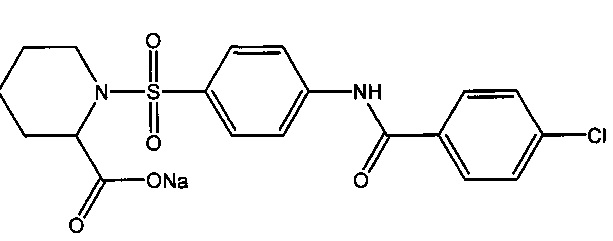
Получали в соответствии с пунктом 1.4. Примера 1 из 1-({4-[(4-хлоробензоил)амино]фенил}сульфонил)-2-пиперидинкарбоновой кислоты (1ж). Выход 95%. Белый порошок, т.пл. 214-215°C. Найдено (%): С, 51.11; Н, 3.89; N, 6.32; S, 7.22. C19H18N2O5SClNa. Вычислено (%): С, 51.30; Н, 4.08; N, 6.30; S, 7.21. ЯМР 1Н (DMSO, δ, м.д.): 1.01-2.11 (м, 6 Н, H2C(3)Ppr, H2C(4)Ppr и H2C(5)Ppr); 2,73, 3.48 (оба м, по 1 Н, H2C(6)Ppr); 4.26 (с, 1 Н, НС(2)Ppr); 7.60 (д, 2 Н, Н(3`), H(5`), 3J=8.5 Гц); 7.79 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 7.96 (д, 2 Н, H(2`), H(6`), 3J=8.7 Гц); 8.03 (д, 2 Н, Н(2), Н(6), 3J=8.5 Гц); 10.98 (с, 1 Н, NH).
Пример 8.
1-({4-[(2-хлорбензоил)амино]фенил}сульфонил)-2-пиперидинкарбоновая кислота (1з).

Получали в соответствии с Примером 7 из D,L-пипеколиновой кислоты и 4-[(2-хлорбензоил)амино]бензолсульфонилхлорида (6б). Выход 67%. Белый порошок, т.пл. 210-212°C. Найдено (%): С, 54.09; Н, 4.50; N, 6.79; S, 7.35; Cl, 8.30. C19H19N2O5SCl. Вычислено (%): С, 53.97; Н, 4.53; N, 6.62; S, 7.58; Cl, 8.38. ЯМР 1Н ((CD3)2CO, δ, м.д.): 1.23-1.78 (м, 6 Н, H2C(3)Ppr, H2C(4)Ppr и H2C(5)Ppr); 3.30, 3.76 (оба м, по 1 Н, H2C(6)Ppr); 4.69 (м, 1 Н, НС(2)Ppr); 7.43-7.67 (м, 4 Н, Н(3`), Н(4`), Н(5`), Н(6`); 7.83 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 8.01 (д, 2 Н, Н(2), H(6), 3J=8.8 Гц); 10.16 (с, 1 H, NH).
Пример 9.
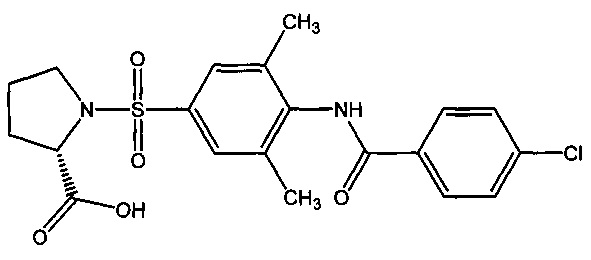
1-({4-[(4-хлорбензоил)амино]-3,5-диметилфенил}сульфонил)-L-пролин (1и).
9.1. N-(4-хлорофенил)-3,5-диметилбензамид (5и)
Получали в соответствии с пунктом 1.1. Примера 1 из 2,6-диметиланилина и п-хлорбензоилхлорида. Выход 87%. Белый порошок, т.пл. 175-176°C.
9.2. 4-[(4-хлорбензоил)-3,5-диметиламино]бензенсульфонилхлорид (6и).
Получали в соответствии с пунктом 1.2. Примера 1 из хлорсульфоновой кислоты и N-(4-хлорофенил)-3,5-диметилбензамида (5и). Выход 74%. Белый порошок, т.пл. 155-156°C. ЯМР 1Н (DMSO, δ, м.д.): 2.15 (с, 6 Н, СН3(3), СН3(5)); 7.07 (д, 2 Н, Н(3`), Н(5`), 3J=7.8 Гц); 7.59 (д, 2 Н, Н(2), Н(6), 3J=7.3 Гц); 8.03 (д, 2 Н, (2`), H(6`), 3J=8.2 Гц); 9.9 (с, 1 Н, NH).
9.3. 1-({4-[(4-хлорбензоил)амино]-3,5-диметилфенил}сульфонил)-L-пролин (1и).
Получали в соответствии с пунктом 1.3. Примера 1 из L-пролина и 4-[(4-хлорбензоил)-3,5-диметиламино]бензенсульфонилхлорида (6и). Выход 63%. Белый порошок, т.пл. 124-125°C. Найдено (%): С, 54.79; Н, 4.90; N, 6.54; S, 7.08. C20H21N2O5SCl. Вычислено (%): С, 54.98; Н, 4.84; N, 6.41; S, 7.34. ЯМР 1Н (DMSO, δ, м.д.): 1.93, 2.15 (два м, 4 Н, H2C(3)Prl, H2C(4)Prl); 2.25, 2.44 (два с, 6 Н, СН3(3), СН3(5)); 3.26, 3.33 (два м, 2 Н, H2C(5)Prl); 4.28 (дд, 1 Н, НС(2)Prl, 3J=8.9 Гц; 3J=2.5 Гц); 7.37 (д, 1 Н, Н(2), 3J=8.3 Гц); 7.62 (м, 2 Н, H(3`), H(5`)); 7.76 (д, 1 Н, Н(6), 3J=8.2 Гц); 8.03 (м, 2 Н, H(2`), Н(6`)); 10.07 (с, 1 Н, NH).
9.4. Натриевая соль 1-({4-[(4-фторбензоил)амино]фенил}сульфонил-L-пролина (2и).
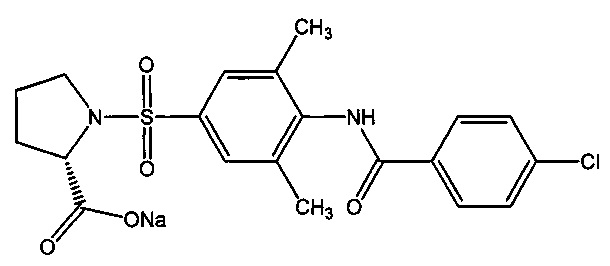
Получали в соответствии с пунктом 1.4. Примера 1 из 1-({4-[(4-хлорбензоил)амино]-3,5-диметилфенил}сульфонил)-L-пролина (1и). Выход 70%. Белый порошок, т.пл. 212-214°C. Найдено (%): С, 52.47; Н, 4,34; N, 6.33; S, 7.02. C20H20N2O5SClNa. Вычислено (%): С, 52.35; Н, 4,39; N, 6.10; S, 6.99. ЯМР 1H (DMSO, δ, м.д.): 1.90, 1.71 (два м, 4 Н, H2C(3)Prl, H2C(4)Prl); 2.23, 2.44 (два с, 6 Н, СН3(3), СН3(5)); 3.21, 3.29 (два м, 2 Н, H2C(5)Prl); 4.05 (т, 1 Н, НС(2)Prl, 3J=6.05 Гц); 7.29 (д, 1 Н, Н(2), 3J=8.3 Гц); 7.62 (м, 2 Н, H(3`), H(5`)); 7.95 (д, 1 Н, Н(6), 3J=8.0 Гц); 8.07 (д, 2 Н, H(2`), Н(6`), 3J=8.6 Гц); 10.28 (с, 1 Н, NH).
Пример 10.
1-({4-[(4-нитробензоил)амино]фенил}сульфонил-2-пиперединкарбоновая кислота (1к).
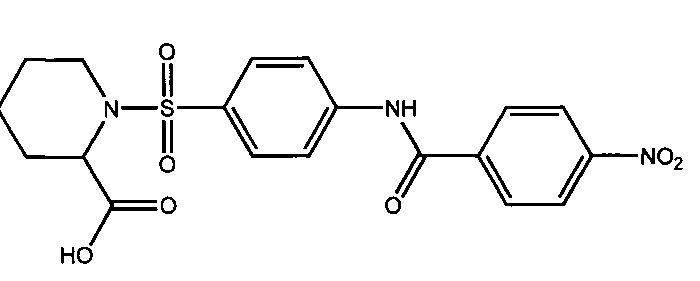
Получали в соответствии с Примером 7 из D,L-пипеколиновой кислоты и 4-[(4-нитробензоил)амино]бензолсульфонилхлорид (6д). Выход 52%. Белый порошок, т.пл. 195-196°C. Найдено (%): С, 52.98; Н, 4.24; N, 9.53; S, 7.30. C19H19N3O7S. Вычислено (%): С, 52.65; Н, 4.42; N, 9,69; S, 7.40. ЯМР 1Н ((CD3)2CO, δ, м.д.): 1.03-2.02 (м, 6 Н, H2C(3)Ppr, H2C(4)Ppr и H2C(5)Ppr); 3.10, 3.20 (оба м, по 1 Н, H2C(6)Ppr); 4.56 (д, 1 Н, HC(2)Ppr, 3J=4.2 Гц); 7.80 (д, 2 Н, Н(2), Н(6), 3J=8.8 Гц); 7.99 (д, 2 Н, Н(3), Н(5), 3J=8.8 Гц); 8.20 (д, 2 Н, Н(2`), Н(6`), 3J=8.8 Гц); 8.40 (д, 2 Н, H(3`), H(5`), 3J=8.8 Гц); 10.62 (с, 1 Н, NH).
Фармакологические свойства заявляемых соединений
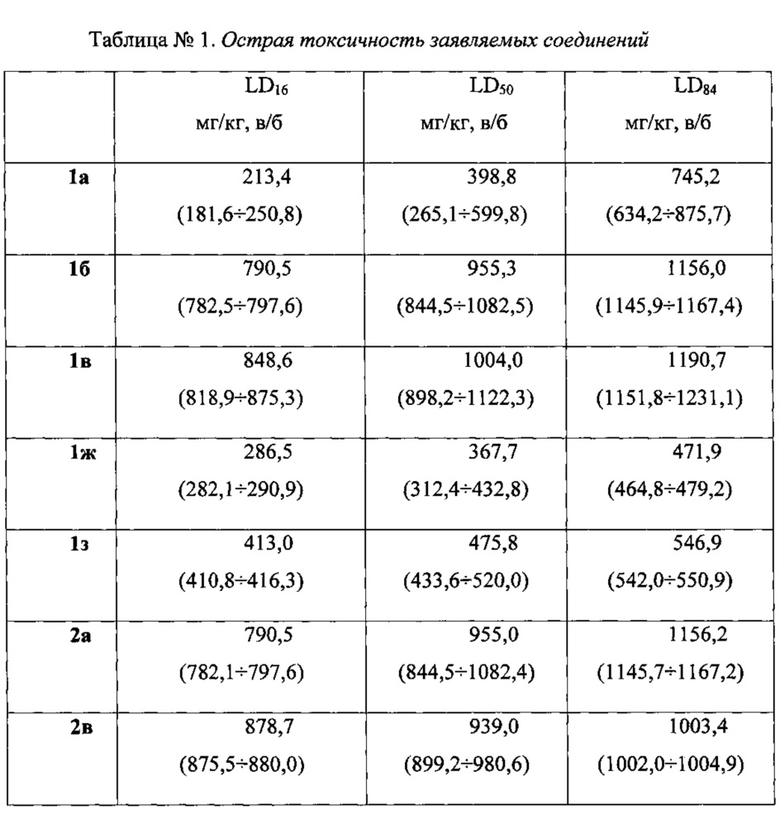
Пример 1. Определение острой токсичности (LD50) заявляемых соединений.
Острую токсичность заявляемых соединений изучали в опытах на беспородных мышах-самцах массой тела 21-24 г. Животных содержали в виварии в соответствии с приказом МЗ РФ №267 от 09.06.2003 «Об учреждении правил лабораторной практики». Заявляемые соединения вводили внутрибрюшинно. В качестве растворителя использовали апирогенную воду для инъекций. Острую токсичность каждого соединения определяли, как минимум, в пяти различных дозах, количество животных в каждой серии 6. Летальность животных оценивали через 24 часа после введения заявляемых соединений. По методу Литчфилда-Уилкоксона рассчитывали LD16, LD50 и LD84 с их доверительными 95% интервалами.
Как следует из полученных данных, большей токсичностью обладают соединения 1а, 1ж и 1з, а меньшей - 1б, 1в, 2а и 2в. Заявляемые соединения относятся к IV классу токсичности, т.е. к малотоксичным веществам (табл. 1).
Пример 2. Изучение влияния заявляемых соединений на содержание металлопротеиназы-9 в плазме крови крыс с острым инфарктом миокарда.
Опыты проводили на беспородных крысах-самцах массой 200-220 г, содержащихся в условиях вивария в соответствии с правилами лабораторной практики (Good Laboratory Practice, GLP) и нормативными документами (Приказ Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. №708н «Об утверждении Правил лабораторной практики»).
Животные были рандомизированы на 10 групп по 6 особей в каждой. 1-ая - интактная, 2-ая - контрольная - инфаркт миокарда, 3-ья - инфаркт миокарда + эталонный препарат доксициклин, 4-ая-10-ая - группы, получавшие заявляемые соединения: соответственно, 1а, 1в, 1ж, 1з, 2а, 2в.
Анестезированных (уретан 1300 мг/кг, в/б) животных интубировали и переводили на искусственное дыхание. После торако- и перикардотомии идентифицировали левую коронарную артерии и производили ее одномоментную перевязку на уровне выхода сосуда из-под ушка сердца. Эталонный препарат доксициклин (40 мг/кг/сут.) и исследуемые соединения в дозе 20 мг/кг/сут. вводили внутрижелудочно через зонд в 0,5 мл физиологического раствора в течение 3 дней, предшествующих эксперименту. Через 3 часа после перевязки коронарной артерии животных забивали, а кровь забирали для иммуноферментного определения содержания в плазме ММП-9. Определение содержания МПП-9 проводили с помощью автоматического биохимического и иммуноферментного анализатора "Chem Well 2910 Combi", США. В работе использовали набор для иммуноферментного определения ММР-9 крысы RMP900 (R&D Systems, США).
Статистическую обработку результатов проводили следующим образом: Нормальность распределения выборок проверяли с помощью критерия Шапиро-Уилка, гомогенность дисперсий - критерия Левена. Так как выборки имели нормальное и близкое к нему распределение и дисперсии были гомогенны, для определения статистической значимости различий использовали однофакторный дисперсионный анализ с последующей обработкой с помощью метода множественных сравнений по Ньюмену-Кейлсу. Результаты выражали в виде средних арифметических и их стандартных ошибок.
Результаты экспериментов приведены на фиг. 1.
Как следует из полученных данных, среди заявляемых соединений выявлены 2 вещества (соединения 1а и 1б), которые по способности ингибировать ММП-9, как минимум, не уступают эталонному препарату доксициклину.
Пример 3. Исследование влияния соединения 1а на ремоделирование миокарда в условиях экспериментального инфаркта миокарда.
Наличие способности заявляемых соединений препятствовать развитию патологического ремоделирования левого желудочка сердца в острейшую фазу экспериментального инфаркта миокарда проиллюстрировано на примере соединения 1a - 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролина, поскольку оно, согласно полученным нами данных, наиболее активно и статистически значимо препятствует формированию этого патологического процесса.
Опыты проводили на беспородных крысах-самцах массой 450-500 г, наркотизированных уретаном (1300 мг/кг, в/б). Животных рандомизировали на четыре группы: 1-я - ложнооперированные (n=6); 2-я - контроль = острый инфаркт миокарда (n=12); 3-я - доксициклин + острый инфаркт миокарда (n=9); 4-я (n=6) - соединение 1а - 1-{4-[(4-хлорбензоил)амино]фенил}-сульфонил-L-пролин + острый инфаркт миокарда. Экспериментальный инфаркт миокарда воспроизводили по методу Селье. После торако- и перикардотомии под переднюю ветвь левой коронарной артерии на 0,5-1 мм ниже ее выхода из-под ушка сердца проводили лигатуру. У ложнооперированных животных лигатура оставалась под коронарной артерией на протяжении всего эксперимента, а у животных 2, 3 и 4 групп производили одномоментную перевязку коронарной артерии.
Измерения производили в одномерном М- и двухмерном В-модальных режимах по методу Teichogolz при положении датчика эхокардиографа в парастернальной позиции по длинной оси сердца. В М-модальном режиме оценивали конечно-систолический (КСР) и конечно-диастолический (КДР) размеры левого желудочка сердца, на основании чего рассчитывали такие показатели насосной функции сердца, как фракция выброса (ФВ), фракция укорочения (ФУ), конечно-систолический объем (КСО), конечно-диастолический объем (КДО) левого желудочка, а также ударный объем сердца. Оценку эхокардиографических показателей проводили, как минимум, по пяти последовательным сердечным циклам. Все измерения производили в соответствии с Рекомендациями Американского общества и Европейской ассоциации по эхокардиографии [Lang R.M. et al. J. Am. Soc. Echocardiogr. 2005; 18: 1440-1463]. В работе использовали цифровой ультразвуковой эхокардиограф DP-6600 с электронным микроконвексным датчиком 65С15ЕА (6,5/8,0 МГц).
Животным 3 группы внутрижелудочно через зонд вводили доксициклин (40 мг/кг/сут. в 0,5 мл физиологического раствора) в течение 3 дней, предшествующих эксперименту. Животным 4 группы по аналогичной схеме и в том же объеме растворителя вводили соединение 1а (30 мг/кг/сут.).
Статистическую обработку данных производили следующим образом. Нормальность распределения выборок определяли с помощью критерия Шапиро-Уилка. Так как выборки имели нормальное распределение, для определения статистической значимости изменений использовали однофакторный дисперсионный анализ и дисперсионный анализ повторных измерений с дальнейшей обработкой методом множественных сравнений по Ньюмену-Кейлсу. Различия считали значимыми при p≤0,05. Данные в таблицах представлены в виде средних арифметических и их стандартных ошибок, а в тексте и фигурах - только в виде средних арифметических.
При эхокардиографической оценке насосной функции сердца у интактных наркотизированных крыс с закрытой грудной клеткой зарегистрированные показатели, отражающие состояние насосной функции сердца, соответствовали таковым, известным из литературы.
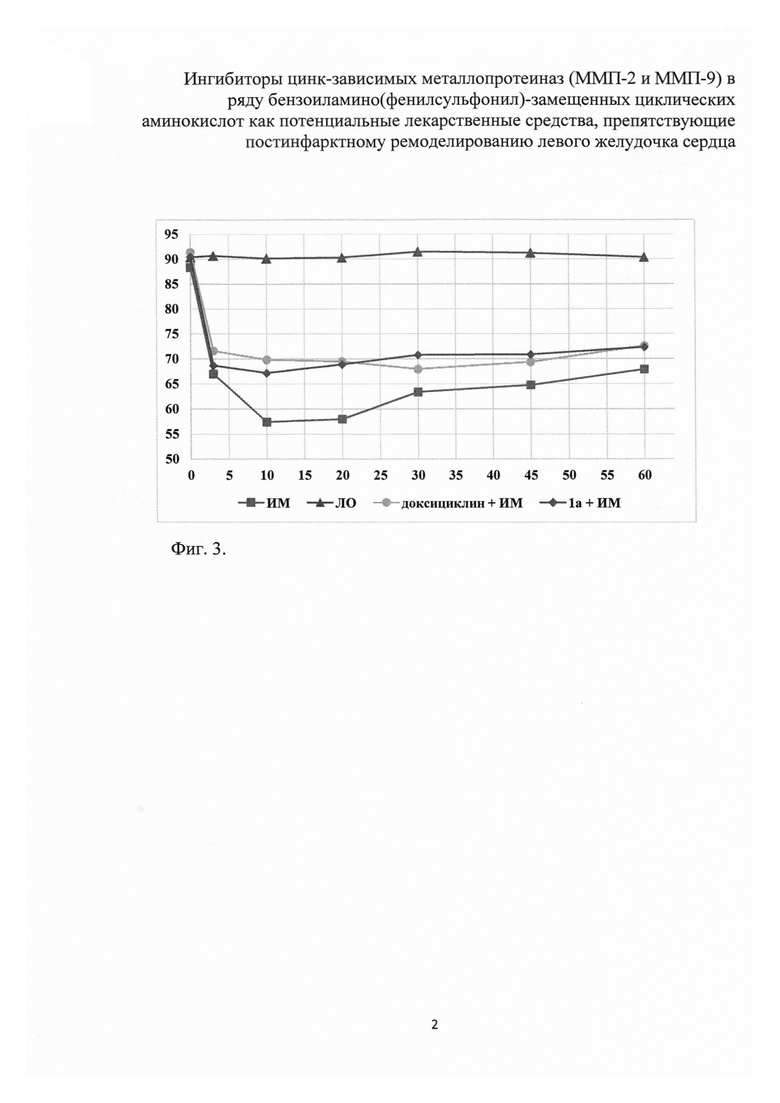
Так, например, в проведенных экспериментах величина ФВ варьировала в пределах 84-93%; по литературным данным величина ФВ у интактных наркотизированных крыс колеблется в пределах 80-90%. Перевод животных на искусственное дыхание, торако- и перикардотомия не влияли на величину регистрируемых показателей насосной функции сердца. Проведение под коронарную артерию лигатуры, которое было осуществлено в группе ложнооперированных животных, также не оказывает какого-либо статистически значимого влияния на систолическую функцию левого желудочка. Одномоментная перевязка коронарной артерии в контрольной группе животных повлекла за собой выраженные изменения систолической функции левого желудочка. На третьей минуте после окклюзии коронарного сосуда КСР увеличился с 1,98 до 3,11 мм; ФВ уменьшилась с 88,40 до 67,00%. ФУ снизилась с 53,17 до 32,27% (фиг. 2, 3).
Таким образом, практически сразу же после одномоментной перевязки коронарной артерии происходит существенное, статистически значимое падение систолической функции левого желудочка. Показано, что этот процесс динамически нарастает во времени и достигает своего максимума в период с 10 по 20-ю минуту после перевязки. Так, например, к 20 минуте КСР увеличился с 1,98 до 3,84 мм, а ФВ уменьшилась с 88,4 до 59,00%. В период с 30-1 по 60-ю минуту от момента перевязки коронарной артерии отмечено постепенное относительное улучшение показателей, характеризующих систолическую функцию левого желудочка, однако все они статистически значимо отличались от исходного уровня. Как следует из приведенных данных, к 60-й минуте ишемии состояние насосной функции сердца относительно улучшалось, и, что важно, регистрируемые показатели систолической функции левого желудочка значительно отличались от таковых, зарегистрированных на 20-й минуте от момента перевязки коронарной артерии.
Как уже было отмечено выше, в качестве эталонного препарата нами был использован антибиотик тетрациклинового ряда - доксициклин. Тетрациклины, в частности доксициклин, помимо собственно антибактериальной активности обладают рядом плейотропных эффектов, в том числе и способностью блокировать гиперпродукцию ММП-2 и ММП-9 как в ишемизированном, так и интактном миокарде и тем самым препятствовать потере экстрацеллюлярного матрикса, приводящей к раннему постинфарктному ремоделированию миокарда [Bench T.J. et al., Pharmacological Research. 2011; 64: 561-566; Griffin M.O. et al. Am. J. Physiol. Cell. Physiol. 2010; 299: С539-С548]. He менее важно и то, что доксициклин является первым лекарственным средством, обладающим свойствами ингибитора ММП, которое было разрешено FDA к применению в клинике по этим показаниям [Lindsey M.L. et al. Global J. Hum. Anat. Physiol. Res. 2014; 1: 6-9].
Показано, что в группе животных (n=9), получавших доксициклин (40 мг/кг, per os), одномоментная перевязка коронарной артерии также влекла за собой снижение систолической функции левого желудочка сердца, однако в первые 20 минут от момента начала ишемии интенсивность этого процесса была статистически значимо ниже (табл. 2, фиг. 2, 3). Так, например, к 20 минуте ишемии у контрольных животных КСР увеличивался с 1,98 до 3,84 мм, т.е. практически в 2 раза, тогда как у животных, получавших доксициклин, увеличение КСР составило менее 60% (соответственно с 1,77 до 2,80 мм) - различие статистически значимы (р=0,004) (табл. 2, фиг. 2). К этому моменту у контрольных животных ФВ снизилась с 88,4 до 58,0%, т.е. на 34%, а у животных, получавших доксициклин - менее чем на 25% (соответственно с 91,4 до 69,5%) - различия статистически значимы (p=0,002) (табл. 2, фиг. 3).

Начиная с 30 минуты ишемии, показатели, характеризующие систолическую функцию левого желудочка сердца, в группе животных, получавших доксициклин, статистически значимо не отличались от таковых, зарегистрированных в это время в контрольной группе
В группе животных (n=6), получавших соединение 1а (30 мг/кг, per os), одномоментная перевязка коронарной артерии также как в контроле и группе животных получавших доксициклин влекла за собой снижение систолической функции левого желудочка сердца, однако в первые 20 минут от момента начала ишемии интенсивность этого процесса была статистически значимо ниже, чем в контроле (табл. 2, фиг. 2, 3). Так, например, к 20 минуте ишемии у контрольных животных КСР увеличивался с 1,98 до 3,84 мм, т.е. практически в 2 раза, тогда как у животных, получавших соединение 1а увеличение КСР составило, так же как и в случае доксициклина, менее 60% (соответственно, с 1,84 до 2,87 мм) - различия статистически значимы (p=0,007) (табл. 2, фиг. 2). К этому моменту у контрольных животных ФВ снизилась с 88,4 до 58,0%, т.е. на 34%, а у животных, получавших соединение 1а - менее чем на 25% (соответственно с 90,5 до 68,9%) - различия статистически значимы (p=0,001) (табл. 2, фиг. 3). Если различия в показателях, отражающих систолическую функцию сердца в период максимального падения сократимости миокарда (10-20 минуты ишемии), между контрольной группой и группой животных, получавших соединение 1а, статистически значимы, то различия в величине КСР и ФВ между группами, получавшими доксициклин и соединение 1а, практически отсутствуют: соответственно p=0,840 и p=0,587.
Данные, полученные в этой серии экспериментов, свидетельствуют о том, что заявляемые соединения, в том числе соединение 1а - 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролин по своей способности препятствовать раннему постинфарктному ремоделированию миокарда, как минимум, не уступает эталонному ингибитору ММП - доксициклину.
Таким образом, выше изложенное позволяет полагать, что заявляемые соединения, которые являются ингибиторами ММП, в частности, соединение 1а - 1-({4-[(4-хлорбензоил)амино]-фенил}сульфонил-L-пролин, могут быть использованы для создания и внедрения в клиническую практику новых оригинальных лекарственных средств, препятствующих развитию постинфарктного ремоделирования левого желудочка сердца.
Описание чертежей
Фиг. 1. Влияние соединений 1а и 1б на содержание ММП-9 в плазме крови крыс с острой ишемией миокарда (ИМ).
По оси абсцисс - группы животных, по оси ординат - концентрация ММП-9 в плазме крови, нг/мл.
Фиг. 2. Влияние соединения 1а на динамику изменения конечно-систолического размера (КСР) у крыс в острейшую фазу инфаркта миокарда.
По оси абсцисс - время, мин, по оси ординат - конечно-систолический размер левого желудочка сердца (мм).
ИМ - острый инфаркт миокарда (контроль); ЛО - ложнооперированные животные; ДЦ + ИМ - эталонный препарат доксициклин + инфаркт миокарда; 1а + ИМ - соединение 1а + инфаркт миокарда
Фиг. 3. Влияние соединения 1а на динамику изменения фракции выброса (ФВ) у крыс в острейшую фазу инфаркта миокарда.
По оси абсцисс - время, мин, по оси ординат - фракция выброса левого желудочка сердца (%).
ИМ - острый инфаркт миокарда (контроль); ЛО - ложнооперированные животные; ДЦ + ИМ - эталонный препарат доксициклин + инфаркт миокарда; 1а + ИМ - соединение 1а + инфаркт миокарда.
| название | год | авторы | номер документа |
|---|---|---|---|
| Ингибитор матриксных металлопротеиназ 2-го и 9-го типов из ряда производного бензоиламино(фенилсульфонил)-L-оксипролина, обладающий нейропротекторной и противоопухолевой активностью | 2023 |
|
RU2826902C1 |
| Производное антраниловой кислоты, обладающее антигипоксической, анальгетической и мнемотропной активностью | 2023 |
|
RU2820516C1 |
| ПРОИЗВОДНЫЕ 2-ЗАМЕЩЕННЫХ ФЕНИЛ-5, 7-ДИГИДРОКАРБИЛ-3, 7-ДИГИДРОПИРРОЛО [2, 3-d] ПИРИМИДИН-4-ОНОВ, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2323220C2 |
| 1H-ПИРРОЛО[3,4-b]ХИНОЛИН-3,9(2H,4H)-ДИОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2457208C2 |
| Бис(метоксибензиламиноалкил)амины, обладающие кардиотропной активностью | 2014 |
|
RU2624438C2 |
| 11b-(ГEТ)АРИЛ-2,3,6,11b-ТЕТРАГИДРООКСАЗОЛО[2',3':2,1]ПИРРОЛО[3,4-b]ХИНОЛИН-5,11-ДИОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2381229C2 |
| ПИРРОЛОХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ 5-НТ6 АНТАГОНИСТОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2013 |
|
RU2688161C2 |
| ИСПОЛЬЗОВАНИЕ ЛИГАНДОВ РЕЦЕПТОРА ЕР4 ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ IL-6 ЗАБОЛЕВАНИЙ | 2003 |
|
RU2285527C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 3-АРИЛ-5-ХЛОРИЗОКСАЗОЛОВ | 2015 |
|
RU2637927C2 |
| ПРОИЗВОДНЫЕ АНТРАНИЛОВОЙ КИСЛОТЫ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1994 |
|
RU2128644C1 |

Изобретение относится к области биологически активных соединений. Предложены бензоиламино(фенилсульфонил)-замещенные циклические аминокислоты общей формулы (1), где R1, R2, R3, R4, R5, R6, R7 могут быть водородами, атомами галогенов, (C1-С4)-алкильными группами, нитрогруппами; «n» может равняться 1-3, и их физиологически приемлемые соли, которые являются ингибиторами цинк-зависимых металлопротеиназ (ММП-2 и ММП-9). Также предложен способ получения соединений формулы (1) и метод лечения ремоделирования левого желудочка сердца в острейшую фазу инфаркта миокарда с использованием соединений формулы (1). 4 н.п. ф-лы, 3 ил., 2 табл., 3 пр.

1. Бензоиламино(фенилсульфонил)-замещенные циклические аминокислоты общей формулы (1),

где R1, R2, R3, R4, R5, R6, R7 могут быть водородами, атомами галогенов, (C1-С4)-алкильными группами, нитрогруппами; «n» может равняться 1-3, и их физиологически приемлемые соли общей формулы 2,

где М+ - катион щелочных металлов, a R1, R2, R3, R4, R5, R6, R7 и n имеют вышеуказанные значения.
2. Соединение 1-({4-[(4-хлорбензоил)амино]фенил}сульфонил-L-пролин 1а, являющееся веществом, препятствующим ремоделированию миокарда в острейшую фазу экспериментального инфаркта миокарда.
3. Способ получения бензоиламино(фенилсульфонил)-замещенных циклических аминокислот общей формулы (1), где R1, R2, R3, R4, R5, R6, R7 имеют вышеуказанные значения по п. 1, заключающийся в том, что арилсульфонилхлориды общей формулы 6:
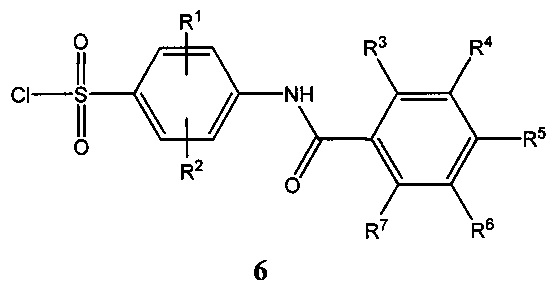
где R1, R2, R3, R4, R5, R6, R7 имеют вышеуказанные значения по п. 1, вводят во взаимодействие с циклическими аминокислотами общей формулы 7:
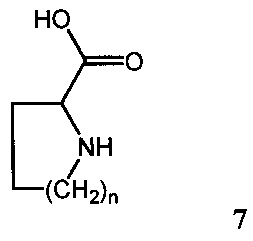
где «n» может равняться 1-3, в полярных растворителях, таких как вода, тетрагидрофуран, диоксан, диметилсульфоксид, диметилформамид, в присутствии акцепторов кислот, таких как, например, гидроксиды щелочных металлов, карбонаты щелочных металлов, аммиак или третичные амины, при температурах от комнатной до 100°С, что приводит к образованию соединений общей формулы 1, где R1, R2, R3, R4, R5, R6, R7 и n имеют вышеуказанные значения по п. 1, которые могут быть превращены в соли присоединения оснований общей формулы 2, где М+, R1, R2, R3, R4, R5, R6, R7 и n имеют вышеуказанные значения по п. 1.
4. Метод лечения ремоделирования левого желудочка сердца в острейшую фазу инфаркта миокарда с помощью эффективных количеств соединений по п. 1 и 2.
| RU 2014123622 A, 27.01.2016 | |||
| RU 2008142598 A, 10.05.2010 | |||
| СУЛЬФИРОВАННЫЕ АМИНОКИСЛОТНЫЕ ПРОИЗВОДНЫЕ И СОДЕРЖАЩИЕ ИХ ИНГИБИТОРЫ МЕТАЛЛОПРОТЕИНАЗ | 1997 |
|
RU2198656C2 |
| US 6177466 B1, 23.01.2001 | |||
| WO 2004060874 A1, 22.07.2004. | |||
Авторы
Даты
2018-03-07—Публикация
2016-02-25—Подача