Настоящее изобретение относится к новому коллагеновому матриксу, в частности для применения в качестве мастики, полоски или пробки, например, зубной пломбы, материалу, содержащему частицы двухфазного костнозамещающего материала с двуслойной структурой на основе кальция фосфата/гидроксиапатита (КФ/ГАП), который имеет однородную внешнюю поверхность, способу получения такого коллагенового матрикса, а также к новой гранулированной смеси, содержащей частицы указанного двухфазного костного материала.
В области медицины, в частности в области ортопедии, под мастикой обычно подразумевают вещество пластилиновой консистенции с соответствующими свойствами пластичности и когезивности. Материалу мастики можно легко придать форму вручную, и он сохраняет свою форму после устранения внешнего давления.
Под полоской обычно понимают гибкий и формоустойчивый материал, который может соответствовать анатомической кривизне области трансплантата. Полоска может быть сжата и сложена, но она возвращается к своей первоначальной форме после прекращения действия внешней силы.
Пломбой обычно называют цилиндрический или конусообразный материал, имеющий различные размеры. Материал гибкий и может быть сжат, но возвращается к своей первоначальной форме после устранения внешней силы. Зубная пломба является пробкой, которую можно установить в ротовой полости. В частности, ее можно использовать для заполнения отверстия или полости, такой как лунка, после удаления зуба.
Предшествующий уровень техники
Дефекты костной структуры возникают при различных обстоятельствах, таких как травма, заболевание и хирургическое вмешательство, причем до сих пор существует потребность в эффективном восстановлении костных дефектов в различных хирургических случаях.
Многочисленные природные и синтетические материалы и композиции используют для стимуляции заживления в месте дефекта кости. Хорошо известным природным остеокондуктивным костнозамещающим материалом, который способствует росту кости при пародонтных и челюстно-лицевых костных дефектах, является коммерческий продукт Geistlich Bio-Oss® фирмы Geistlich Pharma AG. Этот материал изготавливают из натуральной кости с помощью процесса, описанного в US 5167961, который позволяет сохранить трабекулярную архитектуру и нанокристаллическую структуру натуральной кости, в результате чего получают превосходный остеокондуктивный матрикс, который не рассасывается или рассасывается очень медленно.
Системы трикальцийфосфат/гидроксиапатит (ТКФ/ГАП) и их применение в качестве заменителей кости описаны, например, в US 6338752, раскрывающем способ приготовления двухфазного цемента α-ТКФ/ГАП путем нагревания порошковой смеси фосфата аммония и ГАП при 1200-1500°С.
В европейском патенте ЕР 285826 описывают способ получения слоя ГАП на металлических и неметаллических объектах для имплантатов путем нанесения слоя α-ТКФ и полного превращения слоя α-ТКФ в ГАП путем реакции с водой при рН от 2 до 7 при 80-100°С. Полученный продукт представляет собой металлический или неметаллический корпус, покрытый слоем ГАП.
В WO 97/41273 описывают способ нанесения на подложку, такую как, например, гидроксиапатит (ГАП) или другие кальция фосфаты (КФ), покрытия из карбоната гидроксиапатита, то есть гидроксиапатита, в котором ионы фосфата и/или гидроксила частично заменены ионами бикарбоната, посредством процесса, включающего (а) погружение подложки в раствор с рН от 6,8 до 8,0, содержащий ионы кальция, фосфат-ионы и бикарбонат-ионы, при температуре ниже 50°С, (б) нагрев части раствора, контактирующего с подложкой, до температуры от 50 до 80°С до рН выше 8, (в) поддержание контакта подложки со щелочным раствором, полученным на стадии (б), для образования покрытия из карбоната гидроксиапатита, и (г) удаление подложки из раствора и обработка покрытия для высушивания. Установлено, что ионы бикарбоната действуют в качестве ингибиторов роста кристаллов гидроксиапатита, в результате чего образуются нестехиометрические кристаллы, содержащие дефекты и имеющие относительно небольшие размеры, а именно 10-40 нм в длину и 3-10 нм в ширину (см. стр. 7, строки 1-7).
Компоненты систем кальция фосфат/гидроксиапатит (КФ/ГАП), особенно системы ТКФ/ГАП, отличаются по термодинамической стабильности. Из-за этой разницы, если системы ТКФ/ГАП имплантируют млекопитающему, в частности пациенту человеку, растворимость ТКФ и других фосфатов кальция в жидкости организма выше, чем растворимость ГАП. Разница в растворимости между кальция фосфатами и ГАП вызывает разрушение неупорядоченной структуры спекания системы КФ/ГАП, потому что лучше растворимое соединение КФ (например, ТКФ) удаляется быстрее, чем ГАП. Спеченное соединение между КФ и ГАП, полученное при высоких температурах, также существенно влияет на повышенную растворимость устройства в физиологической среде. Два различных типа реакций преобладают in vivo при ускоренном разрушении такой керамики: химическое растворение и биологическое рассасывание клетками. Оба процесса вызывают растворение керамического материала, что, кроме того, вызывает локальное перенасыщение ионами кальция, в результате чего высвобождается больше ионов кальция, чем адсорбируется. Естественный баланс ионов кальция больше не существует ни во внеклеточном матриксе, ни в тканях, окружающих имплантат. Локальное нарушение естественного кальциевого равновесия в виде перенасыщения ионами кальция приводит к повышенной активности остеокластов и, как следствие, к ускоренному неконтролируемому рассасыванию керамического материала и риску неблагоприятных воспалительных реакций, особенно при использовании большого количества синтетического костнозамещающего материала.
При имплантации костнозамещающего материала Geistlich Bio-Oss® пациенту человеку естественный баланс кальция практически не нарушается, концентрация ионов кальция на поверхности материала и в окружающей его среде остается почти постоянной. Таким образом, биологическое рассасывание материала не происходит или протекает очень медленно без риска неблагоприятных воспалительных реакций.
В ЕР-В1-2445543 описывают имеющий большое преимущество костнозамещающий материал на основе фосфата кальция/гидроксиапатита (КФ/ГАП), который, как и костнозамещающий материал Geistlich Bio-Oss®, после затвердевания in vivo обеспечивает концентрацию ионов кальция на поверхности материала и в его локальном окружении почти постоянной и, таким образом, не приводит к повышенной активности остеокластов.
Действительно, естественный баланс концентрации кальция, необходимый для оптимальной регенерации кости, не нарушается. Более того, естественный баланс концентрации кальция поддерживается костнозамещающим материалом до тех пор, пока не завершится процесс регенерации. При соблюдении этих условий не происходит повышения активности остеокластов, следовательно, отсутствует риск неблагоприятных воспалительных реакций.
Изобретение ЕР-В1-2445543 относится к двухфазному костнозамещающему материалу кальций фосфат/гидроксиаппатит (КФ/ГАП), состоящему из спеченного ядра КФ и по меньшей мере одного однородного и замкнутого эпитаксически выращенного слоя нанокристаллического КФ, осажденного поверх спеченного ядра КФ, при этом выращенные эпитаксически нанокристаллы имеют тот же размер и морфологию, что и минерал человеческой кости, т.е. длину от 30 до 46 нм и ширину от 14 до 22 нм.
Спеченное ядро КФ может содержать трикальцийфосфат (ТКФ), особенно α-ТКФ (α-Саз(PO4)2) или ρ-ТКФ (ρ-Са3(PO4)2), и/или тетракальцийфосфат (ТТКФ) Са4(PO4)2O.
В соответствии с часто используемым вариантом осуществления спеченный сердечник КФ по существу состоит из ТКФ, причем предпочтительным является α-ТКФ.
Эпитаксически выращенный слой нанокристаллического ГАП структурно и химически почти идентичен природному минералу кости человека.
Эпитаксически выращенный слой нанокристаллического ГАП обычно имеет толщину по меньшей мере от 15 до 50 нм, предпочтительно по меньшей мере от 20 до 40 нм, более предпочтительно по меньшей мере от 25 до 35 нм. Такая минимальная толщина соответствует одному слою нанокристаллов ГАП в эпитаксиальной ориентации.
Эпитаксически выращенный слой нанокристаллического ГАП может содержать один или несколько слоев нанокристаллов ГАП в эпитаксиальной ориентации. Толщина эпитаксически выращенного слоя нанокристаллического ГАП, связанная с количеством таких слоев нанокристаллов ГАП в эпитаксической ориентации, может быть выбран в соответствии с предполагаемым применением костнозамещающего материала в качестве имплантата или протеза в разных частях тела, отличающихся по нагрузке.
Костнозамещающий материал по настоящему изобретению действительно предназначен для функционирования in vivo в качестве напоминающей живую систему, постепенно превращающей спеченное ядро КФ в гидроксиапатит, по размеру и морфологии аналогичный костному минералу человека, причем скорость такой трансформации зависит от скорости высвобождения кальция спеченным ядром КФ, которое в значительной степени определяется толщиной эпитаксически выращенного слоя нанокристаллического ГАП.
Свойства костнозамещающего материала КФ/ГАП во многом определяются толщиной эпитаксиально выращенного слоя кристаллического ГАП. Термин «свойства» означает способность костнозамещающего материала КФ/ГАП высвобождать постоянную концентрацию ионов кальция в локальную окружающую среду in vitro и in vivo.
Толщина эпитаксиально выращенного слоя нанокристаллического ГАП связана с соотношением спеченного материала сердцевины КФ и ГАП, причем указанное соотношение обычно составляет от 5:95 до 95:5, предпочтительно от 10:90 до 90:10.
Костнозамещающий материал КФ/ГАП может представлять собой частицы или гранулы, причем частицы или гранулы имеют определенный размер и форму. Обычно частицы или гранулы имеют приблизительно сферическую форму и диаметр от 250 до 5000 мкм.
Костнозамещающий материал КФ/ГАП также может представлять собой формованное тело, т.е. винт, гвоздь, штифт или структуру, имеющую профиль костной части тела, такой как, в частности, бедро, ключица, ребро, нижняя челюсть или часть черепа. Такой винт, гвоздь или штифт можно использовать в реконструктивной ортопедической хирургии для фиксации связки к кости, например, в колене или локте. Такая конструкция, имеющая профиль костной части тела, может быть использована в ортопедической хирургии в качестве протеза для замены отсутствующей или дефектной кости или ее части.
Костнозамещающий материал КФ/ГАП согласно ЕР-В1-2445543 должен быть получен способом, включающим стадии:
а) получения спеченного материала сердцевины КФ,
б) погружения спеченного материала сердцевины КФ в водный раствор при температуре от 10°С до 50°С для запуска процесса трансформации КФ в ГАП, в результате чего однородный и замкнутый эпитаксиально выращенный слой нанокристаллического гидроксиапатита образуется на поверхности спеченного ядра КФ, причем эпитаксически выращенные нанокристаллы имеют тот же размер и морфологию, что и минерал кости человека,
в) остановки трансформации путем отделения твердого материала от водного раствора в то время, когда имеется однородное и замкнутое покрытие, по крайней мере, из одного слоя нанокристаллического ГАП, но до полного завершения процесса трансформации,
г) необязательной стерилизация отделенного материала, полученного на стадии в).
Получение спеченного материала ядра КФ может быть выполнено методами, известными в данной области техники, включающими сначала смешивание порошков гидрофосфата кальция (CaHPO4), карбоната кальция и/или гидроксида кальция, затем прокаливание и спекание смеси в соответствующем температурном диапазоне, тем самым получая объемный спеченный материал ядра КФ (см., например, Mathew М. с соавт., 1977, Acta. Cryst. ВЗЗ: 1325; Dickens В. с соавт., 1974, J. Solid State Chemistry 10, 232; Durucan С.с соавт., 2002, J. Mat. Sci., 37:963).
Объемный спеченный материал ядра ТКФ может быть получен таким образом путем смешивания порошков гидрофосфата кальция (СаНРОД карбоната кальция и/или гидроксида кальция в стехиометрическом соотношении, прокаливания и спекания смеси при температуре в диапазоне 1200-1450°С, предпочтительно примерно 1400°С.
С помощью вышеописанного метода также может быть получен объемный спеченный материал ядра ТТКФ.
Объемный спеченный материал КФ, полученный такими методами, может быть пористым с пористостью от 2 до 80 об.% и широким распределением пор. Параметры пористости выбирают в зависимости от предполагаемого применения костнозамещающего материала КФ/ГАП.
Спеченный материал ядра КФ, использованный на стадии б), может быть
- объемным спеченным материалом сердцевины КФ, полученный согласно приведенному выше описанию,
- частицами или гранулами спеченного материала ядра КФ, полученными из объемного спеченного материала ядра КФ, полученному согласно приведенному выше описанию, с использованием обычных методов, таких как дробление, измельчение и/или помол и просеивание, или
- заготовкой из спеченного материала ядра КФ, имеющей нужную форму и размер, например винтом, гвоздем, штифтом или конструкцией, имеющей профиль костной части тела.
Такая заготовка любой нужной формы и размера может быть получена из массивного спеченного материала ядра, полученного согласно описанному выше, с использованием хорошо известных методов прототипирования, таких как фрезерование с числовым программным управлением типа CNC или 3D-печать (см., например, Bartolo Р. с соавт., 2008, в кн.: «Bio-Materials and Prototyping Applications in Medicine», Springer Science New York, ISBN 978-0-387-47682-7; Landers R. с соавт., 2002, Biomaterials 23(23), 4437; Yeong W.-Y. с соавт., 2004, Trends in Biotechnology, 22 (12), 643; Seitz H. с соавт., 2005, Biomed. Mater. Res. 74B (2), 782).
Водный раствор на стадии б) представляет собой чистую воду, искусственную биологическую жидкость или буфер. Важно, что значение рН иммерсионного раствора на стадии б) является почти нейтральным и остается стабильным на протяжении всего процесса трансформации, предпочтительно в диапазоне рН от 5,5 до 9,0.
Термин «искусственная биологическая жидкость» относится к любому раствору, имитирующему жидкость организма. Предпочтительно, искусственная биологическая жидкость имеет концентрацию ионов, аналогичную таковой в плазме крови.
Буфер может быть любым буфером в указанном выше диапазоне рН, но предпочтительно это фосфатный буфер с кальцием, магнием и/или натрием или без них.
Буфер, используемый в примерах (см. примеры 4 и 5), представляет собой водный фосфатный буфер.
Диапазон температуры на стадии б) обычно составляет от 10°С до 50°С, предпочтительно от 25 до 45°С, более предпочтительно от 35°С до 40°С.
Стадия погружения б) вызывает на первой стадии фазовый переход первого порядка материала ядра КФ и, следовательно, зарождение предшественников нанокристаллов КФ. Во время второй фазы полученные предшественники ГАП из первой фазы будут расти, и образовывать замкнутый (т.е. полностью покрывающий) слой эпитаксического нанокристаллического композита. Первый слой нанокристаллов ГАП должен быть однородным, тыйным и эпитаксиально связанным со спеченным материалом сердцевины ГАП.
Во время третьей стадии фазовый переход первого порядка может происходить внутри вновь сформированного двухслойного композита для дальнейшей трансформации спеченного материала ядра КФ (ТКФ или ТТКФ) в нанокристаллический ГАП. Во время этой третьей стадии фазового перехода ионы кальция будут высвобождаться в течение контролируемого времени посредством процесса, определяемого медленной диффузией, до тех пор, пока часть спеченного материала сердцевины КФ не превратится в нанокристаллический ГАП. Толщину слоя ГАП и, следовательно, скорость высвобождения кальция можно регулировать, изменяя время трансформации.
Эпитаксически выращенный нанокристаллический слой ГАП соответствующей толщины получают in vitro, причем трансформацию КФ в ГАП останавливают до его завершения.
Как только костнозамещающий материал КФ/ГАП затвердевает in vivo, процесс трансформации КФ в ГАП реактивируется при контакте с жидкостями организма, и костнозамещающий материал начинает функционировать как живая система, образуя новый гидроксиапатит аналогичного размера и морфологии что и минерал кости человека. Во время процесса фазовой трансформации in vivo переносимые ионы кальция высвобождаются в окружающую среду, поддерживая равновесие кальция в определенном месте, что важно и полезно для процессов регенерации кости.
Из-за разного времени регенерации костных дефектов в участках тела с разной нагрузкой важно, чтобы можно было контролировать скорость высвобождения кальция. Этого можно достичь изменением толщины эпитаксиально выращенного слоя гидроксиапатита.
Таким образом, стадия в) очень важна. Время выдержки в водном растворе на стадии б) зависит от требуемой толщины слоя ГАП. Необходим хотя бы один слой нанокристаллического ГАП в эпитаксиальной ориентации. Важно, что преобразование КФ в ГАП не завершено.
Надлежащее время выдержки в соответствии с требуемой толщиной может быть рассчитано с использованием нескольких термодинамических дифференциальных уравнений, известных специалистам в области химии фосфатов кальция, цемента и бетона.
См., например: Pommersheim J.С, Clifton J.R. Сет.Cone. Res., 1979, 9:765; Pommersheim J.C., Clifton J.R. Cem. Cone. Res., 1982, 12:765; Schlussler K.H., Mcedlov-Petrosjan O.P., 1990, Der Baustoff Beton, VEB Verlag Bauwesen, Берлин.
Перенос решения упомянутых выше дифференциальных уравнений в систему КФ/ГАП позволяет прогнозировать фазовый переход КФ в ГАП и толщину слоя, при которой эпитаксический слой ГАП можно приготовить стабильным и воспроизводимым образом.
Выделение твердого материала из водного раствора в конце стадии в) обычно проводят фильтрованием, промывкой и сушкой с использованием методов, известных в данной области техники.
В примерах ЕР-В1-2445543 (а именно в примере 4 [0057] и примере 5 [0058]) отмывку осуществляют промыванием разделенных гранул костнозамещающего материала 3 раза очищенной водой для удаления остатков из буферного раствора.
Необязательная стадия стерилизации г) может быть осуществлена методами, известными в данной области техники, такими как гамма-облучение или рентгеновское облучение.
Используя, как указано в примерах 4 и 5 патента ЕР-В1-2445543, водный фосфатный буфер для водного раствора на стадии б) и очищенную воду для 3-кратной промывки разделенных гранул в конце стадии в), получают двухфазный костнозамещающий материал кальций фосфат/гидроксиапатит (КФ/ГАП), состоящий из спеченного ядра КФ и замкнутого эпитаксически выращенного слоя нанокристаллического ГАП, осажденного на внешнюю поверхность спеченного ядра КФ, при этом выращенные эпитаксически нанокристаллы имеют тот же размер и морфологию, что и костный минерал человека, при этом замкнутый эпитаксиально выращенный слой нанокристаллического ГАП, нанесенный на внешнюю поверхность спеченного ядра КФ, имеет неоднородную внешнюю поверхность, состоящую из отдельных (разделенных) кластеров плоских кристаллических пластинок, состоящих из эпитаксиально выращенных нанокристаллов ГАП, и гладких участков между отдельными кластерами плоских кристаллических пластинок, процента внешней поверхности, занятой гладкими участками между отдельными кластерами плоских кристаллических пластинок в зависимости от времени трансформации в заданных условиях.
См. фиг. 1А, на котором представлен результат анализа СЭМ (сканирующей электронной микроскопии) прототипа 1 (гранулы 1-2 мм), время трансформации 30 мин, при этом гладкие участки составляют около 70% общей внешней поверхности, измеренной с помощью СЭМ, и фиг. 1Б, представляет СЭМ-изображение прототипа 2 (гранулы 1-2 мм), имеющего время трансформации 40 мин, где гладкие участки составляют около 50% общей внешней поверхности, измеренной с помощью СЭМ.
WO 2015/009154 раскрывает способ получения остеокондуктивного материала с улучшенной остеоиндуктивной способностью, который включает гидротермическую обработку спеченного двухфазного материала кальций фосфат/гидроксиапатит (КФ/ГАП) с топографией поверхности, состоящей из зерен, под давлением 2-4 бара при температуре, равной или превышающей 125°С, без регулирования рН в течение времени, достаточного для превращения зерен фосфата кальция на поверхности исходного материала в иглы кальция фосфата диаметром 10-1500 нм. Температура не менее 125°С и давление не менее 2 бар далеки от условий (близких к физиологическим в организме человека), используемых в ЕР-В1-2445543 (температура 35-40°С, рН 5,5-9,0, давление окружающей среды), которые допускают эпитаксический рост нанокристаллов ГАП. Эти иглы не выращиваются эпитаксически, а прикрепляются к материалу сердцевины или осаждаются на ней и лишь частично (обычно на 40-90%) покрывают ее, тем самым увеличивая ее поверхность и способность укрывать белки, тем самым усиливая остеоиндуктивную способность.
Авторы международной заявки на патент РСТ WO-2019/115704 обнаружили, что при добавлении от 10 до 90%, предпочтительно от 20 до 60%, короткоцепочечного алифатического спирта, включая, метанол, этанол, пропанол или бутанол, но ими перечень не ограничивается, к водному фосфатному буферу на стадии б) при получении двухфазного костнозамещающего материала фосфат кальция/гидроксиапатит (КФ/ГАП) по ЕР-В1-2445543, неоднородная внешняя поверхность замкнутого эпитаксиально выращенного слоя нанокристаллического ГАП, осажденного на внешнюю поверхность спеченного ядра КФ двухфазного костнозамещающего материала фосфат кальция/гидроксиапатит (КФ/ГАП), который состоит из отдельных скоплений плоских кристаллических пластинок и гладких участков между ними, заменяется однородной шероховатой внешней поверхностью, состоящей из плоских кристаллических пластинок без отдельных кристаллических скоплений плоских кристаллических пластинок. Такая однородная шероховатая внешняя поверхность обычно содержит выращенные эпитаксически нанокристаллические пластинки гидроксиапатита, образующие взаимосвязанную сеть пластинок с размерами отдельных пластинок от 0,2 до 20 мкм, а затем от 0,5 до 5 мкм, как определено с помощью СЭМ, в зависимости от количества используемого алифатического спирта.
Как показали тесты in vitro на остеогенную дифференцировку эмбриональных мезенхимальных стволовых клеток человека (hMSC fetal human mesenchymal stem cell), остеогенный ответ in vivo, вероятно, будет сильнее для двухфазного костнозамещающего материала на основе кальция фосфата/гидроксиапатита (КФ/ГАП), имеющего однородную шероховатую внешнюю поверхность, содержащую плоские кристаллические пластинки, чем для двухфазного костнозамещающего материала на основе кальция фосфата/гидроксиапатита (КФ/ГАП), описанного в ЕР-В1-2445543, который имеет неоднородную внешнюю поверхность, содержащую отдельные скопления плоских кристаллических пластинок и гладкие участки между ними.
Изобретение, изложенное в международной заявки на патент РСТ WO-2019/115704, касается двухфазного костнозамещающего материала на основе фосфата кальция/гидроксиапатита (КФ/ГАП), включающего спеченное ядро КФ и замкнутый эпитаксически выращенный слой нанокристаллического ГАП, нанесенный на внешнюю поверхность спеченного ядра КФ, в итоге эпитаксиально выращенные нанокристаллы имеют тот же размер и морфологию, что и костный минерал человека, при этом замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешнюю поверхность спеченного ядра КАП, имеет однородную грубую внешнюю поверхность, содержащую плоские кристаллические пластинки.
Такой двухфазный костнозамещающий материал на основе фосфата кальция/гидроксиапатита (КФ/ГАП) демонстрирует повышенную остеогенную дифференцировку эмбриональных мезенхимальных стволовых клеток человека (hMSC), что является явным признаком усиленного остеогенного ответа in vivo.
Термин «замкнутый эпитаксиально выращенный слой нанокристаллического ГАП, нанесенный на внешнюю поверхность спеченного ядра КФ» означает, что эпитаксически выращенный слой нанокристаллического ГАП полностью покрывает всю внешнюю поверхность спеченного ядра КФ.
Термин «гомогенная шероховатая внешняя поверхность, содержащая плоские кристаллические пластинки» означает, что макроскопически шероховатость внешней поверхности, вызванная плоскими кристаллическими пластинками, статистически равномерно распределена по поверхности ядра КФ без отдельных кристаллических скоплений плоских кристаллических пластинок. См. фиг. 2, на которой представлены СЭМ-изображения прототипов 3-7 двухфазного костнозамещающего материала на основе фосфата кальция/гидроксиапатита (КФ/ГАП) по изобретению с однородной шероховатой внешней поверхностью с различной степенью шероховатости.
Термин «плоские кристаллические пластинки» означает кластеры кристаллов, высота (толщина) которых значительно меньше ширины и длины по отношению к трем взаимно перпендикулярным направлениям. Такие плоские кристаллические пластинки хорошо видны на фиг. 3Б.
Обычно однородная шероховатая внешняя поверхность состоит из эпитаксически выращенных пластинок нанокристаллического гидроксиапатита, образующих переплетенную сеть пластинок с размерами (ширина и длина) от 0,2 до 20 мкм, что было показано с помощью СЭМ (сканирующей электронной микроскопии). ЧЕМ больше размер пластинок, тем больше шероховатость внешней поверхности.
Предпочтительно однородная шероховатая внешняя поверхность состоит из эпитаксически выращенных пластинок нанокристаллического гидроксиапатита, образующих переплетенную сеть пластинок с размерами от 0,5 до 5 мкм, что было показано с помощью СЭМ.
Как правило, такая однородная шероховатая внешняя поверхность состоит из эпитаксически выращенных пластинок гидроксиапатита, образующих взаимосвязанную сеть, содержащую поры от 0,03 до 2 мкм, что определено с помощью ртутной интрузивной порозиметрии (РИП Mercury Intrusion Porosimetry). Чем больше объем пор в диапазоне от 0,03 до 2 мкм, тем выше шероховатость внешней поверхности.
Обычно однородная шероховатая внешняя поверхность может быть охарактеризована с помощью АСМ-полученной (атомно-силовой микроскопии) среднеквадратичной шероховатостью (Rq) в диапазоне от 50 до 400 нм и средней максимальной высотой профиля (Rz) в диапазоне от 500 до 2000 нм.
Предпочтительно однородная шероховатая внешняя поверхность может быть охарактеризована с помощью АСМ-производной среднеквадратичной шероховатостью (Rq) в диапазоне от 110 до 150 нм и средней максимальной высотой профиля (Rz) в диапазоне от 550 до 750 нм.
Как правило, процентное содержание ГАП в двухфазном костнозамещающем материале на основе фосфата кальция/гидроксиапатита (КФ/ГАП) составляет от 1 до 90%, по данным измерения методом ДРЛ.
Предпочтительно процент составляет от 1,5 до 30%, более предпочтительно от 2 до 15%, по данным измерения методом ДРЛ.
Спеченное ядро КФ содержит трикальцийфосфат (ТКФ), особенно α-TCP (α-Са3(PO4)2) или (3-ТКФ (ρ-Са3(PO4)2), и/или тетракальцийфосфат (ТТКФ) Са4(PO4)2O.
В соответствии с часто используемым вариантом осуществления спеченное ядро КФ по существу состоит из ТКФ, причем предпочтительным является α-ТКФ.
Эпитаксически выращенный слой нанокристаллического ГАП структурно почти идентичен природному минералу кости человека.
Костнозамещающий материала на основе КФ/ГАП может представлять собой частицы или гранулы, у которых имеются требуемые размер и форма. Обычно размер частиц или гранул имеет размер от 250 до 5000 мкм, предпочтительно от 1000 до 2000 мкм.
Костнозамещающий материал КФ/ГАП также может представлять собой формованное тело, т.е. винт, гвоздь, штифт или структуру, имеющее профиль костной части тела, например, в частности, бедра, ключицы, ребра, нижней челюсти или части черепа. Такой винт, гвоздь или штифт можно использовать в реконструктивной ортопедической хирургии для фиксации связки к кости, например, в колене или локте. Такая конструкция, имеющая профиль костной части тела, может быть использована в ортопедической хирургии в качестве протеза для замены отсутствующей или дефектной кости или костной части.
В международной заявке на патент РСТ WO-2019/115704 также описывают мастику, содержащую частицы или гранулы определенного выше костнозамещающего материала КФ/ГАП в подходящем матриксе, обычно включающем природные или синтетические полимеры. Как правило, частицы или гранулы имеют размер от 250 до 5000 мкм, предпочтительно от 1000 до 2000 мкм.
В международной заявке на патент РСТ WO-2019/115704 также описывают способ получения описанного выше костнозамещающего материала КФ/ГАП, включающий стадии:
а) получения спеченного материала сердцевины КФ,
б) погружения спеченного материала сердцевины КФ в буферный раствор, содержащий от 10 до 90% короткоцепочечного алифатического спирта, при температуре от 10°С до 50°С, чтобы начать процесс трансформации КФ в ГАП, в результате чего замкнутый эпитаксический выращенный слой нанокристаллического гидроксиапатита формируется на поверхности материала спеченного ядра КФ, при этом выращенные эпитаксическим путем нанокристаллы имеют тот же размер и морфологию, что и костный минерал человека, причем замкнутый эпитаксически выращенный слой нанокристаллического ГАП, образованный на поверхности материала спеченного ядра ГАП, имеет однородную внешнюю поверхность, содержащую плоские кристаллические пластинки,
в) остановки трансформации путем отделения твердого материала от водного раствора в то время, когда имеется однородное и замкнутое покрытие, по крайней мере, из одного слоя нанокристаллического ГАП, но до полного завершения процесса трансформации,
г) необязательной стерилизация отделенного материала, полученного на стадии в).
Соответствующий короткоцепочечный алифатический спирт может быть выбран из группы, состоящей из метанола, этанола, пропанола и бутанола.
Предпочтительно короткоцепочечным алифатическим спиртом является этанол.
Предпочтительно, буферный раствор на стадии б) содержит от 20 до 60%, более предпочтительно от 30 до 50% короткоцепочечного алифатического спирта.
Параметры шероховатости однородной шероховатой внешней поверхности замкнутого эпитаксиально выращенного слоя нанокристаллического ГАП, осажденного на внешней поверхности спеченного ядра КФ, а именно
- параметры АСМ: полученная с помощью АСМ среднеквадратическая шероховатость (Rq) и средняя максимальная высота профиля (Rz),
- размеры эпитаксиально выращенных пластинок нанокристаллического гидроксиапатита, определенные с помощью СЭМ и
- объем пор от 0,03 до 2 мкм, который был определен методом ртутной интрузивной порозиметрии (РИП),
можно легко отрегулировать, изменив процентное содержание короткоцепочечного алифатического спирта в буферном растворе для трансформации.
Чем выше такой процент, тем меньше АСМ-полученная (с помощью атомно-силовой микроскопии) среднеквадратичная шероховатость (Rq) и средняя максимальная высота профиля (Rz), тем меньше размеры эпитаксиально выращенных пластинок нанокристаллического гидроксиапатита по данным СЭМ и меньше объем пор от 0,03 до 2 мкм, по данным РИП.
Буферный раствор на стадии б), содержащий от 10 до 90% короткоцепочечного алифатического спирта, получают путем смешивания водного буферного раствора с различными количествами короткоцепочечного алифатического спирта. Водный буферный раствор выбирают таким образом, чтобы значение рН иммерсионного раствора на стадии б), который дополнительно содержит от 10 до 90% короткоцепочечного алифатического спирта, было почти нейтральным и оставалось стабильным на протяжении всего процесса трансформации, предпочтительно в диапазоне рН от 5,5 до 9,0, более предпочтительно с 7,0 до 8,0.
Подходящим буферным раствором является, например, 0,05-0,3 М водный раствор дигидрофосфата натрия (NaH2PO2) с величиной рН от 7,3 до 7,6.
Диапазон температуры на стадии б) составляет в основном от 10°С до 50°С, предпочтительно от 25 до 45°С, более предпочтительно от 35°С до 40°С.
Предпочтительно стадию б) осуществляют при температуре от 35 до 40°С в растворе фосфатного буфера при рН от 7,0 до 8,0, содержащем от 20 до 60% короткоцепочечного алифатического спирта.
Получение спеченного материала ядра КФ может быть выполнено методами, известными в данной области техники и включающими сначала смешивание порошков гидрофосфата кальция (СаНРОД карбоната кальция и/или гидроксида кальция, затем прокаливание и спекание смеси в соответствующем температурном диапазоне, тем самым получая объемный спеченный материал ядра КФ (см., например, Mathew М. с соавт., Acta. Cryst. 1977, ВЗЗ: 1325; Dickens В. с соавт., J. Solid State Chemistry, 1974, 10, 232; Durucan С.с соавт., J. Mat. Sci., 2002, 37:963).
Таким образом, объемный спеченный материал ядра КФ может быть получен путем смешивания порошков гидрофосфата кальция (СаНРОд), карбоната кальция и/или гидроксида кальция в стехиометрическом соотношении, прокаливания и спекания смеси при температуре в диапазоне 1200-1450°С, предпочтительно примерно 1400°С.
С помощью вышеописанного метода также может быть получен объемный спеченный материал ядра ТТКФ.
Объемный спеченный материал КФ, полученный такими методами, может быть пористым с пористостью от 2 до 80 об.% и широким распределением пор. Параметры пористости выбирают в зависимости от предполагаемого применения костнозамещающего материала КФ/ГАП.
Спеченный материал ядра КФ, использованный на стадии б), может быть
- объемным спеченным материалом ядра КФ, полученный согласно описанному выше,
- частицами или гранулами спеченного материала ядра КФ, полученного из объемного спеченного материала ядра КФ, полученного согласно описанному выше с помощью таких обычных методов, как дробление, измельчение и/или помол и просеивание, или
- заготовкой из спеченного материала ядра КФ, имеющего нужные форму и размер, например в виде винта, гвоздя, штифта или конструкции, имеющей профиль костной части тела.
Такая заготовка любой нужной формы и размера может быть получена из объемного спеченного материала ядра, приготовленного, как описано выше, с использованием известных методов прототипирования, таких как фрезерование с ЧПУ типа CNC или 3D-печать (см., например, Bartolo Р. с соавт., 2008, в кн.: «Bio-Materials and Prototyping Applications in Medicine», Springer Science New York, ISBN 978-0-387-47682-7; Landers R. с соавт., Biomaterials 2002, 23(23), 4437; Yeong W.-Y. с соавт., Trends in Biotechnology, 2004, 22 (12), 643; Seitz H. с соавт., Biomed. Mater. Res. 2005, 74B (2), 782).
Стадия погружения б) вызывает на первой стадии фазовый переход первого порядка материала ядра КФ и, следовательно, зарождение предшественников нанокристаллов КФ. Во время второй фазы полученные предшественники ГАП из первой фазы будут расти, и образовывать замкнутый (т.е. полностью покрывающий) слой эпитаксического нанокристаллического композита. Первый слой нанокристаллов ГАП должен быть однородным, замкнутым и эпитаксиально связанным со спеченным материалом сердцевины ГАП.
Во время третьей стадии фазовый переход первого порядка может происходить внутри вновь сформированного двухслойного композита для дальнейшей трансформации спеченного материала ядра КФ (ТКФ или ТТКФ) в нанокристаллический ГАП. Во время этой третьей стадии фазового перехода ионы кальция будут высвобождаться в течение контролируемого времени посредством процесса, определяемого медленной диффузией, до тех пор, пока часть спеченного материала сердцевины КФ не превратится в нанокристаллический ГАП. Толщину слоя ГАП и, следовательно, скорость высвобождения кальция можно регулировать, изменяя время трансформации.
Эпитаксически выращенный нанокристаллический слой ГАП соответствующей толщины получают in vitro, причем трансформацию КФ в ГАП останавливают до ее завершения.
Как только костнозамещающий материал КФ/ГАП затвердевает in vivo, процесс трансформации КФ в ГАП реактивируется при контакте с жидкостями организма, и костный заменитель начинает функционировать как живая система, образуя новый гидроксиапатит, аналогичный по размеру и морфология минералу кости человека.
Во время процесса фазовой трансформации in vivo переносимые ионы кальция высвобождаются в окружающую среду, поддерживая локальное равновесие кальция, что важно и полезно для процессов регенерации кости.
Из-за разного времени регенерации костных дефектов в участках тела с разной нагрузкой важно, чтобы можно было контролировать скорость высвобождения кальция. Этого можно достичь изменением толщины эпитаксиально выращенного слоя гидроксиапатита.
Таким образом, стадия в) является очень важной. Время выдержки в водном растворе на стадии б) зависит от желаемой толщины слоя ГАП. Необходим хотя бы один слой нанокристаллического ГАП в эпитаксиальной ориентации. Важно, чтобы преобразование КФ в НАР не было завершено.
Надлежащее время выдержки в соответствии с требуемой толщиной может быть рассчитано с использованием нескольких термодинамических дифференциальных уравнений, известных специалистам в области химии фосфатов кальция, цемента и бетона.
См., например: Pommersheim J.С, Clifton J.R. Сет.Cone. Res., 1979, 9:765; Pommersheim J.С, Clifton J.R. Cem. Cone. Res., 1982, 12:765; Schlussler K.H., Mcedlov-Petrosjan O.P., 1990, Der Baustoff Beton, VEB Verlag Bauwesen, Берлин.
Перенос решения упомянутых выше дифференциальных уравнений в систему КФ/ГАП позволяет прогнозировать фазовый переход КФ в ГАП и толщину слоя, при которой эпитаксический слой ГАП можно приготовить стабильным и воспроизводимым образом.
Выделение твердого материала из водного раствора обычно проводят фильтрованием, промывкой и сушкой с использованием методов, известных в данной области техники.
Необязательная стадия стерилизации г) может быть осуществлена методами, известными в данной области техники, такими как гамма-облучение или рентгеновское облучение.
Преимущества костнозамещающего материала КФ/ГАП по международной заявке РСТ WO-2019/115704 и способ его получения
Описываемый двухфазный костнозамещающий материал фосфата кальция/гидроксиапатита (КФ/ГАП) по настоящему изобретению с однородной шероховатой внешней поверхностью, содержащей плоские кристаллические пластинки, показывает повышенную остеогенную дифференцировку эмбриональных мезенхимальных стволовых клеток человека (hMSC), в частности более высокую экспрессию маркеров дифференцировки остеопонтина (OPN - osteopontin) и остеокальцина (OCN - osteocalcin) по сравнению с двухфазным костнозамещающий материалом на основе фосфата кальция/гидроксиапатита (КФ/ГАП) согласно ЕР-В1-2445543, который имеет неоднородную внешнюю поверхность, состоящую из отдельных скоплений плоских кристаллических пластинок и гладких областей между ними. Это явный признак усиленного остеогенного ответа in vivo.
Это согласуется с результатами, опубликованными R.A. Gittens с соавт.{Biomaterials, 2011, 32(13): 3395-3403), которые показали, что введение наноразмерных структур в сочетании с микро-субмикро масштабной шероховатостью улучшает дифференцировку остеобластов и выработку локального фактора, что, в свою очередь, указывает на возможность улучшения остеоинтеграции имплантата in vivo.
Процесс получения двухфазного костнозамещающего материала кальций фосфат /гидроксиапатит (КФ/ГАП) по настоящему изобретению позволяет удобно регулировать параметры шероховатости однородной шероховатой внешней поверхности замкнутого эпитаксиально выращенного слоя нанокристаллического ГАП, нанесенного на внешнюю поверхность спеченного ядра КФ, особенно
- параметры АСМ: полученная с помощью АСМ среднеквадратическая шероховатость (Rq) и средняя максимальная высота профиля (Rz),
- размеры эпитаксиально выращенных пластинок нанокристаллического гидроксиапатита, определенные с помощью СЭМ, и
- объем пор от 0,03 до 2 мкм, который был определен методом РИП, можно легко отрегулировать, изменив процентное содержание
короткоцепочечного алифатического спирта в буферном растворе для трансформации.
Чем выше такой процент, тем меньше АСМ-полученная (с помощью атомно-силовой микроскопии) среднеквадратичная шероховатость (Rq) и средняя максимальная высота профиля (Rz), тем меньше размеры эпитаксиально выращенных пластинок нанокристаллического гидроксиапатита по данным СЭМ и меньше объем пор от 0,03 до 2 мкм, по данным анализа РИП.
Краткое описание изобретения
Выше было указано, что в РСТ WO-2019/115704 описывают материал мастики, содержащий частицы или гранулы охарактеризованного выше заменителя кости КФ/ГАП в подходящем матриксе, обычно включающем природные или синтетические полимеры. Как правило, частицы или гранулы имеют размер от 250 до 5000 мкм, предпочтительно от 1000 до 2000 мкм. Для матрикса мастики не указан какой-либо конкретный синтетический или природный полимер.
В этой международной заявке не упоминаются ни полоски, ни пробки, ни смеси гранул данного костного заменителя КФ/ГАП.
В настоящее время заявитель обнаружил, как приготовить мастику с подходящими обрабатывающими свойствами, содержащую частицы или гранулы определенного выше костнозамещающего материала КФ/ГАП в коллагеновом матриксе, и испытал такую мастику на модели заднелатерального спондилодеза кролика (PLF posterolateral spinal fusion).
Заявитель также обнаружил, как приготовить полоску и пробку из этого костнозамещающего материала КФ/ГАП в коллагеновом матриксе и новую смесь гранул этого костнозамещающего материала КФ/ГАП.
Таким образом, настоящее изобретение относится к коллагеновому матриксу, содержащему частицы двухфазного костнозамещающего материала кальция фосфат /гидроксиапатит (КФ/ГАП), включающего спеченное ядро из КФ и замкнутый эпитаксически выращенный слой нанокристаллического ГАП, нанесенный на внешнюю поверхность спеченного ядра из КФ, посредством чего эпитаксиально выращенные нанокристаллы имеют тот же размер и морфологию, что и костный минерал человека, при этом замкнутый эпитаксически выращенный слой нанокристаллического ГАП, нанесенный на внешнюю поверхность спеченного ядра КФ, имеет однородную шероховатую внешнюю поверхность, состоящую из плоских кристаллических пластинок.
Такой коллагеновый матрикс применим, в частности, для получения мастики, полоски или пробки.
Коллаген может представлять собой коллаген с природными поперечными сшивками, обработанный кислым раствором, обычно при рН от 2 до 5. Такая обработка полезна для влажного измельчения коллагена, чтобы получить однородную суспензию, которую затем можно смешать с частицами костнозамещающего материала КФ/ГАП в кислой среде, обычно при рН от 2 до 5, или в щелочной среде, обычно при рН от 11 до 13. Вышеуказанная процедура позволяет придать коллагеновому матриксу характеристики пластичности и когезивности, которые необходимы для мастики.
Подходящий коллаген с природными поперечными сшивками с высокой степенью нативности описан в US 5837278. Такой коллаген коммерчески доступен под названием Geistlich Bio-Gide® (фирма Geistlich Pharma AG, Швейцария).
Коллаген также может быть телопептидным коллагеном, полученным в результате ферментативного расщепления нативного коллагена с природными поперечными сшивками протеолитическими ферментами, такими как трипсин или пепсин.
Если коллагеновый матрикс используют в виде полоски или пробки, коллаген, как правило, представляет собой коллаген с природными поперечными сшивками, который отвержден за счет физического сшивания с использованием дегидротермической обработки (ДГТО) или, в другом варианте, путем химического сшивания, например, с использованием EDC/NHS.
Обычно коллагеновый матрикс содержит 60-97 мас. % костнозамещающего материала и 3-40 мас. % коллагена, предпочтительно 75-85 мас. % костнозамещающего материала и 15-25 мас. % коллагена.
В международной патентной заявке РСТ WO-2019/115704 указанный выше двухфазный КФ/ГАП костнозамещающий материал проявляет прекрасную способность индуцировать формирование кости.
Обычно однородная шероховатая внешняя поверхность включает эпитаксически выращенные пластинки нанокристаллического гидроксиапатита, образующие взаимосвязанную сеть пластинок с размерами (шириной и длиной) от 0,2 до 20 мкм, что было определено с помощью СЭМ. Чем больше размеры пластинок, тем выше шероховатость внешней поверхности.
Предпочтительно однородная шероховатая внешняя поверхность эпитаксически выращенные пластинки нанокристаллического гидроксиапатита, образующие взаимосвязанную сеть пластинок с размерами от 0,5 до 5 мкм, что было определено с помощью СЭМ.
Обычно однородная шероховатая внешняя поверхность включает эпитаксически выращенные пластинки гидроксиапатита, образующие взаимосвязанную сеть, содержащую поры от 0,03 до 2 мкм, что было определено с помощью с помощью ртутной интрузивной порозиметрии (РИП). Чем выше объем пор в диапазоне от 0,03 до 2 мкм, тем выше шероховатость внешней поверхности.
Обычно однородная шероховатая внешняя поверхность может быть охарактеризована с помощью АСМ (атомно-силовой микроскопии) с АСМ-полученной среднеквадратичной шероховатостью (Rq) в диапазоне от 50 до 400 нм и средней максимальной высотой профиля (Rz) в диапазоне от 500 до 2000 нм.
Предпочтительно однородная шероховатая внешняя поверхность может быть охарактеризована с помощью АСМ-полученной среднеквадратичной шероховатостью (Rq) в диапазоне от 110 до 150 нм и средней максимальной высотой профиля (Rz) в диапазоне от 550 до 750 нм.
Предпочтительно процент ГАП, измеренный ДРЛ, составляет от 1,0 до 10,0%, или от 2,0 до 5,0%.
Спеченное ядро КФ содержит трикальцийфосфат (ТКФ), особенно α-ТКФ (α-Са3(PO4)2) или ρ-ТКФ (ρ-Саз(PO4)2), и/или тетракальцийфосфат (ТТКФ) Са4(PO4)2O.
В соответствии с часто используемым вариантом осуществления спеченное ядро КФ по существу состоит из ТКФ, причем предпочтительным является α-ТКФ.
Эпитаксически выращенный слой нанокристалического ГАП структурно практически идентичен естественному минералу кости человека.
Костнозамещающий материал КФ/ГАП может быть из частиц или гранул, при этом частицы или гранулы имеют желаемый размер и форму. Обычно частицы или гранулы имеют размер от 250 до 5000 мкм, предпочтительно от 500 до 2000 мкм.
Вышеуказанный коллагеновый матрикс может содержать смесь частиц вышеуказанного двухфазного костнозамещающего материала КФ/ГАП в соответствии с международной заявкой РСТ WO-2019/115704 с низким содержанием ГАП (не более 6,0%), которые быстро рассасываются, тем самым способствуя новому образованию кости, и частицы двухфазного костнозамещающего материала КФ/ГАП по ЕР-В1-2445543 с высоким содержанием ГАП (не менее 10,0%), которые медленно рассасываются, или частицы материала, полученного из натуральной кости, который медленно рассасывается, такой медленно рассасывающийся материал обладает остеокондуктивным эффектом.
Хорошо известным медленно рассасывающимся материалом, полученным из натуральной кости, является продукт Geistlich Bio-Oss®, который изготавливают из натуральной кости с помощью процесса, описанного в US 5167961, с получением костного минерала, в основном сохраняющего исходную кристаллическую структуру и минеральную микроструктуру натуральной кости, при этом содержание органических примесей ниже 150 частей на миллион и содержание белка ниже 135 частей на миллион.
Таким образом, настоящее изобретение относится к коллагеновому матриксу, который содержит:
- частицы двухфазного (КФ/ГАП) костнозамещающего материала (А), состоящего из спеченного ядра КФ и нанесенного на внешнюю поверхность спеченного ядра КФ замкнутого эпитаксически выращенного слоя нанокристаллического ГАП, при этом эпитаксиально выращенные нанокристаллы имеют тот же размер и морфологию, что и минерал кости человека, при этом замкнутый эпитаксиально выращенный слой нанокристаллического ГАП, нанесенный на внешнюю поверхность спеченного ядра КФ, имеет однородную шероховатую внешнюю поверхность, состоящую из плоских кристаллических пластинок, причем процент ГАП по измерению методом ДРЛ составляет от 2,0 до 6,0%, и частицы костнозамещающего материала (Б), выбранного из группы, состоящей из:
- двухфазного костозамещающего материала КФ/ГАП, состоящего из спеченного ядра КФ и, по крайней мере, одного замкнутого эпитаксиально выращенного слоя нанокристаллического ГАП, нанесенного на внешнюю поверхность спеченного ядра КФ, при этом эпитаксиально выращенные нанокристаллы имеют такой же размер и морфологию, что и минерал кости человека, в котором процент ГАП, измеренный с помощью ДРЛ, составляет от 10 до 40%, или
- костного минерала, в основном сохраняющего исходную кристаллическую структуру и минеральную микроструктуру натуральной кости, при этом содержание органических примесей ниже 150 частей на миллион и содержание белка ниже 135 частей на миллион.
Предпочтительно, если применяют коллагеновый матрикс в качестве материала мастики в случае заднелатерального спондилодеза (PLF posterolateral spinal fusion) (PLF):
- процент ГАП, измеренный методом ДРЛ, составляет от 2,0 до 6,0% в частицах костнозамещающего материала КФ/ГАП (А), и
- частицы костнозамещающего материала (Б) представляют собой частицы двухфазного костнозамещающего материала КФ/ГАП, включающие спеченное ядро КФ и, по крайней мере, один замкнутый эпитаксически выращенный слой нанокристаллического ГАП, нанесенный на внешнюю поверхность спеченного ядра КФ, при этом эпитаксически выращенные нанокристаллы имеют тот же размер и морфологию, что и минерал кости человека, при этом % ГАП, измеренный с помощью ДРЛ, составляет от 30 до 40%.
Обычно, если такую коллагеновую матрицу используют в качестве материала для зубной пломбы:
- процент ГАП, измеренный методом ДРЛ, составляет от 2,0 до 6,0% в частицах костнозамещающего материала КФ/ГАП (А), и
- частицы костнозамещающего материала (Б) представляют собой частицы костного минерала, полученные из натуральной кости и в основном сохраняющие первоначальную кристаллическую структуру и минеральную микроструктуру натуральной кости, при этом содержание органических примесей ниже 150 частей на миллион и содержание белка ниже 135 частей на миллион.
Как правило, соотношение массы частиц костнозамещающего материала КФ/ГАП (А) к массе частиц костозамещающего материала (Б) составляет от 0,1 до 9,9.
Предпочтительно, если при использовании данного коллагенового матрикса в качестве мастики в случае PLF соотношение масс частиц костнозамещающего материала КФ/ГАП (А) и частиц костозамещающего материала (Б) составляет от 0,4 до 1,0.
Предпочтительно, если при использовании данного коллагенового матрикса в качестве материала зубной пломбы соотношение масс частиц костнозамещающего материала КФ/ГАП (А) и частиц костозамещающего материала (Б) составляет от 0,8 до 4.
Как правило, такой коллагеновый матрикс получают с помощью процесса, включающего диспергирование коллагеновых волокон нативного коллагена с природными поперечными сшивками в кислом растворе при рН от 2 до 5 или в щелочном растворе при рН от 11 до 13, чтобы получить суспензию коллагена, смешивание полученной коллагеновой суспензии с вышеуказанным двухфазным костнозамещающим материалом и гомогенизацию.
Суспензию коллагена - КФ/ГАП затем обычно лиофилизируют и стерилизуют гамма- или рентгеновским облучением или обработкой оксидом этилена.
Перед имплантацией лиофилизированную и стерилизованную мастику обычно регидратируют кровью или изотоническим солевым раствором.
Настоящее изобретение также относится к способу получения вышеуказанного коллагенового матрикса для использования в качестве мастики, который включает диспергирование коллагеновых волокон нативного коллагена с природными поперечными сшивками в кислом растворе при рН от 2 до 5 таким образом, чтобы получить суспензию коллагена, смешивание и гомогенизацию полученной суспензии коллагена с частицами вышеуказанного двухфазного костнозамещающего материала КФ/ГАП, например, для получения суспензии коллагена-КФ/ГАП, лиофилизацию этой суспензии и стерилизацию гамма-лучами или рентгеновским облучением или обработкой оксидом этилена.
Предпочтительно кислую суспензию коллагена подвергают мокрому измельчению в коллоидной мельнице, мельнице-блендере или куттерной мельнице.
Настоящее изобретение также относится к гранулированной смеси, в частности для применения в качестве костнозамещающего материала, представляющей собой смесь частиц вышеуказанного двухфазного костнозамещающего материала КФ/ГАП по международной заявке РСТ WO-2019/115704 с низким содержанием ГАП (не более 6,0%), который быстро рассасывается, тем самым способствуя образованию новой кости, и частиц двухфазного костозамещающего материала КФ/ГАП согласно ЕР-В1-2445543 с высоким содержанием ГАП (не менее 10,0%), которые медленно рассасываются, или частиц материала из натуральной кости, который медленно рассасывается, причем такой медленно рассасывающийся материал обладает остеокондуктивным эффектом.
Хорошо известным медленно рассасывающимся материалом, полученным из натуральной кости, является продукт Geistlich Bio-Oss®, который изготавливают из натуральной кости с помощью процесса, описанного в US 5167961, с получением костного минерала, в основном сохраняющего исходную кристаллическую структуру и минеральную микроструктуру натуральной кости, при этом содержание органических примесей ниже 150 частей на миллион и содержание белка ниже 135 частей на миллион.
Таким образом, настоящее изобретение относится к гранулированной смеси, которая включает:
- частицы двухфазного костнозамещающего материала кальций фосфат/гидроксиаппатит (КФ/ГАП) (А), включающего спеченное ядра КФ и замкнутый эпитаксически выращенный слой нанокристаллического ГАП, причем эпитаксиально выращенные нанокристаллы имеют одинаковый размер и морфологию, подобную минералу кости человека, при этом замкнутый эпитаксиально выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, имеет однородную шероховатую внешнюю поверхность, состоящую из плоских кристаллических пластинок, причем процент ГАП по измерению методом ДРЛ составляет от 2,0 до 6,0%, и
частицы костнозамещающего материала (Б), выбранного из группы, состоящей из:
- двухфазного костозамещающего материала КФ/ГАП, состоящего из спеченного ядра КФ и, по крайней мере, одного замкнутого эпитаксиально выращенного слоя нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, при этом эпитаксиально выращенные нанокристаллы имеют такой же размер и морфологию, что и минерал кости человека, где процент ГАП, измеренный с помощью ДРЛ, составляет от 10 до 40%, или
- костного минерала, в основном сохраняющего исходную кристаллическую структуру и минеральную микроструктуру натуральной кости, при этом содержание органических примесей ниже 150 частей на миллион и содержание белка ниже 135 частей на миллион. Предпочтительно, в такой гранулированной смеси:
- процент ГАП по измерению методом ДРЛ составляет от 2,0 до 6,0% в частицах костнозамещающего материала (А), и
- частицы костнозамещающего материала (Б) представляют собой частицы двухфазного костнозамещающего материала КФ/ГАП, включающие спеченное ядро КФ и, по крайней мере, один замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, при этом эпитаксически выращенные нанокристаллы имеют тот же размер и морфологию, что и минерал кости человека, при этом % ГАП, измеренный с помощью ДРЛ, составляет от 30 до 40%.
Как правило, отношение массы частиц костнозамещающего материала КФ/ГАП (А) к массе частиц костозамещающего материала (Б) составляет от 0,1 до 9,9.
Подробное описание изобретения Краткое описание фигур
Далее настоящее изобретение будет описано более подробно со ссылкой на иллюстративные примеры предпочтительных вариантов осуществления настоящего изобретения и прилагаемые фигуры:
Фигура 1. СЭМ-изображение прототипа 1 (гранулы 1-2 мм) костнозамещающего материала, описанного в ЕР-В1-2445543 и полученного в примере 1, имеющего время трансформации 30 мин, при этом гладкие участки составляют около 70% общей внешней поверхности по данным СЭМ.
Фигура 1Б. СЭМ-изображение прототипа 2 (гранулы 1-2 мм) костнозамещающего материала, описанного в ЕР-В1-2445543 и полученного в примере 1, имеющего время трансформации 40 мин, при этом гладкие участки составляют около 50% общей внешней поверхности по данным СЭМ.
Фигура 2А-2Д. СЭМ-изображение прототипа 3 (фиг. 2А): 20% этанол, гранулы 1-2 мм), прототипа 4 (фиг. 2Б): 30% этанол, гранулы 1-2 мм), прототипа 5 (фиг. 2 В): 40% этанол, гранулы 1-2 мм), прототипа 6 (фиг. 2Г): 50% этанол, гранулы 1-2 мм), прототипа 7 (фиг. 2Д): 60% этанол, гранулы 1-2 мм) костнозамещающего материала по настоящему изобретению.
Все изображения на фиг. 1 и 2А-Д увеличены в 3500 раз.
Фигура 3А. СЭМ-изображение поперечного сечения прототипа 5 (этанол 40%, гранулы 1-2 мм) при малом увеличении (1000 х). В правом нижнем углу показана внешняя поверхность гранулы, а центр гранулы расположен ближе к верхнему левому углу.
Фигура 3Б. СЭМ-изображение поперечного сечения прототипа 5 (этанол 40%, гранулы 1-2 мм) при большом увеличении (14000 х).
Фигура 4. СЭМ-изображения (два верхних изображения) и АСМ-изображения (остальные четыре изображения) прототипов За (слева: 20% этанол) и 6а (справа: 50% этанол) непористых дисков из костнозамещающих материалов по настоящему изобретению, полученных в примере 2.
Фигура 5А-5Б. Реакция в виде остеокальцина (OCN, фиг. 5А) и остеопонтина (OPN, фиг. 5Б) у эмбриональных мезенхимальных стволовых клеток человека (hMSC) при контакте с костнозамещающими материалами по настоящему изобретению по сравнению с костнозамещающими материалами из предшествующего уровня техники в тесте in vitro.
Фигура 6. РИП-диаграммы гранул размером 1-2 мм прототипов 3 (20% этанола), 5 (40% этанола) и 7 (60% этанола) костнозамещающих материалов по настоящему изобретению, полученных в примере 2, и чистый α-ТКФ, полученный согласно описанию в примере 1.
Фигура 7. Рентгенограмма позвоночника кролика через 12 недель после имплантации коллагенового матрикса в качестве материала мастики согласно настоящему изобретению, полученной в примере 6 3).
Фигура 8. Фотография, полученная с помощью флуоресцентной микроскопии гистологического препарата в смоле, при PLF у кролика с использованием прототипа пластыря с коллагеновой матрицей, полученного согласно изобретению в примере 6 3) через 12 недель после имплантации.
Настоящее изобретение иллюстрируется приводимыми ниже примерами, которые не ограничивают области охвата настоящего изобретения.
Пример 1. Получение двухфазных костнозамещающих материалов кальция фосфата/гидроксиаппатита (КФ/ГАП) в соответствии с ЕР-В1-2445543.
Объемный спеченный материал альфα-ТКФ, его пористые гранулы с размером частиц 1,0-2,0 мм и трансформированные гранулы с эпитаксически выращенным ГАП-покрытием готовят аналогично описанному в примерах 1, 2 и 4 ЕР-В1-2445543.
364 г безводного порошка дикальций фосфата, 136 г порошка карбоната кальция и 220 мл деионизированной воды смешивают в течение 5 мин при 700 об/мин с использованием лабораторной мешалки. Суспензию после смешивания немедленно переносят в жаростойкий платиновый тигель. Заполненный платиновый тигель помещают в холодную печь. Печь нагревают до 1400°С, используя скорость нагрева 100°С в час. Эту температуру поддерживают в течение 12 ч, после чего печь охлаждают до 800°С со скоростью охлаждения 500°С в ч, затем охлаждают до 300°С со скоростью охлаждения 125°С в ч и окончательно охлаждают до комнатной температуры выключением печи. Объемный спеченный материал (фаза чистого α-Са3(PO4)2) удаляют из печи и извлекают из платинового тигля. Контроль фазовой чистоты проводят с помощью метода дифракции рентгеновских лучей (ДРЛ).
Объемный продукт измельчают с помощью щековой дробилки (расстояние между щеками варьируют от 10 до 1 мм). Полученные гранулы просеивают с помощью просеивающей машины и сит-вкладышей с размером ячеек 2 мм и 1 мм. После просеивания гранулы промывают этанолом для отделения мелких остатков порошка, адсорбированных на гранулах. Пористые гранулы сушат в течение 1 ч при 80°С в сушильном шкафу. Чистоту поверхностей частиц после ополаскивания контролируют путем наблюдения за поверхностью с помощью сканирующей электронной микроскопии.
Буферный раствор, достаточный для нанесения покрытия и фазовой трансформации, готовят путем растворения 0,4 М/л дигидрофосфата натрия (NaH2PO4) в дистиллированной воде. рН раствора доводят до 7,45 при комнатной температуре с помощью гидроксида натрия (NaOH). Гранулы, полученные в соответствии с предыдущими пунктами, погружают в приготовленный раствор и выдерживают на хорошо прогретой водяной бане (40°С) в течение 30 мин (прототип 1) и соответственно 40 мин (прототип 2). После погружения гранулы промывают 3 раза дистиллированной водой для остановки процесса фазовой трансформации и удаления остатков из буферного раствора. Пористые гранулы сушат при 100°С в сушильном шкафу в течение 2 ч.
Гранулы прототипа 1 и прототипа 2 исследуют с помощью СЭМ при увеличении 3500х.
На фиг. 1А и 1Б из представляющих СЭМ-изображений прототипов 1 и 2 следует, что внешняя поверхность гранул неоднородна и состоит из отдельных (разделенных) скоплений плоских кристаллических пластинок, состоящих из эпитаксически выращенных нанокристаллов ГАП, и гладких участков между кристаллами.
Путем измерения поверхности, занимаемой отдельными кластерами, и гладких участков на СЭМ-изображениях для каждого из прототипов 1 и 2 установлено, что гладкие участки составляют около 70% внешней поверхности для прототипа 1 и около 50% внешней поверхности прототипа 2.
Пример 2. Получение двухфазных костнозамещающих материалов кальция фосфата/гидроксиаппатита (КФ/ГАП) в соответствии с международной патентной заявкой РСТ WO-2019/115704.
1) Получение гранул костнозамещающего материала
Пористые гранулы размером 1-2 мм фазы чистого α-ТКФ получают в соответствии с приведенным выше описанием в примере 1.
Стадию фазовой трансформации и нанесения покрытия проводят в стеклянных колбах, помещенных на водяную баню при температуре 40°С. Буфер для трансформации представляет собой водный раствор дигидрофосфата натрия (NaH2PO4), смешанный с различными пропорциями этанола. Молярность водного раствора дигидрофосфата натрия варьируют от 0,05 М до 0,3 М, а содержание этанола - от 20 до 60 мас. %. рН раствора для трансформации находится в диапазоне от 7,3 до 7,6.
Стеклянные колбы заполняют буфером для трансформации и добавляют гранулы альфα-ТКФ в соотношении от 1:40 до 1:80 (гранулы к раствору для трансформации). Гранулы погружают в трансформирующий раствор при 40°С на период от 24 до 72 ч. После погружения гранулы промывают 5 раз деионизированной водой (соотношение гранул к воде 1:10 по массе) и 2 раза этанолом (соотношение 99,9% гранул к этанолу 1:10 по массе) для прекращения процесса фазовой трансформации и удаления остатков из буферного раствора. Пористые гранулы сушат при 100°С в сушильном шкафу в течение 2 ч.
Морфологию поверхности после нанесения покрытия и процесса фазовой трансформации контролируют с помощью СЭМ.
На фиг. 2 представлены СЭМ-изображения с увеличением 3500х прототипа 3 (20% этанола), прототипа 4 (30% этанола), прототипа 5 (40% этанола), прототипа 6 (50% этанола) и прототипа 7 (60% этанола) костнозамещающих материалов согласно настоящему изобретению. Из сравнения фиг. 1А и 1Б с фиг. 2 видно, что неоднородная внешняя поверхность прототипов 1 и 2 с отдельными скоплениями плоских кристаллических пластин и гладкими участками между ними заменена однородной шероховатой внешней поверхностью без отдельных кристаллических скоплений. Однородная шероховатая внешняя поверхность состоит из переплетенной сети эпитаксиально выращенных пластинок гидроксиапатита. Размеры отдельных пластинок уменьшаются за счет увеличения содержания этанола в растворе для трансформации, что показано с помощью СЭМ, в результате чего снижается шероховатость внешней поверхности.
Фигура 3А представляет СЭМ-изображение поперечного сечения прототипа 5 (этанол 40%, гранулы 1-2 мм) при малом увеличении (1000 х). В правом нижнем углу показана внешняя поверхность гранулы, а центр гранулы расположен ближе к верхнему левому углу.
Фигура 3Б представляет СЭМ-изображение поперечного сечения прототипа 5 (этанол 40%, гранулы 1-2 мм) при большом увеличении (14000 х), где отчетливо видны отдельные плоские кристаллические пластинки, являющиеся строительными блоками грубой поверхности. Нет никакой разницы между грубой внешней поверхностью в центре гранулы и грубой внешней поверхностью на внешней поверхности гранулы.
Анализ распределения пор по размерам с помощью ртутной интрузивной порозиметрии (РИП)
Распределение пор по размерам в гранулах определяют с помощью ртутной интрузивной порозиметрии (РИП). РИП - это стандартный метод для характеристики распределения пор по размерам пористых материалов. Метод хорошо известен в данной области техники и, например, описана в публикации Gregg S. J., Sing K.S.W. в кн.: «Adsorption, Surface Area and Porosity», 2e изд., Academic Press Inc., 1982, 173-190.
На фиг. 6 представлены РИП-диаграммы прототипов 3, 5 и 7 костнозамещающих материалов по настоящему изобретению в сравнении с чистым α-ТКФ (полученных в соответствии с примером 1 и материалом ядра прототипов 3, 5 и 7). Все измерения проводят с гранулами размером 1-2 мм.
Показано, что образец чистого α-ТКФ не имеет пор в диапазоне от 0,03 до 2 мкм из-за его гладкой поверхности. Все костнозамещающие материалы в соответствии с настоящим изобретением содержат поры в диапазоне от 0,03 до 2 мкм из-за пористой природы однородной шероховатой внешней поверхности, которая состоит из переплетенной сети эпитаксически выращенных пластинок гидроксиапатита. Объем пор шероховатой внешней поверхности, соответствующий площади под кривой РИП в диапазоне от 0,03 до 2 мкм, зависит от размеров отдельных пластинок переплетенной сети. Чем крупнее отдельные пластинки, тем больше включенный объем пор взаимосвязанной сети. Таким образом, включенный объем пор взаимосвязанной сети может напрямую коррелировать с шероховатостью поверхности. Чем больше объем пор в диапазоне от 0,03 до 2 мкм на РИП-диаграмме, тем больше шероховатость поверхности. Прототип 3 имеет наибольший объем пор (площадь под кривой) в диапазоне от 0,03 до 2 мкм из показанных прототипов, за ним следуют прототипы 5 и 7. Это подтверждается анализом СЭМ на фиг. 2А-2Д видно, что шероховатость прототипов уменьшается от прототипа 3 к прототипам 5 и 7.
2) Получение непористых дисков костнозамещающего материала
Гранулы фазово-чистого α-ТКФ размером 1-2 мм, полученные, как описано выше в примере 1, измельчают планетарной мельницей в течение 20 ч при 150 об/мин до получения мелкого порошка. Мелкодисперсный порошок засыпают в пресс-форму и уплотняют ручным прессом с нагрузкой 1 тонна. Сырую массу извлекают из формы и переносят в высокотемпературную печь. Печь нагревают до 1450°С, используя скорость нагрева 250°С в час. Эту температуру поддерживают в течение 24 ч, после чего печь охлаждают до 800°С со скоростью охлаждения 500°С в ч, а затем охлаждают до комнатной температуры со скоростью охлаждения 150°С в ч. Объемный спеченный непористый материал (фаза чистого α-Са3(РО4)2) удаляют из печи. Контроль фазовой чистоты проводят с помощью рентгенофазового анализа, а поверхность анализируют с помощью СЭМ. Фазовую трансформацию и нанесение покрытия на подготовленные диски проводят согласно приведенному выше описанию в пункте 1), с той лишь разницей, что весовое соотношение α-ТКФ и раствора для трансформации равно 1 к 3,5.
Таким образом получают прототипы За (20% этанола) и 6а (50% этанола) костнозамещающих материалов согласно настоящему изобретению.
Морфологию поверхности после нанесения покрытия и процесса фазовой трансформации наблюдают с помощью СЭМ. Соответствующие параметры шероховатости определяют с помощью атомно-силовой микроскопии АСМ.
СЭМ-изображения на фиг. 4 подтверждают, что морфология однородной шероховатой внешней поверхности непористых дисков идентична шероховатой внешней поверхности гранул, полученных с соответствующим содержанием этанола из примера 2 пункта 1 (прототипы 3 и 3а и прототипы 6 и 6а).
Атомно-силовая микроскопия (АСМ)
Поверхностные измерения в наномасштабе оценивают с использованием атомно-силовой микроскопии (TT-AFM, АСМ Workshop) в полуконтактном режиме. Анализы АСМ проводят в атмосфере окружающей среды с использованием непористых цилиндрических дисков диаметром 11 мм и высотой 1 мм. Используют резонансную частоту 190 кГц и радиус наконечника до 10 нм. Каждый АСМ-анализ проводят на площади 50 мкм × 50 мкм, и сканируют по три образца из каждой группы. Исходные данные выравнивают по плоскости для устранения наклона путем применения числовой коррекции, а средние значения среднеквадратичной шероховатости (Rq) и средней максимальной высоты профиля (Rz) определяют с использованием программного обеспечения Gwyddion.
Сходные свойства поверхности, например, описаны в US-2013-0045360-A1.
Фиг. 4. Полученные методом АСМ изображения прототипов За (20% этанола, левая сторона) и 6а (50% этанола, правая сторона) непористых дисков, изготовленных согласно изобретению. Полученные методом АСМ показатели шероховатости для прототипов За и 6а представлены табл. 1.
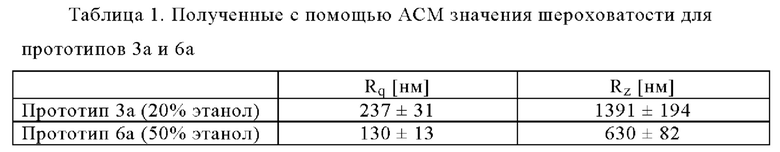
Из табл.1 следует, что среднее значение среднеквадратичной шероховатости (Rq) уменьшилось с 237 нм до 130 нм, а средняя максимальная высота профиля (Rz) уменьшилась с 1391 нм до 630 нм при увеличении содержания этанола с 20% до 50%.
Пример 3. Тест in vitro на остеогенную дифференцировку эмбриональных мезенхимальных стволовых клеток человека (hMSC fetal human mesenchymal stem cell).
Для оценки того, поддерживают ли прототипы костнозамещающего материала, полученные в примерах 1 и 2, остеогенную дифференцировку, берут примерно 200 ООО hMSC, выделенных из бедренной кости плода человека после 22 недель беременности (коммерческий продукт фирмы ScienCell: номер в каталоге 7500, лот 6890), высевают на 320 мг гранул этих прототипов костнозамещающего материала и культивируют в течение трех недель. Первые семь дней культивирования коммерчески доступную среду для размножения hMSC (среда MSCM, номер в каталоге 7501, фирма ScienCell) применяют для оптимальной поддержки клеточной пролиферации. В течение следующих 14 дней среду заменяют на DMEM с добавлением 10% ФСБ и
пенициллина/стрептомицина. Никаких дополнительных остеогенных агентов в среду для культивирования клеток не добавляют.После трех недель культивирования hMSC выделяют суммарную мРНК, ее транскрибируют в кДНК и проводят количественную ПЦР реального времени. Экспрессию гена рассчитывают по методу ДАСТ (см. Livak К. J., Schmittgen Т.ТУ., Methods, 2001, 25, 402-408), используя GAPDH в качестве гена домашнего хозяйства. Экспрессию маркеров остеогенной дифференцировки остеопонтина (OPN) и остеокальцина (OCN) измеряют для всех прототипов костнозамещающих материалов в гранулированной форме (1-2 мм), полученных в примерах 1 и 2.
Эти измерения показывают значительно более высокую экспрессию маркеров остеогенной дифференцировки OPN и OCN для прототипов костнозамещающего материала согласно изобретению из примера 2, чем для прототипов костнозамещающего материала из предшествующего уровня техники из примера 1 (см. фиг. 5А-5Б).
Основываясь на этих результатах in vitro, следует ожидать усиления остеогенной реакции на прототипы костнозамещающего материала по настоящему изобретению in vivo.
Пример 4. Сравнение размера и морфологии нанокристаллов ГАП двухфазного костнозамещающего материала КФ/ГАП по изобретению по международной заявке на патент РСТ WQ-2019/115704 с кристаллами минерала кости человека.
Анализ размера кристаллов выполняют с использованием, как и в ЕР-В1-2445543, уточнения данных дифракции рентгеновских лучей (X-ray diffraction ДРЛ) с применением метода Брэгга на образцах прототипа 3 и на природном минерале кости человека.
См. табл. 2 ниже.

Пример 5. Получение коллагенового матрикса по настоящему изобретению, содержащего частицы костнозамещающего материала КФ/ГАП. содержащего 3,0 мас. % ГАП, согласно международной заявке на патент РСТ WO-2019/115704.
1) Получение быстро рассасывающегося двухфазного костнозамещающего материала КФ/ГАП, содержащего 3.0 мас. % ГАП
Пористые гранулы двухфазного костного заменителя кальция фосфата /гидроксиапатита (КФ/ГАП) размером 0,5-2 мм получают в соответствии с международной патентной заявкой РСТ WO-2019/115704 способом, близким к описанному в примере 2 выше. Буфер для трансформации представляет собой 0,1 М раствор дигидрофосфата натрия (NaH2PO4), содержащий 50% этанола. Содержание ГАП в результате преобразования поверхности, измеренное с помощью ДРЛ, составляет 3,0 мас. %.
2) Получение коллагенового матрикса согласно настоящему изобретению для использования в качестве мастики
Выбранное количество коллагеновых волокон (3 мас. %) диспергируют в деионизированной воде. Источником коллагеновых волокон для производства материала мастики такой же, как и в коммерчески доступном продукте Geistlich Bio-Gide® от фирмы Geistlich Pharma AG. Затем значение рН суспензии доводят 2М раствором соляной кислоты до рН 3,5. После этого суспензию подвергают влажному измельчению с использованием коллоидной мельницы. На следующем этапе гранулы двухфазного костнозамещающего материала КФ/ГАП, полученного на стадии 1) выше, добавляют к суспензии коллагена в соотношении 80 мас. % костного заменителя к 20 мас. % коллагена. Суспензию гомогенизируют после добавления костнозамещающего материала вручную с помощью шпателя. Затем суспензию заливают в металлические формы (23 мм × 23 мм × 6 мм) и затем лиофилизируют (замораживание до -40°С, первичная сушка при -5°С и 300 мкбар в течение 24 ч, вторичная сушка при 20°С и 10 мкбар в течение 11 ч). Лиофилизированный материал стерилизуют рентгеновским излучением.
Прототип мастики с хорошими манипуляционными свойствами получают путем регидратации кровью или изотоническим солевым раствором.
Методика оценки манипуляционных свойств прототипов мастики:
Материалы мастики приводят в контакт с определенным количеством гепаринизированной крови, после чего протокол испытаний включает следующие этапы:
1. Смачивание: пену можно смачивают гепаринизированной кровью в течение 4 мин (без манипуляций).
2. Сдавливание: может быть выдавлено дополнительное количество крови.
3. Липкость: масса мастики не прилипает к перчаткам и инструментам.
4. Сцепленность: мастика является цельной и не распадается.
5. Формуемость: пластичной массе можно легко придать желаемую форму (шар как наиболее оптимальная форма).
6. Сопротивление давлению: материал не смещался в сторону при приложении давления.
3) Получение коллагенового матрикса по настоящему изобретению для использования в качестве полоски или пробки
Лиофилизированный материал, полученный в настоящем примере на стадии 2), подвергают дегидротермической обработке (ДГТО) при 0,1-10 мбар и 80-140°С в течение 12-96 ч. Для получения материала пробки металлические формы на стадии 2) настоящего примера имеют цилиндрическую или коническую форму с диаметром от 8 до 12 мм и глубиной от 8 до 16 мм.
Пример 6. Получение коллагенового матрикса. содержащего смесь частиц костнозамещающего материала КФ/ГАП в соответствии с международной заявкой на патент РСТ WO-2019/115704. содержащих 3.0 мас. % ГАП. и частиц костнозамещающего материала КФ/ГАП в соответствии с ЕР- В1-2445543. содержащих 35 мас. % ГАП.
1) Получение медленно рассасывающегося двухфазного костнозамещающего материала КФ/ГАП по ЕР-В1-2445543. содержащего 35% ГАП.
Пористые гранулы двухфазного костнозамещающего материала фосфата кальция/гидроксиапатита (КФ/ГАП) размером 0,5-2 мм получают методом, описанным в ЕР-В1-2445543. Буфером для трансформации является 0,15М раствор фосфорнокислого натрия однозамещенного (NaH2PO4) с рН 7,45±0,1. Гранулы альфα-ТКФ погружают в раствор для трансформации при 40°С на 24 ч. После трансформации поверхности гранулы промывают и высушивают в сушильном шкафу. Содержание ГАП в результате трансформации поверхности, измеренное с помощью ДРЛ, составляет 35 мас. %.
2) Получение гранулированной смеси, перемешивание быстро рассасывающихся и медленно рассасывающихся частиц двухфазного костнозамещающего материала
Пористые частицы двухфазного костнозамещающего материала КФ/ГАП размером 0,5-2 мм по РСТ WO-2019/115704, содержащие 3,0 мас. % ГАП, приготовленного в разделе 1) примера 5, и пористые частицы размером 0,5-2 мм двухфазного костнозамещающего материала КФ/ГАП по ЕР-В1-2445543, содержащего 35 мас. % ГАП, полученного в этом примере в соответствии с 1), смешивают в соотношении масс 40:60. Гранулированную смесь гомогенизируют в турбулентном шейкере-смесителе.
3) Получение коллагенового матрикса согласно изобретению для применения в качестве мастики.
Выбранное количество коллагеновых волокон продукта Geistlich Bio-Gide® (3 мас. %) диспергируют в деионизированной воде. Затем значение рН суспензии доводят 2М раствором соляной кислоты до рН=3,5. После этого суспензию подвергают влажному измельчению с использованием коллоидной мельницы. На следующем этапе гранулированную смесь двухфазного материала для замещения кости КФ/ГАП, полученную в настоящем примере в пункте 2) выше, добавляют к суспензии коллагена в соотношении 80 мас. % костнозамещающего материала и 20 мас. % коллагена. Суспензию гомогенизируют после добавления вручную с помощью шпателя. Затем суспензию заливают в металлические формы (23 мм × 23 мм × 6 мм) и лиофилизируют (замораживание до -40°С, первичная сушка при -5°С и 300 мкбар в течение 24 ч, вторичная сушка при 20°С и 10 мкбар в течение 11 ч). Затем материал стерилизуют рентгеновским излучением.
4) Получение коллагенового матрикса согласно изобретению для применения в качестве полоски или пробки.
Лиофилизированный материал, полученный на стадии 3) настоящего приведенного выше примера, подвергают дегидротермической обработке (ДГТ) при 0,1-10 мбар и 80-140°С в течение 12-96 ч. Для получения материала для пробки металлические формы на стадии 3) настоящего примера имеют цилиндрическую или коническую форму с диаметром от 8 до 12 мм и глубиной от 8 до 16 мм.
Пример 7. Тестирование пластыря по настоящему изобретению на модели заднебокового спондилодеза кролика (posterolateral spinal fusion - PLF)
Коллагеновый матрикс, полученный в приведенном выше примере 6 на стадии 3), тестируют в качестве мастики на модели PLF кролика, описанной W.R. Walsh с соавт., 2009, Eur. Spine J. 18:1610-1620, по сравнению с мастикой Mastergraft™ (коммерческие двухфазные гранулы фосфата кальция в коллагеновой матрице от фирмы Medtronic) и мастикой Actifuse АВХ (коммерческий Si-замещенный гидр оке и апатит в полоксамерном матриксе фирмы Baxter).
Слитая масса четко видна рентгенологически в случае каждой из этих мастик через 12 недель после имплантации. Паста Mastergraft показывает повышенную скорость разрушения.
См. фиг. 7, где слитая масса отчетливо видна для мастики согласно настоящему изобретению.
Как показано на фиг. 8, частицы двухфазного костнозамещающего материала КФ/ГАП, содержащие 3,0 мас. % ГАП, рассасываются быстрее, чем частицы двухфазного костнозамещающего материала КФ/ГАП, содержащие 35 мас. % ГАП (которые кажутся большими по размеру и более однородными по форме на фиг. 8), обеспечивают объем для врастания новой кости.
Формирование новой кости на месте повреждения можно увидеть на фиг.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОСТНОЗАМЕЩАЮЩИЙ МАТЕРИАЛ | 2018 |
|
RU2800886C2 |
| МАТЕРИАЛ ЗАМЕНИТЕЛЯ КОСТИ | 2011 |
|
RU2591087C2 |
| БИОМИМЕТИЧЕСКИЙ КОЛЛАГЕН-ГИДРОКСИАПАТИТНЫЙ КОМПОЗИТНЫЙ МАТЕРИАЛ | 2014 |
|
RU2662326C2 |
| МАТЕРИАЛ ЗАМЕНИТЕЛЯ КОСТНОЙ ТКАНИ | 2010 |
|
RU2529802C2 |
| ИМПЛАНТАТЫ ДЛЯ ЗАМЕНЫ "НЕСУЩЕЙ НАГРУЗКУ" КОСТИ, ИМЕЮЩИЕ ИЕРАРХИЧЕСКИ ОРГАНИЗОВАННУЮ АРХИТЕКТУРУ, ПОЛУЧЕННЫЕ ПОСРЕДСТВОМ ПРЕВРАЩЕНИЯ РАСТИТЕЛЬНЫХ СТРУКТУР | 2011 |
|
RU2585958C2 |
| Остеопластический материал для замещения дефектов костной ткани | 2024 |
|
RU2824989C1 |
| БИОАКТИВНЫЙ КОМПОЗИЦИОННЫЙ МАТЕРИАЛ ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2617050C1 |
| ТРЕХМЕРНЫЕ МАТРИЦЫ ИЗ СТРУКТУРИРОВАННОГО ПОРИСТОГО МОНЕТИТА ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ И РЕГЕНЕРАЦИИ КОСТИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2491960C9 |
| ГЕМОСТАТИЧЕСКОЕ, РАНОЗАЖИВЛЯЮЩЕЕ И ОСТЕОПЛАСТИЧЕСКОЕ СРЕДСТВО | 1995 |
|
RU2091083C1 |
| МЕДИЦИНСКИЙ КЛЕЙ-БИОИМПЛАНТАТ НОВОГО ПОКОЛЕНИЯ НА ОСНОВЕ БИОПОЛИМЕРНЫХ НАНОКОМПОЗИТОВ В ВИДЕ ПОЛУСИНТЕТИЧЕСКОЙ ПОЛИМЕРНОЙ МАТРИЦЫ С ПРИМЕНЕНИЕМ ЛАЗЕРНЫХ ТЕХНОЛОГИЙ | 2011 |
|
RU2477996C1 |




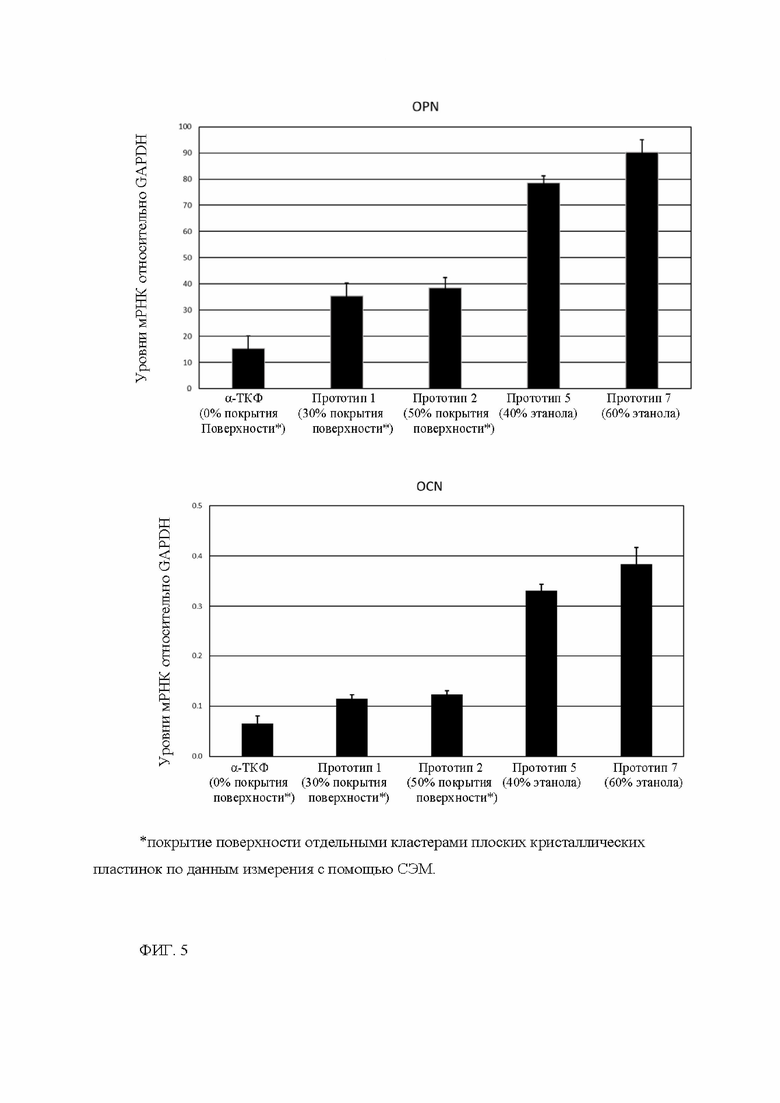
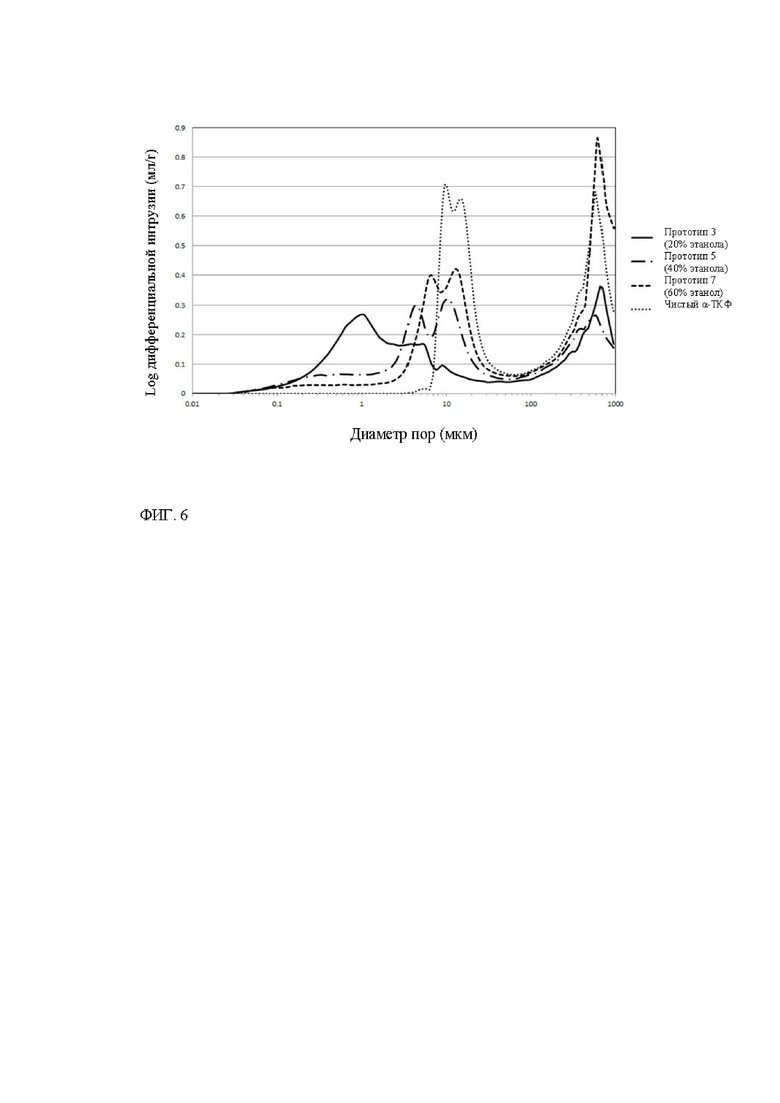
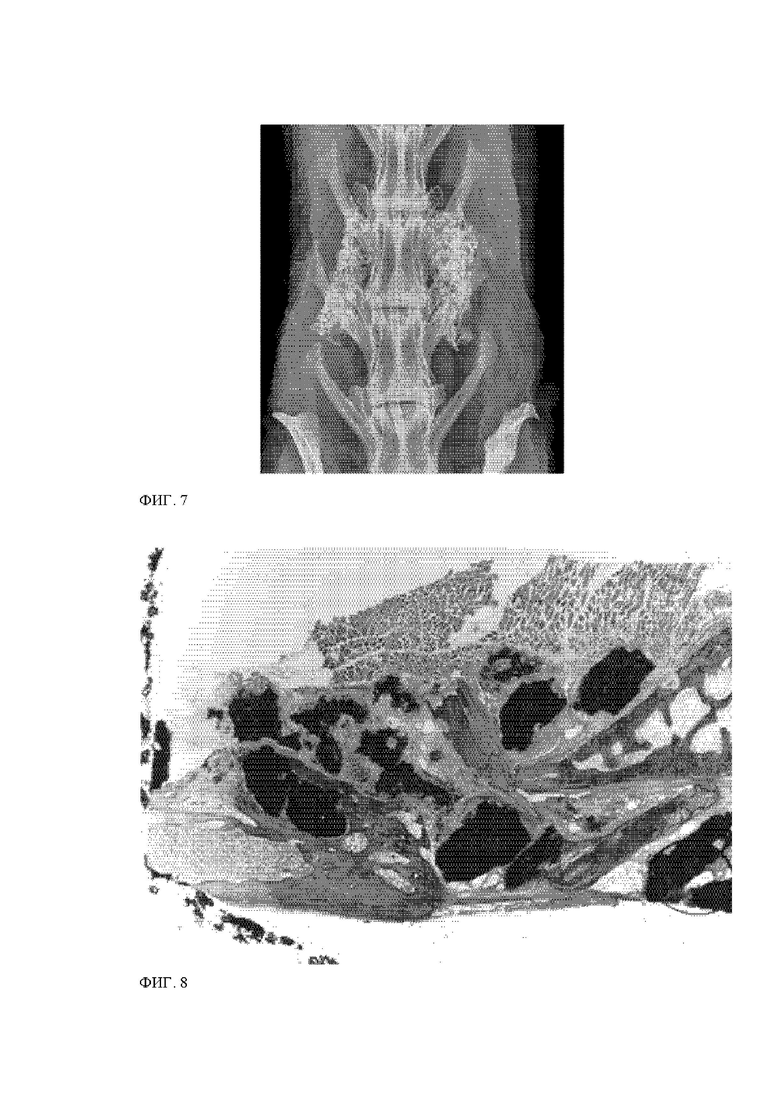
Группа изобретений относится к коллагеновому матриксу для применения в качестве костнозамещающего материала, содержащему коллаген и частицы двухфазного костнозамещающего материала - кальций фосфат/гидроксиапатит (КФ/ГАП), включающего спеченное ядро КФ и замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, в результате чего эпитаксически выращенные нанокристаллы имеют тот же размер и морфологию, что и костный минерал человека, при этом замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, имеет однородную шероховатую внешнюю поверхность, включающую плоские кристаллические пластинки, при этом коллагеновый матрикс содержит 60-97 мас.% костнозамещающего материала и 3-40 мас.% коллагена, также относится к способу получения коллагенового матрикса для применения в качестве мастики, включающему диспергирование коллагеновых волокон нативного коллагена с природными поперечными сшивками в кислом растворе при pH от 2 до 5 таким образом, чтобы получить суспензию коллагена, смешивание и гомогенизацию этой суспензии коллагена с частицами вышеуказанного двухфазного костнозамещающего материала КФ/ГАП, например, для получения суспензии коллагена/КФ/ГАП, сушки вымораживанием и стерилизации этой суспензии с помощью гамма- или рентгеновского облучения или обработки оксидом этилена, при этом коллагеновый матрикс содержит 60-97 мас.% костнозамещающего материала и 3-40 мас.% коллагена, также относится к гранулированной смеси для применения в качестве костнозамещающего материала. Группа изобретений обеспечивает разработку мастики с подходящими обрабатывающими свойствами, содержащую частицы или гранулы костнозамещающего материала КФ/ГАП в коллагеновом матриксе. 3 н. и 14 з.п. ф-лы, 10 ил., 2 табл., 7 пр.
1. Коллагеновый матрикс для применения в качестве костнозамещающего материала, содержащий коллаген и частицы двухфазного костнозамещающего материала - кальций фосфат/гидроксиапатит (КФ/ГАП), включающего спеченное ядро КФ и замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, в результате чего эпитаксически выращенные нанокристаллы имеют тот же размер и морфологию, что и костный минерал человека, при этом замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, имеет однородную шероховатую внешнюю поверхность, включающую плоские кристаллические пластинки, при этом коллагеновый матрикс содержит 60-97 мас.% костнозамещающего материала и 3-40 мас.% коллагена.
2. Коллагеновый матрикс по п. 1, в котором коллаген является коллагеном с природными поперечными сшивками, обработанный кислым раствором.
3. Коллагеновый матрикс по п. 1, в котором коллаген является коллагеном с природными поперечными сшивками, который был физически сшит дегидротермической обработкой (ДГТ) или химически.
4. Коллагеновый матрикс по любому из пп. 1-3, который содержит 75-85 мас.% костнозамещающего материала и 15-25 мас.% коллагена.
5. Коллагеновый матрикс по любому из пп. 1-4, где в двухфазном костнозамещающем материале - кальций фосфат/гидроксиапатит (КФ/ГАП) - шероховатая поверхность включает эпитаксически выращенные нанокристаллические пластинки гидроксиапатита, образующие слитую сеть пластинок размером от 0,2 до 20 мкм, как было определено с помощью сканирующей электронной микроскопии (СЭМ).
6. Коллагеновый матрикс по любому из пп. 1-5, где в двухфазном костнозамещающем материале - кальций фосфат/гидроксиапатит (КФ/ГАП) - однородная шероховатая поверхность включает эпитаксически выращенные нанокристаллические пластинки гидроксиапатита, образующие слитую сеть пластинок с порами размером от 0,03 до 2 мкм, как было определено с помощью ртутной интрузивной порозиметрии.
7. Коллагеновый матрикс по любому из пп. 1-6, где в двухфазном костнозамещающем материале - кальций фосфат/гидроксиапатит (КФ/ГАП) - однородная шероховатая внешняя поверхность характеризуется согласно результату анализа методом атомно-силовой микроскопии (АСМ) среднеквадратичной шероховатостью Rq в диапазоне от 50 до 400 нм и средней максимальной высотой профиля Rz в диапазоне от 500 до 2000 нм.
8. Коллагеновый матрикс по любому из пп. 1-7, где в двухфазном костнозамещающем материале - кальций фосфат/гидроксиапатит (КФ/ГАП) - процент ГАП составляет от 1,0 до 10,0%, как измерено с помощью анализа дифракции рентгеновских лучей (ДРЛ).
9. Коллагеновый матрикс по любому из пп. 1-8, который включает:
- частицы костозамещающего материала КФ/ГАП (А), состоящие из спеченного ядра КФ и замкнутого эпитаксически выращенного слоя нанокристаллического ГАП, осажденного на внешней поверхности спеченного ядра КФ, при этом эпитаксически выращенные нанокристаллы имеют такие же размеры и морфологию, как у костного минерала человека, причем замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденного на внешнюю поверхность спеченного ядра КФ, имеет однородную шероховатую внешнюю поверхность, состоящую из плоских кристаллических пластинок, при этом процент ГАП, измеренный с помощью ДРЛ, составляет от 2,0 до 6,0 %, и
- частицы костнозамещающего материала (Б), выбранного из:
- двухфазного костозамещающего материала КФ/ГАП, состоящего из спеченного ядра КФ и по меньшей мере одного замкнутого эпитаксиально выращенного слоя нанокристаллического ГАП, осажденного на внешней поверхности спеченного ядра КФ, в результате чего эпитаксически выращенные нанокристаллы имеют такой же размер и морфологию, что и минерал кости человека, где процент ГАП, измеренный с помощью ДРЛ, составляет от 10 до 40%, или
- костного минерала, полученного из натуральной кости и сохраняющего по существу первоначальную кристаллическую структуру и минеральную микроструктуру натуральной кости, имеющего при этом содержание органических примесей ниже 150 частей на миллион и содержание белка ниже 135 частей на миллион.
10. Коллагеновый матрикс по п. 9, где
- процент ГАП, согласно измерению с помощью ДРЛ, составляет от 2,0 до 6,0% в частицах костнозамещающего материала КФ/ГАП (А), и
- частицы костнозамещающего материала (Б) являются частицами двухфазного костнозамещающего материала КФ/ГАП, содержащего спеченное ядро КФ и по меньшей мере один замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, в результате чего эпитаксически выращенные нанокристаллы имеют тот же размер и морфологию, что и костный минерал человека, причем процент ГАП, согласно измерению с помощью ДРЛ, составляет от 30 до 40%.
11. Коллагеновый матрикс по п. 9, в котором
- процент ГАП, согласно измерению с помощью ДРЛ, составляет от 2,0 до 6,0% в частицах костнозамещающего материала КФ/ГАП (А), и
- частицы костнозамещающего материала (Б) являются частицами костного минерала, полученного из натуральной кости и в основном сохраняющего первоначальную кристаллическую структуру и минеральную микроструктуру натуральной кости, имеющие при этом содержание органических примесей меньше 150 частей на миллион и содержание белка меньше 135 частей на миллион.
12. Коллагеновый матрикс по любому из пп. 9-11, где соотношение массы частиц костнозамещающего материала КФ/ГАП (А) к массе частиц костнозамещающего материала (Б) составляет от 0,1 до 9,9.
13. Способ получения коллагенового матрикса по любому из пп. 1, 2 и 4-12 для применения в качестве мастики, включающий диспергирование коллагеновых волокон нативного коллагена с природными поперечными сшивками в кислом растворе при pH от 2 до 5 таким образом, чтобы получить суспензию коллагена, смешивание и гомогенизацию этой суспензии коллагена с частицами вышеуказанного двухфазного костнозамещающего материала КФ/ГАП, например, для получения суспензии коллагена/КФ/ГАП, сушки вымораживанием и стерилизации этой суспензии с помощью гамма- или рентгеновского облучения или обработки оксидом этилена, при этом коллагеновый матрикс содержит 60-97 мас.% костнозамещающего материала и 3-40 мас.% коллагена.
14. Гранулированная смесь для применения в качестве костнозамещающего материала, состоящая из:
- частиц двухфазного костнозамещающего материала (КФ/ГАП) (А), включающего спеченное ядро КФ и замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, в результате чего эпитаксически выращенные нанокристаллы имеют тот же размер и морфологию, что и костный минерал человека, при этом замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешней поверхности спеченного ядра КФ, имеет однородную шероховатую внешнюю поверхность, включающую плоские кристаллические пластинки, где процент ГАП согласно данным измерений с помощью ДРЛ составляет от 2,0 до 6,0%, и
- частиц костнозамещающего материала (Б), выбранного из:
- двухфазного костнозамещающего материала КФ/ГАП, содержащего спеченное ядро КФ и по меньшей мере один замкнутый эпитаксически выращенный слой нанокристаллического ГАП, осажденный на внешнюю поверхность спеченного ядра КФ, причем эпитаксически выращенные нанокристаллы имеют тот же размер и морфологию, что и минерал кости человека, при этом процент ГАП согласно данным измерений с помощью ДРЛ составляет от 10 до 40%, или
- костный минерал, полученный из натуральной кости и сохраняющий по существу исходную кристаллическую структуру и минеральную микроструктуру натуральной кости, имеющий при этом содержание органических примесей ниже 150 частей на миллион и содержание белка ниже 135 частей на миллион.
15. Гранулированная смесь по п. 14, где соотношение массы частиц костнозамещающего материала КФ/ГАП (А) к массе частиц костнозамещающего материала (Б) составляет от 0,1 до 9,9.
16. Гранулированная смесь по п. 14, где гранулы имеют диаметр от 250 до 5000 мкм.
17. Коллагеновый матрикс по п. 9, в котором соотношение масс частиц костнозамещающего материала КФ/ГАП (А) и частиц костозамещающего материала (Б) составляет от 0,4 до 1,0.
| US 2013345825 A1, 26.12.2013 | |||
| БИОМИМЕТИЧЕСКИЙ КОЛЛАГЕН-ГИДРОКСИАПАТИТНЫЙ КОМПОЗИТНЫЙ МАТЕРИАЛ | 2014 |
|
RU2662326C2 |
| WO 2018072679 A1, 26.04.2018 | |||
| US 5167961 A, 01.12.1992. | |||
Авторы
Даты
2024-07-04—Публикация
2020-06-12—Подача