ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает преимущество и приоритет заявки на патент Китая № 201910326899.9, поданной 23 апреля 2019 г в Национальное управление интеллектуальной собственности КНР, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
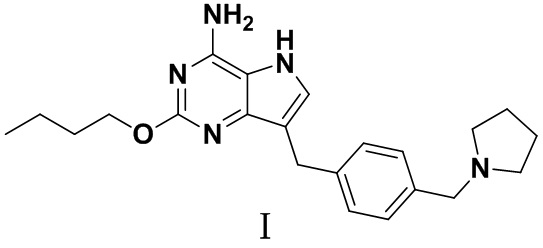
Настоящая заявка относится к области фармацевтической химии и, в частности, относится к твердой фармацевтической композиции, содержащей агонист TLR7, (2-бутокси-7-(4-(пирролидин-1-илметил)бензил)-5H-пирроло[3,2-d]пиримидин-4-амин), способ его получения и медицинское применение.
УРОВЕНЬ ТЕХНИКИ
Толл-подобные рецепторы экспрессируются во множестве иммунных клеток. Толл-подобные рецепторы распознают высококонсервативные структурные мотивы: патоген-ассоциированные молекулярные фрагменты (PAMP), экспрессируемые микробными патогенами, или ассоциированные с повреждениями молекулярные фрагменты (DAMP), высвобождаемые омертвевшими клетками. Толл-подобные рецепторы стимулируются соответствующими PAMP или DAMP для индукции сигнального каскада, что приводит к активации факторов транскрипции, таких как AP-1, NF-κB и фактор регуляции интерферона (функция ответа на импульс). Таким образом, индуцируются различные клеточные реакции, включая выработку интерферонов, провоспалительных цитокинов и эффекторных цитокинов, что способствует иммунному ответу. К настоящему времени у млекопитающих обнаружено 13 толл-подобных рецепторов. Толл-подобные рецепторы 1, 2, 4, 5 и 6 в основном экспрессируются на поверхностях клетки, тогда как толл-подобные рецепторы 3, 7, 8 и 9 экспрессируются в эндосомах. Различные толл-подобные рецепторы могут распознавать лиганды, полученные от разных патогенов. Толл-подобный рецептор 7 (TLR7) в основном экспрессируется в плазмоцитоидных дендритных клетках (pDC) и индуцирует секрецию интерферона альфа (IFN-α) посредством распознавания лиганда. Толл-подобный рецептор 7 (TLR7) и толл-подобный рецептор 8 (TLR8) высоко гомологичны, и, таким образом, лиганды TLR7 во многих случаях являются дополнительными лигандами TLR8. TLR8 стимулируется, чтобы в основном индуцировать продукцию цитокинов, таких как фактор некроза опухоли альфа (TNF-α) и хемокины. Интерферон альфа является одним из основных препаратов, предназначенных для лечения хронического гепатита В или гепатита С, в то время как TNF-α является провоспалительным цитокином, и его чрезмерная секреция может вызывать серьезные побочные эффекты.
В WO2016/023511 описаны определенные соединения, используемые в качестве агониста TLR7. В данной области техники остается потребность в разработке подходящей фармацевтической композиции, содержащей соединение-агонист TLR7.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящая заявка относится к твердой фармацевтической композиции, которая содержит соединение формулы I, разбавитель, связующее, разрыхлитель и смазывающее средство,
 .
.
В одном варианте осуществления разбавитель выбран из группы, состоящей из микрокристаллической целлюлозы, маннита, лактозы, сахарозы, крахмала, прежелатинизированного крахмала, декстрина и их смеси; предпочтительно микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала и их смеси; более предпочтительно микрокристаллической целлюлозы, прежелатинизированного крахмала и их смеси.
В одном варианте осуществления связующее выбрано из группы, состоящей из гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, желатина, поливинилпирролидона, частично гидролизованного крахмала, прежелатинизированного крахмала, глюкозы, полиэтиленгликоля, поливинилового спирта и их смеси; предпочтительно гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы (L-HPC), поливинилпирролидона и их смеси; более предпочтительно гидроксипропилметилцеллюлозы.
В одном варианте осуществления разрыхлитель выбран из группы, состоящей из карбоксиметилкрахмала натрия, сухого крахмала, микрокристаллической целлюлозы, гидроксиэтилметилцеллюлозы, карбоксиметилцеллюлозы натрия, карбоксиметилцеллюлозы кальция, кроскармеллозы натрия, низкозамещенной гидроксипропилметилцеллюлозы или кросповидона, додецилсульфата натрия или додецилсульфата магния и их смеси; предпочтительно карбоксиметилкрахмала натрия, кроскармеллозы натрия и их смеси; более предпочтительно карбоксиметилкрахмала натрия.
В одном варианте осуществления смазывающее средство выбрано из группы, состоящей из стеарата магния, коллоидного диоксида кремния (коллоидный кремнезем), талька, полиэтиленгликоля 4000, полиэтиленгликоля 6000, стеариновой кислоты, стеарилфумарата натрия, додецилсульфата натрия и их смеси; предпочтительно стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия и их смеси; более предпочтительно стеарата магния, коллоидного диоксида кремния и их смеси.
В другом аспекте настоящая заявка дополнительно относится к способу получения твердой фармацевтической композиции, описанной в настоящем документе, который включает способ прямого прессования.
В еще одном аспекте настоящая заявка дополнительно относится к применению твердой фармацевтической композиции, описанной в настоящем документе, для изготовления лекарственного средства, предназначенного для лечения или предупреждения заболевания, ассоциированного с TLR7. В одном варианте осуществления заболевание, ассоциированное с TLR7, выбрано из вирусного инфекционного заболевания. В предпочтительном варианте осуществления вирусное инфекционное заболевание выбрано из группы, состоящей из гепатита B и гепатита C.
ПОДРОБНОЕ ОПИСАНИЕ
Определения и описание
Если не указано иное, используемые в данном документе термины и фразы имеют значения, указанные ниже. Конкретный термин или фраза, если конкретно не указано иное, не следует считать неопределенным или неясным, а следует понимать в соответствии с его общепринятым значением, понятным специалистам в данной области техники. Предполагается, что ссылка на торговое наименование относится к соответствующему ему коммерческому продукту или его активному ингредиенту.
Если конкретно не указано иное или отличное от обычного использования, используемые в данном документе пропорции (включая проценты) или части рассчитываются по массе, например, мас. % или мас. %.
Термин «содержать», «содержит» или «содержащий» или аналогичные слова, синонимичные ему, «включать», «включает» или «включающий», «содержать», «содержит» или «содержащий» и «иметь», «имеет» или «имеющий» и т. п. являются неограниченными и не исключают дополнительных не перечисленных элементов, стадий или компонентов. Фраза «состоящий из» исключает любой элемент, стадию или компонент, которые не указаны. Фраза «состоящий по сути из» относится к тому, что объем ограничен указанными элементами, стадиями или компонентами, а также элементами, стадиями или компонентами, которые необязательно присутствуют и не оказывают существенного влияния на основные и новые характеристики заявленного предмета изобретения. Следует понимать, что термин «содержать», «содержит» или «содержащий» охватывает фразы «состоящий по сути из» и «состоящий из».
Термин «необязательный» или «необязательно» относится к тому, что описанное далее событие или обстоятельство может произойти или не произойти. Описание включает случаи, когда событие или обстоятельство происходит, и случаи, когда событие или обстоятельство не происходит.
В настоящей заявке «один или несколько» или «по меньшей мере один» могут представлять 1, 2, 3, 4, 5, 6, 7, 8, 9 или более. Соответственно, «два или более» могут представлять 2, 3, 4, 5, 6, 7, 8, 9 или более.
В настоящей заявке соединение формулы I включает соединение в форме свободного основания и в форме фармацевтически приемлемой соли. «Фармацевтически приемлемая соль» включает без ограничения соль трифторацетата или соль малеата.
В настоящей заявке содержание соединения формулы I в фармацевтической композиции рассчитывается в форме свободного основания.
Количество «мас. %» определенного ингредиента (включая активное вещество или вспомогательное вещество), описанного в данном документе, относится к процентному массовому содержанию ингредиента в общей массе твердой фармацевтической композиции (где масса соединения формулы I рассчитывается в форме свободного основания). Общая масса твердой фармацевтической композиции не включает массу покрывающего средства.
Способ получения твердой фармацевтической композиции, описанной в данном документе, может осуществляться способами, хорошо известными в данной области техники. Конкретный способ получения может содержать стадии измельчения, смешивания, просеивания, гранулирования, наполнения, таблетирования и т.д. Требуемые стадии и способ или оборудование для реализации конкретных стадий выбраны в соответствии с фактическими условиями. Например, стадия измельчения может выполняться с использованием ступки, шаровой мельницы, валкового пресса, ударной мельницы, молотковой мельницы и/или струйной мельницы; стадия перемешивания может представлять собой перемешивание, перемешивание с измельчением и/или перемешивание с просеиванием; стадия просеивания может осуществляться с использованием механизма для встряхивания сит и/или вибрационного сита. Или ссылаясь на Pharmacy (6-е или 7-е издание, People's Medical Publishing House) под редакцией Cui Fude et al.
Используемое в данном документе «получение смеси» может быть осуществлено посредством одной или нескольких стадий в способе получения твердой фармацевтической композиции. В качестве иллюстрации, например, «получение соединения формулы I, разбавителя, разрыхлителя, связующего и смазывающего средства в виде смеси» может быть осуществлено посредством смешивания всех компонентов на одной стадии или может использоваться многостадийный способ смешивания, при котором сначала смешиваются некоторые компоненты, а затем смешиваются остальные компоненты.
Термин «лечить», «осуществлять лечение» или «лечение» относится к введению соединения или фармацевтической композиции, описанной в данном документе, для облегчения или устранения заболевания или одного или нескольких симптомов, ассоциированных с заболеванием, и включает: (i) ингибирование заболевания или болезненного состояния, т.е. остановка его развития; и (ii) облегчение заболевания или болезненного состояния, т.е. вызывание регрессии заболевания или болезненного состояния.
Термин «предотвращение», «предотвращать» или «осуществлять предотвращение» относится к введению соединения или фармацевтической композиции, описанной в данном документе, для предотвращения заболевания или одного или нескольких симптомов, ассоциированных с заболеванием, и включает: предотвращение возникновения заболевания или болезненного состояние у млекопитающего, особенно когда такое млекопитающее предрасположено к болезненному состоянию, но еще не диагностировано как имеющее его.
Термин «терапевтически эффективное количество» относится к количеству соединения, раскрытого в данном документе, для (i) лечения или предупреждения конкретного заболевания, состояния или нарушения; (ii) смягчения, облегчения или устранения одного или более симптомов конкретного заболевания, состояния или нарушения, или (iii) предупреждения, или замедления начала одного или более симптомов конкретного заболевания, состояния или нарушения, описанных в данном документе. Количество описанного в данном документе соединения, составляющего «терапевтически эффективное количество», варьирует в зависимости от соединения, состояния заболевания и его тяжести, способа введения и возраста млекопитающего, подлежащего лечению, но может быть определено обычным специалистом в данной области техники в соответствии с его знаниями и данным описанием.
Термин «фармацевтически приемлемый» используется в данном документе в отношении тех соединений, материалов, композиций и/или лекарственных форм, которые в пределах объема тщательной медицинской оценки являются подходящими для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений и соизмеримо с приемлемым соотношением польза/риск.
Термин «или их смесь» относится к термину «или смесь двух или более», например, «разбавитель выбран из микрокристаллической целлюлозы, маннита, лактозы, сахарозы, крахмала, прежелатинизированного крахмала, декстрина или их смеси», т.е. «разбавитель выбран из одного или смеси двух или более из микрокристаллической целлюлозы, маннита, лактозы, сахарозы, крахмала, прежелатинизированного крахмала, декстрина».
Используемые в данном документе вспомогательные вещества могут быть определенных типов, обычно используемых в данной области. Например, микрокристаллическая целлюлоза, которую можно использовать, включает без ограничения PH101, PH102, PH103 или PH105. Например, прежелатинизированный крахмал, который можно использовать, включает без ограничения Starch1500, Spress B820 или Unipure WG220. Например, карбоксиметилкрахмал натрия, который можно использовать, включает без ограничения тип A или тип B. Например, гидроксипропилметилцеллюлоза, которую можно использовать, включает без ограничения E3, E5 или E6. Например, коллоидный диоксид кремния (коллоидный кремнезем), который можно использовать, включает без ограничения Pharma 200, AEROSIL 200 или AEROSIL 300. Специалисты в данной области могут либо выбрать конкретный тип по мере необходимости, либо могут выбрать по ссылке на предшествующий уровень техники, такой как Handbook of Pharmaceutical Excipients (6-е издание) под редакцией Raymond C Rowe et al. или Extra Pharmaceutical Necessities (2-е издание) под редакцией Luo Mingsheng et al.
Термин «объемная плотность» относится к объемной плотности упаковки, измеренной после того, как порошок свободно заполняет стандартный контейнер, то есть массе на единицу объема порошка при неплотной упаковке, рассчитанной как масса/объем и представленной в г/мл. Это может быть измерено посредством способов или оборудования, обычно используемых в данной области техники, такого как тестер сыпучести порошка BEP2.
Термин «насыпная плотность» относится к массе на единицу объема порошка после подвергания вибрации и уплотнения, рассчитанной как масса/объем и представленной в г/мл. Это может быть измерено посредством способов или оборудования, обычно используемых в данной области техники, такого как тестер плотности упаковки SOTAX TD1.
Термин «коэффициент Хауснера» относится к соотношению, рассчитанному по насыпной плотности/объемной плотности.
Термин «распределение частиц по размеру» относится к процентному содержанию частиц порошка с различными размерами частиц в общем количестве частиц (распределение массы). Соответствующие параметры распределения частиц по размеру можно измерить с использованием способов или оборудования, обычно используемых в данной области техники, такого как инструмент, представляющий собой вибросито AS200, способ механического просеивания.
Фармацевтическая композиция настоящей заявки
В настоящей заявке предусмотрена твердая фармацевтическая композиция, которая содержит соединение формулы I, разбавитель, связующее, разрыхлитель и смазывающее средство,
 .
.
Соединение формулы I, 2-бутокси-7-(4-(пирролидин-1-илметил)бензил)-5H-пирроло[3,2-d]пиримидин-4-амин, является агонистом TLR7 и может использоваться для лечения или предотвращения вирусных инфекций.
В некоторых вариантах осуществления лекарственная форма твердой фармацевтической композиции может быть выбрана из порошка, гранулы, таблетки, капсулы, пилюли, пеллеты, дисперсионного порошка и порошка для ингаляции, предпочтительно таблетки.
В некоторых вариантах осуществления твердая фармацевтическая композиция может быть получена способом прямого прессования.
В некоторых вариантах осуществления смесь, содержащая соединение формулы I и разбавитель, не подвергается измельчению в способе получения твердой фармацевтической композиции. В некоторых вариантах осуществления смесь, содержащая соединение формулы I и разбавитель, представляющий собой микрокристаллическую целлюлозу или прежелатинизированный крахмал, не подвергается измельчению в способе получения твердой фармацевтической композиции. В некоторых вариантах осуществления смесь, содержащая соединение формулы I и разбавитель, представляющий собой прежелатинизированный крахмал, не подвергается измельчению в способе получения твердой фармацевтической композиции. Описанная в данном документе твердая фармацевтическая композиция может иметь превосходные свойства гомогенности, стабильности и растворения, не подвергаясь такой стадии измельчения.
В некоторых вариантах осуществления твердая фармацевтическая композиция представляет собой фармацевтическую композицию в стандартной дозе. В одном варианте осуществления масса соединения формулы I в композиции на стандартную дозу составляет 0,01-10 мг. В некоторых вариантах осуществления масса соединения формулы I в композиции на стандартную дозу составляет 0,01 мг, 0,02 мг, 0,03 мг, 0,04 мг, 0,05 мг, 0,06 мг, 0,07 мг, 0,08 мг, 0,09 мг, 0,10 мг, 0,20 мг, 0,30 мг, 0,40 мг, 0,50 мг, 0,60 мг, 0,70 мг, 0,80 мг, 0,90 мг, 1,0 мг, 1,5 мг, 2,0 мг, 2,5 мг, 3,0 мг, 3,5 мг, 4,0 мг, 5,0 мг, 6,0 мг, 7,0 мг, 8,0 мг, 9,0 мг или 10,0 мг; или диапазон любых двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления масса соединения формулы I в композиции на стандартную дозу составляет 0,02-8,0 мг, 0,03-6,0 мг, 0,04-4,0 мг или 0,05-2,0 мг.
В некоторых вариантах осуществления количество соединения формулы I в твердой фармацевтической композиции выбрано из 0,01-10 мас. %. В некоторых вариантах осуществления количество соединения формулы I выбрано из группы, состоящей из 0,01 мас. %, 0,02 мас. %, 0,03 мас. %, 0,04 мас. %, 0,05 мас. %, 0,06 мас. %, 0,07 мас. %, 0,08 мас. %, 0,09 мас. %, 0,10 мас. %, 0,15 мас. %, 0,20 мас. %, 0,235 мас. %, 0,25 мас. %, 0,30 мас. %, 0,35 мас. %, 0,40 мас. %, 0,45 мас. %, 0,50 мас. %, 0,55 мас. %, 0,59 мас. %, 0,60 мас. %, 0,65 мас. %, 0,70 мас. %, 0,75 мас. %, 0,80 мас. %, 0,85 мас. %, 0,90 мас. %, 0,95 мас. %, 1,00 мас. %, 1,20 мас. %, 1,40 мас. %, 1,60 мас. %, 1,80 мас. %, 2,00 мас. %, 2,00 мас. %, 2,20 мас. %, 2,35 мас. %, 2,40 мас. %, 2,60 мас. %, 2,80 мас. %, 3,00 мас. %, 3,50 мас. %, 4,00 мас. %, 4,50 мас. %, 5,00 мас. %, 6,00 мас. %, 7,00 мас. %, 8,00 мас. %, 9,00 мас. % и 10 мас. %; и диапазона любых двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления количество соединения формулы I предпочтительно выбрано из 0,02-8,0 мас. %, 0,03-6,0 мас. %, 0,04-4,0 мас. %, 0,05-3,0 мас. %, 0,05-2,6 мас. %, 0,06-3,0 мас. %, 0,06-2,6 мас. % и 0,06-2,4 мас. %. В некоторых вариантах осуществления количество соединения формулы I выбрано из 0,06-2,4 мас. %.
В некоторых вариантах осуществления разбавитель выбран из группы, состоящей из микрокристаллической целлюлозы, маннита, лактозы, сахарозы, крахмала, прежелатинизированного крахмала, декстрина и их смеси; в некоторых вариантах осуществления разбавитель выбран из группы, состоящей из микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала и их смеси; в некоторых вариантах осуществления разбавитель выбран из группы, состоящей из микрокристаллической целлюлозы, прежелатинизированного крахмала и их смеси.
В некоторых вариантах осуществления количество разбавителя выбрано из 50 мас. % или более. В некоторых вариантах осуществления количество разбавителя выбрано из 55 мас. % или более. В некоторых вариантах осуществления количество разбавителя выбрано из 60 мас. % или более. В некоторых вариантах осуществления количество разбавителя выбрано из 65 мас. % или более. В некоторых вариантах осуществления количество разбавителя выбрано из 70 мас. % или более. В некоторых вариантах осуществления количество разбавителя выбрано из 75 мас. % или более. В некоторых вариантах осуществления количество разбавителя выбрано из 80 мас. % или более. В некоторых вариантах осуществления количество разбавителя выбрано из 85 мас. % или более. В некоторых вариантах осуществления количество разбавителя выбрано из группы, состоящей из 50 мас. %, 55 мас. %, 60 мас. %, 65 мас. %, 70 мас. %, 75 мас. %, 80 мас. %, 81 мас. %, 82 мас. %, 83 мас. %, 84 мас. %, 85 мас. %, 86 мас. %, 87 мас. %, 88 мас. %, 89 мас. %, 90 мас. %, 91 мас. %, 92 мас. %, 93 мас. %, 94 мас. %, 95 мас. %, 96 мас. %, 97 мас. % и 98 мас. %; и диапазона любых двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления количество разбавителя выбрано из группы, состоящей из 80-98 мас. %, 81-98 мас. %, 82-98 мас. %, 83-97 мас. %, 84-97 мас. %, 85-97 мас. %, 86-96 мас. %, 87-96 мас. %, и 88-96 мас. %. В некоторых вариантах осуществления количество разбавителя выбрано из 88-96 мас. %.
В некоторых вариантах осуществления разбавитель содержит микрокристаллическую целлюлозу, и количество микрокристаллической целлюлозы выбрано из 30-90 мас. %. В некоторых вариантах осуществления количество микрокристаллической целлюлозы выбрано из группы, состоящей из 30 мас. %, 35 мас. %, 40 мас. %, 42 мас. %, 44 мас. %, 46 мас. %, 48 мас. %, 50 мас. %, 52 мас. %, 54 мас. %, 56 мас. %, 58 мас. %, 60 мас. %, 62 мас. %, 64 мас. %, 66 мас. %, 68 мас. %, 70 мас. %, 71 мас. %, 72 мас. %, 73 мас. %, 74 мас. %, 76 мас. %, 78 мас. %, 80 мас. %, 85 мас. % и 90 мас. %; и диапазона любых двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления количество микрокристаллической целлюлозы выбрано из группы, состоящей из 40-90 мас. %, 46-90 мас. %, 50-85 мас. %, 56-85 мас. %, 60-80 мас. %, 62-78 мас. %, 64-76 мас. % и 66-74 мас. %. В некоторых вариантах осуществления количество микрокристаллической целлюлозы выбрано из 66-74 мас. %.
В некоторых вариантах осуществления разбавитель включает прежелатинизированный крахмал, и количество прежелатинизированного крахмала выбрано из 5-35 мас. %. В некоторых вариантах осуществления количество прежелатинизированного крахмала выбрано из группы, состоящей из 5 мас. %, 8 мас. %, 10 мас. %, 11 мас. %, 12 мас. %, 13 мас. %, 14 мас. %, 15 мас. %, 16 мас. %, 17 мас. %, 18 мас. %, 19 мас. %, 20 мас. %, 21 мас. %, 22 мас. %, 23 мас. %, 24 мас. %, 25 мас. %, 26 мас. %, 27 мас. %, 28 мас. % , 29 мас. %, 30 мас. %, 32 мас. % и 35 мас. %; и диапазона двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления количество прежелатинизированного крахмала выбрано из группы, состоящей из 8-32 мас. %, 10-30 мас. %, 11-29 мас. %, 12-28 мас. %, 13-27 мас. %, 14-26 мас. %, 15-25 мас. %, 16-24 мас. %, 17-23 мас. % и 18-23 мас. %. В некоторых вариантах осуществления количество прежелатинизированного крахмала выбрано из 18-23 мас. %.
В некоторых вариантах осуществления разбавитель представляет собой микрокристаллическую целлюлозу и прежелатинизированный крахмал. Общее количество микрокристаллической целлюлозы и прежелатинизированного крахмала является таким, как описано выше для количества разбавителя, например, 50 мас. % или более, и другие диапазоны или значения точек. Количество как микрокристаллической целлюлозы, так и прежелатинизированного крахмала является таким, как описано выше, например, 30-90 мас. % микрокристаллической целлюлозы, 5-35 мас. % прежелатинизированного крахмала и другие диапазоны или значения точек соответственно.
В некоторых вариантах осуществления разрыхлитель выбран из группы, состоящей из карбоксиметилкрахмала натрия, сухого крахмала, гидроксиэтилметилцеллюлозы, карбоксиметилцеллюлозы натрия, карбоксиметилцеллюлозы кальция, кроскармеллозы натрия, низкозамещенной гидроксипропилметилцеллюлозы, кросповидона, додецилсульфата натрия, додецилсульфата магния и их смеси. В некоторых вариантах осуществления разрыхлитель выбран из группы, состоящей из карбоксиметилкрахмала натрия, кроскармеллозы натрия и их смеси. В некоторых вариантах осуществления разрыхлитель представляет собой карбоксиметилкрахмал натрия.
В некоторых вариантах осуществления количество разрыхлителя выбрано из 1,0-7,0 мас. %. В некоторых вариантах осуществления количество разрыхлителя выбрано из группы, состоящей из 1,0 мас. %, 1,2 мас. %, 1,4 мас. %, 1,6 мас. %, 1,8 мас. %, 2,0 мас. %, 2,2 мас. %, 2,4 мас. %, 2,6 мас. %, 2,8 мас. %, 3,0 мас. %, 3,2 мас. %, 3,4 мас. %, 3,6 мас. %, 3,8 мас. %, 4,0 мас. %, 4,2 мас. %, 4,4 мас. %, 4,6 мас. %, 4,8 мас. %, 5,0 мас. %, 5,2 мас. %, 5,4 мас. %, 5,6 мас. %, 5,8 мас. %, 6,0 мас. %, 6,2 мас. %, 6,4 мас. %, 6,6 мас. %, 6,8 мас. % и 7,0 мас. %; и диапазона двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления количество разрыхлителя выбрано из группы, состоящей из 1,2-6,8 мас. %, 1,4-6,6 мас. %, 1,6-6,4 мас. %, 1,8-6,2 мас. %, 2,0-6,0 мас. %, 2,2-5,8 мас. %, 2,4-5,6 мас. %, 2,6-5,4 мас. %, 2,8-5,2 мас. %, 3,0-5,0 мас. %, 3,2-4,8 мас. %, 3,4-4,6 мас. %, 3,6-4,4 мас. % и 3,8-4,2 мас. %. В некоторых вариантах осуществления количество разрыхлителя составляет 3,8-4,2 мас. %.
В некоторых вариантах осуществления связующее выбрано из группы, состоящей из гидроксипропилметилцеллюлозы (HPMC), карбоксиметилцеллюлозы (CMC), карбоксиметилцеллюлозы натрия (CMC-Na), этилцеллюлозы (EC), метилцеллюлозы (MC), гидроксипропилцеллюлозы (HPC), низкозамещенной гидроксипропилцеллюлозы (L-HPC), желатина, поливинилпирролидона (PVP), частично гидролизованного крахмала, прежелатинизированного крахмала, глюкозы, полиэтиленгликоля (PEG), поливинилового спирта и их смеси; в некоторых вариантах осуществления связующее выбрано из группы, состоящей из гидроксипропилметилцеллюлозы (HPMC), карбоксиметилцеллюлозы (CMC), карбоксиметилцеллюлозы натрия (CMC-Na), этилцеллюлозы (EC), метилцеллюлозы (MC), гидроксипропилцеллюлозы (HPC), низкозамещенной гидроксипропилцеллюлозы (L-HPC), поливинилпирролидона и их смеси; в некоторых вариантах осуществления связующее представляет собой гидроксипропилметилцеллюлозу.
В некоторых вариантах осуществления количество связующего выбрано от 0,1-5 мас. %. В некоторых вариантах осуществления количество связующего выбрано из группы, состоящей из 0,1 мас. %, 0,2 мас. %, 0,3 мас. %, 0,4 мас. %, 0,5 мас. %, 0,6 мас. %, 0,7 мас. %, 0,8 мас. %, 0,9 мас. %, 1,0 мас. %, 1,1 мас. %, 1,2 мас. %, 1,3 мас. %, 1,4 мас. %, 1,5 мас. %, 1,6 мас. %, 1,7 мас. %, 1,8 мас. %, 1,9 мас. %, 2,0 мас. %, 2,1 мас. %, 2,2 мас. %, 2,3 мас. %, 2,4 мас. %, 2,5 мас. %, 2,6 мас. %, 2,7 мас. %, 2,8 мас. %, 2,9 мас. %, 3,0 мас. %, 3,2 мас. %, 3,4 мас. %, 3,6 мас. %, 3,8 мас. %, 4,0 мас. %, 4,2 мас. %, 4,4 мас. %, 4,6 мас. %, 4,8 мас. % и 5,0 мас. %; и диапазона двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления количество связующего выбрано из группы, состоящей из 0,1-3,0 мас. %, 0,1-2,8 мас. %, 0,1-2,6 мас. %, 0,1-2,4 мас. %, 0,1-2,2 мас. %, 0,1-2,0 мас. %, 0,2-3,0 мас. %, 0,2-2,8 мас. %, 0,2-2,6 мас. %, 0,2-2,4 мас. %, 0,2-2,2 мас. %, 0,2-2,0 мас. %, 0,2-1,9 мас. %, 0,3-1,8 мас. %, 0,4-1,7 мас. %, 0,5-1,6 мас. %, 0,6-1,5 мас. %, 0,7-1,4 мас. % и 0,8-1,2 мас. %. В некоторых вариантах осуществления количество связующего составляет 0,8-1,2 мас. %.
В некоторых вариантах осуществления смазывающее средство выбрано из группы, состоящей из стеарата магния, коллоидного диоксида кремния, талька, полиэтиленгликоля 4000, полиэтиленгликоля 6000, стеариновой кислоты, стеарилфумарата натрия, додецилсульфата натрия и их смеси. В некоторых вариантах осуществления смазывающее средство выбрано из группы, состоящей из стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия и их смеси. В некоторых вариантах осуществления смазывающее средство выбрано из группы, состоящей из стеарата магния, коллоидного диоксида кремния и их смеси.
В некоторых вариантах осуществления количество смазывающего средства выбрано из 0,1-5 мас. %. В некоторых вариантах осуществления количество смазывающего вещества выбрано из группы, состоящей из 0,1 мас. %, 0,2 мас. %, 0,3 мас. %, 0,4 мас. %, 0,5 мас. %, 0,6 мас. %, 0,7 мас. %, 0,8 мас. %, 0,9 мас. %, 1,0 мас. %, 1,1 мас. %, 1,2 мас. %, 1,3 мас. %, 1,4 мас. %, 1,5 мас. %, 1,6 мас. %, 1,7 мас. %, 1,8 мас. %, 1,9 мас. %, 2,0 мас. %, 2,1 мас. %, 2,2 мас. %, 2,3 мас. %, 2,4 мас. %, 2,5 мас. %, 2,6 мас. %, 2,7 мас. %, 2,8 мас. %, 2,9 мас. %, 3,0 мас. %, 3,2 мас. %, 3,4 мас. %, 3,6 мас. %, 3,8 мас. %, 4,0 мас. %, 4,2 мас. %, 4,4 мас. %, 4,6 мас. %, 4,8 мас. % и 5,0 мас. %; и диапазона двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления количество смазывающего средства выбрано из группы, состоящей из 0,1-3,0 мас. %, 0,1-2,8 мас. %, 0,1-2,6 мас. %, 0,1-2,4 мас. %, 0,1-2,2 мас. %, 0,1-2,0 мас. %, 0,2-3,0 мас. %, 0,2-2,8 мас. %, 0,2-2,6 мас. %, 0,2-2,4 мас. %, 0,2-2,2 мас. %, 0,2-2,0 мас. %, 0,2-1,9 мас. %, 0,3-1,8 мас. %, 0,4-1,7 мас. %, 0,5-1,6 мас. %, 0,6-1,5 мас. %, 0,7-1,4 мас. %, 0,8-1,2 мас. % и 0,9-1,1 мас. %. В некоторых вариантах осуществления количество смазывающего вещества составляет 0,8-1,2 мас. %.
В некоторых вариантах осуществления смазывающее средство содержит коллоидный диоксид кремния, и количество коллоидного диоксида кремния выбрано из 0,05-3,0 мас. %. В некоторых вариантах осуществления количество коллоидного диоксида кремния выбрано из группы, состоящей из 0,05 мас. %, 0,06 мас. %, 0,07 мас. %, 0,08 мас. %, 0,09 мас. %, 0,10 мас. %, 0,15 мас. %, 0,20 мас. %, 0,25 мас. %, 0,30 мас. %, 0,35 мас. %, 0,40 мас. %, 0,45 мас. %, 0,50 мас. %, 0,55 мас. %, 0,60 мас. %, 0,65 мас. %, 0,70 мас. %, 0,75 мас. %, 0,80 мас. %, 0,85 мас. %, 0,90 мас. %, 0,95 мас. %, 1,0 мас. %, 1,1 мас. %, 1,2 мас. %, 1,3 мас. %, 1,4 мас. %, 1,5 мас. %, 1,6 мас. %, 1,7 мас. %, 1,8 мас. %, 1,9 мас. %, 2,0 мас. %, 2,2 мас. %, 2,4 мас. %, 2,6 мас. %, 2,8 мас. % и 3,0 мас. %, и диапазона двух из вышеперечисленных точек значений в качестве конечных. В некоторых вариантах осуществления количество коллоидного диоксида кремния выбрано из группы, состоящей из 0,05-2,6 мас. %, 0,05-2,2 мас. %, 0,05-1,9 мас. %, 0,05-1,8 мас. %, 0,06-1,7 мас. %, 0,06-1,6 мас. %, 0,07-1,5 мас. %, 0,07-1,4 мас. %, 0,08-1,3 мас. %, 0,08-1,2 мас. %, 0,09-1,1 мас. %, 0,09-1,0 мас. %, 0,10-0,90 мас. %, 0,15-0,85 мас. %, 0,20-0,80 мас. %, 0,25-0,75 мас. %, 0,30-0,70 мас. %, 0,35-0,65 мас. %, 0,40-0,60 мас. % и 0,45-0,55 мас. %. В некоторых вариантах осуществления количество коллоидного диоксида кремния составляет 0,45-0,55 мас. %.
В некоторых вариантах осуществления смазывающее средство содержит стеарат магния, и количество стеарата магния выбрано из 0,05-3,0 мас. %. В некоторых вариантах осуществления количество стеарата магния выбрано из группы, состоящей из 0,05 мас. %, 0,06 мас. %, 0,07 мас. %, 0,08 мас. %, 0,09 мас. %, 0,10 мас. %, 0,15 мас. %, 0,20 мас. %, 0,25 мас. %, 0,30 мас. %, 0,35 мас. %, 0,40 мас. %, 0,45 мас. %, 0,50 мас. %, 0,55 мас. %, 0,60 мас. %, 0,65 мас. %, 0,70 мас. %, 0,75 мас. %, 0,80 мас. %, 0,85 мас. %, 0,90 мас. %, 0,95 мас. %, 1,0 мас. %, 1,1 мас. %, 1,2 мас. %, 1,3 мас. %, 1,4 мас. %, 1,5 мас. %, 1,6 мас. %, 1,7 мас. %, 1,8 мас. %, 1,9 мас. %, 2,0 мас. %, 2,2 мас. %, 2,4 мас. %, 2,6 мас. %, 2,8 мас. % и 3,0 мас. %, и диапазона двух из вышеперечисленных точек значений в качестве конечных. В некоторых вариантах осуществления количество стеарата магния выбрано из группы, состоящей из 0,05-2,6 мас. %, 0,05-2,2 мас. %, 0,05-1,9 мас. %, 0,05-1,8 мас. %, 0,06-1,7 мас. %, 0,06-1,6 мас. %, 0,07-1,5 мас. %, 0,07-1,4 мас. %, 0,08-1,3 мас. %, 0,08-1,2 мас. %, 0,09-1,1 мас. %, 0,09-1,0 мас. %, 0,10-0,90 мас. %, 0,15-0,85 мас. %, 0,20-0,80 мас. %, 0,25-0,75 мас. %, 0,30-0,70 мас. %, 0,35-0,65 мас. %, 0,40-0,60 мас. % и 0,45-0,55 мас. %. В некоторых вариантах осуществления количество стеарата магния составляет 0,45-0,55 мас. %.
В некоторых вариантах осуществления смазывающее средство представляет собой коллоидный диоксид кремния и стеарат магния. Общее количество коллоидного диоксида кремния и стеарата магния такое же, как описано выше для количества смазывающего средства, например, 0,1-5 мас. %, и другие диапазоны или значения точек. Количество как коллоидного диоксида кремния, так и стеарата магния является таким, как описано выше, например 0,05-3,0 мас. % коллоидного диоксида кремния, 0,05-3,0 мас. % стеарата магния и другие диапазоны или значения соответственно.
Микромеритические параметры
В некоторых вариантах осуществления объемная плотность твердой фармацевтической композиции, описанной в данном документе, составляет ≤ 0,50 г/мл, ≤ 0,49 г/мл, ≤ 0,48 г/мл, ≤ 0,47 г/мл, ≤ 0,46 г/мл, ≤ 0,45 г/мл или ≤ 0,44 г/мл. В некоторых конкретных вариантах осуществления объемная плотность твердой фармацевтической композиции, описанной в данном документе, составляет 0,30-0,50 г/мл. В некоторых вариантах осуществления объемная плотность твердой фармацевтической композиции, описанной в данном документе, составляет 0,30 г/мл, 0,31 г/мл, 0,32 г/мл, 0,33 г/мл, 0,34 г/мл, 0,35 г/мл, 0,36 г/мл, 0,37 г/мл, 0,38 г/мл, 0,39 г/мл, 0,40 г/мл, 0,41 г/мл, 0,42 г/мл, 0,43 г/мл, 0,44 г/мл, 0,45 г/мл, 0,46 г/мл, 0,47 г/мл, 0,48 г/мл, 0,49 г/мл или 0,50 г/мл; или диапазон любых двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления объемная плотность твердой фармацевтической композиции, описанной в данном документе, составляет 0,40 г/мл-0,50 г/мл, 0,41 г/мл-0,49 г/мл, 0,42 г/мл-0,48 г/мл, 0,43 г/мл- 0,47 г/мл или 0,44 г/мл-0,46 г/мл.
В некоторых вариантах осуществления насыпная плотность твердой фармацевтической композиции, описанной в данном документе, составляет ≤ 0,65 г/мл, ≤ 0,64 г/мл, ≤ 0,63 г/мл, ≤ 0,62 г/мл, ≤ 0,61 г/мл, ≤ 0,60 г/мл или ≤ 0,59 г/мл. В некоторых вариантах осуществления насыпная плотность твердой фармацевтической композиции, описанной в данном документе, составляет 0,50-0,65 г/мл. В некоторых вариантах осуществления насыпная плотность твердой фармацевтической композиции, описанной в данном документе, составляет 0,50 г/мл, 0,51 г/мл, 0,52 г/мл, 0,53 г/мл, 0,54 г/мл, 0,55 г/мл, 0,56 г/мл, 0,57 г/мл, 0,58 г/мл, 0,59 г/мл, 0,60 г/мл, 0,61 г/мл, 0,62 г/мл, 0,63 г/мл, 0,64 г/мл или 0,65 г/мл; или диапазон любых двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления насыпная плотность твердой фармацевтической композиции, описанной в данном документе, составляет 0,52-0,64 г/мл, 0,54-0,63 г/мл, 0,56-0,62 г/мл или 0,58-0,61 г/мл.
В некоторых вариантах осуществления коэффициент Хауснера твердой фармацевтической композиции, описанной в данном документе, составляет 1,31-1,40. В некоторых вариантах осуществления коэффициент Хауснера твердой фармацевтической композиции, описанной в данном документе, составляет 1,31, 1,32, 1,33, 1,34, 1,35, 1,36, 1,37, 1,38, 1,39 или 1,40; или диапазон любых двух из вышеперечисленных значений в качестве конечных точек. В некоторых вариантах осуществления коэффициент Хауснера твердой фармацевтической композиции, описанной в данном документе, составляет 1,31-1,38, 1,32-1,37, 1,32-1,36, 1,33-1,36 или 1,33-1,35.
Распределение частиц по размеру
Описанная в данном документе твердая фармацевтическая композиция отличается распределением частиц по размеру. Размер частиц в твердой фармацевтической композиции, описанной в данном документе, в основном распределяется в диапазоне менее 75 мкм. В некоторых вариантах осуществления ≥ 50%, ≥ 51%, ≥ 52%, ≥ 53%, ≥ 55%, ≥ 55%, ≥ 56%, ≥ 57%, ≥ 58%, ≥ 59%, ≥ 60%, ≥ 61%, ≥ 62%, ≥ 63%, ≥ 66%, ≥ 65%, ≥ 66%, ≥ 67% или ≥ 68% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер менее 75 мкм. В некоторых вариантах осуществления 50-80% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер менее 75 мкм. В некоторых вариантах осуществления 50%, 51%, 52%, 53%, 55%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 66%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 77%, 75%, 77%, 77%, 78%, 79% или 80% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер менее 75 мкм.; или частиц, количество которых находится в диапазоне любых двух из вышеперечисленных значений в качестве конечных точек, имеют размер менее 75 мкм. В некоторых вариантах осуществления 56-80%, 58-78%, 60-76%, 62-74%, 64-72% или 66-70% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер менее 75 мкм. Вышеупомянутое соотношение представляет собой распределение массы (то есть по массе).
В некоторых вариантах осуществления 24-40% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер менее 75-150 мкм. В некоторых вариантах осуществления 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39% или 40% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер 75-150 мкм; или частицы, количество которых находится в диапазоне любых двух из вышеперечисленных значений в качестве конечных точек, имеют размер 75-150 мкм. В некоторых вариантах осуществления 24-40%, 25-38%, 26-36%, 27-34% или 28-32% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер 75-150 мкм. Вышеупомянутое соотношение представляет собой распределение массы (то есть по массе).
Только небольшое количество частиц в фармацевтической композиции, описанной в данном документе, имеет размер более 150 мкм. В некоторых вариантах осуществления, ≤ 10%, ≤ 9%, ≤ 8%, ≤ 7%, ≤ 6%, ≤ 5%, ≤ 4%, ≤ 3%, ≤ 2% или ≤ 1% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер более 150 мкм. В некоторых вариантах осуществления 0,1-10% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер более 150 мкм. В некоторых вариантах осуществления 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,1%, 1,2%, 1,3%, 1,4%, 1,5%, 1,6%, 1,7%, 1,8%, 1,9%, 2,0%, 2,1%, 2,2%, 2,3%, 2,4%, 2,5%, 2,6%, 2,7%, 2,8%, 2,9%, 3,0%, 3,2%, 3,4%, 3,6%, 3,8%, 4,0%, 4,2%, 4,4%, 4,6%, 4,8%, 5,0%, 5,2%, 5,4%, 5,6%, 5,8%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0 %, 8,5%, 9,0%, 9,5% или 10% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер более 150 мкм, или частицы, количество которых находится в диапазоне любых двух из вышеуказанных значений, в качестве конечных точек имеют размер более 150 мкм. В некоторых вариантах осуществления 0,1-5,0%, 0,1-4,8%, 0,2-4,6%, 0,2-4,4%, 0,3-4,2%, 0,3-4,0%, 0,4-3,8%, 0,4-3,6%, 0,5-3,4%, 0,5-3,2%, 0,6-3,0%, 0,7-2,8%, 0,8-2,6%, 0,9-2,4%, 1,0-2,2%, 1,2-2,0% или 1,4-1,8% частиц в твердой фармацевтической композиции, описанной в данном документе, имеют размер более 150 мкм. Вышеупомянутое соотношение представляет собой распределение массы (то есть по массе).
Специалистам в данной области техники также будет понятно, что в дополнение к соединению формулы I, описанному выше в качестве активного ингредиента, вместе с разбавителем, связующим, разрыхлителем и смазывающим средством, другие фармацевтически приемлемые вспомогательные вещества или добавки могут быть включены в фармацевтическую композицию, описанную в данном документе как необходимо, такие как без ограничения антиоксиданты, консерванты, красители и ароматизаторы, выбор и количество которых могут быть скорректированы специалистами в данной области техники в соответствии с фактическими потребностями.
Описанные в данном документе фармацевтические композиции имеют высокую чистоту (т.е. низкое содержание примесей). В одном варианте осуществления описанная в данном документе фармацевтическая композиция имеет общее содержание примесей 0,5% или меньше, предпочтительно 0,45% или меньше, более предпочтительно 0,4% или меньше и, в частности, предпочтительно 0,3% или меньше.
Описанная в данном документе фармацевтическая композиция имеет превосходную стабильность. В одном варианте осуществления описанная в данном документе фармацевтическая композиция имеет общее содержание примесей 1,2% или меньше, предпочтительно 1,1% или меньше, более предпочтительно 1% или меньше, например, 0,9% или меньше, 0,8% или меньше, 0,7% или меньше, 0,6% или меньше, 0,5% или меньше, 0,4% или меньше, при условиях ускоренных испытаний в течение 6 месяцев (40°C ± 2°C, относительная влажность 75% ± 5%).
Описанная в данном документе фармацевтическая композиция имеет превосходные свойства растворения. В одном варианте осуществления описанная в данном документе фармацевтическая композиция может характеризоваться степенью растворения, составляющей 90% или выше, через 20 мин.
Описанная в данном документе фармацевтическая композиция имеет превосходную гомогенность при смешивании, причем ее гомогенность соответствует предельным требованиям (A + 2,2S ≤ 15,0, см. примеры) и намного ниже верхнего предела требований.
Способы получения
В другом аспекте в настоящей заявке предусмотрен способ получения твердой фармацевтической композиции на основе соединения формулы I, описанного в данном документе, который включает способ прямого прессования.
В одном варианте осуществления способ получения твердой фармацевтической композиции на основе соединения формулы I, описанного в данном документе, включает:
1) смешивание соединения формулы I с частью или со всем разбавителем и необязательно присутствующим по меньшей мере одним из связующего, разрыхлителя и смазывающего средства;
2) смешивание полученной смеси, полученной на стадии 1), с остальной частью разбавителя и остальной частью по меньшей мере одного из связующего, разрыхлителя и смазывающего средства;
необязательно 3) смешивание полученной смеси, полученной на стадии 2), с остальной частью вспомогательных веществ и
4) таблетирование полученной смеси, полученной на стадии 2) или стадии 3).
Выбор и количества соединения формулы I и вспомогательных веществ, таких как разбавитель, связующее, разрыхлитель и смазывающее вещество, используемых в способе, являются такими, как описано выше.
Специалистам в данной области будет понятно, что если весь разбавитель используется на стадии 1), то на стадии 2) не требуется использовать оставшийся разбавитель.
В одном варианте осуществления разбавитель, связующее, разрыхлитель и смазывающее средство могут быть добавлены независимо порциями или сразу для смешивания. Когда вспомогательные вещества, такие как разбавитель, связующее, разрыхлитель и смазывающее средство, добавляют частями, пропорция добавляемых по частям вспомогательных веществ может быть определена специалистами в данной области по мере необходимости.
Описанный в данном документе способ получения может быть осуществлен прямым прессованием без использования (сухой) грануляции.
Твердая фармацевтическая композиция, полученная с использованием описанного в данном документе способа получения, может иметь превосходные свойства гомогенности, стабильности и растворения.
В иллюстративном варианте осуществления способ получения, описанный в данном документе, или способ прямого прессования может включать: 1) подготовка соединения формулы I, разбавителя, разрыхлителя, связующего и смазывающего средства в смеси и 2) таблетирование. В некоторых вариантах осуществления способ прессования включает: 1) подготовка соединения формулы I, разбавителя, разрыхлителя и связующего в смеси; 2) подготовка смеси, полученной на стадии 1), и смазывающего средства в смеси и 3) таблетирование. В другом варианте осуществления способ прямого прессования включает: 1) подготовка соединения формулы I и части разбавителя в смеси; 2) подготовка полученной смеси, полученной на стадии 1), и остального разбавителя, разрыхлителя и связующего средства в смеси; 3) подготовка смеси, полученной на стадии 2), и смазывающего средства в смеси и 4) таблетирование. В альтернативном варианте осуществления способ прямого прессования включает: 1) подготовка соединения формулы I и части разбавителя в смеси; 2) подготовка полученной смеси, полученной на стадии 1), и остального разбавителя, разрыхлителя и связующего средства в смеси; 3) подготовка полученной смеси, полученной на стадии 2), и части смазывающего средства в смеси; 4) подготовка смеси, полученной на стадии 3), и остального смазывающего средства в смеси и 5) таблетирование. В других вариантах осуществления способ прямого прессования включает: 1) подготовка соединения формулы I и разбавителя в смеси; 2) подготовка полученной смеси, полученной на стадии 1), и разрыхлителя и связующего средства в смеси; 3) подготовка смеси, полученной на стадии 2), и смазывающего средства в смеси и 4) таблетирование. В других вариантах осуществления способ прямого прессования включает: 1) подготовка соединения формулы I и разбавителя в смеси; 2) подготовка полученной смеси, полученной на стадии 1), и разрыхлителя и связующего средства в смеси; 3) подготовка полученной смеси, полученной на стадии 2), и части смазывающего средства в смеси; 4) подготовка смеси, полученной на стадии 3), и остального смазывающего средства в смеси и 5) таблетирование. Активный ингредиент и вспомогательные вещества добавляются в соответствии с требуемой пропорцией фармацевтической композиции. Когда вспомогательные вещества добавляют порциями, пропорция добавляемых вспомогательных веществ может быть определена специалистами в данной области техники по мере необходимости.
В некоторых вариантах осуществления смесь, содержащая соединение формулы I и разбавитель, не подвергается измельчению в способе получения твердой фармацевтической композиции на основе соединения формулы I. В некоторых вариантах осуществления смесь, содержащая соединение формулы I и разбавитель, представляющий собой микрокристаллическую целлюлозу или прежелатинизированный крахмал, не подвергается измельчению в способе получения твердой фармацевтической композиции на основе соединения формулы I. В некоторых вариантах осуществления смесь, содержащая соединение формулы I и разбавитель, представляющий собой прежелатинизированный крахмал, не подвергается измельчению в способе получения твердой фармацевтической композиции соединения формулы I. Описанная в данном документе твердая фармацевтическая композиция может иметь превосходные свойства гомогенности, стабильности и растворения, не подвергаясь такой стадии измельчения.
Параметры таблетирования могут быть выбраны специалистами в данной области техники в соответствии с фактическими потребностями. В иллюстративном варианте осуществления параметры, используемые в данном документе, представляют собой мелкий вогнутый пуансон диаметром 6 мм и силой 6-9 Kp.
Варианты осуществления настоящей заявки
В некоторых вариантах осуществления данной заявки твердая фармацевтическая композиция, описанная в данном документе, содержит следующее.
A) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,02-8,0 мас. % соединения формулы I;
50 мас. % или более микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала или их смеси;
1,0-7,0 мас. % карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси;
0,1-5 мас. % гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси и
0,1-5 мас. % стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
B) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,03-7,0 мас. % соединения формулы I;
50 мас. % или более микрокристаллической целлюлозы, прежелатинизированного крахмала или их смеси;
1,0-7,0 мас. % карбоксиметилкрахмала натрия;
0,1-5 мас. % гидроксипропилметилцеллюлозы; и
0,1-5 мас. % стеарата магния, коллоидного диоксида кремния или их смеси.
C) В некоторых вариантах осуществления, твердая фармацевтическая композиция содержит:
0,03-6,0 мас. % соединения формулы I;
60 мас. % или более микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала или их смеси;
1,6-6,4 мас. % карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси;
0,1-2,2 мас. % гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси; и
0,1-2,2 мас. % стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
D) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,04-5,0 мас. % соединения формулы I;
60 мас. % или более микрокристаллической целлюлозы, прежелатинизированного крахмала или их смеси;
1,6-6,4 мас. % карбоксиметилкрахмала натрия;
0,1-2,2 мас. % гидроксипропилметилцеллюлозы и
0,1-2,2 мас. % стеарата магния, коллоидного диоксида кремния или их смеси.
E) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,05-3,5 мас. % соединения формулы I;
70 мас. % или более микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала или их смеси;
2,4-5,6 мас. % карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси;
0,2-2,4 мас. % гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси; и
0,2-2,4 мас. % стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
F) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,05-3,5 мас. % соединения формулы I;
70 мас. % или более микрокристаллической целлюлозы, прежелатинизированного крахмала или их смеси;
2,4-5,6 мас. % карбоксиметилкрахмала натрия;
0,2-2,4 мас. % гидроксипропилметилцеллюлозы и
0,2-2,4 мас. % стеарата магния, коллоидного диоксида кремния или их смеси.
G) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,05-2,8 мас. % соединения формулы I;
80 мас. % или более микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала или их смеси;
3,0-5,0 мас. % карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси;
0,2-1,9 мас. % гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси и
0,2-1,9 мас. % стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
H) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,05-2,8 мас. % соединения формулы I;
80 мас. % или более микрокристаллической целлюлозы, прежелатинизированного крахмала или их смеси;
3,0-5,0 мас. % карбоксиметилкрахмала натрия;
0,2-1,9 мас. % гидроксипропилметилцеллюлозы и
0,2-1,9 мас. % стеарата магния, коллоидного диоксида кремния или их смеси.
I) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,05-2,6 мас. % соединения формулы I;
82-98 мас. % микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала или их смеси;
3,4-4,6 мас. % карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси; и
0,5-1,6 мас. % гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси; и
0,5-1,6 мас. % стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
J) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,05-2,6 мас. % соединения формулы I;
82-98 мас. % микрокристаллической целлюлозы, прежелатинизированного крахмала или их смеси;
3,4-4,6 мас. % карбоксиметилкрахмала натрия;
0,5-1,6 мас. % гидроксипропилметилцеллюлозы и
0,5-1,6 мас. % стеарата магния, коллоидного диоксида кремния или их смеси.
K) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,05-2,6 мас. % соединения формулы I;
82-98 мас. % микрокристаллической целлюлозы и прежелатинизированного крахмала, включая 56-85 мас. % микрокристаллической целлюлозы и 12-28 мас. % прежелатинизированного крахмала;
3,4-4,6 мас. % карбоксиметилкрахмала натрия;
0,5-1,6 мас. % гидроксипропилметилцеллюлозы и
0,5-1,6 мас. % стеарата магния и коллоидного диоксида кремния, включая 0,09-1,0 мас. % стеарата магния и 0,09-1,0 мас. % коллоидного диоксида кремния.
L) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,06-2,6 мас. % соединения формулы I;
85-97 мас. % микрокристаллической целлюлозы, маннита, лактозы или прежелатинизированного крахмала, или их смеси;
3,6-4,4 мас. % карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси;
0,7-1,4 мас. % гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси; и
0,7-1,4 мас. % стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
M) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,06-2,6 мас. % соединения формулы I;
85-97 мас. % микрокристаллической целлюлозы, прежелатинизированного крахмала или их смеси;
3,6-4,4 мас. % карбоксиметилкрахмала натрия;
0,7-1,4 мас. % гидроксипропилметилцеллюлозы и
0,7-1,4 мас. % стеарата магния, коллоидного диоксида кремния или их смеси.
N) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,06-2,6 мас. % соединения формулы I;
85-97 мас. % микрокристаллической целлюлозы и прежелатинизированного крахмала, включая 62-78 мас. % микрокристаллической целлюлозы или 15-25 мас. % прежелатинизированного крахмала;
3,6-4,4 мас. % карбоксиметилкрахмала натрия;
0,7-1,4 мас. % гидроксипропилметилцеллюлозы и
0,7-1,4 мас. % стеарата магния и коллоидного диоксида кремния, включая 0,20-0,80 мас. % стеарата магния и 0,20-0,80 мас. % коллоидного диоксида кремния.
O) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,06-2,4 мас. % соединения формулы I;
88-96 мас. % микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала или их смеси;
3,8-4,2 мас. % карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси;
0,8-1,2 мас. % гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси; и
0,8-1,2 мас. % стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
P) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,06-2,4 мас. % соединения формулы I;
88-96 мас. % микрокристаллической целлюлозы, прежелатинизированного крахмала или их смеси;
3,8-4,2 мас. % карбоксиметилкрахмала натрия;
0,8-1,2 мас. % гидроксипропилметилцеллюлозы и
0,8-1,2 мас. % стеарата магния, коллоидного диоксида кремния или их смеси.
Q) В некоторых вариантах осуществления твердая фармацевтическая композиция содержит:
0,06-2,4 мас. % соединения формулы I;
88-96 мас. % микрокристаллической целлюлозы и прежелатинизированного крахмала, включая 66-74 мас. % микрокристаллической целлюлозы или 18-23 мас. % прежелатинизированного крахмала;
3,8-4,2 мас. % карбоксиметилкрахмала натрия;
0,8-1,2 мас. % гидроксипропилметилцеллюлозы и
0,8-1,2 мас. % стеарата магния и коллоидного диоксида кремния, включая 0,35-0,65 мас. % стеарата магния и 0,35-0,65 мас. % коллоидного диоксида кремния.
В некоторых вариантах осуществления твердая фармацевтическая композиция может дополнительно содержать покрывающее средство. В некоторых вариантах осуществления покрывающее средство составлено из композиции водного пленочного покрытия, где композиция водного пленочного покрытия содержит пленкообразующий полимер, воду и/или спирт в качестве носителя, и необязательно одну или несколько добавок, таких как добавки, известные в области пленочного покрытия. В некоторых вариантах осуществления покрывающее средство выбрано из группы, состоящей из гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, метилцеллюлозы, этилцеллюлозы, гидроксиэтилцеллюлозы, фталата ацетата целлюлозы, сульфата этилцеллюлозы, карбоксиметилцеллюлозы, поливинилпирролидона, зеина, акриловых полимеров (например, сополимеры метакриловой кислоты/метакрилата, такие как сополимеры метакриловой кислоты/метилметакрилата) и поливинилового спирта.
Настоящая заявка дополнительно охватывает следующие варианты осуществления.
1. Твердая фармацевтическая композиция, содержащая соединение формулы I, разбавитель, связующее, разрыхлитель и смазывающее средство,
 .
.
2. Твердая фармацевтическая композиция по варианту осуществления 1, где твердая фармацевтическая композиция представляет собой фармацевтическую композицию в стандартной дозе, и масса соединения формулы I в композиции на стандартную дозу составляет 0,01-10 мг.
3. Твердая фармацевтическая композиция по варианту осуществления 1, где количество соединения формулы I выбрано из 0,01-10 мас.%.
4. Твердая фармацевтическая композиция по варианту осуществления 1, где разбавитель выбран из группы, состоящей из микрокристаллической целлюлозы, маннита, лактозы, сахарозы, крахмала, прежелатинизированного крахмала, декстрина и их смеси; предпочтительно микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала и их смеси; более предпочтительно микрокристаллической целлюлозы, прежелатинизированного крахмала и их смеси.
5. Твердая фармацевтическая композиция по варианту осуществления 1, где количество разбавителя выбрано из 50 мас. % или более.
6. Твердая фармацевтическая композиция по варианту осуществления 4, где разбавитель включает микрокристаллическую целлюлозу и количество микрокристаллической целлюлозы выбрано из 30-90 мас. %.
7. Твердая фармацевтическая композиция по варианту осуществления 4, где разбавитель включает прежелатинизированный крахмал, и количество прежелатинизированного крахмала выбрано из 5-35 мас. %.
8. Твердая фармацевтическая композиция по варианту осуществления 4, где разбавитель представляет собой микрокристаллическую целлюлозу и прежелатинизированный крахмал; предпочтительно 30-90 мас. % микрокристаллической целлюлозы и 5-35 мас. % прежелатинизированного крахмала, и количество разбавителя составляет 50 мас. % или более.
9. Твердая фармацевтическая композиция по варианту осуществления 1, где разрыхлитель выбран из группы, состоящей из карбоксиметилкрахмала натрия, сухого крахмала, микрокристаллической целлюлозы, гидроксиэтилметилцеллюлозы, карбоксиметилцеллюлозы натрия, карбоксиметилцеллюлозы кальция, кроскармеллозы натрия, низкозамещенной гидроксипропилметилцеллюлозы или кросповидона, додецилсульфата натрия или додецилсульфата магния и их смеси; предпочтительно карбоксиметилкрахмала натрия, кроскармеллозы натрия и их смеси; более предпочтительно карбоксиметилкрахмала натрия.
10. Твердая фармацевтическая композиция по варианту осуществления 9, где количество разрыхлителя выбрано из 1,0-7,0 мас. %.
11. Твердая фармацевтическая композиция по варианту осуществления 9, где разрыхлитель представляет собой карбоксиметилкрахмал натрия и количество карбоксиметилкрахмала натрия выбрано из 1,0-7,0 мас. %.
12. Твердая фармацевтическая композиция по варианту осуществления 1, где связующее выбрано из группы, состоящей из гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, желатина, поливинилпирролидона, частично гидролизованного крахмала, прежелатинизированного крахмала, глюкозы, полиэтиленгликоля, поливинилового спирта и их смеси; предпочтительно гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы (L-HPC), поливинилпирролидона и их смеси; более предпочтительно гидроксипропилметилцеллюлозы.
13. Твердая фармацевтическая композиция по варианту осуществления 12, где количество связующего выбрано из 0,1-5 мас. %.
14. Твердая фармацевтическая композиция по варианту осуществления 12, где связующее представляет собой гидроксипропилметилцеллюлозу, и количество гидроксипропилметилцеллюлозы выбрано из 0,1-5 мас. %.
15. Твердая фармацевтическая композиция по варианту осуществления 1, где смазывающее средство выбрано из группы, состоящей из стеарата магния, коллоидного диоксида кремния, талька, полиэтиленгликоля 4000, полиэтиленгликоля 6000, стеариновой кислоты, стеарилфумарата натрия, додецилсульфата натрия и их смеси; предпочтительно стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия и их смеси; более предпочтительно стеарата магния, коллоидного диоксида кремния и их смеси.
16. Твердая фармацевтическая композиция по варианту осуществления 15, где количество смазывающего средства выбрано из 0,1-5 мас. %.
17. Твердая фармацевтическая композиция по варианту осуществления 15, где смазывающее средство включает коллоидный диоксид кремния, и количество коллоидного диоксида кремния выбрано из 0,05-3,0 мас. %.
18. Твердая фармацевтическая композиция по варианту осуществления 15, где смазывающее средство включает стеарат магния, и количество стеарата магния выбрано из 0,05-3,0 мас. %.
19. Твердая фармацевтическая композиция по варианту осуществления 15, где смазывающее средство выбрано из группы, состоящей из коллоидного диоксида кремния и стеарата магния; предпочтительно 0,05-3,0 мас. % коллоидного диоксида кремния и 0,05-3,0 мас. % стеарата магния и количество смазывающего средства выбрано из 0,1-5 мас. %.
20. Твердая фармацевтическая композиция по любому из вариантов осуществления 1-19, содержащая:
0,02-8,0 мас. % соединения формулы I;
50 мас. % или более микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала или их смеси;
1,0-7,0 мас. % карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси;
0,1-5 мас. % гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси и
0,1-5 мас. % стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
21. Твердая фармацевтическая композиция по любому из вариантов осуществления 1-20, дополнительно содержащая покрывающее средство.
22. Твердая фармацевтическая композиция по любому из вариантов осуществления 1-20, где лекарственная форма твердой фармацевтической композиции может быть выбрана из порошка, гранулы, таблетки, капсулы, пилюли, пеллеты, дисперсионного порошка и порошка для ингаляции, предпочтительно таблетки.
23. Твердая фармацевтическая композиция по любому из вариантов осуществления 1-22, где твердая фармацевтическая композиция получена способом прямого прессования.
24. Твердая фармацевтическая композиция по варианту осуществления 23, где способ прямого прессования включает следующий процесс: 1) подготовка соединения формулы I, разбавителя, разрыхлителя, связующего и смазывающего средства в смеси и 2) таблетирование.
25. Способ получения твердой фармацевтической композиции на основе соединения формулы I по любому из вариантов осуществления 1-22, где способ выбран из способа прямого прессования.
26. Способ по варианту осуществления 25, где способ прямого прессования включает следующий процесс: 1) подготовка соединения формулы I, разбавителя, разрыхлителя, связующего и смазывающего средства в смеси и 2) таблетирование.
27. Применение твердой фармацевтической композиции на основе соединения формулы I по любому из вариантов осуществления 1-22 для изготовления лекарственного препарата, предназначенного для лечения заболевания, ассоциированного с TLR7.
28. Применение по варианту осуществления 27, где заболевание, на которое влияет агонизм TLR7, выбрано из вирусного инфекционного заболевания; предпочтительно вирусное инфекционное заболевание выбрано из группы, состоящей из гепатита B и гепатита C.
Лечебные или профилактические способы и применение
В еще одном аспекте настоящая заявка предусматривает применение твердой фармацевтической композиции на основе соединения формулы I для изготовления лекарственного средства, предназначенного для лечения или предупреждения заболевания, ассоциированного с TLR7. В еще одном аспекте в настоящей заявке предусмотрена твердая фармацевтическая композиция на основе соединения формулы I для применения в лечении или предупреждении заболевания, ассоциированного с TLR7. В дополнительном аспекте в настоящей заявке дополнительно предусмотрен способ лечения или предотвращения заболевания, ассоциированного с TLR7, который включает введение субъекту, нуждающемуся в этом, твердой фармацевтической композиции на основе соединения формулы I, описанной в данном документе. Субъектом является, например, млекопитающее, предпочтительно человек.
В некоторых вариантах осуществления заболевание, ассоциированное с TLR7, выбрано из вирусного инфекционного заболевания; предпочтительно вирусное инфекционное заболевание выбрано из группы, состоящей из гепатита B и гепатита C.
Положительные эффекты
Во время разработки твердой фармацевтической композиции на основе соединения формулы I адгезия частиц может вызывать отталкивание между частицами, что приводит к неоднородности смешивания, и во время длительного перемешивания это явление становится все более очевидным вместе с накоплением заряда, вызванным трением, и сопровождается образованием комков. Это может привести к большим различиям в содержании активных ингредиентов в стандартном препарате, влияя на эффективность лекарственного препарата. Кроме того, если препарат имеет небольшой размер в спецификации, токсические и побочные эффекты легко усугубляются из-за неоднородности содержания активных ингредиентов. Следовательно, в способе разработки твердой фармацевтической композиции на основе соединения формулы I вышеуказанные проблемы необходимо решить, чтобы получить фармацевтическую композицию с хорошей гомогенностью, растворимостью и стабильностью для клинического применения.
В настоящей заявке обнаружено, что твердая фармацевтическая композиция, описанная в данном документе, имеет определенные микромеритические параметры и характеристики распределения частиц по размеру, демонстрирует превосходные свойства гомогенности, стабильности и растворения, и характеризуется хорошими фармакокинетическими свойствами, что подходит для клинического применения. Описанная в настоящем документе твердая фармацевтическая композиция, полученная прямым прессованием порошка, имеет превосходные свойства гомогенности, стабильности и растворения, и хорошие фармакокинетические свойства, которые подходят для клинического применения. Кроме того, когда соединение формулы I и разбавитель не измельчаются совместно во время способа получения, полученная твердая фармацевтическая композиция, описанная в данном документе, имеет превосходные свойства гомогенности, стабильности и растворения, и хорошие фармакокинетические свойства, которые подходят для клинического применения.
Примеры
Настоящая заявка будет иллюстративно описана со ссылкой на конкретные примеры; однако эти примеры не предназначены для ограничения объема настоящей заявки. Все используемые вспомогательные вещества и реагенты являются коммерчески доступными продуктами. Например, используемые вспомогательные вещества могут быть доступны от Colorcon, Dow Chemical, FMC Corporation и т. п. Соединение формулы I коммерчески доступно или может быть синтезировано с использованием способа, описанного в WO2016/023511. В примерах описания, если не указано иное, используемое соединение формулы I находится в форме свободного основания. Используемые инструменты и оборудование могут представлять собой подготовительное оборудование, обычно используемое в данной области техники, такое как сухо-влажный гранулятор U5 и смеситель с воронкой HBD-5.
Пример 1. Прямое прессование порошка
Фармацевтическую композицию получали с применением способа прямого прессования (порошка). Используемые ингредиенты и пропорции приведены в следующей таблице.
Способ получения.
1. Предварительная обработка: брали соединение формулы I, затем брали прежелатинизированный крахмал с массовым соотношением соединения формулы I и прежелатинизированного крахмала, равным 1:20 (соединение формулы I:прежелатинизированный крахмал, мас./мас. = 1:20), вручную смешивали два вещества и просеивали смесь через сито с размером ячеек 60 меш с получением предварительно обработанного материала для последующего использования;
2. предварительное смешивание: смешивали предварительно обработанный материал с оставшимся предварительно определенным количеством прежелатинизированного крахмала и предварительно определенным количеством микрокристаллической целлюлозы, карбоксиметилкрахмала натрия и гидроксипропилметилцеллюлозы, и помещали смесь в сухо-влажный гранулятор с получением предварительно смешанного материала;
3. полное смешивание: добавляли предварительно смешанный материал в коллоидный диоксид кремния, помещали смесь в смеситель с воронкой для смешивания, и затем добавляли стеарат магния после смешивания для полного смешивания; и
4. таблетирование: таблетировали полностью перемешанный промежуточный продукт с помощью мелкого вогнутого пуансона диаметром 6 мм и твердостью 6-9 Kp.
Пример 2. Прямое прессование порошка
Фармацевтическую композицию получали с применением способа прямого прессования (порошка). Используемые ингредиенты и пропорции приведены в следующей таблице.
Способ получения.
1. Предварительная обработка: брали предварительно определенное количество соединения формулы I, затем брали прежелатинизированный крахмал с массовым соотношением соединения формулы I и прежелатинизированного крахмала, равным 1:20 (соединение формулы I:прежелатинизированный крахмал, мас./мас. = 1:20), вручную смешивали два вещества и просеивали смесь через сито с размером ячеек 60 меш с получением предварительно обработанного материала для последующего использования;
2. предварительное смешивание: смешивали предварительно обработанный материал с оставшимся предварительно определенным количеством прежелатинизированного крахмала и предварительно определенным количеством микрокристаллической целлюлозы, карбоксиметилкрахмала натрия и гидроксипропилметилцеллюлозы, и помещали смесь в сухо-влажный гранулятор с получением предварительно смешанного материала;
3. полное смешивание: добавляли предварительно смешанный материал в коллоидный диоксид кремния, помещали смесь в смеситель с воронкой для смешивания, и затем добавляли стеарат магния после смешивания для полного смешивания; и
4. таблетирование: таблетировали полностью перемешанный промежуточный продукт с помощью мелкого вогнутого пуансона диаметром 6 мм и твердостью 6-9 Kp.
Пример 3. Прямое прессование порошка
Фармацевтическую композицию получали с применением способа прямого прессования (порошка). Используемые ингредиенты и пропорции приведены в следующей таблице.
Способ получения.
1. Предварительная обработка: брали предварительно определенное количество соединения формулы I и прежелатинизированного крахмала, вручную смешивали два вещества и просеивали смесь через сито с размером ячеек 60 меш с получением предварительно обработанного материала для последующего использования;
2. предварительное смешивание: смешивали предварительно обработанный материал с предварительно определенным количеством микрокристаллической целлюлозы, карбоксиметилкрахмала натрия и гидроксипропилметилцеллюлозы, и помещали смесь в сухо-влажный гранулятор с получением предварительно смешанного материала;
3. полное смешивание: добавляли предварительно смешанный материал в коллоидный диоксид кремния, помещали смесь в смеситель с воронкой для смешивания, и затем добавляли стеарат магния после смешивания для полного смешивания; и
4. таблетирование: таблетировали полностью перемешанный промежуточный продукт с помощью мелкого вогнутого пуансона диаметром 6 мм и твердостью 6-9 Kp.
Пример 4. Прямое прессование порошка
Фармацевтическую композицию получали с применением способа прямого прессования (порошка). Используемые ингредиенты и пропорции приведены в следующей таблице. Согласно способу примера 1, получали пример 4.
Сравнительный пример 1. Сухая грануляция
Способ получения.
1. Предварительная обработка: брали предварительно определенное количество соединения формулы I, затем брали прежелатинизированный крахмал с массовым соотношением соединения формулы I и прежелатинизированного крахмала, равным 1:20 (соединение формулы I:прежелатинизированный крахмал, мас./мас. = 1:20), вручную смешивали два вещества, просеивали смесь через сито с размером ячеек 60 меш и проводили размол на струйной мельнице с получением совместно измельченного порошка для последующего применения;
2. предварительное смешивание: смешивали совместно измельченный порошок с оставшимся предварительно определенным количеством прежелатинизированного крахмала и предварительно определенным количеством микрокристаллической целлюлозы, карбоксиметилкрахмалом натрия (добавленная изнутри часть) и гидроксипропилметилцеллюлозой, просеивали смесь через сито с размером ячеек 60 меш и смешивали с помощью сухо-влажного гранулятора с получением предварительно смешанного материала;
3. сухое гранулирование: проводили сухое гранулирование предварительно смешанного материала;
4. полное смешивание: добавляли сухой гранулированный материал в карбоксиметилкрахмал натрия (добавляемая извне часть) и коллоидный диоксид кремния, помещали смесь в смеситель с воронкой для смешивания и добавляли стеарат магния после смешивания для полного смешивания; и
5. таблетирование: таблетировали полностью перемешанный промежуточный продукт с помощью мелкого вогнутого пуансона диаметром 6 мм и твердостью 6-9 Kp.
Сравнительный пример 2. Сухая грануляция
Способ получения.
1. Предварительное смешивание: брали предварительно определенное количество соединения формулы I и прежелатинизированного крахмала, смешивали их вручную, просеивали смесь через сито 60 меш, затем смешивали смесь с предварительно определенным количеством микрокристаллической целлюлозы, карбоксиметилкрахмала натрия (добавленная изнутри часть) и гидроксипропилметилцеллюлозы в смеситель с воронкой с получением предварительно смешанного материала;
2. сухое гранулирование: проводили сухое гранулирование предварительно смешанного материала;
3. полное смешивание: добавляли сухой гранулированный материал в карбоксиметилкрахмал натрия (добавляемая извне часть) и коллоидный диоксид кремния, помещали смесь в смеситель с воронкой для смешивания и добавляли стеарат магния после смешивания для полного смешивания; и
4. таблетирование: таблетировали полностью перемешанный промежуточный продукт с помощью мелкого вогнутого пуансона диаметром 6 мм и твердостью 6-9 Kp.
Сравнительный пример 3. Сухая грануляция
Способ получения.
1. Предварительное смешивание: брали предварительно определенное количество соединения формулы I и прежелатинизированного крахмала, смешивали их вручную, просеивали смесь через сито 60 меш, затем смешивали смесь с предварительно определенным количеством микрокристаллической целлюлозы, карбоксиметилкрахмала натрия (добавленная изнутри часть) и гидроксипропилметилцеллюлозы в смеситель с воронкой с получением предварительно смешанного материала;
2. сухое гранулирование: проводили сухое гранулирование предварительно смешанного материала;
3. полное смешивание: добавляли сухой гранулированный материал в карбоксиметилкрахмал натрия (добавляемая извне часть) и коллоидный диоксид кремния, помещали смесь в смеситель с воронкой для смешивания и добавляли стеарат магния после смешивания для полного смешивания; и
4. таблетирование: таблетировали полностью перемешанный промежуточный продукт с помощью мелкого вогнутого пуансона диаметром 6 мм и твердостью 6-9 Kp.
Экспериментальный пример 1. Эксперимент растворения
Образец из примера 4 подвергали эксперименту растворения с использованием 900 мл фосфатного буфера, характеризующегося pH 6,8, в качестве среды для растворения, с использованием способа тестирования растворения (в соответствии со способом 2 из General Chapter 0931, Chinese Pharmacopoeia, том IV, издание 2015). Использовали лопастной способ, скорость вращения составляла 50 об/мин, и растворение измеряли через 5, 10, 15, 20, 30, 45 и 60 минут соответственно. Результаты представлены в таблице ниже.
Как видно из приведенных выше результатов, описанная в данном документе фармацевтическая композиция имеет превосходные свойства растворения. Растворение через 20 мин может достигать 90% и выше.
Экспериментальный пример 2. Эксперимент стабильности
Брали образцы сравнительного примера 1, сравнительного примера 2, сравнительного примера 3, примера 1, примера 2 и примера 3, которые подверглись измерению примесей в течение дня 0 и в течение 6 месяцев в условиях ускоренного испытания (40°C ± 2°C, относительная влажность 75 % ± 5%). Результаты измерений являются следующими.
Как видно из приведенных выше результатов, описанная в данном документе фармацевтическая композиция имеет высокую чистоту и превосходную стабильность. В частности, количество общего содержания примесей практически не изменилось в условиях ускоренных испытаний в течение 6 месяцев. Напротив, сравнительный пример показал значительное увеличение общего количества примесей до 4 раз или более в условиях ускоренного тестирования в течение 6 месяцев. Изменение примесей показало, что увеличение примесей в фармацевтической композиции, полученной с помощью прямого прессования порошка, значительно ниже, чем в фармацевтической композиции, полученной с помощью сухой грануляции. Описанная в данном документе фармацевтическая композиция демонстрирует значительное преимущество в стабильности.
Экспериментальный пример 3. Проверка гомогенности смешивания
Брали образцы из примера 2, примера 3 и примера 4, и подвергали измерению гомогенности смешивания с использованием способа тестирования гомогенности содержимого (в соответствии с General Chapter 0941, Chinese Pharmacopoeia, том IV, издание 2015 г.), и эксперимент включает:
1. получение разбавителя, раствора подвижной фазы и контрольного раствора в соответствии со способом тестирования гомогенности содержимого;
2. произвольно выбирали 10 таблеток для испытаний, точно взвешивали каждую таблетку для испытаний, переносили таблетки для испытаний в мерные колбы соответственно, добавляли разбавитель, проводили ультразвуковую обработку в течение 10 мин для дезинтеграции таблеток, охлаждали реакционную смесь до комнатной температуры, разбавляли реакционную смесь разбавителем и перемешивали смесь мешалкой в течение 2 ч;
3. отбирали соответствующее количество раствора в центрифужную пробирку, центрифугировали при 8000 об/мин в течение 10 мин, пипетировали супернатант во флакон с образцом HPLC для введения образца и измеряли содержание тестируемых образцов; и
4. способ обнаружения: отбирали 10 проб, измеряли относительное содержание xi каждого образца в стандартной дозе с указанным количеством 100 соответственно, и вычисляют среднее значение x, стандартное отклонение S 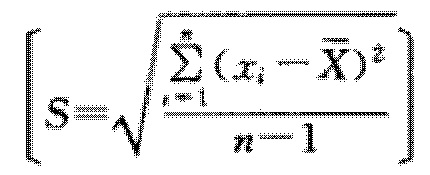 и абсолютное значение A
и абсолютное значение A 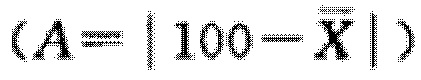 разницы между обозначенной суммой и средним значением. Более низкое A + 2,2S указывает на лучшую гомогенность исследуемых образцов. Если A + 2,2S меньше или равно 15,0, то гомогенность содержимого образцов для испытаний соответствует спецификации.
разницы между обозначенной суммой и средним значением. Более низкое A + 2,2S указывает на лучшую гомогенность исследуемых образцов. Если A + 2,2S меньше или равно 15,0, то гомогенность содержимого образцов для испытаний соответствует спецификации.
Результаты измерений являются следующими.
Как видно из приведенных выше результатов, фармацевтическая композиция, описанная в данном документе, демонстрирует превосходную гомогенность смешивания и отвечает предельным требованиям, и фактические результаты испытаний намного ниже, чем верхний предел требуемых результатов испытаний.
Экспериментальный пример 4. Определение микромеритических параметров и распределения частиц по размеру
Объемная плотность, насыпная плотность, коэффициент Хауснера и гранулометрический состав были измерены/рассчитаны путем взятия полученных смесей, полученных после завершения стадии полного смешивания в твердой фармацевтической композиции сравнительного примера 2 и примера 2, в которых соединение формулы I составляло 0,5 мг соответственно, в качестве образцов.
Объемную плотность измеряли/рассчитывали с помощью прибора для определения сыпучести порошка BEP2. Насыпную плотность измеряли/рассчитывали с помощью прибора для измерения плотности упаковки SOTAX TD1. Распределение частиц по размеру измеряли/рассчитывали с помощью вибрационного сита AS200 и с использованием способа механического просеивания. Результаты являются следующими.
Как видно из приведенных выше результатов, описанная в данном документе фармацевтическая композиция имеет специфические микрометрические свойства и демонстрирует хорошую сыпучесть.
Как видно из приведенных выше результатов, основное количество частиц в фармацевтической композиции, описанной в данном документе, имеет размер менее 75 мкм, меньшее количество частиц имеет размер 75-150 мкм и только небольшое количество имеет размер более 150 мкм.
Хотя в данном документе были проиллюстрированы и описаны типичные варианты осуществления, настоящее изобретение не ограничивается деталями. Поскольку различные возможные модификации и замены не отклоняются от сути настоящего изобретения, специалисты в данной области техники могут использовать варианты и эквиваленты, которые могут быть разработаны с помощью стандартных исследований, и, следовательно, все эти варианты и эквиваленты подпадают под суть и объем защиты, определенные прилагаемой формулой изобретения.
Твердая фармацевтическая композиция, содержащая агонист TLR7, представляющий собой 2-бутокси-7-(4-(пирролидин-1-илметил)бензил)-5H-пирроло[3,2-d]пиримидин-4-амин, способ ее получения и ее медицинское применение. Твердая фармацевтическая композиция характеризуется превосходными свойствами стабильности и растворения. 4 н. и 22 з.п. ф-лы, 5 табл., 4 пр.
1. Твердая фармацевтическая композиция, содержащая соединение формулы I, разбавитель, связующее, разрыхлитель и смазывающее средство,

где
разбавитель выбран из группы, состоящей из микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала и их смеси;
разрыхлитель представляет собой карбоксиметилкрахмал натрия;
связующее выбрано из группы, состоящей из гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона и их смеси;
смазывающее средство выбрано из группы, состоящей из стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия и их смеси;
твердая фармацевтическая композиция получена посредством способа прямого прессования.
2. Твердая фармацевтическая композиция по п. 1, где
масса соединения формулы I в композиции составляет 0,01-10 мг; или количество соединения формулы I выбрано из 0,01-10 мас.%.
3. Твердая фармацевтическая композиция по п. 1, где
разбавитель выбран из группы, состоящей из микрокристаллической целлюлозы, прежелатинизированного крахмала и их смеси.
4. Твердая фармацевтическая композиция по п. 1, где
количество разбавителя выбрано из 50 мас.% или более.
5. Твердая фармацевтическая композиция по п. 4, где
разбавитель включает микрокристаллическую целлюлозу, и количество микрокристаллической целлюлозы выбрано из 30-90 мас.%; или
разбавитель включает прежелатинизированный крахмал, и количество прежелатинизированного крахмала выбрано из 5-35 мас.%; или
разбавитель представляет собой микрокристаллическую целлюлозу и прежелатинизированный крахмал.
6. Твердая фармацевтическая композиция по п. 5, где
разбавитель представляет собой 30-90 мас.% микрокристаллической целлюлозы и 5-35 мас.% прежелатинизированного крахмала, и количество разбавителя составляет 50 мас.% или более.
7. Твердая фармацевтическая композиция по п. 1, где
разрыхлитель представляет собой карбоксиметилкрахмал натрия.
8. Твердая фармацевтическая композиция по п. 7, где
количество разрыхлителя выбрано из 1,0-7,0 мас.%; или
разрыхлитель представляет собой карбоксиметилкрахмал натрия, и количество карбоксиметилкрахмала натрия выбрано из 1,0-7,0 мас.%.
9. Твердая фармацевтическая композиция по п. 1, где
связующее представляет собой гидроксипропилметилцеллюлозу.
10. Твердая фармацевтическая композиция по п. 9, где
количество связующего выбрано из 0,1-5 мас.%; или
связующее представляет собой гидроксипропилметилцеллюлозу, и количество гидроксипропилметилцеллюлозы выбрано из 0,1-5 мас.%.
11. Твердая фармацевтическая композиция по п. 1, где
смазывающее средство выбрано из группы, состоящей из стеарата магния, коллоидного диоксида кремния и их смеси.
12. Твердая фармацевтическая композиция по п. 11, где
количество смазывающего средства выбрано из 0,1-5 мас.%; или
смазывающее средство включает коллоидный диоксид кремния, и количество коллоидного диоксида кремния выбрано из 0,05-3,0 мас.%; или
смазывающее средство включает стеарат магния, и количество стеарата магния выбрано из 0,05-3,0 мас.%; или
смазывающее средство выбрано из группы, состоящей из коллоидного диоксида кремния и стеарата магния.
13. Твердая фармацевтическая композиция по п. 12, где
смазывающее средство представляет собой 0,05-3,0 мас.% коллоидного диоксида кремния и 0,05-3,0 мас.% стеарата магния, и количество смазывающего средства выбрано из 0,1-5 мас.%.
14. Твердая фармацевтическая композиция по любому из пп. 1-13, где твердая фармацевтическая композиция содержит:
0,02-8,0 мас.% соединения формулы I;
50 мас.% или более микрокристаллической целлюлозы, маннита, лактозы, прежелатинизированного крахмала или их смеси;
1,0-7,0 мас.% карбоксиметилкрахмала натрия, кроскармеллозы натрия или их смеси;
0,1-5 мас.% гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы, карбоксиметилцеллюлозы натрия, этилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, низкозамещенной гидроксипропилцеллюлозы, поливинилпирролидона или их смеси и
0,1-5 мас.% стеарата магния, коллоидного диоксида кремния, додецилсульфата натрия или их смеси.
15. Твердая фармацевтическая композиция по любому из пп. 1-14, где твердая фармацевтическая композиция имеет по меньшей мере одну из следующих характеристик:
объемная плотность меньше или равна 0,50 г/мл;
насыпная плотность меньше или равна 0,65 г/мл;
коэффициент Хауснера равен 1,31-1,40;
частицы в количестве, которое больше или равняется 50%, имеют размер менее 75 мкм.
16. Твердая фармацевтическая композиция по п. 15, где объемная плотность равна 0,30-0,50 г/мл.
17. Твердая фармацевтическая композиция по п. 15, где насыпная плотность равна 0,50-0,65 г/мл.
18. Твердая фармацевтическая композиция по п. 15, где частицы в количестве, которое равняется 50-80%, имеют размер менее 75 мкм.
19. Твердая фармацевтическая композиция по любому из пп. 1-18, где
лекарственная форма твердой фармацевтической композиции представляет собой таблетку.
20. Способ получения твердой фармацевтической композиции на основе соединения формулы I по любому из пп. 1-19, включающий способ прямого прессования.
21. Способ получения твердой фармацевтической композиции на основе соединения формулы I по любому из пп. 1-19, включающий:
1) смешивание соединения формулы I с частью или со всем разбавителем и необязательно присутствующим по меньшей мере одним из связующего, разрыхлителя и смазывающего средства;
2) смешивание полученной смеси, полученной на стадии 1), с остальной частью разбавителя и остальной частью по меньшей мере одного из связующего, разрыхлителя и смазывающего средства;
необязательно 3) смешивание полученной смеси, полученной на стадии 2), с остальной частью вспомогательных веществ и
4) таблетирование полученной смеси, полученной на стадии 2) или стадии 3).
22. Способ по п. 20 или 21, где
способ включает следующие стадии: 1) подготовка соединения формулы I, разбавителя, разрыхлителя, связующего и смазывающего средства в смеси и 2) таблетирование.
23. Способ по любому из пп. 20-22, где
смесь, содержащую соединение формулы I и разбавитель, не подвергают измельчению.
24. Применение твердой фармацевтической композиции на основе соединения формулы I по любому из пп. 1-19 для изготовления лекарственного препарата, предназначенного для лечения или предупреждения заболевания, ассоциированного с TLR7.
25. Применение по п. 24, где заболевание, ассоциированное с TLR7, выбрано из вирусного инфекционного заболевания.
26. Применение по п. 25, где вирусное инфекционное заболевание выбрано из группы, состоящей из гепатита В и гепатита С.
| WO 2016023511 A1, 2016.02.18 | |||
| WO 2017133684 A1, 2017.08.10 | |||
| Handbook of pharmaceutical excipients, 5th ed | |||
| / edited by Raymond C., Pharmaceutical Press and American Pharmacists Association, 2006, p | |||
| Способ получения нерастворимых лаков основных красителей в субстанции и на волокнах | 1923 |
|
SU132A1 |
| CN 107550875 A, 2018.01.09. | |||
Авторы
Даты
2024-07-08—Публикация
2020-04-23—Подача