Настоящее изобретение относится к катализатору с кристаллической структурой типа нестехиометрической шпинели, к способу его получения путем осаждения с регулируемой промывкой и его особому применению в реакции разложения N2O. Поэтому мы полагаем, что настоящее изобретение относится к области "зеленой" промышленности, задачей которой является снижение выбросов N2O.
УРОВЕНЬ ТЕХНИКИ
Закись азота является парниковым газом с активностью, в 298 большей, чем у СО2, и разрушающим озоновый слой, обладающим временем жизни в тропосфере, равным 100 годам. В промышленном секторе вырабатывается 5% от полного выброса N2O и по оценкам в этом секторе в ближайшем будущем вероятно наибольшее увеличение выбросов. В промышленном секторе основными источниками выбросов N2O являются производство азотной кислоты и адипиновой кислоты. Поскольку количество предприятий ограничено, снижение выбросов обеспечить проще, чем в других секторах, в которых имеется множество протяженных источников, таких как сжигание биомассы, и в сельском хозяйстве. Уже предприняты меры для большого количества предприятий по производству адипиновой кислоты, однако выбросы предприятий по производству азотной кислоты снизить особенно затруднительно.
Наиболее эффективными технологиями удаления закиси азота на предприятиях по производству азотной кислоты являются процессы каталитического разложения, проводимые после стадии окисления аммиака (вторичная обработка), или его удаление в потоке хвостового газа (третичная обработка). Имеется несколько промышленных катализаторов для вторичной обработки, но они обладают некоторыми недостатками, такими как инактивация, низкая износостойкость или спекание активной фазы вследствие ее нагревания до высоких температур, которые она должна выдержать (от 750°С до 940°С).
Третичная обработка обеспечивает большое преимущество, поскольку она не влияет на основу предприятия по производству азотной кислоты, т.к. ее проводят, как обработку хвостового газа. Основным технологическим затруднением является разработка каталитических систем, которые активны при относительно низких температурах (от 250°С до 500°С) и могут действовать в реальных производственных условиях, поскольку в хвостовом газе имеются другие компоненты (О2, Н2О и, возможно, NOx), которые могут существенно повлиять на эффективность катализатора.
Катализаторами, считающимися активными в реакции разложения N2O при низкой температуре, являются цеолиты, модифицированные различными металлами (Cr, Mn, Fe, Со, Ni или Cu), благородные металлы (Rh, Ru, Pd) на подложке из ZnO, СеО2, Al2O3, TiO2 или ZrO2, производные гидроталькита, шпинели и оксиды металлов [М. Konsolakis, ACS Catal. 2015, 5, 6397-6421; J. Pérez-Ramirez, Appl. Catal. В 44 (2003) 117-151]. Из их числа обладающие наилучшей каталитической активностью и наилучшей стойкостью к O2 и H2O основаны на кобальтовой шпинели. Yan et al [L. Yan, R. Ren, X. Wang, Q. Gao, D. Ji, J. Suo, Catal. Comm. 4 (2003) 505-509; L. Yan, R. Ren, X. Wang, D. Ji, J. Suo, Appl. Catal. В 45 (2003) 85-90] опубликовали исследования систем ZnxCo1-xCo2O4 и MxCo1-xCo2O4 (М=Ni, Mg), для которых Т50 (температура, необходимая для равной 50% степени превращения N2O) найдена равной 250 и 220°С. Использованы следующие рабочие условия: ЧОСГ (часовая объемная скорость газа), равная 15000 ч-1, и концентрации N2O, равные 1000 част./млн при наличии 10% О2 и 5% Н2О. Аналогичные результаты (Т50=260°С) получали Xu et al. [L. Хuе, С.Zhang, Н. Не, Y. Teraoka, Appl. Catal. В 75 (2007) 167-174] при использовании своего СоСе0,05 катализатора, также действующего при объемной скорости, равной 15000 ч-1 и концентрациях, равный 1000 част./млн для N2O, 10% для О2 и 3% для H2O.
Добавление щелочных элементов повышает каталитическую активность кобальтовой шпинели Co3O4 [JP2007054714 (A)]. Stelmachowski et al [P. Stelmachowski, G. Maniak, A. Kotarba, Z. Sojka, Catal. Comm. 10 (2009) 1062-1065] сообщили о степенях превращения, равных 50%, при 335°С при использовании легированных с помощью К кобальтовых шпинелей, действующих при 7000 ч-1 и концентрациях N2O, равных 1500 част./млн и 1% для H2O, и Xue et al, 77% at 350°С [Li Хuе, Changbin Zhang, Hong He, Yasutake Teraoka, Applied Catalysis B: Environmental, Volume 75, Issues 3-4, 2007, Pages 167-174]. В этих исследованиях учитывали наличие O2 и H2O (даже при концентрациях, превышающих актуальные), исследованные объемные скорости все же были намного меньшими, чем использующиеся в промышленности. Кроме того, не проводили исследования стабильности за исключением случая катализатора Co3O4, промотированного с помощью К, когда катализатор исследовали только в течение 10 ч. Другие авторы также описали поведение катализаторов, легированных другими щелочными металлами, такими как Cs, при легировании по методике пропитки. Добавление воды в загрузку в реальных производственных условиях приводит к снижению степени превращения N2O при использовании этих катализаторов [Pawel Stelmachowski, Gabriela Maniak, Andrzej Kotarba, Zbigniew Sojka, Catalysis Communications, Volume 10, Issue 7, 2009, Pages 1062-1065].
Поэтому необходимо получить катализаторы, которые обеспечивают степень превращения более 90% при температурах ниже 350°С при реальных условиях, и катализаторы, которые стабильны при этих условиях.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому материалу формулы Co3O4-х/2Ау, способу его получения и его применению в качестве катализатора реакции разложения N2O.
Первым объектом настоящего изобретения является материал, отличающийся тем, что он обладает кристаллической структурой типа нестехиометрической шпинели, общая формула которого имеет вид "Co3O4- х/2Ау", где "х" равно от 0,02 до 0,3, "А" обозначает щелочной элемент и "у" равно от 0,06 до 0,18, при отношении А/Со, равном от 0,02 до 0,10; размер первичных частиц эквивалентен размеру кристаллитов, равному от 5 до 30 нм.
В настоящем изобретении "нестехиометрическая шпинель" означает любой материал, обладающий кубической структурой оксида кобальта типа шпинели, который частично восстановлен, что приводит к образованию кислородных вакансий, общей формулы Co3O4-х/2Ау, поскольку происходит восстановление Со3+ в Со2+, индуцированное наличием щелочного элемента.
Преимуществом, связанным с этими катализаторами, является то, что они характеризуются десорбцией кислорода с поверхности при температурах около 100°С и десорбцией кислорода из решетки при температурах от 200 до 300°С, поскольку отношение Со2+/Со3+ в катализаторе равно от 0,55 до 0,80.
Материал предпочтительно является мезопористым. В настоящем изобретении "мезопористый материал" означает любой материал, обладающий порами с преобладающим размером, равным от 2 нм до 50 нм.
Преимуществом мезопористого материала является доступность каталитически активных центров для газов, обусловленная идеальным отношением объема пор к удельной площади поверхности. В предпочтительном варианте осуществления материал обладает объемом пор, равным от 0,2 см3/г до 0,4 см3/г, и удельной площадью поверхности БЭТ (определенной по изотерме Брунауэра-Эметта-Теллера), равной от 40 м2/г до 80 м2/г, относительно большой для объемного материала, что приводит к большой площади поверхности контакта газ-твердое вещество что благоприятствует каталитической активности.
В другом предпочтительном варианте осуществления щелочным элементом А является К, х равно 0,182 и у равно 0,09.
В другом предпочтительном варианте осуществления щелочным элементом А является Cs, х равно 0,235 и у равно 0,15.
Другим объектом настоящего изобретения является способ получения материала Co3O4-х/2Ау со структурой нестехиометрической шпинели, характеризующийся следующими стадиями:
a) растворение соли кобальта в воде;
b) растворение соли или гидроксида щелочного металла в воде;
c) медленное добавление раствора, полученного на стадии (b), к раствору, полученному на стадии (а), до установления рН, равного от 8 до 11;
d) отфильтровывание твердого вещества, полученного на стадии (с), и его промывка с помощью от 5 мл до 75 мл воды на 1 г соли кобальта, добавленной на стадии (а);
e) сушка твердого вещества, полученного на стадии (d), при температуре от 50°С до 200°С в течение от 12 ч до 20 ч; и
f) прокаливание твердого вещества, полученного на стадии (е), при температуре от 200°С до 700°С в атмосфере воздуха в течение не менее 30 мин.
Промывку на стадии (d) проводят регулируемым образом и она является критически важной, поскольку от нее зависит содержание А в образце и оно прямо влияет на снижение температуры превращения Со(III) в Со (II) и поэтому на полученное отношение Со2+/Со3+, таким образом регулируя количество щелочного металла, вводимого в кристаллическую решетку материала, предлагаемого в настоящем изобретении, в зависимости от количества воды, использующейся в пересчете на начальное содержание соли Со в реакционной смеси. Кроме того, эта регулируемая промывка устраняет дополнительную стадию, на которой добавляют щелочной металл, делая, предлагаемую в настоящем изобретении, проще, чем описанные в предшествующем уровне техники.
В способе, описанном в настоящем изобретении осаждение нестехиометрической кобальтовой шпинели на основе оксида кобальта, легированной щелочным металлом, происходит таким образом, что непосредственное взаимодействие между Со и ионом щелочного металла происходит на стадии образования осадка. Легирование является легированием объемного типа, при котором распределение щелочного элемента происходит по системе в целом, а не только по поверхности.
На этот способ синтеза непосредственно влияет способ получения кобальтовой шпинели, приводящий к образованию материала с размером первичных частиц, эквивалентным размеру кристаллитов или кристаллического домена, как это показывает рентгенография и сканирующая электронная микроскопия. Небольшой размер первичных частиц кобальтовой шпинели приводит к образованию открытой поверхности с большой удельной площадью, что обеспечивает большое содержание активных центров в пересчете на 1 г катализатора, способствующее улучшению эффективности катализатора.
Кроме того, включение ионов щелочного металла этим способом значительно изменяет физико-химические характеристики материала, поскольку он приводит к частичному восстановлению ионов Со(III) в ионы Со(II). Это меняет стехиометрию полученной шпинели, снижая содержание кислорода в решетке, что приводит к деформации структуры и придает каталитические характеристики, явно не такие, как у обычной шпинели.
В другом предпочтительном варианте осуществления способа соль кобальта на стадии (а) выбрана из группы, включающей гексагидрат нитрата кобальта, сульфат кобальта, хлорид кобальта и ацетат кобальта.
В другом предпочтительном варианте осуществления способа соль или гидроксид щелочного металла на стадии (b) выбран из группы, включающей карбонат щелочного металла, нитрат щелочного металла, гидроксид щелочного металла и ацетат щелочного металла. В более предпочтительном варианте осуществления солью или гидроксидом щелочного металла является карбонат щелочного металла.
В другом предпочтительном варианте осуществления способа, если солью кобальта является гексагидрат нитрата кобальта и солью щелочного металла является карбонат щелочного металла, промывку на стадии (d) проводят количеством воды, равным от 16 мл/г до 21 мл/г гексагидрата нитрата кобальта.
Третьим объектом настоящего изобретения является применение материала, описанного выше, в качестве катализатора.
В более предпочтительном варианте осуществления оно относится к применению материала в качестве катализатора для окисления/разложения газов.
В еще более предпочтительном варианте осуществления оно относится к применению материала в качестве катализатора для разложения N2O.
Катализатор приводит к степени превращения N2O, составляющей 98% при реальных рабочих условиях: 340°С при ЧОСГ, равной 50330 ч-1.
Катализатор приводит к степени превращения N2O, составляющей 98% при реальных рабочих условиях: 310°С при ЧОСГ, равной 24000 ч-1.
Кроме того, он обладает высокой стабильностью в присутствии Н2О и О2 в течение не менее 65 ч без снижения степени превращения N2O и без изменения определяющих характеристик, таких как размер частиц или пористость.
В настоящем описании и формуле изобретения термин "включает" и его варианты не исключает другие технические характеристики, добавки, компоненты или стадии. Другие объекты, преимущества и признаки настоящего изобретения будут очевидны для специалистов в данной области техники частично из описания и частично из практического осуществления настоящего изобретения. Приведенные ниже примеры и чертежи представлены только для иллюстрации и не предназначены для ограничения настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1: Рентгенограммы материалов, предлагаемых в настоящем изобретении.
Фиг. 2: Полученные с помощью сканирующей электронной микроскопии изображения материалов, предлагаемых в настоящем изобретении.
Фиг. 3: Распределение по размерам пор материалов, предлагаемых в настоящем изобретении, полученное с помощью изотерм адсорбции-десорбции N2.
Фиг. 4: Спектры РЭС материалов, предлагаемых в настоящем изобретении.
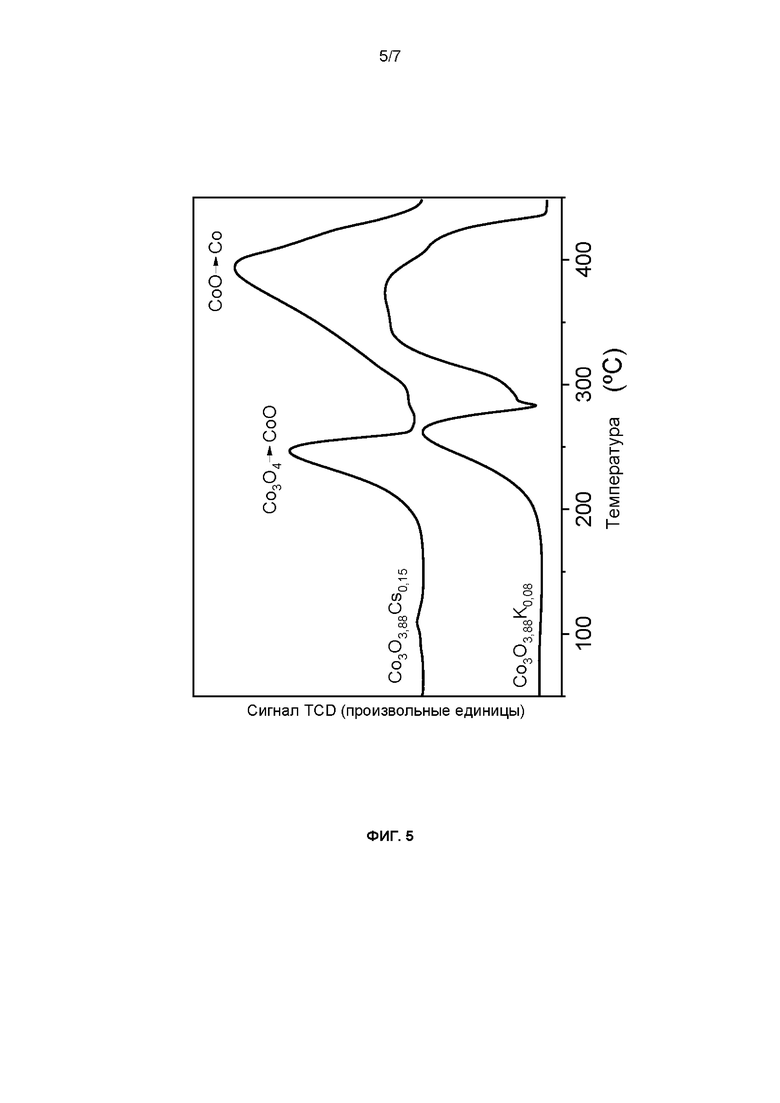
Фиг. 5: Восстановление при программируемой температуре с помощью Н2 материалов, предлагаемых в настоящем изобретении.
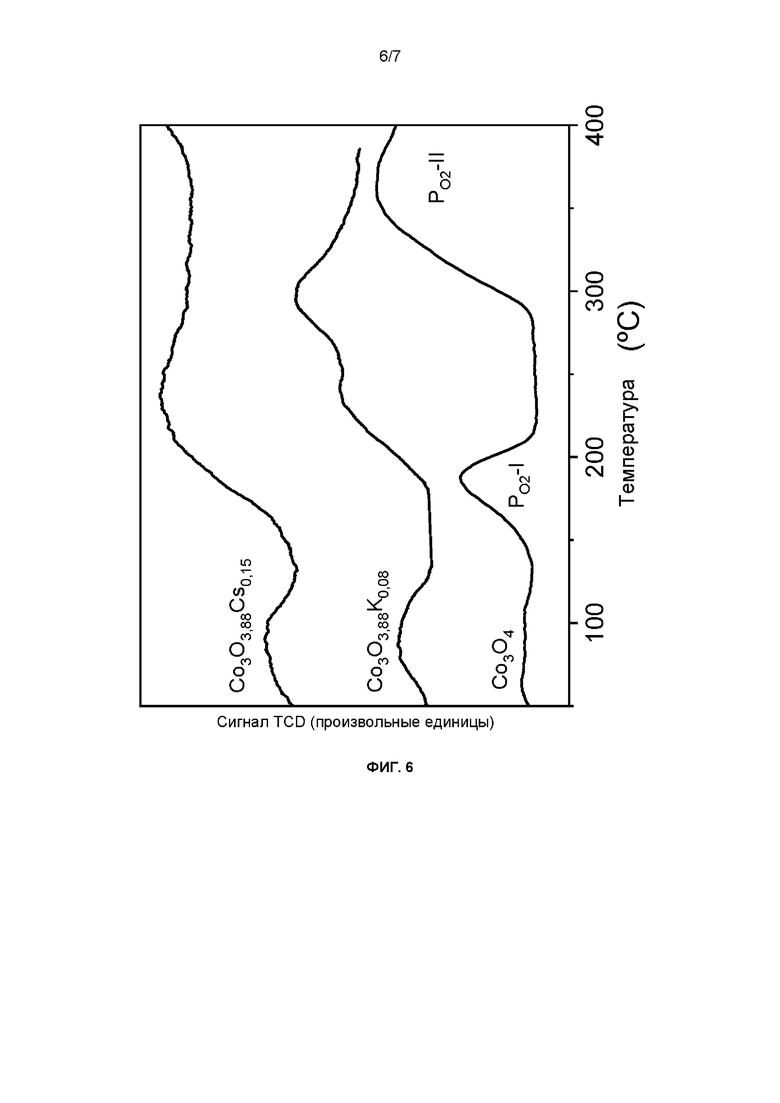
Фиг. 6: Десорбция O2 при программируемой температуре материалов, предлагаемых в настоящем изобретении.
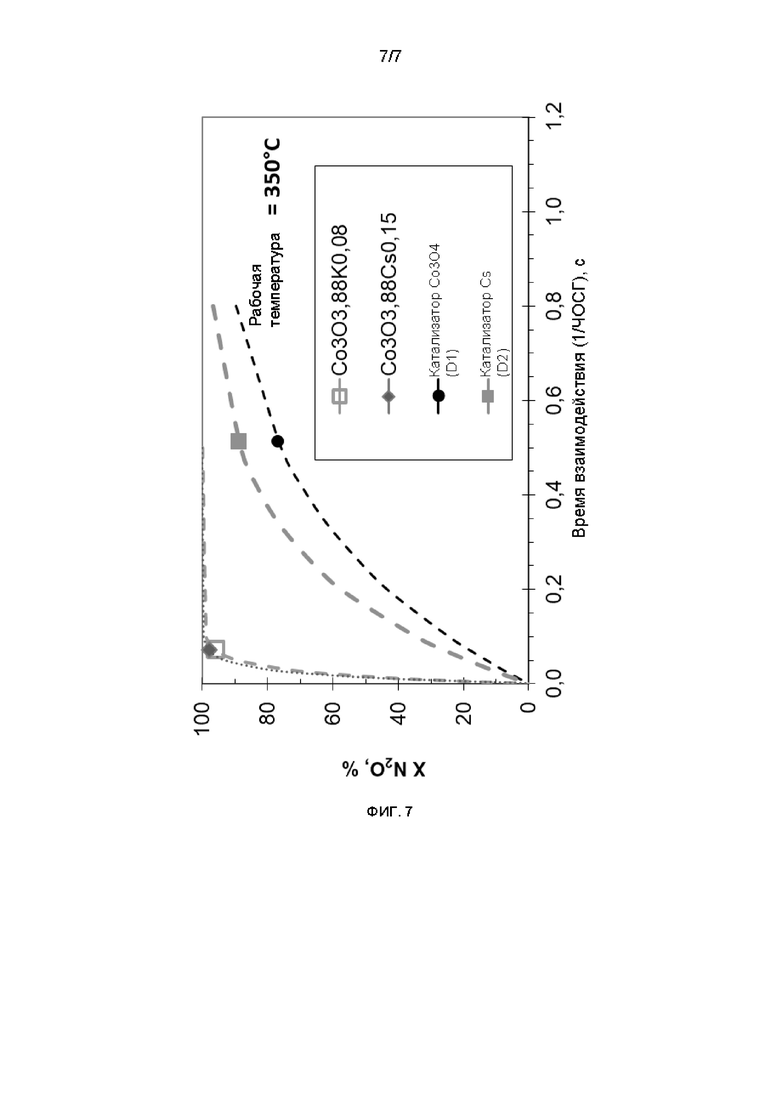
Фиг. 7: Степень превращения N2O в зависимости от времени взаимодействия в присутствии O2 и паров H2O материалов, предлагаемых в настоящем изобретении, и материалов, описанных в данной области техники.
ПРИМЕРЫ
Настоящее изобретение ниже проиллюстрировано с помощью результатов исследований, проведенных авторами настоящего изобретения, которые демонстрируют эффективность продукта, предлагаемого в настоящем изобретении.
Пример 1
14,84 г Нитрата кобальта (Со(NO3)2,6H2O) растворяли в 100 мл воды и раствор выдерживали при перемешивании. Получали 100 мл раствора карбоната калия (К2СО3) 15% мас./мас., помещали в бюретку и медленно добавляли к раствору нитрата кобальта. Добавление карбоната продолжали до установления 30 рН 9. Твердое вещество отфильтровывали и промывали с помощью 250 мл воды при 15°С. Его сушили при 100°С в течение 16 ч и прокаливали при 400°С в течение 2 ч и получали катализатор формулы Со3О3,88К0,08.
Пример 2
Когда образец материала, полученного в соответствии с примером 1, вводили в трубчатый реактор и поток газообразного Ar при концентрации N2O, равной 1400 част./млн, загружали при отношении (скорость потока газа: объем катализатора) ЧОСГ=50300 ч-1, постепенное нагревание газов внутри реактора приводило к нарастающему снижению концентрации N2O на выходе из реактора, эквивалентному значениям степени превращения N2O, равным 73% при 260°С, 95% при 280°С и 98% при температурах выше 310°С.
Когда образец этого вещества вводили в трубчатый реактор и поток газообразного Ar при концентрации N2O, равной 1400 част./млн и O2=3% об./об., загружали при отношении (полная скорость потока газа: объем катализатора) ЧОСГ=50300 ч-1, постепенное нагревание газов внутри реактора приводило к нарастающему снижению концентрации N2O на выходе из реактора, эквивалентному значениям степени превращения N2O, равным 17% при 250°С, 88% при 300°С и 96% при температурах выше 350°С.
Когда образец этого вещества вводили в трубчатый реактор и поток газообразного Ar при концентрации N2O, равной 1400 част./млн и [H2O]=0,5% об./об. загружали при отношении (полная скорость потока газа: объем катализатора) ЧОСГ=50300 ч-1, постепенное нагревание газов внутри реактора приводило к нарастающему снижению концентрации N2O на выходе из реактора, эквивалентному значениям степени превращения N2O, равным 25% при 250°С, 75% при 280°С и 98% при температурах выше 340°С.
Когда образец материала, полученного в соответствии с примером 1, вводили в трубчатый реактор и поток газообразного Ar при концентрации N2O, равной 1400 част./млн, [O2]=3% об./об. и H2O=0,5% об./об. загружали при отношении (полная скорость потока газа: объем катализатора) ЧОСГ=50300 ч-1, постепенное нагревание газов внутри реактора приводило к нарастающему снижению концентрации N2O на выходе из реактора, эквивалентному значениям степени превращения N2O, равным 17% при 260°С, 42% при 275°С, 73% при 290°С, 94% при 315°С и 97% при температурах выше 350°С.
Когда образец материала, полученного в соответствии с примером 1, вводили в трубчатый реактор и поток газообразного Ar при концентрации N2O, равной 1400 част./млн, [O2]=3% об./об. и H2O=0,5% об./об., загружали при отношении (полная скорость потока газа: объем катализатора) ЧОСГ=50300 ч-1, поддерживая температуру реакции равной 360°С, получали начальную степень превращения N2O, равную 93%, и во время реакции происходило небольшое увеличение степени превращения до 96% за 65 ч.
Пример 3
14,84 г Нитрата кобальта (Co(NO3)2,6H2O) растворяли в 100 мл воды и раствор выдерживали при перемешивании. Получали 100 мл раствора карбоната цезия (Cs2CO3) 30% мас./мас.. Этот раствор выливали в бюретку. Медленно добавляли раствор карбоната и добавление продолжали до установления рН 9. Полный объем добавленного карбоната равнялся 57,5 мл. Твердое вещество отфильтровывали и промывали с помощью 220 мл воды при 15°С. Его сушили при 100°С в течение 16 ч и прокаливали при 400°С в течение 2 ч и получали материал формулы Co3O3,88Cs0,15.
Пример 4
Когда образец материала, полученного в соответствии с примером 3, вводили в трубчатый реактор и поток газообразного Ar при концентрации N2O, эквивалентной 1400 част./млн, [О2]=3% об./об. и Н2О=0,5% об./об., загружали при отношении (полная скорость потока газа: объем катализатора) ЧОСГ=50300 ч-1, постепенное нагревание газов внутри реактора приводило к нарастающему снижению концентрации N2O на выходе из реактора, эквивалентному значениям степени превращения N2O, равным 50% при 280°С, 80% при 300°С, 93% при 320°С и 97% при температурах выше 340°С.
Пример 5
59,36 г Нитрата кобальта (Co(NO3)2,6H2O) растворяли в 400 мл воды и 25 раствор выдерживали при перемешивании. Получали 400 мл раствора карбоната цезия (Cs2CO3) 30% мас./мас.. Этот раствор выливали в бюретку. Медленно добавляли раствор карбоната и добавление продолжали до установления рН 9. Полный объем добавленного карбоната равнялся 207 мл. Твердое вещество отфильтровывали и промывали с помощью 1160 мл воды при 15°С. Его сушили 30 при 100°С в течение 16 ч и прокаливали при 400°С в течение 2 ч и получали материал формулы Co3O3,88Cs0,06.
Пример 6
Когда образец материала, полученного в соответствии с примером 5, вводили в трубчатый реактор и поток газообразного Ar при концентрации N2O, эквивалентной 1400 част./млн, [О2]=3% об./об. и Н2О=0,5% об./об., загружали при отношении (полная скорость потока газа: объем катализатора) ЧОСГ=24000 ч-1, постепенное нагревание газов внутри реактора приводило к нарастающему снижению концентрации N2O на выходе из реактора, эквивалентному значениям степени превращения N2O, равным 47% при 250°С, 88% при 280°С, 95% при 300°С и 99% при температурах выше 320°С.
Пример 7
14,84 г Нитрата кобальта (Со(МО3)2,6H2O) растворяли в 100 мл воды и раствор выдерживали при перемешивании. Получали 100 мл раствора карбоната калия (K2CO3) 15% мас./мас., помещали в бюретку и раствор карбоната калия медленно добавляли к раствору нитрата кобальта и добавление карбоната продолжали до установления рН 9. Полный объем добавленного карбоната равнялся 54 мл. Твердое вещество отфильтровывали и промывали с помощью 400 мл воды при 15°С. Его сушили при 100°С в течение 16 ч и прокаливали при 400°С в течение 2 ч и получали не содержащий К материал формулы Co3O4.
Пример 8
Когда образец материала, полученного в соответствии с примером 7, вводили в трубчатый реактор и поток газообразного Ar при концентрации N2O, эквивалентной 1400 част./млн загружали при отношении (скорость потока газа: объем катализатора) ЧОСГ=50300 ч-1, постепенное нагревание газов внутри реактора приводило к нарастающему снижению концентрации N2O на выходе из реактора, эквивалентному значениям степени превращения N2O, равным 9% при 280°С, 20% при 320°С, 34% при 360°С и 44% при 380°С. Снижение степени превращения N2O вследствие отсутствия щелочного элемента наблюдали во всем диапазоне использованной температуры.
Пример 9
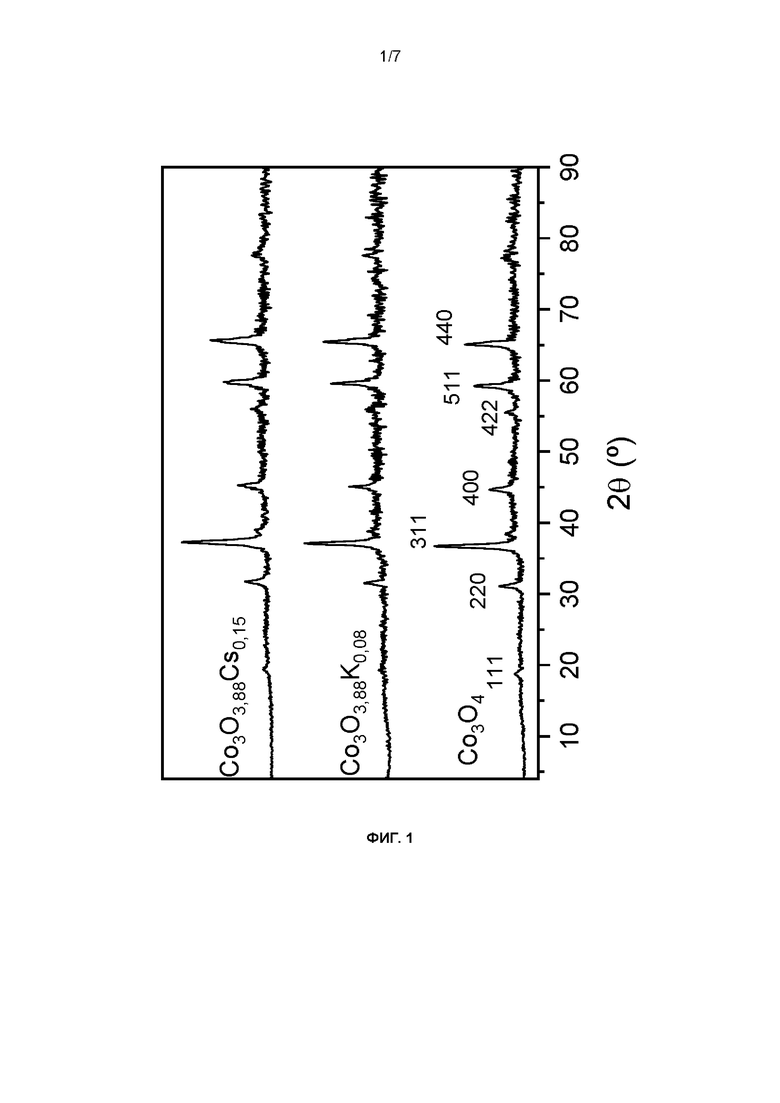
Рентгенограммы (РГГ) материалов, описанных в примерах 1 и 3, показывают, что эти материалы обладают кубической структурой, близкой к структуре шпинели Co3O4, описанной в примере 7 (JCPDS 00-042-1467) (фиг. 1). Средний размер кристаллита рассчитывали по уравнению Шерера и получали значения, соответственно равные примерно 18 нм и 10 нм.
Полученные с помощью сканирующей электронной микроскопии микрофотографии этих материалов (фиг. 2) показали, что средний размер первичных частиц равен от 10 до 20 нм для примера 1 и 8-15 нм для примера 3.
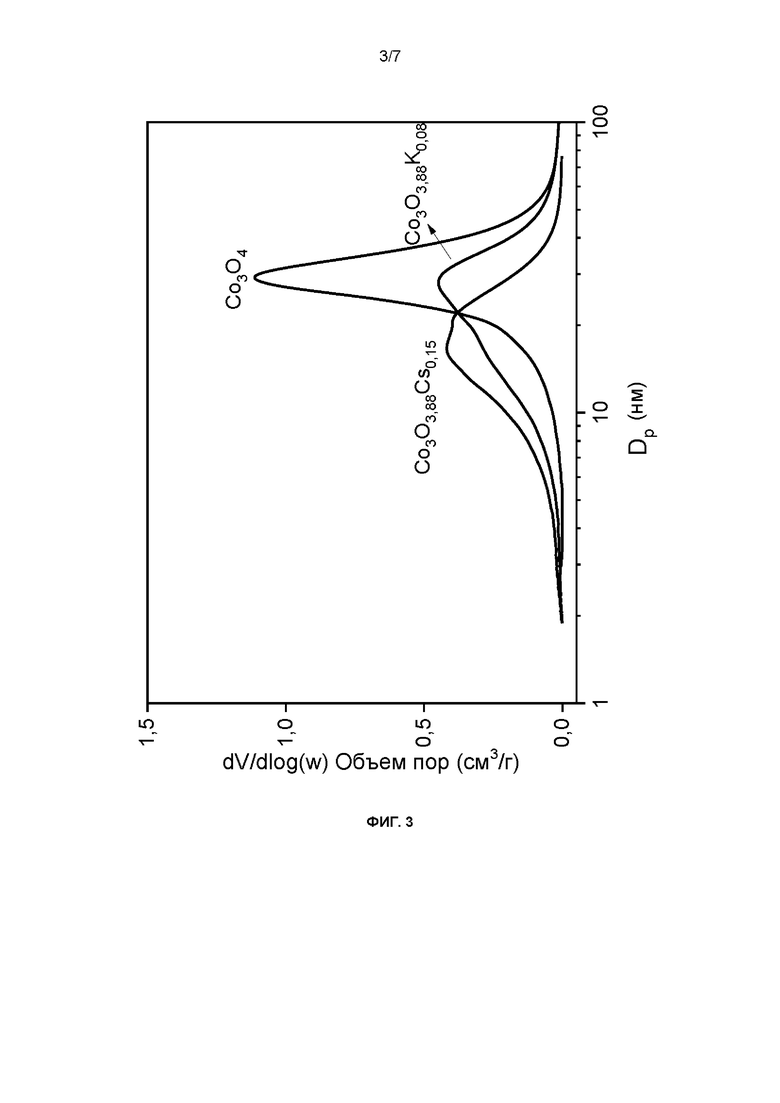
На этих микрофотографиях приведен общий вид поверхности материалов, образованных агломератами первичных частиц с размерами, сходными с полученными для размеров кристаллитов с помощью РГГ, и с порами, диаметр которых по данным изотерм адсорбции-десорбции N2 находится в диапазоне мезопористых материалов (2-50 нм) (фиг. 3).
Пример 10
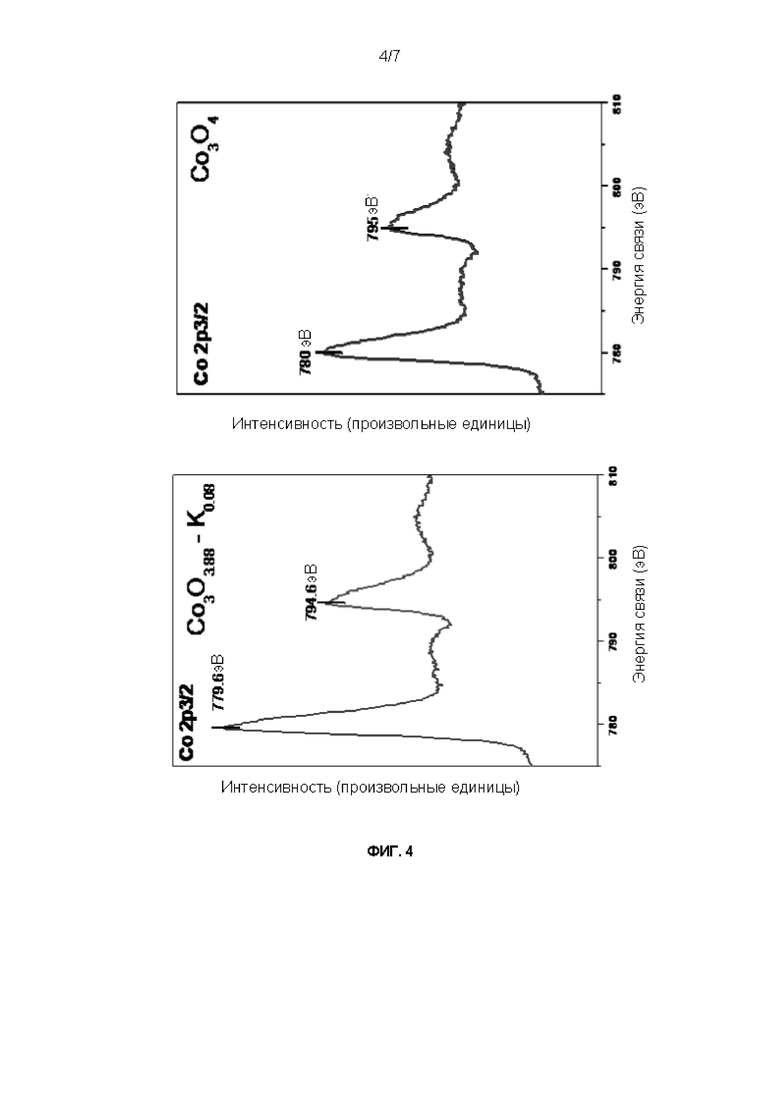
Образцы материалов, описанных в примерах 1 и 7, анализировали с помощью рентгеноэлектронной спектроскопии (РЭС) и обнаружили сдвиг уровня Со 2р в образце Со3О3,88К0,08 (пример 1) в сторону меньших энергий связи по сравнению с образцом, не содержащим К (пример 7), что объяснено увеличением содержания соединений Со(II) (СоО), которые стабилизированы электронодонорным эффектом, стимулированным присутствием ионов К+ (фиг. 4).
По этим результатам материал, полученный по процедуре, описанной в настоящем изобретении, по окислительно-восстановительным характеристикам явно отличается от описанных ранее.
Пример 11
Эксперименты по восстановлению при программируемой температуре проводили для материалов, описанных в примерах 1 и 3, и обнаружили смещение первого пика восстановления в сторону более низких температур (246 и 262°С соответственно для Со3О3,88К0,08 и Со3О3,88Cs0,15) по сравнению с пиками, приведенными в данной области техники для обычной шпинели (фиг. 5). На основании этих результатов рассчитано отношение Со2+/Со3+ и получили значение, превышающее стехиометрическое значение (0,7 по сравнению с 0,5). Это увеличение отношения содержания Со(II) к содержанию Со(III) в решетке шпинели приводит к образованию некоторой доли кислородных вакансий, которые придают поверхности материала особые характеристики адсорбции и активации молекулы N2O. Эти изменения стехиометрии шпинели делают ее дефицитной по кислороду.
По этим результатам материал, полученный по процедуре, описанной в настоящем изобретении, по окислительно-восстановительным характеристикам явно отличается от описанных ранее.
Пример 12
Эксперименты по десорбции О2 при программируемой температуре (О2-TPD) проводили для материалов, описанных в примерах 1, 3 и 7. Для материалов, промывку которых регулировали (примеры 1 и 3), пик для кислорода поверхности (PO2-I) появлялся при температурах около 100°С (фиг. 6), а для материала, не содержащего К, при 190°С (пример 7).
Кроме того, пик для кислорода решетки (PO2-II) смещен в сторону более низких температур (180-350°С)), а для не содержащей К шпинели этот пик появлялся при температуре выше 300°С.
На основании этих результатов можно заключить, что материалы, защищенные настоящим патентом, явно различаются по способности к адсорбции/десорбции своего О2.
Наиболее признанным механизмов реакции разложения N2O является разложение путем адсорбции N2O на активном центре [А] с выделением N2 и сохранении адсорбции атома О на этом центре. Вторая молекула N2O адсорбируется на этом центре с образованием второй молекулы N2. Эти два адсорбированных атома О должны рекомбинировать с образованием молекулярного О2, что является лимитирующей стадией реакции:
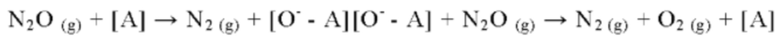
Полученные результаты DTP O2 показывают, что образцы, описанные в примерах 1 и 3 обладают способностью проводить процессы десорбции О2 кислорода решетки (PO2-II) при температуре (200-300°С), значительно более низкой, чем необходимая для образца с обычной структурой шпинели (>300°С). Можно считать, что это связано со снижением температуры, необходимой для проведения процесса разложения N2O этими новыми катализаторами при указанных условиях.
Пример 13
Поводили сопоставление данных для катализатора, полученного в соответствии с примером 1 в настоящем изобретении, с данными, описанными в документах предшествующего уровня техники, "D1" [Li Xue, Changbin Zhang, Hong He, Yasutake Teraoka, Applied Catalysis B: Environmental, Volume 75, Issues 3 4, 2007, Pages 167 174, figure 8], согласно которым, например, при 350°С, можно видеть, что степень превращения, обеспечиваемая этим катализатором при условиях влажности и в присутствии O2 близка к 77%, тогда как степень превращения в случае материала Со3О3,88К0,08 равна 96%. Для сопоставления этих результатов данные анализировали в зависимости от объемной скорости (ЧОСГ), при которой проводили разные эксперименты. На фиг. 7 приведены результаты для степени превращения N2O при условиях влажности и в присутствии O2 для указанных катализаторов в зависимости от объемной скорости или времени взаимодействия, т.е. с рассмотрением объема катализатора и скорости потока, использованных в каждом эксперименте (Т=Vcat/F=1/ЧОСГ). Это сопоставление указывает на большее улучшение каталитической активности этого вещества по сравнению с имеющимися уровнем техники, поскольку для обеспечения сходных или более значительных степеней превращения требуется меньшее время взаимодействия (меньший объем катализатора).
В приведенной ниже таблице представлены значения константы скорости реакции при 350°С, К350°С, рассчитанные с учетом того, что реакция протекает по кинетике первого порядка, что является лучшим количественным представлением каталитической активности.

Согласно этим данным увеличение скорости реакции, обусловленное катализаторами, защищенными настоящим патентом, более, чем на порядок величины превышает наилучшие значения, описанные в публикации, указанной в этом примере.
С другой стороны, катализатор, описанный в указанной публикации, D1, как Co3O4, обладает энергией связи компонента Со 2р 3/2, равной 780,1 эВ, близкой к значению для не содержащей К шпинели, описанной в примере 7 (фиг. 3), и десорбция кислорода решетки, определенная с помощью О2 DTP, происходит как для не содержащей К шпинели, описанной в примере 7, при 300°С и выше (фиг. 5).
Пример 14
Сопоставлены материал, полученный в соответствии с примером 1 и в соответствии с примером 3 в настоящем изобретении, и данные, приведенные в документе предшествующего уровня техники, "D2" [Pawel Stelmachowski, Gabriela Maniak, Andrzej Kotarba, Zbigniew Sojka, Catalysis Communications, Volume 10, Issue 7, 2009, Pages 1062-1065, Figure 7]. На фиг. 7 в "D2" можно видеть, что при условиях влажности (вариант b) легированный с помощью Cs катализатор обеспечивает значение степени превращения, близкое к 90% при 350°С. Легированный с помощью К катализатор значительно менее активен, поскольку при этой температуре оцененная по этой зависимости степень превращения близка к 50%, а степень превращения материалов в примерах 1 и 5 соответственно равна 96 и 98% при намного меньшем объеме катализатора (меньшее время взаимодействия).
Кроме того, в приведенной ниже таблице представлены значения константы скорости реакции при 350°С, К350°С, рассчитанные с учетом того, что реакция протекает по кинетике первого порядка, что является лучшим количественным представлением каталитической активности.

Согласно этим данным увеличение скорости реакции, обусловленное материалами, защищенными настоящим патентом, более, чем на порядок величины превышает наилучшие значения, описанные в публикации, указанной в этом примере.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ ДЛЯ РАЗЛОЖЕНИЯ NO | 2008 |
|
RU2456074C2 |
| СПОСОБ ПОЛУЧЕНИЯ КАТАЛИЗАТОРА ДЛЯ РИФОРМИНГА И РИФОРМИНГ МЕТАНА | 2012 |
|
RU2632197C2 |
| КАТАЛИЗАТОР РАЗЛОЖЕНИЯ ЗАКИСИ АЗОТА | 2014 |
|
RU2684908C2 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ОКИСЛЕНИЯ АММИАКА | 2010 |
|
RU2430782C1 |
| Способ окисления аммиака и система, подходящая для его осуществления | 2014 |
|
RU2646643C2 |
| КАТАЛИЗАТОР ДЛЯ РАЗЛОЖЕНИЯ ЗАКИСИ АЗОТА И СПОСОБ ОСУЩЕСТВЛЕНИЯ ПРОЦЕССОВ, ВКЛЮЧАЮЩИХ ОБРАЗОВАНИЕ ЗАКИСИ АЗОТА | 2001 |
|
RU2237514C1 |
| КАТАЛИЗАТОР ДЛЯ ПРИМЕНЕНИЯ В ВЫСОКОТЕМПЕРАТУРНОЙ РЕАКЦИИ СДВИГА И СПОСОБ ОБОГАЩЕНИЯ СМЕСИ СИНТЕЗ-ГАЗА ВОДОРОДОМ ИЛИ МОНООКСИДОМ УГЛЕРОДА | 2009 |
|
RU2498851C9 |
| КАТАЛИЗАТОР ДЛЯ РАЗЛОЖЕНИЯ NO ЕГО ПРИМЕНЕНИЕ, А ТАКЖЕ СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2258030C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРА | 2015 |
|
RU2710375C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСИДНОГО КОБАЛЬТ-ЦИНКОВОГО КАТАЛИЗАТОРА СИНТЕЗА ФИШЕРА-ТРОПША | 2008 |
|
RU2501605C2 |

Изобретение может быть использовано для снижения выбросов N2O в атмосферу. Предложен материал в качестве катализатора для разложения N2O, обладающий кристаллической структурой типа нестехиометрической шпинели общей формулы Co3O4-x/2Аy, где х равен от 0,02 до 0,3, А обозначает щелочной элемент и у равен от 0,06 до 0,18. При этом отношение А/Со равно от 0,02 до 0,06; отношение Со2+/Со3+ равно от 0,55 до 0,80; размер первичных частиц эквивалентен размеру кристаллитов, равному от 5 до 30 нм. Предложены также способ получения такого материала и его применение в качестве катализатора. Группа изобретений позволяет получить стабильный катализатор, обеспечивающий степень превращения более 90% при температурах ниже 350°С. 3 н. и 10 з.п. ф-лы, 7 ил., 2 табл., 14 пр.
1. Материал в качестве катализатора для разложения N2O, отличающийся тем, что он обладает кристаллической структурой типа нестехиометрической шпинели общей формулы Co3O4-x/2Аy, в которой
х равно от 0,02 до 0,3,
А обозначает щелочной элемент и
у равно от 0,06 до 0,18,
при отношении А/Со, равном от 0,02 до 0,06; отношении Со2+/Со3+, равном от 0,55 до 0,80; и размере первичных частиц, эквивалентном размеру кристаллитов, равному от 5 до 30 нм.
2. Материал по п. 1, где материал обладает удельной площадью поверхности БЭТ, равной от 40 м2/г до 80 м2/г.
3. Материал по любому из пп. 1 или 2, где материал обладает объемом пор, равным от 0,2 см3/г до 0,4 см3/г.
4. Материал по любому из пп. 1-3, где материал является мезопористым.
5. Материал по любому из пп. 1-4, в котором щелочным элементом А является К, х равно 0,182 и у равно 0,09.
6. Материал по любому из пп. 1-4, в котором щелочным элементом А является Cs, х равно 0,235 и у равно 0,15.
7. Способ получения материала по пп. 1-6, отличающийся тем, что он включает следующие стадии:
a) растворение соли кобальта в воде;
b) растворение соли или гидроксида щелочного металла в воде;
c) медленное добавление раствора, полученного на стадии (b), к раствору, полученному на стадии (а), до установления рН, равного от 8 до 11;
d) отфильтровывание твердого вещества, полученного на стадии (с), и его промывка с помощью от 5 мл до 75 мл воды на 1 г соли кобальта, добавленной на стадии (а);
e) сушка твердого вещества, полученного на стадии (d), при температуре от 50°С до 200°С в течение от 12 ч до 20 ч; и
f) прокаливание твердого вещества, полученного на стадии (е), при температуре от 200°С до 700°С в атмосфере воздуха в течение не менее 30 мин.
8. Способ по п. 7, в котором соль кобальта на стадии (а) выбрана из группы, включающей гексагидрат нитрата кобальта, сульфат кобальта, хлорид кобальта и ацетат кобальта.
9. Способ по любому из пп. 7 или 8, в котором соль или гидроксид щелочного металла на стадии (b) выбран из группы, включающей карбонат щелочного металла, нитрат щелочного металла, гидроксид щелочного металла и ацетат щелочного металла.
10. Способ по п. 9, в котором, если солью кобальта является гексагидрат нитрата кобальта и солью щелочного металла является карбонат щелочного металла, промывку на стадии (d) проводят количеством воды, равным от 16 мл/г до 21 мл/г гексагидрата нитрата кобальта.
11. Применение материала по любому из пп. 1-6 в качестве катализатора.
12. Применение материала по п. 11 в качестве катализатора для окисления/разложения газов.
13. Применение материала по п. 11 в качестве катализатора для разложения N2O.
| KIM MIN-JAE et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Раздвижной паровозный золотник со скользящими по его скалке поршнями и упорными для них шайбами | 1922 |
|
SU147A1 |
| СПОСОБ ИСПОЛЬЗОВАНИЯ ОДНОЙ ЛЕНТЫ КИНЕМАТОГРАФА ДЛЯ ДВУХ ЭКРАНОВ | 1920 |
|
SU2886A1 |
| СПОСОБ УДАЛЕНИЯ NO И NO В ПРОЦЕССЕ ПОЛУЧЕНИЯ АЗОТНОЙ КИСЛОТЫ И УСТРОЙСТВО ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА | 2012 |
|
RU2600753C2 |
| JP 2012050969, 15.03.2012 | |||
| JP 2007054714 A, 08.03.2007 | |||
| ASANO K | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2024-08-26—Публикация
2021-02-25—Подача