Изобретение относится к медицине, а именно к нейрохирургии, и предназначено для индивидуального планирования передней клиноидэктомии в микрохирургии сложных церебральных аневризм.
Микрохирургическое лечение церебральных аневризм (ЦА) не теряет своей актуальности (Hoh B.L. et al, 2023 Guideline for the Management of Patients With Aneurysmal Subarachnoid Hemorrhage: A Guideline From the American Heart Association/American Stroke Association. Stroke. 2023;54(7): 314-370). Несмотря на развитие эндоваскулярных технологий, микрохирургия сложных ЦА остается отдельной проблемой сосудистой нейрохирургии. Для клипирования сложных ЦА применяются расширенные базальные доступы. При выполнении расширенных краниоорбитальных доступов к аневризмам внутренней сонной артерии (ВСА) и верхних отделов базилярной артерии (ВОБА) передний наклоненный отросток (ПНО) в ряде случаев подвергается частичной или полной резекции. Существуют две техники передней клиноидэктомии (ПК): интрадуральная (ИПК) и экстрадуральная (ЭПК). Обе техники имеют свои преимущества, однако, не лишены недостатков (Huynh-Le P. et al, Intra- and extradural anterior clinoidectomy: anatomy review and surgical technique step by step.Surgical and Radiologic Anatomy. 2021;43(8): 1291-1303).
В большинстве опубликованных работ отсутствует описание критериев, определяющих показания к ПК. Авторы не уделяют внимания индивидуальному предоперационному планированию и принимают решение о проведении ПК интраоперационно. Кроме этого, в литературе отсутствует описание критериев выбора техники ПК.
Известны способы лечения аневризм клиноидного и супраклиноидного сегментов ВСА и аневризм ВОБА с использованием ПК без применения индивидуального планирования (Yonekawa Y. et al, Basilar bifurcation aneurysms. Lessons learnt from 40 consecutive cases. Acta Neurochir Suppl. 2005;94: 39-44); (Yamada Y. et al, Microsurgical Treatment of Paraclinoid Aneurysms by Extradural Anterior Clinoidectomy: The Fujita Experience. Asian J Neurosurg. 2019;14(3): 868-872). Потенциальным недостатком указанного способа является отсутствие предоперационной оценки особенностей индивидуальной костной и сосудистой анатомии. Указанный недостаток может привести к необоснованной ПК, а также к неоправданному повышению рисков доступ-ассоциированных осложнений.
В качестве ближайшего аналога выбран способ планирования ПК в микрохирургии сложных ЦА (Yonekawa Y, How to Perform Selective Extradural Anterior Clinoidectomy. In: Sindou M. Practical Handbook of Neurosurgery. Springer Vienna; 2009: 155-166). В указанном способе определение показаний к ПК, а также выбор техники резекции осуществляли на основании локализации аневризмы. В хирургии аневризм ВСА, расположенных в области устья задней соединительной артерии, выполняли ИПК. В хирургии параклиноидных, каротидно-офтальмических аневризм ВСА, а также аневризм ВОБА выполняли ЭПК. Отсутствие индивидуального подхода определяет ряд недостатков описанного способа. Не все параклиноидные, каротидно-офтальмические аневризмы и аневризмы ВОБА требуют удаления ПНО, а в хирургии аневризм устья задней соединительной артерии ПК выполняют лишь в небольшом числе случаев. Однако, описание нейровизуализационных критериев, определяющих показания к ПК, в указанном способе отсутствует. Кроме этого, отсутствует описание нейровизуализационных факторов, определяющих способ ПК. Выбор техники резекции, основанный лишь на локализации аневризмы, не учитывающий особенности индивидуальной костной и сосудистой анатомии, противоречит принципам индивидуального подхода.
Отсутствие оценки индивидуальной анатомии может привести к специфическим осложнениям, ассоциированным с ПК. Недооценка анатомии аневризмы ВСА может привести к интраоперационному разрыву в ходе ЭПК.
Недооценка пневматизации ПНО может привести к непреднамеренному внедрению в клиновидную пазуху, что несет риски доступ-ассоциированных послеоперационных осложнений: ликвореи, пневмоцефалии, менингита. Недооценка дополнительных костных точек фиксации ПНО к клиновидной кости может стать причиной его неполного удаления, интраоперационного разрыва, а также повреждения соседних нейро-васкулярных структур.
Таким образом, существует потребность в способе индивидуального планирования ПК в микрохирургии сложных ЦА, лишенном вышеуказанных недостатков.
Техническим результатом предлагаемого способа является повышение эффективности и безопасности лечения пациентов со сложными ЦА; оптимизация алгоритма определения показаний и выбора техники ПК путем применения индивидуального предоперационного планирования; снижение риска развития осложнений, связанных с недооценкой индивидуальной костной и сосудистой анатомии.
Для достижения указанного технического результата в способе индивидуального планирования передней клиноидэктомии в микрохирургии сложных церебральных аневризм, включающем определение показаний к передней клиноидэктомии (ПК), а также выбор техники ПК на основании локализации аневризмы, взаимоотношения аневризмы и костных структур основания черепа, предлагается проводить выполнение нативной КТ и КТ-ангиографии; в режимах реконструкции MPR, 3D-реконструкции и MIP определяют: размер и направление купола аневризмы, расположение купола и шейки аневризмы относительно переднего наклоненного отростка (ПНО) и расстояние от вершины ПНО до проксимальных отделов шейки аневризмы, высоту шейки и купола аневризмы относительно наиболее высокой точки заднего наклоненного отростка (ЗНО), факторы риска экстрадуральной ПК (ЭПК): пневматизацию ПНО, наличие дополнительных точек фиксации ПНО к клиновидной кости - каротидно-клиновидного отверстия и межклиновидного гребня, заднее расположение зрительной распорки; выявляют наличие разрыва аневризмы в анамнезе;
при аневризмах внутренней сонной артерии (ВСА) показаниями для проведения ПК считают расположение аневризм позади ПНО, а также в случаях, когда расстояние между вершиной ПНО и проксимальными отделами шейки аневризмы составляет менее 3 мм;
при аневризмах верхних отделов базилярной артерии (ВОБА) показаниями для проведения ПК считают размер аневризм 15 и более мм в диаметре, расположение купола аневризмы выше 10 мм от ЗНО, расположение шейки аневризмы ниже ЗНО, а также аневризмы с задним и латеральным направлением купола;
для аневризм ВСА диаметром до 15 мм, разорвавшихся аневризм диаметром 15 и более мм с передним и латеральным направлением купола аневризмы, выбирают проведение интрадуральной ПК (ИПК);
для неразорвавшихся аневризм ВСА диаметром 15 и более мм, а также разорвавшихся аневризм ВСА диаметром 15 и более мм с задним или медиальным направлением купола выбирают проведение ЭПК;
для аневризм ВОБА при выявлении хотя бы одного из факторов риска ЭПК выбирают проведение ИПК;
для аневризм ВОБА при отсутствии факторов риска ЭПК выбирают проведение ЭПК.
Для неразорвавшихся аневризм ВСА диаметром 15 и более мм, а также разорвавшихся аневризм ВСА диаметром 15 и более мм с задним или медиальным направлением купола при выявлении хотя бы одного из факторов риска ЭПК: пневматизация ПНО, наличие дополнительных точек фиксации ПНО к клиновидной кости - каротидно - клиновидное отверстие и межклиновидный гребень, заднее расположение ЗР, выбирают выполнение ИПК.
Для аневризм ВОБА при выявлении хотя бы одного из факторов риска ЭПК: пневматизация ПНО, наличие дополнительных точек фиксации ПНО к клиновидной кости - каротидно - клиновидное отверстие и межклиновидный гребень, заднее расположение ЗР, выбирают выполнение ИПК.
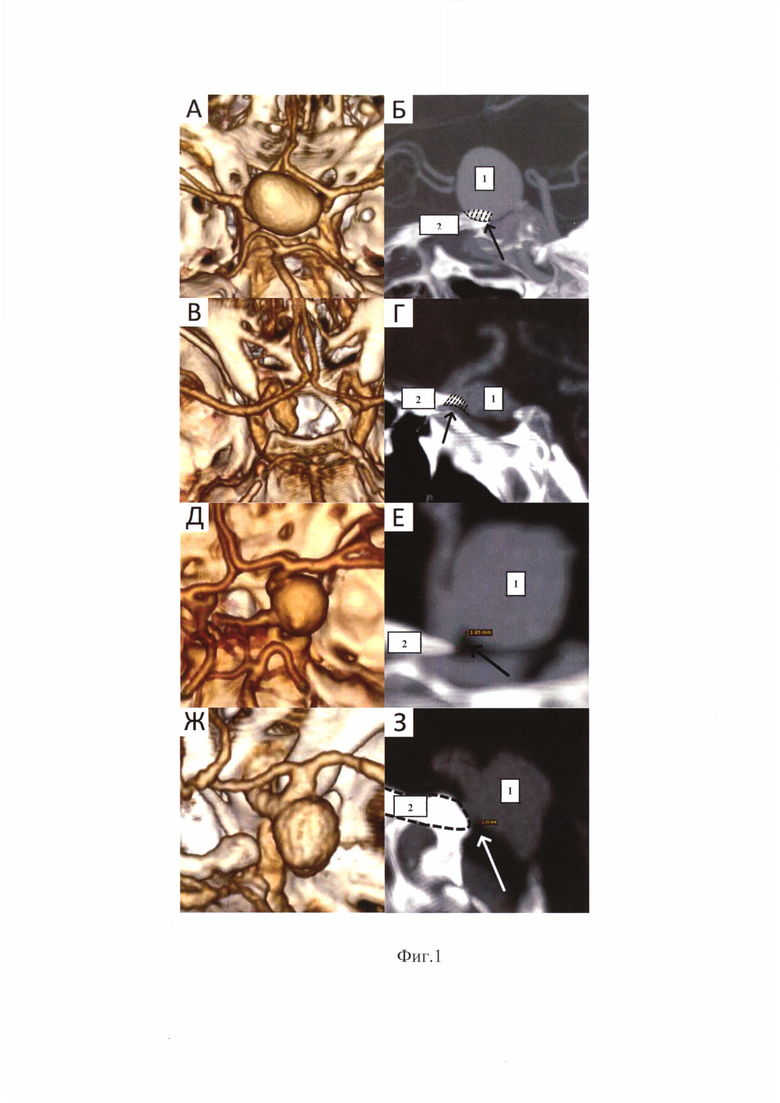
На фиг. 1 показано определение показаний к ПК в микрохирургии аневризм ВСА. А, Б, В, Г - оценка доступности аневризм для хирургических манипуляций по данным КТ-ангиографии. Проксимальная часть аневризм скрыта за ПНО, заштрихована и указана стрелками, Д, Е, Ж, З - оценка возможности интракраниального проксимального контроля кровотока по ВСА.
Расстояние между вершиной ПНО и шейкой аневризмы - 1,85 (Д, Е) и 1,35 (Ж, З) мм. Проксимальный контроль невозможен без ПК. 1 - аневризма ВСА, 2 - ПНО.
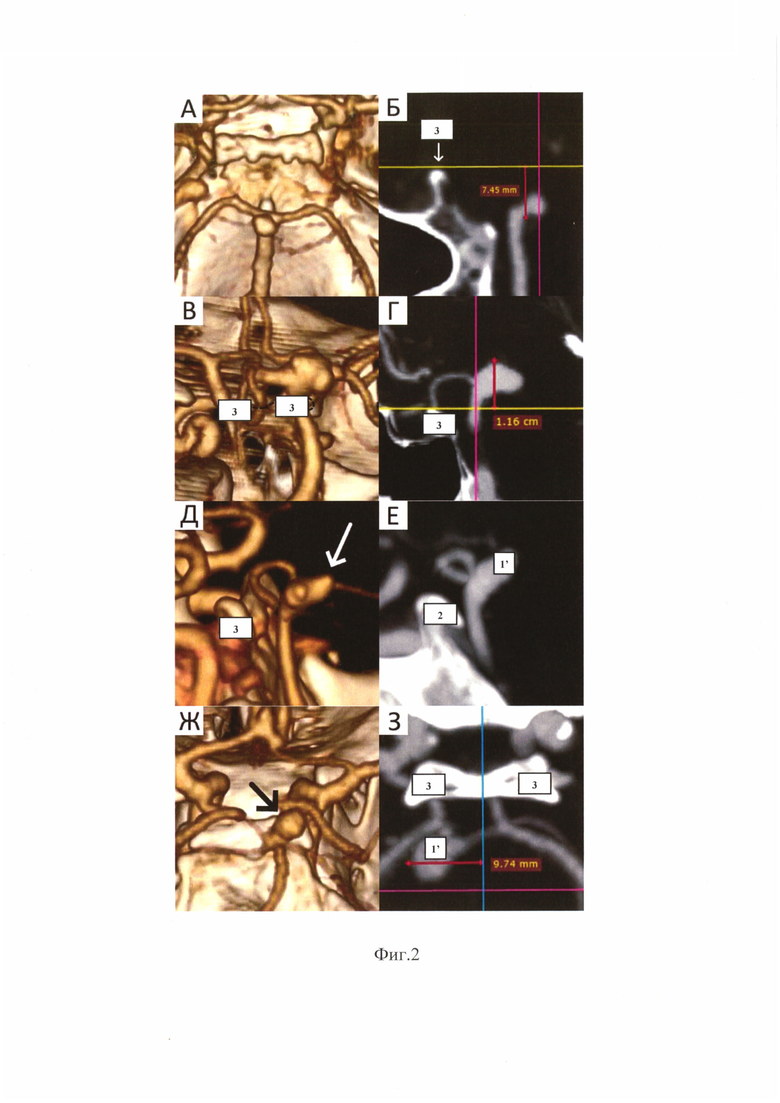
На фиг. 2 показано определение показаний к ПК в микрохирургии аневризм ВОБА. Оценка высоты расположения аневризмы. А, Б - шейка аневризмы располагается ниже ЗНО, В, Г - купол аневризмы располагается выше ЗНО на 11,6 мм, Д, Е - заднее направление купола аневризмы, Ж, 3-латеральное направление купола аневризмы ВОБА, выраженная латерализация аневризмы и базилярной артерии. 1' - аневризма ВОБА, 2 - ПНО, 3 - ЗНО.
На фиг. 3 стрелками показана оценка пневматизации ПНО. А - пневматизация ПНО в области ЗР, Б - пневматизация правого ПНО, аксиальная проекция, В - пневматизация обоих ПНО, фронтальная проекция. 2 - ПНО.
На фиг. 4 показана оценка наличия дополнительных точек фиксации ПНО к клиновидной кости. А, Б - примеры каротидно-клиновидного отверстия, В, Г - примеры межклиновидного гребня. 2 - ПНО, 3 - ЗНО, 4 - ККО, 5 - МКГ.
На фиг. 5 показана оценка положения ЗР. А - переднее положение ЗР, Б - среднее положение ЗР, В - заднее положение ЗР. 6 - ЗР, 7 - клиновидное возвышение (КВ), 8 - прехиазмальная борозда (ПБ), 9 - бугорок турецкого седла (БТС).
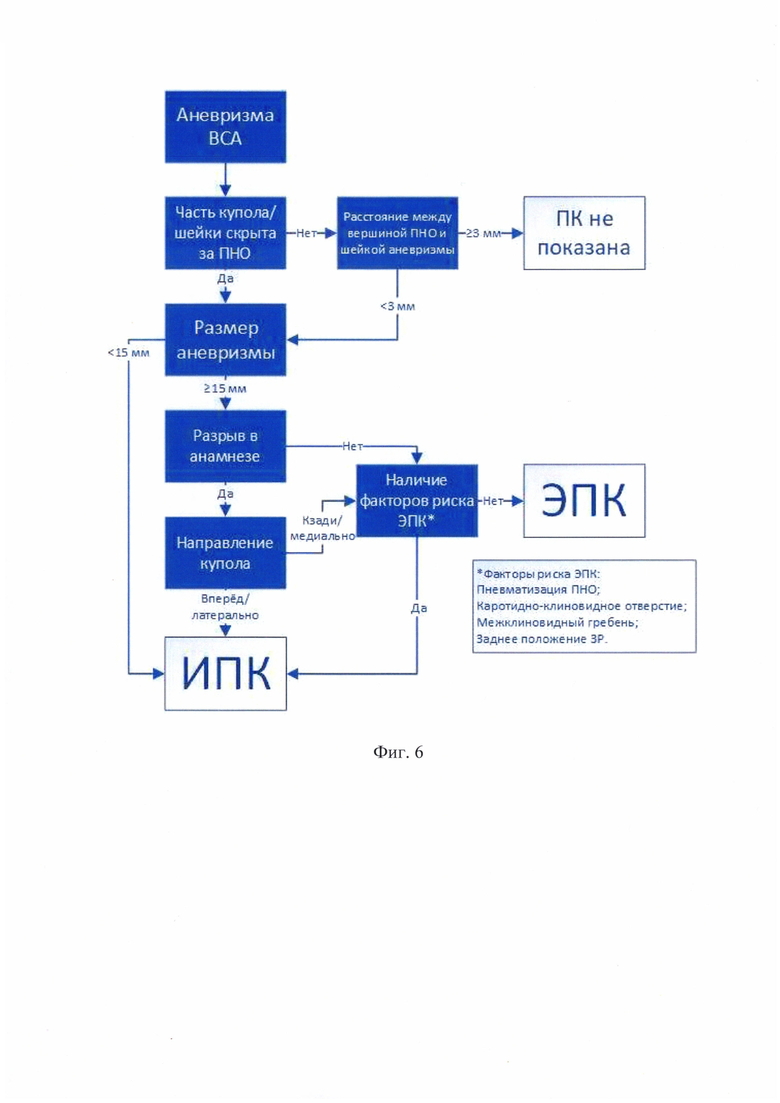
На фиг. 6 показан алгоритм индивидуального планирования ПК в хирургии сложных аневризм ВСА.
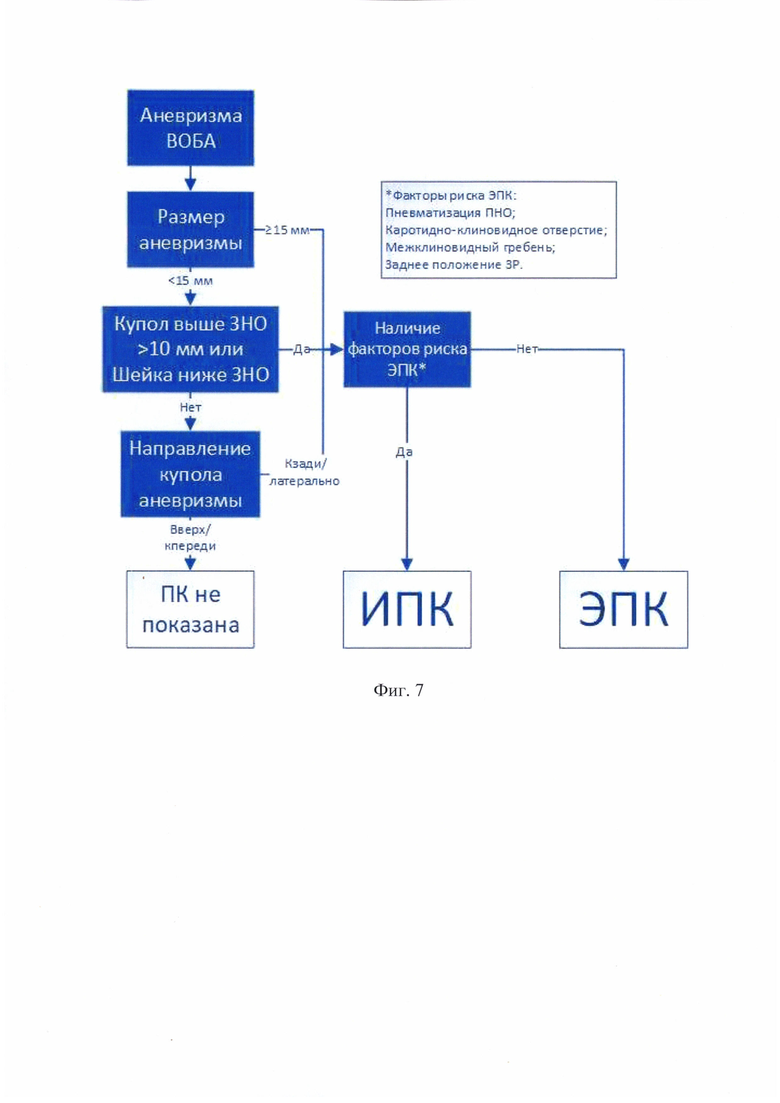
На фиг. 7 показан алгоритм индивидуального планирования ПК в хирургии сложных аневризм ВОБА.
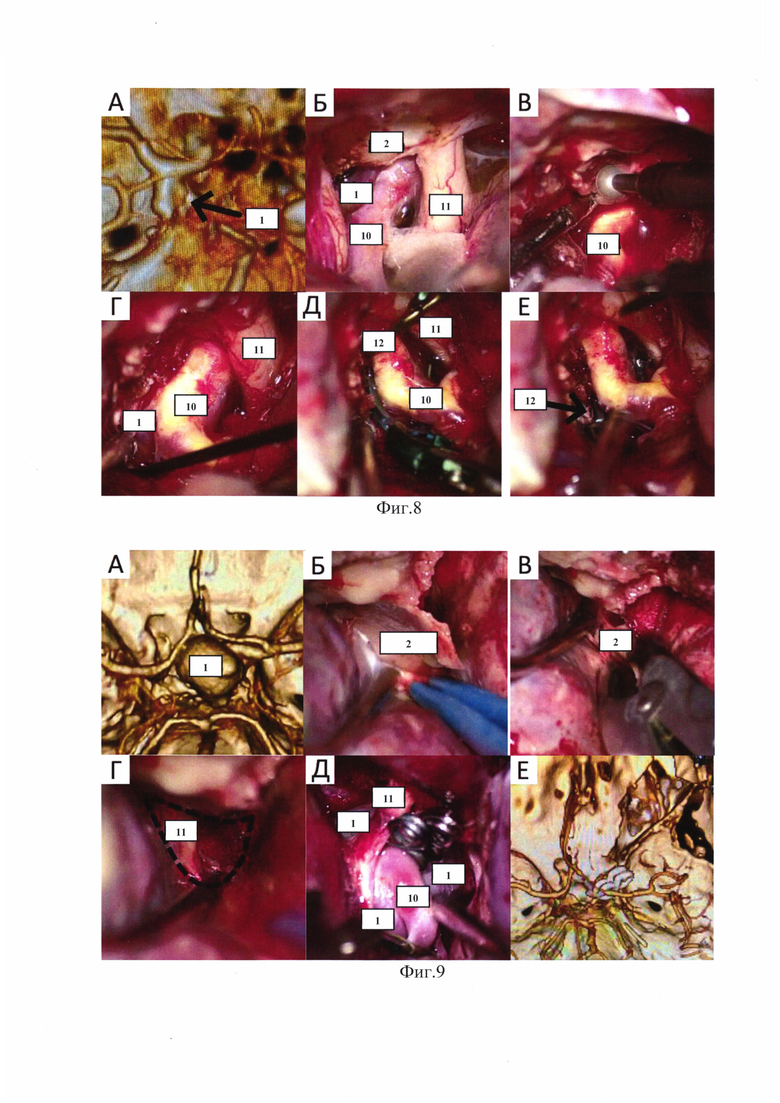
На фиг. 8 проиллюстрирован клинический пример 1, аневризма коммуникантного сегмента левой ВСА. А - 3D-реконструкция КТ-ангиографии, Б - интраоперационный вид до ИПК, В - проведение ИПК высокоскоростным бором, Г - интраоперационный вид после ИПК, Д - клипирование аневризмы на фоне временного клипирования офтальмического сегмента ВСА, Е - аневризма клипирована. 1 - аневризма ВСА, 2 - ПНО, 10 - ВСА, 11 - зрительный нерв (ЗН), 12 - временная клипса.
На фиг. 9 проиллюстрирован клинический пример 2, параклиноидная аневризма левой ВСА. А - 3D-реконструкция КТ-ангиографии, Б - экстрадуральное выделение ПНО, В - выполнение ЭПК костными кусачками, Г - интраоперационный вид после ЭПК, Д - клипирование аневризмы, Е - 3D-реконструкция послеоперационной КТ-ангиографии. 1 - аневризма ВСА, 2 - ПНО, 10 - ВСА, 11 - зрительный нерв (ЗН).
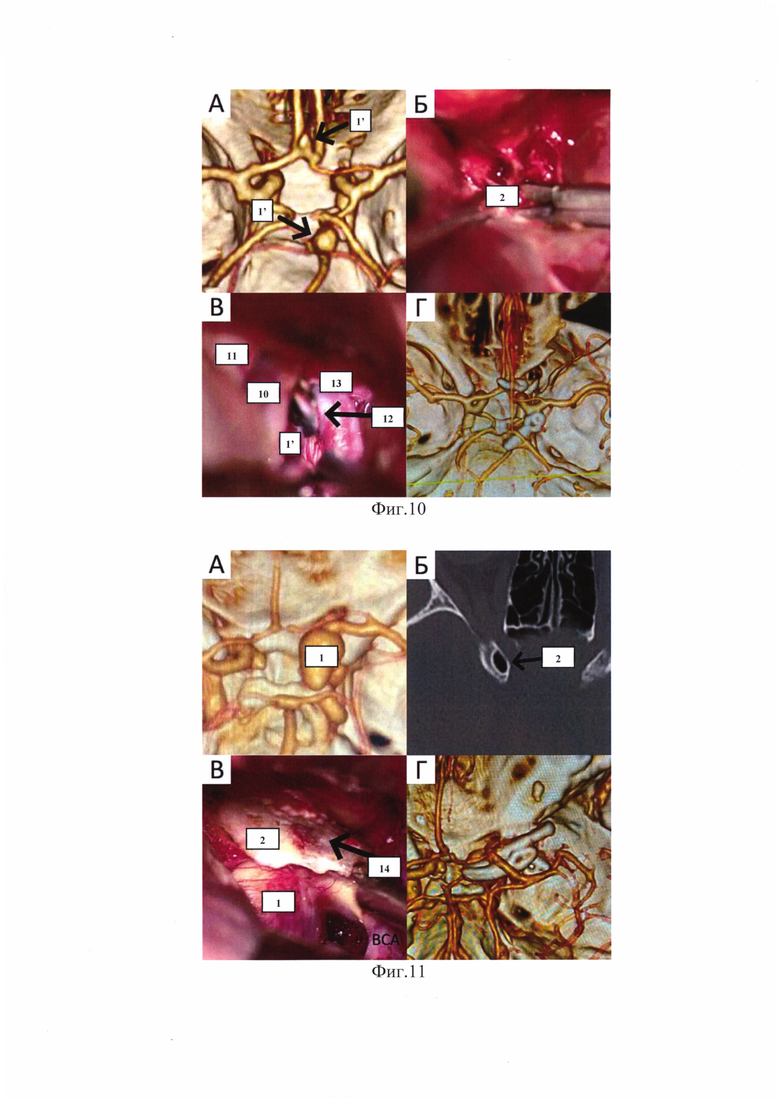
На фиг. 10 проиллюстрирован клинический пример 3, аневризмы ВОБА и передней соединительной артерии. А - 3D-реконструкция КТ-ангиографии, аневризмы указаны стрелками, Б - проведение ЭПК конхотомом, В - аневризма ВОБА клипирована, Г - 3D-реконструкция послеоперационной КТ-ангиографии. 1' - аневризма ВОБА, 2 - ПНО, 10 - ВСА, 11 - зрительный нерв (ЗН), 12 - временная клипса, 13 - базилярная артерия (БА).
На фиг. 11 проиллюстрирован клинический пример 4, аневризма офтальмического сегмента правой ВСА. А - 3D-реконструкция КТ-ангиографии, Б - правый ПНО пневматизирован, отмечено стрелкой, В - выполнена ИПК, слизистая клиновидной пазухи не повреждена, отмечена стрелкой, Г - 3D-реконструкция послеоперационной КТ-ангиографии. 1 - аневризма ВСА, 2 - ПНО, 10 - ВСА, 14 - слизистая клиновидной пазухи.
Способ осуществляют следующим образом.
Перед хирургическим вмешательством по поводу аневризм ВСА и ВОБА проводится индивидуальное планирование ПК. Алгоритм индивидуального планирования включает: определение показаний к резекции ПНО, выбор наиболее оптимальной техники резекции, а также оценку безопасности ЭПК.
Для определения показаний к ПК проводят оценку взаимоотношения костных структур и аневризмы. Оценивают данные нативной КТ и КТ-ангиографии в режимах MPR, 3D-реконструкции и MIP.
В микрохирургии аневризмы ВСА (1) оценивают следующие параметры:
1. Расположение купола и шейки аневризмы (1) относительно ПНО (2);
2. Расстояние от вершины ПНО (2) до проксимальных отделов шейки аневризмы (1).
ПК считают показанной при расположении купола или шейки аневризмы
(1) позади ПНО (2), а также в случаях, когда расстояние между вершиной ПНО
(2) и куполом аневризмы (1) менее 3 мм, что определяет невозможность проксимального контроля кровотока по офтальмическому сегменту ВСА без проведения ПК (Фиг. 1).
В микрохирургии аневризмы ВОБА (1') оценивают следующие параметры:
1. Размер аневризмы (1');
2. Высота расположения шейки и купола аневризмы (1');
3. Направление купола аневризмы (1').
Высоту расположения шейки и купола аневризмы (1') измеряли относительно наиболее высокой точки ЗНО (3) по сагиттальным срезам КТ.
В зависимости от направления купола аневризмы ВОБА аневризмы классифицировали в одну из четырех групп: аневризмы с латеральным, верхним, передним и задним направлением купола.
ПК считают показанной в микрохирургии крупных аневризм - более 15 мм в диаметре, аневризм с высоким расположением купола - более 10 мм от ЗНО (3), низким расположением шейки - ниже ЗНО (3), а также типично расположенных аневризм (1') с задним и латеральным направлением купола (Фиг. 2).
Для выбора техники резекции ПНО в хирургии аневризм ВСА учитывали следующие параметры:
1. Размер аневризмы (1');
2. Наличие разрыва аневризмы в анамнезе;
3. Направление купола аневризмы (1').
В зависимости от направления купола большие и гигантские параклиноидные аневризмы (размеры 15 мм и более в диаметре) классифицировали в одну из четырех групп: аневризмы с медиальным, латеральным, передним и задним направлением купола.
ИПК показана в хирургии милиарных и средних аневризм ВСА (размеры до 15 мм в диаметре), а также больших и гигантских разорвавшихся аневризм ВСА (размеры 15 мм и более в диаметре) с передним или латеральным направлением купола.
ЭПК показана в хирургии неразорвавшихся больших и гигантских аневризм ВСА и разорвавшихся больших и гигантских аневризм ВСА с задним или медиальным направлением купола (размеры 15 мм и более в диаметре).
В хирургии аневризм ВОБА методом выбора является ЭПК.
При оценке безопасности ЭПК учитывали следующие критерии:
1. Наличие пневматизации ПНО (2);
2. Наличие дополнительных точек фиксации ПНО к клиновидной кости;
3. Расположение зрительной распорки (ЗР).
Пневматизацию ПНО (2) выявляли по данным нативной КТ в костном режиме (Фиг. 3).
Наличие дополнительных точек фиксации ПНО (2) к клиновидной кости оценивали по данным нативной КТ в костном режиме с построением 3D-реконструкции. Учитывали наличие ККО (4) - костного кольца, окружающего ВСА, сформированного костным сращением верхушек переднего и среднего наклоненных отростков, а также МКГ (5) - костного сращения верхушек переднего и заднего наклоненных отростков (Фиг. 4).
Положение ЗР определяли по классификации, предложенной Kerr R. и соавт. (Kerr R. et al, Anatomic variation of the optic strut: classification schema, radiologic evaluation, and surgical relevance. J Neurol Surg В Skull Base. 2012;73(6): 424-429). Выделяли три типа расположения ЗР (6): переднее - в области KB (7), среднее - кзади от KB (7) в области ПБ (8), заднее - кзади от ПБ (8) в области БТС (9) (Фиг. 5).
Факторами, определяющими высокие риски осложнений, ассоциированных с ЭПК, считают наличие хотя бы одного из факторов риска: пневматизация ПНО, наличие ККО и/или МКГ, а также заднее расположение ЗР. При их отсутствии выполнение ЭПК безопасно.
В противном случае, ЭПК сопряжена с высокими рисками доступ-ассоциированных осложнений, и методом выбора является ИПК.
На фиг. 6, 7 показаны алгоритмы индивидуального планирования ПК в хирургии сложных аневризм ВСА и ВОБА согласно предлагаемому способу.
Высокая эффективность предлагаемого способа подтверждается следующими клиническими примерами.
Пример 1. Применение ИПК в микрохирургии аневризм ВСА.
Пациент А., 49 лет, переведен в отделение реанимации из другого лечебного учреждения в тяжелом состоянии.
По данным КТ головного мозга выявлено субарахноидальное кровоизлияние. По данным КТ-ангиографии церебральных сосудов верифицирована аневризма коммуникантного сегмента левой ВСА.
Перед хирургическим вмешательством проведено индивидуальное предоперационное планирования ПК предлагаемым способом. Расстояние между вершиной ПНО и шейкой аневризмы составило 1,35 мм, пациенту было показано выполнение ПК. Размер аневризмы составил 12 мм. Методом выбора являлась ИПК.
В ходе доступа к аневризме (1) выполнена птериональная краниотомия. Твердая мозговая оболочка вскрыта дугообразно к основанию черепа. Вскрыты параселлярные цистерны и Сильвиева щель. ИПК проведена высокоскоростным бором и кусачками Керрисона размером 1 и 2 мм, после чего визуализирован офтальмический сегмент ВСА (10). Выделение аневризмы (1) из окружающих тканей и арахноидальных спаек выполнено на фоне временного клипирования офтальмического сегмента ВСА (10). После выделения купола аневризмы (1) проведено клипирование аневризмы (12) (Фиг. 8).
После контроля гемостаза выполнены установка и фиксация костного лоскута, послойное ушивание раны.
Послеоперационный период проходил удовлетворительно. Новых неврологических нарушений, а также послеоперационных осложнений не отмечалось. На 7-е сутки после хирургического вмешательства пациент переведен в отделение неврологии для дальнейшего лечения и реабилитации.
Пример 2. Применение ЭПК в микрохирургии аневризм ВСА.
Пациент П., 35 лет, обратился к офтальмологу с жалобами на нарушение зрения на правый глаз.
В ходе дообследования пациент выполнил МРТ, по данным которой была заподозрена параклиноидная аневризма правой ВСА (1). При выполнении КТ-ангиографии церебральных сосудов аневризма была верифицирована. Пациент направлен на хирургическое лечение.
Перед хирургическим вмешательством проведено индивидуальное предоперационное планирования ПК. Часть купола аневризмы (1) располагалась позади ПНО (2), пациенту было показано выполнение ПК. Размер аневризмы составил 24 мм, факта разрыва аневризмы в анамнезе выявлено не было. Методом выбора являлась ЭПК. При оценке безопасности ЭПК пневматизации ПНО, дополнительных точек фиксации ПНО к клиновидной кости выявлено не было. ЗР имела среднее расположение. Выполнение ЭПК было признано безопасным.
В ходе доступа к аневризме (1) была выполнена птериональная краниотомия, дополненная резекцией крыши орбиты и ЭПК. Твердая мозговая оболочка вскрыта дугообразно к основанию черепа. ЭПК позволила визуализировать проксимальные отделы шейки аневризмы (1) и клиноидный сегмент ВСА (10). Выделение аневризмы из окружающих тканей и арахноидальных спаек осуществлялось на фоне временного клипирования клиноидного сегмента ВСА (10) с использованием традиционной техники. После выделения купола аневризмы (1) проведено реконструктивное клипирование (12) (Фиг. 9).
После контроля гемостаза выполнены установка и фиксация костного лоскута, послойное ушивание раны.
Пациент активизирован в 1-е сутки после операции. Новых неврологических нарушений, а также послеоперационных осложнений не отмечалось. Пациент выписан на 4-е сутки.
Пример 3. Применение ЭПК в микрохирургии аневризм ВОБА.
Пациент С, 52 года, обратился к неврологу с жалобами на двоение в глазах. По данным неврологического осмотра выявлена дисфункция правого глазодвигательного нерва.
В ходе дообследования пациент выполнил МРТ, по данным которой была заподозрена аневризма ВОБА (1'). При выполнении КТ-ангиографии церебральных сосудов верифицированы аневризмы ВОБА и передней соединительной артерии. Пациент направлен на хирургическое лечение.
Перед хирургическим вмешательством проведено индивидуальное предоперационное планирования ПК. Размер аневризмы ВОБА (1') составил 13 мм, купол располагался на 7 мм выше, проксимальные отделы шейки были выше ЗНО (3). Аневризма имела латеральное направление купола, пациенту было показано выполнение ЭПК. При оценке безопасности ЭПК пневматизации ПНО, дополнительных точек фиксации ПНО к клиновидной кости выявлено не было. ЗР имела переднее расположение. Выполнение ЭПК было признано безопасным.
В ходе доступа к аневризме (1') была выполнена птериональная краниотомия, дополненная резекцией крыши орбиты и ЭПК. Твердая мозговая оболочка вскрыта дугообразно к основанию черепа. Вскрыты параселлярные цистерны, Сильвиева щель. Первым этапом выделена и клипирована аневризма ПСА.
Вторым этапом осуществлен доступ к ВОБА. ЭПК, дополненная диссекцией дистального дурального кольца и серповидной связки обеспечила значительную мобилизацию ВСА (10) и зрительного нерва (11), расширение оптико-каротидного и каротидно-окуломоторного треугольников. Указанные манипуляции позволили безопасно выделить из окружающих спаек и клипировать аневризму ВОБА (1') (Фиг. 10).
После контроля гемостаза выполнены установка и фиксация костного лоскута, послойное ушивание раны.
Пациент активизирован в 2-е сутки после операции. Новых неврологических нарушений, а также послеоперационных осложнений не отмечалось. Пациент выписан на 7-е сутки.
Пример 4. Применение ИПК в случае, когда ЭПК сопряжена с высокими рисками послеоперационных осложнений.
Пациент 3., 63 года, проходил лечение по поводу транзиторной ишемической атаки.
В ходе обследования по данным КТ-ангиографии церебральных сосудов выявлена аневризма офтальмического сегмента правой ВСА (1). Пациент направлен на хирургическое лечение.
Перед хирургическим вмешательством проведено индивидуальное предоперационное планирования ПК. Часть купола аневризмы располагалась позади ПНО (2), пациенту было показано выполнение ПК. Размер аневризмы составил 15 мм, факта разрыва аневризмы в анамнезе выявлено не было. Методом выбора являлась ЭПК. При оценке безопасности ЭПК выявлена пневматизация ПНО (2), следовательно, выполнение ЭПК было сопряжено с рисками послеоперационных осложнений: ликворреи, пневмоцефалии, менингита. Принято решение выполнить ИПК.
В ходе доступа к аневризме выполнена птериональная краниотомия. Твердая мозговая оболочка вскрыта дугообразно к основанию черепа. Вскрыты параселлярные цистерны и Сильвиева щель. ИПК проведена ультразвуковым костным скальпелем. В ходе ИПК визуализирована и не повреждена слизистая оболочка клиновидной пазухи. Несмотря на пневматизацию ПНО (2), за счет применения интрадуральной техники и ультразвукового костного скальпеля, внедрения в клиновидную пазуху не произошло. После ИПК визуализированы проксимальные отделы купола и шейки аневризмы (1). Аневризма клипирована на фоне временного пережатия клиноидного сегмента (Фиг. 11).
После контроля гемостаза выполнены установка и фиксация костного лоскута, послойное ушивание раны.
Пациент активизирован в 1-е сутки после операции. Послеоперационных осложнений не отмечалось. Пациент выписан на 5-е сутки.
Пример 5. Применение ИПК при наличии ККО.
Пациент А., 49 лет, переведен в отделение реанимации из другого лечебного учреждения в тяжелом состоянии.
По данным КТ головного мозга выявлено субарахноидальное кровоизлияние. По данным КТ-ангиографии церебральных сосудов верифицирована аневризма ВОБА.
Перед хирургическим вмешательством проведено индивидуальное предоперационное планирования ПК. Размер аневризмы ВОБА составил 8 мм, купол располагался на 3 мм выше ЗНО, проксимальные отделы шейки были ниже ЗНО. Пациенту было показано выполнение ЭПК. При оценке безопасности ЭПК была выявлена дополнительная точка фиксации ПНО к клиновидной кости в виде костного сращения верхушек переднего и среднего наклоненных отростков, формирующего ККО (Фиг. 4, А). Выполнение ЭПК было сопряжено с рисками послеоперационных осложнений: неполная ПК, сопровождающаяся невозможностью доступа к шейке аневризмы, а также повреждение ВСА, проходящей через каротидно-клиновидное отверстие в ходе ЭПК. Принято решение выполнить ИПК.
В ходе доступа к аневризме выполнена птериональная краниотомия справа, дополненная резекцией крыши орбиты. Твердая мозговая оболочка вскрыта дугообразно к основанию черепа. Вскрыты параселлярные цистерны и Сильвиева щель, выполнена вентрикулоцистерностомия через терминальную пластинку, ликвор аспирирован. После релаксации мозга выполнена ИПК, а также резекция ЗНО. ИПК выполнялась под прямым визуальным контролем ВСА, проходящей через ККО, что позволило резецировать ПНО без рисков ее повреждения. Описанные манипуляции позволили визуализировать проксимальные отделы шейки аневризмы. На фоне временного клипирования базилярной артерии аневризма выделена из окружающих арахноидальных спаек и клипирована.
После контроля гемостаза выполнены установка и фиксация костного лоскута, послойное ушивание раны.
Послеоперационный период проходил удовлетворительно. Новых неврологических нарушений, а также послеоперационных осложнений не отмечалось. На 5-е сутки после хирургического вмешательства пациент переведен в отделение неврологии для дальнейшего лечения и реабилитации.
Пример 6. Применение ИПК при наличии МКГ.
Пациент И., 28 лет, переведен в отделение реанимации из другого лечебного учреждения в тяжелом состоянии.
По данным КТ головного мозга выявлено субарахноидальное кровоизлияние. По данным КТ-ангиографии церебральных сосудов верифицирована параклиноидная аневризма левой ВСА.
Перед хирургическим вмешательством проведено индивидуальное предоперационное планирования ПК предлагаемым способом. Часть шейки аневризмы была скрыта за ПНО, пациенту было показано выполнение ПК. Размер аневризмы составил 18 мм, пациент госпитализирован после разрыва аневризмы, аневризма имела заднее направление купола. Методом выбора являлась ЭПК. При оценке безопасности ЭПК была выявлена дополнительная точка фиксации ПНО к клиновидной кости в виде костного сращения верхушек переднего и заднего наклоненных отростков, формирующего МКГ (Фиг. 4, В). Выполнение ЭПК было сопряжено с рисками интраоперационных осложнений: разрыва аневризмы на этапе ЭПК за счет дополнительной фиксации ПНО к клиновидной кости, а также неполной ЭПК, сопровождающейся невозможностью доступа к шейке аневризмы и клиноидному сегменту ВСА. Принято решение выполнить ИПК.
В ходе доступа к аневризме выполнена птериональная краниотомия. Твердая мозговая оболочка вскрыта дугообразно к основанию черепа. Вскрыты параселлярные цистерны и Сильвиева щель, выполнена вентрикулоцистерностомия через терминальную пластинку, ликвор аспирирован. После релаксации мозга выполнена ИПК. ИПК выполнялась под прямым визуальным контролем аневризмы и МКГ, что позволило полностью резецировать ПНО с минимальными рисками интраоперационного разрыва. На фоне временного пережатия клиноидного сегмента ВСА аневризма выделена из окружающих арахноидальных спаек и клипирована.
После контроля гемостаза выполнены установка и фиксация костного лоскута, послойное ушивание раны.
Послеоперационный период проходил удовлетворительно. Новых неврологических нарушений, а также послеоперационных осложнений не отмечалось. На 6-е сутки после хирургического вмешательства пациент переведен в отделение неврологии для дальнейшего лечения и реабилитации.
Пример 7. Применение ИПК при наличии МКГ.
Пациент Д., 67 лет, обратился к офтальмологу с жалобами на нарушение зрения на левый глаз.
В ходе дообследования пациент выполнил МРТ, по данным которой была заподозрена параклиноидная аневризма левой ВСА. При выполнении КТ-ангиографии церебральных сосудов аневризма была верифицирована. Пациент направлен на хирургическое лечение.
Перед хирургическим вмешательством проведено индивидуальное предоперационное планирования ПК предлагаемым способом. Часть шейки аневризмы была скрыта за ПНО, пациенту было показано выполнение ПК. Размер аневризмы составил 21 мм, факта разрыва аневризмы в анамнезе выявлено не было. Методом выбора являлась ЭПК. При оценке безопасности ЭПК было выявлено заднее расположение ЗР (Фиг. 5, В). Выполнение ЭПК было сопряжено с рисками интраоперационных осложнений: разрыва аневризмы на этапе ЭПК за счет дополнительной фиксации ПНО к клиновидной кости, а также неполной ЭПК, сопровождающейся невозможностью доступа к шейке аневризмы и клиноидному сегменту ВСА. Принято решение выполнить ИПК.
В ходе доступа к аневризме выполнена птериональная краниотомия, дополненная резекцией крыши орбиты. Твердая мозговая оболочка вскрыта дугообразно к основанию черепа. Вскрыты параселлярные цистерны и Сильвиева щель, ликвор аспирирован. После релаксации мозга выполнена ИПК. ИПК выполнялась под прямым визуальным контролем аневризмы и ЗР, что позволило полностью резецировать ПНО с минимальными рисками интраоперационного разрыва. На фоне временного пережатия клиноидного сегмента ВСА аневризма выделена из окружающих арахноидальных спаек и клипирована.
После контроля гемостаза выполнены установка и фиксация костного лоскута, послойное ушивание раны.
Пациент активизирован в 2-е сутки после операции. Послеоперационных осложнений не отмечалось. Пациент выписан на 7-е сутки.
Таким образом, предлагаемый способ позволяет повысить эффективность и безопасность лечения пациентов со сложными ЦА; оптимизировать алгоритм определения показаний и выбора техники резекции ПНО путем применения индивидуального предоперационного планирования; снизить риск развития осложнений, связанных с недооценкой индивидуальной костной и сосудистой анатомии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ И КОНТРОЛЯ КРОВОТЕЧЕНИЯ ИЗ АНЕВРИЗМ ОФТАЛЬМИЧЕСКОГО СЕГМЕНТА ВНУТРЕННЕЙ СОННОЙ АРТЕРИИ | 2023 |
|
RU2823205C1 |
| Способ двухлоскутной орбитоптериональной краниотомии | 2024 |
|
RU2836844C1 |
| Способ прогнозирования возвращения пациентов к трудовой деятельности после микрохирургического клипирования разорвавшихся церебральных аневризм в острой стадии разрыва | 2023 |
|
RU2828469C1 |
| МАЛОТРАВМАТИЧНЫЙ ТРАНСОРБИТАЛЬНЫЙ ДОСТУП С ЭКСТРАДУРАЛЬНОЙ РЕЗЕКЦИЕЙ ПЕРЕДНЕГО НАКЛОНЕННОГО ОТРОСТКА В ХИРУРГИИ АНЕВРИЗМ ВЕРХНИХ ОТДЕЛОВ БАЗИЛЯРНОЙ АРТЕРИИ | 2018 |
|
RU2704883C1 |
| СПОСОБ ЛЕЧЕНИЯ АНЕВРИЗМ ВЕРХНИХ ОТДЕЛОВ БАЗИЛЯРНОЙ АРТЕРИИ В ОСТРОМ ПЕРИОДЕ КРОВОИЗЛИЯНИЯ | 2022 |
|
RU2814656C2 |
| Способ латеральной транспальпебральной орбитотомии в хирургическом лечении неразорвавшихся аневризм супраклиноидного сегмента внутренней сонной артерии | 2021 |
|
RU2781742C2 |
| СПОСОБ КОНТРЛАТЕРАЛЬНОГО ЭНДОСКОПИЧЕСКОГО КЛИПИРОВАНИЯ ОФТАЛЬМИЧЕСКИХ АНЕВРИЗМ ВНУТРЕННЕЙ СОННОЙ АРТЕРИИ ЧЕРЕЗ BURR-HOLE ДОСТУП | 2020 |
|
RU2757345C1 |
| Способ эверсионной каротидной эндартерэктомии | 2018 |
|
RU2693676C1 |
| Способ хирургической коррекции сочетанного поражения сонных артерий | 2017 |
|
RU2648881C1 |
| Способ выбора тактики хирургического лечения аневризмы офтальмического сегмента внутренней сонной артерии при вовлечении глазничной артерии в структуру аневризмы либо с ней ассоциированной | 2018 |
|
RU2708058C1 |


Изобретение относится к медицине, а именно к нейрохирургии, и может быть использовано для индивидуального планирования передней клиноидэктомии в микрохирургии сложных церебральных аневризм. Проводят оценку взаимоотношения костных структур и аневризматического комплекса, оценивают данные нативной КТ и КТ-ангиографии в режимах MPR, 3D-реконструкции и MIP. В микрохирургии аневризм ВСА оценивают расположение аневризмы относительно ПНО и расстояние от его вершины до проксимальных отделов шейки аневризмы. В микрохирургии аневризм ВОБА оценивают размер аневризмы, высоту расположения шейки и купола аневризмы по сагиттальным срезам КТ и направление купола относительно наиболее высокой точки ЗНО. Для выбора техники ПК в хирургии аневризм ВСА оценивают размер аневризмы, наличие разрыва аневризмы в анамнезе и направление купола. ИПК считают показанной в хирургии аневризм ВСА до 15 мм в диаметре, а также разорвавшихся аневризм ВСА размером 15 мм и более в диаметре с передним или латеральным направлением купола. ЭПК считают показанной в хирургии неразорвавшихся аневризм ВСА размером 15 мм и более в диаметре и разорвавшихся аневризм ВСА размером 15 мм и более в диаметре с задним или медиальным направлением купола. В хирургии аневризм ВОБА считают показанной ЭПК. Безопасность ЭПК оценивают с учетом пневматизации ПНО, наличия дополнительных точек фиксации ПНО к клиновидной кости, положения ЗР. Способ обеспечивает повышение эффективности и безопасности лечения пациентов, позволяет оптимизировать алгоритм определения показаний и выбора техники резекции ПНО и снизить риск развития осложнений, связанных с недооценкой индивидуальной костной и сосудистой анатомии за счет применения индивидуального предоперационного планирования. 2 з.п. ф-лы, 11 ил., 7 пр.
1. Способ индивидуального планирования передней клиноидэктомии в микрохирургии сложных церебральных аневризм, включающий определение показаний к передней клиноидэктомии (ПК), а также выбор техники ПК на основании локализации аневризмы, взаимоотношения аневризмы и костных структур основания черепа, характеризующийся тем, что проводят выполнение нативной КТ и КТ-ангиографии; в режимах реконструкции MPR, 3D-реконструкции и MIP определяют: размер и направление купола аневризмы, расположение купола и шейки аневризмы относительно переднего наклоненного отростка (ПНО) и расстояние от вершины ПНО до проксимальных отделов шейки аневризмы, высоту шейки и купола аневризмы относительно наиболее высокой точки заднего наклоненного отростка (ЗНО), факторы риска экстрадуральной ПК (ЭПК): пневматизацию ПНО, наличие дополнительных точек фиксации ПНО к клиновидной кости - каротидно-клиновидного отверстия и межклиновидного гребня, заднее расположение зрительной распорки; выявляют наличие разрыва аневризмы в анамнезе;
при аневризмах внутренней сонной артерии (ВСА) показаниями для проведения ПК считают расположение аневризм позади ПНО, а также в случаях, когда расстояние между вершиной ПНО и проксимальными отделами шейки аневризмы составляет менее 3 мм;
при аневризмах верхних отделов базилярной артерии (ВОБА) показаниями для проведения ПК считают размер аневризм 15 мм и более в диаметре, расположение купола аневризмы выше 10 мм от ЗНО, расположение шейки аневризмы ниже ЗНО, а также аневризмы с задним и латеральным направлением купола;
для аневризм ВСА диаметром до 15 мм, разорвавшихся аневризм диаметром 15 мм и более с передним и латеральным направлением купола аневризмы, выбирают проведение интрадуральной ПК (ИПК);
для неразорвавшихся аневризм ВСА диаметром 15 мм и более, а также разорвавшихся аневризм ВСА диаметром 15 мм и более с задним или медиальным направлением купола выбирают проведение ЭПК;
для аневризм ВОБА при выявлении хотя бы одного из факторов риска ЭПК выбирают проведение ИПК;
для аневризм ВОБА при отсутствии факторов риска ЭПК выбирают проведение ЭПК.
2. Способ по п. 1, отличающийся тем, что для неразорвавшихся аневризм ВСА диаметром 15 мм и более, а также разорвавшихся аневризм ВСА диаметром 15 мм и более с задним или медиальным направлением купола при выявлении хотя бы одного из факторов риска ЭПК: пневматизация ПНО, наличие дополнительных точек фиксации ПНО к клиновидной кости - каротидно-клиновидное отверстие и межклиновидный гребень, заднее расположение ЗР, выбирают выполнение ИПК.
3. Способ по п. 1, отличающийся тем, что для аневризм ВОБА при выявлении хотя бы одного из факторов риска ЭПК: пневматизация ПНО, наличие дополнительных точек фиксации ПНО к клиновидной кости - каротидно-клиновидное отверстие и межклиновидный гребень, заднее расположение ЗР, выбирают выполнение ИПК.
| Yonekawa Y, How to Perform Selective Extradural Anterior Clinoidectomy | |||
| In: Sindou M | |||
| Practical Handbook of Neurosurgery | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| СПОСОБ ИНДИВИДУАЛЬНОГО ПЛАНИРОВАНИЯ ТРАНСБРОВНОГО СУПРАОРБИТАЛЬНОГО ДОСТУПА К АНЕВРИЗМАМ БИФУРКАЦИИ M1-СЕГМЕНТА СРЕДНЕЙ МОЗГОВОЙ АРТЕРИИ | 2020 |
|
RU2750108C1 |
| СПОСОБ ОЦЕНКИ ФАКТОРОВ РИСКА РАЗРЫВА ЦЕРЕБРАЛЬНОЙ АНЕВРИЗМЫ ПОСЛЕ УСТАНОВКИ ПОТОКОНАПРАВЛЯЮЩЕГО СТЕНТА | 2020 |
|
RU2768150C1 |
| СПОСОБ ВЫБОРА ПОТОКОНАПРАВЛЯЮЩЕГО СТЕНТА | 2016 |
|
RU2636189C2 |
| СПОСОБ ОЦЕНКИ РИСКА НЕБЛАГОПРИЯТНОГО ИСХОДА ЗАБОЛЕВАНИЯ У БОЛЬНЫХ С НЕТРАВМАТИЧЕСКИМ СУБАРАХНОИДАЛЬНЫМ КРОВОИЗЛИЯНИЕМ (НСАК) ВСЛЕДСТВИЕ РАЗРЫВА АРТЕРИАЛЬНЫХ АНЕВРИЗМ ГОЛОВНОГО МОЗГА | 2019 |
|
RU2723754C1 |
| WO 2012101632 A1, 02.08.2012 | |||
| Люнькова Р.Н., Крылов В.В | |||
| Топография медиальной петли | |||
Авторы
Даты
2024-08-26—Публикация
2023-12-18—Подача