ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к способам проведения диагностических исследований и может быть использовано для идентификации околощитовидных желез и их патологий.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Осложнения из-за повреждения околощитовидных желез в общеоперационной практике встречаются достаточно часто, т.к. существующие методики их идентификации развиты недостаточно. Например, существует технология интраоперационного гамма-сканирования с технетрилом, которая позволяет визуализировать околощитовидные железы примерно в 30% случаев. Однако, данная методика использует дорогостоящее оборудование и радиоактивные материалы, что не позволяет рассматривать ее как перспективную технологию для внедрения в общеоперационную практику.
Другие методы визуализации околощитовидных желез связаны с введением в организм пациента красителей или фотосенсибилизаторов, например, метиленового синего, или же индоцианина зеленого. В первом случае методика не получила широкого применения в связи нестабильностью окрашивания околощитовидных желез и высокой вероятности проявления послеоперационных неврологических нарушений. К тому же околощитовидные железы отличаются небольшим размером (единицы мм), и в случае своего неудобного расположения или же окружения жировой тканью эффективное возбуждение их люминесценции прямым светом прибора с расстояния в десятки сантиметров становится проблематичным.
Из патентных источников известен метод или процесс интраоперационного обеспечения анатомического руководства в эндокринной хирургии (см. EP 3005941 B1, опубл. 27.12.2017) (1). В одном варианте осуществления метод включает этапы освещения тканей человека в области шеи для получения флуоресцентных данных, выделения флуоресцентных сигнатур, соответствующих тканям щитовидной или паращитовидной железы, и их последующую идентификацию.
Аналог (1), как уже было сказано, имеет ряд недостатков, таких как недостаточная точность и эффективность.
В настоящее время также известна лазерно-спектроскопическая рамановская система (см. CN 102928395 A, опубл. 13.02.2013) (2), которая включает в себя лазер ближнего инфракрасного диапазона с выходным волоконно-оптическим разъемом FC, волоконно-оптический соединитель с интерфейсом SMA905, оптический зонд, один конец которого соединен с лазером ближнего инфракрасного диапазона, а другой конец соединен с волоконно-оптическим соединителем спектрометра с ПЗС-детектором ближнего инфракрасного диапазона. Такая система лазерного рамановского спектрометра для ранней диагностики рака верхних отделов желудочно-кишечного тракта удобна, относительно дешева и подходит для раннего клинического выявления рака верхних отделов желудочно-кишечного тракта и может оказать необходимую помощь в исследовании механизмов рака верхних отделов желудочно-кишечного тракта.
Устройство-аналог (2) близко по выполнению к заявленному лазерно-флуоресцентному комплексу для осуществления способа лазерной спектроскопии аутофлюоресценции околощитовидных желез, однако различия в применении устройств обуславливают различия в их конструкции.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение направлено на решение технической проблемы, связанной с созданием способа лазерной спектроскопии аутофлюоресценции околощитовидных желез повышенной эффективности и точности и лазерно-флуоресцентного комплекса для осуществления данного способа.
Техническим результатом изобретения является повышение эффективности и точности идентификации щитовидной и околощитовидных желез и их патологий, а также прогнозирование возможных послеоперационных осложнений.
Технический результат достигается посредством создания и реализации способа лазерной спектроскопии аутофлюоресценции околощитовидных желез при помощи Y-образного оптоволоконного зонда с раздельными оптическими каналами и лазерно-оптической системы, в которой излучение возбуждения непрерывного лазера заводится через узел ввода оптического излучения в оптический зонд и попадает на исследуемую область пациента, далее свет сигнала аутофлюоресценции собирается светоприемным каналом оптического зонда и через узел вывода оптического излучения через светофильтр попадает на спектрометр с охлаждаемым ПЗС-фотодетектором. Разработанное программное обеспечение обеспечивает регистрацию спектральной интенсивности сигнала аутофлюоресценции, выполнение сравнительного спектрального анализа собираемых данных с их последующей обработкой специальными алгоритмами, на основе чего в дальнейшем осуществляется идентификация околощитовидных желез, диагностика их возможных патологий и прогнозируются возможные послеоперационные осложнения.
В предпочтительном варианте исполнения используют лазер возбуждения непрерывного действия с длиной волны 785 нм и мощностью 100 мВт.
В предпочтительном варианте исполнения используют Y-образный оптический зонд с наконечником из хирургической стали.
В предпочтительном варианте исполнения используют длинноволновой спектральный фильтр с длиной волны отсечки 800 нм для подавления рассеянного лазерного излучения.
В предпочтительном варианте исполнения используют спектрометр со спектральной шириной одновременно регистрируемого сигнала около 60 нм в интервале 800-870 нм.
В предпочтительном варианте исполнения используют охлаждаемый ПЗС-фотодетектор.
В предпочтительном варианте исполнения управление комплексом, регистрация спектров аутофлюоресценции и последуюшая обработка данных выполняется с помощью персонального компьютера и разработанного программного обеспечения.
Также технический результат достигается посредством создания лазерно-флуоресцентного комплекса для осуществления способа лазерной спектроскопии аутофлюоресценции околощитовидных желез, содержащего непрерывный лазер возбуждения, соединенный с Y-образным оптоволоконным зондом с раздельными оптическими каналами для излучения лазера возбуждения и сбора света аутофлюоресценции, узлы ввода и вывода оптического излучения в оптический зонд, длинноволновой спектральный фильтр для подавления рассеянного лазерного излучения, спектрометр с охлаждаемым ПЗС-фотодетектором и персональный компьютер.
В предпочтительном варианте исполнения используют лазер возбуждения непрерывного действия с длиной волны 785 нм и мощностью 100 мВт.
В предпочтительном варианте исполнения используют Y-образный оптический зонд с наконечником из хирургической стали.
В предпочтительном варианте исполнения используют длинноволновой спектральный фильтр с длиной волны отсечки 800 нм для подавления рассеянного лазерного излучения.
В предпочтительном варианте выполнения используют спектрометр со спектральной шириной одновременно регистрируемого сигнала около 60 нм (в диапазоне 800-870 нм) и охлаждаемый ПЗС-фотодетектор.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Сущность изобретения поясняется чертежами и рисунками, на которых:
Фиг. 1 - лазерно-флуоресцентный комплекс;
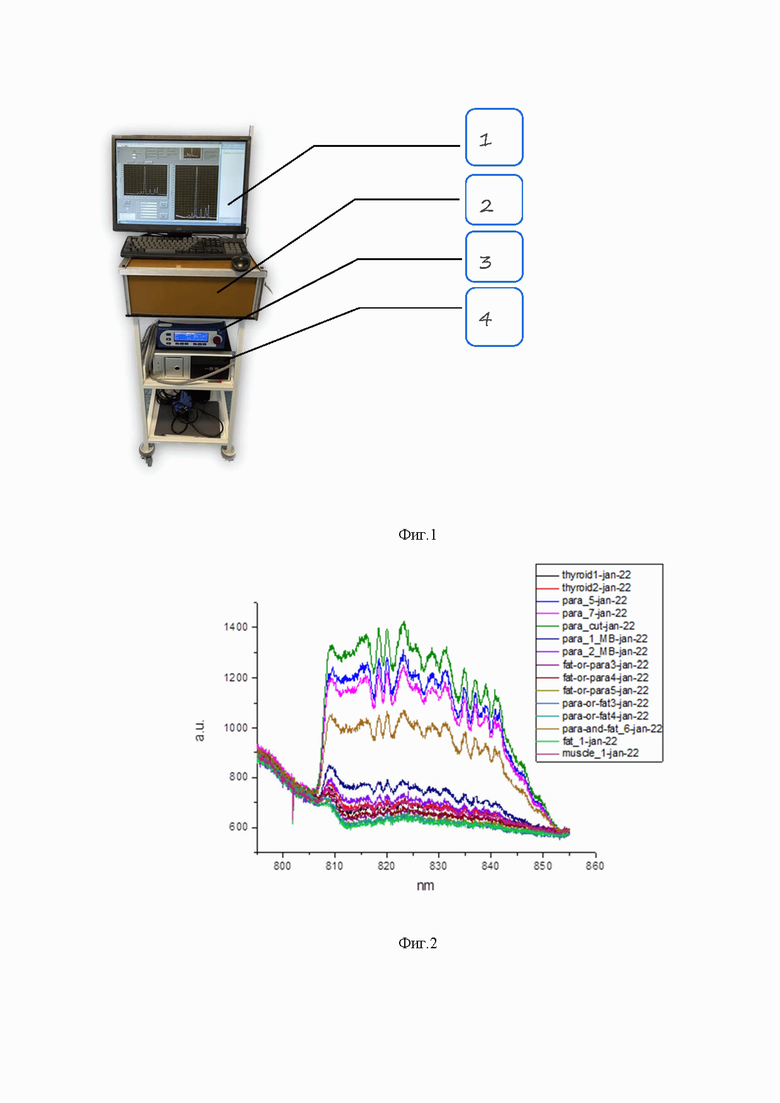
Фиг. 2 - типичные спектры аутофлюоресценции тканей гортани;
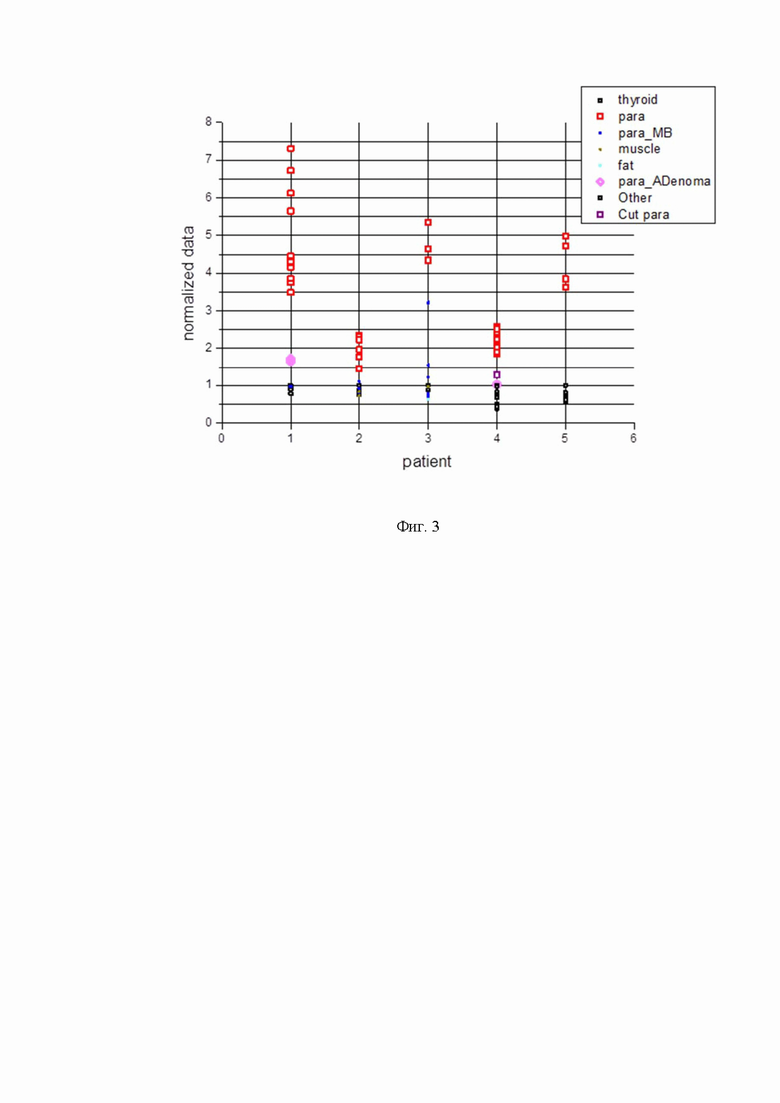
Фиг. 3 - нормированные на сигнал щитовидной железы значения интегральной спектральной интенсивности аутофлюоресценции тканей гортани пациентов;
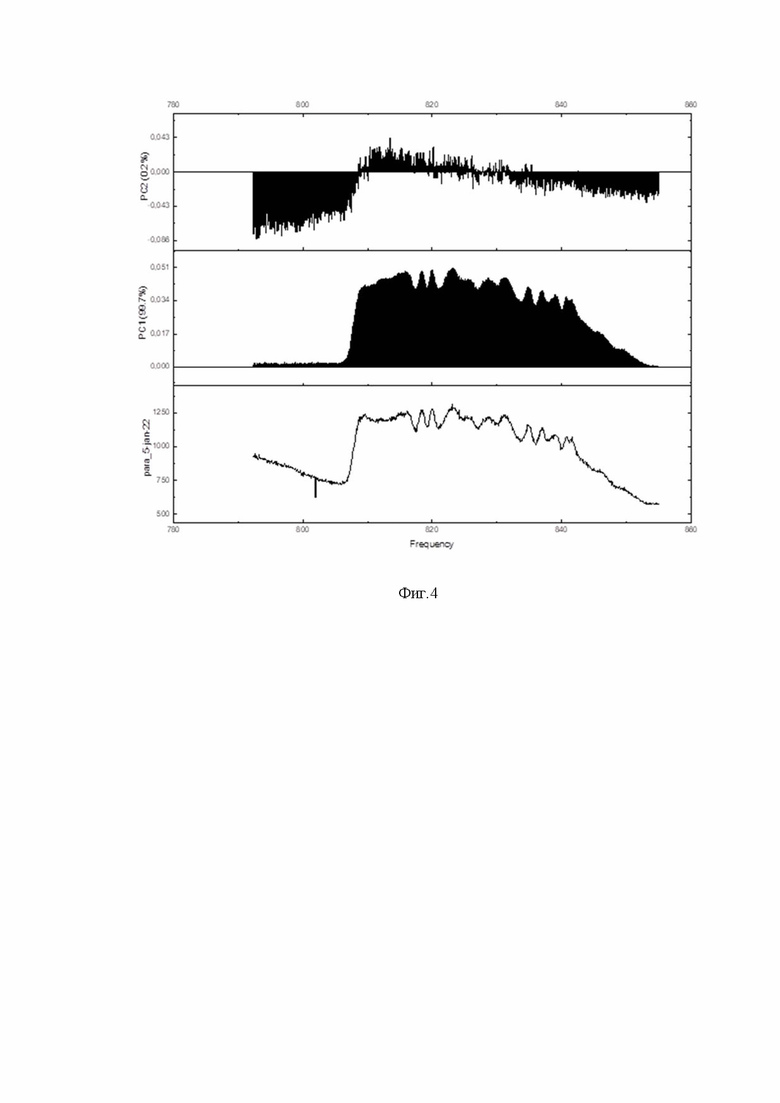
Фиг. 4 - нагрузка для главной компоненты 2 (сверху), для главной компоненты 1 (центр) и пример спектра аутофлюоресценции (снизу).
На фиг. 1 позиции обозначают следующее:
1 - монитор;
2 - лазерно-оптический комплекс;
3 - блок питания лазера;
4 - компьютер.
Приведенные рисунки не охватывают и, кроме того, не ограничивают весь объем вариантов реализации данного технического решения, а представляют собой только иллюстративный материал частного случая его реализации.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Заболеваниями щитовидной железы разной степени тяжести страдает большое количество людей во всем мире. Количество операций на щитовидной железе возрастает с каждым годом - в среднем в Америке их число составляет 150 тыс. в год, в России 50-60 тыс. в год.
Проведение хирургического вмешательства всегда связано с риском послеоперационных осложнений. По статистике, при операциях на щитовидной железе около 40% осложнений связано с гипопаратиреозом, и до 20 % осложнений связано с парезом гортани. Гипопаратиреоз - понижение функции щитовидной железы, парез гортани - уменьшение двигательной активности мышц гортани, приводящее к нарушению голосообразования и дыхательной функции. Временные осложнения после операционного вмешательства происходят в 30% случаях, из них 12% перерастают в постоянные. На данный момент нет эффективных способов профилактики развития осложнений. Существующие же методы борьбы с осложнениями базируются в основном на опыте хирурга, использовании во время операции сложной хирургической техники и выполнении комплекса необходимых послеоперационных мероприятий.
Основной причиной осложнений являются, как правило, повреждение гортанного нерва и неправильная идентификация околощитовидных желез и опухолей из-за труднодоступности их расположения и малых размеров, что может привести, например, к неполному удалению больной железы или удалению здоровой. Разработка эффективного способа дифференциации тканей желез позволит снизить количество послеоперационных осложнений, а анализ данных, полученных в ходе операции, позволит вовремя предпринять меры по профилактике последствий осложнений, тем самым минимизировав ущерб для организма пациента.
Разработка способа лазерной спектроскопии аутофлюоресценции околощитовидных желез включала несколько этапов: на первом этапе образцы тканей гортани пациентов (ткани жира и мышц) и тканей околощитовидных и щитовидной желез исследовались в лабораторных условиях. Далее полученные в лабораторных условиях спектры люминесценции, возбуждения люминесценции и аутолюминесценции образцов анализировались с целью подбора оптимальных условий проведения эксперимента in vivo, благодаря чему была разработана предварительная методика идентификации околощитовидных и щитовидной желез. На основе этой предварительной методики и лабораторных данных подобраны элементы оптической и электронной систем для создания комплекса для осуществления способа лазерной спектроскопии аутофлюоресценции околощитовидных желез.
На следующем этапе для измерения спектров аутофлюоресценции был создан приборный комплекс в составе: непрерывный лазер возбуждения с длиной волны 785 нм и мощностью 100 мВт, Y-образный оптоволоконный зонд с раздельными оптическими каналами для излучения лазера возбуждения и сбора света аутофлюоресценции, узлы ввода и вывода оптического излучения в оптический зонд, длинноволновой спектральный фильтр с длиной волны отсечки 800 нм для подавления рассеянного лазерного излучения, спектрометр со спектральной шириной одновременно регистрируемого сигнала около 60 нм (в диапазоне 800-870 нм) и Пельтье-охлаждаемым ПЗС-фотодетектором. Управление комплексом и регистрация спектров аутофлюоресценции выполнялись с помощью персонального компьютера и оригинального программного обеспечения, численная обработка данных осуществлялась на базе пакета программ Origin. Измерения выполнялись in-vivo в условиях естественного освещения в операционной. Изображение выводилось на монитор. Внешний вид комплекса представлен на фиг. 1.
При помощи Y-образного оптоволоконного зонда с раздельными оптическими каналами свет непрерывного лазера возбуждения попадает через узел ввода оптического излучения в лазерный канал зонда и затем направляется на исследуемую область пациента. Далее излучение аутофлюоресценции собирается фотоприемным каналом оптоволоконного зонда и через узел вывода оптического излучения со спектральным светофильтром попадает на спектрометр с Пельтье-охлаждаемым ПЗС-фотодетектором. Зарегистрированная спектральная интенсивность сигнала обрабатывается программным обеспечением и посредством сравнительного спектрального анализа и на основе разработанного алгоритма обработки данных выполняется идентификация околощитовидных желез, диагностика возможных патологий и прогнозируются возможные послеоперационные осложнения.
Современное развитие технологий позволяет сделать такой комплекс достаточно компактным, чтобы его можно было использовать в операционной. Данный комплекс позволит осуществлять возбуждение аутофлюоресценции тканей околощитовидных и щитовидной желез и одновременно регистрировать спектры аутофлюоресценции in vivo - in vitro. С помощью полученных данных последовательно отработаны методика и алгоритм идентификации и локализации околощитовидных желез и реализован окончательный вариант макета прибора лазерно-флуоресцентного парамониторинга ОЩЖ.
На первом этапе были получены спектры аутофлюоресценции щитовидной и околощитовидных желез, а также других тканей гортани для пяти пациентов. Идентификация тканей выполнялась опытным хирургом. Полученные спектральные данные естественным образом были разбиты на несколько групп: спектры щитовидной железы - thyroid, спектры околощитовидных желез - para, спектры жировой ткани - fat, спектры мышечной ткани - muscle, а также спектры тканей, не идентифицированных хирургом с высокой точностью - para MB, para or/and fat и др. Типичный вид полученных спектров аутофлюоресценции тканей гортани представлен на фиг. 2.
На фиг. 3 представлены сравнительные данные по каждому пациенту после обработки полученных экспериментальных данных. Процедура обработки состояла в следующем: из каждого спектра вычитался фон, затем выполнялось интегрирование по спектру в диапазоне 805-850 нм, и полученные численные значения нормировались на максимальное интегральное значение интенсивности спектра щитовидной железы для данного пациента. Данный алгоритм позволяет избавиться от естественных колебаний уровня освещенности в зоне работы хирурга и позволяет получить численное значение отношения интегральной интенсивности аутофлюоресценции околощитовидной железы к интенсивности аутофлюоресценции щитовидной железы.
Из фиг. 3 можно сделать следующие выводы:
Для случаев уверенного определения хирургом области снятия спектров как околощитовидная либо щитовидная железа отношение сигнала аутофлюоресценции околощитовидной железы к сигналу щитовидной железы для пяти пациентов оказалось лежащим в пределах 1,5-7,3 (см. para на фиг. 3).
Наихудшее отношение сигнала аутофлюоресценции околощитовидной железы к сигналу щитовидной железы в пределах 1,5-2,4 и 1,9-2,5 наблюдалось для пациентов № 2 и № 4, при этом нужно отметить невысокий (по сравнению с другими пациентами) общий уровень сигнала аутофлюоресценции околощитовидной железы этих пациентов.
Интенсивность аутофлюоресценции околощитовидной железы с аденомой либо существенно ниже таковой по сравнению со здоровой околощитовидной железой (пациент № 1), либо близка к интенсивности аутофлюоресценции щитовидной железы (пациент № 4) (см. para_ADenoma на фиг. 3).
Интенсивности аутофлюоресценции тканей щитовидной железы, мышц и жира по порядку величины сравнимы между собой (см. thyroid, muscle, fat на фиг. 3).
Описанный выше алгоритм обработки данных хоть и позволяет получить численный критерий для определения типа исследуемых тканей пациента, но при этом введение конкретного порогового значения отношения сигналов аутолюминесценции для идентификации тканей паращитовидных желез является достаточно дискуссионным. Нами предлагается иной математический подход по обработке экспериментальных данных, а именно подход, основанный на формальных алгоритмах метода главных компонент и иерархического кластерного анализа. В этом случае можно добиться минимизации человеческого фактора при вынесении решения о типе исследуемых тканей пациента, т.к. такое решение будет выноситься в силу формальной математической логики на основе обучающихся алгоритмов.
На этом этапе полученные экспериментальные данные использовались для отладки алгоритма работы предлагаемого математического аппарата по обработке спектров аутофлюоресценции тканей пациентов.
Первоначально к полученным экспериментальным данным был применен метод главных компонент для выявления наиболее существенных спектральных диапазонов, обладающих наибольшей вариативностью при изменении типа ткани, с которой осуществлялась съемка спектров.
Как показал расчет, значение первого собственного числа существенно превосходит последующие. Учет только первой компоненты позволяет объяснить примерно 99,7% экспериментальной информации, а вклад второй и последующих компонент не превышает 0,2%. Это позволяет использовать в дальнейших расчетах только первую компоненту, и, в силу этого, сопоставить многомерному спектру данных некоторую одномерную переменную. На фиг.4 приводятся графики нагрузки для двух первых компонент, а также для примера приводится спектр аутофлюоресценции для ткани паращитовидной железы.
Для спектрометра, регистрирующего интенсивность с равным шагом по длинам волн, переход к одномерной интегральной величине может быть осуществлен введением переменной 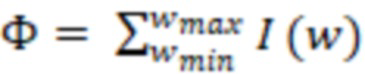 , где wmin и wmax - соответственно нижняя и верхняя границы спектра, определяемые на уровне 50% веса для первой главной компоненты, I(w) - интенсивность люминесценции на длине волны w.
, где wmin и wmax - соответственно нижняя и верхняя границы спектра, определяемые на уровне 50% веса для первой главной компоненты, I(w) - интенсивность люминесценции на длине волны w.
Для предотвращения влияния индивидуальных особенностей люминесценции тканей пациента рассматривается некоторая неоднородная область с паращитовидной тканью и вводится параметр V=(1/Ф)/(< (1/Ф)>), где < (1/Ф)> - средняя величина от 1/Ф по различным тканям в исследуемой области. Параметр 1/Ф удобен тем, что его значения локализованы в конечном интервале величин, в то время как параметр Ф, который определяется абсолютными значениями интенсивности люминесценции, может принимать значения теоретически вплоть до бесконечности.
Все имеющиеся данные по пациентам были протестированы на предмет нормального распределения при разбиении на 2 группы (паращитовидная железа + остальные) и 3 группы (паращитовидная железа + щитовидная железа + остальные). Тестирование производилось с априорным знанием распределения по группам и значений величин V.
При тестировании разбиения по трем группам непротиворечивость нормальности разбиения была подтверждена по тестированию на выполнение критериев Шапиро-Уилка, критерия Лиллиефорса и Колмогорова-Смирнова, а также теста Андерсона-Дарлинга.
Проведенное тестирование позволило на следующем этапе воспользоваться алгоритмом дисперсионного анализа ANNOVA для тестирования значимости групп и поведения средних значений. По результатам тестирования была опровергнута нулевая гипотеза о равенстве средних значений для всех трех групп. Характерное значение вероятности этого (p-value) - было гораздо меньше 0.05.
Тест Тьюки выявил значимую разницу между парами паращитовидная железа+остальные (-0,37247) и паращитовидная железа+щитовидная железа (0,37113), в то же время разница между щитовидной железой и остальными несущественна.
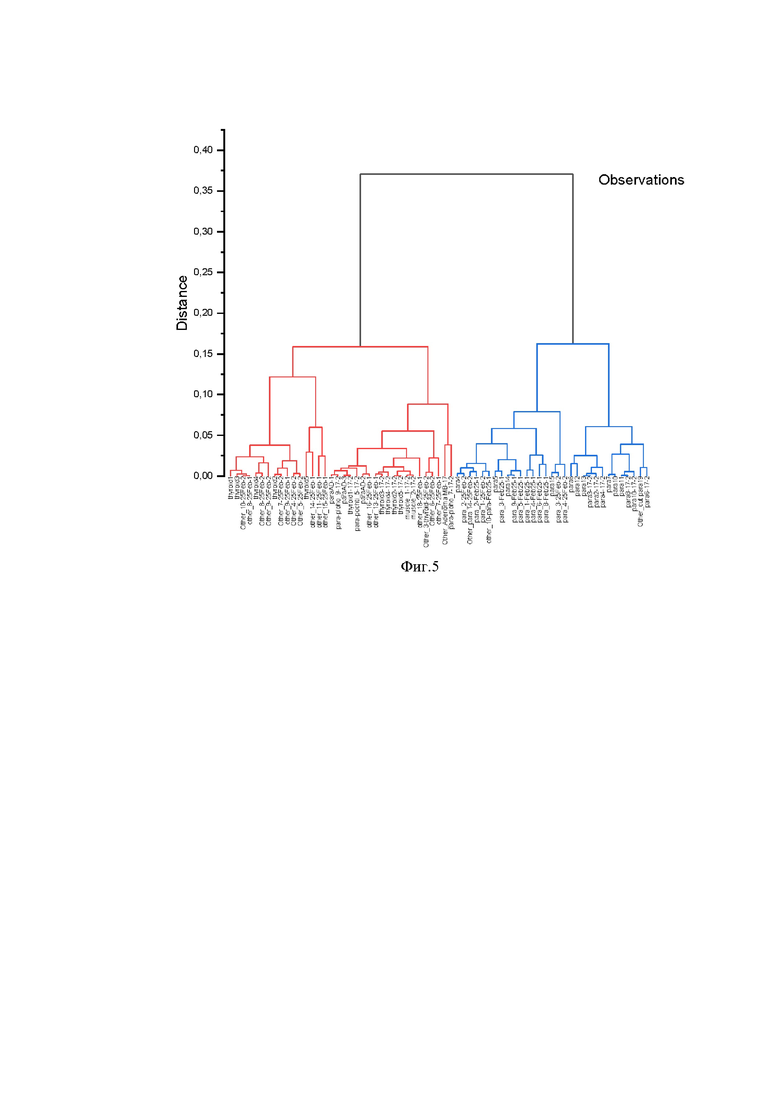
Разделение данных на два больших класса было произведено методом иерархического кластерного анализа c безаприорным знанием типа (закладывается только значение V, отнесение к классу проверяется на финальной стадии). При этом ключевой стадией принятия решения является стадия разделения на два кластера на основании Эвклидового расстояния.
Для двух кластеров были определены средние значения 1,15342 и 0.78276, что близко совпадает с результатами тестов выше на средние значения априорно заданных групп. Результаты иерархического кластерного анализа с расстоянием между кластерами 0,37066 представлены на фиг.5.
Таким образом, определение паращитовидной ткани от остальных было проведено методом иерархического кластерного анализа на основании близости данных. Были определены средние значения кластеров, которые оказались довольно близкими к априорным рассчитанным величинам для известных групп.
В ходе кластеризации были однозначно идентифицированы ткани паращитовидных желез, они были надежно отделены от тканей щитовидной железы и других. Так же было произведено разделение сомнительных моментов, классифицируемых как «other-para». При этом анализ данных проводился сразу для нескольких пациентов, без предварительного обучения системы на тестовых образцах, идентифицированных врачом.
ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ
Заявленный способ люминесцентной спектроскопии аутофлюоресценции околощитовидных желез предназначен для идентификации in vivo околощитовидных желез, а также позволит проводить интраоперационный и последующий анализ спектров люминесценции тканей с целью предотвращения гипопаратериоза.
Заявленный способ позволит надежно отличать ткань околощитовидной железы от окружающей ее жировой клетчатки и щитовидной железы без риска нарушения функциональной активности самих околощитовидных желез в послеоперационный период. Реализация предлагаемого способа способна значительно улучшить результаты операционного вмешательства для пациентов с раком щитовидной железы.
| название | год | авторы | номер документа |
|---|---|---|---|
| МНОГОКАНАЛЬНЫЙ ОПТОВОЛОКОННЫЙ НЕЙРОИНТЕРФЕЙС ДЛЯ МУЛЬТИМОДАЛЬНОЙ МИКРОСКОПИИ МОЗГА ЖИВОТНЫХ | 2014 |
|
RU2584922C1 |
| СПОСОБ ДИСТАНЦИОННОГО БЕСПРОБООТБОРНОГО ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ ХИМИЧЕСКИХ ВЕЩЕСТВ И ОБЪЕКТОВ ОРГАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2014 |
|
RU2567119C1 |
| СПОСОБ ПРОВЕДЕНИЯ ИНТРАОПЕРАЦИОННОЙ КОМБИНИРОВАННОЙ СПЕКТРОСКОПИЧЕСКОЙ ДИАГНОСТИКИ ОПУХОЛЕЙ ГОЛОВНОГО И СПИННОГО МОЗГА | 2012 |
|
RU2497558C1 |
| УСТРОЙСТВО ДЛЯ ОПТИЧЕСКОЙ ДИАГНОСТИКИ КРОВОСНАБЖЕНИЯ И ЖИЗНЕОБЕСПЕЧЕНИЯ БИОЛОГИЧЕСКИХ ТКАНЕЙ | 2017 |
|
RU2663938C1 |
| СПОСОБ МОНИТОРИНГА ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, ВКЛЮЧАЮЩИЙ ФЛУОРЕСЦЕНТНУЮ ДИАГНОСТИКУ ЗАБОЛЕВАНИЯ, И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2511262C2 |
| Способ проведения биопсии у больных с подозрением на рак гортани | 2020 |
|
RU2729503C1 |
| Портативное устройство для мониторинга стрессовых состояний растений | 2021 |
|
RU2775493C1 |
| УСТРОЙСТВО ДЛЯ ФЛУОРЕСЦЕНТНОЙ НАВИГАЦИИ В НЕЙРОХИРУРГИИ | 2017 |
|
RU2661029C1 |
| Устройство для спектрально-флуоресцентного исследования содержания флуорохромов | 2018 |
|
RU2665628C1 |
| Способ прогнозирования формирования келоидного рубца | 2019 |
|
RU2709519C1 |
Группа изобретений относится к медицине. Лазерно-флуоресцентный комплекс для осуществления способа лазерной спектроскопии аутофлюоресценции околощитовидных желез, содержащий непрерывный лазер возбуждения, соединенный с Y-образным оптоволоконным зондом с раздельными оптическими каналами для излучения лазера возбуждения и сбора света аутофлюоресценции, узлы ввода и вывода оптического излучения в оптический зонд, спектральный светофильтр для подавления рассеянного лазерного излучения, спектрометр с охлаждаемым посредством Пельтье элемента ПЗС-фотодетектором. Способ лазерной спектроскопии аутофлюоресценции околощитовидных желез содержит этапы, на которых: вводят в исследуемую область Y-образный оптоволоконный зонд для излучения лазера возбуждения и сбора света аутофлюоресценции, регистрируют спектральную интенсивность сигнала аутофлюоресценции и выполняют сравнительный спектральный анализ собираемых данных, на основе которого производят идентификацию околощитовидной железы, диагностируют её патологию и прогнозируют возможные послеоперационные осложнения. Техническим результатом является повышение эффективности и точности идентификации щитовидной и околощитовидных желез и их патологий, а также прогнозирование возможных послеоперационных осложнений. 2 н. и 4 з.п. ф-лы, 5 ил.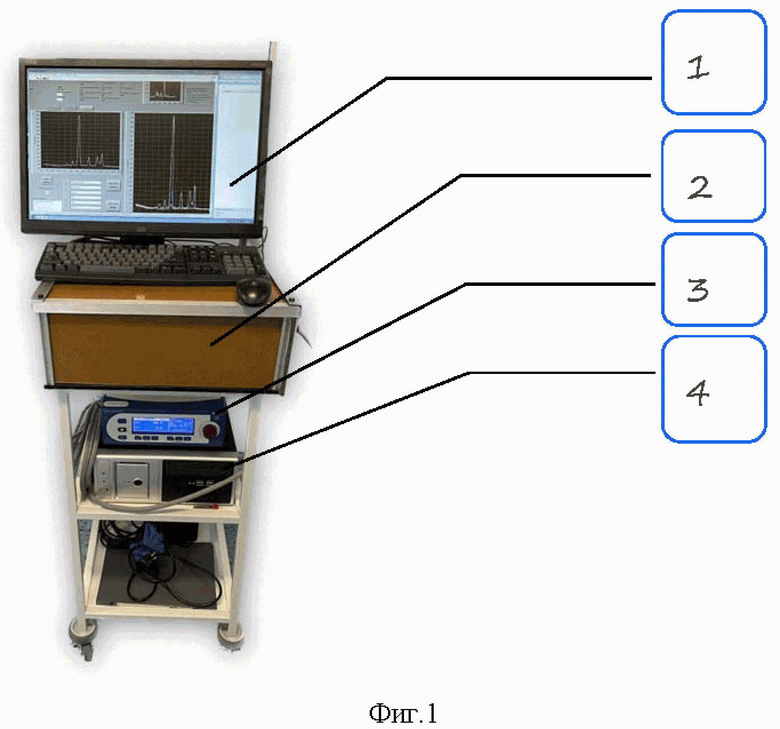
1. Лазерно-флуоресцентный комплекс для осуществления способа лазерной спектроскопии аутофлюоресценции околощитовидных желез, содержащий непрерывный лазер возбуждения, соединенный с Y-образным оптоволоконным зондом с раздельными оптическими каналами для излучения лазера возбуждения и сбора света аутофлюоресценции, узлы ввода и вывода оптического излучения в оптический зонд, спектральный светофильтр для подавления рассеянного лазерного излучения, спектрометр с охлаждаемым посредством Пельтье элемента ПЗС-фотодетектором, при этом оптическое излучение от непрерывного лазера возбуждения через узел ввода оптического излучения и лазерный канал зонда направлено на исследуемую область пациента, излучение аутофлюоресценции, собирающееся фотоприемным каналом оптоволоконного зонда через узел вывода оптического излучения со спектральным светофильтром, направлено на спектрометр с Пельтье-охлаждаемым ПЗС-фотодетектором.
2. Лазерно-флуоресцентный комплекс по п.1, отличающийся тем, что используют лазер возбуждения непрерывного действия с длиной волны 785 нм и мощностью 100 мВт.
3. Лазерно-флуоресцентный комплекс по п.1, отличающийся тем, что используют Y-образный оптический зонд с наконечником из хирургической стали.
4. Лазерно-флуоресцентный комплекс по п.1, отличающийся тем, что используют спектральный светофильтр с длиной волны отсечки 800 нм для подавления рассеянного лазерного излучения.
5. Лазерно-флуоресцентный комплекс по п.1, отличающийся тем, что используют спектрометр со спектральной шириной одновременно регистрируемого сигнала в диапазоне 800-870 нм и охлаждаемый ПЗС-фотодетектор.
6. Способ лазерной спектроскопии аутофлюоресценции околощитовидных желез с использованием лазерно-флуоресцентного комплекса по любому из пп.1-5, содержащий этапы, на которых: вводят в исследуемую область Y-образный оптоволоконный зонд с раздельными оптическими каналами для излучения лазера возбуждения и сбора света аутофлюоресценции, с помощью компьютера и программного обеспечения управляют лазерно-флуоресцентным комплексом, регистрируют спектральную интенсивность сигнала аутофлюоресценции, и выполняют сравнительный спектральный анализ собираемых данных, и на основе этого анализа производят идентификацию околощитовидной железы, диагностируют её патологию и прогнозируют возможные послеоперационные осложнения.
| CN 102762978 A, 31.10.2012 | |||
| CN 112656370 A, 16.04.2021 | |||
| US 10473665 B2, 12.11.2019 | |||
| US 2023165468 A1, 01.06.2023 | |||
| Ветшев П.С., Чилингариди К.Е., Ипполитов Л.И., Харнас С.С., Лощенов В.Б., Габаидзе Д.И., Дуплик А.Ю | |||
| Первый опыт применения лазерной спектроскопии в хирургическом лечении заболеваний щитовидной железы | |||
| Проблемы эндокринологии |
Авторы
Даты
2024-09-16—Публикация
2023-12-14—Подача