Изобретение относится к медицине, а именно к способу выделения липополисахаридов из клеток грамотрицательных бактерий для получения иммунотропных препаратов для профилактики и лечения бактериальных инфекций.
Липополисахарид (ЛПС) представляет собой эндотоксин грамотрицательных бактерий и является одним из основных углевод-содержащих компонентов внешней мембраны клеточной стенки. ЛПС стабилизирует мембрану, придает бактериям устойчивость к защитным системам животных и человека и, таким образом, является одним из факторов патогенности грамотрицательных бактерий. Он включает три различных по функциональному назначению и структуре последовательно соединенных фрагмента: О-специфический полисахарид (ОПС), с молекулярной массой, не превышающей обычно 10-15 кДа, построенный из одинаковых повторяющихся олигосахаридных звеньев (не более 8 моносахаридов), уникальное строение которых определяет иммунологическую специфичность ЛПС. Моносахарид на восстанавливающем конце ОПС присоединяется к олигосахариду кора (10-12 моносахаридов), структура которого сходна для бактерий одного рода. Олигосахарид кора, в свою очередь, присоединяется к эндотоксичному липиду А, который представляет собой патоген-ассоциированный молекулярный паттерн, благодаря которому ЛПС распознается иммунной системой макроорганизма. Липид А, являясь триггером активации иммунной системы организма хозяина, непосредственно взаимодействует с toll-подобным 4 (TLR4), локализованном на поверхности многих иммунокомпетентных клеток, с одной стороны определяет все эндотоксические характеристики ЛПС, а с другой - индуцирует выработку специфических протективных антител к ОПС [1]. Будучи агонистом рецептора TLR4, ЛПС инициирует также выработку провоспалительных цитокинов, направленных на удаление патогена, причем избыток цитокинов может привести к возникновению лихорадки, тахипноэ, тахикардии, гипотензии, вплоть до септического шока и гибели организма [2].
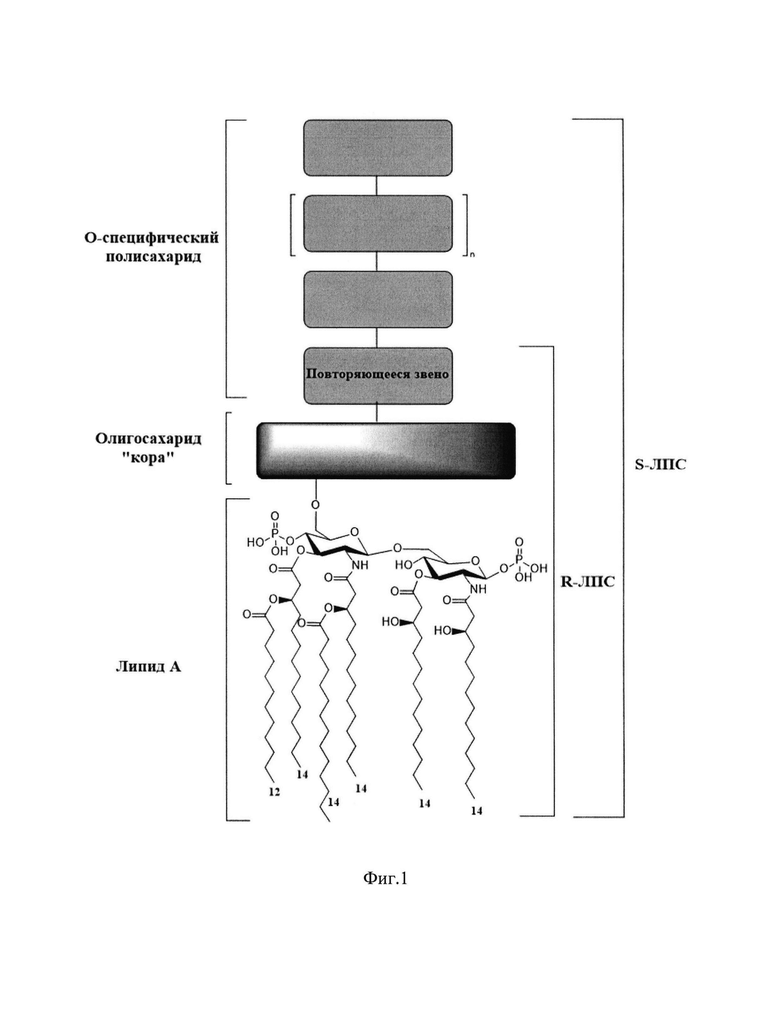
Структура липида А, при которой ЛПС обладает максимально высокой эндотоксической активностью, включает шесть остатков высших жирных кислот (ВЖК) и две фосфатные группировки при С1 и С4' (Фиг. 1), причем уменьшение количества как остатков ВЖК, так и остатков фосфорной кислоты сопровождается снижением иммунологической активности.
Важная роль ЛПС в заболеваниях, вызываемых грамотрицательными бактериями, и его широкое применение в различных экспериментах по стимуляции клеток послужили концептуальной основой для исследований, направленных на выделение, очистку и установление детальных химических характеристик ЛПС.
В последние десятилетия предложено несколько масштабируемых методов выделения ЛПС, которые используются для получения из них липидов А - исходных соединений для производства иммунотропных препаратов. В частности, химически модифицированные низко эндотоксичные производные липида А находят применение в качестве адъювантов при создании вакцин и иммуностимуляторов.
Предложено большое число препаративных и аналитических методов выделения ЛПС из клеток грамотрицательных бактерий: экстракция горячим водным фенолом (ГВФ) по Вестфалю [3]; экстракция трихлоруксусной кислотой при 4°С [4]; водным бутанолом [5]; тритоном/Mg+2 [6]; холодным этанолом [7]; экстракция водой при 100°С [8]. Для выделения R-форм ЛПС (не содержащей ОПС) предложен метод с использованием смеси хлороформа, петролейного эфира и метанола [2]. Так как R-ЛПС обладают наибольшим содержанием липида А для его получения обычно используют штаммы глубоких R-мутантов грамотрицательных микроорганизмов, в частности Re-мутанты Salmonella minnesota R595 (US11186652B2, WO2011/144645A1) и Escherichia colli D31m4 (WO02/078637A2). В состав ЛПС этих мутантов входит обычно липид А с 7 остатками ВЖК и 2-3 остатка 2-кето-3-дезокси октулозоновой кислоты. Большое количество остатков ВЖК и низкое содержание гидрофильных углеводных остатков обеспечивает высокую гидрофобность липида А этих Re-штаммов и, как следствие, его растворимость в неводных средах и возможность его экстракции из бактериальных клеток с помощью органических растворителей.
В примерах перечисленных выше патентов приводятся методики экстракции сухих бактериальных клеток глубоких мутантов (обычно S.minnesota R595) смесью хлороформ-метанол с последующим упариванием органических растворителей. Описанный подход весьма эффективен в случае экстракции Re-ЛПС однако не может быть использован для экстракции S- и R-ЛПС в силу чрезвычайно низкой растворимости этих ЛПС, содержащих гидрофильные поли- и олигосахаридные фрагменты, в органических средах.
Для существующих методов экстракции характерны существенные недостатки: высокая контаминация целевого продукта белками и нуклеиновыми кислотами, токсичность и канцерогенность растворителей (в случае экстракции ГВФ); дороговизна реактивов (тритон, ферменты).
На данный момент экстракция ГВФ остается наиболее распространенным методом для выделения ЛПС, так как считается, что при этом обеспечивается наибольший выход целевого продукта. При температуре 68-70° происходит гомогенизация экстракционной смеси (ЭС), и, таким образом, процесс протекает в однофазной жидкой системе. Эффективность процесса экстракции ГВФ обеспечивается не только перечисленными выше факторами, но и высокой полярностью обоих компонентов ЭС, а также и одновременным присутствием в гомогенной ЭС гидрофильного и гидрофобного компонента. Последние факторы играют важную роль в процессе высвобождения с поверхности бактериальной клетки амфифильной молекулы ЛПС, липидный компонент которой (липид А) «заякорен» во внешней липид-содержащей мембране, а гидрофильный полисахаридный компонент непосредственно контактирует с высоко полярной водосодержащей ЭС. Таким образом, обеспечивается растворимость амфифильного ЛПС в однофазной (при 68-70°) водно-фенольной ЭС.
Однако экстракция сухих бактериальных клеток 45%-ным водным фенолом при температуре 68-70°С - метод небезопасный, требующий при проведении процесса много времени, причем выделенный таким образом ЛПС содержит до 70% примеси белков и нуклеиновых кислот.
В связи с очевидной небезопасностью этого традиционного метода выделения ЛПС и токсичностью отходов разработка гораздо более безопасного и экономичного метода экстракции ЛПС, применимого не только для лабораторного, но и промышленного использования, не теряет актуальности. При этом должно быть обеспечено сохранение основных характеристик ЭС: гомогенность, наличие в ней воды и гидрофобного смешивающегося с водой полярного компонента, растворимость в ней ЛПС и слабая растворимость примесных белков и нуклеиновых кислот.
Наиболее близким аналогом изобретения является способ экстракции клеток грамотрицательных бактерий смесью алифатическая кислота - алифатический амин (или водный аммиак) - вода (US2012/0213821 А1). Кратковременное (5-15 минут) перемешивание сухих бактериальных клеток с экстракционной смесью при комнатной температуре с последующим удалением твердого остатка и выделением из супернатанта с помощью диализа, ультрафильтрации или осаждения спиртом приводит к получению ЛПС, для которых, как указано, не требуется дополнительной очистки от примеси белков и нуклеиновых кислот, при этом выход ЛПС выше, чем при экстракции ГВФ в 2-10 раз.
Отличием заявленного изобретения является возможность выделения ЛПС как из S- так и R-форм грамотрицательных микроорганизмов, использование доступных растворителей (н-пропанол и н-бутанол), высокая степень экстракции бактериальных клеток и чистоты выделяемых ЛПС, а также применение простого оборудования, низкая энергоемкость и возможность масштабирования.
Таким образом, цель разработки состояла в поиске нового безопасного и экономичного метода экстракции ЛПС, который удовлетворял перечисленным выше условиям. Так как важным с экономической точки зрения является температурный режим, поиск экстракционной смеси проводился также в направлении снижения температуры проведения процесса экстракции, что понижает возможность структурных изменений в молекуле ЛПС в процессе экстракции.
Разработан способ экстракции липополисахаридов из сухих клеток грамотрицательных бактерий, включающий экстракцию сухих бактериальных клеток с последующим отделением экстракта, диафильтрацией против воды и лиофилизацией, отличающийся тем, что экстракцию проводят экстрационной смесью, которая приготовляется из равных объемов воды и н-бутанола с последующим прибавлением н-пропанола до гомогенизации, в течение 16-18 часов при нагревании и перемешивании при температуре 37°С - 60°С.
К ЭС могут быть также добавлены вещества щелочной природы для поддержания значения рН в области 8.0-8.5.
В одном из вариантов изобретения в способе выделения липополисахаридов из клеток грамотрицательных микроорганизмов к экстракционной смеси добавляется трис(гидроксиметил)аминометан до рН 8,5-8,6.
Техническим результатом заявленного изобретения является увеличение эффективности экстрагента в отношении ЛПС, обеспечивая высокий выход ЛПС и низкую контаминацию его белками и нуклеиновыми кислотами. Технический результат достигается путем экстракции трехкомпонентной гомогенной ЭС н-пропанол - н-бутанол -вода при нагревании и перемешивании при температуре 37°С - 60°С. Введение щелочных добавок (ТРИС) в экстракционную смесь обеспечивает наиболее эффективную экстракцию ЛПС, О-специфический полисахарид которых имеет кислый характер, то есть, включает остатки кислот, в частности остатки уроновых и аминокислот, а также фосфат-содержащие группировки.
Новый легко масштабируемый способ получения ЛПС из бактериальных клеток отличается от ранее известных тем, что при реализации используются дешевые и безопасные в работе реактивы.
Краткое описание графических материалов.
Фигура 1. Строение липополисахарида.
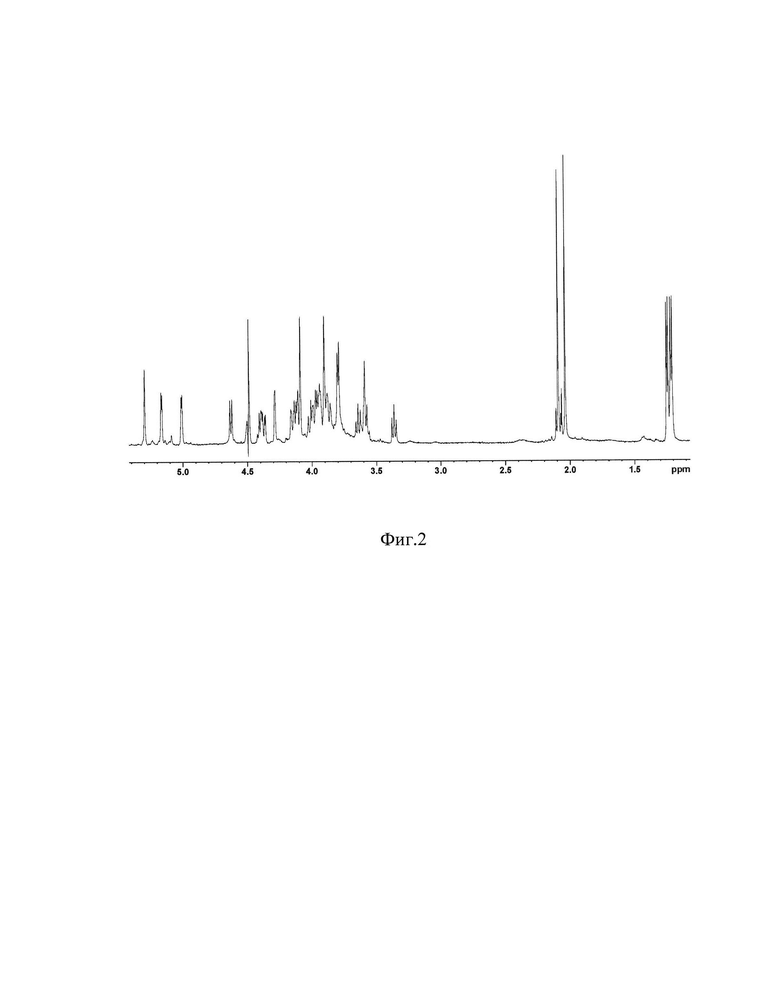
Фигура 2. 1Н ЯМР спектр О-полисахарида Е. coli O157.
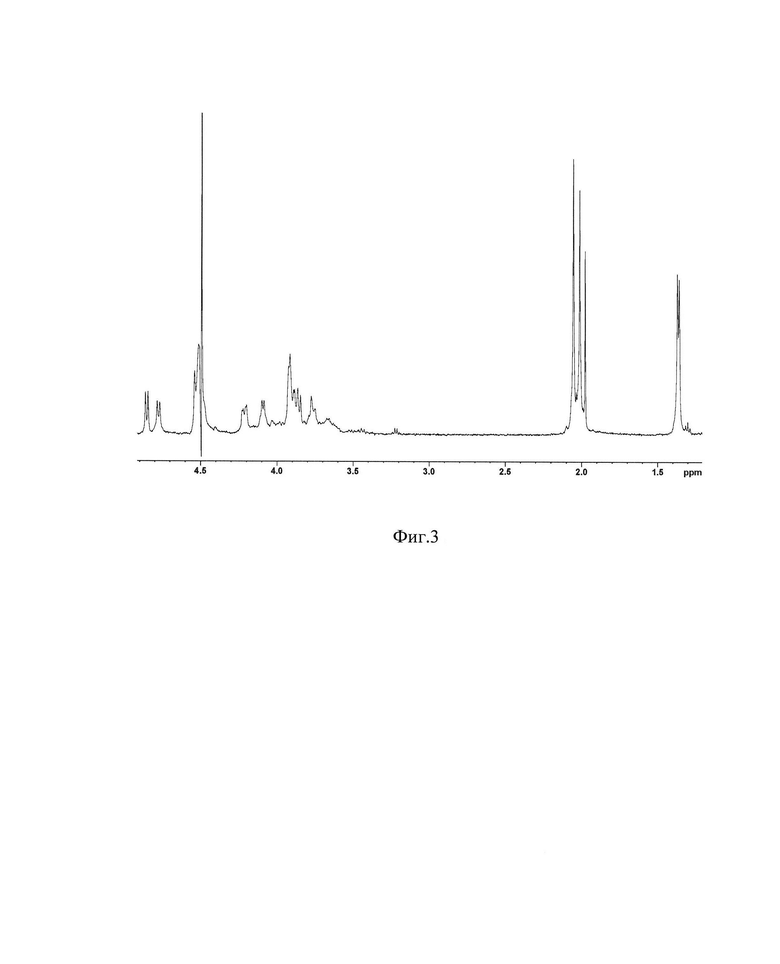
Фигура 3. 1Н ЯМР спектр О-полисахарида Shigella sonnei.
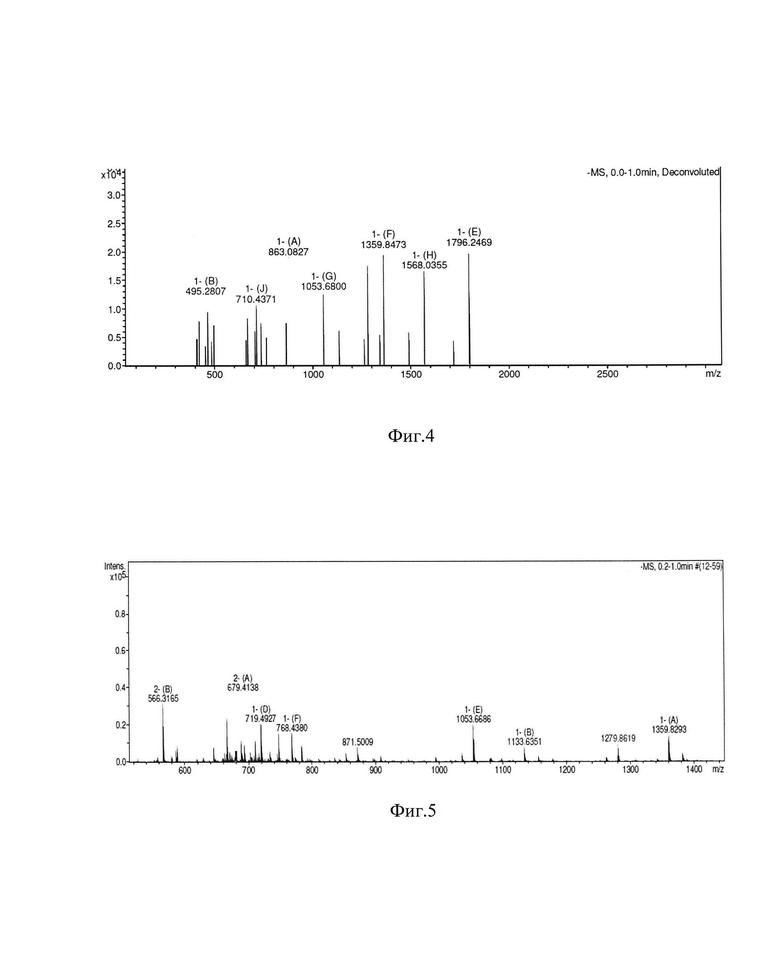
Фигура 4. Масс-спектр липида A E.coli 0157.
Фигура 5. Масс-спектр липида Shigella sonnei.
Раскрытие изобретения
ПРИМЕР 1.
В качестве модельных объектов исследования были выбраны микробные клетки Escherichia coli O157 и Shigella sonnei, фаза 1 (по последней классификации входит в состав рода Escherichia. Из недавних литературных данных об электрофоретической подвижности ЛПС E. colli O157 [9] следует, что мажорной фракцией является длинно цепной S-ЛПС. Напротив, ЛПС S.sonnei, фаза 1 представлена в основном низко молекулярной фракцией S-ЛПС с короткими цепями ОПС. Эти особенности обоих биополимеров позволяют оценить возможность применения предлагаемого метода к ЛПС с различной длиной ОПС.
Повторяющееся звено нейтрального ОПС E.coli O157 построено из моносахаридных остатков с гидрофобными фрагментами (метильные группы остатков фукозы и перозамина, а также N-ацетильные группы остатков галактозамина и перозамина) и не содержит заряженных группировок [10:
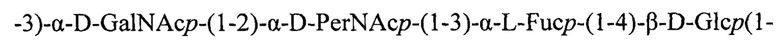
где D-PerNAcp = 4-N-ацетиламино-4,6-дидезокси-D-маннопираноза (перозамин)
ОПС S.sonnei построен из повторяющихся дисахаридных звеньев, в которых остаток N-ацетил-L-альтрозаминуроновой кислоты несет отрицательный заряд, а остаток 4-амино-2-N-ацетиламино-4,6-дидезокси-D-фукозы заряжен положительно [11], то есть ОПС S.sonnei имеет цвиттер-ионный характер:
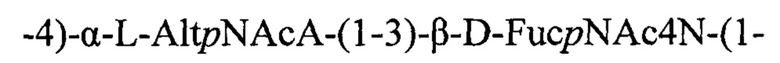
Липид А, входящий в состав ЛПС этих микроорганизмов, имеет сходное микрорганизмов рода Escherichia строение.
Экстракция высушенных ацетоном бактериальных клеток E.coli O157 и S.sonnei фаза 1 проводилась с использованием экстракционной смеси ЭС-1 и ЭС-2 перемешиванием на магнитной мешалке при температуре 37° или 60°С в закупоренном сосуде течение 16-18 часов.
В качестве экстрагента использовалась тройная ЭС-1, которая включает воду, н-бутанол и н-пропанол и которая приготовляется прибавлением н-пропанола к двухфазной смеси воды и н-бутанола в соотношении 1:1 до ее полной гомогенизации (ЭС-1). Ожидалось, что водная однофазная высоко полярная ЭС, имея в своем составе гидрофобные алифатические спирты, будет обладать способностью извлекать амфифильные молекулы ЛПС, содержащие остатки ВЖК, из липид-содержащей мембраны внешней поверхности бактериальной клетки, то есть разрушать гидрофобные взаимодействия между липидом А и мембраной.
Было изучено также влияние щелочных к ЭС-1 добавок на выход ЛПС и содержание примесей белков и нуклеиновых кислот. С этой целью при экстракции к суспензии бактериальных клеток в ЭС-1 прибавляли трисгидроксиметиламинометан (ТРИС) до рН 8.5-8.6 (ЭС-2).
Охлажденную смесь до комнатной температуры подвергали центрифугированию, осадок перемешивали с водой, центрифугировали, объединенные супернатанты очищали от низкомолекулярных примесей с помощью диафильтрации на мембране с пределом отсечения 100 кДа, концентрат лиофилизовали. Для сравнения образцы ЛПС были также выделены из обоих микроорганизмов с помощью традиционного метода экстракции ГВФ при 68-70°С.Для доказательства того, что основным продуктом обработки бактериальных клеток ЭС-1 и ЭС-2 является ЛПС, каждый из полученных препаратов был проанализирован в рамках следующего протокола.
Образцы каждого ЛПС, выделенные с помощью ГВФ, а также при экстракции ЭС-1 или ЭС-2, были очищены от примеси белков и нуклеиновых кислот осаждением их с помощью 50%-ного раствора трихлоруксусной кислоты. К раствору 50 мг продукта экстракции в 5 мл воды прибавляли по каплям при перемешивании 50%-ный раствор CC13COOH до рН 2.0, осадок отделяли центрифугированием, супернатант диализовали против воды и лиофилизировали. К лиофилизату прибавляли 3 мл 2%-ной АсОН и полученный раствор нагревали на кипящей водяной бане (при 100°С) в течение 1 часа.
Образовавшийся осадок липида А отделяли центрифугированием и анализировали с помощью масс-спектрометрии. Супернатант лиофилизировали и далее хроматографировали на колонке, анализировали с помощью и 1Н-ЯМР- спектроскопии. В качестве образцов сравнения использовали препараты углеводной и липидной фракций, полученных из ЛПС S.sonnei и E.coli O157, выделенных с помощью экстракции ГВФ.
Сравнительный масс-спектрометрический анализ [15 (Фиг. 4, Фиг. 5) липидных фракций, полученных при мягком кислотном гидролизе ЛПС для S.sonnei и E.coli O157, выделенных экстракцией ГВФ, а также ЭС-1 или ЭС-2, показал отсутствие структурных изменений в липиде А в процессе экстракции с использованием ЭС-1 или ЭС-2.
Субстанции углевод-содержащих фракций (после отделения липида А), выделенные из ЛПС E.coli O157 и S.sonnei с помощью ЭС-2 при температуре 60°С, подвергнуты препаративной гель-хроматографии с использованием колонки с гелем TSK50, и полученные в результате гель-хроматографии ОПС E.coli 0157 и S.sonnei были проанализированы с помощью 1Н-ЯМР-спектроскопии. Сравнительный анализ экспериментальных (Фиг. 2, Фиг. 3) и литературных [10, 14] спектральных данных показала их полное совпадение.
ПРИМЕР 2.
В качестве одного из критериев сопоставления эффективности традиционного (водно-фенольного) и предлагаемых вариантов нового метода экстракции было выбрано содержание примесей белков и нуклеиновых кислот в неочищенных образцах ЛПС, Другим критерием являлся количественный выход очищенного ЛПС, рассчитанный, исходя из выхода неочищенного ЛПС и процентного содержания в нем примеси белков и нуклеиновых кислот, определение которых проводилось с помощью колориметрических методов (белки - по Бредфорд [12], нуклеиновые кислоты - по Спирину [13].
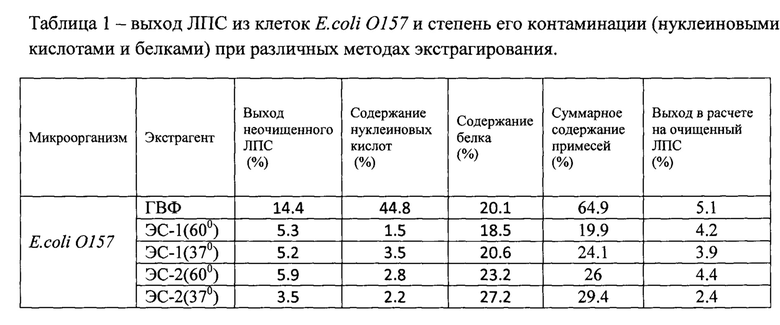
Из приведенных в Таблице 1 данных следует, что больший выход ЛПС E.coli 0157 наблюдается при температуре экстракции 60°С, а наименьшее содержание примесей - в отсутствии ТРИС.
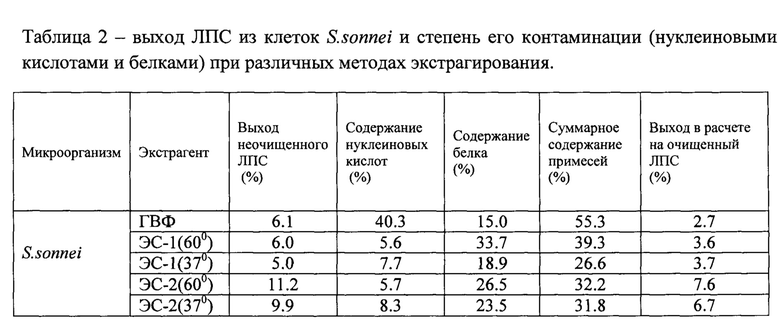
Результаты экстракции клеток S.sonnei перечислены ниже (таблица 2):
1. Выход ЛПС при экстракции ЭС-1 и ЭС-2 существенно выше, чем при экстракции ГВФ;
2. Выход ЛПС при экстракции ЭС-2 заметно выше, чем при экстракции ЭС-1;
3. Повышение температуры экстракции лишь незначительно повышает выход ЛПС.
Таким образом, введение щелочных добавок в экстракционную смесь наиболее эффективно при экстракции ЛПС, О-специфический полисахарид которых имеет кислый характер, то есть, включает остатки кислот, в частности остатки уроновых и аминокислот, а также фосфат-содержащие группировки.
Для того чтобы получить дополнительные данные о ЛПС, полученных при экстракции клеток S,sonnei в присутствии ТРИС и без него, осадок, полученный после экстракции клеток ЭС-1 при 60°С (16 часов) и центрифугирования, был затем подвергнут обработке ЭС-2 в тех же условиях. Выход на первой и второй стадии составил 153 мг и 166 мг, соответственно. После ферментативной обработки (РНК-аза + ДНК-аза, затем протеиназа К) ЛПС, полученные на 1- и 2-ой стадии, были подвергнуты диафильтрации против воды и лиофилизации, выход ЛПС после удаления примесей составил 105 мг и 80 мг, соответственно. Сравнительный анализ выделенных таким образом ЛПС, проведенный по описанной выше схеме, показал, что препараты практически идентичны и что в отсутствие ТРИС в ЭС заметно снижает выход целевого ЛПС.
Из полученных данных о выходе, степени чистоты и стабильности препаратов ЛПС в процессе экстракции следует, что предлагаемый метод выделения ЛПС более эффективен, чем экстракция ГВФ, при том, что процедура выделения ЛПС существенно проще, безопаснее и занимает гораздо меньше времени.
ПРИМЕР 3. Методика выделения ЛПС из бактериальных клеток с помощью экстракции смесью н-бутанола, н-пропанола и воды в присутствии добавки щелочной природы.
В герметизируемом стеклянном сосуде 3 г высушенных бактериальных клеток суспензировали в смеси, которая была приготовлена смешиванием 100 мл воды и 100 мл н-бутанола с последующим прибавлением н-пропанола до гомогенизации ЭС и ТРИС (тв.) до рН 8,5. Экстракцию проводили при перемешивании в течение 16 часов (термостат, 60°С). После охлаждения смесь центрифугировали (13800 об/мин, 15 мин), осадок суспензировали в 200 мл воды и вновь центрифугировали, к объединенным супернатантам прибавляли воду до объема 2 литра и подвергали диафильтрации против воды до отсутствия органических растворителей в фильтрате и лиофилизовали.
Список использованной литературы
[1] Y. Zhao, V. Arce-Gorvel, R. Conde-Alvarez, I. Moriyon, and J.-P. Gorvel, "Vaccine development targeting lipopolysaccharide structure modification," Microbes Infect, vol. 20, no. 9-10, pp. 455-460, Oct. 2018, doi: 10.1016/j.micinf. 2017.11.006.
[2] L. Mazgaeen and P. Gurung, "Recent Advances in Lipopolysaccharide Recognition Systems," Int J Mol Sci, vol. 21, no. 2, p.379, Jan. 2020, doi: 10.3390/ijms21020379.
[3] O. Westphal and K. Jann, "Bacterial Lipopolysaccharides. Extraction with Phenol-Water and Further Applications of the Procedure.," Methods in Carbonydrate Chemistry, vol. 5, pp.83-91, 1965.
[4] Staub AM, "Bacterial lipido-proteinopolysaccharides (O somatic antigens). Extraction with tricloro-acetic acid," Methods in Carbohydrate Chemistry, pp.92-93, 1965.
[5] D. Morrison and L. Leive, "Fractions of lipopolysaccharide from Escherichia coli O111:B4 prepared by two extraction procedures.," Journal of Biological Chemistry, vol. 250, no. 8, pp.2911-2919, Apr. 1975, doi: 10.1016/S0021-9258(19)41574-3.
[6] D. M. Delahooke, G.R. Barclay, and I.R. Poxton, "A re-appraisal of the biological activity of bacteroides LPS," J Med Microbiol, vol. 42, no. 2, pp.102-112, Feb. 1995, doi: 10.1099/00222615-42-2-102.
[7] A. Sonesson, E. Jantzen, K. Bryn, L. Larsson, and J. Eng, "Chemical composition of a lipopolysaccharide from Legionella pneumophila," 1989.
[8] D. N. Eidhin and C. Mouton, "A rapid method for preparation of rough and smooth
lipopolysaccharide from Bacteroides, Porphyromonas and Prevotella," FEMS Microbiol Lett, vol. 110, no. 2, pp. 133-138, Jun. 1993, doi: 10.1111/j.l574-6968.1993.tb06309.x.
[9] I. A. Dyatlov et al., "Molecular Lipopolysaccharide Di-Vaccine Protects from Shiga-Toxin
Producing Epidemic Strains of Escherichia coli 0157:H7 and O104:H4," Vaccines (Basel), vol. 10, no. 11, p.1854, Nov. 2022, doi: 10.3390/vaccinesl0111854.
[10] M.B. Perry, L. MacLean, and D.W. Griffith, "Structure of the O-chain polysaccharide of the phenol-phase soluble lipopolysaccharide of Escherichia coli 0:157:H7," Biochemistry and Cell Biology, vol. 64, no. 1, pp.21-28, Jan. 1986, doi: 10.1139/o86-004.
[11] L. Kenne, B. Lindberg, K. Petersson, E. Katzenellenbogen, and E. Romanowska, "Structural studies of the O-specific side-chains of the shigella sonnei phase I lipopolysaccharide," Carbohydr Res, vol. 78, no. 1, pp.119-126, Jan. 1980, doi: 10.1016/S0008-6215(00)83665-4.
[12] M.M. Bradford, "A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding,"Anal Biochem, vol. 72, no. 1-2, pp. 248-254, May 1976, doi: 10.1016/0003-2697(76)90527-3.
[13] A.S. SPIRIN, "[Spectrophotometric determination of total nucleic acids]", Biokhimiia, vol. 23, no. 5, pp. 656-62,1958.
[14] J.В. Robbins et al., "Synthesis, characterization, and immunogenicity in mice of Shigella sonnei O-specific oligosaccharide-core-protein conjugates," Proceedings of the National Academy of Sciences, vol. 106, no. 19, pp. 7974-7978, May 2009, doi: 10.1073/pnas.0900891106.
[15] V.A. Ledov et al., "11. Highly homogenous tri-acylated S-LPS acts as a novel clinically
applicable vaccine against Shigella flexneri 2a infection," Vaccine, vol. 37, no. 8, pp. 1062-1072, Feb. 2019, doi: 10.1016/j. vaccine. 2018.12.067.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ШИГЕЛЛЕЗНОГО ПРЕПАРАТА | 2015 |
|
RU2614123C1 |
| СПОСОБ РАЗДЕЛЕНИЯ ЛИПОПОЛИСАХАРИДОВ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ | 2010 |
|
RU2478712C2 |
| СПОСОБ ВЫДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ ФРАКЦИИ (БАФ), СОДЕРЖАЩЕЙ S-ЛИПОПОЛИСАХАРИДЫ (S-ЛПС) ИЗ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ, БАФ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ГРАМОТРИЦАТЕЛЬНЫМИ БАКТЕРИЯМИ, ПРОИЗВОДЯЩИМИ ЭНДОТОКСИЧНЫЕ S-ЛПС, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ИНДУКЦИИ ПРОТЕКТИВНОГО ИММУНИТЕТА И УЛУЧШЕНИЯ СОСТОЯНИЯ ПАЦИЕНТА ПРИ СОСТОЯНИЯХ, ТРЕБУЮЩИХ ПОВЫШЕНИЯ ИММУННОГО СТАТУСА | 2002 |
|
RU2260053C2 |
| СПОСОБ НЕКОВАЛЕНТНОЙ ИММОБИЛИЗАЦИИ ЛИПОПОЛИСАХАРИДА Shigella flexneri 2a НА ТВЕРДОМ ГИДРОФОБНОМ НОСИТЕЛЕ | 2010 |
|
RU2447153C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОПОЛИСАХАРИДА ВОЗБУДИТЕЛЯ ЧУМЫ | 2012 |
|
RU2483112C1 |
| ШТАММ БАКТЕРИЙ Shigella flexneri № 1605-8 СЕРОТИП 2a, ДЕПОНИРОВАННЫЙ В ФГУН ГИСК ИМ. Л.А.ТАРАСЕВИЧА ПОД НОМЕРОМ 285, СТАБИЛЬНЫЙ ПРОДУЦЕНТ S-ЛИПОПОЛИСАХАРИДА | 2009 |
|
RU2415921C1 |
| ПОЛИСАХАРИД И ЕГО ПРОИЗВОДНЫЕ С АКТИВНОСТЬЮ К ФИКОЛИНУ-3, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2575752C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ЛИПОПОЛИСАХАРИДА Chlamydia trachomatis | 2015 |
|
RU2593946C1 |
| ШТАММ БАКТЕРИЙ SHIGELLA SONNEI, ФАЗА 1, СТАБИЛЬНЫЙ ПРОДУЦЕНТ S-ЛИПОПОЛИСАХАРИДА | 2001 |
|
RU2241031C2 |
| АДЪЮВАНТ | 2020 |
|
RU2736933C1 |
Изобретение относится к химии и фармацевтике, а именно к способу экстракции липополисахаридов из сухих клеток грамотрицательных бактерий. Предложенный способ включает экстракцию сухих бактериальных клеток Shigella sonnei, которую проводят экстрационной смесью, приготавливаемой из равных объемов воды и н-бутанола с последующим прибавлением н-пропанола до гомогенизации, в течение 16-18 ч при нагревании до температуры 37-60°С и перемешивании, затем осуществляют отделение экстракта, диафильтрацию против воды и лиофилизацию. Изобретение обеспечивает повышение выхода липополисахаридов и снижение контаминации липополисахаридов белками и нуклеиновыми кислотами (уменьшение содержания белков и нуклеиновых кислот). 1 з.п. ф-лы, 5 ил., 2 табл., 3 пр.
1. Способ экстракции липополисахаридов из сухих клеток грамотрицательных бактерий, включающий экстракцию сухих бактериальных клеток с последующими отделением экстракта, фильтрацией и лиофилизацией, отличающийся тем, что экстракцию сухих клеток Shigella sonnei проводят экстрационной смесью, которую приготавливают из равных объемов воды и н-бутанола с последующим прибавлением н-пропанола до гомогенизации, в течение 16-18 ч при нагревании до температуры 37-60°С и перемешивании, причем в качестве фильтрации используют диафильтрацию против воды.
2. Способ экстракции липополисахаридов из сухих клеток грамотрицательных бактерий по п.1, отличающийся тем, что к экстракционной смеси добавляется трис(гидроксиметил)аминометан до рН 8,5-8,6.
| WO 2011144645 A1, 24.11.2011 | |||
| Morrison D.C | |||
| et al | |||
| Говорящий кинематограф | 1920 |
|
SU111A1 |
| Катодное реле | 1921 |
|
SU250A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Способ получения продукта конденсации фенола с формальдегидом | 1924 |
|
SU2911A1 |
| US 11186652 B2, 30.11.2021 | |||
| US 20120213821 A1, 23.08.2012 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОПОЛИСАХАРИДОВ | 2002 |
|
RU2237719C2 |
Авторы
Даты
2024-12-23—Публикация
2023-11-30—Подача